Zestoretic 5/12.5g/mg Lisinopril Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Zestoretic, og hvordan bruges det?
Zestoretic er en receptpligtig medicin, der bruges til at behandle symptomer på hypertension (forhøjet blodtryk) og væskeretention. Zestoretic 5mg kan bruges alene eller sammen med anden medicin.
Det vides ikke, om Zestoretic 5mg er sikkert og effektivt til børn.
Hvad er de mulige bivirkninger af Zestoretic 5mg?
Zestoretic kan forårsage alvorlige bivirkninger, herunder:
- føler sig svimmel,
- øjensmerter eller synsproblemer,
- lidt eller ingen vandladning,
- svaghed,
- døsighed,
- føler sig rastløs,
- feber ,
- kuldegysninger,
- ondt i halsen,
- sår i munden,
- synkebesvær,
- gulfarvning af hud og øjne (gulsot),
- kvalme,
- opkastning,
- prikkende følelse,
- brystsmerter,
- uregelmæssige hjerteslag eller flagrende i brystet,
- tab af bevægelse,
- kramper i benene,
- forstoppelse,
- ekstrem tørst,
- øget vandladning,
- følelsesløshed eller prikken,
- muskelsvaghed,
- hovedpine,
- tab eller koordination, og
- føler sig ustabil
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Zestoretic omfatter:
- hoste
- hovedpine
- svimmelhed
- træthedsfornemmelse
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Zestoretic. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
FØTALT TOKSICITET
- Når graviditet opdages, seponeres behandlingen med ZESTORETIC så hurtigt som muligt.
- Lægemidler, der virker direkte på renin-angiotensin-systemet, kan forårsage skade og død hos fosteret under udvikling. Se ADVARSLER Fostertoksicitet.
BESKRIVELSE
ZESTORETIC® (Lisinopril og Hydrochlorothiazide) kombinerer en angiotensinkonverterende enzymhæmmer, lisinopril, og et diuretikum, hydrochlorthiazid.
Lisinopril, et syntetisk peptidderivat, er en oral langtidsvirkende angiotensinkonverterende enzymhæmmer. Det er kemisk beskrevet som (S)-1-[N2-(1-carboxy-3-phenylpropyl)-L-lysyl]-L-prolin-dihydrat. Dens empiriske formel er C21H31N3O5. 2H2O og dets strukturformel er:
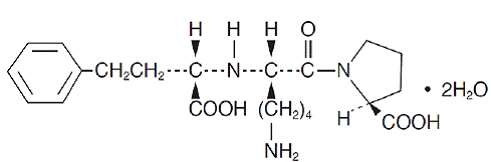
Lisinopril er et hvidt til råhvidt, krystallinsk pulver med en molekylvægt på 441,53. Det er opløseligt i vand, tungtopløseligt i methanol og praktisk talt uopløseligt i ethanol.
Hydrochlorthiazid er 6-chlor-3,4-dihydro-2H-1,2,4-benzothiadiazin-7-sulfonamid-1,1-dioxid. Dens empiriske formel er C7H8ClN3O4S2 og dens strukturformel er:
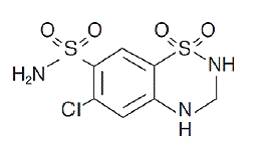
Hydrochlorthiazid er et hvidt eller praktisk talt hvidt krystallinsk pulver med en molekylvægt på 297,72, som er let opløseligt i vand, men let opløseligt i natriumhydroxidopløsning.
ZESTORETIC 5mg er tilgængelig til oral brug i tre tabletkombinationer af lisinopril med hydrochlorthiazid: ZESTORETIC 10-12,5 indeholdende 10 mg lisinopril og 12,5 mg hydrochlorthiazid; ZESTORETIC 20Reference 12.5 indeholdende 20 mg lisinopril og 12,5 mg hydrochlorthiazid; og ZESTORETIC 20-25 indeholdende 20 mg lisinopril og 25 mg hydrochlorthiazid.
inaktive ingredienser
10-12,5 Tabletter -calciumphosphat, magnesiumstearat, mannitol, rød jernoxid, majsstivelse, gul jernoxid.
20-12,5 tabletter -calciumphosphat, magnesiumstearat, mannitol, majsstivelse.
20-25 tabletter -calciumphosphat, magnesiumstearat, mannitol, rød jernoxid, majsstivelse, gul jernoxid.
INDIKATIONER
ZESTORETIC er indiceret til behandling af hypertension for at sænke blodtrykket. Sænkning af blodtrykket sænker risikoen for fatale og ikke-dødelige kardiovaskulære hændelser, primært slagtilfælde og myokardieinfarkter. Disse fordele er blevet set i kontrollerede forsøg med antihypertensiva fra en lang række farmakologiske klasser, herunder lisinopril og hydrochlorthiazid.
Kontrol af forhøjet blodtryk bør være en del af omfattende kardiovaskulær risikostyring, herunder, hvor det er relevant, lipidkontrol, diabetesbehandling, antitrombotisk behandling, rygestop, motion og begrænset natriumindtag. Mange patienter vil kræve mere end 1 lægemiddel for at nå blodtryksmålene. For specifik rådgivning om mål og ledelse, se offentliggjorte retningslinjer, såsom dem fra National High Blood Pressure Education Program's Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC).
Talrige antihypertensiva, fra en række farmakologiske klasser og med forskellige virkningsmekanismer, er i randomiserede kontrollerede forsøg blevet vist at reducere kardiovaskulær morbiditet og dødelighed, og det kan konkluderes, at det er blodtryksreduktion og ikke en anden farmakologisk egenskab ved stofferne, der i høj grad er ansvarlige for disse fordele. Den største og mest konsistente kardiovaskulære udfaldsfordel har været en reduktion i risikoen for slagtilfælde, men reduktioner i myokardieinfarkt og kardiovaskulær dødelighed er også set regelmæssigt.
Forhøjet systolisk eller diastolisk tryk forårsager øget kardiovaskulær risiko, og den absolutte risikostigning pr. mmHg er større ved højere blodtryk, så selv beskedne reduktioner af svær hypertension kan give væsentlige fordele. Relativ risikoreduktion fra blodtryksreduktion er ens på tværs af populationer med varierende absolut risiko, så den absolutte fordel er større hos patienter, der er i højere risiko uafhængigt af deres hypertension (f.eks. patienter med diabetes eller hyperlipidæmi), og sådanne patienter kan forventes at drage fordel af mere aggressiv behandling til et lavere blodtryksmål.
Nogle antihypertensiva har mindre blodtrykseffekter (som monoterapi) hos sorte patienter, og mange antihypertensiva har yderligere godkendte indikationer og virkninger (f.eks. på angina, hjertesvigt eller diabetisk nyresygdom). Disse overvejelser kan styre valg af terapi.
Disse kombinationer med faste doser er ikke indiceret til initial behandling (se DOSERING OG ADMINISTRATION ).
Ved brug af ZESTORETIC bør det tages i betragtning, at en angiotensin-konverterende enzymhæmmer, captopril, har forårsaget agranulocytose, især hos patienter med nedsat nyrefunktion eller kollagen vaskulær sygdom, og at tilgængelige data er utilstrækkelige til at vise, at lisinopril ikke har en lignende risiko (se ADVARSLER ).
Ved overvejelse af brugen af ZESTORETIC mg skal det bemærkes, at ACE-hæmmere er blevet forbundet med en højere forekomst af angioødem hos sorte end hos ikke-sorte patienter (se ADVARSLER , Lisinopril ).
DOSERING OG ADMINISTRATION
Lisinopril monoterapi er en effektiv behandling af hypertension i doser én gang dagligt på 10 mg til 80 mg, mens hydrochlorthiazid monoterapi er effektiv i doser på 12,5 mg pr. dag til 50 mg pr. dag. I kliniske forsøg med kombinationsbehandling med lisinopril/hydrochlorthiazid med lisinoprildoser på 10 mg til 80 mg og hydrochlorthiaziddoser på 6,25 mg til 50 mg, steg de antihypertensive responsrater generelt med stigende dosis af begge komponenter.
Bivirkningerne (se ADVARSLER ) af lisinopril er generelt sjældne og tilsyneladende uafhængige af dosis; dem af hydrochlorthiazid er en blanding af dosisafhængige fænomener (primært hypokaliæmi) og dosisuafhængige fænomener (f.eks. pancreatitis), førstnævnte meget mere almindelige end sidstnævnte. Terapi med en hvilken som helst kombination af lisinopril og hydrochlorthiazid kan være forbundet med enten dosisuafhængige eller dosisafhængige bivirkninger, men tilføjelse af lisinopril i kliniske forsøg gjorde den hypokaliæmi, der normalt ses med diuretika, sløvet.
For at minimere dosisafhængige bivirkninger er det normalt hensigtsmæssigt først at påbegynde kombinationsbehandling, efter at en patient ikke har opnået den ønskede effekt med monoterapi.
Dosistitrering styret af klinisk effekt
En patient, hvis blodtryk ikke er tilstrækkeligt kontrolleret med enten lisinopril eller hydrochlorthiazid monoterapi, kan skiftes til lisinopril/HCTZ 10/12,5 eller lisinopril/HCTZ 20/12,5, afhængigt af den aktuelle monoterapidosis. Yderligere stigninger af den ene eller begge komponenter bør afhænge af klinisk respons med blodtryk målt ved interdoseringsintervallet for at sikre, at der er en tilstrækkelig antihypertensiv effekt på det tidspunkt. Hydrochlorthiazid-dosis bør generelt ikke øges, før der er gået 2 til 3 uger. Efter tilsætning af diuretikum kan det være muligt at reducere dosis af lisinopril. Patienter, hvis blodtryk er tilstrækkeligt kontrolleret med 25 mg dagligt hydrochlorthiazid, men som oplever betydeligt kaliumtab med denne behandling, kan opnå tilsvarende eller større blodtrykskontrol uden elektrolytforstyrrelser, hvis de skiftes til lisinopril/HCTZ 10/12,5.
Hos patienter, som i øjeblikket behandles med et diuretikum, kan der lejlighedsvis forekomme symptomatisk hypotension efter den indledende dosis af lisinopril. Diuretikaet skal om muligt seponeres i to til tre dage før påbegyndelse af behandling med lisinopril for at reducere sandsynligheden for hypotension (se pkt. ADVARSLER ). Hvis patientens blodtryk ikke kontrolleres med lisinopril alene, kan diuretikabehandling genoptages.
Hvis diuretika ikke kan seponeres, bør en startdosis på 5 mg lisinopril anvendes under lægeligt tilsyn i mindst to timer, og indtil blodtrykket har stabiliseret sig i mindst en ekstra time (se pkt. ADVARSLER og FORHOLDSREGLER , DRUGSINTERAKTIONER ).
Samtidig administration af ZESTORETIC med kaliumtilskud, kaliumsalterstatninger eller kaliumbesparende diuretika kan føre til stigninger i serumkalium (se pkt. FORHOLDSREGLER ).
Erstatningsterapi
Kombinationen kan erstatte de titrerede individuelle komponenter.
Brug ved nedsat nyrefunktion
Behandlingsregimer med lisinopril/HCTZ behøver ikke tage hensyn til nyrefunktionen, så længe patientens kreatininclearance er >30 ml/min/1,7 m2 (serumkreatinin ca. ≤3 mg/dL eller 265 μmol/L). Hos patienter med mere alvorlig nyreinsufficiens foretrækkes loop-diuretika frem for thiazider, så lisinopril/HCTZ anbefales ikke (se ADVARSLER , Anafylaktoide reaktioner under membraneksponering ).
HVORDAN LEVERET
ZESTORETIC 10-12,5 tabletter: Ferskenfarvede, runde, bikonvekse, uovertrukne tabletter identificeret med "141" præget på den ene side og "ZESTORETIC" på den anden side, leveres i flasker med 90 tabletter ( NDC 52427-435-90) og flasker med 100 tabletter ( NDC 52427-435-01).
ZESTORETIC 20-12,5 tabletter : Hvide, runde, bikonvekse, uovertrukne tabletter identificeret med "142" præget på den ene side og "ZESTORETIC" på den anden side, leveres i flasker med 90 tabletter ( NDC 52427-436-90) og flasker med 100 tabletter ( NDC 52427-436-01).
ZESTORETIC 20-25 tabletter Ferskenfarvede, runde, bikonvekse, uovertrukne tabletter identificeret med "145" præget på den ene side og "ZESTORETIC" på den anden side, leveres i flasker med 90 tabletter ( NDC 52427-43790) og flasker med 100 tabletter ( NDC 52427-437-01).
Opbevaring
Opbevares ved kontrolleret stuetemperatur, 20-25°C (68-77°F) [se USP]. Beskyt mod overdreven lys og fugt.
Distribueret af: Almatica Pharma, Inc. Pine Brook, NJ 07058 USA. Revideret: juli 2017.
BIVIRKNINGER
ZESTORETIC 12,5gmg er blevet evalueret for sikkerhed hos 930 patienter, herunder 100 patienter behandlet i 50 uger eller mere.
I kliniske forsøg med ZESTORETIC er der ikke observeret bivirkninger, der er særlige for dette kombinationslægemiddel. Bivirkninger, der er opstået, har været begrænset til dem, der tidligere er blevet rapporteret med lisinopril eller hydrochlorthiazid.
De hyppigste kliniske bivirkninger i kontrollerede forsøg (inklusive åbne forlængelser) med enhver kombination af lisinopril og hydrochlorthiazid var: svimmelhed (7,5 %), hovedpine (5,2 %), hoste (3,9 %), træthed (3,7 %) og ortostatiske virkninger (3,2 %), som alle var mere almindelige end hos placebobehandlede patienter. Generelt var uønskede oplevelser milde og forbigående, men se ADVARSLER vedrørende angioødem og overdreven hypotension eller synkope. Seponering af behandlingen på grund af bivirkninger var påkrævet hos 4,4 % af patienterne, primært på grund af svimmelhed, hoste, træthed og muskelkramper.
Bivirkninger, der forekommer hos mere end én procent af patienterne behandlet med lisinopril plus hydrochlorthiazid i kontrollerede kliniske forsøg, er vist nedenfor.
Procent af patienter i kontrollerede undersøgelser
Kliniske bivirkninger, der forekom hos 0,3 % til 1,0 % af patienterne i kontrollerede forsøg og sjældnere, alvorlige, muligvis lægemiddelrelaterede hændelser rapporteret i markedsføringserfaring, er anført nedenfor:
Kroppen som helhed: Brystsmerter, mavesmerter, synkope, ubehag i brystet, feber, traumer, virusinfektion. Kardiovaskulær: Palpitation, ortostatisk hypotension. Fordøjelse: Mave-tarmkramper, mundtørhed, forstoppelse, halsbrand. Muskuloskeletale: Rygsmerter, skuldersmerter, knæsmerter, rygspændinger, myalgi, fodsmerter. Nervøs/psykiatrisk: Nedsat libido, svimmelhed, depression, somnolens. Åndedræt: Almindelig forkølelse, tilstoppet næse, influenza, bronkitis, svælgsmerter, dyspnø, lungetilstopning, kronisk bihulebetændelse, allergisk rhinitis, svælgbesvær. Hud: Rødmen, kløe, hudbetændelse, diaforese, kutant pseudolymfom. Særlige sanser: Sløret syn, tinnitus, otalgi. Urogenital: Urinvejsinfektion.
Angioødem: Angioødem i ansigt, ekstremiteter, læber, tunge, glottis og/eller larynx er blevet rapporteret (se ADVARSLER ).
I sjældne tilfælde er der rapporteret intestinalt angioødem efter markedsføring.
Hypotension: I kliniske forsøg forekom bivirkninger relateret til hypotension som følger: hypotension (1,4 %), ortostatisk hypotension (0,5 %), andre ortostatiske virkninger (3,2 %). Derudover forekom synkope hos 0,8 % af patienterne (se ADVARSLER ).
Hoste: Se FORHOLDSREGLER - Hoste .
Resultater af kliniske laboratorietest
Serum elektrolytter
(Se FORHOLDSREGLER ).
Kreatinin, Blod Urea Nitrogen
Mindre reversible stigninger i blodets urinstofnitrogen og serumkreatinin blev observeret hos patienter med essentiel hypertension behandlet med ZESTORETIC. Mere markante stigninger er også blevet rapporteret og var mere tilbøjelige til at forekomme hos patienter med nyrearteriestenose (se FORHOLDSREGLER ).
Serum Urinsyre, Glucose, Magnesium, Kolesterol, Triglycerider og Calcium
(Se FORHOLDSREGLER ).
Hæmoglobin og hæmatokrit
Små fald i hæmoglobin og hæmatokrit (gennemsnitlige fald på henholdsvis ca. 0,5 g% og 1,5 vol%) forekom hyppigt hos hypertensive patienter behandlet med ZESTORETIC 5 mg, men var sjældent af klinisk betydning, medmindre en anden årsag til anæmi fandtes sideløbende. I kliniske forsøg afbrød 0,4 % af patienterne behandlingen på grund af anæmi.
Leverfunktionstest
I sjældne tilfælde er der forekommet forhøjelser af leverenzymer og/eller serumbilirubin. (Se ADVARSLER , Leversvigt ).
Andre bivirkninger, der er blevet rapporteret med de individuelle komponenter, er anført nedenfor:
Lisinopril
I kliniske forsøg blev bivirkninger, som opstod med lisinopril, også set med ZESTORETIC. Derudover, og siden lisinopril er blevet markedsført, er følgende bivirkninger blevet rapporteret med lisinopril og bør betragtes som potentielle bivirkninger for ZESTORETIC: Kroppen som helhed: Anafylaktoide reaktioner (se ADVARSLER , Anafylaktoide reaktioner under membraneksponering ), utilpashed, ødem, ansigtsødem, smerte, bækkensmerter, flankesmerter, kulderystelser; Kardiovaskulær: Hjertestop, myokardieinfarkt eller cerebrovaskulær ulykke, muligvis sekundært til overdreven hypotension hos højrisikopatienter (se ADVARSLER , Hypotension ), lungeemboli og infarkt, forværring af hjerteinsufficiens, arytmier (inklusive takykardi, ventrikulær takykardi, atriel takykardi, atrieflimren, bradykardi og for tidlige ventrikulære kontraktioner), angina pectoris, forbigående iskæmisk tryk, nocturnoxys, fald i blodet, fald i blodet. ødem, vaskulitis; Fordøjelse: Pancreatitis, hepatitis (hepatocellulær eller kolestatisk gulsot) (se ADVARSLER , Leversvigt ), gastritis, anoreksi, flatulens, øget savlen; Endokrine: Diabetes mellitus, uhensigtsmæssig antidiuretisk hormonsekretion; Hæmatologisk: Sjældne tilfælde af knoglemarvsdepression, hæmolytisk anæmi, leukopeni/neutropeni og trombocytopeni er blevet rapporteret, hvor en årsagssammenhæng med lisinopril ikke kan udelukkes; Metabolisk: Gigt, vægttab, dehydrering, væskeoverbelastning, vægtøgning; Muskuloskeletale: Arthritis, artralgi, nakkesmerter, hoftesmerter, ledsmerter, bensmerter, armsmerter, lænde; Nervesystem/psykiatrisk: Ataksi, hukommelsessvækkelse, tremor, søvnløshed, slagtilfælde, nervøsitet, forvirring, perifer neuropati (f.eks. paræstesi, dysestesi), spasmer, hypersomni, irritabilitet; humørsvingninger (herunder depressive symptomer); hallucinationer; Åndedræt: Maligne lunge-neoplasmer, hæmoptyse, lungeødem, lungeinfiltrater, bronkospasme, astma, pleural effusion, lungebetændelse, eosinofil pneumonitis, hvæsende vejrtrækning, orthopnø, smertefuld respiration, epistaxis, laryngitis, bihulebetændelse, normal svulstbetændelse; Hud: Nældefeber, alopeci, herpes zoster, lysfølsomhed, hudlæsioner, hudinfektioner, pemfigus, erytem, psoriasis, sjældne tilfælde af andre alvorlige hudreaktioner, inklusive toksisk epidermal nekrolyse og Stevens-Johnsons syndrom (årsagssammenhæng er ikke blevet fastlagt); Særlige sanser: Synstab, diplopi, fotofobi, smagsændring, lugteforstyrrelse; Urogenital: Akut nyresvigt, oliguri, anuri, uræmi, progressiv azotæmi, nyreinsufficiens (se FORHOLDSREGLER og DOSERING OG ADMINISTRATION ), pyelonefritis, dysuri, brystsmerter.
Diverse
Et symptomkompleks er blevet rapporteret, som kan omfatte en positiv ANA, en forhøjet erytrocytsedimentationshastighed, artralgi/arthritis, myalgi, feber, vaskulitis, eosinofili og leukocytose. Udslæt, lysfølsomhed eller andre dermatologiske manifestationer kan forekomme alene eller i kombination med disse symptomer.
Hydrochlorthiazid
Kroppen som helhed: Svaghed; Fordøjelse: Anoreksi, maveirritation, kramper, gulsot (intrahepatisk kolestatisk gulsot) (se ADVARSLER , Leversvigt ), pancreatitis, sialoadenitis, obstipation; Hæmatologisk: Leukopeni, agranulocytose, trombocytopeni, aplastisk anæmi, hæmolytisk anæmi; Muskuloskeletale: Muskelspasme; Nervesystem/psykiatrisk: Rastløshed; Nyre: Nyresvigt, nyreinsufficiens, interstitiel nefritis (se ADVARSLER ); Hud: Erythema multiforme, herunder Stevens-Johnsons syndrom, eksfoliativ dermatitis, herunder toksisk epidermal nekrolyse, alopeci; Særlige sanser: Xanthopsia; Overfølsomhed: Purpura, lysfølsomhed, nældefeber, nekrotiserende angiitis (vaskulitis og kutan vaskulitis), åndedrætsbesvær inklusive pneumonitis og lungeødem, anafylaktiske reaktioner.
DRUGSINTERAKTIONER
Lisinopril
Hypotension -patienter på diuretikaterapi
Patienter i diuretika og især dem, hvor diuretikabehandling for nylig er iværksat, kan lejlighedsvis opleve en for kraftig reduktion af blodtrykket efter påbegyndelse af behandling med lisinopril. Muligheden for hypotensive virkninger med lisinopril kan minimeres ved enten at seponere diuretikummet eller øge saltindtaget før påbegyndelse af behandling med lisinopril. Hvis det er nødvendigt at fortsætte diuretikummet, påbegyndes behandlingen med lisinopril i en dosis på 5 mg dagligt, og der skal foretages tæt medicinsk overvågning efter den indledende dosis i mindst to timer, og indtil blodtrykket har stabiliseret sig i mindst en ekstra time (se pkt. ADVARSLER , og DOSERING OG ADMINISTRATION ). Når der tilføjes et diuretikum til behandlingen af en patient, der får lisinopril, observeres en yderligere antihypertensiv virkning normalt (se DOSERING OG ADMINISTRATION ).
Ikke-steroide antiinflammatoriske midler, herunder selektive cyclooxygenase-2-hæmmere (COX-2-hæmmere)
Hos ældre patienter, volumendepleterede (inklusive dem i diuretikabehandling) eller med nedsat nyrefunktion, kan samtidig administration af NSAID'er, inklusive selektive COX-2-hæmmere, med ACE-hæmmere, inklusive lisinopril, resultere i forringelse af nyrefunktionen , herunder eventuelt akut nyresvigt. Disse virkninger er normalt reversible. Overvåg nyrefunktionen periodisk hos patienter, der får lisinopril- og NSAID-behandling.
Den antihypertensive effekt af ACE-hæmmere, inklusive lisinopril, kan svækkes af NSAID'er.
Dobbelt blokade af Renin-Angiotensin System (RAS)
Dobbelt blokade af RAS med angiotensinreceptorblokkere, ACE-hæmmere eller aliskiren er forbundet med øget risiko for hypotension, hyperkaliæmi og ændringer i nyrefunktionen (inklusive akut nyresvigt) sammenlignet med monoterapi.
VA NEPHRON-studiet inkluderede 1448 patienter med type 2-diabetes, forhøjet urin-albumin-til-kreatinin-forhold og nedsat estimeret glomerulær filtrationshastighed (GFR 30 til 89,9 ml/min), randomiserede dem til lisinopril eller placebo på baggrund af losartanbehandling og fulgte dem i en median på 2,2 år. Patienter, der fik kombinationen af losartan og lisinopril, opnåede ingen yderligere fordele sammenlignet med monoterapi for det kombinerede endepunkt med fald i GFR, sluttilstand nyresygdom eller død, men oplevede en øget forekomst af hyperkaliæmi og akut nyreskade sammenlignet med monoterapigruppen .
Generelt skal du undgå kombineret brug af RAS-hæmmere, nøje overvåge blodtryk, nyrefunktion og elektrolytter hos patienter på ZESTORETIC og andre midler, der påvirker RAS.
Giv ikke aliskiren samtidig med ZESTORETIC til patienter med diabetes. Undgå brug af aliskiren med ZESTORETIC 5 mg til patienter med nedsat nyrefunktion (GFR
Andre agenter
Lisinopril er blevet brugt samtidig med nitrater og/eller digoxin uden tegn på klinisk signifikante uønskede interaktioner. Der forekom ingen betydningsfulde klinisk vigtige farmakokinetiske interaktioner, når lisinopril blev brugt samtidig med propranolol, digoxin eller hydrochlorthiazid. Tilstedeværelsen af mad i maven ændrer ikke biotilgængeligheden af lisinopril.
Midler, der øger serumkalium
Lisinopril dæmper kaliumtab forårsaget af diuretika af thiazidtypen. Brug af lisinopril sammen med kaliumbesparende diuretika (f.eks. spironolacton, eplerenon, triamteren eller amilorid), kaliumtilskud eller kaliumholdige salterstatninger kan føre til betydelige stigninger i serumkalium. Hvis samtidig brug af disse midler er indiceret på grund af påvist hypokaliæmi, bør de derfor anvendes med forsigtighed og med hyppig overvågning af serumkalium.
Lithium
Lithiumtoksicitet er blevet rapporteret hos patienter, der får lithium samtidig med lægemidler, der forårsager elimination af natrium, inklusive ACE-hæmmere. Lithiumtoksicitet var sædvanligvis reversibel ved seponering af lithium og ACE-hæmmeren. Det anbefales, at serumlithiumniveauer overvåges hyppigt, hvis lisinopril administreres samtidig med lithium.
mTOR (pattedyr Target Of Rapamycin) hæmmere
Patienter, der får samtidig behandling med ACE-hæmmer og mTOR-hæmmer (f.eks. temsirolimus, sirolimus, everolimus), kan have øget risiko for angioødem. (se ADVARSLER )
Neprilysin-hæmmere
Patienter, der samtidig tager neprilysinhæmmere, kan have øget risiko for angioødem. (se ADVARSLER )
Hydrochlorthiazid
Ved samtidig administration kan følgende lægemidler interagere med thiaziddiuretika.
Alkohol, barbiturater eller narkotika -potentiering af ortostatisk hypotension kan forekomme.
Antidiabetika (orale midler og insulin) -dosisjustering af det antidiabetiske lægemiddel kan være påkrævet.
Andre antihypertensiva -additiv effekt eller potensering.
Kolestyramin og colestipol harpikser - Absorptionen af hydrochlorthiazid er nedsat ved tilstedeværelse af anionbytterharpikser. Enkeltdoser af enten cholestyramin- eller colestipol-harpikser binder hydrochlorthiazidet og reducerer dets absorption fra mave-tarmkanalen med henholdsvis op til 85 % og 43 %.
Kortikosteroider, ACTH - intensiveret elektrolytudtømning, især hypokaliæmi.
Pressoraminer (f.eks. noradrenalin) - Mulig nedsat respons på pressoraminer, men ikke tilstrækkelig til at udelukke deres anvendelse.
Skeletmuskelafslappende midler, ikke-depolariserende (f.eks. tubocurarin) -mulig øget reaktionsevne over for muskelafslappende midler.
Lithium -bør generelt ikke gives sammen med diuretika. Diuretika reducerer den renale clearance af lithium og tilføjer en høj risiko for lithiumtoksicitet. Se indlægssedlen for lithiumpræparater før brug af sådanne præparater med ZESTORETIC.
Ikke-steroide antiinflammatoriske lægemidler Hos nogle patienter kan administration af et ikke-steroidt antiinflammatorisk middel reducere de diuretiske, natriuretiske og antihypertensive virkninger af loop-, kaliumbesparende og thiaziddiuretika. Derfor, når ZESTORETIC og ikke-steroide antiinflammatoriske midler anvendes samtidig, bør patienten observeres nøje for at afgøre, om den ønskede effekt af ZESTORETIC 5 mg opnås.
Guld
Nitritoidreaktioner (symptomer omfatter rødmen i ansigtet, kvalme, opkastning og hypotension) er sjældent blevet rapporteret hos patienter i behandling med injicerbart guld (natriumaurothiomalat) og samtidig behandling med ACE-hæmmere inklusive ZESTORETIC.
ADVARSLER
Lisinopril
Anafylaktoide og muligvis relaterede reaktioner
Formodentlig fordi angiotensin-konverterende enzymhæmmere påvirker metabolismen af eicosanoider og polypeptider, herunder endogent bradykinin, kan patienter, der får ACE-hæmmere (inklusive ZESTORETIC), blive udsat for en række bivirkninger, nogle af dem alvorlige.
Hoved og hals angioødem
Angioødem i ansigt, ekstremiteter, læber, tunge, glottis og/eller strubehoved er blevet rapporteret hos patienter behandlet med angiotensin-konverterende enzymhæmmere, inklusive lisinopril. Dette kan forekomme når som helst under behandlingen. ACE-hæmmere er blevet forbundet med en højere forekomst af angioødem hos sorte end hos ikke-sorte patienter. ZESTORETIC 12,5gmg bør omgående seponeres, og passende behandling og monitorering bør udføres, indtil fuldstændig og vedvarende opløsning af tegn og symptomer er fundet. Selv i de tilfælde, hvor der kun er tale om hævelse af tungen, uden åndedrætsbesvær, kan patienter kræve langvarig observation, da behandling med antihistaminer og kortikosteroider muligvis ikke er tilstrækkelig. Meget sjældent er dødsfald blevet rapporteret på grund af angioødem forbundet med larynxødem eller tungeødem. Patienter med involvering af tungen, glottis eller larynx vil sandsynligvis opleve luftvejsobstruktion, især dem med en historie med luftvejskirurgi. Hvor der er involvering af tungen, glottis eller strubehovedet, som sandsynligvis forårsager luftvejsobstruktion, bør subkutan epinephrinopløsning 1:1000 (0,3 ml til 0,5 ml) og/eller nødvendige foranstaltninger for at sikre frie luftveje omgående sørges for (se BIVIRKNINGER) .
Patienter, der får samtidig administration af ACE-hæmmer og mTOR (pattedyrmål for rapamycin)-hæmmer (f.eks. temsirolimus, sirolimus, everolimus) eller en neprilysinhæmmer kan have øget risiko for angioødem (se FORHOLDSREGLER ).
Intestinalt angioødem
Intestinalt angioødem er blevet rapporteret hos patienter behandlet med ACE-hæmmere. Disse patienter fik mavesmerter (med eller uden kvalme eller opkastning); i nogle tilfælde var der ingen tidligere anamnese med ansigtsangioødem, og C-1-esteraseniveauerne var normale. Angioødemet blev diagnosticeret ved procedurer, herunder abdominal CT-scanning eller ultralyd, eller ved operation, og symptomerne forsvandt efter seponering af ACE-hæmmeren. Intestinalt angioødem bør inkluderes i differentialdiagnosen af patienter på ACE-hæmmere med mavesmerter.
Patienter med en anamnese med angioødem, der ikke er relateret til behandling med ACE-hæmmere, kan have øget risiko for angioødem, mens de får en ACE-hæmmer (se INDIKATIONER og KONTRAINDIKATIONER ).
Anafylaktoide reaktioner under desensibilisering
To patienter, der undergik desensibiliserende behandling med hymenoptera-gift, mens de fik ACE-hæmmere, vedvarende livstruende anafylaktoide reaktioner.
Hos de samme patienter blev disse reaktioner undgået, når ACE-hæmmere midlertidigt blev holdt tilbage, men de dukkede op igen ved utilsigtet genudsættelse.
Anafylaktoide reaktioner under membraneksponering
Thiazidholdige kombinationsprodukter anbefales ikke til patienter med svær nyreinsufficiens. Pludselige og potentielt livstruende anafylaktoide reaktioner er blevet rapporteret hos nogle patienter, der er dialyseret med højfluxmembraner (f.eks. AN69®**) og behandlet samtidig med en ACE-hæmmer. Hos sådanne patienter skal dialyse stoppes øjeblikkeligt, og aggressiv behandling for anafylaktoide reaktioner skal påbegyndes. Symptomerne er ikke blevet lindret af antihistaminer i disse situationer. Hos disse patienter bør det overvejes at bruge en anden type dialysemembran eller en anden klasse af antihypertensiva. Anafylaktoide reaktioner er også blevet rapporteret hos patienter, der gennemgår low-density lipoprotein-aferese med dextransulfatabsorption.
Hypotension og relaterede effekter
Overdreven hypotension blev sjældent set hos ukomplicerede hypertensive patienter, men er en mulig konsekvens af brug af lisinopril hos salt-/volumen-depleterede personer, såsom dem, der behandles kraftigt med diuretika eller patienter i dialyse (se DRUGSINTERAKTIONER og BIVIRKNINGER ).

Synkope er blevet rapporteret hos 0,8 procent af patienterne, der fik ZESTORETIC. Hos patienter med hypertension, der fik lisinopril alene, var forekomsten af synkope 0,1 procent. Den samlede forekomst af synkope kan reduceres ved korrekt titrering af de individuelle komponenter (se DRUGSINTERAKTIONER , BIVIRKNINGER og DOSERING OG ADMINISTRATION ).
Hos patienter med svær kongestiv hjerteinsufficiens, med eller uden associeret nyreinsufficiens, er overdreven hypotension blevet observeret og kan være forbundet med oliguri og/eller progressiv azotæmi og sjældent med akut nyresvigt og/eller død. På grund af det potentielle blodtryksfald hos disse patienter, bør behandlingen påbegyndes under meget tæt medicinsk overvågning. Sådanne patienter bør følges nøje i de første to ugers behandling og hver gang dosis af lisinopril og/eller diuretikum øges. Lignende overvejelser gælder for patienter med iskæmisk hjerte- eller cerebrovaskulær sygdom, hvor et for stort blodtryksfald kan resultere i et myokardieinfarkt eller cerebrovaskulær ulykke.
Hvis der opstår hypotension, skal patienten placeres i liggende stilling og om nødvendigt modtage en intravenøs infusion af normalt saltvand. Et forbigående hypotensivt respons er ikke en kontraindikation for yderligere doser, som normalt kan gives uden besvær, når blodtrykket er steget efter volumenudvidelse.
Leukopeni/Neutropeni/Agranulocytose
En anden angiotensin-konverterende enzymhæmmer, captopril, har vist sig at forårsage agranulocytose og knoglemarvsdepression, sjældent hos ukomplicerede patienter, men hyppigere hos patienter med nedsat nyrefunktion, især hvis de også har en kollagen karsygdom. Tilgængelige data fra kliniske forsøg med lisinopril er utilstrækkelige til at vise, at lisinopril ikke forårsager agranulocytose i tilsvarende hastigheder. Markedsføringserfaring har afsløret sjældne tilfælde af leukopeni/neutropeni og knoglemarvsdepression, hvor en årsagssammenhæng med lisinopril ikke kan udelukkes. Periodisk overvågning af antallet af hvide blodlegemer hos patienter med kollagen vaskulær sygdom og nyresygdom bør overvejes.
Leversvigt
sjældne tilfælde er ACE-hæmmere blevet forbundet med et syndrom, der starter med kolestatisk gulsot eller hepatitis og udvikler sig til fulminant levernekrose og (nogle gange) død. Mekanismen for dette syndrom er ikke forstået. Patienter, der får ACE-hæmmere, og som udvikler gulsot eller markante forhøjelser af leverenzymer, bør seponere ACE-hæmmeren og modtage passende medicinsk opfølgning.
Føtal toksicitet
Graviditetskategori D
Brug af lægemidler, der virker på renin-angiotensin-systemet i andet og tredje trimester af graviditeten, reducerer føtal nyrefunktion og øger føtal og neonatal morbiditet og død. Resulterende oligohydramnios kan være forbundet med føtal lungehypoplasi og skeletdeformationer. Potentielle neonatale bivirkninger omfatter kraniehypoplasi, anuri, hypotension, nyresvigt og død. Når graviditet opdages, seponeres behandlingen med ZESTORETIC så hurtigt som muligt. Disse negative resultater er normalt forbundet med brugen af disse lægemidler i andet og tredje trimester af graviditeten. De fleste epidemiologiske undersøgelser, der undersøgte føtale abnormiteter efter eksponering for antihypertensiv brug i første trimester, har ikke skelnet lægemidler, der påvirker renin-angiotensin-systemet, fra andre antihypertensiva. Passende håndtering af maternel hypertension under graviditet er vigtig for at optimere resultaterne for både mor og foster.
det usædvanlige tilfælde, hvor der ikke er noget passende alternativ til behandling med lægemidler, der påvirker reninangiotensinsystemet for en bestemt patient, skal moderen informeres om den potentielle risiko for fosteret. Udfør serielle ultralydsundersøgelser for at vurdere det intra-amniotiske miljø. Hvis oligohydramnios observeres, skal du seponere ZESTORETIC, medmindre det anses for at være livreddende for moderen. Fostertest kan være passende, baseret på graviditetsugen. Patienter og læger skal dog være opmærksomme på, at oligohydramnios muligvis ikke vises, før fosteret har pådraget sig irreversibel skade. Overvåg nøje spædbørn med historier om in utero eksponering for ZESTORETIC for hypotension, oliguri og hyperkaliæmi. (Se FORHOLDSREGLER, Pædiatrisk brug ).
Ingen teratogene virkninger af lisinopril blev set i undersøgelser af gravide rotter, mus og kaniner. På mg/kg basis var de anvendte doser op til 625 gange (i mus), 188 gange (i rotter) og 0,6 gange (i kaniner) den maksimalt anbefalede humane dosis.
Lisinopril og Hydrochlorthiazid
Teratogenicitetsundersøgelser blev udført på mus og rotter med op til 90 mg/kg/dag af lisinopril (56 gange den maksimale anbefalede humane dosis) i kombination med 10 mg/kg/dag hydrochlorthiazid (2,5 gange den maksimale anbefalede humane dosis). Maternelle eller føtotoksiske virkninger blev ikke set hos mus med kombinationen. Hos rotter forekom der nedsat moderens vægtøgning og nedsat fostervægt ned til 3/10 mg/kg/dag (den laveste testede dosis). Forbundet med den nedsatte føtale vægt var en forsinkelse i føtal ossifikation. Den nedsatte føtale vægt og forsinkelse i føtal ossifikation blev ikke set hos saltvandssupplerede dyr, som fik 90/10 mg/kg/dag.
Når de anvendes under graviditet, i andet og tredje trimester, kan ACE-hæmmere forårsage skade og endda død for det udviklende foster. Når graviditet opdages, skal du seponere ZESTORETIC 5mg så hurtigt som muligt ( Se Lisinopril, føtal toksicitet ).
Hydrochlorthiazid
Akut nærsynethed og sekundær vinkel-lukkende glaukom
Hydrochlorthiazid, et sulfonamid, kan forårsage en idiosynkratisk reaktion, hvilket resulterer i akut forbigående nærsynethed og akut vinkel-lukkende glaukom. Symptomer omfatter akut indtræden af nedsat synsstyrke eller øjensmerter og opstår typisk inden for timer til uger efter lægemiddelinitiering. Ubehandlet akut vinkel-lukkende glaukom kan føre til permanent synstab. Den primære behandling er at seponere hydrochlorthiazid så hurtigt som muligt. Hurtige medicinske eller kirurgiske behandlinger skal muligvis overvejes, hvis det intraokulære tryk forbliver ukontrolleret. Risikofaktorer for udvikling af akut vinkel-lukkende glaukom kan omfatte en historie med sulfonamid- eller penicillinallergi.
Teratogene virkninger
Reproduktionsundersøgelser hos kanin, mus og rotte ved doser op til 100 mg/kg/dag (50 gange human dosis) viste ingen tegn på ydre abnormiteter hos fosteret på grund af hydrochlorthiazid. Hydrochlorthiazid givet i et to-kulds studie med rotter i doser på 4 mg/kg/dag til 5,6 mg/kg/dag (ca. 1 til 2 gange den sædvanlige daglige humane dosis) forringede ikke fertiliteten eller gav fødselsabnormiteter hos afkommet. Thiazider krydser placentabarrieren og optræder i navlestrengsblod.
Ikke-ratatogene virkninger
Disse kan omfatte føtal eller neonatal gulsot, trombocytopeni, og der er muligvis forekommet andre bivirkninger hos den voksne.
Hydrochlorthiazid
Thiazider bør anvendes med forsigtighed ved alvorlig nyresygdom. Hos patienter med nyresygdom kan thiazider udløse azotæmi. Kumulative virkninger af lægemidlet kan udvikle sig hos patienter med nedsat nyrefunktion.
Thiazider bør anvendes med forsigtighed til patienter med nedsat leverfunktion eller progressiv leversygdom, da mindre ændringer i væske- og elektrolytbalancen kan fremkalde leverkoma.
Følsomhedsreaktioner kan forekomme hos patienter med eller uden en historie med allergi eller bronkial astma.
Muligheden for eksacerbation eller aktivering af systemisk lupus erythematosus er blevet rapporteret.
Lithium bør generelt ikke gives sammen med thiazider (se DRUGSINTERAKTIONER , Lisinopril og Hydrochlorthiazid ).
FORHOLDSREGLER
Generel
Lisinopril
Aortastenose/hypertrofisk kardiomyopati
Som med alle vasodilatorer bør lisinopril gives med forsigtighed til patienter med obstruktion i udstrømningskanalen i venstre ventrikel.
Nedsat nyrefunktion
Som en konsekvens af hæmning af renin-angiotensin-aldosteron-systemet kan ændringer i nyrefunktionen forventes hos følsomme personer. Hos patienter med svær kongestiv hjertesvigt, hvis nyrefunktion kan afhænge af aktiviteten af renin-angiotensin-aldosteron-systemet, kan behandling med angiotensin-konverterende enzymhæmmere, inklusive lisinopril, være forbundet med oliguri og/eller progressiv azotæmi og sjældent med akut nyrefunktion. svigt og/eller død.
Hos hypertensive patienter med unilateral eller bilateral nyrearteriestenose kan stigninger i blodets urinstofnitrogen og serumkreatinin forekomme. Erfaring med en anden angiotensin-konverterende enzymhæmmer tyder på, at disse stigninger sædvanligvis er reversible ved seponering af lisinopril og/eller diuretikabehandling. Hos sådanne patienter bør nyrefunktionen overvåges i løbet af de første par uger af behandlingen.
Nogle hypertensive patienter uden tilsyneladende allerede eksisterende renal vaskulær sygdom har udviklet stigninger i blodurinstof og serumkreatinin, sædvanligvis mindre og forbigående, især når lisinopril er blevet givet samtidig med et diuretikum. Dette er mere tilbøjeligt til at forekomme hos patienter med allerede eksisterende nyreinsufficiens. Dosisreduktion af lisinopril og/eller seponering af diuretika kan være påkrævet.
Evaluering af den hypertensive patient bør altid omfatte vurdering af nyrefunktionen (se DOSERING OG ADMINISTRATION).
Hyperkaliæmi
kliniske forsøg forekom hyperkaliæmi (serumkalium større end 5,7 mEq/L) hos ca. 1,4 procent af hypertensive patienter behandlet med lisinopril plus hydrochlorthiazid. I de fleste tilfælde var disse isolerede værdier, som forsvandt på trods af fortsat behandling. Hyperkaliæmi var ikke en årsag til seponering af behandlingen. Risikofaktorer for udvikling af hyperkaliæmi omfatter nyreinsufficiens, diabetes mellitus og samtidig brug af kaliumbesparende diuretika, kaliumtilskud og/eller kaliumholdige salterstatninger. Hyperkaliæmi kan forårsage alvorlige, nogle gange dødelige, arytmier. ZESTORETIC bør anvendes med forsigtighed, hvis overhovedet, med disse midler og med hyppig kontrol af serumkalium (se DRUGSINTERAKTIONER ).
Hoste
Formodentlig på grund af hæmningen af nedbrydningen af endogent bradykinin, er vedvarende ikke-produktiv hoste blevet rapporteret med alle ACE-hæmmere, som næsten altid forsvinder efter seponering af behandlingen. ACE-hæmmer-induceret hoste bør overvejes ved differentialdiagnosticering af hoste.
Kirurgi/Anæstesi
Hos patienter, der gennemgår større operationer eller under anæstesi med midler, der producerer hypotension, kan lisinopril blokere angiotensin II-dannelse sekundært til kompensatorisk reninfrigivelse. Hvis hypotension opstår og anses for at skyldes denne mekanisme, kan den korrigeres ved volumenudvidelse.
Hydrochlorthiazid
Periodisk bestemmelse af serumelektrolytter for at påvise mulig elektrolytubalance bør udføres med passende intervaller.
Alle patienter, der får thiazidbehandling, bør observeres for kliniske tegn på væske- eller elektrolyt-ubalance: nemlig hyponatriæmi, hypokloræmisk alkalose og hypokaliæmi. Serum- og urinelektrolytbestemmelser er særligt vigtige, når patienten kaster op for meget eller får parenterale væsker. Advarselstegn eller symptomer på væske- og elektrolyt-ubalance, uanset årsag, omfatter mundtørhed, tørst, svaghed, sløvhed, døsighed, rastløshed, forvirring, kramper, muskelsmerter eller -kramper, muskeltræthed, hypotension, oliguri, takykardi og mave-tarmforstyrrelser såsom kvalme og opkastning.
Hypokaliæmi kan udvikle sig, især med rask diurese, når der er alvorlig skrumpelever, eller efter længere tids behandling.
Interferens med tilstrækkelig oral elektrolytindtagelse vil også bidrage til hypokaliæmi. Hypokaliæmi kan forårsage hjertearytmi og kan også sensibilisere eller overdrive hjertets reaktion på de toksiske virkninger af digitalis (f.eks. øget ventrikulær irritabilitet). Da lisinopril reducerer produktionen af aldosteron, dæmper samtidig behandling med lisinopril det diuretika-inducerede kaliumtab (se DRUGSINTERAKTIONER , Agenter, der øger serumkalium ).
Selvom ethvert kloridunderskud generelt er mildt og normalt ikke kræver specifik behandling, undtagen under ekstraordinære omstændigheder (som ved leversygdom eller nyresygdom), kan kloriderstatning være påkrævet i behandlingen af metabolisk alkalose.
Fortyndingshyponatriæmi kan forekomme hos ødematøse patienter i varmt vejr; passende behandling er vandrestriktion snarere end administration af salt undtagen i sjældne tilfælde, hvor hyponatriæmien er livstruende. Ved faktisk saltudtømning er passende erstatning den foretrukne terapi.
Hyperurikæmi kan forekomme, eller der kan udløses gigt hos visse patienter, der får thiazidbehandling.
Hos diabetikere kan det være nødvendigt at justere dosis af insulin eller orale hypoglykæmiske midler. Hyperglykæmi kan forekomme med thiaziddiuretika. Derfor kan latent diabetes mellitus blive manifest under thiazidbehandling.
De antihypertensive virkninger af lægemidlet kan forstærkes hos postsympatiktomipatienter.
Hvis progressiv nyreinsufficiens bliver tydelig, skal du overveje at afbryde eller afbryde diuretikabehandling.
Thiazider har vist sig at øge urinudskillelsen af magnesium; dette kan resultere i hypomagnesæmi.
Thiazider kan nedsætte calciumudskillelsen i urinen. Thiazider kan forårsage intermitterende og let forhøjelse af serumcalcium i fravær af kendte forstyrrelser i calciummetabolismen. Udtalt hypercalcæmi kan være tegn på skjult hyperparathyroidisme. Thiazider bør seponeres, før der udføres test for biskjoldbruskkirtlens funktion.
Forøgelser i kolesterol- og triglyceridniveauer kan være forbundet med thiaziddiuretikabehandling.
Karcinogenese, mutagenese, svækkelse af fertilitet
Lisinopril og hydrochlorthiazid
Lisinopril i kombination med hydrochlorthiazid var ikke mutagent i en mikrobiel mutagentest med Salmonella typhimurium (Ames-test) eller Escherichia coli med eller uden metabolisk aktivering eller i et fremadgående mutationsassay med lungeceller fra kinesisk hamster. Lisinopril og hydrochlorthiazid producerede ikke DNA-enkeltstrengsbrud i en in vitro alkalisk elueringstest af rottehepatocytter. Derudover producerede det ikke stigninger i kromosomafvigelser i en in vitro-test i kinesisk hamster-ovarieceller eller i et in vivo-studie i museknoglemarv.
Lisinopril
Der var ingen tegn på en tumorigen effekt, når lisinopril blev administreret i 105 uger til han- og hunrotter i doser op til 90 mg/kg/dag (ca. 56 eller 9 gange* den maksimale daglige humane dosis baseret på kropsvægt og kropsoverflade henholdsvis område). Der var ingen tegn på karcinogenicitet, når lisinopril blev administreret i 92 uger til (han- og hunmus) i doser op til 135 mg/kg/dag (ca. 84 gange* den maksimale anbefalede daglige humane dosis). Denne dosis var 6,8 gange den maksimale humane dosis baseret på kropsoverfladeareal hos mus.
*Beregninger antager en menneskelig vægt på 50 kg og en menneskelig kropsoverflade på 1,62m2.
Lisinopril var ikke mutagent i Ames mikrobielle mutagentest med eller uden metabolisk aktivering. Det var også negativt i et fremadgående mutationsassay under anvendelse af kinesiske hamsterlungeceller. Lisinopril producerede ikke enkeltstrengede DNA-brud i en in vitro alkalisk elueringstest af rottehepatocytter. Derudover producerede lisinopril ikke stigninger i kromosomafvigelser i en in vitro-test i ovarieceller fra kinesisk hamster eller i et in vivo-studie i museknoglemarv.
Der var ingen bivirkninger på reproduktionsevnen hos han- og hunrotter behandlet med op til 300 mg/kg/dag lisinopril. Denne dosis er 188 gange og 30 gange den maksimale daglige humane dosis baseret på henholdsvis mg/kg og mg/m2.
Hydrochlorthiazid
Toårige fodringsundersøgelser i mus og rotter udført i regi af National Toxicology Program (NTP) afslørede ingen tegn på et kræftfremkaldende potentiale af hydrochlorthiazid hos hunmus (ved doser på op til ca. 600 mg/kg/dag) eller hos hankøn. og hunrotter (ved doser på op til ca. 100 mg/kg/dag). Disse doser er 150 gange og 12 gange for mus og 25 gange og 4 gange for rotter den maksimale humane daglige dosis baseret på henholdsvis mg/kg og mg/m2. NTP fandt imidlertid tvetydige beviser for hepatokarcinogenicitet hos hanmus.
Hydrochlorthiazid var ikke genotoksisk in vitro i Ames-mutagenicitetsanalysen af Salmonella typhimurium-stammer TA 98, TA 100, TA 1535, TA 1537 og TA 1538 og i den kinesiske hamsterovarie (CHO)-test for kromosomafvigelser ved brug af vibrationer, eller kimcellekromosomer fra mus, knoglemarvskromosomer fra kinesisk hamster og det kønsbundne recessive letale træk ved Drosophila. Positive testresultater blev kun opnået i in vitro CHO Sister Chromatid Exchange (klastogenicitet) og i muselymfomcelle (mutagenicitet) assays ved anvendelse af koncentrationer af hydrochlorthiazid fra 43 mcg/mL til 1300 mcg/mL og i Aspergillus nidulans nondisjunction assay i en uspecificeret koncentration.
Hydrochlorthiazid havde ingen negative virkninger på fertiliteten hos mus og rotter af begge køn i undersøgelser, hvor disse arter via deres diæt blev udsat for doser på op til henholdsvis 100 mg/kg og 4 mg/kg før undfangelse og gennem hele graviditeten. . Hos mus er denne dosis 25 gange og 2 gange den maksimale daglige humane dosis baseret på henholdsvis mg/kg og mg/m2. Hos rotter er denne dosis 1 gange og 0,2 gange den maksimale daglige humane dosis baseret på henholdsvis mg/kg og mg/m2.
Ammende mødre
Det vides ikke, om lisinopril udskilles i modermælk. Mælk fra diegivende rotter indeholder imidlertid radioaktivitet efter administration af 14C lisinopril. I en anden undersøgelse var lisinopril til stede i rottemælk i niveauer svarende til plasmaniveauer i moderdyrene. Thiazider forekommer i modermælk. På grund af risikoen for alvorlige bivirkninger hos ammende spædbørn fra ACE-hæmmere og hydrochlorthiazid, bør der tages en beslutning om, hvorvidt amningen skal afbrydes og/eller seponeres med ZESTORETIC 12,5 g, under hensyntagen til lægemidlets betydning for moderen.
Pædiatrisk brug
Nyfødte med en historie om i utero eksponering for ZESTORETIC
Hvis der opstår oliguri eller hypotension, skal du rette opmærksomheden mod understøttelse af blodtryk og nyreperfusion. Udskiftningstransfusioner eller dialyse kan være påkrævet som et middel til at vende hypotension og/eller erstatte forstyrret nyrefunktion. Lisinopril, som krydser placenta, er blevet fjernet fra neonatal kredsløb ved peritonealdialyse med en vis klinisk fordel, og kan teoretisk fjernes ved byttetransfusion, selvom der ikke er erfaring med sidstnævnte procedure.
Sikkerhed og effektivitet hos pædiatriske patienter er ikke blevet fastslået.
Geriatrisk brug
Kliniske undersøgelser af ZESTORETIC mg inkluderede ikke et tilstrækkeligt antal forsøgspersoner på 65 år og derover til at afgøre, om de reagerer anderledes end yngre forsøgspersoner. Andre rapporterede kliniske erfaringer har ikke identificeret forskelle i respons mellem ældre og yngre patienter. Generelt bør dosisvalg for en ældre patient være forsigtigt, sædvanligvis begyndende i den lave ende af doseringsområdet, hvilket afspejler den større hyppighed af nedsat lever-, nyre- eller hjertefunktion og af samtidig sygdom eller anden lægemiddelbehandling.
Dette lægemiddel vides at udskilles væsentligt af nyrerne, og risikoen for toksiske reaktioner på dette lægemiddel kan være større hos patienter med nedsat nyrefunktion. Da ældre patienter er mere tilbøjelige til at have nedsat nyrefunktion, bør der udvises forsigtighed ved dosisvalg. Evaluering af den hypertensive patient bør altid omfatte vurdering af nyrefunktionen.
OVERDOSIS
Der er ingen specifik information tilgængelig om behandling af overdosering med ZESTORETIC. Behandlingen er symptomatisk og understøttende. Behandling med ZESTORETIC 12,5 g skal seponeres og patienten observeres nøje. Foreslåede foranstaltninger omfatter fremkaldelse af emeser og/eller maveskylning og korrektion af dehydrering, elektrolytubalance og hypotension ved etablerede procedurer.
Lisinopril
Efter en enkelt oral dosis på 20 g/kg forekom ingen dødelighed hos rotter, og døden forekom hos en af 20 mus, der fik den samme dosis. Den mest sandsynlige manifestation af overdosering vil være hypotension, for hvilken den sædvanlige behandling vil være intravenøs infusion af normal saltvandsopløsning.
Lisinopril kan fjernes ved hæmodialyse (se ADVARSLER , Anafylaktoid reaktion under membraneksponering ).
Hydrochlorthiazid
Oral administration af en enkelt oral dosis på 10 g/kg til mus og rotter var ikke dødelig. De mest almindelige observerede tegn og symptomer er dem, der er forårsaget af elektrolytmangel (hypokalæmi, hypochloræmi, hyponatriæmi) og dehydrering som følge af overdreven diurese. Hvis digitalis også er blevet administreret, kan hypokaliæmi accentuere hjertearytmier.
KONTRAINDIKATIONER
ZESTORETIC 12,5 g er kontraindiceret til patienter, der er overfølsomme over for dette produkt og til patienter med angioødem i anamnesen relateret til tidligere behandling med en angiotensin-konverterende enzymhæmmer og til patienter med arvelig eller idiopatisk angioødem. På grund af hydrochlorthiazid-komponenten er dette produkt kontraindiceret til patienter med anuri eller overfølsomhed over for andre sulfonamid-afledte lægemidler.
ZESTORETIC 12,5 g er kontraindiceret i kombination med en neprilysinhæmmer (f.eks. sacubitril). ZESTORETIC 5 mg må ikke administreres inden for 36 timer efter skift til eller fra sacubitril/valsartan, en neprilysinhæmmer (se ADVARSLER ).
Giv ikke aliskiren samtidig med ZESTORETIC til patienter med diabetes (se DRUGSINTERAKTIONER ).
KLINISK FARMAKOLOGI
Lisinopril og hydrochlorthiazid
Som et resultat af dets diuretiske virkning øger hydrochlorthiazid plasmareninaktiviteten, øger aldosteronsekretionen og nedsætter serumkalium. Administration af lisinopril blokerer reninangiotensin-aldosteron-aksen og har en tendens til at vende kaliumtabet i forbindelse med diuretika.
I kliniske undersøgelser var omfanget af blodtryksreduktion set med kombinationen af lisinopril og hydrochlorthiazid omtrent additiv. ZESTORETIC 10-12.5 kombinationen fungerede lige godt hos sorte og hvide patienter. Kombinationerne ZESTORETIC 20-12.5 og ZESTORETIC 20-25 virkede noget mindre effektive hos sorte patienter, men relativt få sorte patienter blev undersøgt. Hos de fleste patienter var den antihypertensive virkning af ZESTORETIC opretholdt i mindst 24 timer.
en randomiseret, kontrolleret sammenligning var de gennemsnitlige antihypertensive virkninger af ZESTORETIC 20-12.5 og ZESTORETIC 20-25 ens, hvilket tyder på, at mange patienter, der reagerer tilstrækkeligt på sidstnævnte kombination, kan kontrolleres med ZESTORETIC 20-12.5 (se DOSERING OG ADMINISTRATION ).
Samtidig administration af lisinopril og hydrochlorthiazid har ringe eller ingen effekt på biotilgængeligheden af begge lægemidler. Kombinationstabletten er bioækvivalent med samtidig administration af de separate enheder.
Lisinopril
Handlingsmekanisme
Lisinopril hæmmer angiotensin-konverterende enzym (ACE) hos mennesker og dyr. ACE er en peptidyldipeptidase, der katalyserer omdannelsen af angiotensin I til det vasokonstriktor-stof, angiotensin II. Angiotensin II stimulerer også aldosteronsekretionen fra binyrebarken. Hæmning af ACE resulterer i nedsat plasmaangiotensin II, hvilket fører til nedsat vasopressoraktivitet og nedsat aldosteronsekretion. Sidstnævnte fald kan resultere i en lille stigning i serumkalium. Fjernelse af angiotensin II negativ feedback på reninsekretion fører til øget plasmareninaktivitet. Hos hypertensive patienter med normal nyrefunktion behandlet med lisinopril alene i op til 24 uger, var den gennemsnitlige stigning i serumkalium mindre end 0,1 mEq/L; dog havde cirka 15 procent af patienterne stigninger på mere end 0,5 mEq/L, og cirka seks procent havde et fald på mere end 0,5 mEq/L. I samme undersøgelse viste patienter behandlet med lisinopril plus et thiaziddiuretikum stort set ingen ændringer i serumkalium (se FORHOLDSREGLER ).
ACE er identisk med kininase, et enzym, der nedbryder bradykinin. Hvorvidt forhøjede niveauer af bradykinin, et potent vasodepressorpeptid, spiller en rolle i de terapeutiske virkninger af lisinopril, mangler at blive belyst.
Mens den mekanisme, hvorigennem lisinopril sænker blodtrykket, menes primært at være suppression af renin-angiotensin-aldosteron-systemet, er lisinopril antihypertensiv selv hos patienter med lav-renin-hypertension. Selvom lisinopril var antihypertensivt i alle undersøgte racer, havde sorte hypertensive patienter (sædvanligvis en lav-renin hypertensiv population) et mindre gennemsnitligt respons på lisinopril monoterapi end ikke-sorte patienter.
Farmakokinetik og metabolisme
Efter oral administration af lisinopril opstår maksimale serumkoncentrationer inden for ca. 7 timer. Faldende serumkoncentrationer udviser en forlænget terminalfase, som ikke bidrager til lægemiddelakkumulering. Denne terminale fase repræsenterer sandsynligvis mættelig binding til ACE og er ikke proportional med dosis. Lisinopril ser ikke ud til at være bundet til andre serumproteiner.
Lisinopril metaboliseres ikke og udskilles uændret helt i urinen. Baseret på uringenvinding er den gennemsnitlige absorptionsgrad af lisinopril ca. 25 procent, med stor interindividuel variabilitet (6 % til 60 %) ved alle testede doser (5 mg til 80 mg). Lisinopril absorption påvirkes ikke af tilstedeværelsen af mad i mave-tarmkanalen.
Ved gentagen dosering udviser lisinopril en effektiv halveringstid ved akkumulering på 12 timer.
Nedsat nyrefunktion nedsætter eliminationen af lisinopril, som hovedsageligt udskilles gennem nyrerne, men dette fald bliver først klinisk vigtigt, når den glomerulære filtrationshastighed er under 30 ml/min. Over denne glomerulære filtrationshastighed er eliminationshalveringstiden lidt ændret. Ved større svækkelse stiger peak- og dalniveauer af lisinopril imidlertid, tiden til peak-koncentrationen stiger, og tiden til at opnå steady state forlænges. Ældre patienter har i gennemsnit (ca. fordoblet) højere blodniveauer og areal under plasmakoncentrationstidskurven (AUC) end yngre patienter (se DOSERING OG ADMINISTRATION ). I et farmakokinetisk studie med flere doser hos ældre versus unge hypertensive patienter, der brugte lisinopril/hydrochlorthiazid-kombinationen, steg AUC ca. 120 % for lisinopril og ca. 80 % for hydrochlorthiazid hos ældre patienter. Lisinopril kan fjernes ved hæmodialyse.
Undersøgelser med rotter viser, at lisinopril krydser blod-hjerne-barrieren dårligt. Flere doser af lisinopril hos rotter resulterer ikke i akkumulering i noget væv; mælk fra diegivende rotter indeholder imidlertid radioaktivitet efter administration af 14C lisinopril. Ved helkropsautoradiografi blev radioaktivitet fundet i placenta efter administration af mærket lægemiddel til gravide rotter, men ingen blev fundet i fostrene.
Farmakodynamik
Administration af lisinopril til patienter med hypertension resulterer i en reduktion af liggende og stående blodtryk i omtrent samme grad uden kompensatorisk takykardi. Symptomatisk postural hypotension observeres normalt ikke, selvom den kan forekomme og bør forventes hos patienter med volumen og/eller saltfattige (se ADVARSLER ).
Hos de fleste undersøgte patienter sås indtræden af antihypertensiv aktivitet én time efter oral administration af en individuel dosis lisinopril, med en maksimal reduktion af blodtrykket opnået med seks timer.
Hos nogle patienter kan opnåelse af optimal blodtryksreduktion kræve to til fire ugers behandling.
Ved anbefalede daglige enkeltdoser er den antihypertensive virkning opretholdt i mindst 24 timer efter dosering, selvom effekten efter 24 timer var væsentligt mindre end effekten seks timer efter dosering.
De antihypertensive virkninger af lisinopril er fortsat under langtidsbehandling. Pludselig seponering af lisinopril er ikke blevet forbundet med en hurtig stigning i blodtrykket; heller ikke med et betydeligt overskridelse af blodtrykket før behandling.
hæmodynamiske undersøgelser af patienter med essentiel hypertension blev blodtryksreduktion ledsaget af en reduktion i perifer arteriel modstand med ringe eller ingen ændring i hjertevolumen og hjertefrekvens. I en undersøgelse med ni hypertensive patienter, efter administration af lisinopril, var der en stigning i den gennemsnitlige renal blodgennemstrømning, som ikke var signifikant. Data fra flere små undersøgelser er inkonsistente med hensyn til effekten af lisinopril på glomerulær filtrationshastighed hos hypertensive patienter med normal nyrefunktion, men tyder på, at ændringer, hvis nogen, ikke er store.
Hos patienter med renovaskulær hypertension har lisinopril vist sig at være veltolereret og effektivt til at kontrollere blodtrykket (se FORHOLDSREGLER ).
Hydrochlorthiazid
Mekanismen for den antihypertensive virkning af thiazider er ukendt. Thiazider påvirker normalt ikke det normale blodtryk.
Hydrochlorthiazid er et diuretikum og et antihypertensivt middel. Det påvirker den distale renale tubulære mekanisme for elektrolytreabsorption. Hydrochlorthiazid øger udskillelsen af natrium og klorid i omtrent tilsvarende mængder. Natriurese kan være ledsaget af et vist tab af kalium og bikarbonat.
Efter oral brug begynder diurese inden for to timer, topper efter omkring fire timer og varer omkring 6 til 12 timer.
Hydrochlorthiazid metaboliseres ikke, men elimineres hurtigt via nyrerne. Når plasmaniveauer er blevet fulgt i mindst 24 timer, er plasmahalveringstiden blevet observeret at variere mellem 5,6 og 14,8 timer. Mindst 61 procent af den orale dosis elimineres uændret inden for 24 timer. Hydrochlorthiazid krydser placenta, men ikke blod-hjerne-barrieren.
PATIENTOPLYSNINGER
Angioødem
Angioødem, herunder larynxødem, kan forekomme på ethvert tidspunkt under behandling med angiotensin-konverterende enzymhæmmere, inklusive ZESTORETIC. Patienterne skal rådes og fortælles om straks at rapportere tegn eller symptomer, der tyder på angioødem (hævelse af ansigt, ekstremiteter, øjne, læber, tunge, synke- eller vejrtrækningsbesvær) og ikke at tage mere medicin, før de har rådført sig med den ordinerende læge.
Symptomatisk hypotension
Patienter skal advares om at rapportere svimmelhed, især i løbet af de første par dage af behandlingen. Hvis der opstår en egentlig synkope, skal patienterne få besked på at seponere lægemidlet, indtil de har rådført sig med den ordinerende læge.
Alle patienter skal advares om, at overdreven sved og dehydrering kan føre til et for stort blodtryksfald på grund af reduktion i væskevolumen. Andre årsager til volumenmangel såsom opkastning eller diarré kan også føre til et fald i blodtrykket; patienter bør rådes til at rådføre sig med deres læge.
Hyperkaliæmi
Patienter bør informeres om ikke at bruge salterstatninger, der indeholder kalium, uden at have konsulteret deres læge.
Leukopeni/Neutropeni
Patienterne skal informeres om straks at rapportere enhver indikation af infektion (f.eks. ondt i halsen, feber), som kan være tegn på leukopeni/neutropeni.
Graviditet
Kvindelige patienter i den fødedygtige alder bør informeres om konsekvenserne af eksponering for ZESTORETIC under graviditet. Diskuter behandlingsmuligheder med kvinder, der planlægger at blive gravide. Patienter bør bedes om at rapportere graviditeter til deres læger så hurtigt som muligt.
BEMÆRK: Som med mange andre lægemidler er visse råd til patienter, der behandles med ZESTORETIC 12,5 g, berettiget. Denne information er beregnet til at hjælpe med sikker og effektiv brug af denne medicin. Det er ikke en afsløring af alle mulige negative eller tilsigtede virkninger.
