Coreg 3.12mg, 6.25mg, 12.5mg, 25mg Carvedilol Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Coreg 25mg, og hvordan bruges det?
Coreg er en receptpligtig medicin, der bruges til at behandle symptomer på hjertesvigt og forhøjet blodtryk (hypertension). Coreg 25mg kan bruges alene eller sammen med anden medicin.
Coreg tilhører en klasse af lægemidler kaldet Beta-blokkere, Alpha Activity.
Det vides ikke, om Coreg 25mg er sikkert og effektivt til børn.
Hvad er de mulige bivirkninger af Coreg?
Coreg kan forårsage alvorlige bivirkninger, herunder:
- svimmelhed,
- langsomme eller ujævne hjerteslag,
- kold følelse eller følelsesløshed i dine fingre eller tæer,
- brystsmerter,
- tør hoste,
- hvæsen,
- trykken for brystet,
- hævelse,
- hurtig vægtøgning,
- følelse af åndenød,
- øget tørst,
- øget vandladning,
- mundtørhed, og
- frugtig ånde lugt
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Coreg 6,25mg omfatter:
- svimmelhed,
- langsomme hjerteslag,
- diarré,
- vægtøgning,
- tørre øjne, og
- svært ved at bruge kontaktlinser
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Coreg. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
Carvedilol er et ikke-selektivt β-adrenerg blokerende middel med α1-blokerende aktivitet. Det er (±)-1(Carbazol-4-yloxy)-3-[[2-(o-methoxyphenoxy)ethyl]amino]-2-propanol. Carvedilol er en racemisk blanding med følgende struktur:
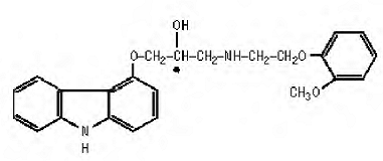
COREG 6,25 mg er en hvid, oval, filmovertrukket tablet, der indeholder 3,125 mg, 6,25 mg, 12,5 mg eller 25 mg carvedilol. Tabletterne på 6,25 mg, 12,5 mg og 25 mg er TILTAB-tabletter. Inaktive ingredienser består af kolloid siliciumdioxid, crospovidon, hypromellose, lactose, magnesiumstearat, polyethylenglycol, polysorbat 80, povidon, saccharose og titaniumdioxid.
Carvedilol er et hvidt til råhvidt pulver med en molekylvægt på 406,5 og en molekylformel på C24H26N2O4. Det er frit opløseligt i dimethylsulfoxid; opløselig i methylenchlorid og methanol; tungtopløselig i 95% ethanol og isopropanol; let opløselig i ethylether; og praktisk talt uopløselig i vand, mavevæske (simuleret, TS, pH 1,1) og tarmvæske (simuleret, TS uden pancreatin, pH 7,5).
INDIKATIONER
Hjertefejl
COREG er indiceret til behandling af mild til svær kronisk hjertesvigt af iskæmisk eller kardiomyopatisk oprindelse, sædvanligvis ud over diuretika, ACE-hæmmere og digitalis, for at øge overlevelsen og også for at reducere risikoen for hospitalsindlæggelse [se DRUGSINTERAKTIONER , Kliniske Studier ].
Venstre ventrikulær dysfunktion efter myokardieinfarkt
COREG er indiceret til at reducere kardiovaskulær dødelighed hos klinisk stabile patienter, som har overlevet den akutte fase af et myokardieinfarkt og har en venstre ventrikel ejektionsfraktion på mindre end eller lig med 40 % (med eller uden symptomatisk hjertesvigt) [se Kliniske Studier ].
Forhøjet blodtryk
COREG 25mg er indiceret til behandling af essentiel hypertension [se Kliniske Studier ]. Det kan bruges alene eller i kombination med andre antihypertensiva, især diuretika af thiazidtypen [se DRUGSINTERAKTIONER ].
DOSERING OG ADMINISTRATION
COREG bør tages sammen med mad for at nedsætte absorptionshastigheden og reducere forekomsten af ortostatiske effekter.
Hjertefejl
DOSERING SKAL VÆRE INDIVIDUALISERET OG NÆRT OVERVÅGET AF EN LÆGE UNDER OPTITRERING. Inden påbegyndelse af COREG 12,5 mg anbefales det, at væskeretention minimeres. Den anbefalede startdosis af COREG er 3,125 mg to gange dagligt i 2 uger. Hvis de tolereres, kan patienterne få deres dosis øget til 6,25, 12,5 og 25 mg to gange dagligt over successive intervaller på mindst 2 uger. Patienter bør holdes på lavere doser, hvis højere doser ikke tolereres. En maksimal dosis på 50 mg to gange dagligt er blevet administreret til patienter med mild til moderat hjertesvigt, der vejer over 85 kg (187 lbs).
Patienter bør informeres om, at påbegyndelse af behandling og (i mindre grad) dosisstigninger kan være forbundet med forbigående symptomer på svimmelhed eller svimmelhed (og sjældent synkope) inden for den første time efter dosering. I disse perioder bør patienter undgå situationer som kørsel eller farlige opgaver, hvor symptomer kan resultere i skade. Vasodilatatoriske symptomer kræver ofte ikke behandling, men det kan være nyttigt at adskille tidspunktet for dosering af COREG 6,25 mg fra tidspunktet for ACE-hæmmeren eller midlertidigt at reducere dosis af ACE-hæmmeren. Dosis af COREG 12,5 mg bør ikke øges, før symptomer på forværret hjertesvigt eller vasodilatation er blevet stabiliseret.
Væskeretention (med eller uden forbigående forværrede hjertesvigtssymptomer) bør behandles med en stigning i dosis af diuretika.
Dosis af COREG bør reduceres, hvis patienter oplever bradykardi (puls mindre end 55 slag i minuttet).
Episoder med svimmelhed eller væskeretention under påbegyndelse af COREG 3,12 mg kan generelt håndteres uden afbrydelse af behandlingen og udelukker ikke efterfølgende vellykket titrering af eller en gunstig respons på carvedilol.
Venstre ventrikulær dysfunktion efter myokardieinfarkt
DOSERING SKAL VÆRE INDIVIDUALISERET OG OVERVÅGES UNDER OP-TITRERING. Behandling med COREG kan startes som indlagt eller ambulant og bør startes, efter at patienten er hæmodynamisk stabil og væskeretention er minimeret. Det anbefales, at COREG 3,12 mg startes med 6,25 mg to gange dagligt og øges efter 3 til 10 dage, baseret på tolerabilitet, til 12,5 mg to gange dagligt, derefter igen til måldosis på 25 mg to gange dagligt. En lavere startdosis kan anvendes (3,125 mg to gange dagligt), og/eller optitreringshastigheden kan sænkes, hvis det er klinisk indiceret (f.eks. på grund af lavt blodtryk eller hjertefrekvens eller væskeretention). Patienter bør holdes på lavere doser, hvis højere doser ikke tolereres. Det anbefalede doseringsregime behøver ikke at blive ændret hos patienter, som fik behandling med en IV eller oral β-blokker under den akutte fase af myokardieinfarkt.
Forhøjet blodtryk
DOSERING SKAL VÆRE INDIVIDUALISERET. Den anbefalede startdosis af COREG 6,25 mg er 6,25 mg to gange dagligt. Hvis denne dosis tolereres, med stående systolisk tryk målt ca. 1 time efter dosering som en vejledning, bør dosis opretholdes i 7 til 14 dage og derefter øges til 12,5 mg to gange dagligt, hvis det er nødvendigt, baseret på bundblodtryk, igen vha. stående systolisk tryk 1 time efter dosering som vejledende for tolerance. Denne dosis bør også opretholdes i 7 til 14 dage og kan derefter justeres op til 25 mg to gange dagligt, hvis det tolereres og er nødvendigt. Den fulde antihypertensive effekt af COREG 6,25 mg ses inden for 7 til 14 dage. Den samlede daglige dosis bør ikke overstige 50 mg.
Samtidig administration med et diuretikum kan forventes at give additive virkninger og overdrive den ortostatiske komponent af carvedilols virkning.
Nedsat leverfunktion
COREG 25 mg bør ikke gives til patienter med svært nedsat leverfunktion [se KONTRAINDIKATIONER ].
HVORDAN LEVERET
Dosering og styrker
De hvide, ovale, filmovertrukne tabletter fås i følgende styrker:
- 3.125 mg - indgraveret med "39" og "SB"
- 6,25 mg - indgraveret med "4140" og "SB"
- 12,5 mg - indgraveret med "4141" og "SB"
- 25 mg - indgraveret med "4142" og "SB"
Opbevaring og håndtering
De hvide, ovale, filmovertrukne tabletter fås i følgende styrker:
- 3.125 mg - indgraveret med "39" og "SB"
- 6,25 mg - indgraveret med "4140" og "SB"
- 12,5 mg - indgraveret med "4141" og "SB"
- 25 mg - indgraveret med "4142" og "SB"
Tabletterne på 6,25 mg, 12,5 mg og 25 mg er TILTAB-tabletter.
- 3,125 mg flasker á 100: NDC 0007-4139-20
- 6,25 mg flasker á 100: NDC 0007-4140-20
- 12,5 mg flasker á 100: NDC 0007-4141-20
- 25 mg flasker á 100: NDC 0007-4142-20
Opbevares under 30°C (86°F). Beskyt mod fugt. Dispenser i en tæt, lysbestandig beholder.
Fremstillet til: GlaxoSmithKline Research Triangle Park, NC 27709. Revideret: Sep 2017.
BIVIRKNINGER
Erfaring fra kliniske studier
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan de bivirkninger, der er observeret i de kliniske forsøg med et lægemiddel, ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
COREG 25mg er blevet evalueret for sikkerhed hos forsøgspersoner med hjertesvigt (mildt, moderat og alvorligt), hos forsøgspersoner med venstre ventrikel dysfunktion efter myokardieinfarkt og hos hypertensive forsøgspersoner. Den observerede bivirkningsprofil var i overensstemmelse med lægemidlets farmakologi og helbredstilstanden for forsøgspersonerne i de kliniske forsøg. Bivirkninger rapporteret for hver af disse patientpopulationer er angivet nedenfor. Udelukket er bivirkninger, der anses for at være for generelle til at være informative, og dem, der ikke med rimelighed er forbundet med brugen af lægemidlet, fordi de var forbundet med den tilstand, der behandles, eller er meget almindelige i den behandlede befolkning. Hyppigheden af bivirkninger var generelt ens på tværs af demografiske undergrupper (mænd og kvinder, ældre og ikke-ældre, sorte og ikke-sorte).
Hjertefejl
COREG 12,5 mg er blevet evalueret for sikkerhed ved hjertesvigt hos mere end 4.500 forsøgspersoner verden over, hvoraf mere end 2.100 deltog i placebokontrollerede kliniske forsøg. Ca. 60 % af den samlede behandlede population i placebokontrollerede kliniske forsøg modtog COREG 3,12 mg i mindst 6 måneder og 30 % modtog COREG i mindst 12 måneder. I COMET-studiet blev 1.511 forsøgspersoner med mild til moderat hjertesvigt behandlet med COREG i op til 5,9 år (gennemsnit: 4,8 år). Både i amerikanske kliniske forsøg med mild til moderat hjertesvigt, der sammenlignede COREG 3,12 mg i daglige doser op til 100 mg (n = 765) med placebo (n = 437), og i et multinationalt klinisk forsøg med alvorlig hjertesvigt (COPERNICUS ), der sammenlignede COREG i daglige doser op til 50 mg (n = 1.156) med placebo (n = 1.133), var seponeringsraten for bivirkninger ens hos carvedilol- og placebo-personer. I placebokontrollerede kliniske forsøg var den eneste årsag til seponering over 1 % og forekom oftere med carvedilol svimmelhed (1,3 % på carvedilol, 0,6 % på placebo i COPERNICUS-studiet).
Tabel 1 viser uønskede hændelser rapporteret hos forsøgspersoner med mild til moderat hjerteinsufficiens, der er inkluderet i amerikanske placebokontrollerede kliniske forsøg, og med alvorlig hjerteinsufficiens indskrevet i COPERNICUS-studiet. Der er vist bivirkninger, der forekom hyppigere hos lægemiddelbehandlede forsøgspersoner end placebobehandlede forsøgspersoner med en incidens på mere end 3 % hos forsøgspersoner behandlet med carvedilol uanset årsagssammenhæng. Medianeksponeringen af medicin i forsøget var 6,3 måneder for både carvedilol- og placebo-personer i forsøgene med mild til moderat hjertesvigt og 10,4 måneder i forsøget med forsøgspersoner med svær hjertesvigt. Bivirkningsprofilen for COREG 3,12 mg observeret i langtids-COMET-forsøget svarede generelt til den, der blev observeret i de amerikanske hjertesvigtsforsøg.
Hjertesvigt og dyspnø blev også rapporteret i disse forsøg, men frekvenserne var lige store eller højere hos forsøgspersoner, der fik placebo.
Følgende bivirkninger blev rapporteret med en frekvens på mere end 1 %, men mindre end eller lig med 3 % og hyppigere med COREG 3,12 mg i enten de amerikanske placebokontrollerede forsøg hos forsøgspersoner med mild til moderat hjertesvigt eller hos forsøgspersoner med alvorlig hjertesvigt i COPERNICUS-forsøget.
Forekomst større end 1 % til mindre end eller lig med 3 %
Kroppen som helhed: Allergi, utilpashed, hypovolæmi, feber, benødem.
Kardiovaskulær: Væskeoverbelastning, postural hypotension, forværret angina pectoris, AV-blok, hjertebanken, hypertension.
Centrale og perifere nervesystem: Hypesthesia, vertigo, paræstesi.
Gastrointestinale: Melena, paradentose.
Lever og galdesystem: SGPT steg, SGOT steg.
Metabolisk og ernæringsmæssig: Hyperurikæmi, hypoglykæmi, hyponatriæmi, øget alkalisk fosfatase, glykosuri, hypervolæmi, diabetes mellitus, øget GGT, vægttab, hyperkaliæmi, øget kreatinin.
Muskuloskeletale: Muskelkramper.
Blodplader, blødninger og koagulering: Protrombin faldt, purpura, trombocytopeni.
Psykiatrisk: Somnolens.
Reproduktiv, mandlig: Impotens.
Særlige sanser: Sløret syn.
Urinsystemet: Nyreinsufficiens, albuminuri, hæmaturi.
Venstre ventrikulær dysfunktion efter myokardieinfarkt
COREG er blevet evalueret for sikkerhed hos overlevende efter et akut myokardieinfarkt med venstre ventrikulær dysfunktion i CAPRICORN-studiet, som involverede 969 forsøgspersoner, der fik COREG 6,25 mg, og 980, der fik placebo. Ca. 75 % af forsøgspersonerne fik COREG 25 mg i mindst 6 måneder og 53 % fik COREG 12,5 mg i mindst 12 måneder. Forsøgspersonerne blev behandlet i gennemsnitligt 12,9 måneder og 12,8 måneder med henholdsvis COREG 12,5 mg og placebo.
De mest almindelige bivirkninger rapporteret med COREG 25 mg i CAPRICORN-studiet var i overensstemmelse med lægemidlets profil i de amerikanske hjertesvigtsforsøg og COPERNICUS-studiet. De eneste yderligere uønskede hændelser, der blev rapporteret i STENBUCK hos mere end 3 % af forsøgspersonerne og mere almindeligt på carvedilol, var dyspnø, anæmi og lungeødem. Følgende bivirkninger blev rapporteret med en frekvens på mere end 1 %, men mindre end eller lig med 3 % og hyppigere med COREG: influenzasyndrom, cerebrovaskulær ulykke, perifer vaskulær lidelse, hypotoni, depression, gastrointestinale smerter, gigt og gigt. Den samlede hyppighed af seponeringer på grund af bivirkninger var ens i begge grupper af forsøgspersoner. I denne database var hypotension hypotension (1,5 % på carvedilol, 0,2 % på placebo) den eneste årsag til seponering på mere end 1 % og hyppigere forekomst af carvedilol.
Forhøjet blodtryk
COREG er blevet evalueret for sikkerhed ved hypertension hos mere end 2.193 forsøgspersoner i amerikanske kliniske forsøg og i 2.976 forsøgspersoner i internationale kliniske forsøg. Ca. 36 % af den samlede behandlede population modtog COREG i mindst 6 måneder. De fleste bivirkninger rapporteret under behandling med COREG 25 mg var af mild til moderat sværhedsgrad. I amerikansk kontrollerede kliniske forsøg, der direkte sammenlignede COREG 12,5 mg i doser op til 50 mg (n = 1.142) med placebo (n = 462), seponerede 4,9 % af forsøgspersonerne, der fik COREG 6,25 mg, på grund af bivirkninger mod 5,2 % af placebo-personerne. Selvom der ikke var nogen overordnet forskel i seponeringsrater, var seponeringer mere almindelige i carvedilolgruppen for postural hypotension (1 % versus 0). Den samlede forekomst af bivirkninger i amerikanske placebokontrollerede forsøg steg med stigende dosis af COREG. For individuelle bivirkninger kunne dette kun skelnes for svimmelhed, som steg i frekvens fra 2 % til 5 %, da den samlede daglige dosis steg fra 6,25 mg til 50 mg.
Tabel 2 viser uønskede hændelser i amerikanske placebokontrollerede kliniske forsøg for hypertension, der opstod med en forekomst på mere end eller lig med 1 % uanset årsagssammenhæng, og som var hyppigere hos lægemiddelbehandlede forsøgspersoner end placebobehandlede forsøgspersoner.
Dyspnø og træthed blev også rapporteret i disse forsøg, men frekvenserne var lige store eller højere hos forsøgspersoner, der fik placebo.
Følgende bivirkninger, der ikke er beskrevet ovenfor, blev rapporteret som muligvis eller sandsynligvis relateret til COREG 25mg i verdensomspændende åbne eller kontrollerede forsøg med COREG 12,5mg hos forsøgspersoner med hypertension eller hjertesvigt.
Incidens større end 0,1 % til mindre end eller lig med 1 %
Kardiovaskulær: Perifer iskæmi, takykardi.
Central og perifer nervesystem m: Hypokinesi.
Gastrointestinale: Bilirubinæmi, øgede leverenzymer (0,2 % af patienter med hypertension og 0,4 % af patienter med hjertesvigt blev afbrudt fra behandlingen på grund af stigninger i leverenzymer) [se Postmarketing oplevelse ].
Psykiatrisk: Nervøsitet, søvnforstyrrelser, forværret depression, nedsat koncentrationsevne, unormal tænkning, paroniria, følelsesmæssig labilitet.
Åndedrætsorganerne: Astma [se KONTRAINDIKATIONER ].
Reproduktiv, mandlig: Nedsat libido.
Hud og vedhæng: Kløe, erytematøst udslæt, makulopapulært udslæt, psoriaform udslæt, lysfølsomhedsreaktion.
Særlige sanser: Tinnitus.
Urinsystemet: Miktionshyppigheden steg.
Autonome nervesystem: Mundtørhed, øget svedtendens.
Metabolisk og ernæringsmæssig: Hypokaliæmi, hypertriglyceridæmi.
Hæmatologisk: Anæmi, leukopeni.
Følgende hændelser blev rapporteret hos mindre end eller lig med 0,1 % af forsøgspersonerne og er potentielt vigtige: komplet AV-blok, bundtgrenblok, myokardieiskæmi, cerebrovaskulær lidelse, kramper, migræne, neuralgi, pareser, anafylaktoid reaktion, alopeci, eksfoliativ dermatitis, amnesi, GI-blødning, bronkospasme, lungeødem, nedsat hørelse, respiratorisk alkalose, øget BUN, nedsat HDL, pancytopeni og atypiske lymfocytter.
Laboratorieabnormiteter
Reversible stigninger i serumtransaminaser (ALAT eller ASAT) er blevet observeret under behandling med COREG. Hyppigheder af transaminaseforhøjelser (2 til 3 gange den øvre grænse for normal) observeret under kontrollerede kliniske forsøg har generelt været ens mellem forsøgspersoner behandlet med COREG og dem behandlet med placebo. Transaminaseforhøjelser, bekræftet ved genudsættelse, er imidlertid blevet observeret med COREG. I et langsigtet, placebokontrolleret forsøg med alvorligt hjertesvigt havde forsøgspersoner behandlet med COREG 25 mg lavere værdier for levertransaminaser end forsøgspersoner behandlet med placebo, muligvis fordi forbedringer i hjertefunktionen induceret af COREG 6,25 mg førte til mindre levertilstopning og/ eller forbedret blodgennemstrømning i leveren.
COREG 25mg er ikke blevet forbundet med klinisk signifikante ændringer i serumkalium, totale triglycerider, totalkolesterol, HDL-kolesterol, urinsyre, blodurinstofnitrogen eller kreatinin. Der blev ikke observeret nogen klinisk relevante ændringer i fastende serumglukose hos hypertensive patienter; fastende serumglukose blev ikke evalueret i de kliniske hjertesvigtsforsøg.
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af COREG efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Blod og lymfesystem lidelser
Aplastisk anæmi.
Forstyrrelser i immunsystemet
Overfølsomhed (f.eks. anafylaktiske reaktioner, angioødem, nældefeber).
Nyre- og urinvejslidelser
Ufrivillig vandladning.
Åndedræts-, thorax- og mediastinale lidelser
Interstitiel pneumonitis.
Hud- og subkutane vævsforstyrrelser
Stevens-Johnsons syndrom, toksisk epidermal nekrolyse, erythema multiforme.
DRUGSINTERAKTIONER
CYP2D6-hæmmere og dårlige metabolisatorer
Interaktioner mellem carvedilol og potente hæmmere af CYP2D6-isoenzym (såsom quinidin, fluoxetin, paroxetin og propafenon) er ikke blevet undersøgt, men disse lægemidler forventes at øge blodniveauet af R(+)-enantiomeren af carvedilol [se KLINISK FARMAKOLOGI ]. Retrospektiv analyse af bivirkninger i kliniske forsøg viste, at dårlige 2D6-metabolisatorer havde en højere grad af svimmelhed under optitrering, formodentlig som følge af vasodilaterende virkninger af de højere koncentrationer af den α-blokerende R(+)-enantiomer.
Hypotensive midler
Patienter, der tager en β-blokker og et lægemiddel, der kan nedbryde katekolaminer (f.eks. reserpin- og monoaminoxidasehæmmere), bør observeres nøje for tegn på hypotension og/eller svær bradykardi.
Samtidig administration af clonidin og en β-blokker kan forårsage hypotension og bradykardi. Når samtidig behandling med en β-blokker og clonidin skal afsluttes, bør β-blokkeren seponeres først. Clonidinbehandling kan derefter afbrydes flere dage senere ved gradvist at reducere dosis.
Cyclosporin
Der blev observeret beskedne stigninger i gennemsnitlige dalkoncentrationer af cyclosporin efter påbegyndelse af carvedilolbehandling hos 21 nyretransplanterede personer, der led af kronisk vaskulær afstødning. Hos omkring 30 % af forsøgspersonerne måtte dosis af ciclosporin reduceres for at opretholde ciclosporinkoncentrationer inden for det terapeutiske område, mens der i resten ikke var behov for justering. I gennemsnit for gruppen blev dosen af cyclosporin reduceret med ca. 20 % hos disse forsøgspersoner. På grund af stor interindividuel variabilitet i den nødvendige dosisjustering anbefales det, at ciclosporinkoncentrationer overvåges nøje efter påbegyndelse af carvedilolbehandling, og at dosis af ciclosporin justeres efter behov.
Digitalis glycosider
Både digitalis-glykosider og β-blokkere sænker atrioventrikulær ledning og mindsker hjertefrekvensen. Samtidig brug kan øge risikoen for bradykardi. Digoxinkoncentrationer øges med ca. 15 %, når digoxin og carvedilol administreres samtidigt. Derfor anbefales øget overvågning af digoxin ved påbegyndelse, justering eller afbrydelse af COREG [se KLINISK FARMAKOLOGI ].
Inducere/hæmmere af levermetabolisme
Rifampin reducerede plasmakoncentrationer af carvedilol med omkring 70 % [se KLINISK FARMAKOLOGI ]. Cimetidin øgede AUC med ca. 30 %, men forårsagede ingen ændring i Cmax [se KLINISK FARMAKOLOGI ].
Amiodaron
Amiodaron og dets metabolit desethylamiodaron, hæmmere af CYP2C9 og P-glycoprotein øgede koncentrationerne af S(-)-enantiomeren af carvedilol med mindst 2 gange [se KLINISK FARMAKOLOGI ]. Samtidig administration af amiodaron eller andre CYP2C9-hæmmere såsom fluconazol og COREG kan øge den β-blokerende aktivitet, hvilket resulterer i yderligere nedsættelse af hjertefrekvensen eller hjerteledning. Patienter bør observeres for tegn på bradykardi eller hjerteblokade, især når det ene middel sættes til allerede eksisterende behandling med det andet.
Calciumkanalblokkere
Ledningsforstyrrelser (sjældent med hæmodynamisk kompromittering) er blevet observeret, når COREG 25 mg administreres samtidigt med diltiazem. Som med andre β-blokkere, hvis COREG 25 mg administreres sammen med calciumkanalblokkere af verapamil- eller diltiazem-typen, anbefales det, at EKG og blodtryk overvåges.
Insulin eller oral hypoglykæmi
β-blokkere kan forstærke den blodsukkerreducerende virkning af insulin og orale hypoglykæmi. Derfor anbefales det, at patienter, der tager insulin eller orale hypoglykæmi, regelmæssig monitorering af blodsukkeret [se ADVARSLER OG FORHOLDSREGLER ].
Anæstesi
Hvis behandling med COREG skal fortsættes perioperativt, skal der udvises særlig forsigtighed, når der anvendes anæstesimidler, der sænker myokardiefunktionen, såsom ether, cyclopropan og trichlorethylen [se OVERDOSIS ].
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Ophør af terapi
Patienter med koronararteriesygdom, som er i behandling med COREG, bør frarådes pludseligt seponering af behandlingen. Alvorlig forværring af angina og forekomsten af myokardieinfarkt og ventrikulære arytmier er blevet rapporteret hos patienter med angina efter pludselig ophør af behandling med β-blokkere. De sidste 2 komplikationer kan forekomme med eller uden forudgående eksacerbation af angina pectoris. Som med andre β-blokkere, når seponering af COREG er planlagt, skal patienterne observeres nøje og rådes til at begrænse fysisk aktivitet til et minimum. COREG bør seponeres over 1 til 2 uger, når det er muligt. Hvis anginaen forværres, eller der udvikles akut koronar insufficiens, anbefales det, at COREG omgående genoptages, i det mindste midlertidigt. Fordi koronararteriesygdom er almindelig og muligvis ikke erkendt, kan det være klogt ikke at afbryde behandlingen med COREG 3,12 mg brat, selv hos patienter, der kun behandles for hypertension eller hjertesvigt.
Bradykardi
kliniske forsøg forårsagede COREG 25 mg bradykardi hos omkring 2 % af hypertensive forsøgspersoner, 9 % af forsøgspersoner med hjertesvigt og 6,5 % af forsøgspersoner med myokardieinfarkt og venstre ventrikel dysfunktion. Hvis pulsen falder til under 55 slag i minuttet, bør dosis reduceres.
Hypotension
kliniske forsøg med primært mild til moderat hjertesvigt forekom hypotension og postural hypotension hos 9,7 % og synkope hos 3,4 % af forsøgspersonerne, der fik COREG sammenlignet med henholdsvis 3,6 % og 2,5 % af placebo-personerne. Risikoen for disse hændelser var højest i løbet af de første 30 dage af doseringen, svarende til optitreringsperioden og var en årsag til seponering af behandlingen hos 0,7 % af forsøgspersonerne, der fik COREG 12,5 mg, sammenlignet med 0,4 % af placebo-personerne. I et langvarigt, placebo-kontrolleret forsøg med alvorligt hjertesvigt (COPERNICUS), forekom hypotension og postural hypotension hos 15,1 % og synkope hos 2,9 % af patienter med hjertesvigt, der fik COREG sammenlignet med henholdsvis 8,7 % og 2,3 % af placebopersonerne. Disse hændelser var en årsag til seponering af behandlingen hos 1,1 % af patienterne, der fik COREG, sammenlignet med 0,8 % af placebo-personerne.
Postural hypotension forekom hos 1,8 % og synkope hos 0,1 % af hypertensive forsøgspersoner, primært efter den indledende dosis eller på tidspunktet for dosisstigning og var en årsag til seponering af behandlingen hos 1 % af forsøgspersonerne.
I CAPRICORN-studiet med overlevende efter et akut myokardieinfarkt forekom hypotension eller postural hypotension hos 20,2 % af forsøgspersonerne, der fik COREG sammenlignet med 12,6 % af placebo-personerne. Synkope blev rapporteret hos henholdsvis 3,9 % og 1,9 % af forsøgspersonerne. Disse hændelser var en årsag til seponering af behandlingen hos 2,5 % af patienterne, der fik COREG, sammenlignet med 0,2 % af placebo-personerne.
Start med en lav dosis, administration med mad og gradvis optitrering bør mindske sandsynligheden for synkope eller overdreven hypotension [se DOSERING OG ADMINISTRATION ]. Under påbegyndelse af behandlingen skal patienten advares om at undgå situationer såsom kørsel eller farlige opgaver, hvor der kan opstå skader, hvis der skulle opstå synkope.
Hjertesvigt/væskeophobning
Forværring af hjertesvigt eller væskeretention kan forekomme under optitrering af carvedilol. Hvis sådanne symptomer opstår, bør diuretika øges, og carvediloldosis bør ikke øges, før den kliniske stabilitet genoptager [se DOSERING OG ADMINISTRATION ]. Lejlighedsvis er det nødvendigt at sænke carvediloldosis eller midlertidigt seponere den. Sådanne episoder udelukker ikke efterfølgende vellykket titrering af eller en gunstig reaktion på carvedilol. I et placebokontrolleret forsøg med forsøgspersoner med alvorligt hjertesvigt blev forværret hjertesvigt i løbet af de første 3 måneder rapporteret i samme grad med carvedilol og placebo. Når behandlingen blev opretholdt ud over 3 måneder, blev forværring af hjertesvigt rapporteret mindre hyppigt hos forsøgspersoner behandlet med carvedilol end med placebo. Forværring af hjertesvigt observeret under langtidsbehandling er mere sandsynligt relateret til patienternes underliggende sygdom end til behandling med carvedilol.
Ikke-allergisk bronkospasme
Patienter med bronkospastisk sygdom (f.eks. kronisk bronkitis, emfysem) bør generelt ikke modtage β-blokkere. COREG kan dog anvendes med forsigtighed til patienter, som ikke reagerer på eller ikke kan tolerere andre antihypertensiva. Det er klogt, hvis COREG anvendes, at anvende den mindste effektive dosis, således at hæmning af endogene eller eksogene β-agonister minimeres.
I kliniske forsøg med forsøgspersoner med hjertesvigt blev forsøgspersoner med bronkospastisk sygdom inkluderet, hvis de ikke havde brug for oral eller inhaleret medicin til at behandle deres bronkospastiske sygdom. Hos sådanne patienter anbefales det, at carvedilol anvendes med forsigtighed. Doseringsanbefalingerne bør følges nøje, og dosis bør sænkes, hvis der observeres tegn på bronkospasme under optitreringen.
Glykæmisk kontrol ved type 2-diabetes
Generelt kan β-blokkere maskere nogle af manifestationerne af hypoglykæmi, især takykardi. Ikke-selektive β-blokkere kan forstærke insulin-induceret hypoglykæmi og forsinke genopretning af serumglukoseniveauer. Patienter med spontan hypoglykæmi eller diabetespatienter, der får insulin eller orale hypoglykæmiske midler, bør advares om disse muligheder.
Hos patienter med hjertesvigt og diabetes kan carvedilolbehandling føre til forværring af hyperglykæmi, som reagerer på intensivering af hypoglykæmisk behandling. Det anbefales, at blodsukkeret monitoreres, når carvedilol-dosering påbegyndes, justeres eller afbrydes. Forsøg designet til at undersøge virkningerne af carvedilol på glykæmisk kontrol hos patienter med diabetes og hjertesvigt er ikke blevet udført.
et forsøg designet til at undersøge virkningerne af carvedilol på glykæmisk kontrol i en population med mild til moderat hypertension og velkontrolleret type 2 diabetes mellitus, havde carvedilol ingen negativ effekt på glykæmisk kontrol, baseret på HbA1c-målinger [se Kliniske Studier ].
Perifer vaskulær sygdom
β-blokkere kan fremkalde eller forværre symptomer på arteriel insufficiens hos patienter med perifer vaskulær sygdom. Der bør udvises forsigtighed hos sådanne personer.
Forringelse af nyrefunktionen
sjældne tilfælde har brug af carvedilol hos patienter med hjertesvigt resulteret i forringelse af nyrefunktionen. Risikopatienter ser ud til at være dem med lavt blodtryk (systolisk blodtryk mindre end 100 mm Hg), iskæmisk hjertesygdom og diffus vaskulær sygdom og/eller underliggende nyreinsufficiens. Nyrefunktionen er vendt tilbage til baseline, da carvedilol blev stoppet. Hos patienter med disse risikofaktorer anbefales det, at nyrefunktionen overvåges under optitrering af carvedilol, og at lægemidlet seponeres eller dosis reduceres, hvis der opstår en forværring af nyrefunktionen.
Større operation
Kronisk administreret β-blokerende behandling bør ikke rutinemæssigt seponeres før større operation; hjertets svækkede evne til at reagere på refleks adrenerge stimuli kan dog øge risikoen for generel anæstesi og kirurgiske indgreb.
Thyrotoksikose
β-adrenerg blokade kan maskere kliniske tegn på hyperthyroidisme, såsom takykardi. Pludselig seponering af β-blokade kan efterfølges af en forværring af symptomerne på hyperthyroidisme eller kan udløse skjoldbruskkirtelstorm.
Fæokromocytom
Hos patienter med fæokromocytom bør et α-blokerende middel påbegyndes før brug af et β-blokerende middel. Selvom carvedilol har både α- og β-blokerende farmakologiske aktiviteter, har der ikke været erfaring med dets anvendelse i denne tilstand. Derfor bør der udvises forsigtighed ved administration af carvedilol til patienter, der mistænkes for at have fæokromocytom.
Prinzmetals variant angina
Midler med ikke-selektiv β-blokerende aktivitet kan fremkalde brystsmerter hos patienter med Prinzmetals variant angina. Der har ikke været nogen klinisk erfaring med carvedilol hos disse patienter, selvom den α-blokerende aktivitet kan forhindre sådanne symptomer. Der bør dog udvises forsigtighed ved administration af carvedilol til patienter, der mistænkes for at have Prinzmetals variant angina.
Risiko for anafylaktisk reaktion
Mens de tager β-blokkere, kan patienter med en historie med alvorlig anafylaktisk reaktion på en række allergener være mere reaktive over for gentagne udfordringer, enten utilsigtet, diagnostisk eller terapeutisk. Sådanne patienter kan ikke reagere på de sædvanlige doser af adrenalin, der bruges til at behandle allergiske reaktioner.
Intraoperativt Floppy Iris Syndrom
Intraoperativt Floppy Iris Syndrome (IFIS) er blevet observeret under kataraktkirurgi hos nogle patienter behandlet med alfa-1-blokkere (COREG er en alfa/beta-blokker). Denne variant af lille pupilsyndrom er karakteriseret ved kombinationen af en slap iris, der bølger som reaktion på intraoperative skyllestrømme, progressiv intraoperativ miose trods præoperativ udvidelse med standard mydriatiske lægemidler og potentiel prolaps af iris mod phacoemulsification incisions. Patientens øjenlæge bør være forberedt på mulige ændringer af den kirurgiske teknik, såsom brug af iriskroge, irisdilatatorringe eller viskoelastiske stoffer. Der ser ikke ud til at være en fordel ved at stoppe alfa-1-blokkerbehandlingen før operation for grå stær.
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( PATIENTOPLYSNINGER ).
Patienter, der tager COREG, skal informeres om følgende:
- Patienter bør tage COREG sammen med mad.
- Patienter bør ikke afbryde eller ophøre med at bruge COREG 25mg uden en læges råd.
- Patienter med hjertesvigt bør konsultere deres læge, hvis de oplever tegn eller symptomer på forværret hjertesvigt, såsom vægtøgning eller øget åndenød.
- Patienter kan opleve et fald i blodtrykket, når de står op, hvilket resulterer i svimmelhed og sjældent besvimelse. Patienter bør sidde eller ligge ned, når disse symptomer på nedsat blodtryk opstår.
- Hvis de oplever svimmelhed eller træthed, bør patienter undgå kørsel eller farlige opgaver.
- Patienter bør konsultere en læge, hvis de oplever svimmelhed eller besvimelse, i tilfælde af at dosis skal justeres.
- Diabetikere bør rapportere ændringer i blodsukkerniveauet til deres læge.
- Kontaktlinsebrugere kan opleve nedsat tåreflåd.
COREG 25mg, COREG 3.12mg CR og TILTAB er varemærker ejet af eller licenseret til GSK-gruppen af virksomheder.
Det andet mærke, der er anført, er et varemærke ejet af eller licenseret til dets ejer og er ikke ejet af eller licenseret til GSK-gruppen af virksomheder. Producenten af dette mærke er ikke tilknyttet og støtter ikke GSK-gruppen af virksomheder eller dens produkter.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
I 2-årige undersøgelser udført i rotter givet carvedilol i doser op til 75 mg pr. kg pr. dag (12 gange MRHD som mg pr. m2) eller i mus givet op til 200 mg pr. kg pr. dag (16 gange MRHD som mg pr. m2), havde carvedilol ingen kræftfremkaldende effekt.
Carvedilol var negativ, når den blev testet i en række genotoksicitetsassays, inklusive Ames- og CHO/HGPRT-assays for mutagenicitet og in vitro hamster-mikronerne og in vivo humane lymfocytcelletests for klastogenicitet.
en kombineret fertilitets-/udviklings-/postnatal toksicitetsundersøgelse fik rotter carvedilol (12, 60, 300 mg pr. kg pr. dag) oralt ved sondemad i 2 uger før parring og gennem parring, drægtighed og fravænning for hunner og i 62 dage før og gennem parring for hanner. Ved en dosis på 300 mg pr. kg pr. dag (større end eller lig med 50 gange MRHD som mg pr. m2) var carvedilol giftig for voksne rotter (sedation, reduceret vægtøgning) og var forbundet med et reduceret antal vellykkede parringer, forlænget parringstid, færre corpora lutea og implantater pr. moderdyr, færre levende unger pr. kuld og forsinkelser i fysisk vækst/udvikling. Ingen-effektniveauet for åbenlys toksicitet og svækkelse af fertilitet var 60 mg pr. kg pr. dag (10 gange MRHD som mg pr. m2).
Brug i specifikke populationer
Graviditet
Risikooversigt
Tilgængelige data vedrørende brug af COREG 12,5 mg til gravide kvinder er utilstrækkelige til at afgøre, om der er lægemiddelrelaterede risici for uønskede udviklingsresultater. Der er risici for moderen og fosteret forbundet med dårligt kontrolleret hypertension under graviditeten. Brugen af betablokkere i tredje trimester af graviditeten kan øge risikoen for hypotension, bradykardi, hypoglykæmi og respirationsdepression hos nyfødte [ se Kliniske overvejelser ]. I reproduktionsstudier på dyr var der ingen tegn på uønskede udviklingsresultater ved klinisk relevante doser [ se Data ]. Oral administration af carvedilol til gravide rotter under organogenese resulterede i post-implantationstab, nedsat føtal kropsvægt og en øget hyppighed af forsinket føtal skeletudvikling ved maternelt toksiske doser, der var 50 gange den maksimale anbefalede humane dosis (MRHD). Derudover resulterede oral administration af carvedilol til drægtige kaniner under organogenese i øget post-implantationstab ved doser på 25 gange MRHD [ se Data ].
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort for de angivne populationer er ukendt. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre ugunstige udfald. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 % til 4 % og 15 % til 20 %.

Kliniske overvejelser
Sygdomsassocieret moder- og/eller embryo-/fosterrisiko
Hypertension under graviditet øger moderens risiko for præeklampsi, svangerskabsdiabetes, for tidlig fødsel og fødselskomplikationer (f.eks. behov for kejsersnit og post-partum blødning). Hypertension øger fosterets risiko for intrauterin vækstbegrænsning og intrauterin død. Gravide kvinder med hypertension bør overvåges omhyggeligt og behandles i overensstemmelse hermed.
Fetale/neonatale bivirkninger
Nyfødte af kvinder med hypertension, som behandles med betablokkere i tredje trimester af graviditeten, kan have øget risiko for hypotension, bradykardi, hypoglykæmi og respirationsdepression. Observer nyfødte for symptomer på hypotension, bradykardi, hypoglykæmi og respirationsdepression, og forvalter derefter.
Data
Dyredata
Undersøgelser udført på rotter og kaniner, der fik carvedilol under føtal organogenese, viste øget post-implantationstab hos rotter ved en modertoksisk dosis på 300 mg pr. kg pr. dag (50 gange MRHD som mg pr. m2) og hos kaniner (i fravær af maternel toksicitet) ved doser på 75 mg pr. kg pr. dag (25 gange MRHD som mg pr. m2). Hos rotterne var der også et fald i føtal kropsvægt på 300 mg pr. kg pr. dag (50 gange MRHD som mg pr. m2) ledsaget af en øget forekomst af fostre med forsinket skeletudvikling. Hos rotter var niveauet uden effekt for embryo-føtal toksicitet 60 mg pr. kg pr. dag (10 gange MRHD som mg pr. m2); hos kaniner var den 15 mg pr. kg pr. dag (5 gange MRHD som mg pr. m2). I et præ- og postnatalt udviklingsstudie med rotter, der fik carvedilol fra sen drægtighed til diegivning, blev der observeret øget embryodødelighed ved en modertoksisk dosis på 200 mg pr. kg pr. dag (ca. 32 gange MRHD som mg pr. m2). og hvalpedødelighed og forsinkelser i fysisk vækst/udvikling blev observeret ved 60 mg pr. kg pr. dag (10 gange MRHD som mg pr. m2) i fravær af maternel toksicitet. Ingen effekt-niveauet var 12 mg pr. kg pr. dag (2 gange MRHD som mg pr. m2). Carvedilol var til stede i føtalt rottevæv.
Amning
Risikooversigt
Der er ingen data om tilstedeværelsen af carvedilol i modermælk, virkningerne på det ammede spædbarn eller virkningerne på mælkeproduktionen. Carvedilol er til stede i mælken fra diegivende rotter. De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for COREG og eventuelle negative virkninger på det ammede spædbarn fra COREG 3,12 mg eller fra den underliggende moderens tilstand.
Pædiatrisk brug
Effektiviteten af COREG 3,12 mg hos patienter yngre end 18 år er ikke blevet fastslået.
et dobbeltblindt forsøg, 161 børn (gennemsnitsalder: 6 år; interval: 2 måneder til 17 år; 45 % yngre end 2 år) med kronisk hjertesvigt [NYHA klasse II-IV, venstre ventrikel ejektionsfraktion mindre end 40 % for børn med en systemisk venstre ventrikel (LV) og moderat-alvorlig ventrikulær dysfunktion kvalitativt ved ekko for dem med en systemisk ventrikel, der ikke var en LV], som modtog standard baggrundsbehandling blev randomiseret til placebo eller til 2 dosisniveauer af carvedilol. Disse dosisniveauer gav placebokorrigeret hjertefrekvensreduktion på 4 til 6 hjerteslag pr. minut, hvilket tyder på β-blokadeaktivitet. Eksponeringen så ud til at være lavere hos pædiatriske forsøgspersoner end hos voksne. Efter 8 måneders opfølgning var der ingen signifikant effekt af behandlingen på kliniske resultater. Bivirkninger i dette forsøg, som forekom hos mere end 10 % af forsøgspersonerne behandlet med COREG og med dobbelt så høj frekvens af placebobehandlede forsøgspersoner, omfattede brystsmerter (17 % versus 6 %), svimmelhed (13 % versus 2 %) og dyspnø ( 11 % mod 0 %).
Geriatrisk brug
Af de 765 forsøgspersoner med hjertesvigt randomiseret til COREG 6,25 mg i amerikanske kliniske forsøg, var 31 % (235) i alderen 65 år eller ældre, og 7,3 % (56) var 75 år eller ældre. Ud af de 1.156 forsøgspersoner randomiseret til COREG 3,12 mg i et langtids, placebokontrolleret forsøg med alvorlig hjertesvigt, var 47 % (547) i alderen 65 år eller ældre, og 15 % (174) var 75 år eller ældre. Ud af 3.025 forsøgspersoner, der fik COREG 6,25 mg i hjertesvigtsforsøg på verdensplan, var 42 % i alderen 65 år eller ældre.
Af de 975 forsøgspersoner med myokardieinfarkt randomiseret til COREG i CAPRICORN-studiet, var 48 % (468) i alderen 65 år eller ældre, og 11 % (111) var 75 år eller ældre.
Af de 2.065 hypertensive forsøgspersoner i amerikanske kliniske undersøgelser af effektivitet eller sikkerhed, som blev behandlet med COREG 25 mg, var 21 % (436) i alderen 65 år eller ældre. Ud af 3.722 forsøgspersoner, der fik COREG i kliniske hypertensionsforsøg udført på verdensplan, var 24 % i alderen 65 år eller ældre.
Med undtagelse af svimmelhed hos hypertensive forsøgspersoner (hyppighed 8,8 % hos ældre versus 6 % hos yngre forsøgspersoner), blev der ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet (se figur 2 og 4) mellem de ældre forsøgspersoner og yngre forsøgspersoner i hver af de disse befolkninger. Tilsvarende har andre rapporterede kliniske erfaringer ikke identificeret forskelle i respons mellem ældre og yngre forsøgspersoner, men større følsomhed hos nogle ældre individer kan ikke udelukkes.
OVERDOSIS
Overdosering kan forårsage alvorlig hypotension, bradykardi, hjerteinsufficiens, kardiogent shock og hjertestop. Luftvejsproblemer, bronkospasmer, opkastning, bevidsthedstab og generaliserede anfald kan også forekomme.
Patienten skal placeres i liggende stilling og om nødvendigt holdes under observation og behandles under intensive forhold. Følgende midler kan administreres:
Ved overdreven bradykardi : Atropin, 2 mg IV.
For at understøtte kardiovaskulær funktion Glukagon, 5 til 10 mg IV hurtigt over 30 sekunder, efterfulgt af en kontinuerlig infusion på 5 mg i timen; sympatomimetika (dobutamin, isoprenalin, adrenalin) i doser efter kropsvægt og effekt.
Hvis perifer vasodilatation dominerer, kan det være nødvendigt at administrere adrenalin eller noradrenalin med kontinuerlig monitorering af kredsløbstilstande. Ved terapi-resistent bradykardi bør pacemakerbehandling udføres. Ved bronkospasme bør der gives β-sympathomimetika (som aerosol eller IV) eller aminofyllin IV. I tilfælde af anfald anbefales langsom IV-injektion af diazepam eller clonazepam.
BEMÆRK: I tilfælde af alvorlig forgiftning, hvor der er symptomer på shock, skal behandling med modgift fortsættes i en tilstrækkelig lang periode i overensstemmelse med halveringstiden på 7 til 10 timer for carvedilol.
Tilfælde af overdosering med COREG 3,12 mg alene eller i kombination med andre lægemidler er blevet rapporteret. Indtaget mængder oversteg i nogle tilfælde 1.000 milligram. De oplevede symptomer omfattede lavt blodtryk og puls. Standard understøttende behandling blev givet, og individer kom sig.
KONTRAINDIKATIONER
COREG 25mg er kontraindiceret under følgende forhold:
- Bronkial astma eller relaterede bronkospastiske tilstande. Dødsfald fra status asthmaticus er blevet rapporteret efter enkeltdoser af COREG.
- Anden eller tredje grads AV-blok.
- Syg sinus syndrom.
- Alvorlig bradykardi (medmindre en permanent pacemaker er på plads).
- Patienter med kardiogent shock eller som har dekompenseret hjertesvigt, der kræver brug af intravenøs inotropisk behandling. Sådanne patienter skal først vænnes fra intravenøs behandling, før COREG påbegyndes.
- Patienter med svært nedsat leverfunktion.
- Patienter med en historie med en alvorlig overfølsomhedsreaktion (f.eks. Stevens-Johnsons syndrom, anafylaktisk reaktion, angioødem) over for en hvilken som helst komponent i denne medicin eller anden medicin, der indeholder carvedilol.
KLINISK FARMAKOLOGI
Handlingsmekanisme
COREG 3,12mg er en racemisk blanding, hvor ikke-selektiv β-adrenoreceptorblokerende aktivitet er til stede i S(-)-enantiomeren, og α1-adrenerg blokerende aktivitet er til stede i både R(+)- og S(-)-enantiomerer med samme styrke. COREG 6,25mg har ingen iboende sympatomimetisk aktivitet.
Farmakodynamik
Hjertefejl
Grundlaget for de gavnlige virkninger af COREG ved hjertesvigt er ikke etableret.
To placebo-kontrollerede forsøg sammenlignede de akutte hæmodynamiske virkninger af COREG med baseline-målinger hos 59 og 49 forsøgspersoner med NYHA klasse II-IV hjertesvigt, der fik diuretika, ACE-hæmmere og digitalis. Der var signifikante reduktioner i systemisk blodtryk, pulmonalarterietryk, pulmonært kapillærkiletryk og hjertefrekvens. Indledende virkninger på hjertevolumen, slagvolumenindeks og systemisk vaskulær modstand var små og variable.
Disse forsøg målte hæmodynamiske virkninger igen efter 12 til 14 uger. COREG 25mg reducerede signifikant systemisk blodtryk, pulmonalarterietryk, højre atrietryk, systemisk vaskulær modstand og hjertefrekvens, mens slagvolumenindekset blev øget.
Blandt 839 forsøgspersoner med NYHA klasse II-III hjertesvigt behandlet i 26 til 52 uger i 4 amerikanske placebokontrollerede forsøg, steg den gennemsnitlige venstre ventrikulære ejektionsfraktion (EF) målt ved radionuklidventrikulografi med 9 EF-enheder (%) hos forsøgspersoner, der fik COREG 6,25 mg og med 2 EF-enheder hos placebo-personer med en måldosis på 25 til 50 mg to gange dagligt. Virkningerne af carvedilol på ejektionsfraktionen var relateret til dosis. Doser på 6,25 mg to gange dagligt, 12,5 mg to gange dagligt og 25 mg to gange dagligt var forbundet med placebokorrigerede stigninger i EF på henholdsvis 5 EF-enheder, 6 EF-enheder og 8 EF-enheder; hver af disse effekter var nominelt statistisk signifikante.
Venstre ventrikulær dysfunktion efter myokardieinfarkt
Grundlaget for de gavnlige virkninger af COREG 25mg hos patienter med venstre ventrikulær dysfunktion efter et akut myokardieinfarkt er ikke fastlagt.
Forhøjet blodtryk
Den mekanisme, hvorved β-blokade frembringer en antihypertensiv virkning, er ikke blevet fastlagt.
β-adrenoreceptorblokerende aktivitet er blevet påvist i dyre- og menneskestudier, der viser, at carvedilol (1) reducerer hjertevolumen hos normale forsøgspersoner, (2) reducerer trænings- og/eller isoproterenol-induceret takykardi og (3) reducerer refleksortostatisk takykardi. Signifikant β-adrenoreceptorblokerende effekt ses sædvanligvis inden for 1 time efter lægemiddeladministration.
α1-adrenoreceptorblokerende aktivitet er blevet påvist i humane og dyreforsøg, hvilket viser, at carvedilol (1) dæmper phenylephrins pressoreffekter, (2) forårsager vasodilatation og (3) reducerer perifer vaskulær modstand. Disse virkninger bidrager til reduktion af blodtrykket og ses normalt inden for 30 minutter efter lægemiddeladministration.
På grund af carvedilols α1-receptorblokerende aktivitet sænkes blodtrykket mere i stående end i liggende stilling, og symptomer på postural hypotension (1,8%), inklusive sjældne tilfælde af synkope, kan forekomme. Efter oral administration, når postural hypotension er opstået, har den været forbigående og er ualmindelig, når COREG administreres sammen med mad i den anbefalede startdosis, og titreringsstigninger følges nøje [se DOSERING OG ADMINISTRATION ].
Hos hypertensive patienter med normal nyrefunktion nedsatte terapeutiske doser af COREG renal vaskulær modstand uden ændring i glomerulær filtrationshastighed eller renal plasmaflow. Ændringer i udskillelse af natrium, kalium, urinsyre og phosphor hos hypertensive patienter med normal nyrefunktion var ens efter COREG og placebo.
COREG 3,12 mg har ringe effekt på plasma katekolaminer, plasma aldosteron eller elektrolytniveauer, men det reducerer signifikant plasmareninaktivitet, når det gives i mindst 4 uger. Det øger også niveauet af atrielt natriuretisk peptid.
Farmakokinetik
COREG absorberes hurtigt og ekstensivt efter oral administration med en absolut biotilgængelighed på ca. 25 % til 35 % på grund af en signifikant grad af first-pass metabolisme. Efter oral administration varierer den tilsyneladende gennemsnitlige terminale eliminationshalveringstid for carvedilol generelt fra 7 til 10 timer. De opnåede plasmakoncentrationer er proportionale med den indgivne orale dosis. Når det administreres sammen med mad, nedsættes absorptionshastigheden, hvilket fremgår af en forsinkelse i tiden til at nå maksimale plasmaniveauer, uden nogen signifikant forskel i omfanget af biotilgængelighed. Indtagelse af COREG sammen med mad bør minimere risikoen for ortostatisk hypotension.
Carvedilol metaboliseres i vid udstrækning. Efter oral administration af radioaktivt mærket carvedilol til raske frivillige udgjorde carvedilol kun ca. 7 % af den totale radioaktivitet i plasma målt ved arealet under kurven (AUC). Mindre end 2 % af dosis blev udskilt uændret i urinen. Carvedilol metaboliseres primært ved aromatisk ringoxidation og glucuronidering.
De oxidative metabolitter metaboliseres yderligere ved konjugering via glucuronidering og sulfatering. Metabolitterne af carvedilol udskilles primært via galden i fæces. Demethylering og hydroxylering ved phenolringen producerer 3 aktive metabolitter med β-receptorblokerende aktivitet. Baseret på prækliniske undersøgelser er 4'-hydroxyphenyl-metabolitten ca. 13 gange mere potent end carvedilol til β-blokade.
Sammenlignet med carvedilol udviser de 3 aktive metabolitter svag vasodilaterende aktivitet. Plasmakoncentrationer af de aktive metabolitter er omkring en tiendedel af dem, der er observeret for carvedilol og har en farmakokinetik svarende til forælderens.
Carvedilol gennemgår stereoselektiv first-pass metabolisme med plasmaniveauer af R(+)-carvedilol ca. 2 til 3 gange højere end S(-)-carvedilol efter oral administration til raske forsøgspersoner. De gennemsnitlige tilsyneladende terminale eliminationshalveringstider for R(+)-carvedilol varierer fra 5 til 9 timer sammenlignet med 7 til 11 timer for S(-)-enantiomeren.
De primære P450-enzymer, der er ansvarlige for metabolismen af både R(+) og S(-)-carvedilol i humane levermikrosomer, var CYP2D6 og CYP2C9 og i mindre grad CYP3A4, 2C19, 1A2 og 2E1. CYP2D6 menes at være det vigtigste enzym i 4'- og 5'-hydroxyleringen af carvedilol, med et potentielt bidrag fra 3A4. CYP2C9 menes at være af primær betydning i O-methyleringsvejen for S(-)-carvedilol.
Carvedilol er genstand for virkningerne af genetisk polymorfi med dårlige metabolisatorer af debrisoquin (en markør for cytochrom P450 2D6), der udviser 2-3 gange højere plasmakoncentrationer af R(+)-carvedilol sammenlignet med omfattende metabolisatorer. I modsætning hertil øges plasmaniveauer af S(-)-carvedilol kun med omkring 20% til 25% hos dårlige metabolisatorer, hvilket indikerer, at denne enantiomer metaboliseres i mindre grad af cytochrom P450 2D6 end R(+)-carvedilol. Carvedilols farmakokinetik ser ikke ud til at være anderledes hos dårlige metabolisatorer af S-mephenytoin (patienter med mangel på cytokrom P450 2C19).
Carvedilol er mere end 98 % bundet til plasmaproteiner, primært med albumin. Plasmaproteinbindingen er uafhængig af koncentrationen over det terapeutiske område. Carvedilol er en basisk, lipofil forbindelse med et steady-state distributionsvolumen på ca. 115 L, hvilket indikerer væsentlig fordeling i ekstravaskulære væv. Plasmaclearance varierer fra 500 til 700 ml/min.
Specifikke populationer
Hjertefejl
Steady-state plasmakoncentrationer af carvedilol og dets enantiomerer steg proportionalt over dosisområdet 6,25 til 50 mg hos personer med hjertesvigt. Sammenlignet med raske forsøgspersoner havde forsøgspersoner med hjertesvigt øgede gennemsnitlige AUC- og Cmax-værdier for carvedilol og dets enantiomerer, med op til 50 % til 100 % højere værdier observeret hos 6 forsøgspersoner med NYHA klasse IV hjertesvigt. Den gennemsnitlige tilsyneladende terminale eliminationshalveringstid for carvedilol svarede til den, der blev observeret hos raske forsøgspersoner.
Geriatrisk
Plasmaniveauer af carvedilol er i gennemsnit omkring 50 % højere hos ældre sammenlignet med unge forsøgspersoner. Nedsat leverfunktion Sammenlignet med raske forsøgspersoner udviser patienter med alvorlig leverinsufficiens (cirrose) en 4- til 7-dobbelt stigning i carvedilol-niveauer. Carvedilol er kontraindiceret til patienter med svær leverinsufficiens.
Nedsat nyrefunktion
Selvom carvedilol primært metaboliseres af leveren, er plasmakoncentrationer af carvedilol blevet rapporteret at være øget hos patienter med nedsat nyrefunktion. Baseret på gennemsnitlige AUC-data blev ca. 40 % til 50 % højere plasmakoncentrationer af carvedilol observeret hos personer med hypertension og moderat til svær nyreinsufficiens sammenlignet med en kontrolgruppe af forsøgspersoner med hypertension og normal nyrefunktion. Områderne for AUC-værdier var imidlertid ens for begge grupper. Ændringer i gennemsnitlige maksimale plasmaniveauer var mindre udtalte, ca. 12 % til 26 % højere hos personer med nedsat nyrefunktion.
I overensstemmelse med dets høje grad af plasmaproteinbinding, ser carvedilol ikke ud til at blive elimineret signifikant ved hæmodialyse.
Lægemiddel-lægemiddelinteraktioner
Da carvedilol gennemgår betydelig oxidativ metabolisme, kan carvedilols metabolisme og farmakokinetik blive påvirket af induktion eller hæmning af cytochrom P450-enzymer.
Amiodaron
et farmakokinetisk forsøg udført med 106 japanske forsøgspersoner med hjerteinsufficiens resulterede samtidig administration af små belastnings- og vedligeholdelsesdoser af amiodaron med carvedilol i mindst en 2-fold stigning i steady-state dalkoncentrationerne af S(-)-carvedilol [se DRUGSINTERAKTIONER ].
Cimetidin
I et farmakokinetisk forsøg udført med 10 raske mandlige forsøgspersoner øgede cimetidin (1.000 mg dagligt) steady-state AUC for carvedilol med 30 % uden ændring i Cmax [se DRUGSINTERAKTIONER ].
Digoxin
Efter samtidig administration af carvedilol (25 mg én gang dagligt) og digoxin (0,25 mg én gang dagligt) i 14 dage, steg steady-state AUC og dalkoncentrationer af digoxin med henholdsvis 14 % og 16 % hos 12 forsøgspersoner med hypertension [se DRUGSINTERAKTIONER ].
Glyburide
Hos 12 raske forsøgspersoner resulterede kombineret administration af carvedilol (25 mg én gang dagligt) og en enkelt dosis glyburid ikke i en klinisk relevant farmakokinetisk interaktion for nogen af stofferne.
Hydrochlorthiazid
En enkelt oral dosis carvedilol 25 mg ændrede ikke farmakokinetikken af en enkelt oral dosis hydrochlorthiazid 25 mg hos 12 forsøgspersoner med hypertension. På samme måde havde hydrochlorthiazid ingen effekt på carvedilols farmakokinetik.
Rifampin
I et farmakokinetisk forsøg udført med 8 raske mandlige forsøgspersoner reducerede rifampin (600 mg dagligt i 12 dage) AUC og Cmax for carvedilol med ca. 70 % [se DRUGSINTERAKTIONER ].
Torsemid
I et forsøg med 12 raske forsøgspersoner resulterede kombineret oral administration af carvedilol 25 mg én gang dagligt og torsemid 5 mg én gang dagligt i 5 dage ikke i nogen signifikante forskelle i deres farmakokinetik sammenlignet med administration af lægemidlerne alene.
Warfarin
Carvedilol (12,5 mg to gange dagligt) havde ingen effekt på steady-state protrombintidsforhold og ændrede ikke farmakokinetikken af R(+)- og S(-)-warfarin efter samtidig administration med warfarin hos 9 raske frivillige.
Kliniske Studier
Hjertefejl
alt 6.975 forsøgspersoner med mild til svær hjerteinsufficiens blev evalueret i placebokontrollerede forsøg med carvedilol.
Mild til moderat hjertesvigt
Carvedilol blev undersøgt i 5 multicenter, placebo-kontrollerede forsøg og i 1 aktivt kontrolleret forsøg (COMET-forsøg), der involverede forsøgspersoner med mild til moderat hjertesvigt.
Fire amerikanske multicenter, dobbeltblindede, placebokontrollerede forsøg inkluderede 1.094 forsøgspersoner (696 randomiseret til carvedilol) med NYHA klasse II-III hjertesvigt og ejektionsfraktion mindre end eller lig med 0,35. Langt de fleste var på digitalis, diuretika og en ACE-hæmmer ved start af forsøget. Patienterne blev tildelt forsøgene baseret på træningsevne. Et Australien-New Zealand dobbeltblindt, placebokontrolleret forsøg inkluderede 415 forsøgspersoner (halvt randomiseret til carvedilol) med mindre alvorlig hjertesvigt. Alle protokoller udelukkede forsøgspersoner, der forventedes at gennemgå hjertetransplantation i løbet af 7,5 til 15 måneders dobbeltblind opfølgning. Alle randomiserede forsøgspersoner havde tolereret et 2-ugers kursus på carvedilol 6,25 mg to gange dagligt.
hvert forsøg var der et primært slutpunkt, enten progression af hjertesvigt (1 amerikansk forsøg) eller træningstolerance (2 amerikanske forsøg, der opfylder tilmeldingsmålene og forsøget Australien-New Zealand). Der var mange sekundære endepunkter specificeret i disse forsøg, herunder NYHA-klassificering, patient- og læge globale vurderinger og kardiovaskulær hospitalsindlæggelse. Andre analyser, der ikke var prospektivt planlagt, inkluderede summen af dødsfald og samlede kardiovaskulære indlæggelser. I situationer, hvor de primære endepunkter af et forsøg ikke viser en signifikant fordel ved behandling, er tildeling af signifikansværdier til de andre resultater kompleks, og sådanne værdier skal fortolkes med forsigtighed.
Resultaterne af forsøgene i USA og Australien-New Zealand var som følger:
Langsom udvikling af hjertesvigt
Et amerikansk multicenterforsøg (366 forsøgspersoner) havde som sit primære endepunkt summen af kardiovaskulær dødelighed, kardiovaskulær hospitalsindlæggelse og vedvarende stigning i hjertesvigtsmedicin. Hjertesvigtprogression blev reduceret, i løbet af en gennemsnitlig opfølgning på 7 måneder, med 48 % (P = 0,008).
I forsøget Australien-New Zealand blev dødsfald og samlede indlæggelser reduceret med omkring 25 % over 18 til 24 måneder. I de 3 største amerikanske forsøg blev dødsfald og samlede hospitalsindlæggelser reduceret med 19 %, 39 % og 49 %, nominelt statistisk signifikant i de sidste 2 forsøg. Resultaterne fra Australien-New Zealand var statistisk grænseoverskridende.
Funktionelle foranstaltninger
Ingen af multicenterforsøgene havde NYHA-klassificering som et primært slutpunkt, men alle sådanne forsøg havde det som et sekundært slutpunkt. Der var i det mindste en tendens til forbedring i NYHA-klassen i alle forsøg. Træningstolerance var det primære endepunkt i 3 forsøg; hos ingen blev der fundet en statistisk signifikant effekt.
Subjektive foranstaltninger
Sundhedsrelateret livskvalitet, målt med et standardspørgeskema (et primært slutpunkt i 1 forsøg), var upåvirket af carvedilol. Patienternes og efterforskernes globale vurderinger viste imidlertid signifikant forbedring i de fleste forsøg.
Dødelighed
Døden var ikke et forudbestemt endepunkt i nogen undersøgelse, men blev analyseret i alle forsøg. Samlet set blev dødeligheden reduceret i disse 4 amerikanske forsøg, nominelt signifikant i 2 forsøg.
COMET-processen
dette dobbeltblindede forsøg blev 3.029 forsøgspersoner med NYHA klasse II-IV hjertesvigt (venstre ventrikulær ejektionsfraktion mindre end eller lig med 35%) randomiseret til at modtage enten carvedilol (måldosis: 25 mg to gange dagligt) eller metoprolol med øjeblikkelig frigivelse tartrat (måldosis: 50 mg to gange dagligt). Gennemsnitsalderen for forsøgspersonerne var ca. 62 år, 80 % var mænd, og den gennemsnitlige venstre ventrikulære ejektionsfraktion ved baseline var 26 %. Ca. 96 % af forsøgspersonerne havde NYHA klasse II eller III hjertesvigt. Samtidig behandling inkluderede diuretika (99 %), ACE-hæmmere (91 %), digitalis (59 %), aldosteronantagonister (11 %) og "statin" lipidsænkende midler (21 %). Den gennemsnitlige varighed af opfølgningen var 4,8 år. Den gennemsnitlige dosis af carvedilol var 42 mg pr. dag.
Forsøget havde 2 primære endepunkter: dødelighed af alle årsager og sammensætningen af død plus hospitalsindlæggelse uanset årsag. Resultaterne af COMET er vist i tabel 3 nedenfor. Dødelighed af alle årsager vejede det meste af den statistiske vægt og var den primære determinant for forsøgets størrelse. Mortalitet af alle årsager var 34 % hos forsøgspersonerne behandlet med carvedilol og var 40 % i metoprololgruppen med øjeblikkelig frigivelse (P = 0,0017; hazard ratio = 0,83, 95 % CI: 0,74 til 0,93). Effekten på dødeligheden skyldtes primært en reduktion i kardiovaskulær død. Forskellen mellem de 2 grupper med hensyn til det sammensatte endepunkt var ikke signifikant (P = 0,122). Den estimerede gennemsnitlige overlevelse var 8,0 år med carvedilol og 6,6 år med metoprolol med øjeblikkelig frigivelse.
Det vides ikke, om denne formulering af metoprolol i en hvilken som helst dosis eller denne lave dosis af metoprolol i nogen formulering har nogen effekt på overlevelse eller hospitalsindlæggelse hos patienter med hjertesvigt. Dette forsøg forlænger således den tid, som carvedilol viser fordele ved overlevelse ved hjertesvigt, men det er ikke bevis for, at carvedilol forbedrer resultatet i forhold til formuleringen af metoprolol (TOPROL-XL) med fordele ved hjertesvigt.
Alvorlig hjertesvigt (COPERNICUS)
et dobbelt-blindt forsøg (COPERNICUS), 2.289 forsøgspersoner med hjertesvigt i hvile eller med minimal anstrengelse og venstre ventrikel ejektionsfraktion mindre end 25 % (gennemsnit 20 %), på trods af digitalis (66 %), diuretika (99 %) og ACE-hæmmere (89%) blev randomiseret til placebo eller carvedilol. Carvedilol blev titreret fra en startdosis på 3,125 mg to gange dagligt til den maksimalt tolererede dosis eller op til 25 mg to gange dagligt over minimum 6 uger. De fleste forsøgspersoner opnåede måldosis på 25 mg. Forsøget blev gennemført i Øst- og Vesteuropa, USA, Israel og Canada. Tilsvarende antal forsøgspersoner pr. gruppe (ca. 100) trak sig tilbage under titreringsperioden.
Det primære endepunkt for forsøget var dødelighed af alle årsager, men årsagsspecifik dødelighed og risikoen for død eller hospitalsindlæggelse (total, kardiovaskulær [CV] eller hjertesvigt [HF]) blev også undersøgt. De udviklende forsøgsdata blev fulgt af et dataovervågningsudvalg, og dødelighedsanalyser blev justeret for disse multiple udseende. Forsøget blev stoppet efter en median opfølgning på 10 måneder på grund af en observeret 35 % reduktion i dødeligheden (fra 19,7 % pr. patientår på placebo til 12,8 % på carvedilol; hazard ratio 0,65, 95 % CI: 0,52 til 0,81, P = 0,0014, justeret) (se figur 1). Resultaterne af COPERNICUS er vist i tabel 4.
Figur 1. Overlevelsesanalyse for COPERNICUS (Intent-to-Treat) 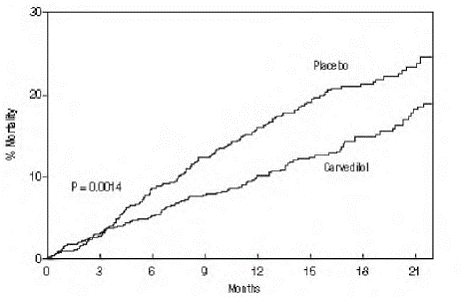
Effekten på dødeligheden var primært resultatet af en reduktion i antallet af pludselige dødsfald blandt forsøgspersoner uden forværring af hjertesvigt.
Patienternes globale vurderinger, hvor carvedilol-behandlede forsøgspersoner blev sammenlignet med placebo, var baseret på forudspecificerede, periodiske selvevalueringer af patienten med hensyn til, om den kliniske status efter behandlingen viste forbedring, forværring eller ingen ændring sammenlignet med baseline. Forsøgspersoner behandlet med carvedilol viste signifikante forbedringer i globale vurderinger sammenlignet med dem, der blev behandlet med placebo i COPERNICUS.
Protokollen specificerede også, at indlæggelser ville blive vurderet. Færre forsøgspersoner på COREG 6,25 mg end på placebo blev indlagt af en eller anden årsag (372 versus 432, P = 0,0029), af kardiovaskulære årsager (246 versus 314, P = 0,0003) eller for forværret hjertesvigt (198 versus 2600, P = 010). ).
COREG 6,25mg havde en konsekvent og gavnlig effekt på dødelighed af alle årsager samt de kombinerede endepunkter for dødelighed af alle årsager plus hospitalsindlæggelse (total, CV eller hjertesvigt) i den samlede forsøgspopulation og i alle undersøgte undergrupper, inkl. mænd og kvinder, ældre og ikke-ældre, sorte og ikke-sorte og diabetikere og ikke-diabetikere (se figur 2).
Figur 2. Effekter på dødelighed for undergrupper i COPERNICUS 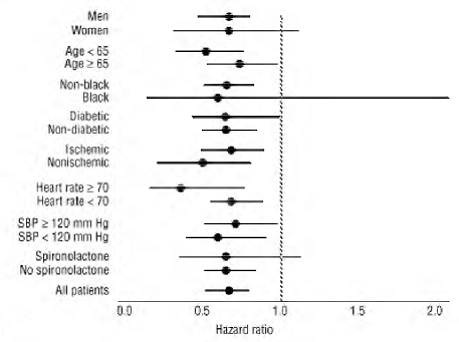
Venstre ventrikulær dysfunktion efter myokardieinfarkt
CAPRICORN var et dobbeltblindt forsøg, der sammenlignede carvedilol og placebo hos 1.959 forsøgspersoner med et nyligt myokardieinfarkt (inden for 21 dage) og venstre ventrikeludstødningsfraktion på mindre end eller lig med 40 %, med (47 %) eller uden symptomer på hjertesvigt. Forsøgspersoner, der fik carvedilol, fik 6,25 mg to gange dagligt, titreret som tolereret til 25 mg to gange dagligt. Forsøgspersonerne skulle have et systolisk blodtryk på over 90 mm Hg, en siddende puls på mere end 60 slag i minuttet og ingen kontraindikation for brug af β-blokkere. Behandling af indeksinfarkt omfattede aspirin (85%), IV eller orale β-blokkere (37%), nitrater (73%), heparin (64%), trombolytika (40%) og akut angioplastik (12%). Baggrundsbehandling omfattede ACE-hæmmere eller angiotensinreceptorblokkere (97 %), antikoagulantia (20 %), lipidsænkende midler (23 %) og diuretika (34 %). Baseline populationskarakteristika omfattede en gennemsnitsalder på 63 år, 74 % mænd, 95 % kaukasiske, gennemsnitligt blodtryk 121/74 mm Hg, 22 % med diabetes og 54 % med en historie med hypertension. Den gennemsnitlige opnåede dosis af carvedilol var 20 mg to gange dagligt; den gennemsnitlige varighed af opfølgningen var 15 måneder.
Mortalitet af alle årsager var 15 % i placebogruppen og 12 % i carvedilolgruppen, hvilket indikerer en risikoreduktion på 23 % hos forsøgspersoner behandlet med carvedilol (95 % CI: 2 % til 40 %, P = 0,03), som vist i figuren 3. Effekterne på dødeligheden i forskellige undergrupper er vist i figur 4. Næsten alle dødsfald var kardiovaskulære (som blev reduceret med 25 % af carvedilol), og de fleste af disse dødsfald var pludselige eller relateret til pumpesvigt (begge dødsfald blev reduceret af carvedilol). Et andet forsøgsslutpunkt, total dødelighed og hospitalsindlæggelse af alle årsager, viste ikke en signifikant forbedring.
Der blev også observeret en signifikant 40 % reduktion i dødelig eller ikke-dødelig myokardieinfarkt i gruppen behandlet med carvedilol (95 % CI: 11 % til 60 %, P = 0,01). En tilsvarende reduktion i risikoen for myokardieinfarkt blev også observeret i en metaanalyse af placebokontrollerede forsøg med carvedilol ved hjertesvigt.
Figur 3. Overlevelsesanalyse for STENDEN (Intent-to-Treat) 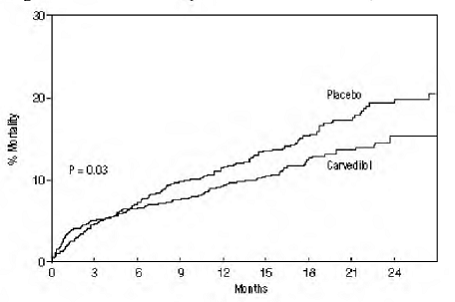
Figur 4. Effekter på dødelighed for undergrupper i STENDEN 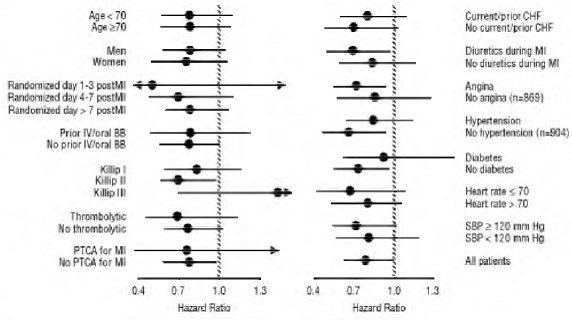
Forhøjet blodtryk
COREG 25mg blev undersøgt i 2 placebokontrollerede forsøg, hvor der blev brugt to gange daglig dosering ved samlede daglige doser på 12,5 til 50 mg. I disse og andre forsøg oversteg startdosis ikke 12,5 mg. Ved 50 mg dagligt reducerede COREG siddende lavtryk (12 timer) med ca. 9/5,5 mm Hg; ved 25 mg pr. dag var virkningen ca. 7,5/3,5 mm Hg. Sammenligninger af bund-til-top-blodtryk viste et bund-til-top-forhold for blodtryksrespons på omkring 65 %. Hjertefrekvensen faldt med omkring 7,5 slag i minuttet ved 50 mg pr. dag. Generelt, som det er tilfældet for andre β-blokkere, var svarene mindre hos sorte end ikke-sorte forsøgspersoner. Der var ingen alders- eller kønsrelaterede forskelle i respons.
Den maksimale antihypertensive effekt indtrådte 1 til 2 timer efter en dosis. Det dosisrelaterede blodtryksrespons blev ledsaget af en dosisrelateret stigning i bivirkninger [se BIVIRKNINGER ].
Hypertension med type 2 diabetes mellitus
et dobbeltblindt forsøg (GEMINI) blev COREG 25 mg, tilføjet til en ACE-hæmmer eller angiotensin-receptorblokker, evalueret i en population med mild til moderat hypertension og velkontrolleret type 2-diabetes mellitus. Den gennemsnitlige HbA1c ved baseline var 7,2 %. COREG blev titreret til en gennemsnitlig dosis på 17,5 mg to gange dagligt og opretholdt i 5 måneder. COREG havde ingen negativ effekt på glykæmisk kontrol, baseret på HbA1c-målinger (gennemsnitlig ændring fra baseline på 0,02 %, 95 % CI: -0,06 til 0,10, P = NS) [se ADVARSLER OG FORHOLDSREGLER ].
PATIENTOPLYSNINGER
COREG (Co-REG) (carvedilol) Tabletter
Læs patientinformationen, der følger med COREG, før du begynder at tage den, og hver gang du får en genopfyldning. Der kan være nye oplysninger. Disse oplysninger træder ikke i stedet for at tale med din læge om din medicinske tilstand eller din behandling. Spørg din læge eller apoteket, hvis du har spørgsmål om COREG 3,12mg.
Hvad er COREG 3,12mg?
COREG er et receptpligtigt lægemiddel, der tilhører en gruppe lægemidler, der kaldes "betablokkere". COREG 6,25mg bruges, ofte sammen med anden medicin, til følgende tilstande:
- at behandle patienter med visse typer hjertesvigt
- at behandle patienter, der havde et hjerteanfald, der forværrede, hvor godt hjertet pumper
- til behandling af patienter med forhøjet blodtryk (hypertension)
COREG er ikke godkendt til brug hos børn under 18 år.
Hvem bør ikke tage COREG?
Tag ikke COREG 6,25 mg, hvis du:
- har alvorligt hjertesvigt og er indlagt på intensivafdelingen eller har behov for visse intravenøse medicin, der hjælper med at understøtte cirkulationen (inotrop medicin).
- er tilbøjelige til at få astma eller andre vejrtrækningsproblemer.
- har et langsomt hjerteslag eller et hjerte, der springer et slag over (uregelmæssig hjerterytme).
- har leverproblemer.
- er allergiske over for nogen af ingredienserne i COREG. Den aktive ingrediens er carvedilol. Se slutningen af denne folder for en liste over alle ingredienserne i COREG.
Hvad skal jeg fortælle min læge, før jeg tager COREG?
Fortæl din læge om alle dine medicinske tilstande, herunder hvis du:
- har astma eller andre lungeproblemer (såsom bronkitis eller emfysem).
- har problemer med blodgennemstrømningen i dine fødder og ben (perifer vaskulær sygdom). COREG 3,12mg kan gøre nogle af dine symptomer værre.
- har diabetes.
- har problemer med skjoldbruskkirtlen.
- har en tilstand kaldet fæokromocytom.
- har haft alvorlige allergiske reaktioner.
- er gravid eller forsøger at blive gravid. Det vides ikke, om COREG er sikkert for dit ufødte barn. Du og din læge bør tale om den bedste måde at kontrollere dit høje blodtryk på under graviditeten.
- ammer. Det vides ikke, om COREG udskilles i din modermælk. Tal med din læge om den bedste måde at fodre din baby på, hvis du tager COREG.
- er planlagt til operation og får bedøvelsesmidler.
- er planlagt til operation for grå stær og har taget eller tager COREG.
- tager receptpligtig eller håndkøbsmedicin, vitaminer og naturlægemidler. COREG og visse andre lægemidler kan påvirke hinanden og forårsage alvorlige bivirkninger. COREG 3,12 mg kan påvirke den måde, anden medicin virker på. Også anden medicin kan påvirke, hvor godt COREG 25mg virker.
Hold en liste over al den medicin, du tager. Vis denne liste til din læge og apotek, før du begynder på en ny medicin.
Hvordan skal jeg tage COREG?
Det er vigtigt for dig at tage din medicin hver dag som anvist af din læge. Hvis du pludselig stopper med at tage COREG, kan du få brystsmerter og/eller et hjerteanfald. Hvis din læge beslutter, at du skal stoppe med at tage COREG 6,25 mg, kan din læge langsomt sænke din dosis over en periode, før den stopper helt.
- Tag COREG nøjagtigt som foreskrevet. Din læge vil fortælle dig, hvor mange tabletter du skal tage og hvor ofte. For at minimere mulige bivirkninger kan din læge begynde med en lav dosis og derefter langsomt øge dosis.
- Stop ikke med at tage COREG, og skift ikke mængden af COREG, du tager uden at tale med din læge.
- Fortæl det til din læge, hvis du tager på i vægt eller har problemer med at trække vejret, mens du tager COREG.
- Tag COREG med mad.
- Hvis du glemmer en dosis COREG 3,12 mg, skal du tage din dosis, så snart du husker det, medmindre det er tid til at tage din næste dosis. Tag din næste dosis på det sædvanlige tidspunkt. Tag ikke 2 doser på samme tid.
- Hvis du tager for meget COREG 25mg, skal du straks kontakte din læge eller giftkontrolcenter.
Hvad skal jeg undgå, mens jeg tager COREG 3,12mg?
- COREG kan få dig til at føle dig svimmel, træt eller besvime. Kør ikke bil, brug ikke maskiner eller gør noget, der kræver, at du er opmærksom, hvis du har disse symptomer.
Hvad er mulige bivirkninger af COREG?
- Lavt blodtryk (som kan forårsage svimmelhed eller besvimelse, når du rejser dig). Hvis disse sker, skal du sidde eller ligge ned med det samme og fortælle det til din læge.
- Træthed. Hvis du føler dig træt eller svimmel, bør du ikke køre bil, bruge maskiner eller gøre noget, der kræver, at du er opmærksom.
- Langsomt hjerteslag.
- Ændringer i dit blodsukker. Hvis du har diabetes, skal du fortælle det til din læge, hvis du har ændringer i dit blodsukkerniveau.
- COREG kan skjule nogle af symptomerne på lavt blodsukker, især et hurtigt hjerteslag.
- COREG kan maskere symptomerne på hyperthyroidisme (overaktiv skjoldbruskkirtel).
- Forværring af alvorlige allergiske reaktioner.
- Sjældne, men alvorlige allergiske reaktioner (inklusive nældefeber eller hævelse af ansigt, læber, tunge og/eller svælg, der kan forårsage åndedrætsbesvær eller synkebesvær) er forekommet hos patienter, der var på COREG. Disse reaktioner kan være livstruende.
Andre bivirkninger af COREG omfatter åndenød, vægtøgning, diarré og færre tårer eller tørre øjne, der bliver generende, hvis du bruger kontaktlinser.
Ring til din læge, hvis du har bivirkninger, der generer dig eller ikke forsvinder.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA1088.
Hvordan skal jeg opbevare COREG 6,25mg?
- Opbevar COREG ved mindre end 86°F (30°C). Hold tabletterne tørre.
- Smid sikkert COREG væk, der er forældet eller ikke længere er nødvendigt.
- Opbevar COREG 6,25mg og al medicin utilgængeligt for børn.
Generel information om COREG
Lægemidler ordineres nogle gange til andre tilstande end dem, der er beskrevet i indlægssedler. Brug ikke COREG 3,12 mg til en tilstand, som den ikke er ordineret til. Giv ikke COREG til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Denne folder opsummerer de vigtigste oplysninger om COREG. Hvis du vil have mere information, så tal med din læge. Du kan bede din læge eller apotek om oplysninger om COREG 6,25mg, der er skrevet til sundhedspersonale.
Hvad er ingredienserne i COREG?
Aktiv ingrediens: carvedilol.
Inaktive ingredienser: kolloid siliciumdioxid, crospovidon, hypromellose, lactose, magnesiumstearat, polyethylenglycol, polysorbat 80, povidon, saccharose og titaniumdioxid.
Carvedilol tabletter findes i følgende styrker: 3,125 mg, 6,25 mg, 12,5 mg, 25 mg.
Hvad er forhøjet blodtryk (hypertension)?
Blodtrykket er blodets kraft i dine blodkar, når dit hjerte slår, og når dit hjerte hviler. Du har forhøjet blodtryk, når kraften er for stor. Forhøjet blodtryk får hjertet til at arbejde hårdere for at pumpe blod gennem kroppen og forårsager skader på blodkarrene. COREG kan hjælpe dine blodkar med at slappe af, så dit blodtryk er lavere. Medicin, der sænker blodtrykket, kan nedsætte din chance for at få et slagtilfælde eller hjerteanfald.
