Vasotec 2.5mg, 5mg, 10mg Enalapril Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Vasotec, og hvordan bruges det?
Vasotec er en receptpligtig medicin, der bruges til at behandle symptomer på forhøjet blodtryk (hypertension), venstre ventrikulær dysfunktion og kongestiv hjertesvigt. Vasotec kan bruges alene eller sammen med anden medicin.
- Vasotec tilhører en klasse af lægemidler kaldet ACE-hæmmere.
- Det vides ikke, om Vasotec er sikkert og effektivt til børn under 1 måned.
Hvad er de mulige bivirkninger af Vasotec 2,5 mg?
Vasotec 2,5 mg kan forårsage alvorlige bivirkninger, herunder:
- svimmelhed,
- brystsmerter,
- gulfarvning af huden eller øjnene (gulsot),
- lidt eller ingen vandladning,
- feber,
- kuldegysninger,
- ondt i halsen,
- kvalme,
- svaghed,
- prikkende følelse,
- uregelmæssige hjerteslag, og
- tab af bevægelse
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Vasotec omfatter:
- svimmelhed,
- træthed, og
- svimmelhed
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Vasotec. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
FØTALT TOKSICITET
- Når graviditet opdages, skal du seponere VASOTEC® så hurtigt som muligt.
- Lægemidler, der virker direkte på renin-angiotensin-systemet, kan forårsage skade og død hos fosteret under udvikling. Se ADVARSLER: Føtal toksicitet
BESKRIVELSE
VASOTEC® (Enalapril Maleate) er maleatsaltet af enalapril, ethylesteren af en langtidsvirkende angiotensin-konverterende enzymhæmmer, enalaprilat. Enalaprilmaleat er kemisk beskrevet som (S)-1[N-[1-(ethoxycarbonyl)-3-phenylpropyl]-L-alanyl]-L-prolin, (Z)-2-butendioatsalt (1:1). Dens empiriske formel er C20H28N2O5•C4H4O4, og dens strukturformel er:
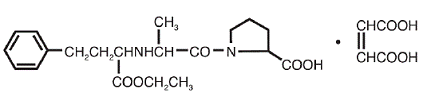
Enalaprilmaleat er et hvidt til råhvidt, krystallinsk pulver med en molekylvægt på 492,53. Det er tungtopløseligt i vand, opløseligt i ethanol og frit opløseligt i methanol.
Enalapril er et pro-lægemiddel; efter oral administration bioaktiveres det ved hydrolyse af ethylesteren til enalaprilat, som er den aktive angiotensin-konverterende enzymhæmmer.
Enalaprilmaleat leveres som 2,5 mg, 5 mg, 10 mg og 20 mg tabletter til oral administration. Ud over den aktive ingrediens enalaprilmaleat indeholder hver tablet følgende inaktive ingredienser: lactose, magnesiumstearat, natriumbicarbonat og stivelse. 10 mg og 20 mg tabletterne indeholder også jernoxider.
INDIKATIONER
Forhøjet blodtryk
VASOTEC er indiceret til behandling af hypertension.
VASOTEC er effektivt alene eller i kombination med andre antihypertensiva, især diuretika af thiazidtypen. De blodtrykssænkende virkninger af VASOTEC 10 mg og thiazider er tilnærmelsesvis additive.
Hjertefejl
VASOTEC er indiceret til behandling af symptomatisk kongestiv hjerteinsufficiens, sædvanligvis i kombination med diuretika og digitalis. Hos disse patienter forbedrer VASOTEC 5mg symptomer, øger overlevelse og reducerer hyppigheden af indlæggelse (se KLINISK FARMAKOLOGI , Hjertefejl , Dødelighedsforsøg for detaljer og begrænsninger af overlevelsesforsøg ).
Asymptomatisk venstre ventrikulær dysfunktion
Hos klinisk stabile asymptomatiske patienter med venstre ventrikulær dysfunktion (ejektionsfraktion ≤ 35 procent), sænker VASOTEC 5mg udviklingshastigheden af åbenlyst hjertesvigt og reducerer forekomsten af hospitalsindlæggelse for hjertesvigt (se KLINISK FARMAKOLOGI , Hjertefejl , Dødelighedsforsøg for detaljer og begrænsninger af overlevelsesforsøg ).
Ved brug af VASOTEC 2,5 mg skal det tages i betragtning, at en anden angiotensinkonverterende enzymhæmmer, captopril, har forårsaget agranulocytose, især hos patienter med nedsat nyrefunktion eller kollagen vaskulær sygdom, og at tilgængelige data er utilstrækkelige til at vise, at VASOTEC 2,5 mg ikke har en lignende risiko (se ADVARSLER ).
Når man overvejer at bruge VASOTEC, skal det bemærkes, at i kontrollerede kliniske forsøg har ACE-hæmmere en effekt på blodtrykket, der er mindre hos sorte patienter end hos ikke-sorte. Derudover skal det bemærkes, at sorte patienter, der får ACE-hæmmere, er blevet rapporteret at have en højere forekomst af angioødem sammenlignet med ikke-sorte (se ADVARSLER , Hoved- og nakkeangioødem ).
DOSERING OG ADMINISTRATION
Forhøjet blodtryk
Hos patienter, som i øjeblikket behandles med et diuretikum, kan der lejlighedsvis forekomme symptomatisk hypotension efter den indledende dosis af VASOTEC. Diuretika bør om muligt seponeres i to til tre dage før påbegyndelse af behandling med VASOTEC for at reducere sandsynligheden for hypotension (se ADVARSLER ). Hvis patientens blodtryk ikke kontrolleres med VASOTEC alene, kan diuretikabehandling genoptages.
Hvis diuretika ikke kan seponeres, bør en startdosis på 2,5 mg anvendes under lægeligt tilsyn i mindst to timer, og indtil blodtrykket har stabiliseret sig i mindst en ekstra time (se ADVARSLER og FORHOLDSREGLER , DRUGSINTERAKTIONER ).
Den anbefalede startdosis til patienter, der ikke tager diuretika, er 5 mg én gang dagligt. Dosis bør justeres i henhold til blodtryksrespons. Det sædvanlige dosisområde er 10 til 40 mg dagligt indgivet i en enkelt dosis eller to opdelte doser. Hos nogle patienter, der behandles én gang dagligt, kan den antihypertensive effekt aftage mod slutningen af doseringsintervallet. Hos sådanne patienter bør en stigning i dosis eller administration to gange dagligt overvejes. Hvis blodtrykket ikke kontrolleres med VASOTEC 2,5 mg alene, kan et diuretikum tilsættes. Samtidig administration af VASOTEC 5 mg og kaliumtilskud, kaliumsalterstatninger eller kaliumbesparende diuretika kan føre til stigninger i serumkalium (se FORHOLDSREGLER ).
Dosisjustering hos hypertensive patienter med nedsat nyrefunktion
Den sædvanlige dosis af enalapril anbefales til patienter med en kreatininclearance på mere end 30 ml/min (serumkreatinin på op til ca. 3 mg/dL). For patienter med kreatininclearance mindre end eller lig med 30 ml/min (serumkreatinin mere end eller lig med 3 mg/dL), er den første dosis 2,5 mg én gang dagligt. Dosis kan titreres opad, indtil blodtrykket er kontrolleret eller til maksimalt 40 mg dagligt.
Hjertefejl
VASOTEC er indiceret til behandling af symptomatisk hjerteinsufficiens, sædvanligvis i kombination med diuretika og digitalis. I de placebokontrollerede undersøgelser, der viste forbedret overlevelse, blev patienterne titreret som tolereret op til 40 mg, indgivet i to opdelte doser.
Den anbefalede startdosis er 2,5 mg. Det anbefalede doseringsområde er 2,5 til 20 mg givet to gange dagligt. Doser bør titreres opad, som tolereret, over en periode på et par dage eller uger. Den maksimale daglige dosis administreret i kliniske forsøg var 40 mg i opdelte doser.
Efter den indledende dosis af VASOTEC skal patienten observeres under lægeligt tilsyn i mindst to timer, og indtil blodtrykket har stabiliseret sig i mindst en ekstra time (se ADVARSLER og DRUGSINTERAKTIONER ). Hvis det er muligt, bør dosis af ethvert samtidig diuretikum reduceres, hvilket kan mindske sandsynligheden for hypotension. Forekomsten af hypotension efter den indledende dosis af VASOTEC udelukker ikke efterfølgende omhyggelig dosistitrering med lægemidlet efter effektiv behandling af hypotensionen.
Asymptomatisk venstre ventrikulær dysfunktion
I forsøget, der viste effekt, blev patienterne startet med 2,5 mg to gange dagligt og blev titreret som tolereret til den målrettede daglige dosis på 20 mg (i opdelte doser).
Efter den indledende dosis af VASOTEC 10 mg skal patienten observeres under lægeligt opsyn i mindst to timer, og indtil blodtrykket har stabiliseret sig i mindst en ekstra time (se ADVARSLER og DRUGSINTERAKTIONER ). Hvis det er muligt, bør dosis af ethvert samtidig diuretikum reduceres, hvilket kan mindske sandsynligheden for hypotension. Forekomsten af hypotension efter den indledende dosis af VASOTEC 5 mg udelukker ikke efterfølgende omhyggelig dosistitrering med lægemidlet efter effektiv behandling af hypotensionen.
Dosisjustering hos patienter med hjertesvigt og nedsat nyrefunktion eller hyponatriæmi
Hos patienter med hjertesvigt, som har hyponatriæmi (serumnatrium mindre end 130 mEq/L) eller med serumkreatinin større end 1,6 mg/dL, bør behandlingen påbegyndes med 2,5 mg dagligt under tæt medicinsk overvågning (se Hjertefejl , ADVARSLER og DRUGSINTERAKTIONER ). Dosis kan øges til 2,5 mg to gange dagligt, derefter 5 mg to gange dagligt og højere efter behov, sædvanligvis med intervaller på fire dage eller mere, hvis der på tidspunktet for dosisjustering ikke er overdreven hypotension eller signifikant forringelse af nyrefunktionen. Den maksimale daglige dosis er 40 mg.
Pædiatriske hypertensive patienter
Den sædvanlige anbefalede startdosis er 0,08 mg/kg (op til 5 mg) én gang dagligt. Dosis bør justeres i henhold til blodtryksrespons. Doser over 0,58 mg/kg (eller over 40 mg) er ikke blevet undersøgt hos pædiatriske patienter (se KLINISK FARMAKOLOGI , Klinisk farmakologi hos pædiatriske patienter ).
VASOTEC 5mg anbefales ikke til nyfødte og til pædiatriske patienter med glomerulær filtrationshastighed mindre end 30 ml/min/1,73 m², da der ikke er tilgængelige data.
Fremstilling af suspension (til 200 ml af en 1,0 mg/ml suspension)
Tilsæt 50 mL Bicitra® til en polyethylenterephthalat (PET) flaske indeholdende ti 20 mg tabletter af VASOTEC 10 mg og ryst i mindst 2 minutter. Lad koncentratet stå i 60 minutter. Efter 60 minutters holdetid rystes koncentratet i yderligere et minut. Tilsæt 150 ml Ora-Sweet SF™2 til koncentratet i PET-flasken, og ryst suspensionen for at dispergere ingredienserne. Suspensionen skal opbevares i køleskab ved 2-8°C (36-46°F) og kan opbevares i op til 30 dage. Ryst suspensionen før hver brug.
HVORDAN LEVERET
Opbevaring
Opbevares ved 25°C (77°F); udflugter tilladt til 15-30°C (59-86°F) [se USP kontrolleret rumtemperatur ].
Hold beholderen tæt lukket.
Beskyt mod fugt.
Dispenser i en tæt beholder i henhold til USP, hvis produktpakken er underopdelt.
Fremstillet for: Valeant Pharmaceuticals North America LLC Bridgewater, NJ 08807 USA. Fremstillet af: Valeant Pharmaceuticals International, Inc. Steinbach, MB R5G 1Z7 Canada. Revision: juli 2017.
BIVIRKNINGER
VASOTEC er blevet evalueret for sikkerhed hos mere end 10.000 patienter, herunder over 1000 patienter behandlet i et år eller mere. VASOTEC 10 mg har vist sig at være generelt veltolereret i kontrollerede kliniske forsøg med 2987 patienter. For det meste var uønskede oplevelser milde og forbigående. I kliniske forsøg var det nødvendigt at seponere behandlingen på grund af kliniske bivirkninger hos 3,3 procent af patienterne med hypertension og hos 5,7 procent af patienterne med hjertesvigt. Hyppigheden af bivirkninger var ikke relateret til den samlede daglige dosis inden for de sædvanlige dosisområder. Hos patienter med hypertension var den samlede procentdel af patienter behandlet med VASOTEC, der rapporterede bivirkninger, sammenlignelig med placebo.
Forhøjet blodtryk
Bivirkninger, der forekommer hos mere end én procent af patienter med hypertension behandlet med VASOTEC 2,5 mg i kontrollerede kliniske forsøg, er vist nedenfor. Hos patienter behandlet med VASOTEC var den maksimale behandlingsvarighed tre år; hos placebobehandlede patienter var den maksimale behandlingsvarighed 12 uger.
Hjertefejl
Bivirkninger, der forekommer hos mere end én procent af patienter med hjertesvigt behandlet med VASOTEC 5mg, er vist nedenfor. Incidensen repræsenterer erfaringerne fra både kontrollerede og ukontrollerede kliniske forsøg (maksimal behandlingsvarighed var ca. et år). Hos de placebobehandlede patienter er de rapporterede forekomster fra de kontrollerede forsøg (maksimal behandlingsvarighed er 12 uger). Procentdelen af patienter med alvorligt hjertesvigt (NYHA klasse IV) var 29 procent og 43 procent for patienter behandlet med henholdsvis VASOTEC 2,5 mg og placebo.
Andre alvorlige kliniske bivirkninger, der er opstået, siden lægemidlet blev markedsført, eller bivirkninger, der forekommer hos 0,5 til 1,0 procent af patienter med hypertension eller hjertesvigt i kliniske forsøg, er angivet nedenfor og er inden for hver kategori i rækkefølge efter faldende sværhedsgrad.
Kroppen som helhed
Anafylaktoide reaktioner (se ADVARSLER , Anafylaktoide og muligvis relaterede reaktioner ).
Kardiovaskulær
Hjertestop; myokardieinfarkt eller cerebrovaskulær ulykke, muligvis sekundært til overdreven hypotension hos højrisikopatienter (se ADVARSLER , Hypotension ); lungeemboli og infarkt; lungeødem; rytmeforstyrrelser, herunder atriel takykardi og bradykardi; atrieflimren; hjertebanken, Raynauds fænomen.
Fordøjelse
Ileus, pancreatitis, leversvigt, hepatitis (hepatocellulær [påvist ved genudsættelse] eller kolestatisk gulsot) (se ADVARSLER , Leversvigt ), melena, anoreksi, dyspepsi, forstoppelse, glossitis, stomatitis, mundtørhed.
Hæmatologisk
Sjældne tilfælde af neutropeni, trombocytopeni og knoglemarvsdepression.
Muskuloskeletale
Muskelkramper.
Nervøs/psykiatrisk
Depression, forvirring, ataksi, somnolens, søvnløshed, nervøsitet, perifer neuropati (f.eks. paræstesi, dysestesi), drømmeabnormitet.
Åndedræt
Bronkospasme, rhinoré, ondt i halsen og hæshed, astma, øvre luftvejsinfektion, lungeinfiltrater, eosinofil pneumonitis.
Hud
Eksfoliativ dermatitis, toksisk epidermal nekrolyse, Stevens-Johnsons syndrom, pemphigus, herpes zoster, erythema multiforme, nældefeber, kløe, alopeci, rødmen, diaforese, lysfølsomhed.
Særlige sanser
Sløret syn, smagsændring, anosmi, tinnitus, conjunctivitis, tørre øjne, tåreflåd.
Urogenital
Nyresvigt, oliguri, nyreinsufficiens (se FORHOLDSREGLER og DOSERING OG ADMINISTRATION ), flankesmerter, gynækomasti, impotens.
Diverse
Der er rapporteret et symptomkompleks, som kan omfatte nogle af eller alle følgende: en positiv ANA, en forhøjet erytrocytsedimentationshastighed, artralgi/gigt, myalgi/myositis, feber, serositis, vaskulitis, leukocytose, eosinofili, lysfølsomhed, udslæt og andre dermatologiske manifestationer.
Angioødem
Angioødem er blevet rapporteret hos patienter, der fik VASOTEC 2,5 mg, med en højere incidens hos sorte patienter end hos ikke-sorte patienter. Angioødem forbundet med larynxødem kan være fatalt. Hvis der opstår angioødem i ansigtet, ekstremiteterne, læberne, tungen, glottis og/eller strubehovedet, skal behandlingen med VASOTEC seponeres og passende behandling iværksættes straks (se ADVARSLER ).
Hypotension
Hos de hypertensive patienter forekom hypotension hos 0,9 procent og synkope hos 0,5 procent af patienterne efter den indledende dosis eller under forlænget behandling. Hypotension eller synkope var en årsag til seponering af behandlingen hos 0,1 procent af hypertensive patienter. Hos patienter med hjertesvigt forekom hypotension hos 6,7 procent og synkope hos 2,2 procent af patienterne. Hypotension eller synkope var en årsag til seponering af behandlingen hos 1,9 procent af patienter med hjertesvigt (se ADVARSLER ).
Hoste
Se FORHOLDSREGLER , Hoste .
Pædiatriske patienter
Bivirkningsprofilen for pædiatriske patienter ser ud til at svare til den, der ses hos voksne patienter.
Resultater af kliniske laboratorietest
Serum elektrolytter
Hyperkaliæmi (se FORHOLDSREGLER ), hyponatriæmi.
Kreatinin, Blod Urea Nitrogen
kontrollerede kliniske undersøgelser blev der observeret mindre stigninger i blodets urinstofnitrogen og serumkreatinin, som var reversible ved seponering af behandlingen, hos ca. 0,2 procent af patienterne med essentiel hypertension behandlet med VASOTEC alene. Forøgelser er mere tilbøjelige til at forekomme hos patienter, der samtidig får diuretika eller hos patienter med nyrearteriestenose (se FORHOLDSREGLER ). Hos patienter med hjerteinsufficiens, som også fik diuretika med eller uden digitalis, blev stigninger i blodets urinstofnitrogen eller serumkreatinin, sædvanligvis reversible ved seponering af VASOTEC 5 mg og/eller anden samtidig diuretikabehandling, observeret hos omkring 11 procent af patienterne. Forøgelser i blodets urinstofnitrogen eller kreatinin var en årsag til seponering hos 1,2 procent af patienterne.
Hæmatologi
Små fald i hæmoglobin og hæmatokrit (gennemsnitlige fald på henholdsvis ca. 0,3 g procent og 1,0 vol procent) forekommer hyppigt hos patienter med enten hypertension eller kongestiv hjertesvigt, der behandles med VASOTEC 5 mg, men er sjældent af klinisk betydning, medmindre en anden årsag til anæmi eksisterer sideløbende. I kliniske forsøg afbrød mindre end 0,1 procent af patienterne behandlingen på grund af anæmi. Hæmolytisk anæmi, herunder tilfælde af hæmolyse hos patienter med G6PD-mangel, er blevet rapporteret; en årsagssammenhæng til enalapril kan ikke udelukkes.
Leverfunktionstest
Forhøjelser af leverenzymer og/eller serumbilirubin er forekommet (se ADVARSLER , Leversvigt ).
Kontakt Valeant Pharmaceuticals North America LLC på 1-800-321-4576 eller FDA på 1-800-FDA-1088 eller www.fda.gov/medwatch for at rapportere FORSINKTE BIVIRKNINGER.
DRUGSINTERAKTIONER
Neprilysin-hæmmere
Patienter, der samtidig tager neprilysinhæmmere, kan have øget risiko for angioødem. (se ADVARSLER )
Dobbelt blokade af Renin-Angiotensin System (RAS)
Dobbelt blokade af RAS med angiotensinreceptorblokkere, ACE-hæmmere eller aliskiren er forbundet med øget risiko for hypotension, hyperkaliæmi og ændringer i nyrefunktionen (inklusive akut nyresvigt) sammenlignet med monoterapi. De fleste patienter, der får kombinationen af to RAS-hæmmere, opnår ingen yderligere fordele sammenlignet med monoterapi. Undgå generelt kombineret brug af RAS-hæmmere. Overvåg nøje blodtryk, nyrefunktion og elektrolytter hos patienter på VASOTEC 2,5 mg og andre midler, der påvirker RAS.
Giv ikke aliskiren samtidig med VASOTEC 5mg til patienter med diabetes. Undgå brug af aliskiren med VASOTEC til patienter med nedsat nyrefunktion (GFR
Hypotension - Patienter i diuretikabehandling
Patienter i diuretika og især dem, hvor diuretikabehandling for nylig er påbegyndt, kan lejlighedsvis opleve en for kraftig reduktion af blodtrykket efter påbegyndelse af behandling med enalapril. Muligheden for hypotensive virkninger med enalapril kan minimeres ved enten at seponere diuretikummet eller øge saltindtaget før påbegyndelse af behandling med enalapril. Hvis det er nødvendigt at fortsætte med diuretika, skal du sørge for tæt lægelig overvågning efter den indledende dosis i mindst to timer, og indtil blodtrykket har stabiliseret sig i mindst en ekstra time (se ADVARSLER og DOSERING OG ADMINISTRATION ).
Agenter, der forårsager reninfrigivelse
Den antihypertensive effekt af VASOTEC 10mg forstærkes af antihypertensiva, der forårsager reninfrigivelse (f.eks. diuretika).
Ikke-steroide antiinflammatoriske midler, herunder selektive cyclooxygenase-2-hæmmere (COX-2-hæmmere)
Hos ældre patienter, volumendepleterede (inklusive dem i diuretikabehandling) eller med nedsat nyrefunktion, kan samtidig administration af NSAID'er, inklusive selektive COX-2-hæmmere, med ACE-hæmmere, inklusive enalapril, resultere i forringelse af nyrefunktionen, inkl. mulig akut nyresvigt. Disse virkninger er normalt reversible. Overvåg nyrefunktionen periodisk hos patienter, der får enalapril- og NSAID-behandling.
I et klinisk farmakologisk studie blev indomethacin eller sulindac administreret til hypertensive patienter, der fik VASOTEC. I denne undersøgelse var der ingen tegn på en sløvhed af den antihypertensive virkning af VASOTEC. Rapporter tyder dog på, at NSAID'er kan mindske den antihypertensive effekt af ACE-hæmmere.
Andre kardiovaskulære midler
VASOTEC 10mg er blevet brugt sammen med beta-adrenerge-blokerende midler, methyldopa, nitrater, calcium-blokerende midler, hydralazin, prazosin og digoxin uden tegn på klinisk signifikante uønskede interaktioner.
Midler, der øger serumkalium
VASOTEC dæmper kaliumtab forårsaget af diuretika af thiazidtypen. Kaliumbesparende diuretika (f.eks. spironolacton, triamteren eller amilorid), kaliumtilskud eller kaliumholdige salterstatninger kan føre til betydelige stigninger i serumkalium. Hvis samtidig brug af disse midler er indiceret på grund af påvist hypokaliæmi, bør de derfor anvendes med forsigtighed og med hyppig overvågning af serumkalium. Kaliumbesparende midler bør generelt ikke anvendes til patienter med hjertesvigt, der får VASOTEC.
Lithium
Lithiumtoksicitet er blevet rapporteret hos patienter, der får lithium samtidig med lægemidler, der forårsager elimination af natrium, inklusive ACE-hæmmere. Nogle få tilfælde af lithiumtoksicitet er blevet rapporteret hos patienter, der samtidig fik VASOTEC og lithium og var reversible efter seponering af begge lægemidler. Det anbefales, at serumlithiumniveauer overvåges hyppigt, hvis enalapril administreres samtidig med lithium.
Guld
Nitritoidreaktioner (symptomer omfatter rødmen i ansigtet, kvalme, opkastning og hypotension) er sjældent blevet rapporteret hos patienter i behandling med injicerbart guld (natriumaurothiomalat) og samtidig behandling med ACE-hæmmere inklusive VASOTEC.
mTOR (pattedyr Target Of Rapamycin) hæmmere
Patienter, der får samtidig behandling med ACE-hæmmer og mTOR-hæmmer (f.eks. temsirolimus, sirolimus, everolimus), kan have øget risiko for angioødem (se ADVARSLER ).
ADVARSLER
Anafylaktoide og muligvis relaterede reaktioner
Formodentlig fordi angiotensin-konverterende enzymhæmmere påvirker metabolismen af eicosanoider og polypeptider, herunder endogent bradykinin, kan patienter, der får ACE-hæmmere (inklusive VASOTEC), blive udsat for en række bivirkninger, nogle af dem alvorlige.
Hoved og hals angioødem
Angioødem i ansigt, ekstremiteter, læber, tunge, glottis og/eller strubehoved er blevet rapporteret hos patienter behandlet med angiotensinkonverterende enzymhæmmere, inklusive VASOTEC. Dette kan forekomme når som helst under behandlingen. I sådanne tilfælde skal VASOTEC 2,5 mg omgående seponeres, og passende behandling og monitorering skal udføres, indtil der er fundet fuldstændig og vedvarende opløsning af tegn og symptomer. I tilfælde, hvor hævelse har været begrænset til ansigt og læber, er tilstanden generelt løst uden behandling, selvom antihistaminer har været nyttige til at lindre symptomer. Angioødem forbundet med larynxødem kan være fatalt. Hvis der er involvering af tungen, glottis eller strubehovedet, som sandsynligvis forårsager luftvejsobstruktion, bør passende behandling, f.eks. subkutan epinephrinopløsning 1:1000 (0,3 mL til 0,5 mL) og/eller nødvendige foranstaltninger for at sikre en fri luftvej, træffes omgående. stillet til rådighed (se BIVIRKNINGER ).
Patienter, der får samtidig administration af ACE-hæmmer og mTOR (pattedyrmål for rapamycin)-hæmmer (f.eks. temsirolimus, sirolimus, everolimus) eller en neprilysinhæmmer kan have øget risiko for angioødem (se FORHOLDSREGLER ).
Intestinalt angioødem
Intestinalt angioødem er blevet rapporteret hos patienter behandlet med ACE-hæmmere. Disse patienter fik mavesmerter (med eller uden kvalme eller opkastning); i nogle tilfælde var der ingen tidligere anamnese med ansigtsangioødem, og C-1-esteraseniveauerne var normale. Angioødemet blev diagnosticeret ved procedurer, herunder abdominal CT-scanning eller ultralyd, eller ved operation, og symptomerne forsvandt efter seponering af ACE-hæmmeren. Intestinalt angioødem bør inkluderes i differentialdiagnosen af patienter på ACE-hæmmere med mavesmerter.
Patienter med en anamnese med angioødem, der ikke er relateret til ACE-hæmmerbehandling, kan have øget risiko for angioødem, mens de får en ACE-hæmmer (se også INDIKATIONER OG BRUG og KONTRAINDIKATIONER ).
Anafylaktoide reaktioner under desensibilisering
To patienter, der undergik desensibiliserende behandling med hymenoptera-gift, mens de fik ACE-hæmmere, vedvarende livstruende anafylaktoide reaktioner. Hos de samme patienter blev disse reaktioner undgået, når ACE-hæmmere midlertidigt blev holdt tilbage, men de dukkede op igen ved utilsigtet genudsættelse.
Anafylaktoide reaktioner under membraneksponering
Anafylaktoide reaktioner er blevet rapporteret hos patienter, der er dialyseret med højfluxmembraner og samtidig behandlet med en ACE-hæmmer. Anafylaktoide reaktioner er også blevet rapporteret hos patienter, der gennemgår low-density lipoprotein-aferese med dextransulfatabsorption.
Hypotension
Overdreven hypotension er sjælden hos ukomplicerede hypertensive patienter, der behandles med VASOTEC 5 mg alene. Patienter med hjertesvigt, der får VASOTEC, har almindeligvis en vis reduktion i blodtrykket, især med den første dosis, men afbrydelse af behandlingen for fortsat symptomatisk hypotension er normalt ikke nødvendig, når doseringsinstruktionerne følges; Der skal udvises forsigtighed, når behandlingen påbegyndes (se DOSERING OG ADMINISTRATION ). Patienter med risiko for overdreven hypotension, nogle gange forbundet med oliguri og/eller progressiv azotæmi, og sjældent med akut nyresvigt og/eller død, omfatter patienter med følgende tilstande eller karakteristika: hjertesvigt, hyponatriæmi, højdosis diuretikabehandling, nylig intensiv diurese eller stigning i diuretikadosis, nyredialyse eller alvorlig volumen- og/eller saltdepletering af enhver ætiologi. Det kan være tilrådeligt at eliminere diuretikummet (undtagen hos patienter med hjertesvigt), reducere diuretikadosis eller øge saltindtaget forsigtigt før påbegyndelse af behandling med VASOTEC 10mg hos patienter med risiko for overdreven hypotension, som er i stand til at tolerere sådanne justeringer (se DRUGSINTERAKTIONER og BIVIRKNINGER ). Hos patienter med risiko for overdreven hypotension bør behandlingen påbegyndes under meget tæt medicinsk overvågning, og sådanne patienter bør følges tæt i de første to ugers behandling, og når som helst dosis af enalapril og/eller diuretikum øges. Lignende overvejelser kan gøre sig gældende for patienter med iskæmisk hjerte- eller cerebrovaskulær sygdom, hvor et for stort fald i blodtrykket kan resultere i et myokardieinfarkt eller cerebrovaskulær ulykke.
Hvis der opstår for kraftig hypotension, skal patienten placeres i liggende stilling og om nødvendigt modtage en intravenøs infusion af normalt saltvand. Et forbigående hypotensivt respons er ikke en kontraindikation for yderligere doser af VASOTEC 2,5 mg, som normalt kan gives uden besvær, når blodtrykket er stabiliseret. Hvis der udvikles symptomatisk hypotension, kan en dosisreduktion eller seponering af VASOTEC eller samtidig diuretikum være nødvendig.
Neutropeni/Agranulocytose
En anden angiotensinkonverterende enzymhæmmer, captopril, har vist sig at forårsage agranulocytose og knoglemarvsdepression, sjældent hos ukomplicerede patienter, men hyppigere hos patienter med nedsat nyrefunktion, især hvis de også har en kollagen karsygdom. Tilgængelige data fra kliniske forsøg med enalapril er utilstrækkelige til at vise, at enalapril ikke forårsager agranulocytose i tilsvarende hastigheder. Markedsføringserfaring har afsløret tilfælde af neutropeni eller agranulocytose, hvor en årsagssammenhæng med enalapril ikke kan udelukkes. Periodisk overvågning af antallet af hvide blodlegemer hos patienter med kollagen vaskulær sygdom og nyresygdom bør overvejes.
Leversvigt
sjældne tilfælde er ACE-hæmmere blevet forbundet med et syndrom, der starter med kolestatisk gulsot og udvikler sig til fulminant levernekrose og (nogle gange) død. Mekanismen for dette syndrom er ikke forstået. Patienter, der får ACE-hæmmere, og som udvikler gulsot eller markante forhøjelser af leverenzymer, bør seponere ACE-hæmmeren og modtage passende medicinsk opfølgning.
Føtal toksicitet
Brug af lægemidler, der virker på renin-angiotensin-systemet i andet og tredje trimester af graviditeten, reducerer føtal nyrefunktion og øger føtal og neonatal morbiditet og død. Resulterende oligohydramnios kan være forbundet med føtal lungehypoplasi og skeletdeformationer. Potentielle neonatale bivirkninger omfatter kraniehypoplasi, anuri, hypotension, nyresvigt og død. Når graviditet opdages, seponeres VASOTEC 10mg så hurtigt som muligt. Disse negative resultater er normalt forbundet med brugen af disse lægemidler i andet og tredje trimester af graviditeten. De fleste epidemiologiske undersøgelser, der undersøgte føtale abnormiteter efter eksponering for antihypertensiv brug i første trimester, har ikke skelnet lægemidler, der påvirker renin-angiotensin-systemet, fra andre antihypertensiva. Passende håndtering af maternel hypertension under graviditet er vigtig for at optimere resultaterne for både mor og foster.
det usædvanlige tilfælde, hvor der ikke er noget passende alternativ til behandling med lægemidler, der påvirker reninangiotensinsystemet for en bestemt patient, skal moderen informeres om den potentielle risiko for fosteret. Udfør serielle ultralydsundersøgelser for at vurdere det intra-amniotiske miljø. Hvis der observeres oligohydramnios, skal VASOTEC seponeres, medmindre det anses for at være livreddende for moderen. Fostertest kan være passende, baseret på graviditetsugen. Patienter og læger skal dog være opmærksomme på, at oligohydramnios muligvis ikke vises, før fosteret har pådraget sig irreversibel skade. Overvåg nøje spædbørn med historier om in utero eksponering for VASOTEC for hypotension, oliguri og hyperkaliæmi (se FORHOLDSREGLER , Pædiatrisk brug ).
Der blev ikke set teratogene virkninger af enalapril i undersøgelser af gravide rotter og kaniner. På basis af kropsoverfladen var de anvendte doser henholdsvis 57 gange og 12 gange den maksimalt anbefalede daglige dosis til mennesker (MRHDD).
FORHOLDSREGLER
Generel
Aortastenose/hypertrofisk kardiomyopati
Som med alle vasodilatorer bør enalapril gives med forsigtighed til patienter med obstruktion i udstrømningskanalen i venstre ventrikel.
Nedsat nyrefunktion
Som en konsekvens af hæmning af renin-angiotensin-aldosteron-systemet kan ændringer i nyrefunktionen forventes hos følsomme personer. Hos patienter med alvorligt hjertesvigt, hvis nyrefunktion kan afhænge af aktiviteten af renin-angiotensin-aldosteron-systemet, kan behandling med angiotensin-konverterende enzymhæmmere, inklusive VASOTEC, være forbundet med oliguri og/eller progressiv azotæmi og sjældent med akut nyresvigt og / eller død (se DRUGSINTERAKTIONER ).
I kliniske undersøgelser af hypertensive patienter med unilateral eller bilateral nyrearteriestenose blev stigninger i blodurinstofnitrogen og serumkreatinin observeret hos 20 procent af patienterne. Disse stigninger var næsten altid reversible ved seponering af enalapril og/eller diuretikabehandling. Hos sådanne patienter bør nyrefunktionen overvåges i løbet af de første par uger af behandlingen.
Nogle patienter med hypertension eller hjertesvigt uden tilsyneladende eksisterende vaskulær nyresygdom har udviklet stigninger i blodurinstof og serumkreatinin, sædvanligvis mindre og forbigående, især når VASOTEC er blevet givet samtidig med et diuretikum. Dette er mere tilbøjeligt til at forekomme hos patienter med allerede eksisterende nyreinsufficiens. Dosisreduktion og/eller seponering af diuretika og/eller VASOTEC 5 mg kan være påkrævet.
Evaluering af patienter med hypertension eller hjertesvigt bør altid omfatte vurdering af nyrefunktionen (se DOSERING OG ADMINISTRATION ).
Hyperkaliæmi
Forhøjet serumkalium (større end 5,7 mEq/L) blev observeret hos ca. en procent af hypertensive patienter i kliniske forsøg. I de fleste tilfælde var disse isolerede værdier, som forsvandt på trods af fortsat behandling. Hyperkaliæmi var en årsag til seponering af behandlingen hos 0,28 procent af hypertensive patienter. I kliniske forsøg med hjertesvigt blev hyperkaliæmi observeret hos 3,8 procent af patienterne, men var ikke en årsag til seponering.
Risikofaktorer for udvikling af hyperkalæmi omfatter nyreinsufficiens, diabetes mellitus og samtidig brug af kaliumbesparende diuretika, kaliumtilskud og/eller kaliumholdige salterstatninger, som bør anvendes med forsigtighed, hvis overhovedet, med VASOTEC (se DRUGSINTERAKTIONER ).
Hoste
Formodentlig på grund af hæmningen af nedbrydningen af endogent bradykinin, er vedvarende ikke-produktiv hoste blevet rapporteret med alle ACE-hæmmere, som altid forsvinder efter seponering af behandlingen. ACE-hæmmer-induceret hoste bør overvejes ved differentialdiagnosticering af hoste.
Kirurgi/Anæstesi
Hos patienter, der gennemgår større operationer eller under anæstesi med midler, der producerer hypotension, kan enalapril blokere angiotensin II-dannelse sekundært til kompensatorisk reninfrigivelse. Hvis hypotension opstår og anses for at skyldes denne mekanisme, kan den korrigeres ved volumenudvidelse.
Karcinogenese, mutagenese, svækkelse af fertilitet
Der var ingen tegn på en tumorigen effekt, når enalapril blev administreret i 106 uger til han- og hunrotter i doser op til 90 mg/kg/dag eller i 94 uger til han- og hunmus i doser på op til 90 og 180 mg/kg/ dag hhv. Disse doser er 26 gange (i rotter og hunmus) og 13 gange (i hanmus) den maksimale anbefalede daglige dosis til mennesker (MRHDD) sammenlignet på basis af kropsoverfladeareal.
Hverken enalaprilmaleat eller den aktive disyre var mutagen i Ames mikrobielle mutagentest med eller uden metabolisk aktivering. Enalapril var også negativ i følgende genotoksicitetsundersøgelser: rec-assay, revers mutationsassay med E. coli, søsterkromatidudveksling med dyrkede pattedyrsceller og mikronukleustesten med mus, såvel som i en in vivo cytogen undersøgelse med museknoglemarv .
Der var ingen negative virkninger på reproduktionsevnen hos han- og hunrotter behandlet med op til 90 mg/kg/dag af enalapril (26 gange MRHDD sammenlignet på basis af kropsoverfladeareal).
Graviditet
Ammende mødre
Enalapril og enalaprilat er blevet påvist i human modermælk. På grund af risikoen for alvorlige bivirkninger hos ammende spædbørn fra enalapril, bør der tages en beslutning om, hvorvidt amningen skal seponeres eller VASOTEC 2,5 mg skal seponeres under hensyntagen til lægemidlets betydning for moderen.
Pædiatrisk brug
Nyfødte med en historie med in utero eksponering for VASOTEC
Hvis der opstår oliguri eller hypotension, skal du rette opmærksomheden mod understøttelse af blodtryk og nyreperfusion. Udskiftningstransfusioner eller dialyse kan være påkrævet som et middel til at vende hypotension og/eller erstatte forstyrret nyrefunktion. Enalapril, som krydser placenta, er blevet fjernet fra neonatal cirkulation ved peritonealdialyse med en vis klinisk fordel, og kan teoretisk fjernes ved udvekslingstransfusion, selvom der ikke er erfaring med sidstnævnte procedure.
Antihypertensive virkninger af VASOTEC er blevet påvist hos hypertensive pædiatriske patienter i alderen 1 måned til 16 år. Brug af VASOTEC 5 mg i disse aldersgrupper understøttes af evidens fra tilstrækkelige og velkontrollerede undersøgelser af VASOTEC 2,5 mg hos pædiatriske og voksne patienter samt af publiceret litteratur hos pædiatriske patienter (se KLINISK FARMAKOLOGI , Klinisk farmakologi hos pædiatriske patienter og DOSERING OG ADMINISTRATION ).
VASOTEC anbefales ikke til nyfødte og pædiatriske patienter med glomerulær filtrationshastighed
OVERDOSIS
Begrænsede data er tilgængelige med hensyn til overdosering hos mennesker.
Enkelte orale doser af enalapril over 1.000 mg/kg og ≥ 1.775 mg/kg var forbundet med dødelighed hos henholdsvis mus og rotter.
Den mest sandsynlige manifestation af overdosering vil være hypotension, for hvilken den sædvanlige behandling vil være intravenøs infusion af normal saltvandsopløsning.
Enalaprilat kan fjernes fra det almindelige kredsløb ved hæmodialyse og er blevet fjernet fra neonatal kredsløb ved peritonealdialyse (se ADVARSLER , Anafylaktoide reaktioner under membraneksponering ).
KONTRAINDIKATIONER
VASOTEC 2,5 mg er kontraindiceret til patienter, der er overfølsomme over for dette produkt og til patienter med angioødem i anamnesen relateret til tidligere behandling med en angiotensinkonverterende enzymhæmmer og til patienter med arvelig eller idiopatisk angioødem.
Giv ikke aliskiren samtidig med VASOTEC til patienter med diabetes (se DRUGSINTERAKTIONER ).
VASOTEC 10 mg er kontraindiceret i kombination med en neprilysinhæmmer (f.eks. sacubitril). Giv ikke VASOTEC inden for 36 timer efter skift til eller fra sacubitril/valsartan, en neprilysinhæmmer (se ADVARSLER ).
KLINISK FARMAKOLOGI
Handlingsmekanisme
Enalapril hæmmer, efter hydrolyse til enalaprilat, angiotensin-konverterende enzym (ACE) hos mennesker og dyr. ACE er en peptidyldipeptidase, der katalyserer omdannelsen af angiotensin I til det vasokonstriktor-stof, angiotensin II. Angiotensin II stimulerer også aldosteronsekretionen fra binyrebarken. De gavnlige virkninger af enalapril ved hypertension og hjertesvigt synes primært at skyldes suppression af renin-angiotensin-aldosteron-systemet. Hæmning af ACE resulterer i nedsat plasmaangiotensin II, hvilket fører til nedsat vasopressoraktivitet og til nedsat aldosteronsekretion. Selvom sidstnævnte fald er lille, resulterer det i små stigninger af serumkalium. Hos hypertensive patienter behandlet med VASOTEC alene i op til 48 uger, blev der observeret gennemsnitlige stigninger i serumkalium på ca. 0,2 mEq/L. Hos patienter behandlet med VASOTEC 5 mg plus et thiaziddiuretikum var der stort set ingen ændring i serumkalium (se FORHOLDSREGLER ). Fjernelse af angiotensin II negativ feedback på reninsekretion fører til øget plasmareninaktivitet.
ACE er identisk med kininase, et enzym, der nedbryder bradykinin. Hvorvidt øgede niveauer af bradykinin, et potent vasodepressorpeptid, spiller en rolle i de terapeutiske virkninger af VASOTEC, mangler at blive belyst.
Mens mekanismen, hvorved VASOTEC 5 mg sænker blodtrykket, menes primært at være suppression af renin-angiotensin-aldosteron-systemet, er VASOTEC 10 mg antihypertensiv selv hos patienter med lav-renin-hypertension. Selvom VASOTEC var antihypertensiv i alle undersøgte racer, havde sorte hypertensive patienter (sædvanligvis en lav-renin hypertensiv population) et mindre gennemsnitligt respons på enalapril monoterapi end ikke-sorte patienter.
Farmakokinetik og metabolisme
Efter oral administration af VASOTEC optræder maksimale serumkoncentrationer af enalapril inden for ca. en time. Baseret på uringenvinding er omfanget af absorption af enalapril cirka 60 procent. Enalapril absorption påvirkes ikke af tilstedeværelsen af mad i mave-tarmkanalen. Efter absorption hydrolyseres enalapril til enalaprilat, som er en mere potent angiotensinkonverterende enzymhæmmer end enalapril; enalaprilat absorberes dårligt, når det administreres oralt. Maksimal serumkoncentration af enalaprilat forekommer tre til fire timer efter en oral dosis af enalaprilmaleat. Udskillelse af VASOTEC er primært renal. Cirka 94 procent af dosis genfindes i urinen og afføringen som enalaprilat eller enalapril. De vigtigste komponenter i urinen er enalaprilat, der tegner sig for omkring 40 procent af dosis, og intakt enalapril. Der er ingen tegn på metabolitter af enalapril, bortset fra enalaprilat.
Serumkoncentrationsprofilen af enalaprilat udviser en forlænget terminal fase, der tilsyneladende repræsenterer en lille del af den administrerede dosis, der er blevet bundet til ACE. Den bundne mængde stiger ikke med dosis, hvilket indikerer et mætteligt bindingssted. Den effektive halveringstid for akkumulering af enalaprilat efter flere doser af enalaprilmaleat er 11 timer. Disponeringen af enalapril og enalaprilat hos patienter med nyreinsufficiens er den samme som hos patienter med normal nyrefunktion, indtil den glomerulære filtrationshastighed er 30 ml/min eller mindre. Med glomerulær filtrationshastighed ≤ 30 ml/min. stiger top- og bundniveauer for enalaprilat, tiden til maksimal koncentration stiger og tiden til steady state kan være forsinket. Den effektive halveringstid for enalaprilat efter multiple doser af enalaprilmaleat forlænges ved dette niveau af nyreinsufficiens (se DOSERING OG ADMINISTRATION ). Enalaprilat kan dialyseres med en hastighed på 62 ml/min.
Undersøgelser af hunde viser, at enalapril krydser blod-hjerne-barrieren dårligt, hvis overhovedet; enalaprilat kommer ikke ind i hjernen. Flere doser af enalaprilmaleat hos rotter resulterer ikke i akkumulering i noget væv. Mælk fra diegivende rotter indeholder radioaktivitet efter administration af 14C-enalaprilmaleat. Radioaktivitet blev fundet at krydse placenta efter administration af mærket lægemiddel til gravide hamstere.
Farmakodynamik og kliniske effekter
Forhøjet blodtryk
Administration af VASOTEC til patienter med hypertension af sværhedsgrad, der spænder fra mild til svær, resulterer i en reduktion af både liggende og stående blodtryk, normalt uden ortostatisk komponent. Symptomatisk postural hypotension er derfor sjælden, selvom den kan forventes hos patienter med volumendepletering (se ADVARSLER ).
Hos de fleste undersøgte patienter, efter oral administration af en enkelt dosis enalapril, sås begyndelse af antihypertensiv aktivitet efter en time med maksimal reduktion af blodtrykket opnået med fire til seks timer.
Ved anbefalede doser er den antihypertensive virkning opretholdt i mindst 24 timer. Hos nogle patienter kan virkningen aftage mod slutningen af doseringsintervallet (se DOSERING OG ADMINISTRATION ).
Hos nogle patienter kan opnåelse af optimal blodtryksreduktion kræve flere ugers behandling.
De antihypertensive virkninger af VASOTEC er fortsat under langtidsbehandling. Pludselig seponering af VASOTEC 10 mg er ikke blevet forbundet med en hurtig stigning i blodtrykket.
hæmodynamiske undersøgelser af patienter med essentiel hypertension blev blodtryksreduktionen ledsaget af en reduktion i perifer arteriel modstand med en stigning i hjertevolumen og ringe eller ingen ændring i hjertefrekvensen. Efter administration af VASOTEC er der en stigning i renal blodgennemstrømning; glomerulær filtrationshastighed er normalt uændret. Virkningerne ser ud til at være ens hos patienter med renovaskulær hypertension.
Når det gives sammen med diuretika af thiazidtypen, er de blodtrykssænkende virkninger af VASOTEC 5 mg tilnærmelsesvis additive.
I et klinisk farmakologisk studie blev indomethacin eller sulindac administreret til hypertensive patienter, der fik VASOTEC. I denne undersøgelse var der ingen tegn på en sløvhed af den antihypertensive virkning af VASOTEC (se DRUGSINTERAKTIONER ).
Hjertefejl
forsøg med patienter behandlet med digitalis og diuretika resulterede behandling med enalapril i nedsat systemisk vaskulær modstand, blodtryk, pulmonært kapillært kiletryk og hjertestørrelse og øget hjertevolumen og træningstolerance. Hjertefrekvensen var uændret eller let reduceret, og den gennemsnitlige ejektionsfraktion var uændret eller øget. Der var en gavnlig effekt på sværhedsgraden af hjertesvigt målt ved New York Heart Association (NYHA) klassifikation og på symptomer på dyspnø og træthed. Hæmodynamiske virkninger blev observeret efter den første dosis og så ud til at blive opretholdt i ukontrollerede undersøgelser, der varede så længe som fire måneder. Effekter på træningstolerance, hjertestørrelse og sværhedsgrad og symptomer på hjertesvigt blev observeret i placebokontrollerede undersøgelser, der varede fra otte uger til over et år.
Hjertesvigt, dødelighedsprøver
et multicenter, placebokontrolleret klinisk forsøg blev 2.569 patienter med alle grader af symptomatisk hjertesvigt og ejektionsfraktion ≤ 35 procent randomiseret til placebo eller enalapril og fulgt i op til 55 måneder (SOLVD-behandling). Brug af enalapril var forbundet med en 11 procent reduktion i dødelighed af alle årsager og en 30 procent reduktion i hospitalsindlæggelse for hjertesvigt. Sygdomme, der udelukkede patienter fra optagelse i undersøgelsen, omfattede svær stabil angina (>2 anfald/dag), hæmodynamisk signifikant obstruktion af klap- eller udstrømningskanalen, nyresvigt (kreatinin >2,5 mg/dL), cerebrovaskulær sygdom (f.eks. signifikant carotisarteriesygdom) , fremskreden lungesygdom, maligniteter, aktiv myocarditis og constrictive pericarditis. Dødelighedsfordelen forbundet med enalapril ser ikke ud til at afhænge af, at digitalis er til stede.
Et andet multicenterforsøg brugte SOLVD-protokollen til undersøgelse af asymptomatiske eller minimalt symptomatiske patienter. SOLVD-Prevention-patienter, som havde venstre ventrikulær ejektionsfraktion ≤ 35 % og ingen historie med symptomatisk hjertesvigt, blev randomiseret til placebo (n=2117) eller enalapril (n=2111) og fulgt i op til 5 år. Størstedelen af patienterne i SOLVD-Prevention-studiet havde en historie med iskæmisk hjertesygdom. En historie med myokardieinfarkt var til stede hos 80 procent af patienterne, nuværende angina pectoris hos 34 procent og en historie med hypertension hos 37 procent. Der blev ikke påvist nogen statistisk signifikant dødelighedseffekt i denne population. Enalapril-behandlede forsøgspersoner havde 32 % færre første indlæggelser på grund af hjertesvigt og 32 % færre samlede hjertesvigtsindlæggelser. Sammenlignet med placebo udviklede 32 procent færre patienter, der fik enalapril, symptomer på åbenlyst hjertesvigt. Hospitalsindlæggelser af kardiovaskulære årsager blev også reduceret. Der var en ubetydelig reduktion i hospitalsindlæggelser uanset årsag i enalapril-behandlingsgruppen (hhv. for enalapril vs. placebo, 1166 vs. 1201 første indlæggelser, 2649 vs. 2840 samlede indlæggelser), selvom undersøgelsen ikke var drevet til at lede efter en sådan effekt.
SOLVD-forebyggelsesstudiet var ikke designet til at afgøre, om behandling af asymptomatiske patienter med lav ejektionsfraktion ville være bedre end tættere opfølgning og brug af enalapril med hensyn til forebyggelse af hospitalsindlæggelse ved det tidligste tegn på hjertesvigt. Men under betingelserne for opfølgning i SOLVD-forebyggende forsøg (hver 4. måned på undersøgelsesklinikken; personlig læge efter behov), havde 68 % af patienterne på placebo, som var indlagt på hospitalet for hjertesvigt, ingen tidligere registrerede symptomer, som ville have signalerede behandlingsstart.
SOLVD-forebyggende forsøg var heller ikke designet til at vise, om enalapril modificerede progressionen af underliggende hjertesygdom.
I et andet multicenter, placebokontrolleret forsøg (CONSENSUS) begrænset til patienter med NYHA klasse IV kongestiv hjerteinsufficiens og radiografisk tegn på kardiomegali, var brug af enalapril forbundet med forbedret overlevelse. Resultaterne er vist i følgende tabel.
både CONSENSUS- og SOLVD-Treatment-forsøg fik patienterne normalt også digitalis, diuretika eller begge dele.
Klinisk farmakologi hos pædiatriske patienter
Et farmakokinetisk studie med multiple doser blev udført med 40 hypertensive mandlige og kvindelige pædiatriske patienter i alderen 2 måneder til ≤ 16 år efter daglig oral administration af 0,07 til 0,14 mg/kg enalaprilmaleat. Ved steady state var den gennemsnitlige effektive halveringstid for akkumulering af enalaprilat 14 timer, og den gennemsnitlige uringenvinding af total enalapril og enalaprilat på 24 timer var 68 % af den administrerede dosis. Omdannelsen af enalapril til enalaprilat var i intervallet 63-76%. De overordnede resultater af denne undersøgelse indikerer, at enalaprils farmakokinetik hos hypertensive børn i alderen 2 måneder til ≤ 16 år er konsistente på tværs af de undersøgte aldersgrupper og i overensstemmelse med farmakokinetiske historiske data hos raske voksne.
et klinisk studie med 110 hypertensive pædiatriske patienter i alderen 6 til 16 år fik patienter, der vejede
I de ovennævnte pædiatriske undersøgelser blev enalaprilmaleat givet som tabletter af VASOTEC, og til de børn og spædbørn, som ikke var i stand til at sluge tabletter, eller som havde brug for en lavere dosis end tilgængelig i tabletform, blev enalapril administreret i en suspensionsformulering (se DOSERING OG ADMINISTRATION , Forberedelse af suspension ).
PATIENTOPLYSNINGER
Angioødem
Angioødem, herunder larynxødem, kan forekomme på ethvert tidspunkt under behandling med angiotensinkonverterende enzymhæmmere, inklusive enalapril. Patienterne skal rådes og fortælles om straks at rapportere tegn eller symptomer, der tyder på angioødem (hævelse af ansigt, ekstremiteter, øjne, læber, tunge, synke- eller vejrtrækningsbesvær) og ikke at tage mere medicin, før de har rådført sig med den ordinerende læge.
Hypotension
Patienter skal advares om at rapportere svimmelhed, især i løbet af de første par dage af behandlingen. Hvis der opstår en egentlig synkope, skal patienterne få besked på at seponere lægemidlet, indtil de har rådført sig med den ordinerende læge. Alle patienter skal advares om, at overdreven sved og dehydrering kan føre til et for stort blodtryksfald på grund af reduktion i væskevolumen. Andre årsager til volumenmangel såsom opkastning eller diarré kan også føre til et fald i blodtrykket; patienter bør rådes til at rådføre sig med lægen.
Hyperkaliæmi
Patienter bør informeres om ikke at bruge salterstatninger, der indeholder kalium, uden at have konsulteret deres læge.
Neutropeni
Patienterne skal informeres om straks at rapportere enhver indikation på infektion (f.eks. ondt i halsen, feber), som kan være tegn på neutropeni.
Graviditet
Kvindelige patienter i den fødedygtige alder bør informeres om konsekvenserne af eksponering for VASOTEC under graviditet. Diskuter behandlingsmuligheder med kvinder, der planlægger at blive gravide. Patienter bør bedes om at rapportere graviditeter til deres læger så hurtigt som muligt.
BEMÆRK: Som med mange andre lægemidler er visse råd til patienter, der behandles med enalapril, berettiget. Denne information er beregnet til at hjælpe med sikker og effektiv brug af denne medicin. Det er ikke en afsløring af alle mulige negative eller tilsigtede virkninger.
