Aceon 2mg, 4mg, 8mg Perindopril Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Aceon 4mg, og hvordan bruges det?
Aceon 8mg er en receptpligtig medicin, der bruges til at behandle symptomerne på forhøjet blodtryk (hypertension) og stabil koronararteriesygdom (CAD). Aceon kan bruges alene eller sammen med anden medicin.
Aceon tilhører en klasse af lægemidler kaldet ACE-hæmmere.
Det vides ikke, om Aceon er sikkert og effektivt til børn.
Hvad er de mulige bivirkninger af Aceon 4mg?
Aceon kan forårsage alvorlige bivirkninger, herunder:
- nældefeber,
- åndedrætsbesvær,
- hævelse af dit ansigt, læber, tunge eller hals,
- svaghed,
- langsom eller uregelmæssig hjerterytme,
- besvimelse,
- kvalme,
- opkastning,
- mistet appetiten,
- mavesmerter,
- gulfarvning af øjne eller hud (gulsot),
- mørk urin, og
- svær svimmelhed
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Aceon 2mg omfatter:
- svimmelhed,
- svimmelhed,
- træthed, og
- tør hoste
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Aceon. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
FØTALT TOKSICITET
- Når graviditet opdages, skal du seponere ACEON 4mg så hurtigt som muligt. ADVARSLER OG FORHOLDSREGLER
- Lægemidler, der virker direkte på renin-angiotensin-systemet, kan forårsage skade og død hos fosteret under udvikling. ADVARSLER OG FORHOLDSREGLER
BESKRIVELSE
ACEON® (perindopril erbumin) Tabletter indeholder tert-butylaminsaltet af perindopril, ethylesteren af en ikke-sulfhydrylangiotensin-konverterende enzym (ACE)-hæmmer. Perindopril erbumin er kemisk beskrevet som (2S,3DS,7DS)-1-[(S)-N-[(S)-1-carboxy-butyl]alanyl]hexahydro-2-indolincarboxylsyre, 1-ethylester, forbindelse med tert-butylamin (1:1). Dens molekylære formel er C19H32N2O5C4H11N. Dens strukturformel er:
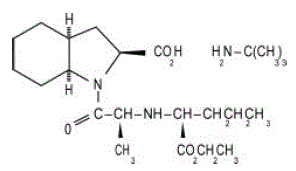
Perindopril erbumin er et hvidt, krystallinsk pulver med en molekylvægt på 368,47 (fri syre) eller 441,61 (saltform). Det er frit opløseligt i vand (60% w/w), alkohol og chloroform.
Perindopril er den frie syreform af perindopril erbumin, er et prodrug og metaboliseres in vivo ved hydrolyse af estergruppen til dannelse af perindoprilat, den biologisk aktive metabolit.
ACEON er tilgængelig i styrker på 2 mg, 4 mg og 8 mg til oral administration. Ud over perindopril erbumin indeholder hver tablet følgende inaktive ingredienser: kolloid silica (hydrofob), lactose, magnesiumstearat og mikrokrystallinsk cellulose. 4 mg og 8 mg tabletterne indeholder også jernoxid.
INDIKATIONER
Forhøjet blodtryk
ACEON er indiceret til behandling af patienter med essentiel hypertension. ACEON kan anvendes alene eller givet sammen med andre klasser af antihypertensiva, især thiaziddiuretika.
Stabil koronararteriesygdom
ACEON 8mg er indiceret til behandling af patienter med stabil koronararteriesygdom for at reducere risikoen for kardiovaskulær dødelighed eller ikke-fatalt myokardieinfarkt. ACEON kan bruges sammen med konventionel behandling til behandling af koronararteriesygdom, såsom blodpladehæmmende, antihypertensiv eller lipidsænkende behandling.
DOSERING OG ADMINISTRATION
Forhøjet blodtryk
Anvendelse til ukomplicerede hypertensive patienter
Hos patienter med essentiel hypertension er den anbefalede startdosis 4 mg én gang dagligt. Dosis kan titreres efter behov til maksimalt 16 mg pr. dag. Det sædvanlige vedligeholdelsesdosisområde er 4 mg til 8 mg administreret som en enkelt daglig dosis eller i to opdelte doser.
Anvendelse hos ældre patienter
Den anbefalede indledende daglige dosis af ACEON 4 mg til ældre er 4 mg dagligt, givet i en eller to opdelte doser. Erfaring med ACEON er begrænset hos ældre ved doser over 8 mg. Doser over 8 mg bør administreres med omhyggelig blodtryksovervågning og dosistitrering [se Brug i specifikke populationer ].
Brug sammen med diuretika
Hos patienter, som i øjeblikket er i behandling med et diuretikum, kan der opstå symptomatisk hypotension efter den indledende dosis af ACEON. Overvej at reducere dosis af diuretikum, før du starter ACEON [se DRUGSINTERAKTIONER ].
Stabil koronararteriesygdom
Hos patienter med stabil koronararteriesygdom bør ACEON 4 mg gives i en startdosis på 4 mg én gang dagligt i 2 uger, og derefter øges som tolereret til en vedligeholdelsesdosis på 8 mg én gang dagligt. Hos ældre patienter (over 70 år) bør ACEON gives som en dosis på 2 mg én gang dagligt i den første uge, efterfulgt af 4 mg én gang dagligt i den anden uge og 8 mg én gang dagligt til vedligeholdelsesdosis, hvis det tolereres.
Dosisjustering ved nedsat nyrefunktion og dialyse
Eliminationen af perindoprilat er nedsat hos patienter med nedsat nyrefunktion. ACEON anbefales ikke til patienter med kreatininclearance
HVORDAN LEVERET
Doseringsformer og styrker
Tabletterne er aflange med en rille på den ene side.
2 mg tablet er hvid og præget på siden uden delekærv med "ACN 2".
4 mg tablet er lyserød og præget på siden uden delekærv med "ACN 4".
8 mg tablet er laks og præget på siden uden delekærv med "ACN 8".
Opbevaring og håndtering
Tabletterne er aflange med en rille på den ene side.
Opbevares utilgængeligt for børn.
Opbevares ved kontrolleret stuetemperatur 20° til 25°C (68° til 77°F) [se USP]. Beskyt mod fugt.
For yderligere information, ring venligst til vores medicinske kommunikationsafdeling gratis på 888-985-7657.
Fremstillet af: Patheon Pharmaceuticals, Inc. Cincinnati, OH 45237 USA. Revideret: september 2017
BIVIRKNINGER
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan antallet af bivirkninger observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med frekvenserne i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Erfaring med kliniske forsøg
Følgende bivirkninger er diskuteret andetsteds i mærkningen:
- Anafylaktoide reaktioner, herunder angioødem [se ADVARSLER OG FORHOLDSREGLER ]
- Hypotension [se ADVARSLER OG FORHOLDSREGLER ]
- Neutropeni og agranulocytose [se ADVARSLER OG FORHOLDSREGLER ]
- Nedsat nyrefunktion [se ADVARSLER OG FORHOLDSREGLER ]
- Hyperkaliæmi [se ADVARSLER OG FORHOLDSREGLER ]
- Hoste [se ADVARSLER OG FORHOLDSREGLER ]
Forhøjet blodtryk
ACEON 4mg er blevet evalueret for sikkerhed hos ca. 3.400 patienter med hypertension i amerikanske og udenlandske kliniske forsøg. Dataene præsenteret her er baseret på resultater fra de 1.417 ACEON-behandlede patienter, som deltog i de amerikanske kliniske forsøg. Over 220 af disse patienter blev behandlet med ACEON® (perindopril erbumin) i mindst et år.
placebokontrollerede amerikanske kliniske forsøg var forekomsten af for tidlig seponering af behandlingen på grund af bivirkninger 6,5 % hos patienter behandlet med ACEON 2 mg og 6,7 % hos patienter behandlet med placebo. De mest almindelige årsager var hoste, hovedpine, asteni og svimmelhed.
Blandt 1.012 patienter i placebokontrollerede amerikanske forsøg var den samlede hyppighed af rapporterede bivirkninger ens hos patienter behandlet med ACEON og hos dem behandlet med placebo (ca. 75 % i hver gruppe). De eneste bivirkninger, hvis forekomst på ACEON 4 mg var mindst 2 % større end på placebo, var hoste (12 % vs. 4,5 %) og rygsmerter (5,8 % vs. 3,1 %).
Svimmelhed blev ikke rapporteret hyppigere i perindoprilgruppen (8,2 %) end i placebogruppen (8,5 %), men sandsynligheden steg med dosis, hvilket tyder på en årsagssammenhæng med perindopril.
Stabil koronararteriesygdom
Perindopril er blevet evalueret for sikkerhed i EUROPA, et dobbeltblindt, placebokontrolleret studie med 12.218 patienter med stabil koronararteriesygdom. Den overordnede seponeringsrate var omkring 22 % på lægemiddel og placebo. De mest almindelige medicinske årsager til seponering, som var hyppigere med perindopril end placebo, var hoste, lægemiddelintolerance og hypotension.
Postmarketing oplevelse
Frivillige indberetninger om bivirkninger hos patienter, der tager ACEON, som er modtaget siden markedsintroduktionen og er af ukendt årsagssammenhæng med ACEON 8mg omfatter: hjertestop, eosinofil pneumonitis, neutropeni/agranulocytose, pancytopeni, anæmi (herunder hæmolytisk og aplastisk), trombocytisk, trombocytisk nyresvigt, nefritis, leversvigt, gulsot (hepatocellulær eller kolestatisk), symptomatisk hyponatriæmi, bulløs pemfigoid, pemphigus, akut pancreatitis, fald, psoriasis, eksfoliativ dermatitis og et syndrom, der kan omfatte: arthralgi/arthritis, sekulitis, myveritis, vaskulitis, , udslæt eller andre dermatologiske manifestationer, et positivt antinukleært antistof (ANA), leukocytose, eosinofili eller en forhøjet erytrocytsedimentationshastighed (ESR).
Resultater af kliniske laboratorietest
Hæmatologi
Små fald i hæmoglobin og hæmatokrit forekommer hyppigt hos hypertensive patienter behandlet med ACEON 8mg, men er sjældent af klinisk betydning. I kontrollerede kliniske forsøg blev ingen patient seponeret fra behandling på grund af udvikling af anæmi. Leukopeni (herunder neutropeni) blev observeret hos 0,1 % af patienterne i amerikanske kliniske forsøg [se ADVARSLER OG FORHOLDSREGLER ].
Leverfunktionstest
Forhøjelser i ALAT (1,6 % ACEON versus 0,9 % placebo) og ASAT (0,5 % ACEON 2 mg versus 0,4 % placebo) er blevet observeret i placebokontrollerede kliniske forsøg. Forhøjelserne var generelt milde og forbigående og forsvandt efter seponering af behandlingen.
DRUGSINTERAKTIONER
Diuretika
Patienter på diuretika, og især dem, der er startet for nylig, kan lejlighedsvis opleve en for kraftig reduktion af blodtrykket efter påbegyndelse af ACEON-behandling. Muligheden for hypotensive virkninger kan minimeres ved enten at nedsætte dosis af eller seponering af diuretika eller ved at øge saltindtaget før påbegyndelse af behandling med perindopril. Hvis diuretikabehandlingen ikke kan ændres, skal du sørge for tæt medicinsk overvågning med den første dosis ACEON i mindst to timer, og indtil blodtrykket har stabiliseret sig i endnu en time [se ADVARSLER OG FORHOLDSREGLER ].
Hastigheden og omfanget af perindoprils absorption og elimination påvirkes ikke af samtidige diuretika. Biotilgængeligheden af perindoprilat blev dog reduceret af diuretika, og dette var forbundet med et fald i plasma ACE-hæmning.
Kaliumtilskud og kaliumbesparende diuretika
ACEON 8mg kan øge serumkalium på grund af dets potentiale til at reducere aldosteronproduktionen. Brug af kaliumbesparende diuretika (spironolacton, amilorid, triamteren og andre), kaliumtilskud eller andre lægemidler, der er i stand til at øge serumkalium (indomethacin, heparin, cyclosporin og andre) kan øge risikoen for hyperkaliæmi. Hvis samtidig brug af sådanne midler er indiceret, skal patientens serumkalium derfor overvåges ofte.
Lithium
Øget serumlithium og symptomer på lithiumtoksicitet er blevet rapporteret hos patienter, der samtidig får lithium- og ACE-hæmmerbehandling. Hyppig overvågning af serumlithiumkoncentrationen anbefales. Brug af et diuretikum kan yderligere øge risikoen for lithiumtoksicitet.
Guld
Nitritoidreaktioner (symptomer omfatter rødmen i ansigtet, kvalme, opkastning og hypotension) er sjældent blevet rapporteret hos patienter i behandling med injicerbart guld (natriumaurothiomalat) og samtidig behandling med ACE-hæmmere inklusive ACEON.
Digoxin
Et kontrolleret farmakokinetisk studie har ikke vist nogen effekt på plasmadigoxinkoncentrationer, når det administreres sammen med ACEON, men en effekt af digoxin på plasmakoncentrationen af perindopril/perindoprilat er ikke blevet udelukket.
Gentamicin
Dyredata har antydet muligheden for interaktion mellem perindopril og gentamicin. Dette er dog ikke blevet undersøgt i humane undersøgelser.
Ikke-steroide antiinflammatoriske midler, herunder selektive cyclooxygenase-2-hæmmere (COX-2-hæmmere)
Hos ældre patienter, volumendepleterede (inklusive dem i diuretikabehandling) eller med kompromitteret nyrefunktion, kan samtidig administration af NSAID'er, inklusive selektive COX-2-hæmmere, med ACE-hæmmere, inklusive perindopril, resultere i forringelse af nyrefunktionen , herunder eventuelt akut nyresvigt. Disse virkninger er normalt reversible. Overvåg nyrefunktionen periodisk hos patienter, der får perindopril- og NSAID-behandling.
Den antihypertensive virkning af ACE-hæmmere, inklusive perindopril, kan svækkes af NSAID'er, herunder selektive COX-2-hæmmere.
Dobbelt blokade af Renin-Angiotensin System (RAS)
Dobbelt blokade af RAS med angiotensinreceptorblokkere, ACE-hæmmere eller aliskiren er forbundet med øget risiko for hypotension, hyperkaliæmi og ændringer i nyrefunktionen (inklusive akut nyresvigt) sammenlignet med monoterapi. De fleste patienter, der får kombinationen af to RAS-hæmmere, opnår ingen yderligere fordele sammenlignet med monoterapi. Undgå generelt kombineret brug af RAS-hæmmere. Overvåg nøje blodtryk, nyrefunktion og elektrolytter hos patienter på ACEON 2mg og andre midler, der påvirker RAS.
Giv ikke aliskiren samtidig med ACEON 8mg til patienter med diabetes. Undgå brug af aliskiren med ACEON 2mg til patienter med nedsat nyrefunktion (GFR
mTOR-hæmmere
Patienter, der samtidig tager behandling med mTOR-hæmmere (pattedyrmål for rapamycin) kan have øget risiko for angioødem [se ADVARSLER OG FORHOLDSREGLER ].
Neprilysin-hæmmer
Patienter, der samtidig tager neprilysinhæmmere, kan have øget risiko for angioødem. [se ADVARSLER OG FORHOLDSREGLER ]
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Anafylaktoide og muligvis relaterede reaktioner
Formodentlig fordi angiotensin-konverterende enzymhæmmere påvirker metabolismen af eicosanoider og polypeptider, herunder endogent bradykinin, kan patienter, der får ACE-hæmmere (inklusive ACEON), blive udsat for en række uønskede hændelser, nogle af dem alvorlige. Sorte patienter, der får ACE-hæmmere, har en højere forekomst af angioødem sammenlignet med ikke-sorte.
Hoved og hals angioødem
Angioødem i ansigtet, ekstremiteterne, læberne, tungen, glottis eller strubehovedet er blevet rapporteret hos patienter behandlet med ACE-hæmmere, inklusive ACEON (0,1 % af patienterne behandlet med ACEON i amerikanske kliniske forsøg). Angioødem forbundet med involvering af tungen, glottis eller larynx kan være dødelig. I sådanne tilfælde skal behandlingen med ACEON straks afbrydes og observeres, indtil hævelsen forsvinder. Når involvering af tungen, glottis eller strubehovedet ser ud til at forårsage luftvejsobstruktion, indgiv passende behandling, såsom subkutan epinephrinopløsning 1:1000 (0,3 til 0,5 ml), omgående.
Patienter, der samtidig tager behandling med mTOR-hæmmere (f.eks. temsirolimus) eller en neprilysin-hæmmer, kan have øget risiko for angioødem [se DRUGSINTERAKTIONER ].
Intestinalt angioødem
Intestinalt angioødem er blevet rapporteret hos patienter behandlet med ACE-hæmmere. Disse patienter fik mavesmerter (med eller uden kvalme eller opkastning); i nogle tilfælde var der ingen tidligere anamnese med ansigtsangioødem, og C-1-esteraseniveauerne var normale. Angioødemet blev diagnosticeret ved procedurer, herunder abdominal CT-scanning eller ultralyd, eller ved operation, og symptomerne forsvandt efter seponering af ACE-hæmmeren. Intestinalt angioødem bør inkluderes i differentialdiagnosen af patienter på ACE-hæmmere med mavesmerter.
Hypotension
ACEON 4mg kan forårsage symptomatisk hypotension. ACEON er blevet forbundet med hypotension hos 0,3 % af ukomplicerede hypertensive patienter i amerikanske placebokontrollerede forsøg. Symptomer relateret til ortostatisk hypotension blev rapporteret hos yderligere 0,8 % af patienterne.
Symptomatisk hypotension er mest sandsynligt, at der opstår hos patienter, der har været volumen- eller saltdepleterede som følge af langvarig diuretikabehandling, saltrestriktion i kosten, dialyse, diarré eller opkastning [se DOSERING OG ADMINISTRATION ].
ACE-hæmmere kan forårsage for høj hypotension og kan være forbundet med oliguri eller azotæmi og sjældent med akut nyresvigt og død. Hos patienter med iskæmisk hjertesygdom eller cerebrovaskulær sygdom kan et for stort blodtryksfald resultere i et myokardieinfarkt eller en cerebrovaskulær ulykke.
Hos patienter med risiko for overdreven hypotension bør ACEON-behandling påbegyndes under meget tæt medicinsk overvågning. Patienterne bør følges nøje i de første to ugers behandling og hver gang dosis af ACEON 2 mg og/eller diuretikum øges.
Hvis der opstår for kraftig hypotension, skal patienten straks placeres i liggende stilling og om nødvendigt behandles med en intravenøs infusion af fysiologisk saltvand. ACEON 4 mg-behandling kan normalt fortsættes efter genopretning af volumen og blodtryk.

Neutropeni/Agranulocytose
ACE-hæmmere er blevet forbundet med agranulocytose og knoglemarvsdepression, hyppigst hos patienter med nedsat nyrefunktion, især patienter med en kollagen vaskulær sygdom såsom systemisk lupus erythematosus eller sklerodermi.
Føtal toksicitet
Graviditetskategori D
Brug af lægemidler, der virker på renin-angiotensin-systemet i andet og tredje trimester af graviditeten, reducerer føtal nyrefunktion og øger føtal og neonatal morbiditet og død. Resulterende oligohydramnios kan være forbundet med føtal lungehypoplasi og skeletdeformationer. Potentielle neonatale bivirkninger omfatter kraniehypoplasi, anuri, hypotension, nyresvigt og død. Når graviditet opdages, skal du seponere ACEON 4mg så hurtigt som muligt [se Brug i specifikke populationer ].
Nedsat nyrefunktion
Som en konsekvens af hæmning af renin-angiotensin-aldosteron-systemet kan ændringer i nyrefunktionen forventes hos følsomme personer. Nyrefunktionen bør overvåges periodisk hos patienter, der får ACEON [se DOSERING OG ADMINISTRATION ], [se DRUGSINTERAKTIONER ].
Hos patienter med svær kongestiv hjerteinsufficiens, hvor nyrefunktionen kan afhænge af aktiviteten af renin-angiotensinaldosteronsystemet, kan behandling med ACE-hæmmere, inklusive ACEON, være forbundet med oliguri, progressiv azotæmi og i sjældne tilfælde akut nyresvigt og død.
Hos hypertensive patienter med unilateral eller bilateral nyrearteriestenose kan der forekomme stigninger i blodurinstofnitrogen og serumkreatinin; normalt reversibel ved seponering af ACE-hæmmeren. Hos sådanne patienter bør nyrefunktionen overvåges i løbet af de første par uger af behandlingen.
Nogle ACEON-behandlede patienter har udviklet mindre og forbigående stigninger i blodets urinstofnitrogen og serumkreatinin, især hos dem, der samtidig behandles med et diuretikum.
Hyperkaliæmi
Forhøjelser af serumkalium er blevet observeret hos nogle patienter behandlet med ACE-hæmmere, inklusive ACEON. De fleste tilfælde var isolerede enkeltværdier, der ikke forekom klinisk relevante og sjældent var årsag til tilbagetrækning. Risikofaktorer for udvikling af hyperkaliæmi omfatter nyreinsufficiens, diabetes mellitus og samtidig brug af midler såsom kaliumbesparende diuretika, kaliumtilskud og/eller kaliumholdige salterstatninger [se DRUGSINTERAKTIONER ].
Serumkalium bør monitoreres periodisk hos patienter, der får ACEON.
Hoste
Formodentlig på grund af hæmningen af nedbrydningen af endogent bradykinin, er vedvarende ikke-produktiv hoste blevet rapporteret med alle ACE-hæmmere, som generelt forsvinder efter seponering af behandlingen. Overvej ACE-hæmmer-induceret hoste i differentialdiagnosen af hoste.
Leversvigt
sjældne tilfælde er ACE-hæmmere blevet forbundet med et syndrom, der starter med kolestatisk gulsot og udvikler sig til fulminant levernekrose og nogle gange død. Mekanismen for dette syndrom er ikke forstået. Patienter, der får ACE-hæmmere, og som udvikler gulsot eller markante forhøjelser af leverenzymer, bør seponere ACE-hæmmeren og modtage passende medicinsk opfølgning.
Kirurgi/Anæstesi
Hos patienter, der gennemgår kirurgi eller under anæstesi med midler, der producerer hypotension, kan ACEON blokere angiotensin II-dannelse, som ellers ville forekomme sekundært til kompensatorisk reninfrigivelse. Hypotension, der kan tilskrives denne mekanisme, kan korrigeres ved volumenudvidelse.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Kræftfremkaldende egenskaber
Der blev ikke observeret tegn på kræftfremkaldende virkning i studier med rotter og mus, når perindopril blev administreret i doser op til 20 gange (mg/kg) eller 2 til 4 gange (mg/m2) de maksimale foreslåede kliniske doser (16 mg/dag) for 104 uger.
Mutagenese
Der blev ikke påvist noget genotoksisk potentiale for ACEON, perindoprilat og andre metabolitter i forskellige in vitro og in vivo undersøgelser, herunder Ames testen, Saccharomyces cerevisiae D4 testen, dyrkede humane lymfocytter, TK ± muse lymfom assay, mus og rotte mikronucleus test og kinesisk hamster knoglemarvsanalyse.
Forringelse af fertilitet
Der var ingen betydningsfuld effekt på forplantningsevnen eller fertiliteten hos rotter givet op til 30 gange (mg/kg) eller 6 gange (mg/m2) den foreslåede maksimale kliniske dosis af ACEON 2 mg i perioden med spermatogenese hos hanner eller oogenese og drægtighed hos hunner.
Brug i specifikke populationer
Graviditet
Graviditetskategori D [se KASSE ADVARSEL og ADVARSLER OG FORHOLDSREGLER ].
Brug af lægemidler, der virker på renin-angiotensin-systemet i andet og tredje trimester af graviditeten, reducerer føtal nyrefunktion og øger føtal og neonatal morbiditet og død. Resulterende oligohydramnios kan være forbundet med føtal lungehypoplasi og skeletdeformationer. Potentielle neonatale bivirkninger omfatter kraniehypoplasi, anuri, hypotension, nyresvigt og død. Når graviditet opdages, skal du seponere ACEON så hurtigt som muligt. Disse negative resultater er normalt forbundet med brugen af disse lægemidler i andet og tredje trimester af graviditeten. De fleste epidemiologiske undersøgelser, der undersøgte føtale abnormiteter efter eksponering for antihypertensiv brug i første trimester, har ikke skelnet lægemidler, der påvirker renin-angiotensin-systemet, fra andre antihypertensiva.
Passende håndtering af maternel hypertension under graviditet er vigtig for at optimere resultaterne for både mor og foster.
det usædvanlige tilfælde, hvor der ikke er noget passende alternativ til behandling med lægemidler, der påvirker renin-angiotensin-systemet for en bestemt patient, skal du informere moderen om den potentielle risiko for fosteret. Udfør serielle ultralydsundersøgelser for at vurdere det intra-amniotiske miljø. Hvis oligohydramnios observeres, skal du seponere ACEON 2mg, medmindre det anses for at være livreddende for moderen. Fostertest kan være passende, baseret på graviditetsugen. Patienter og læger skal dog være opmærksomme på, at oligohydramnios muligvis ikke vises, før fosteret har pådraget sig irreversibel skade. Overvåg nøje spædbørn med historier om in utero eksponering for ACEON for hypotension, oliguri og hyperkaliæmi [se Pædiatrisk brug ].
Radioaktivitet var påviselig hos fostre efter administration af 14C-perindopril til gravide rotter.
Ammende mødre
Mælk fra diegivende rotter indeholdt radioaktivitet efter administration af 14C-perindopril. Det vides ikke, om perindopril udskilles i modermælk. Da mange lægemidler udskilles i modermælk, bør der udvises forsigtighed, når ACEON gives til ammende mødre.
Pædiatrisk brug
Nyfødte med en historie om i utero eksponering for ACEON
Hvis der opstår oliguri eller hypotension, skal du rette opmærksomheden mod understøttelse af blodtryk og nyreperfusion. Udskiftningstransfusioner eller dialyse kan være påkrævet som et middel til at vende hypotension og/eller erstatte forstyrret nyrefunktion. Perindopril, som krydser placenta, kan teoretisk fjernes fra det neonatale kredsløb på denne måde, men begrænset erfaring har ikke vist, at en sådan fjernelse er central i behandlingen af disse spædbørn.
Sikkerhed og effektivitet af ACEON 8mg hos pædiatriske patienter er ikke blevet fastslået.
Geriatrisk brug
Den gennemsnitlige blodtrykseffekt af perindopril var noget mindre hos patienter over 60 end hos yngre patienter, selvom forskellen ikke var signifikant. Plasmakoncentrationer af både perindopril og perindoprilat var øget hos ældre patienter sammenlignet med koncentrationer hos yngre patienter. Ingen bivirkninger var tydeligt øget hos ældre patienter med undtagelse af svimmelhed og muligvis udslæt.
Start med en lav dosis og titrér langsomt efter behov. Overvåg for svimmelhed på grund af risiko for fald.
Erfaring med ACEON 8 mg til ældre patienter i daglige doser over 8 mg er begrænset.
Nedsat nyrefunktion
Dosisjustering kan være nødvendig hos patienter med nedsat nyrefunktion [se DOSERING OG ADMINISTRATION og KLINISK FARMAKOLOGI ].
Nedsat leverfunktion
Biotilgængeligheden af perindoprilat er øget hos patienter med nedsat leverfunktion [se KLINISK FARMAKOLOGI ].
OVERDOSIS
Hos dyr var doser af perindopril op til 2.500 mg/kg hos mus, 3.000 mg/kg hos rotter og 1.600 mg/kg hos hunde ikke-dødelige. Tidligere erfaringer var sparsomme, men antydede, at overdosering med andre ACE-hæmmere også var ret godt tolereret af mennesker. Den mest sandsynlige manifestation er hypotension, og behandlingen bør være symptomatisk og støttende. Behandling med ACE-hæmmeren bør seponeres, og patienten bør observeres. Dehydrering, elektrolytforstyrrelser og hypotension bør behandles efter etablerede procedurer.
Blandt de rapporterede tilfælde af overdosering af perindopril krævede patienter, som var kendt for at have indtaget en dosis på 80 mg til 120 mg, assisteret ventilation og cirkulationsstøtte. En yderligere patient udviklede hypotermi, cirkulationsstop og døde efter indtagelse af op til 180 mg perindopril. Indgrebet for overdosering af perindopril kan kræve kraftig støtte.
Laboratoriebestemmelser af serumniveauer af perindopril og dets metabolitter er ikke almindeligt tilgængelige, og sådanne bestemmelser har under alle omstændigheder ingen etableret rolle i behandlingen af overdosering af perindopril.
Der er ingen tilgængelige data, der tyder på fysiologiske manøvrer (f.eks. manøvrer til at ændre urinens pH), som kan fremskynde eliminering af perindopril og dets metabolitter. Perindopril kan fjernes ved hæmodialyse med en clearance på 52 ml/min for perindopril og 67 ml/min for perindoprilat.
Angiotensin II kunne formentlig tjene som en specifik antagonist-modgift ved afvikling af perindopril-overdosis, men angiotensin II er stort set ikke tilgængelig uden for spredte forskningsfaciliteter. Fordi den hypotensive virkning af perindopril opnås gennem vasodilatation og effektiv hypovolæmi, er det rimeligt at behandle overdosis af perindopril ved infusion af normal saltvandsopløsning.
KONTRAINDIKATIONER
ACEON® (perindopril erbumin) er kontraindiceret til patienter, der vides at være overfølsomme (inklusive angioødem) over for dette produkt eller over for enhver anden ACE-hæmmer. ACEON 4mg er også kontraindiceret til patienter med arvelig eller idiopatisk angioødem.
Giv ikke aliskiren samtidig med ACEON til patienter med diabetes. [se DRUGSINTERAKTIONER ]
ACEON er kontraindiceret i kombination med neprilysinhæmmer (f.eks. sacubitril). Indgiv ikke ACEON 8mg inden for 36 timer efter skift til eller fra sacubitril/valsartan, en neprilysinhæmmer [se ADVARSLER OG FORHOLDSREGLER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
ACEON® (perindopril erbumin) er et pro-lægemiddel til perindoprilat, som hæmmer ACE hos mennesker og dyr. Den mekanisme, hvorigennem perindoprilat sænker blodtrykket, menes primært at være hæmning af ACE-aktivitet. ACE er en peptidyldipeptidase, der katalyserer omdannelsen af det inaktive decapeptid, angiotensin I, til vasokonstriktoren, angiotensin II. Angiotensin II er en potent perifer vasokonstriktor, som stimulerer aldosteronsekretion fra binyrebarken og giver negativ feedback på renin-sekretion. Hæmning af ACE resulterer i nedsat plasmaangiotensin II, hvilket fører til nedsat vasokonstriktion, øget plasmareninaktivitet og nedsat aldosteronsekretion. Sidstnævnte resulterer i diurese og natriurese og kan være forbundet med en lille stigning i serumkalium.
ACE er identisk med kininase II, et enzym, der nedbryder bradykinin. Hvorvidt øgede niveauer af bradykinin, et potent vasodepressorpeptid, spiller en rolle i de terapeutiske virkninger af ACEON 4mg, mangler at blive belyst.
Mens den vigtigste mekanisme for perindopril til blodtryksreduktion menes at være gennem renin-angiotensinaldosteron-systemet, har ACE-hæmmere en vis effekt selv ved tilsyneladende lav-renin-hypertension. Perindopril er blevet undersøgt hos relativt få sorte patienter, sædvanligvis en lav-renin-population, og den gennemsnitlige respons af diastolisk blodtryk på perindopril var omkring halvdelen af responsen set hos ikke-sorte patienter, et fund i overensstemmelse med tidligere erfaringer med andre ACE-hæmmere.
Farmakodynamik
Efter administration af perindopril hæmmes ACE på en dosis- og blodkoncentrationsrelateret måde, med den maksimale hæmning på 80 til 90 % opnået ved 8 mg ved i 10 til 12 timer. 24 timers ACE-hæmning er omkring 60 % efter disse doser. Graden af ACE-hæmning opnået med en given dosis ser ud til at aftage over tid (ID50 stiger). Pressorresponset på en angiotensin I-infusion reduceres af perindopril, men denne effekt er ikke så vedvarende som virkningen på ACE; der er ca. 35 % hæmning 24 timer efter en dosis på 12 mg.
Farmakokinetik
Absorption
Oral administration af ACEON resulterer i maksimale plasmakoncentrationer, der forekommer efter ca. 1 time. Den absolutte orale biotilgængelighed af perindopril er omkring 75 %. Efter absorption hydrolyseres ca. 30 til 50 % af systemisk tilgængeligt perindopril til dets aktive metabolit, perindoprilat, som har en gennemsnitlig biotilgængelighed på ca. 25 %. Maksimal plasmakoncentration af perindoprilat opnås 3 til 7 timer efter administration af perindopril. Oral administration af ACEON 8mg sammen med mad sænker ikke hastigheden eller omfanget af perindopril-absorption signifikant i forhold til fastende tilstand. Imidlertid er omfanget af biotransformation af perindopril til den aktive metabolit, perindoprilat, reduceret med ca. 43 %, hvilket resulterer i en reduktion i plasma ACE-hæmningskurven på ca. 20 %, sandsynligvis klinisk ubetydelig. I kliniske forsøg blev perindopril generelt administreret i en ikke-fastende tilstand.
Med 4 mg, 8 mg og 16 mg doser af ACEON, øges Cmax og AUC for perindopril og perindoprilat på en dosisproportional måde efter både enkelt oral dosering og ved steady state under et regime med flere doser én gang dagligt.
Fordeling
Ca. 60 % af cirkulerende perindopril er bundet til plasmaproteiner, og kun 10 til 20 % af perindoprilat er bundet. Derfor forventes lægemiddelinteraktioner medieret gennem virkninger på proteinbinding ikke.
Metabolisme og eliminering
Efter oral administration udviser perindopril multicompartment farmakokinetik, herunder et dybt vævsrum (ACE-bindingssteder). Den gennemsnitlige halveringstid for perindopril forbundet med det meste af dets eliminering er ca. 0,8 til 1 time.
Perindopril metaboliseres i vid udstrækning efter oral administration, hvor kun 4 til 12 % af dosis genfindes uændret i urinen. Seks metabolitter som følge af hydrolyse, glucuronidering og ringslutning via dehydrering er blevet identificeret. Disse omfatter den aktive ACE-hæmmer, perindoprilat (hydrolyseret perindopril), perindopril og perindoprilat glucuronider, dehydreret perindopril og diastereoisomererne af dehydreret perindoprilat. Hos mennesker synes hepatisk esterase at være ansvarlig for hydrolysen af perindopril.
Den aktive metabolit, perindoprilat, udviser også multikompartment farmakokinetik efter oral administration af ACEON. Dannelsen af perindoprilat sker gradvist med maksimale plasmakoncentrationer mellem 3 og 7 timer. Det efterfølgende fald i plasmakoncentrationen viser en tilsyneladende gennemsnitlig halveringstid på 3 til 10 timer for størstedelen af eliminationen, med en forlænget terminal eliminationshalveringstid på 30 til 120 timer som følge af langsom dissociation af perindoprilat fra plasma/væv ACE-binding websteder. Ved gentagen oral dosering én gang dagligt med perindopril akkumuleres perindoprilat ca. 1,5 til 2 gange og opnår steady state plasmaniveauer i løbet af 3 til 6 dage. Clearance af perindoprilat og dets metabolitter er næsten udelukkende renal.
Ældre
Plasmakoncentrationer af både perindopril og perindoprilat hos ældre patienter (over 70 år) er cirka det dobbelte af dem, der er observeret hos yngre patienter, hvilket afspejler både øget omdannelse af perindopril til perindoprilat og nedsat renal udskillelse af perindoprilat [se DOSERING OG ADMINISTRATION og Brug i specifikke populationer ].
Hjertefejl
Perindoprilat-clearance er reduceret hos patienter med kongestiv hjertesvigt, hvilket resulterer i et 40 % højere dosisinterval AUC.
Nedsat nyrefunktion
Med perindopril doser på 2 mg til 4 mg øges perindoprilat AUC med faldende nyrefunktion. Ved kreatininclearance på 30 til 80 ml/min er AUC omkring det dobbelte af det ved 100 ml/min. Når kreatininclearance falder til under 30 ml/min, øges AUC mere markant.
Hos et begrænset antal undersøgte patienter varierede perindopril-clearance ved dialyse fra ca. 40 til 80 ml/min. Perindoprilat-clearance ved dialyse varierede fra ca. 40 til 90 ml/min [se DOSERING OG ADMINISTRATION ].
Nedsat leverfunktion
Biotilgængeligheden af perindoprilat er øget hos patienter med nedsat leverfunktion. Plasmakoncentrationer af perindoprilat hos patienter med nedsat leverfunktion var omkring 50 % højere end dem, der blev observeret hos raske forsøgspersoner eller hypertensive patienter med normal leverfunktion.
Kliniske Studier
Forhøjet blodtryk
placebokontrollerede undersøgelser af perindopril monoterapi (2 mg til 16 mg én gang dagligt) hos patienter med et gennemsnitligt blodtryk på ca. 150/100 mm Hg havde 2 mg ringe effekt, men doser på 4 mg til 16 mg sænkede blodtrykket. Doserne på 8 mg og 16 mg kunne ikke skelnes, og begge havde en større effekt end dosis på 4 mg. I disse undersøgelser gav doser på 8 mg og 16 mg dagligt liggende, lave blodtryksreduktioner på 9 til 15/5 til 6 mm Hg. Når dosering én gang dagligt og to gange daglig dosering blev sammenlignet, var doseringsregimet to gange dagligt generelt lidt bedre, men med ikke mere end ca. 0,5 mm Hg til 1 mm Hg. Efter 2 mg til 16 mg doser af perindopril var de laveste gennemsnitlige systoliske og diastoliske blodtrykseffekter omkring 75 til 100 % af de maksimale effekter.
Perindoprils virkning på blodtrykket var ens, når den blev givet alene eller på baggrund af 25 mg hydrochlorthiazid. Generelt indtrådte virkningen af perindopril omgående, med virkningerne en anelse øget over flere uger.
Formelle interaktionsundersøgelser af ACEON® (perindopril erbumin) er ikke blevet udført med andre antihypertensiva end thiazider. Begrænset erfaring med kontrollerede og ukontrollerede forsøg med samtidig administration af ACEON 2mg med en calciumkanalblokker, et loop-diuretikum eller tripelbehandling (betablokker, vasodilator og et diuretikum), tyder ikke på nogen uventede interaktioner. Generelt har ACE-hæmmere mindre end additive virkninger, når de gives sammen med beta-adrenerge blokkere, formentlig fordi begge virker delvist gennem renin-angiotensin-systemet.
I ukontrollerede undersøgelser af patienter med insulinafhængig diabetes syntes perindopril ikke at påvirke den glykæmiske kontrol. Ved langtidsbrug blev der ikke set nogen effekt på proteinudskillelsen i urinen hos disse patienter.
Effektiviteten af ACEON 4mg var ikke påvirket af sex, og den var mindre effektiv hos sorte patienter end hos ikke-sorte patienter. Hos ældre patienter (større end eller lig med 60 år) var den gennemsnitlige blodtrykseffekt noget mindre end hos yngre patienter, selvom forskellen ikke var signifikant.
Stabil koronararteriesygdom
Det europæiske forsøg på reduktion af hjertehændelser med Perindopril ved stabil koronararteriesygdom (EUROPA) var et multicenter, randomiseret, dobbeltblindt og placebokontrolleret studie udført i 12.218 patienter, som havde tegn på stabil koronararteriesygdom uden klinisk hjertesvigt. Patienterne havde tegn på koronararteriesygdom dokumenteret ved tidligere myokardieinfarkt mere end 3 måneder før screening, koronar revaskularisering mere end 6 måneder før screening, angiografiske tegn på stenose (mindst 70 % forsnævring af en eller flere større kranspulsårer) eller positiv stress test hos mænd med en historie med brystsmerter. Efter en indkøringsperiode på 4 uger, hvor alle patienter fik perindopril 2 mg til 8 mg, blev patienterne tilfældigt tildelt perindopril 8 mg én gang dagligt (n=6.110) eller matchende placebo (n=6.108). Den gennemsnitlige opfølgning var 4,2 år. Undersøgelsen undersøgte de langsigtede virkninger af perindopril på tid til den første begivenhed af kardiovaskulær dødelighed, ikke-fatalt myokardieinfarkt eller hjertestop hos patienter med stabil koronararteriesygdom.
Patienternes gennemsnitsalder var 60 år; 85 % var mænd, 92 % tog blodpladehæmmere, 63 % tog β-blokkere, og 56 % tog lipidsænkende behandling. EUROPA-undersøgelsen viste, at perindopril signifikant reducerede den relative risiko for de primære endepunkthændelser (tabel 1). Denne gavnlige effekt kan i høj grad tilskrives en reduktion i risikoen for ikke-fatalt myokardieinfarkt. Denne gavnlige effekt af perindopril på det primære resultat var tydelig efter ca. et års behandling (figur 1). Resultatet var ens på tværs af alle foruddefinerede undergrupper efter alder, underliggende sygdom eller samtidig medicinering (figur 2).
Figur 1. Tid til første forekomst af primært endepunkt 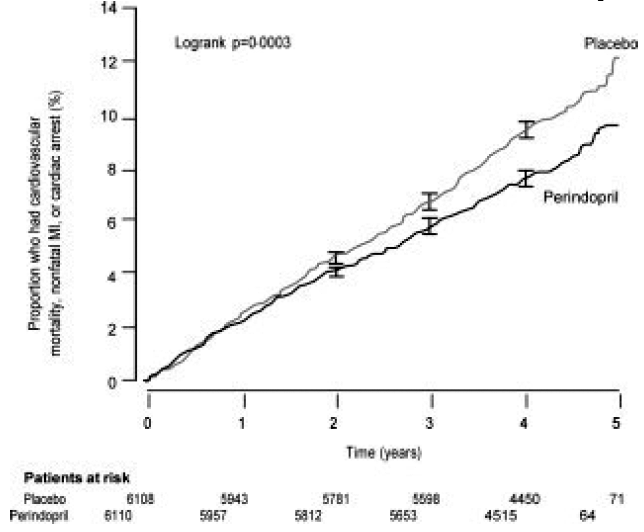
Figur 2. Fordelagtig effekt af perindoprilbehandling på primært endepunkt i foruddefinerede undergrupper 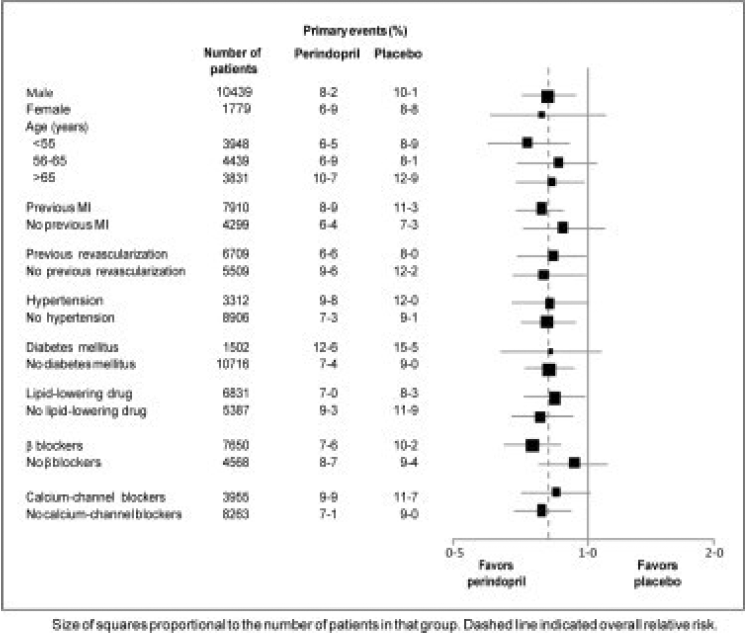
PATIENTOPLYSNINGER
Kvindelige patienter i den fødedygtige alder bør informeres om konsekvenserne af eksponering for ACEON 2 mg under graviditet. Diskuter behandlingsmuligheder med kvinder, der planlægger at blive gravide. Patienter bør bedes om at rapportere graviditeter til deres læger så hurtigt som muligt.
Fortæl patienterne, at de straks skal rapportere enhver indikation på infektion (f.eks. ondt i halsen, feber), som kan være tegn på neutropeni.
