Prinivil 2.5mg, 5mg, 10mg Lisinopril Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Prinivil 2,5mg, og hvordan bruges det?
Prinivil er en receptpligtig medicin, der bruges til at behandle symptomer på forhøjet blodtryk (hypertension) efter et hjerteanfald eller hjertesvigt. Prinivil kan bruges alene eller sammen med anden medicin.
- Prinivil tilhører en klasse af lægemidler kaldet ACE-hæmmere.
- Det vides ikke, om Prinivil er sikkert og effektivt til børn under 6 år.
Hvad er de mulige bivirkninger af Prinivil?
Prinivil kan forårsage alvorlige bivirkninger, herunder:
- svimmelhed,
- feber,
- ondt i halsen,
- kvalme,
- svaghed,
- prikkende følelse,
- brystsmerter,
- uregelmæssige hjerteslag,
- tab af bevægelse,
- lidt eller ingen vandladning,
- hævelse i dine fødder eller ankler,
- træthedsfornemmelse,
- forpustet,
- smerter i øvre mave,
- kløe,
- træt følelse,
- mistet appetiten,
- mørk urin,
- lerfarvede afføring, og
- gulfarvning af huden eller øjnene (gulsot)
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Prinivil 5mg omfatter:
- hovedpine,
- svimmelhed,
- hoste, og
- brystsmerter
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Prinivil. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
FØTALT TOKSICITET
- Når graviditet opdages, skal du stoppe behandlingen med PRINIVIL så hurtigt som muligt [se ADVARSLER OG FORHOLDSREGLER].
- Lægemidler, der virker direkte på renin-angiotensin-systemet, kan forårsage skade og død på det udviklende foster [se ADVARSLER OG FORHOLDSREGLER].
BESKRIVELSE
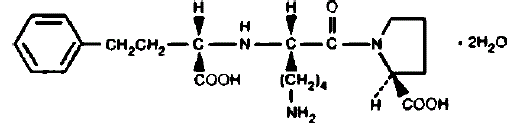
PRINIVIL indeholder lisinopril, et syntetisk peptidderivat, og en oral, langtidsvirkende angiotensinkonverterende enzymhæmmer. Lisinopril er kemisk beskrevet som (S)-1-[N2-(1-carboxy-3-phenylpropyl)-Llysyl]-L-prolin-dihydrat. Dens empiriske formel er C21H31N3O5•2H2O og dens strukturformel er:
Lisinopril er et hvidt til råhvidt, krystallinsk pulver med en molekylvægt på 441,52. Det er opløseligt i vand og tungtopløseligt i methanol og praktisk talt uopløseligt i ethanol.
PRINIVIL 10 mg leveres som 5 mg, 10 mg og 20 mg tabletter til oral administration. Ud over den aktive ingrediens, lisinopril, indeholder hver tablet følgende inaktive ingredienser: calciumphosphat, mannitol, magnesiumstearat og stivelse. 10 mg og 20 mg tabletterne indeholder også jernoxid.
INDIKATIONER
Forhøjet blodtryk
PRINIVIL er indiceret til behandling af hypertension hos voksne patienter og pædiatriske patienter på 6 år og ældre for at sænke blodtrykket. Sænkning af blodtrykket sænker risikoen for fatale og ikke-dødelige kardiovaskulære hændelser, primært slagtilfælde og myokardieinfarkter. Disse fordele er blevet set i kontrollerede forsøg med antihypertensiva fra en lang række farmakologiske klasser.
Kontrol af forhøjet blodtryk bør være en del af omfattende kardiovaskulær risikostyring, herunder, hvor det er relevant, lipidkontrol, diabetesbehandling, antitrombotisk behandling, rygestop, motion og begrænset natriumindtag. Mange patienter vil kræve mere end 1 lægemiddel for at nå blodtryksmålene. For specifik rådgivning om mål og ledelse, se offentliggjorte retningslinjer, såsom dem fra National High Blood Pressure Education Programs Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC).
Talrige antihypertensiva, fra en række farmakologiske klasser og med forskellige virkningsmekanismer, er i randomiserede kontrollerede forsøg blevet vist at reducere kardiovaskulær morbiditet og dødelighed, og det kan konkluderes, at det er blodtryksreduktion og ikke en anden farmakologisk egenskab ved stofferne, der i høj grad er ansvarlige for disse fordele. Den største og mest konsistente kardiovaskulære udfaldsfordel har været en reduktion i risikoen for slagtilfælde, men reduktioner i myokardieinfarkt og kardiovaskulær dødelighed er også set regelmæssigt.
Forhøjet systolisk eller diastolisk tryk forårsager øget kardiovaskulær risiko, og den absolutte risikostigning pr. mmHg er større ved højere blodtryk, så selv beskedne reduktioner af svær hypertension kan give væsentlige fordele. Relativ risikoreduktion fra blodtryksreduktion er ens på tværs af populationer med varierende absolut risiko, så den absolutte fordel er større hos patienter, der er i højere risiko uafhængigt af deres hypertension (f.eks. patienter med diabetes eller hyperlipidæmi), og sådanne patienter kan forventes at drage fordel af mere aggressiv behandling til et lavere blodtryksmål.
Nogle antihypertensiva har mindre blodtrykseffekter (som monoterapi) hos sorte patienter, og mange antihypertensiva har yderligere godkendte indikationer og virkninger (f.eks. på angina, hjertesvigt eller diabetisk nyresygdom). Disse overvejelser kan styre valg af terapi.
PRINIVIL kan administreres alene eller sammen med andre antihypertensiva [se Kliniske Studier ].
Hjertefejl
PRINIVIL er indiceret til at reducere tegn og symptomer på hjertesvigt hos patienter, som ikke reagerer tilstrækkeligt på diuretika og digitalis [se Kliniske Studier ].
Akut myokardieinfarkt
PRINIVIL er indiceret til reduktion af mortalitet ved behandling af hæmodynamisk stabile patienter inden for 24 timer efter akut myokardieinfarkt. Patienter bør efter behov modtage de anbefalede standardbehandlinger såsom trombolytika, aspirin og betablokkere [se Kliniske Studier ].
DOSERING OG ADMINISTRATION
Forhøjet blodtryk
Initial behandling hos voksne: Den anbefalede startdosis er 10 mg én gang dagligt. Juster dosis efter blodtryksrespons. Det sædvanlige dosisområde er 20 til 40 mg dagligt indgivet i en enkelt daglig dosis. Der er brugt doser op til 80 mg, men det ser ikke ud til at give større effekt.
Brug sammen med diuretika hos voksne
Hvis blodtrykket ikke kontrolleres med PRINIVIL 10 mg alene, kan en lav dosis af et diuretikum tilsættes (f.eks. hydrochlorthiazid 12,5 mg).
Den anbefalede startdosis til voksne patienter med hypertension, der tager diuretika, er 5 mg én gang dagligt [se DRUGSINTERAKTIONER ].
Pædiatriske patienter 6 år og ældre med hypertension
For pædiatriske patienter med glomerulær filtrationshastighed >30 ml/min/1,73 m² er den anbefalede startdosis 0,07 mg/kg én gang dagligt (op til 5 mg i alt). Dosis bør justeres i henhold til blodtryksrespons op til et maksimum på 0,61 mg/kg (op til 40 mg) én gang dagligt. Doser over 0,61 mg/kg (eller over 40 mg) er ikke blevet undersøgt hos pædiatriske patienter [se KLINISK FARMAKOLOGI ].
PRINIVIL 2,5 mg anbefales ikke til pædiatriske patienter Brug i specifikke populationer og Kliniske Studier ].
Hjertefejl
Den anbefalede startdosis for PRINIVIL 2,5 mg, når det bruges sammen med diuretika og (normalt) digitalis som supplerende behandling, er 5 mg én gang dagligt. Den anbefalede startdosis til disse patienter med hyponatriæmi (serumnatrium
Diuretikadosis skal muligvis justeres for at hjælpe med at minimere hypovolæmi, som kan bidrage til hypotension [se ADVARSLER OG FORHOLDSREGLER og DRUGSINTERAKTIONER ]. Forekomsten af hypotension efter den indledende dosis af PRINIVIL udelukker ikke efterfølgende omhyggelig dosistitrering med lægemidlet efter effektiv behandling af hypotensionen.
Akut myokardieinfarkt
Hos hæmodynamisk stabile patienter inden for 24 timer efter debut af symptomer på akut myokardieinfarkt, giv PRINIVIL 5 mg oralt, efterfulgt af 5 mg efter 24 timer, 10 mg efter 48 timer og derefter 10 mg én gang dagligt. Doseringen skal fortsætte i mindst 6 uger.
Påbegynd behandling med 2,5 mg hos patienter med lavt systolisk blodtryk (100-120 mmHg) i løbet af de første 3 dage efter infarktet [se ADVARSLER OG FORHOLDSREGLER ]. Hvis der opstår hypotension (systolisk blodtryk ≤100 mmHg), skal du overveje doser på 2,5 eller 5 mg. Hvis der opstår langvarig hypotension (systolisk blodtryk
Dosis til patienter med nedsat nyrefunktion
Dosisjustering af PRINIVIL 2,5 mg er ikke nødvendig hos patienter med kreatininclearance >30 ml/min. Hos patienter med kreatininclearance 10-30 ml/min reduceres startdosis af PRINIVIL til halvdelen af den sædvanlige anbefalede dosis (dvs. hypertension, 5 mg; hjertesvigt eller akut MI, 2,5 mg). For patienter i hæmodialyse eller kreatininclearance Brug i specifikke populationer og KLINISK FARMAKOLOGI ].
Forberedelse af suspension
For at lave 200 ml af en suspension ved 1,0 mg/ml, tilsæt 10 ml renset vand USP til en polyethylenterephthalat (PET) flaske indeholdende ti 20 mg tabletter af PRINIVIL 5 mg og ryst i mindst et minut. Tilsæt 30 mL natriumcitrat og citronsyre oral opløsning eller Cytra-2-fortynder og 160 mL Ora-Sweet SF™ til koncentratet i PET-flasken og ryst forsigtigt i flere sekunder for at sprede ingredienserne. Suspensionen skal opbevares ved eller under 25°C (77°F) og kan opbevares i op til fire uger. Ryst suspensionen før hver brug.
HVORDAN LEVERET
Doseringsformer og styrker
Tabletter PRINIVIL, 5 mg, er hvide, ovale komprimerede tabletter med kode MSD 19 på den ene side og delekærv på den anden side.
Tabletter PRINIVIL, 10 mg, er lysegule, ovale komprimerede tabletter med kode MSD 106 på den ene side og delekærv på den anden side.
Tabletter PRINIVIL, 20 mg, er ferskenfarvede, ovale komprimerede tabletter med kode MSD 207 på den ene side og delekærv på den anden side.
Opbevaring og håndtering
PRINIVIL 10mg leveres som ovale, komprimerede tabletter med delekærv på den ene side.
Opbevaring
Opbevares ved kontrolleret stuetemperatur, 15-30°C (59-86°F), og beskyt mod fugt.
Dispenser i en tæt beholder, hvis produktpakken er underopdelt.
Distribueret af: Merck Sharp & Dohme Corp., et datterselskab af MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Revideret: november 2021
BIVIRKNINGER
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske undersøgelser af et lægemiddel ikke direkte sammenlignes med frekvenser i de kliniske undersøgelser af et andet lægemiddel og afspejler muligvis ikke frekvenserne observeret i praksis.
Forhøjet blodtryk
Følgende bivirkninger (hændelser 2 % større på PRINIVIL 5 mg end på placebo) blev observeret med PRINIVIL 2,5 mg vs. placebo: hovedpine (5,7 % mod 1,9 %), svimmelhed (5,4 % vs. 1,9 %), hoste (3,5 % vs. 1,0 % ).
Hjertefejl
kontrollerede undersøgelser med patienter med hjertesvigt blev behandlingen afbrudt hos 8,1 % af patienterne behandlet med PRINIVIL 10 mg i 12 uger sammenlignet med 7,7 % af patienterne behandlet med placebo i 12 uger.
Følgende bivirkninger (hændelser 2 % større på PRINIVIL 2,5 mg end på placebo) blev observeret med PRINIVIL vs. placebo: hypotension (4,4 % vs. 0,6 %), brystsmerter (3,4 % vs. 1,3 %).
I ATLAS-forsøget [se Kliniske Studier ] hos patienter med hjertesvigt, var seponeringerne for bivirkninger ens i lav- og højdosisgrupperne. Følgende bivirkninger, hovedsagelig relateret til ACE-hæmning, blev rapporteret mere almindeligt i højdosisgruppen:
Akut myokardieinfarkt
Patienter i GISSI-3-studiet, der blev behandlet med PRINIVIL 10 mg, havde en højere forekomst af hypotension (9,0 % vs. 3,7 %) og nyreinsufficiens (2,4 % vs. 1,1 %) sammenlignet med patienter, der ikke tog PRINIVIL.
Andre kliniske bivirkninger, der forekommer hos 1 % eller derover af patienter med hypertension eller hjertesvigt behandlet med PRINIVIL 2,5 mg i kontrollerede kliniske forsøg, og som ikke optræder i andre sektioner af mærkningen, er anført nedenfor:
Kroppen som helhed: Træthed, asteni, ortostatiske virkninger.
Fordøjelse: Pancreatitis, forstoppelse, flatulens, mundtørhed, diarré.
Hæmatologisk: Sjældne tilfælde af knoglemarvsdepression, hæmolytisk anæmi, leukopeni/neutropeni og trombocytopeni.
Endokrine: Diabetes mellitus, uhensigtsmæssig sekretion af antidiuretisk hormon.
Metabolisk: Gigt
Hud: Nældefeber, alopeci, lysfølsomhed, erytem, rødmen, diaforese, kutan pseudolymfom, toksisk epidermal nekrolyse, Stevens-Johnsons syndrom og kløe.
Særlige sanser: Synstab, diplopi, sløret syn, tinnitus, fotofobi, smagsforstyrrelser, lugteforstyrrelser.
Urogenital: Impotens
Diverse: Et symptomkompleks er blevet rapporteret, som kan omfatte en positiv ANA, en forhøjet erytrocytsedimentationshastighed, artralgi/arthritis, myalgi, feber, vaskulitis, eosinofili, leukocytose, paræstesi og vertigo. Udslæt, lysfølsomhed eller andre dermatologiske manifestationer kan forekomme alene eller i kombination med disse symptomer.
Resultater af kliniske laboratorietest
Serum kalium
I kliniske forsøg forekom hyperkaliæmi (serumkalium >5,7 mEq/L) hos 2,2 % og 4,8 % af PRINIVIL-behandlede patienter med henholdsvis hypertension og hjertesvigt [se ADVARSLER OG FORHOLDSREGLER ].
Kreatinin, Blod Urea Nitrogen
Mindre stigninger i blodurinstofnitrogen og serumkreatinin, reversible ved seponering af behandlingen, blev observeret hos ca. 2 % af patienter med hypertension behandlet med PRINIVIL 5 mg alene. Forøgelser var mere almindelige hos patienter, der samtidig fik diuretika, og hos patienter med nyrearteriestenose [se ADVARSLER OG FORHOLDSREGLER ]. Reversible mindre stigninger i blodets urinstofnitrogen og serumkreatinin blev observeret hos 11,6 % af patienterne med hjertesvigt ved samtidig diuretikabehandling. Disse abnormiteter forsvandt ofte, når doseringen af diuretikum blev reduceret.
Patienter med akut myokardieinfarkt i GISSI-3-studiet behandlet med PRINIVIL havde en højere (2,4 % versus 1,1 % i placebo) forekomst af nyreinsufficiens på hospitalet og efter 6 uger (øgende kreatininkoncentration til over 3 mg/dL eller en fordobling eller mere af baseline serumkreatininkoncentrationen).
Hæmoglobin og hæmatokrit
Små fald i hæmoglobin (gennemsnit 0,4 mg/dL) og hæmatokrit (gennemsnit 1,3 %) forekom hyppigt hos patienter behandlet med PRINIVIL 5 mg, men var sjældent af klinisk betydning hos patienter uden anden årsag til anæmi. I kliniske forsøg afbrød færre end 0,1 % af patienterne behandlingen for anæmi.
Leverenzymer
Sjældent er forhøjelser af leverenzymer og/eller serumbilirubin forekommet [se ADVARSLER OG FORHOLDSREGLER ].
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af lisinopril efter godkendelse, som ikke er inkluderet i andre sektioner af mærkningen. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering. Andre reaktioner omfatter:
Metabolisme og ernæringsforstyrrelser
Hyponatriæmi [se ADVARSLER OG FORHOLDSREGLER ], tilfælde af hypoglykæmi hos diabetespatienter på orale antidiabetika eller insulin [se DRUGSINTERAKTIONER ]
Nervesystemet og psykiatriske lidelser
Humørændringer (herunder depressive symptomer), mental forvirring
DRUGSINTERAKTIONER
Diuretika
Påbegyndelse af PRINIVIL hos patienter på diuretika kan resultere i for kraftig reduktion af blodtrykket. Muligheden for hypotensive virkninger med PRINIVIL kan minimeres ved enten at reducere eller seponere diuretikummet eller øge saltindtaget før påbegyndelse af behandling med PRINIVIL. Hvis dette ikke er muligt, reduceres startdosis af PRINIVIL [se DOSERING OG ADMINISTRATION og ADVARSLER OG FORHOLDSREGLER ].
PRINIVIL 2,5 mg dæmper kaliumtab forårsaget af diuretika af thiazidtypen. Kaliumbesparende diuretika (spironolacton, amilorid, triamteren og andre) eller andre lægemidler, der kan øge serumkalium, kan øge risikoen for hyperkaliæmi. Derfor, hvis samtidig brug af sådanne midler er indiceret, skal du ofte overvåge patientens serumkalium.
Antidiabetika
Samtidig administration af PRINIVIL 10 mg og antidiabetiske lægemidler (insuliner, orale hypoglykæmiske midler) kan forårsage en øget blodsukkersænkende effekt med risiko for hypoglykæmi.
Ikke-steroide antiinflammatoriske midler, herunder selektive cyclooxygenase-2-hæmmere (COX-2-hæmmere)
Hos ældre patienter, volumendepleterede (inklusive dem i diuretikabehandling) eller med nedsat nyrefunktion, kan samtidig administration af NSAID'er, inklusive selektive COX-2-hæmmere, med ACE-hæmmere, inklusive lisinopril, resultere i forringelse af nyrefunktionen, inkl. mulig akut nyresvigt. Disse virkninger er normalt reversible. Overvåg nyrefunktionen periodisk hos patienter, der får lisinopril- og NSAID-behandling.
Den antihypertensive effekt af ACE-hæmmere, inklusive lisinopril, kan svækkes af NSAID'er.
Dobbelt blokade af Renin-Angiotensin System (RAS)
Dobbelt blokade af RAS med angiotensinreceptorblokkere, ACE-hæmmere eller direkte reninhæmmere (såsom aliskiren) er forbundet med øget risiko for hypotension, synkope, hyperkaliæmi og ændringer i nyrefunktionen (inklusive akut nyresvigt) sammenlignet med monoterapi.
Veterans Affairs Nephropathy in Diabetes (VA NEPHRON-D)-forsøg inkluderede 1448 patienter med type 2-diabetes, forhøjet urin-albumin-til-kreatinin-forhold og nedsat estimeret glomerulær filtrationshastighed (GFR 30 til 89,9 ml/min), randomiserede dem til lisinopril eller placebo på baggrund af losartanbehandling og fulgte dem i en median på 2,2 år. Patienter, der fik kombinationen af losartan og lisinopril, opnåede ingen yderligere fordele sammenlignet med monoterapi for det kombinerede endepunkt med fald i GFR, nyresygdom i slutstadiet eller død, men oplevede en øget forekomst af hyperkaliæmi og akut nyreskade sammenlignet med monoterapigruppen .
Undgå generelt kombineret brug af RAS-hæmmere. Overvåg blodtryk, nyrefunktion og elektrolytter hos patienter på PRINIVIL 5 mg og andre midler, der påvirker RAS.
Giv ikke aliskiren samtidig med PRINIVIL til patienter med diabetes. Undgå brug af aliskiren med PRINIVIL 2,5 mg til patienter med nedsat nyrefunktion (GFR
Lithium
Lithiumtoksicitet er blevet rapporteret hos patienter, der får lithium samtidig med lægemidler, som forårsager elimination af natrium, inklusive ACE-hæmmere. Lithiumtoksicitet var sædvanligvis reversibel ved seponering af lithium og ACE-hæmmeren. Overvåg serumlithiumniveauer under samtidig brug.
Guld
Nitritoidreaktioner (symptomer omfatter rødmen i ansigtet, kvalme, opkastning og hypotension) er sjældent blevet rapporteret hos patienter i behandling med injicerbart guld (natriumaurothiomalat) og samtidig behandling med ACE-hæmmere inklusive PRINIVIL.
Pattedyrsmål for Rapamycin (mTOR) hæmmere
Patienter, der samtidig tager behandling med mTOR-hæmmere (f.eks. temsirolimus, sirolimus, everolimus), kan have øget risiko for angioødem [se ADVARSLER OG FORHOLDSREGLER ].
Neprilysin-hæmmere
Patienter, der samtidig tager en neprilysinhæmmer (f.eks. sacubitril), kan have øget risiko for angioødem [se KONTRAINDIKATIONER og ADVARSLER OG FORHOLDSREGLER ].
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.

FORHOLDSREGLER
Føtal toksicitet
PRINIVIL kan forårsage fosterskader, når det administreres til en gravid kvinde. Brug af lægemidler, der virker på reninangiotensin-systemet i andet og tredje trimester af graviditeten, reducerer føtal nyrefunktion og øger føtal og neonatal morbiditet og død. Resulterende oligohydramnios kan være forbundet med føtal lungehypoplasi og skeletdeformationer. Potentielle neonatale bivirkninger omfatter kraniehypoplasi, anuri, hypotension, nyresvigt og død. Når graviditet opdages, afbrydes behandlingen med PRINIVIL så hurtigt som muligt [se Brug i specifikke populationer ].
Angioødem og anafylaktoide reaktioner
Angioødem
Hoved og hals angioødem
Angioødem i ansigt, ekstremiteter, læber, tunge, glottis og/eller strubehoved, inklusive nogle fatale reaktioner, er forekommet hos patienter behandlet med angiotensinkonverterende enzymhæmmere, inklusive PRINIVIL, på ethvert tidspunkt under behandlingen. Patienter med involvering af tungen, glottis eller larynx vil sandsynligvis opleve luftvejsobstruktion, især dem med en historie med luftvejskirurgi. PRINIVIL 5mg bør omgående seponeres, og passende behandling og monitorering bør gives, indtil fuldstændig og vedvarende opløsning af tegn og symptomer på angioødem er opstået.
Patienter med en anamnese med angioødem, der ikke er relateret til ACE-hæmmerbehandling, kan have øget risiko for angioødem, mens de får en ACE-hæmmer [se KONTRAINDIKATIONER ]. ACE-hæmmere er blevet forbundet med en højere forekomst af angioødem hos sorte end hos ikke-sorte patienter.
Patienter, der samtidig får behandling med ACE-hæmmer og mTOR (pattedyrmål for rapamycin) hæmmer (f.eks. temsirolimus, sirolimus, everolimus) kan have øget risiko for angioødem [se DRUGSINTERAKTIONER ].
Patienter, der samtidig får behandling med ACE-hæmmere og neprilysin-hæmmere, kan have øget risiko for angioødem [se KONTRAINDIKATIONER og DRUGSINTERAKTIONER ].
Intestinalt angioødem
Intestinalt angioødem er forekommet hos patienter behandlet med ACE-hæmmere. Disse patienter fik mavesmerter (med eller uden kvalme eller opkastning); i nogle tilfælde var der ingen tidligere anamnese med ansigtsangioødem, og C-1-esteraseniveauerne var normale. I nogle tilfælde blev angioødemet diagnosticeret ved procedurer, herunder abdominal CT-scanning eller ultralyd, eller ved operation, og symptomerne forsvandt efter seponering af ACE-hæmmeren.
Anafylaktoide reaktioner
Anafylaktoide reaktioner under desensibilisering
To patienter, der undergik desensibiliserende behandling med Hymenoptera-gift, mens de fik ACE-hæmmere, vedvarende livstruende anafylaktoide reaktioner.
Anafylaktoide reaktioner under dialyse
Pludselige og potentielt livstruende anafylaktoide reaktioner er forekommet hos nogle patienter, der er dialyseret med højfluxmembraner og samtidig behandlet med en ACE-hæmmer. Hos sådanne patienter skal dialyse stoppes øjeblikkeligt, og aggressiv behandling for anafylaktoide reaktioner skal påbegyndes. Symptomerne er ikke blevet lindret af antihistaminer i disse situationer. Hos disse patienter bør det overvejes at bruge en anden type dialysemembran eller en anden klasse af antihypertensiva. Anafylaktoide reaktioner er også blevet rapporteret hos patienter, der gennemgår low-density lipoprotein-aferese med dextransulfatabsorption.
Nedsat nyrefunktion
Overvåg nyrefunktionen periodisk hos patienter behandlet med PRINIVIL. Ændringer i nyrefunktionen inklusive akut nyresvigt kan være forårsaget af lægemidler, der hæmmer renin-angiotensin-systemet. Patienter, hvis nyrefunktion til dels kan afhænge af aktiviteten af renin-angiotensin-systemet (f.eks. patienter med nyrearteriestenose, kronisk nyresygdom, alvorlig kongestiv hjertesvigt, post-myokardieinfarkt eller volumendepletion) kan have særlig risiko for at udvikle akut nyresvigt på PRINIVIL. Overvej at tilbageholde eller afbryde behandlingen hos patienter, som udvikler et klinisk signifikant fald i nyrefunktionen på PRINIVIL [se BIVIRKNINGER og DRUGSINTERAKTIONER ].
Hypotension
PRINIVIL kan forårsage symptomatisk hypotension, nogle gange kompliceret af oliguri, progressiv azotæmi, akut nyresvigt eller død. Patienter med risiko for overdreven hypotension omfatter dem med følgende tilstande eller karakteristika: hjertesvigt med systolisk blodtryk under 100 mmHg, iskæmisk hjertesygdom, cerebrovaskulær sygdom, hyponatriæmi, højdosis diuretikabehandling, nyredialyse eller alvorlig volumen- og/eller saltmangel. af enhver ætiologi.
Hos disse patienter skal du starte PRINIVIL under lægeligt tilsyn og følge sådanne patienter i de første to ugers behandling, og når som helst dosis af PRINIVIL og/eller diuretikum øges. Undgå brug af PRINIVIL 2,5 mg til patienter, der er hæmodynamisk ustabile efter akut MI.
Symptomatisk hypotension er også mulig hos patienter med svær aortastenose eller hypertrofisk kardiomyopati.
Kirurgi/Anæstesi
Hos patienter, der gennemgår større operationer eller under anæstesi med midler, der producerer hypotension, kan PRINIVIL blokere angiotensin II-dannelse sekundært til kompensatorisk reninfrigivelse. Hvis hypotension opstår og anses for at skyldes denne mekanisme, kan den korrigeres ved volumenudvidelse.
Hyperkaliæmi
Overvåg serumkalium periodisk hos patienter, der får PRINIVIL. Lægemidler, der hæmmer reninangiotensinsystemet, kan forårsage hyperkaliæmi. Risikofaktorer for udvikling af hyperkaliæmi omfatter nyreinsufficiens, diabetes mellitus og samtidig brug af kaliumbesparende diuretika, kaliumtilskud, kaliumholdige salterstatninger eller andre lægemidler, der kan øge serumkalium [se DRUGSINTERAKTIONER ].
Leversvigt
ACE-hæmmere er blevet forbundet med et syndrom, der starter med kolestatisk gulsot eller hepatitis og udvikler sig til fulminant levernekrose og nogle gange død. Mekanismen for dette syndrom er ikke forstået. Patienter, der får ACE-hæmmere, og som udvikler gulsot eller markante forhøjelser af leverenzymer, bør seponere ACE-hæmmeren og modtage passende medicinsk behandling.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Der var ingen tegn på tumorigen effekt, når lisinopril blev administreret i 105 uger til han- og hunrotter i doser op til 90 mg pr. kg pr. dag eller i 92 uger til han- og hunmus i doser op til 135 mg pr. kg pr. dag. Disse doser er henholdsvis 10 gange og 7 gange MRHDD sammenlignet på basis af kropsoverfladeareal.
Lisinopril var ikke mutagent i Ames mikrobielle mutagentest med eller uden metabolisk aktivering. Det var også negativt i et fremadgående mutationsassay under anvendelse af kinesiske hamsterlungeceller. Lisinopril producerede ikke enkeltstrengede DNA-brud i en in vitro alkalisk elueringstest af rottehepatocytter. Derudover producerede lisinopril ikke stigninger i kromosomafvigelser i en in vitro-test i ovarieceller fra kinesisk hamster eller i et in vivo-studie i museknoglemarv.
Der var ingen negative virkninger på reproduktionsevnen hos han- og hunrotter behandlet med op til 300 mg/kg/dag af lisinopril (33 gange MRHDD sammenlignet på basis af kropsoverfladeareal).
Undersøgelser med rotter viser, at lisinopril krydser blod-hjernebarrieren dårligt. Flere doser af lisinopril hos rotter resulterer ikke i akkumulering i noget væv. Mælk fra diegivende rotter indeholder radioaktivitet efter administration af 14C lisinopril. Ved helkropsautoradiografi blev radioaktivitet fundet i placenta efter administration af mærket lægemiddel til gravide rotter, men ingen blev fundet i fostrene.
Brug i specifikke populationer
Graviditet
Risikooversigt
PRINIVIL kan forårsage fosterskader, når det administreres til en gravid kvinde. Brug af lægemidler, der virker på reninangiotensin-systemet i andet og tredje trimester af graviditeten, reducerer føtal nyrefunktion og øger føtal og neonatal morbiditet og død. De fleste epidemiologiske undersøgelser, der undersøgte føtale abnormiteter efter eksponering for antihypertensiv brug i første trimester, har ikke skelnet lægemidler, der påvirker reninangiotensinsystemet, fra andre antihypertensiva. Når graviditet opdages, afbrydes behandlingen med PRINIVIL 5mg så hurtigt som muligt.
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort for den angivne population er ukendt. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre ugunstige udfald. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2-4 % og 15-20 %.
Kliniske overvejelser
Sygdomsassocieret moder- og/eller embryo-/fosterrisiko
Hypertension under graviditet øger moderens risiko for præeklampsi, svangerskabsdiabetes, for tidlig fødsel og fødselskomplikationer (f.eks. behov for kejsersnit og blødning efter fødslen). Hypertension øger fosterets risiko for intrauterin vækstbegrænsning og intrauterin død. Gravide kvinder med hypertension bør overvåges omhyggeligt og behandles i overensstemmelse hermed.
Fetale/neonatale bivirkninger
Oligohydramnios hos gravide kvinder, der bruger lægemidler, der påvirker renin-angiotensin-systemet i graviditetens andet og tredje trimester, kan resultere i følgende: nedsat føtal nyrefunktion, der fører til anuri og nyresvigt, føtal lungehypoplasi og skeletdeformationer, herunder kraniehypoplasi, hypotension , og døden. I det usædvanlige tilfælde, at der ikke er nogen passende alternativ behandling til lægemidler, der påvirker renin-angiotensin-systemet for en bestemt patient, skal du informere moderen om den potentielle risiko for fosteret.
Hos patienter, der tager PRINIVIL under graviditet, skal der udføres serielle ultralydsundersøgelser for at vurdere det intra-amniotiske miljø. Fostertest kan være passende, baseret på graviditetsugen. Hvis der observeres oligohydramnios, skal du seponere PRINIVIL 10 mg, medmindre det anses for at være livreddende for moderen. Patienter og læger skal dog være opmærksomme på, at oligohydramnios muligvis ikke vises, før fosteret har pådraget sig irreversibel skade.
Overvåg nøje spædbørn med historier om in utero eksponering for PRINIVIL for hypotension, oliguri og hyperkaliæmi. Hos nyfødte med en anamnese med in utero eksponering for PRINIVIL, hvis der opstår oliguri eller hypotension, støtte blodtryk og nyreperfusion. Udskiftningstransfusioner eller dialyse kan være påkrævet som et middel til at vende hypotension og/eller erstatte forstyrret nyrefunktion.
Amning
Risikooversigt
Der er ingen tilgængelige data vedrørende tilstedeværelsen af lisinopril i modermælk eller virkningerne af lisinopril på det ammede spædbarn eller på mælkeproduktionen. Lisinopril findes i rottemælk. Fordi mange lægemidler udskilles i modermælk og på grund af potentialet for alvorlige bivirkninger hos de ammede spædbørn fra ACE-hæmmere, skal du stoppe amningen eller afbryde PRINIVIL.
Pædiatrisk brug
Antihypertensiv virkning og sikkerhed af PRINIVIL er blevet fastslået hos pædiatriske patienter i alderen 6 til 16 år [se DOSERING OG ADMINISTRATION og Kliniske Studier ]. Der blev ikke identificeret nogen relevante forskelle mellem bivirkningsprofilen for pædiatriske patienter og voksne patienter.
Sikkerhed og effektivitet af PRINIVIL er ikke blevet fastslået hos pædiatriske patienter under 6 år eller hos pædiatriske patienter med glomerulær filtrationshastighed KLINISK FARMAKOLOGI og Kliniske Studier ].
Geriatrisk brug
Dosisjustering med PRINIVIL 2,5 mg er ikke nødvendig hos ældre patienter. I et klinisk studie med PRINIVIL 10 mg hos patienter med myokardieinfarkter (GISSI-3-forsøg) var 4.413 (47%) 65 og derover, mens 1.656 (18%) var 75 og derover. I denne undersøgelse afbrød 4,8 % af patienter i alderen 75 år og ældre behandling med PRINIVIL 5 mg på grund af nedsat nyrefunktion mod 1,3 % af patienter under 75 år. Der blev ikke observeret andre forskelle i sikkerhed eller effektivitet mellem ældre og yngre patienter, men større følsomhed hos nogle ældre personer kan ikke udelukkes.
Race
ACE-hæmmere, inklusive PRINIVIL, har en effekt på blodtrykket, der er mindre hos sorte patienter end hos ikke-sorte.
Nedsat nyrefunktion
Dosisjustering af PRINIVIL er påkrævet hos patienter, der gennemgår hæmodialyse, eller hvis kreatininclearance er ≤30 ml/min. Dosisjustering af PRINIVIL 5 mg er ikke nødvendig hos patienter med kreatininclearance >30 ml/min [se DOSERING OG ADMINISTRATION og KLINISK FARMAKOLOGI ].
OVERDOSIS
Efter en enkelt oral dosis på 20 g/kg forekom der ingen dødelighed hos rotter, og døden forekom hos en af 20 mus, der fik den samme dosis. Den mest sandsynlige manifestation af overdosering vil være hypotension, for hvilken den sædvanlige behandling vil være intravenøs infusion af normal saltvandsopløsning.
Lisinopril kan fjernes ved hæmodialyse [se ADVARSLER OG FORHOLDSREGLER ].
KONTRAINDIKATIONER
PRINIVIL 10 mg er kontraindiceret til patienter med:
- en historie med angioødem eller overfølsomhed relateret til tidligere behandling med en angiotensinkonverterende enzymhæmmer
- arvelig eller idiopatisk angioødem.
Giv ikke aliskiren samtidig med PRINIVIL 5 mg til patienter med diabetes [se DRUGSINTERAKTIONER ]. PRINIVIL er kontraindiceret i kombination med en neprilysinhæmmer (f.eks. sacubitril). Indgiv ikke PRINIVIL 2,5 mg inden for 36 timer efter skift til eller fra sacubitril/valsartan, et produkt, der indeholder en neprilysinhæmmer [se ADVARSLER OG FORHOLDSREGLER og DRUGSINTERAKTIONER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Lisinopril hæmmer angiotensin-konverterende enzym (ACE) hos mennesker og dyr. ACE er en peptidyldipeptidase, der katalyserer omdannelsen af angiotensin I til det vasokonstriktor-stof, angiotensin II. Angiotensin II stimulerer også aldosteronsekretionen fra binyrebarken. De gavnlige virkninger af lisinopril ved hypertension og hjertesvigt synes primært at skyldes suppression af renin-angiotensinaldosteronsystemet. Hæmning af ACE resulterer i nedsat plasmaangiotensin II, hvilket fører til nedsat vasopressoraktivitet og nedsat aldosteronsekretion. Sidstnævnte fald kan resultere i en lille stigning i serumkalium. Hos hypertensive patienter med normal nyrefunktion behandlet med PRINIVIL 10 mg alene i op til 24 uger, var den gennemsnitlige stigning i serumkalium ca. 0,1 mEq/L; dog havde ca. 15 % af patienterne stigninger på mere end 0,5 mEq/L, og ca. 6 % havde et fald på mere end 0,5 mEq/L. I samme undersøgelse havde patienter behandlet med PRINIVIL 2,5 mg og hydrochlorthiazid i op til 24 uger et gennemsnitligt fald i serumkalium på 0,1 mækv./l; ca. 4 % af patienterne havde stigninger på mere end 0,5 mEq/L og ca. 12 % havde et fald på mere end 0,5 mEq/L [se ADVARSLER OG FORHOLDSREGLER ]. Fjernelse af angiotensin II negativ feedback på reninsekretion fører til øget plasmareninaktivitet.
ACE er identisk med kininase, et enzym, der nedbryder bradykinin. Hvorvidt øgede niveauer af bradykinin, et potent vasodepressorpeptid, spiller en rolle i de terapeutiske virkninger af PRINIVIL 5mg, mangler at blive belyst.
Mens mekanismen, hvorved PRINIVIL 2,5 mg sænker blodtrykket, menes primært at være suppression af renin-angiotensin-aldosteron-systemet, er PRINIVIL antihypertensiv selv hos patienter med lav-renin-hypertension. Selvom PRINIVIL 10 mg var antihypertensiv i alle undersøgte racer, havde sorte hypertensive patienter (sædvanligvis en lav-renin hypertensiv population) et mindre gennemsnitligt respons på monoterapi end ikke-sorte patienter.
Samtidig administration af PRINIVIL 5 mg og hydrochlorthiazid reducerede blodtrykket yderligere hos sorte og ikke-sorte patienter, og enhver racemæssig forskel i blodtryksrespons var ikke længere tydelig.
Farmakodynamik
Forhøjet blodtryk
Voksne patienter
Administration af PRINIVIL til patienter med hypertension resulterer i en reduktion af liggende og stående blodtryk i omtrent samme grad uden kompensatorisk takykardi. Symptomatisk postural hypotension observeres normalt ikke, selvom den kan forekomme og bør forventes hos patienter med volumen og/eller saltfattige [se ADVARSLER OG FORHOLDSREGLER ]. Når de gives sammen med diuretika af thiazidtypen, er de blodtrykssænkende virkninger af de to lægemidler tilnærmelsesvis additive.
Hos de fleste undersøgte patienter sås indtræden af antihypertensiv aktivitet én time efter oral administration af en individuel dosis PRINIVIL, med en maksimal reduktion af blodtrykket opnået med 6 timer. Selvom der blev observeret en antihypertensiv effekt 24 timer efter dosering med anbefalede daglige enkeltdoser, var effekten mere konsistent, og den gennemsnitlige effekt var betydeligt større i nogle undersøgelser med doser på 20 mg eller mere end ved lavere doser. Ved alle undersøgte doser var den gennemsnitlige antihypertensive effekt imidlertid væsentligt mindre 24 timer efter dosering, end den var 6 timer efter dosering.
Den antihypertensive virkning af PRINIVIL opretholdes under langtidsbehandling. Pludselig seponering af PRINIVIL 10 mg er ikke blevet forbundet med en hurtig stigning i blodtrykket eller en signifikant stigning i blodtrykket sammenlignet med niveauerne før behandling.
Farmakokinetik
Voksne patienter
Efter oral administration af PRINIVIL forekommer maksimale serumkoncentrationer af lisinopril inden for ca. 7 timer, selvom der var en tendens til en lille forsinkelse i den tid, det tager at nå maksimale serumkoncentrationer hos patienter med akut myokardieinfarkt. Faldende serumkoncentrationer udviser en forlænget terminalfase, som ikke bidrager til lægemiddelakkumulering. Denne terminale fase repræsenterer sandsynligvis mættelig binding til ACE og er ikke proportional med dosis. Ved gentagen dosering udviser lisinopril en effektiv halveringstid på 12 timer.
Lisinopril ser ikke ud til at være bundet til andre serumproteiner. Lisinopril metaboliseres ikke og udskilles uændret helt i urinen. Baseret på uringenvinding er den gennemsnitlige grad af absorption af lisinopril ca. 25 procent, med stor inter-individ variabilitet (6-60 procent) ved alle testede doser (5-80 mg). Lisinopril absorption påvirkes ikke af tilstedeværelsen af mad i mave-tarmkanalen. Den absolutte biotilgængelighed af lisinopril er reduceret til omkring 16 procent hos patienter med stabil NYHA klasse II-IV kongestiv hjerteinsufficiens, og distributionsvolumenet ser ud til at være lidt mindre end hos normale forsøgspersoner.
Den orale biotilgængelighed af lisinopril hos patienter med akut myokardieinfarkt svarer til den hos raske frivillige.
Nedsat nyrefunktion nedsætter eliminationen af lisinopril, som hovedsageligt udskilles gennem nyrerne, men dette fald bliver først klinisk vigtigt, når den glomerulære filtrationshastighed er under 30 ml/min. Over denne glomerulære filtrationshastighed er eliminationshalveringstiden lidt ændret. Ved større svækkelse stiger peak- og dalniveauer af lisinopril imidlertid, tiden til peak-koncentrationen stiger, og tiden til at opnå steady state forlænges. Ældre patienter har i gennemsnit (ca. fordoblet) højere blodniveauer og areal under plasmakoncentrationstidskurven (AUC) end yngre patienter [se DOSERING OG ADMINISTRATION ]. Lisinopril kan fjernes ved hæmodialyse.
Undersøgelser med rotter viser, at lisinopril krydser blod-hjerne-barrieren dårligt. Flere doser af lisinopril hos rotter resulterer ikke i akkumulering i noget væv. Mælk fra diegivende rotter indeholder radioaktivitet efter administration af 14C lisinopril. Ved helkropsautoradiografi blev radioaktivitet fundet i placenta efter administration af mærket lægemiddel til gravide rotter, men ingen blev fundet i fostrene.
Pædiatriske patienter
Lisinoprils farmakokinetik blev undersøgt hos 29 pædiatriske hypertensive patienter mellem 6 år og 16 år med glomerulær filtrationshastighed >30 ml/min/1,73 m². Efter doser på 0,1 til 0,2 mg/kg forekom steady state maksimale plasmakoncentrationer af lisinopril inden for 6 timer, og omfanget af absorption baseret på uringenvinding var omkring 28%. Disse værdier svarer til dem, der tidligere er opnået hos voksne. Den typiske værdi af lisinopril oral clearance (systemisk clearance/absolut biotilgængelighed) hos et barn, der vejer 30 kg, er 10 l/time, hvilket øges proportionalt med nyrefunktionen.
Kliniske Studier
Forhøjet blodtryk
Voksne patienter
To dosis-respons-undersøgelser, hvor der blev anvendt et regime én gang dagligt, blev udført hos 438 milde til moderate hypertensive patienter, der ikke fik et diuretikum. Blodtrykket blev målt 24 timer efter dosering. En antihypertensiv effekt af PRINIVIL blev set med 5 mg hos nogle patienter. I begge undersøgelser forekom blodtryksreduktionen dog hurtigere og var større hos patienter behandlet med 10, 20 eller 80 mg PRINIVIL. I kontrollerede kliniske studier med patienter med mild til moderat hypertension er PRINIVIL 20-80 mg blevet sammenlignet med hydrochlorthiazid 12,5-50 mg og med atenolol 50-500 mg, og hos patienter med moderat til svær hypertension med metoprolol 100-200 mg. Det var bedre end hydrochlorthiazid med hensyn til virkninger på systolisk og diastolisk blodtryk i en population, der var 75 % kaukasisk. PRINIVIL 10 mg svarede tilnærmelsesvis til atenolol og metoprolol med hensyn til påvirkning af det diastoliske blodtryk og havde en noget større effekt på det systoliske blodtryk.
PRINIVIL havde lignende virkning og bivirkninger hos yngre og ældre (>65 år) patienter. Det var mindre effektivt hos sorte end hos kaukasiere.
I hæmodynamiske undersøgelser af PRINIVIL 5 mg hos patienter med essentiel hypertension blev blodtryksreduktion ledsaget af en reduktion i perifer arteriel modstand med ringe eller ingen ændring i hjertevolumen og hjertefrekvens. I et studie med ni hypertensive patienter, efter administration af PRINIVIL 5 mg, var der en stigning i den gennemsnitlige renal blodgennemstrømning, som ikke var signifikant. Data fra flere små undersøgelser er inkonsistente med hensyn til effekten af lisinopril på glomerulær filtrationshastighed hos hypertensive patienter med normal nyrefunktion, men tyder på, at ændringer, hvis nogen, ikke er store.
Hos patienter med renovaskulær hypertension har PRINIVIL vist sig at være veltolereret og effektiv til at sænke blodtrykket [se ADVARSLER OG FORHOLDSREGLER ].
Pædiatriske patienter
et klinisk studie med 115 hypertensive pædiatriske patienter i alderen 6 til 16 år fik patienter, der vejede 1,25 mg (0,02 mg/kg). Denne effekt blev bekræftet i en abstinensfase, hvor det diastoliske tryk steg med ca. 9 mmHg mere hos patienter randomiseret til placebo, end det gjorde hos patienter, der blev randomiseret til at forblive på den mellemste og høje dosis af lisinopril. Den dosisafhængige antihypertensive effekt af lisinopril var konsistent på tværs af flere demografiske undergrupper: alder, Tanner-stadium, køn og race. I denne undersøgelse blev lisinopril generelt veltolereret.
de ovennævnte pædiatriske undersøgelser blev lisinopril givet enten som tabletter eller i en suspension til de børn og spædbørn, der ikke var i stand til at sluge tabletter, eller som havde brug for en lavere dosis end tilgængelig i tabletform [se DOSERING OG ADMINISTRATION ].
Hjertefejl
to placebokontrollerede, 12-ugers kliniske undersøgelser sammenlignede tilsætningen af PRINIVIL 2,5 mg op til 20 mg dagligt med digitalis og diuretika alene. Kombinationen af PRINIVIL, digitalis og diuretika reducerede følgende tegn og symptomer på hjertesvigt: ødem, raser, paroxysmal natlig dyspnø og halsvenøs udspilning. I et af undersøgelserne reducerede kombinationen af PRINIVIL 2,5 mg, digitalis og diuretika orthopnø, tilstedeværelse af tredje hjertelyd og antallet af patienter klassificeret som NYHA klasse III og IV, og det forbedrede træningstolerancen. Et stort (over 3000 patienter) overlevelsesstudie, ATLAS-studiet, der sammenlignede 2,5 og 35 mg lisinopril hos patienter med systolisk hjertesvigt, viste, at den højere dosis lisinopril havde resultater, der var mindst lige så gunstige som den lavere dosis. Under baseline-kontrollerede kliniske undersøgelser hos patienter, der fik digitalis og diuretika, resulterede enkeltdoser af PRINIVIL 5 mg i fald i pulmonært kapillærkiletryk, systemisk vaskulær modstand og blodtryk ledsaget af en stigning i hjertevolumen og ingen ændring i hjertefrekvens.
Akut myokardieinfarkt
Gruppo Italiano per lo Studio della Sopravvienza nell’Infarto Miocardico (GISSI-3) undersøgelsen var et multicenter, kontrolleret, randomiseret, ublindet klinisk forsøg udført i 19.394 patienter med akut myokardieinfarkt (MI) indlagt på en koronarafdeling. Det var designet til at undersøge virkningerne af kortvarig (6 uger) behandling med lisinopril, nitrater, deres kombination eller ingen behandling på kortvarig (6 uger) dødelighed og på langvarig død og markant svækket hjertefunktion. Hæmodynamisk stabile patienter, der viste sig inden for 24 timer efter symptomernes begyndelse, blev randomiseret, i et 2 x 2 faktorielt design, til 6 uger med enten 1) PRINIVIL alene (n=4841), 2) nitrater alene (n=4869), 3 ) PRINIVIL 2,5 mg plus nitrater (n=4841), eller 4) åben kontrol (n=4843). Alle patienter modtog rutinebehandlinger, inklusive trombolytika (72 %), aspirin (84 %) og en betablokker (31 %), som normalt anvendes til patienter med akut myokardieinfarkt (MI).
Protokollen udelukkede patienter med hypotension (systolisk blodtryk ≤100 mmHg), alvorlig hjertesvigt, kardiogent shock og nyreinsufficiens (serumkreatinin >2 mg/dL og/eller proteinuri >500 mg pr. 24 timer). Patienter randomiseret til PRINIVIL 5 mg fik 5 mg inden for 24 timer efter symptomernes begyndelse, 5 mg efter 24 timer og derefter 10 mg dagligt. Patienter med systolisk blodtryk mindre end 120 mmHg ved baseline fik 2,5 mg PRINIVIL. Hvis der opstod hypotension, blev PRINIVIL 10 mg-dosis reduceret, eller hvis der opstod alvorlig hypotension, blev PRINIVIL stoppet [se DOSERING OG ADMINISTRATION ].
De primære resultater af forsøget var den samlede dødelighed efter 6 uger og et kombineret endepunkt ved 6 måneder efter myokardieinfarktet, bestående af antallet af patienter, der døde, havde sent (dag 4) klinisk kongestiv hjertesvigt eller havde omfattende venstre ventrikel. skade defineret som ejektionsfraktion ≤35 % eller en akinetisk-dyskinetisk [AD]-score ≥45 %. Patienter, der fik PRINIVIL (n=9646), alene eller sammen med nitrater, havde en 11 % lavere risiko for død (p = 0,04) sammenlignet med patienter, der ikke fik PRINIVIL (n=9672) (henholdsvis 6,4 % vs. 7,2 %). ved 6 uger. Selvom patienter randomiseret til at modtage PRINIVIL i op til 6 uger også klarede sig numerisk bedre på det kombinerede endepunkt efter 6 måneder, var den åbne karakter af vurderingen af hjertesvigt, betydeligt tab til opfølgende ekkokardiografi og betydelig overskydende brug af PRINIVIL 10mg, mellem 6 uger og 6 måneder i gruppen randomiseret til 6 ugers lisinopril, udelukker enhver konklusion om dette endepunkt.
Patienter med akut myokardieinfarkt, behandlet med PRINIVIL 10 mg, havde en højere (9,0 % versus 3,7 %) forekomst af vedvarende hypotension (systolisk blodtryk BIVIRKNINGER ].
PATIENTOPLYSNINGER
BEMÆRK: Denne information er beregnet til at hjælpe med sikker og effektiv brug af denne medicin. Det er ikke en afsløring af alle mulige negative eller tilsigtede virkninger.
Graviditet
Fortæl kvindelige patienter i den fødedygtige alder om konsekvenserne af eksponering for PRINIVIL 10 mg under graviditet. Diskuter behandlingsmuligheder med kvinder, der planlægger at blive gravide. Fortæl patienterne om at rapportere graviditeter til deres læger så hurtigt som muligt.
Angioødem
Angioødem, herunder larynxødem, kan forekomme på ethvert tidspunkt under behandling med angiotensinkonverterende enzymhæmmere, inklusive PRINIVIL. Fortæl patienterne omgående at rapportere tegn eller symptomer, der tyder på angioødem (hævelse af ansigt, ekstremiteter, øjne, læber, tunge, synke- eller vejrtrækningsbesvær) og ikke at tage mere medicin, før de har rådført sig med den ordinerende læge.
Symptomatisk hypotension
Fortæl patienterne om at rapportere svimmelhed, især i løbet af de første par dage af behandlingen. Hvis faktisk synkope opstår, skal du fortælle patienten om at seponere lægemidlet, indtil de har rådført sig med den ordinerende læge.
Fortæl patienterne, at overdreven sved og dehydrering kan føre til et for stort fald i blodtrykket på grund af reduktion i væskevolumen. Andre årsager til volumenmangel såsom opkastning eller diarré kan også føre til et fald i blodtrykket; rådgive patienterne herom.
Hyperkaliæmi
Fortæl patienterne ikke at bruge salterstatninger, der indeholder kalium uden at konsultere deres læge.
Hypoglykæmi
Fortæl diabetikere, der behandles med orale antidiabetika eller insulin, der starter en ACE-hæmmer, om at overvåge for hypoglykæmi nøje, især i den første måned af kombineret brug [se DRUGSINTERAKTIONER ].
Leukopeni/Neutropeni
Fortæl patienterne, at de straks skal rapportere enhver indikation af infektion (f.eks. ondt i halsen, feber), som kan være tegn på leukopeni/neutropeni.
