Minipress 1mg, 2mg Prazosin Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Minipress, og hvordan bruges det?
Minipress (prazosinhydrochlorid) er en alfa-adrenerg blokker, der bruges til at behandle hypertension (højt blodtryk).
Hvad er bivirkninger af Minipress 2mg?
Almindelige bivirkninger af Minipress 1mg omfatter:
- hovedpine,
- døsighed,
- træthed,
- svaghed,
- sløret syn,
- kvalme,
- opkastning,
- diarré, eller
- forstoppelse, når din krop tilpasser sig medicinen
Andre bivirkninger af Minipress 2mg omfatter:
- svimmelhed eller svimmelhed ved stående stilling, især efter den første dosis og kort efter indtagelse af en dosis af lægemidlet i løbet af den første uge af behandlingen.
Fortæl det til din læge, hvis du oplever alvorlige bivirkninger af Minipress 1mg, herunder hurtige eller dunkende hjerteslag eller flagrende i brystet, følelse af at du kan besvime, vejrtrækningsbesvær, hævede hænder eller fødder eller en erektion, der er smertefuld eller varer 4 timer. eller længere.
BESKRIVELSE
MINIPRESS® (prazosinhydrochlorid), et quinazolinderivat, er det første i en ny kemisk klasse af antihypertensiva. Det er hydrochloridsaltet af 1-(4-amino-6,7-dimethoxy-2-quinazolinyl)-4-(2-furoyl) piperazin, og dets strukturformel er:
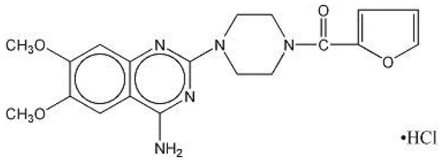
Molekylformel C19H21N5O4•HCl
Det er et hvidt, krystallinsk stof, let opløseligt i vand og isotonisk saltvand og har en molekylvægt på 419,87. Hver 1 mg kapsel MINIPRESS til oral brug indeholder lægemiddel svarende til 1 mg fri base.
Inerte ingredienser i formuleringerne er: hårde gelatinekapsler (som kan indeholde blå 1, rød 3, rød 28, rød 40 og andre inerte ingredienser); magnesiumstearat; natriumlaurylsulfat; stivelse; saccharose.
INDIKATIONER
MINIPRESS 1mg er indiceret til behandling af hypertension for at sænke blodtrykket. Sænkning af blodtrykket reducerer risikoen for fatale og ikke-dødelige kardiovaskulære hændelser, primært slagtilfælde og myokardieinfarkter. Disse fordele er blevet set i kontrollerede forsøg med antihypertensiva fra en lang række farmakologiske klasser, inklusive dette lægemiddel.
Kontrol af forhøjet blodtryk bør være en del af omfattende kardiovaskulær risikostyring, herunder, hvor det er relevant, lipidkontrol, diabetesbehandling, antitrombotisk behandling, rygestop, motion og begrænset natriumindtag. Mange patienter vil kræve mere end ét lægemiddel for at nå blodtryksmålene. For specifik rådgivning om mål og ledelse, se offentliggjorte retningslinjer, såsom dem fra National High Blood Pressure Education Program's Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC).
Talrige antihypertensiva, fra en række farmakologiske klasser og med forskellige virkningsmekanismer, er i randomiserede kontrollerede forsøg blevet vist at reducere kardiovaskulær morbiditet og dødelighed, og det kan konkluderes, at det er blodtryksreduktion og ikke en anden farmakologisk egenskab ved stofferne, der i høj grad er ansvarlige for disse fordele. Den største og mest konsistente kardiovaskulære udfaldsfordel har været en reduktion i risikoen for slagtilfælde, men reduktioner i myokardieinfarkt og kardiovaskulær dødelighed er også set regelmæssigt.
Forhøjet systolisk eller diastolisk tryk forårsager øget kardiovaskulær risiko, og den absolutte risikostigning pr. mmHg er større ved højere blodtryk, så selv beskedne reduktioner af svær hypertension kan give væsentlige fordele. Relativ risikoreduktion fra blodtryksreduktion er ens på tværs af populationer med varierende absolut risiko, så den absolutte fordel er større hos patienter, der er i højere risiko uafhængigt af deres hypertension (f.eks. patienter med diabetes eller hyperlipidæmi), og sådanne patienter kan forventes at drage fordel af mere aggressiv behandling til et lavere blodtryksmål.
Nogle antihypertensiva har mindre blodtrykseffekter (som monoterapi) hos sorte patienter, og mange antihypertensiva har yderligere godkendte indikationer og virkninger (f.eks. på angina, hjertesvigt eller diabetisk nyresygdom). Disse overvejelser kan styre valg af terapi.
MINIPRESS kan bruges alene eller i kombination med andre antihypertensiva, såsom diuretika eller beta-adrenerge blokerende midler.
DOSERING OG ADMINISTRATION
Dosis af MINIPRESS 1 mg bør justeres i henhold til patientens individuelle blodtryksrespons. Følgende er en vejledning til administrationen:
Startdosis
1 mg to eller tre gange dagligt (se ADVARSLER .)
Vedligeholdelsesdosis
Dosis kan langsomt øges til en samlet daglig dosis på 20 mg givet i opdelte doser. De mest almindeligt anvendte terapeutiske doser har varieret fra 6 mg til 15 mg dagligt givet i opdelte doser. Doser højere end 20 mg øger normalt ikke effektiviteten, men nogle få patienter kan have gavn af yderligere stigninger op til en daglig dosis på 40 mg givet i opdelte doser. Efter indledende titrering kan nogle patienter opretholdes tilstrækkeligt på et doseringsregime to gange dagligt.
Brug sammen med andre stoffer
Ved tilsætning af et diuretikum eller et andet antihypertensivt middel, skal dosis af MINIPRESS 1 mg reduceres til 1 mg eller 2 mg tre gange dagligt, og der skal derefter genoptages.
Samtidig administration af MINIPRESS 1mg med en PDE-5-hæmmer kan resultere i additive blodtrykssænkende effekter og symptomatisk hypotension; derfor bør PDE-5-hæmmerbehandling påbegyndes med den laveste dosis hos patienter, der tager MINIPRESS.
HVORDAN LEVERET
Distribueret af: Pfizer Labs, Division of Pfizer Inc., NY, NY 10017. Revideret: feb 2015
BIVIRKNINGER
Kliniske forsøg blev udført på mere end 900 patienter. Under disse forsøg og efterfølgende markedsføringserfaringer er de hyppigste reaktioner forbundet med MINIPRESS-behandling: svimmelhed 10,3 %, hovedpine 7,8 %, døsighed 7,6 %, mangel på energi 6,9 %, svaghed 6,5 %, hjertebanken 5,3 % og kvalme 4,9 %. I de fleste tilfælde er bivirkninger forsvundet med fortsat behandling eller er blevet tolereret uden reduktion i dosis af lægemidlet.
Mindre hyppige bivirkninger, som er rapporteret at forekomme hos 1-4 % af patienterne, er:
Gastrointestinale: opkastning, diarré, forstoppelse.
Kardiovaskulær: ødem, ortostatisk hypotension, dyspnø, synkope.
Centralnervesystemet: svimmelhed, depression, nervøsitet.
Dermatologisk: udslæt.
Genitourinære: urinfrekvens.
EENT: sløret syn, rødmet sclera, næseblødning, mundtørhed, tilstoppet næse.
Derudover har færre end 1 % af patienterne rapporteret følgende (i nogle tilfælde er nøjagtige årsagssammenhænge ikke blevet fastlagt):
Gastrointestinale: abdominal ubehag og/eller smerte, leverfunktionsabnormiteter, pancreatitis.
Kardiovaskulær: takykardi.
Centralnervesystemet: paræstesi, hallucinationer.
Dermatologisk: pruritus, alopeci, lichen planus.
Genitourinære: inkontinens, impotens, priapisme.
EENT: tinnitus.
Andet: diaforese, feber, positiv ANA-titer, artralgi.
Enkelte rapporter om pigmentpletter og serøs retinopati og enkelte rapporter om udvikling eller forsvinden af grå stær er blevet rapporteret. I disse tilfælde er den nøjagtige årsagssammenhæng ikke blevet fastslået, fordi baseline-observationerne ofte var utilstrækkelige.
I mere specifikke spaltelampe- og funduskopiske undersøgelser, som omfattede tilstrækkelige baseline undersøgelser, er der ikke rapporteret lægemiddelrelaterede abnorme oftalmologiske fund.
Der findes litteraturrapporter, der forbinder MINIPRESS 1 mg-behandling med en forværring af allerede eksisterende narkolepsi. En årsagssammenhæng er usikker i disse tilfælde.
Efter markedsføring er følgende bivirkninger blevet rapporteret:
Autonome nervesystem: rødmen.

Kroppen som helhed: allergisk reaktion, asteni, utilpashed, smerter.
Kardiovaskulær, generelt: angina pectoris, hypotension.
Endokrine: gynækomasti.
Puls/rytme: bradykardi.
Psykiatrisk: søvnløshed.
Hud/vedhæng: nældefeber.
Vaskulær (ekstrakardial): vaskulitis.
Vision: øjensmerter.
Særlige sanser: Under grå stærkirurgi er en variant af lille pupilsyndrom kendt som intraoperativt floppy iris syndrom (IFIS) blevet rapporteret i forbindelse med alfa-1-blokkerbehandling (se FORHOLDSREGLER ).
DRUGSINTERAKTIONER
MINIPRESS 2mg er blevet administreret uden nogen uønskede lægemiddelinteraktioner i begrænset klinisk erfaring til dato med følgende: (1) hjerteglykosider-digitalis og digoxin; (2) hypoglykæmi-insulin, chlorpropamid, phenformin, tolazamid og tolbutamid; (3) beroligende midler og beroligende midler - chlordiazepoxid, diazepam og phenobarbital; (4) anti-allopurinol, colchicin og probenecid; (5) antiarytmika-procainamid, propranolol (se ADVARSLER dog), og quinidin; og (6) analgetika, antipyretika og antiinflammatoriske midler - propoxyphen, aspirin, indomethacin og phenylbutazon.
Tilsætning af et diuretikum eller et andet antihypertensivt middel til MINIPRESS 2mg har vist sig at forårsage en additiv hypotensiv virkning. Denne effekt kan minimeres ved at reducere MINIPRESS-dosis til 1 til 2 mg tre gange dagligt, ved at indføre yderligere antihypertensiva med forsigtighed og derefter ved at gentage MINIPRESS baseret på klinisk respons. Samtidig administration af MINIPRESS og en phosphodiesterase-5 (PDE-5) hæmmer kan resultere i additive blodtrykssænkende effekter og symptomatisk hypotension (se DOSERING OG ADMINISTRATION ).
Interaktioner med lægemiddel/laboratorietest
en undersøgelse med fem patienter, der fik fra 12 til 24 mg prazosin om dagen i 10 til 14 dage, var der en gennemsnitlig stigning på 42 % i urinmetabolitten af noradrenalin og en gennemsnitlig stigning i urin-VMA på 17 %. Derfor kan falske positive resultater forekomme i screeningstests for fæokromocytom hos patienter, der behandles med prazosin. Hvis der konstateres en forhøjet VMA, bør prazosin seponeres, og patienten testes igen efter en måned.
Laboratorieprøver
I kliniske undersøgelser, hvor lipidprofiler blev fulgt, var der generelt ingen uønskede ændringer mellem lipidniveauer før og efter behandling.
ADVARSLER
Som med alle alfablokkere kan MINIPRESS forårsage synkope med pludseligt bevidsthedstab. I de fleste tilfælde menes dette at skyldes en overdreven postural hypotensiv effekt, selvom syncopalepis-ode lejlighedsvis er blevet forudgået af et anfald af svær takykardi med hjertefrekvenser på 120-160 slag i minuttet. Syncopalepis-oder er sædvanligvis forekommet inden for 30 til 90 minutter efter den indledende dosis af lægemidlet; lejlighedsvis er de blevet rapporteret i forbindelse med hurtige aldersforøgelser eller introduktion af et andet antihypertensivt lægemiddel i regimet hos en patient, der tager høje doser MINIPRESS. Hyppigheden af syncopalepis odes er ca. 1 % hos patienter, der får en startdosis på 2 mg eller mere. Kliniske forsøg udført i undersøgelsesfasen af dette lægemiddel tyder på, at synkopale episoder kan minimeres ved at begrænse den indledende dosis af lægemidlet til 1 mg, ved efterfølgende at øge dosisalderen langsomt og ved at introducere yderligere antihypertensiva i patientens regime. med forsigtighed (se DOSERING OG ADMINISTRATION). Hypotension kan udvikle sig hos patienter, der får MINIPRESS, som også får en betablokker, såsom propranolol.
Hvis der opstår synkope, skal patienten placeres i liggende stilling og behandles støttende efter behov. Denne bivirkning er selvbegrænsende og optræder i de fleste tilfælde ikke efter den indledende behandlingsperiode eller under efterfølgende dosistitrering.
Patienter skal altid startes på 1 mg kapslerne af MINIPRESS. 2 og 5 mg kapslerne er ikke indiceret til indledende behandling.
Mere almindelige end bevidstløshed er de symptomer, der ofte er forbundet med sænkning af blodtrykket, nemlig svimmelhed og svimmelhed. Patienten skal advares om disse mulige bivirkninger og informeres om, hvilke foranstaltninger der skal tages, hvis de udvikler sig. Patienten skal også advares om at undgå situationer, hvor der kan opstå skade, hvis der opstår synkope under påbegyndelse af MINIPRESS 2 mg-behandling.
Priapisme
Langvarige erektioner og priapisme er blevet rapporteret med alfa-1-blokkere inklusive prazosin efter markedsføring. I tilfælde af en erektion, der varer længere end 4 timer, søg omgående lægehjælp. Hvis priapisme ikke behandles med det samme, kan det medføre skade på penisvæv og permanent tab af styrke.
FORHOLDSREGLER
Generel
Intraoperativt Floppy Iris Syndrome (IFIS) er blevet observeret under kataraktkirurgi hos nogle patienter behandlet med alfa-1-blokkere. Denne variant af lille pupilsyndrom er karakteriseret ved kombinationen af en slap iris, der bølger som reaktion på intraoperative skyllestrømme, progressiv intraoperativ miose trods præoperativ udvidelse med standard mydriatiske lægemidler og potentiel prolaps af iris mod phacoemulsification incisions. Patientens øjenlæge bør være forberedt på mulige modifikationer af den kirurgiske teknik, såsom brug af iriskroge, irisdilatatorringe eller viskoelastiske stoffer. Der ser ikke ud til at være en fordel ved at stoppe alfa-1-blokkerbehandlingen før operation for grå stær.
Karcinogenese, mutagenese, svækkelse af fertilitet
Intet karcinogent potentiale blev påvist i et 18 måneders studie med rotter med MINIPRESS 1 mg ved dosisniveauer mere end 225 gange den sædvanlige maksimale anbefalede humane dosis på 20 mg dagligt. MINIPRESS 2mg var ikke mutagent i in vivo genetiske toksikologiske undersøgelser. I en undersøgelse af fertilitet og generel reproduktionsevne hos rotter, viste både hanner og hunner, behandlet med 75 mg/kg (225 gange den sædvanlige maksimale anbefalede humane dosis), nedsat fertilitet, mens de behandlede med 25 mg/kg (75 gange den sædvanlige) maksimal anbefalet human dosis) ikke.
kroniske undersøgelser (et år eller mere) af MINIPRESS hos rotter og hunde forekom testikelforandringer bestående af atrofi og nekrose ved 25 mg/kg/dag (75 gange den sædvanlige maksimale anbefalede humane dosis). Ingen testikelforandringer blev set hos rotter eller hunde ved 10 mg/kg/dag (30 gange den sædvanlige maksimale anbefalede humane dosis). I lyset af de testikelforandringer, der blev observeret hos dyr, blev 105 patienter i langtidsbehandling med MINIPRESS overvåget for 17-ketosteroidudskillelse, og der blev ikke observeret nogen ændringer, der indikerer en lægemiddeleffekt. Derudover havde 27 mænd på MINIPRESS 1 mg i op til 51 måneder ikke ændringer i sædmorfologi, der tyder på lægemiddeleffekt.
Brug under graviditet
Graviditetskategori C. MINIPRESS 1mg har vist sig at være forbundet med nedsat kuldstørrelse ved fødslen, 1, 4 og 21 dage gamle hos rotter, når de gives doser mere end 225 gange den sædvanlige maksimale anbefalede humane dosis. Der blev ikke observeret tegn på lægemiddelrelaterede ydre, viscerale eller skeletfetale abnormiteter. Der blev ikke observeret lægemiddelrelaterede ydre, viscerale eller skeletabnormaliteter hos fostre af gravide kaniner og gravide aber ved doser mere end henholdsvis 225 gange og 12 gange den sædvanlige maksimale anbefalede humane dosis.
Brugen af prazosin og en betablokker til kontrol af svær hypertension hos 44 gravide kvinder afslørede ingen lægemiddelrelaterede føtale abnormiteter eller bivirkninger. Behandling med prazosin blev fortsat i så længe som 14 uger.1
Prazosin er også blevet brugt alene eller i kombination med andre hypotensive midler ved svær hypertension af graviditeten af andre forskere. Der er ikke rapporteret føtale eller neonatale abnormiteter ved brug af prazosin.2
Der er ingen tilstrækkelige og velkontrollerede undersøgelser, der fastslår sikkerheden af MINIPRESS hos gravide kvinder. MINIPRESS bør kun anvendes under graviditet, hvis den potentielle fordel opvejer den potentielle risiko for moderen og fosteret.
Ammende mødre
MINIPRESS 1mg har vist sig at blive udskilt i små mængder i modermælk. Der skal udvises forsigtighed, når MINIPRESS 2 mg administreres til en ammende kvinde.
Brug hos børn
Sikkerhed og effektivitet hos børn er ikke blevet fastslået.
REFERENCER
1. Lubbe, WF og Hodge, JV: New Zealand Med J, 94 (691) 169-172, 1981.
2. Davey, DA, og Dommisse, J: SA Med J, 4. oktober, 1980 (551-556).
OVERDOSIS
Utilsigtet indtagelse af mindst 50 mg MINIPRESS hos et to-årigt barn resulterede i dyb døsighed og nedtrykte reflekser. Der blev ikke noteret noget fald i blodtrykket. Genopretningen var begivenhedsløs.
Skulle overdosering føre til hypotension, er støtte af det kardiovaskulære system af første vigtighed. Genoprettelse af blodtryk og normalisering af hjertefrekvens kan opnås ved at holde patienten i liggende stilling. Hvis denne foranstaltning er utilstrækkelig, bør stød først behandles med volumenudvidere. Om nødvendigt bør vasopressorer derefter anvendes. Nyrefunktionen bør overvåges og understøttes efter behov. Laboratoriedata indikerer, at MINIPRESS ikke kan dialyseres, fordi det er proteinbundet.
KONTRAINDIKATIONER
MINIPRESS er kontraindiceret til patienter med kendt følsomhed over for quinazoliner, prazosin eller nogen af de inaktive ingredienser.
KLINISK FARMAKOLOGI
Den nøjagtige mekanisme for den hypotensive virkning af prazosin er ukendt. Prazosin forårsager et fald i total perifer modstand og blev oprindeligt antaget at have en direkte afslappende virkning på vaskulær glat muskulatur. Nylige dyreforsøg har imidlertid antydet, at den vasodilatoriske virkning af prazosin også er relateret til blokade af postsynaptiske alfa-adrenoceptorer. Resultaterne af hundeforbenseksperimenter viser, at den perifere vasodilatoriske virkning af prazosin hovedsageligt er begrænset til niveauet af modstandskarrene (arterioler). I modsætning til konventionelle alfablokkere er den antihypertensive virkning af prazosin normalt ikke ledsaget af reflekstakykardi. Tolerance er ikke blevet observeret at udvikle sig ved langtidsbehandling.
Hæmodynamiske undersøgelser er blevet udført hos mennesker efter akut enkeltdosisadministration og i løbet af langvarig vedligeholdelsesbehandling. Resultaterne bekræfter, at den terapeutiske effekt er et fald i blodtrykket, der ikke er ledsaget af en klinisk signifikant ændring i hjertevolumen, hjertefrekvens, renal blodgennemstrømning og glomerulær filtrationshastighed. Der er ingen målbar negativ kronotrop effekt.
I kliniske undersøgelser til dato har prazosinhydrochlorid ikke øget plasmareninaktivitet.
Hos mennesker sænkes blodtrykket i både liggende og stående stilling. Denne effekt er mest udtalt på det diastoliske blodtryk.
Efter oral administration når humane plasmakoncentrationer et højdepunkt efter ca. tre timer med en plasmahalveringstid på to til tre timer. Lægemidlet er stærkt bundet til plasmaprotein. Biotilgængelighedsundersøgelser har vist, at den totale absorption i forhold til lægemidlet i en 20 % alkoholisk opløsning er 90 %, hvilket resulterer i maksimale niveauer på ca. 65 % af stoffet i opløsning. Dyreforsøg indikerer, at prazosinhydrochlorid metaboliseres i vid udstrækning, primært ved demethylering og konjugering, og udskilles hovedsageligt via galde og fæces. Mindre omfattende menneskelige undersøgelser tyder på lignende metabolisme og udskillelse hos mennesker.
I kliniske undersøgelser, hvor lipidprofiler blev fulgt, var der generelt ingen uønskede ændringer mellem lipidniveauer før og efter behandling.
PATIENTOPLYSNINGER
Svimmelhed eller døsighed kan forekomme efter den første dosis af denne medicin. Undgå at køre bil eller udføre farlige opgaver i de første 24 timer efter indtagelse af denne medicin, eller når dosis øges. Svimmelhed, svimmelhed eller besvimelse kan forekomme, især når man rejser sig fra en liggende eller siddende stilling. At rejse sig langsomt op kan hjælpe med at mindske problemet. Disse effekter kan også opstå, hvis du drikker alkohol, står i længere tid, træner, eller hvis vejret er varmt. Mens du tager MINIPRESS, skal du være forsigtig med mængden af alkohol, du drikker. Vær også ekstra forsigtig under træning eller varmt vejr, eller hvis du står i lange perioder. Spørg din læge, hvis du har spørgsmål.
