Catapres 100mcg Clonidine Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Catapres, og hvordan bruges det?
Catapres er en receptpligtig medicin, der bruges til at behandle symptomer for højt blodtryk, ADHD og kræftsmerter. Catapres 100mcg kan bruges alene eller sammen med anden medicin.
Catapres 100mcg tilhører en klasse af lægemidler kaldet Alpha2-agonister, centralt virkende, ADHD-midler.
Det vides ikke, om Catapres 100mcg er sikkert og effektivt til børn under 12 år.
Hvad er de mulige bivirkninger af Catapres?
Catapres kan forårsage alvorlige bivirkninger, herunder:
- Abstinenssymptomer,
- nervøsitet,
- agitation,
- hovedpine,
- rysten, og
- hurtig stigning i blodtrykket
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Catapres 100mcg omfatter:
- tør mund,
- svimmelhed,
- døsighed,
- træthed,
- forstoppelse,
- hovedpine,
- kvalme, og
- søvnbesvær (søvnløshed)
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Catapres. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
Catapres® (clonidinhydrochlorid, USP) er et centralt virkende alfa-agonist hypotensivt middel tilgængeligt som tabletter til oral administration i tre doseringsstyrker: 0,1 mg, 0,2 mg og 0,3 mg. 0,1 mg tabletten svarer til 0,087 mg af den frie base.
De inaktive ingredienser er kolloid siliciumdioxid, majsstivelse, dibasisk calciumphosphat, FD&C Yellow No. 6, gelatine, glycerin, lactose og magnesiumstearat. Catapres 0,1 mg tabletten indeholder også FD&C Blue No.1 og FD&C Red No.3.
Clonidinhydrochlorid er et imidazolinderivat og eksisterer som en mesomer forbindelse. Det kemiske navn er 2-(2,6-dichlorphenylamino)-2-imidazolinhydrochlorid. Følgende er strukturformlen:
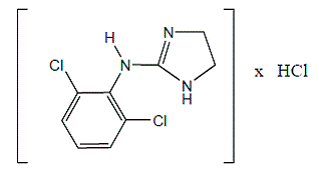 C9H9Cl2N3 · HCl Mol. Wt. 266,56
C9H9Cl2N3 · HCl Mol. Wt. 266,56 Clonidinhydrochlorid er et lugtfrit, bittert, hvidt, krystallinsk stof, der er opløseligt i vand og alkohol.
INDIKATIONER
CATAPRES tabletter er indiceret til behandling af hypertension. CATAPRES tabletter kan anvendes alene eller sammen med andre antihypertensiva.
DOSERING OG ADMINISTRATION
Voksne
Dosis af Catapres® (clonidinhydrochlorid, USP) tabletter skal justeres i henhold til patientens individuelle blodtryksrespons. Det følgende er en generel vejledning til administrationen.
Startdosis
0,1 mg tablet to gange dagligt (morgen og sengetid). Ældre patienter kan have gavn af en lavere startdosis.
Vedligeholdelsesdosis
Yderligere stigninger på 0,1 mg pr. dag kan foretages med ugentlige intervaller, hvis det er nødvendigt, indtil det ønskede respons er opnået. Indtagelse af den største del af den orale daglige dosis ved sengetid kan minimere forbigående tilpasningseffekter af mundtørhed og døsighed. De mest almindeligt anvendte terapeutiske doser har varieret fra 0,2 mg til 0,6 mg pr. dag givet i opdelte doser. Undersøgelser har vist, at 2,4 mg er den maksimale effektive daglige dosis, men så høje doser som dette er sjældent blevet anvendt.
Nedsat nyrefunktion
Patienter med nedsat nyrefunktion kan have gavn af en lavere startdosis. Patienter bør overvåges nøje. Da kun en minimal mængde clonidin fjernes under rutinehæmodialyse, er det ikke nødvendigt at give supplerende clonidin efter dialyse.
HVORDAN LEVERET
Catapres® (clonidinhydrochlorid, USP) tabletter leveres som følger:
Opbevares ved 25°C (77°F); udflugter tilladt til 15°-30°C (59°-86°F) [se USP kontrolleret rumtemperatur ].
Dispenser i tæt, lysbestandig beholder.
Distribueret af: Boehringer Ingelheim Pharmaceuticals, Inc., Ridgefield, CT 06877 USA. Fremstillet af: Boehringer Ingelheim Promeco SA de CV, Mexico City, Mexico. Licenseret fra: Boehringer Ingelheim, International GmbH, Adresser medicinske forespørgsler til: (800) 542-6257 eller (800) 459-9906. Revideret: maj 2012
BIVIRKNINGER
De fleste bivirkninger er milde og har tendens til at aftage ved fortsat behandling. De hyppigste (som ser ud til at være dosis-relaterede) er mundtørhed, der forekommer hos omkring 40 ud af 100 patienter; døsighed, omkring 33 ud af 100; svimmelhed, omkring 16 ud af 100; forstoppelse og sedation, hver omkring 10 ud af 100.
Følgende mindre hyppige bivirkninger er også blevet rapporteret hos patienter, der fik CATAPRES 100 mcg tabletter, men i mange tilfælde fik patienterne samtidig medicin, og en årsagssammenhæng er ikke blevet fastslået.
Kroppen som helhed: Træthed, feber, hovedpine, bleghed, svaghed og abstinenssyndrom. Der blev også rapporteret en svagt positiv Coombs' test og øget følsomhed over for alkohol.
Kardiovaskulær: Bradykardi, kongestiv hjertesvigt, elektrokardiografiske abnormiteter (dvs. sinusknudestop, junctional bradykardi, høj grad af AV-blokering og arytmier), ortostatiske symptomer, hjertebanken, Raynauds fænomen, synkope og takykardi. Der er rapporteret tilfælde af sinusbradykardi og atrioventrikulær blokering, både med og uden brug af samtidig digitalis.
Centralnervesystemet: Agitation, angst, delirium, vrangforestillinger, hallucinationer (herunder visuelle og auditive), søvnløshed, mental depression, nervøsitet, andre adfærdsændringer, paræstesi, rastløshed, søvnforstyrrelser og livlige drømme eller mareridt.
Dermatologisk: Alopeci, angioneurotisk ødem, nældefeber, kløe, udslæt og nældefeber.
Gastrointestinale: Mavesmerter, anoreksi, obstipation, hepatitis, utilpashed, milde forbigående abnormiteter i leverfunktionsprøver, kvalme, parotitis, pseudo-obstruktion (herunder colon-pseudo-obstruktion), spytkirtelsmerter og opkastning.
Genitourinære: Nedsat seksuel aktivitet, besvær med vandladning, erektil dysfunktion, tab af libido, nocturi og urinretention.
Hæmatologisk: Trombocytopeni.
Metabolisk: Gynækomasti, forbigående forhøjelse af blodsukker eller serum kreatinfosfokinase og vægtøgning.
Muskuloskeletale: Benkramper og muskel- eller ledsmerter.
Oro-otolaryngeal: Tørhed af næseslimhinden.
Oftalmologisk: Akkommodationsforstyrrelse, sløret syn, brændende øjne, nedsat tåreflåd og tørre øjne.
DRUGSINTERAKTIONER
Clonidin kan forstærke de CNS-depressive virkninger af alkohol, barbiturater eller andre beroligende stoffer. Hvis en patient, der får clonidinhydrochlorid, også tager tricykliske antidepressiva, kan den hypotensive virkning af clonidin blive reduceret, hvilket nødvendiggør en stigning i clonidindosis. Hvis en patient, der får clonidin, også tager neuroleptika, kan ortostatiske reguleringsforstyrrelser (f.eks. ortostatisk hypotension, svimmelhed, træthed) induceres eller forværres.
Overvåg hjertefrekvens hos patienter, der får clonidin samtidig med midler, der vides at påvirke sinusknudefunktionen eller AV-knudeoverledningen, f.eks. digitalis, calciumkanalblokkere og betablokkere. Sinusbradykardi, der resulterer i hospitalsindlæggelse og pacemakerindsættelse, er blevet rapporteret i forbindelse med brug af clonidin samtidig med diltiazem eller verapamil.
Amitriptylin i kombination med clonidin øger manifestationen af hornhindelæsioner hos rotter (se Toksikologi ).
Baseret på observationer hos patienter i en tilstand af alkoholisk delirium er det blevet foreslået, at høje intravenøse doser af clonidin kan øge det arytmogene potentiale (QT-forlængelse, ventrikulær fibrillering) af høje intravenøse doser af haloperidol. Årsagssammenhæng og relevans for clonidin orale tabletter er ikke fastlagt.
ADVARSLER
Tilbagetrækning
Patienter bør instrueres i ikke at afbryde behandlingen uden at konsultere deres læge. Pludselig ophør af clonidinbehandling har i nogle tilfælde resulteret i symptomer som nervøsitet, agitation, hovedpine og tremor ledsaget eller efterfulgt af en hurtig stigning i blodtrykket og forhøjede katekolaminkoncentrationer i plasma. Sandsynligheden for sådanne reaktioner ved seponering af clonidinbehandling ser ud til at være større efter administration af højere doser eller fortsættelse af samtidig behandling med betablokker, og særlig forsigtighed tilrådes derfor i disse situationer. Sjældne tilfælde af hypertensiv encefalopati, cerebrovaskulære ulykker og død er blevet rapporteret efter seponering af clonidin. Når behandlingen med CATAPRES-tabletter afbrydes, bør lægen reducere dosis gradvist over 2 til 4 dage for at undgå abstinenssymptomatologi.
En overdreven stigning i blodtrykket efter seponering af behandlingen med CATAPRES 100 mcg tabletter kan vendes ved administration af oral clonidinhydrochlorid eller ved intravenøs phentolamin. Hvis behandlingen skal seponeres hos patienter, der får en betablokker og clonidin samtidigt, skal betablokkeren seponeres flere dage før den gradvise seponering af CATAPRES 100 mcg tabletter.
Fordi børn ofte har mave-tarm-sygdomme, der fører til opkastning, kan de være særligt modtagelige for hypertensive episoder som følge af pludselig manglende evne til at tage medicin.
FORHOLDSREGLER
Generel
Hos patienter, som har udviklet lokal kontaktsensibilisering over for Catapres-TTS® (clonidin), kan fortsættelse af Catapres-TTS eller substitution af oral clonidinhydrochloridbehandling være forbundet med udviklingen af et generaliseret hududslæt.
Hos patienter, som udvikler en allergisk reaktion over for Catapres-TTS, kan substitution af oral clonidinhydrochlorid også fremkalde en allergisk reaktion (herunder generaliseret udslæt, nældefeber eller angioødem).
Den sympatolytiske virkning af clonidin kan forværre sinusknudedysfunktion og atrioventrikulær (AV) blokering, især hos patienter, der tager andre sympatolytiske lægemidler. Der er post-marketing rapporter om patienter med overledningsforstyrrelser og/eller tager andre sympatolytiske lægemidler, som udviklede svær bradykardi, der krævede IV atropin, IV isoproterenol og midlertidig hjertestimulering, mens de tog clonidin.
Ved hypertension forårsaget af fæokromocytom kan der ikke forventes nogen terapeutisk effekt af CATAPRES 100mcg tabletter.
Perioperativ brug
Administration af Catapres® (clonidinhydrochlorid, USP) tabletter skal fortsættes til inden for 4 timer efter operationen og genoptages hurtigst muligt derefter. Blodtrykket bør overvåges omhyggeligt under operationen, og yderligere foranstaltninger til at kontrollere blodtrykket bør være tilgængelige, hvis det er nødvendigt.
Karcinogenese, mutagenese, svækkelse af fertilitet
Kronisk diætadministration af clonidin var ikke kræftfremkaldende for henholdsvis rotter (132 uger) eller mus (78 uger) doseret med op til 46 eller 70 gange den maksimale anbefalede daglige dosis til mennesker som mg/kg (9 eller 6 gange MRDHD på en mg/m² basis). Der var ingen tegn på genotoksicitet i Ames-testen for mutagenicitet eller musens mikronukleustest for klastogenicitet.
Fertiliteten hos han- eller hunrotter var upåvirket af clonidindoser så høje som 150 μg/kg (ca. 3 gange MRDHD). I et separat eksperiment så fertiliteten hos hunrotter ud til at være påvirket ved dosisniveauer på 500 til 2000 μg/kg (10 til 40 gange den orale MRDHD på mg/kg basis; 2 til 8 gange MRDHD på en mg/m² basis ).
Graviditet
Teratogene virkninger
Graviditetskategori C
Reproduktionsundersøgelser udført på kaniner i doser op til ca. 3 gange den orale maksimale anbefalede daglige humane dosis (MRDHD) af Catapres® (clonidinhydrochlorid, USP)-tabletter gav ingen tegn på teratogent eller embryotoksisk potentiale hos kaniner. Hos rotter var doser så lave som 1/3 af den orale MRDHD (1/15 MRDHD på mg/m²-basis) af clonidin imidlertid forbundet med øgede resorptioner i en undersøgelse, hvor moderdyrene blev behandlet kontinuerligt fra 2 måneder før parring . Øgede resorptioner var ikke forbundet med behandling på samme tid eller ved højere dosisniveauer (op til 3 gange den orale MRDHD), når moderdyrene blev behandlet på drægtighedsdage 6 til 15. Forøgelser i resorption blev observeret ved meget højere dosisniveauer (40 gange oral MRDHD på mg/kg-basis; 4 til 8 gange MRDHD på mg/m²-basis) hos mus og rotter behandlet på drægtighedsdage 1 til 14 (laveste dosis anvendt i undersøgelsen var 500 μg/kg).
Der er ikke udført tilstrækkelige, velkontrollerede undersøgelser af gravide kvinder. Clonidin krydser placentabarrieren (se KLINISK FARMAKOLOGI , Farmakokinetik ). Da reproduktionsstudier på dyr ikke altid forudsiger human respons, bør dette lægemiddel kun anvendes under graviditet, hvis det er klart nødvendigt.
Ammende mødre
Da clonidinhydrochlorid udskilles i modermælk, bør der udvises forsigtighed, når CATAPRES 100 mcg tabletter administreres til en ammende kvinde.
Pædiatrisk brug
Sikkerhed og effektivitet hos pædiatriske patienter er ikke blevet fastslået i tilstrækkelige og velkontrollerede forsøg (se ADVARSLER , Tilbagetrækning ).
OVERDOSIS
Hypertension kan udvikle sig tidligt og kan efterfølges af hypotension, bradykardi, respirationsdepression, hypotermi, døsighed, nedsatte eller manglende reflekser, svaghed, irritabilitet og miose. Hyppigheden af CNS-depression kan være højere hos børn end hos voksne. Store overdoser kan resultere i reversible hjerteledningsdefekter eller dysrytmier, apnø, koma og kramper. Tegn og symptomer på overdosering opstår generelt inden for 30 minutter til to timer efter eksponering. Så lidt som 0,1 mg clonidin har givet tegn på toksicitet hos børn.
Der er ingen specifik modgift mod overdosering af clonidin. Overdosering af clonidin kan resultere i hurtig udvikling af CNS-depression; derfor anbefales fremkaldelse af opkastning med ipecac sirup ikke. Maveskylning kan være indiceret efter nylige og/eller store indtagelser. Administration af aktivt kul og/eller et kathartisk middel kan være gavnligt. Støttende behandling kan omfatte atropinsulfat til bradykardi, intravenøse væsker og/eller vasopressormidler til hypotension og vasodilatorer til hypertension. Naloxon kan være et nyttigt supplement til behandling af clonidin-induceret respirationsdepression, hypotension og/eller koma; Blodtrykket bør overvåges, da administration af naloxon lejlighedsvis har resulteret i paradoksal hypertension. Det er ikke sandsynligt, at dialyse signifikant øger elimineringen af clonidin.
Den hidtil største overdosis involverede en 28-årig mand, der indtog 100 mg clonidinhydrochloridpulver. Denne patient udviklede hypertension efterfulgt af hypotension, bradykardi, apnø, hallucinationer, semikom og for tidlige ventrikulære kontraktioner. Patienten kom sig fuldt ud efter intensiv behandling. Plasmaklonidinniveauer var 60 ng/ml efter 1 time, 190 ng/ml efter 1,5 timer, 370 ng/ml efter 2 timer og 120 ng/ml efter 5,5 og 6,5 timer. Hos mus og rotter er den orale LD50 af clonidin henholdsvis 206 og 465 mg/kg.
KONTRAINDIKATIONER
Catapres® (clonidinhydrochlorid, USP) tabletter bør ikke anvendes til patienter med kendt overfølsomhed over for clonidin (se FORHOLDSREGLER ).
KLINISK FARMAKOLOGI
Clonidin stimulerer alfa-adrenoreceptorer i hjernestammen. Denne handling resulterer i reduceret sympatisk udstrømning fra centralnervesystemet og i fald i perifer modstand, renal vaskulær modstand, hjertefrekvens og blodtryk. CATAPRES 100mcg tabletter virker relativt hurtigt. Patientens blodtryk falder inden for 30 til 60 minutter efter en oral dosis, det maksimale fald sker inden for 2 til 4 timer. Renal blodgennemstrømning og glomerulær filtrationshastighed forbliver i det væsentlige uændret. Normale posturale reflekser er intakte; derfor er ortostatiske symptomer milde og sjældne.
Akutte undersøgelser med clonidinhydrochlorid hos mennesker har vist en moderat reduktion (15 % til 20 %) af hjertevolumen i liggende stilling uden ændring i den perifere modstand: ved en 45° hældning er der en mindre reduktion i hjertevolumen og et fald. af perifer modstand. Under langtidsbehandling har hjertets output en tendens til at vende tilbage til kontrolværdier, mens den perifere modstand forbliver nedsat. Nedsættelse af pulsfrekvensen er blevet observeret hos de fleste patienter, der fik clonidin, men lægemidlet ændrer ikke normalt hæmodynamisk respons på træning.
Tolerance over for den antihypertensive effekt kan udvikles hos nogle patienter, hvilket nødvendiggør en revurdering af behandlingen.
Andre undersøgelser af patienter har vist en reduktion i plasmareninaktivitet og i udskillelsen af aldosteron og katekolaminer. Det nøjagtige forhold mellem disse farmakologiske virkninger og den antihypertensive virkning af clonidin er ikke blevet fuldstændig belyst.
Clonidin stimulerer akut væksthormonfrigivelse hos både børn og voksne, men producerer ikke en kronisk forhøjelse af væksthormon ved længere tids brug.
Farmakokinetik
Clonidins farmakokinetik er dosisproportional i intervallet 100 til 600 μg. Den absolutte biotilgængelighed af clonidin ved oral administration er 70% til 80%. Maksimal plasma clonidin niveauer nås i løbet af ca. 1 til 3 timer.
Efter intravenøs administration udviser clonidin bifasisk disposition med en distributionshalveringstid på ca. 20 minutter og en eliminationshalveringstid på 12 til 16 timer. Halveringstiden øges op til 41 timer hos patienter med alvorlig nedsat nyrefunktion. Clonidin krydser placentabarrieren. Det har vist sig at krydse blod-hjerne-barrieren hos rotter.
Efter oral administration genfindes ca. 40 % til 60 % af den absorberede dosis i urinen som uændret lægemiddel i løbet af 24 timer. Omkring 50 % af den absorberede dosis metaboliseres i leveren. Hverken mad eller patientens race påvirker clonidins farmakokinetik.
Den antihypertensive effekt opnås ved plasmakoncentrationer mellem ca. 0,2 og 2,0 ng/ml hos patienter med normal udskillelsesfunktion. En yderligere stigning i plasmaniveauerne vil ikke forstærke den antihypertensive effekt.
Toksikologi
I flere undersøgelser med oralt clonidinhydrochlorid blev der set en dosisafhængig stigning i forekomsten og sværhedsgraden af spontan nethindegeneration hos albinorotter behandlet i seks måneder eller længere. Vævsfordelingsundersøgelser hos hunde og aber viste en koncentration af clonidin i årehinden.
lyset af den retinale degeneration, der ses hos rotter, blev øjenundersøgelser udført under kliniske forsøg hos 908 patienter før og periodisk efter påbegyndelse af clonidinbehandling. Hos 353 af disse 908 patienter blev øjenundersøgelserne udført over perioder på 24 måneder eller længere. Bortset fra en vis tørhed i øjnene blev der ikke registreret lægemiddelrelaterede unormale oftalmologiske fund, og ifølge specialiserede tests såsom elektroretinografi og makulær blændelse var nethindens funktion uændret.
I kombination med amitriptylin førte administration af clonidinhydrochlorid til udvikling af hornhindelæsioner hos rotter inden for 5 dage.
PATIENTOPLYSNINGER
Patienter skal advares mod at afbryde behandlingen med CATAPRES 100mcg tabletter uden deres læges råd.
Da patienter kan opleve en mulig beroligende effekt, svimmelhed eller akkommodationsforstyrrelse ved brug af clonidin, skal patienterne være forsigtige med at deltage i aktiviteter såsom at køre bil eller betjene apparater eller maskiner. Informer også patienterne om, at denne beroligende effekt kan øges ved samtidig brug af alkohol, barbiturater eller andre beroligende stoffer.
Patienter, der bruger kontaktlinser, skal advares om, at behandling med CATAPRES-tabletter kan forårsage tørre øjne.
