Hyzaar 12.5mg Hydrochlorothiazide Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Hyzaar, og hvordan bruges det?
Hyzaar 12,5mg er en receptpligtig medicin, der bruges til at behandle symptomerne på forhøjet blodtryk (hypertension). Hyzaar kan bruges alene eller sammen med anden medicin.
Hyzaar tilhører en klasse af lægemidler kaldet ARB/HCTZ Combos.
Det vides ikke, om Hyzaar er sikkert og effektivt til børn.
Hvad er de mulige bivirkninger af Hyzaar 12,5 mg?
Hyzaar kan forårsage alvorlige bivirkninger, herunder:
- svimmelhed,
- uregelmæssige hjerteslag,
- øjensmerter,
- synsproblemer,
- lidt eller ingen vandladning,
- hurtig vægtøgning,
- hævelse i dine hænder, fødder eller ankler,
- ledsmerter,
- hududslæt på dine kinder eller arme, der forværres i sollys,
- øget tørst,
- øget vandladning,
- forvirring,
- opkastning,
- forstoppelse,
- muskelsmerter,
- kramper i benene,
- svær svaghed,
- følelsesløshed eller prikken,
- tab af bevægelse, og
- føler sig nervøs eller ustabil
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Hyzaar omfatter:
- svimmelhed,
- rygsmerter, og
- forkølelsessymptomer (tilstoppet næse, nysen, ondt i halsen)
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Hyzaar. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
FØTALT TOKSICITET
Når graviditet opdages, afbrydes HYZAAR så hurtigt som muligt. Lægemidler, der virker direkte på renin-angiotensin-systemet, kan forårsage skade og død på fosteret under udvikling [se ADVARSLER OG FORHOLDSREGLER ].
BESKRIVELSE
HYZAAR 50/12.5 (losartan kalium-hydrochlorthiazid), HYZAAR 100/12.5 (losartan kaliumhydrochlorthiazid) og HYZAAR 100/25 (losartan kalium-hydrochlorthiazid) tabletter kombinerer en angiotensin II receptor, der virker på receptoren, subtype AT1, hydrochlorothiazid, hydrochlorothiazid-receptorblokker og receptor-subtype receptorblokker.
Losartan-kalium, et ikke-peptidmolekyle, er kemisk beskrevet som 2-butyl-4-chlor-1-[p-(o-1H-tetrazol-5-ylphenyl)benzyl]imidazol-5-methanolmonokaliumsalt. Dens empiriske formel er C22H22ClKN6O, og dens strukturformel er:
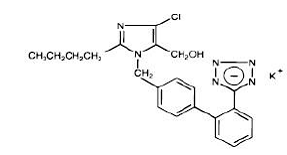
Losartan kalium er et hvidt til råhvidt fritflydende krystallinsk pulver med en molekylvægt på 461,01. Det er frit opløseligt i vand, opløseligt i alkoholer og let opløseligt i almindelige organiske opløsningsmidler, såsom acetonitril og methylethylketon.
Oxidation af 5-hydroxymethylgruppen på imidazolringen resulterer i den aktive metabolit af losartan.
Hydrochlorthiazid er 6-chlor-3,4-dihydro-2H-1,2,4-benzothiadiazin-7-sulfonamid-1,1-dioxid. Dens empiriske formel er C7H8ClN3O4S2 og dens strukturformel er:
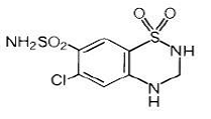
Hydrochlorthiazid er et hvidt eller praktisk talt hvidt krystallinsk pulver med en molekylvægt på 297,74, som er let opløseligt i vand, men let opløseligt i natriumhydroxidopløsning.
HYZAAR er tilgængelig til oral administration i tre tabletkombinationer af losartan og hydrochlorthiazid. HYZAAR 50/12,5 indeholder 50 mg losartankalium og 12,5 mg hydrochlorthiazid. HYZAAR 100/12,5 indeholder 100 mg losartankalium og 12,5 mg hydrochlorthiazid. HYZAAR 100/25 indeholder 100 mg losartankalium og 25 mg hydrochlorthiazid. Inaktive ingredienser er mikrokrystallinsk cellulose, vandholdig laktose, prægelatineret stivelse, magnesiumstearat, hydroxypropylcellulose, hypromellose og titaniumdioxid.
HYZAAR 50/12.5 og HYZAAR 100/25 indeholder også D&C gul nr. 10 aluminiumssø. HYZAAR 50/12.5, HYZAAR 100/12.5 og HYZAAR 100/25 kan også indeholde carnaubavoks.
HYZAAR 50/12,5 indeholder 4,24 mg (0,108 mEq) kalium, HYZAAR 100/12,5 indeholder 8,48 mg (0,216 mEq) kalium, og HYZAAR 100/25 indeholder 8,48 mg (0,216 mEq) kalium.
INDIKATIONER
Forhøjet blodtryk
HYZAAR® er indiceret til behandling af hypertension for at sænke blodtrykket. Sænkning af blodtrykket sænker risikoen for fatale og ikke-dødelige kardiovaskulære (CV) hændelser, primært slagtilfælde og myokardieinfarkt. Disse fordele er set i kontrollerede forsøg med antihypertensiva fra en lang række farmakologiske klasser, herunder losartan og hydrochlorthiazid.
Kontrol af forhøjet blodtryk bør være en del af omfattende kardiovaskulær risikostyring, herunder, hvor det er relevant, lipidkontrol, diabetesbehandling, antitrombotisk behandling, rygestop, motion og begrænset natriumindtag. Mange patienter vil kræve mere end 1 lægemiddel for at nå blodtryksmålene. For specifik rådgivning om mål og ledelse, se offentliggjorte retningslinjer, såsom dem fra National High Blood Pressure Education Programs Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC).
Talrige antihypertensiva, fra en række farmakologiske klasser og med forskellige virkningsmekanismer, er i randomiserede kontrollerede forsøg blevet vist at reducere kardiovaskulær morbiditet og dødelighed, og det kan konkluderes, at det er blodtryksreduktion og ikke en anden farmakologisk egenskab ved stofferne, der i høj grad er ansvarlige for disse fordele. Den største og mest konsistente kardiovaskulære udfaldsfordel har været en reduktion i risikoen for slagtilfælde, men reduktioner i myokardieinfarkt og kardiovaskulær dødelighed er også set regelmæssigt.
Forhøjet systolisk eller diastolisk tryk forårsager øget kardiovaskulær risiko, og den absolutte risikostigning pr. mmHg er større ved højere blodtryk, så selv beskedne reduktioner af svær hypertension kan give væsentlige fordele. Relativ risikoreduktion fra blodtryksreduktion er ens på tværs af populationer med varierende absolut risiko, så den absolutte fordel er større hos patienter, der er i højere risiko uafhængigt af deres hypertension (f.eks. patienter med diabetes eller hyperlipidæmi), og sådanne patienter kan forventes at drage fordel af mere aggressiv behandling til et lavere blodtryksmål.
Nogle antihypertensiva har mindre blodtrykseffekter (som monoterapi) hos sorte patienter, og mange antihypertensiva har yderligere godkendte indikationer og virkninger (f.eks. på angina, hjertesvigt eller diabetisk nyresygdom). Disse overvejelser kan styre valg af terapi.
Denne faste dosiskombination er ikke indiceret til initial behandling af hypertension, undtagen når hypertensionen er alvorlig nok til, at værdien af at opnå hurtig blodtrykskontrol overstiger risikoen for at påbegynde kombinationsbehandling hos disse patienter [se Kliniske Studier og DOSERING OG ADMINISTRATION ].
HYZAAR kan administreres sammen med andre antihypertensiva.
Hypertensive patienter med venstre ventrikulær hypertrofi
HYZAAR er indiceret til at reducere risikoen for slagtilfælde hos patienter med hypertension og venstre ventrikelhypertrofi, men der er tegn på, at denne fordel ikke gælder for sorte patienter. [Se Brug i specifikke populationer , KLINISK FARMAKOLOGI , og DOSERING OG ADMINISTRATION .]
DOSERING OG ADMINISTRATION
Forhøjet blodtryk
Den sædvanlige startdosis af HYZAAR er 50/12,5 (losartan 50 mg/hydrochlorthiazid 12,5 mg) én gang dagligt. Dosis kan øges efter 3 ugers behandling til maksimalt 100/25 (losartan 100 mg/hydrochlorthiazid 25 mg) én gang dagligt efter behov for at kontrollere blodtrykket [se Kliniske Studier ].
Påbegynd en patient, hvis blodtryk ikke er tilstrækkeligt kontrolleret, med losart en 50 mg monoterapi med HYZAAR 50/12,5 én gang dagligt. Hvis blodtrykket forbliver under kontrol efter ca. 3 ugers behandling, kan dosis øges til to tabletter HYZAAR 50/12,5 én gang dagligt eller én tablet HYZAAR 100/25 én gang dagligt.
Påbegynd en patient, hvis blodtryk ikke er tilstrækkeligt kontrolleret, med losartan 100 mg monoterapi med HYZAAR 100/12,5 (losartan 100 mg/hydrochlorthiazid 12,5 mg) én gang dagligt. Hvis blodtrykket forbliver ukontrolleret efter ca. 3 ugers behandling, øges dosis til to tabletter HYZAAR 50/12,5 én gang dagligt eller én tablet HYZAAR 100/25 én gang dagligt.
Indled en patient, hvis blodtryk er utilstrækkeligt kontrolleret med hydrochlorthiazid 25 mg én gang dagligt, eller er kontrolleret, men som oplever hypokaliæmi med dette regime, med HYZAAR 50/12,5 én gang dagligt, hvorved dosis af hydrochlorthiazid reduceres uden at reducere det samlede forventede antihypertensive respons. Evaluer det kliniske respons på HYZAAR 50/12.5, og hvis blodtrykket forbliver ukontrolleret efter ca. 3 ugers behandling, øges dosis til to tabletter HYZAAR 50/12.5 én gang dagligt eller én tablet HYZAAR 100/25 én gang dagligt.
Hypertensive patienter med venstre ventrikulær hypertrofi
Hos patienter, hvis blodtryk ikke er tilstrækkeligt kontrolleret med 50 mg losartankalium, påbegyndes behandling med HYZAAR 50/12,5. Hvis yderligere blodtryksreduktion er nødvendig, øges dosis til HYZAAR 100/12,5 efterfulgt af HYZAAR 100/25. For yderligere blodtryksreduktion tilsættes andre antihypertensiva [se Kliniske Studier ].
HVORDAN LEVERET
Doseringsformer og styrker
- HYZAAR 50/12.5 er gule, ovale, filmovertrukne tabletter med kode 717 på den ene side.
- HYZAAR 100/12.5 er hvide, ovale, filmovertrukne tabletter med kode 745 på den ene side.
- HYZAAR 100/25 er lysegule, ovale, filmovertrukne tabletter med kode 747 på den ene side.
Opbevaring og håndtering
HYZAAR leveres som en filmovertrukket tablet.
Opbevares ved 25°C (77°F); udflugter tilladt til 15-30°C (59-86°F) [se USP kontrolleret rumtemperatur ]. Hold beholderen tæt lukket. Beskyt mod lys.
Fremstillet for: Organon LLC, et datterselskab af ORGANON & Co., Jersey City, NJ 07302, USA. Revideret: juni 2021
BIVIRKNINGER
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Losartan-kalium-hydrochlorthiazid er blevet evalueret for sikkerhed hos 858 patienter behandlet for essentiel hypertension og 3889 patienter behandlet for hypertension og venstre ventrikelhypertrofi. De fleste bivirkninger har været milde og forbigående og har ikke krævet seponering af behandlingen. I kontrollerede kliniske forsøg var seponering af behandlingen på grund af kliniske bivirkninger påkrævet hos kun 2,8 % og 2,3 % af patienterne behandlet med henholdsvis kombinationen og placebo.
I disse dobbeltblindede kontrollerede kliniske undersøgelser var bivirkninger, der forekom hos mere end 2 % af forsøgspersonerne behandlet med losartan-hydrochlorthiazid og i højere grad end placebo: rygsmerter (2,1 % mod 0,6 %), svimmelhed (5,7 % vs. 2,9 %). og øvre luftvejsinfektion (6,1 % mod 4,6 %).
Følgende yderligere bivirkninger er blevet rapporteret i kliniske forsøg med HYZAAR og/eller de enkelte komponenter:
Blod og lymfesystem lidelser: Anæmi, aplastisk anæmi, hæmolytisk anæmi, leukopeni, agranulocytose.
Metabolisme og ernæringsforstyrrelser: Anoreksi, hyperglykæmi, hyperurikæmi, elektrolyt ubalance, herunder hyponatriæmi og hypokaliæmi.
Psykiatriske lidelser: Søvnløshed, rastløshed.
Forstyrrelser i nervesystemet: Dysgeusi, hovedpine, migræne, paræstesier.
Øjenlidelser: Xanthopsia, forbigående sløret syn.
Hjertelidelser: Hjertebanken, takykardi.
Vaskulære lidelser: Dosisrelaterede ortostatiske virkninger, nekrotiserende angiitis (vaskulitis, kutan vaskulitis).
Åndedræts-, thorax- og mediastinumsygdomme: Tilstoppet næse.
Gastrointestinale lidelser: Dyspepsi, mavesmerter, maveirritation, kramper, kvalme, opkastning, pancreatitis, sialoadenitis.
Lever-galdelidelser: Gulsot (intrahepatisk kolestatisk gulsot).
Hud- og subkutane vævssygdomme: Udslæt, pruritus, purpura, toksisk epidermal nekrolyse, nældefeber, lysfølsomhed, kutan lupus erythematosus.
Sygdomme i bevægeapparatet og bindevæv: Muskelkramper, muskelspasmer.
Nyre- og urinvejslidelser: Glycosuri, nyreinsufficiens, interstitiel nefritis, nyresvigt.
Reproduktionssystem og brystsygdomme: Erektil dysfunktion/impotens.
Generelle lidelser og tilstande på administrationsstedet: Brystsmerter, utilpashed, svaghed.
Undersøgelser: Leverfunktionsabnormiteter.
Hoste
Vedvarende tør hoste har været forbundet med brug af ACE-hæmmere og kan i praksis være en årsag til seponering af ACE-hæmmerbehandling. To prospektive, parallelgruppe, dobbeltblinde, randomiserede, kontrollerede forsøg blev udført for at vurdere virkningen af losartan på forekomsten af hoste hos hypertensive patienter, som havde oplevet hoste, mens de fik ACE-hæmmerbehandling. Patienter, som havde typisk ACE-hæmmer hoste, da de blev udsat for lisinopril, hvis hoste forsvandt på placebo, blev randomiseret til losartan 50 mg, lisinopril 20 mg eller enten placebo (én undersøgelse, n=97) eller 25 mg hydrochlorthiazid (n=135). Den dobbeltblindede behandlingsperiode varede op til 8 uger. Forekomsten af hoste er vist i tabel 1 nedenfor.
Disse undersøgelser viser, at forekomsten af hoste forbundet med losartanbehandling i en population, som alle havde hoste forbundet med behandling med ACE-hæmmere, svarer til den, der er forbundet med hydrochlorthiazid- eller placebobehandling.
Tilfælde af hoste, inklusive positive genudfordringer, er blevet rapporteret efter brug af losartan efter markedsføring.
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af HYZAAR efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt at estimere deres hyppighed pålideligt eller at etablere en årsagssammenhæng til lægemiddeleksponering.
Fordøjelse: Hepatitis er sjældent blevet rapporteret hos patienter behandlet med losartan.
Hæmatologisk: Trombocytopeni.
Overfølsomhed: Angioødem, herunder hævelse af strubehovedet og glottis, der forårsager luftvejsobstruktion og/eller hævelse af ansigt, læber, svælg og/eller tunge er sjældent blevet rapporteret hos patienter behandlet med losartan; nogle af disse patienter har tidligere oplevet angioødem med andre lægemidler, herunder ACE-hæmmere. Vaskulitis, inklusive Henoch-Schönlein purpura, er blevet rapporteret med losartan. Anafylaktiske reaktioner er blevet rapporteret.
Muskuloskeletale: Rhabdomyolyse.
Hud: Erythrodermi.
Ikke-melanom hudkræft: Hydrochlorthiazid er forbundet med en øget risiko for ikke-melanom hudkræft. I en undersøgelse udført i Sentinel System var øget risiko overvejende for planocellulært karcinom (SCC) og hos hvide patienter, der tog store kumulative doser. Den øgede risiko for SCC i den samlede befolkning var ca. 1 ekstra tilfælde pr. 16.000 patienter om året, og for hvide patienter, der tog en kumulativ dosis på ≥50.000 mg, var risikostigningen ca. 1 yderligere SCC-tilfælde for hver 6.700 patienter om året.
DRUGSINTERAKTIONER
Midler, der øger serumkalium
Samtidig administration af losartan og andre lægemidler, der øger serumkaliumniveauet, kan resultere i hyperkaliæmi. Overvåg serumkalium hos sådanne patienter.
Lithium
Der er rapporteret stigninger i serumlithiumkoncentrationer og lithiumtoksicitet ved samtidig brug af angiotensin II-receptorantagonister eller thiaziddiuretika. Overvåg lithiumniveauer hos patienter, der får HYZAAR 12,5 mg og lithium.
Ikke-steroide antiinflammatoriske midler, herunder selektive cyclooxygenase-2-hæmmere
Losartan kalium
Hos ældre patienter, volumendepleterede (inklusive dem i diuretikabehandling) eller med nedsat nyrefunktion, kan samtidig administration af NSAID'er, inklusive selektive COX-2-hæmmere, med angiotensin II-receptorantagonister (inklusive losartan) resultere i forringelse af nyrefunktion, herunder eventuelt akut nyresvigt. Disse virkninger er normalt reversible. Overvåg nyrefunktionen periodisk hos patienter, der får losartan- og NSAID-behandling.
Den antihypertensive virkning af angiotensin II-receptorantagonister, inklusive losartan, kan svækkes af NSAID'er, herunder selektive COX-2-hæmmere.
Hydrochlorthiazid
Administration af et ikke-steroidt antiinflammatorisk middel, herunder en selektiv COX-2-hæmmer, kan reducere de diuretiske, natriuretiske og antihypertensive virkninger af loop-, kaliumbesparende og thiaziddiuretika. Derfor, når HYZAAR og ikke-steroide antiinflammatoriske midler, herunder selektive COX-2-hæmmere anvendes samtidig, skal man observere nøje for at afgøre, om den ønskede effekt af diuretika opnås.
Hos patienter, der får diuretikabehandling, kan samtidig administration af NSAID'er og angiotensinreceptorblokkere, inklusive losartan, resultere i forringelse af nyrefunktionen, inklusive mulig akut nyresvigt. Disse virkninger er normalt reversible. Overvåg nyrefunktionen periodisk hos patienter, der får hydrochlorthiazid-, losartan- og NSAID-behandling.
Dobbelt blokade af Renin-Angiotensin System (RAS)
Dobbelt blokade af RAS med angiotensinreceptorblokkere, ACE-hæmmere eller aliskiren er forbundet med øget risiko for hypotension, synkope, hyperkaliæmi og ændringer i nyrefunktionen (inklusive akut nyresvigt) sammenlignet med monoterapi.
Veterans Affairs Nephropathy in Diabetes (VA NEPHRON-D)-forsøg inkluderede 1448 patienter med type 2-diabetes, forhøjet urin-albumin-til-kreatinin-forhold og nedsat estimeret glomerulær filtrationshastighed (GFR 30 til 89,9 mL/min), randomiserede dem til lisinopril eller placebo på baggrund af losartanbehandling og fulgte dem i en median på 2,2 år. Patienter, der fik kombinationen af losartan og lisinopril, opnåede ingen yderligere fordele sammenlignet med monoterapi for det kombinerede endepunkt med fald i GFR, nyresygdom i slutstadiet eller død, men oplevede en øget forekomst af hyperkaliæmi og akut nyreskade sammenlignet med monoterapien. gruppe.
Overvåg nøje blodtryk, nyrefunktion og elektrolytter hos patienter på HYZAAR 12,5 mg og andre midler, der påvirker RAS.
Giv ikke aliskiren samtidig med HYZAAR 12,5 mg til patienter med diabetes. Undgå brug af aliskiren med HYZAAR 12,5 mg til patienter med nedsat nyrefunktion (GFR
Brugen af hydrochlorthiazid sammen med andre lægemidler
Når de administreres samtidigt, kan følgende lægemidler interagere med thiaziddiuretika [se KLINISK FARMAKOLOGI ]:
Antidiabetika (orale midler og insulin) - dosisjustering af det antidiabetiske lægemiddel kan være påkrævet.
Cholestyramin- og colestipolharpikser - Absorptionen af hydrochlorthiazid er nedsat ved tilstedeværelse af anionbytterharpikser. Enkeltdoser af enten cholestyramin- eller colestipol-harpikser binder hydrochlorthiazidet og reducerer dets absorption fra mave-tarmkanalen med henholdsvis op til 85 og 43 procent.
Fordel doseringen af hydrochlorthiazid og harpiksen, således at hydrochlorthiazid administreres mindst 4 timer før eller 4 til 6 timer efter administration af harpiksen.
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Føtal toksicitet
Brug af lægemidler, der virker på renin-angiotensin-systemet i andet og tredje trimester af graviditeten, reducerer føtal nyrefunktion og øger føtal og neonatal morbiditet og død. Resulterende oligohydramnios kan være forbundet med føtal lungehypoplasi og skeletdeformationer. Potentielle neonatale bivirkninger omfatter kraniehypoplasi, anuri, hypotension, nyresvigt og død. Når graviditet opdages, seponeres HYZAAR 12,5 mg så hurtigt som muligt.
Thiazider krydser placentabarrieren og optræder i navlestrengsblod. Bivirkninger omfatter føtal eller neonatal gulsot, trombocytopeni [se Brug i specifikke populationer ].
Hypotension hos patienter med volumen- eller saltdepletering
Hos patienter med et aktiveret renin-angiotensin-system, såsom volumen- eller saltdepleterede patienter (f.eks. dem, der behandles med høje doser diuretika), kan symptomatisk hypotension forekomme efter påbegyndelse af behandling med HYZAAR. Korriger volumen eller saltmangel før administration af HYZAAR. Brug ikke HYZAAR som initial behandling til patienter med intravaskulær volumendepletering.
Nedsat nyrefunktion
Ændringer i nyrefunktionen, herunder akut nyresvigt, kan være forårsaget af lægemidler, der hæmmer reninangiotensinsystemet, og af diuretika. Patienter, hvis nyrefunktion til dels kan afhænge af aktiviteten af renin-angiotensin-systemet (f.eks. patienter med nyrearteriestenose, kronisk nyresygdom, alvorlig kongestiv hjertesvigt eller volumendepletering) kan have særlig risiko for at udvikle akut nyresvigt HYZAAR. Overvåg nyrefunktionen periodisk hos disse patienter. Overvej at tilbageholde eller afbryde behandlingen hos patienter, som udvikler et klinisk signifikant fald i nyrefunktionen på HYZAAR [se DRUGSINTERAKTIONER og Brug i specifikke populationer ].
Overfølsomhed
Overfølsomhedsreaktioner over for hydrochlorthiazid kan forekomme hos patienter med eller uden en anamnese med allergi eller bronkial astma, men er mere sandsynlige hos patienter med en sådan anamnese.
Elektrolyt og metaboliske effekter
dobbeltblindede kliniske forsøg med forskellige doser af losartankalium og hydrochlorthiazid var forekomsten af hypertensive patienter, der udviklede hypokaliæmi (serumkalium 5,7 mEq/L) var 0,4 % versus 0 % for placebo.
HYZAAR indeholder hydrochlorthiazid, som kan forårsage hypokaliæmi, hyponatriæmi og hypomagnesæmi. Hypomagnesæmi kan resultere i hypokaliæmi, som kan være svær at behandle på trods af kaliumgenopfyldning. HYZAAR 12,5 mg indeholder også losartan, som kan forårsage hyperkaliæmi. Overvåg serumelektrolytter periodisk [se DRUGSINTERAKTIONER ].
Samtidig brug af andre lægemidler, der kan øge serumkalium, kan føre til hyperkaliæmi [se DRUGSINTERAKTIONER ].
Hydrochlorthiazid kan ændre glukosetolerancen og øge serumniveauet af kolesterol og triglycerider.
Hyperurikæmi kan forekomme, eller åbenlys gigt kan udløses hos patienter, der får thiazidbehandling. Fordi losartan nedsætter urinsyren, dæmper losartan i kombination med hydrochlorthiazid den diuretika-inducerede hyperukæmi.
Hydrochlorthiazid nedsætter calciumudskillelsen i urinen og kan forårsage forhøjede serumcalcium. Overvåg calciumniveauer.
Akut nærsynethed og sekundær vinkel-lukkende glaukom
Hydrochlorthiazid, et sulfonamid, kan forårsage en idiosynkratisk reaktion, hvilket resulterer i akut forbigående nærsynethed og akut vinkel-lukkende glaukom. Symptomer omfatter akut indtræden af nedsat synsstyrke eller øjensmerter og opstår typisk inden for timer til uger efter lægemiddelinitiering. Ubehandlet akut vinkel-lukkende glaukom kan føre til permanent synstab. Den primære behandling er at seponere hydrochlorthiazid så hurtigt som muligt. Hurtige medicinske eller kirurgiske behandlinger skal muligvis overvejes, hvis det intraokulære tryk forbliver ukontrolleret. Risikofaktorer for udvikling af akut vinkel-lukkende glaukom kan omfatte en historie med sulfonamid- eller penicillinallergi.
Systemisk Lupus erythematosus
Thiaziddiuretika er blevet rapporteret at forårsage eksacerbation eller aktivering af systemisk lupus erythematosus.
Postsympatektomipatienter
De antihypertensive virkninger af lægemidlet kan forstærkes hos postsympatiktomipatienter.
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( PATIENTOPLYSNINGER ).
Graviditet
Rådgiv kvindelige patienter i den fødedygtige alder om konsekvenserne af eksponering for HYZAAR 12,5 mg under graviditet. Diskuter behandlingsmuligheder med kvinder, der planlægger at blive gravide. Fortæl patienterne om at rapportere graviditeter til deres læger så hurtigt som muligt [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].

Symptomatisk hypotension
Rådgiv patienterne om, at der kan opstå svimmelhed, især i løbet af de første dage af behandlingen, og at rapportere dette symptom til en læge. Informer patienterne om, at dehydrering fra utilstrækkelig væskeindtagelse, overdreven sved, opkastning eller diarré kan føre til et for stort blodtryksfald. Hvis der opstår synkope, skal du råde patienterne til at kontakte deres læge [se ADVARSLER OG FORHOLDSREGLER ].
Kaliumtilskud
Rådgive patienter om ikke at bruge kaliumtilskud eller salterstatninger indeholdende kalium uden at konsultere deres læge [se DRUGSINTERAKTIONER ].
Akut nærsynethed og sekundær vinkel-lukkende glaukom
Rådgiv patienterne om at seponere HYZAAR 12,5 mg og søge øjeblikkelig lægehjælp, hvis de oplever symptomer på akut nærsynethed eller sekundært lukket vinkelglaukom [se ADVARSLER OG FORHOLDSREGLER ].
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Losartan Kalium-Hydrochlorthiazid
Der er ikke udført karcinogenicitetsundersøgelser med losartan-kalium-hydrochlorthiazid-kombinationen.
Losartan-kalium-hydrochlorthiazid var, når det blev testet i et vægtforhold på 4:1, negativt i Ames mikrobiel mutagenese-assay og V-79 kinesisk hamster-lungecelle-mutagenese-assay. Derudover var der ingen tegn på direkte genotoksicitet i in vitro alkalisk elueringsassay i rottehepatocytter og in vitro kromosomafvigelsesassay i kinesisk hamster-ovarieceller ved ikke-cytotoksiske koncentrationer.
Losartankalium, administreret sammen med hydrochlorthiazid, havde ingen effekt på fertiliteten eller parringsadfærden hos hanrotter ved doser op til 135 mg/kg/dag af losartan og 33,75 mg/kg/dag af hydrochlorthiazid. Disse doser har vist sig at give respektive systemiske eksponeringer (AUC'er) for losartan, dets aktive metabolit og hydrochlorthiazid, som er ca. 60, 60 og 30 gange større end dem, der opnås hos mennesker med 100 mg losartankalium i kombination med 25 mg hydrochlorthiazid. Hos hunrotter var samtidig administration af doser så lave som 10 mg/kg/dag losartan og 2,5 mg/kg/dag hydrochlorthiazid imidlertid forbundet med små, men statistisk signifikante fald i frugtbarhed og fertilitetsindeks. AUC-værdier for losartan, dets aktive metabolit og hydrochlorthiazid, ekstrapoleret fra data opnået med losartan administreret til rotter i en dosis på 50 mg/kg/dag i kombination med 12,5 mg/kg/dag hydrochlorthiazid, var ca. 6, 2 og 2 gange større end dem, der opnås hos mennesker med 100 mg losartan i kombination med 25 mg hydrochlorthiazid.
Losartan kalium
Losartankalium var ikke karcinogent, når det blev administreret i maksimalt tolererede doser til rotter og mus i henholdsvis 105 og 92 uger. Hunrotter, der fik den højeste dosis (270 mg/kg/dag), havde en lidt højere forekomst af pancreas acinar adenom. De maksimalt tolererede doser (270 mg/kg/dag hos rotter, 200 mg/kg/dag hos mus) gav systemiske eksponeringer for losartan og dets farmakologisk aktive metabolit, som var ca. 160 og 90 gange (rotter) og 30 og 15 gange (mus) ) eksponeringen af et menneske på 50 kg givet 100 mg pr. dag.
Losartan kalium var negativ i mikrobiel mutagenese og V-79 pattedyrcelle mutagenese assays og i in vitro alkalisk eluering og in vitro og in vivo kromosomafvigelsesanalyser. Derudover viste den aktive metabolit ingen tegn på genotoksicitet i mikrobiel mutagenese, in vitro alkalisk eluering og in vitro kromosomafvigelsesassays.
Fertilitet og reproduktionsevne blev ikke påvirket i studier med hanrotter, der fik orale doser af losartankalium op til ca. 150 mg/kg/dag. Indgivelse af toksiske dosisniveauer hos kvinder (300/200 mg/kg/dag) var forbundet med et signifikant (p
Hydrochlorthiazid
Toårige fodringsundersøgelser i mus og rotter udført i regi af National Toxicology Program (NTP) afslørede ingen tegn på et kræftfremkaldende potentiale af hydrochlorthiazid hos hunmus (ved doser på op til ca. 600 mg/kg/dag) eller hos hankøn. og hunrotter (ved doser på op til ca. 100 mg/kg/dag). NTP fandt imidlertid tvetydige beviser for hepatokarcinogenicitet hos hanmus.
Hydrochlorthiazid var ikke genotoksisk in vitro i Ames-mutagenicitetsanalysen af Salmonella typhimurium-stammer TA 98, TA 100, TA 1535, TA 1537 og TA 1538 og i den kinesiske hamsterovarie (CHO)-test for kromosomafvigelser ved brug af vibrationer, eller kimcellekromosomer fra mus, knoglemarvskromosomer fra kinesisk hamster og det kønsbundne recessive letale træk ved Drosophila. Positive testresultater blev kun opnået i in vitro CHO Sister Chromatid Exchange (klastogenicitet) og i muselymfomcelle (mutagenicitet) assays ved anvendelse af koncentrationer af hydrochlorthiazid fra 43 til 1300 mcg/ml og i Aspergillus nidulans non-disjunction assay kl. en uspecificeret koncentration.
Hydrochlorthiazid havde ingen negative virkninger på fertiliteten hos mus og rotter af begge køn i undersøgelser, hvor disse arter via deres diæt blev eksponeret for doser på henholdsvis op til 100 og 4 mg/kg før parring og under hele graviditeten.
Brug i specifikke populationer
Graviditet
Graviditetskategori D
Brug af lægemidler, der virker på renin-angiotensin-systemet i andet og tredje trimester af graviditeten, reducerer føtal nyrefunktion og øger føtal og neonatal morbiditet og død. Resulterende oligohydramnios kan være forbundet med føtal lungehypoplasi og skeletdeformationer. Potentielle neonatale bivirkninger omfatter kraniehypoplasi, anuri, hypotension, nyresvigt og død. Når graviditet opdages, skal du seponere losartan så hurtigt som muligt. Disse negative resultater er normalt forbundet med brugen af disse lægemidler i andet og tredje trimester af graviditeten. De fleste epidemiologiske undersøgelser, der undersøgte føtale abnormiteter efter eksponering for antihypertensiv brug i første trimester, har ikke skelnet lægemidler, der påvirker renin-angiotensin-systemet, fra andre antihypertensiva. Passende håndtering af maternel hypertension under graviditet er vigtig for at optimere resultaterne for både mor og foster.
det usædvanlige tilfælde, hvor der ikke er noget passende alternativ til behandling med lægemidler, der påvirker reninangiotensinsystemet for en bestemt patient, skal moderen informeres om den potentielle risiko for fosteret. Udfør serielle ultralydsundersøgelser for at vurdere det intra-amniotiske miljø. Hvis der observeres oligohydramnios, skal HYZAAR afbrydes, medmindre det anses for at være livreddende for moderen. Fostertest kan være passende, baseret på graviditetsugen. Patienter og læger skal dog være opmærksomme på, at oligohydramnios muligvis ikke vises, før fosteret har pådraget sig irreversibel skade. Overvåg nøje spædbørn med historier om in utero eksponering for HYZAAR 12,5 mg for hypotension, oliguri og hyperkaliæmi [se Pædiatrisk brug ].
Der var ingen tegn på teratogenicitet hos rotter eller kaniner behandlet med en maksimal losartankaliumdosis på 10 mg/kg/dag i kombination med 2,5 mg/kg/dag hydrochlorthiazid. Ved disse doser var de respektive eksponeringer (AUC'er) af losartan, dets aktive metabolit og hydrochlorthiazid hos kaniner ca. 5, 1,5 og 1,0 gange dem, der blev opnået hos mennesker med 100 mg losartan i kombination med 25 mg hydrochlorthiazid. AUC-værdier for losartan, dets aktive metabolit og hydrochlorthiazid, ekstrapoleret fra data opnået med losartan administreret til rotter i en dosis på 50 mg/kg/dag i kombination med 12,5 mg/kg/dag hydrochlorthiazid, var ca. 6, 2 og 2 gange større end dem, der opnås hos mennesker med 100 mg losartan i kombination med 25 mg hydrochlorthiazid. Føtal toksicitet hos rotter, som påvist ved en let stigning i overtallige ribben, blev observeret, når hunner blev behandlet før og under hele graviditeten med 10 mg/kg/dag losartan i kombination med 2,5 mg/kg/dag hydrochlorthiazid. Som også observeret i studier med losartan alene, forekom uønskede føtale og neonatale virkninger, herunder nedsat kropsvægt, nyretoksicitet og dødelighed, når drægtige rotter blev behandlet under sen drægtighed og/eller diegivning med 50 mg/kg/dag losartan i kombination med 12,5 mg/kg/dag hydrochlorthiazid. Respektive AUC'er for losartan, dets aktive metabolit og hydrochlorthiazid ved disse doser hos rotter var ca. 35, 10 og 10 gange større end dem, der blev opnået hos mennesker ved administration af 100 mg losartan i kombination med 25 mg hydrochlorthiazid. Når hydrochlorthiazid blev administreret uden losartan til gravide mus og rotter i deres respektive perioder med større organogenese i doser op til henholdsvis 3000 og 1000 mg/kg/dag, var der ingen tegn på skade på fosteret.
Thiazider krydser placentabarrieren og optræder i navlestrengsblod. Der er risiko for føtal eller neonatal gulsot, trombocytopeni og muligvis andre bivirkninger, der er opstået hos voksne.
Ammende mødre
Det vides ikke, om losartan udskilles i modermælk, men signifikante niveauer af losartan og dets aktive metabolit har vist sig at være til stede i rottemælk. Thiazider forekommer i modermælk. På grund af potentialet for uønskede virkninger på det ammende spædbarn, bør der tages en beslutning om, hvorvidt amningen skal afbrydes eller lægemidlet skal seponeres under hensyntagen til lægemidlets betydning for moderen.
Pædiatrisk brug
Sikkerhed og effektivitet af HYZAAR hos pædiatriske patienter er ikke blevet fastlagt.
Nyfødte med en historie om i utero eksponering for HYZAAR
Hvis der opstår oliguri eller hypotension, skal du rette opmærksomheden mod understøttelse af blodtryk og nyreperfusion. Udskiftningstransfusion eller dialyse kan være påkrævet for at vende hypotension og/eller erstatte forstyrret nyrefunktion.
Geriatrisk brug
et kontrolleret klinisk studie for reduktion af den kombinerede risiko for kardiovaskulær død, slagtilfælde og myokardieinfarkt hos hypertensive patienter med venstre ventrikulær hypertrofi, var 2857 patienter (62%) 65 år og derover, mens 808 patienter (18%) var 75 år. og over. I et forsøg på at kontrollere blodtrykket i denne undersøgelse fik patienterne samtidig administreret losartan og hydrochlorthiazid 74 % af den samlede tid, de var på undersøgelseslægemidlet. Der blev ikke observeret nogen overordnede forskelle i effektivitet mellem disse patienter og yngre patienter. Bivirkninger var noget hyppigere hos ældre sammenlignet med ikke-ældre patienter for både losartan-hydrochlorthiazid- og kontrolgrupperne [se KLINISK FARMAKOLOGI ].
Race
undersøgelsen Losartan Intervention For Endpoint Reduction in Hypertension (LIFE) havde sorte patienter med hypertension og venstre ventrikelhypertrofi behandlet med atenolol en lavere risiko for slagtilfælde, det primære sammensatte endepunkt, sammenlignet med sorte patienter behandlet med losartan (begge samtidig behandlet med hydrochlorthiazid hos de fleste patienter). I undergruppen af sorte patienter (n=533, 6 % af patienterne i LIFE-studiet) var der 29 primære endepunkter blandt 263 patienter på atenolol (11 %, 26 pr. 1000 patientår) og 46 primære endepunkter blandt 270 patienter (17 %, 42 pr. 1000 patientår) på losartan. Dette fund kunne ikke forklares på baggrund af forskelle i andre populationer end race eller på eventuelle ubalancer mellem behandlingsgrupper. Derudover var blodtryksreduktioner i begge behandlingsgrupper konsistente mellem sorte og ikke-sorte patienter. I betragtning af vanskeligheden ved at fortolke undergruppeforskelle i store forsøg, kan det ikke vides, om den observerede forskel er et resultat af tilfældigheder. LIFE-studiet giver dog ingen evidens for, at fordelene ved losartan ved at reducere risikoen for kardiovaskulære hændelser hos hypertensive patienter med venstre ventrikelhypertrofi gælder for sorte patienter [se KLINISK FARMAKOLOGI ].
Nedsat leverfunktion
Påbegyndelse af HYZAAR 12,5 mg anbefales ikke til patienter med nedsat leverfunktion, fordi den passende startdosis af losartan, 25 mg, ikke er tilgængelig.
Nedsat nyrefunktion
Ændringer i nyrefunktionen er blevet rapporteret hos følsomme personer [se DOSERING OG ADMINISTRATION , ADVARSLER OG FORHOLDSREGLER , og KLINISK FARMAKOLOGI ]. Sikkerhed og effektivitet af HYZAAR hos patienter med svært nedsat nyrefunktion (kreatininclearance
OVERDOSIS
Losartan kalium
Signifikant dødelighed blev observeret hos mus og rotter efter oral administration af henholdsvis 1000 mg/kg og 2000 mg/kg, ca. 44 og 170 gange den maksimalt anbefalede humane dosis på mg/m-basis.
Begrænsede data er tilgængelige med hensyn til overdosering hos mennesker. Den mest sandsynlige manifestation af overdosering vil være hypotension og takykardi; bradykardi kunne opstå fra parasympatisk (vagal) stimulation. Hvis symptomatisk hypotension skulle opstå, bør understøttende behandling iværksættes.
Hverken losartan eller dets aktive metabolit kan fjernes ved hæmodialyse.
Hydrochlorthiazid
Den orale LD af hydrochlorthiazid er større end 10 g/kg hos både mus og rotter. De mest almindelige observerede tegn og symptomer er dem, der er forårsaget af elektrolytmangel (hypokaliæmi, hypochloræmi, hyponatriæmi) og dehydrering som følge af overdreven diurese. Hvis digitalis også er blevet administreret, kan hypokaliæmi accentuere hjertearytmier. I hvilken grad hydrochlorthiazid fjernes ved hæmodialyse er ikke fastlagt.
KONTRAINDIKATIONER
HYZAAR 12,5 mg er kontraindiceret:
- Hos patienter, der er overfølsomme over for nogen komponent i dette produkt.
- Hos patienter med anuri
- Til samtidig administration med aliskiren til patienter med diabetes
KLINISK FARMAKOLOGI
Handlingsmekanisme
Losartan kalium
Angiotensin II [dannet ud fra angiotensin I i en reaktion katalyseret af angiotensin-konverterende enzym (ACE, kininase II)], er en potent vasokonstriktor, det primære vasoaktive hormon i renin-angiotensin-systemet og en vigtig komponent i patofysiologien af hypertension. Det stimulerer også aldosteronsekretion af binyrebarken. Losartan og dets vigtigste aktive metabolit blokerer de vasokonstriktor- og aldosteronudskillende virkninger af angiotensin II ved selektivt at blokere bindingen af angiotensin II til AT1-receptoren, der findes i mange væv (f.eks. vaskulær glat muskulatur, binyrer). Der findes også en AT2-receptor i mange væv, men den vides ikke at være forbundet med kardiovaskulær homeostase. Hverken losartan eller dets primære aktive metabolit udviser nogen delvis agonistaktivitet ved AT1-receptoren, og begge har meget større affinitet (ca. 1000 gange) for AT1-receptoren end til AT2-receptoren. In vitro bindingsundersøgelser indikerer, at losartan er en reversibel, kompetitiv hæmmer af AT1-receptoren. Den aktive metabolit er 10 til 40 gange mere potent i vægt end losartan og ser ud til at være en reversibel, ikke-kompetitiv hæmmer af AT1-receptoren.
Hverken losartan eller dets aktive metabolit hæmmer ACE (kininase II, enzymet, der omdanner angiotensin I til angiotensin II og nedbryder bradykinin), og de binder heller ikke til eller blokerer andre hormonreceptorer eller ionkanaler, der vides at være vigtige i kardiovaskulær regulering.
Hydrochlorthiazid
Hydrochlorthiazid er et thiaziddiuretikum. Thiazider påvirker de renale tubulære mekanismer for elektrolytreabsorption, hvilket direkte øger udskillelsen af natrium og chlorid i omtrent tilsvarende mængder. Indirekte reducerer hydrochlorthiazids diuretiske virkning plasmavolumen med deraf følgende stigninger i plasmareninaktivitet, stigninger i aldosteronsekretion, stigninger i urinkaliumtab og fald i serumkalium. Renin-aldosteron-forbindelsen medieres af angiotensin II, så samtidig administration af en angiotensin II-receptorantagonist har en tendens til at vende det kaliumtab, der er forbundet med disse diuretika. Mekanismen for thiaziders antihypertensive virkning er ukendt.
Farmakodynamik
Losartan kalium
Losartan hæmmer pressoreffekten af angiotensin II (såvel som angiotensin I) infusioner. En dosis på 100 mg hæmmer pressoreffekten med ca. 85 % ved peak med 25-40 % hæmning ved i 24 timer. Fjernelse af den negative feedback af angiotensin II forårsager en fordobling til tredobling af plasmareninaktiviteten og deraf følgende stigning i angiotensin II-plasmakoncentrationen hos hypertensive patienter. Losartan påvirker ikke responset på bradykinin, hvorimod ACE-hæmmere øger responset på bradykinin. Aldosteron-plasmakoncentrationen falder efter administration af losartan. På trods af losartans effekt på aldosteronsekretion blev der observeret meget lille effekt på serumkalium.
Effekten af losartan er i det væsentlige til stede inden for en uge, men i nogle undersøgelser indtraf den maksimale effekt efter 3-6 uger. I langsigtede opfølgningsstudier (med outplacebokontrol) så effekten af losartan ud til at blive opretholdt i op til et år. Der er ingen tilsyneladende rebound-effekt efter brat seponering af losartan. Der var stort set ingen ændring i den gennemsnitlige hjertefrekvens hos losartan-behandlede patienter i kontrollerede forsøg.
Hydrochlorthiazid
Efter oral administration af hydrochlorthiazid begynder diurese inden for 2 timer, topper efter ca. 4 timer og varer ca. 6 til 12 timer.
Lægemiddelinteraktioner
Hydrochlorthiazid
Alkohol, barbiturater eller narkotika - potensering af ortostatisk hypotension kan forekomme.
Andre antihypertensiva - additiv effekt eller potensering.
Skeletmuskelafslappende midler, ikke-depolariserende (f.eks. tubocurarin) - mulig øget reaktion på muskelafslappende midler.
Kortikosteroider, ACTH eller glycyrrhizin (findes i lakrids) - intensiveret elektrolytudtømning, især hypokaliæmi.
Pressoraminer (f.eks. noradrenalin) - mulig nedsat respons på pressoraminer, men ikke tilstrækkelig til at udelukke deres anvendelse.
Farmakokinetik
Losartan kalium
Absorption
Efter oral administration absorberes losartan godt og gennemgår betydelig first-pass metabolisme. Den systemiske biotilgængelighed af losartan er ca. 33 %. Den gennemsnitlige maksimale koncentration af losartan og dets aktive metabolit nås efter henholdsvis 1 time og 3-4 timer. Mens maksimale plasmakoncentrationer af losartan og dets aktive metabolit er omtrent lige store, er metabolittens AUC (areal under kurven) omkring 4 gange så stor som losartan. Et måltid forsinker absorptionen af losartan og sænker dets Cmax max, men har kun en mindre effekt på losartan AUC eller på metabolittens AUC (~10 % fald). Farmakokinetikken af losartan og dets aktive metabolit er lineær med orale losartandoser op til 200 mg og ændres ikke over tid.
Fordeling
Fordelingsvolumenet af losartan og den aktive metabolit er henholdsvis ca. 34 liter og 12 liter. Både losartan og dets aktive metabolit er i høj grad bundet til plasmaproteiner, primært albumin, med plasmafrie fraktioner på henholdsvis 1,3 % og 0,2 %. Plasmaproteinbinding er konstant over det koncentrationsområde, der opnås med anbefalede doser. Undersøgelser med rotter viser, at losartan krydser blod-hjerne-barrieren dårligt, hvis overhovedet.
Metabolisme
Losartan er et oralt aktivt stof, som gennemgår betydelig first-pass metabolisme af cytokrom P450-enzymer. Det omdannes til dels til en aktiv carboxylsyremetabolit, der er ansvarlig for det meste af angiotensin II-receptorantagonismen, der følger efter behandling med losartan. Ca. 14 % af en oralt administreret dosis losartan omdannes til den aktive metabolit. Ud over den aktive carboxylsyremetabolit dannes flere inaktive metabolitter. In vitro undersøgelser indikerer, at cytochrom P450 2C9 og 3A4 er involveret i biotransformationen af losartan til dets metabolitter.
Elimination
Total plasmaclearance af losartan og den aktive metabolit er henholdsvis ca. 600 ml/min og 50 ml/min med renal clearance på henholdsvis ca. 75 ml/min og 25 ml/min. Den terminale halveringstid for losartan er ca. 2 timer, og metabolitten er ca. 6-9 timer. Efter enkeltdoser af losartan administreret oralt udskilles ca. 4 % af dosis uændret i urinen, og ca. 6 % udskilles i urinen som aktiv metabolit. Biliær udskillelse bidrager til elimineringen af losartan og dets metabolitter. Efter oral 14C-mærket losartan genfindes omkring 35 % af radioaktiviteten i urinen og omkring 60 % i fæces. Efter en intravenøs dosis af 14C-mærket losartan genfindes omkring 45 % af radioaktiviteten i urinen og 50 % i fæces. Hverken losartan eller dets metabolit akkumuleres i plasma ved gentagen dosering én gang dagligt.
Hydrochlorthiazid
Hydrochlorthiazid metaboliseres ikke, men elimineres hurtigt via nyrerne. Når plasmaniveauer er blevet fulgt i mindst 24 timer, er plasmahalveringstiden blevet observeret at variere mellem 5,6 og 14,8 timer. Mindst 61 procent af den orale dosis elimineres uændret inden for 24 timer. Hydrochlorthiazid krydser placenta, men ikke blod-hjerne-barrieren og udskilles i modermælken.
Specifikke populationer
Geriatri og køn
Losartans farmakokinetik er blevet undersøgt hos ældre (65-75 år) og hos begge køn. Plasmakoncentrationerne af losartan og dets aktive metabolit er ens hos ældre og unge hypertensive patienter. Plasmakoncentrationerne af losartan var omkring dobbelt så høje hos hypertensive kvinder som hos mænd med hypertensive patienter, men koncentrationerne af den aktive metabolit var ens hos mænd og kvinder.
Race
Farmakokinetiske forskelle på grund af race er ikke blevet undersøgt [se også Brug i specifikke populationer ].
Leverinsufficiens
Efter oral administration til patienter med mild til moderat alkoholisk levercirrose var plasmakoncentrationerne af losartan og dets aktive metabolit henholdsvis 5 gange og ca. 1,7 gange højere end hos unge mandlige frivillige. Sammenlignet med normale forsøgspersoner var den totale plasmaclearance af losartan hos patienter med leverinsufficiens ca. 50 % lavere, og den orale biotilgængelighed var ca. fordoblet. Den lavere startdosis af losartan, der anbefales til patienter med nedsat leverfunktion, kan ikke gives ved brug af HYZAAR. Dets anvendelse til sådanne patienter som et middel til losartan titrering anbefales derfor ikke [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
Nyreinsufficiens
Losartan
Efter oral administration øges plasmakoncentrationer og AUC'er af losartan og dets aktive metabolit med 50-90 % hos patienter med mild (kreatininclearance på 50 til 74 ml/min) eller moderat (kreatininclearance 30 til 49 ml/min) nyreinsufficiens. I denne undersøgelse blev renal clearance reduceret med 55-85 % for bådelosartan og dets aktive metabolit hos patienter med mild eller moderat nyreinsufficiens. Hverken losartan eller dets aktive metabolit kan fjernes ved hæmodialyse.
Hydrochlorthiazid
Efter oral administration øges AUC for hydrochlorthiazid med 70 og 700 % for patienter med henholdsvis mild og moderat nyreinsufficiens. I denne undersøgelse faldt renal clearance af hydrochlorthiazid med 45 og 85 % hos patienter med henholdsvis mild og moderat nedsat nyrefunktion.
Brug de sædvanlige behandlingsregimer med HYZAAR, så længe patientens kreatininclearance er større end 30 ml/min. Sikkerhed og effektivitet af HYZAAR 12,5 mg indlagte patienter med svært nedsat nyrefunktion (kreatininclearance mindre end 30 ml/min) er ikke blevet fastlagt [se Brug i specifikke populationer ].
Lægemiddelinteraktioner
Losartan kalium
Der er ikke fundet klinisk signifikante lægemiddelinteraktioner i studier af losartan-kalium med hydrochlorthiazid, digoxin, warfarin, cimetidin og phenobarbital. Imidlertid har rifampin vist sig at reducere AUC for losartan og dets aktive metabolit med henholdsvis 30 % og 40 %. Fluconazol, en hæmmer af cytochromP450 2C9, reducerede AUC af den aktive metabolit med ca. 40 %, men øgede AUC af losartan med ca. 70 % efter gentagne doser. Omdannelse af losartan til dets aktive metabolit efter intravenøs administration påvirkes ikke af ketoconazol, en hæmmer af P450 3A4. AUC for aktiv metabolit efter oral losartan blev ikke påvirket af erythromycin, en hæmmer af P450 3A4, men AUC for losartan blev øget med 30 %.
De farmakodynamiske konsekvenser af samtidig brug af losartan og inhibitorer af P450 2C9 er ikke blevet undersøgt. Forsøgspersoner, der ikke metaboliserer losartan til aktiv metabolit, har vist sig at have en specifik, sjælden defekt i cytokrom P450 2C9. Disse data tyder på, at omdannelsen af losartan til dets aktive metabolit primært medieres af P450 2C9 og ikke P450 3A4.
Kliniske Studier
Losartan monoterapi
Reduktion af risikoen for slagtilfælde
LIFE-studiet var et multinationalt, dobbeltblindt studie, der sammenlignede losartan og atenolol hos 9193 hypertensive patienter med EKG-dokumenteret venstre ventrikelhypertrofi. Patienter med myokardieinfarkt eller slagtilfælde inden for seks måneder før randomisering blev ekskluderet. Patienterne blev randomiseret til at modtage losartan en gang dagligt 50 mg eller atenolol 50 mg. Hvis målblodtryk (
bestræbelserne på at kontrollere blodtrykket fik patienterne i begge arme af LIFE-studiet samtidig hydrochlorthiazid, det meste af tiden, de var på studielægemidlet (henholdsvis 73,9 % og 72,4 % af dagene i losartan- og atenolol-armene).
Af de randomiserede patienter var 4963 (54%) kvinder og 533 (6%) sorte. Gennemsnitsalderen var 67 med 5704 (62%) alder ≥65. Ved baseline havde 1195 (13%) diabetes, 1326 (14%) havde isoleret systolisk hypertension, 1469 (16%) havde koronar hjertesygdom, og 728 (8%) havde cerebrovaskulær sygdom. Baseline gennemsnitligt blodtryk var 174/98 mmHg i begge behandlingsgrupper. Den gennemsnitlige varighed af opfølgning var 4,8 år. Ved afslutningen af undersøgelsen eller ved det sidste besøg før et primært endepunkt tog 77 % af gruppen behandlet med losartan og 73 % af gruppen behandlet med atenolol stadig undersøgelsesmedicin. Af de patienter, der stadig tog undersøgelsesmedicin, var de gennemsnitlige doser af losartan og atenolol begge omkring 80 mg/dag, og 15% tog atenolol eller losartan som monoterapi, mens 77% også fik hydrochlorthiazid (ved gennemsnitlig dosis på 20 mg/dag i hver gruppe). Blodtryksreduktionen målt ved lavpunkt var ens for begge behandlingsgrupper, men blodtrykket blev ikke målt på noget andet tidspunkt af dagen. Ved afslutningen af undersøgelsen eller ved det sidste besøg før et primært endepunkt var gennemsnitsblodtrykket 144,1/81,3 mmHg for gruppen behandlet med losartan og 145,4/80,9 mmHg for gruppen behandlet med atenolol [forskellen i SBP på 1,3 mmHg var signifikant (p
Det primære endepunkt var den første forekomst af kardiovaskulær død, ikke-fatalt slagtilfælde eller ikke-fatalt myokardieinfarkt. Patienter med ikke-dødelige hændelser forblev i forsøget, således at der også var en undersøgelse af den første hændelse af hver type, selvom det ikke var den første hændelse (f.eks. ville et slagtilfælde efter et indledende myokardieinfarkt tælles med i analysen af slagtilfælde) . Behandling med losartan resulterede i en 13 % reduktion (p=0,021) i risikoen for det primære endepunkt sammenlignet med atenololgruppen; denne forskel var primært resultatet af en effekt på fatalt og ikke-dødeligt slagtilfælde. Behandling med losartan reducerede risikoen for slagtilfælde med 25 % i forhold til atenolol (p=0,001).
Losartan Kalium-Hydrochlorthiazid
De 3 kontrollerede studier af losartan og hydrochlorthiazid omfattede over 1300 patienter, der vurderede den antihypertensive effekt af forskellige doser losartan (25, 50 og 100 mg) og samtidig hydrochlorthiazid (6,25, 12,5 og 25 mg). En faktoriel undersøgelse sammenlignede kombinationen af losartan/hydrochlorthiazid 50/12,5 mg med dets komponenter og placebo. Kombinationen af losartan/hydrochlorthiazid 50/12,5 mg resulterede i en omtrent additiv placebo-justeret systolisk/diastolisk respons (15,5/9,0 mmHg for kombinationen sammenlignet med 8,5/5,0 mmHg for losartan alene og 7,0/3,0 mmHg for hydrochlorthiazid alene). En anden undersøgelse undersøgte dosis-respons-forholdet mellem forskellige doser af hydrochlorthiazid (6,25, 12,5 og 25 mg) eller placebo på baggrund af losartan (50 mg) hos patienter, der ikke var tilstrækkeligt kontrolleret (siddende diastolisk blodtryk [SiDBP] 93-120 mmHg) på losartan (50 mg) alene. Den tredje undersøgelse undersøgte dosis-respons-forholdet mellem forskellige doser losartan (25, 50 og 100 mg) eller placebo på baggrund af hydrochlorthiazid (25 mg) hos patienter, der ikke var tilstrækkeligt kontrolleret (SiDBP93-120 mmHg) på hydrochlorthiazid (25 mg). alene. Disse undersøgelser viste et øget antihypertensivt respons ved lavpunkt (24 timer efter dosering) af hydrochlorthiazid 12,5 eller 25 mg tilsat losartan 50 mg på henholdsvis 5,5/3,5 og 10,0/6,0 mmHg. På samme måde var der et øget antihypertensivt respons, når losartan 50 eller 100 mg blev tilsat til hydrochlorthiazid 25 mg på henholdsvis 9,0/5,5 og 12,5/6,5 mmHg. Der var ingen signifikant effekt på hjertefrekvensen.
Der var ingen forskel i respons for mænd og kvinder eller hos patienter over eller under 65 år.
Sorte patienter havde et større respons på hydrochlorthiazid end ikke-sorte patienter og et mindre respons på losartan. Det overordnede respons på kombinationen var ens for sorte og ikke-sorte patienter.
Svær hypertension (SiDBP ≥110 mmHg)
Sikkerheden og effekten af HYZAAR som indledende behandling for svær hypertension (defineret som en gennemsnitlig SiDBP ≥110 mmHg bekræftet ved 2 separate lejligheder efter al antihypertensiv behandling) blev undersøgt i et 6-ugers dobbeltblindt, randomiseret multicenterstudie. Patienterne blev randomiseret til enten losartan og hydrochlorthiazid (50/12,5 mg, én gang dagligt) eller til losartan (50 mg, én gang dagligt) og fulgt for blodtryksrespons. Patienterne blev titreret med 2-ugers intervaller, hvis deres SiDBP ikke nåede målet (
Undersøgelsen inkluderede 585 patienter, herunder 264 (45%) kvinder, 124 (21%) sorte og 21 (4%) ≥65 år. Det gennemsnitlige blodtryk ved baseline for den samlede population var 171/113 mmHg. Gennemsnitsalderen var 53 år. Efter 4 ugers behandling var den gennemsnitlige SiDBP 3,1 mmHg lavere, og den gennemsnitlige SiSBP var 5,6 mmHglowere i gruppen behandlet med HYZAAR. Som et resultat nåede en større andel af patienterne på HYZAAR 12,5 mg det diastoliske målblodtryk (17,6 % for HYZAAR 12,5 mg, 9,4 % for losartan; p=0,006). Lignende tendenser blev set, når patienterne blev grupperet efter køn, race eller alder (
Efter 6 ugers behandling nåede flere patienter, der fik kombinationsregimet, det diastoliske mål for blodtryk end dem, der modtog monoterapiregimet (29,8 % versus 12,5 %).
PATIENTOPLYSNINGER
HYZAAR® (HY-zar) (losartan kalium og hydrochlorthiazid tabletter)50/12,5 mg, 100/12,5 mg, 100/25 mg
Læs patientinformationen, der følger med HYZAAR®, før du begynder at tage den, og hver gang du får en genopfyldning. Der kan være nye oplysninger. Denne indlægsseddel træder ikke i stedet for at tale med din læge om din tilstand og behandling.
Hvad er den vigtigste information, jeg bør vide om HYZAAR?
- HYZAAR kan forårsage skade eller død på et ufødt barn.
- Tal med din læge om andre måder at sænke dit blodtryk på, hvis du planlægger at blive gravid.
- Hvis du bliver gravid, mens du tager HYZAAR 12,5 mg, skal du straks fortælle det til din læge.
Hvad er HYZAAR 12,5mg?
HYZAAR 12,5mg indeholder 2 receptpligtig medicin, en angiotensinreceptorblokker (ARB) og et vanddrivende middel (vandpille). Det bruges til at:
- lavere forhøjet blodtryk (hypertension). HYZAAR er normalt ikke det første lægemiddel, der bruges til at behandle forhøjet blodtryk.
- mindske risikoen for slagtilfælde hos patienter med forhøjet blodtryk og et hjerteproblem kaldet venstre ventrikulær hypertrofi (LVH). HYZAAR hjælper muligvis ikke sorte patienter med dette problem.
HYZAAR er ikke blevet undersøgt hos børn under 18 år.
Højt blodtryk (hypertension). Blodtrykket er kraften i dine blodkar, når dit hjerte slår, og når dit hjerte hviler. Du har forhøjet blodtryk, når kraften er for stor. Losartan-ingrediensen i HYZAAR 12,5 mg kan hjælpe dine blodkar med at slappe af, så dit blodtryk er lavere. Hydrochlorthiazidet i gredientin HYZAAR virker ved at få dine nyrer til at passere mere vand og salt.
Venstre ventrikulær hypertrofi (LVH) er en forstørrelse af væggene i hjertets venstre kammer (hjertets hovedpumpekammer). LVH kan ske af flere ting. Højt blodtryk er den mest almindelige årsag til LVH.
Hvem bør ikke tage HYZAAR?
Tag ikke HYZAAR 12,5 mg, hvis du:
- er allergisk over for indholdsstoffer i HYZAAR. Se en komplet liste over ingredienser i HYZAAR i slutningen af denne indlægsseddel.
- ikke tisser.
- har diabetes og tager en medicin kaldet aliskiren for at sænke blodtrykket.
Hvad skal jeg fortælle min læge, før jeg tager HYZAAR?
Fortæl din læge om alle dine medicinske tilstande, herunder hvis du:
- er gravid eller planlægger at blive gravid. Se "Hvad er den vigtigste information, jeg bør vide om HYZAAR?"
- ammer eller planlægger at amme. HYZAAR kan gå over i din mælk og kan skade din baby. Du og din læge bør beslutte, om du vil tage HYZAAR eller amme. Du bør ikke gøre begge dele.
- har kastet op (kastet op), haft diarré, svedt meget eller ikke drukket nok væske. Disse kan forårsage, at du har lavt blodtryk.
- har leverproblemer
- har nyreproblemer
- har systemisk lupus erythematosus (Lupus; SLE)
- har diabetes
- har gigt
- har nogen allergier
- har haft hudkræft, eller hvis du udvikler en ny hudlæsion under behandlingen. Behandling med hydrochlorthiazid kan øge risikoen for nogle typer hudkræft (non-melanom hudkræft). Diskuter med din læge, hvordan du beskytter din hud mod soleksponering, og hvor ofte du skal gennemgå hudkræftscreening.
Fortæl din læge om al den medicin, du tager, inklusive receptpligtig og ikke-receptpligtig medicin, vitaminer og naturlægemidler.
HYZAAR 12,5 mg og visse andre lægemidler kan interagere med hinanden. Fortæl det især din læge, hvis du tager:
- kaliumtilskud
- salterstatninger indeholdende kalium
- anden medicin, der kan øge serumkalium
- vandpiller (diuretika)
- lithium (et lægemiddel, der bruges til at behandle en bestemt form for depression)
- medicin, der bruges til at behandle smerter og gigt, kaldet non-steroide antiinflammatoriske lægemidler (NSAID), herunder COX-2-hæmmere
- anden medicin til at reducere blodtrykket.
Kend den medicin du tager. Hold en liste over din medicin og vis den til din læge og apotek, når du får en ny medicin.
Hvordan skal jeg tage HYZAAR 12,5 mg?
- Tag HYZAAR 12,5 mg nøjagtigt som foreskrevet af din læge. Din læge kan ændre din dosis, hvis det er nødvendigt.
- HYZAAR kan tages med eller uden mad.
- Hvis du glemmer en dosis, skal du tage den, så snart du husker det. Hvis det er tæt på din næste dosis, må du ikke tage den glemte dosis. Tag blot den næste dosis på dit normale tidspunkt.
- Hvis du tager for meget HYZAAR 12,5 mg, skal du ringe til din læge eller Giftinformationscentralen, eller gå til den nærmeste skadestue på hospitalet med det samme.
- Din læge kan tage blodprøver fra tid til anden, mens du tager HYZAAR.
Hvad er de mulige bivirkninger af HYZAAR?
HYZAAR kan forårsage følgende bivirkninger, der kan være alvorlige:
- Skade eller død af ufødte babyer. Se "Hvad er den vigtigste information, jeg bør vide om HYZAAR?"
- Allergisk reaktion. Symptomer på en allergisk reaktion er hævelse af ansigt, læber, hals eller tunge. Få akut lægehjælp med det samme og stop med at tage HYZAAR.
- Lavt blodtryk (hypotension). Lavt blodtryk kan få dig til at føle dig besvimet eller svimmel. Læg dig ned, hvis du føler dig besvimet eller svimmel. Ring til din læge med det samme.
- Hvis du har nyreproblemer, kan du se en forværring af, hvor godt dine nyrer fungerer. Ring til din læge, hvis du får hævelser i dine fødder, ankler eller hænder eller uforklarlig vægtøgning.
- En ny eller forværret tilstand kaldet systemisk lupus erythematosus (Lupus; SLE)
- Øjenproblemer. En af medicinen i HYZAAR 12,5 mg kan forårsage øjenproblemer, der, hvis de ikke behandles, kan føre til synstab. Symptomer på øjenproblemer kan opstå inden for timer til uger efter start af HYZAAR. Fortæl din læge med det samme, hvis du har:
- fald i synet
- øjensmerter
- Hudens følsomhed over for solen og risiko for hudkræft.
De mest almindelige bivirkninger af HYZAAR 12,5 mg hos personer med forhøjet blodtryk er:
- "forkølelse" (øvre luftvejsinfektion)
- svimmelhed
- tilstoppet næse
- rygsmerte
Fortæl din læge, hvis du får en bivirkning, der generer dig, eller som ikke vil forsvinde. Dette er ikke en komplet liste over bivirkninger. For en komplet liste, spørg din læge eller apotek.
Hvordan skal jeg opbevare HYZAAR 12,5 mg?
- Opbevar HYZAAR ved stuetemperatur ved 59°F til 86°F (15°C til 30°C).
- Opbevar HYZAAR i en tæt lukket beholder, og hold HYZAAR væk fra lyset.
- Opbevar HYZAAR 12,5 mg og al medicin utilgængeligt for børn.
Generel information om HYZAAR
Lægemidler ordineres nogle gange til tilstande, der ikke er nævnt i indlægssedler. Brug ikke HYZAAR til en tilstand, som det ikke er ordineret til. Giv ikke HYZAAR til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Denne folder opsummerer de vigtigste oplysninger om HYZAAR. Hvis du vil have mere information, så tal med din læge. Du kan bede din apoteker eller læge om oplysninger, der er skrevet til sundhedspersonale.
Hvad er ingredienserne i HYZAAR?
Aktive ingredienser: losartan kalium, hydrochlorthiazid
Inaktive ingredienser:
mikrokrystallinsk cellulose, vandholdig laktose, prægelatineret stivelse, magnesiumstearat, hydroxypropylcellulose, hypromellose, titaniumdioxid. HYZAAR 50/12.5 og HYZAAR 100/25 indeholder også D&C gul nr. 10 aluminiumssø.
HYZAAR 50/12.5, HYZAAR 100/12.5 og HYZAAR 100/25 kan også indeholde carnaubavoks.
