Avapro 150mg, 300mg Irbesartan Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Avapro 300mg, og hvordan bruges det?
Avapro 300mg er en receptpligtig medicin, der bruges til at behandle symptomer på forhøjet blodtryk (hypertension), nervesmerter forårsaget af type 2-diabetes. Avapro kan bruges alene eller sammen med anden medicin.
Avapro 300mg tilhører en klasse af lægemidler ARB'er.
Det vides ikke, om Avapro 150mg er sikkert og effektivt til børn under 6 år.
Hvad er de mulige bivirkninger af Avapro 300mg?
Avapro kan forårsage alvorlige bivirkninger, herunder:
- uforklarlige muskelsmerter,
- ømhed eller svaghed,
- feber,
- usædvanlig træthed,
- mørk farvet urin,
- svimmelhed,
- lidt eller ingen vandladning,
- hævelse,
- hurtig vægtøgning,
- forvirring,
- mistet appetiten,
- opkastning, og
- smerter i siden eller lænden
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Avapro omfatter:
- diarré,
- halsbrand,
- ondt i maven, og
- træt følelse
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Avapro. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
FØTALT TOKSICITET
- Når graviditet opdages, skal du seponere AVAPRO så hurtigt som muligt.
- Lægemidler, der virker direkte på renin-angiotenerne i systemet, kan forårsage skade og død på det udviklende foster [se ADVARSLER OG FORHOLDSREGLER].
BESKRIVELSE
AVAPRO (irbesartan) er en angiotensin II-receptor (AT1 subtype) antagonist.
Irbesartan er en ikke-peptidforbindelse, kemisk beskrevet som en 2-butyl-3-[p-(o-1H-tetrazol-5-ylphenyl)benzyl]-1,3-diazaspiro[4.4]non-1-en-4 -en.
Dens empiriske formel er C25H28N6O, og strukturformlen:
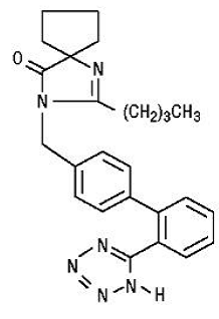
Irbesartan er et hvidt til råhvidt krystallinsk pulver med en molekylvægt på 428,5. Det er en upolær forbindelse med en fordelingskoefficient (oktanol/vand) på 10,1 ved pH på 7,4. Irbesartan er svagt opløseligt i alkohol og methylenchlorid og praktisk talt uopløseligt i vand.
AVAPRO fås til oral administration i tabletter uden delekærv, der indeholder 75 mg, 150 mg eller 300 mg irbesartan. Inaktive ingredienser omfatter: lactose, mikrokrystallinsk cellulose, prægelatineret stivelse, croscarmellosenatrium, poloxamer 188, siliciumdioxid og magnesiumstearat.
INDIKATIONER
Forhøjet blodtryk
AVAPRO® er indiceret til behandling af hypertension for at sænke blodtrykket. Sænkning af blodtrykket sænker risikoen for fatale og ikke-dødelige kardiovaskulære (CV) hændelser, primært slagtilfælde og myokardieinfarkt. Disse fordele er blevet set i kontrollerede forsøg med antihypertensiva fra en lang række farmakologiske klasser, herunder dette lægemiddel.
Kontrol af forhøjet blodtryk bør være en del af omfattende kardiovaskulær risikostyring, herunder, hvor det er relevant, lipidkontrol, diabetesbehandling, antitrombotisk behandling, rygestop, motion og begrænset natriumindtag. Mange patienter vil kræve mere end 1 lægemiddel for at nå blodtryksmålene. For specifik rådgivning om mål og ledelse, se offentliggjorte retningslinjer, såsom dem fra National High Blood Pressure Education Programs Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC).
Talrige antihypertensiva, fra en række farmakologiske klasser og med forskellige virkningsmekanismer, er i randomiserede kontrollerede forsøg blevet vist at reducere kardiovaskulær morbiditet og dødelighed, og det kan konkluderes, at det er blodtryksreduktion og ikke en anden farmakologisk egenskab ved stofferne, der i høj grad er ansvarlige for disse fordele. Den største og mest konsistente kardiovaskulære udfaldsfordel har været en reduktion i risikoen for slagtilfælde, men reduktioner i myokardieinfarkt og kardiovaskulær dødelighed er også set regelmæssigt.
Forhøjet systolisk eller diastolisk tryk forårsager øget kardiovaskulær risiko, og den absolutte risikostigning pr. mmHg er større ved højere blodtryk, så selv beskedne reduktioner af svær hypertension kan give væsentlige fordele. Relativ risikoreduktion fra blodtryksreduktion er ens på tværs af populationer med varierende absolut risiko, så den absolutte fordel er større hos patienter, der er i højere risiko uafhængigt af deres hypertension (f.eks. patienter med diabetes eller hyperlipidæmi), og sådanne patienter kan forventes at drage fordel af mere aggressiv behandling til et lavere blodtryksmål.
Nogle antihypertensiva har mindre blodtrykseffekter (som monoterapi) hos sorte patienter, og mange antihypertensiva har yderligere godkendte indikationer og virkninger (f.eks. på angina, hjertesvigt eller diabetisk nyresygdom). Disse overvejelser kan styre valg af terapi.
AVAPRO 300mg kan bruges alene eller i kombination med andre antihypertensiva.
Nefropati hos type 2-diabetespatienter
AVAPRO er indiceret til behandling af diabetisk nefropati hos patienter med type 2-diabetes og hypertension, forhøjet serumkreatinin og proteinuri (>300 mg/dag). I denne population reducerer AVAPRO hastigheden af progression af nefropati målt ved forekomsten af fordobling af serumkreatinin eller nyresygdom i slutstadiet (behov for dialyse eller nyretransplantation) [se Kliniske Studier ].
DOSERING OG ADMINISTRATION
Generelle betragtninger
AVAPRO kan administreres sammen med andre antihypertensiva og med eller uden mad.
Forhøjet blodtryk
Den anbefalede startdosis af AVAPRO 300 mg er 150 mg én gang dagligt. Dosis kan øges til en maksimal dosis på 300 mg én gang dagligt efter behov for at kontrollere blodtrykket [se Kliniske Studier ].
Nefropati hos type 2-diabetespatienter
Den anbefalede dosis er 300 mg én gang dagligt [se Kliniske Studier ].
Dosisjustering i volumen- og saltfattige patienter
Den anbefalede startdosis er 75 mg én gang dagligt til patienter med udtømning af intravaskulært volumen eller salt (f.eks. patienter, der behandles kraftigt med diuretika eller i hæmodialyse) [se ADVARSLER OG FORHOLDSREGLER ].
HVORDAN LEVERET
Doseringsformer og styrker
AVAPRO 75 mg er en hvid til råhvid, bikonveks oval, filmovertrukket tablet præget med et hjerte på den ene side og "2871" på den anden.
AVAPRO 150 mg er en hvid til råhvid, bikonveks oval, filmovertrukket tablet præget med et hjerte på den ene side og "2872" på den anden.
AVAPRO 300 mg er en hvid til råhvid, bikonveks oval, filmovertrukket tablet præget med et hjerte på den ene side og "2873" på den anden side.
Opbevaring og håndtering
AVAPRO (irbesartan) fås som hvide til råhvide, bikonvekse ovale, filmovertrukne tabletter, præget med en hjerteform på den ene side og en kode på den anden (se tabel nedenfor). Engangsflasker indeholder 30 eller 90 filmovertrukne tabletter som følger:
Opbevares ved 25°C (77°F); udflugter tilladt til 15°C–30°C (59°F–86°F) [se USP kontrolleret rumtemperatur ].
sanofi-aventis US LLC, Bridgewater, NJ 08807, A SANOFI COMPANY. Revideret: september 2021
BIVIRKNINGER
Følgende vigtige bivirkninger er beskrevet andetsteds i mærkningen:
- Hypotension hos patienter med volumen eller saltmangel [se ADVARSLER OG FORHOLDSREGLER ]
- Nedsat nyrefunktion [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis. Bivirkningsoplysningerne fra kliniske forsøg giver dog et grundlag for at identificere de bivirkninger, der ser ud til at være relateret til stofbrug, og for at tilnærme rater.
Forhøjet blodtryk
AVAPRO er blevet evalueret for sikkerhed hos mere end 4300 patienter med hypertension og omkring 5000 personer i alt. Denne erfaring omfatter 1303 patienter behandlet i over 6 måneder og 407 patienter i 1 år eller mere.
placebokontrollerede kliniske forsøg blev følgende bivirkninger rapporteret hos mindst 1 % af patienterne behandlet med AVAPRO (n=1965) og med en højere forekomst sammenlignet med placebo (n=641), ekskl. ikke med rimelighed forbundet med brugen af lægemidlet, fordi de var forbundet med den tilstand, der behandles eller er meget almindelige i den behandlede befolkning, omfatter: diarré (3 % vs 2 %), dyspepsi/halsbrand (2 % vs 1 %) og træthed (4 % mod 3 %).
Brug af irbesartan var ikke forbundet med en øget forekomst af tør hoste, som det typisk er forbundet med brug af ACE-hæmmere. I placebokontrollerede undersøgelser var forekomsten af hoste hos irbesartanbehandlede patienter 2,8 % versus 2,7 % hos patienter, der fik placebo.
Nefropati hos type 2-diabetespatienter
Hyperkaliæmi
Irbesartan Diabetic Nephropathy Trial (IDNT) (proteinuri ≥900 mg/dag og serumkreatinin i området fra 1,0-3,0 mg/dL), var procentdelen af patienter med kalium >6 mEq/L 18,6 % i AVAPRO 300 mg-gruppen versus 6,0 % i placebogruppen. Seponeringer på grund af hyperkaliæmi i AVAPRO 150 mg-gruppen var 2,1 % mod 0,4 % i placebogruppen.
I IDNT svarede bivirkningerne til dem, der blev set hos patienter med hypertension med undtagelse af en øget forekomst af ortostatiske symptomer, som forekom hyppigere i AVAPRO 150 mg versus placebogruppen: svimmelhed (10,2 % vs. 6,0 %), ortostatisk svimmelhed (5,4 %). % vs 2,7 %) og ortostatisk hypotension (5,4 % vs 3,2 %).
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af AVAPRO efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt at estimere deres hyppighed pålideligt eller at etablere en årsagssammenhæng til lægemiddeleksponering.
Nældefeber; angioødem (involverer hævelse af ansigt, læber, svælg og/eller tunge); anafylaktisk reaktion inklusive anafylaktisk shock; øgede leverfunktionsprøver; gulsot; hepatitis; hyperkaliæmi; anæmi; trombocytopeni; øget CPK; tinnitus; og hypoglykæmi hos diabetespatienter.
DRUGSINTERAKTIONER
Midler, der øger serumkalium
Samtidig administration af AVAPRO og andre lægemidler, der øger serumkaliumniveauet, kan resultere i hyperkaliæmi, nogle gange alvorlig. Overvåg serumkalium hos sådanne patienter.
Lithium
Der er rapporteret stigninger i serumlithiumkoncentrationer og lithiumtoksicitet ved samtidig brug af irbesartan og lithium. Overvåg lithiumniveauer hos patienter, der får irbesartan og lithium.
Ikke-steroide antiinflammatoriske lægemidler (NSAID'er) inklusive selektive cyclooxygenase-2-hæmmere (COX-2-hæmmere)
Hos ældre patienter, volumendepleterede (inklusive dem i diuretikabehandling) eller med nedsat nyrefunktion, kan samtidig administration af NSAID'er, herunder selektive COX-2-hæmmere, med angiotensin II-receptorantagonister (inklusive irbesartan) resultere i forringelse af nyrefunktionen , herunder eventuelt akut nyresvigt. Disse virkninger er normalt reversible. Overvåg nyrefunktionen periodisk hos patienter, der får irbesartan- og NSAID-behandling.
Den antihypertensive virkning af angiotensin II-receptorantagonister, inklusive irbesartan, kan svækkes af NSAID'er, herunder selektive COX-2-hæmmere.
Dobbelt blokade af Renin-Angiotensin System (RAS)
Dobbelt blokade af RAS med angiotensinreceptorblokkere, ACE-hæmmere eller aliskiren er forbundet med øget risiko for hypotension, hyperkaliæmi og ændringer i nyrefunktionen (inklusive akut nyresvigt) sammenlignet med monoterapi. De fleste patienter, der får kombinationen af to RAS-hæmmere, opnår ingen yderligere fordele sammenlignet med monoterapi. Undgå generelt kombineret brug af RAS-hæmmere. Overvåg nøje blodtryk, nyrefunktion og elektrolytter hos patienter på AVAPRO 150mg og andre midler, der påvirker RAS.
Giv ikke aliskiren samtidig med AVAPRO til patienter med diabetes. Undgå brug af aliskiren sammen med AVAPRO hos patienter med nedsat nyrefunktion (GFR
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Føtal toksicitet
AVAPRO 150mg kan forårsage fosterskader, når det administreres til en gravid kvinde. Brug af lægemidler, der virker på reninangiotensin-systemet i andet og tredje trimester af graviditeten, reducerer føtal nyrefunktion og øger føtal og neonatal morbiditet og død. Resulterende oligohydramnios kan være forbundet med føtal lungehypoplasi og skeletdeformationer. Potentielle neonatale bivirkninger omfatter kraniehypoplasi, anuri, hypotension, nyresvigt og død. Når graviditet opdages, seponeres AVAPRO så hurtigt som muligt [se Brug i specifikke populationer ].
Hypotension hos patienter med volumen eller saltmangel
Hos patienter med et aktiveret renin-angiotensin-system, såsom volumen- eller saltfattige patienter (f.eks. dem, der behandles med høje doser diuretika), kan symptomatisk hypotension forekomme efter initialisering af behandling med AVAPRO. Korriger volumen eller saltmangel før administration af AVAPRO 300mg eller brug en lavere startdosis [se DOSERING OG ADMINISTRATION ].
Nedsat nyrefunktion
Ændringer i nyrefunktionen inklusive akut nyresvigt kan være forårsaget af lægemidler, der hæmmer renin-angiotensin-systemet. Patienter, hvis nyrefunktion til dels kan afhænge af aktiviteten af renin-angiotensin-systemet (f.eks. patienter med nyrearteriestenose, kronisk nyresygdom, alvorlig hjertesvigt eller volumendepletion) kan have særlig risiko for at udvikle akut nyresvigt eller død på AVAPRO. Overvåg nyrefunktionen periodisk hos disse patienter. Overvej at tilbageholde eller afbryde behandlingen hos patienter, som udvikler et klinisk signifikant fald i nyrefunktionen på AVAPRO [se DRUGSINTERAKTIONER ].
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Der blev ikke observeret tegn på karcinogenicitet, når irbesartan blev administreret i doser på op til 500/1000 mg/kg/dag (henholdsvis hanner/hun) til rotter og 1000 mg/kg/dag til mus i op til 2 år. For han- og hunrotter gav 500 mg/kg/dag en gennemsnitlig systemisk eksponering for irbesartan (AUC 0–24 timer, bundet plus ubundet) henholdsvis ca. 3 og 11 gange den gennemsnitlige systemiske eksponering hos mennesker, der fik den maksimalt anbefalede humane eksponering. dosis (MRHD) på 300 mg irbesartan/dag, hvorimod 1000 mg/kg/dag (kun givet til kvinder) gav en gennemsnitlig systemisk eksponering omkring 21 gange den, der blev rapporteret for mennesker ved MRHD. For han- og hunmus gav 1000 mg/kg/dag en eksponering for irbesartan henholdsvis ca. 3 og 5 gange den menneskelige eksponering ved 300 mg/dag.
Irbesartan var ikke mutagent i en række in vitro-tests (Ames mikrobiel test, rotte-hepatocyt-DNA-reparationstest, V79 pattedyr-celle forward gen-mutation assay). Irbesartan var negativ i flere tests for induktion af kromosomafvigelser (in vitro - human lymfocytanalyse; in vivo - mikronukleusundersøgelse hos mus).
Irbesartan havde ingen negative virkninger på fertilitet eller parring af han- eller hunrotter ved orale doser ≤650 mg/kg/dag, den højeste dosis gav en systemisk eksponering for irbesartan (AUC 0–24 timer, bundet plus ubundet) ca. fundet hos mennesker, der modtager MRHD på 300 mg/dag.
Brug i specifikke populationer
Graviditet
Risikooversigt
AVAPRO kan forårsage fosterskader, når det administreres til en gravid kvinde. Brug af lægemidler, der virker på reninangiotensin-systemet i andet og tredje trimester af graviditeten, reducerer føtal nyrefunktion og øger føtal og neonatal morbiditet og død [se Kliniske overvejelser ]. De fleste epidemiologiske undersøgelser, der undersøgte føtale abnormiteter efter eksponering for antihypertensiv brug i første trimester, har ikke skelnet lægemidler, der påvirker renin-angiotensin-systemet, fra andre antihypertensiva. Når graviditet opdages, skal du seponere AVAPRO 150mg så hurtigt som muligt.
Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre ugunstige udfald uanset lægemiddeleksponering. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 % til 4 % og 15 % til 20 %.
Kliniske overvejelser
Sygdomsassocieret moder- og/eller embryo-føtal risiko
Hypertension under graviditet øger moderens risiko for præeklampsi, svangerskabsdiabetes, for tidlig fødsel og fødselskomplikationer (f.eks. behov for kejsersnit og postpartum blødning). Hypertension øger fosterets risiko for intrauterin vækstbegrænsning og intrauterin død. Gravide kvinder med hypertension bør overvåges omhyggeligt og behandles i overensstemmelse hermed.
Fetale/neonatale bivirkninger

Oligohydramnios hos gravide kvinder, der bruger lægemidler, der påvirker renin-angiotensin-systemet i graviditetens andet og tredje trimester, kan resultere i følgende: nedsat føtal nyrefunktion, der fører til anuri og nyresvigt, føtal lungehypoplasi, skeletdeformationer, herunder kraniehypoplasi, hypotension , og døden.
I det usædvanlige tilfælde, hvor der ikke er noget passende alternativ til behandling med lægemidler, der påvirker renin-angiotensin-systemet for en bestemt patient, skal du informere moderen om den potentielle risiko for fosteret.
Udfør serielle ultralydsundersøgelser for at vurdere det intra-amniotiske miljø. Fostertest kan være passende, baseret på graviditetsugen. Patienter og læger skal dog være opmærksomme på, at oligohydramnios muligvis ikke vises, før fosteret har pådraget sig irreversibel skade. Hvis der observeres oligohydramnios, overveje alternativ behandling. Overvåg nøje spædbørn med historier om in utero eksponering for AVAPRO for hypotension, oliguri og hyperkaliæmi og andre symptomer på nyreinsufficiens. Hvis der opstår oliguri eller hypotension hos nyfødte med en anamnese med in utero eksponering for AVAPRO 300 mg, skal opmærksomheden rettes mod understøttelse af blodtryk og nyreperfusion. Udskiftningstransfusion eller dialyse kan være påkrævet for at vende hypotension og/eller erstatte forstyrret nyrefunktion.
Data
Dyredata
Irbesartan krydser placenta hos rotter og kaniner. Hos hunrotter, der fik irbesartan før parring gennem drægtighed og diegivning i orale doser på 50, 180 eller 650 mg/kg/dag (1,6 til 21,1 gange den maksimale anbefalede humane dosis (MRHD) baseret på kropsoverfladeareal), blev fostre undersøgt på Drægtighedsdag 20 viste øget forekomst af hydroureter og nyrebækkenkavitation og/eller fravær af nyrepapiller i alle irbesartan-behandlede grupper. Subkutant ødem forekom også hos fostre ved maternelle doser ≥180 mg/kg/dag (5,8 gange MRHD). Disse anomalier opstod, når hunrotter modtog irbesartan fra før parring til og med dag 20 af drægtighed, men ikke blev observeret hos unger postnatalt i samme undersøgelse, eller når irbesartan kun blev givet til drægtige rotter under organogenese (drægtighedsdag 6 til drægtighedsdag 15) kl. orale doser fra 50 til 450 mg/kg/dag (op til 14,6 gange MRHD). Derudover blev der ikke observeret nogen bivirkninger på nyreudviklingen hos unger fra moderdyr, der fik irbesartan fra drægtighedsdag 15 til og med diegivningsdag 24 ved doser på 50, 180 eller 650 mg/kg/dag (op til 21,1 gange MRHD). De observerede virkninger menes at være sene svangerskabseffekter af lægemidlet. Drægtige kaniner, der fik orale doser af irbesartan på 30 mg/kg/dag (1,9 gange MRHD baseret på kropsoverfladeareal) oplevede en høj mødredødelighed og abort. Overlevende hunner havde en lille stigning i tidlige resorptioner og et tilsvarende fald i levende fostre.
Radioaktivitet var til stede hos rotte- og kaninfostre under sen drægtighed efter orale doser af radioaktivt mærket irbesartan.
Amning
Der er ingen tilgængelige data om tilstedeværelsen af irbesartan i modermælk, virkninger på mælkeproduktionen eller det ammede spædbarn. Irbesartan eller en anden metabolit af irbesartan udskilles i mælken hos diegivende rotter [se KLINISK FARMAKOLOGI ]. På grund af potentialet for uønskede virkninger på det ammende spædbarn frarådes brugen af AVAPRO 150mg til ammende kvinder.
Pædiatrisk brug
Irbesartan, i en undersøgelse med en dosis på op til 4,5 mg/kg/dag, én gang dagligt, syntes ikke at sænke blodtrykket effektivt hos pædiatriske patienter i alderen 6 til 16 år.
AVAPRO er ikke blevet undersøgt hos pædiatriske patienter under 6 år.
Geriatrisk brug
Af 4925 forsøgspersoner, der fik AVAPRO i kontrollerede kliniske undersøgelser af hypertension, var 911 (18,5 %) 65 år og derover, mens 150 (3,0 %) var 75 år og derover. Der blev ikke observeret nogen overordnede forskelle i effektivitet eller sikkerhed mellem disse forsøgspersoner og yngre forsøgspersoner, men større følsomhed hos nogle ældre individer kan ikke udelukkes. [Se KLINISK FARMAKOLOGI og Kliniske Studier ]
OVERDOSIS
Der er ingen tilgængelige data vedrørende overdosering hos mennesker. Daglige doser på 900 mg i 8 uger blev dog godt tolereret. De mest sandsynlige manifestationer af overdosering forventes at være hypotension og takykardi; bradykardi kan også forekomme ved overdosering. Irbesartan fjernes ikke ved hæmodialyse.
Akutte orale toksicitetsundersøgelser med irbesartan hos mus og rotter indikerede, at akutte letale doser var over henholdsvis 2000 mg/kg, ca. 25 gange og 50 gange MRHD (300 mg) baseret på kropsoverfladeareal.
KONTRAINDIKATIONER
AVAPRO 150mg er kontraindiceret til patienter, der er overfølsomme over for en komponent i dette produkt.
Giv ikke aliskiren samtidig med AVAPRO 300mg til patienter med diabetes.
KLINISK FARMAKOLOGI
Handlingsmekanisme
Angiotensin II er en potent vasokonstriktor dannet ud fra angiotensin I i en reaktion katalyseret af angiotensinkonverterende enzym (ACE, kininase II). Angiotensin II er det primære vasoaktive hormon i reninangiotensinsystemet og en vigtig komponent i patofysiologien af hypertension. Det stimulerer også aldosteronsekretion af binyrebarken. Irbesartan blokerer de vasokonstriktor- og aldosteronudskillende virkninger af angiotensin II ved selektivt at binde sig til AT1 angiotensin II-receptoren, der findes i mange væv (f.eks. vaskulær glat muskulatur, binyrer). Der er også en AT2-receptor i mange væv, men den er ikke involveret i kardiovaskulær homeostase.
Irbesartan er en specifik kompetitiv antagonist af AT1-receptorer med en meget større affinitet (mere end 8500 gange) til AT1-receptoren end til AT2-receptoren og uden agonistaktivitet.
Blokering af AT1-receptoren fjerner den negative feedback af angiotensin II på reninsekretion, men den resulterende øgede plasma-reninaktivitet og cirkulerende angiotensin II overvinder ikke virkningerne af irbesartan på blodtrykket.
Irbesartan hæmmer ikke ACE eller renin eller påvirker andre hormonreceptorer eller ionkanaler, der vides at være involveret i den kardiovaskulære regulering af blodtryk og natriumhomeostase.
Farmakodynamik
Hos raske forsøgspersoner frembragte enkelt orale irbesartandoser på op til 300 mg dosisafhængig hæmning af pressoreffekten af angiotensin II-infusioner. Hæmningen var fuldstændig (100 %) 4 timer efter orale doser på 150 mg eller 300 mg, og delvis hæmning blev opretholdt i 24 timer (henholdsvis 60 % og 40 % ved 300 mg og 150 mg).
Hos hypertensive patienter forårsager hæmning af angiotensin II-receptor efter kronisk administration af irbesartan en 1,5- til 2-fold stigning i angiotensin II-plasmakoncentrationen og en 2- til 3-fold stigning i plasmareninniveauer. Aldosteron plasmakoncentrationer falder generelt efter administration af irbesartan, men serumkaliumniveauer påvirkes ikke signifikant ved anbefalede doser.
Hos hypertensive patienter havde kroniske orale doser af irbesartan (op til 300 mg) ingen effekt på glomerulær filtrationshastighed, renal plasmaflow eller filtrationsfraktion. I undersøgelser med flere doser hos hypertensive patienter var der ingen klinisk vigtige virkninger på fastende triglycerider, total kolesterol eller HDL-kolesterolkoncentrationer. Der var ingen effekt på serumurinsyre under kronisk oral administration og ingen urikosurisk effekt.
Farmakokinetik
Absorption
Den orale absorption af irbesartan er hurtig og fuldstændig med en gennemsnitlig absolut biotilgængelighed på 60 % til 80 %. Efter oral administration af AVAPRO opnås maksimale plasmakoncentrationer af irbesartan 1,5 til 2 timer efter dosering. Mad påvirker ikke biotilgængeligheden af irbesartan.
Irbesartan udviser lineær farmakokinetik over det terapeutiske dosisområde.
Fordeling
Irbesartan er 90 % bundet til serumproteiner (primært albumin og α-syreglycoprotein) med ubetydelig binding til cellulære komponenter i blodet. Det gennemsnitlige distributionsvolumen er 53 til 93 liter.
Dyreforsøg indikerer, at radioaktivt mærket irbesartan svagt krydser blod-hjerne-barrieren og placenta. Irbesartan udskilles i mælken hos diegivende rotter.
Elimination
Samlet plasma- og nyreclearance er i området fra henholdsvis 157 til 176 ml/min og 3,0 til 3,5 ml/min. Den terminale eliminationshalveringstid for irbesartan er i gennemsnit 11 til 15 timer. Steady-state koncentrationer opnås inden for 3 dage. Begrænset akkumulering af irbesartan (
Metabolisme
Irbesartan er et oralt aktivt stof, der ikke kræver biotransformation til en aktiv form. Irbesartan metaboliseres via glucuronidkonjugering og oxidation. Efter oral eller intravenøs administration af Clabeled irbesartan kan mere end 80 % af den cirkulerende plasmaradioaktivitet tilskrives uændret irbesartan. Den primære cirkulerende metabolit er det inaktive irbesartan glucuronid konjugat (ca. 6%). De resterende oxidative metabolitter bidrager ikke mærkbart til irbesartans farmakologiske aktivitet.
In vitro undersøgelser indikerer, at irbesartan primært oxideres af CYP2C9; metabolisme af CYP3A4 er ubetydelig.
Udskillelse
Irbesartan og dets metabolitter udskilles både via galden og nyrerne. Efter enten oral eller intravenøs administration af 14C-mærket irbesartan genfindes ca. 20 % af radioaktiviteten i urinen og resten i fæces som irbesartan eller irbesartan glucuronid.
Specifikke populationer
Køn
Ingen kønsrelaterede forskelle i farmakokinetik er observeret hos raske ældre (alder 65-80 år) eller hos raske unge (alder 18-40 år). I undersøgelser af hypertensive patienter er der ingen kønsforskel i halveringstid eller akkumulering, men noget højere plasmakoncentrationer af irbesartan er observeret hos kvinder (11%-44%). Ingen kønsrelateret dosisjustering er nødvendig.
Geriatri
Hos ældre forsøgspersoner (65-80 år) ændres eliminationshalveringstiden for irbesartan ikke væsentligt, men AUC- og Cmax-værdier er omkring 20 % til 50 % højere end hos unge forsøgspersoner (18-40 år). Dosisjustering er ikke nødvendig hos ældre.
Race/etnicitet
Hos raske sorte forsøgspersoner er AUC-værdierne for irbesartan ca. 25 % højere end hvide; der er ingen forskel i Cmax-værdier.
Nedsat nyrefunktion
Irbesartans farmakokinetik er ikke ændret hos patienter med nedsat nyrefunktion eller hos patienter i hæmodialyse. Irbesartan fjernes ikke ved hæmodialyse. Ingen dosisjustering er nødvendig hos patienter med let til svær nyreinsufficiens, medmindre en patient med nedsat nyrefunktion også er volumenmangel [se ADVARSLER OG FORHOLDSREGLER og DOSERING OG ADMINISTRATION ].
Leverinsufficiens
Irbesartans farmakokinetik efter gentagen oral administration påvirkes ikke signifikant hos patienter med mild til moderat levercirrhose. Dosisjustering er ikke nødvendig hos patienter med leverinsufficiens.
Lægemiddel-lægemiddelinteraktioner
In vitro-studier viser signifikant hæmning af dannelsen af oxiderede irbesartan-metabolitter med de kendte cytokrom CYP2C9-substrater/hæmmere sulphenazol, tolbutamid og nifedipin. I kliniske undersøgelser var konsekvenserne af samtidig irbesartan på farmakodynamikken af warfarin imidlertid ubetydelige. Baseret på in vitro data forventes ingen interaktion med lægemidler, hvis metabolisme er afhængig af cytokrom P450 isoenzymer 1A1, 1A2, 2A6, 2B6, 2D6, 2E1 eller 3A4.
I separate undersøgelser af patienter, der fik vedligeholdelsesdoser af warfarin, hydrochlorthiazid eller digoxin, har administration af irbesartan i 7 dage ingen effekt på farmakodynamikken af warfarin (protrombintid) eller farmakokinetikken af digoxin. Irbesartans farmakokinetik påvirkes ikke af samtidig administration af nifedipin eller hydrochlorthiazid.
Kliniske Studier
Forhøjet blodtryk
Den antihypertensive virkning af AVAPRO blev undersøgt i 7 placebokontrollerede 8- til 12-ugers forsøg hos patienter med baseline diastolisk blodtryk på 95 til 110 mmHg. Doser på 1 til 900 mg blev inkluderet i disse forsøg for fuldt ud at udforske dosisområdet for irbesartan. Disse undersøgelser muliggjorde sammenligning af regimer én eller to gange dagligt ved 150 mg/dag, sammenligninger af top- og bundeffekter og sammenligninger af respons efter køn, alder og race. To af de syv placebokontrollerede undersøgelser identificeret ovenfor undersøgte de antihypertensive virkninger af irbesartan og hydrochlorthiazid i kombination.
De 7 undersøgelser af irbesartan monoterapi omfattede i alt 1915 patienter randomiseret til irbesartan (1-900 mg) og 611 patienter randomiseret til placebo. Doser én gang dagligt på 150 mg og 300 mg gav statistisk og klinisk signifikante fald i systolisk og diastolisk blodtryk med laveste (24 timer efter dosis) virkninger efter 6 til 12 ugers behandling sammenlignet med placebo på ca. 8-10/ henholdsvis 5–6 mmHg og 8–12/5–8 mmHg. Der blev ikke set yderligere effektforøgelse ved doser større end 300 mg. Dosis-respons-relationerne for virkninger på systolisk og diastolisk tryk er vist i figur 1 og 2.
Figur 1: Placebo-subtraheret reduktion i bundfald af SeSBP; integreret analyse
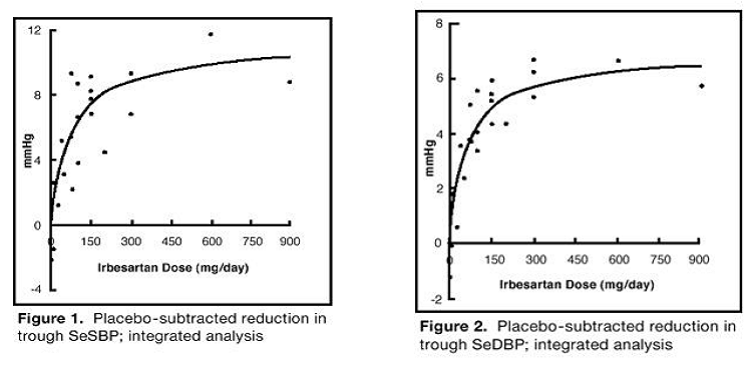
Figur 2: Placebo-subtraheret reduktion i bundfald af SeSBP; integreret analyse
En gang daglig administration af terapeutiske doser af irbesartan gav maksimale virkninger efter omkring 3 til 6 timer og, i et ambulant blodtryksmonitoreringsstudie, igen omkring 14 timer. Dette blev set ved både dosering én gang dagligt og to gange dagligt. Lav-til-top-forhold for systolisk og diastolisk respons var generelt mellem 60 % og 70 %. I et kontinuerligt ambulant blodtryksovervågningsstudie gav dosering én gang dagligt med 150 mg laveste og gennemsnitlige 24-timers respons svarende til dem, der blev observeret hos patienter, der fik dosering to gange dagligt med den samme samlede daglige dosis.
I kontrollerede forsøg gav tilføjelsen af irbesartan til hydrochlorthiaziddoser på 6,25 mg, 12,5 mg eller 25 mg yderligere dosisrelaterede blodtryksreduktioner svarende til dem, der opnås med den samme monoterapidosis af irbesartan. HCTZ havde også en tilnærmelsesvis additiv effekt.
Analyse af alder, køn og race undergrupper af patienter viste, at mænd og kvinder, og patienter over og under 65 år, generelt havde lignende svar. Irbesartan var effektivt til at reducere blodtrykket uanset race, selvom virkningen var noget mindre hos sorte (normalt en lav-renin-population).
Virkningen af irbesartan er tydelig efter den første dosis, og den er tæt på dens fulde observerede effekt efter 2 uger. Ved slutningen af en 8-ugers eksponering var omkring 2/3 af den antihypertensive effekt stadig til stede en uge efter den sidste dosis. Rebound-hypertension blev ikke observeret. Der var stort set ingen ændring i den gennemsnitlige hjertefrekvens hos irbesartan-behandlede patienter i kontrollerede undersøgelser.
Nefropati hos type 2-diabetespatienter
Irbesartan Diabetic Nephropathy Trial (IDNT) var et randomiseret, placebo- og aktivt-kontrolleret, dobbeltblindt, multicenter-studie udført på verdensplan med 1715 patienter med type 2-diabetes, hypertension (SeSBP >135 mmHg eller SeDBP >85 mmHg) og nefropati (serum). kreatinin 1,0 til 3,0 mg/dL hos kvinder eller 1,2 til 3,0 mg/dL hos mænd og proteinuri ≥900 mg/dag). Patienterne blev randomiseret til at modtage AVAPRO 75 mg, amlodipin 2,5 mg eller matchende placebo én gang dagligt. Patienterne blev titreret til en vedligeholdelsesdosis på AVAPRO 300 mg eller amlodipin 10 mg, alt efter hvad de tolererede. Yderligere antihypertensiva (eksklusive ACE-hæmmere, angiotensin II-receptorantagonister og calciumkanalblokkere) blev tilføjet efter behov for at nå blodtryksmålet (≤135/85 eller 10 mmHg reduktion i systolisk blodtryk, hvis højere end 160 mmHg) for patienter i alle grupper .
Undersøgelsespopulationen var 66,5 % mænd, 72,9 % under 65 år og 72 % hvide (asiatisk/Stillehavsøboer 5,0 %, sorte 13,3 %, spansktalende 4,8 %). De gennemsnitlige baseline siddende systoliske og diastoliske blodtryk var henholdsvis 159 mmHg og 87 mmHg. Patienterne gik ind i forsøget med en gennemsnitlig serumkreatinin på 1,7 mg/dL og en gennemsnitlig proteinuri på 4144 mg/dag.
Det gennemsnitlige opnåede blodtryk var 142/77 mmHg for AVAPRO, 142/76 mmHg for amlodipin og 145/79 mmHg for placebo. Samlet set fik 83,0 % af patienterne måldosis af irbesartan mere end 50 % af tiden. Patienterne blev fulgt i en gennemsnitlig varighed på 2,6 år.
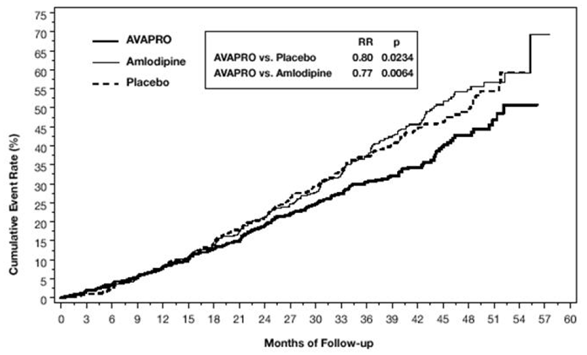
Det primære sammensatte endepunkt var tiden til forekomsten af en af følgende hændelser: fordobling af baseline serumkreatinin, nyresygdom i slutstadiet (ESRD; defineret ved serumkreatinin ≥6 mg/dL, dialyse eller nyretransplantation) eller død . Behandling med AVAPRO 150 mg resulterede i en risikoreduktion på 20 % i forhold til placebo (p=0,0234) (se figur 3 og tabel 1). Behandling med AVAPRO 150 mg reducerede også forekomsten af vedvarende fordobling af serumkreatinin som et separat endepunkt (33 %), men havde ingen signifikant effekt på ESRD alene og ingen effekt på den samlede dødelighed (se tabel 1).
Figur 3: IDNT: Kaplan-Meier-estimater af primært endepunkt (fordobling af serumkreatinin, nyresygdom i slutstadiet eller dødelighed af alle årsager)
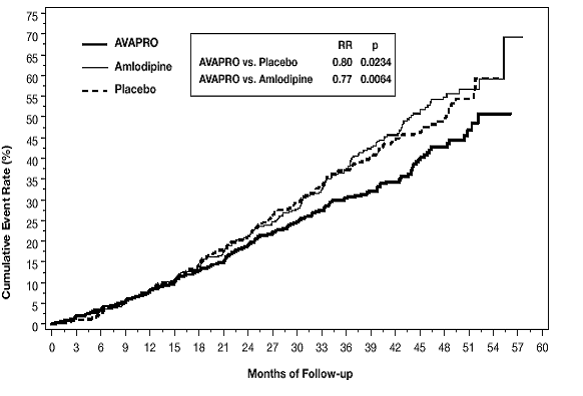
Procentdelen af patienter, der oplever en hændelse i løbet af undersøgelsen, kan ses i tabel 1 nedenfor:
Undersøgelsens sekundære endepunkt var en sammensætning af kardiovaskulær dødelighed og morbiditet (myokardieinfarkt, hospitalsindlæggelse for hjertesvigt, slagtilfælde med permanent neurologisk deficit, amputation). Der var ingen statistisk signifikante forskelle mellem behandlingsgrupperne i disse endepunkter. Sammenlignet med placebo reducerede AVAPRO 150 mg proteinuri signifikant med ca. 27 %, en effekt der var tydelig inden for 3 måneder efter start af behandlingen. AVAPRO reducerede signifikant hastigheden af tab af nyrefunktion (glomerulær filtrationshastighed), målt ved den reciproke af serumkreatininkoncentrationen, med 18,2 %.
Tabel 2 viser resultater for demografiske undergrupper. Undergruppeanalyser er svære at fortolke, og det vides ikke, om disse observationer repræsenterer sande forskelle eller tilfældige effekter. For det primære endepunkt blev AVAPROs gunstige virkning set hos patienter, der også tog anden antihypertensiv medicin (angiotensin II-receptorantagonister, angiotensin-konverterende enzymhæmmere og calciumkanalblokkere var ikke tilladt), orale hypoglykæmiske midler og lipid- sænkende midler.
PATIENTOPLYSNINGER
Graviditet
Rådgiv kvindelige patienter i den fødedygtige alder om konsekvenserne af eksponering for AVAPRO under graviditet. Diskuter behandlingsmuligheder med kvinder, der planlægger at blive gravide. Patienter bør bedes om at rapportere graviditeter til deres læger så hurtigt som muligt.
Kaliumtilskud
Rådgiv patienter, der får AVAPRO, ikke at bruge kaliumtilskud eller salterstatninger, der indeholder kalium uden at konsultere deres læge [se DRUGSINTERAKTIONER ].
