Benicar 10mg, 20mg, 40mg Olmesartan Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Benicar 40mg, og hvordan bruges det?
Benicar er en receptpligtig medicin, der bruges til at behandle symptomer på forhøjet blodtryk (hypertension). Benicar 10mg kan bruges alene eller sammen med anden medicin.
Benicar er en angiotensin II-receptorblokker eller ARB'er.
Det vides ikke, om Benicar er sikkert og effektivt til børn under 6 år.
Hvad er de mulige bivirkninger af Benicar 40mg?
Benicar kan forårsage alvorlige bivirkninger, herunder:
- svimmelhed
- lidt eller ingen vandladning
- hævelse i dine hænder eller fødder
- kvalme
- svaghed
- prikkende følelse
- brystsmerter
- hurtig eller uregelmæssig hjerterytme
- tab af bevægelse
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Benicar omfatter:
- svimmelhed
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Benicar. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
FØTALT TOKSICITET
- Når graviditet opdages, skal du stoppe med Benicar 40mg så hurtigt som muligt [se ADVARSLER OG FORHOLDSREGLER]
- Lægemidler, der virker direkte på renin-angiotenerne i systemet, kan forårsage skade og død på det udviklende foster [se ADVARSLER OG FORHOLDSREGLER]
BESKRIVELSE
Olmesartan medoxomil, et prodrug, hydrolyseres til olmesartan under absorption fra mave-tarmkanalen. Olmesartan er en selektiv AT1-undertype angiotensin II-receptorantagonist.
Olmesartanmedoxomil beskrives kemisk som 2,3-dihydroxy-2-butenyl-4-(1-hydroxy-1-methylethyl)-2-propyl-1-[p-(o-1H-tetrazol-5-ylphenyl)benzyl]imidazol- 5 carboxylat, cyklisk 2,3-carbonat.
Dens empiriske formel er C29H30N6O6 og dens strukturformel er:
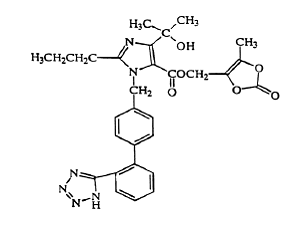
Olmesartan medoxomil er et hvidt til lys gulligt-hvidt pulver eller krystallinsk pulver med en molekylvægt på 558,59. Det er praktisk talt uopløseligt i vand og tungtopløseligt i methanol. Benicar 20mg er tilgængelig til oral brug som filmovertrukne tabletter indeholdende 5 mg, 20 mg eller 40 mg olmesartanmedoxomil og følgende inaktive ingredienser: hydroxypropylcellulose, hypromellose, lactosemonohydrat, lavsubstitueret hydroxypropylcellulose, magnesiumstearat, mikrokrystallinsk cellulose , talkum, titaniumdioxid og (kun 5 mg) gult jernoxid.
INDIKATIONER
Benicar 40mg er indiceret til behandling af hypertension hos voksne og børn fra seks år og ældre for at sænke blodtrykket. Sænkning af blodtrykket reducerer risikoen for fatale og ikke-dødelige kardiovaskulære hændelser, primært slagtilfælde og myokardieinfarkter. Disse fordele er blevet set i kontrollerede forsøg med antihypertensiva fra en lang række farmakologiske klasser, herunder den klasse, som dette lægemiddel hovedsagelig tilhører. Der er ingen kontrollerede forsøg, der viser risikoreduktion med Benicar.
Kontrol af forhøjet blodtryk bør være en del af omfattende kardiovaskulær risikostyring, herunder, hvor det er relevant, lipidkontrol, diabetesbehandling, antitrombotisk behandling, rygestop, motion og begrænset natriumindtag. Mange patienter vil kræve mere end ét lægemiddel for at nå blodtryksmålene. For specifik rådgivning om mål og ledelse, se offentliggjorte retningslinjer, såsom dem fra National High Blood Pressure Education Program's Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC).
Talrige antihypertensiva, fra en række farmakologiske klasser og med forskellige virkningsmekanismer, er i randomiserede kontrollerede forsøg blevet vist at reducere kardiovaskulær morbiditet og dødelighed, og det kan konkluderes, at det er blodtryksreduktion og ikke en anden farmakologisk egenskab ved stofferne, der i høj grad er ansvarlige for disse fordele. Den største og mest konsistente kardiovaskulære udfaldsfordel har været en reduktion i risikoen for slagtilfælde, men reduktioner i myokardieinfarkt og kardiovaskulær dødelighed er også set regelmæssigt.
Forhøjet systolisk eller diastolisk tryk forårsager øget kardiovaskulær risiko, og den absolutte risikostigning pr. mmHg er større ved højere blodtryk, så selv beskedne reduktioner af svær hypertension kan give væsentlige fordele. Relativ risikoreduktion fra blodtryksreduktion er ens på tværs af populationer med varierende absolut risiko, så den absolutte fordel er større hos patienter, der er i højere risiko uafhængigt af deres hypertension (f.eks. patienter med diabetes eller hyperlipidæmi), og sådanne patienter kan forventes at drage fordel af mere aggressiv behandling til et lavere blodtryksmål.
Nogle antihypertensiva har mindre blodtrykseffekter (som monoterapi) hos sorte patienter, og mange antihypertensiva har yderligere godkendte indikationer og virkninger (f.eks. på angina, hjertesvigt eller diabetisk nyresygdom). Disse overvejelser kan styre valg af terapi.
Det kan anvendes alene eller i kombination med andre antihypertensiva.
DOSERING OG ADMINISTRATION
Voksen hypertension
Dosering skal være individuel. Den sædvanlige anbefalede startdosis af Benicar 20 mg er 20 mg én gang dagligt, når det anvendes som monoterapi hos patienter, der ikke er volumenkontrakterede. For patienter, der har behov for yderligere reduktion af blodtrykket efter 2 ugers behandling, kan dosis af Benicar øges til 40 mg. Doser over 40 mg ser ikke ud til at have større effekt. Dosering to gange dagligt giver ingen fordel i forhold til den samme samlede dosis givet én gang dagligt.
For patienter med mulig udtømning af intravaskulært volumen (f.eks. patienter behandlet med diuretika, især dem med nedsat nyrefunktion), påbegynd Benicar under tæt medicinsk overvågning og overvej at bruge en lavere startdosis [se ADVARSLER OG FORHOLDSREGLER ].
Pædiatrisk hypertension (6 år og ældre)
Dosering skal være individuel. For børn, der kan sluge tabletter, er den sædvanlige anbefalede startdosis af Benicar 10 mg én gang dagligt for patienter, der vejer 20 til
Brug af Benicar 10 mg til børn ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
Til børn, der ikke kan sluge tabletter, kan den samme dosis gives ved hjælp af en extempore suspension som beskrevet nedenfor [se KLINISK FARMAKOLOGI ]. Følg instruktionerne til fremstilling af suspension nedenfor for at administrere Benicar som en suspension.
Fremstilling af suspension (til 200 ml af en 2 mg/ml suspension)
Tilsæt 50 ml renset vand til en ravfarvet polyethylenterephthalat (PET) flaske indeholdende tyve Benicar 20 mg tabletter og lad det stå i mindst 5 minutter. Ryst beholderen i mindst 1 minut og lad suspensionen stå i mindst 1 minut. Gentag 1 minuts omrystning og 1 minuts stående yderligere fire gange. Tilsæt 100 mL ORA-Sweet® og 50 mL ORA-Plus®* til suspensionen og ryst godt i mindst 1 minut. Suspensionen skal opbevares i køleskab ved 2-8°C (36-46°F) og kan opbevares i op til 4 uger. Ryst suspensionen godt før hver brug og sæt den straks tilbage i køleskabet.
HVORDAN LEVERET
Doseringsformer og styrker
- 5 mg gule, runde, filmovertrukne tabletter uden delekærv præget med Sankyo på den ene side og C12 på den anden side
- 20 mg hvide, runde, filmovertrukne tabletter uden delekærv præget med Sankyo på den ene side og C14 på den anden side
- 40 mg hvide, ovale, filmovertrukne tabletter uden delekærv præget med Sankyo på den ene side og C15 på den anden side
Opbevaring og håndtering
Benicar leveres som gule, runde, filmovertrukne tabletter uden delekærv indeholdende 5 mg olmesartanmedoxomil, som hvide, runde, filmovertrukne tabletter uden delekærv indeholdende 20 mg olmesartanmedoxomil og som hvide, ovale. , filmovertrukne tabletter uden delekærv indeholdende 40 mg olmesartanmedoxomil. Tabletterne er præget med Sankyo på den ene side og C12, C14 eller C15 på den anden side af henholdsvis 5, 20 og 40 mg tabletterne.
Tabletterne leveres som følger:
Opbevaring
Opbevares ved 20-25°C (68-77°F) [se USP-kontrolleret rumtemperatur].
Fremstillet til Daiichi Sankyo, Inc., Basking Ridge, NJ 07920. Revideret: Okt 2019
BIVIRKNINGER
Erfaring med kliniske forsøg
Fordi kliniske undersøgelser udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske undersøgelser af et lægemiddel ikke direkte sammenlignes med frekvenser i de kliniske undersøgelser af et andet lægemiddel og afspejler muligvis ikke frekvenserne observeret i praksis.
Voksen hypertension
Benicar er blevet evalueret for sikkerhed hos mere end 3825 patienter/personer, herunder mere end 3275 patienter behandlet for hypertension i kontrollerede forsøg. Denne erfaring omfattede omkring 900 patienter behandlet i mindst 6 måneder og mere end 525 i mindst 1 år. Hændelser var generelt milde, forbigående og havde ingen relation til dosis af Benicar.
Analyse af køns-, alders- og racegrupper viste ingen forskelle mellem Benicar 40 mg og placebobehandlede patienter. Hyppigheden af seponeringer på grund af bivirkninger i alle forsøg med hypertensive patienter var 2,4 % (dvs. 79/3278) af patienter behandlet med Benicar 40 mg og 2,7 % (dvs. 32/1179) af kontrolpatienter. I placebokontrollerede forsøg var den eneste bivirkning, der forekom hos mere end 1 % af patienterne behandlet med Benicar 20 mg og med en højere forekomst i forhold til placebo, svimmelhed (3 % vs. 1 %).
Ansigtsødem blev rapporteret hos fem patienter, der fik Benicar. Angioødem er blevet rapporteret med angiotensin II-antagonister.
Pædiatrisk hypertension
Der blev ikke identificeret nogen relevante forskelle mellem bivirkningsprofilen for pædiatriske patienter i alderen 1 til 16 år og den tidligere rapporterede for voksne patienter.
Post-marketing oplevelse
Følgende bivirkninger er blevet rapporteret efter markedsføring. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Kroppen som helhed: Asteni, angioødem, anafylaktiske reaktioner
Gastrointestinale: Opkastning, sprue-lignende enteropati [se ADVARSLER OG FORHOLDSREGLER ]
Metaboliske og ernæringsforstyrrelser: Hyperkaliæmi
Muskuloskeletale: Rhabdomyolyse
Urogenital system: Akut nyresvigt, øget blodkreatininniveau
Hud og vedhæng: Alopeci, pruritus, nældefeber
Data fra et kontrolleret forsøg og en epidemiologisk undersøgelse har antydet, at højdosis olmesartan kan øge kardiovaskulær (CV) risiko hos diabetespatienter, men de overordnede data er ikke afgørende. Det randomiserede, placebokontrollerede, dobbeltblinde ROADMAP-studie (Randomized Olmesartan And Diabetes MicroAlbuminuria Prevention trial, n=4447) undersøgte brugen af olmesartan, 40 mg dagligt, vs. placebo hos patienter med type 2-diabetes mellitus, normoalbuminuri og kl. mindst én yderligere risikofaktor for CV-sygdom. Forsøget opfyldte sit primære endepunkt, forsinket indtræden af mikroalbuminuri, men olmesartan havde ingen gavnlig effekt på faldet i glomerulær filtrationshastighed (GFR). Der var et fund af øget CV-dødelighed (bedømt pludselig hjertedød, fatalt myokardieinfarkt, fatalt slagtilfælde, revaskulariseringsdød) i olmesartan-gruppen sammenlignet med placebo-gruppen (15 olmesartan vs. 3 placebo, HR 4,9, 95 % konfidensinterval [CI ], 1,4, 17), men risikoen for ikke-dødelig myokardieinfarkt var lavere med olmesartan (HR 0,64, 95 % CI 0,35, 1,18).
Det epidemiologiske studie omfattede patienter 65 år og ældre med en samlet eksponering på > 300.000 patientår. I undergruppen af diabetespatienter, der fik højdosis olmesartan (40 mg/d) i > 6 måneder, så der ud til at være en øget risiko for død (HR 2,0, 95 % CI 1,1, 3,8) sammenlignet med lignende patienter, der tog andre angiotensin-receptorblokkere. I modsætning hertil syntes højdosis olmesartan til ikke-diabetespatienter at være forbundet med en nedsat risiko for død (HR 0,46, 95 % CI 0,24, 0,86) sammenlignet med lignende patienter, der tog andre angiotensinreceptorblokkere. Der blev ikke observeret forskelle mellem grupperne, der fik lavere doser af olmesartan sammenlignet med andre angiotensinblokkere, eller dem, der fik behandling i
Samlet set giver disse data anledning til bekymring for en mulig øget CV-risiko forbundet med brugen af højdosis olmesartan til diabetespatienter. Der er dog bekymringer med troværdigheden af fundet af øget CV-risiko, især observationen i den store epidemiologiske undersøgelse for en overlevelsesgevinst hos ikke-diabetikere af en størrelsesorden svarende til det negative fund hos diabetikere.
DRUGSINTERAKTIONER
Midler, der øger serumkalium
Samtidig brug af olmesartan med andre midler, der blokerer renin-angiotensin-systemet, kaliumbesparende diuretika (f.eks. spironolacton, triamteren, amilorid), kaliumtilskud, salterstatninger indeholdende kalium eller andre lægemidler, der kan øge kaliumniveauet (f.eks. heparin) kan føre til stigninger i serumkalium. Hvis samtidig medicin anses for nødvendigt, tilrådes monitorering af serumkalium.
Ikke-steroide antiinflammatoriske midler, herunder selektive cyclooxygenase-2-hæmmere (COX-2-hæmmere)
Hos ældre patienter, volumendepleterede (inklusive dem i diuretikabehandling) eller med nedsat nyrefunktion, kan samtidig administration af NSAID'er, herunder selektive COX-2-hæmmere, med angiotensin II-receptorantagonister, inklusive olmesartanmedoxomil, resultere i forværring af nyrefunktionen, herunder eventuelt akut nyresvigt. Disse virkninger er normalt reversible. Overvåg nyrefunktionen periodisk hos patienter, der får olmesartanmedoxomil og NSAID-behandling.
Den antihypertensive virkning af angiotensin II-receptorantagonister, inklusive olmesartanmedoxomil, kan svækkes af NSAID'er, herunder selektive COX-2-hæmmere.
Dobbelt blokade af Renin-Angiotensin System (RAS)
Dobbelt blokade af RAS med angiotensinreceptorblokkere, ACE-hæmmere eller aliskiren er forbundet med øget risiko for hypotension, hyperkaliæmi og ændringer i nyrefunktionen (inklusive akut nyresvigt) sammenlignet med monoterapi. De fleste patienter, der får kombinationen af to RAS-hæmmere, opnår ingen yderligere fordele sammenlignet med monoterapi. Undgå generelt kombineret brug af RAS-hæmmere. Overvåg nøje blodtryk, nyrefunktion og elektrolytter hos patienter på Benicar og andre midler, der påvirker RAS.
Giv ikke aliskiren samtidig med Benicar til patienter med diabetes [se KONTRAINDIKATIONER ]. Undgå brug af aliskiren med Benicar 40 mg til patienter med nedsat nyrefunktion (GFR
Lithium
Stigninger i serumlithiumkoncentrationer og lithiumtoksicitet er blevet rapporteret under samtidig administration af lithium og angiotensin II-receptorantagonister, inklusive BENICAR. Overvåg serumlithiumniveauer under samtidig brug.
Colesevelam Hydrochlorid
Samtidig administration af galdesyrebindende middel colesevelamhydrochlorid reducerer den systemiske eksponering og maksimale plasmakoncentration af olmesartan. Administration af olmesartan mindst 4 timer før colesevelamhydrochlorid reducerede lægemiddelinteraktionseffekten. Overvej at administrere olmesartan mindst 4 timer før dosis af colesevelamhydrochlorid [se KLINISK FARMAKOLOGI ].
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Føtal toksicitet
Benicar 10mg kan forårsage fosterskader, når det administreres til en gravid kvinde. Brug af lægemidler, der virker på renin-angiotensin-systemet (RAS) i andet og tredje trimester af graviditeten, reducerer føtal nyrefunktion og øger føtal og neonatal morbiditet og død. Resulterende oligohydramnios kan være forbundet med føtal lungehypoplasi og skeletdeformationer. Potentielle neonatale bivirkninger omfatter kraniehypoplasi, anuri, hypotension, nyresvigt og død. Når graviditet opdages, skal du seponere Benicar så hurtigt som muligt [se Brug i specifikke populationer ].
Sygelighed hos spædbørn
Brug af Benicar til børn Brug i specifikke populationer ].
Hypotension hos patienter med volumen-eller saltdepletering
Hos patienter med et aktiveret renin-angiotensin-aldosteron-system, såsom volumen- og/eller saltfattige patienter (f.eks. dem, der behandles med høje doser diuretika), kan symptomatisk hypotension forventes efter påbegyndelse af behandling med Benicar. Påbegynd behandling under tæt medicinsk overvågning og overvej at starte med en lavere dosis. Hvis der opstår hypotension, læg patienten i liggende stilling og giv om nødvendigt en intravenøs infusion af normalt saltvand [se DOSERING OG ADMINISTRATION ]. Et forbigående hypotensivt respons er ikke en kontraindikation for yderligere behandling, som normalt kan fortsættes uden besvær, når blodtrykket er stabiliseret.
Nedsat nyrefunktion
Som følge af hæmning af renin-angiotensin-aldosteron-systemet kan ændringer i nyrefunktionen forventes hos følsomme personer, der behandles med Benicar. Hos patienter, hvis nyrefunktion kan afhænge af aktiviteten af renin-angiotensinaldosteron-systemet (f.eks. patienter med alvorlig kongestiv hjertesvigt), er behandling med angiotensin-konverterende enzym (ACE)-hæmmere og angiotensin-receptor-antagonister blevet forbundet med oliguri og/eller progressiv azotæmi. og sjældent med akut nyresvigt og/eller død. Lignende resultater kan forventes hos patienter behandlet med Benicar [se DOSERING OG ADMINISTRATION , DRUGSINTERAKTIONER , Brug i specifikke populationer og KLINISK FARMAKOLOGI ].
I undersøgelser af ACE-hæmmere hos patienter med unilateral eller bilateral nyrearteriestenose er stigninger i serumkreatinin eller blodurinstofnitrogen (BUN) blevet rapporteret. Der har ikke været langtidsbrug af Benicar hos patienter med unilateral eller bilateral nyrearteriestenose, men lignende resultater kan forventes.
Sprue-lignende enteropati
Alvorlig, kronisk diarré med betydeligt vægttab er blevet rapporteret hos patienter, der tager olmesartan måneder til år efter behandlingsstart. Intestinale biopsier af patienter viste ofte villøs atrofi. Hvis en patient udvikler disse symptomer under behandling med olmesartan, udelukkes andre ætiologier. Overvej alternativ antihypertensiv behandling i tilfælde, hvor ingen anden ætiologi er identificeret.

Hyperkaliæmi
Serumkalium bør overvåges hos patienter, der får Benicar. Lægemidler, der hæmmer renin-angiotensinsystemet, kan forårsage hyperkaliæmi. Risikofaktorer for udvikling af hyperkaliæmi omfatter nyreinsufficiens, diabetes mellitus og samtidig brug af kaliumbesparende diuretika, kaliumtilskud og/eller kaliumholdige salterstatninger [se DRUGSINTERAKTIONER ].
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Olmesartan medoxomil var ikke karcinogent, når det blev administreret ved diæt til rotter i op til 2 år. Den højeste testede dosis (2000 mg/kg/dag) var på mg/m2-basis ca. 480 gange den maksimalt anbefalede humane dosis (MRHD) på 40 mg/dag. To carcinogenicitetsundersøgelser udført i mus, en 6-måneders sondemadundersøgelse i p53 knockout-musen og en 6-måneders diætadministrationsundersøgelse i den transgene Hras2-mus i doser på op til 1000 mg/kg/dag (ca. 120 gange MRHD) , viste ingen tegn på en karcinogen effekt af olmesartan medoxomil.
Både olmesartan medoxomil og olmesartan testede negativt i in vitro syrisk hamster embryo celletransformation assay og viste ingen tegn på genetisk toksicitet i Ames (bakteriel mutagenicitet) testen. Begge viste sig imidlertid at inducere kromosomafvigelser i dyrkede celler in vitro (kinesisk hamsterlunge) og testede positive for thymidinkinasemutationer i in vitro muselymfomanalysen. Olmesartan medoxomil testede negativt in vivo for mutationer i MutaMouse-tarmen og nyren og for klastogenicitet i museknoglemarv (mikronukleustest) ved orale doser på op til 2000 mg/kg (olmesartan ikke testet).
Fertilitet hos rotter var upåvirket af administration af olmesartanmedoxomil i dosisniveauer så høje som 1000 mg/kg/dag (240 gange MRHD) i en undersøgelse, hvor doseringen blev påbegyndt 2 (hun) eller 9 (han) uger før parring.
Brug i specifikke populationer
Graviditet
Risikooversigt
Benicar 10mg kan forårsage fosterskader, når det administreres til en gravid kvinde. Brug af lægemidler, der virker på renin-angiotensin-systemet i andet og tredje trimester af graviditeten, reducerer føtal nyrefunktion og øger føtal og neonatal morbiditet og død. De fleste epidemiologiske undersøgelser, der undersøgte føtale abnormiteter efter eksponering for antihypertensiv brug i første trimester, har ikke skelnet lægemidler, der påvirker renin-angiotensin-systemet, fra andre antihypertensiva. I reproduktionsstudier på dyr resulterede Benicar-behandling under organogenese i øget embryoføtal toksicitet hos rotter ved doser, der var lavere end maternelt toksiske doser.
Når graviditet opdages, skal du seponere Benicar så hurtigt som muligt. Overvej alternativ antihypertensiv behandling under graviditet.
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort for den angivne population er ukendt. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre ugunstige udfald. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2%-4% og 15%-20%.
Kliniske overvejelser
Sygdomsassocieret moder- og/eller embryo-/fosterrisiko
Hypertension under graviditet øger moderens risiko for præeklampsi, svangerskabsdiabetes, for tidlig fødsel og fødselskomplikationer (f.eks. behov for kejsersnit og post-partum blødning). Hypertension øger fosterets risiko for intrauterin vækstbegrænsning og intrauterin død. Gravide kvinder med hypertension bør overvåges omhyggeligt og behandles i overensstemmelse hermed.
Fetale/neonatale bivirkninger
Oligohydramnios hos gravide kvinder, der bruger lægemidler, der påvirker renin-angiotensin-systemet i graviditetens andet og tredje trimester, kan resultere i følgende: nedsat føtal nyrefunktion, der fører til anuri og nyresvigt, føtal lungehypoplasi, skeletdeformationer, herunder kraniehypoplasi, hypotension og døden. Hos patienter, der tager Benicar 20 mg under graviditet, skal du udføre serielle ultralydsundersøgelser for at vurdere det intra-amniotiske miljø. Fostertest kan være passende, baseret på graviditetsugen. Patienter og læger skal dog være opmærksomme på, at oligohydramnios muligvis ikke vises, før fosteret har pådraget sig irreversibel skade.
Overvåg nøje spædbørn med historier om in utero eksponering for Benicar 40 mg for hypotension, oliguri og hyperkaliæmi. Hvis der opstår oliguri eller hypotension hos nyfødte med en anamnese med in utero eksponering for Benicar, skal der anvendes foranstaltninger til at opretholde tilstrækkeligt blodtryk og nyreperfusion. Udskiftningstransfusioner eller dialyse kan være påkrævet som et middel til at vende hypotension og understøtte nyrefunktionen.
Data
Dyredata
Der blev ikke observeret teratogene virkninger, når olmesartanmedoxomil blev administreret til drægtige rotter i orale doser op til 1000 mg/kg/dag (240 gange den maksimale anbefalede humane dosis (MRHD) på mg/m2-basis) eller gravide kaniner i orale doser op til 1 mg/kg/dag (halvdelen af MRHD på mg/m2-basis; højere doser kunne ikke evalueres for virkninger på fosterudviklingen, da de var dødelige for dorne). Hos rotter blev der observeret signifikante fald i ungernes fødselsvægt og vægtøgning ved doser ≥1,6 mg/kg/dag og forsinkelser i udviklingsmæssige milepæle (forsinket adskillelse af øret auricula, udbrud af nedre fortænder, udseende af abdominalt hår, nedstigning af testikler, og adskillelse af øjenlåg) og dosisafhængige stigninger i forekomsten af dilatation af nyrebækkenet blev observeret ved doser ≥ 8 mg/kg/dag. Den ingen observerede effektdosis for udviklingstoksicitet hos rotter er 0,3 mg/kg/dag, ca. en tiendedel af MRHD på 40 mg/dag.
Amning
Risikooversigt
Der er ingen information om tilstedeværelsen af olmesartan i modermælk, virkningerne på det ammede spædbarn eller virkningerne på mælkeproduktionen. Olmesartan udskilles i lav koncentration i mælken fra diegivende rotter (se Data ). På grund af potentialet for uønskede virkninger på det ammende spædbarn, bør der tages en beslutning om, hvorvidt amningen skal afbrydes eller lægemidlet skal seponeres under hensyntagen til lægemidlets betydning for moderen.
Data
Tilstedeværelse af olmesartan i mælk blev observeret efter en enkelt oral administration af 5 mg/kg [14C] olmesartan medoxomil til diegivende rotter.
Pædiatrisk brug
De antihypertensive virkninger af Benicar blev evalueret i et randomiseret, dobbeltblindt klinisk studie med pædiatriske patienter i alderen 1 til 16 år [se Kliniske Studier ]. Benicars farmakokinetik blev evalueret hos pædiatriske patienter i alderen 1 til 16 år [se KLINISK FARMAKOLOGI ]. Benicar 10 mg var generelt veltolereret hos pædiatriske patienter, og bivirkningsprofilen svarede til den, der er beskrevet for voksne.
Benicar 20mg har ikke vist sig at være effektiv til hypertension hos børn
Brug af Benicar til børn ADVARSLER OG FORHOLDSREGLER ]. Renin-angiotensin-aldosteron-systemet (RAAS) spiller en afgørende rolle i nyreudviklingen. RAAS-blokade har vist sig at føre til unormal nyreudvikling hos meget unge mus. Administration af lægemidler, der virker direkte på reninangiotensin-aldosteronsystemet (RAAS), kan ændre den normale nyreudvikling.
Geriatrisk brug
Af det samlede antal hypertensive patienter, der fik Benicar i kliniske undersøgelser, var mere end 20 % 65 år og derover, mens mere end 5 % var 75 år og ældre. Der blev ikke observeret nogen overordnede forskelle i effektivitet eller sikkerhed mellem ældre patienter og yngre patienter. Andre rapporterede kliniske erfaringer har ikke identificeret forskelle i respons mellem ældre og yngre patienter, men større følsomhed hos nogle ældre individer kan ikke udelukkes [se KLINISK FARMAKOLOGI ].
Nedsat leverfunktion
Forøgelser i AUC0-∞ og Cmax blev observeret hos patienter med moderat nedsat leverfunktion sammenlignet med dem i matchede kontroller, med en stigning i AUC på ca. 60 %. Ingen initial dosisjustering anbefales til patienter med moderat til markant leverdysfunktion [se KLINISK FARMAKOLOGI ].
Nedsat nyrefunktion
Patienter med nyreinsufficiens har forhøjede serumkoncentrationer af olmesartan sammenlignet med personer med normal nyrefunktion. Efter gentagen dosering blev AUC ca. tredoblet hos patienter med svært nedsat nyrefunktion (kreatininclearance DOSERING OG ADMINISTRATION , ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Sorte patienter
Den antihypertensive effekt af Benicar 10 mg var mindre hos sorte patienter (sædvanligvis en lav-renin-population), som det er set med ACE-hæmmere, betablokkere og andre angiotensinreceptorblokkere.
OVERDOSIS
Begrænsede data er tilgængelige relateret til overdosering hos mennesker. De mest sandsynlige manifestationer af overdosering vil være hypotension og takykardi; bradykardi kan opstå, hvis der forekommer parasympatisk (vagal) stimulation. Hvis der opstår symptomatisk hypotension, påbegyndes understøttende behandling. Dialyserbarheden af olmesartan er ukendt.
KONTRAINDIKATIONER
Giv ikke aliskiren samtidig med Benicar 20 mg til patienter med diabetes [se DRUGSINTERAKTIONER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Angiotensin II dannes ud fra angiotensin I i en reaktion katalyseret af angiotensin-konverterende enzym (ACE, kininase II). Angiotensin II er det vigtigste pressormiddel i renin-angiotensin-systemet, med virkninger, der omfatter vasokonstriktion, stimulering af syntese og frigivelse af aldosteron, hjertestimulering og renal reabsorption af natrium. Olmesartan blokerer de vasokonstriktoreffekter af angiotensin II ved selektivt at blokere bindingen af angiotensin II til AT1-receptoren i vaskulær glat muskulatur. Dets virkning er derfor uafhængig af veje til angiotensin II-syntese.
En AT2-receptor findes også i mange væv, men denne receptor vides ikke at være forbundet med kardiovaskulær homeostase. Olmesartan har mere end 12.500 gange større affinitet til AT1-receptoren end til AT2-receptoren.
Blokering af renin-angiotensin-systemet med ACE-hæmmere, som hæmmer biosyntesen af angiotensin II fra angiotensin I, er en mekanisme for mange lægemidler, der bruges til at behandle hypertension. ACE-hæmmere hæmmer også nedbrydningen af bradykinin, en reaktion også katalyseret af ACE. Da olmesartanmedoxomil ikke hæmmer ACE (kininase II), påvirker det ikke responsen på bradykinin. Om denne forskel har klinisk relevans vides endnu ikke.
Blokering af angiotensin II-receptoren hæmmer den negative regulatoriske feedback af angiotensin II på reninsekretion, men den resulterende øgede plasmareninaktivitet og cirkulerende angiotensin II-niveauer overvinder ikke effekten af olmesartan på blodtrykket.
Farmakodynamik
Benicar-doser på 2,5 mg til 40 mg hæmmer pressoreffekterne af angiotensin I-infusion. Varigheden af den hæmmende effekt var relateret til dosis, idet doser af Benicar >40 mg gav >90 % hæmning efter 24 timer.
Plasmakoncentrationer af angiotensin I og angiotensin II og plasmareninaktivitet (PRA) stiger efter enkelt og gentagen administration af Benicar 10 mg til raske forsøgspersoner og hypertensive patienter. Gentagen administration af op til 80 mg Benicar havde minimal indflydelse på aldosteronniveauer og ingen effekt på serumkalium.
Farmakokinetik
Absorption
Olmesartan medoxomil bioaktiveres hurtigt og fuldstændigt ved esterhydrolyse til olmesartan under absorption fra mave-tarmkanalen.
Benicar-tabletter og suspensionsformuleringen fremstillet af Benicar-tabletter er bioækvivalente [se DOSERING OG ADMINISTRATION ].
Den absolutte biotilgængelighed af olmesartan er ca. 26 %. Efter oral administration nås den maksimale plasmakoncentration (Cmax) af olmesartan efter 1 til 2 timer. Mad påvirker ikke biotilgængeligheden af olmesartan. Benicar kan administreres med eller uden mad.
Fordeling
Fordelingsvolumen af olmesartan er ca. 17 l. Olmesartan er stærkt bundet til plasmaproteiner (99%) og trænger ikke ind i røde blodlegemer. Proteinbindingen er konstant ved plasmakoncentrationer af olmesartan et godt stykke over det område, der opnås med anbefalede doser.
Hos rotter passerede olmesartan blod-hjerne-barrieren dårligt, hvis overhovedet. Olmesartan passerede over placentabarrieren hos rotter og blev fordelt til fosteret. Olmesartan blev distribueret til mælk i lave niveauer hos rotter.
Metabolisme og udskillelse
Efter den hurtige og fuldstændige omdannelse af olmesartanmedoxomil til olmesartan under absorption er der praktisk talt ingen yderligere metabolisme af olmesartan. Total plasmaclearance af olmesartan er 1,3 l/time med en renal clearance på 0,6 l/time. Ca. 35 % til 50 % af den absorberede dosis genfindes i urinen, mens resten udskilles i fæces via galden.
Olmesartan ser ud til at blive elimineret på en bifasisk måde med en terminal halveringstid på ca. 13 timer. Olmesartan viser lineær farmakokinetik efter enkelte orale doser på op til 320 mg og multiple orale doser på op til 80 mg. Steady-state-niveauer af olmesartan opnås inden for 3 til 5 dage, og der sker ingen akkumulering i plasma ved dosering én gang dagligt.
Specifikke populationer
Geriatriske patienter
Olmesartans farmakokinetik blev undersøgt hos ældre (≥65 år). Samlet set var maksimale plasmakoncentrationer af olmesartan ens hos unge voksne og ældre. Beskeden ophobning af olmesartan blev observeret hos ældre ved gentagen dosering; AUCss, τ var 33 % højere hos ældre patienter, svarende til en ca. 30 % reduktion i CLR [se DOSERING OG ADMINISTRATION og Brug i specifikke populationer ].
Pædiatriske patienter
Olmesartans farmakokinetik blev undersøgt hos pædiatriske hypertensive patienter i alderen 1 til 16 år. Clearance af olmesartan hos pædiatriske patienter svarede til den hos voksne patienter, når den blev justeret efter kropsvægten [se Brug i specifikke populationer ].
Olmesartans farmakokinetik er ikke blevet undersøgt hos pædiatriske patienter under 1 år [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
Mandlige og kvindelige patienter
Der blev observeret mindre forskelle i olmesartans farmakokinetik hos kvinder sammenlignet med mænd. AUC og Cmax var 10-15 % højere hos kvinder end hos mænd.
Patienter med nedsat leverfunktion
Stigninger i AUC0-∞ og Cmax blev observeret hos patienter med moderat nedsat leverfunktion sammenlignet med dem i matchede kontroller, med en stigning i AUC på ca. 60 % [se DOSERING OG ADMINISTRATION og Brug i specifikke populationer ].
Patienter med nedsat nyrefunktion
Hos patienter med nyreinsufficiens var serumkoncentrationerne af olmesartan forhøjede sammenlignet med personer med normal nyrefunktion. Efter gentagen dosering blev AUC ca. tredoblet hos patienter med svært nedsat nyrefunktion (kreatininclearance DOSERING OG ADMINISTRATION , ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
Lægemiddelinteraktionsstudier
Galdesyrebindende middel Colesevelam
Samtidig administration af 40 mg olmesartanmedoxomil og 3750 mg colesevelamhydrochlorid til raske forsøgspersoner resulterede i 28 % reduktion i Cmax og 39 % reduktion i AUC for olmesartan. Mindre effekter, 4 % og 15 % reduktion i henholdsvis Cmax og AUC, blev observeret, når olmesartanmedoxomil blev administreret 4 timer før colesevelamhydrochlorid [se DRUGSINTERAKTIONER ].
Andre undersøgelser
Der blev ikke rapporteret signifikante lægemiddelinteraktioner i undersøgelser, hvor olmesartanmedoxomil blev administreret sammen med digoxin eller warfarin hos raske frivillige.
Biotilgængeligheden af olmesartan blev ikke væsentligt ændret ved samtidig administration af antacida [Al(OH)3/Mg(OH)2].
Olmesartan medoxomil metaboliseres ikke af cytochrom P450-systemet og har ingen virkning på P450-enzymer; interaktioner med lægemidler, der hæmmer, inducerer eller metaboliseres af disse enzymer, forventes således ikke.
Kliniske Studier
Voksen hypertension
De antihypertensive virkninger af Benicar 10 mg er blevet påvist i syv placebokontrollerede undersøgelser ved doser fra 2,5 mg til 80 mg i 6 til 12 uger, som hver viser statistisk signifikante reduktioner i top- og bundblodtryk. I alt 2693 patienter (2145 Benicar; 548 placebo) med essentiel hypertension blev undersøgt. Benicar 40 mg én gang dagligt sænkede det diastoliske og systoliske blodtryk. Responsen var dosisrelateret, som vist i den følgende graf. En Benicar-dosis på 20 mg dagligt giver en reduktion af det laveste siddende blodtryk (BP) i forhold til placebo på ca. 10/6 mmHg, og en dosis på 40 mg dagligt giver en reduktion af det laveste siddende blodtryk i forhold til placebo på ca. 12/7 mmHg. Benicar 10 mg doser større end 40 mg havde ringe yderligere effekt. Begyndelsen af den antihypertensive virkning indtraf inden for 1 uge og var stort set manifest efter 2 uger.
Benicar 40 mg dosisrespons Placebojusteret reduktion i blodtryk (mmHg) 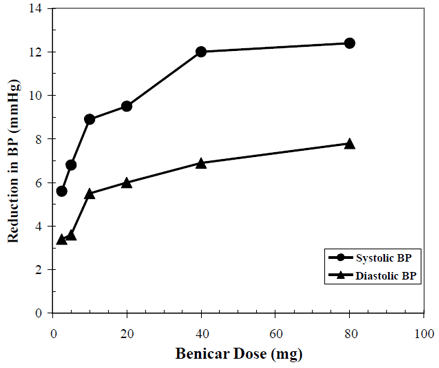
Data ovenfor er fra syv placebokontrollerede undersøgelser (2145 Benicar-patienter, 548 placebopatienter). Den blodtrykssænkende effekt blev opretholdt i hele 24-timersperioden med Benicar én gang dagligt, med dal-til-top-forhold for systolisk og diastolisk respons mellem 60 og 80 %.
Den blodtrykssænkende effekt af Benicar 40 mg, med og uden hydrochlorthiazid, blev opretholdt hos patienter behandlet i op til 1 år. Der var ingen tegn på takyfylakse under langtidsbehandling med Benicar eller rebound-effekt efter brat seponering af olmesartanmedoxomil efter 1 års behandling.
Den antihypertensive virkning af Benicar var ens hos mænd og kvinder og hos patienter ældre og yngre end 65 år. Effekten var mindre hos sorte patienter (normalt en lav-renin-population), som det er set med ACE-hæmmere, betablokkere og andre angiotensinreceptorblokkere. Benicar havde en yderligere blodtrykssænkende effekt, når den blev tilføjet til hydrochlorthiazid.
Der er ingen forsøg med Benicar, der viser reduktioner i kardiovaskulær risiko hos patienter med hypertension, men mindst ét farmakologisk lignende lægemiddel har vist sådanne fordele.
Pædiatrisk hypertension
De antihypertensive virkninger af Benicar 40 mg i den pædiatriske population blev evalueret i et randomiseret, dobbeltblindt studie med 302 hypertensive patienter i alderen 6 til 16 år. Undersøgelsespopulationen bestod af en helt sort kohorte på 112 patienter og en blandet racegruppe på 190 patienter, inklusive 38 sorte patienter. Ætiologien af hypertensionen var overvejende essentiel hypertension (87 % af den sorte kohorte og 67 % af den blandede kohorte). Patienter, der vejede 20 til
samme undersøgelse fik 59 patienter i alderen 1 til 5 år, der vejede ≥5 kg, 0,3 mg/kg Benicar 10 mg én gang dagligt i tre uger i en åben fase og blev derefter randomiseret til at modtage Benicar eller placebo i en dobbeltblindet fase. Ved slutningen af den anden uge med abstinenser var det gennemsnitlige systoliske/diastoliske blodtryk ved lavpunkt 3/3 mmHg lavere i gruppen randomiseret til Benicar; denne forskel i blodtryk var ikke statistisk signifikant (95 % CI -2 til 7/-1 til 7).
PATIENTOPLYSNINGER
Graviditet
Rådgiv kvindelige patienter i den fødedygtige alder om konsekvenserne af eksponering for Benicar 20 mg under graviditet. Diskuter behandlingsmuligheder med kvinder, der planlægger at blive gravide. Fortæl patienterne om at rapportere graviditeter til deres læger så hurtigt som muligt [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
Amning
Råd ammende kvinder om ikke at amme under behandling med BENICAR [se Brug i specifikke populationer ].
Hyperkaliæmi
Rådgive patienter om ikke at bruge kaliumtilskud eller salterstatninger, der indeholder kalium uden at konsultere deres læge [se DRUGSINTERAKTIONER ].
