Zyvox 600mg Linezolid Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Zyvox 600mg, og hvordan bruges det?
Zyvox er en receptpligtig medicin, der bruges til at behandle symptomer på bakterielle infektioner såsom lungebetændelse, hudinfektioner og infektioner, der er resistente over for andre antibiotika. Zyvox 600mg kan bruges alene eller sammen med anden medicin.
Zyvox tilhører en klasse af lægemidler kaldet Antibiotika, Andet; Oxazolidinoner.
Det vides ikke, om Zyvox er sikkert og effektivt til børn.
Hvad er de mulige bivirkninger af Zyvox?
Zyvox kan forårsage alvorlige bivirkninger, herunder:
- nældefeber,
- åndedrætsbesvær,
- hævelse i dit ansigt eller hals,
- alvorlig hudreaktion,
- feber,
- ondt i halsen,
- brændende øjne,
- hudsmerter,
- rødt eller lilla hududslæt med blærer og afskalning,
- synsproblemer,
- ændringer i dit syn,
- stærke mavesmerter,
- diarré, der er vandig eller blodig,
- anfald,
- svedeture,
- føler sig angst eller ryster,
- agitation,
- hallucinationer,
- feber,
- rystende,
- hurtig puls,
- muskelstivhed,
- trækninger,
- tab af koordination,
- kvalme,
- opkastning,
- diarré,
- usædvanlige muskelsmerter,
- vejrtrækningsbesvær,
- mavesmerter,
- uregelmæssig puls,
- svimmelhed,
- føler sig kold,
- føler sig meget svag eller træt,
- forvirring,
- sår i munden,
- hudsår,
- let blå mærker,
- usædvanlig blødning,
- bleg hud,
- kolde hænder og fødder,
- svimmelhed, og
- stakåndet
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Zyvox omfatter:
- kvalme,
- opkastning,
- diarré,
- mildt hududslæt,
- anæmi (lavt antal røde blodlegemer),
- hovedpine, og
- svimmelhed
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Zyvox. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
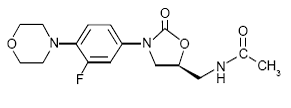
ZYVOX 600mg IV injektion, ZYVOX tabletter og ZYVOX til oral suspension indeholder linezolid, som er et syntetisk antibakterielt middel af oxazolidinon-klassen. Det kemiske navn for linezolid er (S)-N-[[3-[3-Fluoro-4-(4morpholinyl)phenyl]-2-oxo-5-oxazolidinyl]methyl]-acetamid.
Den empiriske formel er C16H20FN3O4. Dens molekylvægt er 337,35, og dens kemiske struktur er repræsenteret nedenfor:
ZYVOX 600mg IV Injection leveres som en steril isotonisk opløsning, der er klar til brug, til intravenøs infusion. Hver ml indeholder 2 mg linezolid. Inaktive ingredienser er natriumcitrat, citronsyre og dextrose i en vandig vehikel til intravenøs administration. Natriumindholdet (Na+) er 0,38 mg/ml (5 mEq/300 mL pose og 1,7 mEq/100 mL pose).
ZYVOX tablet til oral administration indeholder 600 mg linezolid som en filmovertrukket komprimeret tablet. Inaktive ingredienser er majsstivelse, mikrokrystallinsk cellulose, hydroxypropylcellulose, natriumstivelsesglycolat, magnesiumstearat, hypromellose, polyethylenglycol, titaniumdioxid og carnaubavoks. Natriumindholdet (Na+) er 2,92 mg pr. 600 mg tablet (0,1 mEq/tablet).
ZYVOX 600mg til oral suspension leveres som et granulat/pulver med appelsinsmag til sammensætning til en suspension til oral administration. Efter konstitution indeholder hver 5 ml 100 mg linezolid. Inaktive ingredienser er saccharose, citronsyre, natriumcitrat, mikrokrystallinsk cellulose og carboxymethylcellulosenatrium, aspartam, xanthangummi, mannitol, natriumbenzoat, kolloid siliciumdioxid, natriumchlorid og smagsstoffer [se PATIENTOPLYSNINGER ]. Natriumindholdet (Na+) er 8,52 mg/5 ml (0,4 mækv./5 ml).
INDIKATIONER
Nosokomiel lungebetændelse
ZYVOX er indiceret til behandling af nosokomiel lungebetændelse forårsaget af Staphylococcus aureus (methicillin-modtagelige og -resistente isolater) eller Streptococcus pneumoniae [se Kliniske Studier ].
Samfundserhvervet lungebetændelse
ZYVOX 600mg er indiceret til behandling af samfundserhvervet lungebetændelse forårsaget af Streptococcus pneumoniae, inklusive tilfælde med samtidig bakteriæmi eller Staphylococcus aureus (kun meticillin-modtagelige isolater) [se Kliniske Studier ].
Komplicerede hud- og hudstrukturinfektioner
ZYVOX 600mg er indiceret til behandling af komplicerede hud- og hudstrukturinfektioner, inklusive diabetiske fodinfektioner, uden samtidig osteomyelitis, forårsaget af Staphylococcus aureus (methicillin-modtagelige og -resistente isolater), Streptococcus pyogenes eller Streptococcus agalactiae. ZYVOX er ikke blevet undersøgt til behandling af decubitus-sår [se Kliniske Studier ].
Ukomplicerede hud- og hudstrukturinfektioner
ZYVOX 600mg er indiceret til behandling af ukomplicerede hud- og hudstrukturinfektioner forårsaget af Staphylococcus aureus (kun meticillin-modtagelige isolater) eller Streptococcus pyogenes [se Kliniske Studier ].
Vancomycin-resistente Enterococcus faecium-infektioner
ZYVOX 600mg er indiceret til behandling af vancomycin-resistente Enterococcus faecium-infektioner, herunder tilfælde med samtidig bakteriæmi [se Kliniske Studier ].
Brugsbegrænsninger
- ZYVOX 600mg er ikke indiceret til behandling af gramnegative infektioner. Det er afgørende, at specifik gramnegativ behandling påbegyndes øjeblikkeligt, hvis et samtidig gramnegativt patogen er dokumenteret eller mistænkt [se ADVARSLER OG FORHOLDSREGLER ].
- Sikkerheden og effekten af ZYVOX 600 mg formuleringer givet i mere end 28 dage er ikke blevet evalueret i kontrollerede kliniske forsøg [se Kliniske Studier ].
Brug
For at reducere udviklingen af lægemiddelresistente bakterier og bevare effektiviteten af ZYVOX 600mg og andre antibakterielle lægemidler, bør ZYVOX kun bruges til at behandle eller forebygge infektioner, der er bevist eller stærkt mistænkt for at være forårsaget af modtagelige bakterier. Når kultur- og modtagelighedsoplysninger er tilgængelige, bør de overvejes ved udvælgelse eller ændring af antibakteriel behandling. I mangel af sådanne data kan lokal epidemiologi og modtagelighedsmønstre bidrage til den empiriske udvælgelse af terapi.
DOSERING OG ADMINISTRATION
Generel dosering og administration
Den anbefalede dosis for ZYVOX 600 mg formuleringer til behandling af infektioner er beskrevet i tabel 1.
Dosisjustering er ikke nødvendig ved skift fra intravenøs til oral administration.
Intravenøs administration
ZYVOX 600mg IV Injection leveres i enkeltdosis, klar til brug infusionsposer. Parenterale lægemidler bør inspiceres visuelt for partikler før administration. Tjek for små utætheder ved at klemme posen godt sammen. Hvis der opdages utætheder, skal opløsningen kasseres, da steriliteten kan blive forringet. Opbevar infusionsposerne i indpakningen, indtil de skal bruges. Opbevares ved stuetemperatur. Beskyt mod frysning. ZYVOX 600mg IV Injection kan udvise en gul farve, der kan intensiveres over tid uden at påvirke styrken negativt.
ZYVOX IV-injektion bør administreres ved intravenøs infusion over en periode på 30 til 120 minutter. Brug ikke denne intravenøse infusionspose i serieforbindelser. Tilsætningsstoffer bør ikke indføres i denne opløsning. Hvis ZYVOX 600mg IV-injektion skal gives samtidig med et andet lægemiddel, skal hvert lægemiddel gives separat i overensstemmelse med den anbefalede dosering og administrationsvej for hvert produkt. Kassér ubrugte portioner.
Hvis den samme intravenøse slange bruges til sekventiel infusion af flere lægemidler, skal slangen skylles før og efter infusion af ZYVOX IV Injection med en infusionsopløsning, der er kompatibel med ZYVOX 600mg IV Injection og med andre lægemidler administreret via denne fælles linje .
Kompatibiliteter
Kompatible intravenøse opløsninger omfatter 0,9 % natriumchloridinjektion, USP, 5 % dextrose-injektion, USP og Lactated Ringer's Injection, USP.
Uforeneligheder
Fysiske uforligeligheder resulterede, når ZYVOX 600mg IV-injektion blev kombineret med følgende lægemidler under simuleret Y-sted administration: amphotericin B, chlorpromazin HCl, diazepam, pentamidin isothionat, erythromycin lactobionat, phenytoin natrium og trimethoprim-sulfamethazol. Derudover resulterede kemisk inkompatibilitet, når ZYVOX IV Injection blev kombineret med ceftriaxonnatrium.
Konstitution af oral suspension
ZYVOX til oral suspension leveres som et pulver/granulat til konstitution. Bank forsigtigt på flasken for at løsne pulveret. Tilsæt i alt 123 ml destilleret vand i to portioner. Efter tilsætning af den første halvdel skal du ryste kraftigt for at fugte alt pulveret. Tilsæt derefter den anden halvdel af vandet og ryst kraftigt for at opnå en ensartet suspension. Efter konstituering indeholder hver 5 ml af suspensionen 100 mg linezolid. Før brug blandes forsigtigt ved at vende flasken 3 til 5 gange. Må ikke rystes. Opbevar sammensat suspension ved stuetemperatur. Bruges inden for 21 dage efter konstituering.
HVORDAN LEVERET
Doseringsformer og styrker
ZYVOX 600mg IV-injektion: 200 mg/100 ml (2 mg/ml) og 600 mg/300 ml (2 mg/ml) linezolid enkeltdosis, brugsklare fleksible plastikinfusionsposer i en folielaminat-indpakning.
ZYVOX 600 mg tablet:
hvid, kapselformet, filmovertrukket tablet præget med "ZYV" på den ene side og "600" på den anden. ZYVOX 600 mg til oral suspension: tør, hvid til råhvid, granulat/pulver med appelsinsmag. Når den er sammensat som anvist, vil hver flaske indeholde 150 ml af en suspension, der svarer til 100 mg linezolid pr. 5 ml.
Opbevaring og håndtering
Indsprøjtning
ZYVOX 600mg IV Injektion fås i enkeltdosis, brugsklare fleksible plastikinfusionsposer i et folielaminat-overtræk. Infusionsposerne og portene er ikke lavet af naturgummilatex. Infusionsposerne fås i følgende pakkestørrelser:
200 mg/100 ml (2 mg/ml) linezolid x 10 - NDC 0009-5137-04 600 mg/300 ml (2 mg/ml) linezolid x 10 - NDC 0009-5140-04
Tabletter
ZYVOX 600mg tabletter er tilgængelige som følger:
600 mg (hvide, kapselformede, filmovertrukne tabletter præget med "ZYV" på den ene side og "600" på den anden)
20 tabletter i HDPE-flaske - NDC 0009-5138-02 Enhedsdosispakninger med 30 tabletter - NDC 0009-5138-03
Oral suspension
ZYVOX til oral suspension fås som et tørt, hvidt til råhvidt granulat/pulver med appelsinsmag. Når den er sammensat som anvist, vil hver flaske indeholde 150 ml af en suspension, der svarer til 100 mg linezolid pr. 5 ml. ZYVOX til oral suspension leveres som følger:
100 mg/5 ml i 240 ml glasflasker - NDC 0009-5136-01
Opbevaring og håndtering
Opbevares ved 25°C (77°F). Beskyt mod lys. Hold flaskerne tæt lukkede for at beskytte mod fugt. Det anbefales, at infusionsposerne opbevares i indpakningen, indtil de er klar til brug. Beskyt infusionsposer mod frysning.
Distribueret af Pharmacia & Upjohn Co Division af Pfizer Inc, NY, NY 10017. Revideret: nov 2021.
BIVIRKNINGER
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Voksne
Sikkerheden af ZYVOX 600 mg-formuleringer blev evalueret hos 2.046 voksne patienter, der var inkluderet i syv fase 3-komparatorkontrollerede kliniske forsøg, som blev behandlet i op til 28 dage.
Af de patienter, der blev behandlet for ukomplicerede hud- og hudstrukturinfektioner (uSSSI'er), oplevede 25,4 % af de ZYVOX-behandlede og 19,6 % af de komparatorbehandlede patienter mindst én lægemiddelrelateret bivirkning. For alle andre indikationer oplevede 20,4 % af ZYVOX-behandlede og 14,3 % af komparatorbehandlede patienter mindst én lægemiddelrelateret bivirkning.
Tabel 2 viser forekomsten af behandlingsudspringende bivirkninger rapporteret hos mindst 1 % af voksne patienter i disse forsøg efter dosis af ZYVOX.
Af de patienter, der blev behandlet for uSSSI'er, afbrød 3,5 % af de ZYVOX-behandlede og 2,4 % af de sammenlignende patienter behandlingen på grund af lægemiddelrelaterede bivirkninger. For alle andre indikationer forekom seponeringer på grund af lægemiddelrelaterede bivirkninger hos 2,1 % af de ZYVOX-behandlede og 1,7 % af de komparatorbehandlede patienter. De mest almindelige rapporterede lægemiddelrelaterede bivirkninger, der førte til seponering af behandlingen, var kvalme, hovedpine, diarré og opkastning.
Pædiatriske patienter
Sikkerheden af ZYVOX-formuleringer blev evalueret hos 215 pædiatriske patienter i alderen fra fødslen til 11 år, og hos 248 pædiatriske patienter i alderen 5 til 17 år (146 af disse 248 var i alderen 5 til 11 og 102 var i alderen 12 til 17). Disse patienter blev inkluderet i to fase 3-komparatorkontrollerede kliniske forsøg og blev behandlet i op til 28 dage. I undersøgelsen af hospitalsindlagte pædiatriske patienter (fødsel gennem 11 år) med grampositive infektioner, som blev randomiseret 2 til 1 (linezolid: vancomycin), var dødeligheden 6,0 % (13/215) i linezolid-armen og 3,0 % (3/101) i vancomycinarmen. På grund af den alvorlige underliggende sygdom i patientpopulationen kunne der imidlertid ikke fastslås nogen årsagssammenhæng.
Af de pædiatriske patienter, der blev behandlet for uSSSI'er, oplevede 19,2 % af de ZYVOX-behandlede og 14,1 % af de komparatorbehandlede patienter mindst én lægemiddelrelateret bivirkning. For alle andre indikationer oplevede 18,8 % af ZYVOX-behandlede og 34,3 % af komparatorbehandlede patienter mindst én lægemiddelrelateret bivirkning.
Tabel 3 viser forekomsten af uønskede reaktioner, der skyldes alle årsager, rapporteret hos mere end 1 % af pædiatriske patienter (og mere end 1 patient) i begge behandlingsgrupper i de sammenlignende kontrollerede fase 3-studier.
Af de pædiatriske patienter, der blev behandlet for uSSSI'er, afbrød 1,6 % af de ZYVOX-behandlede og 2,4 % af de komparatorbehandlede patienter behandlingen på grund af lægemiddelrelaterede bivirkninger. For alle andre indikationer forekom seponeringer på grund af lægemiddelrelaterede bivirkninger hos 0,9 % af ZYVOX-behandlede og 6,1 % af komparatorbehandlede patienter.
Laboratorieabnormiteter
ZYVOX er blevet forbundet med trombocytopeni, når det anvendes i doser op til og inklusive 600 mg hver 12. time i op til 28 dage. I fase 3 komparator-kontrollerede undersøgelser var procentdelen af voksne patienter, som udviklede et væsentligt lavt blodpladetal (defineret som mindre end 75 % af den nedre grænse for normal og/eller baseline) 2,4 % (interval blandt studier: 0,3 til 10,0 %) med ZYVOX 600 mg og 1,5 % (interval mellem undersøgelser: 0,4 til 7,0 %) med en komparator. I en undersøgelse af indlagte pædiatriske patienter i alderen fra fødslen til 11 år, var procentdelen af patienter, der udviklede et væsentligt lavt blodpladetal (defineret som mindre end 75 % af den nedre grænse for normal og/eller baseline) 12,9 % med ZYVOX 600 mg og 13,4 % med vancomycin. I en ambulant undersøgelse af pædiatriske patienter i alderen fra 5 til 17 år var procentdelen af patienter, der udviklede et væsentligt lavt blodpladetal, 0 % med ZYVOX og 0,4 % med cefadroxil. Trombocytopeni forbundet med brugen af ZYVOX ser ud til at være afhængig af behandlingens varighed (generelt mere end 2 ugers behandling). Trombocyttallet for de fleste patienter vendte tilbage til normalområdet/baseline under opfølgningsperioden. Ingen relaterede kliniske bivirkninger blev identificeret i fase 3 kliniske forsøg med patienter, der udviklede trombocytopeni. Blødningshændelser blev identificeret hos trombocytopeniske patienter i et program med compassionate use for ZYVOX; linezolids rolle i disse hændelser kan ikke bestemmes [se ADVARSLER OG FORHOLDSREGLER ].
Ændringer set i andre laboratorieparametre, uden hensyntagen til lægemiddelforhold, viste ingen væsentlige forskelle mellem ZYVOX 600 mg og komparatorerne. Disse ændringer var generelt ikke klinisk signifikante, førte ikke til seponering af behandlingen og var reversible. Forekomsten af voksne og pædiatriske patienter med mindst én væsentligt unormal hæmatologisk eller serumkemiværdi er vist i tabel 4, 5, 6 og 7.
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af ZYVOX efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering:
- Myelosuppression (herunder anæmi, leukopeni, pancytopeni og trombocytopeni) [se ADVARSLER OG FORHOLDSREGLER ]; sideroblastisk anæmi.
- Perifer neuropati og optisk neuropati udvikler sig nogle gange til tab af synet [se ADVARSLER OG FORHOLDSREGLER ].
- Laktatacidose [se ADVARSLER OG FORHOLDSREGLER ]. Selvom disse rapporter primært har været hos patienter behandlet i længere tid end den maksimalt anbefalede varighed på 28 dage, er disse hændelser også blevet rapporteret hos patienter, der fik kortere behandlingsforløb.
- Serotonergt syndrom er blevet rapporteret hos patienter, der samtidig får serotonerge midler, herunder antidepressiva såsom selektive serotoningenoptagshæmmere (SSRI) og opioider, og ZYVOX [se ADVARSLER OG FORHOLDSREGLER ].
- Kramper [se ADVARSLER OG FORHOLDSREGLER ].
- Anafylaksi, angioødem, bulløse hudlidelser, herunder alvorlige kutane bivirkninger (SCAR) såsom toksisk epidermal nekrolyse og Stevens-Johnsons syndrom og overfølsomhedsvaskulitis.
- Overfladisk misfarvning af tænder og misfarvning af tungen er blevet rapporteret ved brug af linezolid. Tandmisfarvningen kunne fjernes med professionel tandrensning (manuel afkalkning) i tilfælde med kendt resultat.
- Hypoglykæmi, herunder symptomatiske episoder [se ADVARSLER OG FORHOLDSREGLER ].
- Hyponatriæmi og/eller syndrom af uhensigtsmæssig antidiuretisk hormonsekretion (SIADH) [se ADVARSLER OG FORHOLDSREGLER ].
DRUGSINTERAKTIONER
Monoaminoxidasehæmmere
Linezolid er en reversibel, ikke-selektiv hæmmer af monoaminoxidase [se KONTRAINDIKATIONER og KLINISK FARMAKOLOGI ].
Adrenerge og serotonerge midler
Linezolid har potentiale for interaktion med adrenerge og serotonerge midler [se ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Myelosuppression
Myelosuppression (inklusive anæmi, leukopeni, pancytopeni og trombocytopeni) er blevet rapporteret hos patienter, der får linezolid. I tilfælde, hvor resultatet er kendt, når linezolid blev seponeret, er de påvirkede hæmatologiske parametre steget mod niveauer før behandling. Fuldstændige blodtal bør overvåges ugentligt hos patienter, der får linezolid, især hos dem, der får linezolid i mere end to uger, dem med allerede eksisterende myelosuppression, dem, der samtidig får lægemidler, der producerer knoglemarvssuppression, eller dem med en kronisk infektion, som har modtaget tidligere eller samtidig antibakteriel behandling. Seponering af behandling med linezolid bør overvejes hos patienter, som udvikler eller har forværret myelosuppression.
Perifer og optisk neuropati
Perifere og optiske neuropatier er blevet rapporteret hos patienter behandlet med ZYVOX 600 mg, primært hos de patienter, der blev behandlet i længere tid end den maksimalt anbefalede varighed på 28 dage. I tilfælde af optisk neuropati, der udviklede sig til tab af synet, blev patienterne behandlet i længere perioder ud over den maksimalt anbefalede varighed. Visuel sløring er blevet rapporteret hos nogle patienter behandlet med ZYVOX i mindre end 28 dage. Perifer og optisk neuropati er også blevet rapporteret hos børn.
Hvis patienter oplever symptomer på synsforstyrrelser, såsom ændringer i synsstyrke, ændringer i farvesyn, sløret syn eller synsfeltdefekt, anbefales hurtig oftalmisk evaluering. Synsfunktionen bør overvåges hos alle patienter, der tager ZYVOX i længere perioder (≥ 3 måneder) og hos alle patienter, der rapporterer nye visuelle symptomer uanset behandlingstiden med ZYVOX. Hvis der opstår perifer eller optisk neuropati, bør den fortsatte brug af ZYVOX 600 mg til disse patienter afvejes mod de potentielle risici.
Serotonin syndrom
Spontane rapporter om serotonergt syndrom, herunder fatale tilfælde forbundet med samtidig administration af ZYVOX og serotonerge midler, inklusive antidepressiva såsom selektive serotoningenoptagshæmmere (SSRI'er), er blevet rapporteret.
Medmindre det er klinisk passende, og patienterne observeres nøje for tegn og/eller symptomer på serotonergt syndrom eller neuroleptika maligne syndrom-lignende (NMS-lignende) reaktioner, bør linezolid ikke administreres til patienter med carcinoid syndrom og/eller patienter, der tager nogen af følgende lægemidler : serotonin-genoptagelseshæmmere, tricykliske antidepressiva, bupropion, buspiron, serotonin 5-HT1-receptoragonister (triptaner) og opioider, inklusive meperidin [se DRUGSINTERAKTIONER og KLINISK FARMAKOLOGI ].
nogle tilfælde kan en patient, der allerede får et serotonergt antidepressivum eller buspiron, kræve akut behandling med linezolid. Hvis alternativer til linezolid ikke er tilgængelige, og de potentielle fordele ved linezolid opvejer risikoen for serotonergt syndrom eller NMS-lignende reaktioner, skal det serotonerge antidepressivum stoppes omgående og linezolid administreres. Patienten skal overvåges i to uger (fem uger hvis fluoxetin blev taget) eller indtil 24 timer efter den sidste dosis linezolid, alt efter hvad der kommer først. Symptomer på serotonergt syndrom eller NMS-lignende reaktioner omfatter hypertermi, rigiditet, myoklonus, autonom ustabilitet og mentale statusændringer, der omfatter ekstrem agitation, der udvikler sig til delirium og koma. Patienten skal også overvåges for seponeringssymptomer af antidepressiva (se indlægssedlen med det eller de specificerede midler for en beskrivelse af de tilhørende seponeringssymptomer).
Dødelighedsubalance i en undersøgelsesundersøgelse hos patienter med kateterrelaterede blodbaneinfektioner, herunder dem med kateterinfektioner
En ubalance i dødelighed blev set hos patienter behandlet med linezolid i forhold til vancomycin/dicloxacillin/oxacillin i et åbent studie med alvorligt syge patienter med intravaskulære kateter-relaterede infektioner [78/363 (21,5 %) vs. 58/363 (16,0 %). ); odds ratio 1,426, 95 % CI 0,970, 2,098]. Selvom kausalitet ikke er blevet fastslået, opstod denne observerede ubalance primært hos linezolid-behandlede patienter, hvor enten gramnegative patogener, blandede gramnegative og grampositive patogener eller intet patogen blev identificeret ved baseline, men som ikke blev set hos patienter med Kun grampositive infektioner.
Linezolid er ikke godkendt og bør ikke anvendes til behandling af patienter med kateterrelaterede blodbaneinfektioner eller kateterinfektioner.
Linezolid har ingen klinisk aktivitet mod gramnegative patogener og er ikke indiceret til behandling af gramnegative infektioner. Det er afgørende, at specifik gramnegativ behandling påbegyndes øjeblikkeligt, hvis et samtidig gramnegativt patogen er dokumenteret eller mistænkt [se INDIKATIONER ].
Clostridioides Difficile-associeret diarré
Clostridioides difficile-associeret diarré (CDAD) er blevet rapporteret ved brug af næsten alle antibakterielle midler, inklusive ZYVOX 600mg, og kan variere i sværhedsgrad fra mild diarré til fatal colitis. Behandling med antibakterielle midler ændrer den normale flora i tyktarmen, hvilket fører til overvækst af C. difficile.
C. difficile producerer toksinerne A og B, som bidrager til udviklingen af CDAD. Hypertoksinproducerende stammer af C. difficile forårsager øget morbiditet og dødelighed, da disse infektioner kan være modstandsdygtige over for antimikrobiel behandling og kan kræve kolektomi. CDAD skal overvejes hos alle patienter, som får diarré efter brug af antibakteriel medicin.
Omhyggelig sygehistorie er nødvendig, da CDAD er blevet rapporteret at forekomme over to måneder efter administration af antibakterielle midler.
Hvis der er mistanke om eller bekræftet CDAD, skal igangværende brug af antibakteriel medicin, der ikke er rettet mod C. difficile, muligvis afbrydes. Passende væske- og elektrolytbehandling, proteintilskud, antibakteriel lægemiddelbehandling af C. difficile og kirurgisk evaluering bør iværksættes som klinisk indiceret.
Potentielle interaktioner, der frembringer forhøjelse af blodtrykket
Medmindre patienter overvåges for potentielle stigninger i blodtrykket, bør linezolid ikke administreres til patienter med ukontrolleret hypertension, fæokromocytom, thyrotoksikose og/eller patienter, der tager nogen af følgende typer medicin: direkte og indirekte virkende sympatomimetiske midler (f.eks. pseudoephedrin), vasopressive midler (f.eks. epinephrin, noradrenalin), dopaminerge midler (f.eks. dopamin, dobutamin) [se DRUGSINTERAKTIONER og KLINISK FARMAKOLOGI ].
Mælkesyreacidose
Laktacidose er blevet rapporteret ved brug af ZYVOX. I rapporterede tilfælde oplevede patienterne gentagne episoder med kvalme og opkastning. Patienter, der udvikler tilbagevendende kvalme eller opkastning, uforklarlig acidose eller et lavt niveau af bikarbonat, mens de får ZYVOX, bør øjeblikkeligt modtage medicinsk vurdering.
Kramper
Kramper er blevet rapporteret hos patienter i behandling med linezolid. I nogle af disse tilfælde blev der rapporteret en historie med anfald eller risikofaktorer for anfald.
Hypoglykæmi
Postmarketing tilfælde af symptomatisk hypoglykæmi er blevet rapporteret hos patienter med diabetes mellitus, der får insulin eller orale hypoglykæmiske midler, når de behandles med linezolid, en reversibel, ikke-selektiv MAO-hæmmer. Nogle MAO-hæmmere er blevet forbundet med hypoglykæmiske episoder hos diabetespatienter, der får insulin eller hypoglykæmiske midler. Selvom der ikke er fastslået en årsagssammenhæng mellem linezolid og hypoglykæmi, bør diabetespatienter advares om potentielle hypoglykæmiske reaktioner, når de behandles med linezolid.
Hvis der opstår hypoglykæmi, kan et fald i dosis af insulin eller oralt hypoglykæmisk middel eller seponering af oralt hypoglykæmisk middel, insulin eller linezolid være nødvendigt.
Hyponatriæmi og/eller syndrom af uhensigtsmæssig antidiuretisk hormonsekretion (SIADH)
Postmarketing tilfælde af hyponatriæmi og/eller syndrom med uhensigtsmæssig antidiuretisk hormonsekretion (SIADH) er blevet observeret hos patienter behandlet med linezolid. I rapporterede tilfælde omfattede tegnene og symptomerne forvirring, somnolens, generaliseret svaghed og førte i alvorlige tilfælde til respirationssvigt og endda død. Overvåg serumnatriumniveauer regelmæssigt hos ældre, hos patienter, der tager diuretika, og hos andre patienter med risiko for hyponatriæmi og/eller SIADH, mens de tager ZYVOX. Hvis der opstår tegn og symptomer på hyponatriæmi og/eller SIADH, skal du afbryde behandlingen med ZYVOX 600 mg og iværksætte passende støtteforanstaltninger.
Risici hos patienter med phenylketonuri
Phenylalanin kan være skadeligt for patienter med phenylketonuri (PKU). ZYVOX til oral suspension indeholder phenylalanin, en komponent af aspartam. Hver 5 ml af den 100 mg/5 ml orale suspension indeholder 20 mg phenylalanin. Før du ordinerer ZYVOX 600 mg til oral suspension til en patient med PKU, skal du overveje den kombinerede daglige mængde phenylalanin fra alle kilder, inklusive ZYVOX til oral suspension.
De andre ZYVOX-formuleringer indeholder ikke phenylalanin.
Udvikling af lægemiddelresistente bakterier
Udskrivning af ZYVOX i fravær af en påvist eller stærkt mistænkt bakteriel infektion eller en profylaktisk indikation er usandsynligt, at gavn for patienten og øger risikoen for udvikling af lægemiddelresistente bakterier.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Livstidsundersøgelser på dyr er ikke blevet udført for at evaluere linezolids carcinogene potentiale. Hverken mutagent eller klastogent potentiale blev fundet i en række tests, herunder: assays for mutagenicitet (Ames bakteriel reversion og CHO-cellemutation), en in vitro unscheduled DNA-syntese (UDS) assay, en in vitro kromosomafvigelsesanalyse i humane lymfocytter og en in vivo muse mikronucleus assay.
Linezolid påvirkede ikke fertiliteten eller reproduktionsevnen hos voksne hunrotter, der fik orale doser på op til 100 mg/kg/dag i 14 dage før parring til og med drægtighedsdag 7. Det nedsatte reversibelt fertilitet og reproduktionsevne hos voksne hanrotter, når det blev givet kl. doser ≥ 50 mg/kg/dag, med eksponeringer omtrent lig med eller større end det forventede humane eksponeringsniveau (eksponeringssammenligninger er baseret på AUC'er). De reversible fertilitetseffekter blev medieret gennem ændret spermatogenese. Berørte spermatider indeholdt unormalt dannede og orienterede mitokondrier og var ikke-levedygtige. Epitelcellehypertrofi og hyperplasi i epididymis blev observeret i forbindelse med nedsat fertilitet. Lignende epididymalændringer blev ikke set hos hunde.
Hos seksuelt modne hanrotter, der blev udsat for lægemiddel som unge, blev der observeret let nedsat fertilitet efter behandling med linezolid gennem det meste af deres seksuelle udviklingsperiode (50 mg/kg/dag fra dag 7 til 36 og 100 mg/kg/dag). fra dag 37 til 55 år), med eksponeringer op til 1,7 gange større end de gennemsnitlige AUC'er observeret hos pædiatriske patienter i alderen 3 måneder til 11 år. Nedsat fertilitet blev ikke observeret med kortere behandlingsperioder, svarende til eksponering in utero gennem den tidlige neonatale periode (drægtighedsdag 6 til postnatal dag 5), neonatal eksponering (postnatal dag 5 til 21) eller til juvenil eksponering (postnatal dag 22 til 35) ). Reversible reduktioner i sædmotilitet og ændret sædmorfologi blev observeret hos rotter behandlet fra postnatal dag 22 til 35.
Brug i specifikke populationer
Graviditet
Risikooversigt
Tilgængelige data fra offentliggjorte og postmarketing-caserapporter med brug af linezolid til gravide kvinder har ikke identificeret en lægemiddelrelateret risiko for alvorlige fødselsdefekter, abort eller uønskede maternelle eller føtale resultater. Ved administration under organogenese forårsagede linezolid ikke misdannelser hos mus, rotter eller kaniner ved maternelle eksponeringsniveauer ca. 6,5 gange (mus), svarende til (rotter) eller 0,06 gange (kaniner) den kliniske terapeutiske eksponering, baseret på AUC'er. Imidlertid blev embryo-føtal dødelighed observeret hos mus ved 6,5 gange den estimerede humane eksponering. Når hunrotter blev doseret under organogenese gennem laktation, blev postnatal overlevelse af unger reduceret ved doser, der omtrent svarer til den estimerede humane eksponering baseret på AUC'er (se Data ).
Baggrundsrisikoen for alvorlige fødselsdefekter og abort for de angivne populationer er ukendt. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre ugunstige udfald. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2-4 % og 15-20 %.
Data
Dyredata
Hos mus blev embryo-føtal toksicitet kun observeret ved doser, der forårsagede maternel toksicitet (kliniske tegn og reduceret vægtøgning). En oral dosis på 450 mg/kg/dag givet fra Gestation Day (GD) 6-16 (6,5 gange den estimerede humane eksponering baseret på AUC'er) korrelerede med øget postimplantationel embryodød, inklusive totalt kuldtab, nedsat føtal kropsvægt og en øget forekomst af kystbruskfusion. Hverken maternel eller embryo-føtal toksicitet blev observeret ved doser op til 150 mg/kg/dag. Fostermisdannelser blev ikke observeret.
Hos rotter blev føtal toksicitet observeret ved 15 og 50 mg/kg/dag administreret oralt fra GD 6-17 (eksponeringer henholdsvis 0,22 gange til ca. svarende til den estimerede humane eksponering baseret på AUC'er). Virkningerne bestod af nedsat føtal kropsvægt og nedsat knogledannelse af brystben, et fund, der ofte ses i forbindelse med nedsat føtal kropsvægt. Fostermisdannelser blev ikke observeret. Maternel toksicitet i form af reduceret vægtøgning blev set ved 50 mg/kg/dag.
Hos kaniner forekom reduceret føtal kropsvægt kun ved tilstedeværelse af maternel toksicitet (kliniske tegn, reduceret kropsvægtøgning og fødeindtagelse), når det blev administreret i en oral dosis på 15 mg/kg/dag givet fra GD 6-20 (0,06 gange estimeret human eksponering baseret på AUC'er). Fostermisdannelser blev ikke observeret.
Når hunrotter blev behandlet med 50 mg/kg/dag (ca. svarende til den estimerede humane eksponering baseret på AUC'er) af linezolid under drægtighed og diegivning (GD 6 til og med laktationsdag 20), var overlevelsen af hvalpe nedsat på postnatale dag 1 til 4 Han- og hununger, der fik lov til at modnes til reproduktiv alder, viste, når de blev parret, en stigning i præimplantationstab.
Amning
Risikooversigt
Linezolid findes i modermælk. Baseret på data fra tilgængelige offentliggjorte case-rapporter vil den daglige dosis linezolid, som spædbarnet vil modtage fra modermælk, være ca. 6 % til 9 % af den anbefalede terapeutiske spædbarnsdosis (10 mg/kg hver 8. time). Der er ingen information om linezolids virkning på det ammede spædbarn; diarré og opkastning var imidlertid de mest almindelige bivirkninger rapporteret i kliniske forsøg hos spædbørn, der fik linezolid terapeutisk [se BIVIRKNINGER og (se kliniske overvejelser). Der er ingen information om linezolids virkning på mælkeproduktionen. De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for linezolid og eventuelle negative virkninger på det ammede barn fra linezolid eller fra den underliggende moderens tilstand.
Kliniske overvejelser
Råd ammende kvinder om at overvåge et ammende spædbarn for diarré og opkastning.
Hunner og mænd med reproduktionspotentiale
Infertilitet
Hanner
Baseret på resultater fra undersøgelser med rotter kan ZYVOX reversibelt svække fertiliteten hos mandlige patienter [se Ikke-klinisk toksikologi )].
Pædiatrisk brug
Sikkerheden og effektiviteten af ZYVOX 600 mg til behandling af pædiatriske patienter med følgende infektioner understøttes af evidens fra tilstrækkelige og velkontrollerede undersøgelser hos voksne, farmakokinetiske data hos pædiatriske patienter og yderligere data fra en sammenlignende kontrolleret undersøgelse af Gram-positive infektioner hos pædiatriske patienter i alderen fra fødslen til 11 år [se INDIKATIONER , KLINISK FARMAKOLOGI og Kliniske Studier ]:
- nosokomiel lungebetændelse
- komplicerede hud- og hudstrukturinfektioner
- samfundserhvervet lungebetændelse (også understøttet af beviser fra en ukontrolleret undersøgelse med patienter i alderen fra 8 måneder til 12 år)
- vancomycin-resistente Enterococcus faecium-infektioner
Sikkerheden og effektiviteten af ZYVOX 600 mg til behandling af pædiatriske patienter med følgende infektion er blevet fastslået i et sammenlignende kontrolleret studie med pædiatriske patienter i alderen fra 5 til 17 år [se Kliniske Studier ]:
- ukomplicerede hud- og hudstrukturinfektioner forårsaget af Staphylococcus aureus (kun methicillinfølsomme stammer) eller Streptococcus pyogenes
Farmakokinetisk information genereret hos pædiatriske patienter med ventrikuloperitoneale shunts viste variable linezolidkoncentrationer i cerebrospinalvæske (CSF) efter enkelt- og multipel dosering af linezolid; terapeutiske koncentrationer blev ikke konsekvent opnået eller opretholdt i CSF. Derfor anbefales brug af linezolid til empirisk behandling af pædiatriske patienter med infektioner i centralnervesystemet ikke.
Linezolids farmakokinetik er blevet evalueret hos pædiatriske patienter fra fødslen til 17 års alderen. Generelt falder vægtbaseret clearance af linezolid gradvist med stigende alder hos pædiatriske patienter. Men hos præmature (gestational alder DOSERING OG ADMINISTRATION og KLINISK FARMAKOLOGI ].
begrænset klinisk erfaring havde 5 ud af 6 (83 %) pædiatriske patienter med infektioner på grund af grampositive patogener med minimale hæmmende koncentrationer (MIC'er) på 4 mcg/ml behandlet med ZYVOX 600 mg klinisk helbredelse. Pædiatriske patienter udviser dog større variation i linezolid-clearance og systemisk eksponering (AUC) sammenlignet med voksne. Hos pædiatriske patienter med et suboptimalt klinisk respons, især dem med patogener med MIC på 4 mcg/ml, bør lavere systemisk eksponering, infektionssted og sværhedsgrad og den underliggende medicinske tilstand tages i betragtning ved vurdering af klinisk respons [se KLINISK FARMAKOLOGI og DOSERING OG ADMINISTRATION ].
Geriatrisk brug
Ud af de 2.046 patienter, der blev behandlet med ZYVOX 600 mg i fase 3-komparatorkontrollerede kliniske studier, var 589 (29%) 65 år eller ældre og 253 (12%) var 75 år eller ældre. Der blev ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet mellem disse patienter og yngre patienter, og anden rapporteret klinisk erfaring har ikke identificeret forskelle i respons mellem ældre og yngre patienter, men større følsomhed hos nogle ældre personer kan ikke udelukkes.
OVERDOSIS
tilfælde af overdosering tilrådes støttende behandling med opretholdelse af glomerulær filtration. Hæmodialyse kan lette hurtigere eliminering af linezolid. I et klinisk fase 1-forsøg blev ca. 30 % af en dosis linezolid fjernet under en 3-timers hæmodialysesession, der begyndte 3 timer efter, at dosis linezolid blev administreret. Data er ikke tilgængelige for fjernelse af linezolid med peritonealdialyse eller hæoperfusion. Kliniske tegn på akut toksicitet hos dyr var nedsat aktivitet og ataksi hos rotter og opkastning og rysten hos hunde behandlet med henholdsvis 3.000 mg/kg/dag og 2.000 mg/kg/dag.
KONTRAINDIKATIONER
Overfølsomhed
ZYVOX-formuleringer er kontraindiceret til brug hos patienter, som har kendt overfølsomhed over for linezolid eller nogen af de andre produktkomponenter.
Monoaminoxidasehæmmere
Linezolid bør ikke anvendes til patienter, der tager noget lægemiddel, som hæmmer monoaminoxidaser A eller B (f.eks. phenelzin, isocarboxazid) eller inden for to uger efter at have taget et sådant lægemiddel.
KLINISK FARMAKOLOGI
Handlingsmekanisme
ZYVOX er et antibakterielt lægemiddel [se Mikrobiologi ].
Farmakodynamik
et randomiseret, positivt og placebo-kontrolleret crossover grundigt QT-studie fik 40 raske forsøgspersoner en enkelt ZYVOX 600 mg dosis via en 1 times IV infusion, en enkelt ZYVOX 1.200 mg dosis via en 1 times IV infusion, placebo og en enkelt oral dosis af positiv kontrol. Ved både 600 mg og 1.200 mg ZYVOX 600 mg doser blev der ikke påvist nogen signifikant effekt på QTc-intervallet ved maksimal plasmakoncentration eller på noget andet tidspunkt.
Farmakokinetik
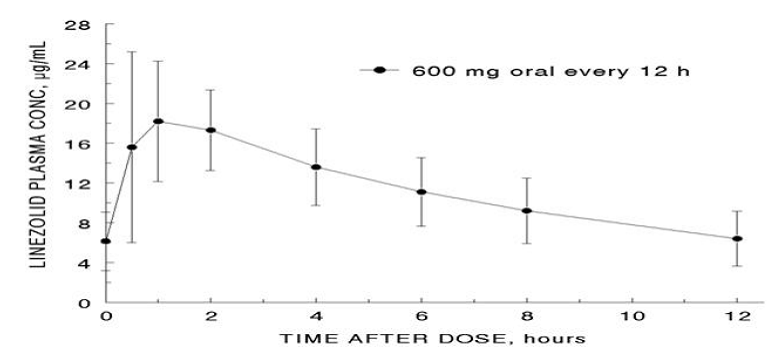
De gennemsnitlige farmakokinetiske parametre for linezolid hos voksne efter enkelte og multiple orale og intravenøse doser er opsummeret i tabel 8. Plasmakoncentrationer af linezolid ved steady-state efter orale doser på 600 mg givet hver 12. time er vist i figur 1.
Figur 1. Plasmakoncentrationer af linezolid hos voksne ved steady-state efter oral dosering hver 12. time (middel ± standardafvigelse, n=16)
Absorption
Linezolid absorberes i vid udstrækning efter oral dosering. Maksimal plasmakoncentration nås ca. 1 til 2 timer efter dosering, og den absolutte biotilgængelighed er ca. 100%. Linezolid kan derfor gives oralt eller intravenøst uden dosisjustering.
Linezolid kan administreres uden hensyntagen til tidspunktet for måltider. Tiden til at nå den maksimale koncentration er forsinket fra 1,5 timer til 2,2 timer, og Cmax falder med ca. 17 %, når mad med højt fedtindhold gives sammen med linezolid. Imidlertid er den samlede eksponering målt som AUC0-∞ ens under begge forhold.
Fordeling
Dyre- og humane farmakokinetiske undersøgelser har vist, at linezolid let distribueres til godt perfunderet væv. Plasmaproteinbindingen af linezolid er ca. 31 % og er koncentrationsuafhængig. Fordelingsvolumen af linezolid ved steady-state var i gennemsnit 40 til 50 liter hos raske voksne frivillige.
Linezolidkoncentrationer er blevet bestemt i forskellige væsker fra et begrænset antal forsøgspersoner i fase 1 forsøg med frivillige efter gentagen dosering af linezolid. Forholdet mellem linezolid i spyt i forhold til plasma var 1,2 til 1, og forholdet mellem linezolid i sved i forhold til plasma var 0,55 til 1.
Metabolisme
Linezolid metaboliseres primært ved oxidation af morpholinringen, hvilket resulterer i to inaktive ringåbnede carboxylsyremetabolitter: aminoethoxyeddikesyremetabolitten (A) og hydroxyethylglycinmetabolitten (B). Dannelse af metabolit A formodes at blive dannet via en enzymatisk vej, hvorimod metabolit B medieres af en ikke-enzymatisk kemisk oxidationsmekanisme in vitro. In vitro undersøgelser har vist, at linezolid metaboliseres minimalt og kan medieres af humant cytochrom P450. Imidlertid er linezolids metaboliske vej ikke fuldt ud forstået.
Udskillelse
Nonrenal clearance udgør ca. 65 % af den totale clearance af linezolid. Under steady-state forekommer ca. 30 % af dosis i urinen som linezolid, 40 % som metabolit B og 10 % som metabolit A. Den gennemsnitlige renale clearance af linezolid er 40 ml/min, hvilket tyder på netto tubulær reabsorption. Der forekommer stort set intet linezolid i fæces, mens cirka 6 % af dosis forekommer i fæces som metabolit B og 3 % som metabolit A.
En lille grad af ikke-linearitet i clearance blev observeret med stigende doser af linezolid, hvilket ser ud til at skyldes lavere renal og nonrenal clearance af linezolid ved højere koncentrationer. Forskellen i clearance var dog lille og blev ikke afspejlet i den tilsyneladende eliminationshalveringstid.
Specifikke populationer
Geriatriske patienter
Linezolids farmakokinetik er ikke signifikant ændret hos ældre patienter (65 år eller ældre). Derfor er dosisjustering for geriatriske patienter ikke nødvendig.
Pædiatriske patienter
Farmakokinetikken af linezolid efter en enkelt intravenøs dosis blev undersøgt hos pædiatriske patienter i alderen fra fødslen til 17 år (inklusive for tidligt fødte og fuldbårne nyfødte), hos raske teenagere i alderen 12 til 17 år og hos pædiatriske patienter i alderen fra 1 uge til og med 12 år. De farmakokinetiske parametre for linezolid er opsummeret i tabel 9 for de undersøgte pædiatriske populationer og raske voksne personer efter administration af enkelt intravenøse doser.
Cmax og distributionsvolumen (Vss) for linezolid er ens uanset alder hos pædiatriske patienter. Plasmaclearance af linezolid varierer dog som funktion af alder. Med udelukkelse af præmature nyfødte under en uges alderen er vægtbaseret clearance hurtigst i de yngste aldersgrupper fra
Lignende gennemsnitlige daglige AUC-værdier blev observeret hos pædiatriske patienter fra fødslen til 11 års alderen, doseret hver 8. time i forhold til teenagere eller voksne doseret hver 12. time. Derfor bør dosis til pædiatriske patienter op til 11 år være 10 mg/kg hver 8. time. Pædiatriske patienter på 12 år og ældre skal have 600 mg hver 12. time [se DOSERING OG ADMINISTRATION ].
Køn
Hunnerne har et lidt lavere distributionsvolumen af linezolid end hannerne. Plasmakoncentrationerne er højere hos kvinder end hos mænd, hvilket til dels skyldes forskelle i kropsvægt. Efter en dosis på 600 mg er den gennemsnitlige orale clearance ca. 38 % lavere hos kvinder end hos mænd. Der er dog ingen signifikante kønsforskelle i den gennemsnitlige tilsyneladende eliminationshastighedskonstant eller halveringstid. Lægemiddeleksponering hos kvinder forventes således ikke at stige væsentligt ud over niveauer, der vides at være veltolererede. Derfor synes dosisjustering efter køn ikke at være nødvendig.
Nedsat nyrefunktion
Farmakokinetikken af moderlægemidlet, linezolid, ændres ikke hos patienter med nogen grad af nedsat nyrefunktion; dog akkumuleres de to primære metabolitter af linezolid hos patienter med nedsat nyrefunktion, hvor mængden af akkumulering stiger med sværhedsgraden af nyreinsufficiens (se tabel 10). Farmakokinetikken af linezolid og dets to metabolitter er også blevet undersøgt hos patienter med nyresygdom i slutstadiet (ESRD), som er i hæmodialyse. I ESRD-studiet blev 14 patienter doseret med linezolid 600 mg hver 12. time i 14,5 dage (se tabel 11). Da der opnås lignende plasmakoncentrationer af linezolid uanset nyrefunktion, anbefales ingen dosisjustering til patienter med nedsat nyrefunktion. Men da der mangler information om den kliniske betydning af akkumulering af de primære metabolitter, bør brugen af linezolid hos patienter med nedsat nyrefunktion vejes mod de potentielle risici for akkumulering af disse metabolitter. Både linezolid og de to metabolitter elimineres ved hæmodialyse. Der er ingen tilgængelig information om virkningen af peritonealdialyse på linezolids farmakokinetik. Ca. 30 % af en dosis blev elimineret i en 3-timers hæmodialysesession, der startede 3 timer efter, at dosis linezolid blev administreret; derfor bør linezolid gives efter hæmodialyse.
Nedsat leverfunktion
Linezolids farmakokinetik er ikke ændret hos patienter (n=7) med let til moderat nedsat leverfunktion (Child-Pugh klasse A eller B). På grundlag af den tilgængelige information anbefales ingen dosisjustering til patienter med let til moderat nedsat leverfunktion. Linezolids farmakokinetik hos patienter med svært nedsat leverfunktion er ikke blevet evalueret.
Lægemiddelinteraktioner
Lægemidler metaboliseret af Cytokrom P450
Linezolid er ikke en inducer af cytochrom P450 (CYP450) hos rotter. Derudover hæmmer linezolid ikke aktiviteterne af klinisk signifikante humane CYP-isoformer (f.eks. 1A2, 2C9, 2C19, 2D6, 2E1, 3A4). Derfor forventes linezolid ikke at påvirke farmakokinetikken af andre lægemidler, der metaboliseres af disse vigtige enzymer. Samtidig administration af linezolid ændrer ikke væsentligt de farmakokinetiske egenskaber af (S)-warfarin, som i vid udstrækning metaboliseres af CYP2C9. Lægemidler såsom warfarin og phenytoin, som er CYP2C9-substrater, kan gives sammen med linezolid uden ændringer i dosisregimen.
Antibakterielle lægemidler
Aztreonam: Farmakokinetikken af linezolid eller aztreonam ændres ikke, når de administreres sammen.
Gentamicin: Farmakokinetikken af linezolid eller gentamicin ændres ikke, når de administreres sammen.
Antioxidanter
Potentialet for lægemiddelinteraktioner med linezolid og antioxidanterne C-vitamin og E-vitamin blev undersøgt hos raske frivillige. Forsøgspersonerne fik en 600 mg oral dosis linezolid på dag 1 og en anden 600 mg dosis linezolid på dag 8. På dag 2-9 fik forsøgspersonerne enten C-vitamin (1.000 mg/dag) eller E-vitamin (800 IE/dag) dag). AUC0-∞ for linezolid steg 2,3 %, når det administreres sammen med C-vitamin og 10,9 %, når det administreres sammen med E-vitamin. Ingen linezolid-dosisjustering anbefales ved samtidig administration med C-vitamin eller E-vitamin.
Stærke CYP 3A4 inducere
Rifampin
Effekten af rifampin på linezolids farmakokinetik blev evalueret i et studie med 16 raske voksne mænd. Frivillige fik oral linezolid 600 mg to gange dagligt i 5 doser med og uden rifampin 600 mg én gang dagligt i 8 dage. Samtidig administration af rifampin og linezolid resulterede i et fald på 21 % i linezolid Cmax [90 % CI, 15 % - 27 %] og et 32 % fald i linezolid AUC0-12 [90 % CI, 27 % - 37 %]. Den kliniske betydning af denne interaktion er ukendt. Mekanismen for denne interaktion er ikke fuldt ud forstået og kan være relateret til induktionen af leverenzymer. Andre stærke inducere af leverenzymer (f.eks. carbamazepin, phenytoin, phenobarbital) kan forårsage et lignende eller mindre fald i linezolideksponering.
Monoaminoxidasehæmning
Linezolid er en reversibel, ikke-selektiv hæmmer af monoaminoxidase. Linezolid har derfor potentiale for interaktion med adrenerge og serotonerge midler.
Adrenerge midler
Nogle personer, der får ZYVOX 600 mg, kan opleve en reversibel forstærkning af pressorresponset på indirekte virkende sympatomimetiske midler, vasopressorer eller dopaminerge midler. Almindeligt anvendte lægemidler såsom phenylpropanolamin og pseudoephedrin er blevet specifikt undersøgt. Startdoser af adrenerge midler, såsom dopamin eller epinephrin, bør reduceres og titreres for at opnå det ønskede respons.
Tyramin
Et signifikant pressor-respons er blevet observeret hos normale voksne forsøgspersoner, der fik linezolid- og tyramindoser på mere end 100 mg. Derfor skal patienter, der får linezolid, undgå at indtage store mængder fødevarer eller drikkevarer med højt tyraminindhold [se PATIENTOPLYSNINGER ].
Pseudoephedrin HCl eller phenylpropanolamin HCl
En reversibel forøgelse af pressorresponset af enten pseudoephedrin HCl (PSE) eller phenylpropanolamin HCl (PPA) observeres, når linezolid administreres til raske normotensive forsøgspersoner [se ADVARSLER OG FORHOLDSREGLER og DRUGSINTERAKTIONER ]. En lignende undersøgelse er ikke blevet udført med hypertensive patienter. Interaktionsundersøgelserne udført i normotensive forsøgspersoner evaluerede blodtryks- og hjertefrekvenseffekterne af placebo, PPA eller PSE alene, linezolid alene og kombinationen af steady-state linezolid (600 mg hver 12. time i 3 dage) med to doser PPA ( 25 mg) eller PSE (60 mg) givet med 4 timers mellemrum. Hjertefrekvensen blev ikke påvirket af nogen af behandlingerne. Blodtrykket blev forhøjet med begge kombinationsbehandlinger. Maksimale blodtryksniveauer blev set 2 til 3 timer efter den anden dosis af PPA eller PSE og vendte tilbage til baseline 2 til 3 timer efter peak. Resultaterne af PPA-undersøgelsen følger, som viser det gennemsnitlige (og interval) maksimale systoliske blodtryk i mm Hg: placebo = 121 (103 til 158); linezolid alene = 120 (107 til 135); PPA alene = 125 (106 til 139); PPA med linezolid = 147 (129 til 176). Resultaterne fra PSE-undersøgelsen lignede dem i PPA-undersøgelsen. Den gennemsnitlige maksimale stigning i systolisk blodtryk over baseline var 32 mm Hg (interval: 20-52 mm Hg) og 38 mm Hg (interval: 18-79 mm Hg) under samtidig administration af linezolid med henholdsvis pseudoephedrin eller phenylpropanolamin.
Serotonerge midler
Dextromethorphan
Den potentielle lægemiddelinteraktion med dextromethorphan blev undersøgt hos raske frivillige. Forsøgspersonerne fik dextromethorphan (to 20 mg doser givet med 4 timers mellemrum) med eller uden linezolid. Ingen serotonergt syndrom-effekter (forvirring, delirium, rastløshed, rysten, rødmen, diaforese, hyperpyreksi) er blevet observeret hos normale forsøgspersoner, der fik linezolid og dextromethorphan.
Mikrobiologi
Handlingsmekanisme
Linezolid er et syntetisk antibakterielt middel af oxazolidinon-klassen, som har klinisk anvendelighed til behandling af infektioner forårsaget af aerobe gram-positive bakterier. Linezolids aktivitetsspektrum in vitro omfatter også visse gramnegative bakterier og anaerobe bakterier. Linezolid binder sig til et sted på det bakterielle 23S ribosomale RNA i 50S-underenheden og forhindrer dannelsen af et funktionelt 70S-initieringskompleks, som er afgørende for bakteriel reproduktion. Resultaterne af tidsdræbende undersøgelser har vist, at linezolid er bakteriostatisk over for enterokokker og stafylokokker. For streptokokker blev linezolid fundet at være bakteriedræbende for de fleste isolater.
Modstand
In vitro undersøgelser har vist, at punktmutationer i 23S rRNA er forbundet med linezolidresistens. Rapporter om, at vancomycin-resistent Enterococcus faecium bliver resistent over for linezolid under dets kliniske brug, er blevet offentliggjort. Der er rapporter om Staphylococcus aureus (methicillin-resistent), der udvikler resistens over for linezolid under klinisk brug. Linezolidresistensen i disse organismer er forbundet med en punktmutation i organismens 23S rRNA (substitution af thymin med guanin i position 2576). Organismer, der er resistente over for oxazolidinoner via mutationer i kromosomale gener, der koder for 23S rRNA eller ribosomale proteiner (L3 og L4), er generelt krydsresistente over for linezolid. Også linezolidresistens hos stafylokokker medieret af enzymet methyltransferase er blevet rapporteret. Denne resistens medieres af cfr-genet (chloramphenicol-florfenicol) placeret på et plasmid, som kan overføres mellem stafylokokker.
Interaktion med andre antimikrobielle lægemidler
In vitro undersøgelser har vist additivitet eller ligegyldighed mellem linezolid og vancomycin, gentamicin, rifampin, imipenem-cilastatin, aztreonam, ampicillin eller streptomycin.
Linezolid har vist sig at være aktivt mod de fleste isolater af følgende mikroorganismer, både in vitro og ved kliniske infektioner [se INDIKATIONER ].
Gram-positive bakterier
Enterococcus faecium (kun vancomycin-resistente isolater) Staphylococcus aureus (inklusive methicillin-resistente isolater) Streptococcus agalactiae Streptococcus pneumoniae Streptococcus pyogenes
Følgende in vitro-data er tilgængelige, men deres kliniske betydning er ukendt. Mere end 90 % af de følgende bakterier udviser en in vitro MIC, der er mindre end eller lig med det linezolid-følsomme brudpunkt for organismer af lignende slægt. Sikkerheden og effektiviteten af linezolid til behandling af kliniske infektioner på grund af disse bakterier er ikke blevet fastslået i tilstrækkelige og velkontrollerede kliniske forsøg.
Gram-positive bakterier
Enterococcus faecalis (herunder vancomycin-resistente isolater) Enterococcus faecium (vancomycin-følsomme isolater) Staphylococcus epidermidis (inklusive methicillin-resistente isolater) Staphylococcus haemolyticus Viridans gruppe streptokokker
Gram-negative bakterier
Pasteurella multocida
Modtagelighedstest
For specifik information om fortolkningskriterier for følsomhedstest og tilhørende testmetoder og kvalitetskontrolstandarder anerkendt af FDA for dette lægemiddel, se venligst: https://www.fda.gov/STIC.
Dyretoksikologi og/eller farmakologi
Målorganer med linezolidtoksicitet var ens hos unge og voksne rotter og hunde. Dosis- og tidsafhængig myelosuppression, som påvist ved knoglemarvshypocellularitet/nedsat hæmatopoiese, nedsat ekstramedullær hæmatopoiese i milt og lever og nedsatte niveauer af cirkulerende erytrocytter, leukocytter og blodplader er set i dyreforsøg. Lymfoid udtømning forekom i thymus, lymfeknuder og milt. Generelt var de lymfoide fund forbundet med anoreksi, vægttab og undertrykkelse af kropsvægtøgning, hvilket kan have bidraget til de observerede effekter.
Hos rotter, der fik linezolid oralt i 6 måneder, blev ikke-reversibel, minimal til mild aksonal degeneration af iskiasnerver observeret ved 80 mg/kg/dag; minimal degeneration af ischiasnerven blev også observeret hos 1 mand ved dette dosisniveau ved en 3-måneders midlertidig obduktion. Følsom morfologisk evaluering af perfusionsfikseret væv blev udført for at undersøge tegn på optisk nervedegeneration. Minimal til moderat degeneration af synsnerven var tydelig hos 2 hanrotter efter 6 måneders dosering, men det direkte forhold til lægemidlet var tvetydigt på grund af fundets akutte karakter og dets asymmetriske fordeling. Den observerede nervedegeneration var mikroskopisk sammenlignelig med spontan unilateral optisk nervedegeneration rapporteret hos aldrende rotter og kan være en forværring af almindelig baggrundsændring.
Disse virkninger blev observeret ved eksponeringsniveauer, der er sammenlignelige med dem, der er observeret hos nogle mennesker. De hæmatopoietiske og lymfoide virkninger var reversible, selvom reverseringen i nogle undersøgelser var ufuldstændig inden for varigheden af restitutionsperioden.
Kliniske Studier
Voksne
Nosokomiel lungebetændelse
Voksne patienter med klinisk og radiologisk dokumenteret nosokomiel lungebetændelse blev inkluderet i et randomiseret, multicenter, dobbeltblindet forsøg. Patienterne blev behandlet i 7 til 21 dage. Den ene gruppe fik ZYVOX IV injektion 600 mg hver 12. time, og den anden gruppe fik vancomycin 1 g hver 12. time intravenøst. Begge grupper fik samtidig aztreonam (1 til 2 g hver 8. time intravenøst), som kunne fortsættes, hvis det var klinisk indiceret. Der var 203 linezolid-behandlede og 193 vancomycin-behandlede patienter inkluderet i undersøgelsen. Et hundrede og toogtyve (60 %) linezolid-behandlede patienter og 103 (53 %) vancomycin-behandlede patienter var klinisk evaluerbare. Helbredelsesraterne hos klinisk evaluerbare patienter var 57 % for linezolidbehandlede patienter og 60 % for vancomycinbehandlede patienter. Helbredelsesraterne hos klinisk evaluerbare patienter med ventilator-associeret lungebetændelse var 47 % for linezolid-behandlede patienter og 40 % for vancomycin-behandlede patienter. En modificeret intent-to-treat-analyse (MITT) af 94 linezolid-behandlede patienter og 83 vancomycin-behandlede patienter inkluderede forsøgspersoner, som havde et patogen isoleret før behandling. Helbredelsesraterne i MITT-analysen var 57 % hos linezolidbehandlede patienter og 46 % hos vancomycinbehandlede patienter. Helbredelsesraterne efter patogen for mikrobiologisk evaluerbare patienter er vist i tabel 12.
Komplicerede hud- og hudstrukturinfektioner
Voksne patienter med klinisk dokumenterede komplicerede hud- og hudstrukturinfektioner blev inkluderet i et randomiseret, multicenter, dobbeltblindet, dobbelt-dummy-forsøg, der sammenlignede undersøgelsesmedicin administreret intravenøst efterfulgt af medicin givet oralt i i alt 10 til 21 dages behandling. En gruppe patienter fik ZYVOX IV injektion 600 mg hver 12. time efterfulgt af ZYVOX 600 mg tabletter 600 mg hver 12. time; den anden gruppe fik oxacillin 2 g hver 6. time intravenøst efterfulgt af dicloxacillin 500 mg hver 6. time oralt. Patienter kan få samtidig aztreonam, hvis det er klinisk indiceret. Der var 400 linezolid-behandlede og 419 oxacillin-behandlede patienter inkluderet i undersøgelsen. To hundrede og femogfyrre (61 %) linezolid-behandlede patienter og 242 (58 %) oxacillin-behandlede patienter var klinisk evaluerbare. Helbredelsesraten hos klinisk evaluerbare patienter var 90 % hos linezolidbehandlede patienter og 85 % hos oxacillinbehandlede patienter. En modificeret intent-to-treat (MITT)-analyse af 316 linezolid-behandlede patienter og 313 oxacillin-behandlede patienter inkluderede forsøgspersoner, der opfyldte alle kriterier for undersøgelsesdeltagelse. Helbredelsesraterne i MITT-analysen var 86 % hos linezolidbehandlede patienter og 82 % hos oxacillinbehandlede patienter. Helbredelsesraterne efter patogen for mikrobiologisk evaluerbare patienter er vist i tabel 13.
En separat undersøgelse gav yderligere erfaring med brugen af ZYVOX til behandling af methicillin-resistente Staphylococcus aureus (MRSA) infektioner. Dette var et randomiseret, åbent forsøg med indlagte voksne patienter med dokumenteret eller mistænkt MRSA-infektion.
En gruppe patienter fik ZYVOX IV-injektion 600 mg hver 12. time efterfulgt af ZYVOX-tabletter 600 mg hver 12. time. Den anden gruppe patienter fik vancomycin 1 g hver 12. time intravenøst. Begge grupper blev behandlet i 7 til 28 dage og kunne samtidig modtage aztreonam eller gentamicin, hvis det var klinisk indiceret. Helbredelsesraterne hos mikrobiologisk evaluerbare patienter med MRSA-hud- og hudstrukturinfektion var 26/33 (79 %) for linezolidbehandlede patienter og 24/33 (73 %) for vancomycinbehandlede patienter.
Infektioner i diabetesfod
Voksne diabetespatienter med klinisk dokumenterede komplicerede hud- og hudstrukturinfektioner ("diabetiske fodinfektioner") blev inkluderet i et randomiseret (2:1 forhold), multicenter, åbent forsøg, der sammenlignede undersøgelsesmedicin administreret intravenøst eller oralt i i alt 14 til 28 dages behandling. En gruppe patienter fik ZYVOX 600 mg hver 12. time intravenøst eller oralt; den anden gruppe fik ampicillin/sulbactam 1,5 til 3 g intravenøst eller amoxicillin/clavulanat 500 til 875 mg hver 8. til 12. time oralt. I lande, hvor ampicillin/sulbactam ikke markedsføres, blev amoxicillin/clavulanat 500 mg til 2 g hver 6. time anvendt til det intravenøse regime. Patienter i komparatorgruppen kunne også behandles med vancomycin 1 g hver 12. time intravenøst, hvis MRSA blev isoleret fra fodinfektionen. Patienter i begge behandlingsgrupper, som havde gramnegative baciller isoleret fra infektionsstedet, kunne også modtage aztreonam 1 til 2 g hver 8.-12. time intravenøst. Alle patienter var berettigede til at modtage passende supplerende behandlingsmetoder, såsom debridement og aflastning, som typisk kræves i behandlingen af diabetiske fodinfektioner, og de fleste patienter modtog disse behandlinger. Der var 241 linezolid-behandlede og 120 komparator-behandlede patienter i intention-to-treat (ITT) undersøgelsespopulationen. To hundrede tolv (86 %) linezolid-behandlede patienter og 105 (85 %) komparator-behandlede patienter var klinisk evaluerbare. I ITT-populationen var helbredelsesraterne 68,5 % (165/241) hos linezolidbehandlede patienter og 64 % (77/120) hos komparatorbehandlede patienter, hvor patienter med ubestemte og manglende udfald blev betragtet som svigt. Helbredelsesraterne hos de klinisk evaluerbare patienter (eksklusive dem med ubestemte og manglende udfald) var henholdsvis 83 % (159/192) og 73 % (74/101) hos linezolid- og komparatorbehandlede patienter. En kritisk post-hoc-analyse fokuserede på 121 linezolid-behandlede og 60 komparator-behandlede patienter, som havde et gram-positivt patogen isoleret fra infektionsstedet eller fra blod, som havde færre tegn på underliggende osteomyelitis end den samlede undersøgelsespopulation, og som ikke modtaget forbudte antimikrobielle stoffer. Baseret på denne analyse var helbredelsesraterne 71 % (86/121) hos de linezolidbehandlede patienter og 63 % (38/60) hos de sammenlignende patienter. Ingen af ovenstående analyser blev justeret for brugen af supplerende terapier. Helbredelsesraterne efter patogen for mikrobiologisk evaluerbare patienter er vist i tabel 14.
Vancomycin-resistente enterokokinfektioner
Voksne patienter med dokumenteret eller mistænkt vancomycin-resistent enterokokinfektion blev inkluderet i et randomiseret, multicenter, dobbeltblindet forsøg, der sammenlignede en høj dosis ZYVOX (600 mg) med en lav dosis ZYVOX (200 mg) givet hver 12. time, enten intravenøst (IV) eller oralt i 7 til 28 dage. Patienter kan samtidig få aztreonam eller aminoglykosider. Der var 79 patienter randomiseret til højdosis linezolid og 66 til lavdosis linezolid. Intent-to-treat-populationen (ITT) med dokumenteret vancomycin-resistent enterokokinfektion ved baseline bestod af 65 patienter i højdosis-armen og 52 i lavdosis-armen.
Helbredelsesraterne for ITT-populationen med dokumenteret vancomycin-resistent enterokokinfektion ved baseline er vist i tabel 15 efter infektionskilde. Disse helbredelsesrater inkluderer ikke patienter med manglende eller ubestemte udfald. Helbredelsesraten var højere i højdosis-armen end i lavdosis-armen, selvom forskellen ikke var statistisk signifikant på 0,05-niveauet.
Pædiatriske patienter
Infektioner på grund af grampositive bakterier
Et sikkerheds- og virkningsstudie gav erfaring med brugen af ZYVOX 600 mg til pædiatriske patienter til behandling af nosokomial lungebetændelse, komplicerede hud- og hudstrukturinfektioner og andre infektioner på grund af gram-positive bakterielle patogener, herunder methicillin-resistente og modtagelige Staphylococcus aureus og vancomycin-resistent Enterococcus faecium. Pædiatriske patienter i alderen fra fødslen til og med 11 år med infektioner forårsaget af de dokumenterede eller mistænkte grampositive bakterier blev indskrevet i et randomiseret, openPage-mærket, sammenlignende-kontrolleret forsøg. En gruppe patienter fik ZYVOX 600 mg IV-injektion 10 mg/kg hver 8. time efterfulgt af ZYVOX 600 mg til oral suspension 10 mg/kg hver 8. time. En anden gruppe fik vancomycin 10 til 15 mg/kg intravenøst hver 6. til 24. time, afhængigt af alder og renal clearance. Patienter, der havde bekræftet VRE-infektioner, blev placeret i en tredje arm af undersøgelsen og fik ZYVOX 10 mg/kg hver 8. time intravenøst og/eller oralt. Alle patienter blev behandlet i i alt 10 til 28 dage og kunne samtidig modtage gramnegative antibakterielle lægemidler, hvis det var klinisk indiceret. I intent-to-treat-populationen (ITT) var der 206 patienter randomiseret til linezolid og 102 patienter randomiseret til vancomycin. Helbredelsesraterne for ITT, MITT og klinisk evaluerbare patienter er vist i tabel 16. Efter at undersøgelsen var afsluttet, blev 13 yderligere patienter fra 4 dage til 16 år indskrevet i en åben udvidelse af VRE-armen i undersøgelse. Tabel 17 viser kliniske helbredelsesrater efter patogen for mikrobiologisk evaluerbare patienter, herunder mikrobiologisk evaluerbare patienter med vancomycin-resistent Enterococcus faecium fra forlængelsen af denne undersøgelse.
PATIENTOPLYSNINGER
Vigtige administrationsinstruktioner
Rådgiv patienterne, at ZYVOX kan tages med eller uden mad.
Perifer og optisk neuropati
Råd patienter til at informere deres læge, hvis de oplever ændringer i synet, mens de tager ZYVOX [se ADVARSLER OG FORHOLDSREGLER ].
Serotonin syndrom
Rådgive patienter om at informere deres læge, hvis de tager serotonerge midler, herunder serotonin genoptagelseshæmmere eller andre antidepressiva og opioider [se ADVARSLER OG FORHOLDSREGLER ].
Potentielle interaktioner, der frembringer forhøjelse af blodtrykket
- Råd patienter til at informere deres læge, hvis de har en historie med hypertension.
- Rådgiv patienterne om at undgå store mængder mad eller drikkevarer med højt tyraminindhold, mens de tager ZYVOX. Fødevarer med højt tyraminindhold omfatter dem, der kan have gennemgået proteinændringer ved ældning, gæring, syltning eller rygning for at forbedre smagen, såsom lagrede oste, fermenteret eller lufttørret kød, surkål, sojasovs, fadeøl og rødvine. Tyraminindholdet i enhver proteinrig mad kan øges, hvis den opbevares i længere perioder eller forkert nedkølet.
- Råd patienter til at informere deres læge, hvis de tager medicin, der indeholder pseudoephedrin HCl eller phenylpropanolamin HCl, såsom forkølelsesmidler og dekongestanter [se ADVARSLER OG FORHOLDSREGLER ].
Mælkesyreacidose
Råd patienter til at informere deres læge, hvis de oplever gentagne episoder med kvalme eller opkastning, mens de får ZYVOX [se ADVARSLER OG FORHOLDSREGLER ].
Kramper
Råd patienter til at informere deres læge, hvis de har en historie med anfald eller kramper [se ADVARSLER OG FORHOLDSREGLER ].
Hypoglykæmi
Råd patienter til at informere deres læge, hvis de har diabetes mellitus. Hypoglykæmiske reaktioner, såsom diaforese og tremuløshed, sammen med lavt blodsukkermålinger kan forekomme, når de behandles med linezolid. Hvis sådanne reaktioner opstår, skal patienter kontakte en læge eller anden sundhedsprofessionel for korrekt behandling [se ADVARSLER OG FORHOLDSREGLER ].
Hyponatriæmi og/eller SIADH
Rådgiv patienter med risiko for hyponatriæmi om at informere deres læge, hvis de oplever tegn og symptomer på hyponatriæmi og/eller SIADH, herunder forvirring, døsighed, generaliseret svaghed og åndedrætsbesvær [se ADVARSLER OG FORHOLDSREGLER ].
Fenylketonuri
Rådgiv patienter med phenylketonuri (PKU), at hver 5 ml af 100 mg/5 ml ZYVOX til oral suspension indeholder 20 mg phenylalanin. De andre ZYVOX 600 mg formuleringer indeholder ikke phenylalanin. Phenylalanin kan være skadeligt for patienter med phenylketonuri. Kontakt din læge eller apotek, når du får ordineret ZYVOX 600 mg til oral suspension [se ADVARSLER OG FORHOLDSREGLER ].
Antibakteriel resistens
Patienter bør rådgives om, at antibakterielle lægemidler inklusive ZYVOX kun bør anvendes til behandling af bakterielle infektioner. De behandler ikke virusinfektioner (f.eks. forkølelse). Når ZYVOX 600 mg er ordineret til behandling af en bakteriel infektion, skal patienterne fortælles, at selvom det er almindeligt at føle sig bedre tidligt i behandlingsforløbet, skal medicinen tages nøjagtigt som anvist. At springe doser over eller ikke fuldføre hele behandlingsforløbet kan mindske effektiviteten af den øjeblikkelige behandling og øge sandsynligheden for, at bakterier udvikler resistens og ikke vil kunne behandles med ZYVOX eller andre antibakterielle lægemidler i fremtiden.
Diarré
Diarré er et almindeligt problem forårsaget af antibakterielle lægemidler, som normalt ender, når det antibakterielle lægemiddel seponeres. Nogle gange kan patienter efter start af behandling med antibakterielle lægemidler udvikle vandig og blodig afføring (med eller uden mavekramper og feber) selv så sent som to eller flere måneder efter at have taget den sidste dosis af det antibakterielle lægemiddel. Hvis dette sker, skal patienter kontakte deres læge så hurtigt som muligt [se ADVARSLER OG FORHOLDSREGLER ].
Infertilitet
Rådgiv mandlige patienter, at ZYVOX reversibelt kan svække fertiliteten [se Brug i specifikke populationer ].
Dette produkts mærkning kan være blevet opdateret. Besøg www.pfizer.com for at få de seneste ordinationsoplysninger.
