Vantin 200mg, 100mg Cefpodoxime Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Vantin 100mg, og hvordan bruges det?
Vantin 100mg er en receptpligtig medicin, der bruges til at behandle symptomerne på forskellige bakterielle infektioner såsom bronkitis, lungebetændelse, bihulebetændelse, pharyngitis, tonsillitis, urinvejsinfektioner, hudinfektioner og gonoré. Vantin 200mg kan bruges alene eller sammen med anden medicin.
Vantin tilhører en klasse af lægemidler kaldet Caphalosporiner, 3. generation.
Det vides ikke, om Vantin er sikkert og effektivt til børn under 2 måneder.
Hvad er de mulige bivirkninger af Vantin 200mg?
Vantin kan forårsage alvorlige bivirkninger, herunder:
- nældefeber,
- åndedrætsbesvær,
- hævelse af dit ansigt, læber, tunge eller hals,
- feber,
- ondt i halsen,
- brændende i dine øjne,
- hudsmerter,
- rødt eller lilla hududslæt, der spreder sig og forårsager blærer og afskalning,
- stærke mavesmerter,
- diarré, der er vandig eller blodig,
- hævede kirtler,
- ledsmerter,
- generel dårlig følelse,
- bankende hjerteslag,
- flagrende i dit bryst,
- åndenød, og
- anfald
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Vantin omfatter:
- vaginal kløe eller udflåd,
- bleudslæt hos et spædbarn, der bruger denne medicin,
- kvalme,
- opkastning,
- diarré,
- mavesmerter, og
- hovedpine
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Vantin. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
For at reducere udviklingen af lægemiddelresistente bakterier og bevare effektiviteten af VANTIN 100mg og andre antibakterielle lægemidler, bør VANTIN 100mg kun bruges til at behandle eller forebygge infektioner, der er bevist eller stærkt mistænkt for at være forårsaget af bakterier.
BESKRIVELSE
Cefpodoxim proxetil er et oralt administreret, udvidet spektrum, semisyntetisk antibiotikum af cephalosporin-klassen. Det kemiske navn er (RS)-1(isopropoxycarbonyloxy)ethyl(+)-(6R,7R)-7-[2-(2-amino-4-thiazolyl)-2-{(Z)methoxyimino}acetamido]-3 -methoxymethyl-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-en-2-carboxylat. Dens empiriske formel er C21H27N5O9S2, og dens strukturformel er repræsenteret nedenfor:
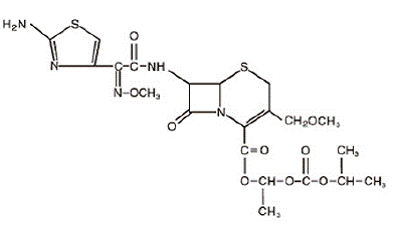
Molekylvægten af cefpodoxim proxetil er 557,6.
Cefpodoxim proxetil er et prodrug; dens aktive metabolit er cefpodoxim. Alle doser af cefpodoxim proxetil i denne indsats er udtrykt i form af den aktive cefpodoxim-del. Lægemidlet leveres både som filmovertrukne tabletter og som aromatiseret granulat til oral suspension.
VANTIN-tabletter indeholder cefpodoximproxetil svarende til 100 mg eller 200 mg cefpodoximaktivitet og følgende inaktive ingredienser: carboxymethylcellulosecalcium, carnaubavoks, FD&C Yellow No. 6, hydroxypropylcellulose, hypromellose, vandholdig laktose, magnesiumstearat, natriumglycurolsulfat, natriumglycurolsulfat og propylenglycol. titandioxid. Derudover indeholder de 100 mg filmovertrukne tabletter D&C Yellow No. 10, og de 200 mg filmovertrukne tabletter indeholder FD&C Red No. 40.
Hver 5 ml VANTIN Oral Suspension indeholder cefpodoximproxetil svarende til 50 mg eller 100 mg cefpodoximaktivitet efter konstitution og følgende inaktive ingredienser: kunstige smagsstoffer, butyleret hydroxyanisol (BHA), carboxymethylcellulosenatrium, mikrokrystallinsk cellulose, colloidalsyre, cellulose, carboxylsyre. siliciumdioxid, croscarmellosenatrium, hydroxypropylcellulose, lactose, maltodextrin, naturlige smagsstoffer, propylenglycolalginat, natriumcitrat, natriumbenzoat, stivelse, saccharose og vegetabilsk olie.
INDIKATIONER
Cefpodoxim proxetil er indiceret til behandling af patienter med milde til moderate infektioner forårsaget af modtagelige stammer af de udpegede mikroorganismer under de tilstande, der er anført nedenfor.
Anbefalede doser, behandlingsvarigheder og relevante patientpopulationer varierer blandt disse infektioner. Se venligst DOSERING OG ADMINISTRATION for specifikke anbefalinger. Akut mellemørebetændelse forårsaget af Streptococcus pneumoniae (eksklusive penicillin-resistente stammer), Streptococcus pyogenes, Haemophilus influenzae (herunder beta-lactamase-producerende stammer) eller Moraxella (Branhamella) catarrhalis (inklusive beta-lactamase-producerende stammer).
Pharyngitis og/eller tonsillitis forårsaget af Streptococcus pyogenes.
BEMÆRK: Kun penicillin ad intramuskulær indgivelsesvej har vist sig at være effektiv til profylakse af gigtfeber. Cefpodoxim proxetil er generelt effektiv til udryddelse af streptokokker fra oropharynx. Data, der fastslår effektiviteten af cefpodoximproxetil til profylakse af efterfølgende gigtfeber, er dog ikke tilgængelige.
Samfundserhvervet lungebetændelse forårsaget af S. pneumoniae eller H. Influenzae (herunder beta-lactamaseproducerende stammer).
Akut bakteriel forværring af kronisk bronkitis forårsaget af S. pneumoniae, H. influenzae (kun ikke-betalactamase-producerende stammer) eller M. catarrhalis. Data er utilstrækkelige på nuværende tidspunkt til at fastslå effektivitet hos patienter med akutte bakterielle eksacerbationer af kronisk bronkitis forårsaget af beta-lactamase-producerende stammer af H. influenzae.
Akut, ukompliceret urethral og cervikal gonoré forårsaget af Neisseria gonorrhoeae (herunder penicillinase-producerende stammer).
Akutte, ukomplicerede ano-rektale infektioner hos kvinder på grund af Neisseria gonorrhoeae (herunder penicillinase-producerende stammer).
BEMÆRK: Effekten af cefpodoxim til behandling af mandlige patienter med rektale infektioner forårsaget af N. gonorrhoeae er ikke blevet fastslået. Data understøtter ikke brugen af cefpodoximproxetil til behandling af pharyngeale infektioner på grund af N. gonorrhoeae hos mænd eller kvinder.
Ukomplicerede hud- og hudstrukturinfektioner forårsaget af Staphylococcus aureus (herunder penicillinase-producerende stammer) eller Streptococcus pyogenes. Abscesser skal drænes kirurgisk som klinisk indiceret.
BEMÆRK: I kliniske forsøg var vellykket behandling af ukomplicerede hud- og hudstrukturinfektioner dosisrelateret. Den effektive terapeutiske dosis til hudinfektioner var højere end dem, der blev brugt til andre anbefalede indikationer. (Se DOSERING OG ADMINISTRATION .)
Akut maksillær bihulebetændelse forårsaget af Haemophilus influenzae (herunder beta-lactamase-producerende stammer), Streptococcus pneumoniae og Moraxella catarrhalis.
Ukomplicerede urinvejsinfektioner (cystitis) forårsaget af Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis eller Staphylococcus saprophyticus.
BEMÆRK: Ved overvejelse af brugen af cefpodoxim proxetil i behandlingen af blærebetændelse, bør cefpodoxim proxetils lavere bakterielle udryddelsesrater afvejes mod de øgede udryddelsesrater og forskellige sikkerhedsprofiler for nogle andre klasser af godkendte midler. (Se Kliniske Studier afsnit.)
Der bør indhentes passende prøver til bakteriologisk undersøgelse for at isolere og identificere forårsagende organismer og for at bestemme deres modtagelighed for cefpodoxim. Terapi kan påbegyndes, mens man afventer resultaterne af disse undersøgelser. Når disse resultater er tilgængelige, bør antimikrobiel behandling justeres i overensstemmelse hermed.
For at reducere udviklingen af lægemiddelresistente bakterier og bevare effektiviteten af VANTIN 100mg og andre antibakterielle lægemidler, bør VANTIN 200mg kun bruges til at behandle eller forebygge infektioner, der er bevist eller stærkt mistænkt for at være forårsaget af modtagelige bakterier. Når kultur- og modtagelighedsoplysninger er tilgængelige, bør de overvejes ved udvælgelse eller ændring af antibakteriel behandling. I mangel af sådanne data kan lokal epidemiologi og modtagelighedsmønstre bidrage til den empiriske udvælgelse af terapi.
DOSERING OG ADMINISTRATION
(Se INDIKATIONER OG BRUG for indikerede patogener.)
Filmovertrukne tabletter
VANTIN tabletter bør indgives oralt med mad for at øge absorptionen. (Se KLINISK FARMAKOLOGI .)
De anbefalede doser, behandlingsvarigheder og anvendelig patientpopulation er som beskrevet i følgende skema:
Voksne og unge (12 år og ældre)
Granulat til oral suspension
VANTIN Oral Suspension kan gives uden hensyntagen til mad. De anbefalede doser, behandlingsvarigheder og relevante patientpopulationer er som beskrevet i følgende skema:
Voksne og unge (12 år og ældre)
Spædbørn og pædiatriske patienter (i alderen 2 måneder til 12 år)
Patienter med nedsat nyrefunktion
For patienter med svært nedsat nyrefunktion (
Når kun serumkreatininniveauet er tilgængeligt, kan følgende formel (baseret på patientens køn, vægt og alder) bruges til at estimere kreatininclearance (ml/min). For at dette estimat er gyldigt, bør serumkreatininniveauet repræsentere en stabil nyrefunktion.
Mænd (ml/min): Vægt (kg) x (140 - alder)/72 x serumkreatinin (mg/100 ml)
Hunner (ml/min) : 0,85 x over værdi
Patienter med skrumpelever
Cefpodoxims farmakokinetik hos cirrosepatienter (med eller uden ascites) er den samme som hos raske forsøgspersoner. Dosisjustering er ikke nødvendig i denne population.
Forberedelse af suspension
Forfatningsvejledning til oral suspension
Efter blanding skal suspensionen opbevares i køleskab, 2° til 8°C (36° til 46°F). Ryst godt før brug. Hold beholderen tæt lukket. Blandingen kan bruges i 14 dage. Kassér ubrugt portion efter 14 dage.
HVORDAN LEVERET
VANTIN tabletter fås i følgende styrker (ækvivalent cefpodoxim), farver og størrelser:
100 mg (lyse orange, elliptisk, præget med U3617)
20 flasker NDC 0009-3617-01 Flasker med 100 stk NDC 0009-3617-02 Enhedsdosispakninger med 100 stk NDC 0009-3617-03
200 mg (koralrød, elliptisk, præget med U3618)
20 flasker NDC 0009-3618-01 Flasker med 100 stk NDC 0009-3618-02
200 mg (koralrød, elliptisk, præget med U3618)
Enhedsdosis pakker med 100 stk NDC 0009-3618-03
Opbevar tabletter ved kontrolleret stuetemperatur 20° til 25°C (68° til 77°F) [se USP ].
Sæt hætten på igen efter hver åbning. Beskyt enhedsdosispakninger mod overdreven fugt.
VANTIN 200mg oral suspension giver hvad der svarer til 50 mg eller 100 mg cefpodoxim pr. 5 ml suspension (når den er sammensat som anvist) og fås i citroncreme smag i følgende størrelser:
50 mg/5 ml
100 ml suspension NDC 0009-3531-01 75 ml suspension NDC 0009-3531-02 50 ml suspension NDC 0009-3531-03
100 mg/5 ml
100 ml suspension NDC 0009-3615-01 75 ml suspension NDC 0009-3615-02 50 ml suspension NDC 0009-3615-03
Opbevar ususpenderede granulat ved kontrolleret stuetemperatur 20° til 25°C (68° til 77°F) [se USP ].
Vejledning til blanding er inkluderet på etiketten. Efter blanding skal suspensionen opbevares i køleskab, 2° til 8°C (36° til 46°F). Ryst godt før brug. Hold beholderen tæt lukket. Blandingen kan bruges i 14 dage. Kassér ubrugt portion efter 14 dage.
Distribueret af: Pharmacia & Upjohn Company, Division of Pfizer Inc., NY, NY 10017. Revideret: Aug 2016
BIVIRKNINGER
Kliniske forsøg
Filmovertrukne tabletter (flere doser)
I kliniske forsøg ved hjælp af flere doser af cefpodoxim proxetil filmovertrukne tabletter blev 4696 patienter behandlet med de anbefalede doser af cefpodoxim (100 til 400 mg Q 12 timer). Der var ingen dødsfald eller permanente handicap, der menes at være relateret til lægemiddeltoksicitet. Et hundrede niogtyve (2,7 %) patienter ophørte med medicinering på grund af bivirkninger, der menes muligvis eller sandsynligvis relateret til lægemiddeltoksicitet. Treoghalvfems (52 %) af de 178 patienter, der afbrød behandlingen (uanset om de mente det var relateret til lægemiddelbehandling eller ej) gjorde det på grund af mave-tarmforstyrrelser, kvalme, opkastning eller diarré. Procentdelen af cefpodoxim proxetil-behandlede patienter, som afbrød studielægemidlet på grund af bivirkninger, var signifikant større ved en dosis på 800 mg dagligt end ved en dosis på 400 mg dagligt eller ved en dosis på 200 mg dagligt. Bivirkninger, der menes muligvis eller sandsynligvis relateret til cefpodoxim i kliniske forsøg med flere doser (N=4696 cefpodoxim-behandlede patienter) var:
Incidens større end 1 %
Diarré 7,0 %
Diarré eller løs afføring var dosisrelateret: faldende fra 10,4 % af patienterne, der fik 800 mg dagligt, til 5,7 % for dem, der fik 200 mg dagligt. Af patienter med diarré havde 10 % C. difficile organisme eller toksin i afføringen. (Se ADVARSLER .)
Kvalme 3,3 % vaginale svampeinfektioner 1,0 % vulvovaginale infektioner 1,3 % mavesmerter 1,2 % hovedpine 1,0 %
Incidens mindre end 1 %
Efter kropssystem i faldende rækkefølge
Kliniske Studier
Uønskede hændelser, der tænkes muligvis eller sandsynligvis er relateret til Cefpodoxim Proxetil, der forekom hos mindre end 1 % af patienterne (N=4696)
Krop - svampeinfektioner, abdominal udspilning, utilpashed, træthed, asteni, feber, brystsmerter, rygsmerter, kulderystelser, generaliserede smerter, unormale mikrobiologiske tests, moniliasis, byld, allergisk reaktion, ansigtsødem, bakterielle infektioner, parasitære infektioner, lokaliseret ødem, lokaliseret smerte .
Kardiovaskulær - kongestiv hjertesvigt, migræne, hjertebanken, vasodilatation, hæmatom, hypertension, hypotension.
Fordøjelse - opkastning, dyspepsi, mundtørhed, flatulens, nedsat appetit, forstoppelse, oral moniliasis, anoreksi, udbrud, gastritis, mundsår, gastrointestinale lidelser, rektale lidelser, tungelidelser, tandlidelser, øget tørst, orale læsioner, tenesmus, tør hals .
hemisk og lymfatisk - anæmi.
Metabolisk og ernæringsmæssig - dehydrering, gigt, perifert ødem, vægtstigning.
Muskulo-skelet - myalgi.
nervøs - svimmelhed, søvnløshed, somnolens, angst, rysten, nervøsitet, hjerneinfarkt, ændring i drømme, nedsat koncentrationsevne, forvirring, mareridt, paræstesi, svimmelhed.
Åndedræt - astma, hoste, næseblødning, rhinitis, hvæsen, bronkitis, dyspnø, pleural effusion, lungebetændelse, bihulebetændelse.
Hud - nældefeber, udslæt, kløe uden påføringssted, diaforese, makulopapulært udslæt, svampeeksem, afskalning, tør hud uden påføringssted, hårtab, vesikulobulløst udslæt, solskoldning.
Særlige sanser - smagsændringer, øjenirritation, smagstab, tinnitus.
Urogenital - hæmaturi, urinvejsinfektioner, metrorragi, dysuri, vandladningsfrekvens, nocturi, penisinfektion, proteinuri, vaginal smerte.
Granulat til oral suspension (flere doser)
kliniske forsøg med multiple doser af cefpodoxim proxetil granulat til oral suspension blev 2128 pædiatriske patienter (hvoraf 93 % var under 12 år) behandlet med de anbefalede doser af cefpodoxim (10 mg/kg/dag Q 24 timer eller opdelt Q 12 timer til en maksimal ækvivalent voksendosis). Der var ingen dødsfald eller permanente handicap hos nogen af patienterne i disse undersøgelser. Fireogtyve patienter (1,1 %) ophørte med at tage medicinen på grund af bivirkninger, der menes muligvis eller sandsynligvis relateret til undersøgelseslægemidlet. Primært var disse seponeringer på grund af mave-tarmforstyrrelser, normalt diarré, opkastning eller udslæt.
Bivirkninger, der menes muligvis eller sandsynligvis relateret til eller af ukendt sammenhæng med cefpodoxim proxetil til oral suspension i kliniske forsøg med flere doser (N=2128 patienter behandlet med cefpodoxim) var:
Incidens større end 1 %
Diarré 6,0 % Forekomsten af diarré hos spædbørn og småbørn (i alderen 1 måned til 2 år) var 12,8 %. Bleudslæt/svampeudslæt 2,0 % (inklusive moniliasis) Forekomsten af bleudslæt hos spædbørn og småbørn var 8,5 %. Andre hududslæt 1,8 % Opkastning 2,3 %
Incidens mindre end 1 %
Legeme: Lokaliserede mavesmerter, mavekramper, hovedpine, monilia, generaliserede mavesmerter, asteni, feber, svampeinfektion.
Fordøjelse: Kvalme, monilia, anoreksi, mundtørhed, stomatitis, pseudomembranøs colitis.
Hemisk og lymfatisk: Trombocytæmi, positiv direkte Coombs' test, eosinofili, leukocytose, leukopeni, forlænget partiel tromboplastintid, trombocytopenisk purpura.
Metabolisk og ernæringsmæssig: Øget SGPT.
Muskuloskelet: Myalgi.
Nervøs: Hallucinationer, hyperkinesi, nervøsitet, somnolens.
Åndedræt: Epistaxis, rhinitis.

Hud: Hudmoniliasis, nældefeber, svampeeksem, acne, eksfoliativ dermatitis, makulopapulært udslæt.
Særlige sanser: Smag perversion.
Filmovertrukne tabletter (enkeltdosis)
I kliniske forsøg med en enkelt dosis af cefpodoxim proxetil filmovertrukne tabletter blev 509 patienter behandlet med den anbefalede dosis af cefpodoxim (200 mg). Der var ingen dødsfald eller permanente handicap, der menes at være relateret til lægemiddeltoksicitet i disse undersøgelser.
Bivirkninger, der menes muligvis eller sandsynligvis relateret til cefpodoxim i kliniske enkeltdosisforsøg udført i USA, var:
Incidens større end 1 %
Kvalme 1,4 % Diarré 1,2 %
Incidens mindre end 1 %
Centralnervesystemet: Svimmelhed, hovedpine, synkope. Dermatologisk: Udslæt. Genital: Vaginitis. Gastrointestinale: Mavesmerter. Psykiatrisk: Angst.
Laboratorieændringer
Væsentlige laboratorieændringer, der er blevet rapporteret hos voksne og pædiatriske patienter i kliniske forsøg med cefpodoximproxetil, uden hensyntagen til lægemiddelforhold, var:
Hepatisk: Forbigående stigninger i AST (SGOT), ALT (SGPT), GGT, alkalisk fosfatase, bilirubin og LDH.
Hæmatologisk: Eosinofili, leukocytose, lymfocytose, granulocytose, basofili, monocytose, trombocytose, nedsat hæmoglobin, nedsat hæmatokrit, leukopeni, neutropeni, lymfocytopeni, trombocytopeni, trombocytæmi, positiv Coombs' test og forlænget PT og PTT.
Serumkemi: Hyperglykæmi, hypoglykæmi, hypoalbuminæmi, hypoproteinæmi, hyperkaliæmi og hyponatriæmi.
Nyre: Stigning i BUN og kreatinin.
De fleste af disse abnormiteter var forbigående og ikke klinisk signifikante.
Post Marketing Erfaring
Følgende alvorlige bivirkninger er blevet rapporteret: allergiske reaktioner, herunder Stevens-Johnsons syndrom, toksisk epidermal nekrolyse, erythema multiforme og serumsygelignende reaktioner, pseudomembranøs colitis, blodig diarré med mavesmerter, colitis ulcerosa, rektorragi med hypotension, anafy leverskade, in utero eksponering med abort, purpurisk nefritis, lungeinfiltrat med eosinofili og øjenlågsdermatitis.
Ét dødsfald blev tilskrevet pseudomembranøs colitis og dissemineret intravaskulær koagulation.
Cephalosporin Klassemærkning
Ud over de ovennævnte bivirkninger, som er blevet observeret hos patienter behandlet med cefpodoximproxetil, er følgende bivirkninger og ændrede laboratorietest blevet rapporteret for antibiotika i cephalosporinklassen:
Bivirkninger og unormale laboratorietests: Renal dysfunktion, toksisk nefropati, leverdysfunktion inklusive kolestase, aplastisk anæmi, hæmolytisk anæmi, serumsygelignende reaktion, blødning, agranulocytose og pancytopeni.
Adskillige cephalosporiner har været impliceret i at udløse anfald, især hos patienter med nedsat nyrefunktion, når dosis ikke blev reduceret. (Se DOSERING OG ADMINISTRATION og OVERDOSERING .) Hvis der opstår anfald i forbindelse med lægemiddelbehandling, bør lægemidlet seponeres. Antikonvulsiv behandling kan gives, hvis det er klinisk indiceret.
DRUGSINTERAKTIONER
Antacida
Samtidig administration af høje doser af antacida (natriumbicarbonat og aluminiumhydroxid) eller H2-blokkere reducerer maksimale plasmaniveauer med henholdsvis 24 % til 42 % og absorptionsgraden med 27 % til 32 %. Absorptionshastigheden ændres ikke af disse samtidige medikamenter. Orale anti-cholinergika (f.eks. propanthelin) forsinker maksimale plasmaniveauer (47 % stigning i Tmax), men påvirker ikke omfanget af absorption (AUC).
Probenecid
Som med andre beta-lactam-antibiotika blev den renale udskillelse af cefpodoxim hæmmet af probenecid og resulterede i en stigning på ca. 31 % i AUC og en stigning på 20 % i maksimale cefpodoxim-plasmaniveauer.
Nefrotoksiske lægemidler
Selvom nefrotoksicitet ikke er blevet observeret, når cefpodoximproxetil blev givet alene, tilrådes nøje monitorering af nyrefunktionen, når cefpodoximproxetil administreres samtidig med forbindelser med kendt nefrotoksisk potentiale.
Interaktioner med lægemiddel/laboratorietest
Cephalosporiner, herunder cefpodoxim proxetil, vides lejlighedsvis at inducere en positiv direkte Coombs' test.
ADVARSLER
FØR BEHANDLING MED CEFPODOXIM PROXETIL INDSTILLES, SKAL DER FORETAGES OMhyggelig undersøgelse for at afgøre, OM PATIENTEN HAR HAVET TIDLIGERE OVERfølsomhedsreaktioner på CEFPODOXIM, ANDRE CEFALOSPORINER, PORICINER. HVIS CEFPODOXIM SKAL ADMINISTRERES TIL PENICILLIN-SENSITIVE PATIENTER, BØR UDØVES FORSIGTIGHED, FORDI KRYDSOVERfølsomhed BLANDT BETA-LACTAM ANTIBIOTIKA HAR VÆRET KLART DOKUMENTET OG KAN FOREKOMME I 10 % AF TIDER. HVIS EN ALLERGISK REAKTION OVER FOR CEFPODOXIME PROXETIL OPtræder, SKAL DU AFBINDE MED MEDICINEN. ALVORLIGE AKUTTE OVERfølsomhedsreaktioner KAN KRÆVE BEHANDLING MED EPINEFRIN OG ANDRE NØDFORANSTALTNINGER, HERUNDER ILT, INTRAVENØSE VÆSKER, INTRAVENØS ANTIHISTAMIN OG LUFTVEJSBEHANDLING, SOM KLINDISK.
Clostridium difficile associeret diarré (CDAD) er blevet rapporteret ved brug af næsten alle antibakterielle midler, inklusive VANTIN, og kan variere i sværhedsgrad fra mild diarré til fatal colitis. Behandling med antibakterielle midler ændrer den normale flora i tyktarmen, hvilket fører til overvækst af C. difficile.
C. difficile producerer toksinerne A og B, som bidrager til udviklingen af CDAD. Hypertoksinproducerende stammer af C. difficile forårsager øget morbiditet og dødelighed, da disse infektioner kan være modstandsdygtige over for antimikrobiel behandling og kan kræve kolektomi. CDAD skal overvejes hos alle patienter, der får diarré efter brug af antibiotika. Omhyggelig sygehistorie er nødvendig, da CDAD er blevet rapporteret at forekomme over to måneder efter administration af antibakterielle midler.
Hvis CDAD er mistænkt eller bekræftet, kan det være nødvendigt at afbryde igangværende antibiotikabrug, der ikke er rettet mod C. difficile. Passende væske- og elektrolytbehandling, proteintilskud, antibiotikabehandling af C. difficile og kirurgisk evaluering bør iværksættes som klinisk indiceret.
En fælles indsats for at monitorere for C. difficile hos cefpodoxim-behandlede patienter med diarré blev iværksat på grund af en øget forekomst af diarré forbundet med C. difficile i tidlige forsøg hos normale forsøgspersoner. C. difficile organismer eller toksin blev rapporteret hos 10 % af de cefpodoxim-behandlede voksne patienter med diarré; dog blev der ikke stillet nogen specifik diagnose af pseudomembranøs colitis hos disse patienter.
Efter markedsføring uden for USA er der modtaget rapporter om pseudomembranøs colitis forbundet med brugen af cefpodoximproxetil.
FORHOLDSREGLER
Generel
Hos patienter med forbigående eller vedvarende reduktion i urinproduktion på grund af nyreinsufficiens, bør den samlede daglige dosis af cefpodoximproxetil reduceres, fordi høje og forlængede serumantibiotikakoncentrationer kan forekomme hos sådanne personer efter sædvanlige doser. Cefpodoxim bør ligesom andre cephalosporiner administreres med forsigtighed til patienter, der samtidig får behandling med potente diuretika. (Se DOSERING OG ADMINISTRATION .)
Som med andre antibiotika kan langvarig brug af cefpodoximproxetil resultere i overvækst af ikke-følsomme organismer. Gentagen evaluering af patientens tilstand er afgørende. Hvis der opstår superinfektion under behandlingen, skal der træffes passende foranstaltninger.
Udskrivning af VANTIN i fravær af en påvist eller stærkt mistænkt bakteriel infektion eller en profylaktisk indikation er usandsynligt, at gavn for patienten og øger risikoen for udvikling af lægemiddelresistente bakterier.
Karcinogenese, mutagenese, svækkelse af fertilitet
Der er ikke udført langtidskarcinogeneseundersøgelser af cefpodoximproxetil hos dyr. Mutageneseundersøgelser af cefpodoxim, inklusive Ames-testen både med og uden metabolisk aktivering, kromosomaberrationstesten, det ikke-planlagte DNA-synteseassay, mitotisk rekombination og genkonvertering, det fremadrettede genmutationsassay og in vivo mikronukleustesten, var alle negative. Der blev ikke observeret nogen uønskede virkninger på fertilitet eller reproduktion, når 100 mg/kg/dag eller mindre (2 gange den humane dosis baseret på mg/m²) blev administreret oralt til rotter.
Graviditet
Teratogene virkninger
Cefpodoxim proxetil var hverken teratogent eller embryocid, når det blev givet til rotter under organogenese i doser op til 100 mg/kg/dag (2 gange den humane dosis baseret på mg/m²) eller til kaniner i doser op til 30 mg/kg/dag (1 -2 gange den humane dosis baseret på mg/m²).
Der er dog ingen tilstrækkelige og velkontrollerede undersøgelser af brugen af cefpodoximproxetil hos gravide kvinder. Da reproduktionsstudier på dyr ikke altid forudsiger human respons, bør dette lægemiddel kun anvendes under graviditet, hvis det er klart nødvendigt.
Arbejde og levering
Cefpodoxim proxetil er ikke blevet undersøgt til brug under veer og fødsel. Behandling bør kun gives, hvis det er klart nødvendigt.
Ammende mødre
Cefpodoxim udskilles i modermælk. I et studie med 3 ammende kvinder var niveauerne af cefpodoxim i modermælk 0 %, 2 % og 6 % af samtidige serumniveauer 4 timer efter en 200 mg oral dosis af cefpodoximproxetil. 6 timer efter dosering var niveauerne 0 %, 9 % og 16 % af samtidige serumniveauer. På grund af risikoen for alvorlige reaktioner hos ammende spædbørn bør der tages en beslutning om, hvorvidt amningen skal afbrydes eller lægemidlet skal seponeres, under hensyntagen til lægemidlets betydning for moderen.
Pædiatrisk brug
Sikkerhed og effekt hos spædbørn under 2 måneder er ikke blevet fastslået.
Geriatrisk brug
Af de 3338 patienter i kliniske studier med flere doser af cefpodoxim proxetil filmovertrukne tabletter var 521 (16%) 65 og derover, mens 214 (6%) var 75 og derover. Der blev ikke observeret nogen overordnede forskelle i effektivitet eller sikkerhed mellem ældre og yngre patienter. Hos raske geriatriske personer med normal nyrefunktion var cefpodoxims halveringstid i plasma i gennemsnit 4,2 timer, og uringenopretningen var i gennemsnit 21 % efter en dosis på 400 mg blev givet hver 12. time i 15 dage. Andre farmakokinetiske parametre var uændrede i forhold til dem, der blev observeret hos raske yngre forsøgspersoner.
Dosisjustering hos ældre patienter med normal nyrefunktion er ikke nødvendig.
OVERDOSIS
I akutte gnavertoksicitetsundersøgelser gav en enkelt oral dosis på 5 g/kg ingen bivirkninger.
I tilfælde af alvorlig toksisk reaktion fra overdosering kan hæmodialyse eller peritonealdialyse hjælpe med at fjerne cefpodoxim fra kroppen, især hvis nyrefunktionen er kompromitteret.
De toksiske symptomer efter en overdosis af beta-lactam-antibiotika kan omfatte kvalme, opkastning, epigastrisk nød og diarré.
KONTRAINDIKATIONER
Cefpodoxim proxetil er kontraindiceret hos patienter med kendt allergi over for cefpodoxim eller over for cephalosporingruppen af antibiotika.
KLINISK FARMAKOLOGI
Absorption og udskillelse
Cefpodoxim proxetil er et prodrug, der absorberes fra mave-tarmkanalen og deesterificeres til dets aktive metabolit, cefpodoxim. Efter oral administration af 100 mg cefpodoxim proxetil til fastende forsøgspersoner blev ca. 50 % af den administrerede cefpodoximdosis absorberet systemisk. Over det anbefalede dosisområde (100 til 400 mg) blev ca. 29 til 33 % af den administrerede cefpodoximdosis udskilt uændret i urinen i løbet af 12 timer. Der er minimal metabolisme af cefpodoxim in vivo.
Effekter af mad
Absorptionsgraden (gennemsnitlig AUC) og den gennemsnitlige maksimale plasmakoncentration steg, når filmovertrukne tabletter blev administreret sammen med mad. Efter en 200 mg tabletdosis taget sammen med mad var AUC 21 til 33 % højere end under fastende forhold, og den maksimale plasmakoncentration var i gennemsnit 3,1 mcg/mL hos fodrede forsøgspersoner mod 2,6 mcg/mL hos fastende forsøgspersoner. Tid til maksimal koncentration var ikke signifikant forskellig mellem fodrede og fastende forsøgspersoner.
Når en dosis på 200 mg af suspensionen blev taget sammen med mad, var absorptionsgraden (gennemsnitlig AUC) og den gennemsnitlige maksimale plasmakoncentration hos fodrede forsøgspersoner ikke signifikant forskellige fra fastende forsøgspersoner, men absorptionshastigheden var langsommere med mad (48 % stigning i Tmax).
Farmakokinetik af Cefpodoxim Proxetil filmovertrukne tabletter
Over det anbefalede dosisområde (100 til 400 mg) udviste hastigheden og omfanget af cefpodoxim-absorption dosisafhængighed; dosisnormaliseret Cmax og AUC faldt med op til 32 % med stigende dosis. Over det anbefalede doseringsområde var Tmax ca. 2 til 3 timer, og T½ varierede fra 2,09 til 2,84 timer. Gennemsnitlig Cmax var 1,4 mcg/ml for 100 mg dosis, 2,3 mcg/ml for 200 mg dosis og 3,9 mcg/ml for 400 mg dosis. Hos patienter med normal nyrefunktion blev der hverken observeret akkumulering eller signifikante ændringer i andre farmakokinetiske parametre efter multiple orale doser på op til 400 mg Q 12 timer.
CEFPODOXIM PLASMA-NIVEAUER (mcg/mL) I FASTE VOKSNE EFTER ADMINISTRATION AF FILMOVERTRAKTET TABLET (Enkeltdosis)
Farmakokinetik af Cefpodoxim Proxetil Suspension
Hos voksne forsøgspersoner gav en dosis på 100 mg oral suspension en gennemsnitlig maksimal cefpodoximkoncentration på ca. 1,5 mcg/ml (interval: 1,1 til 2,1 mcg/ml), hvilket svarer til det, der er rapporteret efter administration af 100 mg tabletten. Tid til maksimal plasmakoncentration og areal under plasmakoncentration-tid-kurven (AUC) for den orale suspension svarede også til dem, der blev fremstillet med filmovertrukne tabletter til voksne efter en 100 mg oral dosis.
Farmakokinetikken af cefpodoxim blev undersøgt hos 29 patienter i alderen 1 til 17 år. Hver patient fik en enkelt, oral, 5 mg/kg dosis cefpodoxim oral suspension. Plasma- og urinprøver blev opsamlet i 12 timer efter dosering. Plasmaniveauerne rapporteret fra denne undersøgelse er som følger:
CEFPODOXIM PLASMA-NIVEAUER (mcg/mL) HOS FASTE PATIENTER (1 til 17 ÅRS ALDER) EFTER SUSPENSIONSADMINISTRATION
Fordeling
Proteinbinding af cefpodoxim varierer fra 22 til 33 % i serum og fra 21 til 29 % i plasma.
Hudblister
Efter administration af flere doser hver 12. time i 5 dage af 200 mg eller 400 mg cefpodoximproxetil var den gennemsnitlige maksimale cefpodoximkoncentration i hudblistervæske i gennemsnit henholdsvis 1,6 og 2,8 mcg/ml. Hudblistervæskeniveauerne af cefpodoxim 12 timer efter dosering var i gennemsnit 0,2 og 0,4 mcg/ml for henholdsvis 200 mg og 400 mg multiple dosisregimerne.
Tonsilvæv
Efter en enkelt oral 100 mg cefpodoxim proxetil filmovertrukket tablet var den gennemsnitlige maksimale cefpodoximkoncentration i tonsilvæv i gennemsnit 0,24 mcg/g 4 timer efter dosering og 0,09 mcg/g 7 timer efter dosering. Ligevægt blev opnået mellem plasma og tonsilvæv inden for 4 timer efter dosering. Ingen påvisning af cefpodoxim i tonsillarvæv blev rapporteret 12 timer efter dosering. Disse resultater viste, at koncentrationer af cefpodoxim oversteg MIC90 for S. pyogenes i mindst 7 timer efter dosering af 100 mg cefpodoxim proxetil.
Lungevæv
Efter en enkelt oral 200 mg cefpodoxim proxetil filmovertrukken tablet var den gennemsnitlige maksimale cefpodoximkoncentration i lungevævet i gennemsnit 0,63 mcg/g 3 timer efter dosering, 0,52 mcg/g 6 timer efter dosering og 0,19 mcg/g 12 timer efter dosering. Resultaterne af denne undersøgelse indikerede, at cefpodoxim trængte ind i lungevæv og producerede vedvarende lægemiddelkoncentrationer i mindst 12 timer efter dosering ved niveauer, der oversteg MIC90 for S. pneumoniae og H. influenzae.
CSF
Der er ikke tilstrækkelige data om CSF-niveauer af cefpodoxim.
Virkninger af nedsat nyrefunktion
Elimination af cefpodoxim er reduceret hos patienter med moderat til svær nyreinsufficiens ( FORHOLDSREGLER og DOSERING OG ADMINISTRATION .) Hos personer med let nedsat nyrefunktion (50 til 80 ml/min kreatininclearance) var den gennemsnitlige plasmahalveringstid for cefpodoxim 3,5 timer. Hos personer med moderat (30 til 49 ml/min kreatininclearance) eller svært nedsat nyrefunktion (5 til 29 ml/min kreatininclearance) øgedes halveringstiden til henholdsvis 5,9 og 9,8 timer. Ca. 23 % af den administrerede dosis blev fjernet fra kroppen under en standard 3-timers hæmodialyseprocedure.
Virkning af nedsat leverfunktion (cirrose)
Absorptionen var noget formindsket og eliminationen uændret hos patienter med cirrhose. Den gennemsnitlige cefpodoxim T½ og renal clearance hos cirrosepatienter svarede til dem, der blev udledt i undersøgelser af raske forsøgspersoner. Ascites så ikke ud til at påvirke værdierne hos cirrotiske personer. Ingen dosisjustering anbefales til denne patientpopulation.
Farmakokinetik hos ældre forsøgspersoner
Ældre forsøgspersoner behøver ikke dosisjusteringer, medmindre de har nedsat nyrefunktion. (Se FORHOLDSREGLER .) Hos raske geriatriske forsøgspersoner var cefpodoxims halveringstid i plasma i gennemsnit 4,2 timer (mod 3,3 hos yngre forsøgspersoner), og uringenvinding var i gennemsnit 21 % efter en dosis på 400 mg blev administreret hver 12. time. Andre farmakokinetiske parametre (Cmax, AUC og Tmax) var uændrede i forhold til dem, der blev observeret hos raske unge forsøgspersoner.
Mikrobiologi
Handlingsmekanisme
Cefpodoxim er et bakteriedræbende middel, der virker ved at hæmme bakteriel cellevægsyntese. Cefpodoxim har aktivitet i nærvær af nogle beta-lactamaser, både penicillinaser og cephalosporinaser, af gramnegative og grampositive bakterier.
Modstandsmekanisme
Resistens over for Cefpodoxim er primært gennem hydrolyse af beta-lactamase, ændring af penicillin-bindende proteiner (PBP'er) og nedsat permeabilitet.
Cefpodoxim har vist sig at være aktiv mod de fleste isolater af følgende bakterier, både in vitro og ved kliniske infektioner som beskrevet i afsnittet Indikationer og anvendelse (1):
Gram-positive bakterier
Staphylococcus aureus (methicillin-følsomme stammer, inklusive dem, der producerer penicillinaser) Staphylococcus saprophyticus Streptococcus pneumoniae (undtagen penicillin-resistente isolater) Streptococcus pyogenes
Gram-negative bakterier
Escherichia coli Klebsiella pneumoniae Proteus mirabilis Haemophilus influenzae (herunder beta-lactamase-producerende isolater) Moraxella catarrhalis Neisseria gonorrhoeae (herunder penicillinase-producerende isolater)
Følgende in vitro-data er tilgængelige, men deres kliniske betydning er ukendt. Mindst 90 procent af følgende mikroorganismer udviser en in vitro minimal hæmmende koncentration (MIC) mindre end eller lig med det følsomme brudpunkt for Cefpodoxim. Effekten af Cefpodoxim til behandling af kliniske infektioner forårsaget af disse mikroorganismer er imidlertid ikke blevet fastslået i tilstrækkelige og velkontrollerede kliniske forsøg.
Gram-positive bakterier
Streptococcus agalactiae Streptococcus spp. (Grupper C, F, G)
Gram-negative bakterier
Citrobacter diversus Klebsiella oxytoca Proteus vulgaris Providencia rettgeri Haemophilus parainfluenzae
Anaerobe grampositive bakterier
Peptostreptokokker magnus
Modtagelighedstestmetoder
Når det er tilgængeligt, skal det kliniske mikrobiologiske laboratorium fremlægge resultaterne af in vitro-følsomhedstestresultater for antimikrobielle lægemidler, der anvendes på hjemmehørende hospitaler, til lægen som periodiske rapporter, der beskriver modtagelighedsprofilen for nosokomiale og samfundserhvervede patogener. Disse rapporter skal hjælpe lægen med at vælge et antibakterielt lægemiddel til behandling.
Fortyndingsteknikker
Kvantitative metoder bruges til at bestemme antimikrobielle minimale hæmmende koncentrationer (MIC'er). Disse MIC'er giver estimater af bakteriers modtagelighed over for antimikrobielle forbindelser. MIC'erne bør bestemmes ved hjælp af en standardiseret testmetode. MIC-værdierne skal fortolkes i henhold til kriterierne i tabel 1.
Diffusionsteknikker
Kvantitative metoder, der kræver måling af zonediametre, giver også reproducerbare estimater af bakteriers modtagelighed over for antimikrobielle forbindelser. Zonestørrelsen giver et skøn over bakteriers modtagelighed over for antimikrobielle forbindelser. Zonestørrelsen bør bestemmes ved hjælp af en standardiseret testmetode. Denne procedure bruger papirskiver imprægneret med 10 mcg Cefpodoxim til at teste mikroorganismers modtagelighed for Cefpodoxim. Diskdiffusionsfortolkningskriterierne er angivet i tabel 1.
En rapport om modtagelig indikerer, at det antimikrobielle middel sandsynligvis vil hæmme væksten af patogenet, hvis den antimikrobielle forbindelse når den koncentration på infektionsstedet, der er nødvendig for at hæmme væksten af patogenet. En rapport om Intermediate indikerer, at resultatet skal betragtes som tvetydigt, og hvis mikroorganismen ikke er fuldt modtagelig for alternative, klinisk mulige lægemidler, skal testen gentages. Denne kategori indebærer mulig klinisk anvendelighed på kropssteder, hvor lægemidlet er fysiologisk koncentreret, eller i situationer, hvor en høj dosis af lægemidlet kan anvendes. Denne kategori giver også en bufferzone, der forhindrer små ukontrollerede tekniske faktorer i at forårsage store uoverensstemmelser i fortolkningen. En rapport om resistent indikerer, at det antimikrobielle middel sandsynligvis ikke vil hæmme væksten af patogenet, hvis den antimikrobielle forbindelse når de koncentrationer, der normalt kan opnås på infektionsstedet; anden terapi bør vælges.
Kvalitetskontrol
Standardiserede følsomhedstestprocedurer kræver brug af laboratoriekontroller til at overvåge og sikre nøjagtigheden og præcisionen af forsyninger og reagenser, der anvendes i analysen, og teknikkerne for den person, der udfører testen1,2,3. Standard Cefpodoxim-pulver bør give følgende interval af MIC-værdier angivet i tabel 2. For diffusionsteknikken, der anvender 10 mcg-skiven, skal kriterierne i tabel 2 være opfyldt.
Kliniske forsøg
Blærebetændelse
I to dobbeltblindede, 2:1 randomiserede, sammenlignende forsøg udført med voksne i USA, blev cefpodoximproxetil sammenlignet med andre beta-lactam-antibiotika. I disse undersøgelser blev følgende bakterielle udryddelsesrater opnået 5 til 9 dage efter behandlingen:
disse undersøgelser var de kliniske helbredelsesrater og bakterielle udryddelsesrater for cefpodoximproxetil sammenlignelige med komparatormidlerne; dog var de kliniske helbredelsesrater og bakteriologiske udryddelsesrater lavere end dem, der blev observeret med nogle andre klasser af godkendte midler mod blærebetændelse.
Studier af akut mellemørebetændelse
I kontrollerede undersøgelser af akut mellemørebetændelse udført i USA, hvor der blev fundet betydelige mængder af betalactamase-producerende organismer, blev cefpodoxim proxetil sammenlignet med cefixim. I disse undersøgelser, ved brug af meget strenge evaluerbarhedskriterier og mikrobiologiske og kliniske responskriterier ved 4 til 21 dages postterapiopfølgning, blev følgende formodede bakterielle udryddelse/kliniske succesresultater (helbredt og forbedret).
REFERENCER
1. Clinical and Laboratory Standards Institute (CLSI). Metoder til fortynding Antimikrobielle følsomhedstests for bakterier, der vokser aerobt; Godkendt standard - niende udgave. CLSI-dokument M07-A9, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2012.
2. Clinical and Laboratory Standards Institute (CLSI). Ydeevnestandarder for antimikrobiel følsomhedstestning; Treogtyvende informationstillæg, CLSI-dokument M100-S23. CLSI-dokument M100-S23, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2013.
3. Clinical and Laboratory Standards Institute (CLSI). Ydeevnestandarder for antimikrobielle diskdiffusionsfølsomhedstests; Godkendt standard - ellevte udgave CLSI-dokument M02-A11, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2012.
PATIENTOPLYSNINGER
Patienter bør rådgives om, at antibakterielle lægemidler inklusive VANTIN kun bør anvendes til behandling af bakterielle infektioner. De behandler ikke virusinfektioner (f.eks. forkølelse). Når VANTIN ordineres til behandling af en bakteriel infektion, skal patienterne fortælles, at selvom det er almindeligt at føle sig bedre tidligt i behandlingsforløbet, skal medicinen tages nøjagtigt som anvist. At springe doser over eller ikke fuldføre hele behandlingsforløbet kan (1) mindske effektiviteten af den øjeblikkelige behandling og (2) øge sandsynligheden for, at bakterier udvikler resistens og ikke vil kunne behandles med VANTIN eller andre antibakterielle lægemidler i fremtiden.
Diarré er et almindeligt problem forårsaget af antibiotika, som normalt ophører, når antibiotikaen seponeres. Nogle gange kan patienter efter start af behandling med antibiotika udvikle vandig og blodig afføring (med eller uden mavekramper og feber) selv så sent som to eller flere måneder efter at have taget den sidste dosis af antibiotika. Hvis dette sker, skal patienter kontakte deres læge hurtigst muligt.
