Levaquin 250mg, 500mg, 750mg Levofloxacin Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Levaquin 750mg, og hvordan bruges det?
Levaquin er en receptpligtig medicin, der bruges til at behandle symptomerne på forskellige bakterielle infektioner. Levaquin kan bruges alene eller sammen med anden medicin.
Levaquin 500mg tilhører en klasse af lægemidler kaldet Fluoroquinoloner.
Det vides ikke, om Levaquin er sikkert og effektivt til børn i behandlingsvarighed over 14 dage.
Hvad er de mulige bivirkninger af Levaquin 500mg?
Levaquin 750mg kan forårsage alvorlige bivirkninger, herunder:
- hovedpine,
- sult,
- svedeture,
- irritabilitet,
- svimmelhed,
- kvalme,
- hurtig puls,
- føler sig angst eller rystende,
- følelsesløshed eller prikken i dine hænder, arme, ben eller fødder,
- svaghed i dine arme, hænder, ben eller fødder,
- brændende smerte i dine arme, hænder, ben eller fødder,
- alvorlige humør- eller adfærdsændringer,
- nervøsitet,
- forvirring,
- agitation,
- paranoia,
- hallucinationer,
- hukommelsesproblemer,
- koncentrationsbesvær,
- tanker om selvmord,
- seneruptur,
- pludselig smerte,
- hævelse,
- blå mærker,
- ømhed,
- stivhed,
- bevægelsesproblemer,
- en snappende eller knaldende lyd i nogen af dine led,
- stærke mavesmerter,
- diarré, der er vandig eller blodig,
- flagrende i dit bryst,
- stakåndet,
- udslæt,
- vejrtrækningsproblemer,
- kramper (kramper),
- svær hovedpine,
- synsproblemer,
- smerte bag dine øjne,
- smerter i øvre mave,
- mistet appetiten,
- mørk urin,
- lerfarvede afføring, og
- gulfarvning af huden eller øjnene (gulsot)
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Levaquin 250mg omfatter:
- kvalme,
- forstoppelse,
- diarré,
- hovedpine,
- svimmelhed, og
- problemer med at sove
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Levaquin. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
ALVORLIGE BIVIRKNINGER HERUNDER TENDINIT, SENERUPTUR, PERIFER NEUROPATI, CENTRALE NERVESYSTEMETS VIRKNINGER OG FORÆRRING AF MYASTHENIA GRAVIS
- Fluoroquinoloner, inklusive LEVAQUIN®, er blevet forbundet med invaliderende og potentielt irreversible alvorlige bivirkninger, der er opstået sammen [se ADVARSLER OG FORHOLDSREGLER], herunder:
- Tendinitis og seneruptur [se ADVARSLER OG FORHOLDSREGLER]
- Perifer neuropati [se ADVARSLER OG FORHOLDSREGLER]
- Virkninger på centralnervesystemet [se ADVARSLER OG FORHOLDSREGLER]
Afbryd straks LEVAQUIN® og undgå brugen af fluoroquinoloner, inklusive LEVAQUIN®, hos patienter, som oplever nogen af disse alvorlige bivirkninger [se ADVARSLER OG FORHOLDSREGLER]
- Fluoroquinoloner, inklusive LEVAQUIN®, kan forværre muskelsvaghed hos patienter med myasthenia gravis. Undgå LEVAQUIN® hos patienter med en kendt anamnese med myasthenia gravis [se ADVARSLER OG FORHOLDSREGLER ].
- Fordi fluoroquinoloner, inklusive LEVAQUIN®, er blevet forbundet med alvorlige bivirkninger [se ADVARSLER OG FORHOLDSREGLER ], reserver LEVAQUIN® til brug hos patienter, der ikke har alternative behandlingsmuligheder for følgende indikationer:
- Ukompliceret urinvejsinfektion [se INDIKATIONER ]
- Akut bakteriel eksacerbation af kronisk bronkitis [se INDIKATIONER ]
- Akut bakteriel bihulebetændelse [se INDIKATIONER ].
BESKRIVELSE
LEVAQUIN® tabletter er syntetiske antibakterielle midler til oral administration. Kemisk set er levofloxacin, en chiral fluoreret carboxyquinolon, den rene (-)-(S)-enantiomer af det racemiske lægemiddelstof ofloxacin. Det kemiske navn er (-)-(S)-9-fluor-2,3-dihydro-3-methyl-10-(4-methyl-1-piperazinyl)-7-oxo-7H-pyrido[1,2, 3-de]-1,4-benzoxazin-6-carboxylsyrehemihydrat.
Figur 1: Den kemiske struktur af Levofloxacin
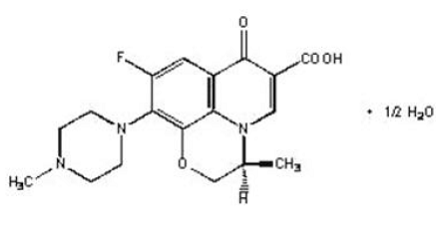
Den empiriske formel er C18H20FN3O4 · ½ H2O og molekylvægten er 370,38. Levofloxacin er et lys gulligt-hvidt til gul-hvidt krystal eller krystallinsk pulver. Molekylet eksisterer som en zwitterion ved pH-forholdene i tyndtarmen.
Dataene viser, at fra pH 0,6 til 5,8 er opløseligheden af levofloxacin i det væsentlige konstant (ca. 100 mg/ml). Levofloxacin anses for at være opløseligt til frit opløseligt i dette pH-område, som defineret af USP-nomenklaturen. Over pH 5,8 stiger opløseligheden hurtigt til sit maksimum ved pH 6,7 (272 mg/ml) og anses for frit opløselig i dette område. Over pH 6,7 falder opløseligheden og når en minimumsværdi (ca. 50 mg/ml) ved en pH på ca. 6,9.
Levofloxacin har potentialet til at danne stabile koordinationsforbindelser med mange metalioner. Dette in vitro cheleringspotentiale har følgende dannelsesrækkefølge: Al+3>Cu+2>Zn+2>Mg+2>Ca+2.
LEVAQUIN® tabletter fås som filmovertrukne tabletter og indeholder følgende inaktive ingredienser:
- 250 mg (som udtrykt i vandfri form): crospovidon, hypromellose, magnesiumstearat, mikrokrystallinsk cellulose, polyethylenglycol, polysorbat 80, syntetisk rødt jernoxid og titaniumdioxid.
- 500 mg (som udtrykt i vandfri form): crospovidon, hypromellose, magnesiumstearat, mikrokrystallinsk cellulose, polyethylenglycol, polysorbat 80, syntetiske røde og gule jernoxider og titaniumdioxid.
- 750 mg (som udtrykt i vandfri form): crospovidon, hypromellose, magnesiumstearat, mikrokrystallinsk cellulose, polyethylenglycol, polysorbat 80, titaniumdioxid.
INDIKATIONER
Nosokomiel lungebetændelse
LEVAQUIN® er indiceret til voksne patienter til behandling af nosokomiel lungebetændelse på grund af methicillin-følsomme Staphylococcus aureus, Pseudomonas aeruginosa, Serratia marcescens, Escherichia coli, Klebsiella pneumoniae, Haemophilus influenzae eller Streptococcus pneumoniae. Tillægsbehandling bør anvendes som klinisk indiceret. Hvor Pseudomonas aeruginosa er et dokumenteret eller formodet patogen, anbefales kombinationsbehandling med en anti-pseudomonal β-lactam [se Kliniske Studier ].
Samfundserhvervet lungebetændelse
7 til 14 dages behandlingsregime
LEVAQUIN® er indiceret til voksne patienter til behandling af samfundserhvervet lungebetændelse på grund af methicillin-følsomme Staphylococcus aureus, Streptococcus pneumoniae (inklusive multi-resistente Streptococcus pneumoniae [MDRSP]), Haemophilus influenza Morenzae, Haemophilus influenzae, parafluenzae, Haemophilus influenza. , Chlamydophila pneumoniae, Legionella pneumophila eller Mycoplasma pneumoniae [se DOSERING OG ADMINISTRATION og Kliniske Studier ].
MDRSP-isolater er isolater, der er resistente over for to eller flere af følgende antibakterielle midler: penicillin (MIC ≥2 mcg/mL), 2. generations cephalosporiner, f.eks. cefuroxim, makrolider, tetracycliner og trimethoprim/sulfamethoxazol.
Samfundserhvervet lungebetændelse
5-dages behandlingsregime
LEVAQUIN® er indiceret til voksne patienter til behandling af samfundserhvervet lungebetændelse forårsaget af Streptococcus pneumoniae (eksklusive multi-drug-resistente isolater [MDRSP]), Haemophilus influenzae, Haemophilus parainfluenzae, Mycoplasma pneumyoniae, eller Chneumydophilsee DOSERING OG ADMINISTRATION og Kliniske Studier ].
Komplicerede hud- og hudstrukturinfektioner
LEVAQUIN® er indiceret til voksne patienter til behandling af komplicerede hud- og hudstrukturinfektioner på grund af methicillin-følsomme Staphylococcus aureus, Enterococcus faecalis, Streptococcus pyogenes eller Proteus mirabilis [se Kliniske Studier ].
Ukomplicerede hud- og hudstrukturinfektioner
LEVAQUIN® er indiceret til voksne patienter til behandling af ukomplicerede hud- og hudstrukturinfektioner (milde til moderate) inklusive bylder, cellulitis, furuncles, impetigo, pyoderma, sårinfektioner på grund af methicillin-modtagelige Staphylococcus aureus eller Streptococcus pyogenes.
Kronisk bakteriel prostatitis
LEVAQUIN® er indiceret til voksne patienter til behandling af kronisk bakteriel prostatitis forårsaget af Escherichia coli, Enterococcus faecalis eller methicillin-modtagelig Staphylococcus epidermidis [se Kliniske Studier ].
Inhalationsmiltbrand (efter eksponering)
LEVAQUIN® er indiceret til inhalationsmiltbrand (post-eksponering) for at reducere forekomsten eller progressionen af sygdom efter eksponering for aerosoliseret Bacillus anthracis hos voksne og pædiatriske patienter, 6 måneder og ældre [se DOSERING OG ADMINISTRATION ]. Effektiviteten af LEVAQUIN® er baseret på plasmakoncentrationer opnået hos mennesker, et surrogat-endepunkt, der med rimelighed kan forudsige kliniske fordele.
LEVAQUIN® er ikke blevet testet på mennesker til forebyggelse af post-eksponering af inhalationsmiltbrand. Sikkerheden af LEVAQUIN® hos voksne i behandlingsvarigheder ud over 28 dage eller hos pædiatriske patienter i behandlingsvarigheder ud over 14 dage er ikke blevet undersøgt. Langvarig LEVAQUIN®-behandling bør kun anvendes, når fordelen opvejer risikoen [se Kliniske Studier ].
Pest
LEVAQUIN® er indiceret til behandling af pest, herunder pneumonisk og septicemisk pest, på grund af Yersinia pestis (Y. pestis) og profylakse mod pest hos voksne og pædiatriske patienter, 6 måneder og ældre [se DOSERING OG ADMINISTRATION ].
Effektstudier af LEVAQUIN® kunne ikke udføres hos mennesker med pest af etiske og gennemførlighedsmæssige årsager. Derfor var godkendelsen af denne indikation baseret på en effektivitetsundersøgelse udført i dyr [se Kliniske Studier ].
Komplicerede urinvejsinfektioner
5-dages behandlingsregime
LEVAQUIN® er indiceret til voksne patienter til behandling af komplicerede urinvejsinfektioner forårsaget af Escherichia coli, Klebsiella pneumoniae eller Proteus mirabilis [se Kliniske Studier ].
Komplicerede urinvejsinfektioner
10-dages behandlingsregime
LEVAQUIN® er indiceret til voksne patienter til behandling af komplicerede urinvejsinfektioner (milde til moderate) på grund af Enterococcus faecalis, Enterobacter cloacae, Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis eller Pseudomonas aeruginosa [se Kliniske Studier ].
Akut Pyelonefritis
5 eller 10-dages behandlingsregime
LEVAQUIN® er indiceret til voksne patienter til behandling af akut pyelonefritis forårsaget af Escherichia coli, herunder tilfælde med samtidig bakteriæmi [se Kliniske Studier ].
Ukomplicerede urinvejsinfektioner
LEVAQUIN® er indiceret til voksne patienter til behandling af ukomplicerede urinvejsinfektioner (milde til moderate) på grund af Escherichia coli, Klebsiella pneumoniae eller Staphylococcus saprophyticus.
Fordi fluoroquinoloner, inklusive LEVAQUIN®, er blevet forbundet med alvorlige bivirkninger [se ADVARSLER OG FORHOLDSREGLER og for nogle patienter er ukompliceret urinvejsinfektion selvbegrænsende, reserver LEVAQUIN® til behandling af ukomplicerede urinvejsinfektioner hos patienter, der ikke har alternative behandlingsmuligheder.
Akut bakteriel eksacerbation af kronisk bronkitis
LEVAQUIN® er indiceret til voksne patienter til behandling af akut bakteriel eksacerbation af kronisk bronkitis (ABECB) på grund af methicillin-følsomme Staphylococcus aureus, Streptococcus pneumoniae, Haemophilus influenzae, Haemophilus parainfluenzae catarrhal eller Morisaxella.
Fordi fluoroquinoloner, inklusive LEVAQUIN®, er blevet forbundet med alvorlige bivirkninger [se ADVARSLER OG FORHOLDSREGLER ] og for nogle patienter er ABECB selvbegrænsende, reserver LEVAQUIN® til behandling af ABECB hos patienter, der ikke har alternative behandlingsmuligheder.
Akut bakteriel bihulebetændelse
5-dages og 10-14 dages behandlingsregimer
LEVAQUIN® er indiceret til voksne patienter til behandling af akut bakteriel bihulebetændelse (ABS) på grund af Streptococcus pneumoniae, Haemophilus influenzae eller Moraxella catarrhalis [se Kliniske Studier ].
Fordi fluoroquinoloner, inklusive LEVAQUIN®, er blevet forbundet med alvorlige bivirkninger [se ADVARSLER OG FORHOLDSREGLER og for nogle patienter er ABS selvbegrænsende, reserver LEVAQUIN® til behandling af ABS hos patienter, som ikke har alternative behandlingsmuligheder.
Brug
For at reducere udviklingen af lægemiddelresistente bakterier og bevare effektiviteten af LEVAQUIN® og andre antibakterielle lægemidler, bør LEVAQUIN® kun bruges til at behandle eller forebygge infektioner, der er bevist eller stærkt mistænkt for at være forårsaget af modtagelige bakterier. Når kultur- og modtagelighedsoplysninger er tilgængelige, bør de overvejes ved udvælgelse eller ændring af antibakteriel behandling. I mangel af sådanne data kan lokal epidemiologi og modtagelighedsmønstre bidrage til den empiriske udvælgelse af terapi.
Kultur og modtagelighedstest
Passende dyrknings- og modtagelighedstest bør udføres før behandling for at isolere og identificere organismer, der forårsager infektionen og for at bestemme deres modtagelighed for levofloxacin [se Mikrobiologi ]. Behandling med LEVAQUIN® kan påbegyndes, før resultaterne af disse tests er kendt; når resultaterne er tilgængelige, bør passende behandling vælges.
Som med andre lægemidler i denne klasse kan nogle isolater af Pseudomonas aeruginosa udvikle resistens ret hurtigt under behandling med LEVAQUIN®. Kultur- og modtagelighedstest, der udføres periodisk under behandlingen, vil give information om patogenernes fortsatte modtagelighed over for det antimikrobielle middel og også den mulige fremkomst af bakteriel resistens.
DOSERING OG ADMINISTRATION
Dosering af LEVAQUIN® tabletter til voksne patienter med kreatininclearance ≥ 50 ml/minut
Den sædvanlige dosis af LEVAQUIN® tabletter er 250 mg, 500 mg eller 750 mg indgivet oralt hver 24. time, som angivet ved infektion og beskrevet i tabel 1.
Disse anbefalinger gælder for patienter med kreatininclearance ≥ 50 ml/minut. For patienter med kreatininclearance mindre end 50 ml/min er justeringer af doseringsregimet påkrævet [se Dosisjustering hos voksne med nedsat nyrefunktion ].
Dosering af LEVAQUIN®-tabletter til pædiatriske patienter med inhalationsmiltbrand eller pest
Doseringen af LEVAQUIN® tabletter til inhalationsmiltbrand (post-eksponering) og pest hos pædiatriske patienter, der vejer 30 kg eller derover, er beskrevet nedenfor i tabel 2. LEVAQUIN® tabletter kan ikke administreres til patienter, der vejer mindre end 30 kg på grund af begrænsningerne af den tilgængelige styrke. Alternative formuleringer af levofloxacin kan overvejes til pædiatriske patienter, der vejer mindre end 30 kg.
Dosisjustering hos voksne med nedsat nyrefunktion
Administrer LEVAQUIN® med forsigtighed til patienter med nedsat nyrefunktion. Omhyggelig klinisk observation og passende laboratorieundersøgelser bør udføres før og under behandlingen, da eliminationen af levofloxacin kan være reduceret hos disse patienter.
Hos patienter med nedsat nyrefunktion (kreatininclearance mindre end 50 ml/min) er justering af dosisregimen nødvendig for at undgå akkumulering af levofloxacin på grund af nedsat clearance [se Brug i specifikke populationer ]. Ingen justering er nødvendig for patienter med en kreatininclearance større end eller lig med 50 ml/minut.
Tabel 3 viser, hvordan dosis justeres baseret på kreatininclearance.
Lægemiddelinteraktion med chelateringsmidler
Antacida, sucralfat, metalkationer, multivitaminer
LEVAQUIN® tabletter bør administreres mindst to timer før eller to timer efter antacida indeholdende magnesium, aluminium samt sucralfat, metalkationer såsom jern og multivitaminpræparater med zink eller didanosin tyggetabletter/buffrede tabletter eller det pædiatriske pulver til oral opløsning [se DRUGSINTERAKTIONER og PATIENTOPLYSNINGER ].
Administrationsinstruktioner
LEVAQUIN® tabletter kan indgives uden hensyntagen til mad.
Hydrering til patienter, der modtager LEVAQUIN®-tabletter
Tilstrækkelig hydrering af patienter, der får LEVAQUIN®, bør opretholdes for at forhindre dannelsen af højkoncentreret urin. Krystalluri og cylindruri er blevet rapporteret med quinoloner [se BIVIRKNINGER og PATIENTOPLYSNINGER ].
HVORDAN LEVERET
Doseringsformer og styrker
TABLETTER, filmovertrukne, kapselformede
- 250 mg terracotta pink tabletter, præget med "250" på den ene side og "LEVAQUIN" på den anden side
- 500 mg ferskentabletter, præget med "500" på den ene side og "LEVAQUIN" på den anden side
- 750 mg hvide tabletter, præget med "750" på den ene side og "LEVAQUIN" på den anden side
Opbevaring og håndtering
LEVAQUIN® tabletter leveres som 250, 500 og 750 mg kapselformede, overtrukne tabletter.
LEVAQUIN® tabletter er pakket i flasker i følgende konfigurationer:
- 250 mg tabletter er terra cotta pink og er præget: "LEVAQUIN®" på den ene side og "250" på den anden side
- flasker á 50 ( NDC 50458-920-50)
- 500 mg tabletter er ferskenfarvet og er præget: "LEVAQUIN®" på den ene side og "500" på den anden side
- flasker á 50 ( NDC 50458-925-50)
- 750 mg tabletter er hvide og er præget "LEVAQUIN®" på den ene side og "750" på den anden side
- flasker á 20 ( NDC 50458-930-20)
LEVAQUIN® tabletter skal opbevares ved 15° til 30°C (59° til 86°F) i godt lukkede beholdere.
Fremstillet af: Active Ingredient Made in Japan. Revideret: juli 2018
BIVIRKNINGER
Alvorlige og ellers vigtige bivirkninger
Følgende alvorlige og ellers vigtige bivirkninger diskuteres mere detaljeret i andre sektioner af mærkningen:
- Invaliderende og potentielt irreversible alvorlige bivirkninger [se ADVARSLER OG FORHOLDSREGLER ]
- Tendinitis og seneruptur [se ADVARSLER OG FORHOLDSREGLER ]
- Perifer neuropati [se ADVARSLER OG FORHOLDSREGLER ]
- Virkninger på centralnervesystemet [se ADVARSLER OG FORHOLDSREGLER ]
- Forværring af Myasthenia Gravis [se ADVARSLER OG FORHOLDSREGLER ]
- Andre alvorlige og nogle gange fatale reaktioner [se ADVARSLER OG FORHOLDSREGLER ]
- Overfølsomhedsreaktioner [se ADVARSLER OG FORHOLDSREGLER ]
- Hepatotoksicitet [se ADVARSLER OG FORHOLDSREGLER ]
- Clostridium difficile-associeret diarré [se ADVARSLER OG FORHOLDSREGLER ]
- Forlængelse af QT-intervallet [se ADVARSLER OG FORHOLDSREGLER ]
- Muskuloskeletale lidelser hos pædiatriske patienter [se ADVARSLER OG FORHOLDSREGLER ]
- Blodsukkerforstyrrelser [se ADVARSLER OG FORHOLDSREGLER ]
- Lysfølsomhed/fototoksicitet [se ADVARSLER OG FORHOLDSREGLER ]
- Udvikling af lægemiddelresistente bakterier [se ADVARSLER OG FORHOLDSREGLER ]
Krystalluri og cylindruri er blevet rapporteret med quinoloner, inklusive LEVAQUIN®. Derfor bør tilstrækkelig hydrering af patienter, der får LEVAQUIN® opretholdes for at forhindre dannelsen af en meget koncentreret urin [se DOSERING OG ADMINISTRATION ].
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Dataene beskrevet nedenfor afspejler eksponering for LEVAQUIN® hos 7537 patienter i 29 poolede fase 3 kliniske forsøg. Den undersøgte population havde en gennemsnitsalder på 50 år (ca. 74 % af befolkningen var INDIKATIONER ]. Patienterne fik LEVAQUIN® doser på 750 mg én gang dagligt, 250 mg én gang dagligt eller 500 mg én eller to gange dagligt.
Behandlingsvarighed var normalt 3-14 dage, og det gennemsnitlige antal dage i behandling var 10 dage.
Den samlede forekomst, type og fordeling af bivirkninger var ens hos patienter, der fik LEVAQUIN® doser på 750 mg én gang dagligt, 250 mg én gang dagligt og 500 mg én eller to gange dagligt.
Seponering af LEVAQUIN® på grund af bivirkninger forekom hos 4,3 % af patienterne generelt, 3,8 % af patienterne behandlet med 250 mg og 500 mg doser og 5,4 % af patienterne behandlet med 750 mg dosis. De mest almindelige bivirkninger, der førte til seponering med 250 og 500 mg doser, var gastrointestinale (1,4%), primært kvalme (0,6%); opkastning (0,4%); svimmelhed (0,3%); og hovedpine (0,2%). De mest almindelige bivirkninger, der førte til seponering med 750 mg dosis, var gastrointestinale (1,2 %), primært kvalme (0,6 %), opkastning (0,5 %). svimmelhed (0,3%); og hovedpine (0,3%).
Bivirkninger, der forekommer hos ≥1 % af LEVAQUIN®-behandlede patienter og mindre almindelige bivirkninger, der forekommer hos 0,1 til
kliniske forsøg med flerdosisbehandling er der observeret oftalmologiske abnormiteter, inklusive grå stær og multiple punktformede lentikulære uklarheder, hos patienter, der er i behandling med quinoloner, inklusive LEVAQUIN®. Forholdet mellem stofferne og disse hændelser er ikke på nuværende tidspunkt fastslået.
Postmarketing oplevelse
Tabel 6 viser bivirkninger, der er blevet identificeret under brug af LEVAQUIN® efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
DRUGSINTERAKTIONER
Chelationsmidler
Antacida, sucralfat, metalkationer, multivitaminer
Mens chelationen med divalente kationer er mindre udtalt end med andre fluorquinoloner, kan samtidig administration af LEVAQUIN® tabletter med antacida indeholdende magnesium eller aluminium samt sucralfat, metalkationer såsom jern og multivitaminpræparater med zink forstyrre den gastrointestinale absorption af levofloxacin, hvilket resulterer i systemiske niveauer betydeligt lavere end ønsket. Tabletter med antacida indeholdende magnesium, aluminium samt sucralfat, metalkationer såsom jern og multivitaminpræparater med zink eller didanosin kan i væsentlig grad interferere med den gastrointestinale absorption af levofloxacin, hvilket resulterer i systemiske niveauer betydeligt lavere end ønsket. Disse midler bør tages mindst to timer før eller to timer efter oral administration af LEVAQUIN®.
Warfarin
Der blev ikke påvist nogen signifikant effekt af LEVAQUIN® på maksimale plasmakoncentrationer, AUC og andre dispositionsparametre for R- og S-warfarin i et klinisk studie med raske frivillige. Tilsvarende blev der ikke observeret nogen synlig effekt af warfarin på levofloxacins absorption og disposition. Der har dog været rapporter efter markedsføring af patienter om, at LEVAQUIN® forstærker virkningen af warfarin. Forhøjelser af protrombintiden i forbindelse med samtidig brug af warfarin og LEVAQUIN® er blevet forbundet med episoder med blødning. Protrombintid, International Normalized Ratio (INR) eller andre egnede antikoagulationstest bør overvåges nøje, hvis LEVAQUIN® administreres samtidig med warfarin. Patienter bør også overvåges for tegn på blødning [se BIVIRKNINGER og PATIENTOPLYSNINGER ].
Antidiabetiske midler
Forstyrrelser i blodsukkeret, herunder hyperglykæmi og hypoglykæmi, er blevet rapporteret hos patienter, der blev behandlet samtidig med fluoroquinoloner og et antidiabetisk middel. Derfor anbefales omhyggelig overvågning af blodsukkeret, når disse midler administreres samtidigt [se ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER , og PATIENTOPLYSNINGER ].
Ikke-steroide antiinflammatoriske lægemidler
Samtidig administration af et ikke-steroidt antiinflammatorisk lægemiddel med en fluoroquinolon, inklusive LEVAQUIN®, kan øge risikoen for CNS-stimulering og krampeanfald [se ADVARSLER OG FORHOLDSREGLER ].
Theophyllin
Der blev ikke påvist nogen signifikant effekt af LEVAQUIN® på plasmakoncentrationer, AUC og andre dispositionsparametre for theophyllin i et klinisk studie med raske frivillige. Tilsvarende blev der ikke observeret nogen tydelig effekt af theophyllin på levofloxacins absorption og disposition. Samtidig administration af andre fluoroquinoloner med theophyllin har imidlertid resulteret i forlænget eliminationshalveringstid, forhøjede serum-theophyllinniveauer og en efterfølgende stigning i risikoen for theophyllin-relaterede bivirkninger i patientpopulationen. Derfor bør theophyllinniveauer overvåges nøje, og passende dosisjusteringer skal foretages, når LEVAQUIN® administreres samtidigt. Bivirkninger, herunder krampeanfald, kan forekomme med eller uden en stigning i serumtheophyllinniveauet [se ADVARSLER OG FORHOLDSREGLER ].
Cyclosporin
Der blev ikke påvist nogen signifikant effekt af LEVAQUIN® på maksimale plasmakoncentrationer, AUC og andre dispositionsparametre for cyclosporin i et klinisk studie med raske frivillige. Forhøjede serumniveauer af cyclosporin er imidlertid blevet rapporteret i patientpopulationen, når det administreres sammen med nogle andre fluorquinoloner. Levofloxacin Cmax og ke var lidt lavere, mens Tmax og t1/2 var lidt længere ved tilstedeværelse af cyclosporin end dem, der blev observeret i andre undersøgelser uden samtidig medicin. Forskellene anses dog ikke for at være klinisk signifikante. Derfor er dosisjustering ikke nødvendig for LEVAQUIN® eller cyclosporin, når det administreres samtidigt.
Digoxin
Der blev ikke påvist nogen signifikant effekt af LEVAQUIN® på maksimale plasmakoncentrationer, AUC og andre dispositionsparametre for digoxin i et klinisk studie med raske frivillige. Levofloxacins absorption og dispositionskinetik var ens i nærvær eller fravær af digoxin. Derfor er dosisjustering af LEVAQUIN® eller digoxin ikke nødvendig, når det administreres samtidigt.
Probenecid og cimetidin
Der blev ikke observeret nogen signifikant effekt af probenecid eller cimetidin på Cmax for levofloxacin i et klinisk studie med raske frivillige. AUC og t1/2 for levofloxacin var højere, mens CL/F og CLR var lavere under samtidig behandling af LEVAQUIN® med probenecid eller cimetidin sammenlignet med LEVAQUIN® alene. Disse ændringer berettiger dog ikke dosisjustering af LEVAQUIN®, når probenecid eller cimetidin administreres samtidigt.
Interaktioner med laboratorie- eller diagnostiske tests
Nogle fluoroquinoloner, inklusive LEVAQUIN®, kan give falsk positive urinscreeningsresultater for opiater ved brug af kommercielt tilgængelige immunoassay-sæt. Bekræftelse af positive opiatskærme med mere specifikke metoder kan være nødvendig.
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Invaliderende og potentielt irreversible alvorlige bivirkninger, herunder tendinitis og seneruptur, perifer neuropati og virkninger på centralnervesystemet
Fluoroquinoloner, inklusive LEVAQUIN®, er blevet forbundet med invaliderende og potentielt irreversible alvorlige bivirkninger fra forskellige kropssystemer, som kan forekomme sammen hos den samme patient. Almindelige bivirkninger omfatter senebetændelse, seneruptur, artralgi, myalgi, perifer neuropati og virkninger på centralnervesystemet (hallucinationer, angst, depression, søvnløshed, svær hovedpine og forvirring). Disse reaktioner kan forekomme inden for timer til uger efter start af LEVAQUIN®. Patienter i alle aldre eller uden allerede eksisterende risikofaktorer har oplevet disse bivirkninger [se Tendinitis og seneruptur, perifer neuropati, virkninger på centralnervesystemet ].
Afbryd LEVAQUIN® straks ved de første tegn eller symptomer på en alvorlig bivirkning. Undgå desuden brugen af fluorquinoloner, inklusive LEVAQUIN®, hos patienter, som har oplevet nogen af disse alvorlige bivirkninger forbundet med fluorquinoloner.
Tendinitis og seneruptur
Fluoroquinoloner, inklusive LEVAQUIN®, er blevet forbundet med en øget risiko for senebetændelse og seneruptur i alle aldre [se Invaliderende og potentielt irreversible alvorlige bivirkninger, herunder tendinitis og seneruptur, perifer neuropati og virkninger på centralnervesystemet og BIVIRKNINGER ]. Denne bivirkning involverer oftest akillessenen og er også blevet rapporteret med rotatormanchetten (skulderen), hånden, biceps, tommelfinger og andre senesteder. Tendinitis eller seneruptur kan forekomme inden for timer eller dage efter start af LEVAQUIN® eller så længe som flere måneder efter afslutning af fluoroquinolonbehandling. Tendinitis og seneruptur kan forekomme bilateralt.
Risikoen for at udvikle fluoroquinolon-associeret senebetændelse og seneruptur er øget hos patienter over 60 år, hos dem, der tager kortikosteroidlægemidler, og hos patienter med nyre-, hjerte- eller lungetransplantationer. Andre faktorer, der uafhængigt kan øge risikoen for seneruptur, omfatter anstrengende fysisk aktivitet, nyresvigt og tidligere senelidelser såsom leddegigt. Tendinitis og seneruptur er blevet rapporteret hos patienter, der tager fluoroquinoloner, som ikke har ovennævnte risikofaktorer. Afbryd straks LEVAQUIN®, hvis patienten oplever smerte, hævelse, betændelse eller senebrud. Patienter bør rådes til at hvile sig ved det første tegn på senebetændelse eller seneruptur og kontakte deres læge for at skifte til et ikke-quinolon antimikrobielt lægemiddel. Undgå LEVAQUIN® hos patienter, som har haft senelidelser eller seneruptur i anamnesen [se BIVIRKNINGER og PATIENTOPLYSNINGER ].
Perifer neuropati
Fluoroquinoloner, inklusive LEVAQUIN®, er blevet forbundet med en øget risiko for perifer neuropati. Tilfælde af sensorisk eller sensorimotorisk aksonal polyneuropati, der påvirker små og/eller store axoner, hvilket resulterer i paræstesier, hypoæstesier, dysestesier og svaghed er blevet rapporteret hos patienter, der får fluorokinoloner, inklusive LEVAQUIN®. Symptomer kan opstå kort efter påbegyndelse af LEVAQUIN® og kan være irreversible hos nogle patienter [se Invaliderende og potentielt irreversible alvorlige bivirkninger, herunder tendinitis og seneruptur, perifer neuropati og virkninger på centralnervesystemet og BIVIRKNINGER ].
Afbryd LEVAQUIN® øjeblikkeligt, hvis patienten oplever symptomer på neuropati, herunder smerte, brændende, snurren, følelsesløshed og/eller svaghed eller andre ændringer af fornemmelse, herunder let berøring, smerte, temperatur, stillingssans og vibrationsfornemmelse. Undgå fluoroquinoloner, inklusive LEVAQUIN®, hos patienter, som tidligere har oplevet perifer neuropati [se BIVIRKNINGER og PATIENTOPLYSNINGER ].
Virkninger på centralnervesystemet
Fluoroquinoloner, inklusive LEVAQUIN®, er blevet forbundet med en øget risiko for virkninger på centralnervesystemet (CNS), inklusive kramper, toksiske psykoser, øget intrakranielt tryk (inklusive pseudotumor cerebri). Fluoroquinoloner kan også forårsage stimulering af centralnervesystemet, som kan føre til rystelser, rastløshed, angst, svimmelhed, forvirring, hallucinationer, paranoia, depression, mareridt og søvnløshed. Selvmordstanker og forsøg på eller fuldført selvmord kan også forekomme, især hos patienter med en anamnese med depression eller en underliggende risikofaktor for depression. Disse reaktioner kan forekomme efter den første dosis. Hvis disse reaktioner opstår hos patienter, der får LEVAQUIN®, skal du seponere LEVAQUIN® og iværksætte passende foranstaltninger. Som med andre fluoroquinoloner bør LEVAQUIN® anvendes med forsigtighed til patienter med en kendt eller mistænkt lidelse i centralnervesystemet (CNS), som kan disponere dem for anfald eller sænke krampetærsklen (f.eks. svær cerebral arteriosklerose, epilepsi) eller i nærvær af andre risikofaktorer, der kan disponere dem for anfald eller sænke anfaldstærsklen (f.eks. visse lægemidler, nyreinsufficiens). [se BIVIRKNINGER , DRUGSINTERAKTIONER , og PATIENTOPLYSNINGER ].
Forværring af Myasthenia Gravis
Fluoroquinoloner, inklusive LEVAQUIN®, har neuromuskulær blokerende aktivitet og kan forværre muskelsvaghed hos patienter med myasthenia gravis. Alvorlige bivirkninger efter markedsføring, herunder dødsfald og behov for ventilatorisk støtte, er blevet forbundet med brug af fluoroquinolon hos patienter med myasthenia gravis. Undgå LEVAQUIN® hos patienter med en kendt anamnese med myasthenia gravis [se BIVIRKNINGER og PATIENTOPLYSNINGER ].
Andre alvorlige og nogle gange fatale bivirkninger
Andre alvorlige og til tider fatale bivirkninger, nogle på grund af overfølsomhed, og nogle på grund af usikker ætiologi, er sjældent blevet rapporteret hos patienter i behandling med fluoroquinoloner, inklusive LEVAQUIN®. Disse hændelser kan være alvorlige og opstår generelt efter administration af flere doser. Kliniske manifestationer kan omfatte en eller flere af følgende:
- feber, udslæt eller alvorlige dermatologiske reaktioner (f.eks. toksisk epidermal nekrolyse, Stevens-Johnsons syndrom);
- vaskulitis; artralgi; myalgi; serum sygdom;
- allergisk pneumonitis;
- interstitiel nefritis; akut nyreinsufficiens eller -svigt;
- hepatitis; gulsot; akut levernekrose eller -svigt;
- anæmi, herunder hæmolytisk og aplastisk; trombocytopeni, herunder trombotisk trombocytopenisk purpura; leukopeni; agranulocytose; pancytopeni; og/eller andre hæmatologiske abnormiteter.
Afbryd behandlingen med LEVAQUIN® med det samme ved den første forekomst af hududslæt, gulsot eller andre tegn på overfølsomhed, og iværksæt støttende foranstaltninger [se BIVIRKNINGER og PATIENTOPLYSNINGER ].
Overfølsomhedsreaktioner
Alvorlig og lejlighedsvis fatal overfølsomhed og/eller anafylaktiske reaktioner er blevet rapporteret hos patienter i behandling med fluoroquinoloner, inklusive LEVAQUIN®. Disse reaktioner opstår ofte efter den første dosis. Nogle reaktioner har været ledsaget af kardiovaskulært kollaps, hypotension/chok, krampeanfald, bevidsthedstab, snurren, angioødem (inklusive tunge, larynx, hals eller ansigtsødem/hævelse), luftvejsobstruktion (inklusive bronkospasmer, åndenød og akut åndedræt). angst), dyspnø, nældefeber, kløe og andre alvorlige hudreaktioner. LEVAQUIN® bør seponeres øjeblikkeligt ved den første forekomst af hududslæt eller andre tegn på overfølsomhed. Alvorlige akutte overfølsomhedsreaktioner kan kræve behandling med epinephrin og andre genoplivningsforanstaltninger, herunder oxygen, intravenøse væsker, antihistaminer, kortikosteroider, pressoraminer og luftvejsbehandling, som klinisk indiceret [se BIVIRKNINGER og PATIENTOPLYSNINGER ].
Hepatotoksicitet
Post-marketing rapporter om alvorlig hepatotoksicitet (inklusive akut hepatitis og fatale hændelser) er modtaget for patienter behandlet med LEVAQUIN®. Ingen tegn på alvorlig lægemiddelassocieret levertoksicitet blev påvist i kliniske forsøg med over 7.000 patienter. Alvorlig hepatotoksicitet forekom generelt inden for 14 dage efter påbegyndelse af behandlingen, og de fleste tilfælde forekom inden for 6 dage. De fleste tilfælde af alvorlig hepatotoksicitet var ikke forbundet med overfølsomhed [se Andre alvorlige og nogle gange fatale bivirkninger ].
Størstedelen af fatale levertoksicitetsrapporter forekom hos patienter på 65 år eller ældre, og de fleste var ikke forbundet med overfølsomhed. LEVAQUIN® bør seponeres øjeblikkeligt, hvis patienten udvikler tegn og symptomer på hepatitis [se BIVIRKNINGER og PATIENTOPLYSNINGER ].
Clostridium Difficile-associeret diarré
Clostridium difficile-associeret diarré (CDAD) er blevet rapporteret ved brug af næsten alle antibakterielle midler, inklusive LEVAQUIN®, og kan variere i sværhedsgrad fra mild diarré til fatal colitis. Behandling med antibakterielle midler ændrer den normale flora i tyktarmen, hvilket fører til overvækst af C. difficile.
C. difficile producerer toksinerne A og B, som bidrager til udviklingen af CDAD. Hypertoksinproducerende stammer af C. difficile forårsager øget morbiditet og dødelighed, da disse infektioner kan være modstandsdygtige over for antimikrobiel behandling og kan kræve kolektomi. CDAD skal overvejes hos alle patienter, der får diarré efter brug af antibiotika. Omhyggelig sygehistorie er nødvendig, da CDAD er blevet rapporteret at forekomme over to måneder efter administration af antibakterielle midler.
Hvis CDAD er mistænkt eller bekræftet, kan det være nødvendigt at afbryde igangværende antibiotikabrug, der ikke er rettet mod C. difficile. Passende væske- og elektrolytbehandling, proteintilskud, antibiotikabehandling af C. difficile og kirurgisk evaluering bør iværksættes som klinisk indiceret [se BIVIRKNINGER og PATIENTOPLYSNINGER ].
Forlængelse af QT-intervallet
Nogle fluorokinoloner, inklusive LEVAQUIN®, er blevet forbundet med forlængelse af QT-intervallet på elektrokardiogrammet og sjældne tilfælde af arytmi. Sjældne tilfælde af torsade de pointes er blevet spontant rapporteret under postmarketingovervågning hos patienter, der får fluoroquinoloner, inklusive LEVAQUIN®. LEVAQUIN® bør undgås hos patienter med kendt forlængelse af QT-intervallet, patienter med ukorrigeret hypokaliæmi og patienter, der får klasse IA (quinidin, procainamid) eller klasse III (amiodaron, sotalol) antiarytmika. Ældre patienter kan være mere modtagelige for lægemiddelrelaterede effekter på QT-intervallet [se BIVIRKNINGER , Brug i specifikke populationer , og PATIENTOPLYSNINGER ].
Muskuloskeletale lidelser hos pædiatriske patienter og artropatiske virkninger hos dyr
LEVAQUIN® er kun indiceret til pædiatriske patienter (6 måneder og ældre) til forebyggelse af inhalationsmiltbrand (efter eksponering) og til pest [se INDIKATIONER ]. En øget forekomst af muskuloskeletale lidelser (artralgi, arthritis, tendinopati og gangabnormitet) sammenlignet med kontroller er blevet observeret hos pædiatriske patienter, der får LEVAQUIN® [se Brug i specifikke populationer ].
Hos umodne rotter og hunde resulterede oral og intravenøs administration af levofloxacin i øget osteochondrose. Histopatologisk undersøgelse af de vægtbærende led hos umodne hunde doseret med levofloxacin afslørede vedvarende læsioner af brusken. Andre fluoroquinoloner producerer også lignende erosioner i de vægtbærende led og andre tegn på artropati hos umodne dyr af forskellige arter [se Dyrefarmakologi ].
Blodsukkerforstyrrelser
Som med andre fluoroquinoloner er forstyrrelser i blodsukkeret, inklusive symptomatisk hyper- og hypoglykæmi, blevet rapporteret med LEVAQUIN®, sædvanligvis hos diabetespatienter, der samtidig får behandling med et oralt hypoglykæmisk middel (f.eks. glyburid) eller med insulin. Hos disse patienter anbefales omhyggelig overvågning af blodsukkeret. Hvis der opstår en hypoglykæmisk reaktion hos en patient, der behandles med LEVAQUIN®, skal LEVAQUIN® seponeres, og passende behandling skal påbegyndes øjeblikkeligt [se BIVIRKNINGER , DRUGSINTERAKTIONER og PATIENTOPLYSNINGER ].
Fotosensitivitet/Fototoksicitet
Moderate til svære fotosensitivitets-/fototoksicitetsreaktioner, hvoraf sidstnævnte kan vise sig som overdrevne solskoldningsreaktioner (f.eks. svie, erytem, ekssudation, vesikler, blærer, ødem), der involverer områder udsat for lys (typisk ansigtet, "V"-området på halsen , ekstensoroverflader på underarmene, dorsa på hænderne), kan være forbundet med brugen af fluoroquinoloner efter eksponering for sol eller UV-lys. Derfor bør overdreven eksponering for disse lyskilder undgås. Lægemiddelbehandling bør seponeres, hvis der opstår lysfølsomhed/fototoksicitet [se BIVIRKNINGER og PATIENTOPLYSNINGER ].
Udvikling af lægemiddelresistente bakterier
Udskrivning af LEVAQUIN® i fravær af en påvist eller stærkt mistænkt bakteriel infektion eller en profylaktisk indikation vil sandsynligvis ikke give gavn for patienten og øger risikoen for udvikling af lægemiddelresistente bakterier [se PATIENTOPLYSNINGER ].
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( Medicinvejledning ).
Alvorlige bivirkninger
Rådgive patienter om at stoppe med at tage LEVAQUIN®, hvis de oplever en bivirkning, og at ringe til deres læge for at få råd om at afslutte hele behandlingsforløbet med et andet antibakterielt lægemiddel.
Informer patienterne om følgende alvorlige bivirkninger, der er blevet forbundet med LEVAQUIN® eller anden brug af fluorquinolon:
- Invaliderende og potentielt irreversible alvorlige bivirkninger, der kan opstå sammen: Informer patienterne om, at invaliderende og potentielt irreversible alvorlige bivirkninger, herunder senebetændelse og seneruptur, perifere neuropatier og virkninger på centralnervesystemet, er blevet forbundet med brugen af LEVAQUIN® og kan forekomme sammen hos den samme patient. Informer patienterne om at stoppe med at tage LEVAQUIN® med det samme, hvis de oplever en bivirkning, og ring til deres læge.
- Tendinitis og seneruptur: Instruer patienterne i at kontakte deres læge, hvis de oplever smerte, hævelse eller betændelse i en sene, eller svaghed eller manglende evne til at bruge et af deres led; hvile og afstå fra træning; og afbryd LEVAQUIN®-behandlingen. Symptomer kan være irreversible. Risikoen for alvorlig senelidelse med fluoroquinoloner er højere hos ældre patienter, sædvanligvis over 60 år, hos patienter, der tager kortikosteroidlægemidler, og hos patienter med nyre-, hjerte- eller lungetransplantationer.
- Perifere neuropatier: Informer patienterne om, at perifere neuropatier er blevet forbundet med brug af levofloxacin, symptomer kan opstå kort efter påbegyndelse af behandlingen og kan være irreversible. Hvis der opstår symptomer på perifer neuropati, herunder smerte, brænden, snurren, følelsesløshed og/eller svaghed, skal du straks afbryde behandlingen med LEVAQUIN® og fortælle dem, at de skal kontakte deres læge.
- Virkninger på centralnervesystemet (f.eks. kramper, svimmelhed, svimmelhed, øget intrakranielt tryk): Informer patienterne om, at der er rapporteret kramper hos patienter, der får fluorquinoloner, inklusive levofloxacin. Instruer patienterne i at underrette deres læge, før de tager dette lægemiddel, hvis de har en historie med kramper. Informer patienterne om, at de bør vide, hvordan de reagerer på LEVAQUIN®, før de betjener en bil eller et maskineri eller engagerer sig i andre aktiviteter, der kræver mental årvågenhed og koordination. Instruer patienterne i at underrette deres læge, hvis der opstår vedvarende hovedpine med eller uden sløret syn.
- Forværring af Myasthenia Gravis: Instruer patienterne i at informere deres læge om enhver historie med myasthenia gravis. Instruer patienterne i at underrette deres læge, hvis de oplever symptomer på muskelsvaghed, herunder åndedrætsbesvær.
- Overfølsomhedsreaktioner: Informer patienterne om, at levofloxacin kan forårsage overfølsomhedsreaktioner, selv efter en enkelt dosis, og at seponere lægemidlet ved de første tegn på hududslæt, nældefeber eller andre hudreaktioner, et hurtigt hjerteslag, synke- eller vejrtrækningsbesvær, enhver hævelse, der tyder på angioødem ( for eksempel hævelse af læber, tunge, ansigt, tæthed i halsen, hæshed) eller andre symptomer på en allergisk reaktion.
- Hepatotoksicitet: Informer patienterne om, at alvorlig hepatotoksicitet (inklusive akut hepatitis og fatale hændelser) er blevet rapporteret hos patienter, der tager LEVAQUIN®. Instruer patienterne i at informere deres læge, hvis de oplever tegn eller symptomer på leverskade, herunder: tab af appetit, kvalme, opkastning, feber, svaghed, træthed, ømhed i øverste højre kvadrant, kløe, gulfarvning af hud og øjne, lyse afføringer eller mørkfarvet urin.
- Diarré: Diarré er et almindeligt problem forårsaget af antibiotika, som normalt ophører, når antibiotikaen seponeres. Nogle gange kan patienter efter start af behandling med antibiotika udvikle vandig og blodig afføring (med eller uden mavekramper og feber) selv så sent som to eller flere måneder efter at have taget den sidste dosis af antibiotika. Hvis dette sker, instruer patienterne i at kontakte deres læge så hurtigt som muligt.
- Forlængelse af QT-intervallet: Instruer patienterne i at informere deres læge om enhver personlig eller familiehistorie med QT-forlængelse eller proarytmiske tilstande såsom hypokaliæmi, bradykardi eller nylig myokardieiskæmi; hvis de tager antiarytmika af klasse IA (quinidin, procainamid) eller klasse III (amiodaron, sotalol). Instruer patienterne i at underrette deres læge, hvis de har symptomer på forlængelse af QT-intervallet, herunder forlænget hjertebanken eller bevidsthedstab.
- Muskuloskeletale lidelser hos pædiatriske patienter: Instruer forældre til at informere deres barns læge, hvis barnet har en historie med ledrelaterede problemer, før de tager dette lægemiddel. Informer forældre til pædiatriske patienter om at underrette deres barns læge om eventuelle ledrelaterede problemer, der opstår under eller efter levofloxacinbehandling [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
- Lysfølsomhed/fototoksicitet: Informer patienterne om, at lysfølsomhed/fototoksicitet er blevet rapporteret hos patienter, der får fluorquinoloner. Informer patienterne om at minimere eller undgå eksponering for naturligt eller kunstigt sollys (solarier eller UVA/B-behandling), mens de tager fluorquinoloner. Hvis patienter skal være udendørs, mens de bruger fluoroquinoloner, skal du instruere dem i at bære løstsiddende tøj, der beskytter huden mod soleksponering, og diskutere andre solbeskyttelsesforanstaltninger med deres læge. Hvis der opstår en solskoldningslignende reaktion eller hududbrud, instruer patienterne i at kontakte deres læge.
Antibakteriel resistens
Antibakterielle lægemidler inklusive LEVAQUIN® bør kun bruges til at behandle bakterielle infektioner. De behandler ikke virusinfektioner (f.eks. forkølelse). Når LEVAQUIN® ordineres til behandling af en bakteriel infektion, skal patienterne fortælles, at selvom det er almindeligt at føle sig bedre tidligt i behandlingsforløbet, skal medicinen tages nøjagtigt som anvist. At springe doser over eller ikke fuldføre hele behandlingsforløbet kan (1) mindske effektiviteten af den øjeblikkelige behandling og (2) øge sandsynligheden for, at bakterier udvikler resistens og ikke vil kunne behandles med LEVAQUIN® eller andre antibakterielle lægemidler i fremtiden.
Administration med mad, væsker og samtidig medicin
Patienterne skal informeres om, at LEVAQUIN® tabletter kan tages med eller uden mad. Tabletterne skal tages på samme tidspunkt hver dag.
Patienter bør drikke rigeligt med væske, mens de tager LEVAQUIN® for at undgå dannelse af højkoncentreret urin og krystaldannelse i urinen.
Antacida indeholdende magnesium eller aluminium samt sucralfat, metalkationer såsom jern og multivitaminpræparater med zink eller didanosin bør tages mindst to timer før eller to timer efter oral administration af LEVAQUIN®.
Lægemiddelinteraktioner med insulin, orale hypoglykæmiske midler og warfarin
Patienter skal informeres om, at hvis de er diabetikere og behandles med insulin eller et oralt hypoglykæmisk middel, og der opstår en hypoglykæmisk reaktion, skal de seponere LEVAQUIN® og konsultere en læge.
Patienterne skal informeres om, at samtidig administration af warfarin og LEVAQUIN® er blevet forbundet med stigninger i International Normalized Ratio (INR) eller protrombintid og kliniske episoder med blødning. Patienter bør underrette deres læge, hvis de tager warfarin, overvåges for tegn på blødning og også få deres antikoagulationstest overvåget nøje, mens de tager warfarin samtidig.
Pest- og miltbrandstudier
Patienter, der får LEVAQUIN® til disse tilstande, skal informeres om, at effektivitetsundersøgelser ikke kunne udføres på mennesker af etiske og gennemførlighedsmæssige årsager. Godkendelsen af disse betingelser var derfor baseret på effektivitetsundersøgelser udført på dyr.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
et livstidsbioassay hos rotter udviste levofloxacin intet karcinogent potentiale efter daglig diætadministration i 2 år; den højeste dosis (100 mg/kg/dag) var 1,4 gange den højeste anbefalede humane dosis (750 mg) baseret på det relative kropsoverfladeareal. Levofloxacin forkortede ikke tiden til tumorudvikling af UV-inducerede hudtumorer i hårløse albino (Skh-1) mus ved noget levofloxacin dosisniveau og var derfor ikke fotocarcinogen under betingelserne i denne undersøgelse. Dermale levofloxacinkoncentrationer i de hårløse mus varierede fra 25 til 42 mcg/g ved det højeste levofloxacindosisniveau (300 mg/kg/dag), der blev brugt i fotokarcinogenicitetsstudiet. Til sammenligning var dermale levofloxacinkoncentrationer hos mennesker, der fik 750 mg LEVAQUIN®, i gennemsnit cirka 11,8 mcg/g ved Cmax.
Levofloxacin var ikke mutagent i følgende assays: Ames bakteriel mutationsassay (S. typhimurium og E. coli), CHO/HGPRT forward mutation assay, muse mikronucleus test, mus dominant letal test, rotte ikke-planlagt DNA syntese assay og musesøster kromatid udvekslingsanalyse. Det var positivt i in vitro-kromosomafvigelser (CHL-cellelinje) og søsterkromatidudvekslings- (CHL/IU-cellelinje) assays.
Levofloxacin forårsagede ingen svækkelse af fertilitet eller reproduktionsevne hos rotter ved orale doser så høje som 360 mg/kg/dag, svarende til 4,2 gange den højeste anbefalede humane dosis baseret på relativ kropsoverflade og intravenøse doser så høje som 100 mg/kg/ dag, svarende til 1,2 gange den højeste anbefalede humane dosis baseret på det relative kropsoverfladeareal.
Brug i specifikke populationer
Graviditet
Graviditetskategori C
Levofloxacin var ikke teratogent hos rotter ved doser så høje som 810 mg/kg/dag, hvilket svarer til 9,4 gange den højeste anbefalede orale humane dosis baseret på det relative kropsoverfladeareal. Den orale dosis på 810 mg/kg/dag til rotter forårsagede nedsat føtal kropsvægt og øget føtal dødelighed. Der blev ikke observeret teratogenicitet, når kaniner blev doseret oralt så højt som 50 mg/kg/dag, hvilket svarer til 1,1 gange den højeste anbefalede orale humane dosis baseret på det relative kropsoverfladeareal.
Der er dog ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder. LEVAQUIN® bør kun anvendes under graviditet, hvis den potentielle fordel opvejer den potentielle risiko for fosteret.
Ammende mødre
Baseret på data om andre fluorquinoloner og meget begrænsede data om LEVAQUIN®, kan det antages, at levofloxacin vil blive udskilt i modermælk. På grund af muligheden for alvorlige bivirkninger fra LEVAQUIN® hos ammende spædbørn, bør der tages en beslutning om, hvorvidt amningen skal afbrydes eller lægemidlet skal seponeres, under hensyntagen til lægemidlets betydning for moderen.
Pædiatrisk brug
Quinoloner, herunder levofloxacin, forårsager artropati og osteochondrose hos unge dyr af flere arter. [se ADVARSLER OG FORHOLDSREGLER og Dyrefarmakologi ].
Inhalationsmiltbrand (efter eksponering)
Levofloxacin er indiceret til pædiatriske patienter i alderen 6 måneder og ældre mod inhalationsmiltbrand (posteksponering). Risiko-benefit-vurderingen indikerer, at administration af levofloxacin til pædiatriske patienter er passende. Sikkerheden af levofloxacin hos pædiatriske patienter behandlet i mere end 14 dage er ikke blevet undersøgt [se INDIKATIONER , DOSERING OG ADMINISTRATION og Kliniske Studier ].
Pest
Levofloxacin er indiceret til pædiatriske patienter, 6 måneder og ældre, til behandling af pest, herunder pneumonisk og septicemisk pest på grund af Yersinia pestis (Y. pestis) og profylakse mod pest. Effektstudier af LEVAQUIN® kunne ikke udføres hos mennesker med pneumonisk pest af etiske og gennemførlighedsmæssige årsager. Derfor var godkendelsen af denne indikation baseret på en effektivitetsundersøgelse udført på dyr. Risiko-benefit-vurderingen indikerer, at administration af levofloxacin til pædiatriske patienter er passende [se INDIKATIONER , DOSERING OG ADMINISTRATION og Kliniske Studier ].
Sikkerhed og effektivitet af LEVAQUIN® hos pædiatriske patienter under seks måneder er ikke blevet fastslået.
Farmakokinetik efter intravenøs administration
Levofloxacins farmakokinetik efter en enkelt intravenøs dosis blev undersøgt hos pædiatriske patienter i alderen fra seks måneder til 16 år. Pædiatriske patienter clearede levofloxacin hurtigere end voksne patienter, hvilket resulterede i lavere plasmaeksponeringer end voksne for en given mg/kg dosis [se KLINISK FARMAKOLOGI og Kliniske Studier ].
Dosering hos pædiatriske patienter med inhalationsmiltbrand eller pest
For den anbefalede LEVAQUIN® tabletdosering til pædiatriske patienter med inhalationsmiltbrand eller pest, se DOSERING OG ADMINISTRATION . LEVAQUIN® tabletter kan ikke administreres til pædiatriske patienter, der vejer mindre end 30 kg på grund af begrænsningerne i de tilgængelige styrker. Alternative formuleringer af levofloxacin kan overvejes til pædiatriske patienter, der vejer mindre end 30 kg.
Bivirkninger
kliniske forsøg blev 1534 pædiatriske patienter (6 måneder til 16 år) behandlet med oral og intravenøs LEVAQUIN®. Pædiatriske patienter i alderen 6 måneder til 5 år fik LEVAQUIN® 10 mg/kg to gange dagligt, og pædiatriske patienter over 5 år fik 10 mg/kg én gang dagligt (maksimalt 500 mg pr. dag) i ca. 10 dage. LEVAQUIN® tabletter kan kun administreres til pædiatriske patienter med inhalationsmiltbrand (post-eksponering) eller pest, som vejer 30 kg eller derover på grund af begrænsningerne af de tilgængelige styrker [se DOSERING OG ADMINISTRATION ].
En undergruppe af pædiatriske patienter i de kliniske forsøg (1340 LEVAQUIN®-behandlede og 893 ikke-fluorquinolon-behandlede) indrulleret i et prospektivt, langsigtet overvågningsstudie for at vurdere forekomsten af protokoldefinerede muskel- og skeletlidelser (artralgi, arthritis, gadeabnormalitet) ) i løbet af 60 dage og 1 år efter den første dosis af undersøgelseslægemidlet. Pædiatriske patienter behandlet med LEVAQUIN® havde en signifikant højere forekomst af muskuloskeletale lidelser sammenlignet med de ikke-fluoroquinolonbehandlede børn som illustreret i tabel 7. LEVAQUIN® tabletter kan kun administreres til pædiatriske patienter med inhalationsmiltbrand (post-eksponering) eller pest som er 30 kg eller derover på grund af begrænsningerne af de tilgængelige styrker [se DOSERING OG ADMINISTRATION ].
Artralgi var den hyppigst forekommende muskuloskeletale lidelse i begge behandlingsgrupper. De fleste af de muskuloskeletale lidelser i begge grupper involverede flere vægtbærende led. Lidelserne var moderate hos 8/46 (17 %) børn og milde hos 35/46 (76 %) LEVAQUIN®-behandlede pædiatriske patienter, og de fleste blev behandlet med analgetika. Mediantiden til opløsning var 7 dage for LEVAQUIN® -behandlede pædiatriske patienter og 9 for ikke-fluorquinolonbehandlede børn (ca. 80 % forsvandt inden for 2 måneder i begge grupper). Ingen pædiatrisk patient havde en alvorlig eller alvorlig lidelse, og alle muskel- og skeletlidelser forsvandt uden følgesygdomme.
Opkastning og diarré var de hyppigst rapporterede bivirkninger, som forekom i samme hyppighed hos LEVAQUIN®-behandlede og ikke-fluorquinolonbehandlede pædiatriske patienter.
Ud over de bivirkninger, der er rapporteret hos pædiatriske patienter i kliniske forsøg, rapporterede bivirkninger hos voksne under kliniske forsøg eller erfaring efter markedsføring [se BIVIRKNINGER ] kan også forventes at forekomme hos pædiatriske patienter.
Geriatrisk brug
Geriatriske patienter har øget risiko for at udvikle alvorlige senelidelser, herunder seneruptur, når de behandles med en fluoroquinolon såsom LEVAQUIN®. Denne risiko øges yderligere hos patienter, der samtidig får kortikosteroidbehandling. Tendinitis eller seneruptur kan involvere akilles, hånd, skulder eller andre senesteder og kan forekomme under eller efter afslutning af behandlingen; tilfælde, der opstår op til flere måneder efter fluoroquinolonbehandling, er blevet rapporteret. Der bør udvises forsigtighed, når LEVAQUIN® ordineres til ældre patienter, især dem, der tager kortikosteroider. Patienterne skal informeres om denne potentielle bivirkning og rådes til at seponere LEVAQUIN® og kontakte deres læge, hvis der opstår symptomer på senebetændelse eller seneruptur [se KASSE ADVARSEL ; ADVARSLER OG FORHOLDSREGLER ; og BIVIRKNINGER ].
fase 3 kliniske forsøg var 1.945 LEVAQUIN®-behandlede patienter (26%) ≥ 65 år. Af disse var 1.081 patienter (14%) mellem 65 og 74 år, og 864 patienter (12%) var 75 år eller ældre. Der blev ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet mellem disse forsøgspersoner og yngre forsøgspersoner, men større følsomhed hos nogle ældre individer kan ikke udelukkes.
Alvorlige, og nogle gange fatale, tilfælde af levertoksicitet er blevet rapporteret efter markedsføring i forbindelse med LEVAQUIN®. Størstedelen af fatale levertoksicitetsrapporter forekom hos patienter på 65 år eller ældre, og de fleste var ikke forbundet med overfølsomhed. LEVAQUIN® bør seponeres øjeblikkeligt, hvis patienten udvikler tegn og symptomer på hepatitis [se ADVARSLER OG FORHOLDSREGLER ].
Ældre patienter kan være mere modtagelige for lægemiddelrelaterede virkninger på QT-intervallet. Derfor bør der tages forsigtighed ved anvendelse af LEVAQUIN® med samtidig medicin, der kan resultere i forlængelse af QT-intervallet (f.eks. klasse IA eller klasse III antiarytmika) eller hos patienter med risikofaktorer for torsade de pointes (f.eks. kendt QT-forlængelse, ukorrigeret) hypokaliæmi) [se ADVARSLER OG FORHOLDSREGLER ].
De farmakokinetiske egenskaber af levofloxacin hos yngre voksne og ældre voksne adskiller sig ikke væsentligt, når kreatininclearance tages i betragtning. Men da lægemidlet vides at udskilles væsentligt af nyrerne, kan risikoen for toksiske reaktioner på dette lægemiddel være større hos patienter med nedsat nyrefunktion. Da ældre patienter er mere tilbøjelige til at have nedsat nyrefunktion, bør der udvises forsigtighed ved dosisvalg, og det kan være nyttigt at overvåge nyrefunktionen [se KLINISK FARMAKOLOGI ].
Nedsat nyrefunktion
Clearance af levofloxacin er væsentligt reduceret, og plasmaelimineringshalveringstid er væsentligt forlænget hos patienter med nedsat nyrefunktion (kreatininclearance DOSERING OG ADMINISTRATION ].
Nedsat leverfunktion
Farmakokinetiske undersøgelser af patienter med nedsat leverfunktion er ikke blevet udført. På grund af det begrænsede omfang af levofloxacins metabolisme forventes levofloxacins farmakokinetik ikke at blive påvirket af nedsat leverfunktion.
OVERDOSIS
I tilfælde af en akut overdosering skal mavesækken tømmes. Patienten bør observeres og passende hydrering opretholdes. Levofloxacin fjernes ikke effektivt ved hæmodialyse eller peritonealdialyse.
LEVAQUIN® udviser et lavt potentiale for akut toksicitet. Mus, rotter, hunde og aber udviste følgende kliniske tegn efter at have modtaget en enkelt høj dosis LEVAQUIN®: ataksi, ptosis, nedsat bevægelsesaktivitet, dyspnø, udmattelse, rysten og kramper. Doser på over 1500 mg/kg oralt og 250 mg/kg IV gav signifikant dødelighed hos gnavere.
KONTRAINDIKATIONER
LEVAQUIN® er kontraindiceret hos personer med kendt overfølsomhed over for levofloxacin eller andre quinolon-antibakterielle midler [se ADVARSLER OG FORHOLDSREGLER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Levofloxacin er et medlem af fluoroquinolonklassen af antibakterielle midler [ se Mikrobiologi ].
Farmakokinetik
De gennemsnitlige ± SD farmakokinetiske parametre for levofloxacin bestemt under enkelt- og steady-state-betingelser efter administration af de orale tabletter er opsummeret i tabel 8.
Levofloxacins farmakokinetik er lineær og forudsigelig efter enkelt og multiple orale eller IV doseringsregimer. Steady-state-tilstande nås inden for 48 timer efter en dosis på 500 mg eller 750 mg én gang dagligt. De gennemsnitlige ± SD top- og bundplasmakoncentrationer opnået efter flere orale doseringsregimer én gang dagligt var ca. 5,7 ± 1,4 og 0,5 ± 0,2 mcg/ml efter 500 mg-doserne og 8,6 ± 1,9 og 1,1 ± 0,4 mcg/5 ml. mg doser, hhv. De gennemsnitlige ± SD top- og bundplasmakoncentrationer opnået efter flere intravenøse regimer én gang dagligt var ca. 6,4 ± 0,8 og 0,6 ± 0,2 mcg/ml efter 500 mg-doserne og 12,1 ± 4,1 og 1,3 ± 0,71 mcg/50 mg. doser, hhv.
Absorption
Levofloxacin absorberes hurtigt og stort set fuldstændigt efter oral administration. Maksimal plasmakoncentration opnås sædvanligvis en til to timer efter oral dosering. Den absolutte biotilgængelighed af levofloxacin fra en 500 mg tablet og en 750 mg tablet af LEVAQUIN® er begge ca. 99 %, hvilket viser fuldstændig oral absorption af levofloxacin. Efter en enkelt intravenøs dosis af LEVAQUIN® til raske frivillige var den gennemsnitlige ± SD peak plasmakoncentration opnået 6,2 ± 1,0 mcg/ml efter en 500 mg dosis infunderet over 60 minutter og 11,5 ± 4,0 mcg/ml efter en 750 mg dosis indgivet 90 minutter. Oral administration af en dosis på 500 mg LEVAQUIN® sammen med mad forlænger tiden til maksimal koncentration med ca. 1 time og reducerer maksimal koncentration med ca. 14 % efter tablet og ca. 25 % efter oral opløsning. Derfor kan LEVAQUIN® tabletter administreres uden hensyntagen til mad.
Plasmakoncentrationsprofilen for levofloxacin efter IV-administration er ens og sammenlignelig med hensyn til eksponeringsgrad (AUC) med den, der observeres for LEVAQUIN®-tabletter, når lige doser (mg/mg) administreres. Derfor kan de orale og IV indgivelsesveje betragtes som udskiftelige.
Fordeling
Det gennemsnitlige distributionsvolumen for levofloxacin varierer generelt fra 74 til 112 l efter enkelte og multiple doser på 500 mg eller 750 mg, hvilket indikerer udbredt fordeling i kropsvæv. Levofloxacin når sit højeste niveau i hudvæv og i blistervæske hos raske forsøgspersoner ca. 3 timer efter dosering. Hudvævsbiopsi til plasma AUC-forholdet er ca. 2, og blistervæske-plasma-AUC-forholdet er ca. 1 efter flere gange daglig oral administration af henholdsvis 750 mg og 500 mg doser af LEVAQUIN® til raske forsøgspersoner. Levofloxacin trænger også godt ind i lungevæv. Lungevævskoncentrationer var generelt 2- til 5 gange højere end plasmakoncentrationer og varierede fra ca. 2,4 til 11,3 mcg/g over en 24-timers periode efter en enkelt 500 mg oral dosis.
In vitro, over et klinisk relevant interval (1 til 10 mcg/ml) af serum/plasma levofloxacin-koncentrationer, er levofloxacin ca. 24 til 38 % bundet til serumproteiner på tværs af alle undersøgte arter, som bestemt ved ligevægtsdialysemetoden. Levofloxacin er hovedsageligt bundet til serumalbumin hos mennesker. Levofloxacins binding til serumproteiner er uafhængig af lægemiddelkoncentrationen.
Elimination
Metabolisme
Levofloxacin er stereokemisk stabilt i plasma og urin og inverterer ikke metabolisk til dets enantiomer, D-ofloxacin. Levofloxacin gennemgår begrænset metabolisme hos mennesker og udskilles primært som uændret lægemiddel i urinen. Efter oral administration blev ca. 87 % af en administreret dosis genfundet som uændret lægemiddel i urinen inden for 48 timer, mens mindre end 4 % af dosis blev genfundet i fæces på 72 timer. Mindre end 5 % af en administreret dosis blev genfundet i urinen som desmethyl- og N-oxidmetabolitter, de eneste metabolitter, der er identificeret hos mennesker. Disse metabolitter har ringe relevant farmakologisk aktivitet.
Udskillelse
Levofloxacin udskilles stort set som uændret lægemiddel i urinen. Den gennemsnitlige terminale plasmaelimineringshalveringstid for levofloxacin varierer fra ca. 6 til 8 timer efter en enkelt eller flere doser af levofloxacin givet oralt eller intravenøst. Den gennemsnitlige tilsyneladende totale kropsclearance og renal clearance varierer fra henholdsvis ca. 144 til 226 ml/min og 96 til 142 ml/min. Renal clearance ud over den glomerulære filtrationshastighed tyder på, at tubulær sekretion af levofloxacin forekommer ud over dets glomerulære filtration. Samtidig administration af enten cimetidin eller probenecid resulterer i henholdsvis ca. 24 % og 35 % reduktion af levofloxacin renal clearance, hvilket indikerer, at sekretion af levofloxacin sker i den renale proksimale tubuli. Der blev ikke fundet levofloxacinkrystaller i nogen af de friske urinprøver fra forsøgspersoner, der fik LEVAQUIN®.
Specifikke populationer
Geriatriske patienter
Der er ingen signifikante forskelle i levofloxacins farmakokinetik mellem unge og ældre forsøgspersoner, når forsøgspersonerne' forskelle i kreatininclearance tages i betragtning. Efter en 500 mg oral dosis af LEVAQUIN® til raske ældre forsøgspersoner (66-80 år) var den gennemsnitlige terminale plasmaelimineringshalveringstid for levofloxacin ca. 7,6 timer sammenlignet med ca. 6 timer hos yngre voksne. Forskellen skyldtes variationen i nyrefunktionsstatus hos forsøgspersonerne og mentes ikke at være klinisk signifikant. Lægemiddelabsorption ser ud til at være upåvirket af alder. LEVAQUIN® dosisjustering baseret på alder alene er ikke nødvendig [se Brug i specifikke populationer ].
Pædiatriske patienter
Levofloxacins farmakokinetik efter en enkelt 7 mg/kg intravenøs dosis blev undersøgt hos pædiatriske patienter i alderen fra 6 måneder til 16 år. Pædiatriske patienter clearede levofloxacin hurtigere end voksne patienter, hvilket resulterede i lavere plasmaeksponeringer end voksne for en given mg/kg dosis. Efterfølgende farmakokinetiske analyser forudsagde, at et doseringsregime på 8 mg/kg hver 12. time (må ikke overstige 250 mg pr. dosis) til pædiatriske patienter i alderen 6 måneder til 17 år ville opnå sammenlignelige steady state plasmaeksponeringer (AUC0-24 og Cmax ) til dem, der er observeret hos voksne patienter, der fik 500 mg levofloxacin én gang hver 24. time. LEVAQUIN® tabletter kan kun administreres til pædiatriske patienter med inhalationsmiltbrand (post-eksponering) eller pest, som vejer 30 kg eller derover på grund af begrænsningerne af de tilgængelige styrker [se DOSERING OG ADMINISTRATION ].
Mandlige og kvindelige emner
Der er ingen signifikante forskelle i levofloxacins farmakokinetik mellem mandlige og kvindelige forsøgspersoner, når forsøgspersoner' forskelle i kreatininclearance tages i betragtning. Efter en 500 mg oral dosis af LEVAQUIN® til raske mandlige forsøgspersoner var den gennemsnitlige terminale plasmaelimineringshalveringstid for levofloxacin ca. 7,5 timer sammenlignet med ca. 6,1 timer hos kvindelige forsøgspersoner. Denne forskel kunne tilskrives variationen i nyrefunktionsstatus hos de mandlige og kvindelige forsøgspersoner og mentes ikke at være klinisk signifikant. Lægemiddelabsorption ser ud til at være upåvirket af forsøgspersonernes køn. Dosisjustering baseret på køn alene er ikke nødvendig.
Race- eller etniske grupper
Effekten af race på levofloxacins farmakokinetik blev undersøgt gennem en kovariat analyse udført på data fra 72 forsøgspersoner: 48 hvide og 24 ikke-hvide. Den tilsyneladende totale kropsclearance og tilsyneladende distributionsvolumen blev ikke påvirket af forsøgspersonernes race.
Patienter med nedsat nyrefunktion
Clearance af levofloxacin er væsentligt reduceret, og plasmaelimineringshalveringstid er væsentligt forlænget hos voksne patienter med nedsat nyrefunktion (kreatininclearance DOSERING OG ADMINISTRATION og Brug i specifikke populationer ].
Patienter med nedsat leverfunktion
Farmakokinetiske undersøgelser hos patienter med nedsat leverfunktion er ikke blevet udført. På grund af det begrænsede omfang af levofloxacins metabolisme forventes levofloxacins farmakokinetik ikke at blive påvirket af nedsat leverfunktion [se Brug i specifikke populationer ].
Patienter med bakteriel infektion
Levofloxacins farmakokinetik hos patienter med alvorlige samfundserhvervede bakterielle infektioner er sammenlignelig med dem, der er observeret hos raske forsøgspersoner.
Lægemiddelinteraktionsstudier
Potentialet for farmakokinetiske lægemiddelinteraktioner mellem LEVAQUIN® og antacida, warfarin, theophyllin, cyclosporin, digoxin, probenecid og cimetidin er blevet evalueret [se DRUGSINTERAKTIONER ].
Mikrobiologi
Handlingsmekanisme
Levofloxacin er L-isomeren af racematet, ofloxacin, et quinolon antimikrobielt middel. Den antibakterielle aktivitet af ofloxacin ligger primært i L-isomeren. Virkningsmekanismen af levofloxacin og andre fluoroquinolon-antimikrobielle midler involverer hæmning af bakteriel topoisomerase IV og DNA-gyrase (som begge er type II topoisomeraser), enzymer, der kræves til DNA-replikation, transkription, reparation og rekombination.
Modstand
Fluoroquinolonresistens kan opstå gennem mutationer i definerede områder af DNA-gyrase eller topoisomerase IV, kaldet Quinolon-resistensbestemmende regioner (QRDR'er), eller gennem ændret efflux.
Fluoroquinoloner, herunder levofloxacin, adskiller sig i kemisk struktur og virkemåde fra aminoglykosider, makrolider og β-lactam-antibiotika, herunder penicilliner. Fluoroquinoloner kan derfor være aktive mod bakterier, der er resistente over for disse antimikrobielle stoffer.
Resistens over for levofloxacin på grund af spontan mutation in vitro er en sjælden forekomst (interval: 10-9 til 10-10). Der er observeret krydsresistens mellem levofloxacin og nogle andre fluoroquinoloner, nogle mikroorganismer, der er resistente over for andre fluoroquinoloner, kan være modtagelige over for levofloxacin.
Antimikrobiel aktivitet
Levofloxacin har in vitro aktivitet mod gram-negative og gram-positive bakterier.
Levofloxacin har vist sig at være aktivt mod de fleste isolater af følgende bakterier både in vitro og ved kliniske infektioner som beskrevet i se INDIKATIONER :
Aerobe bakterier
Gram-positive bakterier
Enterococcus faecalis Staphylococcus aureus (methicillin-modtagelige isolater) Staphylococcus epidermidis (methicillin-modtagelige isolater) Staphylococcus saprophyticus Streptococcus pneumoniae (herunder multi-drug-resistente isolater [MDRococcus] 1)
Gram-negative bakterier
Enterobacter cloacaeEscherichia coliHaemophilus influenzaeHaemophilus parainfluenzaeKlebsiella pneumoniaeLegionella pneumophilaMoraxella catarrhalisProteus mirabilisPseudomonas aeruginosaSerratia marcescens
Andre mikroorganismer
Chlamydophila pneumoniae Mycoplasma pneumoniae
Følgende in vitro-data er tilgængelige, men deres kliniske betydning er ukendt: Levofloxacin udviser in vitro minimale hæmmende koncentrationer (MIC-værdier) på 2 mcg/ml eller mindre mod de fleste (≥90%) isolater af følgende mikroorganismer; Sikkerheden og effektiviteten af LEVAQUIN® til behandling af kliniske infektioner på grund af disse bakterier er dog ikke blevet fastslået i tilstrækkelige og velkontrollerede kliniske forsøg.
MDRSP (Multi-drug resistente Streptococcus pneumoniae) isolater er isolater, der er resistente over for to eller flere af følgende antibiotika: penicillin (MIC ≥2 mcg/mL), 2. generations cephalosporiner, f.eks. cefuroxim; makrolider, tetracykliner og trimethoprim/sulfamethoxazol.
Aerobe bakterier
Gram-positive bakterier
Staphylococcus haemolyticusβ-hæmolytisk Streptococcus (Gruppe C/F)β-hæmolytisk Streptococcus (Gruppe G)Streptococcus agalactiaeStreptococcus milleriViridans gruppe streptokokkerBacillus anthracis
Gram-negative bakterier
Acinetobacter baumanniiAcinetobacter lwoffiiBordetella pertussisCitrobacter koseriCitrobacter freundiiEnterobacter aerogenesEnterobacter sakazakiiKlebsiella oxytocaMorganella morganiiPantoea agglomeransProteusstiiensProvidcia stugeriens
Anaerobe bakterier
Gram-positive bakterier
Clostridium perfringens
Modtagelighedstest
For specifik information om fortolkningskriterier for følsomhedstest og tilhørende testmetoder og kvalitetskontrolstandarder, der er anerkendt af FDA for dette lægemiddel, se venligst: https://www.fda.gov/STIC.
Dyretoksikologi og/eller farmakologi
Levofloxacin og andre quinoloner har vist sig at forårsage artropati hos umodne dyr af de fleste testede arter [se ADVARSLER OG FORHOLDSREGLER ]. Hos umodne hunde (4-5 måneder gamle) resulterede orale doser på 10 mg/kg/dag i 7 dage og intravenøse doser på 4 mg/kg/dag i 14 dage af levofloxacin i artropatiske læsioner. Administration ved orale doser på 300 mg/kg/dag i 7 dage og intravenøse doser på 60 mg/kg/dag i 4 uger frembragte artropati hos unge rotter. Tre måneder gamle beaglehunde doseret oralt med levofloxacin på 40 mg/kg/dag udviste klinisk alvorlig artrotoksicitet, hvilket resulterede i afbrydelse af doseringen på dag 8 i en 14-dages doseringsrutine. Små muskuloskeletale kliniske effekter, i fravær af alvorlige patologiske eller histopatologiske virkninger, skyldes det laveste dosisniveau på 2,5 mg/kg/dag (ca. 0,2 gange den pædiatriske dosis baseret på AUC-sammenligninger). Synovitis og ledbrusklæsioner blev observeret ved dosisniveauerne på 10 og 40 mg/kg (henholdsvis ca. 0,7 gange og 2,4 gange den pædiatriske dosis baseret på AUC-sammenligninger). Artikulær brusk bruttopatologi og histopatologi vedblev til slutningen af den 18-ugers restitutionsperiode for de hunde fra dosisniveauerne 10 og 40 mg/kg/dag.
Når det blev testet i en bioassay med hævelse af museører, udviste levofloxacin fototoksicitet svarende til ofloxacin, men mindre fototoksicitet end andre quinoloner.
Mens krystalluri er blevet observeret i nogle intravenøse rotteundersøgelser, dannes der ikke urinkrystaller i blæren, de er kun til stede efter vandladning og er ikke forbundet med nefrotoksicitet.
Hos mus forstærkes den CNS-stimulerende virkning af quinoloner ved samtidig administration af ikke-steroide antiinflammatoriske lægemidler.
Hos hunde frembragte levofloxacin administreret ved 6 mg/kg eller højere ved hurtig intravenøs injektion hypotensive virkninger. Disse virkninger blev anset for at være relateret til histaminfrigivelse.
In vitro og in vivo undersøgelser på dyr indikerer, at levofloxacin hverken er en enzyminducer eller inhibitor i det humane terapeutiske plasmakoncentrationsområde; derfor forventes ingen lægemiddelmetaboliserende enzym-relaterede interaktioner med andre lægemidler eller midler.
Kliniske Studier
Nosokomiel lungebetændelse
Voksne patienter med klinisk og radiologisk dokumenteret nosokomial lungebetændelse blev inkluderet i et multicenter, randomiseret, åbent studie, der sammenlignede intravenøs LEVAQUIN® (750 mg én gang dagligt) efterfulgt af oral LEVAQUIN® (750 mg én gang dagligt) i i alt 7-15 dage til intravenøs imipenem/cilastatin (500-1000 mg hver 6.-8. time dagligt) efterfulgt af oral ciprofloxacin (750 mg hver 12. time dagligt) i i alt 7-15 dage. LEVAQUIN®-behandlede patienter fik i gennemsnit 7 dages intravenøs behandling (interval: 1-16 dage); komparatorbehandlede patienter fik i gennemsnit 8 dages intravenøs behandling (interval: 1-19 dage).
Samlet set i den klinisk og mikrobiologisk evaluerbare population blev supplerende behandling empirisk påbegyndt ved studiestart hos 56 ud af 93 (60,2 %) patienter i LEVAQUIN®-armen og 53 ud af 94 (56,4 %) patienter i komparatorarmen. Den gennemsnitlige varighed af supplerende behandling var 7 dage i LEVAQUIN®-armen og 7 dage i komparatoren. Hos klinisk og mikrobiologisk evaluerbare patienter med dokumenteret Pseudomonas aeruginosa-infektion fik 15 ud af 17 (88,2 %) ceftazidim (N = 11) eller piperacillin/tazobactam (N = 4) i LEVAQUIN®-armen, og 16 ud af 17 (94,1 %) fik en aminoglykosid i komparatorarmen. Samlet set blev vancomycin til klinisk og mikrobiologisk evaluerbare patienter føjet til behandlingsregimet for 37 ud af 93 (39,8 %) patienter i LEVAQUIN®-armen og 28 ud af 94 (29,8 %) patienter i komparatorarmen for mistænkt methicillin-resistent S. aureus infektion.
Kliniske succesrater hos klinisk og mikrobiologisk evaluerbare patienter ved besøget efter behandling (primært studie-endepunkt vurderet på dag 3-15 efter afsluttet behandling) var 58,1 % for LEVAQUIN® og 60,6 % for komparator. 95 % CI for forskellen i responsrater (LEVAQUIN® minus komparator) var [-17,2, 12,0]. De mikrobiologiske eradikeringsrater ved postterapibesøget var 66,7 % for LEVAQUIN® og 60,6 % for komparator. 95 % CI for forskellen i udryddelsesrater (LEVAQUIN® minus komparator) var [-8,3, 20,3]. Klinisk succes og mikrobiologiske udryddelsesrater efter patogen er detaljeret beskrevet i tabel 9.
Samfundserhvervet lungebetændelse
7-14 dages behandlingsregime
Voksne indlagte patienter og ambulante patienter med diagnosen samfundserhvervet bakteriel lungebetændelse blev evalueret i 2 pivotale kliniske undersøgelser. I den første undersøgelse blev 590 patienter inkluderet i et prospektivt, multicenter, ublindet randomiseret forsøg, der sammenlignede LEVAQUIN® 500 mg én gang dagligt oralt eller intravenøst i 7 til 14 dage med ceftriaxon 1 til 2 gram intravenøst én gang eller i ligeligt fordelte doser to gange dagligt. efterfulgt af cefuroximaxetil 500 mg oralt to gange dagligt i i alt 7 til 14 dage. Patienter, der blev tildelt behandling med kontrolregimen, fik lov til at modtage erythromycin (eller doxycyclin, hvis de var intolerante over for erythromycin), hvis en infektion på grund af atypiske patogener var mistænkt eller bevist. Kliniske og mikrobiologiske evalueringer blev udført under behandlingen, 5 til 7 dage efter behandling og 3 til 4 uger efter behandling. Klinisk succes (helbredelse plus forbedring) med LEVAQUIN® 5 til 7 dage efter behandling, den primære effektvariabel i denne undersøgelse, var overlegen (95 %) i forhold til kontrolgruppen (83 %). 95 % CI for forskellen i responsrater (LEVAQUIN® minus komparator) var [-6, 19]. I den anden undersøgelse blev 264 patienter inkluderet i et prospektivt, multicenter, ikke-sammenlignende forsøg med 500 mg LEVAQUIN® administreret oralt eller intravenøst én gang dagligt i 7 til 14 dage. Klinisk succes for klinisk evaluerbare patienter var 93 %. For begge undersøgelser var den kliniske succesrate hos patienter med atypisk lungebetændelse på grund af Chlamydophila pneumoniae, Mycoplasma pneumoniae og Legionella pneumophila henholdsvis 96 %, 96 % og 70 %. Mikrobiologiske udryddelsesrater på tværs af begge undersøgelser er vist i tabel 10.
Samfundserhvervet lungebetændelse på grund af multiresistent Streptococcus Pneumoniae
LEVAQUIN® var effektiv til behandling af samfundserhvervet lungebetændelse forårsaget af multi-drug resistente Streptococcus pneumoniae (MDRSP). MDRSP-isolater er isolater, der er resistente over for to eller flere af følgende antibakterielle midler: penicillin (MIC ≥2 mcg/mL), 2. generations cephalosporiner (f.eks. cefuroxim, makrolider, tetracycliner og trimethoprim/sulfamethoxazol). Ud af 40 mikrobiologisk evaluerbare patienter med MDRSP-isolater opnåede 38 patienter (95,0%) klinisk og bakteriologisk succes efter behandlingen. De kliniske og bakterielle succesrater er vist i tabel 11.
Ikke alle isolater var resistente over for alle testede antimikrobielle klasser. Succes- og udryddelsesrater er opsummeret i tabel 12.
Samfundserhvervet lungebetændelse
5-dages behandlingsregime
For at evaluere sikkerheden og effektiviteten af den højere dosis og kortere forløb af LEVAQUIN® blev 528 ambulante og indlagte voksne med klinisk og radiologisk bestemt mild til svær samfundserhvervet lungebetændelse evalueret i en dobbeltblind, randomiseret, prospektiv, multicenterundersøgelse, der sammenlignede LEVAQUIN ® 750 mg, IV eller oralt, hver dag i fem dage eller LEVAQUIN® 500 mg IV eller oralt, hver dag i 10 dage.
De kliniske succesrater (helbredelse plus forbedring) i den klinisk evaluerbare population var 90,9 % i LEVAQUIN® 750 mg-gruppen og 91,1 % i LEVAQUIN® 500 mg-gruppen. 95 % CI for forskellen i responsrater (LEVAQUIN® 750 minus LEVAQUIN® 500) var [-5,9, 5,4]. I den klinisk evaluerbare population (31-38 dage efter indskrivning) blev lungebetændelse observeret hos 7 ud af 151 patienter i LEVAQUIN® 750 mg-gruppen og 2 ud af 147 patienter i LEVAQUIN® 500 mg-gruppen. I betragtning af de små observerede tal kan betydningen af dette fund ikke bestemmes statistisk. Den mikrobiologiske effektivitet af 5-dages kuren blev dokumenteret for infektioner anført i tabel 13.
Akut bakteriel bihulebetændelse
5-dages og 10-14 dages behandlingsregimer
LEVAQUIN® er godkendt til behandling af akut bakteriel bihulebetændelse (ABS) med enten 750 mg gennem munden × 5 dage eller 500 mg gennem munden en gang dagligt × 10-14 dage. For at evaluere sikkerheden og effektiviteten af en højdosis kort kur med LEVAQUIN® blev 780 ambulante voksne med klinisk og radiologisk bestemt akut bakteriel bihulebetændelse evalueret i et dobbeltblindt, randomiseret, prospektivt multicenterstudie, der sammenlignede LEVAQUIN® 750 mg gennem munden én gang dagligt. i fem dage til LEVAQUIN® 500 mg gennem munden én gang dagligt i 10 dage.
Kliniske succesrater (defineret som fuldstændig eller delvis opløsning af før-behandlingens tegn og symptomer på ABS i en sådan grad, at ingen yderligere antibiotikabehandling blev anset for nødvendig) i den mikrobiologisk evaluerbare population var 91,4 % (139/152) i LEVAQUIN® 750 mg-gruppen og 88,6 % (132/149) i LEVAQUIN® 500 mg-gruppen ved test-of-cure (TOC) besøget (95 % CI [-4,2, 10,0] for LEVAQUIN® 750 mg minus LEVAQUIN® 500 mg) .
Hyppigheder af klinisk succes af patogen i den mikrobiologisk evaluerbare population, som havde prøver opnået ved antral tap ved undersøgelsens start, viste sammenlignelige resultater for fem- og ti-dages regimerne ved test-of-cure-besøget 22 dage efter behandling (se tabel 14) .
Komplicerede hud- og hudstrukturinfektioner
Tre hundrede nioghalvfems patienter blev indskrevet i et åbent, randomiseret, sammenlignende studie for komplicerede hud- og hudstrukturinfektioner. Patienterne blev randomiseret til at modtage enten LEVAQUIN® 750 mg én gang dagligt (IV efterfulgt af oral) eller en godkendt komparator i en median på 10 ± 4,7 dage. Som det forventes ved komplicerede hud- og hudstrukturinfektioner, blev kirurgiske indgreb udført i LEVAQUIN®- og komparatorgruppen. Kirurgi (incision og dræning eller debridering) blev udført på 45 % af de LEVAQUIN®-behandlede patienter og 44 % af de komparatorbehandlede patienter, enten kort før eller under antibiotikabehandling og udgjorde en integreret del af behandlingen for denne indikation.
Blandt dem, der kunne evalueres klinisk 2-5 dage efter afslutning af studielægemidlet, var de samlede succesrater (forbedret eller helbredt) 116/138 (84,1 %) for patienter behandlet med LEVAQUIN® og 106/132 (80,3 %) for patienter behandlet med komparatoren.
Succesraterne varierede med typen af diagnose fra 68 % hos patienter med inficerede sår til 90 % hos patienter med inficerede sår og bylder. Disse rater svarede til dem, der blev set med komparatorlægemidler.
Kronisk bakteriel prostatitis
Voksne patienter med en klinisk diagnose af prostatitis og mikrobiologiske dyrkningsresultater fra urinprøver indsamlet efter prostatamassage (VB3) eller udtrykt prostatisk sekretion (EPS)-prøver opnået via Meares-Stamey-proceduren blev indskrevet i et multicenter, randomiseret, dobbeltblindet studie, der sammenlignede oral LEVAQUIN® 500 mg, én gang dagligt i i alt 28 dage til oral ciprofloxacin 500 mg, to gange dagligt i i alt 28 dage. Det primære effektmål var mikrobiologisk effekt hos mikrobiologisk evaluerbare patienter. I alt 136 og 125 mikrobiologisk evaluerbare patienter blev inkluderet i henholdsvis LEVAQUIN®- og ciprofloxacin-grupperne. Den mikrobiologiske udryddelsesrate ved patientinfektion 5-18 dage efter afslutning af behandlingen var 75,0 % i LEVAQUIN®-gruppen og 76,8 % i ciprofloxacin-gruppen (95 % CI [-12,58, 8,98] for LEVAQUIN® minus ciprofloxacin). De overordnede udryddelsesrater for patogener af interesse er vist i tabel 15.
Udryddelsesrater for S. epidermidis, når fundet sammen med andre co-patogener, er i overensstemmelse med hastigheder set i rene isolater.
Klinisk succes (helbredelse + forbedring uden behov for yderligere antibiotikabehandling) i mikrobiologisk evaluerbar population 5-18 dage efter afslutning af behandlingen var 75,0 % for LEVAQUIN®-behandlede patienter og 72,8 % for ciprofloxacin-behandlede patienter (95 % CI [- 8,87, 13,27] for LEVAQUIN® minus ciprofloxacin). Kliniske langsigtede succesrater (24-45 dage efter afslutning af behandlingen) var 66,7 % for de LEVAQUIN®-behandlede patienter og 76,9 % for de ciprofloxacinbehandlede patienter (95 % CI [-23,40, 2,89] for LEVAQUIN® minus ciprofloxacin).
Komplicerede urinvejsinfektioner og akut pyelonefritis
5-dages behandlingsregime
For at evaluere sikkerheden og effektiviteten af den højere dosis og kortere forløb af LEVAQUIN® blev 1109 patienter med cUTI og AP inkluderet i et randomiseret, dobbeltblindet, multicenter klinisk forsøg udført i USA fra november 2004 til april 2006, hvor man sammenlignede LEVAQUIN® 750 mg IV eller oralt én gang dagligt i 5 dage (546 patienter) med ciprofloxacin 400 mg IV eller 500 mg oralt to gange dagligt i 10 dage (563 patienter). Patienter med AP kompliceret af underliggende nyresygdomme eller tilstande såsom fuldstændig obstruktion, kirurgi, transplantation, samtidig infektion eller medfødt misdannelse blev udelukket. Effektiviteten blev målt ved bakteriologisk udryddelse af baseline-organismen/-organismerne ved postterapibesøget hos patienter med et patogen identificeret ved baseline. Besøget efter behandling (test-of-cure) fandt sted 10 til 14 dage efter den sidste aktive dosis af LEVAQUIN® og 5 til 9 dage efter den sidste dosis af aktiv ciprofloxacin.
De bakteriologiske helbredelsesrater overordnet for LEVAQUIN® og kontrol ved test-of-cure (TOC) besøget for gruppen af alle patienter med et dokumenteret patogen ved baseline (modificeret intention to treat eller mITT) og gruppen af patienter i mITT-populationen som nøje fulgte protokollen (mikrobiologisk evaluerbar), er opsummeret i tabel 16.
Mikrobiologiske udryddelsesrater i den mikrobiologisk evaluerbare population ved TOC for individuelle patogener udvundet fra patienter randomiseret til LEVAQUIN®-behandling er vist i tabel 17.
Komplicerede urinvejsinfektioner og akut pyelonefritis
10-dages behandlingsregime
For at evaluere sikkerheden og effektiviteten af 250 mg dosis, 10 dages regimen af LEVAQUIN®, blev 567 patienter med ukompliceret UVI, mild til moderat cUTI og mild til moderat AP inkluderet i et randomiseret, dobbeltblindt multicenter. kliniske forsøg udført i USA fra juni 1993 til januar 1995, hvor LEVAQUIN® 250 mg oralt én gang dagligt i 10 dage (285 patienter) blev sammenlignet med ciprofloxacin 500 mg oralt to gange dagligt i 10 dage (282 patienter). Patienter med et resistent patogen, tilbagevendende UVI, kvinder over 55 år og med et indlagt kateter blev oprindeligt udelukket før protokolændringen, som fandt sted efter 30 % af tilmeldingen. Mikrobiologisk effektivitet blev målt ved bakteriologisk udryddelse af baseline-organismen(-erne) 1-12 dage efter behandling hos patienter med et patogen identificeret ved baseline.
De bakteriologiske helbredelsesrater overordnet for LEVAQUIN® og kontrol ved test-of-cure (TOC) besøget for gruppen af alle patienter med et dokumenteret patogen ved baseline (modificeret intention to treat eller mITT) og gruppen af patienter i mITT-populationen som nøje fulgte protokollen (mikrobiologisk evaluerbar), er opsummeret i tabel 18.
Inhalationsmiltbrand (efter eksponering)
Effektiviteten af LEVAQUIN® til denne indikation er baseret på plasmakoncentrationer opnået hos mennesker, et surrogat-endepunkt, der med rimelighed kan forudsige kliniske fordele. LEVAQUIN® er ikke blevet testet på mennesker til forebyggelse af post-eksponering af inhalationsmiltbrand. De gennemsnitlige plasmakoncentrationer af LEVAQUIN® forbundet med en statistisk signifikant forbedring af overlevelse i forhold til placebo i rhesus abe-modellen for inhalationsmiltbrand nås eller overskrides hos voksne og pædiatriske patienter, der får de anbefalede orale og intravenøse doseringsregimer [se INDIKATIONER og DOSERING OG ADMINISTRATION ].
Levofloxacins farmakokinetik er blevet evalueret hos voksne og pædiatriske patienter. Den gennemsnitlige (± SD) steady state peak plasmakoncentration hos voksne mennesker, der får 500 mg oralt eller intravenøst én gang dagligt, er henholdsvis 5,7 ± 1,4 og 6,4 ± 0,8 mcg/ml; og den tilsvarende totale plasmaeksponering (AUC ) er henholdsvis 47,5 ± 6,7 og 54,6 ± 11,1 mcg.h/mL. De forudsagte steady-state farmakokinetiske parametre hos pædiatriske patienter i alderen fra 6 måneder til 17 år, som fik 8 mg/kg oralt hver 12. time (må ikke overstige 250 mg pr. dosis) blev beregnet til at være sammenlignelige med dem, der blev observeret hos voksne, der fik 500 mg oralt en gang dagligt [se KLINISK FARMAKOLOGI ].
LEVAQUIN® tabletter kan kun administreres til pædiatriske patienter med inhalationsmiltbrand (posteksponering) eller pest, som vejer 30 kg eller mere på grund af begrænsningerne af de tilgængelige styrker [se DOSERING OG ADMINISTRATION ].
Hos voksne er sikkerheden af LEVAQUIN® i behandlingsvarigheder på op til 28 dage velkarakteriseret. Oplysninger vedrørende forlænget brug ved 500 mg dagligt i op til 60 dage er dog begrænset. Langvarig LEVAQUIN®-behandling til voksne bør kun anvendes, når fordelen opvejer risikoen.
Hos pædiatriske patienter er sikkerheden af levofloxacin i behandlingsvarigheder på mere end 14 dage ikke blevet undersøgt. En øget forekomst af muskuloskeletale bivirkninger (artralgi, arthritis, tendinopati, gangabnormitet) sammenlignet med kontroller er blevet observeret i kliniske undersøgelser med behandlingsvarighed på op til 14 dage. Langsigtede sikkerhedsdata, herunder virkninger på brusk, efter administration af levofloxacin til pædiatriske patienter er begrænsede [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
Der blev udført et placebokontrolleret dyreforsøg med rhesusaber udsat for en inhaleret middeldosis på 49 LD50 (~2,7 × 106) sporer (interval 17 – 118 LD50) af B. anthracis (Ames-stamme). Den minimale hæmmende koncentration (MIC) af levofloxacin for miltbrandstammen anvendt i denne undersøgelse var 0,125 mcg/ml. I de undersøgte dyr varierede gennemsnitlige plasmakoncentrationer af levofloxacin opnået ved forventet Tmax (1 time efter dosis) efter oral dosering til steady state fra 2,79 til 4,87 mcg/ml. Steady-state dalkoncentrationer 24 timer efter dosis varierede fra 0,107 til 0,164 mcg/ml. Gennemsnitlig (SD) steady state AUC0-24 var 33,4 ± 3,2 mcg.t/mL (interval 30,4 til 36,0 mcg.t/mL). Dødelighed på grund af miltbrand for dyr, der modtog en 30-dages behandling med oral LEVAQUIN® begyndende 24 timer efter eksponering, var signifikant lavere (1/10) sammenlignet med placebogruppen (9/10) [P = 0,0011, 2-sidet Fisher 39;s nøjagtige test]. Det ene levofloxacin-behandlede dyr, der døde af miltbrand, gjorde det efter den 30-dages lægemiddelindgivelsesperiode.
Pest
Effektstudier af LEVAQUIN® kunne ikke udføres hos mennesker med pneumonisk pest af etiske og gennemførlighedsmæssige årsager. Derfor var godkendelsen af denne indikation baseret på en effektivitetsundersøgelse udført på dyr.
De gennemsnitlige plasmakoncentrationer af LEVAQUIN® forbundet med en statistisk signifikant forbedring af overlevelse i forhold til placebo i en afrikansk grøn abemodel af lungepest nås eller overskrides hos voksne og pædiatriske patienter, der får de anbefalede orale og intravenøse doseringsregimer [se INDIKATIONER og DOSERING OG ADMINISTRATION ].
Levofloxacins farmakokinetik er blevet evalueret hos voksne og pædiatriske patienter. Den gennemsnitlige (± SD) steady state peak plasmakoncentration hos voksne mennesker, der får 500 mg oralt eller intravenøst én gang dagligt, er henholdsvis 5,7 ± 1,4 og 6,4 ± 0,8 mcg/ml; og den tilsvarende totale plasmaeksponering (AUC0-24) er henholdsvis 47,5 ± 6,7 og 54,6 ± 11,1 mcg.h/mL. De forudsagte steady-state farmakokinetiske parametre hos pædiatriske patienter i alderen fra 6 måneder til 17 år, som fik 8 mg/kg oralt hver 12. time (må ikke overstige 250 mg pr. dosis) blev beregnet til at være sammenlignelige med dem, der blev observeret hos voksne, der fik 500 mg oralt en gang dagligt [se KLINISK FARMAKOLOGI ]. LEVAQUIN® tabletter kan kun administreres til pædiatriske patienter med inhalationsmiltbrand (posteksponering) eller pest, som vejer 30 kg eller mere på grund af begrænsningerne af de tilgængelige styrker [se DOSERING OG ADMINISTRATION ].
Et placebokontrolleret dyreforsøg med afrikanske grønne aber udsat for en inhaleret middeldosis på 65 LD (interval 3 til 145 LD50) af Yersinia pestis (CO92-stamme) blev udført. Den minimale hæmmende koncentration (MIC) af levofloxacin for Y. pestis-stammen anvendt i denne undersøgelse var 0,03 mcg/ml. Gennemsnitlige plasmakoncentrationer af levofloxacin opnået ved slutningen af en enkelt 30-minutters infusion varierede fra 2,84 til 3,50 mcg/ml hos afrikanske grønne aber. Laveste koncentrationer 24 timer efter dosis varierede fra
PATIENTOPLYSNINGER
LEVAQUIN® (Leave ah kwin)(levofloxacin) tabletter
Hvad er den vigtigste information, jeg bør vide om LEVAQUIN 500mg?
LEVAQUIN 500mg, et fluorquinolon-antibiotikum, kan forårsage alvorlige bivirkninger. Nogle af disse alvorlige bivirkninger kan opstå på samme tid og kan resultere i døden.
Hvis du får nogle af følgende alvorlige bivirkninger, mens du tager LEVAQUIN 500mg, du skal stoppe med at tage LEVAQUIN med det samme og få lægehjælp med det samme.
- Seneproblemer kan forekomme hos mennesker i alle aldre, der tager LEVAQUIN. Sener er hårde vævssnore, der forbinder muskler med knogler. Nogle seneproblemer omfatter:
- smerte
- hævelse
- rifter og hævelse af sener inklusive bagsiden af anklen (achilles), skulder, hånd eller andre senesteder.
- Risikoen for at få seneproblemer, mens du tager LEVAQUIN er højere, hvis du:
- er over 60 år
- har fået en nyre-, hjerte- eller lungetransplantation.
- Seneproblemer kan forekomme hos personer, der ikke har ovenstående risikofaktorer, når de tager LEVAQUIN.
- Andre årsager, der kan øge din risiko for seneproblemer, kan omfatte:
- fysisk aktivitet eller motion
- nyresvigt
- seneproblemer i fortiden, såsom hos mennesker med leddegigt (RA)
- Stop straks med at tage LEVAQUIN og få lægehjælp med det samme ved det første tegn på senesmerter, hævelse eller betændelse. Undgå træning og brug af det berørte område.
- Det mest almindelige område med smerte og hævelse er akillessenen på bagsiden af din ankel. Dette kan også ske med andre sener. Du kan få brug for et andet antibiotikum, der ikke er en fluoroquinolon til at behandle din infektion.
- Seneruptur kan ske, mens du tager eller efter du er færdig med at tage LEVAQUIN. Senerupturer kan ske inden for timer eller dage efter at have taget LEVAQUIN og er sket op til flere måneder efter, at folk er færdige med at tage deres fluorquinolon.
- Stop med at tage LEVAQUIN 750mg med det samme og få lægehjælp med det samme, hvis du får nogle af følgende tegn eller symptomer på en seneruptur:
- høre eller føle et snap eller et spring i et seneområde
- blå mærker lige efter en skade i et seneområde
- ude af stand til at flytte det berørte område eller bære vægt
- smerte
- brændende
- prikkende
- følelsesløshed
- svaghed
Nerveskaden kan være permanent.
- anfald
- høre stemmer, se ting eller fornemme ting, der ikke er der (hallucinationer)
- føle sig rastløs
- rystelser
- føler sig ængstelig eller nervøs
- forvirring
- depression
- problemer med at sove
- mareridt
- føler sig svimmel eller svimmel
- føle sig mere mistænksom (paranoia)
- selvmordstanker eller -handlinger
- hovedpine, der ikke vil forsvinde, med eller uden sløret syn
Hvad er LEVAQUIN?
LEVAQUIN 500mg er et fluoroquinolon-antibiotisk lægemiddel, der bruges til voksne i alderen 18 år eller ældre til at behandle visse infektioner forårsaget af visse bakterier kaldet bakterier. Disse bakterielle infektioner omfatter:
- nosokomiel lungebetændelse
- samfundserhvervet lungebetændelse
- hudinfektioner, komplicerede og ukomplicerede
- kronisk prostatainfektion
- indånding miltbrand bakterier
- pest
- urinvejsinfektioner, komplicerede og ukomplicerede
- akut nyreinfektion (pyelonefritis)
- akut sinusinfektion
- akut forværring eller kronisk bronkitis
Undersøgelser af LEVAQUIN til brug i behandlingen af pest og miltbrand blev kun udført hos dyr, fordi pest og miltbrand ikke kunne studeres hos mennesker.
LEVAQUIN bør ikke anvendes til patienter med ukomplicerede urinvejsinfektioner, akut bakteriel forværring af kronisk bronkitis eller akut bakteriel bihulebetændelse, hvis der er andre behandlingsmuligheder tilgængelige.
LEVAQUIN 750mg tabletter bruges også til at behandle børn, der vejer mindst 66 pund (eller mindst 30 kg) og kan have indåndet miltbrandbakterier, har pest eller været udsat for pestbakterier. Det vides ikke, om LEVAQUIN er sikkert og effektivt til børn under 6 måneder.
Sikkerheden og effektiviteten hos børn behandlet med LEVAQUIN® i mere end 14 dage kendes ikke.
Hvem bør ikke tage LEVAQUIN 750mg?
Tag ikke LEVAQUIN: hvis du nogensinde har haft en alvorlig allergisk reaktion på et antibiotikum kendt som en fluoroquinolon, eller hvis du er allergisk over for levofloxacin eller et af indholdsstofferne i LEVAQUIN. Se slutningen af denne indlægsseddel for en komplet liste over ingredienser i LEVAQUIN.
Inden du tager LEVAQUIN, skal du fortælle din læge om alle dine medicinske tilstande, inklusive hvis du:
- har seneproblemer; LEVAQUIN 250mg bør ikke anvendes til personer, der tidligere har haft seneproblemer.
- har et problem, der forårsager muskelsvaghed (myasthenia gravis); LEVAQUIN bør ikke anvendes til personer, som har en kendt historie med myasthenia gravis.
- har problemer med centralnervesystemet såsom anfald (epilepsi).
- har nerveproblemer; LEVAQUIN 250mg bør ikke anvendes til patienter, der tidligere har haft et nerveproblem kaldet perifer neuropati.
- har eller nogen i din familie har en uregelmæssig hjerterytme, især en tilstand kaldet "QT-forlængelse".
- har lavt kaliumindhold i blodet (hypokalæmi).
- har knogleproblemer.
- har ledproblemer, herunder leddegigt (RA).
- har nyreproblemer. Du kan få brug for en lavere dosis LEVAQUIN, hvis dine nyrer ikke fungerer godt.
- har leverproblemer.
- har diabetes eller problemer med lavt blodsukker (hypoglykæmi).
- er gravid eller planlægger at blive gravid. Det vides ikke, om LEVAQUIN 750mg vil skade dit ufødte barn.
- ammer eller planlægger at amme. Det vides ikke, om LEVAQUIN udskilles i din modermælk. Du og din læge bør beslutte, om du vil tage LEVAQUIN 250mg eller amme. Du bør ikke gøre begge dele.
Fortæl din læge om al den medicin, du tager, herunder receptpligtig og håndkøbsmedicin, vitaminer og naturlægemidler.
LEVAQUIN og anden medicin kan påvirke hinanden og forårsage bivirkninger.
Fortæl især din læge, hvis du tager:
- en steroid medicin.
- et antipsykotisk lægemiddel.
- et tricyklisk antidepressivum.
- en vandpille (vanddrivende).
- visse lægemidler kan forhindre LEVAQUIN 750mg i at virke korrekt. Tag LEVAQUIN® enten 2 timer før eller 2 timer efter du har taget disse lægemidler eller kosttilskud:
- et antacidum, multivitamin eller anden medicin eller kosttilskud, der indeholder magnesium, aluminium, jern eller zink
- sucralfat (Carafate®)
- didanosin (Videx®, Videx® EC)
- et blodfortyndende middel (warfarin, Coumadin, Jantoven).
- en oral anti-diabetes medicin eller insulin.
- et NSAID (Non-Steroidal Anti-inflammatory Drug). Mange almindelige lægemidler til smertelindring er NSAID'er. Hvis du tager et NSAID, mens du tager LEVAQUIN 250mg eller andre fluorquinoloner, kan det øge din risiko for påvirkninger af centralnervesystemet og anfald.
- theophyllin (Theo-24®, Elixophyllin®, Theochron®, Uniphyl®, Theolair®).
- et lægemiddel til at kontrollere din puls eller rytme (antiarytmika).
Spørg din sundhedsplejerske, hvis du ikke er sikker på, om nogen af dine lægemidler er anført ovenfor. Kend den medicin du tager. Hold en liste over dine lægemidler og vis den til din læge og apotek, når du får en ny medicin.
Hvordan skal jeg tage LEVAQUIN 500mg?
- Tag LEVAQUIN nøjagtigt som din læge fortæller dig at tage det.
- Tag LEVAQUIN 750 mg på omtrent samme tidspunkt hver dag.
- Drik rigeligt med væske, mens du tager LEVAQUIN.
- LEVAQUIN kan tages med eller uden mad.
- Hvis du glemmer en dosis LEVAQUIN 500 mg, skal du tage den, så snart du husker det. Tag ikke mere end 1 dosis på 1 dag.
- Spring ikke nogen doser af LEVAQUIN 750mg over eller stop med at tage det, selvom du begynder at få det bedre, før du er færdig med din ordinerede behandling, medmindre:
- du har seneproblemer. Se "Hvad er den vigtigste information, jeg bør vide om LEVAQUIN 500mg?".
- du har et nerveproblem. Se "Hvad er de mulige bivirkninger af LEVAQUIN?".
- du har et problem med centralnervesystemet. Se "Hvad er de mulige bivirkninger af LEVAQUIN 750mg?".
- du har en alvorlig allergisk reaktion. Se "Hvad er de mulige bivirkninger af LEVAQUIN 250mg?".
- din læge fortæller dig, at du skal stoppe med at tage LEVAQUIN.
At tage alle dine LEVAQUIN 500 mg doser vil hjælpe med at sikre, at alle bakterierne bliver dræbt. Hvis du tager alle dine LEVAQUIN 250 mg doser, vil det hjælpe dig med at mindske chancen for, at bakterierne bliver resistente over for LEVAQUIN. Hvis din infektion ikke bliver bedre, mens du tager LEVAQUIN 750mg, kan det betyde, at de bakterier, der forårsager din infektion, kan være resistente over for LEVAQUIN. Hvis din infektion ikke bliver bedre, skal du kontakte din læge. Hvis din infektion ikke bliver bedre, vil LEVAQUIN og andre lignende antibiotika muligvis ikke virke for dig i fremtiden.
- Hvis du tager for meget LEVAQUIN, skal du kontakte din læge eller få lægehjælp med det samme.
Hvad skal jeg undgå, mens jeg tager LEVAQUIN 500mg?
- LEVAQUIN kan få dig til at føle dig svimmel og svimmel. Lade være med køre bil, betjene maskiner eller udføre andre aktiviteter, der kræver mental årvågenhed eller koordination, indtil du ved, hvordan LEVAQUIN påvirker dig.
- Undgå sollamper, solarier, og prøv at begrænse din tid i solen. LEVAQUIN 750mg kan gøre din hud følsom over for solen (lysfølsomhed) og lyset fra sollamper og solarier. Du kan få alvorlig solskoldning, vabler eller hævelse af din hud. Hvis du får nogle af disse symptomer, mens du tager LEVAQUIN, skal du straks kontakte din læge. Du bør bruge en solcreme og have en hat og tøj på, der dækker din hud, hvis du skal være i sollys.
Hvad er de mulige bivirkninger af LEVAQUIN 750mg?
LEVAQUIN 750mg kan forårsage alvorlige bivirkninger, herunder:
- Se "Hvad er den vigtigste information, jeg bør vide om LEVAQUIN 250mg?"
- Alvorlige allergiske reaktioner.
Allergiske reaktioner kan forekomme hos personer, der tager fluorquinoloner, inklusive LEVAQUIN 500 mg, selv efter kun 1 dosis. Stop med at tage LEVAQUIN 500mg og få akut lægehjælp med det samme, hvis du har nogle af følgende symptomer på en alvorlig allergisk reaktion:
- nældefeber
- problemer med at trække vejret eller synke
- hævelse af læber, tunge, ansigt
- stramhed i halsen, hæshed
- hurtig hjerterytme
- svag
- udslæt
Hududslæt kan forekomme hos personer, der tager LEVAQUIN 500 mg, selv efter kun 1 dosis. Stop med at tage LEVAQUIN 250 mg ved det første tegn på hududslæt og ring straks til din læge. Hududslæt kan være et tegn på en mere alvorlig reaktion på LEVAQUIN.
- Leverskade (hepatotoksicitet): Hepatotoksicitet kan forekomme hos personer, der tager LEVAQUIN®. Ring til din læge med det samme, hvis du har uforklarlige symptomer som:
- kvalme eller opkastning
- mavesmerter
- feber
- svaghed
- mavesmerter eller ømhed
- kløe
- usædvanlig træthed
- mistet appetiten
- lyse afføringer
- mørk farvet urin
- gulfarvning af din hud eller det hvide i dine øjne
Stop med at tage LEVAQUIN 750mg og fortæl din læge med det samme, hvis du får gulfarvning af din hud eller hvide del af dine øjne, eller hvis du har mørk urin. Disse kan være tegn på en alvorlig reaktion på LEVAQUIN (et leverproblem).
- Tarminfektion (Pseudomembranøs colitis) Pseudomembranøs colitis kan forekomme med mange antibiotika, herunder LEVAQUIN. Ring til din læge med det samme, hvis du får vandig diarré, diarré, der ikke går væk, eller blodig afføring. Du kan have mavekramper og feber. Pseudomembranøs colitis kan forekomme 2 eller flere måneder efter, at du er færdig med din antibiotika.
- Alvorlige hjerterytmeændringer (QT-forlængelse og torsades depointes) Fortæl din læge med det samme, hvis du har en ændring i dit hjerteslag (en hurtig eller uregelmæssig hjerterytme), eller hvis du besvimer. LEVAQUIN 250 mg kan forårsage et sjældent hjerteproblem kendt som forlængelse af QT-intervallet. Denne tilstand kan forårsage en unormal hjerterytme og kan være meget farlig. Chancerne for at dette sker er højere hos mennesker:
- som er ældre
- med en familiehistorie med forlænget QT-interval
- med lavt kaliumindhold i blodet (hypokalæmi)
- som tager visse lægemidler for at kontrollere hjerterytmen (antiarytmika)
- Ledproblemer Øget chance for problemer med led og væv omkring led hos børn kan forekomme. Fortæl dit barns sundhedsplejerske, hvis dit barn har ledproblemer under eller efter behandling med LEVAQUIN.
- Ændringer i blodsukkeret Personer, der tager LEVAQUIN og anden fluoroquinolon-medicin sammen med oral medicin mod diabetes eller med insulin, kan få lavt blodsukker (hypoglykæmi) og højt blodsukker (hyperglykæmi). Følg din sundhedsudbyders instruktioner for, hvor ofte du skal kontrollere dit blodsukker. Hvis du har diabetes, og du får lavt blodsukker, mens du tager LEVAQUIN, skal du stoppe med at tage LEVAQUIN 500 mg og kontakte din læge med det samme. Din antibiotikamedicin skal muligvis ændres.
- Følsomhed over for sollys (lysfølsomhed) Se "Hvad skal jeg undgå, mens jeg tager LEVAQUIN?" De mest almindelige bivirkninger af LEVAQUIN 250mg omfatter:
- kvalme
- hovedpine
- diarré
- søvnløshed
- forstoppelse
- svimmelhed
Hos børn på 6 måneder og ældre, som tager LEVAQUIN til behandling af miltbrandsygdom eller pest, er opkastning også almindelig.
LEVAQUIN kan forårsage falsk positive urinscreeningsresultater for opiater, når testning udføres med nogle kommercielt tilgængelige kits. Et positivt resultat bør bekræftes ved hjælp af en mere specifik test. Disse er ikke alle de mulige bivirkninger af LEVAQUIN.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare LEVAQUIN 250mg?
- Opbevar LEVAQUIN 500mg ved stuetemperatur mellem 59°F til 86°F (15°C til 30°C).
- Opbevar LEVAQUIN 500mg i en tæt lukket beholder.
Generel information om sikker og effektiv brug af LEVAQUIN.
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en medicinvejledning. Brug ikke LEVAQUIN til en tilstand, som den ikke er ordineret til. Giv ikke LEVAQUIN 500 mg til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem. Denne medicinvejledning opsummerer de vigtigste oplysninger om LEVAQUIN. Hvis du ønsker mere information om LEVAQUIN 750mg, så tal med din læge. Du kan bede din sundhedsplejerske eller apotek om oplysninger om LEVAQUIN 500mg, der er skrevet til sundhedspersonale.
Hvad er ingredienserne i LEVAQUIN 500mg?
Aktiv ingrediens: levofloxacin
Inaktive ingredienser : crospovidon, hypromellose, magnesiumstearat, mikrokrystallinsk cellulose, polyethylenglycol, polysorbat 80, titaniumdioxid.
LEVAQUIN 250 mg tabletter indeholder også syntetisk rødt jernoxid.
LEVAQUIN 500 mg tabletter indeholder også syntetisk rød jernoxid og syntetisk gul jernoxid.
Denne medicinvejledning er godkendt af US Food and Drug Administration
