Omnicef 300mg Cefdinir Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Omnicef, og hvordan bruges det?
Omnicef (cefdinir) er et cephalosporin-antibiotikum, der bruges til at behandle mange forskellige typer infektioner forårsaget af bakterier. Varemærket Omnicef er udgået i USA. Omnicef er tilgængelig i generisk form.
Hvad er bivirkninger af Omnicef?
Almindelige bivirkninger af Omnicef 300mg omfatter:
- diarré,
- kvalme,
- opkastning,
- mavesmerter,
- dårlig fordøjelse,
- hovedpine,
- svimmelhed,
- bleudslæt hos et spædbarn, der tager flydende cefdinir,
- kløe, eller
- udslæt,
Bemærk: Denne liste indeholder muligvis ikke alle mulige bivirkninger.
For at reducere udviklingen af lægemiddelresistente bakterier og bevare effektiviteten af OMNICEF 300mg og andre antibakterielle lægemidler, bør OMNICEF kun bruges til at behandle eller forebygge infektioner, der er bevist eller stærkt mistænkt for at være forårsaget af bakterier.
BESKRIVELSE
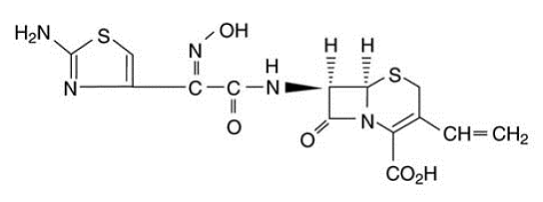
OMNICEF (cefdinir) kapsler og OMNICEF (cefdinir) til oral suspension indeholder den aktive ingrediens cefdinir, et udvidet spektrum, semisyntetisk cephalosporin, til oral administration. Kemisk er cefdinir [6R-[6α, 7β (Z)]]-7-[[(2-amino-4-thiazolyl)(hydroxyimino)acetyl]amino]3-ethenyl-8-oxo-5-thia-1 -azabicyclo[4.2.0]oct-2-en-2-carboxylsyre. Cefdinir er et hvidt til let brungult fast stof. Det er let opløseligt i fortyndet saltsyre og tungtopløseligt i 0,1 M pH 7,0 fosfatbuffer. Den empiriske formel er C14H13N5O5S2 og molekylvægten er 395,42. Cefdinir har strukturformlen vist nedenfor:
OMNICEF 300 mg kapsler indeholder 300 mg cefdinir og følgende inaktive ingredienser: carboxymethylcellulose calcium, NF; polyoxyl 40 stearat, NF; og magnesiumstearat, NF. Kapselskallerne indeholder FD&C Blue #1; FD&C Rød #40; D&C Rød #28; titaniumdioxid, NF; gelatine, NF; siliciumdioxid, NF; og natriumlaurylsulfat, NF.
OMNICEF 300 mg til oral suspension, efter rekonstitution, indeholder 125 mg cefdinir pr. 5 ml eller 250 mg cefdinir pr. 5 ml og følgende inaktive ingredienser: saccharose, NF; citronsyre, USP; natriumcitrat, USP; natriumbenzoat, NF; xanthangummi, NF; guargummi, NF; kunstige jordbær- og flødesmagsstoffer; siliciumdioxid, NF; og magnesiumstearat, NF.
INDIKATIONER
For at reducere udviklingen af lægemiddelresistente bakterier og bevare effektiviteten af OMNICEF 300mg og andre antibakterielle lægemidler, bør OMNICEF 300mg kun bruges til at behandle eller forebygge infektioner, der er bevist eller stærkt mistænkt for at være forårsaget af modtagelige bakterier. Når kultur- og modtagelighedsoplysninger er tilgængelige, bør de overvejes ved udvælgelse eller ændring af antibakteriel behandling. I mangel af sådanne data kan lokal epidemiologi og modtagelighedsmønstre bidrage til den empiriske udvælgelse af terapi.
OMNICEF (cefdinir) kapsler og OMNICEF (cefdinir) til oral suspension er indiceret til behandling af patienter med milde til moderate infektioner forårsaget af modtagelige stammer af de udpegede mikroorganismer under de nedenfor anførte tilstande.
Voksne og unge
Samfundserhvervet lungebetændelse
forårsaget af Haemophilus influenzae (herunder β-lactamase-producerende stammer), Haemophilus parainfluenzae (herunder β-lactamase-producerende stammer), Streptococcus pneumoniae (kun penicillin-modtagelige stammer) og Moraxella catarrhalis (β-lactamase-producerende stammer) og Moraxella catarrhalis- Kliniske Studier ).
Akutte eksacerbationer af kronisk bronkitis
forårsaget af Haemophilus influenzae (herunder β-lactamase-producerende stammer), Haemophilus parainfluenzae (herunder β-lactamase-producerende stammer), Streptococcus pneumoniae (kun penicillin-modtagelige stammer) og Moraxella catarrhalis-stammer (β-lactamase-producerende stammer).
Akut Maxillær Bihulebetændelse
forårsaget af Haemophilus influenzae (herunder β-lactamase-producerende stammer), Streptococcus pneumoniae (kun penicillin-modtagelige stammer) og Moraxella catarrhalis (herunder βlactamase-producerende stammer).
BEMÆRK: For information om brug til pædiatriske patienter, se Pædiatrisk brug og DOSERING OG ADMINISTRATION .
Pharyngitis/Tonsillitis
forårsaget af Streptococcus pyogenes (se Kliniske Studier ).
BEMÆRK: Cefdinir er effektivt til udryddelse af S. pyogenes fra oropharynx. Cefdinir er dog ikke blevet undersøgt til forebyggelse af gigtfeber efter S. pyogenes pharyngitis/tonsillitis. Kun intramuskulær penicillin har vist sig at være effektiv til forebyggelse af gigtfeber.
Ukomplicerede hud- og hudstrukturinfektioner
forårsaget af Staphylococcus aureus (herunder β-lactamase-producerende stammer) og Streptococcus pyogenes.
Pædiatriske patienter
Akut bakteriel mellemørebetændelse forårsaget af Haemophilus influenzae (herunder β-lactamase-producerende stammer), Streptococcus pneumoniae (kun penicillin-modtagelige stammer) og Moraxella catarrhalis (herunder β-lactamase-producerende stammer).
Pharyngitis/Tonsillitis
forårsaget af Streptococcus pyogenes (se Kliniske Studier ).
BEMÆRK: Cefdinir er effektivt til udryddelse af S. pyogenes fra oropharynx. Cefdinir er dog ikke blevet undersøgt til forebyggelse af gigtfeber efter S. pyogenes pharyngitis/tonsillitis. Kun intramuskulær penicillin har vist sig at være effektiv til forebyggelse af gigtfeber.
Ukomplicerede hud- og hudstrukturinfektioner
forårsaget af Staphylococcus aureus (herunder β-lactamase-producerende stammer) og Streptococcus pyogenes.
DOSERING OG ADMINISTRATION
(se INDIKATIONER OG BRUG til Indikerede patogener )
Kapsler
Den anbefalede dosis og behandlingsvarighed for infektioner hos voksne og unge er beskrevet i følgende skema; den samlede daglige dosis for alle infektioner er 600 mg. Dosering én gang dagligt i 10 dage er lige så effektiv som to gange daglig dosering. Dosering én gang dagligt er ikke blevet undersøgt ved lungebetændelse eller hudinfektioner; derfor bør OMNICEF kapsler administreres to gange dagligt ved disse infektioner. OMNICEF kapsler kan tages uden hensyntagen til måltider.
Voksne og unge (13 år og ældre)
Pulver til oral suspension
Den anbefalede dosis og behandlingsvarighed for infektioner hos pædiatriske patienter er beskrevet i følgende skema; den samlede daglige dosis for alle infektioner er 14 mg/kg, op til en maksimal dosis på 600 mg pr. dag. Dosering én gang dagligt i 10 dage er lige så effektiv som to gange daglig dosering. Dosering én gang dagligt er ikke undersøgt ved hudinfektioner; derfor bør OMNICEF 300 mg til oral suspension administreres to gange dagligt ved denne infektion. OMNICEF for oral suspension kan administreres uden hensyntagen til måltider.
Pædiatriske patienter (alder fra 6 måneder til 12 år)
OMNICEF FOR ORAL SUSPENSION PÆDIATRISK DOSERINGSKEMA
Patienter med nyreinsufficiens
Til voksne patienter med kreatininclearance
Kreatininclearance er vanskelig at måle hos ambulante patienter. Imidlertid kan følgende formel bruges til at estimere kreatininclearance (CLcr) hos voksne patienter. For at estimaterne er valide, bør serumkreatininniveauer afspejle steady-state niveauer af nyrefunktion.
hvor kreatininclearance er i ml/min, alder er i år, vægt er i kilogram, og serumkreatinin er i mg/dL.4
Følgende formel kan bruges til at estimere kreatininclearance hos pædiatriske patienter:
CLcr = K × kropslængde eller højde/serumkreatinin
hvor K = 0,55 for pædiatriske patienter ældre end 1 år5 og 0,45 for spædbørn (op til 1 år)6.
I ovenstående ligning er kreatininclearance i ml/min/1,73 m², kropslængde eller højde er i centimeter, og serumkreatinin er i mg/dL.
Til pædiatriske patienter med en kreatininclearance på
Patienter i hæmodialyse
Hæmodialyse fjerner cefdinir fra kroppen. Hos patienter, der er i kronisk hæmodialyse, er den anbefalede initiale dosis en dosis på 300 mg eller 7 mg/kg hver anden dag.
Ved afslutningen af hver hæmodialysesession skal der gives 300 mg (eller 7 mg/kg). Efterfølgende doser (300 mg eller 7 mg/kg) indgives derefter hver anden dag.
Vejledning til blanding af Omnicef 300mg til oral suspension
Efter blanding kan suspensionen opbevares ved stuetemperatur (25°C/77°F). Beholderen skal holdes tæt lukket, og suspensionen skal rystes godt før hver administration. Suspensionen kan bruges i 10 dage, hvorefter eventuel ubrugt portion skal kasseres.
HVORDAN LEVERET
OMNICEF kapsler , indeholdende 300 mg cefdinir, som lavendel og turkis kapsler påtrykt produktnavnet, er tilgængelige som følger:
60 kapsler/flaske NDC 0074-3769-60 OMNI-PAC™ karton med 3-brugsenheder, 5-dages, 10-kapsler blisterkort NDC 0074-3769-30
OMNICEF 300mg til oral suspension er en cremefarvet pulverformulering, der, når den er rekonstitueret som anvist, indeholder 125 mg cefdinir/5 ml eller 250 mg cefdinir/5 ml. De rekonstituerede suspensioner har en cremefarve og jordbærsmag. Pulveret fås som følger:
125 mg/5 ml
60 ml flasker NDC 0074-3771-60 100 ml flasker NDC 0074-3771-13 250 mg/5 mL 60 mL flasker NDC 0074-6151-60 100 ml flasker NDC 0074-6151-13
Opbevar kapslerne og det ususpenderede pulver ved 25°C (77°F); udflugter tilladt til 15°-30°C (59°-86°F) [se USP kontrolleret rumtemperatur]. Efter rekonstituering kan den orale suspension opbevares ved kontrolleret stuetemperatur i 10 dage.
Fremstillet af: CEPH International Corporation Carolina, Puerto Rico 00986. For: AbbVie Inc., North Chicago, IL 60064, USA, under licens fra: Astellas Pharma Inc. Tokyo, Japan. Revideret nov 2015
BIVIRKNINGER
Uønskede hændelser
Kliniske forsøg - OMNICEF kapsler (voksne og unge patienter)
I kliniske undersøgelser blev 5093 voksne og unge patienter (3841 amerikanske og 1252 ikke-amerikanske) behandlet med den anbefalede dosis cefdinir-kapsler (600 mg/dag). De fleste bivirkninger var milde og selvbegrænsende. Ingen dødsfald eller permanente handicap blev tilskrevet cefdinir. Et hundrede og syvogfyrre af 5093 (3%) patienter ophørte med medicinering på grund af uønskede hændelser, som efterforskerne mente at være muligvis, sandsynligvis eller helt sikkert forbundet med cefdinir-behandling. Seponeringerne skyldtes primært mave-tarmforstyrrelser, normalt diarré eller kvalme. Nitten ud af 5093 (0,4%) patienter blev seponeret på grund af udslæt, der var relateret til administration af cefdinir.
I USA blev følgende bivirkninger af efterforskerne anset for at være muligvis, sandsynligvis eller definitivt relateret til cefdinir-kapsler i kliniske forsøg med flere doser (N = 3841 cefdinir-behandlede patienter):
BIVIRKNINGER I FORBINDELSE MED CEFDINIR KAPSULER USA FORSØG HOS VOKSNE OG UNGE PATIENTER (N = 3841)a
Følgende ændringer i laboratorieværdier af mulig klinisk betydning, uanset forholdet til behandling med cefdinir, blev set under kliniske forsøg udført i USA:
LABORATORIEVÆRDIÆNDRINGER OBSERVERET MED CEFDINIR-KAPSLER USA FORSØG HOS VOKSNE OG UNGE PATIENTER (N = 3841)
Kliniske forsøg - OMNICEF for oral suspension (pædiatriske patienter)
kliniske forsøg blev 2289 pædiatriske patienter (1783 amerikanske og 506 ikke-US) behandlet med den anbefalede dosis cefdinirsuspension (14 mg/kg/dag). De fleste bivirkninger var milde og selvbegrænsende. Ingen dødsfald eller permanente handicap blev tilskrevet cefdinir. Fyrre af 2289 (2 %) patienter ophørte med medicinering på grund af bivirkninger, som efterforskerne anså for at være muligvis, sandsynligvis eller definitivt forbundet med cefdinir-behandling. Afbrydelser skyldtes primært mave-tarmforstyrrelser, sædvanligvis diarré. Fem ud af 2289 (0,2%) patienter blev seponeret på grund af udslæt, der var relateret til administration af cefdinir.
I USA mente efterforskerne følgende bivirkninger muligvis, sandsynligvis eller definitivt relateret til cefdinir-suspension i kliniske forsøg med flere doser (N = 1783 cefdinirbehandlede patienter):
BIVIRKNINGER I FORBINDELSE MED CEFDINIR SUSPENSION US FORSØG I PÆDIATRISKE PATIENTER (N = 1783)a
BEMÆRK: Hos både cefdinir- og kontrolbehandlede patienter var hyppigheden af diarré og udslæt højere hos de yngste pædiatriske patienter. Forekomsten af diarré hos cefdinir-behandlede patienter ≤ 2 år var 17 % (95/557) sammenlignet med 4 % (51/1226) hos patienter > 2 år. Hyppigheden af udslæt (primært bleudslæt hos de yngre patienter) var 8 % (43/557) hos patienter ≤ 2 år sammenlignet med 1 % (8/1226) hos dem > 2 år.
Følgende ændringer i laboratorieværdier af mulig klinisk betydning, uanset forholdet til behandling med cefdinir, blev set under kliniske forsøg udført i USA:
LABORATORIEVÆRDIÆNDRINGER AF MULIG KLINISK BETYDNING OBSERVERET MED CEFDINIR SUSPENSION US FORSØG I PÆDIATRISKE PATIENTER (N = 1783)
Postmarketing oplevelse
Følgende bivirkninger og ændrede laboratorietests, uanset deres forhold til cefdinir, er blevet rapporteret under omfattende postmarketing-erfaringer, begyndende med godkendelse i Japan i 1991: shock, anafylaksi med sjældne tilfælde af dødsfald, ansigts- og larynxødem, følelse af kvælning, serumsygelignende reaktioner, conjunctivitis, stomatitis, Stevens-Johnsons syndrom, toksisk epidermal nekrolyse, eksfoliativ dermatitis, erythema multiforme, erythema nodosum, akut hepatitis, kolestase, fulminant hepatitis, leversvigt, gulsot, forhøjet dicolaritis i blodet, øget dicolaritis i blodet, hæmoragisk colitis, melena, pseudomembranøs colitis, pancytopeni, granulocytopeni, leukopeni, trombocytopeni, idiopatisk trombocytopenisk purpura, hæmolytisk anæmi, akut respirationssvigt, astmatisk anfald, lægemiddel-induceret lungebetændelse, eosinofil pneumoni, eosinofil pneumoni, eosinofil pneumoni, idiopathyneumonial pneumoni, eosinofil pneumonie blødningstendens, koagulationsdis orden, dissemineret intravaskulær koagulation, øvre GI-blødning, mavesår, ileus, bevidsthedstab, allergisk vaskulitis, mulig cefdinir-diclofenac interaktion, hjertesvigt, brystsmerter, myokardieinfarkt, hypertension, ufrivillige bevægelser og rhabdomyolyse.
Bivirkninger i cephalosporinklassen
Følgende bivirkninger og ændrede laboratorietests er blevet rapporteret for antibiotika i cephalosporinklassen generelt:
Allergiske reaktioner, anafylaksi, Stevens-Johnsons syndrom, erythema multiforme, toksisk epidermal nekrolyse, nyreinsufficiens, toksisk nefropati, leverdysfunktion inklusive kolestase, aplastisk anæmi, hæmolytisk anæmi, blødning, urinær-positiv test, urin-positiv test, p-granulocytose, psykiatriske blodprøver . Pseudomembranøs colitis symptomer kan begynde under eller efter antibiotikabehandling (se ADVARSLER ).
Adskillige cephalosporiner har været impliceret i at udløse anfald, især hos patienter med nedsat nyrefunktion, når dosis ikke blev reduceret (se DOSERING OG ADMINISTRATION og OVERDOSERING ). Hvis der opstår anfald i forbindelse med lægemiddelbehandling, skal lægemidlet seponeres. Antikonvulsiv behandling kan gives, hvis det er klinisk indiceret.
DRUGSINTERAKTIONER
Antacida (aluminium- eller magnesiumholdig)
Samtidig administration af 300 mg cefdinir-kapsler med 30 ml Maalox® TC-suspension reducerer absorptionshastigheden (Cmax) og omfanget (AUC) med ca. 40 %. Tiden til at nå Cmax forlænges også med 1 time. Der er ingen signifikant effekt på cefdinirs farmakokinetik, hvis antacida administreres 2 timer før eller 2 timer efter cefdinir. Hvis antacida er påkrævet under behandling med OMNICEF 300 mg, skal OMNICEF 300 mg tages mindst 2 timer før eller efter antacida.
Probenecid
Som med andre β-lactam-antibiotika hæmmer probenecid den renale udskillelse af cefdinir, hvilket resulterer i en omtrentlig fordobling i AUC, en 54 % stigning i peak cefdinir plasmaniveauer og en 50 % forlængelse af den tilsyneladende elimination t½.
Jerntilskud og fødevarer beriget med jern
Samtidig administration af cefdinir med et terapeutisk jerntilskud indeholdende 60 mg elementært jern (som FeSO4) eller vitaminer suppleret med 10 mg elementært jern reducerede absorptionsgraden med henholdsvis 80% og 31%. Hvis jerntilskud er påkrævet under OMNICEF 300 mg-behandling, skal OMNICEF tages mindst 2 timer før eller efter tilskuddet.
Effekten af fødevarer stærkt beriget med elementært jern (primært jernberigede morgenmadsprodukter) på cefdinirabsorption er ikke blevet undersøgt.
Samtidig indgivet jernberiget modermælkserstatning (2,2 mg elementært jern/6 oz) har ingen signifikant effekt på cefdinirs farmakokinetik. Derfor kan OMNICEF for oral suspension administreres med jernberiget modermælkserstatning.
Der har været rapporter om rødlig afføring hos patienter, der fik cefdinir. I mange tilfælde fik patienterne også jernholdige produkter. Den rødlige farve skyldes dannelsen af et ikke-absorberbart kompleks mellem cefdinir eller dets nedbrydningsprodukter og jern i mave-tarmkanalen.
Interaktioner med lægemiddel/laboratorietest
En falsk-positiv reaktion for ketoner i urinen kan forekomme med tests med nitroprussid, men ikke med dem der bruger nitroferricyanid. Administration af cefdinir kan resultere i en falsk positiv reaktion for glukose i urinen ved brug af Clinitest®, Benedicts opløsning eller Fehlings opløsning. Det anbefales, at der anvendes glukosetest baseret på enzymatiske glucoseoxidase-reaktioner (såsom Clinistix® eller Tes-Tape®). Cephalosporiner er kendt for lejlighedsvis at inducere en positiv direkte Coombs' test.
ADVARSLER
FØR BEHANDLING MED OMNICEF (CEFDINIR) INSTITUTES, SKAL DER FORETAGES OMNYGGELIG FORESPØRGSEL FOR AT BESTEMME, OM PATIENTEN HAR HAVET TIDLIGERE OVERfølsomhedsreaktioner på CEFDINIR, ANDRE CEFALOSPORINER, PENICILLER. HVIS CEFDINIR SKAL GIVES TIL PENICILLIN-SENSITIVE PATIENTER, BØR UDØVES FORSIGTIGHED, FORDI KRYDS-OVERSENSITIVITET BLANDT β-LACTAM-ANTIBIOTIKA ER VÆRET KLART DOKUMENTET OG KAN FOREKOMME I 10% OP TIL EN PHI. HVIS EN ALLERGISK REAKTION OVER FOR CEFDINIR OPKOMST, SKAL GENNEMFØRELSEN AFHØRES. ALVORLIGE AKUTTE OVERfølsomhedsreaktioner KAN KRÆVE BEHANDLING MED EPINEFRIN OG ANDRE NØDFORANSTALTNINGER, HERUNDER ILT, INTRAVENØSE VÆSKER, INTRAVENØSE ANTIHISTAMINER, CORTICOSTEROIDER, PRESSOR-AMINATE, PRESSOR AMINAT.
Clostridium difficile associeret diarré (CDAD) er blevet rapporteret ved brug af næsten alle antibakterielle midler, inklusive OMNICEF, og kan variere i sværhedsgrad fra mild diarré til fatal colitis. Behandling med antibakterielle midler ændrer den normale flora i tyktarmen, hvilket fører til overvækst af C. difficile.
C. difficile producerer toksinerne A og B, som bidrager til udviklingen af CDAD. Hypertoksinproducerende stammer af C. difficile forårsager øget morbiditet og dødelighed, da disse infektioner kan være modstandsdygtige over for antimikrobiel behandling og kan kræve kolektomi. CDAD skal overvejes hos alle patienter, som får diarré efter antibakteriel brug. Omhyggelig sygehistorie er nødvendig, da CDAD er blevet rapporteret at forekomme over to måneder efter administration af antibakterielle midler.
Hvis CDAD er mistænkt eller bekræftet, kan det være nødvendigt at afbryde igangværende antibakteriel brug, der ikke er rettet mod C. difficile. Passende væske- og elektrolytbehandling, proteintilskud, antibakteriel behandling af C. difficile og kirurgisk evaluering bør iværksættes som klinisk indiceret.
FORHOLDSREGLER
Generel
Udskrivning af OMNICEF 300 mg i fravær af en påvist eller stærkt mistænkt bakteriel infektion eller en profylaktisk indikation vil næppe give gavn for patienten og øger risikoen for udvikling af lægemiddelresistente bakterier.
Som med andre bredspektrede antibiotika kan langvarig behandling resultere i mulig fremkomst og overvækst af resistente organismer. Omhyggelig observation af patienten er afgørende. Hvis der opstår superinfektion under behandlingen, bør passende alternativ behandling gives.
Cefdinir bør, som med andre bredspektrede antimikrobielle stoffer (antibiotika), ordineres med forsigtighed til personer med en historie med colitis.
Hos patienter med forbigående eller vedvarende nyreinsufficiens (kreatininclearance DOSERING OG ADMINISTRATION ).
Karcinogenese, mutagenese, svækkelse af fertilitet
Det karcinogene potentiale af cefdinir er ikke blevet evalueret. Ingen mutagene virkninger blev set i bakteriel omvendt mutationsanalyse (Ames) eller punktmutationsanalyse ved hypoxanthin-guanin phosphoribosyltransferase locus (HGPRT) i V79 kinesisk hamster lungeceller. Der blev ikke observeret klastogene effekter in vitro i det strukturelle kromosomafvigelsesassay i V79 kinesisk hamster-lungeceller eller in vivo i mikronukleusassayet i museknoglemarv. Hos rotter blev fertilitet og reproduktionsevne ikke påvirket af cefdinir ved orale doser op til 1000 mg/kg/dag (70 gange den humane dosis baseret på mg/kg/dag, 11 gange baseret på mg/m²/dag).
Graviditet
Teratogene virkninger
Graviditetskategori B
Cefdinir var ikke teratogent hos rotter ved orale doser op til 1000 mg/kg/dag (70 gange den humane dosis baseret på mg/kg/dag, 11 gange baseret på mg/m²/dag) eller hos kaniner ved orale doser op til 10 mg/kg/dag (0,7 gange den humane dosis baseret på mg/kg/dag, 0,23 gange baseret på mg/m²/dag). Maternel toksicitet (nedsat vægtøgning) blev observeret hos kaniner ved den maksimalt tolererede dosis på 10 mg/kg/dag uden bivirkninger på afkommet. Nedsat kropsvægt forekom hos rottefostre ved ≥ 100 mg/kg/dag og hos rotteafkom ved ≥ 32 mg/kg/dag. Der blev ikke observeret nogen effekter på moderens reproduktionsparametre eller afkoms overlevelse, udvikling, adfærd eller reproduktionsfunktion.
Der er dog ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder. Da reproduktionsstudier på dyr ikke altid forudsiger human respons, bør dette lægemiddel kun anvendes under graviditet, hvis det er klart nødvendigt.
Arbejde og levering
Cefdinir er ikke blevet undersøgt til brug under veer og fødsel.
Ammende mødre
Efter administration af enkeltdoser på 600 mg blev cefdinir ikke påvist i human modermælk.
Pædiatrisk brug
Sikkerhed og effekt hos nyfødte og spædbørn under 6 måneder er ikke blevet fastlagt. Brug af cefdinir til behandling af akut maksillær bihulebetændelse hos pædiatriske patienter (i alderen 6 måneder til 12 år) understøttes af beviser fra tilstrækkelige og velkontrollerede undersøgelser hos voksne og unge, den lignende patofysiologi af akut bihulebetændelse hos voksne og pædiatriske patienter, og sammenlignende farmakokinetiske data i den pædiatriske population.
Geriatrisk brug
Effekten er sammenlignelig hos geriatriske patienter og yngre voksne. Mens cefdinir er blevet veltolereret i alle aldersgrupper, oplevede geriatriske patienter i kliniske forsøg en lavere frekvens af bivirkninger, herunder diarré, end yngre voksne. Dosisjustering hos ældre patienter er ikke nødvendig, medmindre nyrefunktionen er markant kompromitteret (se DOSERING OG ADMINISTRATION ).
OVERDOSIS
Information om overdosering af cefdinir hos mennesker er ikke tilgængelig. I akutte gnavertoksicitetsundersøgelser gav en enkelt oral dosis på 5600 mg/kg ingen bivirkninger. Toksiske tegn og symptomer efter overdosering med andre β-lactam-antibiotika har omfattet kvalme, opkastning, epigastrisk nød, diarré og kramper. Hæmodialyse fjerner cefdinir fra kroppen. Dette kan være nyttigt i tilfælde af en alvorlig toksisk reaktion fra overdosering, især hvis nyrefunktionen er kompromitteret.
KONTRAINDIKATIONER
OMNICEF (cefdinir) er kontraindiceret til patienter med kendt allergi over for cephalosporinklassen af antibiotika.
KLINISK FARMAKOLOGI
Farmakokinetik og lægemiddelmetabolisme
Absorption
Oral biotilgængelighed
Maksimale plasmakoncentrationer af cefdinir forekommer 2 til 4 timer efter dosering efter indgivelse af kapsel eller suspension. Plasma-cefdinirkoncentrationer stiger med dosis, men stigningerne er mindre end dosisproportionale fra 300 mg (7 mg/kg) til 600 mg (14 mg/kg). Efter administration af suspension til raske voksne er cefdinirs biotilgængelighed 120 % i forhold til kapsler. Estimeret biotilgængelighed af cefdinir-kapsler er 21 % efter administration af en 300 mg kapseldosis og 16 % efter administration af en 600 mg kapseldosis. Estimeret absolut biotilgængelighed af cefdinirsuspension er 25 %. Cefdinir oral suspension på 250 mg/5 ml styrke blev vist at være bioækvivalent med styrken på 125 mg/5 ml hos raske voksne under fastende forhold.
Effekt af mad
Cmax og AUC for cefdinir fra kapslerne reduceres med henholdsvis 16 % og 10 %, når det gives sammen med et fedtrigt måltid. Hos voksne, der får 250 mg/5 ml oral suspension sammen med et fedtrigt måltid, er Cmax og AUC for cefdinir reduceret med henholdsvis 44 % og 33 %. Størrelsen af disse reduktioner er sandsynligvis ikke klinisk signifikante, fordi sikkerheds- og virkningsundersøgelserne af oral suspension hos pædiatriske patienter blev udført uden hensyntagen til fødeindtagelse. Derfor kan cefdinir tages uden hensyntagen til mad.
Cefdinir kapsler
Cefdinir plasmakoncentrationer og farmakokinetiske parameterværdier efter administration af enkelt 300- og 600 mg orale doser af cefdinir til voksne personer er vist i følgende tabel:
Gennemsnitlige (± SD) plasma Cefdinir farmakokinetiske parameterværdier efter administration af kapsler til voksne forsøgspersoner
Cefdinir Suspension
Cefdinir plasmakoncentrationer og farmakokinetiske parameterværdier efter administration af enkeltstående 7- og 14 mg/kg orale doser af cefdinir til pædiatriske forsøgspersoner (i alderen 6 måneder-12 år) er vist i følgende tabel:
Gennemsnitlige (± SD) plasma Cefdinir farmakokinetiske parameterværdier efter administration af suspension til pædiatriske forsøgspersoner
Multipel dosering
Cefdinir akkumuleres ikke i plasma efter administration én eller to gange dagligt til personer med normal nyrefunktion.
Fordeling
Det gennemsnitlige distributionsvolumen (Vdarea) af cefdinir hos voksne er 0,35 l/kg (± 0,29); hos pædiatriske forsøgspersoner (6 måneder-12 år) er cefdinir Vdarea 0,67 l/kg (± 0,38). Cefdinir er 60 % til 70 % bundet til plasmaproteiner hos både voksne og pædiatriske forsøgspersoner; binding er uafhængig af koncentration.
Hudblister
Hos voksne forsøgspersoner blev median (interval) maksimal blistervæske cefdinir-koncentrationer på 0,65 (0,33-1,1) og 1,1 (0,49-1,9) μg/ml observeret 4 til 5 timer efter administration af henholdsvis 300- og 600 mg doser. Gennemsnitlige (± SD) blister Cmax og AUC (0-∞) værdier var 48 % (± 13) og 91 % (± 18) af tilsvarende plasmaværdier.
Tonsilvæv
Hos voksne patienter, der gennemgår elektiv tonsillektomi, var de respektive mediane cefdinir-koncentrationer i tonsilvæv 4 timer efter administration af enkeltdoser på 300 og 600 mg 0,25 (0,220,46) og 0,36 (0,22-0,80) μg/g. Gennemsnitlige tonsilvævskoncentrationer var 24 % (± 8) af tilsvarende plasmakoncentrationer.
Sinus væv
Hos voksne patienter, der gennemgår elektiv maksillær og ethmoid sinuskirurgi, var de respektive mediane cefdinir-koncentrationer i sinusvæv 4 timer efter administration af enkeltdoser på 300 og 600 mg
Lungevæv
Hos voksne patienter, der gennemgår diagnostisk bronkoskopi, var de respektive mediane koncentrationer af bronchial mucosa cefdinir 4 timer efter administration af enkeltdoser på 300 og 600 mg 0,78 (
Mellemørevæske
Hos 14 pædiatriske patienter med akut bakteriel mellemørebetændelse var de respektive mediane mellemørevæske-cefdinir-koncentrationer 3 timer efter administration af enkeltdoser på 7 og 14 mg/kg 0,21 (
CSF
Data om cefdinir-penetration i human cerebrospinalvæske er ikke tilgængelige.
Metabolisme og udskillelse
Cefdinir metaboliseres ikke nævneværdigt. Aktivitet skyldes primært modermiddel. Cefdinir elimineres hovedsageligt via renal udskillelse med en gennemsnitlig plasmaelimineringshalveringstid (t½) på 1,7 (± 0,6) timer. Hos raske forsøgspersoner med normal nyrefunktion er nyreclearance 2,0 (± 1,0) mL/min/kg, og tilsyneladende oral clearance er 11,6 (± 6,0) og 15,5 (± 5,4) mL/min/kg efter doser på 300- og 600 -mg, henholdsvis. Gennemsnitlig procentdel af dosis, der genfindes uændret i urinen efter 300- og 600-mg-doser, er henholdsvis 18,4 % (± 6,4) og 11,6 % (± 4,6). Cefdinir-clearance er reduceret hos patienter med nedsat nyrefunktion (se Særlige Populationer - Patienter med nyreinsufficiens ).
Da renal udskillelse er den dominerende eliminationsvej, bør dosis justeres hos patienter med markant kompromitteret nyrefunktion, eller som gennemgår hæmodialyse (se DOSERING OG ADMINISTRATION ).
Særlige Populationer
Patienter med nyreinsufficiens
Cefdinirs farmakokinetik blev undersøgt hos 21 voksne forsøgspersoner med varierende grader af nyrefunktion. Fald i cefdinir-eliminationshastighed, tilsyneladende oral clearance (CL/F) og renal clearance var tilnærmelsesvis proportional med reduktionen i kreatininclearance (CLcr). Som følge heraf var plasmakoncentrationen af cefdinir højere og varede længere hos personer med nedsat nyrefunktion end hos personer uden nedsat nyrefunktion. Hos personer med CLcr mellem 30 og 60 ml/min. steg Cmax og t½ med ca. 2 gange og AUC ca. 3 gange. Hos forsøgspersoner med CLcr DOSERING OG ADMINISTRATION ).
Hæmodialyse
Cefdinirs farmakokinetik blev undersøgt hos 8 voksne forsøgspersoner, der gennemgår hæmodialyse. Dialyse (4 timers varighed) fjernede 63 % af cefdinir fra kroppen og reducerede tilsyneladende elimination t½ fra 16 (± 3,5) til 3,2 (± 1,2) timer. Dosisjustering anbefales til denne patientpopulation (se DOSERING OG ADMINISTRATION ).
Hepatisk sygdom
Da cefdinir overvejende elimineres renalt og ikke metaboliseres nævneværdigt, blev der ikke udført undersøgelser af patienter med nedsat leverfunktion. Det forventes ikke, at dosisjustering vil være nødvendig i denne population.
Geriatriske patienter
Effekten af alder på cefdinirs farmakokinetik efter en enkelt dosis på 300 mg blev evalueret hos 32 forsøgspersoner i alderen 19 til 91 år. Systemisk eksponering for cefdinir var væsentligt øget hos ældre forsøgspersoner (N = 16), Cmax med 44 % og AUC med 86 %. Denne stigning skyldtes en reduktion i cefdinir-clearance. Det tilsyneladende distributionsvolumen blev også reduceret, hvorfor der ikke blev observeret nogen nævneværdige ændringer i tilsyneladende elimination t½ (ældre: 2,2 ± 0,6 timer vs. unge: 1,8 ± 0,4 timer). Da cefdinir-clearance har vist sig at være primært relateret til ændringer i nyrefunktionen snarere end alder, behøver ældre patienter ikke dosisjustering, medmindre de har markant kompromitteret nyrefunktion (kreatininclearance Patienter med nyreinsufficiens, ovenfor ).
Køn og Race
Resultaterne af en meta-analyse af klinisk farmakokinetik (N = 217) indikerede ingen signifikant indflydelse af hverken køn eller race på cefdinirs farmakokinetik.
Mikrobiologi
Virkningsmekanisme
Som med andre cephalosporiner er cefdinirs bakteriedræbende aktivitet et resultat af hæmning af cellevægssyntese. Cefdinir er stabilt i nærværelse af nogle, men ikke alle, β-lactamase-enzymer. Som følge heraf er mange organismer, der er resistente over for penicilliner og nogle cephalosporiner, modtagelige for cefdinir.
Modstandsmekanisme
Resistens over for cefdinir er primært gennem hydrolyse af nogle β-lactamaser, ændring af penicillin-bindende proteiner (PBP'er) og nedsat permeabilitet. Cefdinir er inaktivt mod de fleste stammer af Enterobacter spp., Pseudomonas spp., Enterococcus spp., penicillin-resistente streptokokker og methicillin-resistente stafylokokker. β-lactamase-negative, ampicillin-resistente (BLNAR) H. influenzae-stammer er typisk ikke-modtagelige for cefdinir.
Antimikrobiel aktivitet
Cefdinir har vist sig at være aktiv mod de fleste stammer af følgende mikroorganismer, både in vitro og ved kliniske infektioner som beskrevet i INDIKATIONER OG BRUG .
Gram-positive bakterier
Staphylococcus aureus (kun meticillin-modtagelige stammer) Streptococcus pneumoniae (kun penicillin-modtagelige stammer) Streptococcus pyogenes
Gram-negative bakterier
Haemophilus influenzae Haemophilus parainfluenzae Moraxella catarrhalis
Følgende in vitro-data er tilgængelige, men deres kliniske betydning er ukendt.
Cefdinir udviser in vitro minimale hæmmende koncentrationer (MIC'er) på 1 mcg/ml eller mindre mod (≥ 90%) stammer af følgende mikroorganismer; dog er sikkerheden og effektiviteten af cefdinir til behandling af kliniske infektioner på grund af disse mikroorganismer ikke blevet fastslået i tilstrækkelige og velkontrollerede kliniske forsøg.
Gram-positive bakterier
Staphylococcus epidermidis (kun meticillin-modtagelige stammer) Streptococcus agalactiae Viridans gruppe streptokokker
Gram-negative bakterier
Citrobacter koseri Escherichia coli Klebsiella pneumoniae Proteus mirabilis
Modtagelighedstestmetoder
Når det er tilgængeligt, bør det kliniske mikrobiologiske laboratorium levere periodiske rapporter, der beskriver den regionale/lokale modtagelighedsprofil for potentielle nosokomiale og samfundserhvervede patogener. Disse rapporter skal hjælpe lægen med at vælge et antibakterielt lægemiddel til behandling.
Fortyndingsteknikker
Kvantitative metoder bruges til at bestemme antimikrobielle minimumshæmmende koncentrationer (MIC'er). Disse MIC'er giver estimater af bakteriers modtagelighed over for antimikrobielle forbindelser. MIC'erne bør bestemmes ved hjælp af en standardiseret testmetode1 (bouillon og/eller agar). MIC-værdierne skal fortolkes i henhold til kriterierne i tabel 1.
Diffusionsteknikker
Kvantitative metoder, der kræver måling af zonediametre, giver også reproducerbare estimater af bakteriers modtagelighed over for antimikrobielle forbindelser. Zonestørrelsen bør bestemmes ved hjælp af en standardiseret metode.2 Proceduren bruger papirskiver imprægneret med 5 mcg cefdinir til at teste bakteriernes modtagelighed. Diskdiffusionsfortolkningskriterierne er angivet i tabel 1.
Stafylokokkers modtagelighed for cefdinir kan udledes af testning af penicillin og enten cefoxitin eller oxacillin. Stafylokokker, der er modtagelige for oxacillin (cefoxitin), kan anses for at være modtagelige for cefdinir.3
En rapport om "følsom" indikerer, at antimikrobielt middel sandsynligvis vil hæmme væksten af patogenet, hvis den antimikrobielle forbindelse når de koncentrationer på infektionsstedet, der er nødvendige for at hæmme væksten af patogenet. En rapport med "Mellem" angiver, at resultatet skal betragtes som tvetydigt, og hvis mikroorganismen ikke er fuldt modtagelig for alternative, klinisk mulige lægemidler, bør testen gentages. Denne kategori indebærer mulig klinisk anvendelighed på kropssteder, hvor lægemidlet er fysiologisk koncentreret, eller i situationer, hvor en høj dosis af lægemidlet kan anvendes. Denne kategori giver også en bufferzone, der forhindrer små ukontrollerede tekniske faktorer i at forårsage store uoverensstemmelser i fortolkningen. En rapport om "Resistent" indikerer, at det antimikrobielle middel sandsynligvis ikke vil hæmme væksten af patogenet, hvis den antimikrobielle forbindelse når de koncentrationer, der normalt kan opnås på infektionsstedet; anden terapi bør vælges.
Kvalitetskontrol
Standardiserede følsomhedstestprocedurer kræver brug af laboratoriekontroller til at overvåge og sikre nøjagtigheden og præcisionen af forsyninger og reagenser, der anvendes i analysen, og teknikkerne for den person, der udfører testen.1,2,3 Standard cefdinirpulver bør give følgende område af MIC-værdier som angivet i tabel 2. For diffusionsteknikken ved anvendelse af en 5 mcg-skive skal kriterierne i tabel 2 være opfyldt.
Kliniske Studier
Samfundserhvervet bakteriel lungebetændelse
I et kontrolleret, dobbeltblindt studie med voksne og unge udført i USA, blev cefdinir BID sammenlignet med cefaclor 500 mg tre gange daglig. Ved at bruge strenge evaluerbarhed og mikrobiologiske/kliniske responskriterier 6 til 14 dage efter behandling blev følgende kliniske helbredelsesrater, formodede mikrobiologiske udryddelsesrater og statistiske resultater opnået:
US Community-erhvervet lungebetændelse undersøgelse Cefdinir vs Cefaclor
et andet kontrolleret, investigator-blindt studie med voksne og unge, primært udført i Europa, blev cefdinir to gange daglig sammenlignet med amoxicillin/clavulanat 500/125 mg tre gange daglig. Ved at bruge strenge evaluerbarheds- og kliniske responskriterier 6 til 14 dage efter behandling blev følgende kliniske helbredelsesrater, formodede mikrobiologiske udryddelsesrater og statistiske resultater opnået:
EU-erhvervet lungebetændelse undersøgelse Cefdinir vs Amoxicillin/Clavulanat
Streptokok pharyngitis/tonsillitis
fire kontrollerede undersøgelser udført i USA blev cefdinir sammenlignet med 10 dages penicillin hos voksne, unge og pædiatriske patienter. To undersøgelser (en hos voksne og unge, den anden hos pædiatriske patienter) sammenlignede 10 dages cefdinir QD eller BID med penicillin 250 mg eller 10 mg/kg QID. Ved at bruge strenge evaluerbarhed og mikrobiologiske/kliniske responskriterier 5 til 10 dage efter behandling blev følgende kliniske helbredelsesrater, mikrobiologiske udryddelsesrater og statistiske resultater opnået:
Pharyngitis/tonsillitis undersøgelser Cefdinir (10 dage) vs Penicillin (10 dage)
To undersøgelser (en hos voksne og unge, den anden hos pædiatriske patienter) sammenlignede 5 dages cefdinir to gange dagligt med 10 dages penicillin 250 mg eller 10 mg/kg QID. Ved at bruge strenge evaluerbarhed og mikrobiologiske/kliniske responskriterier 4 til 10 dage efter behandling blev følgende kliniske helbredelsesrater, mikrobiologiske udryddelsesrater og statistiske resultater opnået:
Pharyngitis/tonsillitis undersøgelser Cefdinir (5 dage) vs Penicillin (10 dage)
REFERENCER
1. Clinical and Laboratory Standards Institute (CLSI). Metoder til fortynding Antimikrobielle følsomhedstests for bakterier, der vokser aerobt; Godkendt standard – tiende udgave. CLSI Document M07-A10 [2015], Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
2. Clinical and Laboratory Standards Institute (CLSI). Ydeevnestandarder for antimikrobielle diskdiffusionsfølsomhedstests; Godkendt standard – tolvte udgave. CLSI Document M02-A12 [2015], Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
3. Clinical and Laboratory Standards Institute (CLSI). Ydeevnestandarder for antimikrobiel følsomhedstestning; Femogtyvende informationstillæg, CLSI-dokument M100-S25 [2015], Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
4. Cockcroft DW, Gault MH. Forudsigelse af kreatininclearance fra serumkreatinin. Nephron 1976;16:31-41.
5. Schwartz GJ, Haycock GB, Edelmann CM, Spitzer A. Et simpelt skøn over glomerulær filtrationshastighed hos børn afledt af kropslængde og plasmakreatinin. Pediatrics 1976;58:259-63.
6. Schwartz GJ, Feld LG, Langford DJ. Et simpelt estimat af glomerulær filtrationshastighed hos fuldbårne spædbørn i løbet af det første leveår. J Pediatrics 1984;104:849-54.
PATIENTOPLYSNINGER
Patienter bør rådgives om, at antibakterielle lægemidler inklusive OMNICEF 300 mg kun bør anvendes til behandling af bakterielle infektioner. De behandler ikke virusinfektioner (f.eks. forkølelse). Når OMNICEF 300 mg ordineres til behandling af en bakteriel infektion, skal patienterne fortælles, at selvom det er almindeligt at føle sig bedre tidligt i behandlingsforløbet, skal medicinen tages nøjagtigt som anvist. At springe doser over eller ikke fuldføre hele behandlingsforløbet kan (1) mindske effektiviteten af den øjeblikkelige behandling og (2) øge sandsynligheden for, at bakterier udvikler resistens og ikke vil kunne behandles med OMNICEF 300mg eller andre antibakterielle lægemidler i fremtiden.
Antacida indeholdende magnesium eller aluminium forstyrrer absorptionen af cefdinir. Hvis denne type antacida er påkrævet under OMNICEF 300 mg behandling, skal OMNICEF tages mindst 2 timer før eller efter antacida.
Jerntilskud, herunder multivitaminer, der indeholder jern, forstyrrer absorptionen af cefdinir. Hvis jerntilskud er påkrævet under OMNICEF 300 mg-behandling, skal OMNICEF tages mindst 2 timer før eller efter tilskuddet.
Jernberiget modermælkserstatning interfererer ikke signifikant med absorptionen af cefdinir. Derfor kan OMNICEF 300 mg til oral suspension administreres med jernberiget modermælkserstatning.
Diabetikere og pårørende skal være opmærksomme på, at den orale suspension indeholder 2,86 g saccharose pr. teske.
Diarré er et almindeligt problem forårsaget af antibiotika, som normalt ophører, når antibiotikaen seponeres. Nogle gange kan patienter efter start af behandling med antibiotika udvikle vandig og blodig afføring (med eller uden mavekramper og feber) selv så sent som to eller flere måneder efter at have taget den sidste dosis af antibiotika. Hvis dette sker, skal patienter kontakte deres læge hurtigst muligt.
