Minocin 50mg, 100mg Minocycline Hydrochloride Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Minocin Oral Suspension, og hvordan bruges det?
Minocin (minocyclin hydrochlorid) er et tetracyclin antibiotikum, der bruges til at behandle mange forskellige bakterielle infektioner, såsom urinvejsinfektioner, luftvejsinfektioner, hudinfektioner, svær acne, gonoré, flåtfeber, klamydia og andre.
Hvad er bivirkninger af Minocin Oral Suspension?
Almindelige bivirkninger af Minocin omfatter:
- svimmelhed,
- træt følelse,
- snurrende fornemmelse,
- led- eller muskelsmerter,
- misfarvning af din hud eller negle eller tandkød,
- kvalme,
- diarré,
- dårlig mave,
- hududslæt eller kløe,
- hævet tunge, eller
- vaginal kløe eller udflåd.
Fortæl din læge, hvis du har alvorlige bivirkninger af Minocin 50mg, herunder:
- mavekramper,
- diarré, der er vandig eller blodig,
- influenza symptomer,
- sår i din mund og hals,
- svaghed,
- mørk farvet urin,
- usædvanlig blødning,
- lilla eller røde prikkede pletter under din hud,
- feber,
- udslæt,
- blå mærker,
- alvorlig prikken eller følelsesløshed,
- muskelsvaghed,
- mistet appetiten,
- gulfarvning af hud eller øjne,
- brystsmerter,
- uregelmæssig hjerterytme,
- hoste,
- hvæsen,
- stakåndet,
- forvirring,
- opkastning,
- hævelse,
- vægtøgning,
- vandladning mindre end normalt eller slet ikke,
- hovedpine eller smerter bag dine øjne,
- ringen for dine ører,
- synsproblemer,
- ledsmerter eller hævelse med feber,
- hævede kirtler,
- muskelsmerter,
- generel dårlig følelse,
- usædvanlige tanker eller adfærd,
- kramper (kramper), eller
- en alvorlig hudreaktion.
For at reducere udviklingen af lægemiddelresistente bakterier og bevare effektiviteten af MINOCIN® Oral Suspension og andre antibakterielle lægemidler, bør MINOCIN Oral Suspension kun bruges til at behandle eller forebygge infektioner, der er bevist eller stærkt mistænkt for at være forårsaget af bakterier.
BESKRIVELSE
MINOCIN 100mg minocyclinhydrochlorid, er et semisyntetisk derivat af tetracyclin, 4,7Bis(dimethylamino)-1,4,4a,5,5a,6,11,12a-octahydro-3,10,12,12a-tetrahydroxy-1,11 -dioxo-2naphthacencarboxamidmonohydrochlorid.
Dens strukturformel er:
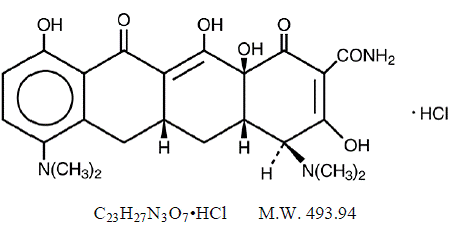 C23H27N3O7•HCl MW 493,94
C23H27N3O7•HCl MW 493,94 MINOCIN 50mg oral suspension indeholder minocyclinhydrochlorid svarende til 50 mg minocyclin pr. 5 ml (10 mg/mL) og følgende inaktive ingredienser: Alkohol, Butylparaben, Calciumhydroxid, Cellulose, Decaglyceryltetraoleat, Edetate-polyguarg0-dinatrium, , Propylparaben, Propylenglycol, Natriumsaccharin, Natriumsulfit (se ADVARSLER ) og sorbitol.
INDIKATIONER
MINOCIN 100mg oral suspension er indiceret til behandling af følgende infektioner på grund af modtagelige stammer af de udpegede mikroorganismer:
Rocky Mountain plettet feber, tyfusfeber og tyfusgruppen, Q-feber, rickettsialpox og skovflåtfeber forårsaget af rickettsiae.
Luftvejsinfektioner forårsaget af Mycoplasma pneumoniae.
Lymphogranuloma venereum forårsaget af Chlamydia trachomatis.
Psittacosis (Ornithosis) på grund af Chlamydophila psittaci.
Trakom forårsaget af Chlamydia trachomatis, selvom smitstoffet ikke altid elimineres, vurderet ud fra immunfluorescens.
Inklusionskonjunktivitis forårsaget af Chlamydia trachomatis.
Nongonokok urethritis, endocervikale eller rektale infektioner hos voksne forårsaget af Ureaplasma urealyticum eller Chlamydia trachomatis.
Tilbagefaldende feber på grund af Borrelia recurrentis.
Chancroid forårsaget af Haemophilus ducreyi.
Pest på grund af Yersinia pestis.
Tularæmi på grund af Francisella tularensis.
Kolera forårsaget af Vibrio cholerae.
Campylobacter foster infektioner forårsaget af Campylobacter foster.
Brucellose på grund af Brucella-arter (i forbindelse med streptomycin).
Bartonellose på grund af Bartonella bacilliformis.
Granuloma inguinale forårsaget af Klebsiella granulomatis.
Minocyclin er indiceret til behandling af infektioner forårsaget af følgende gramnegative mikroorganismer, når bakteriologisk testning indikerer passende modtagelighed for lægemidlet:
Escherichia coli.
Enterobacter aerogenes.
Shigella arter.
Acinetobacter arter.
Luftvejsinfektioner forårsaget af Haemophilus influenzae.
Luftvejs- og urinvejsinfektioner forårsaget af Klebsiella-arter.
MINOCIN Oral Suspension er indiceret til behandling af infektioner forårsaget af følgende gram-positive mikroorganismer, når bakteriologiske undersøgelser indikerer passende modtagelighed for lægemidlet:
Øvre luftvejsinfektioner forårsaget af Streptococcus pneumoniae. Hud- og hudstrukturinfektioner forårsaget af Staphylococcus aureus (bemærk: Minocyclin er ikke det foretrukne lægemiddel til behandling af enhver form for stafylokokkinfektion).
Når penicillin er kontraindiceret, er minocyclin et alternativt lægemiddel til behandling af følgende infektioner:
Ukompliceret urethritis hos mænd på grund af Neisseria gonorrhoeae og til behandling af andre gonokokinfektioner.
Infektioner hos kvinder forårsaget af Neisseria gonorrhoeae.
Syfilis forårsaget af Treponema pallidum underart pallidum.
Kæber forårsaget af Treponema pallidum underart pertenue.
Listeriose på grund af Listeria monocytogenes.
Miltbrand på grund af Bacillus anthracis.
Vincents infektion forårsaget af Fusobacterium fusiforme.
Actinomycosis forårsaget af Actinomyces israelii.
Infektioner forårsaget af Clostridium-arter.
Ved akut intestinal amebiasis kan minocyclin være et nyttigt supplement til amebicider.
Ved svær acne kan minocyclin være nyttig supplerende terapi.
Oral minocyclin er indiceret til behandling af asymptomatiske bærere af Neisseria meningitidis for at eliminere meningokokker fra nasopharynx. For at bevare nytten af minocyclin i behandlingen af asymptomatiske meningokokbærere bør der udføres diagnostiske laboratorieprocedurer, herunder serotypning og følsomhedstestning, for at fastslå bærertilstanden og den korrekte behandling. Det anbefales, at profylaktisk brug af minocyclin forbeholdes situationer, hvor risikoen for meningokok-meningitis er høj.
Oral Minocyclin er ikke indiceret til behandling af meningokokinfektion.
Selvom der ikke er udført kontrollerede kliniske effektivitetsstudier, viser begrænsede kliniske data, at oral minocyclinhydrochlorid er blevet brugt med succes til behandling af infektioner forårsaget af Mycobacterium marinum.
For at reducere udviklingen af lægemiddelresistente bakterier og bevare effektiviteten af MINOCIN 100mg oral suspension og andre antibakterielle lægemidler, bør MINOCIN oral suspension kun bruges til at behandle eller forebygge infektioner, der er bevist eller stærkt mistænkt for at være forårsaget af modtagelige bakterier. Når kultur- og modtagelighedsoplysninger er tilgængelige, bør de overvejes ved udvælgelse eller ændring af antibakteriel behandling. I mangel af sådanne data kan lokal epidemiologi og modtagelighedsmønstre bidrage til den empiriske udvælgelse af terapi.
DOSERING OG ADMINISTRATION
DEN SÆDvanlige DOSERING OG FREKVENS AF ADMINISTRATION AF MINOCYKLIN ER AFSKILLENDE FRA DOSERING AF DE ANDRE TETRACYKLINER. OVERSKRIVNING AF DEN ANBEFALEDE DOSERING KAN RESULTERE I EN ØGET FOREkomst AF BIVIRKNINGER.
Behandlingen bør fortsættes i mindst 24 til 48 timer efter, at symptomer og feber er aftaget.
Hidtil undersøgelser har vist, at absorptionen af MINOCIN Oral Suspension ikke er særlig påvirket af fødevarer og mejeriprodukter.
Farmakokinetikken af minocyclin hos patienter med nedsat nyrefunktion (CLCR ADVARSLER ).
Ved behandling af streptokokinfektioner bør en terapeutisk dosis af tetracyclin administreres i mindst ti dage.
Til pædiatriske patienter over 8 år
Sædvanlig pædiatrisk dosis af MINOCIN er 4 mg/kg initialt efterfulgt af 2 mg/kg hver 12. time, for ikke at overstige den sædvanlige voksendosis.
Voksne
Den sædvanlige dosis af MINOCIN er 200 mg initialt efterfulgt af 100 mg hver 12. time.
Til behandling af syfilis bør den sædvanlige dosis af MINOCIN administreres over en periode på 10 til 15 dage. Tæt opfølgning, herunder laboratorieundersøgelser, anbefales.
Gonorépatienter, der er følsomme over for penicillin, kan behandles med MINOCIN 50 mg, indgivet som 200 mg indledningsvis, efterfulgt af 100 mg hver 12. time i minimum 4 dage, med kulturer efter terapi inden for 2 til 3 dage.
Ved behandling af meningokokbærertilstand er den anbefalede dosis 100 mg hver 12. time i 5 dage.
Mycobacterium marinum-infektioner: Selvom optimale doser ikke er blevet fastlagt, har 100 mg hver 12. time i 6 til 8 uger været anvendt med succes i et begrænset antal tilfælde.
Ukompliceret urethral, endocervikal eller rektal infektion hos voksne forårsaget af Chlamydia trachomatis eller Ureaplasma urealyticum: 100 mg oralt hver 12. time i mindst 7 dage.
Ved behandling af ukompliceret gonokokurethritis hos mænd anbefales 100 mg to gange dagligt oralt i 5 dage.
HVORDAN LEVERET
MINOCIN (minocyclin hydrochlorid) Oral Suspension indeholder minocyclinhydrochlorid svarende til 50 mg minocyclin pr. teskefuld (5 ml). Konserveret med propylparaben 0,10 % og butylparaben 0,06 % med Alkohol USP 5 % v/v. Vanillecreme-smag.
NDC 16781-473-60 - Flaske 2 fl. Oz. (60 ml)
Opbevares ved kontrolleret stuetemperatur 20° til 25°C (68° til 77°F).
FRYS IKKE.
Fremstillet til: Onset Dermatologics, LLC Cumberland, RI 02864. Revideret: nov 2018
BIVIRKNINGER
På grund af oral minocyclins næsten fuldstændige absorption, har bivirkninger til den nedre tarm, især diarré, været sjældne. Følgende bivirkninger er blevet observeret hos patienter, der får tetracykliner.
Kroppen som helhed: Feber og misfarvning af sekret.
Gastrointestinale: Anoreksi, kvalme, opkastning, diarré, dyspepsi, stomatitis, glossitis, dysfagi, emaljehypoplasi, enterocolitis, pseudomembranøs colitis, pancreatitis, inflammatoriske læsioner (med monilial overvækst) i de orale og anogenitale regioner.
Genitourinære: Vulvovaginitis.
Hepatisk toksicitet: Hyperbilirubinæmi, hepatisk kolestase, stigninger i leverenzymer, fatalt leversvigt og gulsot. Hepatitis, herunder autoimmun hepatitis, og leversvigt er blevet rapporteret (se FORHOLDSREGLER ).

Hud: Alopeci, erythema nodosum, hyperpigmentering af negle, kløe, toksisk epidermal nekrolyse, vaskulitis, makulopapulært udslæt og erytematøst udslæt. Eksfoliativ dermatitis er blevet rapporteret. Der er rapporteret om faste lægemiddeludbrud, herunder balanitis. Erythema multiforme og Stevens-Johnsons syndrom er blevet rapporteret. Fotosensitivitet er diskuteret ovenfor (se ADVARSLER ). Pigmentering af hud og slimhinder er blevet rapporteret.
Åndedræt: Hoste, dyspnø, bronkospasme, forværring af astma og pneumonitis.
Renal toksicitet: Interstitiel nefritis. Forhøjelser i BUN er blevet rapporteret og er tilsyneladende dosisrelaterede (se ADVARSLER ). Reversibel akut nyresvigt er blevet rapporteret.
Muskuloskeletale: Artralgi, gigt, knoglemisfarvning, myalgi, ledstivhed og ledhævelse.
Overfølsomhedsreaktioner: Nældefeber, angioneurotisk ødem, polyartralgi, anafylaksi/anafylaktoid reaktion (inklusive shock og dødsfald), anafylaktoid purpura, myocarditis, pericarditis, forværring af systemisk lupus erythematosus og pulmonale infiltrater med eosinofili. Et forbigående lupuslignende syndrom og serumsygelignende reaktioner er også blevet rapporteret.
Blod: Agranulocytose, hæmolytisk anæmi, trombocytopeni, leukopeni, neutropeni, pancytopeni og eosinofili er blevet rapporteret.
Centralnervesystemet: Kramper, svimmelhed, hypestesi, paræstesi, sedation og svimmelhed. Pseudotumor cerebri (godartet intrakraniel hypertension) hos voksne og svulmende fontaneller hos spædbørn (se FORHOLDSREGLER - Generel ). Hovedpine er også blevet rapporteret.
Andet: Kræft i skjoldbruskkirtlen er blevet rapporteret efter markedsføring i forbindelse med minocyclinprodukter. Når minocyclinbehandling gives over længere perioder, bør monitorering for tegn på skjoldbruskkirtelkræft overvejes. Når tetracykliner gives over længere perioder, er det rapporteret at producere brun-sort mikroskopisk misfarvning af skjoldbruskkirtlen. Tilfælde af unormal skjoldbruskkirtelfunktion er blevet rapporteret.
Tandmisfarvning hos børn under 8 år (se ADVARSLER ) og også hos voksne er blevet rapporteret.
Misfarvning af mundhulen (inklusive tunge, læbe og tandkød) er blevet rapporteret.
Tinnitus og nedsat hørelse er blevet rapporteret hos patienter på MINOCIN (minocyclinhydrochlorid).
Følgende syndromer er blevet rapporteret. I nogle tilfælde, der involverer disse syndromer, er dødsfald blevet rapporteret. Som med andre alvorlige bivirkninger, hvis nogen af disse syndromer genkendes, skal lægemidlet seponeres med det samme:
Overfølsomhedssyndrom bestående af kutan reaktion (såsom udslæt eller eksfoliativ dermatitis), eosinofili og en eller flere af følgende: hepatitis, pneumonitis, nefritis, myocarditis og pericarditis. Feber og lymfadenopati kan være til stede.
Lupus-lignende syndrom bestående af positivt antinukleært antistof; artralgi, arthritis, ledstivhed eller ledhævelse; og en eller flere af følgende: feber, myalgi, hepatitis, udslæt og vaskulitis.
Serumsygelignende syndrom bestående af feber; nældefeber eller udslæt; og artralgi, arthritis, ledstivhed eller ledhævelse og lymfadenopati. Eosinofili kan være til stede.
Kontakt Valeant Pharmaceuticals North America LLC på 1-800-321-4576 eller FDA på 1-800-FDA-1088 eller www.fda.gov/medwatch for at rapportere FORSINKTE BIVIRKNINGER.
DRUGSINTERAKTIONER
Fordi tetracykliner har vist sig at sænke plasmaprotrombinaktiviteten, kan patienter, som er i antikoagulantbehandling, have behov for nedjustering af deres antikoagulantdosis.
Da bakteriostatiske lægemidler kan interferere med den bakteriedræbende virkning af penicillin, er det tilrådeligt at undgå at give tetracyclin-klasse lægemidler sammen med penicillin.
Absorption af tetracykliner svækkes af antacida indeholdende aluminium, calcium eller magnesium og jernholdige præparater.
Samtidig brug af tetracyclin og methoxyfluran er blevet rapporteret at resultere i fatal nyretoksicitet.
Samtidig brug af tetracykliner og orale præventionsmidler kan gøre orale præventionsmidler mindre effektive.
Administration af isotretinoin bør undgås kort før, under og kort efter minocyclinbehandling. Hvert lægemiddel alene er blevet forbundet med pseudotumor cerebri (se FORHOLDSREGLER ).
Øget risiko for ergotisme, når ergotalkaloider eller deres derivater gives sammen med tetracykliner.
ADVARSLER
Tandudvikling
MINOCIN Oral Suspension kan ligesom andre antibiotika af tetracyclinklassen forårsage fosterskader, når det administreres til en gravid kvinde. Hvis der anvendes tetracyclin under graviditet, eller hvis patienten bliver gravid, mens han tager disse lægemidler, skal patienten informeres om den potentielle fare for fosteret. Brug af lægemidler af tetracyklinklassen under tandudvikling (sidste halvdel af graviditeten, spædbørn og barndom til 8 års alderen) kan forårsage permanent misfarvning af tænderne (gul-grå-brun).
Denne bivirkning er mere almindelig under langvarig brug af lægemidlet, men er blevet observeret efter gentagne kortvarige behandlinger. Emaljehypoplasi er også blevet rapporteret. Tetracyklinlægemidler bør derfor ikke anvendes under tandudvikling, medmindre andre lægemidler sandsynligvis ikke er effektive eller er kontraindicerede.
Skeletudvikling
Alle tetracykliner danner et stabilt calciumkompleks i ethvert knogledannende væv. Et fald i fibula-væksthastigheden er blevet observeret hos præmature spædbørn, der fik oral tetracyclin i doser på 25 mg/kg hver sjette time. Denne reaktion viste sig at være reversibel, da lægemidlet blev seponeret.
Brug under graviditet
Resultater af dyreforsøg indikerer, at tetracykliner krydser placenta, findes i fostervæv og kan have toksiske virkninger på fosteret under udvikling (ofte relateret til retardering af skeletudvikling). Der er observeret tegn på embryotoksicitet hos dyr behandlet tidligt i graviditeten. Sikkerheden af MINOCIN til brug under graviditet er ikke fastlagt.
Dermatologisk reaktion
Lægemiddeludslæt med eosinofili og systemiske symptomer (DRESS), inklusive fatale tilfælde, er blevet rapporteret ved brug af minocyclin. Hvis dette syndrom er anerkendt, bør lægemidlet seponeres med det samme.
Antianabolsk handling
Den antianabolske virkning af tetracyklinerne kan forårsage en stigning i BUN. Selvom dette ikke er et problem hos dem med normal nyrefunktion, kan højere serumniveauer af tetracyclin hos patienter med væsentligt nedsat funktion føre til azotæmi, hyperfosfatæmi og acidose. Under sådanne forhold anbefales overvågning af kreatinin og BUN, og den samlede daglige dosis bør ikke overstige 200 mg på 24 timer (se DOSERING OG ADMINISTRATION ). Hvis der er nedsat nyrefunktion, kan selv sædvanlige orale eller parenterale doser føre til systemisk akkumulering af lægemidlet og mulig levertoksicitet.
Lysfølsomhed
Lysfølsomhed manifesteret ved en overdreven solskoldningsreaktion er blevet observeret hos nogle individer, der tager tetracykliner. Dette er blevet rapporteret med minocyclin.
Virkninger på centralnervesystemet
Bivirkninger fra centralnervesystemet, herunder svimmelhed, svimmelhed eller vertigo, er blevet rapporteret ved behandling med minocyclin. Patienter, der oplever disse symptomer, bør advares om at køre bil eller bruge farlige maskiner, mens de er i minocyclinbehandling. Disse symptomer kan forsvinde under behandlingen og forsvinder normalt hurtigt, når lægemidlet seponeres.
Clostridium Difficile Associeret Diarré
Clostridium difficile-associeret diarré (CDAD) er blevet rapporteret ved brug af næsten alle antibakterielle midler, inklusive MINOCIN 50mg, og kan variere i sværhedsgrad fra mild diarré til fatal colitis. Behandling med antibakterielle midler ændrer den normale flora i tyktarmen, hvilket fører til overvækst af C. difficile.
C. difficile producerer toksinerne A og B, som bidrager til udviklingen af CDAD. Hypertoksinproducerende stammer af C. difficile forårsager øget morbiditet og dødelighed, da disse infektioner kan være modstandsdygtige over for antimikrobiel behandling og kan kræve kolektomi. CDAD skal overvejes hos alle patienter, der får diarré efter brug af antibiotika. Omhyggelig sygehistorie er nødvendig, da CDAD er blevet rapporteret at forekomme over to måneder efter administration af antibakterielle midler.
Hvis CDAD er mistænkt eller bekræftet, kan det være nødvendigt at afbryde igangværende antibiotikabrug, der ikke er rettet mod C. difficile. Passende væske- og elektrolytbehandling, proteintilskud, antibiotikabehandling af C. difficile og kirurgisk evaluering bør iværksættes som klinisk indiceret.
Overfølsomhed over for natriumsulfit
MINOCIN Oral Suspension indeholder natriumsulfit, en sulfit, der kan forårsage allergiske reaktioner, herunder anafylaktiske symptomer og livstruende eller mindre alvorlige astmatiske episoder hos visse modtagelige personer. Den overordnede prævalens af sulfitfølsomhed i den generelle befolkning er ukendt og sandsynligvis lav. Sulfitfølsomhed ses hyppigere hos astmatikere end hos ikke-nastmapatienter.
Intrakraniel hypertension
Intrakraniel hypertension (IH, pseudotumor cerebri) er blevet forbundet med brugen af tetracykliner, herunder MINOCIN. Kliniske manifestationer af IH omfatter hovedpine, sløret syn, diplopi og synstab; papilleødem kan findes på fundoskopi. Kvinder i den fødedygtige alder, som er overvægtige eller har en historie med IH, har større risiko for at udvikle tetracyklin-associeret IH. Samtidig brug af isotretinoin og MINOCIN bør undgås, da isotretinoin også er kendt for at forårsage pseudotumor cerebri.
Selvom IH typisk forsvinder efter seponering af behandlingen, er der mulighed for permanent synstab. Hvis der opstår visuelle symptomer under behandlingen, er hurtig oftalmologisk vurdering berettiget. Da det intrakranielle tryk kan forblive forhøjet i uger efter medicinophør, bør patienter overvåges, indtil de stabiliserer sig.
FORHOLDSREGLER
Generel
Som med andre antibiotikapræparater kan brug af dette lægemiddel resultere i overvækst af ikke-modtagelige organismer, herunder svampe. Hvis der opstår superinfektion, bør antibiotikabehandlingen seponeres og passende behandling iværksættes.
Hepatotoksicitet er blevet rapporteret med minocyclin; derfor bør minocyclin anvendes med forsigtighed til patienter med leverdysfunktion og sammen med andre hepatotoksiske lægemidler.
Incision og dræning eller andre kirurgiske procedurer bør udføres i forbindelse med antibiotikabehandling, når det er indiceret.
Ordinering af MINOCIN oral suspension i fravær af en påvist eller stærkt mistænkt bakteriel infektion eller en profylaktisk indikation er usandsynligt, at gavn for patienten og øger risikoen for udvikling af lægemiddelresistente bakterier.
Laboratorieprøver
Periodiske laboratorieevalueringer af organsystemer, herunder hæmatopoietiske, renale og hepatiske, bør udføres.
Alle patienter med gonoré bør have en serologisk test for syfilis på tidspunktet for diagnosen. Patienter behandlet med minocyclin bør have en opfølgende serologisk test for syfilis efter 3 måneder.
Interaktioner med lægemiddel/laboratorietest
Falske forhøjelser af katekolaminniveauer i urinen kan forekomme på grund af interferens med fluorescenstesten.
Karcinogenese, mutagenese, svækkelse af fertilitet
Diætadministration af minocyclin i langtidsstudier af tumorigenicitet hos rotter resulterede i tegn på produktion af thyreoidea-tumor. Minocyclin har også vist sig at producere thyreoideahyperplasi hos rotter og hunde. Derudover har der været tegn på onkogen aktivitet hos rotter i studier med et beslægtet antibiotikum, oxytetracyclin (dvs. binyre- og hypofysetumorer). På samme måde, selvom mutagenicitetsundersøgelser af minocyclin ikke er blevet udført, er positive resultater i in vitro pattedyrcelleassays (dvs. muselymfom og kinesisk hamster-lungeceller) blevet rapporteret for relaterede antibiotika (tetracyclinhydrochlorid og oxytetracyclin). Segment I (fertilitet og generel reproduktion) undersøgelser har vist, at minocyclin forringer fertiliteten hos hanrotter.
Graviditet
Risikooversigt
Alle graviditeter har en baggrundsrisiko for medfødte defekter, tab eller andre uønskede udfald uanset lægemiddeleksponering. Der er ingen tilstrækkelige og velkontrollerede undersøgelser af brugen af minocyclin hos gravide kvinder. Minocyclin passerer ligesom andre antibiotika i tetracyclinklassen placenta og kan forårsage fosterskader, når det administreres til en gravid kvinde. Sjældne spontane rapporter om medfødte anomalier, herunder reduktion af lemmer, er blevet rapporteret efter markedsføring. Kun begrænset information er tilgængelig om disse rapporter; der kan derfor ikke fastslås nogen konklusion om årsagssammenhæng. Hvis minocyclin anvendes under graviditet, eller hvis patienten bliver gravid, mens han tager dette lægemiddel, skal patienten informeres om den potentielle fare for fosteret.
Ikke-ratatogene virkninger: (se ADVARSLER ).
Arbejde og levering
Effekten af tetracykliner på fødsel og fødsel er ukendt.
Ammende mødre
Tetracykliner udskilles i modermælk. På grund af risikoen for alvorlige bivirkninger hos ammende spædbørn fra tetracyklinerne, bør der tages stilling til, om man skal stoppe amningen eller seponere lægemidlet under hensyntagen til lægemidlets betydning for moderen (se ADVARSLER ).
Pædiatrisk brug
Minocyclin anbefales ikke til børn under 8 år, medmindre de forventede fordele ved behandlingen opvejer risiciene (se ADVARSLER ).
Geriatrisk brug
Kliniske undersøgelser af oral minocyclin inkluderede ikke et tilstrækkeligt antal forsøgspersoner på 65 år og derover til at afgøre, om de reagerer anderledes end yngre forsøgspersoner. Generelt bør dosisvalg for en ældre patient være forsigtigt, sædvanligvis begyndende i den lave ende af doseringsområdet, hvilket afspejler den større hyppighed af nedsat lever-, nyre- eller hjertefunktion og samtidig sygdom eller anden lægemiddelbehandling (se ADVARSLER , DOSERING OG ADMINISTRATION ).
MINOCIN 50mg oral suspension indeholder 4,3 mg (0,18 mEq) natrium pr. 5 ml.
OVERDOSIS
De bivirkninger, der oftest ses ved overdosis, er svimmelhed, kvalme og opkastning.
Der kendes ingen specifik modgift mod minocyclin.
I tilfælde af overdosering skal du afbryde medicinen, behandle symptomatisk og iværksætte støttende foranstaltninger. Minocyclin fjernes ikke i væsentlige mængder ved hæmodialyse eller peritonealdialyse.
KONTRAINDIKATIONER
Dette lægemiddel er kontraindiceret hos personer, der har vist overfølsomhed over for nogen af tetracyklinerne eller nogen af komponenterne i produktformuleringen.
KLINISK FARMAKOLOGI
Efter en enkelt dosis på to 100 mg minocyclin HCl pulverfyldte kapsler administreret til ti normale voksne frivillige, varierede serumniveauerne fra 0,74 til 4,45 mcg/ml på 1 time (gennemsnit 2,24); efter 12 timer varierede de fra 0,34 til 2,36 mcg/ml (gennemsnit 1,25). Serumhalveringstiden efter en enkelt dosis på 200 mg hos 12 i det væsentlige normale frivillige varierede fra 11 til 17 timer. Hos syv patienter med nedsat leverfunktion varierede det fra 11 til 16 timer, og hos 5 patienter med nedsat nyrefunktion varierede det fra 18 til 69 timer. Urin- og fækal genvinding af minocyclin, når det blev administreret til 12 normale frivillige, var halvdelen til en tredjedel af andre tetracykliner.
Mikrobiologi
Handlingsmekanisme
Tetracyklinerne er primært bakteriostatiske og menes at udøve deres antimikrobielle virkning ved at hæmme proteinsyntesen. Tetracyklinerne, herunder minocyclin, har et lignende antimikrobielt spektrum af aktivitet mod en lang række gram-positive og gram-negative organismer. Krydsresistens af disse organismer over for tetracyclin er almindelig.
Antimikrobiel aktivitet
Minocyclin har vist sig at være aktiv mod de fleste stammer af følgende mikroorganismer, både in vitro og ved kliniske infektioner som beskrevet i INDIKATIONER afsnit:
Gram-positive bakterier
Bacillus anthracis Listeria monocytogenes Staphylococcus aureus Streptococcus pneumoniae
Gram-negative bakterier
Bartonella bacilliformis Brucella-arter Klebsiella granulomatis Campylobacter foster Francisella tularensis Haemophilus ducreyi Vibrio cholerae Yersinia pestis Acinetobacter-arter Enterobacter aerogenes Escherichia coli Haemophilus influenzae Klebsiella-arter Neisiella-arter Neisiella-arter Neisiella-arter
Andre mikroorganismer
Actinomyces-arter Borrelia recurrentis Chlamydophila psittaci Chlamydia trachomatis Clostridium-arter Entamoeba-arter Fusobacterium nucleatum-underart fusiforme Mycobacterium marinum Mycoplasma pneumoniae Propionibacterium acnes Rickettsiae Treponema pallidum-underart pallidum subspecies Urealum subspecies pallidum subspecies.
Modtagelighedstest
For specifik information om fortolkningskriterier for følsomhedstest og tilhørende testmetoder og kvalitetskontrolstandarder, der er anerkendt af FDA for dette lægemiddel, se venligst: https://www.fda.gov/STIC.
Dyrefarmakologi og toksikologi
Minocyclin HCl er blevet observeret at forårsage en mørk misfarvning af skjoldbruskkirtlen hos forsøgsdyr (rotter, minigrise, hunde og aber). Hos rotter har kronisk behandling med minocyclinhydrochlorid resulteret i struma ledsaget af forhøjet optagelse af radioaktivt jod og tegn på thyreoidea tumorproduktion. Minocyclinhydrochlorid har også vist sig at producere thyreoideahyperplasi hos rotter og hunde.
PATIENTOPLYSNINGER
Diarré er et almindeligt problem forårsaget af antibiotika, som normalt ophører, når antibiotikaen seponeres. Nogle gange kan patienter efter start af behandling med antibiotika udvikle vandig og blodig afføring (med eller uden mavekramper og feber) selv så sent som to eller flere måneder efter at have taget den sidste dosis af antibiotika. Hvis dette sker, skal patienter kontakte deres læge hurtigst muligt.
Lysfølsomhed manifesteret ved en overdreven solskoldningsreaktion er blevet observeret hos nogle individer, der tager tetracykliner. Patienter, der er tilbøjelige til at blive udsat for direkte sollys eller ultraviolet lys, bør informeres om, at denne reaktion kan forekomme med tetracyklinlægemidler, og behandlingen bør afbrydes ved det første tegn på huderytem. Denne reaktion er blevet rapporteret ved brug af minocyclin.
Patienter, der oplever symptomer på centralnervesystemet, skal advares om at køre bil eller bruge farlige maskiner, mens de er i behandling med minocyklin (se ADVARSLER ).
Samtidig brug af tetracyclin og orale præventionsmidler kan gøre orale præventionsmidler mindre effektive (se DRUGSINTERAKTIONER ).
Patienter bør rådgives om, at antibakterielle lægemidler inklusive MINOCIN 50 mg oral suspension kun bør anvendes til behandling af bakterielle infektioner. De behandler ikke virusinfektioner (f.eks. forkølelse). Når MINOCIN Oral Suspension ordineres til behandling af en bakteriel infektion, skal patienterne fortælles, at selvom det er almindeligt at føle sig bedre tidligt i behandlingsforløbet, skal medicinen tages nøjagtigt som anvist. At springe doser over eller ikke fuldføre hele behandlingsforløbet kan (1) mindske effektiviteten af den øjeblikkelige behandling og (2) øge sandsynligheden for, at bakterier udvikler resistens og ikke vil kunne behandles med MINOCIN 50mg oral suspension eller andre antibakterielle lægemidler i fremtiden .
Ubrugte forsyninger af tetracyclin-antibiotika skal kasseres inden udløbsdatoen.
