Biaxin 250mg, 500mg Clarithromycin Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Biaxin 500mg, og hvordan bruges det?
Biaxin er en receptpligtig medicin, der bruges til at behandle symptomerne på mange forskellige bakterielle infektioner, herunder mavesår og Helicobacter pylori. Biaxin kan bruges alene eller sammen med anden medicin.
Biaxin 500mg er et antibiotikum.
Det vides ikke, om Biaxin er sikkert og effektivt til børn under 6 måneder.
Hvad er de mulige bivirkninger af Biaxin 250mg?
Biaxin 500mg kan forårsage alvorlige bivirkninger, herunder:
- stærke mavesmerter,
- diarré indeholdende blod,
- hurtige eller bankende hjerteslag,
- flagrende i dit bryst,
- stakåndet,
- pludselig svimmelhed,
- forvirring,
- snurrende fornemmelse,
- mistet appetiten,
- smerter i øvre mave,
- træthed,
- mørk urin,
- lerfarvet afføring,
- gulfarvning af øjne og hud (gulsot),
- lidt eller ingen urin,
- hævelse i dine fødder eller ankler,
- træthedsfornemmelse,
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Biaxin omfatter:
- mavesmerter,
- kvalme,
- opkastning,
- diarré,
- usædvanlig eller ubehagelig smag i munden,
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Biaxin. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
Clarithromycin er et semisyntetisk makrolid antimikrobielt middel til oral brug. Kemisk er det 6-0methylerythromycin. Molekylformlen er C38H69NO13, og molekylvægten er 747,96. Strukturformlen er:
Figur 1: Struktur af Clarithromycin
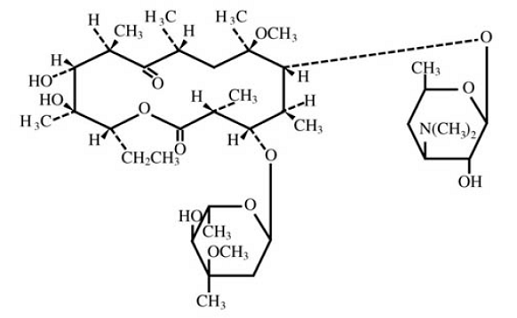
Clarithromycin er et hvidt til råhvidt krystallinsk pulver. Det er opløseligt i acetone, lidt opløseligt i methanol, ethanol og acetonitril og praktisk talt uopløseligt i vand.
BIAXIN fås som tabletter med øjeblikkelig frigivelse, tabletter med forlænget frigivelse og granulat til oral suspension.
Hver gul oval filmovertrukken BIAXIN Filmtab-tablet med øjeblikkelig frigivelse (clarithromycin-tabletter, USP) indeholder 250 mg eller 500 mg clarithromycin og følgende inaktive ingredienser:
- 250 mg tabletter: hypromellose, hydroxypropylcellulose, croscarmellosenatrium, D&C Yellow No. 10, FD&C Blue No. 1, magnesiumstearat, mikrokrystallinsk cellulose, povidon, prægelatineret stivelse, propylenglycol, siliciumdioxid, sorbinsyre, sorbitaarinsyre, sorbitaarinsyre, sorbitaarinsyre talkum, titaniumdioxid og vanillin.
- 500 mg tabletter: hypromellose, hydroxypropylcellulose, kolloid siliciumdioxid, croscarmellosenatrium, D&C Yellow No. 10, magnesiumstearat, mikrokrystallinsk cellulose, povidon, propylenglycol, sorbinsyre, sorbitanmonooleat, titandioxid og vanillindioxid.
Hver gul oval filmovertrukken BIAXIN XL Filmtab-tablet (clarithromycin-tabletter med forlænget frigivelse) indeholder 500 mg clarithromycin og følgende inaktive ingredienser: cellulosepolymerer, D&C Yellow No. 10, lactosemonohydrat, magnesiumstearat, propylenglycol, sorbitansyre, monooleat, talkum, titaniumdioxid og vanillin.
Hver 5 ml BIAXIN 500 mg rekonstitueret suspension (clarithromycin til oral suspension, USP) indeholder 125 mg eller 250 mg clarithromycin. Hver flaske BIAXIN granulat indeholder 1250 mg (50 ml størrelse), 2500 mg (50 og 100 ml størrelse) eller 5000 mg (100 ml størrelse) clarithromycin og følgende inaktive ingredienser: carbomer, ricinusolie, citronsyre, hypromellosephthalat, maltodextrin, kaliumsorbat, povidon, siliciumdioxid, saccharose, xanthangummi, titaniumdioxid og frugtpunch smag.
INDIKATIONER
Akut bakteriel eksacerbation af kronisk bronkitis
BIAXIN (Filmtab, Granulat) og BIAXIN XL Filmtab er indiceret til voksne til behandling af milde til moderate infektioner forårsaget af modtagelige isolater forårsaget af Haemophilus influenzae, Haemophilus parainfluenzae, Moraxella catarrhalis eller Streptococcus pneumoniae [se INDIKATIONER OG BRUG ].
Akut Maxillær Bihulebetændelse
BIAXIN (Filmtab, Granulat) og BIAXIN 500mg XL Filmtab (hos voksne) er indiceret til behandling af milde til moderate infektioner forårsaget af modtagelige isolater på grund af Haemophilus influenzae, Moraxella catarrhalis eller Streptococcus pneumoniae [se INDIKATIONER OG BRUG ].
Samfundserhvervet lungebetændelse
BIAXIN (Filmtab, Granulat) og BIAXIN XL Filmtab er angivet [se INDIKATIONER OG BRUG ] til behandling af milde til moderate infektioner forårsaget af modtagelige isolater på grund af:
- Haemophilus influenzae (hos voksne)
- Haemophilus parainfluenzae (BIAXIN 500mg XL Filmtab hos voksne)
- Moraxella catarrhalis (BIAXIN 250mg XL Filmtab hos voksne)
- Mycoplasma pneumoniae, Streptococcus pneumoniae, Chlamydophila pneumoniae (BIAXIN 500mg XL Filmtab [hos voksne]; BIAXIN Filmtab og BIAXIN Granulat [hos voksne og pædiatriske patienter])
Pharyngitis/Tonsillitis
BIAXIN 500mg Filmtab og BIAXIN 500mg Granulat er indiceret til behandling af milde til moderate infektioner forårsaget af modtagelige isolater på grund af Streptococcus pyogenes som et alternativ til personer, der ikke kan anvende førstelinjebehandling.
Ukomplicerede hud- og hudstrukturinfektioner
BIAXIN Filmtab og BIAXIN Granulat er indiceret til behandling af milde til moderate infektioner forårsaget af modtagelige isolater på grund af Staphylococcus aureus eller Streptococcus pyogenes.
Akut mellemørebetændelse
BIAXIN Filmtab og BIAXIN 250 mg granulat er indiceret til pædiatriske patienter til behandling af milde til moderate infektioner forårsaget af modtagelige isolater på grund af Haemophilus influenzae, Moraxella catarrhalis eller Streptococcus pneumoniae [se Kliniske Studier ].
Behandling og profylakse af disseminerede mykobakterielle infektioner
BIAXIN 500mg Filmtab og BIAXIN 250mg Granulat er indiceret til behandling af milde til moderate infektioner forårsaget af modtagelige isolater på grund af Mycobacterium avium eller Mycobacterium intracellulare hos patienter med fremskreden HIV-infektion [se Kliniske Studier ].
Helicobacter Pylori-infektion og duodenalsårsygdom
BIAXIN 250mg Filmtab gives i kombination med andre lægemidler til voksne som beskrevet nedenfor for at udrydde H. pylori. Udryddelse af H. pylori har vist sig at reducere risikoen for tilbagefald af duodenalsår [se Kliniske Studier ].
- BIAXIN Filmtab i kombination med amoxicillin og PREVACID (lansoprazol) eller PRILOSEC (omeprazol) kapsler med forsinket frigivelse, som tredobbelt terapi, er indiceret til behandling af patienter med H. pylori-infektion og duodenalsår (aktiv eller fem års historie med duodenal tolvfingertarmen) ulcus) for at udrydde H. pylori.
- BIAXIN 250mg Filmtab i kombination med PRILOSEC (omeprazol) kapsler er indiceret til behandling af patienter med et aktivt duodenalsår forbundet med H. pylori-infektion. Regimer, der indeholder BIAXIN 250mg Filmtab som enkelt antibakterielt middel, er mere tilbøjelige til at være forbundet med udvikling af clarithromycinresistens blandt patienter, som ikke behandles. Clarithromycin-holdige regimer bør ikke anvendes til patienter med kendte eller mistænkte clarithromycin-resistente isolater, fordi behandlingens effektivitet er reduceret i denne indstilling.
Brugsbegrænsninger
BIAXIN 500mg XL Filmtab er kun indiceret til akut maksillær bihulebetændelse, akut bakteriel forværring af kronisk bronkitis og samfundserhvervet pneumoni hos voksne. Effekten og sikkerheden af BIAXIN 500mg XL Filmtab til behandling af andre infektioner, som BIAXIN Filmtab og BIAXIN Granulat er godkendt til, er ikke blevet fastslået.
Der er resistens over for makrolider i visse bakterielle infektioner forårsaget af Streptococcus pneumoniae og Staphylococcus aureus. Følsomhedstest bør udføres, når det er klinisk indiceret.
Brug
For at reducere udviklingen af lægemiddelresistente bakterier og opretholde effektiviteten af BIAXIN og andre antibakterielle lægemidler, bør BIAXIN kun bruges til at behandle eller forebygge infektioner, der er bevist eller stærkt mistænkt for at være forårsaget af modtagelige bakterier. Når kultur- og modtagelighedsoplysninger er tilgængelige, bør de overvejes ved udvælgelse eller ændring af antibakteriel behandling. I mangel af sådanne data kan lokal epidemiologi og modtagelighedsmønstre bidrage til den empiriske udvælgelse af terapi.
DOSERING OG ADMINISTRATION
Vigtige administrationsinstruktioner
BIAXIN Filmtab og BIAXIN 250 mg granulat kan gives med eller uden mad.
BIAXIN XL Filmtab bør tages sammen med mad. Swallow BIAXIN 500mg XL Filmtab hel; BIAXIN 500mg XL Filmtab må ikke tygges, knuses eller knuses.
Voksen dosering
De anbefalede doser af BIAXIN 250mg Filmtab og BIAXIN 250mg XL Filmtab til behandling af milde til moderate infektioner hos voksne er anført i tabel 1.
Kombinationsdoseringsregimer til H. pylori-infektion
- Tredobbelt behandling: BIAXIN 500mg Filmtab/lansoprazol/amoxicillin Den anbefalede voksendosis er 500 mg BIAXIN 500 mg Filmtab, 30 mg lansoprazol og 1 gram amoxicillin, alle givet hver 12. time i 10 eller 14 dage [se INDIKATIONER OG BRUG og Kliniske Studier ].
- Tredobbelt behandling: BIAXIN Filmtab/omeprazol/amoxicillin Den anbefalede voksendosis er 500 mg BIAXIN 250 mg Filmtab, 20 mg omeprazol og 1 gram amoxicillin; alle givet hver 12. time i 10 dage. Hos patienter med et sår til stede på tidspunktet for påbegyndelse af behandlingen anbefales yderligere 18 dage med omeprazol 20 mg én gang dagligt til heling af sår og symptomlindring [se INDIKATIONER OG BRUG og Kliniske Studier ].
- Dobbeltbehandling: BIAXIN 500mg Filmtab/omeprazol Den anbefalede voksendosis er 500 mg BIAXIN 250 mg Filmtab givet hver 8. time og 40 mg omeprazol givet én gang hver morgen i 14 dage. Yderligere 14 dage med omeprazol 20 mg én gang dagligt anbefales til heling af sår og symptomlindring [se INDIKATIONER OG BRUG og Kliniske Studier ].
Pædiatrisk dosering
Den anbefalede daglige dosis er 15 mg/kg/dag fordelt hver 12. time i 10 dage (op til voksendosis). Se doseringsregimer for mykobakterielle infektioner hos pædiatriske patienter for yderligere dosisinformation [se Doseringsregimer for mykobakterielle infektioner ].
Doseringsregimer til mykobakterielle infektioner
Til behandling af dissemineret infektion på grund af Mycobacterium avium complex (MAC), anbefales BIAXIN Filmtab og BIAXIN 500mg Granulat som de primære midler. BIAXIN Filmtab og BIAXIN Granulat bør anvendes i kombination med andre antimykobakterielle lægemidler (f.eks. ethambutol), som har vist in vitro-aktivitet mod MAC eller klinisk fordel ved MAC-behandling [se Kliniske Studier ].
Voksne patienter
Til behandling og profylakse af mykobakterielle infektioner hos voksne er den anbefalede dosis af BIAXIN 500 mg hver 12. time.
Pædiatriske patienter
Til behandling og profylakse af mykobakterielle infektioner hos pædiatriske patienter er den anbefalede dosis 7,5 mg/kg hver 12. time op til 500 mg hver 12. time. [Se Brug i specifikke populationer og Kliniske Studier ].
Behandling med BIAXIN 250 mg bør fortsætte, hvis der observeres klinisk respons. BIAXIN kan seponeres, når patienten anses for at have lav risiko for spredt infektion.
Dosisjustering hos patienter med nedsat nyrefunktion
Se tabel 2 for dosisjustering hos patienter med moderat eller svær nyreinsufficiens med eller uden samtidige atazanavir- eller ritonavir-holdige regimer [se DRUGSINTERAKTIONER ].
Dosisjustering på grund af lægemiddelinteraktioner
Reducer dosis af BIAXIN 500 mg med 50 %, når det administreres sammen med atazanavir [se DRUGSINTERAKTIONER ]. Dosisjusteringer for andre lægemidler, når de administreres sammen med BIAXIN 250 mg, kan anbefales på grund af lægemiddelinteraktioner [se DRUGSINTERAKTIONER ].
Rekonstitution af BIAXIN granulat
De medfølgende BIAXIN 250 mg granulat skal rekonstitueres med vand før administration af BIAXIN til oral suspension. Tabel 3 nedenfor angiver mængden af vand, der skal tilsættes ved rekonstituering. For at rekonstituere:
Ryst godt før hver brug. Efter blanding skal den opbevares ved 15° til 30°C (59° til 86°F) og anvendes inden for 14 dage. Må ikke opbevares i køleskab.
HVORDAN LEVERET
Doseringsformer og styrker
BIAXIN 500mg fås som:
- BIAXIN 250mg Filmtab (gul oval filmovertrukket tablet):
- 250 mg: præget i blåt med "a"-logoet og KT
- 500 mg: præget med "a"-logoet på den ene side og KL på den modsatte side
- BIAXIN XL Filmtab (gul oval filmovertrukket tablet med forlænget frigivelse):
- 500 mg: præget med "a"-logoet og KJ
- BIAXIN granulat (hvidt til råhvidt granulat før rekonstituering; hvid til råhvidt uigennemsigtigt suspension efter rekonstitution):
- 125 mg/5 ml koncentration tilgængelig i 50 ml og 100 ml flasker
- 250 mg/5 mL koncentration tilgængelig i 50 mL og 100 mL flasker
Opbevaring og håndtering
BIAXIN 250mg Filmtab (clarithromycin tabletter, USP) leveres som gule ovale filmovertrukne tabletter i følgende pakningsstørrelser: 250 mg tabletter: (påtrykt i blåt med "a"-logoet og KT)
Flasker med 60 stk. NDC 0074-3368-60) og enhedsdosis-strippakninger på 100 ( NDC 0074-3368-11).
Opbevar BIAXIN Filmtab 250 mg ved kontrolleret stuetemperatur 15° til 30°C (59° til 86°F) i en godt lukket beholder. Beskyt mod lys.
500 mg tabletter : (præget med "a"-logoet på den ene side og KL på den modsatte side)
Flasker á 60 (NDC 0074-2586-60) og enhedsdosis-strippakninger á 100 ( NDC 0074-2586-11).
Opbevar BIAXIN Filmtab 500 mg ved kontrolleret stuetemperatur 20° til 25°C (68° til 77°F) i en godt lukket beholder.
BIAXIN XL Filmtab (clarithromycin tabletter med forlænget frigivelse) leveres som gule ovale filmovertrukne tabletter i følgende pakningsstørrelser:
500 mg tabletter : (præget med "a"-logoet og KJ)
Flasker á 60 (NDC 0074-3165-60), enhedsdosis-strippakninger á 100 ( NDC 0074-3165-11), og BIAXIN XL PAC karton med 4 blisterpakninger 14 tabletter hver ( NDC 0074-3165-41).
Opbevar BIAXIN 500mg XL Filmtab ved 20° til 25°C (68° til 77°F). Udflugter tilladt til 15° til 30°C (59° til 86°F). [Se USP kontrolleret rumtemperatur .]
BIAXIN 500mg granulat (clarithromycin til oral suspension, USP) leveres som hvidt til råhvidt granulat i følgende styrker og størrelser:
Opbevar BIAXIN 500mg granulat under 25°C (77°F) i en godt lukket beholder. Opbevar ikke de rekonstituerede BIAXIN 500 mg granulat i køleskab.
BIAXIN Filmtab 250 mg og 500 mg og BIAXIN 250mg XL Filmtab 500 mg Mfd. af AbbVie LTD, Barceloneta, PR 00617. BIAXIN Granulat, 125 mg/5 mL og 250 mg/5 mL Mfd. af AbbVie Inc., North Chicago, IL 60064 For AbbVie Inc., North Chicago, IL 60064, USA Revideret: nov 2018.
BIVIRKNINGER
Følgende alvorlige bivirkninger er beskrevet nedenfor og andetsteds i mærkningen:
- Akutte overfølsomhedsreaktioner [se ADVARSLER OG FORHOLDSREGLER ]
- QT-forlængelse [se ADVARSLER OG FORHOLDSREGLER ]
- Hepatotoksicitet [se ADVARSLER OG FORHOLDSREGLER ]
- Alvorlige bivirkninger på grund af samtidig brug med andre lægemidler [se ADVARSLER OG FORHOLDSREGLER ]
- Clostridium difficile associeret diarré [se ADVARSLER OG FORHOLDSREGLER ]
- Forværring af Myasthenia Gravis [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske undersøgelser udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske undersøgelser af et lægemiddel ikke direkte sammenlignes med frekvenser i de kliniske undersøgelser af et andet lægemiddel og afspejler muligvis ikke frekvenserne observeret i praksis.
Baseret på samlede data på tværs af alle indikationer er de hyppigste bivirkninger for både voksne og pædiatriske populationer observeret i kliniske forsøg mavesmerter, diarré, kvalme, opkastning og dysgeusi. Der blev også rapporteret dyspepsi, unormal leverfunktionstest, anafylaktisk reaktion, candidiasis, hovedpine, søvnløshed og udslæt.
De efterfølgende underafsnit viser de mest almindelige bivirkninger til profylakse og behandling af mykobakterielle infektioner og duodenalsår forbundet med H. pylori-infektion. Generelt stemmer disse profiler overens med de samlede data beskrevet ovenfor.
Profylakse af mykobakterielle infektioner
Hos AIDS-patienter behandlet med BIAXIN over længere perioder for profylakse mod M. avium var det ofte vanskeligt at skelne bivirkninger, der muligvis var forbundet med BIAXIN-administration, fra underliggende HIV-sygdom eller interkurrent sygdom. Median behandlingsvarighed var 10,6 måneder for BIAXIN-gruppen og 8,2 måneder for placebogruppen.
Ændringer i laboratorieværdier
Udvalgte laboratoriebivirkninger, der blev rapporteret under behandling hos mere end 2 % af voksne patienter behandlet med BIAXIN i et randomiseret dobbeltblindet klinisk forsøg med 682 patienter, er vist i tabel 5.
Hos immunkompromitterede patienter, der fik profylakse mod M. avium, blev der foretaget evalueringer af laboratorieværdier ved at analysere disse værdier uden for den alvorligt abnorme værdi (dvs. den ekstreme høje eller lave grænse) for den specificerede test.
Behandling af mykobakterielle infektioner
Bivirkningsprofilerne for både 500 mg og 1000 mg to gange dagligt dosisregimer var ens.
Hos AIDS-patienter og andre immunkompromitterede patienter behandlet med de højere doser af BIAXIN over lange perioder for mykobakterielle infektioner, var det ofte vanskeligt at skelne bivirkninger, der muligvis er forbundet med BIAXIN 250 mg administration, fra underliggende tegn på HIV-sygdom eller interkurrent sygdom.
Den følgende analyse opsummerer erfaringerne i løbet af de første 12 ugers behandling med BIAXIN. Data er rapporteret separat for forsøg 1 (randomiseret, dobbeltblindt) og forsøg 2 (åbent mærket, compassionate use) og også kombineret. Bivirkninger blev rapporteret mindre hyppigt i forsøg 2, hvilket til dels kan skyldes forskelle i monitorering mellem de to studier.
Hos voksne patienter, der får BIAXIN 500 mg to gange dagligt, er de hyppigst rapporterede bivirkninger, der anses for muligvis eller muligvis relateret til undersøgelseslægemidlet, med en forekomst på 5 % eller mere, anført nedenfor (tabel 6). Ca. 8 % af patienterne, der fik 500 mg to gange dagligt, og 12 % af patienterne, der fik 1000 mg to gange dagligt, afbrød behandlingen på grund af lægemiddelrelaterede bivirkninger i løbet af de første 12 uger af behandlingen; bivirkninger, der førte til seponering hos mindst 2 patienter, omfattede kvalme, opkastning, mavesmerter, diarré, udslæt og asteni.
Et begrænset antal pædiatriske AIDS-patienter er blevet behandlet med BIAXIN suspension for mykobakterielle infektioner. De hyppigst rapporterede bivirkninger, bortset fra dem, der skyldes patientens samtidige tilstande, var i overensstemmelse med dem, der blev observeret hos voksne patienter.
Ændringer i laboratorieværdier
I de første 12 uger efter start med BIAXIN 500 mg to gange dagligt, har 3 % af patienterne SGOT-stigninger, og 2 % af patienterne har SGPT-stigninger > 5 gange den øvre grænse for normal i forsøg 2 (469 inkluderede voksne patienter), mens forsøg 1 (154 tilmeldte patienter) havde ingen forhøjelse af transaminaser. Dette omfatter kun patienter med baseline-værdier inden for normalområdet eller lave grænseværdier.
Duodenalsår associeret med H. pylori-infektion
kliniske forsøg med kombinationsbehandling med BIAXIN 500 mg plus omeprazol og amoxicillin er der ikke observeret bivirkninger, der er specifikke for kombinationen af disse lægemidler. Bivirkninger, der er opstået, har været begrænset til dem, der tidligere er blevet rapporteret med BIAXIN 250 mg, omeprazol eller amoxicillin.
Bivirkningsprofilerne er vist nedenfor (tabel 7) for fire randomiserede dobbeltblindede kliniske forsøg, hvor patienterne fik kombinationen af BIAXIN 500 mg tre gange dagligt og omeprazol 40 mg dagligt i 14 dage efterfulgt af omeprazol 20 mg én gang pr. dag, (tre undersøgelser) eller 40 mg én gang dagligt (én undersøgelse) i yderligere 14 dage. Af de 346 patienter, der fik kombinationen, ophørte 3,5 % af patienterne med lægemidlet på grund af bivirkninger.
Ændringer i laboratorieværdier
Ændringer i laboratorieværdier med mulig klinisk betydning hos patienter, der tager BIAXIN og omeprazol i fire randomiserede dobbeltblindede forsøg med 945 patienter, er som følger:
Hepatisk forhøjet direkte bilirubin
Mindre hyppige bivirkninger observeret under kliniske forsøg med clarithromycin
Baseret på poolede data på tværs af alle indikationer blev følgende bivirkninger observeret i kliniske forsøg med clarithromycin i en hastighed på mindre end 1 %:
Blod og lymfesystem lidelser: Leukopeni, neutropeni, trombocytæmi, eosinofili
Hjertelidelser: Elektrokardiogram QT forlænget, hjertestop, atrieflimren, ekstrasystoler, hjertebanken
Øre- og labyrintlidelser: Vertigo, tinnitus, hørehæmmede
Gastrointestinale lidelser: Stomatitis, glossitis, esophagitis, gastroøsofageal reflukssygdom, gastritis, proctalgi, abdominal udspilning, obstipation, mundtørhed, udbrud, flatulens
Generelle lidelser og administrationsbetingelser: Malaise, pyreksi, asteni, brystsmerter, kulderystelser, træthed
Lever og galdeveje: Kolestase, hepatitis
Forstyrrelser i immunsystemet: Overfølsomhed
Infektioner og angreb: Cellulitis, gastroenteritis, infektion, vaginal infektion
Undersøgelser: Forhøjet bilirubin i blodet, forhøjet alkalisk fosfatase i blodet, øget blodlaktatdehydrogenase, unormalt albuminglobulinforhold
Metabolisme og ernæringsforstyrrelser: Anoreksi, nedsat appetit
Muskuloskeletale og bindevævslidelser: Myalgi, muskelspasmer, nakkestivhed
Forstyrrelser i nervesystemet: Svimmelhed, tremor, bevidsthedstab, dyskinesi, somnolens
Psykiatriske lidelser: Angst, nervøsitet
Nyre- og urinvejslidelser: Kreatinin i blodet steg, urinstof i blodet steg
Åndedræts-, thorax- og mediastinale lidelser: Astma, epistaxis, lungeemboli
Hud- og subkutane vævsforstyrrelser: Nældefeber, dermatitis bulløs, pruritus, hyperhidrose, maculo-papulært udslæt
Gastrointestinale bivirkninger
undersøgelser af akut forværring af kronisk bronkitis og akut maksillær bihulebetændelse blev overordnede gastrointestinale bivirkninger rapporteret af en tilsvarende andel af patienter, der tog enten BIAXIN 250mg Filmtab eller BIAXIN 500mg XL Filmtab; dog rapporterede patienter, der tog BIAXIN 500mg XL Filmtab, signifikant mindre alvorlige gastrointestinale symptomer sammenlignet med patienter, der tog BIAXIN 250mg Filmtab. Derudover havde patienter, der tog BIAXIN 500mg XL Filmtab, signifikant færre for tidlige seponeringer på grund af lægemiddelrelaterede gastrointestinale eller unormale smagsbivirkninger sammenlignet med BIAXIN Filmtab.
Dødelighed af alle årsager hos patienter med koronararteriesygdom 1 til 10 år efter eksponering for BIAXIN
et klinisk forsøg, der evaluerede behandling med clarithromycin på resultater hos patienter med koronararteriesygdom, blev der observeret en stigning i risikoen for dødelighed af alle årsager hos patienter randomiseret til clarithromycin. Clarithromycin til behandling af koronararteriesygdom er ikke en godkendt indikation. Patienterne blev behandlet med clarithromycin eller placebo i 14 dage og observeret for primære udfaldshændelser (f.eks. dødelighed af alle årsager eller ikke-dødelige hjertehændelser) i flere år.1 Et numerisk højere antal primære udfaldshændelser hos patienter randomiseret til at modtage clarithromycin var observeret med et hazard ratio på 1,06 (95 % konfidensinterval 0,98 til 1,14). Ved opfølgning 10 år efter behandling var der dog 866 (40 %) dødsfald i clarithromycingruppen og 815 (37 %) dødsfald i placebogruppen, hvilket repræsenterede et hazard ratio for dødelighed af alle årsager på 1,10 (95 % konfidensinterval 1,00 til 1,21). Forskellen i antallet af dødsfald viste sig efter et år eller mere efter endt behandling.
Årsagen til forskellen i dødelighed af alle årsager er ikke fastlagt. Andre epidemiologiske undersøgelser, der evaluerer denne risiko, har vist variable resultater [se ADVARSLER OG FORHOLDSREGLER ].
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af BIAXIN efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Blod og lymfesystem: Trombocytopeni, agranulocytose
Hjerte: Ventrikulær arytmi, ventrikulær takykardi, torsades de pointes
Øre og labyrint: Døvhed blev primært rapporteret hos ældre kvinder og var normalt reversibel.
Gastrointestinale: Akut pancreatitis, misfarvning af tungen, misfarvning af tænder blev rapporteret og var normalt reversibel med professionel rengøring ved seponering af lægemidlet.
Der har været rapporter om BIAXIN 250mg XL Filmtab i afføringen, hvoraf mange er forekommet hos patienter med anatomiske (inklusive ileostomi eller kolostomi) eller funktionelle gastrointestinale lidelser med kortere GI transittider. I flere rapporter er der opstået tabletrester i forbindelse med diarré. Det anbefales, at patienter, som oplever tabletrester i afføringen og ingen forbedring af deres tilstand, skifter til en anden clarithromycinformulering (f.eks. suspension) eller et andet antibakterielt lægemiddel.
Lever og galde: Leversvigt, gulsot hepatocellulært. Bivirkninger relateret til leverdysfunktion er blevet rapporteret med clarithromycin [se ADVARSLER OG FORHOLDSREGLER ].
Infektioner og angreb: Pseudomembranøs colitis [se ADVARSLER OG FORHOLDSREGLER ]
Immunsystem: Anafylaktiske reaktioner, angioødem
Undersøgelser: Protrombintiden forlænges, antallet af hvide blodlegemer faldt, internationalt normaliseret forhold steg. Unormal urinfarve er blevet rapporteret, forbundet med leversvigt.
Metabolisme og ernæring: Hypoglykæmi er blevet rapporteret hos patienter, der tager orale hypoglykæmiske midler eller insulin.
Muskuloskeletale og bindevæv: Myopati rhabdomyolyse blev rapporteret, og i nogle af rapporterne blev clarithromycin administreret samtidig med statiner, fibrater, colchicin eller allopurinol [se KONTRAINDIKATIONER og ADVARSLER OG FORHOLDSREGLER ].
Nervesystem: Parosmi, anosmi, ageusia, paræstesi og kramper
Psykiatrisk: Unormal adfærd, forvirringstilstand, depersonalisering, desorientering, hallucinationer, depression, manisk adfærd, unormal drøm, psykotisk lidelse. Disse lidelser forsvinder normalt ved seponering af lægemidlet.
Nyre og urinveje: Nephritis interstitiel, nyresvigt
Hud og subkutant væv: Stevens-Johnsons syndrom, toksisk epidermal nekrolyse, lægemiddeludslæt med eosinofili og systemiske symptomer (DRESS), Henoch-Schonlein purpura, acne, akut generaliseret eksantematøs pustulose
Vaskulær: Blødning
DRUGSINTERAKTIONER
Samtidig administration af BIAXIN 250 mg er kendt for at hæmme CYP3A, og et lægemiddel, der primært metaboliseres af CYP3A, kan være forbundet med forhøjede lægemiddelkoncentrationer, der kan øge eller forlænge både terapeutiske og bivirkninger af det samtidige lægemiddel.
BIAXIN bør anvendes med forsigtighed til patienter, der modtager behandling med andre lægemidler, der vides at være CYP3A-enzymsubstrater, især hvis CYP3A-substratet har en snæver sikkerhedsmargin (f.eks. carbamazepin), og/eller substratet metaboliseres i vid udstrækning af dette enzym. Juster dosis, når det er relevant, og overvåg serumkoncentrationer af lægemidler, der primært metaboliseres af CYP3A, nøje hos patienter, der samtidig får clarithromycin.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Akutte overfølsomhedsreaktioner
tilfælde af alvorlige akutte overfølsomhedsreaktioner, såsom anafylaksi, Stevens-Johnsons syndrom, toksisk epidermal nekrolyse, lægemiddeludslæt med eosinofili og systemiske symptomer (DRESS), Henoch-Schonlein purpura og akut generaliseret eksantematøs pustulose, afbryd behandlingen med det samme og BIAXIN 250maxIN iværksætte passende behandling.
QT forlængelse
BIAXIN 500mg er blevet forbundet med forlængelse af QT-intervallet og sjældne tilfælde af arytmi. Tilfælde af torsades de pointes er blevet spontant rapporteret under postmarketingovervågning hos patienter, der fik BIAXIN. Der er rapporteret om dødsfald.
Undgå BIAXIN hos følgende patienter:
- patienter med kendt forlængelse af QT-intervallet, ventrikulær hjertearytmi, inklusive torsades de pointes
- patienter, der får lægemidler, der vides at forlænge QT-intervallet [se også KONTRAINDIKATIONER ]
- patienter med igangværende proarytmiske tilstande såsom ukorrigeret hypokaliæmi eller hypomagnesæmi, klinisk signifikant bradykardi og hos patienter, der får klasse IA (f.eks. quinidin, procainamid, disopyramid) eller klasse III (f.eks. dofetilid, amiodaron, sotalol) antiarytmika.
Ældre patienter kan være mere modtagelige for lægemiddelrelaterede effekter på QT-intervallet [se Brug i specifikke populationer ].
Hepatotoksicitet
Leverdysfunktion, herunder øgede leverenzymer, og hepatocellulær og/eller kolestatisk hepatitis, med eller uden gulsot, er blevet rapporteret med clarithromycin. Denne leverdysfunktion kan være alvorlig og er normalt reversibel. I nogle tilfælde er leversvigt med dødelig udgang blevet rapporteret og har generelt været forbundet med alvorlige underliggende sygdomme og/eller samtidig medicin. Symptomer på hepatitis kan omfatte anoreksi, gulsot, mørk urin, pruritus eller øm mave. Afbryd straks BIAXIN 500mg, hvis der opstår tegn og symptomer på hepatitis.
Alvorlige bivirkninger på grund af samtidig brug med andre lægemidler
Lægemidler metaboliseret af CYP3A4
Alvorlige bivirkninger er blevet rapporteret hos patienter, der tager BIAXIN samtidig med CYP3A4-substrater. Disse omfatter colchicin toksicitet med colchicin; rhabdomyolyse med simvastatin, lovastatin og atorvastatin; hypoglykæmi og hjertearytmier (f.eks. torsades de pointes) med disopyramid; hypotension og akut nyreskade med calciumkanalblokkere metaboliseret af CYP3A4 (f.eks. verapamil, amlodipin, diltiazem, nifedipin). De fleste rapporter om akut nyreskade med calciumkanalblokkere metaboliseret af CYP3A4 involverede ældre patienter på 65 år eller ældre. Brug BIAXIN 500mg med forsigtighed, når det administreres samtidig med medicin, der inducerer cytokrom CYP3A4-enzymet. Brugen af BIAXIN 250mg med simvastatin, lovastatin, ergotamin eller dihydroergotamin er kontraindiceret [se KONTRAINDIKATIONER og DRUGSINTERAKTIONER ].
Colchicin
Livstruende og fatale lægemiddelinteraktioner er blevet rapporteret hos patienter behandlet med BIAXIN og colchicin. Clarithromycin er en stærk CYP3A4-hæmmer, og denne interaktion kan forekomme, mens du bruger begge lægemidler i de anbefalede doser. Hvis samtidig administration af BIAXIN og colchicin er nødvendig hos patienter med normal nyre- og leverfunktion, reduceres dosis af colchicin. Overvåg patienter for kliniske symptomer på colchicin toksicitet. Samtidig administration af BIAXIN 500 mg og colchicin er kontraindiceret hos patienter med nedsat nyre- eller leverfunktion [se KONTRAINDIKATIONER og DRUGSINTERAKTIONER ].
HMG-CoA-reduktasehæmmere (statiner)
Samtidig brug af BIAXIN og lovastatin eller simvastatin er kontraindiceret [se KONTRAINDIKATIONER da disse statiner i vid udstrækning metaboliseres af CYP3A4, og samtidig behandling med BIAXIN øger deres plasmakoncentration, hvilket øger risikoen for myopati, herunder rhabdomyolyse. Der er rapporteret tilfælde af rhabdomyolyse hos patienter, der tager BIAXIN samtidig med disse statiner. Hvis behandling med BIAXIN ikke kan undgås, skal behandling med lovastatin eller simvastatin suspenderes under behandlingsforløbet.
Udvis forsigtighed, når du ordinerer BIAXIN 250mg med atorvastatin eller pravastatin. I situationer, hvor samtidig brug af BIAXIN og atorvastatin eller pravastatin ikke kan undgås, bør atorvastatindosis ikke overstige 20 mg dagligt, og pravastatindosis bør ikke overstige 40 mg dagligt. Brug af et statin, der ikke er afhængig af CYP3A-metabolisme (f.eks. fluvastatin), kan overvejes. Det anbefales at ordinere den laveste registrerede dosis, hvis samtidig brug ikke kan undgås.
Orale hypoglykæmiske midler/insulin
Samtidig brug af BIAXIN 500 mg og orale hypoglykæmiske midler og/eller insulin kan resultere i signifikant hypoglykæmi. Med visse hypoglykæmiske lægemidler, såsom nateglinid, pioglitazon, repaglinid og rosiglitazon, kan hæmning af CYP3A-enzymet af clarithromycin være involveret og kan forårsage hypoglykæmi, når det bruges samtidigt. Omhyggelig overvågning af glukose anbefales [se DRUGSINTERAKTIONER ].
Quetiapin
Brug quetiapin og clarithromycin samtidig med forsigtighed. Samtidig administration kan resultere i øget eksponering for quetiapin og quetiapin-relaterede toksiciteter såsom somnolens, ortostatisk hypotension, ændret bevidsthedstilstand, malignt neuroleptikasyndrom og QT-forlængelse. Se quetiapins ordinationsinformation for anbefalinger om dosisreduktion, hvis det administreres sammen med CYP3A4-hæmmere såsom clarithromycin [se DRUGSINTERAKTIONER ].
Orale antikoagulantia
Der er risiko for alvorlig blødning og signifikante stigninger i INR og protrombintid, når BIAXIN administreres sammen med warfarin. Overvåg INR- og protrombintider ofte, mens patienter får BIAXIN og orale antikoagulantia samtidigt [se DRUGSINTERAKTIONER ].
Benzodiazepiner
Øget sedation og forlængelse af sedation er blevet rapporteret ved samtidig administration af BIAXIN 250mg og triazolobenzodiazepiner, såsom triazolam og midazolam [se DRUGSINTERAKTIONER ].
Dødelighed af alle årsager hos patienter med koronararteriesygdom 1 til 10 år efter BIAXIN-eksponering
et klinisk forsøg, der evaluerede behandling med clarithromycin på resultater hos patienter med koronararteriesygdom, blev der observeret en stigning i risikoen for dødelighed af alle årsager et år eller mere efter endt behandling hos patienter randomiseret til at modtage clarithromycin.1 Clarithromycin til behandling af koronar arteriesygdom er ikke en godkendt indikation. Årsagen til den øgede risiko er ikke fastlagt. Andre epidemiologiske undersøgelser, der evaluerer denne risiko, har vist variable resultater [se BIVIRKNINGER ]. Overvej at balancere denne potentielle risiko med behandlingsfordelene, når BIAXIN ordineres til patienter, der har mistanke om eller bekræftet koronararteriesygdom.
Clostridium Difficile Associeret Diarré
Clostridium difficile-associeret diarré (CDAD) er blevet rapporteret ved brug af næsten alle antibakterielle midler, inklusive BIAXIN, og kan variere i sværhedsgrad fra mild diarré til fatal colitis. Behandling med antibakterielle midler ændrer den normale flora i tyktarmen, hvilket fører til overvækst af C. difficile.
C. difficile producerer toksinerne A og B, som bidrager til udviklingen af CDAD. Hypertoksinproducerende stammer af C. difficile forårsager øget morbiditet og dødelighed, da disse infektioner kan være modstandsdygtige over for antimikrobiel behandling og kan kræve kolektomi. CDAD skal overvejes hos alle patienter, som får diarré efter antibakteriel brug. Omhyggelig sygehistorie er nødvendig, da CDAD er blevet rapporteret at forekomme over to måneder efter administration af antibakterielle midler.
Hvis CDAD er mistænkt eller bekræftet, kan det være nødvendigt at afbryde igangværende antibakteriel brug, der ikke er rettet mod C. difficile. Passende væske- og elektrolytbehandling, proteintilskud, antibakteriel behandling af C. difficile og kirurgisk evaluering bør iværksættes som klinisk indiceret.
Embryofetal toksicitet
Clarithromycin bør ikke anvendes til gravide kvinder undtagen under kliniske omstændigheder, hvor ingen alternativ behandling er passende. Hvis BIAXIN 500mg anvendes under graviditet, eller hvis graviditet opstår, mens patienten tager dette lægemiddel, skal patienten informeres om den potentielle fare for fosteret. Clarithromycin har påvist negative virkninger på graviditetsudfald og/eller embryo-føtal udvikling hos aber, rotter, mus og kaniner ved doser, der producerede plasmaniveauer 2 gange til 17 gange serumniveauerne opnået hos mennesker behandlet med de maksimalt anbefalede humane doser [se Brug i specifikke populationer ].
Forværring af Myasthenia Gravis
Forværring af symptomer på myasthenia gravis og nye indtræden af symptomer på myasthenisk syndrom er blevet rapporteret hos patienter i behandling med BIAXIN 250 mg.
Udvikling af lægemiddelresistente bakterier
Udskrivning af BIAXIN i fravær af en påvist eller stærkt mistænkt bakteriel infektion eller en profylaktisk indikation er usandsynligt, at gavn for patienten og øger risikoen for udvikling af lægemiddelresistente bakterier.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Følgende in vitro mutagenicitetstest er blevet udført med clarithromycin:
- Salmonella/pattedyrmikrosomtest
- Bakterieinduceret mutationsfrekvenstest
- In vitro kromosomafvigelsestest
- Rotte-hepatocyt-DNA-synteseassay
- Muse lymfom assay
- Musedominerende dødelig undersøgelse
- Mus mikronukleus test
Alle tests havde negative resultater undtagen in vitro kromosomafvigelsestesten, som var positiv i én test og negativ i en anden. Derudover er der udført en bakteriel omvendt mutationstest (Ames-test) på clarithromycinmetabolitter med negative resultater.
Forringelse af fertilitet
Fertilitets- og reproduktionsundersøgelser har vist, at daglige doser på op til 160 mg/kg/ til han- og hunrotter ikke forårsagede skadelige virkninger på brunstcyklus, fertilitet, fødsel eller antal og levedygtighed af afkom. Plasmaniveauer hos rotter efter 150 mg/kg/dag var det dobbelte af humane serumniveauer.
Testikelatrofi forekom hos rotter ved doser 7 gange, hos hunde ved doser 3 gange og hos aber ved doser 8 gange større end den maksimale humane daglige dosis (på kropsoverfladebasis).
Brug i specifikke populationer
Graviditet
Teratogene virkninger
Graviditetskategori C
Clarithromycin bør ikke anvendes til gravide kvinder undtagen under kliniske omstændigheder, hvor ingen alternativ behandling er passende. Hvis der opstår graviditet, mens du tager dette lægemiddel, skal patienten informeres om den potentielle fare for fosteret [se ADVARSLER OG FORHOLDSREGLER ].
Fire teratogenicitetsundersøgelser hos rotter (tre med orale doser og en med intravenøse doser på op til 160 mg/kg/dag administreret i perioden med større organogenese) og to på kaniner ved orale doser op til 125 mg/kg/dag (ca. Den anbefalede maksimale humane dosis baseret på mg/m²) eller intravenøse doser på 30 mg/kg/dag administreret under graviditetsdage 6 til 18 viste ikke nogen teratogenicitet fra clarithromycin. To yderligere orale undersøgelser i en anden rottestamme ved lignende doser og lignende tilstande viste en lav forekomst af kardiovaskulære anomalier ved doser på 150 mg/kg/dag administreret under drægtighedsdage 6 til 15.
Plasmaniveauer efter 150 mg/kg/dag var det dobbelte af humane serumniveauer. Fire undersøgelser med mus afslørede en variabel forekomst af ganespalte efter orale doser på 1000 mg/kg/dag (henholdsvis 2 og 4 gange den anbefalede maksimale humane dosis baseret på mg/m²) under drægtighedsdage 6 til 15. Ganespalte var også set ved 500 mg/kg/dag. Eksponeringen på 1000 mg/kg/dag resulterede i plasmaniveauer på 17 gange de humane serumniveauer. Hos aber gav en oral dosis på 70 mg/kg/dag fostervæksthæmning ved plasmaniveauer, der var dobbelt så høje som humane serumniveauer.
Ammende mødre
Der skal udvises forsigtighed, når BIAXIN administreres til ammende kvinder. Udviklingen og de sundhedsmæssige fordele ved fodring med modermælk bør overvejes sammen med moderens kliniske behov for BIAXIN og eventuelle negative virkninger på det modermælkefodrede barn fra lægemidlet eller fra den underliggende moderens tilstand.
Clarithromycin og dets aktive metabolit 14-hydroxy clarithromycin udskilles i modermælk. Serum- og mælkeprøver blev opnået efter 3 dages behandling, ved steady state, fra en offentliggjort undersøgelse af 12 ammende kvinder, som tog BIAXIN 250 mg oralt to gange dagligt. Baseret på de begrænsede data fra denne undersøgelse og forudsat et mælkeforbrug på 150 ml/kg/dag, vil et spædbarn, der udelukkende fodres med modermælk, modtage et estimeret gennemsnit på 136 mcg/kg/dag af clarithromycin og dets aktive metabolit med denne maternelle dosis kur. Dette er mindre end 2 % af moderens vægtjusterede dosis (7,8 mg/kg/dag, baseret på moderens gennemsnitlige vægt på 64 kg), og mindre end 1 % af den pædiatriske dosis (15 mg/kg/dag) for børn over 6 måneder.
En prospektiv observationsundersøgelse af 55 ammede spædbørn af mødre, der tog et makrolid antibakterielt middel (6 blev udsat for clarithromycin) blev sammenlignet med 36 ammede spædbørn af mødre, der tog amoxicillin. Bivirkningerne var sammenlignelige i begge grupper. Bivirkninger forekom hos 12,7 % af spædbørn, der blev eksponeret for makrolider, og omfattede udslæt, diarré, appetitløshed og somnolens.
Pædiatrisk brug
Sikkerheden og effektiviteten af BIAXIN Filmtab og BIAXIN 500 mg granulat er blevet fastslået til behandling af følgende tilstande eller sygdomme hos pædiatriske patienter 6 måneder og ældre. Anvendelse til disse indikationer er baseret på kliniske forsøg hos pædiatriske patienter eller tilstrækkelige og velkontrollerede undersøgelser hos voksne med yderligere farmakokinetiske og sikkerhedsdata hos pædiatriske patienter:
- Pharyngitis/Tonsillitis
- Samfundserhvervet lungebetændelse
- Akut maksillær bihulebetændelse
- Akut mellemørebetændelse [se Kliniske Studier ]
- Ukomplicerede hud- og hudstrukturinfektioner
Sikkerheden og effektiviteten af BIAXIN 500mg Filmtab og BIAXIN 500mg granulat er blevet etableret til forebyggelse af dissemineret Mycobacterium avium kompleks (MAC) sygdom hos pædiatriske patienter 20 måneder og ældre med fremskreden HIV-infektion. Der er ikke udført undersøgelser af BIAXIN til MAC-profylakse i pædiatriske populationer, og de doser, der anbefales til profylakse, er afledt af MAC-pædiatriske behandlingsundersøgelser.
Sikkerheden og effektiviteten af BIAXIN 500mg XL Filmtab til behandling af pædiatriske patienter er ikke blevet fastslået.
Sikkerhed og effektivitet af BIAXIN 250 mg hos pædiatriske patienter under 6 måneder er ikke blevet fastlagt. Sikkerheden af BIAXIN 500mg er ikke blevet undersøgt hos MAC-patienter under 20 måneder.
Geriatrisk brug
et steady-state studie, hvor raske ældre forsøgspersoner (65 år til 81 år) fik 500 mg BIAXIN hver 12. time, blev de maksimale serumkoncentrationer og arealet under kurverne for clarithromycin og 14-OH clarithromycin øget sammenlignet med dem, der opnås hos raske unge voksne. Disse ændringer i farmakokinetik parallelt med kendte aldersrelaterede fald i nyrefunktionen. I kliniske forsøg havde ældre patienter ikke en øget forekomst af bivirkninger sammenlignet med yngre patienter. Overvej dosisjustering hos ældre patienter med svært nedsat nyrefunktion. Ældre patienter kan være mere modtagelige for udvikling af torsades de pointes arytmier end yngre patienter [se ADVARSLER OG FORHOLDSREGLER ].
De fleste rapporter om akut nyreskade med calciumkanalblokkere metaboliseret af CYP3A4 (f.eks. verapamil, amlodipin, diltiazem, nifedipin) involverede ældre patienter på 65 år eller ældre [se ADVARSLER OG FORHOLDSREGLER ].
Især hos ældre patienter har der været rapporter om colchicintoksicitet ved samtidig brug af clarithromycin og colchicin, hvoraf nogle forekom hos patienter med nyreinsufficiens. Dødsfald er blevet rapporteret hos nogle patienter [se KONTRAINDIKATIONER og ADVARSLER OG FORHOLDSREGLER ].
Nyre- og leverinsufficiens
BIAXIN 500mg udskilles hovedsageligt via leveren og nyrerne. BIAXIN kan administreres uden dosisjustering til patienter med nedsat leverfunktion og normal nyrefunktion. Ved alvorlig nyreinsufficiens med eller uden samtidig leverinsufficiens kan reduceret dosis eller forlængede doseringsintervaller være passende [se DOSERING OG ADMINISTRATION ].
REFERENCER
1.Winkel P, Hilden J, Hansen JF, Kastrup J, Kolmos HJ, Kjøller E, et al. Clarithromycin til stabil koronar hjertesygdom øger alle årsager og kardiovaskulær mortalitet og cerebrovaskulær morbiditet over 10 år i det randomiserede, blindede kliniske CLARICOR-studie. Int J Cardiol 2015;182:459-65.
OVERDOSIS
Overdosering af BIAXIN kan forårsage gastrointestinale symptomer såsom mavesmerter, opkastning, kvalme og diarré.
Behandle bivirkninger, der ledsager overdosering, ved hurtig eliminering af uabsorberet lægemiddel og understøttende foranstaltninger. Som med andre makrolider forventes BIAXIN serumkoncentrationer ikke at blive mærkbart påvirket af hæmodialyse eller peritonealdialyse.
KONTRAINDIKATIONER
Overfølsomhed
BIAXIN er kontraindiceret hos patienter med kendt overfølsomhed over for clarithromycin, erythromycin eller et hvilket som helst af de antibakterielle makrolidmidler [se ADVARSLER OG FORHOLDSREGLER ].
Hjertearytmier
Samtidig administration af BIAXIN med cisaprid og pimozid er kontraindiceret [se DRUGSINTERAKTIONER ].
Der har været rapporter efter markedsføring om lægemiddelinteraktioner, når clarithromycin administreres sammen med cisaprid eller pimozid, hvilket resulterer i hjertearytmier (QT-forlængelse, ventrikulær takykardi, ventrikulær fibrillation og torsades de pointes), sandsynligvis på grund af hæmning af disse lægemidlers metabolisme af BIAX. . Der er rapporteret om dødsfald.
Kolestatisk gulsot/hepatisk dysfunktion
BIAXIN er kontraindiceret til patienter med en historie med kolestatisk gulsot eller leverdysfunktion forbundet med tidligere brug af clarithromycin.
Colchicin
Samtidig administration af BIAXIN og colchicin er kontraindiceret hos patienter med nedsat nyre- eller leverfunktion.
HMG-CoA-reduktasehæmmere
Brug ikke BIAXIN samtidig med HMG-CoA-reduktasehæmmere (statiner), som i vid udstrækning metaboliseres af CYP3A4 (lovastatin eller simvastatin), på grund af den øgede risiko for myopati, herunder rabdomyolyse [se ADVARSLER OG FORHOLDSREGLER og DRUGSINTERAKTIONER ].
Ergot Alkaloider
Samtidig administration af clarithromycin og ergotamin eller dihydroergotamin er kontraindiceret [se DRUGSINTERAKTIONER ].
Kontraindikationer for samtidig administrerede lægemidler
For information om kontraindikationer for andre lægemidler, der er indiceret i kombination med BIAXIN, henvises til deres fulde ordinationsinformation (afsnittet kontraindikationer).
KLINISK FARMAKOLOGI
Handlingsmekanisme
Clarithromycin er et makrolid antimikrobielt lægemiddel [se Mikrobiologi ].
Farmakokinetik
Absorption
BIAXIN 250mg Filmtab tabletter med øjeblikkelig frigivelse
Den absolutte biotilgængelighed af 250 mg clarithromycin-tabletter var ca. 50 %. For en enkelt 500 mg dosis af clarithromycin, forsinker mad en smule begyndelsen af clarithromycin absorption, hvilket øger spidsbelastningstiden fra ca. 2 til 2,5 timer. Mad øger også clarithromycins maksimale plasmakoncentration med ca. 24 %, men påvirker ikke omfanget af clarithromycins biotilgængelighed. Føde påvirker ikke starten af dannelsen af den aktive metabolit, 14-OH clarithromycin eller dens maksimale plasmakoncentration, men reducerer en smule omfanget af metabolitdannelsen, angivet ved et 11 % fald i arealet under plasmakoncentration-tid-kurven (AUC). . Derfor kan BIAXIN Filmtab gives uden hensyntagen til mad. Hos ikke-fastende raske mennesker (mænd og kvinder) blev maksimale plasmakoncentrationer opnået inden for 2 til 3 timer efter oral dosering.
BIAXIN 500mg XL Filmtab-tabletter med forlænget udgivelse
Clarithromycin-tabletter med forlænget frigivelse giver forlænget absorption af clarithromycin fra mave-tarmkanalen efter oral administration. I forhold til en tilsvarende total daglig dosis af clarithromycin-tabletter med øjeblikkelig frigivelse giver clarithromycin-tabletter med forlænget frigivelse lavere og senere steady-state peak plasmakoncentrationer, men tilsvarende 24-timers AUC'er for både clarithromycin og dets mikrobiologisk aktive metabolit, 14-OH clarithromycin. Mens omfanget af dannelsen af 14-OH clarithromycin efter administration af BIAXIN 500mg XL Filmtab (2 x 500 mg tabletter én gang dagligt) ikke påvirkes af mad, er administration under fastende forhold forbundet med ca. 30 % lavere clarithromycin AUC i forhold til administration sammen med mad . Derfor bør BIAXIN 250mg XL Filmtab tages sammen med mad.
Figur 2: Steady-State Clarithromycin Plasma Koncentration-Time Profiler 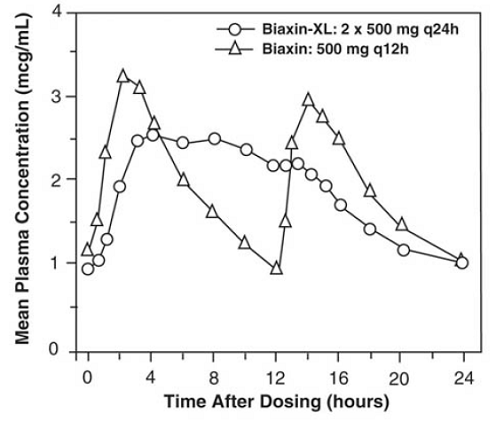
BIAXIN Granulat Til Oral Suspension
Når 250 mg doser af clarithromycin som BIAXIN som oral suspension blev administreret til fastende raske voksne forsøgspersoner, blev maksimale plasmakoncentrationer opnået omkring 3 timer efter dosering.
For voksne patienter svarer biotilgængeligheden af 10 mL af 125 mg/5 mL suspensionen eller 10 mL af 250 mg/5 mL suspensionen til henholdsvis en 250 mg eller 500 mg tablet.
Hos voksne, der fik 250 mg clarithromycin som suspension (n = 22), syntes mad at sænke den gennemsnitlige maksimale plasmakoncentration af clarithromycin fra 1,2 (± 0,4) mcg/mL til 1,0 (± 0,4) mcg/mL og absorptionsgraden fra 7,2 (± 0,4) 2,5) hr•mcg/ml til 6,5 (± 3,7) hr•mcg/ml.
Fordeling
Clarithromycin og 14-OH clarithromycin metabolitten fordeler sig let i kropsvæv og væsker. Der er ingen tilgængelige data om cerebrospinalvæskepenetration. På grund af høje intracellulære koncentrationer er vævskoncentrationer højere end serumkoncentrationer. Eksempler på vævs- og serumkoncentrationer er vist nedenfor.
Metabolisme og eliminering
BIAXIN 500mg Filmtab tabletter med øjeblikkelig frigivelse
Steady-state peak plasma clarithromycin koncentrationer blev opnået inden for 3 dage og var ca. 1 mcg/ml til 2 mcg/ml med en 250 mg dosis administreret hver 12. time og 3 mcg/ml til 4 mcg/ml med en 500 mg dosis administreret hver 8 timer til 12 timer. Eliminationshalveringstiden for clarithromycin var ca. 3 timer til 4 timer med 250 mg administreret hver 12. time, men øget til 5 timer til 7 timer med 500 mg administreret hver 8. time til 12 timer. Ikke-lineariteten af clarithromycins farmakokinetik er lille ved de anbefalede doser på 250 mg og 500 mg administreret hver 8. time til 12. time. Med en dosering på 250 mg hver 12. time opnår hovedmetabolitten, 14-OH clarithromycin, en maksimal steady-state koncentration på ca. 0,6 mcg/ml og har en eliminationshalveringstid på 5 timer til 6 timer. Med en dosering på 500 mg hver 8. time til 12 timer er den maksimale steady-state koncentration af 14-OH clarithromycin lidt højere (op til 1 mcg/ml), og dets eliminationshalveringstid er ca. 7 timer til 9 timer. Med nogen af disse doseringsregimer opnås steady-state-koncentrationen af denne metabolit generelt inden for 3 dage til 4 dage.
Efter en 250 mg tablet hver 12. time udskilles cirka 20 % af dosis i urinen som clarithromycin, mens efter en 500 mg tablet hver 12. time er urinudskillelsen af clarithromycin noget større, cirka 30 %. Til sammenligning, efter en oral dosis på 250 mg (125 mg/5 ml) suspension hver 12. time, udskilles ca. 40 % i urinen som clarithromycin. Den renale clearance af clarithromycin er imidlertid relativt uafhængig af dosisstørrelsen og nærmer sig den normale glomerulære filtrationshastighed. Den vigtigste metabolit i urinen er 14-OH clarithromycin, som udgør yderligere 10 % til 15 % af dosis med enten en 250 mg eller en 500 mg tablet administreret hver 12. time.
BIAXIN 250mg XL Filmtab tabletter med forlænget udgivelse
Hos raske mennesker opnåedes steady-state maksimale plasmaclarithromycinkoncentrationer på ca. 2 mcg/ml til 3 mcg/ml ca. 5 timer til 8 timer efter oral administration af 1000 mg BIAXIN 250 mg XL Filmtab én gang dagligt; for 14-OH clarithromycin blev steady-state maksimale plasmakoncentrationer på ca. 0,8 mcg/ml opnået ca. 6 timer til 9 timer efter dosering. Steady-state maksimale plasma-clarithromycinkoncentrationer på ca. 1 mcg/ml til 2 mcg/ml blev opnået ca. 5 timer til 6 timer efter oral administration af en enkelt 500 mg BIAXIN XL Filmtab én gang dagligt; for 14-OH clarithromycin blev steady-state maksimale plasmakoncentrationer på ca. 0,6 mcg/ml opnået ca. 6 timer efter dosering.
Steady-state maksimale plasmakoncentrationer blev opnået i løbet af 2 dage til 3 dage og var ca. 2 mcg/ml for clarithromycin og 0,7 mcg/ml for 14-OH clarithromycin, når 250 mg doser af clarithromycin suspensionen blev administreret hver 12. time. Eliminationshalveringstiden for clarithromycin (3 timer til 4 timer) og den for 14-OH clarithromycin (5 timer til 7 timer) svarede til dem, der blev observeret ved steady state efter administration af ækvivalente doser af BIAXIN Filmtab.
Specifikke populationer for BIAXIN Filmtab, BIAXIN 500mg XL Filmtab og BIAXIN 250mg granulatformuleringer
BIAXIN granulat til oral suspension hos pædiatriske patienter
Clarithromycin trænger ind i mellemørevæsken hos pædiatriske patienter med sekretorisk mellemørebetændelse.
Når pædiatriske patienter (n = 10) fik en enkelt oral dosis på 7,5 mg/kg BIAXIN 500 mg som oral suspension, øgede maden den gennemsnitlige maksimale plasma-clarithromycinkoncentration fra 3,6 (± 1,5) mcg/ml til 4,6 (± 2,8) mcg/ ml og omfanget af absorption fra 10,0 (± 5,5) hr•mcg/mL til 14,2 (± 9,4) hr•mcg/ml.
Hos pædiatriske patienter, der har behov for antibakteriel behandling, resulterede administration af 7,5 mg/kg hver 12. time af BIAXIN som oral suspension generelt i steady-state maksimale plasmakoncentrationer på 3 mcg/ml til 7 mcg/ml for clarithromycin og 1 mcg/ml til 2 mcg/ml for 14-OH clarithromycin.
Hos HIV-inficerede pædiatriske patienter, der tog 15 mg/kg BIAXIN som oral suspension hver 12. time, varierede steady-state topkoncentrationer af clarithromycin generelt fra 6 mcg/ml til 15 mcg/ml.
HIV-infektion
Steady-state-koncentrationer af clarithromycin og 14-OH clarithromycin observeret efter administration af 500 mg doser af clarithromycin hver 12. time til voksne patienter med HIV-infektion svarede til dem, der blev observeret hos raske frivillige. Hos voksne HIV-inficerede patienter, der tog 500 mg eller 1000 mg doser af clarithromycin hver 12. time, varierede steady-state clarithromycin Cmax værdier fra henholdsvis 2 mcg/ml til 4 mcg/ml og 5 mcg/ml til 10 mcg/ml. .
Nedsat leverfunktion
Steady-state-koncentrationerne af clarithromycin hos forsøgspersoner med nedsat leverfunktion afveg ikke fra dem hos normale forsøgspersoner; dog var 14-OH clarithromycin-koncentrationerne lavere hos de personer med nedsat leverfunktion. Den nedsatte dannelse af 14-OH clarithromycin blev i det mindste delvist opvejet af en stigning i renal clearance af clarithromycin hos forsøgspersoner med nedsat leverfunktion sammenlignet med raske forsøgspersoner.
Nedsat nyrefunktion
Clarithromycins farmakokinetik blev også ændret hos personer med nedsat nyrefunktion [se Brug i specifikke populationer og DOSERING OG ADMINISTRATION ].
Lægemiddelinteraktioner
Fluconazol
Efter administration af fluconazol 200 mg daglig og clarithromycin 500 mg to gange dagligt til 21 raske frivillige, steg steady-state clarithromycin Cmin og AUC med henholdsvis 33 % og 18 %. Clarithromycineksponeringen var øget, og steady-state koncentrationer af 14-OH clarithromycin blev ikke signifikant påvirket af samtidig administration af fluconazol.
Colchicin
Når en enkelt dosis colchicin 0,6 mg blev administreret med clarithromycin 250 mg 2 gange dagligt i 7 dage, steg colchicin Cmax 197 %, og AUC0-∞ steg 239 % sammenlignet med administration af colchicin alene.
Atazanavir
Efter administration af clarithromycin (500 mg to gange dagligt) med atazanavir (400 mg én gang dagligt), steg clarithromycin AUC 94 %, 14-OH clarithromycin AUC faldt 70 % og atazanavir AUC steg 28 %.
Ritonavir
Samtidig administration af clarithromycin og ritonavir (n = 22) resulterede i en 77 % stigning i clarithromycin AUC og et 100 % fald i AUC for 14-OH clarithromycin.
Saquinavir
Efter administration af clarithromycin (500 mg to gange dagligt) og saquinavir (bløde gelatinekapsler, 1200 mg tid) til 12 raske frivillige, steg steady-state saquinavir AUC og Cmax med henholdsvis 177 % og 187 % sammenlignet med administration af saquinavir alene. Clarithromycin AUC og Cmax steg med henholdsvis 45 % og 39 %, hvorimod 14–OH clarithromycin AUC og Cmax faldt med henholdsvis 24 % og 34 % sammenlignet med administration med clarithromycin alene.
Didanosin
Samtidig administration af clarithromycin tabletter og didanosin til 12 HIV-inficerede voksne patienter resulterede ikke i nogen statistisk signifikant ændring i didanosin farmakokinetik.
Zidovudin
Efter administration af clarithromycin 500 mg tabletter to gange dagligt med zidovudin 100 mg hver 4. time, faldt steady-state zidovudin AUC 12 % sammenlignet med administration af zidovudin alene (n=4). Individuelle værdier varierede fra et fald på 34 % til en stigning på 14 %. Når clarithromycin-tabletter blev administreret to til fire timer før zidovudin, steg steady-state zidovudin Cmax 100 %, mens AUC var upåvirket (n=24).
Omeprazol
Clarithromycin 500 mg hver 8. time blev givet i kombination med omeprazol 40 mg dagligt til raske voksne forsøgspersoner. Steady-state plasmakoncentrationer af omeprazol blev øget (Cmax, AUC0-24 og t½ stigninger på henholdsvis 30 %, 89 % og 34 %) ved samtidig administration af clarithromycin.
Plasmaniveauerne af clarithromycin og 14-OH clarithromycin blev øget ved samtidig administration af omeprazol. For clarithromycin var den gennemsnitlige Cmax 10 % større, den gennemsnitlige Cmin var 27 % større, og den gennemsnitlige AUC0-8 var 15 % højere, når clarithromycin blev administreret sammen med omeprazol, end når clarithromycin blev administreret alene. Lignende resultater blev set for 14-OH clarithromycin, den gennemsnitlige Cmax var 45% større, den gennemsnitlige Cmin var 57% større, og den gennemsnitlige AUC0-8 var 45% større. Clarithromycinkoncentrationer i mavevæv og slim blev også øget ved samtidig administration af omeprazol.
Clarithromycin vævskoncentrationer 2 timer efter dosis (mcg/mL)/(mcg/g)
Theophyllin
to undersøgelser, hvor theophyllin blev administreret sammen med clarithromycin (en theophyllin-formulering med langvarig frigivelse blev doseret med enten 6,5 mg/kg eller 12 mg/kg sammen med 250 eller 500 mg 12. time clarithromycin), var steady-state-niveauerne af Cmax, Cmin, og arealet under serumkoncentrationstidskurven (AUC) for theophyllin steg med ca. 20%.
Midazolam
Når en enkelt dosis midazolam blev administreret sammen med clarithromycin-tabletter (500 mg to gange dagligt i 7 dage), steg midazolams AUC 174 % efter intravenøs administration af midazolam og 600 % efter oral administration.
For information om andre lægemidler, der er indiceret i kombination med BIAXIN, henvises til deres fulde ordinationsinformation, KLINISK FARMAKOLOGI afsnit.
Mikrobiologi
Handlingsmekanisme
Clarithromycin udøver sin antibakterielle virkning ved at binde sig til 50S ribosomale underenhed af modtagelige bakterier, hvilket resulterer i hæmning af proteinsyntese.
Modstand
De vigtigste resistensveje er modifikation af 23S rRNA i den 50S ribosomale underenhed over for ufølsomheds- eller lægemiddeludstrømningspumper. Beta-lactamase-produktion bør ikke have nogen effekt på clarithromycin-aktivitet.
De fleste isolater af methicillin-resistente og oxacillin-resistente stafylokokker er resistente over for clarithromycin.
Hvis H. pylori ikke udryddes efter behandling med clarithromycinholdige kombinationsregimer, kan patienter udvikle clarithromycinresistens i H. pylori-isolater. For patienter, der mislykkes i behandlingen, bør clarithromycin-følsomhedstest derfor udføres, hvis det er muligt. Patienter med clarithromycin-resistent H. pylori bør ikke behandles med nogen af følgende: omeprazol/clarithromycin dobbeltbehandling; omeprazol/clarithromycin/amoxicillin tripelbehandling; trippelbehandling med lansoprazol/clarithromycin/amoxicillin; eller andre kure, der inkluderer clarithromycin som det eneste antibakterielle middel.
Antimikrobiel aktivitet
Clarithromycin har vist sig at være aktivt mod de fleste af isolaterne af følgende mikroorganismer både in vitro og ved kliniske infektioner [se INDIKATIONER OG BRUG ].
Gram-positive bakterier
- Staphylococcus aureus
- Streptococcus pneumoniae
- Streptococcus pyogenes
Gram-negative bakterier
- Haemophilus influenzae
- Haemophilus parainfluenzae
- Moraxella catarrhalis
Andre mikroorganismer
- Chlamydophila pneumoniae
- Helicobacter pylori
- Mycobacterium avium kompleks (MAC) bestående af M. avium og M. intracellulare
- Mycoplasma pneumoniae
Mindst 90 procent af mikroorganismerne anført nedenfor udviser in vitro minimale hæmmende koncentrationer (MIC'er) mindre end eller lig med det clarithromycin-følsomme MIC-brudpunkt for organismer af lignende type som dem, der er vist i tabel 11. Clarithromycins effektivitet til behandling af kliniske infektioner på grund af disse mikroorganismer er ikke blevet fastslået i tilstrækkelige og velkontrollerede kliniske forsøg.
Gram-positive bakterier
- Streptococcus agalactiae
- Streptokokker (gruppe C, F, G)
- Viridans gruppe streptokokker
Gram-negative bakterier
- Legionella pneumophila
- Pasteurella multocida
Anaerobe bakterier
- Clostridium perfringens
- Peptococcus niger
- Prevotella melaninogenica
- Propionibacterium acnes
Modtagelighedstest
For specifik information om fortolkningskriterier for følsomhedstest og tilhørende testmetoder og kvalitetskontrolstandarder, der er anerkendt af FDA for dette lægemiddel, se venligst: http://www.fda.gov/STIC.
Dyretoksikologi og/eller farmakologi
Hornhindeopacitet forekom hos hunde ved doser 12 gange og hos aber ved doser 8 gange større end den maksimale humane daglige dosis (på kropsoverfladebasis). Lymfoiddepletering forekom hos hunde ved doser 3 gange større end og hos aber ved doser 2 gange større end den maksimale humane daglige dosis (på kropsoverfladebasis).
Kliniske Studier
Mykobakterielle infektioner
Profylakse af mykobakterielle infektioner
Et randomiseret, dobbeltblindt klinisk forsøg (forsøg 3) sammenlignede clarithromycin 500 mg to gange dagligt med placebo hos patienter med CDC-defineret AIDS og CD4-tæller mindre end 100 celler/μL. Dette forsøg samlede 682 patienter fra november 1992 til januar 1994, med et median CD4-celletal ved indgang på 30 celler/mcL. Medianvarigheden af BIAXIN 500 mg var 10,6 måneder mod 8,2 måneder for placebo. Flere patienter i placebo-armen end BIAXIN-armen stoppede for tidligt fra forsøget (henholdsvis 75,6 % og 67,4 %). Men hvis for tidlig seponering på grund af Mycobacterium avium-kompleks (MAC) eller død udelukkes, afbrød cirka lige store procentdel af patienter på hver arm (54,8 %) på BIAXIN og 52,5 % på placebo tidligt med undersøgelseslægemidlet af andre årsager. Forsøget var designet til at evaluere følgende endepunkter:
MAC Bakteriæmi
Hos patienter randomiseret til BIAXIN var risikoen for MAC-bakteriæmi reduceret med 69 % sammenlignet med placebo. Forskellen mellem grupperne var statistisk signifikant (p
Overlevelse
En statistisk signifikant overlevelsesfordel ved BIAXIN sammenlignet med placebo blev observeret (se figur 3 og tabel 13). Da analysen efter 18 måneder omfatter patienter, der ikke længere modtager profylakse, kan overlevelsesgevinsten ved BIAXIN 250 mg være undervurderet.
Figur 3: Overlevelse af alle randomiserede AIDS-patienter over tid i forsøg 3 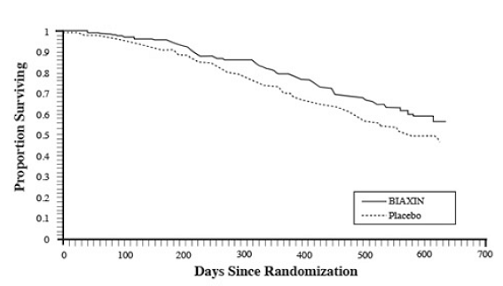
Klinisk signifikant dissemineret MAC-sygdom
I forbindelse med den nedsatte forekomst af MAC-bakteriæmi viste patienter i gruppen randomiseret til BIAXIN reduktioner i tegn og symptomer på dissemineret MAC-sygdom, herunder feber, nattesved, vægttab og anæmi.
Behandling af mykobakterielle infektioner
Dosisvarierende monoterapiforsøg hos voksne AIDS-patienter med MAC
To randomiserede kliniske forsøg (forsøg 1 og 2) sammenlignede forskellige doser af BIAXIN hos patienter med CDC-defineret AIDS og CD4-tal mindre end 100 celler/mcL. Disse forsøg påløb patienter fra maj 1991 til marts 1992. Forsøg 500 var et randomiseret, dobbeltblindt forsøg; forsøg 577 var et åbent forsøg med medfølende brug. Begge forsøg brugte 500 mg og 1000 mg to gange daglig dosering af BIAXIN; forsøg 1 havde også en 2000 mg BIAXIN 500mg-gruppe to gange dagligt. Forsøg 1 inkluderede 154 voksne patienter og forsøg 2 inkluderede 469 voksne patienter. Størstedelen af patienterne havde CD4-celletal mindre end 50 celler/mcL ved start af undersøgelsen. Forsøgene var designet til at evaluere følgende slutpunkter:
Resultaterne for forsøg 1 er beskrevet nedenfor. Resultaterne af forsøg 2 svarede til resultaterne af forsøg 1.
MAC Bakteriæmi
Fald i MAC-bakteriæmi eller negative blodkulturer blev set hos størstedelen af patienterne i alle BIAXIN 500 mg dosisgrupper. Den gennemsnitlige reduktion i MAC kolonidannende enheder (CFU) fra baseline efter 4 ugers behandling i 1000 mg (n=32) to gange dagligt og 2000 mg (n=26) to gange dagligt regimen var 2,3 log CFU sammenlignet med 1,5 log CFU i BIAXIN 500 mg to gange dagligt (n=35) regimen. Et separat forsøg med et regime med fire lægemidler2 (ciprofloxacin, ethambutol, rifampicin og clofazimin) havde en gennemsnitlig reduktion på 1,4 log CFU.
Kliniske resultater evalueret med de forskellige doseringsregimer af clarithromycin monoterapi er vist i tabel 14. Doserne på 1000 mg og 2000 mg to gange dagligt viste signifikant bedre kontrol af bakteriæmi i løbet af de første fire uger af behandlingen. Ingen signifikante forskelle blev set ud over dette punkt. Alle isolater havde MIC mindre end 8 mcg/ml ved forbehandling. Tilbagefald var næsten altid ledsaget af en stigning i MIC.
Klinisk signifikant dissemineret MAC-sygdom
Blandt patienter, der oplevede nattesved før behandlingen, viste 84 % opløsning eller forbedring på et tidspunkt i løbet af de 12 uger af BIAXIN ved doser på 500 mg til 2000 mg to gange dagligt. Tilsvarende rapporterede 77 % af patienterne opløsning eller forbedring af feber på et tidspunkt. Responsrater for kliniske tegn på MAC er angivet i tabel 15 nedenfor.
Den mediane varighed af respons, defineret som forbedring eller opløsning af kliniske tegn og symptomer, var 2 uger til 6 uger.
Da forsøget ikke var designet til at bestemme fordelen ved monoterapi ud over 12 uger, kan varigheden af respons være undervurderet for de 25 % til 33 % af patienterne, som fortsatte med at vise klinisk respons efter 12 uger.
Overlevelse
Median overlevelsestid fra start af forsøg (forsøg 1) var 249 dage ved en dosis på 500 mg to gange daglig sammenlignet med 215 dage med en dosis på 1000 mg to gange daglig. I løbet af de første 12 ugers behandling var der dog 2 dødsfald hos 53 patienter i gruppen med 500 mg to gange dagligt mod 13 dødsfald hos 51 patienter i gruppen med 1000 mg to gange dagligt. Årsagen til denne tilsyneladende dødelighedsforskel kendes ikke. Overlevelsen i de to grupper var ens ud over 12 uger. De gennemsnitlige overlevelsestider for disse doser svarede til nyere historiske kontroller med MAC, når de blev behandlet med kombinationsterapier.2
Median overlevelsestid fra start i forsøg 2 var 199 dage for dosis på 500 mg to gange dagligt og 179 dage for dosis på 1000 mg to gange daglig. I løbet af de første fire ugers behandling, mens patienterne blev fastholdt på deres oprindeligt tildelte dosis, var der 11 dødsfald hos 255 patienter, der tog 500 mg to gange dagligt, og 18 dødsfald hos 214 patienter, der tog 1000 mg to gange dagligt.
Monoterapiforsøg med dosering i pædiatriske AIDS-patienter med MAC
Forsøg 4 var et pædiatrisk forsøg med 3,75 mg/kg, 7,5 mg/kg og 15 mg/kg BIAXIN to gange dagligt hos patienter med CDC-defineret AIDS og CD4-tal mindre end 100 celler/mcL. Forsøget inkluderede 25 patienter i alderen 1 til 20 år. Forsøget evaluerede de samme endepunkter som i voksenforsøg 1 og 2. Resultaterne med 7,5 mg/kg to gange daglig dosis i det pædiatriske forsøg var sammenlignelige med resultaterne for 500 mg to gange dagligt i voksenforsøgene.
Kombinationsterapi hos AIDS-patienter med dissemineret MAC
Forsøg 5 sammenlignede sikkerheden og effekten af BIAXIN 250mg i kombination med ethambutol versus BIAXIN 250mg i kombination med ethambutol og clofazimin til behandling af dissemineret MAC (dMAC) infektion. Dette 24-ugers forsøg inkluderede 106 patienter med AIDS og dMAC, med 55 patienter randomiseret til at modtage BIAXIN 500mg og ethambutol, og 51 patienter randomiseret til at modtage clarithromycin, ethambutol og clofazim. Baseline-karakteristika mellem behandlingsarme var ens med undtagelse af, at median CFU-tal var mindst 1 log højere i BIAXIN 500 mg, ethambutol og clofazim-armen.
Sammenlignet med tidligere erfaringer med clarithromycin monoterapi, forlængede to-lægemiddelbehandlingen af clarithromycin og ethambutol tiden til mikrobiologisk tilbagefald, hovedsageligt ved at undertrykke fremkomsten af clarithromycin-resistente stammer. Men tilføjelsen af clofazimin til kuren tilføjede ingen yderligere mikrobiologiske eller kliniske fordele. Tolerabiliteten af begge multidrug-regimer var sammenlignelig med de mest almindelige bivirkninger, som var gastrointestinale. Patienter, der fik den clofazimin-holdige behandling, havde reduceret overlevelsesrater; deres baseline mycobakterielle kolonital var imidlertid højere. Resultaterne af dette forsøg understøtter tilføjelsen af ethambutol til clarithromycin til behandling af initiale dMAC-infektioner, men understøtter ikke tilføjelse af clofazimin som et tredje middel.
Mellemørebetændelse
Otitis Media-forsøg med BIAXIN vs. oral cephalosporin
et kontrolleret klinisk forsøg med pædiatriske patienter med akut mellemørebetændelse udført i USA, hvor der blev fundet betydelige mængder af beta-lactamase-producerende organismer, blev BIAXIN 500 mg sammenlignet med en oral cephalosporin. I dette forsøg blev strenge evaluerbarhedskriterier brugt til at bestemme klinisk respons. For de 223 patienter, der blev evalueret for klinisk effekt, var den kliniske succesrate (dvs. helbredelse plus forbedring) ved besøget efter behandling 88 % for BIAXIN 500 mg og 91 % for cephalosporin.
Hos et mindre antal patienter blev der foretaget mikrobiologiske bestemmelser ved forbehandlingsbesøget. De formodede bakterieudryddelse/kliniske helbredelsesresultater (dvs. klinisk succes) er vist i tabel 16.
Mellemørebetændelse forsøg med BIAXIN vs. antimikrobiel/beta-lactamasehæmmer
to andre kontrollerede kliniske forsøg med akut mellemørebetændelse udført i USA, hvor der blev fundet betydelige mængder af beta-lactamase-producerende organismer, blev BIAXIN sammenlignet med et oralt antimikrobielt middel, der indeholdt en specifik beta-lactamase-hæmmer. I disse forsøg blev strenge evaluerbarhedskriterier brugt til at bestemme de kliniske responser. Hos de 233 patienter, der blev evalueret for klinisk effekt, var den kombinerede kliniske succesrate (dvs. helbredelse og forbedring) ved besøget efter behandling 91 % for både BIAXIN 500 mg og kontrollen.
For de patienter, der havde mikrobiologiske bestemmelser ved før-behandlingsbesøget, er de formodede bakterieudryddelse/kliniske helbredelsesresultater (dvs. klinisk succes) vist i tabel 17.
H. pylori-udryddelse for at mindske risikoen for tilbagefald af duodenalsår
BIAXIN + Lansoprazol og Amoxicillin
To amerikanske randomiserede, dobbeltblindede kliniske forsøg (forsøg 6 og forsøg 7) med patienter med H. pylori og duodenalsår (defineret som et aktivt sår eller historie med et aktivt sår inden for et år) evaluerede effekten af BIAXIN 500 mg to gange dagligt i kombination med lansoprazol 30 mg to gange dagligt og amoxicillin 1 g to gange dagligt som 14-dages tripelbehandling til udryddelse af H. pylori.
H. pylori-udryddelse blev defineret som to negative tests (kultur og histologi) 4 uger til 6 uger efter afslutningen af behandlingen.
Kombinationen af BIAXIN plus lansoprazol og amoxicillin som tredobbelt terapi var effektiv til udryddelse af H. pylori (se resultater i tabel 18). Udryddelse af H. pylori har vist sig at reducere risikoen for tilbagefald af duodenalsår.
Et randomiseret, dobbeltblindt klinisk forsøg (forsøg 8) udført i USA med patienter med H. pylori og duodenalsår (defineret som et aktivt sår eller historie med et sår inden for et år) sammenlignede effekten af BIAXIN 250 mg i kombination med lansoprazol og amoxicillin som tredobbelt behandling i 10 dage og 14 dage. Dette forsøg fastslog, at 10-dages tripelterapi var ækvivalent med 14-dages tripelterapi til udryddelse af H. pylori (se resultater i tabel 18).
BIAXIN + Omeprazol og Amoxicillin Terapi
Tre amerikanske, randomiserede, dobbeltblindede kliniske forsøg med patienter med H. pylori-infektion og duodenalsårsygdom (n = 558) sammenlignede BIAXIN plus omeprazol og amoxicillin med BIAXIN 250 mg plus amoxicillin. To forsøg (forsøg 9 og 10) blev udført med patienter med et aktivt sår på tolvfingertarmen, og det tredje forsøg (forsøg 11) blev udført på patienter med sår på tolvfingertarmen inden for de seneste 5 år, men uden et sår til stede på indskrivningstidspunktet . Dosisregimet i forsøgene var BIAXIN 500 mg to gange dagligt plus omeprazol 20 mg to gange dagligt plus amoxicillin 1 gram to gange dagligt i 10 dage. I forsøg 9 og 10 fik patienter, der tog omeprazol-kuren, også yderligere 18 dage med omeprazol 20 mg én gang dagligt. Undersøgte endepunkter var udryddelse af H. pylori og heling af duodenalsår (kun forsøg 9 og 10). H. pylori-status blev bestemt ved CLOtest®, histologi og kultur i alle tre forsøg. For en given patient blev H. pylori betragtet som udryddet, hvis mindst to af disse test var negative, og ingen var positiv. Kombinationen af BIAXIN plus omeprazol og amoxicillin var effektiv til at udrydde H. pylori (se resultater i tabel 19).
BIAXIN + Omeprazol Terapi
Fire randomiserede, dobbeltblindede multicenterforsøg (forsøg 12, 13, 14 og 15) evaluerede BIAXIN 500 mg tre gange dagligt plus omeprazol 40 mg én gang dagligt i 14 dage, efterfulgt af omeprazol 20 mg én gang dagligt ( forsøg 12, 13 og 15) eller med omeprazol 40 mg én gang dagligt (forsøg 14) i yderligere 14 dage hos patienter med aktivt duodenalsår forbundet med H. pylori. Forsøg 12 og 13 blev udført i USA og Canada og inkluderede henholdsvis 242 og 256 patienter. H. pylori-infektion og duodenalsår blev bekræftet hos 219 patienter i forsøg 12 og 228 patienter i forsøg 13. Disse undersøgelser sammenlignede kombinationsregimet med omeprazol- og BIAXIN-monoterapier. Forsøg 14 og 15 blev udført i Europa og omfattede henholdsvis 154 og 215 patienter. H. pylori-infektion og duodenalsår blev bekræftet hos 148 patienter i forsøg 14 og 208 patienter i forsøg 15. Disse forsøg sammenlignede kombinationsregimet med omeprazol monoterapi. Resultaterne for effektivitetsanalyserne for disse forsøg er beskrevet i tabel 20, 21 og 22.
Heling af duodenalsår
Kombinationen af BIAXIN 250 mg og omeprazol var lige så effektiv som omeprazol alene til heling af duodenalsår (se tabel 20).
Udryddelse af H. pylori forbundet med duodenalsår
Kombinationen af BIAXIN 500 mg og omeprazol var effektiv til at udrydde H. pylori (se tabel 21). H. pylori-udryddelse blev defineret som ingen positiv test (kultur eller histologi) 4 uger efter afslutningen af behandlingen, og to negative tests var påkrævet for at blive betragtet som udryddet. I pr-protokolanalysen blev følgende patienter udelukket: Frafald, patienter med større protokolbrud, patienter med manglende H. pylori-test efter behandling og patienter, der ikke blev vurderet for H. pylori-udryddelse 4 uger efter afslutningen af behandling, fordi de viste sig at have et uhelet sår ved behandlingens afslutning.
Duodenalsår tilbagefald
Tilbagefald af sår 6 måneder og 12 måneder efter afslutningen af behandlingen blev vurderet for patienter, hvor sår var helet efter behandlingen (se resultaterne i tabel 22). Hos patienter med duodenalsår forbundet med H. pylori-infektion reducerede udryddelse af H. pylori således tilbagefald af sår.
REFERENCER
2. Kemper CA, et al. Behandling af Mycobacterium avium Complex Bacteremia i AIDS med et oralt regime med fire lægemidler. Ann Praktikant Med. 1992;116:466-472.
PATIENTOPLYSNINGER
Giv patienterne følgende instruktioner eller oplysninger om BIAXIN 250mg:
- Rådgiv patienterne om, at antibakterielle lægemidler inklusive BIAXIN (clarithromycin) kun bør bruges til at behandle bakterielle infektioner. De behandler ikke virusinfektioner (f.eks. forkølelse). Når BIAXIN 250mg ordineres til behandling af en bakteriel infektion, skal patienterne fortælles, at selvom det er almindeligt at føle sig bedre tidligt i behandlingsforløbet, skal medicinen tages nøjagtigt som anvist. At springe doser over eller ikke fuldføre hele behandlingsforløbet kan (1) mindske effektiviteten af den øjeblikkelige behandling og (2) øge sandsynligheden for, at bakterier udvikler resistens og ikke vil kunne behandles med BIAXIN 250mg eller andre antibakterielle lægemidler i fremtiden.
- Rådgiv patienterne, at diarré er et almindeligt problem forårsaget af antibakterielle midler, herunder BIAXIN (clarithromycin), som normalt slutter, når det antibakterielle middel seponeres. Nogle gange kan patienter efter start af behandling med antibakterielle midler udvikle vandig og blodig afføring (med eller uden mavekramper og feber) selv så sent som to eller flere måneder efter at have taget den sidste dosis af det antibakterielle middel. Hvis dette sker, instruer patienterne i at kontakte deres læge så hurtigt som muligt.
- Rådgiv patienterne om, at BIAXIN (clarithromycin) kan interagere med nogle lægemidler; råd derfor patienterne til at rapportere brugen af anden medicin til deres læge.
- Rådgiv patienterne, at BIAXIN (clarithromycin) Filmtab og oral suspension kan tages med eller uden mad og kan tages med mælk; BIAXIN 250mg XL Filmtab (clarithromycin-depottabletter) bør dog tages sammen med mad. Opbevar ikke suspensionen i køleskab.
- Der er ingen data om virkningen af BIAXIN (clarithromycin) på evnen til at køre bil eller betjene maskiner. Rådgiv dog patienterne om risikoen for svimmelhed, svimmelhed, forvirring og desorientering, som kan opstå med medicinen. Potentialet for disse bivirkninger bør tages i betragtning, før patienter kører bil eller betjener maskiner.
- Rådgiv patienterne om, at hvis der opstår graviditet, mens de tager dette lægemiddel, er der en potentiel fare for fosteret [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
- Rådgiv patienter, der har koronararteriesygdom, om at fortsætte med medicin og livsstilsændringer for deres koronararteriesygdom, fordi BIAXIN 500mg kan være forbundet med øget risiko for dødelighed år efter afslutningen af BIAXIN-behandlingen.
