Cleocin 150mg, 300mg Clindamycin Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Cleocin 300mg hydrochloridkapsler?
Cleocin Hydrochloride Kapsler indeholder et antibiotikum, der er indiceret til behandling af alvorlige infektioner forårsaget af modtagelige anaerobe bakterier. Cleocin 150mg hydrochlorid er også indiceret til behandling af alvorlige infektioner på grund af modtagelige stammer af streptokokker, pneumokokker og stafylokokker. Dets brug bør forbeholdes penicillin-allergiske patienter eller andre patienter, for hvem en penicillin efter lægens vurdering er uegnet. Cleocin Hydrochloride er tilgængelig i generisk form.
Hvad er bivirkninger af Cleocin 300mg hydrochloridkapsler?
Almindelige bivirkninger af Cleocin Hydrochloride omfatter:
- Clostridium difficile colitis,
- mavesmerter,
- pseudomembranøs colitis,
- esophagitis,
- kvalme,
- opkastning,
- diarré,
- udslæt,
- nældefeber,
- alvorlige allergiske reaktioner (anafylaksi),
- overfølsomhedsreaktioner,
- kløe,
- vaginalt udflåd og ubehag,
- hævelse af huden,
- gulfarvning af hud og øjne (gulsot),
- unormale leverfunktionsprøver, og
- ledsmerter.
For at reducere udviklingen af lægemiddelresistente bakterier og bevare effektiviteten af CLEOCIN 300mg HCl og andre antibakterielle lægemidler, bør CLEOCIN 300mg HCl kun bruges til at behandle eller forebygge infektioner, der er bevist eller stærkt mistænkt for at være forårsaget af bakterier.
ADVARSEL
Clostridium difficile associeret diarré (CDAD) er blevet rapporteret ved brug af næsten alle antibakterielle midler, inklusive CLEOCIN HCl og kan variere i sværhedsgrad fra mild diarré til fatal colitis. Behandling med antibakterielle midler ændrer den normale flora i tyktarmen, hvilket fører til overvækst af C. difficle.
Da CLEOCIN 150 mg HCl-behandling er blevet forbundet med alvorlig colitis, som kan ende dødeligt, bør den reserveres til alvorlige infektioner, hvor mindre toksiske antimikrobielle midler er uhensigtsmæssige, som beskrevet i INDIKATIONER OG BRUG afsnit. Det bør ikke anvendes til patienter med ikke-bakterielle infektioner, såsom de fleste øvre luftvejsinfektioner.
C. difficle producerer toksinerne A og B, som bidrager til udviklingen af CDAD. Hypertoksin-producerende stammer af C. difficle forårsager øget morbiditet og dødelighed, da disse infektioner kan være modstandsdygtige over for antimikrobiel behandling og kan kræve kolektomi. CDAD skal overvejes hos alle patienter, der får diarré efter brug af antibiotika. Omhyggelig sygehistorie er nødvendig, da CDAD er blevet rapporteret at forekomme over to måneder efter administration af antibakterielle midler.
Hvis CDAD er mistænkt eller bekræftet, kan det være nødvendigt at afbryde igangværende antibiotikabrug, der ikke er rettet mod C. difficle. Passende væske- og elektrolytbehandling, proteintilskud, antibiotikabehandling af C. difficle og kirurgisk evaluering bør iværksættes som klinisk indiceret.
BESKRIVELSE
Clindamycinhydrochlorid er det hydrerede hydrochloridsalt af clindamycin. Clindamycin er et semisyntetisk antibiotikum fremstillet ved en 7(S)-chlor-substitution af 7(R)-hydroxylgruppen i moderforbindelsen lincomycin.
CLEOCIN HCl-kapsler indeholder clindamycinhydrochlorid svarende til 75 mg, 150 mg eller 300 mg clindamycin.
Inaktive ingredienser: 75 mg - majsstivelse, FD&C blå nr. 1, FD&C gul nr. 5, gelatine, lactose, magnesiumstearat og talkum; 150 mg - majsstivelse, FD&C blå nr. 1, FD&C gul nr. 5, gelatine, lactose, magnesiumstearat, talkum og titaniumdioxid; 300 mg - majsstivelse, FD&C blå nr. 1, gelatine, lactose, magnesiumstearat, talkum og titaniumdioxid.
Den strukturelle formel er repræsenteret nedenfor:
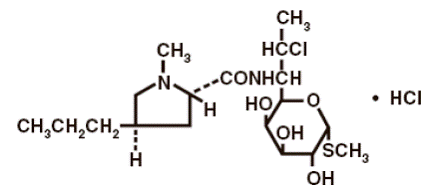
Det kemiske navn for clindamycinhydrochlorid er Methyl-7-chlor-6,7,8-trideoxy-6-(1-methyl-trans-4-propyl-L-2-pyrrolidincarboxamido)-1-thio-L-threo-α- D-galacto-octopyranosid monohydrochlorid.
INDIKATIONER
Clindamycin er indiceret til behandling af alvorlige infektioner forårsaget af modtagelige anaerobe bakterier.
Clindamycin er også indiceret til behandling af alvorlige infektioner på grund af modtagelige stammer af streptokokker, pneumokokker og stafylokokker. Dets brug bør forbeholdes penicillin-allergiske patienter eller andre patienter, for hvem en penicillin efter lægens vurdering er uegnet. På grund af risikoen for tyktarmsbetændelse, som beskrevet i ADVARSEL AF INDKAMMET, bør lægen, før valget af clindamycin, overveje arten af infektionen og egnetheden af mindre toksiske alternativer (f.eks. erythromycin).
Anaerobe: Alvorlige luftvejsinfektioner såsom empyem, anaerob pneumonitis og lungeabscess; alvorlige hud- og bløddelsinfektioner; septikæmi; intra-abdominale infektioner såsom peritonitis og intra-abdominal abscess (typisk som følge af anaerobe organismer, der er bosat i den normale mave-tarmkanal); infektioner i det kvindelige bækken og kønsorganer såsom endometritis, ikke-gonokok tubo-ovarie byld, bækkencellulitis og postkirurgisk vaginal manchetinfektion.
Streptokokker: Alvorlige luftvejsinfektioner; alvorlige hud- og bløddelsinfektioner.
stafylokokker: Alvorlige luftvejsinfektioner; alvorlige hud- og bløddelsinfektioner.
Pneumokokker: Alvorlige luftvejsinfektioner.
Bakteriologiske undersøgelser bør udføres for at bestemme de forårsagende organismer og deres modtagelighed for clindamycin.
For at reducere udviklingen af lægemiddelresistente bakterier og bevare effektiviteten af CLEOCIN HCl og andre antibakterielle lægemidler, bør CLEOCIN HCl kun bruges til at behandle eller forebygge infektioner, der er bevist eller stærkt mistænkt for at være forårsaget af modtagelige bakterier. Når kultur- og modtagelighedsoplysninger er tilgængelige, bør de overvejes ved udvælgelse eller ændring af antibakteriel behandling. I mangel af sådanne data kan lokal epidemiologi og modtagelighedsmønstre bidrage til den empiriske udvælgelse af terapi.
DOSERING OG ADMINISTRATION
Hvis der opstår betydelig diarré under behandlingen, bør dette antibiotikum seponeres (se KASSET ADVARSEL ).
Voksne
Alvorlige infektioner - 150 til 300 mg hver 6. time. Mere alvorlige infektioner - 300 til 450 mg hver 6. time.
Pædiatriske patienter (til børn, der er i stand til at sluge kapsler):
Alvorlige infektioner 8 til 16 mg/kg/dag (4 til 8 mg/lb/dag) fordelt på tre eller fire lige store doser. Mere alvorlige infektioner - 16 til 20 mg/kg/dag (8 til 10 mg/lb/dag) opdelt i tre eller fire lige store doser.
For at undgå muligheden for irritation af spiserøret bør CLEOCIN 300mg HCl-kapsler tages med et helt glas vand.
CLEOCIN HCl-kapsler er ikke egnede til børn, der ikke er i stand til at sluge dem hele. Kapslerne giver ikke nøjagtige mg/kg doser, derfor kan det være nødvendigt at bruge clindamycinpalmitat oral opløsning i nogle tilfælde.
Alvorlige infektioner på grund af anaerobe bakterier behandles normalt med CLEOCIN PHOSPHATE® Sterile Solution. Under klinisk passende omstændigheder kan lægen dog vælge at påbegynde behandling eller fortsætte behandlingen med CLEOCIN 150 mg HCl-kapsler.
I tilfælde af β-hæmolytiske streptokokinfektioner bør behandlingen fortsætte i mindst 10 dage.
HVORDAN LEVERET
CLEOCIN HCl-kapsler fås i følgende styrker, farver og størrelser:
75 mg Grønne flasker med 100 stk NDC 0009-0331-02
150 mg Lyseblå og grønne flasker af 100 stk NDC 0009-0225-02
300 mg Lyseblå flasker af 100 stk NDC 0009-0395-14
Opbevares ved kontrolleret stuetemperatur 20° til 25° C (68° til 77° F) [se USP ].
Distribueret af: Pharmacia & Upjohn Co, Division of Pfizer Inc, NY, NY 10017. Revideret 2017
BIVIRKNINGER
Følgende reaktioner er blevet rapporteret ved brug af clindamycin.
Infektioner og angreb: Clostridium difficile colitis
Gastrointestinale: Mavesmerter, pseudomembranøs colitis, esophagitis, kvalme, opkastning og diarré (se KASSET ADVARSEL ). Begyndelsen af pseudomembranøs colitis-symptomer kan forekomme under eller efter antibakteriel behandling (se ADVARSLER ). Esophageal ulcus er blevet rapporteret. En ubehagelig eller metallisk smag er blevet rapporteret efter oral administration.
Overfølsomhedsreaktioner: Generaliserede milde til moderate morbilliform-lignende (makulopapulære) hududslæt er de hyppigst rapporterede bivirkninger. Vesikulobulløse udslæt såvel som nældefeber er blevet observeret under lægemiddelbehandling. Alvorlige hudreaktioner såsom toksisk epidermal nekrolyse, nogle med dødelig udgang, er blevet rapporteret (se ADVARSLER ). Tilfælde af akut generaliseret eksantematøs pustulose (AGEP), erythema multiforme, nogle der ligner Stevens-Johnsons syndrom, anafylaktisk shock, anafylaktisk reaktion og overfølsomhed er også blevet rapporteret.
Hud og slimhinder: Kløe, vaginitis, angioødem og sjældne tilfælde af eksfoliativ dermatitis er blevet rapporteret. (Se Overfølsomhedsreaktioner .)
Lever: Gulsot og abnormiteter i leverfunktionsprøver er blevet observeret under clindamycinbehandling.
Nyre: Selvom der ikke er påvist nogen direkte sammenhæng mellem clindamycin og nyreskade, er nyreinsufficiens som påvist ved azotæmi, oliguri og/eller proteinuri blevet observeret.
Hæmatopoietisk: Forbigående neutropeni (leukopeni) og eosinofili er blevet rapporteret. Der er rapporteret om agranulocytose og trombocytopeni. Intet direkte ætiologisk forhold til samtidig clindamycinterapi kunne dannes i nogen af de foregående.
Immunsystem: Lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS) er blevet rapporteret.
Muskuloskeletale: Tilfælde af polyarthritis er blevet rapporteret.
DRUGSINTERAKTIONER
Clindamycin har vist sig at have neuromuskulært blokerende egenskaber, som kan forstærke virkningen af andre neuromuskulære blokerende midler. Derfor bør det bruges med forsigtighed hos patienter, der får sådanne midler.
Clindamycin metaboliseres overvejende af CYP3A4, og i mindre grad af CYP3A5, til hovedmetabolitten clindamycinsulfoxid og den mindre metabolit N-desmethylclindamycin. Derfor kan inhibitorer af CYP3A4 og CYP3A5 øge plasmakoncentrationerne af clindamycin, og inducere af disse isoenzymer kan reducere plasmakoncentrationerne af clindamycin. Overvåg for bivirkninger ved tilstedeværelse af stærke CYP3A4-hæmmere. Ved tilstedeværelse af stærke CYP3A4-inducere, såsom rifampicin, skal du overvåge for tab af effektivitet.
In vitro undersøgelser indikerer, at clindamycin ikke hæmmer CYP1A2, CYP2C9, CYP2C19, CYP2E1 eller CYP2D6 og kun moderat hæmmer CYP3A4.
Antagonisme er blevet påvist mellem clindamycin og erythromycin in vitro. På grund af mulig klinisk betydning bør disse to lægemidler ikke administreres samtidigt.
ADVARSLER
Se KASSET ADVARSEL
Clostridium Difficile Associeret Diarré
Clostridium difficile associeret diarré (CDAD) er blevet rapporteret ved brug af næsten alle antibakterielle midler, inklusive CLEOCIN 300mg HCl, og kan variere i sværhedsgrad fra mild diarré til fatal colitis. Behandling med antibakterielle midler ændrer den normale flora i tyktarmen, hvilket fører til overvækst af C. difficle.
C. difficle producerer toksinerne A og B, som bidrager til udviklingen af CDAD. Hypertoksin-producerende stammer af C. difficle forårsager øget morbiditet og dødelighed, da disse infektioner kan være modstandsdygtige over for antimikrobiel behandling og kan kræve kolektomi. CDAD skal overvejes hos alle patienter, der får diarré efter brug af antibiotika. Omhyggelig sygehistorie er nødvendig, da CDAD er blevet rapporteret at forekomme over to måneder efter administration af antibakterielle midler.
Hvis CDAD er mistænkt eller bekræftet, kan det være nødvendigt at afbryde igangværende antibiotikabrug, der ikke er rettet mod C. difficle. Passende væske- og elektrolytbehandling, proteintilskud, antibiotikabehandling af C. difficle og kirurgisk evaluering bør iværksættes som klinisk indiceret.
Anafylaktiske og svære overfølsomhedsreaktioner
Anafylaktisk shock og anafylaktiske reaktioner er blevet rapporteret (se BIVIRKNINGER ).
Alvorlige overfølsomhedsreaktioner, herunder alvorlige hudreaktioner såsom toksisk epidermal nekrolyse (TEN), lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS) og Stevens-Johnsons syndrom (SJS), nogle med dødelig udgang, er blevet rapporteret (se BIVIRKNINGER ).
I tilfælde af en sådan anafylaktisk eller alvorlig overfølsomhedsreaktion skal behandlingen afbrydes permanent og igangsættes passende behandling.
Der bør foretages en omhyggelig undersøgelse vedrørende tidligere følsomhed over for lægemidler og andre allergener.
Anvendelse ved meningitis
Da clindamycin ikke diffunderer tilstrækkeligt ind i cerebrospinalvæsken, bør lægemidlet ikke anvendes til behandling af meningitis.
FORHOLDSREGLER
Generel
Gennemgang af de hidtidige erfaringer tyder på, at en undergruppe af ældre patienter med tilhørende alvorlig sygdom kan tåle diarré dårligere. Når clindamycin er indiceret til disse patienter, bør de overvåges nøje for ændringer i tarmfrekvensen.
CLEOCIN 300mg HCl bør ordineres med forsigtighed til personer med en historie med mave-tarmsygdomme, især colitis.
CLEOCIN 300mg HCl bør ordineres med forsigtighed til atopiske personer.
Indicerede kirurgiske indgreb bør udføres i forbindelse med antibiotikabehandling.
Brugen af CLEOCIN 150mg HCl resulterer lejlighedsvis i overvækst af ikke-modtagelige organismer - især gær. Hvis der opstår superinfektioner, skal der træffes passende foranstaltninger som angivet af den kliniske situation.
Ændring af dosis af clindamycin er muligvis ikke nødvendig hos patienter med nyresygdom. Hos patienter med moderat til svær leversygdom er der konstateret forlængelse af clindamycins halveringstid. Imidlertid blev det postuleret fra undersøgelser, at når det gives hver ottende time, skulle akkumulering sjældent forekomme. Derfor er det muligvis ikke nødvendigt at ændre dosis hos patienter med leversygdom. Imidlertid bør periodiske leverenzymbestemmelser foretages ved behandling af patienter med alvorlig leversygdom.
75 mg og 150 mg kapslerne indeholder FD&C gult nr. 5 (tartrazin), som kan forårsage allergiske reaktioner (inklusive bronkial astma) hos visse modtagelige personer. Selvom den samlede forekomst af FD&C gult nr. 5 (tartrazin)-følsomheden i den generelle befolkning er lav, ses den hyppigt hos patienter, der også har aspirinoverfølsomhed.
Udskrivning af CLEOCIN 150mg HCl i fravær af en påvist eller stærkt mistænkt bakteriel infektion eller en profylaktisk indikation vil sandsynligvis ikke give patienten fordel og øge risikoen for udvikling af lægemiddelresistente bakterier.
Laboratorieprøver
Under langvarig behandling bør der udføres periodiske lever- og nyrefunktionstests og blodtællinger.
Karcinogenese, mutagenese, svækkelse af fertilitet
Der er ikke udført langtidsforsøg på dyr med clindamycin for at vurdere det karcinogene potentiale. Genotoksicitetstests, der blev udført, omfattede en mikronukleustest for rotter og en Ames Salmonella-reversionstest. Begge tests var negative.
Fertilitetsundersøgelser hos rotter behandlet oralt med op til 300 mg/kg/dag (ca. 1,6 gange den højeste anbefalede voksendosis baseret på mg/m²) viste ingen effekt på fertilitet eller parringsevne.
Graviditet
Teratogene virkninger
I kliniske forsøg med gravide kvinder er systemisk administration af clindamycin i andet og tredje trimester ikke blevet forbundet med en øget hyppighed af medfødte abnormiteter.
Clindamycin bør kun anvendes i første trimester af graviditeten, hvis det er klart nødvendigt. Der er ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder i graviditetens første trimester. Da reproduktionsstudier på dyr ikke altid er forudsigelige for den menneskelige reaktion, bør dette lægemiddel kun anvendes under graviditet, hvis det er klart nødvendigt.
Reproduktionsundersøgelser udført på rotter og mus med orale doser af clindamycin op til 600 mg/kg/dag (3,2 og 1,6 gange den højeste anbefalede voksendosis baseret på henholdsvis mg/m²) eller subkutane doser af clindamycin op til 250 mg/kg /dag (henholdsvis 1,3 og 0,7 gange den højeste anbefalede dosis til mennesker baseret på mg/m²) viste ingen tegn på teratogenicitet.
Ammende mødre
Det er rapporteret, at clindamycin optræder i modermælk i området 0,7 til 3,8 mcg/ml. Clindamycin har potentiale til at forårsage uønskede virkninger på det ammede spædbarns mave-tarmflora. Hvis oral eller intravenøs clindamycin er påkrævet af en ammende mor, er det ikke en grund til at stoppe amningen, men et alternativt lægemiddel kan foretrækkes. Overvåg barnet for mulige negative virkninger på mave-tarmfloraen, såsom diarré, candidiasis (trøske, bleudslæt) eller sjældent blod i afføringen, der indikerer mulig antibiotika-associeret colitis.
De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for clindamycin og eventuelle negative virkninger på det ammede barn fra clindamycin eller fra den underliggende moderens tilstand.
Pædiatrisk brug
Når CLEOCIN 300 mg HCl administreres til den pædiatriske population (fødsel til 16 år), er passende overvågning af organsystemets funktioner ønskelig.
Geriatrisk brug
Kliniske undersøgelser af clindamycin omfattede ikke et tilstrækkeligt antal patienter på 65 år og derover til at afgøre, om de reagerer anderledes end yngre patienter. Andre rapporterede kliniske erfaringer indikerer dog, at antibiotika-associeret colitis og diarré (på grund af Clostridium difficile) set i forbindelse med de fleste antibiotika forekommer hyppigere hos ældre (> 60 år) og kan være mere alvorlige. Disse patienter bør overvåges nøje for udvikling af diarré.
Farmakokinetiske undersøgelser med clindamycin har ikke vist nogen klinisk vigtige forskelle mellem unge og ældre forsøgspersoner med normal leverfunktion og normal (aldersjusteret) nyrefunktion efter oral eller intravenøs administration.
OVERDOSIS
Signifikant dødelighed blev observeret hos mus ved en intravenøs dosis på 855 mg/kg og hos rotter ved en oral eller subkutan dosis på ca. 2618 mg/kg. Hos musene blev der observeret kramper og depression.
Hæmodialyse og peritonealdialyse er ikke effektive til at fjerne clindamycin fra serumet.
KONTRAINDIKATIONER
CLEOCIN 150mg HCl er kontraindiceret til personer med en historie med overfølsomhed over for præparater, der indeholder clindamycin eller lincomycin.
KLINISK FARMAKOLOGI
Human farmakologi
Absorption
Serumniveauundersøgelser med en 150 mg oral dosis af clindamycinhydrochlorid hos 24 normale voksne frivillige viste, at clindamycin blev absorberet hurtigt efter oral administration. Et gennemsnitligt maksimalt serumniveau på 2,50 mcg/ml blev nået på 45 minutter; serumniveauer var i gennemsnit 1,51 mcg/ml efter 3 timer og 0,70 mcg/ml efter 6 timer. Absorptionen af en oral dosis er praktisk talt fuldstændig (90%), og samtidig administration af mad ændrer ikke serumkoncentrationerne nævneværdigt; serumniveauer har været ensartede og forudsigelige fra person til person og dosis til dosis. Serumniveauundersøgelser efter multiple doser af CLEOCIN 150 mg HCl i op til 14 dage viser ingen tegn på akkumulering eller ændret stofskifte af lægemidlet. Doser på op til 2 gram clindamycin om dagen i 14 dage er blevet godt tolereret af raske frivillige, bortset fra at forekomsten af gastrointestinale bivirkninger er større med de højere doser.
Fordeling
Koncentrationer af clindamycin i serum steg lineært med øget dosis. Serumniveauer overstiger MIC (minimum hæmmende koncentration) for de fleste indikerede organismer i mindst seks timer efter administration af de sædvanligvis anbefalede doser. Clindamycin er bredt fordelt i kropsvæsker og væv (inklusive knogler). Der opnås ingen signifikante niveauer af clindamycin i cerebrospinalvæsken, selv ved tilstedeværelse af betændte meninges.
Metabolisme
In vitro undersøgelser i humane lever- og tarmmikrosomer indikerede, at clindamycin overvejende metaboliseres af Cytochrom P450 3A4 (CYP3A4), med mindre bidrag fra CYP3A5, til dannelse af clindamycinsulfoxid og en mindre metabolit, N-desmethylclindamycin.
Udskillelse
Den gennemsnitlige biologiske halveringstid er 2,4 timer. Ca. 10 % af bioaktiviteten udskilles i urinen og 3,6 % i fæces; resten udskilles som bioinaktive metabolitter.
Særlige Populationer
Nedsat nyrefunktion
Serumhalveringstid for clindamycin øges en smule hos patienter med markant nedsat nyrefunktion. Hæmodialyse og peritonealdialyse er ikke effektive til at fjerne clindamycin fra serumet.
Brug hos ældre
Farmakokinetiske undersøgelser hos ældre frivillige (61-79 år) og yngre voksne (18-39 år) indikerer, at alder alene ikke ændrer clindamycins farmakokinetik (clearance, eliminationshalveringstid, distributionsvolumen og areal under serumkoncentration-tid-kurven) ) efter IV administration af clindamycinphosphat. Efter oral administration af clindamycinhydrochlorid øges eliminationshalveringstiden til ca. 4,0 timer (interval 3,4-5,1 timer) hos ældre sammenlignet med 3,2 timer (interval 2,1-4,2 timer) hos yngre voksne. Omfanget af absorption er dog ikke forskelligt mellem aldersgrupper, og det er ikke nødvendigt at ændre dosis for ældre med normal leverfunktion og normal (aldersjusteret) nyrefunktion1.
Mikrobiologi
Virkningsmekanisme
Clindamycin hæmmer bakteriel proteinsyntese ved at binde til 23S RNA'et i 50S underenheden af ribosomet. Clindamycin er bakteriostatisk.
Modstand
Resistens over for clindamycin er oftest forårsaget af modifikation af specifikke baser af 23S ribosomalt RNA. Krydsresistens mellem clindamycin og lincomycin er fuldstændig. Fordi bindingsstederne for disse antibakterielle lægemidler overlapper hinanden, observeres krydsresistens nogle gange blandt lincosamider, makrolider og streptogramin B. Makrolid-inducerbar resistens over for clindamycin forekommer i nogle isolater af makrolid-resistente bakterier. Makrolid-resistente isolater af stafylokokker og beta-hæmolytiske streptokokker bør screenes for induktion af clindamycinresistens ved hjælp af D-zone-testen.
Antimikrobiel aktivitet
Clindamycin har vist sig at være aktivt mod de fleste af isolaterne af følgende mikroorganismer, både in vitro og ved kliniske infektioner, som beskrevet i INDIKATIONER OG BRUG afsnit.
Gram-positive bakterier
Staphylococcus aureus (methicillin-følsomme stammer) Streptococcus pneumoniae (penicillin-følsomme stammer) Streptococcus pyogenes
Anaerobe bakterier
Clostridium perfringens Fusobacterium necrophorum Fusobacterium nucleatum Peptostreptococcus anaerobius Prevotella melaninogenica
Mindst 90 % af mikroorganismerne anført nedenfor udviser in vitro minimale hæmmende koncentrationer (MIC'er) mindre end eller lig med det clindamycinfølsomme MIC-brudpunkt for organismer af lignende type som dem, der er vist i tabel 1. Effekten af clindamycin ved behandling af klinisk infektioner på grund af disse mikroorganismer er ikke blevet påvist i tilstrækkelige og velkontrollerede kliniske forsøg.
Gram-positive bakterier
Staphylococcus epidermidis (methicillin-følsomme stammer) Streptococcus agalactiae Streptococcus anginosus Streptococcus mitis Streptococcus oralis
Anaerobe bakterier
Actinomyces israelii Clostridium clostridioforme Eggertella lenta Finegoldia (Peptostreptococcus) magna Micromonas (Peptostreptococcus) micros Prevotella bivia Prevotella intermedia Propionibacterium acnes
Metoder til følsomhedstestning
Når det er tilgængeligt, bør det kliniske mikrobiologiske laboratorium levere kumulative in vitro-følsomhedstestresultater for antimikrobielle lægemidler, der anvendes på lokale hospitaler og praksisområder, til lægen som periodiske rapporter, der beskriver følsomhedsprofilen for nosokomiale og samfundserhvervede patogener. Disse rapporter skal hjælpe lægen med at vælge et antibakterielt lægemiddel til behandling.
Fortyndingsteknikker
Kvantitative metoder bruges til at bestemme antimikrobielle minimumshæmmende koncentrationer (MIC'er). Disse MIC'er giver estimater af bakteriers modtagelighed over for antimikrobielle forbindelser. MIC'erne bør bestemmes ved hjælp af en standardiseret testmetode2,3 (bouillon og/eller agar). MIC-værdierne skal fortolkes i henhold til kriterierne i tabel 1.
Diffusionsteknikker
Kvantitative metoder, der kræver måling af zonediametre, kan også give reproducerbare estimater af bakteriers modtagelighed over for antimikrobielle forbindelser. Zonestørrelsen bør bestemmes ved hjælp af en standardiseret metode2,5. Denne procedure bruger papirskiver imprægneret med 2 mcg clindamycin til at teste bakteriers modtagelighed for clindamycin. Diskdiffusionsbrudpunkterne er angivet i tabel 1.
Anaerobe teknikker
For anaerobe bakterier kan modtageligheden for clindamycin bestemmes ved en standardiseret testmetode2,4. De opnåede MIC-værdier skal fortolkes i henhold til kriterierne i tabel 1.
En rapport om modtagelig (S ) indikerer, at det antimikrobielle lægemiddel sandsynligvis vil hæmme væksten af patogenet, hvis det antimikrobielle lægemiddel når den koncentration, der sædvanligvis kan opnås på infektionsstedet. En rapport af mellemprodukt (I) angiver, at resultatet bør betragtes som tvetydigt, og hvis mikroorganismen ikke er fuldt modtagelig for alternative, klinisk mulige lægemidler, bør testen gentages. Denne kategori indebærer mulig klinisk anvendelighed på kropssteder, hvor lægemidlet er fysiologisk koncentreret, eller i situationer, hvor høje doser af lægemidlet kan anvendes. Denne kategori giver også en bufferzone, der forhindrer små, ukontrollerede tekniske faktorer i at forårsage store uoverensstemmelser i fortolkningen. En rapport om resistent (R) indikerer, at det antimikrobielle lægemiddel sandsynligvis ikke vil hæmme væksten af patogenet, hvis det antimikrobielle lægemiddel når den koncentration, der normalt kan opnås på infektionsstedet; anden terapi bør vælges.
Kvalitetskontrol
Standardiserede følsomhedstestprocedurer kræver brug af laboratoriekontroller til at overvåge og sikre nøjagtigheden og præcisionen af de forsyninger og reagenser, der anvendes i assayet, og teknikkerne for de personer, der udfører testen.2,3,4,5 Standard clindamycinpulver bør give MIC-intervallerne i tabel 2. For diskdiffusionsteknikken ved anvendelse af 2 mcg clindamycin-skiven skal kriterierne i tabel 2 være opfyldt.
anaerober kan testes med enten bouillon-mikrofortynding eller agarfortyndingsmetoder. NA=Ikke relevant ATCC® er et registreret varemærke tilhørende American Type Culture Collection
REFERENCER
1. Smith RB, Phillips JP: Evaluering af CLEOCIN HCl og CLEOCIN Phosphate i en ældre befolkning. Upjohn TR 8147-82-9122-021, december 1982.
2. CLSI. Ydeevnestandarder for antimikrobiel modtagelighedstest: 26. udg. CLSI supplement M100S. Wayne, PA: Clinical and Laboratory Standards Institute; 2016.
3. CLSI. Metoder til fortynding Antimikrobielle følsomhedstests for bakterier, der vokser aerobt; Godkendt standard - tiende udgave. CLSI dokument M07-A10. Wayne, PA: Clinical and Laboratory Standards Institute; 2015.
4. CLSI. Metoder til antimikrobiel følsomhedstestning af anaerobe bakterier; Godkendt Standard-ottende udgave. CLSI dokument M11-A8. Wayne, PA: Clinical and Laboratory Standards Institute; 2012.
5. CLSI. Ydeevnestandarder for antimikrobielle diskfølsomhedstests; Godkendt standard - tolvte udgave. CLSI dokument M02-A12. Wayne, PA: Clinical and Laboratory Standards Institute; 2015.
PATIENTOPLYSNINGER
Patienter bør rådgives om, at antibakterielle lægemidler, inklusive CLEOCIN HCl, kun bør anvendes til behandling af bakterielle infektioner. De behandler ikke virusinfektioner (f.eks. forkølelse). Når CLEOCIN HCl ordineres til behandling af en bakteriel infektion, skal patienterne fortælles, at selvom det er almindeligt at føle sig bedre tidligt i behandlingsforløbet, skal medicinen tages nøjagtigt som anvist. At springe doser over eller ikke fuldføre hele behandlingsforløbet kan (1) mindske effektiviteten af den øjeblikkelige behandling og (2) øge sandsynligheden for, at bakterier udvikler resistens og ikke vil kunne behandles med CLEOCIN 150mg HCl eller andre antibakterielle lægemidler i fremtiden.
Diarré er et almindeligt problem forårsaget af antibiotika, som normalt ophører, når antibiotikaen seponeres. Nogle gange kan patienter efter start af behandling med antibiotika udvikle vandig og blodig afføring (med eller uden mavekramper og feber) selv så sent som to eller flere måneder efter at have taget den sidste dosis af antibiotika. Hvis dette sker, skal patienter kontakte deres læge hurtigst muligt.
