Myambutol 200mg, 400mg, 600mg, 800mg Ethambutol Hydrochloride Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Myambutol, og hvordan bruges det?
Myambutol er en receptpligtig medicin, der bruges til at behandle symptomerne på tuberkulose. Myambutol 400mg kan bruges alene eller sammen med anden medicin.
Myambutol tilhører en klasse af lægemidler kaldet antituberkulære midler.
Det vides ikke, om Myambutol 800mg er sikkert og effektivt til børn under 13 år.
Hvad er de mulige bivirkninger af Myambutol 800mg?
Myambutol kan forårsage alvorlige bivirkninger, herunder:
- nældefeber,
- åndedrætsbesvær,
- hævelse af dit ansigt, læber, tunge eller hals,
- synsproblemer,
- synstab, der kan være permanent,
- sløret syn,
- problemer med at fokusere,
- tab af syn på det ene øje, der varer en time eller længere,
- øget følsomhed i dine øjne over for lys,
- tab af farvesyn,
- smerte ved øjenbevægelser,
- smerte bag øjnene,
- ny eller forværret hoste med feber,
- følelsesløshed af snurren i dine hænder eller fødder,
- forvirring,
- hallucinationer,
- feber,
- hævede kirtler,
- smertefulde sår i munden,
- hudsår,
- symptomer på forkølelse eller influenza,
- generel dårlig følelse,
- let blå mærker eller blødning,
- næseblod,
- blødende tandkød,
- lidt eller ingen vandladning,
- smerter i øvre mave,
- mørk urin,
- lerfarvede afføring,
- gulfarvning af huden eller øjnene (gulsot),
- ondt i halsen,
- brændende i dine øjne,
- hudsmerter,
- rødt eller lilla hududslæt, der breder sig (især i ansigtet eller overkroppen) og forårsager blærer og afskalninger,
- brystsmerter, og
- stakåndet
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Myambutol omfatter:
- kløe,
- udslæt,
- ledsmerter,
- hovedpine,
- svimmelhed,
- kvalme,
- opkastning,
- mavesmerter,
- fordøjelsesbesvær, og
- mistet appetiten
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Myambutol. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
MYAMBUTOL (ethambutolhydrochlorid) er et oralt kemoterapeutisk middel, som er specifikt effektivt mod aktivt voksende mikroorganismer af slægten Mycobacterium, herunder M. tuberculosis. Strukturformlen er:
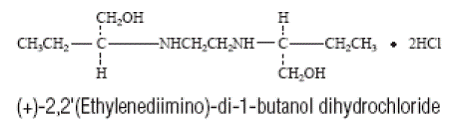
MYAMBUTOL (ethambutolhydrochlorid) 100 og 400 mg tabletter indeholder følgende inaktive ingredienser: Gelatine, hydroxypropylmethylcellulose, magnesiumstearat, natriumlaurylsulfat, sorbitol, stearinsyre, saccharose, titandioxid og andre ingredienser.
INDIKATIONER
MYAMBUTOL er indiceret til behandling af lungetuberkulose. Det bør ikke bruges som det eneste antituberkuløse lægemiddel, men bør bruges sammen med mindst ét andet antituberkuløst lægemiddel. Udvælgelsen af det ledsagende lægemiddel bør baseres på klinisk erfaring, overvejelser om komparativ sikkerhed og passende in vitro-følsomhedsundersøgelser. Hos patienter, der ikke har modtaget tidligere antituberkuløs behandling, dvs. indledende behandling, har de hyppigst anvendte regimer været følgende:
MYAMBUTOL plus isoniazid
MYAMBUTOL 800mg plus isoniazid plus streptomycin.
Hos patienter, som tidligere har modtaget antituberkuløs behandling, er mykobakteriel resistens over for andre lægemidler, der anvendes i den indledende behandling, hyppig. Som følge heraf bør MYAMBUTOL til sådanne genbehandlingspatienter kombineres med mindst et af de anden linje lægemidler, der ikke tidligere er administreret til patienten, og som bakteriel modtagelighed er blevet indikeret over for ved passende in vitro undersøgelser. Antituberkuløse lægemidler brugt sammen med MYAMBUTOL har inkluderet cycloserin, ethionamid, pyrazinamid, viomycin og andre lægemidler. Isoniazid, aminosalicylsyre og streptomycin er også blevet brugt i flere lægemiddelregimer. Alternerende lægemiddelregimer er også blevet anvendt.
DOSERING OG ADMINISTRATION
MYAMBUTOL 200mg bør ikke anvendes alene, i indledende behandling eller ved genbehandling. MYAMBUTOL 400mg bør kun administreres én gang hver 24-timers basis. Absorptionen ændres ikke signifikant ved administration sammen med mad. Behandlingen bør generelt fortsættes, indtil den bakteriologiske omdannelse er blevet permanent, og der er opnået maksimal klinisk forbedring.
MYAMBUTOL anbefales ikke til brug til pædiatriske patienter under tretten år, da sikre betingelser for brug ikke er blevet fastlagt.
Indledende behandling: Hos patienter, som ikke har modtaget tidligere antituberkuløs behandling, indgives MYAMBUTOL 15 mg/kg (7 mg/lb) kropsvægt som en enkelt oral dosis én gang hver 24. time. I de nyere undersøgelser er isoniazid blevet administreret samtidigt i en enkelt daglig oral dosis.
Genbehandling: Hos patienter, som tidligere har modtaget antituberkuløs behandling, indgives MYAMBUTOL 25 mg/kg (11 mg/lb) kropsvægt som en enkelt oral dosis én gang hver 24. time. Administrer samtidig mindst ét andet antituberkuløst lægemiddel, som organismerne har vist sig at være modtagelige for ved passende in vitro-tests. Egnede lægemidler består sædvanligvis af dem, der ikke tidligere er brugt i behandlingen af patienten. Efter 60 dages administration af MYAMBUTOL 600 mg reduceres dosis til 15 mg/kg (7 mg/lb) kropsvægt og indgives som en enkelt oral dosis én gang hver 24. time.
I den periode, hvor en patient er på en daglig dosis på 25 mg/kg, tilrådes månedlige øjenundersøgelser.
Se tabel for let valg af korrekt vægt-dosis tablet(er).
Vægt-Dosis tabel
HVORDAN LEVERET
Ethambutolhydrochlorid-tabletter USP
100 mg – runde, konvekse, hvide, filmovertrukne tabletter indgraveret E6 på den ene side leveres som følger:
NDC 54879-001-01 - Flaske med 100 stk NDC 54879-001-00 - 10 blisterpakninger x 10 tabletter
400 mg – runde, konvekse, hvide, filmovertrukne tabletter med delekærv, indgraveret med E til venstre og 7 til højre for delekærv på den ene side, leveres som følger:
NDC 54879-002-01 - Flaske med 100 stk NDC 54879-002-00 - 10 blisterpakninger x 10 tabletter
Opbevares ved kontrolleret stuetemperatur 20° til 25°C (68° til 77°F).
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088
Fremstillet for og distribueret af: STI Pharma, LLC Langhorne, PA 19047. Revideret marts 2013
BIVIRKNINGER
MYAMBUTOL kan give nedsat synsstyrke, herunder irreversibel blindhed, som ser ud til at skyldes optisk neuritis. Optisk neuropati, herunder optisk neuritis eller retrobulbar neuritis, der forekommer i forbindelse med ethambutolbehandling, kan karakteriseres ved en eller flere af følgende hændelser: nedsat synsstyrke, scotoma, farveblindhed og/eller synsfejl. Disse hændelser er også blevet rapporteret i fravær af en diagnose af optisk eller retrobulbar neuritis.
Patienter bør rådes til straks at rapportere enhver ændring i synsstyrken til deres læge.
Ændringen i synsstyrken kan være ensidig eller bilateral, og derfor skal hvert øje testes separat og begge øjne testes sammen. Test af synsstyrke bør udføres før påbegyndelse af MYAMBUTOL-behandling og periodisk under lægemiddeladministration, bortset fra at det bør udføres månedligt, når en patient er på en dosis på mere end 15 mg pr. kg pr. dag. Snellen øjenkort anbefales til test af synsstyrke. Undersøgelser har vist, at der er klare udsving på en eller to linjer i Snellen-diagrammet i synsstyrken hos mange tuberkuløse patienter, der ikke får MYAMBUTOL.

Følgende tabel kan være nyttig til fortolkning af mulige ændringer i synsstyrken, der kan tilskrives MYAMBUTOL.
Generelt kan ændringer i synsstyrken mindre end dem, der er angivet under "Betydende antal linjer" og "Reducer antallet af punkter", skyldes tilfældige variationer, begrænsninger af testmetoden eller fysiologisk variation. Omvendt indikerer ændringer i synsstyrken, der er lig med eller overstiger dem under "Significant Number of Lines" og "Reducer Number of Points" behov for gentestning og omhyggelig evaluering af patientens synsstatus. Hvis omhyggelig evaluering bekræfter omfanget af den visuelle ændring og ikke afslører en anden årsag, bør MYAMBUTOL 400 mg seponeres, og patienten revurderes med hyppige intervaller. Progressive fald i synsstyrken under behandlingen må anses for at skyldes MYAMBUTOL.
Hvis der anvendes korrigerende briller før behandling, skal disse bæres under synsstyrketest. I løbet af 1 til 2 års behandling kan der udvikles en brydningsfejl, som skal korrigeres for at opnå nøjagtige testresultater. Test af synsstyrken gennem et nålehul eliminerer brydningsfejl. Patienter, der udvikler synsforstyrrelser under behandling med MYAMBUTOL 800 mg, kan vise subjektive visuelle symptomer før eller samtidig med påvisningen af fald i synsstyrken, og alle patienter, der får MYAMBUTOL, bør med jævne mellemrum udspørges om sløret syn og andre subjektive øjensymptomer.
Genopretning af synsstyrken sker generelt over en periode på uger til måneder efter, at lægemidlet er blevet seponeret. Nogle patienter har fået MYAMBUTOL (ethambutolhydrochlorid) igen efter en sådan bedring uden gentagelse af tab af synsstyrke.
Andre rapporterede bivirkninger omfatter: overfølsomhed, anafylaktisk/anafylaktoid reaktion, dermatitis, erythema multiforme, pruritus og ledsmerter; anoreksi, kvalme, opkastning, gastrointestinale forstyrrelser og mavesmerter; feber, utilpashed, hovedpine og svimmelhed; mental forvirring, desorientering og mulige hallucinationer; trombocytopeni, leukopeni og neutropeni. Følelsesløshed og prikken i ekstremiteterne på grund af perifer neuritis er blevet rapporteret.
Forhøjede serumurinsyreniveauer forekommer, og der er rapporteret udfældning af akut gigt. Lungeinfiltrater, med eller uden eosinofili, er også blevet rapporteret under MYAMBUTOL-behandling. Levertoksicitet, herunder dødsfald, er blevet rapporteret (se ADVARSLER .) Da MYAMBUTOL 400mg anbefales til behandling sammen med et eller flere andre antituberkuløse lægemidler, kan disse ændringer være relateret til den samtidige behandling. Overfølsomhedssyndrom bestående af kutan reaktion (såsom udslæt eller eksfoliativ dermatitis), eosinofili og en eller flere af følgende: hepatitis, pneumonitis, nefritis, myocarditis, pericarditis. Feber og lymfadenopati kan være til stede.
DRUGSINTERAKTIONER
Resultaterne af en undersøgelse af samtidig administration af MYAMBUTOL (50 mg/kg) med et aluminiumhydroxid indeholdende antacida til 13 patienter med tuberkulose viste en reduktion af gennemsnitsserumkoncentrationer og urinudskillelse af ethambutol på henholdsvis ca. 20 % og 13 %, hvilket tyder på, at oral absorption af ethambutol kan reduceres af disse antacida produkter. Det anbefales at undgå samtidig administration af ethambutol med antacida indeholdende aluminiumhydroxid i mindst 4 timer efter administration af ethambutol.
ADVARSLER
MYAMBUTOL 600mg kan forårsage fald i synsstyrken, som ser ud til at skyldes optisk neuritis. Denne effekt kan være relateret til dosis og varighed af behandlingen. Denne effekt er generelt reversibel, når administrationen af lægemidlet seponeres omgående. Imidlertid er irreversibel blindhed blevet rapporteret. (Se FORHOLDSREGLER og BIVIRKNINGER ).
Levertoksicitet inklusive dødsfald er blevet rapporteret (se BIVIRKNINGER ). Der bør udføres baseline og periodisk vurdering af leverfunktionen.
FORHOLDSREGLER
MYAMBUTOL 800mg ethambutolhydrochlorid anbefales ikke til brug til pædiatriske patienter under tretten år, da sikre betingelser for brug ikke er blevet fastlagt.
Patienter med nedsat nyrefunktion skal reducere dosis som bestemt af serumniveauer af MYAMBUTOL, da hovedvejen for udskillelse af dette lægemiddel er via nyrerne.
Fordi dette lægemiddel kan have negative virkninger på synet, bør fysisk undersøgelse omfatte oftalmoskopi, fingerperimetri og test af farvediskrimination. Hos patienter med synsfejl som grå stær, tilbagevendende betændelsestilstande i øjet, optisk neuritis og diabetisk retinopati er evalueringen af ændringer i synsstyrken sværere, og man bør være opmærksom på, at variationerne i synet ikke skyldes de underliggende sygdomstilstande. Hos sådanne patienter bør forholdet mellem forventede fordele og mulig visuel forringelse tages i betragtning, da evaluering af synsforandringer er vanskelig. (For anbefalede procedurer, se næste afsnit under BIVIRKNINGER ).
Som med ethvert potent lægemiddel bør der udføres baseline og periodisk vurdering af organsystemfunktioner, herunder nyre-, lever- og hæmatopoietiske.
Graviditet
Teratogene virkninger
Graviditetskategori C.
Der er ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder. Der er rapporter om oftalmiske abnormiteter hos spædbørn født af kvinder i antituberkuløs behandling, som inkluderede MYAMBUTOL. MYAMBUTOL bør kun anvendes under graviditet, hvis fordelene opvejer den potentielle risiko for fosteret.
MYAMBUTOL 200mg har vist sig at være teratogent hos gravide mus og kaniner, når det gives i høje doser. Når gravide mus eller kaniner blev behandlet med høje doser af ethambutolhydrochlorid, var føtal dødelighed let, men ikke signifikant (P>0,05) øget. Hunrotter behandlet med ethambutolhydrochlorid udviste små, men ubetydelige (P>0,05) fald i fertilitet og kuldstørrelse.
Hos fostre født af mus behandlet med høje doser af MYAMBUTOL 400 mg under graviditet, blev der observeret en lav forekomst af ganespalte, exencefali og abnormitet i hvirvelsøjlen. Mindre abnormiteter af halshvirvelen blev set hos nyfødte af rotter behandlet med høje doser ethambutolhydrochlorid under graviditeten. Kaniner, der fik høje doser af MYAMBUTOL under graviditeten, fødte to fostre med monophthalmia, et med en forkortet højre underarm ledsaget af bilateral håndledskontraktur og et med harelæbe og ganespalte.
Ammende mødre
MYAMBUTOL udskilles i modermælken. Brugen af MYAMBUTOL bør kun overvejes, hvis den forventede fordel for moderen opvejer den potentielle risiko for spædbarnet.
Pædiatrisk brug
MYAMBUTOL (ethambutolhydrochlorid) anbefales ikke til brug til pædiatriske patienter under tretten år, da sikre betingelser for brug ikke er blevet fastlagt.
Geriatrisk brug
Der er begrænsede data om brugen af ethambutol hos ældre. En undersøgelse af 101 patienter, 65 år og ældre, på flere lægemiddelbehandlinger mod tuberkulose inkluderede 94 patienter på ethambutol. Der blev ikke observeret nogen forskelle i sikkerhed eller tolerabilitet hos disse patienter sammenlignet med det, der er rapporteret hos voksne generelt. Andre rapporterede kliniske erfaringer har ikke identificeret forskelle i respons mellem ældre og yngre patienter, men større følsomhed hos nogle ældre personer kan ikke udelukkes.
OVERDOSIS
Ingen oplysninger givet
KONTRAINDIKATIONER
MYAMBUTOL er kontraindiceret til patienter, som er kendt for at være overfølsomme over for dette lægemiddel. Det er også kontraindiceret til patienter med kendt optisk neuritis, medmindre klinisk vurdering bestemmer, at det kan anvendes. MYAMBUTOL er kontraindiceret til patienter, som ikke er i stand til at forstå og rapportere visuelle bivirkninger eller ændringer i synet (f.eks. små børn, bevidstløse patienter).
KLINISK FARMAKOLOGI
MYAMBUTOL 600 mg, efter en enkelt oral dosis på 25 mg/kg legemsvægt, opnår en topværdi på 2 til 5 mg/ml i serum 2 til 4 timer efter administration. Når lægemidlet administreres dagligt i længere perioder ved denne dosis, er serumniveauerne ens. Serumniveauet af MYAMBUTOL falder til uopdagelige niveauer 24 timer efter den sidste dosis undtagen hos nogle patienter med unormal nyrefunktion. De intracellulære koncentrationer af erytrocytter når peakværdier, der er ca. det dobbelte af plasma, og opretholder dette forhold gennem de 24 timer.
løbet af 24-timersperioden efter oral administration af MYAMBUTOL udskilles ca. 50 procent af startdosis uændret i urinen, mens yderligere 8 til 15 procent vises i form af metabolitter. Hovedvejen for metabolisme ser ud til at være en indledende oxidation af alkoholen til et aldehydisk mellemprodukt, efterfulgt af omdannelse til en dicarboxylsyre. Fra 20 til 22 procent af startdosis udskilles i fæces som uændret lægemiddel. Ingen lægemiddelakkumulering er blevet observeret med konsekutive enkeltdoser på 25 mg/kg hos patienter med normal nyrefunktion, selvom der er påvist markant akkumulering hos patienter med nyreinsufficiens.
MYAMBUTOL diffunderer ind i aktivt voksende mykobakterieceller såsom tuberkelbaciller. MYAMBUTOL 800mg synes at hæmme syntesen af en eller flere metabolitter og forårsager således svækkelse af cellemetabolisme, standsning af formering og celledød. Der er ikke påvist krydsresistens med andre tilgængelige antimykobakterielle midler.
MYAMBUTOL 200mg har vist sig at være effektiv mod stammer af Mycobacterium tuberculosis, men synes ikke at være aktiv mod svampe, vira eller andre bakterier. Mycobacterium tuberculosis-stammer, der tidligere ikke er blevet eksponeret for MYAMBUTOL, har været ensartet følsomme over for koncentrationer på 8 eller mindre mcg/ml, afhængigt af dyrkningsmediets beskaffenhed. Når MYAMBUTOL er blevet brugt alene til behandling af tuberkulose, har tuberkelbaciller fra disse patienter udviklet resistens over for MYAMBUTOL (ethambutolhydrochlorid) ved in vitro følsomhedstests; udviklingen af resistens har været uforudsigelig og ser ud til at ske på en trinlignende måde. Der er ikke rapporteret krydsresistens mellem MYAMBUTOL og andre antituberkuløse lægemidler. MYAMBUTOL har reduceret forekomsten af mykobakteriel resistens over for isoniazid, når begge lægemidler er blevet brugt samtidigt.
En mikrobiologisk agardiffusionsanalyse baseret på hæmning af Mycobacterium smegmatis (ATCC 607) kan bruges til at bestemme koncentrationer af MYAMBUTOL i serum og urin.
Dyrefarmakologi
Toksikologiske undersøgelser hos hunde med høje forlængede doser viste tegn på myokardiebeskadigelse og -svigt og depigmentering af øjnenes tapetum lucidum, hvis betydning ikke er kendt. Degenerative ændringer i centralnervesystemet, tilsyneladende ikke dosisrelaterede, er også blevet observeret hos hunde, der får ethambutolhydrochlorid over en længere periode.
Hos rhesus-aben optrådte neurologiske tegn efter behandling med høje doser givet dagligt over en periode på flere måneder. Disse var korreleret med specifikke serumniveauer af ethambutol og med tydelige neuroanatomiske ændringer i centralnervesystemet. Fokal interstitiel carditis blev også observeret hos aber, som fik ethambutolhydrochlorid i høje doser i en længere periode.
PATIENTOPLYSNINGER
Ingen oplysninger angivet. Der henvises til ADVARSLER og FORHOLDSREGLER sektioner.
