Cipro 1000mg, 250mg, 500mg, 750mg Ciprofloxacin Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Cipro 750mg, og hvordan bruges det?
Cipro 500mg er en receptpligtig medicin, der bruges til at behandle symptomer på bakterielle infektioner. Cipro kan bruges alene eller sammen med anden medicin.
Cipro tilhører en klasse af lægemidler kaldet fluoroquinoloner.
Det vides ikke, om Cipro 750mg er sikkert og effektivt til børn under 1 år.
Hvad er mulige bivirkninger af Cipro?
Cipro kan forårsage alvorlige bivirkninger, herunder:
- lavt blodsukker,
- hovedpine,
- sult,
- svedeture,
- irritabilitet,
- svimmelhed,
- kvalme,
- hurtig puls,
- føler sig angst eller rystende,
- følelsesløshed i dine hænder, arme, ben eller fødder,
- svaghed,
- prikkende eller brændende smerte,
- nervøsitet,
- forvirring,
- agitation,
- paranoia,
- hallucinationer,
- hukommelsesproblemer,
- koncentrationsbesvær,
- tanker om selvmord,
- pludselig smerte,
- hævelse,
- blå mærker,
- ømhed,
- stivhed,
- bevægelsesproblemer,
- knækker eller springer i enhver led,
- svære eller konstante brystsmerter, mave eller ryg,
- diarré, der er vandig eller blodig,
- flagrende i dit bryst,
- stakåndet,
- svimmelhed,
- udslæt,
- vejrtrækningsproblemer,
- lidt eller ingen vandladning,
- gulfarvning af hud eller øjne,
- svær hovedpine,
- ringen for dine ører,
- synsproblemer og
- smerte bag dine øjne
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Cipro 1000mg omfatter:
- kvalme,
- opkastning,
- diarré,
- mavesmerter,
- vaginal kløe eller udflåd,
- hovedpine, og
- unormale leverfunktionsprøver
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Cipro. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
ALVORLIGE BIVIRKNINGER HERUNDER TENDINIT, SENERUPTUR, PERIFER NEUROPATI, CENTRALE NERVESYSTEMETS VIRKNINGER OG FORÆRRING AF MYASTHENIA GRAVIS
- Fluoroquinoloner, inklusive Cipro 250mg, er blevet forbundet med invaliderende og potentielt irreversible alvorlige bivirkninger, der er opstået sammen [se ADVARSLER OG FORHOLDSREGLER], herunder:
- Tendinitis og seneruptur [se ADVARSLER OG FORHOLDSREGLER]
- Perifer neuropati [se ADVARSLER OG FORHOLDSREGLER]
- Virkninger på centralnervesystemet [se ADVARSLER OG FORHOLDSREGLER]
Afbryd straks Cipro 750mg og undgå brugen af fluoroquinoloner, inklusive Cipro, hos patienter, som oplever nogen af disse alvorlige bivirkninger [se ADVARSLER OG FORHOLDSREGLER ]
- Fluoroquinoloner, inklusive Cipro 750 mg, kan forværre muskelsvaghed hos patienter med myasthenia gravis. Undgå Cipro hos patienter med kendt anamnese med myasthenia gravis. [se ADVARSLER OG FORHOLDSREGLER]
- Fordi fluorokinoloner, inklusive CIPRO 500 mg, er blevet forbundet med alvorlige bivirkninger [se ADVARSLER OG FORHOLDSREGLER], reserver CIPRO til brug hos patienter, som ikke har alternative behandlingsmuligheder for ukomplicerede urinvejsinfektioner [se INDIKATIONER]
BESKRIVELSE
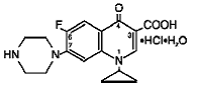
Cipro (cipro 750mgfloxacin*) tabletter med forlænget frigivelse indeholder cipro 500mgfloxacin, et syntetisk antimikrobielt middel til oral administration. Cipro 1000mg tabletter er overtrukne, dobbeltlagstabletter bestående af et lag med øjeblikkelig frigivelse og et lag med kontrolleret frigivelse af erosionsmatrix-typen. Tabletterne indeholder en kombination af to typer ciprofloxacin-lægemiddelstof, ciprofloxacinhydrochlorid og ciprofloxacinbetain (base). Cipro 750mgfloxacinhydrochlorid er 1-cyclopropyl-6-fluor-1,4dihydro-4-oxo-7-(1-piperazinyl)-3-quinolincarboxylsyrehydrochlorid. Det er tilvejebragt som en blanding af monohydratet og sesquihydratet. Den empiriske formel for monohydratet er C17H18FN3O3. HCl. H2O og dets molekylvægt er 385,8. Den empiriske formel for sesquihydratet er C17H18FN3O3. HCl. 1,5 H2O og dens molekylvægt er 394,8. Lægemiddelstoffet er et svagt gulligt til lysegult krystallinsk stof. Den kemiske struktur af monohydratet er som følger:
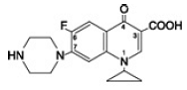
Cipro 1000mgfloxacin betain er 1-cyclopropyl-6-fluor-1, 4-dihydro-4-oxo-7-(1-piperazinyl)-3-quinolincarboxylsyre. Som et hydrat er dets empiriske formel C17H18FN3O3. 3,5 H2O og dens molekylvægt er 394,3. Det er et svagt gulligt til lysegult krystallinsk stof, og dets kemiske struktur er som følger:
Cipro fås i 500 mg og 1000 mg (cipro 500 mgfloxacin ækvivalent) tabletstyrker. Cipro tabletter er næsten hvide til let gullige, filmovertrukne, aflange tabletter. Hver Cipro 500 mg tablet indeholder 500 mg ciprofloxacin som ciprofloxacin HCl (287,5 mg, beregnet som ciprofloxacin på den tørrede basis) og cipro 1000mgfloxacin† (212,6 mg, beregnet på den tørrede basis). Hver Cipro 1000 mg tablet indeholder 1000 mg ciprofloxacin som ciprofloxacin HCl (574,9 mg, beregnet som ciprofloxacin på den tørrede basis) og cipro 750 mgfloxacin† (425,2 mg, beregnet på den tørrede basis). De inaktive ingredienser er crospovidon, hypromellose, magnesiumstearat, polyethylenglycol, kolloid vandfri silica, ravsyre og titaniumdioxid.
* da cipro 500mgfloxacin† og cipro 250mgfloxacinhydrochlorid † ikke overholder tab ved tørretest og rester ved antændelsestest i USP-monografien.
INDIKATIONER
Hud- og hudstrukturinfektioner
CIPRO 1000mg er indiceret til voksne patienter til behandling af hud- og hudstrukturinfektioner forårsaget af Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Proteus mirabilis, Proteus vulgaris, Providencia stuartii, Morganella morganii, Citrobacter freundomosai, a Staphylinosai, Staphylinosai, Staphylinosai, a Staphylinosai methicillinmodtagelig Staphylococcus epidermidis eller Streptococcus pyogenes.
Knogle- og ledinfektioner
CIPRO 750mg er indiceret til voksne patienter til behandling af knogle- og ledinfektioner forårsaget af Enterobacter cloacae, Serratia marcescens eller Pseudomonas aeruginosa.
Komplicerede intra-abdominale infektioner
CIPRO 250mg er indiceret til voksne patienter til behandling af komplicerede intraabdominale infektioner (brugt i kombination med metronidazol) forårsaget af Escherichia coli, Pseudomonas aeruginosa, Proteus mirabilis, Klebsiella pneumoniae eller Bacteroides fragilis.
Infektiøs diarré
CIPRO 500mg er indiceret til voksne patienter til behandling af infektiøs diarré forårsaget af Escherichia coli (enterotoksige isolater), Campylobacter jejuni, Shigella boydii †, Shigella dysenteriae, Shigella flexneri eller Shigella sonnei†, når antibakteriel terapi er indiceret.
†Selvom behandling af infektioner forårsaget af denne organisme i dette organsystem viste et klinisk signifikant resultat, blev effekten undersøgt hos færre end 10 patienter.
Tyfusfeber (enterisk feber)
CIPRO 1000mg er indiceret til voksne patienter til behandling af tyfus (tarmfeber) forårsaget af Salmonella typhi. Effekten af ciprofloxacin til udryddelse af den kroniske tyfus-bærertilstand er ikke blevet påvist.
Ukompliceret cervikal og urethral gonoré
CIPRO er indiceret til voksne patienter til behandling af ukompliceret cervikal og urethral gonoré på grund af Neisseria gonorrhoeae [se ADVARSLER OG FORHOLDSREGLER ].
Inhalationsmiltbrand (efter eksponering)
CIPRO 250mg er indiceret til voksne og pædiatriske patienter fra fødslen til 17 års alderen for inhalationsmiltbrand (post-eksponering) for at reducere forekomsten eller progressionen af sygdom efter eksponering for aerosoliseret Bacillus anthracis.
Cipro 500mgfloxacin serumkoncentrationer opnået hos mennesker tjente som et surrogat-endepunkt, der med rimelighed kunne forudsige kliniske fordele og gav det første grundlag for godkendelse af denne indikation.1 Understøttende klinisk information om ciprofloxacin til miltbrandprofylakse efter eksponering blev opnået under miltbrandbioterrorangrebene i oktober 2001 [se Kliniske Studier ].
Pest
CIPRO 1000mg er indiceret til behandling af pest, herunder pneumonisk og septicemisk pest, på grund af Yersinia pestis (Y. pestis) og profylakse mod pest hos voksne og pædiatriske patienter fra fødslen til 17 års alderen. Effektstudier af cipro 250mgfloxacin kunne ikke udføres hos mennesker med pest af gennemførlighedsgrunde. Derfor er denne indikation kun baseret på en effektivitetsundersøgelse udført på dyr [se Kliniske Studier ].
Kronisk bakteriel prostatitis
CIPRO er indiceret til voksne patienter til behandling af kronisk bakteriel prostatitis forårsaget af Escherichia coli eller Proteus mirabilis.
Nedre luftvejsinfektioner
CIPRO 750mg er indiceret til voksne patienter til behandling af nedre luftvejsinfektioner forårsaget af Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Proteus mirabilis, Pseudomonas aeruginosa, Haemophilus influenzae, Haemophilus influenzae, Haemophilus pneumoniae.
CIPRO er ikke et førstevalgspræparat til behandling af formodet eller bekræftet lungebetændelse sekundært til Streptococcus pneumoniae.
CIPRO er indiceret til behandling af akutte eksacerbationer af kronisk bronkitis (AECB) forårsaget af Moraxella catarrhalis.
Fordi fluorquinoloner, inklusive CIPRO, er blevet forbundet med alvorlige bivirkninger [se ADVARSLER OG FORHOLDSREGLER ] og for nogle patienter er AECB selvbegrænsende, reserver CIPRO 750 mg til behandling af AECB hos patienter, der ikke har alternative behandlingsmuligheder.
Urinvejsinfektioner
Urinvejsinfektioner hos voksne
CIPRO 500mg er indiceret til voksne patienter til behandling af urinvejsinfektioner forårsaget af Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Serratia marcescens, Proteus mirabilis, Providencia rettgeri, Morganella morganii, Citrobacter metrhythumid, Stapindomiosa, citrocillin, citrobacter, citroen, citrobacter, citrobacti , Staphylococcus saprophyticus eller Enterococcus faecalis.
Akut ukompliceret blærebetændelse
CIPRO 750mg er indiceret til voksne kvindelige patienter til behandling af akut ukompliceret blærebetændelse forårsaget af Escherichia coli eller Staphylococcus saprophyticus.
Fordi fluorquinoloner, inklusive CIPRO, er blevet forbundet med alvorlige bivirkninger [se ADVARSLER OG FORHOLDSREGLER ] og for nogle patienter er akut ukompliceret blærebetændelse selvbegrænsende, reserver CIPRO til behandling af akut ukompliceret blærebetændelse hos patienter, der ikke har alternative behandlingsmuligheder.
Kompliceret urinvejsinfektion og pyelonefritis hos pædiatriske patienter
CIPRO er indiceret til pædiatriske patienter i alderen et til 17 år til behandling af komplicerede urinvejsinfektioner (cUTI) og pyelonefritis forårsaget af Escherichia coli [se Brug i specifikke populationer ].
Selvom det er effektivt i kliniske forsøg, er CIPRO ikke et førstevalgspræparat i den pædiatriske population på grund af en øget forekomst af bivirkninger sammenlignet med kontroller, herunder reaktioner relateret til led og/eller omgivende væv. CIPRO 250mg er ligesom andre fluorquinoloner forbundet med artropati og histopatologiske ændringer i vægtbærende led hos unge dyr [se ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER , Brug i specifikke populationer og Ikke-klinisk toksikologi ].
Akut bihulebetændelse
CIPRO er indiceret til voksne patienter til behandling af akut bihulebetændelse forårsaget af Haemophilus influenzae, Streptococcus pneumoniae eller Moraxella catarrhalis.
Fordi fluorquinoloner, inklusive CIPRO, er blevet forbundet med alvorlige bivirkninger [se ADVARSLER OG FORHOLDSREGLER ] og for nogle patienter er akut bihulebetændelse selvbegrænsende, reserver CIPRO til behandling af akut bihulebetændelse hos patienter, som ikke har alternative behandlingsmuligheder.
Brug
For at reducere udviklingen af lægemiddelresistente bakterier og bevare effektiviteten af CIPRO 1000mg og andre antibakterielle lægemidler, bør CIPRO 500mg kun bruges til at behandle eller forebygge infektioner, der er bevist eller stærkt mistænkt for at være forårsaget af modtagelige bakterier. Når kultur- og modtagelighedsoplysninger er tilgængelige, bør de overvejes ved udvælgelse eller ændring af antibakteriel behandling. I mangel af sådanne data kan lokal epidemiologi og modtagelighedsmønstre bidrage til den empiriske udvælgelse af terapi.
Hvis anaerobe organismer mistænkes for at bidrage til infektionen, bør passende behandling gives. Der bør udføres passende dyrknings- og modtagelighedstest før behandling for at isolere og identificere organismer, der forårsager infektion, og for at bestemme deres modtagelighed for ciprofloxacin. Behandling med CIPRO kan påbegyndes, før resultaterne af disse tests er kendt; Når resultaterne foreligger, bør passende behandling fortsættes.
Som med andre lægemidler kan nogle isolater af Pseudomonas aeruginosa udvikle resistens ret hurtigt under behandling med cipro 1000mgfloxacin. Kultur- og modtagelighedstest, der udføres periodisk under terapien, vil give information ikke kun om den terapeutiske virkning af det antimikrobielle middel, men også om den mulige fremkomst af bakteriel resistens.
DOSERING OG ADMINISTRATION
CIPRO 1000mg tabletter og oral suspension skal administreres oralt som beskrevet i de relevante tabeller med doseringsvejledninger.
Dosering hos voksne
Bestemmelsen af dosis og varighed for en bestemt patient skal tage hensyn til infektionens sværhedsgrad og art, følsomheden af den forårsagende mikroorganisme, integriteten af patientens værtsforsvarsmekanismer og status for nyre- og leverfunktion. . CIPRO tabletter eller CIPRO til oral suspension kan administreres til voksne patienter, når det er klinisk indiceret efter lægens skøn. Administrer CIPRO til oral suspension ved hjælp af den sampakkede måleske [se DOSERING OG ADMINISTRATION ].
Konvertering af IV til oral dosering hos voksne
Patienter, hvis behandling er startet med CIPRO IV, kan skifte til CIPRO 750 mg tabletter eller oral suspension, når det er klinisk indiceret efter lægens skøn (tabel 2) [se KLINISK FARMAKOLOGI ].
Dosering hos pædiatriske patienter
Dosering og indledende behandlingsvej (dvs. IV eller oral) for cUTI eller pyelonefritis bør bestemmes af infektionens sværhedsgrad. CIPRO skal administreres som beskrevet i tabel 3. CIPRO til oral suspension skal administreres ved hjælp af den sampakkede måleske [se DOSERING OG ADMINISTRATION ].
Dosisændringer hos patienter med nedsat nyrefunktion
Cipro 250mgfloxacin elimineres primært ved renal udskillelse; lægemidlet metaboliseres dog også delvist gennem leverens galdesystem og gennem tarmen. Disse alternative veje til lægemiddeleliminering ser ud til at kompensere for den reducerede nyreudskillelse hos patienter med nedsat nyrefunktion. Ikke desto mindre anbefales en vis ændring af dosis, især for patienter med alvorlig nyreinsufficiens. Retningslinjer for dosering til patienter med nedsat nyrefunktion er vist i tabel 4.
Når kun serumkreatininkoncentrationen er kendt, kan følgende formler bruges til at estimere kreatininclearance:
Serumkreatininen bør repræsentere en stabil nyrefunktion.
Hos patienter med svære infektioner og svært nedsat nyrefunktion kan en enhedsdosis på 750 mg administreres med de intervaller, der er nævnt ovenfor. Patienter bør overvåges nøje.
Pædiatriske patienter med moderat til svær nyreinsufficiens blev udelukket fra det kliniske forsøg med cUTI og pyelonefritis. Der er ingen tilgængelige oplysninger om nødvendige dosisjusteringer for pædiatriske patienter med moderat til svær nyreinsufficiens (dvs. kreatininclearance
Vigtige administrationsinstruktioner
Med multivalente kationer
Administrer CIPRO mindst 2 timer før eller 6 timer efter magnesium/aluminium antacida; polymere phosphatbindere (f.eks. sevelamer, lanthancarbonat) eller sucralfat; Videx® (didanosin) tyggetabletter/buffrede tabletter eller pædiatrisk pulver til oral opløsning; andre stærkt bufrede lægemidler; eller andre produkter indeholdende calcium, jern eller zink.
Med mejeriprodukter
Samtidig administration af CIPRO 500 mg med mejeriprodukter (såsom mælk eller yoghurt) eller calciumberigede juicer alene bør undgås, da nedsat absorption er mulig; CIPRO kan dog tages sammen med et måltid, der indeholder disse produkter.
Hydrering af patienter, der modtager CIPRO
Sørg for tilstrækkelig hydrering af patienter, der får CIPRO 1000mg for at forhindre dannelsen af højkoncentreret urin. Krystalluri er blevet rapporteret med quinoloner.
Instruer patienten om den passende CIPRO 1000mg administration [se Patientrådgivningsinformation ].
Glemte doser
Hvis en dosis glemmes, skal den tages når som helst, men ikke senere end 6 timer før den næste planlagte dosis. Hvis der er mindre end 6 timer tilbage før næste dosis, bør den glemte dosis ikke tages, og behandlingen skal fortsættes som foreskrevet med den næste planlagte dosis. Dobbeltdoser bør ikke tages for at kompensere for en glemt dosis.
Opdeling CIPRO 1000mg tabletter
CIPRO 750 mg tabletter, 250 mg og 500 mg er tabletter med funktionelt delekærv, som kan deles i halvdelen ved den delekærede linje for at give en styrke på henholdsvis 125 mg og 250 mg.
Vejledning til rekonstitution af CIPRO 500 mg mikrokapsler til oral suspension
CIPRO 750 mg oral suspension leveres i styrker på 5 % (5 g ciprofloxacin i 100 ml) og 10 % (10 g cipro 750 mgfloxacin i 100 ml). CIPRO 250 mg oral suspension er sammensat af to komponenter (mikrokapsler og fortynder), som skal kombineres før dispensering.
Forberedelse af suspensionen
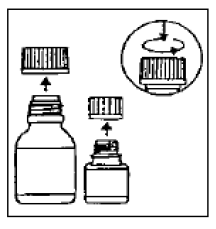
Trin 1
Den lille flaske indeholder mikrokapslerne, den store flaske indeholder fortyndingsmidlet.

Trin 2
Åbn begge flasker. Børnesikker hætte: Tryk ned i henhold til instruktionerne på hætten, mens du drejer til venstre.

Trin 3
 Hæld mikrokapslerne helt i den større flaske med fortynder. Tilsæt ikke vand til suspensionen .
Trin 4
 Fjern det øverste lag af fortynderflaskens etiket (for at afsløre CIPRO 1000mg oral suspensionsmærkat). Luk den store flaske helt i henhold til anvisningerne på låget og ryst kraftigt i ca. 15 sekunder. Suspensionen er klar til brug.
Trin 5
Skriv udløbsdatoen for den rekonstituerede orale suspension på flaskens etiket.
Rekonstitueret produkt kan opbevares under 30°C (86°F) i 14 dage. Beskyt mod frysning.
Der må ikke tilsættes den blandede endelige ciprofloxacinsuspension. CIPRO 1000mg oral suspension bør ikke administreres gennem ernæring eller NG (nasogastriske) sonde på grund af dets fysiske egenskaber.
Administrationsvejledning til CIPRO Til oral suspension efter rekonstitution
- Ryst CIPRO 750 mg oral suspension kraftigt hver gang før brug i ca. 15 sekunder.
- Administrer CIPRO oral suspension ved hjælp af den sampakkede graduerede teske, der er leveret til patienten (se figur 1)
Figur 1: Sampakket 5 mL gradueret teske
Den sampakkede graduerede teske (5mL) medfølger med markeringer for ½ (2,5 mL) og 1/1 (5 mL)
- Efter brug rengøres måleskeen under rindende vand med opvaskemiddel og tørres grundigt.
- Tyg ikke mikrokapslerne i CIPRO 250 mg oral suspension, slug dem i stedet hele.
- Vand kan tages efterfølgende.
- Luk flasken korrekt efter hver brug i henhold til instruktionerne på låget.
- Efter at behandlingen er afsluttet, bør CIPRO 1000mg oral suspension ikke genbruges.
Dosering af CIPRO til oral suspension ved hjælp af den medpakkede ske til voksne og pædiatriske patienter
HVORDAN LEVERET
Doseringsformer og styrker
Tabletter
- 250 mg, let gullig, filmovertrukket, rund, funktionelt delekærv, præget med "BAYER" på den ene side og "CIP 250" på den anden.
- 500 mg, let gullig, filmovertrukket, kapselformet, funktionelt delekærv, præget med "BAYER" på den ene side og "CIP 500" på den anden.
Oral suspension
- % oral suspension: 250 mg cipro 750mgfloxacin pr. 5 ml efter rekonstitution
- 10 % oral suspension: 500 mg cipro 250mgfloxacin pr. 5 ml efter rekonstitution
Opbevaring og håndtering
CIPRO (cipro 750mgfloxacinhydrochlorid) Tabletter fås som runde, let gullige filmovertrukne tabletter indeholdende 250 mg cipro 500mgfloxacin. 250 mg tabletten er kodet med ordet "BAYER" på den ene side og funktionelt delekærv og indgraveret med "CIP 250" på bagsiden. CIPRO fås også som kapselformede, let gullige filmovertrukne tabletter indeholdende 500 mg ciprofloxacin. 500 mg tabletten er kodet med ordet "BAYER" på den ene side og funktionelt delekærv og indgraveret med "CIP 500" på bagsiden. CIPRO 250 mg og 500 mg fås i flasker med 100 stk.
Opbevares ved 20° til 25°C (68° til 77°F); udflugter tilladt til 15° til 30°C (59° til 86°F) [se USP kontrolleret rumtemperatur ].
CIPRO Oral Suspension leveres i 5% og 10% styrker. Lægemidlet er sammensat af to komponenter (mikrokapsler indeholdende den aktive ingrediens og fortyndingsmiddel), som skal blandes af apoteket [se DOSERING OG ADMINISTRATION ].
Opbevar mikrokapsler og fortyndingsmiddel under 25°C (77°F); udflugter er tilladt fra 15°C til 30°C (59°F til 86°F) [se USP kontrolleret rumtemperatur ]. Beskyt mod frysning.
Det rekonstituerede produkt kan opbevares ved 25°C (77°F) i 14 dage; udflugter er tilladt fra 15°C til 30°C (59°F til 86°F) [se USP kontrolleret rumtemperatur ]. Beskyt mod frysning.
En gradueret teske (5 mL) med markeringerne ½ (2,5 mL) og 1/1 (5 mL) leveres til patienten.
REFERENCER
1. 21 CFR 314.510 (Subpart H – Accelereret godkendelse af nye lægemidler til livstruende sygdomme).
2. Friedman J, Polifka J. Teratogene virkninger af lægemidler: en ressource for klinikere (TERIS). Baltimore, Maryland: Johns Hopkins University Press, 2000:149-195.
3. Loebstein R, Addis A, Ho E, et al. Graviditetsresultat efter graviditetseksponering for fluorquinoloner: en multicenter prospektiv kontrolleret undersøgelse. Antimikrobielle midler Kemother. 1998;42(6):1336-1339.
Fremstillet for: Bayer HealthCare Pharmaceuticals Inc. Whippany, NJ 07981. Revideret: nov 2021
BIVIRKNINGER
Følgende alvorlige og ellers vigtige bivirkninger diskuteres mere detaljeret i andre sektioner af mærkningen:
- Invaliderende og potentielt irreversible alvorlige bivirkninger [se ADVARSLER OG FORHOLDSREGLER ]
- Tendinitis og seneruptur [se ADVARSLER OG FORHOLDSREGLER ]
- Perifer neuropati [se ADVARSLER OG FORHOLDSREGLER ]
- Virkninger på centralnervesystemet [se ADVARSLER OG FORHOLDSREGLER ] Forværring af Myasthenia Gravis [se ADVARSLER OG FORHOLDSREGLER ]
- Andre alvorlige og nogle gange fatale bivirkninger [se ADVARSLER OG FORHOLDSREGLER ]
- Overfølsomhedsreaktioner [se ADVARSLER OG FORHOLDSREGLER ]
- Hepatotoksicitet [se ADVARSLER OG FORHOLDSREGLER ]
- Risiko for aortaaneurisme og dissektion [se ADVARSLER OG FORHOLDSREGLER ]
- Alvorlige bivirkninger med samtidig teophyllin [se ADVARSLER OG FORHOLDSREGLER ]
- Clostridioides difficile-associeret diarré [se ADVARSLER OG FORHOLDSREGLER ]
- Forlængelse af QT-intervallet [se ADVARSLER OG FORHOLDSREGLER ]
- Muskuloskeletale lidelser hos pædiatriske patienter [se ADVARSLER OG FORHOLDSREGLER ]
- Lysfølsomhed/fototoksicitet [se ADVARSLER OG FORHOLDSREGLER ]
- Udvikling af lægemiddelresistente bakterier [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Voksne patienter
Under kliniske undersøgelser med oral og parenteral CIPRO 750mg fik 49.038 patienter behandling med lægemidlet.
De hyppigst rapporterede bivirkninger fra kliniske forsøg med alle formuleringer, alle doser, alle lægemiddelbehandlingsvarigheder og for alle indikationer af ciprofloxacinbehandling var kvalme (2,5 %), diarré (1,6 %), unormale leverfunktionsprøver (1,3 %). ), opkastning (1 %) og udslæt (1 %).
I randomiserede, dobbeltblindede kontrollerede kliniske forsøg, der sammenlignede CIPRO-tabletter [500 mg to gange dagligt (BID)] med cefuroximaxetil (250 mg-500 mg BID) og med clarithromycin (500 mg BID) hos patienter med luftvejsinfektioner, viste CIPRO en CNS-bivirkningsprofil, der kan sammenlignes med kontrolpræparaterne.
Pædiatriske patienter
Kort (6 uger) og langsigtet (1 år) muskuloskeletal og neurologisk sikkerhed af oral/intravenøs ciprofloxacin blev sammenlignet med et cephalosporin til behandling af cUTI eller pyelonefritis hos pædiatriske patienter i alderen 1 til 17 år (gennemsnitsalder på 6 ± 4 år) ) i et internationalt multicenterforsøg. Behandlingsvarigheden var 10 til 21 dage (gennemsnitlig behandlingsvarighed var 11 dage med et interval på 1 til 88 dage). I alt 335 cipro 250mgfloxacin- og 349 komparatorbehandlede patienter blev inkluderet.
En uafhængig pædiatrisk sikkerhedskomité (IPSC) gennemgik alle tilfælde af muskuloskeletale bivirkninger, herunder unormal gang eller unormal ledundersøgelse (baseline eller behandlingsfremkaldende). Inden for 6 uger efter behandlingsstart var frekvensen af muskuloskeletale bivirkninger 9,3 % (31/335) i den cipro 750 mgfloxacin-behandlede gruppe versus 6 % (21/349) hos sammenlignende patienter. Alle muskuloskeletale bivirkninger, der opstod inden for 6 uger, forsvandt (klinisk opløsning af tegn og symptomer), sædvanligvis inden for 30 dage efter behandlingens afslutning. Radiologiske evalueringer blev ikke rutinemæssigt brugt til at bekræfte opløsningen af bivirkningerne. Cipro 500mgfloxacin-behandlede patienter var mere tilbøjelige til at rapportere mere end én bivirkning og ved mere end én lejlighed sammenlignet med kontrolpatienter. Hyppigheden af muskuloskeletale bivirkninger var konsekvent højere i ciprofloxacingruppen sammenlignet med kontrolgruppen på tværs af alle aldersundergrupper. Ved udgangen af 1 år var frekvensen af disse bivirkninger rapporteret på et hvilket som helst tidspunkt i denne periode 13,7 % (46/335) i den cipro 250mgfloxacin-behandlede gruppe versus 9,5 % (33/349) hos de sammenlignende patienter ( Tabel 9).
Hyppigheden af neurologiske bivirkninger inden for 6 uger efter behandlingsstart var 3 % (9/335) i CIPRO-gruppen versus 2 % (7/349) i sammenligningsgruppen og inkluderede svimmelhed, nervøsitet, søvnløshed og somnolens.
dette forsøg var den samlede forekomst af bivirkninger inden for 6 uger efter behandlingsstart 41 % (138/335) i cipro 250mgfloxacin-gruppen versus 31 % (109/349) i sammenligningsgruppen. De hyppigste bivirkninger var gastrointestinale: 15 % (50/335) af ciprofloxacinpatienter sammenlignet med 9 % (31/349) af sammenlignende patienter. Alvorlige bivirkninger blev set hos 7,5 % (25/335) af ciprofloxacin-behandlede patienter sammenlignet med 5,7 % (20/349) af kontrolpatienterne. Seponering af lægemidlet på grund af en bivirkning blev observeret hos 3 % (10/335) af ciprofloxacin-behandlede patienter versus 1,4 % (5/349) af sammenlignende patienter. Andre bivirkninger, der forekom hos mindst 1 % af ciprofloxacinpatienterne, var diarré 4,8 %, opkastning 4,8 %, mavesmerter 3,3 %, dyspepsi 2,7 %, kvalme 2,7 %, feber 2,1 %, astma 1,8 % og udslæt 1,8 %.
Kortsigtede sikkerhedsdata for cipro 1000mgfloxacin blev også indsamlet i et randomiseret, dobbeltblindt klinisk forsøg til behandling af akutte pulmonale eksacerbationer hos patienter med cystisk fibrose (alder 5-17 år). 67 patienter fik CIPRO IV 10 mg/kg/dosis hver 8. time i en uge efterfulgt af CIPRO 250 mg tabletter 20 mg/kg/dosis hver 12. time for at fuldføre 10-21 dages behandling, og 62 patienter modtog kombinationen af ceftazidim intravenøst 50 mg/kg/dosis hver 8. time og tobramycin intravenøst 3 mg/kg/dosis hver 8. time i i alt 10-21 dage. Periodiske muskuloskeletale vurderinger blev udført af behandlingsblindede undersøgere. Patienterne blev fulgt i gennemsnitligt 23 dage efter endt behandling (interval 0-93 dage). Muskuloskeletale bivirkninger blev rapporteret hos 22 % af patienterne i ciprofloxacingruppen og 21 % i sammenligningsgruppen. Nedsat bevægelsesområde blev rapporteret hos 12 % af forsøgspersonerne i ciprofloxacingruppen og 16 % i sammenligningsgruppen. Artralgi blev rapporteret hos 10 % af patienterne i cipro 500mgfloxacin-gruppen og 11 % i sammenligningsgruppen. Andre bivirkninger var af samme art og hyppighed mellem behandlingsarme. Effekten af CIPRO til behandling af akutte pulmonale eksacerbationer hos pædiatriske patienter med cystisk fibrose er ikke blevet fastslået.
Ud over de bivirkninger, der er rapporteret hos pædiatriske patienter i kliniske forsøg, bør det forventes, at bivirkninger, der er rapporteret hos voksne under kliniske forsøg eller efter markedsføringserfaring, også kan forekomme hos pædiatriske patienter.
Postmarketing oplevelse
Følgende bivirkninger er blevet rapporteret fra verdensomspændende markedsføringserfaring med fluorquinoloner, inklusive CIPRO. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering (tabel 10).
Uønskede laboratorieændringer
Ændringer i laboratorieparametre under behandling med CIPRO 250mg er angivet nedenfor:
Hepatisk – Forhøjelser af ALT (SGPT), AST (SGOT), alkalisk fosfatase, LDH, serumbilirubin.
Hæmatologisk – Eosinofili, leukopeni, nedsatte blodplader, forhøjede blodplader, pancytopeni.
Renal – Forhøjelser af serumkreatinin, BUN, krystalluri, cylindruri og hæmaturi er blevet rapporteret.
Andre forekomne ændringer var: forhøjet serum gammaglutamyltransferase, forhøjet serumamylase, reduktion i blodglukose, forhøjet urinsyre, fald i hæmoglobin, anæmi, blødende diatese, stigning i blodmonocytter og leukocytose.
DRUGSINTERAKTIONER
Ciprofloxacin er en hæmmer af human cytokrom P450 1A2 (CYP1A2) medieret metabolisme. Samtidig administration af CIPRO med andre lægemidler, der primært metaboliseres af CYP1A2, resulterer i øgede plasmakoncentrationer af disse lægemidler og kan føre til klinisk signifikante bivirkninger af det samtidig administrerede lægemiddel.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Invaliderende og potentielt irreversible alvorlige bivirkninger, herunder tendinitis og seneruptur, perifer neuropati og virkninger på centralnervesystemet
Fluoroquinoloner, inklusive CIPRO, er blevet forbundet med invaliderende og potentielt irreversible alvorlige bivirkninger fra forskellige kropssystemer, som kan forekomme sammen hos den samme patient. Almindelige bivirkninger omfatter senebetændelse, seneruptur, artralgi, myalgi, perifer neuropati og virkninger på centralnervesystemet (hallucinationer, angst, depression, søvnløshed, svær hovedpine og forvirring). Disse reaktioner kan forekomme inden for timer til uger efter start af CIPRO. Patienter i alle aldre eller uden allerede eksisterende risikofaktorer har oplevet disse bivirkninger [se ADVARSLER OG FORHOLDSREGLER ].
Afbryd straks CIPRO 250mg ved de første tegn eller symptomer på en alvorlig bivirkning. Undgå desuden brugen af fluorquinoloner, inklusive CIPRO 500 mg, hos patienter, som har oplevet nogen af disse alvorlige bivirkninger forbundet med fluorquinoloner.
Tendinitis og seneruptur
Fluoroquinoloner, inklusive CIPRO, er blevet forbundet med en øget risiko for senebetændelse og seneruptur i alle aldre [se ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ]. Denne bivirkning involverer oftest akillessenen og er også blevet rapporteret med rotatormanchetten (skulderen), hånden, biceps, tommelfinger og andre sener. Tendinitis eller seneruptur kan forekomme inden for timer eller dage efter påbegyndelse af CIPRO 500 mg, eller så længe som flere måneder efter afslutning af fluoroquinolonbehandling. Tendinitis og seneruptur kan forekomme bilateralt.
Risikoen for at udvikle fluoroquinolon-associeret senebetændelse og seneruptur er øget hos patienter over 60 år, hos patienter, der tager kortikosteroidlægemidler og hos patienter med nyre-, hjerte- eller lungetransplantationer. Andre faktorer, der uafhængigt kan øge risikoen for seneruptur, omfatter anstrengende fysisk aktivitet, nyresvigt og tidligere senelidelser såsom leddegigt. Tendinitis og seneruptur er også forekommet hos patienter, der tager fluoroquinoloner, som ikke har ovennævnte risikofaktorer. Afbryd straks CIPRO 250mg, hvis patienten oplever smerte, hævelse, betændelse eller senebrud. Undgå fluoroquinoloner, inklusive CIPRO 250mg, hos patienter, som har haft senelidelser i anamnesen eller har oplevet senebetændelse eller seneruptur [se BIVIRKNINGER ].
Perifer neuropati
Fluoroquinoloner, inklusive CIPRO, er blevet forbundet med en øget risiko for perifer neuropati. Tilfælde af sensorisk eller sensorimotorisk aksonal polyneuropati, der påvirker små og/eller store axoner, hvilket resulterer i paræstesier, hypoæstesier, dysestesier og svaghed er blevet rapporteret hos patienter, der får fluoroquinoloner, inklusive CIPRO. Symptomer kan opstå kort efter påbegyndelse af CIPRO og kan være irreversible hos nogle patienter [se ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ].
Afbryd CIPRO øjeblikkeligt, hvis patienten oplever symptomer på perifer neuropati, herunder smerte, brændende, snurren, følelsesløshed og/eller svaghed, eller andre ændringer i fornemmelser, herunder let berøring, smerte, temperatur, positionssans og vibrationsfornemmelse og/eller motorisk styrke i for at minimere udviklingen af en irreversibel tilstand. Undgå fluoroquinoloner, inklusive CIPRO 500 mg, hos patienter, som tidligere har oplevet perifer neuropati [se BIVIRKNINGER ].
Virkninger på centralnervesystemet
Psykiatriske bivirkninger
Fluoroquinoloner, inklusive CIPRO, er blevet forbundet med en øget risiko for psykiatriske bivirkninger, herunder: toksisk psykose, psykotiske reaktioner, der udvikler sig til selvmordstanker/-tanker, hallucinationer eller paranoia; depression eller selvskadende adfærd, såsom forsøg på eller fuldført selvmord; angst, agitation eller nervøsitet; forvirring, delirium, desorientering eller opmærksomhedsforstyrrelser; søvnløshed eller mareridt; hukommelsessvækkelse. Disse reaktioner kan forekomme efter den første dosis. Rådgiv patienter, der får CIPRO, om straks at informere deres sundhedsplejerske, hvis disse reaktioner opstår, afbryde lægemidlet og indlede passende behandling.
Bivirkninger i centralnervesystemet
Fluoroquinoloner, inklusive CIPRO 750 mg, er blevet forbundet med en øget risiko for anfald (kramper), øget intrakranielt tryk (pscudotumor cerebri), svimmelhed og rysten. CIPRO er ligesom andre fluorquinoloner kendt for at udløse anfald eller sænke anfaldstærsklen. Tilfælde af status epilepticus er blevet rapporteret. Som med alle fluoroquinoloner skal du bruge CIPRO med forsigtighed til epileptiske patienter og patienter med kendte eller mistænkte CNS-lidelser, der kan disponere for krampeanfald eller sænke krampetærsklen (f.eks. svær cerebral arteriosklerose, tidligere krampeanfald, nedsat cerebral blodgennemstrømning, ændret hjerne struktur eller slagtilfælde), eller ved tilstedeværelse af andre risikofaktorer, der kan disponere for anfald eller sænke anfaldstærsklen (f.eks. visse lægemidler, nyreinsufficiens). Hvis der opstår anfald, afbryd behandlingen med CIPRO 500mg og indled passende behandling [se BIVIRKNINGER og DRUGSINTERAKTIONER ].
Forværring af Myasthenia Gravis
Fluoroquinoloner, inklusive CIPRO, har neuromuskulær blokerende aktivitet og kan forværre muskelsvaghed hos patienter med myasthenia gravis. Alvorlige bivirkninger efter markedsføring, inklusive dødsfald og behov for ventilatorisk støtte, er blevet forbundet med brug af fluoroquinolon hos patienter med myasthenia gravis. Undgå CIPRO hos patienter med kendt anamnese med myasthenia gravis [se BIVIRKNINGER ].
Andre alvorlige og nogle gange fatale bivirkninger
Andre alvorlige og til tider fatale bivirkninger, nogle på grund af overfølsomhed, og nogle på grund af usikker ætiologi, er blevet rapporteret hos patienter i behandling med quinoloner, inklusive CIPRO. Disse hændelser kan være alvorlige og opstår generelt efter administration af flere doser. Kliniske manifestationer kan omfatte en eller flere af følgende:
- Feber, udslæt eller alvorlige dermatologiske reaktioner (for eksempel toksisk epidermal nekrolyse, Stevens-Johnsons syndrom);
- Vaskulitis; artralgi; myalgi; serum sygdom;
- Allergisk pneumonitis;
- Interstitiel nefritis; akut nyreinsufficiens eller -svigt;
- Hepatitis; gulsot; akut levernekrose eller -svigt;
- Anæmi, herunder hæmolytisk og aplastisk; trombocytopeni, herunder trombotisk trombocytopenisk purpura; leukopeni; agranulocytose; pancytopeni; og/eller andre hæmatologiske abnormiteter.
Afbryd behandlingen med CIPRO 500 mg øjeblikkeligt ved den første forekomst af hududslæt, gulsot eller ethvert andet tegn på overfølsomhed og støttende foranstaltninger iværksat [se BIVIRKNINGER ].
Overfølsomhedsreaktioner
Alvorlige og lejlighedsvis fatale overfølsomhedsreaktioner (anafylaktiske) reaktioner, nogle efter den første dosis, er blevet rapporteret hos patienter i fluoroquinolonbehandling, inklusive CIPRO. Nogle reaktioner var ledsaget af kardiovaskulært kollaps, bevidsthedstab, snurren, svælg- eller ansigtsødem, dyspnø, nældefeber og kløe. Kun få patienter havde en historie med overfølsomhedsreaktioner. Alvorlige anafylaktiske reaktioner kræver øjeblikkelig akut behandling med epinephrin og andre genoplivningsforanstaltninger, herunder ilt, intravenøse væsker, intravenøse antihistaminer, kortikosteroider, pressoraminer og luftvejsbehandling, inklusive intubation, som angivet [se BIVIRKNINGER ].
Hepatotoksicitet
Tilfælde af svær levertoksicitet, herunder levernekrose, livstruende leversvigt og fatale hændelser, er blevet rapporteret med CIPRO. Akut leverskade opstår hurtigt (interval 1-39 dage) og er ofte forbundet med overfølsomhed. Mønstret for skade kan være hepatocellulært, kolestatisk eller blandet. De fleste patienter med dødelig udgang var ældre end 55 år. I tilfælde af tegn og symptomer på hepatitis (såsom anoreksi, gulsot, mørk urin, kløe eller øm mave), skal behandlingen straks afbrydes.
Der kan være en midlertidig stigning i transaminaser, alkalisk fosfatase eller kolestatisk gulsot, især hos patienter med tidligere leverskade, som behandles med CIPRO [se BIVIRKNINGER ].
Risiko for aortaaneurisme og dissektion
Epidemiologiske undersøgelser rapporterer en øget hastighed af aortaaneurisme og dissektion inden for to måneder efter brug af fluoroquinoloner, især hos ældre patienter. Årsagen til den øgede risiko er ikke identificeret. Hos patienter med en kendt aortaaneurisme eller patienter, der har større risiko for aortaaneurismer, skal CIPRO 750 mg kun reserveres til brug, når der ikke findes alternative antibakterielle behandlinger.
Alvorlige bivirkninger med samtidig teophyllin
Alvorlige og fatale reaktioner er blevet rapporteret hos patienter, der fik samtidig administration af CIPRO 250 mg og theophyllin. Disse reaktioner har inkluderet hjertestop, krampeanfald, status epilepticus og respirationssvigt. Tilfælde af kvalme, opkastning, tremor, irritabilitet eller hjertebanken er også forekommet.
Selvom lignende alvorlige bivirkninger er blevet rapporteret hos patienter, der får theophyllin alene, kan muligheden for, at disse reaktioner kan forstærkes af CIPRO, ikke elimineres. Hvis samtidig brug ikke kan undgås, skal du overvåge serumniveauer af theophyllin og justere dosis efter behov [se DRUGSINTERAKTIONER ].
Clostridioides Difficile-associeret diarré
Clostridioides difficile (C. difficile)-associeret diarré (CDAD) er blevet rapporteret ved brug af næsten alle antibakterielle midler, inklusive CIPRO, og kan variere i sværhedsgrad fra mild diarré til fatal colitis. Behandling med antibakterielle midler ændrer den normale flora i tyktarmen, hvilket fører til overvækst af C. difficile.
C. difficile producerer toksinerne A og B, som bidrager til udviklingen af CDAD. Hypertoksinproducerende isolater af C. difficile forårsager øget morbiditet og dødelighed, da disse infektioner kan være modstandsdygtige over for antimikrobiel behandling og kan kræve kolektomi. CDAD skal overvejes hos alle patienter, som får diarré efter antibakteriel brug. Omhyggelig sygehistorie er nødvendig, da CDAD er blevet rapporteret at forekomme over to måneder efter administration af antibakterielle midler.
Hvis CDAD er mistænkt eller bekræftet, kan det være nødvendigt at afbryde igangværende antibakteriel brug, der ikke er rettet mod C. difficile. Passende væske- og elektrolytbehandling, proteintilskud, antibakteriel behandling af C. difficile og igangsæt kirurgisk evaluering som klinisk indiceret [se BIVIRKNINGER ].
Forlængelse af QT-intervallet
Nogle fluorokinoloner, inklusive CIPRO 750 mg, er blevet forbundet med forlængelse af QT-intervallet på elektrokardiogrammet og tilfælde af arytmi. Tilfælde af torsade de pointes er blevet rapporteret under postmarketingovervågning hos patienter, der får fluorquinoloner, inklusive CIPRO.
Undgå CIPRO 1000mg til patienter med kendt forlængelse af QT-intervallet, risikofaktorer for QT-forlængelse eller torsade de pointes (f.eks. medfødt lang QT-syndrom, ukorrigeret elektrolytforstyrrelse, såsom hypokaliæmi eller hypomagnesæmi og hjertesygdomme, såsom hjertesvigt, myokardie infarkt eller bradykardi), og patienter, der får klasse IA antiarytmika (quinidin, procainamid) eller klasse III antiarytmika (amiodaron, sotalol), tricykliske antidepressiva, makrolider og antipsykotika. Ældre patienter kan også være mere modtagelige for lægemiddelrelaterede virkninger på QT-intervallet [se BIVIRKNINGER , Brug i specifikke populationer ].
Muskuloskeletale lidelser hos pædiatriske patienter og artropatiske virkninger hos dyr
CIPRO 250mg er kun indiceret til pædiatriske patienter (under 18 år) til cUTI, forebyggelse af inhalationsmiltbrand (efter eksponering) og pest [se INDIKATIONER OG BRUG ]. En øget forekomst af bivirkninger sammenlignet med kontroller, herunder reaktioner relateret til led og/eller omgivende væv, er blevet observeret [se BIVIRKNINGER ].
I prækliniske undersøgelser forårsagede oral administration af CIPRO halthed hos umodne hunde. Histopatologisk undersøgelse af disse hundes vægtbærende led afslørede permanente læsioner af brusken. Beslægtede lægemidler i quinolonklassen producerer også erosioner af brusk i vægtbærende led og andre tegn på artropati hos umodne dyr af forskellige arter [se Brug i specifikke populationer og Ikke-klinisk toksikologi ].
Fotosensitivitet/Fototoksicitet
Moderate til svære lysfølsomheds-/fototoksicitetsreaktioner, hvoraf sidstnævnte kan vise sig som overdrevne solskoldningsreaktioner (f.eks. svie, erytem, ekssudation, vesikler, blærer, ødem), der involverer områder udsat for lys (typisk ansigtet, "V"-området på hals, ekstensorflader på underarmene, dorsa på hænderne), kan associeres med brugen af quinoloner inklusive CIPRO efter sol- eller UV-lyseksponering. Undgå derfor overdreven eksponering for disse lyskilder. Afbryd CIPRO 250 mg, hvis der opstår fototoksicitet [se BIVIRKNINGER ].
Udvikling af lægemiddelresistente bakterier
Ordinering af CIPRO 250mg tabletter og CIPRO oral suspension i fravær af en påvist eller stærkt formodet bakteriel infektion eller en profylaktisk indikation vil næppe give gavn for patienten og øger risikoen for udvikling af lægemiddelresistente bakterier.
Potentielle risici ved samtidig brug af lægemidler metaboliseret af cytokrom P450 1A2 enzymer
CIPRO 750mg er en hæmmer af den hepatiske CYP1A2-enzymvej. Samtidig administration af CIPRO og andre lægemidler, der primært metaboliseres af CYP1A2 (f.eks. theophyllin, methylxanthiner, koffein, tizanidin, ropinirol, clozapin, olanzapin og zolpidem), resulterer i øgede plasmakoncentrationer af det samtidig administrerede lægemiddel og kan føre til klinisk signifikant farmakodynamiske bivirkninger af det samtidig administrerede lægemiddel [se DRUGSINTERAKTIONER og KLINISK FARMAKOLOGI ].
Interferens med rettidig diagnose af syfilis
CIPRO 1000mg har ikke vist sig at være effektivt til behandling af syfilis. Antimikrobielle midler, der anvendes i høje doser i korte perioder til behandling af gonoré, kan maskere eller forsinke symptomerne på inkuberende syfilis. Udfør en serologisk test for syfilis hos alle patienter med gonoré på diagnosetidspunktet. Udfør opfølgende serologisk test for syfilis tre måneder efter CIPRO-behandling.
Krystalluri
Krystaller af ciprofloxacin er sjældent blevet observeret i urinen hos mennesker, men hyppigere i urinen fra forsøgsdyr, som normalt er basisk [se Ikke-klinisk toksikologi ]. Krystalluri relateret til CIPRO er kun sjældent blevet rapporteret hos mennesker, fordi human urin normalt er sur. Undgå alkalinitet af urinen hos patienter, der får CIPRO. Hydrat patienterne godt for at forhindre dannelsen af højkoncentreret urin [se DOSERING OG ADMINISTRATION ].
Blodsukkerforstyrrelser
Fluoroquinoloner, inklusive CIPRO, er blevet forbundet med forstyrrelser i blodsukkeret, herunder symptomatisk hyperglykæmi og hypoglykæmi, sædvanligvis hos diabetespatienter, der samtidig får behandling med et oralt hypoglykæmisk middel (f.eks. glyburid) eller med insulin. Hos disse patienter anbefales omhyggelig overvågning af blodsukkeret. Alvorlige tilfælde af hypoglykæmi, der resulterer i koma eller død, er blevet rapporteret. Hvis der opstår en hypoglykæmisk reaktion hos en patient, der behandles med CIPRO, skal du seponere CIPRO 750mg og straks påbegynde passende behandling [se BIVIRKNINGER , DRUGSINTERAKTIONER ].
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( Medicinvejledning )
Alvorlige bivirkninger
Rådgiv patienterne om at stoppe med at tage CIPRO 250mg, hvis de oplever en bivirkning, og at ringe til deres læge for at få råd om at fuldføre hele behandlingsforløbet med et andet antibakterielt lægemiddel.
Informer patienterne om følgende alvorlige bivirkninger, der er blevet forbundet med CIPRO eller anden brug af fluorquinolon:
- Invaliderende og potentielt irreversible alvorlige bivirkninger, der kan forekomme sammen: Informer patienterne om, at invaliderende og potentielt irreversible alvorlige bivirkninger, herunder tendinitis og seneruptur, perifere neuropatier og virkninger på centralnervesystemet, er blevet forbundet med brugen af CIPRO 1000mg og kan forekomme sammen hos samme patient. Informer patienterne om at stoppe med at tage CIPRO øjeblikkeligt, hvis de oplever en bivirkning, og ring til deres læge.
- Tendinitis og seneruptur: Instruer patienterne i at kontakte deres læge, hvis de oplever smerte, hævelse eller betændelse i en sene, eller svaghed eller manglende evne til at bruge et af deres led; hvile og afstå fra træning; og afbryd behandlingen med CIPRO 750mg. Symptomer kan være irreversible. Risikoen for alvorlig senelidelse med fluoroquinoloner er højere hos ældre patienter, sædvanligvis over 60 år, hos patienter, der tager kortikosteroidlægemidler, og hos patienter med nyre-, hjerte- eller lungetransplantationer.
- Perifere neuropatier: Informer patienterne om, at perifere neuropatier er blevet forbundet med brug af ciprofloxacin, symptomer kan opstå kort efter påbegyndelse af behandlingen og kan være irreversible. Hvis der opstår symptomer på perifer neuropati, herunder smerte, brænden, snurren, følelsesløshed og/eller svaghed, skal du straks afbryde behandlingen med CIPRO og fortælle dem, at de skal kontakte deres læge.
- Virkninger på centralnervesystemet (f.eks. kramper, svimmelhed, svimmelhed, øget intrakranielt tryk): Informer patienterne om, at der er rapporteret kramper hos patienter, der får fluorquinoloner, inklusive Ciprofloxacin. Instruer patienterne i at underrette deres læge, før de tager dette lægemiddel, hvis de har en historie med kramper. Informer patienterne om, at de skal vide, hvordan de reagerer på CIPRO, før de betjener en bil eller et maskineri eller engagerer sig i andre aktiviteter, der kræver mental årvågenhed og koordination. Instruer patienterne i at underrette deres læge, hvis der opstår vedvarende hovedpine med eller uden sløret syn.
- Forværring af Myasthenia Gravis: Instruer patienterne i at informere deres læge om enhver historie med myasthenia gravis. Instruer patienterne i at underrette deres læge, hvis de oplever symptomer på muskelsvaghed, herunder åndedrætsbesvær.
- Overfølsomhedsreaktioner: Informer patienterne om, at ciprofloxacin kan forårsage overfølsomhedsreaktioner, selv efter en enkelt dosis, og at seponere lægemidlet ved de første tegn på hududslæt, nældefeber eller andre hudreaktioner, hurtig hjerterytme, synke- eller vejrtrækningsbesvær, hævelse, der tyder på angioødem ( for eksempel hævelse af læber, tunge, ansigt, tæthed i halsen, hæshed) eller andre symptomer på en allergisk reaktion.
- Hepatotoksicitet: Informer patienterne om, at alvorlig hepatotoksicitet (inklusive akut hepatitis og fatale hændelser) er blevet rapporteret hos patienter, der tager CIPRO. Instruer patienterne i at informere deres læge, hvis de oplever tegn eller symptomer på leverskade, herunder: tab af appetit, kvalme, opkastning, feber, svaghed, træthed, ømhed i øverste højre kvadrant, kløe, gulfarvning af hud og øjne, lyse afføringer eller mørkfarvet urin.
- Aortaaneurisme og dissektion: Informer patienterne om at søge akut lægehjælp, hvis de oplever pludselige bryst-, mave- eller rygsmerter.
- Diarré: Diarré er et almindeligt problem forårsaget af antibiotika, som normalt ophører, når antibiotikaen seponeres. Nogle gange kan patienter efter start af behandling med antibiotika udvikle vandig og blodig afføring (med eller uden mavekramper og feber) selv så sent som to eller flere måneder efter at have taget den sidste dosis af antibiotika. Hvis dette sker, instruer patienterne i at kontakte deres læge så hurtigt som muligt.
- Forlængelse af QT-intervallet: Instruer patienterne i at informere deres læge om enhver personlig eller familiehistorie med QT-forlængelse eller proarytmiske tilstande såsom hypokaliæmi, bradykardi eller nylig myokardieiskæmi; hvis de tager antiarytmika af klasse IA (quinidin, procainamid) eller klasse III (amiodaron, sotalol). Instruer patienterne i at underrette deres læge, hvis de har symptomer på forlængelse af QT-intervallet, herunder forlænget hjertebanken eller bevidsthedstab.
- Muskuloskeletale lidelser hos pædiatriske patienter: Instruer forældre til at informere deres barns læge, hvis barnet har en historie med ledrelaterede problemer, før de tager dette lægemiddel. Informer forældre til pædiatriske patienter om at underrette deres barns læge om eventuelle ledrelaterede problemer, der opstår under eller efter behandling med cipro 1000mgfloxacin [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
- Tizanidin: Instruer patienterne i ikke at bruge cipro 250mgfloxacin, hvis de allerede tager tizanidin. CIPRO øger virkningen af tizanidin (Zanaflex®).
- Theophyllin: Informer patienterne om, at cipro 250mgfloxacin CIPRO 1000mg kan øge virkningen af theophyllin. Livstruende CNS-effekter og arytmier kan forekomme. Råd patienterne til straks at søge lægehjælp, hvis de oplever anfald, hjertebanken eller åndedrætsbesvær.
- Koffein: Informer patienterne om, at CIPRO 500mg kan øge virkningen af koffein. Der er mulighed for koffeinophobning, når produkter, der indeholder koffein, indtages, mens du tager quinoloner.
- Lysfølsomhed/fototoksicitet: Informer patienterne om, at lysfølsomhed/fototoksicitet er blevet rapporteret hos patienter, der får fluorquinoloner. Informer patienterne om at minimere eller undgå eksponering for naturligt eller kunstigt sollys (solarier eller UVA/B-behandling), mens de tager quinoloner. Hvis patienter skal være udendørs, mens de bruger quinoloner, skal du instruere dem i at bære løstsiddende tøj, der beskytter huden mod soleksponering, og diskutere andre solbeskyttelsesforanstaltninger med deres læge. Hvis der opstår en solskoldningslignende reaktion eller hududbrud, instruer patienterne i at kontakte deres læge.
- Blodsukkerforstyrrelser: Informer patienterne om, at hvis de er diabetikere og behandles med insulin eller et oralt hypoglykæmisk middel, og der opstår en hypoglykæmisk reaktion, skal de seponere CIPRO 250 mg og konsultere en læge.
- Amning: For andre indikationer end inhalationsmiltbrand (efter eksponering), rådgive en kvinde om, at amning ikke anbefales under behandling med Cipro og i yderligere 2 dage efter den sidste dosis. Alternativt kan en kvinde pumpe og kassere under behandlingen og i yderligere 2 dage efter den sidste dosis [se Brug i specifikke populationer ].
Antibakteriel resistens
Informer patienterne om, at antibakterielle lægemidler inklusive CIPRO 250 mg tabletter og CIPRO 1000 mg oral suspension kun bør anvendes til behandling af bakterielle infektioner. De behandler ikke virusinfektioner (for eksempel almindelig forkølelse). Når CIPRO 500 mg tabletter og CIPRO 500 mg oral suspension ordineres til behandling af en bakteriel infektion, skal patienterne fortælles, at selvom det er almindeligt at føle sig bedre tidligt i behandlingsforløbet, skal medicinen tages nøjagtigt som anvist. At springe doser over eller ikke fuldføre hele behandlingsforløbet kan (1) mindske effektiviteten af den øjeblikkelige behandling og (2) øge sandsynligheden for, at bakterier udvikler resistens og ikke kan behandles med CIPRO 500 mg tabletter og CIPRO 250 mg oral suspension eller andre antibakterielle midler. stoffer i fremtiden.
Administrationsinstruktioner
Instruer patienten
- At ryste CIPRO Oral Suspension kraftigt hver gang før brug i ca. 15 sekunder.
- For altid at bruge den sampakkede måleske med markeringer for ½ (2,5 mL) og 1/1 (5 mL), for at opnå den nøjagtige dosis.
- Efter brug skal måleskeen rengøres under rindende vand med opvaskemiddel og tørres grundigt.
- Ikke for at tygge mikrokapslerne, men for at sluge dem hele.
- Det vand kan tages bagefter.
- Luk flasken korrekt efter hver brug i henhold til instruktionerne på låget.
- Efter at behandlingen er afsluttet, bør CIPRO 1000mg oral suspension ikke genbruges.
Informer patienterne om, at CIPRO 250 mg kan tages med eller uden mad.
Informer patienterne om at drikke rigeligt med væske, mens de tager CIPRO for at undgå dannelse af højkoncentreret urin og krystaldannelse i urinen.
Informer patienterne om, at antacida indeholdende magnesium eller aluminium samt sucralfat, metalkationer såsom jern og multivitaminpræparater med zink eller didanosin bør tages mindst to timer før eller seks timer efter administration af CIPRO 1000mg. CIPRO bør ikke tages sammen med mælkeprodukter (såsom mælk eller yoghurt) eller calciumberiget juice alene, da absorptionen af ciprofloxacin kan være betydeligt reduceret; dog kan CIPRO 500mg tages sammen med et måltid, der indeholder disse produkter.
Informer patienterne om, at hvis en dosis glemmes, skal den tages når som helst, men ikke senere end 6 timer før den næste planlagte dosis. Hvis der er mindre end 6 timer tilbage før næste dosis, bør den glemte dosis ikke tages, og behandlingen skal fortsættes som foreskrevet med den næste planlagte dosis. Dobbeltdoser bør ikke tages for at kompensere for en glemt dosis.
Rådfør patienterne om, at CIPRO 500 mg tabletter (250 mg og 500 mg) er bedømt og kan opdeles i halvdelen ved stregen for at give en styrke på henholdsvis 125 mg eller 250 mg.
Lægemiddelinteraktioner Orale antidiabetiske midler
Informer patienterne om, at hypoglykæmi er blevet rapporteret, når cipro 250mgfloxacin og orale antidiabetika blev administreret samtidigt; hvis lavt blodsukker forekommer med CIPRO 750mg, instruer dem i at konsultere deres læge, og at deres antibakterielle medicin muligvis skal ændres.
Miltbrand og peststudier
Informer patienter, der får CIPRO for disse tilstande, om, at effektivitetsundersøgelser ikke kunne udføres på mennesker af gennemførlighedsgrunde. Godkendelsen af disse betingelser var derfor baseret på effektivitetsundersøgelser udført på dyr.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Otte in vitro mutagenicitetstest er blevet udført med cipro 500mgfloxacin, og testresultaterne er angivet nedenfor:
- Salmonella/mikrosomtest (negativ)
- E. coli DNA-reparationsanalyse (negativ)
- Muse lymfom celle fremad mutationsanalyse (positiv)
- Kinesisk hamster V79 celle HGPRT-test (negativ)
- Syrisk hamster embryocelletransformationsanalyse (negativ)
- Saccharomyces cerevisiae punktmutationsanalyse (negativ)
- Saccharomyces cerevisiae mitotisk krydsover- og genkonverteringsassay (negativ)
- Rottehepatocyt-DNA-reparationsanalyse (positiv)
Således var 2 af de 8 tests positive, men resultaterne af de følgende 3 in vivo testsystemer gav negative resultater:
- Rotte-hepatocyt-DNA-reparationsanalyse
- Mikronukleustest (mus)
- Dominant lethal test (mus)
Langsigtede carcinogenicitetsundersøgelser hos rotter og mus resulterede ikke i nogen karcinogene eller tumorogene virkninger på grund af cipro 500mgfloxacin ved daglige orale dosisniveauer op til 250 mg/kg og 750 mg/kg til henholdsvis rotter og mus (ca. 1,7 og 2,5 gange den højeste anbefalede terapeutiske dosis baseret på henholdsvis kropsoverfladeareal).
Resultater fra foto-co-carcinogenicitetstest indikerer, at cipro 1000mgfloxacin ikke reducerer tiden til fremkomst af UV-inducerede hudtumorer sammenlignet med vehikelkontrol. Hårløse (Skh-1) mus blev udsat for UVA-lys i 3,5 timer fem gange hver anden uge i op til 78 uger, mens de samtidig fik ciprofloxacin. Tiden til udvikling af de første hudtumorer var 50 uger hos mus, der blev behandlet samtidig med UVA og cipro 1000mgfloxacin (musedosis omtrent lig med maksimal anbefalet human dosis baseret på kropsoverfladeareal), i modsætning til 34 uger, hvor dyrene blev behandlet med både UVA og køretøj. Tiderne til udvikling af hudtumorer varierede fra 16 uger til 32 uger hos mus, der blev behandlet samtidig med UVA og andre quinoloner.5
I denne model udviklede mus behandlet med ciprofloxacin alene ikke hud- eller systemiske tumorer. Der er ingen data fra lignende modeller, der anvender pigmenterede mus og/eller fuldhårede mus. Den kliniske betydning af disse fund for mennesker er ukendt.
Fertilitetsundersøgelser udført på han- og hunrotter ved orale doser af cipro 250 mgfloxacin op til 100 mg/kg (ca. 0,6 gange den højeste anbefalede terapeutiske orale dosis baseret på kropsoverfladeareal) viste ingen tegn på svækkelse. Hanrotter fik oral ciprofloxacin i 10 uger før parring, og hunner blev doseret i 3 uger før parring til og med drægtighedsdag 7.
Brug i specifikke populationer
Graviditet
Risikooversigt
Langvarig erfaring med cipro 1000mgfloxacin hos gravide kvinder gennem flere årtier, baseret på tilgængelig offentliggjort information fra case-rapporter, case-kontrolstudier og observationsstudier af cipro 1000mgfloxacin administreret under graviditet, har ikke identificeret nogen lægemiddelassocieret risiko for alvorlige fødselsdefekter, abort eller uønskede moderens eller fosterets udfald (se Data ). Oral administration af cipro 500mgfloxacin under organogenese i doser op til 100 mg/kg til gravide mus og rotter og op til 30 mg/kg til gravide kaniner forårsagede ikke føtale misdannelser (se Data ). Disse doser var op til 0,3, 0,6 og 0,4 gange den maksimalt anbefalede kliniske orale dosis til henholdsvis mus, rotter og kaniner baseret på kropsoverfladeareal. Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort for den angivne population er ukendt. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre ugunstige udfald. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 til 4 % og 15 til 20 %.
Data
Menneskelige data
Mens tilgængelige undersøgelser ikke endegyldigt kan fastslå fraværet af risiko, har offentliggjorte data fra prospektive observationsstudier over flere årtier ikke etableret en sammenhæng med cipro 250mgfloxacin brug under graviditet og større fødselsdefekter, abort eller uønskede maternelle eller føtale resultater. Tilgængelige undersøgelser har metodiske begrænsninger, herunder lille prøvestørrelse, og nogle af dem er ikke specifikke for ciprofloxacin. Et kontrolleret prospektivt observationsstudie fulgte 200 kvinder eksponeret for fluorquinoloner (52,5 % eksponeret for cipro 250mgfloxacin og 68 % eksponeringer i første trimester) under graviditeten. In utero eksponering for fluoroquinoloner under embryogenese var ikke forbundet med øget risiko for større misdannelser. De rapporterede forekomster af større medfødte misdannelser var 2,2 % for fluoroquinolongruppen og 2,6 % for kontrolgruppen (baggrundshyppigheden af større misdannelser er 1-5 %). Hyppigheden af spontane aborter, præmaturitet og lav fødselsvægt var ikke forskellige mellem grupperne, og der var ingen klinisk signifikante muskuloskeletale dysfunktioner op til et års alderen hos de cipro 500 mgfloxacin-eksponerede børn.
En anden prospektiv opfølgningsundersøgelse rapporterede om 549 graviditeter med eksponering for fluorquinolon (93 % eksponering i første trimester). Der var 70 eksponeringer for cipro 500mgfloxacin, alle inden for det første trimester. Misdannelseshyppigheden blandt levendefødte babyer, der blev eksponeret for cipro 750mgfloxacin og for fluoroquinoloner generelt, var begge inden for baggrundsincidensintervallet. Ingen specifikke mønstre af medfødte abnormiteter blev fundet. Undersøgelsen afslørede ingen klare bivirkninger som følge af in utero eksponering for ciprofloxacin.
Der blev ikke set forskelle i antallet af præmaturiteter, spontane aborter eller fødselsvægt hos kvinder, der blev eksponeret for ciprofloxacin under graviditet. Disse små epidemiologiske undersøgelser efter markedsføring, hvoraf de fleste erfaringer er fra kortvarig eksponering i første trimester, er imidlertid utilstrækkelige til at vurdere risikoen for mindre almindelige defekter eller til at tillade pålidelige og definitive konklusioner vedrørende sikkerheden af ciprofloxacin hos gravide kvinder og deres fostre under udvikling. .
Dyredata
Udviklingstoksikologiske undersøgelser er blevet udført med cipro 500mgfloxacin hos rotter, mus og kaniner. Hos rotter og mus var orale doser på op til 100 mg/kg administreret under organogenese (drægtighedsdage, GD, 6-17) ikke forbundet med uønskede udviklingsresultater, herunder embryoføtal toksicitet eller misdannelser. Hos rotter og mus er en dosis på 100 mg/kg henholdsvis ca. 0,6 og 0,3 gange den maksimale daglige orale humane dosis (1500 mg/dag) baseret på kropsoverfladeareal. I en række udviklingstoksikologiske undersøgelser af kanin modtog han oral eller intravenøs cipro 250mgfloxacin i en af følgende 5 dages perioder: GD 6 til 10, GD 10 til 14 eller GD 14 til 18, beregnet til at dække organogeneseperioden. Dette var et forsøg på at afbøde den gastrointestinale intolerance observeret hos kaniner, der får antibakterielle midler, manifesteret ved reduceret fødeforbrug og vægttab, hvilket kan føre til embryoføtal resorption eller spontan abort. En oral cipro 750mgfloxacindosis på 100 mg/kg (ca. 1,3 gange den højeste anbefalede kliniske orale dosis baseret på kropsoverfladeareal) forårsagede overdreven maternel toksicitet, der forvirrede evalueringen af fostrene. En oral dosis på 30 mg/kg (ca. 0,4 gange den højeste anbefalede kliniske orale dosis) var forbundet med suppression af moderens og føtale vægtøgning, men føtale misdannelser blev ikke observeret. Intravenøs administration af doser op til 20 mg/kg (ca. 0,3 gange den højeste anbefalede kliniske orale dosis baseret på kropsoverfladeareal) til gravide kaniner var ikke toksisk for moderen, og der blev hverken observeret embryoføtal toksicitet eller føtale misdannelser.
peri- og postnatale undersøgelser fik rotter cipro 1000 mgfloxacin doser op til 200 mg/kg/dag (oral) eller op til 30 mg/kg/dag (subkutant) fra GD 16 til 22 dage efter fødslen. Dosis på 200 mg/kg er ca. 1,3 gange den maksimalt anbefalede kliniske orale dosis baseret på kropsoverfladeareal. Hverken maternel toksicitet eller negative virkninger på ungernes vækst og udvikling blev observeret, herunder ingen tegn på artropati på ungernes bageste benled. Ciprofloxacin og andre quinoloner har vist sig at forårsage artropati hos umodne dyr af de fleste testede arter, når de administreres direkte [se ADVARSLER OG FORHOLDSREGLER og Ikke-klinisk toksikologi ].
Amning
Risikooversigt
Publiceret litteratur rapporterer, at cipro 1000mgfloxacin er til stede i modermælk efter intravenøs og oral administration. Der er ingen information om virkningen af CIPRO på mælkeproduktionen eller det ammede spædbarn. På grund af den potentielle risiko for alvorlige bivirkninger hos ammede spædbørn, inklusive artropati vist i unge dyreforsøg [se Brug i specifikke populationer (Kliniske overvejelser)], for de fleste indikationer kan en ammende kvinde overveje at pumpe og kassere modermælk under behandling med CIPRO 500 mg og yderligere to dage (fem halveringstider) efter den sidste dosis. Alternativt skal du rådgive en kvinde om, at amning ikke anbefales under behandling med CIPRO og i yderligere to dage (fem halveringstider) efter den sidste dosis.
For inhalationsmiltbrand (efter eksponering), under en hændelse, der resulterer i udsættelse for miltbrand, kan risiko-benefit-vurderingen af fortsat amning, mens moderen (og potentielt spædbarnet) er (er) på CIPRO være acceptabel [se DOSERING OG ADMINISTRATION , Pædiatrisk brug , og Kliniske Studier ]. De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for CIPRO og eventuelle negative virkninger på det ammede barn fra CIPRO 1000mg eller fra den underliggende moderens tilstand.
Kliniske overvejelser
Cipro 1000mgfloxacin kan forårsage ændring af tarmfloraen hos det ammende spædbarn. Råd en kvinde om at overvåge det ammede spædbarn for løs eller blodig afføring og candidiasis (trøske, bleudslæt).
Pædiatrisk brug
Selvom det er effektivt i kliniske forsøg, er CIPRO 750 mg ikke et førstevalgslægemiddel i den pædiatriske population på grund af en øget forekomst af bivirkninger sammenlignet med kontroller. Quinoloner, inklusive CIPRO, forårsager artropati (artralgi, arthritis) hos unge dyr [se ADVARSLER OG FORHOLDSREGLER og Ikke-klinisk toksikologi ].
Kompliceret urinvejsinfektion og pyelonefritis
CIPRO 250mg er indiceret til behandling af cUTI og pyelonefritis på grund af Escherichia coli hos pædiatriske patienter i alderen 1 til 17 år. Selvom det er effektivt i kliniske forsøg, er CIPRO 500mg ikke et førstevalgslægemiddel i den pædiatriske population på grund af en øget forekomst af bivirkninger sammenlignet med kontrollerne, herunder hændelser relateret til led og/eller omgivende væv [se BIVIRKNINGER og Kliniske Studier ].
Inhalationsmiltbrand (efter eksponering)
CIPRO 750mg er indiceret til pædiatriske patienter fra fødslen til 17 års alderen mod inhalationsmiltbrand (post-eksponering). Risiko-benefit-vurderingen indikerer, at administration af ciprofloxacin til pædiatriske patienter er passende [se DOSERING OG ADMINISTRATION og Kliniske Studier ].
Pest
CIPRO 500mg er indiceret til pædiatriske patienter fra fødslen til 17 års alderen til behandling af pest, herunder pneumonisk og septicemisk pest på grund af Yersinia pestis (Y. pestis) og profylakse mod pest. Effektstudier af CIPRO kunne ikke udføres hos mennesker med pneumonisk pest af gennemførlighedsgrunde. Derfor var godkendelsen af denne indikation baseret på en effektivitetsundersøgelse udført på dyr. Risiko-benefit-vurderingen indikerer, at administration af CIPRO til pædiatriske patienter er passende [se INDIKATIONER OG BRUG , DOSERING OG ADMINISTRATION og Kliniske Studier ].
Geriatrisk brug
Geriatriske patienter har øget risiko for at udvikle alvorlige senelidelser, herunder seneruptur, når de behandles med en fluoroquinolon såsom CIPRO. Denne risiko øges yderligere hos patienter, der samtidig får kortikosteroidbehandling. Tendinitis eller seneruptur kan involvere akilles, hånd, skulder eller andre senesteder og kan forekomme under eller efter afslutning af behandlingen; tilfælde, der opstår op til flere måneder efter fluoroquinolonbehandling, er blevet rapporteret. Der bør udvises forsigtighed ved ordinering af CIPRO 500 mg til ældre patienter, især dem, der tager kortikosteroider. Patienterne skal informeres om denne potentielle bivirkning og rådes til at seponere CIPRO 500mg og kontakte deres læge, hvis der opstår symptomer på senebetændelse eller seneruptur [se KASSET ADVARSEL , ADVARSLER OG FORHOLDSREGLER , og BIVIRKNINGER ].
Epidemiologiske undersøgelser rapporterer en øget hastighed af aortaaneurisme og dissektion inden for to måneder efter brug af fluoroquinoloner, især hos ældre patienter [se ADVARSLER OG FORHOLDSREGLER ].
en retrospektiv analyse af 23 flerdosis kontrollerede kliniske undersøgelser af CIPRO omfattende over 3500 ciprofloxacinbehandlede patienter, var 25 % af patienterne ældre end eller lig med 65 år og 10 % var ældre end eller lig med 75 år. Der blev ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet mellem disse forsøgspersoner og yngre forsøgspersoner, og anden rapporteret klinisk erfaring har ikke identificeret forskelle i respons mellem ældre og yngre patienter, men større følsomhed hos nogle ældre individer over for nogen form for lægemiddelbehandling kan ikke udelukkes. Ciprofloxacin er kendt for at udskilles væsentligt af nyrerne, og risikoen for bivirkninger kan være større hos patienter med nedsat nyrefunktion. Ingen ændring af dosis er nødvendig for patienter over 65 år med normal nyrefunktion. Men da nogle ældre personer oplever nedsat nyrefunktion i kraft af deres høje alder, bør der udvises forsigtighed ved dosisvalg til ældre patienter, og nyrefunktionsmonitorering kan være nyttig hos disse patienter [se DOSERING OG ADMINISTRATION og KLINISK FARMAKOLOGI ].
Generelt kan ældre patienter være mere modtagelige for lægemiddelrelaterede effekter på QT-intervallet. Derfor bør der tages forsigtighed, når du bruger CIPRO 500mg sammen med lægemidler, der kan resultere i forlængelse af QT-intervallet (f.eks. klasse IA eller klasse III antiarytmika) eller hos patienter med risikofaktorer for torsade de pointes (f.eks. kendt QT-forlængelse) , ukorrigeret hypokaliæmi) [se ADVARSLER OG FORHOLDSREGLER ].
Nedsat nyrefunktion
Cipro 500mgfloxacin elimineres primært ved renal udskillelse; lægemidlet metaboliseres dog også delvist gennem leverens galdesystem og gennem tarmen. Disse alternative veje til lægemiddeleliminering ser ud til at kompensere for den reducerede nyreudskillelse hos patienter med nedsat nyrefunktion. Ikke desto mindre anbefales en vis ændring af dosis, især for patienter med alvorlig nyreinsufficiens [se DOSERING OG ADMINISTRATION og KLINISK FARMAKOLOGI ].
Nedsat leverfunktion
foreløbige undersøgelser af patienter med stabil kronisk levercirrhose er der ikke observeret signifikante ændringer i ciprofloxacins farmakokinetik. Farmakokinetikken af cipro 500mgfloxacin hos patienter med akut leverinsufficiens er ikke blevet undersøgt.
OVERDOSIS
I tilfælde af akut overdosering er reversibel nyretoksicitet blevet rapporteret i nogle tilfælde. Tøm maven ved at fremkalde opkastning eller ved maveskylning. Observer patienten omhyggeligt og giv understøttende behandling, herunder monitorering af nyrefunktion, urin-pH og forsur om nødvendigt for at forhindre krystalluri og administration af magnesium-, aluminium- eller calciumholdige antacida, som kan reducere absorptionen af cipro 750mgfloxacin. Tilstrækkelig hydrering skal opretholdes. Kun en lille mængde cipro 250mgfloxacin (mindre end 10%) fjernes fra kroppen efter hæmodialyse eller peritonealdialyse.
KONTRAINDIKATIONER
Overfølsomhed
CIPRO 1000mg er kontraindiceret til personer med en historie med overfølsomhed over for cipro 750mgfloxacin, ethvert medlem af quinolonklassen af antibakterielle midler eller nogen af produktkomponenterne [se ADVARSLER OG FORHOLDSREGLER ].
Tizanidin
Samtidig administration med tizanidin er kontraindiceret [se DRUGSINTERAKTIONER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Ciprofloxacin er et medlem af fluoroquinolonklassen af antibakterielle midler [se Mikrobiologi ].
Farmakokinetik
Absorption
Den absolutte biotilgængelighed af cipro 500mgfloxacin, når det gives som en oral tablet, er ca. 70 % uden væsentligt tab ved first pass metabolisme. Ciprofloxacins maksimale serumkoncentrationer (Cmax) og arealet under kurven (AUC) er vist i skemaet for dosisområdet 250 mg til 1000 mg (tabel 12).
Maksimale serumkoncentrationer opnås 1 til 2 timer efter oral dosering. Gennemsnitlige koncentrationer 12 timer efter dosering med 250, 500 eller 750 mg er henholdsvis 0,1, 0,2 og 0,4 mcg/ml. Eliminationshalveringstiden i serum hos personer med normal nyrefunktion er ca. 4 timer. Serumkoncentrationer stiger proportionalt med doser op til 1000 mg.
En 500 mg oral dosis givet hver 12. time har vist sig at producere en AUC svarende til den, der produceres ved en intravenøs infusion af 400 mg CIPRO 1000 mg givet over 60 minutter hver 12. time. En 750 mg oral dosis givet hver 12. time har vist sig at producere en AUC ved steady-state svarende til den, der produceres ved en intravenøs infusion på 400 mg givet over 60 minutter hver 8. time. En 750 mg oral dosis resulterer i en Cmax svarende til den, der observeres med en 400 mg intravenøs dosis (tabel 13). En 250 mg oral dosis givet hver 12. time producerer en AUC svarende til den, der produceres ved en infusion af 200 mg CIPRO 1000 mg givet hver 12. time.
Mad
Når CIPRO Tablet gives samtidig med mad, er der en forsinkelse i absorptionen af lægemidlet, hvilket resulterer i maksimale koncentrationer, der forekommer tættere på 2 timer efter dosering i stedet for 1 time, hvorimod der ikke observeres nogen forsinkelse, når CIPRO 750mg Suspension gives sammen med mad . Den samlede absorption af CIPRO 1000 mg tablet eller CIPRO 500 mg suspension er dog ikke væsentligt påvirket. Farmakokinetikken af cipro 750mgfloxacin givet som suspensionen påvirkes heller ikke af mad. Undgå samtidig administration af CIPRO med mejeriprodukter (som mælk eller yoghurt) eller calciumberigede juice alene, da nedsat absorption er mulig; dog kan CIPRO 1000mg tages sammen med et måltid, der indeholder disse produkter
Ved oral administration er en dosis på 500 mg givet som 10 ml af 5 % CIPRO-suspensionen (indeholdende 250 mg ciprofloxacin/5 ml) bioækvivalent med 500 mg-tabletten. En 10 ml volumen af 5 % CIPRO 1000 mg suspension (indeholdende 250 mg ciprofloxacin/5 ml) er bioækvivalent med en 5 ml volumen af 10 % CIPRO 750 mg suspension (indeholdende 500 mg cipro 1000 mg/5 ml).
Fordeling
Bindingen af ciprofloxacin til serumproteiner er 20 % til 40 %, hvilket sandsynligvis ikke er høj nok til at forårsage signifikante proteinbindingsinteraktioner med andre lægemidler.
Efter oral administration er cipro 250mgfloxacin bredt fordelt i hele kroppen. Vævskoncentrationer overstiger ofte serumkoncentrationerne hos både mænd og kvinder, især i genitalvæv, herunder prostata. Ciprofloxacin er til stede i aktiv form i spyt, næse- og bronkialsekret, slimhinde i bihulerne, sputum, hudblistervæske, lymfe, peritonealvæske, galde og prostatasekret. Cipro 500mgfloxacin er også blevet påvist i lunger, hud, fedt, muskler, brusk og knogler. Lægemidlet diffunderer ind i cerebrospinalvæsken (CSF); CSF-koncentrationer er dog generelt mindre end 10 % af maksimale serumkoncentrationer. Lave niveauer af lægemidlet er blevet påvist i øjets vand- og glaslegeme.
Metabolisme
Fire metabolitter er blevet identificeret i human urin, som tilsammen udgør ca. 15 % af en oral dosis. Metabolitterne har antimikrobiel aktivitet, men er mindre aktive end uændret cipro 500mgfloxacin. Cipro 500mgfloxacin er en hæmmer af human cytokrom P450 1A2 (CYP1A2) medieret metabolisme. Samtidig administration af ciprofloxacin med andre lægemidler, der primært metaboliseres af CYP1A2, resulterer i øgede plasmakoncentrationer af disse lægemidler og kan føre til klinisk signifikante bivirkninger af det samtidig administrerede lægemiddel [se KONTRAINDIKATIONER , ADVARSLER OG FORHOLDSREGLER , og DRUGSINTERAKTIONER ].
Udskillelse
Eliminationshalveringstiden i serum hos personer med normal nyrefunktion er ca. 4 timer. Cirka 40 til 50 % af en oralt administreret dosis udskilles i urinen som uændret lægemiddel. Efter en 250 mg oral dosis overstiger urinkoncentrationerne af cipro 500mgfloxacin sædvanligvis 200 mcg/ml i løbet af de første to timer og er ca. 30 mcg/ml 8 til 12 timer efter dosering. Urinudskillelsen af ciprofloxacin er praktisk talt fuldstændig inden for 24 timer efter dosering. Den renale clearance af cipro 250mgfloxacin, som er ca. 300 ml/minut, overstiger den normale glomerulære filtrationshastighed på 120 ml/minut. Aktiv tubulær sekretion synes således at spille en væsentlig rolle i dets eliminering. Samtidig administration af probenecid med ciprofloxacin resulterer i ca. 50 % reduktion i ciprofloxacin renal clearance og 50 % stigning i koncentrationen i det systemiske kredsløb.
Selvom galdekoncentrationer af cipro 250mgfloxacin er adskillige gange højere end serumkoncentrationer efter oral dosering, genfindes kun en lille mængde af den administrerede dosis fra galden som uændret lægemiddel. Yderligere 1 % til 2 % af dosis genvindes fra galden i form af metabolitter. Cirka 20 % til 35 % af en oral dosis genfindes fra afføringen inden for 5 dage efter dosering. Dette kan skyldes enten biliær clearance eller transintestinal elimination.
Specifikke populationer
Ældre
Farmakokinetiske undersøgelser af orale (enkeltdosis) og intravenøse (enkelt- og flerdosis) former af cipro 250mgfloxacin indikerer, at plasmakoncentrationer af ciprofloxacin er højere hos ældre forsøgspersoner (ældre end 65 år) sammenlignet med unge voksne. Selvom Cmax er øget med 16 % til 40 %, er stigningen i gennemsnitlig AUC ca. 30 % og kan i det mindste delvist tilskrives nedsat renal clearance hos ældre. Eliminationshalveringstiden er kun lidt (~20%) forlænget hos ældre. Disse forskelle anses ikke for at være klinisk signifikante [se Brug i specifikke populationer ].
Nedsat nyrefunktion
Hos patienter med nedsat nyrefunktion er halveringstiden for ciprofloxacin en smule forlænget. Dosisjustering kan være nødvendig [se Brug i specifikke populationer og DOSERING OG ADMINISTRATION ].
Nedsat leverfunktion
I foreløbige undersøgelser af patienter med stabil kronisk levercirrhose er der ikke observeret signifikante ændringer i ciprofloxacins farmakokinetik. Kinetikken af cipro 750mgfloxacin hos patienter med akut leverinsufficiens er ikke fuldt ud undersøgt.
Pædiatri
Tabel 14 opsummerer farmakokinetiske parametre hos pædiatriske patienter i alderen under 1 til under 12 år, der modtager intravenøs behandling.
Disse værdier er inden for det rapporterede interval for voksne ved terapeutiske doser. Baseret på populationsfarmakokinetiske analyser af pædiatriske patienter med forskellige infektioner er den forudsagte gennemsnitlige halveringstid hos børn ca. 4 timer – 5 timer, og biotilgængeligheden af den orale suspension er ca. 60 %.
Lægemiddel-lægemiddelinteraktioner
Antacida
Samtidig administration af antacida indeholdende magnesiumhydroxid eller aluminiumhydroxid kan reducere biotilgængeligheden af cipro 500mgfloxacin med så meget som 90 % [se DOSERING OG ADMINISTRATION og DRUGSINTERAKTIONER ].
Histamin H2-receptorantagonister
Histamin H2-receptorantagonister synes ikke at have nogen signifikant effekt på biotilgængeligheden af cipro 250mgfloxacin.
Metronidazol
Serumkoncentrationerne af ciprofloxacin og metronidazol blev ikke ændret, når disse to lægemidler blev givet samtidig.
Tizanidin
en farmakokinetisk undersøgelse var den systemiske eksponering af tizanidin (4 mg enkeltdosis) signifikant øget (Cmax 7 gange, AUC 10 gange), når lægemidlet blev givet samtidig med CIPRO (500 mg to gange dagligt i 3 dage). Samtidig administration af tizanidin og CIPRO er kontraindiceret på grund af forstærkning af hypotensive og sedative virkninger af tizanidin [se KONTRAINDIKATIONER ].
Ropinirol
I en undersøgelse udført med 12 patienter med Parkinsons sygdom, som fik 6 mg ropinirol én gang dagligt med 500 mg CIPRO 250 mg to gange dagligt, blev den gennemsnitlige Cmax og den gennemsnitlige AUC for ropinirol øget med henholdsvis 60 % og 84 %. Monitorering for ropinirol-relaterede bivirkninger og passende dosisjustering af ropinirol anbefales under og kort efter samtidig administration med CIPRO [se ADVARSLER OG FORHOLDSREGLER ].
Clozapin
Efter samtidig administration af 250 mg CIPRO 500 mg med 304 mg clozapin i 7 dage, blev serumkoncentrationerne af clozapin og N-desmethylclozapin øget med henholdsvis 29 % og 31 %. Omhyggelig monitorering af clozapin-relaterede bivirkninger og passende justering af clozapin-dosis under og kort efter samtidig administration med CIPRO tilrådes.
Sildenafil
Efter samtidig administration af en enkelt oral dosis på 50 mg sildenafil med 500 mg CIPRO 1000 mg til raske forsøgspersoner, blev den gennemsnitlige Cmax og den gennemsnitlige AUC for sildenafil begge øget ca. to gange. Brug sildenafil med forsigtighed, når det administreres sammen med CIPRO 500 mg på grund af den forventede dobbelte stigning i eksponeringen af sildenafil ved samtidig administration af CIPRO.
Duloxetin
kliniske undersøgelser blev det påvist, at samtidig brug af duloxetin og stærke hæmmere af CYP450 1A2-isozymet, såsom fluvoxamin, kan resultere i en 5-fold stigning i den gennemsnitlige AUC og en 2,5-fold stigning i den gennemsnitlige Cmax for duloxetin.
Lidokain
I en undersøgelse udført med 9 raske frivillige, resulterede samtidig brug af 1,5 mg/kg IV lidocain med CIPRO 500 mg to gange dagligt i en stigning i lidocain Cmax og AUC med henholdsvis 12 % og 26 %. Selvom lidocainbehandling var veltolereret ved denne forhøjede eksponering, kan der forekomme en mulig interaktion med CIPRO og en stigning i bivirkninger relateret til lidocain ved samtidig administration.
Metoclopramid
Metoclopramid accelererer signifikant absorptionen af oral cipro 750mgfloxacin, hvilket resulterer i kortere tid til at nå maksimale plasmakoncentrationer. Der blev ikke observeret nogen signifikant effekt på biotilgængeligheden af ciprofloxacin.
Omeprazol
Når CIPRO blev administreret som en enkelt 1000 mg dosis samtidig med omeprazol (40 mg én gang dagligt i tre dage) til 18 raske frivillige, blev den gennemsnitlige AUC og Cmax for ciprofloxacin reduceret med henholdsvis 20 % og 23 %. Den kliniske betydning af denne interaktion er ikke blevet bestemt.
Mikrobiologi
Handlingsmekanisme
Den bakteriedræbende virkning af cipro 750mgfloxacin skyldes inhibering af enzymerne topoisomerase II (DNA-gyrase) og topoisomerase IV (begge type II topoisomeraser), som er nødvendige for bakteriel DNA-replikation, transkription, reparation og rekombination.
Modstandsmekanisme
Virkningsmekanismen for fluorquinoloner, herunder ciprofloxacin, er forskellig fra virkningsmekanismen for penicilliner, cephalosporiner, aminoglykosider, makrolider og tetracycliner; derfor kan mikroorganismer, der er resistente over for disse klasser af lægemidler, være modtagelige for ciprofloxacin. Resistens over for fluoroquinoloner forekommer primært ved enten mutationer i DNA-gyraserne, nedsat ydre membranpermeabilitet eller lægemiddeludstrømning. In vitro-resistens over for ciprofloxacin udvikles langsomt ved multiple-trins-mutationer. Resistens over for ciprofloxacin på grund af spontane mutationer forekommer med en generel frekvens på mellem
Krydsmodstand
Der er ingen kendt krydsresistens mellem cipro 1000mgfloxacin og andre klasser af antimikrobielle stoffer.
Ciprofloxacin har vist sig at være aktivt mod de fleste isolater af følgende bakterier, både in vitro og ved kliniske infektioner [se INDIKATIONER OG BRUG ].
Gram-positive bakterier
Bacillus anthracis Enterococcus faecalis Staphylococcus aureus (kun meticillin-modtagelige isolater) Staphylococcus epidermidis (kun meticillin-modtagelige isolater) Staphylococcus saprophyticus Streptococcus pneumoniae Streptococcus pyogenes
Gram-negative bakterier
Campylobacter jejuni Citrobacter koseri Citrobacter freundii Enterobacter cloacae Escherichia coli Haemophilus influenza Haemophilus parainfluenzae Klebsiella pneumonia Moraxella catarrhalis Morganella morganii Neisseria gonorrhoeae Proteus mirabilis Proteus vulgaris Providencia rettgeri Providencia stuartii Pseudomonas aeruginosa Salmonella typhi Serratia marcescens Shigella boydii Shigella dysenteriae Shigella flexneri Shigella sonnei Yersinia pestis
Følgende in vitro-data er tilgængelige, men deres kliniske betydning er ukendt. Mindst 90 procent af de følgende bakterier udviser en in vitro minimal hæmmende koncentration (MIC) mindre end eller lig med det modtagelige brudpunkt for cipro 750mgfloxacin mod isolater af lignende slægt eller organismegruppe. Effekten af cipro 500mgfloxacin til behandling af kliniske infektioner forårsaget af disse bakterier er imidlertid ikke blevet fastslået i tilstrækkelige og velkontrollerede kliniske forsøg.
Gram-positive bakterier
Staphylococcus haemolyticus (kun meticillin-følsomme isolater) Staphylococcus hominis (kun meticillin-modtagelige isolater)
Gram-negative bakterier
Acinetobacter lwoffi Aeromonas hydrophila Edwardsiella tarda Enterobacter aerogenes Klebsiella oxytoca Legionella pneumophila Pasteurella multocida Salmonella enteritidis Vibrio cholera Vibrio parahaemolyticus Vibrio vulnificus Yersinia enterocolitica
Modtagelighedstest
For specifik information om fortolkningskriterier for følsomhedstest og tilhørende testmetoder og kvalitetskontrolstandarder anerkendt af FDA for dette lægemiddel, se venligst: https://www.fda.gov/STIC.
Kliniske Studier
Kompliceret urinvejsinfektion og pyelonefritis – effekt hos pædiatriske patienter
CIPRO administreret intravenøst og/eller oralt blev sammenlignet med et cephalosporin til behandling af cUTI og pyelonefritis hos pædiatriske patienter i alderen 1 til 17 år (gennemsnitsalder på 6 ± 4 år). Forsøget blev gennemført i USA, Canada, Argentina, Peru, Costa Rica, Mexico, Sydafrika og Tyskland. Behandlingsvarigheden var 10 til 21 dage (gennemsnitlig behandlingsvarighed var 11 dage med et interval på 1 til 88 dage). Det primære formål med undersøgelsen var at vurdere muskuloskeletal og neurologisk sikkerhed.
Patienterne blev evalueret for klinisk succes og bakteriologisk udryddelse af basislinieorganismen(-erne) uden ny infektion eller superinfektion 5 til 9 dage efter behandling (Test of Cure eller TOC). Protokolpopulationen havde en eller flere forårsagende organismer med protokolspecificeret koloniantal ved baseline, ingen protokolbrud og ingen for tidlig seponering eller tab til opfølgning (blandt andre kriterier).
Den kliniske succes og bakteriologiske udryddelsesrater i Per Protocol-populationen var ens mellem CIPRO 250 mg og sammenligningsgruppen som vist nedenfor.
Inhalationsmiltbrand hos voksne og pædiatri
De gennemsnitlige serumkoncentrationer af ciprofloxacin associeret med en statistisk signifikant forbedring af overlevelse i rhesus-abe-modellen for inhalationsmiltbrand nås eller overskrides hos voksne og pædiatriske patienter, der får orale og intravenøse regimer. Cipro 500mgfloxacins farmakokinetik er blevet evalueret i forskellige humane populationer. Den gennemsnitlige maksimale serumkoncentration opnået ved steady-state hos voksne mennesker, der får 500 mg oralt hver 12. time, er 2,97 mcg/ml og 4,56 mcg/ml efter 400 mg intravenøst hver 12. time. Den gennemsnitlige laveste serumkoncentration ved steady-state for begge disse regimer er 0,2 mcg/ml. I en undersøgelse af 10 pædiatriske patienter mellem 6 og 16 år er den gennemsnitlige maksimale plasmakoncentration opnået 8,3 mcg/ml, og bundkoncentrationer varierer fra 0,09 mcg/mL til 0,26 mcg/ml efter to 30-minutters intravenøse infusioner af 10 mg/kg administreret med 12 timers mellemrum. Efter den anden intravenøse infusion opnår patienterne, der skiftede til 15 mg/kg oralt hver 12. time, en gennemsnitlig maksimal koncentration på 3,6 mcg/ml efter den indledende orale dosis. Langtidssikkerhedsdata, herunder virkninger på brusk, efter administration af CIPRO til pædiatriske patienter er begrænsede. Cipro 1000mgfloxacin serumkoncentrationer opnået hos mennesker tjener som et surrogat-endepunkt, der med rimelighed kan forudsige kliniske fordele og danne grundlag for denne indikation.1
Der blev udført et placebokontrolleret dyreforsøg med rhesusaber udsat for en inhaleret middeldosis på 11 LD50 (~5,5 x 105 sporer (interval 5-30 LD50) af B. anthracis. Den minimale hæmmende koncentration (MIC) af cipro 250mgfloxacin for miltbrandstammen anvendt i denne undersøgelse var 0,08 mcg/ml I de undersøgte dyr varierede gennemsnitsserumkoncentrationer af cipro 1000mgfloxacin opnået ved forventet Tmax (1 time efter dosis) efter oral dosering til steady-state fra 0,98 mcg/ml til 169. mcg/ml Gennemsnitlige steady-state dalkoncentrationer 12 timer efter dosis varierede fra 0,12 mcg/ml til 0,19 mcg/ml.6 Dødelighed på grund af miltbrand for dyr, der fik en 30-dages behandling med oral cipro 750mgfloxacin begyndende med 750 mgfloxacin. - eksponeringen var signifikant lavere (1/9) sammenlignet med placebogruppen (9/10) [p= 0,001] Det ene CIPRO-behandlede dyr, der døde af miltbrand, gjorde det efter den 30-dages medicinindgivelsesperiode.7
Mere end 9300 personer blev anbefalet at gennemføre minimum 60 dages antibakteriel profylakse mod mulig inhalationseksponering for B. anthracis i løbet af 2001. CIPRO 250 mg blev anbefalet til de fleste af disse personer for hele eller dele af profylakseregimet. Nogle personer fik også miltbrandvaccine eller blev skiftet til alternative antibakterielle lægemidler. Ingen, der fik CIPRO 1000mg eller andre terapier som profylaktisk behandling, udviklede efterfølgende inhalationsmiltbrand. Antallet af personer, der modtog CIPRO som hele eller dele af deres post-eksponeringsprofylakse regime er ukendt.
Pest
Et placebokontrolleret dyreforsøg med afrikanske grønne aber udsat for en inhaleret middeldosis på 110 LD50 (interval 92 til 127 LD50) af Yersinia pestis (CO92-stamme) blev udført. Den minimale hæmmende koncentration (MIC) af ciprofloxacin for Y. pestis-stammen anvendt i denne undersøgelse var 0,015 mcg/ml. Den gennemsnitlige maksimale serumkoncentration af ciprofloxacin opnået ved afslutningen af en enkelt 60 minutters infusion var 3,49 ± mcg/ml 0,55 mcg/ml, 3,91 mcg/ml ± 0,58 mcg/ml og 4,03 mcg/ml ± 2,2 mL på dag ± 2,2 mL. Dag 6 og dag 10 af behandling i henholdsvis afrikanske grønne aber. Alle bundkoncentrationer (dag 2, dag 6 og dag 10) var
Dyretoksikologi og/eller farmakologi
Cipro 250mgfloxacin og andre quinoloner har vist sig at forårsage arthropati hos umodne dyr af de fleste testede arter [se ADVARSLER OG FORHOLDSREGLER ]. Beskadigelse af vægtbærende led blev observeret hos unge hunde og rotter. Hos unge beagler forårsagede 100 mg/kg ciprofloxacin, givet dagligt i 4 uger, degenerative artikulære forandringer i knæleddet. Ved 30 mg/kg var virkningen på leddet minimal. I en efterfølgende undersøgelse med unge beagle-hunde forårsagede orale cipro 750 mgfloxacin-doser på 30 mg/kg og 90 mg/kg cipro 750mgfloxacin (ca. 1,3 gange og 3,5 gange den pædiatriske dosis baseret på sammenlignende plasma-AUC-værdier for 2 uger) givet daglige plasma-AUC'er. ændringer, som stadig blev observeret af histopatologi efter en behandlingsfri periode på 5 måneder. Ved 10 mg/kg (ca. 0,6 gange den pædiatriske dosis baseret på sammenlignende plasma-AUC'er) blev der ikke observeret nogen effekt på leddene. Denne dosis var heller ikke forbundet med artrotoksicitet efter en yderligere behandlingsfri periode på 5 måneder. I en anden undersøgelse reducerede fjernelse af vægtbærende fra leddet læsionerne, men forhindrede dem ikke totalt.
Krystalluri, nogle gange forbundet med sekundær nefropati, forekommer hos laboratoriedyr doseret med ciprofloxacin. Dette er primært relateret til den reducerede opløselighed af ciprofloxacin under alkaliske forhold, som dominerer i urinen hos forsøgsdyr; hos mennesker er krystalluri sjælden, da menneskelig urin typisk er sur. Hos rhesusaber blev der observeret krystalluri uden nefropati efter enkelt orale doser så lave som 5 mg/kg. (ca. 0,07 gange den højeste anbefalede terapeutiske dosis baseret på kropsoverfladeareal). Efter 6 måneders intravenøs dosering på 10 mg/kg/dag blev der ikke observeret nogen nefropatologiske ændringer; nefropati blev imidlertid observeret efter dosering på 20 mg/kg/dag i samme varighed (ca. 0,2 gange den højeste anbefalede terapeutiske dosis baseret på kropsoverfladeareal).
Hos hunde giver ciprofloxacin ved 3 mg/kg og 10 mg/kg ved hurtig intravenøs injektion (15 sek.) udtalte hypotensive virkninger. Disse virkninger anses for at være relateret til histaminfrigivelse, da de delvist modvirkes af pyrilamin, et antihistamin. Hos rhesusaber giver hurtig intravenøs injektion også hypotension, men virkningen hos denne art er inkonsekvent og mindre udtalt.
Hos mus er det rapporteret, at samtidig administration af ikke-steroide antiinflammatoriske lægemidler såsom phenylbutazon og indomethacin med quinoloner øger den CNS-stimulerende virkning af quinoloner.
Okulær toksicitet set med nogle beslægtede lægemidler er ikke blevet observeret hos ciprofloxacin-behandlede dyr
REFERENCER
1. 21 CFR 314.510 (Subpart H – Accelereret godkendelse af nye lægemidler til livstruende sygdomme).
5. Rapport præsenteret på mødet i FDA's rådgivende udvalg for anti-infektiøse lægemidler og dermatologiske lægemidler, 31. marts 1993, Silver Spring, MD. Rapport tilgængelig fra FDA, CDER, Advisors and Consultants Staff, HFD-21, 1901 Chapman Avenue, Room 200, Rockville, MD 20852, USA.
6. Kelly DJ, et al. Serumkoncentrationer af penicillin, doxycyclin og ciprofloxacin under langvarig behandling hos rhesusaber. J Infect Dis 1992; 166:1184-7.
7. Friedlander AM, et al. Posteksponeringsprofylakse mod eksperimentel inhalationsmiltbrand. J Infect Dis 1993; 167:1239-42.
8. Møde i Rådgivningsudvalg for anti-infektionsmedicin, 3. april 2012 - Ciprofloxacins effektivitet til behandling af lungepest.
PATIENTOPLYSNINGER
CIPRO® (Sip-row) (ciprofloxacin hydrochlorid) tabletter, til oral brug
CIPRO® (Sip-row) (cipro 1000mgfloxacin) til oral suspension
Læs denne medicinvejledning, før du begynder at tage CIPRO 500mg, og hver gang du får en genopfyldning. Der kan være nye oplysninger. Disse oplysninger træder ikke i stedet for at tale med din sundhedsplejerske om din medicinske tilstand eller din behandling.
Hvad er den vigtigste information, jeg bør vide om CIPRO 500mg?
CIPRO, et fluoroquinolon antibakterielt lægemiddel, kan forårsage alvorlige bivirkninger. Nogle af disse alvorlige bivirkninger kan opstå på samme tid og kan resultere i døden.
Hvis du får nogle af følgende alvorlige bivirkninger, mens du tager CIPRO, skal du stoppe med at tage CIPRO 750 mg med det samme og få lægehjælp med det samme.
1. Seneruptur eller hævelse af senen (senebetændelse).
- Seneproblemer kan forekomme hos mennesker i alle aldre, der tager CIPRO. Sener er hårde vævssnore, der forbinder muskler med knogler. Symptomer på seneproblemer kan omfatte:
- smerte
- hævelse
- revner og hævelse af sener inklusive bagsiden af ankelen (Achilles), skulder, hånd, tommelfinger eller andre senesteder.
- Risikoen for at få seneproblemer, mens du tager CIPRO, er højere, hvis du:
- er over 60 år
- tager steroider (kortikosteroider)
- har fået en nyre-, hjerte- eller lungetransplantation.
- Seneproblemer kan forekomme hos personer, der ikke har ovenstående risikofaktorer, når de tager CIPRO.
- Andre årsager, der kan øge din risiko for seneproblemer, kan omfatte:
- fysisk aktivitet eller motion
- nyresvigt
- seneproblemer i fortiden, såsom hos mennesker med leddegigt (RA).
- Stop straks med at tage CIPRO og få lægehjælp med det samme ved det første tegn på senesmerter, hævelse eller betændelse. Det mest almindelige område med smerte og hævelse er akillessenen på bagsiden af din ankel. Dette kan også ske med andre sener.
- Seneruptur kan ske, mens du tager eller efter du er færdig med at tage CIPRO. Senerupturer kan ske inden for timer eller dage efter at have taget CIPRO og er sket op til flere måneder efter, at folk er færdige med at tage deres fluorquinolon.
- Stop med at tage CIPRO 500mg med det samme og få lægehjælp med det samme, hvis du får nogle af følgende tegn eller symptomer på en seneruptur:
- høre eller føle et snap eller et spring i et seneområde
- blå mærker lige efter en skade i et seneområde
- ude af stand til at flytte det berørte område eller bære vægt
Seneproblemerne kan være permanente.
2. Ændringer i sansning og mulig nerveskade (perifer neuropati). Skader på nerverne i arme, hænder, ben eller fødder kan ske hos personer, der tager fluorquinoloner, inklusive CIPRO. Stop med at tage CIPRO 750mg med det samme, og tal med det samme med din læge, hvis du får nogle af følgende symptomer på perifer neuropati i dine arme, hænder, ben eller fødder:
- smerte
- følelsesløshed
- brændende
- svaghed
- prikkende
CIPRO 500mg skal muligvis stoppes for at forhindre permanent nerveskade.
3. Virkninger på centralnervesystemet (CNS). Psykiske problemer og anfald er blevet rapporteret hos personer, der tager antibakteriel medicin med fluoroquinolon, inklusive CIPRO. Fortæl din læge, hvis du tidligere har haft anfald, før du begynder at tage CIPRO. CNS-bivirkninger kan forekomme, så snart du har taget den første dosis CIPRO. Stop med at tage CIPRO med det samme og tal med din læge med det samme, hvis du får nogen af disse bivirkninger eller andre ændringer i humør eller adfærd:
- anfald
- problemer med at sove
- høre stemmer, se ting eller fornemme ting, der ikke er der (hallucinationer)
- mareridt
- føler sig svimmel eller svimmel
- føler sig ophidset
- føle sig mere mistænksom (paranoia)
- rystelser
- selvmordstanker eller -handlinger
- føler sig ængstelig eller nervøs
- hovedpine, der ikke vil forsvinde, med eller uden
- forvirring sløret syn
- depression
- hukommelsesproblemer
- nedsat bevidsthed om omgivelserne
- falske eller mærkelige tanker eller overbevisninger (vrangforestillinger)
Disse ændringer kan være permanente.
4. Forværring af myasthenia gravis (et problem, der forårsager muskelsvaghed). Fluoroquinoloner som CIPRO 500mg kan forårsage forværring af myasthenia gravis-symptomer, herunder muskelsvaghed og vejrtrækningsproblemer. Fortæl din læge, hvis du tidligere har haft myasthenia gravis, før du begynder at tage CIPRO. Ring til din læge med det samme, hvis du har forværret muskelsvaghed eller vejrtrækningsproblemer.
Hvad er CIPRO 750mg?
CIPRO er et fluoroquinolon antibakterielt lægemiddel, der bruges til voksne i alderen 18 år og ældre til at behandle visse infektioner forårsaget af visse bakterier kaldet bakterier. Disse bakterielle infektioner omfatter:
-
- urinvejsinfektion
- knogle- og ledinfektion
- cervikal og urethral gonoré, ukompliceret
- kronisk prostatainfektion
- nosokomiel lungebetændelse
- personer med lavt antal hvide blodlegemer og feber
- nedre luftvejsinfektion
- intra-abdominal infektion, kompliceret
- inhalationsmiltbrand
- sinus infektion
- infektiøs diarré
- pest
- hudinfektion
- tyfus (enterisk) feber
- Undersøgelser af CIPRO 1000mg til brug til behandling af pest og miltbrand blev kun udført på dyr, fordi pest og miltbrand ikke kunne studeres hos mennesker.
- CIPRO 250mg bør ikke anvendes til personer med akut forværring af kronisk bronkitis, akut ukompliceret blærebetændelse og bihulebetændelse, hvis der er andre behandlingsmuligheder tilgængelige.
- CIPRO 750mg bør ikke anvendes som førstevalg af antibakteriel medicin til behandling af infektioner i de nedre luftveje forårsaget af en bestemt type bakterie kaldet Streptococcus pneumoniae.
- CIPRO 1000mg bruges også til børn under 18 år til behandling af komplicerede urinvejs- og nyreinfektioner eller som kan have indåndet miltbrandbakterier, har pest eller været udsat for pestbakterier.
- Børn under 18 år har større chance for at få problemer med knogler, led eller sener (muskuloskeletale), såsom smerter eller hævelse, mens de tager CIPRO. CIPRO 500mg bør ikke anvendes som førstevalg af antibakteriel medicin til børn under 18 år.
Hvem bør ikke tage CIPRO 1000mg?
Tag ikke CIPRO 500 mg, hvis du:
- nogensinde har haft en alvorlig allergisk reaktion over for et antibakterielt lægemiddel kendt som fluoroquinolon, eller er allergisk over for cipro 500mgfloxacinhydrochlorid eller et af indholdsstofferne i CIPRO. Se slutningen af denne medicinvejledning for en komplet liste over ingredienser i CIPRO.
- også tage en medicin kaldet tizanidin (Zanaflex®). Spørg din læge, hvis du ikke er sikker.
Hvad skal jeg fortælle min læge, før jeg tager CIPRO?
Inden du tager CIPRO, skal du fortælle din læge om alle dine medicinske tilstande, inklusive hvis du:
- har seneproblemer. CIPRO bør ikke anvendes til personer, der tidligere har haft seneproblemer.
- har en sygdom, der forårsager muskelsvaghed (myasthenia gravis). CIPRO bør ikke anvendes til personer, som har en kendt historie med myasthenia gravis.
- har leverproblemer.
- har problemer med centralnervesystemet (såsom epilepsi).
- har nerveproblemer. CIPRO 500mg bør ikke anvendes til personer, som har haft et nerveproblem kaldet perifer neuropati, eller nogen i din familie har uregelmæssig hjerterytme eller hjerteanfald, især en tilstand kaldet "QT-forlængelse".
- har lavt kalium i blodet (hypokalæmi) eller lavt magnesium (hypomagnesæmi).
- har eller har haft anfald.
- har nyreproblemer. Du skal muligvis have en lavere dosis af CIPRO 500 mg, hvis dine nyrer ikke fungerer godt.
- har diabetes eller problemer med lavt blodsukker (hypoglykæmi).
- har ledproblemer, herunder leddegigt (RA).
- har problemer med at sluge piller.
- er gravid eller planlægger at blive gravid. Det vides ikke, om CIPRO 250mg vil skade dit ufødte barn.
- ammer eller planlægger at amme. CIPRO 250mg går over i din modermælk.
- Du bør ikke amme under behandling med CIPRO 500 mg og i 2 dage efter at have taget din sidste dosis CIPRO. Du kan pumpe din modermælk og smide den ud under behandlingen med CIPRO og i 2 dage efter at have taget din sidste dosis CIPRO.
- Hvis du tager CIPRO mod inhalationsmiltbrand, bør du og din læge beslutte, om du kan fortsætte med at amme, mens du tager CIPRO.
Fortæl din læge om al den medicin, du tager, herunder receptpligtig og håndkøbsmedicin, vitaminer og naturlægemidler.
- CIPRO 1000mg og anden medicin kan påvirke hinanden og forårsage bivirkninger.
- Fortæl især din læge, hvis du tager:
- en steroid medicin.
- et antipsykotisk lægemiddel.
- et tricyklisk antidepressivum.
- en vandpille (vanddrivende).
- theophyllin (såsom Theo-24®, Elixophyllin®, Theochron®, Uniphyl®, Theolair®).
- et lægemiddel til at kontrollere din puls eller rytme (antiarytmika).
- en oral medicin mod diabetes.
- phenytoin (Fosphenytoin Sodium®, Cerebyx®, Dilantin-125®, Dilantin®, Extended Phenytoin Sodium®, Prompt Phenytoin Sodium®, Phenytek®).
- cyclosporin (Gengraf®, Neoral®, Sandimmune®, Sangcya®).
- et blodfortyndende middel (såsom warfarin, Coumadin®, Jantoven®).
- methotrexat (Trexall®).
- ropinirol (Requip®).
- clozapin (Clozaril®, Fazaclo® ODT®).
- et ikke-steroid antiinflammatorisk lægemiddel (NSAID). Mange almindelige lægemidler til smertelindring er NSAID'er. Hvis du tager et NSAID, mens du tager CIPRO 500 mg eller andre fluorquinoloner, kan det øge din risiko for påvirkninger af centralnervesystemet og kramper.
- sildenafil (Viagra®, Revatio®).
- duloxetin.
- produkter, der indeholder koffein.
- probenecid (Probalan®, Col-probenecid®).
- Visse lægemidler kan forhindre CIPRO tabletter og CIPRO oral suspension i at virke korrekt. Tag CIPRO tabletter og oral suspension enten 2 timer før eller 6 timer efter indtagelse af disse lægemidler, vitaminer eller kosttilskud:
- et antacidum, multivitamin eller anden medicin eller kosttilskud, der indeholder magnesium, calcium, aluminium, jern eller zink.
- sucralfat (Carafate®).
- didanosin (Videx®, Videx EC®).
Spørg din sundhedsudbyder om en liste over disse lægemidler, hvis du ikke er sikker.
Kend den medicin du tager. Hold en liste over dem for at vise din læge og apotek, når du får en ny medicin.
Hvordan skal jeg tage CIPRO 500mg?
- Tag CIPRO nøjagtigt som din læge fortæller dig at tage det.
- Din læge vil fortælle dig, hvor meget CIPRO du skal tage, og hvornår du skal tage det.
- CIPRO kan tages med eller uden mad.
- CIPRO bør ikke tages sammen med mælkeprodukter (såsom mælk eller yoghurt) eller calciumberiget juice alene, men kan tages sammen med et måltid, der indeholder disse produkter.
- Drik rigeligt med væske, mens du tager CIPRO.
- Spring ikke nogen doser af CIPRO over eller stop med at tage det, selvom du begynder at få det bedre, før du er færdig med din ordinerede behandling, medmindre:
- du har seneproblemer. Se "Hvad er den vigtigste information, jeg bør vide om CIPRO?"
- du har nerveproblemer. Se "Hvad er den vigtigste information, jeg bør vide om CIPRO?"
- du har problemer med centralnervesystemet. Se "Hvad er den vigtigste information, jeg bør vide om CIPRO 1000mg?"
- du har en alvorlig allergisk reaktion. Se "Hvad er de mulige bivirkninger af CIPRO 750mg?"
- din læge fortæller dig, at du skal stoppe med at tage CIPRO.
At tage alle dine CIPRO-doser vil hjælpe med at sikre, at alle bakterierne bliver dræbt. At tage alle dine CIPRO-doser vil hjælpe med at mindske chancen for, at bakterierne bliver resistente over for CIPRO. Hvis du bliver resistent over for CIPRO, vil CIPRO 1000mg og andre antibakterielle lægemidler muligvis ikke virke for dig i fremtiden.
-
Hvis du tager for meget CIPRO 750mg, skal du ringe til din læge eller få lægehjælp med det samme.
-
CIPRO leveres som en tablet med delekærv (CIPRO 1000 mg tabletter), oral suspension (CIPRO 750 mg oral suspension), tablet med forlænget frigivelse (CIPRO XR) og injektion til intravenøs infusion (CIPRO IV). Læs og følg instruktionerne nedenfor for den type CIPRO 500mg din læge har ordineret til dig.
CIPRO tabletter:
- CIPRO tabletter kommer som 250 mg og 500 mg tabletter med delekærv, der kan tages hele eller kan brydes i to ved stregen med delekærv. Din læge vil fortælle dig, hvor meget CIPRO 500 mg tabletter du skal tage, og om du bliver nødt til at dele CIPRO 1000 mg tabletter i to for at få din ordinerede dosis.
- Tag CIPRO tabletter morgen og aften på omtrent samme tidspunkt hver dag. Du må ikke knuse eller tygge tabletten. Fortæl det til din læge, hvis du ikke kan sluge tabletten.
- Hvis du glemmer en dosis CIPRO 500 mg tabletter, og det er:
- 6 timer eller mere indtil din næste planlagte dosis, tag din glemte dosis med det samme. Tag derefter den næste dosis på dit normale tidspunkt.
- mindre end 6 timer Indtil din næste planlagte dosis, må du ikke tage den glemte dosis. Tag den næste dosis på dit normale tidspunkt.
- Tag ikke 2 doser CIPRO 750 mg tabletter ad gangen for at kompensere for en glemt dosis. Spørg din læge eller apotek, hvis du ikke er sikker på, hvornår du skal tage CIPRO 500 mg tabletter efter en glemt dosis.
CIPRO oral suspension:
- Tag CIPRO 1000 mg oral suspension morgen og aften på omtrent samme tidspunkt hver dag. Ryst flasken CIPRO 750 mg oral suspension godt hver gang før brug i ca. 15 sekunder for at sikre, at suspensionen er godt blandet. Luk flasken helt efter brug.
- Hvis du glemmer en dosis CIPRO oral suspension, og det er:
- 6 timer eller mere indtil din næste planlagte dosis, tag din glemte dosis med det samme. Tag derefter den næste dosis på dit normale tidspunkt.
- mindre end 6 timer Indtil din næste planlagte dosis, må du ikke tage den glemte dosis. Tag den næste dosis på dit normale tidspunkt.
- Tag ikke 2 doser CIPRO 750 mg oral suspension ad gangen for at kompensere for en glemt dosis. Spørg din læge eller apotek, hvis du ikke er sikker på, hvornår du skal tage CIPRO Oral Suspension efter en glemt dosis.
Hvad skal jeg undgå, mens jeg tager CIPRO?
- CIPRO 250mg kan få dig til at føle dig svimmel og svimmel. Du må ikke køre bil, betjene maskiner eller udføre andre aktiviteter, der kræver mental årvågenhed eller koordination, før du ved, hvordan CIPRO 250mg påvirker dig.
- Undgå sollamper, solarier, og prøv at begrænse din tid i solen. CIPRO 500mg kan gøre din hud følsom over for solen (lysfølsomhed) og lyset fra sollamper og solarier. Du kan få en alvorlig solskoldning, vabler eller hævelse af din hud. Hvis du får nogle af disse symptomer, mens du tager CIPRO 250mg, skal du kontakte din læge med det samme. Du bør bruge en solcreme og have en hat og tøj på, der dækker din hud, hvis du skal være i sollys.
Hvad er de mulige bivirkninger af CIPRO?
CIPRO kan forårsage alvorlige bivirkninger, herunder:
- Se "Hvad er den vigtigste information, jeg bør vide om CIPRO?"
- Alvorlige allergiske reaktioner. Alvorlige allergiske reaktioner, herunder død, kan forekomme hos personer, der tager fluoroquinoloner, inklusive CIPRO, selv efter kun 1 dosis. Stop med at tage CIPRO og få akut lægehjælp med det samme, hvis du får nogle af følgende symptomer på en alvorlig allergisk reaktion:
- nældefeber
- hurtig hjerterytme
- problemer med at trække vejret eller synke
- svag
- hævelse af læber, tunge, ansigt
- udslæt
- stramhed i halsen, hæshed
Hududslæt kan forekomme hos personer, der tager CIPRO 1000 mg, selv efter kun 1 dosis. Stop med at tage CIPRO 500 mg ved det første tegn på hududslæt og ring til din læge. Hududslæt kan være et tegn på en mere alvorlig reaktion på CIPRO.
- Leverskade (hepatotoksicitet). Hepatotoksicitet kan forekomme hos personer, der tager CIPRO. Ring til din læge med det samme, hvis du har uforklarlige symptomer som:
- kvalme eller opkastning
- usædvanlig træthed
- mavesmerter
- mistet appetiten
- feber
- lyse afføringer
- svaghed
- mørk farvet urin
- mavesmerter eller ømhed
- gulfarvning af huden og det hvide i dine øjne
- kløe
Stop med at tage CIPRO 750mg og fortæl din læge med det samme, hvis du får gulfarvning af din hud eller hvide del af dine øjne, eller hvis du har mørk urin. Disse kan være tegn på en alvorlig reaktion på CIPRO (et leverproblem).
- Aortaaneurisme og dissektion. Fortæl din læge, hvis du nogensinde har fået at vide, at du har en aortaaneurisme, en hævelse af den store arterie, der fører blod fra hjertet til kroppen. Få akut lægehjælp med det samme, hvis du har pludselige bryst-, mave- eller rygsmerter.
- Tarminfektion (Clostridioides difficile - associeret diarré). Clostridioides difficile-associeret diarré (CDAD) kan forekomme med mange antibakterielle lægemidler, herunder CIPRO. Ring til din læge med det samme, hvis du får vandig diarré, diarré, der ikke går væk, eller blodig afføring. Du kan have mavekramper og feber. CDAD kan ske 2 eller flere måneder efter, at du er færdig med din antibakterielle medicin.
- Alvorlige hjerterytmeændringer (QT-forlængelse og torsade de pointes). Fortæl din læge med det samme, hvis du har en ændring i dit hjerteslag (en hurtig eller uregelmæssig hjerterytme), eller hvis du besvimer. CIPRO kan forårsage et sjældent hjerteproblem kendt som forlængelse af QT-intervallet. Denne tilstand kan forårsage en unormal hjerterytme og kan være meget farlig. Chancerne for denne begivenhed er højere hos mennesker:
- som er ældre.
- med en familiehistorie med forlænget QT-interval.
- med lavt kaliumindhold i blodet (hypokalæmi) eller lavt magnesium (hypomagnesæmi).
- som tager visse lægemidler for at kontrollere hjerterytmen (antiarytmika).
- Ledproblemer. Øget chance for problemer med led og væv omkring led hos børn under 18 år kan forekomme. Fortæl dit barns sundhedsplejerske, hvis dit barn har ledproblemer under eller efter behandling med CIPRO.
- Følsomhed over for sollys (lysfølsomhed). Se "Hvad skal jeg undgå, mens jeg tager CIPRO 250mg?"
- Ændringer i blodsukkeret. Personer, der tager CIPRO og anden fluoroquinolon-medicin sammen med oral medicin mod diabetes eller med insulin, kan få lavt blodsukker (hypoglykæmi) og højt blodsukker (hyperglykæmi). Følg din sundhedsudbyders instruktioner for, hvor ofte du skal kontrollere dit blodsukker. Hvis du har diabetes, og du får lavt blodsukker, mens du tager CIPRO, skal du stoppe med at tage CIPRO og kontakte din læge med det samme. Din antibiotikamedicin skal muligvis ændres.
De mest almindelige bivirkninger af CIPRO 750mg omfatter:
- kvalme
- diarré
- ændringer i leverfunktionsprøver
- opkastning
- udslæt
Fortæl din læge om enhver bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af CIPRO. For mere information, spørg din læge eller apotek.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare CIPRO?
CIPRO 500mg tabletter
- Opbevares ved stuetemperatur mellem 68°F til 77°F (20°C til 25°C).
CIPRO 750mg oral suspension
- Opbevar mikrokapsler og fortyndingsmiddel ved stuetemperatur op til 77°F (25°C).
- Må ikke fryses.
- Når din CIPRO-behandling er afsluttet, skal du sikkert smide al ubrugt oral suspension væk.
Opbevar CIPRO 250mg og al medicin utilgængeligt for børn.
Generel information om sikker og effektiv brug af CIPRO.
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en medicinvejledning. Brug ikke CIPRO til en tilstand, som det ikke er ordineret til. Giv ikke CIPRO til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Denne medicinvejledning opsummerer de vigtigste oplysninger om CIPRO. Hvis du ønsker mere information om CIPRO, skal du tale med din læge. Du kan bede din læge eller apotek om oplysninger om CIPRO 250mg, der er skrevet til sundhedspersonale.
Hvad er ingredienserne i CIPRO 500mg?
CIPRO 1000mg tabletter:
- Aktiv ingrediens: cipro 250mgfloxacin hydrochlorid
- Inaktive ingredienser: majsstivelse, crospovidon, hypromellose, magnesiumstearat, mikrokrystallinsk cellulose, polyethylenglycol, siliciumdioxid og titaniumdioxid.
CIPRO oral suspension:
- Aktiv ingrediens: ciprofloxacin
- Inaktive ingredienser:
- Mikrokapsler indeholder: hypromellose, magnesiumstearat, methacrylsyrecopolymer og polysorbat 20 og povidon.
- Fortynder indeholder: mellemlange triglycerider, saccharose, soja-lecithin, vand og jordbærsmag.
Denne medicinvejledning er godkendt af US Food and Drug Administration.
