Keflex 250mg, 500mg Cephalexin Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Keflex 250mg, og hvordan bruges det?
Keflex er en receptpligtig medicin, der bruges til at behandle symptomerne på forskellige bakterielle infektioner ved at stoppe væksten af bakterier. Keflex 500mg kan bruges alene eller sammen med anden medicin.
Keflex er kendt som et cephalosporin-antibiotikum.
Hvad er bivirkninger af Keflex?
Keflex kan forårsage alvorlige bivirkninger, herunder:
- stærke mavesmerter,
- diarré, der er vandig eller blodig,
- usædvanlig træthed,
- følelse af svimmelhed eller åndenød,
- let blå mærker,
- usædvanlig blødning,
- lilla eller røde pletter under din hud,
- anfald,
- bleg hud,
- kolde hænder og fødder,
- gulnet hud, mørkfarvet urin,
- feber,
- svaghed,
- smerter i siden eller lænden,
- smertefuld vandladning,
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Keflex 500mg omfatter:
- diarré,
- kvalme,
- opkastning,
- dårlig fordøjelse,
- mavesmerter,
- vaginal kløe eller udflåd,
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Keflex. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
KEFLEX® (cephalexin) Capsules, USP er et semisyntetisk cephalosporin antibakterielt lægemiddel beregnet til oral administration. Det er 7-(D-α-Amino-α-phenylacetamido)-3-methyl-3-cephem-4-carboxylsyremonohydrat. Cephalexin har molekylformlen C16H17N3O4S•H2O og molekylvægten er 365,41.
Cephalexin har følgende strukturformel:
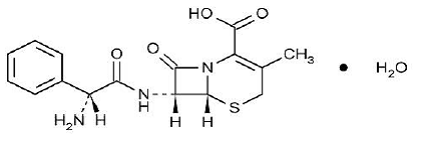
Hver kapsel indeholder cephalexinmonohydrat svarende til 250 mg, 500 mg eller 750 mg cephalexin. Kapslerne indeholder også carboxymethylcellulosenatrium, D&C Yellow No. 10, dimethicon, FD&C Blue No. 1, FD&C Yellow No. 6, gelatine, magnesiumstearat, mikrokrystallinsk cellulose og titaniumdioxid.
INDIKATIONER
Luftvejsinfektioner
KEFLEX er indiceret til behandling af luftvejsinfektioner forårsaget af modtagelige isolater af Streptococcus pneumoniae og Streptococcus pyogenes.
Mellemørebetændelse
KEFLEX er indiceret til behandling af mellemørebetændelse forårsaget af modtagelige isolater af Streptococcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus, Streptococcus pyogenes og Moraxella catarrhalis.
Hud- og hudstrukturinfektioner
KEFLEX 250mg er indiceret til behandling af hud- og hudstrukturinfektioner forårsaget af modtagelige isolater af følgende gram-positive bakterier: Staphylococcus aureus og Streptococcus pyogenes.
Knogleinfektioner
KEFLEX 250mg er indiceret til behandling af knogleinfektioner forårsaget af modtagelige isolater af Staphylococcus aureus og Proteus mirabilis.
Infektioner i kønsorganerne
KEFLEX er indiceret til behandling af genitourinære infektioner, herunder akut prostatitis, forårsaget af modtagelige isolater af Escherichia coli, Proteus mirabilis og Klebsiella pneumoniae.
Brug
For at reducere udviklingen af lægemiddelresistente bakterier og bevare effektiviteten af KEFLEX 250mg og andre antibakterielle lægemidler, bør KEFLEX 500mg kun bruges til at behandle infektioner, der er bevist eller stærkt mistænkt for at være forårsaget af modtagelige bakterier. Når kultur- og modtagelighedsoplysninger er tilgængelige, bør disse oplysninger tages i betragtning ved valg eller ændring af antibakteriel behandling. I mangel af sådanne data kan lokal epidemiologi og modtagelighedsmønstre bidrage til den empiriske udvælgelse af terapi.
DOSERING OG ADMINISTRATION
Voksne og pædiatriske patienter på mindst 15 år
Den sædvanlige dosis af oral KEFLEX 250 mg er 250 mg hver 6. time, men en dosis på 500 mg hver 12. time kan indgives. Behandlingen administreres i 7 til 14 dage.
Ved mere alvorlige infektioner kan det være nødvendigt med større doser af oral KEFLEX, op til 4 gram dagligt fordelt på to til fire ligeligt fordelte doser.
Pædiatriske patienter (over 1 år)
Den anbefalede samlede daglige dosis af oral KEFLEX 500 mg til pædiatriske patienter er 25 til 50 mg/kg givet i ligeligt opdelte doser i 7 til 14 dage. Ved behandling af β-hæmolytiske streptokokinfektioner anbefales en varighed på mindst 10 dage. Ved alvorlige infektioner kan en samlet daglig dosis på 50 til 100 mg/kg administreres i ligeligt opdelte doser.
Til behandling af mellemørebetændelse er den anbefalede daglige dosis 75 til 100 mg/kg givet i ligeligt opdelte doser.
Dosisjusteringer hos voksne og pædiatriske patienter på mindst 15 år med nedsat nyrefunktion
Administrer følgende doseringsregimer for KEFLEX til patienter med nedsat nyrefunktion [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
HVORDAN LEVERET
Doseringsformer og styrker
250 mg kapsler: et hvidt til lysegult pulver fyldt i en uigennemsigtig hvid og uigennemsigtig mørkegrøn kapsel, der er præget med KEFLEX 250 mg i spiselig sort blæk på den hvide krop.
500 mg kapsler: et hvidt til lysegult pulver fyldt i en uigennemsigtig lysegrøn og uigennemsigtig mørkegrøn kapsel, der er præget med KEFLEX 500 mg i spiselig sort blæk på den lysegrønne krop.
750 mg kapsler: et hvidt til lysegult pulver fyldt i en aflang uigennemsigtig mørkegrøn og uigennemsigtig mørkegrøn kapsel, der er præget KEFLEX 750 mg i spiseligt hvidt blæk på den mørkegrønne krop.
Opbevaring og håndtering
KEFLEX (cephalexin) kapsler , USP, leveres som følger:
250 mg kapsler, flasker med 100 – NDC 59630-112-10 500 mg kapsler, flasker med 100 – NDC 59630-113-10 750 mg kapsler, flasker med 50 – NDC 59630-115-05
KEFLEX skal opbevares ved 25°C (77°F); udflugter tilladt til 15° til 30°C (59° til 86°F) [se USP kontrolleret rumtemperatur ].
Dispenser i en tæt, lysbestandig beholder.
Fremstillet for: Shionogi Inc. Florham Park, NJ 07932. Fremstillet af: Sandoz GmbH Kundl, Østrig. Revideret: oktober 2015.
BIVIRKNINGER
Følgende alvorlige hændelser er beskrevet mere detaljeret i afsnittet Advarsler og forholdsregler:
- Overfølsomhedsreaktioner [se ADVARSLER OG FORHOLDSREGLER ]
- Clostridium difficile-associeret diarré [se ADVARSLER OG FORHOLDSREGLER ]
- Direkte Coombs' Test Serokonvertering [se ADVARSLER OG FORHOLDSREGLER ]
- Potentiale for anfald [se ADVARSLER OG FORHOLDSREGLER ]
- Virkning på protrombinaktivitet [se ADVARSLER OG FORHOLDSREGLER ]
- Udvikling af lægemiddelresistente bakterier [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med frekvenser i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke frekvenserne observeret i praksis
I kliniske forsøg var den hyppigste bivirkning diarré. Kvalme og opkastning, dyspepsi, gastritis og mavesmerter er også forekommet. Som med penicilliner og andre cephalosporiner er forbigående hepatitis og kolestatisk gulsot blevet rapporteret.
Andre reaktioner har inkluderet overfølsomhedsreaktioner, genital og anal pruritus, genital candidiasis, vaginitis og vaginalt udflåd, svimmelhed, træthed, hovedpine, agitation, forvirring, hallucinationer, artralgi, arthritis og ledlidelser. Reversibel interstitiel nefritis er blevet rapporteret. Eosinofili, neutropeni, trombocytopeni, hæmolytisk anæmi og lette stigninger i aspartattransaminase (AST) og alanintransaminase (ALT) er blevet rapporteret.
Ud over de ovennævnte bivirkninger, som er blevet observeret hos patienter behandlet med KEFLEX 500 mg, er følgende bivirkninger og andre ændrede laboratorietests blevet rapporteret for antibakterielle lægemidler i cephalosporinklassen:
Andre bivirkninger
Feber, colitis, aplastisk anæmi, blødning, nyreinsufficiens og toksisk nefropati.
Ændrede laboratorieprøver
Forlænget protrombintid, øget blodurinstofnitrogen (BUN), øget kreatinin, forhøjet alkalisk fosfatase, forhøjet bilirubin, forhøjet lactatdehydrogenase (LDH), pancytopeni, leukopeni og agranulocytose.
DRUGSINTERAKTIONER
Metformin
Administration af KEFLEX 250 mg med metformin resulterer i øgede plasmakoncentrationer af metformin og nedsat renal clearance af metformin.
Omhyggelig patientovervågning og dosisjustering af metformin anbefales til patienter, der samtidig tager KEFLEX og metformin [se KLINISK FARMAKOLOGI ].
Probenecid
Den renale udskillelse af KEFLEX hæmmes af probenecid. Samtidig administration af probenecid og KEFLEX 500 mg anbefales ikke.
Interaktion med laboratorie- eller diagnostisk testning
En falsk-positiv reaktion kan forekomme, når man tester for tilstedeværelsen af glukose i urinen med Benedicts opløsning eller Fehlings opløsning.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Overfølsomhedsreaktioner
Allergiske reaktioner i form af udslæt, nældefeber, angioødem, anafylaksi, erythema multiforme, Stevens-Johnsons syndrom eller toksisk epidermal nekrolyse er blevet rapporteret ved brug af KEFLEX. Inden behandling med KEFLEX 500 mg påbegyndes, forhør dig om, hvorvidt patienten har haft overfølsomhedsreaktioner over for cephalexin, cephalosporiner, penicilliner eller andre lægemidler. Krydsoverfølsomhed blandt beta-lactam antibakterielle lægemidler kan forekomme hos op til 10 % af patienter med en historie med penicillinallergi.
Hvis der opstår en allergisk reaktion på KEFLEX 500mg, skal du seponere lægemidlet og indlede passende behandling.
Clostridium Difficile-associeret diarré
Clostridium difficile-associeret diarré (CDAD) er blevet rapporteret ved brug af næsten alle antibakterielle midler, inklusive KEFLEX 500 mg, og kan variere i sværhedsgrad fra mild diarré til fatal colitis. Behandling med antibakterielle midler ændrer den normale flora i tyktarmen, hvilket fører til overvækst af C. difficile.
C. difficile producerer toksinerne A og B, som bidrager til udviklingen af CDAD. Hypertoksin-producerende stammer af C. difficile forårsager øget morbiditet og dødelighed, da disse infektioner kan være modstandsdygtige over for antimikrobiel behandling og kan kræve kolektomi. CDAD skal overvejes hos alle patienter, der får diarré efter brug af antibiotika. Omhyggelig sygehistorie er nødvendig, da CDAD er blevet rapporteret at forekomme over to måneder efter administration af antibakterielle midler.
Hvis CDAD er mistænkt eller bekræftet, kan det være nødvendigt at afbryde igangværende antibiotikabrug, der ikke er rettet mod C. difficile. Passende væske- og elektrolytbehandling, proteintilskud, antibiotikabehandling af C. difficile og kirurgisk evaluering bør iværksættes som klinisk indiceret.
Direkte Coombs' Test Seroconversion
Positive direkte Coombs' test er blevet rapporteret under behandling med cephalosporin antibakterielle lægemidler, herunder cephalexin. Akut intravaskulær hæmolyse induceret af cephalexinbehandling er blevet rapporteret. Hvis der udvikles anæmi under eller efter cephalexinbehandling, skal du udføre en diagnostisk undersøgelse for lægemiddelinduceret hæmolytisk anæmi, seponere cephalexin og igangsætte passende behandling.
Potentiale for anfald
Adskillige cephalosporiner har været impliceret i at udløse anfald, især hos patienter med nedsat nyrefunktion, når dosis ikke blev reduceret. Hvis der opstår anfald, skal du afbryde behandlingen med KEFLEX. Antikonvulsiv behandling kan gives, hvis det er klinisk indiceret.
Forlænget protrombintid
Cephalosporiner kan være forbundet med forlænget protrombintid. De i risikogruppen omfatter patienter med nedsat nyre- eller leverfunktion eller dårlig ernæringstilstand, såvel som patienter, der får et langvarigt forløb med antibakteriel terapi, og patienter, der får antikoagulantbehandling. Overvåg protrombintiden hos patienter i risikozonen og administrer som angivet.
Udvikling af lægemiddelresistente bakterier
Det er usandsynligt, at ordination af KEFLEX i fravær af en påvist eller stærkt mistænkt bakteriel infektion vil give patienten fordele og øger risikoen for udvikling af lægemiddelresistente bakterier.
Langvarig brug af KEFLEX kan resultere i overvækst af ikke-modtagelige organismer. Omhyggelig observation af patienten er afgørende. Hvis der opstår superinfektion under behandlingen, skal der træffes passende foranstaltninger.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Livstidsundersøgelser på dyr er ikke blevet udført for at evaluere det karcinogene potentiale af cephalexin. Der er ikke udført tests for at bestemme det mutagene potentiale af cephalexin. Hos han- og hunrotter blev fertilitet og reproduktionsevne ikke påvirket af orale cephalexindoser op til 1,5 gange den højeste anbefalede humane dosis baseret på kropsoverfladeareal.
Brug i specifikke populationer
Graviditet
Graviditetskategori B
Der er ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder. Da reproduktionsstudier på dyr ikke altid forudsiger human respons, bør dette lægemiddel kun anvendes under graviditet, hvis det er klart nødvendigt.
Reproduktionsundersøgelser er blevet udført på mus og rotter under anvendelse af orale doser af cephalexinmonohydrat 0,6 og 1,5 gange den maksimale daglige humane dosis (66 mg/kg/dag) baseret på kropsoverfladebasis og har ikke afsløret tegn på nedsat fertilitet eller skade på fosteret.
Ammende mødre
Cephalexin udskilles i modermælk. Der skal udvises forsigtighed, når KEFLEX administreres til en ammende kvinde.
Pædiatrisk brug
Sikkerheden og effektiviteten af KEFLEX 500 mg til pædiatriske patienter blev fastslået i kliniske forsøg for de doseringer, der er beskrevet i afsnittet om dosering og administration [se DOSERING OG ADMINISTRATION ].
Geriatrisk brug
Af de 701 forsøgspersoner i 3 offentliggjorte kliniske undersøgelser af cephalexin var 433 (62%) 65 og derover. Der blev ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet mellem disse forsøgspersoner og yngre forsøgspersoner, og anden rapporteret klinisk erfaring har ikke identificeret forskelle i respons mellem ældre og yngre patienter.
Dette lægemiddel udskilles væsentligt af nyrerne, og risikoen for toksiske reaktioner på dette lægemiddel kan være større hos patienter med nedsat nyrefunktion. Da ældre patienter er mere tilbøjelige til at have nedsat nyrefunktion, bør der udvises forsigtighed ved dosisvalg [se ADVARSLER OG FORHOLDSREGLER ].
Nedsat nyrefunktion
KEFLEX bør administreres med forsigtighed i tilfælde af nedsat nyrefunktion (kreatininclearance DOSERING OG ADMINISTRATION ].
REFERENCER
1. Clinical and Laboratory Standards Institute (CLSI). Metoder til fortynding Antimikrobielle følsomhedstests for bakterier, der vokser aerobt; Godkendt standard - tiende udgave. CLSI-dokument M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
2. Clinical and Laboratory Standards Institute (CLSI). Ydeevnestandarder for antimikrobielle følsomhedstests; Femogtyvende informationstillæg. CLSI-dokument M100-S25, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
3. Clinical and Laboratory Standards Institute (CLSI). Ydeevnestandarder for antimikrobielle diskfølsomhedstests; Godkendt standard - tolvte udgave. CLSI-dokument M02-A12, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
OVERDOSIS
Symptomer på oral overdosis kan omfatte kvalme, opkastning, epigastrisk nød, diarré og hæmaturi. I tilfælde af en overdosis skal du iværksætte generelle støtteforanstaltninger.
Tvungen diurese, peritonealdialyse, hæmodialyse eller kulhæmoperfusion er ikke blevet påvist som gavnlige for en overdosis af cephalexin.
KONTRAINDIKATIONER
KEFLEX er kontraindiceret til patienter med kendt overfølsomhed over for cephalexin eller andre medlemmer af cephalosporinklassen af antibakterielle lægemidler.
KLINISK FARMAKOLOGI
Handlingsmekanisme
Cephalexin er et cephalosporin antibakterielt lægemiddel [se Mikrobiologi ].
Farmakokinetik
Absorption
Cephalexin er syrestabilt og kan gives uden hensyntagen til måltider. Efter doser på 250 mg, 500 mg og 1 g blev der opnået gennemsnitlige maksimale serumniveauer på henholdsvis ca. 9, 18 og 32 mcg/ml efter 1 time. Serumniveauer kunne påvises 6 timer efter administration (ved et påvisningsniveau på 0,2 mcg/ml).
Fordeling
Cephalexin er ca. 10 % til 15 % bundet til plasmaproteiner.
Udskillelse
Cephalexin udskilles i urinen ved glomerulær filtration og tubulær sekretion. Undersøgelser viste, at over 90% af lægemidlet blev udskilt uændret i urinen inden for 8 timer. I denne periode var maksimale urinkoncentrationer efter 250 mg, 500 mg og 1 g doser henholdsvis ca. 1000, 2200 og 5000 mcg/ml.
Lægemiddelinteraktioner
Hos raske forsøgspersoner, der fik enkelte 500 mg doser af cephalexin og metformin, steg den gennemsnitlige Cmax og AUC for plasmametformin med henholdsvis 34 % og 24 % i gennemsnit, og den gennemsnitlige nyreclearance for metformin faldt med 14 %. Der er ingen tilgængelig information om interaktionen mellem cephalexin og metformin efter flere doser af begge lægemidler.
Mikrobiologi
Virkningsmekanisme
Cephalexin er et bakteriedræbende middel, der virker ved at hæmme bakteriel cellevægsyntese.
Modstand
Methicillin-resistente stafylokokker og de fleste isolater af enterokokker er resistente over for cephalexin. Cephalexin er ikke aktivt mod de fleste isolater af Enterobacter spp., Morganella morganii og Proteus vulgaris. Cephalexin har ingen aktivitet mod Pseudomonas spp. eller Acinetobacter calcoaceticus. Penicillin-resistente Streptococcus pneumoniae er sædvanligvis krydsresistente over for beta-lactam antibakterielle lægemidler.
Antimikrobiel aktivitet
Cephalexin har vist sig at være aktivt mod de fleste isolater af følgende bakterier både in vitro og ved kliniske infektioner [se INDIKATIONER OG BRUG ].
Gram-positive bakterier
Staphylococcus aureus (kun meticillin-modtagelige isolater) Streptococcus pneumoniae (penicillin-modtagelige isolater) Streptococcus pyogenes
Gram-negative bakterier
Escherichia coli Haemophilus influenzae Klebsiella pneumoniae Moraxella catarrhalis Proteus mirabilis
Modtagelighedstestmetoder
Når det er tilgængeligt, skal det kliniske mikrobiologiske laboratorium fremlægge resultaterne af in vitro-følsomhedstestresultater for antimikrobielle lægemidler, der anvendes på hjemmehørende hospitaler, til lægen som periodiske rapporter, der beskriver modtagelighedsprofilen for nosokomiale og samfundserhvervede patogener. Disse rapporter skal hjælpe lægen med at vælge et antibakterielt lægemiddel til behandling.
Kun i tilfælde af ukompliceret urinvejsinfektion kan E. coli, K. pneumoniae og P. mirabilis modtagelighed for cephalexin udledes ved at teste cefazolin2.
Fortyndingsteknikker
Kvantitative metoder bruges til at bestemme antimikrobielle minimale hæmmende koncentrationer (MIC'er). Disse MIC'er giver estimater af bakteriers modtagelighed over for antimikrobielle forbindelser. MIC'erne skal bestemmes ved hjælp af en standardiseret testmetode (bouillon eller agar)1,2.
Diffusionsteknikker
Kvantitative metoder, der kræver måling af zonediametre, giver også reproducerbare estimater af bakteriers modtagelighed over for antimikrobielle forbindelser. Zonestørrelsen giver et skøn over bakteriers modtagelighed over for antimikrobielle forbindelser. Zonestørrelsen skal bestemmes ved hjælp af en standardiseret testmetode2,3.
En rapport om modtagelig (S) indikerer, at det antimikrobielle lægemiddel sandsynligvis vil hæmme væksten af patogenet, hvis det antimikrobielle lægemiddel når den koncentration, der normalt kan opnås på infektionsstedet. En rapport af mellemprodukt (I) indikerer, at resultatet skal betragtes som tvetydigt, og hvis mikroorganismen ikke er fuldt modtagelig for alternative klinisk mulige lægemidler, skal testen gentages. Denne kategori indebærer mulig klinisk anvendelighed på kropssteder, hvor lægemidlet er fysiologisk koncentreret, eller i situationer, hvor en høj dosis af lægemidlet kan anvendes. Denne kategori giver også en bufferzone, der forhindrer små ukontrollerede tekniske faktorer i at forårsage store uoverensstemmelser i fortolkningen. En rapport om resistent (R) indikerer, at det antimikrobielle lægemiddel sandsynligvis ikke vil hæmme væksten af patogenet, hvis det antimikrobielle lægemiddel når de koncentrationer, der normalt kan opnås på infektionsstedet; anden terapi bør vælges.
Kvalitetskontrol
Standardiserede følsomhedstestprocedurer kræver brug af laboratoriekontroller til at overvåge og sikre nøjagtigheden og præcisionen af forsyninger og reagenser, der anvendes i analysen, og teknikkerne for den person, der udfører testen1,2,3.
PATIENTOPLYSNINGER
- Informer patienter om, at allergiske reaktioner, herunder alvorlige allergiske reaktioner, kan forekomme, og at alvorlige reaktioner kræver øjeblikkelig behandling. Spørg patienten om eventuelle tidligere overfølsomhedsreaktioner over for KEFLEX, andre beta-lactamer (inklusive cephalosporiner) eller andre allergener
- Rådgiv patienterne om, at diarré er et almindeligt problem forårsaget af antibakterielle lægemidler og normalt forsvinder, når lægemidlet seponeres. Nogle gange kan hyppig vandig eller blodig diarré forekomme og kan være tegn på en mere alvorlig tarminfektion. Hvis der udvikler sig alvorlig vandig eller blodig diarré, rådgiv patienterne at kontakte deres læge.
- Rådgiv patienterne om, at antibakterielle lægemidler, inklusive KEFLEX, kun bør bruges til at behandle bakterielle infektioner. De behandler ikke virusinfektioner (f.eks. forkølelse). Når KEFLEX 500 mg er ordineret til behandling af en bakteriel infektion, skal du fortælle patienterne, at selvom det er almindeligt at føle sig bedre tidligt i behandlingsforløbet, skal medicinen tages nøjagtigt som anvist. At springe doser over eller ikke fuldføre hele behandlingsforløbet kan (1) mindske effektiviteten af den øjeblikkelige behandling og (2) øge sandsynligheden for, at bakterier udvikler resistens og ikke vil kunne behandles med KEFLEX eller andre antibakterielle lægemidler i fremtiden.
