Augmentin 250/125mg, 500/125mg, 750/250mg, 875/125mg Clavulanate Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Augmentin 875mg, og hvordan bruges det?
Augmentin 250mg er en receptpligtig medicin, der bruges til at behandle symptomerne på mange forskellige infektioner forårsaget af bakterier, såsom infektioner i nedre luftveje, kronisk obstruktiv lungesygdom, bakteriel bihulebetændelse, bidsår fra dyr og mennesker og hudinfektioner. Augmentin 125mg kan bruges alene eller sammen med anden medicin.
- Augmentin er en Penicillin, Amino.
Hvad er de mulige bivirkninger af Augmentin?
Augmentin 750mg kan forårsage alvorlige bivirkninger, herunder:
- stærke mavesmerter,
- diarré, der er vandig eller blodig,
- bleg eller gulnet hud,
- mørkfarvet urin,
- feber,
- forvirring,
- svaghed,
- mistet appetiten,
- smerter i øvre mave,
- gulfarvning af hud eller øjne (gulsot),
- let blå mærker eller blødning,
- lidt eller ingen vandladning,
- ondt i halsen,
- hævelse i dit ansigt eller tunge,
- brændende i dine øjne,
- hudsmerter efterfulgt af et rødt eller lilla udslæt, der breder sig (i ansigtet eller på overkroppen) med vabler og afskalning
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Augmentin omfatter:
- kvalme,
- diarré,
- vaginal kløe eller udflåd,
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Augmentin. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
AUGMENTIN 500mg er en oral antibakteriel kombination bestående af amoxicillin og beta-lactamasehæmmeren, clavulanat-kalium (kaliumsaltet af clavulansyre).
Amoxicillin er en analog af ampicillin, afledt af den grundlæggende penicillinkerne, 6 aminopenicillansyre. Amoxicillin-molekylformlen er C16H19N3O5S•3H2O, og molekylvægten er 419,46. Kemisk er amoxicillin (2S,5R,6R)-6-[(R)-(-)-2-amino-2-(p-hydroxyphenyl)acetamido]-3,3-dimethyl-7-oxo-4-thia -1-azabicyclo[3.2.0]heptan-2-carboxylsyretrihydrat og kan være repræsenteret strukturelt som:
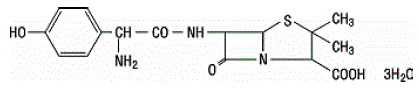
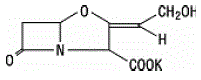
Clavulansyre produceres ved fermentering af Streptomyces clavuligerus. Det er en beta-lactam, der er strukturelt relateret til penicillinerne og har evnen til at inaktivere nogle beta-lactamaser ved at blokere de aktive steder i disse enzymer. Clavulanat-kalium-molekylformlen er C8H8KNO5, og molekylvægten er 237,25. Kemisk er clavulanat-kalium kalium (Z)(2R,5R)-3-(2-hydroxyethyliden)-7-oxo-4-oxa-1-azabicyclo[3.2.0]-heptan-2-carboxylat og kan være repræsenteret strukturelt som:
inaktive ingredienser
- Tabletter- Kolloid siliciumdioxid, hypromellose, magnesiumstearat, mikrokrystallinsk cellulose, polyethylenglycol, natriumstivelsesglykolat og titaniumdioxid. Hver tablet AUGMENTIN indeholder 0,63 mEq kalium.
- Pulver til oral suspension - kolloid siliciumdioxid, smagsstoffer, xanthangummi og en eller flere af følgende: hypromellose, mannitol, silicagel, siliciumdioxid, ravsyre, natriumsaccharin og aspartam. [se ADVARSLER OG FORHOLDSREGLER ]
- Tyggetabletter- Kolloid siliciumdioxid, smagsstoffer, magnesiumstearat, mannitol og en eller flere af følgende: D&C Yellow No. 10, FD&C Red No. 40, glycin, natriumsaccharin og aspartam. [se ADVARSLER OG FORHOLDSREGLER]
- Hver 125-mg tyggetablet og hver 5 mL rekonstitueret 125/5 mL oral suspension af AUGMENTIN 750mg indeholder 0,16 mEq kalium
- Hver 250 mg tyggetablet og hver 5 ml rekonstitueret 250/5 ml oral suspension af AUGMENTIN indeholder 0,32 mEq kalium
- Hver 200 mg tyggetablet og hver 5 ml rekonstitueret 200/5 ml oral suspension af AUGMENTIN indeholder 0,14 mEq kalium
- Hver 400 mg tyggetablet og hver 5 ml rekonstitueret 400/5 ml oral suspension af AUGMENTIN 500 mg indeholder 0,29 mEq kalium
INDIKATIONER
For at reducere udviklingen af lægemiddelresistente bakterier og bevare effektiviteten af AUGMENTIN (amoxicillin/clavulanatkalium) og andre antibakterielle lægemidler, bør AUGMENTIN 500mg kun bruges til at behandle infektioner, der er bevist eller stærkt mistænkt for at være forårsaget af modtagelige bakterier. Når kultur- og modtagelighedsoplysninger er tilgængelige, bør de overvejes ved udvælgelse eller ændring af antibakteriel behandling. I mangel af sådanne data kan lokal epidemiologi og modtagelighedsmønstre bidrage til den empiriske udvælgelse af terapi.
AUGMENTIN® er en kombination af penicillin-klassen antibakteriel og beta-lactamase-hæmmer indiceret til behandling af infektioner på grund af modtagelige isolater af de udpegede bakterier under de nedenfor anførte tilstande*:
Nedre luftvejsinfektioner
Forårsaget af beta-lactamase-producerende isolater af Haemophilus influenzae og Moraxella catarrhalis.
Akut bakteriel mellemørebetændelse
Forårsaget af beta-lactamase-producerende isolater af H. influenzae og M. catarrhalis.
Bihulebetændelse
Forårsaget af beta-lactamase-producerende isolater af H. influenzae og M. catarrhalis.
Hud- og hudstrukturinfektioner
Forårsaget af beta-lactamase-producerende isolater af Staphylococcus aureus, Escherichia coli og Klebsiella arter.
Urinvejsinfektioner
Forårsaget af beta-lactamase-producerende isolater af E. coli, Klebsiella-arter og Enterobacter-arter.
Brugsbegrænsninger
Når følsomhedstestresultater viser følsomhed over for amoxicillin, hvilket indikerer ingen beta-lactamase-produktion, bør AUGMENTIN ikke anvendes.
DOSERING OG ADMINISTRATION
AUGMENTIN 875mg kan tages uden hensyntagen til måltider; absorptionen af clavulanat-kalium øges dog, når AUGMENTIN 250 mg administreres i starten af et måltid. For at minimere risikoen for gastrointestinal intolerance bør AUGMENTIN 125 mg tages i starten af et måltid.
Voksne
Den sædvanlige voksendosis er en 500 mg tablet AUGMENTIN hver 12. time eller en 250 mg tablet AUGMENTIN 125 mg hver 8. time. Ved mere alvorlige infektioner og infektioner i luftvejene bør dosis være en 875 mg tablet AUGMENTIN 875 mg hver 12. time eller en 500 mg tablet AUGMENTIN hver 8. time. Voksne, der har svært ved at synke, kan få 125 mg/5 ml eller 250 mg/5 ml suspension i stedet for 500 mg tabletten. 200 mg/5 ml suspensionen eller 400 mg/5 ml suspensionen kan bruges i stedet for 875 mg tabletten.
To 250 mg tabletter AUGMENTIN bør ikke erstatte en 500 mg tablet AUGMENTIN. Da både 250 mg og 500 mg tabletterne af AUGMENTIN indeholder den samme mængde clavulansyre (125 mg, som kaliumsaltet), svarer to 250 mg tabletter ikke til én 500 mg tablet AUGMENTIN.
250 mg tabletten af AUGMENTIN og 250 mg tyggetabletten bør ikke erstatte hinanden, da de ikke er udskiftelige. 250 mg tabletten AUGMENTIN 250 mg og 250 mg tyggetabletten indeholder ikke den samme mængde clavulansyre (som kaliumsaltet). 250 mg tabletten af AUGMENTIN indeholder 125 mg clavulansyre, mens 250 mg tyggetabletten indeholder 62,5 mg clavulansyre.
Pædiatriske patienter
Baseret på amoxicillin-komponenten bør AUGMENTIN doseres som følger:
Nyfødte og spædbørn i alderen
Den anbefalede dosis af AUGMENTIN er 30 mg/kg/dag fordelt hver 12. time baseret på amoxicillin-komponenten. Erfaring med 200 mg/5 ml formulering i denne aldersgruppe er begrænset, og derfor anbefales brug af 125 mg/5 ml oral suspension.
Patienter i alderen 12 uger (3 måneder) og ældre
Se doseringsregimerne i tabel 1. Hver 12. time anbefales, da det er forbundet med signifikant mindre diarré [se Kliniske Studier ]. Dog indeholder suspensionen hver 12. time (200 mg/5 ml og 400 mg/5 ml) og tyggetabletter (200 mg og 400 mg) aspartam og bør ikke anvendes af phenylketonurika. [se ADVARSLER OG FORHOLDSREGLER ]
Patienter, der vejer 40 kg eller mere
Pædiatriske patienter, der vejer 40 kg eller mere, bør doseres i henhold til voksnes anbefalinger.
AUGMENTIN-tabletten på 250 mg bør ikke bruges, før barnet vejer mindst 40 kg, på grund af de forskellige forhold mellem amoxicillin og clavulansyre i 250 mg-tabletten AUGMENTIN (250/125) versus tyggetabletten på 250 mg. AUGMENTIN (250/62,5).
Patienter med nedsat nyrefunktion
Patienter med nedsat nyrefunktion behøver generelt ikke en dosisreduktion, medmindre svækkelsen er alvorlig. Patienter med nedsat nyrefunktion med en glomerulær filtrationshastighed på
Hæmodialysepatienter bør modtage 500 mg eller 250 mg hver 24. time, afhængigt af infektionens sværhedsgrad. De skal have en ekstra dosis både under og ved afslutningen af dialysen.
Vejledning til blanding af oral suspension
Forbered en suspension på tidspunktet for dispensering som følger: Tap på flasken, indtil alt pulveret flyder frit. Tilsæt ca. 2/3 af den samlede mængde vand til rekonstitution (se tabel 2 nedenfor) og ryst kraftigt for at suspendere pulveret. Tilsæt resten af vandet og ryst igen kraftigt.
Bemærk: Ryst oral suspension godt før brug. Rekonstitueret suspension skal opbevares i køleskab og kasseres efter 10 dage.
HVORDAN LEVERET
Doseringsformer og styrker
Tabletter
- 250 mg/125 mg tabletter: Hver hvid oval filmovertrukket tablet, præget med AUGMENTIN 750 mg på den ene side og 250/125 på den anden side, indeholder 250 mg amoxicillin og 125 mg clavulansyre som kaliumsalt.
- 500 mg/125 mg tabletter: Hver hvid oval filmovertrukket tablet, præget med AUGMENTIN 125 mg på den ene side og 500/125 på den anden side, indeholder 500 mg amoxicillin og 125 mg clavulansyre som kaliumsalt.
- 875 mg/125 mg tabletter: Hver hvid kapselformet tablet med delekærv, præget med AUGMENTIN 875 på den ene side og delekærv på den anden side, indeholder 875 mg amoxicillin og 125 mg clavulansyre som kaliumsalt.
Pulver til oral suspension
- 125 mg/31,25 mg pr. 5 ml: Pulver til oral suspension med banansmag (hver 5 ml rekonstitueret suspension indeholder 125 mg amoxicillin og 31,25 mg clavulansyre som kaliumsalt).
- 200 mg/28,5 mg pr. 5 ml: Orange-begunstiget pulver til oral suspension (hver 5 ml rekonstitueret suspension indeholder 200 mg amoxicillin og 28,5 mg clavulansyre som kaliumsalt).
- 250 mg/62,5 mg pr. 5 ml: Pulver til oral suspension med appelsinsmag (hver 5 ml rekonstitueret suspension indeholder 250 mg amoxicillin og 62,5 mg clavulansyre som kaliumsalt).
- 400 mg/57 mg pr. 5 ml Pulver til oral suspension med appelsinsmag (hver 5 ml rekonstitueret suspension indeholder 400 mg amoxicillin og 57,0 mg clavulansyre som kaliumsalt).
Tyggetabletter
- 125 mg/31,25 mg tyggetabletter: Hver plettet gul, rund tablet med citron-lime-smag, præget med BMP 189, indeholder 125 mg amoxicillin og 31,25 mg clavulansyre som kaliumsalt.
- 200 mg/28,5 mg tyggetabletter: Hver plettet lyserød, rund, bikonveks tablet med kirsebær-banan-smag, præget med AUGMENTIN 200, indeholder 200 mg amoxicillin og 28,5 mg clavulansyre som kaliumsalt.
- 250 mg/62,5 mg tyggetabletter: Hver plettet gul, rund tablet med citron-lime-smag, præget med BMP 190 indeholder 250 mg amoxicillin og 62,5 mg clavulansyre som kaliumsalt.
- 400 mg/57 mg tyggetabletter: Hver plettet lyserød, rund, bikonveks tablet med kirsebær-banan-smag, præget med AUGMENTIN 400, indeholder 400 mg amoxicillin og 57,0 mg clavulansyre som kaliumsalt.
250 mg tabletten AUGMENTIN 750 mg og 250 mg tyggetabletten bør IKKE erstattes af hinanden, da de ikke er udskiftelige, og 250 mg tabletten bør ikke anvendes til børn, der vejer mindre end 40 kg. 250 mg tabletten af AUGMENTIN og 250 mg tyggetabletten indeholder ikke den samme mængde clavulansyre. AUGMENTIN-tabletten på 250 mg indeholder 125 mg clavulansyre, mens tyggetabletten på 250 mg indeholder 62,5 mg clavulansyre.
To 250 mg tabletter AUGMENTIN 750 mg bør IKKE erstattes med en 500 mg tablet AUGMENTIN. Da både 250 mg og 500 mg tabletterne af AUGMENTIN indeholder den samme mængde clavulansyre (125 mg, som kaliumsaltet), svarer to 250 mg tabletter af AUGMENTIN 750 mg ikke til en 500 mg tablet AUGMENTIN.
Opbevaring og håndtering
Tabletter
250 mg/125 mg tabletter: Hver hvid oval filmovertrukket tablet, præget med AUGMENTIN 750 mg på den ene side og 250/125 på den anden side, indeholder 250 mg amoxicillin som trihydrat og 125 mg clavulansyre som kaliumsalt.
NDC 43598-018-30 flasker á 30 stk NDC 43598-018-78 Enhedsdosis (10x10) 100 tabletter
500 mg/125 mg tabletter: Hver hvid oval filmovertrukket tablet, præget med AUGMENTIN på den ene side og 500/125 på den anden side, indeholder 500 mg amoxicillin som trihydrat og 125 mg clavulansyre som kaliumsalt.
NDC 43598-006-14 flasker á 20 stk NDC 43598-006-78 Enhedsdosis (10x10) 100 tabletter
875 mg/125 mg tabletter: Hver hvid kapselformet tablet med delekærv, præget med AUGMENTIN 875 på den ene side og delekærv på den anden side, indeholder 875 mg amoxicillin som trihydrat og 125 mg clavulansyre som kaliumsalt.
NDC 43598-021-14 flasker á 20 stk NDC 43598-021-78 Enhedsdosis (10x10) 100 tabletter
Pulver til oral suspension: 125 mg/31,25 mg pr. 5 ml: Pulver til oral suspension med banansmag (hver 5 ml rekonstitueret suspension indeholder 125 mg amoxicillin og 31,25 mg clavulansyre som kaliumsalt).
NDC 43598-012-51 75 mL flaske NDC 43598-012-52 100 ml flaske NDC 43598-012-53 150 ml flaske
200 mg/28,5 mg pr. 5 ml: Orange-begunstiget pulver til oral suspension (hver 5 ml rekonstitueret suspension indeholder 200 mg amoxicillin og 28,5 mg clavulansyre som kaliumsalt).
NDC 43598-013-50 50 mL flaske NDC 43598-013-51 75 mL flaske NDC 43598-013-52 100 mL flaske
250 mg/62,5 mg pr. 5 ml: Pulver til oral suspension med appelsinsmag (hver 5 ml rekonstitueret suspension indeholder 250 mg amoxicillin og 62,5 mg clavulansyre som kaliumsalt).
NDC 43598-004-51 75 mL flaske NDC 43598-004-52 100 ml flaske NDC 43598-004-53 150 ml flaske
400 mg/57 mg pr. 5 ml Pulver til oral suspension med appelsinsmag (hver 5 ml rekonstitueret suspension indeholder 400 mg amoxicillin og 57,0 mg clavulansyre som kaliumsalt).
NDC 43598-008-50 50 mL flaske NDC 43598-008-51 75 mL flaske NDC 43598-008-52 100 ml flaske
Tyggetabletter: 125 mg/31,25 mg tyggetabletter: Hver plettet gul, rund tablet med citron-lime-smag, præget med BMP 189, indeholder 125 mg amoxicillin og 31,25 mg clavulansyre som kaliumsalt.
NDC 43598-014-31 karton med 30 (5x6) tabletter
200 mg/28,5 mg tyggetabletter: Hver plettet lyserød, rund, bikonveks tablet med kirsebær-banan-smag, præget med AUGMENTIN 200, indeholder 200 mg amoxicillin og 28,5 mg clavulansyre som kaliumsalt.
NDC 43598-015-14 karton med 20 tabletter
250 mg/62,5 mg tyggetabletter: Hver plettet gul, rund tablet med citron-lime-smag, præget med BMP 190, indeholder 250 mg amoxicillin og 62,5 mg clavulansyre som kaliumsalt.
NDC 43598-016-31 karton med 30 (5x6) tabletter
400 mg/57 mg tyggetabletter: Hver plettet lyserød, rund, bikonveks tablet med kirsebær-banan-smag, præget med AUGMENTIN 400, indeholder 400 mg amoxicillin og 57,0 mg clavulansyre som kaliumsalt.
NDC 43598-017-14 karton med 20 tabletter
Dispenser i original beholder.
Opbevar tabletter og tørt pulver ved eller under 25°C (77°F).
Opbevar rekonstitueret suspension i køleskab. Kassér ubrugt suspension efter 10 dage. Opbevares utilgængeligt for børn.
REFERENCER
1. Swanson-Biearman B, Dean BS, Lopez G, Krenzelok EP. Virkningerne af indtagelse af penicillin og cephalosporin hos børn under seks år. Dyrlægen Hum Toxicol. 1988; 30: 66 67.
2. Clinical and Laboratory Standards Institute (CLSI). Metoder til fortynding Antimikrobielle følsomhedstests for bakterier, der vokser aerobt; Godkendt standard – 8. CLSI-dokument M7-A9. CLSI, 940 West Valley Road, Suite 1400, Wayne, PA, 19087, 2012.
3. Clinical and Laboratory Standards Institute (CLSI). Ydeevnestandard for antimikrobielle diskfølsomhedstests; Godkendt standard – 11. CLSI-dokument M2-A11. CLSI, 940 West Valley Road, Suite 1400, Wayne, PA, 19087, 2012.
4. CLSI. Ydeevnestandarder for antimikrobiel følsomhedstestning: 22. informationstillæg. CLSI dokument M100-S22. CLSI, Wayne, PA, 2012.
Distribueret af: Dr. Reddy's Laboratories Inc.Bridgewater, NJ 08807. Revideret: marts 2013
BIVIRKNINGER
Følgende diskuteres mere detaljeret i andre afsnit af mærkningen:
- Anafylaktiske reaktioner [se ADVARSLER OG FORHOLDSREGLER ]
- Leverdysfunktion [se ADVARSLER OG FORHOLDSREGLER ]
- CDAD [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
De hyppigst rapporterede bivirkninger var diarré/løs afføring (9%), kvalme (3%), hududslæt og nældefeber (3%), opkastning (1%) og vaginitis (1%). Mindre end 3 % af patienterne afbrød behandlingen på grund af lægemiddelrelaterede bivirkninger. Den samlede forekomst af bivirkninger, og især diarré, steg med den højere anbefalede dosis. Andre mindre hyppigt rapporterede bivirkninger (
Hos pædiatriske patienter (i alderen 2 måneder til 12 år) blev der udført 1 amerikansk/canadisk klinisk undersøgelse, som sammenlignede 45/6,4 mg/kg/dag (delt hver 12. time) af AUGMENTIN i 10 dage versus 40/10 mg/kg/dag (opdelt hver 8. time) af AUGMENTIN 125 mg i 10 dage til behandling af akut mellemørebetændelse. I alt 575 patienter blev indskrevet, og kun suspensionsformuleringerne blev brugt i dette forsøg. Samlet set var de observerede bivirkninger sammenlignelige med ovennævnte; der var dog forskelle i hyppigheden af diarré, hududslæt/urticaria og udslæt på bleområdet. [Se Kliniske Studier ]
Postmarketing oplevelse
Ud over bivirkninger rapporteret fra kliniske forsøg, er følgende blevet identificeret under postmarketing brug af AUGMENTIN. Da de rapporteres frivilligt fra en population af ukendt størrelse, kan der ikke foretages skøn over hyppigheden. Disse hændelser er blevet valgt til inklusion på grund af en kombination af deres alvor, hyppighed af rapportering eller potentielle årsagssammenhænge til AUGMENTIN.
Gastrointestinale
Fordøjelsesbesvær, gastritis, stomatitis, glossitis, sort "håret" tunge, mukokutan candidiasis, enterocolitis og hæmoragisk/pseudomembranøs colitis. Debut af pseudomembranøs colitis-symptomer kan forekomme under eller efter antibiotikabehandling. [se ADVARSLER OG FORHOLDSREGLER ]
Overfølsomhedsreaktioner
Kløe, angioødem, serumsygelignende reaktioner (nældefeber eller hududslæt ledsaget af arthritis, artralgi, myalgi og ofte feber), erythema multiforme, Stevens Johnsons syndrom, akut generaliseret exanthematouspustulose, overfølsomhed vasculitis og tilfælde af eksfoli- dermatisk dermatitis toksisk epiindir nekrolyse) er blevet rapporteret. [se ADVARSLER OG FORHOLDSREGLER ]
Lever
Leverdysfunktion, herunder hepatitis og kolestatisk gulsot, stigninger i serumtransaminaser (AST og/eller ALAT), serumbilirubin og/eller alkalisk fosfatase er blevet rapporteret med AUGMENTIN. Det er blevet rapporteret mere almindeligt hos ældre, mænd eller patienter i langvarig behandling. De histologiske fund på leverbiopsi har overvejende bestået af kolestatisk behandling. De histologiske fund på leverbiopsi har bestået overvejende af kolestatiske, hepatocellulære eller blandede kolestatiske hepatocellulære forandringer. Begyndelsen af tegn/symptomer på leverdysfunktion kan forekomme i løbet af eller flere uger efter, at behandlingen er seponeret. Leverdysfunktionen, som kan være alvorlig, er normalt reversibel. Dødsfald er blevet rapporteret. [se KONTRAINDIKATIONER , ADVARSLER OG FORHOLDSREGLER ]
Renal
Interstitiel nefritis, hæmaturi og krystalluri er blevet rapporteret. [se OVERDOSIS ]

Hemiske og lymfatiske systemer
Anæmi, herunder hæmolytisk anæmi, trombocytopeni, trombocytopenisk purpura, eosinofili, leukopeni og agranulocytose er blevet rapporteret. Disse reaktioner er normalt reversible ved seponering af behandlingen og menes at være overfølsomhedsfænomener. Trombocytose blev observeret hos mindre end 1 % af patienterne behandlet med AUGMENTIN. Der har været rapporter om øget protrombintid hos patienter, der fik AUGMENTIN 125 mg og antikoagulantbehandling samtidigt. [se DRUGSINTERAKTIONER ]
Centralnervesystemet
Agitation, angst, adfærdsændringer, forvirring, kramper, svimmelhed, søvnløshed og reversibel hyperaktivitet er blevet rapporteret.
Diverse
Tandmisfarvning (brun, gul eller grå farvning) er blevet rapporteret. De fleste rapporter forekom hos pædiatriske patienter. Misfarvning blev reduceret eller elimineret med børstning eller tandrensning i de fleste tilfælde.
DRUGSINTERAKTIONER
Probenecid
Probenecid nedsætter den renale tubulære sekretion af amoxicillin, men forsinker ikke renal udskillelse af clavulansyre. Samtidig brug med AUGMENTIN 875 mg kan resultere i øgede og forlængede blodkoncentrationer af amoxicillin. Samtidig administration af probenecid anbefales ikke.
Orale antikoagulantia
Unormal forlængelse af protrombintid (øget internationalt normaliseret ratio [INR]) er blevet rapporteret hos patienter, der får amoxicillin og orale antikoagulantia. Der bør foretages passende overvågning, når antikoagulantia ordineres samtidig med AUGMENTIN. Det kan være nødvendigt at justere dosis af orale antikoagulantia for at opretholde det ønskede niveau af antikoagulering.
Allopurinol
Samtidig administration af allopurinol og amoxicillin øger forekomsten af udslæt hos patienter, der får begge lægemidler, sammenlignet med patienter, der får amoxicillin alene. Det vides ikke, om denne forstærkning af amoxicillin-udslæt skyldes allopurinol eller den hyperurikæmi, der er til stede hos disse patienter.
Orale præventionsmidler
AUGMENTIN 750mg kan påvirke tarmfloraen, hvilket fører til lavere østrogenreabsorption og reduceret effektivitet af kombinerede orale østrogen/progesteronpræventionsmidler.
Effekter på laboratorietests
Høje urinkoncentrationer af amoxicillin kan resultere i falsk-positive reaktioner, når der testes for tilstedeværelsen af glukose i urinen med CLINITEST®, Benedict's Solution eller Fehling's Solution. Da denne effekt også kan forekomme med AUGMENTIN, anbefales det, at der anvendes glukosetest baseret på enzymatiske glucoseoxidase-reaktioner.
Efter administration af amoxicillin til gravide kvinder er der observeret et forbigående fald i plasmakoncentrationen af total konjugeret østriol, østriol-glucuronid, konjugeret østron og østradiol.
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Overfølsomhedsreaktioner
Alvorlige og lejlighedsvis fatale overfølsomhedsreaktioner (anafylaktiske) er blevet rapporteret hos patienter, der får beta-lactam antibakterielle midler, inklusive AUGMENTIN. Disse reaktioner er mere tilbøjelige til at forekomme hos personer med en historie med penicillin-overfølsomhed og/eller en historie med følsomhed over for flere allergener. Før behandling med AUGMENTIN 250 mg påbegyndes, bør der foretages omhyggelig undersøgelse vedrørende tidligere overfølsomhedsreaktioner over for penicilliner, cephalosporiner eller andre allergener. Hvis der opstår en allergisk reaktion, skal AUGMENTIN seponeres og passende behandling iværksættes.
Leverdysfunktion
Leverdysfunktion, herunder hepatitis og kolestatisk gulsot, er blevet forbundet med brugen af AUGMENTIN. Hepatisk toksicitet er sædvanligvis reversibel; dog er der rapporteret om dødsfald. Leverfunktionen bør overvåges med regelmæssige intervaller hos patienter med nedsat leverfunktion.
Clostridium Difficile Associated Diarrhea (CDAD)
Clostridium difficile-associeret diarré (CDAD) er blevet rapporteret ved brug af næsten alle antibakterielle midler, inklusive AUGMENTIN 250mg, og kan variere i sværhedsgrad fra mild diarré til fatal colitis. Behandling med antibakterielle midler ændrer den normale flora i tyktarmen, hvilket fører til overvækst af C. difficile.
C. difficile producerer toksinerne A og B, som bidrager til udviklingen af CDAD. Hypertoksinproducerende stammer af C. difficile forårsager øget morbiditet og dødelighed, da disse infektioner kan være modstandsdygtige over for antimikrobiel behandling og kan kræve kolektomi. CDAD skal overvejes hos alle patienter, som får diarré efter antibakteriel brug. Omhyggelig sygehistorie er nødvendig, da CDAD er blevet rapporteret at forekomme over 2 måneder efter administration af antibakterielle midler.
Hvis CDAD er mistænkt eller bekræftet, kan det være nødvendigt at afbryde igangværende antibakteriel brug, der ikke er rettet mod C. difficile. Passende væske- og elektrolytbehandling, proteintilskud, antibakteriel behandling af C. difficile og kirurgisk evaluering bør iværksættes som klinisk indiceret.
Hududslæt hos patienter med mononukleose
En høj procentdel af patienter med mononukleose, som får amoxicillin, udvikler erytematøst hududslæt. AUGMENTIN bør derfor ikke administreres til patienter med mononukleose.
Potentiale for mikrobiel overvækst
Muligheden for superinfektioner med svampe- eller bakteriepatogener bør overvejes under behandlingen. Hvis der opstår superinfektion, bør amoxicillin/clavulanatkalium seponeres og passende behandling iværksættes.
Fenylketonurik
AUGMENTIN 500mg tyggetabletter og AUGMENTIN pulver til oral opløsning indeholder aspartam, som indeholder phenylalanin. Hver 200 mg tyggetablet AUGMENTIN 750 mg indeholder 2,1 mg phenylalanin; hver 400 mg tyggetablet indeholder 4,2 mg phenylalanin; hver 5 ml af enten 200 mg/5 ml eller 400 mg/5 ml oral suspension indeholder 7 mg phenylalanin. De andre formuleringer af AUGMENTIN 875mg indeholder ikke phenylalanin.
Udvikling af lægemiddelresistente bakterier
Udskrivning af AUGMENTIN 250 mg i fravær af en påvist eller stærkt mistænkt bakteriel infektion vil næppe give gavn for patienten og øger risikoen for udvikling af lægemiddelresistente bakterier.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Langtidsundersøgelser på dyr er ikke blevet udført for at vurdere kræftfremkaldende potentiale.
AUGMENTIN (formulering af amoxicillin:clavulanat i forholdet 4:1) var ikke-mutagen i Ames-bakteriemutationsanalysen og gærgenkonverteringsassayet. AUGMENTIN var svagt positiv i muse-lymfom-assayet, men tendensen mod øgede mutationsfrekvenser i dette assay forekom ved doser, der også var forbundet med nedsat celleoverlevelse. AUGMENTIN var negativ i mikronukleustesten hos mus og i den dominerende letale analyse hos mus. Kaliumclavulanat alene blev testet i Ames bakterielle mutationsassay og i muse mikronucleus test og var negativ i hver af disse assays.
AUGMENTIN (formulering af amoxicillin:clavulanat i forholdet 2:1) ved orale doser på op til 1.200 mg/kg/dag viste sig ikke at have nogen effekt på fertilitet og reproduktionsevne hos rotter. Baseret på kropsoverfladen er denne dosis af amoxicillin ca. 4 gange den maksimalt anbefalede orale dosis til voksne mennesker (875 mg hver 12. time). For clavulanat er dosismultipel ca. 9 gange højere end den maksimalt anbefalede orale dosis til voksne mennesker (125 mg hver 8. time), også baseret på kropsoverfladeareal.
Brug i specifikke populationer
Graviditet
Teratogene virkninger
Graviditet Kategori B. Reproduktionsundersøgelser udført på gravide rotter og mus, der fik AUGMENTIN (2:1-formulering af amoxicillin:clavulanat) i orale doser op til 1200 mg/kg/dag viste ingen tegn på skade på fosteret på grund af AUGMENTIN. Amoxicillindoserne hos rotter og mus (baseret på kropsoverfladeareal) var ca. 4 og 2 gange den maksimalt anbefalede orale dosis til voksne (875 mg hver 12. time). For clavulanat var disse dosismultipler ca. 9 og 4 gange den maksimalt anbefalede orale dosis til voksne (125 mg hver 8. time). Der er dog ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder. Da reproduktionsstudier på dyr ikke altid forudsiger human respons, bør dette lægemiddel kun anvendes under graviditet, hvis det er klart nødvendigt.
Arbejde og levering
Orale ampicillin-antibiotika absorberes dårligt under fødslen. Det vides ikke, om brug af amoxicillin/clavulanatkalium hos mennesker under fødslen eller fødslen har umiddelbare eller forsinkede bivirkninger på fosteret, forlænger fødslens varighed eller øger sandsynligheden for nødvendigheden af en obstetrisk intervention.
Ammende mødre
Amoxicillin har vist sig at blive udskilt i modermælk. Brug af amoxicillin/clavulanatkalium hos ammende mødre kan føre til sensibilisering af spædbørn. Der bør udvises forsigtighed, når amoxicillin/clavulanatkalium administreres til en ammende kvinde.
Pædiatrisk brug
Sikkerheden og effektiviteten af AUGMENTIN pulver til oral suspension og tyggetabletter er blevet fastslået hos pædiatriske patienter. Brug af AUGMENTIN 125 mg til pædiatriske patienter understøttes af beviser fra undersøgelser af AUGMENTIN tabletter hos voksne med yderligere data fra en undersøgelse af AUGMENTIN pulver til oral suspension hos pædiatriske patienter i alderen 2 måneder til 12 år med akut mellemørebetændelse. [se Kliniske Studier ]
På grund af ufuldstændigt udviklet nyrefunktion hos nyfødte og spædbørn kan eliminationen af amoxicillin forsinkes; Clavulanat-elimineringen er uændret i denne aldersgruppe. Dosering af AUGMENTIN 500 mg bør ændres hos pædiatriske patienter i alderen DOSERING OG ADMINISTRATION ]
Geriatrisk brug
Af de 3.119 patienter i en analyse af kliniske undersøgelser af AUGMENTIN var 32 % ≥65 år og 14 % var ≥75 år. Der blev ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet mellem disse forsøgspersoner og yngre forsøgspersoner, og anden rapporteret klinisk erfaring har ikke identificeret forskelle i respons mellem ældre og yngre patienter, men større følsomhed hos nogle ældre individer kan ikke udelukkes.
Dette lægemiddel vides at udskilles væsentligt af nyrerne, og risikoen for bivirkninger af dette lægemiddel kan være større hos patienter med nedsat nyrefunktion. Da ældre patienter er mere tilbøjelige til at have nedsat nyrefunktion, bør der udvises forsigtighed ved dosisvalg, og det kan være nyttigt at overvåge nyrefunktionen.
Dosering ved nedsat nyrefunktion
Amoxicillin elimineres primært via nyrerne, og dosisjustering er normalt påkrævet hos patienter med svært nedsat nyrefunktion (GFR Patienter med nedsat nyrefunktion for specifikke anbefalinger til patienter med nedsat nyrefunktion.
OVERDOSIS
I tilfælde af overdosering skal du afbryde medicinen, behandle symptomatisk og iværksætte støttende foranstaltninger efter behov. En prospektiv undersøgelse af 51 pædiatriske patienter på et giftkontrolcenter antydede, at overdosering på mindre end 250 mg/kg amoxicillin ikke er forbundet med signifikante kliniske symptomer1.
Interstitiel nefritis, der resulterer i oligurisk nyresvigt, er blevet rapporteret hos patienter efter overdosering med amoxicillin/clavulanatkalium.
Krystalluri, som i nogle tilfælde fører til nyresvigt, er også blevet rapporteret efter overdosering af amoxicillin/clavulanat-kalium hos voksne og pædiatriske patienter. I tilfælde af overdosering bør tilstrækkelig væskeindtagelse og diurese opretholdes for at reducere risikoen for amoxicillin/clavulanat-kaliumkrystalluri. Nedsat nyrefunktion ser ud til at være reversibel med ophør af lægemiddeladministration. Høje blodniveauer kan lettere forekomme hos patienter med nedsat nyrefunktion på grund af nedsat renal clearance af amoxicillin/clavulanatkalium. Amoxicillin/clavulanat-kalium kan fjernes fra cirkulationen ved hæmodialyse. [se DOSERING OG ADMINISTRATION ]
KONTRAINDIKATIONER
Alvorlige overfølsomhedsreaktioner
AUGMENTIN er kontraindiceret hos patienter med en historie med alvorlige overfølsomhedsreaktioner (f.eks. anafylaksi eller Stevens-Johnsons syndrom) over for amoxicillin, clavulanat eller andre beta-lactam antibakterielle lægemidler (f.eks. penicilliner og cephalosporiner).
Kolestatisk gulsot/hepatisk dysfunktion
AUGMENTIN 250mg er kontraindiceret til patienter med tidligere kolestatisk gulsot/leverdysfunktion i forbindelse med AUGMENTIN.
KLINISK FARMAKOLOGI
Handlingsmekanisme
AUGMENTIN er et antibakterielt lægemiddel. [se Mikrobiologi ]
Farmakokinetik
Gennemsnitlige farmakokinetiske parametre for amoxicillin og clavulanatkalium hos normale voksne efter administration af AUGMENTIN 250 mg tabletter er vist i tabel 3, og efter administration af AUGMENTIN 250 mg pulver til oral suspension og tyggetabletter er vist i tabel 4.
Oral administration af 5 mL 250 mg/5 mL suspension af AUGMENTIN eller den ækvivalente dosis på 10 mL 125 mg/5 mL suspension af AUGMENTIN giver gennemsnitlige maksimale serumkoncentrationer ca. 1 time efter dosering på 6,9 mcg/ml for amoxicillin og 1,6 mcg /ml for clavulansyre. Områderne under serumkoncentrationskurverne opnået i løbet af de første 4 timer efter dosering var 12,6 mcg*t/mL for amoxicillin og 2,9 mcg*t/ml for clavulansyre, når 5 mL 250 mg/5 mL suspension af AUGMENTIN eller tilsvarende dosis af 10 ml 125 mg/5 ml suspension af AUGMENTIN blev administreret til normale voksne. En 250 mg tyggetablet AUGMENTIN eller to 125 mg tyggetabletter AUGMENTIN svarer til 5 ml 250 mg/5 ml suspension af AUGMENTIN og giver tilsvarende serumkoncentrationer af amoxicillin og clavulansyre.
Amoxicillin-serumkoncentrationer opnået med AUGMENTIN 250 mg svarer til dem, der produceres ved oral administration af ækvivalente doser af amoxicillin alene. Tid over den minimale hæmmende koncentration på 1 mcg/ml for amoxicillin har vist sig at være ens efter hver 12. time og hver 8. time doseringsregimer af AUGMENTIN 250 mg til voksne og børn.
Absorption
Dosering i fastende eller fodertilstand har minimal effekt på amoxicillins farmakokinetik. Mens AUGMENTIN kan gives uden hensyntagen til måltider, er absorptionen af clavulanatkalium, når det tages sammen med mad, større i forhold til fastetilstanden. I en undersøgelse blev den relative biotilgængelighed af clavulanat reduceret, når AUGMENTIN blev doseret 30 og 150 minutter efter starten på en morgenmad med højt fedtindhold.
Fordeling
Ingen af komponenterne i AUGMENTIN er stærkt proteinbundet; clavulansyre er ca. 25 % bundet til humant serum og amoxicillin ca. 18 % bundet. Amoxicillin diffunderer let ind i de fleste kropsvæv og væsker med undtagelse af hjernen og spinalvæsken.
To timer efter oral administration af en enkelt 35 mg/kg dosis af suspension af AUGMENTIN 500 mg til fastende børn, blev der påvist gennemsnitlige koncentrationer på 3 mcg/ml amoxicillin og 0,5 mcg/ml clavulansyre i mellemøret effusioner.
Metabolisme og udskillelse
Halveringstiden for amoxicillin efter oral administration af AUGMENTIN 125 mg er 1,3 timer og for clavulansyre er 1 time.
Ca. 50% til 70% af amoxicillin og ca. 25% til 40% af clavulansyre udskilles uændret i urinen i løbet af de første 6 timer efter administration af en enkelt 250 mg eller 500 mg tablet AUGMENTIN.
Mikrobiologi
Amoxicillin er et semisyntetisk antibiotikum med in vitro bakteriedræbende aktivitet mod Gram-positive og Gram-negative bakterier. Amoxicillin er imidlertid modtageligt for nedbrydning af beta-lactamaser, og derfor omfatter aktivitetsspektret ikke organismer, der producerer disse enzymer. Clavulansyre er en beta-lactam, strukturelt beslægtet med penicillinerne, som har evnen til at inaktivere nogle beta-lactamase-enzymer, der almindeligvis findes i mikroorganismer, der er resistente over for penicilliner og cephalosporiner. Især har det god aktivitet mod de klinisk vigtige plasmid-medierede betalaktamaser, der ofte er ansvarlige for overført lægemiddelresistens.
Formuleringen af amoxicillin og clavulansyre i AUGMENTIN beskytter amoxicillin mod nedbrydning af nogle beta-lactamase-enzymer og udvider amoxicillins antibiotiske spektrum til at omfatte mange bakterier, der normalt er resistente over for amoxicillin.
Amoxicillin/clavulansyre har vist sig at være aktiv mod de fleste isolater af følgende bakterier, både in vitro og ved kliniske infektioner som beskrevet i afsnittet INDIKATIONER OG ANVENDELSE.
Gram-positive bakterier
Staphylococcus aureus
Gram-negative bakterier
Enterobacter arter Escherichia coli Haemophilus influenzae Klebsiella arter Moraxella catarrhalis
Følgende in vitro-data er tilgængelige, men deres kliniske betydning er ukendt . Mindst 90 procent af de følgende bakterier udviser en in vitro minimal hæmmende koncentration (MIC) mindre end eller lig med det modtagelige brudpunkt for amoxicillin/clavulansyre. Effekten af amoxicillin/clavulansyre til behandling af kliniske infektioner på grund af disse bakterier har ikke været etableret i tilstrækkelige og velkontrollerede kliniske forsøg.
Gram-positive bakterier
Enterococcus faecalis Staphylococcus epidermidis Staphylococcus saprophyticus Streptococcus pneumoniae Streptococcus pyogenes Viridans gruppe Streptococcus
Gram-negative bakterier
Eikenellacorrodens Proteus mirabilis
Anaerobe bakterier
Bacteroides-arter inklusive Bacteroides fragilis Fusobacterium-arter Peptostreptokok-arter
Modtagelighedstestmetoder
Når det er tilgængeligt, skal det kliniske mikrobiologiske laboratorium fremlægge resultaterne af in vitro-følsomhedstestresultater for antimikrobielle lægemidler, der anvendes på hjemmehørende hospitaler, til lægen som periodiske rapporter, der beskriver modtagelighedsprofilen for nosokomiale og samfundserhvervede patogener. Disse rapporter skal hjælpe lægen med at vælge et antibakterielt lægemiddel til behandling.
Fortyndingsteknikker
Kvantitative metoder bruges til at bestemme antimikrobielle minimumshæmmende koncentrationer (MIC'er). Disse MIC'er giver estimater af bakteriers modtagelighed over for antimikrobielle forbindelser. MIC'erne bør bestemmes ved hjælp af en standardiseret testmetode2,3 (bouillon og/eller agar). MIC-værdierne skal fortolkes i henhold til kriterierne i tabel 5.
Diffusionsteknikker
Kvantitative metoder, der kræver måling af zonediametre, kan også give reproducerbare estimater af bakteriers modtagelighed over for antimikrobielle forbindelser. Zonestørrelsen giver et skøn over bakteriers modtagelighed over for antimikrobielle forbindelser. Zonestørrelsen skal bestemmes ved hjælp af en standardiseret testmetode3,4. Denne procedure bruger papirskiver imprægneret med 30 mcg amoxicillin/clavulansyre (20 mcg amoxicillin plus 10 mcg clavulansyre) til at teste bakteriers modtagelighed for amoxicillin/clavulansyre. Fortolkningskriterierne for diskdiffusion er angivet i tabel 5.
Kvalitetskontrol
Standardiserede følsomhedstestprocedurer kræver brug af laboratoriekontroller til at overvåge og sikre nøjagtigheden og præcisionen af forsyninger og reagenser, der anvendes i analysen, og teknikkerne for de personer, der udfører testen2,3,4. Standard amoxicillin/clavulansyre-pulver skal give følgende række af MIC-værdier angivet i tabel 6 for diffusionsteknikken ved brug af 30 mcg amoxicillin/clavulansyre (20 mcg amoxicillin plus 10 mcg clavulansyre), kriterierne i tabel 6 skal opfyldes .
Kliniske Studier
Nedre luftveje og komplicerede urinvejsinfektioner
Data fra 2 pivotale forsøg med 1.191 patienter behandlet for enten nedre luftvejsinfektioner eller komplicerede urinvejsinfektioner sammenlignede et regime på 875 mg tabletter AUGMENTIN hver 12. time med 500 mg tabletter AUGMENTIN 125 mg doseret hver 8. time (henholdsvis 584 og 607 patienter) ). Sammenlignelig effekt blev påvist mellem hver 12. og hver 8. time doseringsregime. Der var ingen signifikant forskel i procentdelen af bivirkninger i hver gruppe. Den hyppigst rapporterede bivirkning var diarré; incidensraterne var ens for 875 mg hver 12. time og 500 mg hver 8. time (henholdsvis 15 % og 14 %); dog var der en statistisk signifikant forskel (p
et af disse pivotale forsøg blev patienter med enten pyelonefritis (n = 361) eller en kompliceret urinvejsinfektion (dvs. patienter med abnormiteter i urinvejene, der disponerer for tilbagefald af bakteriuri efter udryddelse, n = 268) randomiseret (1: 1) at modtage enten 875 mg tabletter af AUGMENTIN 125 mg hver 12. time (n=308) eller 500 mg tabletter af AUGMENTIN hver 8. time (n=321).
Antallet af bakteriologisk evaluerbare patienter var sammenligneligt mellem de to doseringsregimer. AUGMENTIN 250 mg producerede sammenlignelige bakteriologiske succesrater hos patienter vurderet 2 til 4 dage umiddelbart efter endt behandling. De bakteriologiske effektivitetsrater var sammenlignelige ved et af opfølgningsbesøgene (5 til 9 dage efter behandling) og ved et sent besøg efter behandling (i de fleste tilfælde var dette 2 til 4 uger efter behandling), som det ses i tabel 7.
Som nævnt før, selvom der ikke var nogen signifikant forskel i procentdelen af bivirkninger i hver gruppe, var der en statistisk signifikant forskel i hyppigheden af svær diarré eller abstinenser med diarré mellem regimerne.
Akut bakteriel mellemørebetændelse og diarré hos pædiatriske patienter
Et amerikansk/canadisk klinisk forsøg blev udført, som sammenlignede 45/6,4 mg/kg/dag (delt hver 12. time) af AUGMENTIN i 10 dage versus 40/10 mg/kg/dag (delt hver 8. time) af AUGMENTIN i 10 dage i behandling af akut mellemørebetændelse. Kun suspensionsformuleringerne blev anvendt i dette forsøg. I alt 575 pædiatriske patienter (i alderen 2 måneder til 12 år) blev indskrevet, med en jævn fordeling mellem de 2 behandlingsgrupper, og et sammenligneligt antal patienter var evaluerbare (dvs. ³ 84 %) pr. behandlingsgruppe. Otitis media-specifikke kriterier var påkrævet for berettigelse, og der blev fundet en stærk sammenhæng ved afslutningen af terapien og opfølgningen mellem disse kriterier og lægens vurdering af klinisk respons. De kliniske effektivitetsrater ved afslutningen af terapibesøget (defineret som 2 4 dage efter afslutningen af terapien) og ved opfølgningsbesøget (defineret som 22 28 dage efter afslutning af terapien) var sammenlignelige for de 2 behandlingsgrupper, med følgende helbredelsesrater opnået for de evaluerbare patienter: Ved afslutningen af behandlingen var 87 % (n = 265) og 82 % (n = 260) for henholdsvis 45 mg/kg/dag hver 12. time og 40 mg/kg/dag hver 8. time. . Ved opfølgning var 67 % (n = 249) og 69 % (n = 243) for henholdsvis 45 mg/kg/dag hver 12. time og 40 mg/kg/dag hver 8. time.
Diarré blev defineret som enten: (a) 3 eller flere vandig eller 4 eller flere løs/vandig afføring på 1 dag; ELLER (b) 2 vandig afføring pr. dag eller 3 løs/vandig afføring pr. dag i 2 på hinanden følgende dage. Forekomsten af diarré var signifikant lavere hos patienter, der fik kuren hver 12. time sammenlignet med patienter, der fik kuren hver 8. time (henholdsvis 14 % og 34 %). Derudover var antallet af patienter med enten svær diarré eller som blev seponeret med diarré signifikant lavere i behandlingsgruppen hver 12. time (hhv. 3 % og 8 % for hver 12. time/10. dag og hver 8./10. dag). ). I behandlingsgruppen hver 12. time blev 3 patienter (1 %) afbrudt med en allergisk reaktion, mens 1 patient i gruppen hver 8. time blev seponeret af denne grund. Antallet af patienter med en candidalinfektion i bleområdet var 4 % og 6 % for henholdsvis hver 12. time og hver 8. time.
Det vides ikke, om fundet af en statistisk signifikant reduktion i diarré med de orale suspensioner doseret hver 12. time versus suspensioner doseret hver 8. time kan ekstrapoleres til tyggetabletterne. Tilstedeværelsen af mannitol i tyggetabletterne kan bidrage til en anden diarréprofil. De orale suspensioner hver 12. time (200 mg/5 ml og 400 mg/5 ml) sødes med aspartam.
PATIENTOPLYSNINGER
Patienterne skal informeres om, at AUGMENTIN kan tages hver 8. time eller hver 12. time, afhængigt af den ordinerede dosis. Hver dosis bør tages sammen med et måltid eller snack for at reducere muligheden for mave-tarmbesvær.
Patienter bør rådgives om, at antibakterielle lægemidler, inklusive AUGMENTIN 125mg, kun bør anvendes til behandling af bakterielle infektioner. De behandler ikke virusinfektioner (f.eks. forkølelse). Når AUGMENTIN ordineres til behandling af en bakteriel infektion, skal patienterne fortælles, at selvom det er almindeligt at føle sig bedre tidligt i behandlingsforløbet, skal medicinen tages nøjagtigt som anvist. At springe doser over eller ikke fuldføre hele behandlingsforløbet kan: (1) mindske effektiviteten af den øjeblikkelige behandling og (2) øge sandsynligheden for, at bakterier udvikler resistens og ikke vil kunne behandles med AUGMENTIN 250mg eller andre antibakterielle lægemidler i fremtiden .
Rådgiv patienterne om, at diarré er et almindeligt problem forårsaget af antibakterielle midler, og det slutter normalt, når det antibakterielle middel seponeres. Nogle gange kan patienter efter påbegyndelse af behandling med antibakterielle midler udvikle vandig og blodig afføring (med eller uden mavekramper og feber) selv så sent som 2 eller flere måneder efter at have taget deres sidste dosis af det antibakterielle middel. Hvis diarré er alvorlig eller varer mere end 2 eller 3 dage, bør patienter kontakte deres læge.
Patienter bør rådes til at opbevare suspensionen nedkølet. Ryst godt før brug. Når du doserer et barn med suspensionen (væske) af AUGMENTIN 125mg, skal du bruge en doseringsske eller medicindråbe. Sørg for at skylle skeen eller dråberen efter hver brug. Flasker med suspension af AUGMENTIN kan indeholde mere væske end nødvendigt. Følg din læges anvisninger om mængden, der skal bruges, og de behandlingsdage dit barn har brug for. Kassér al ubrugt medicin.
Patienter skal være opmærksomme på, at AUGMENTIN 125mg indeholder et lægemiddel i penicillinklassen, som kan forårsage allergiske reaktioner hos nogle individer.
