Flagyl 200mg, 400mg Metronidazole Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Flagyl, og hvordan bruges det?
Flagyl er en receptpligtig medicin, der bruges til at behandle symptomerne på bakterielle infektioner i skeden, maven, leveren, huden, leddene, hjernen og luftvejene. Flagyl kan bruges alene eller sammen med anden medicin.
Flagyl er en nitroimidazoler, CYP3A4-hæmmer, moderat.
Hvad er de mulige bivirkninger af Flagyl 200mg?
Flagyl 400mg kan forårsage alvorlige bivirkninger, herunder:
- diarré,
- smertefuldt eller vandladningsbesvær,
- søvnbesvær,
- depression,
- irritabilitet,
- hovedpine,
- svimmelhed
- svaghed,
- svimmelhed,
- vabler eller sår i munden,
- rødt eller hævet tandkød, og
- synkebesvær
Fortæl det til din læge, hvis du oplever alvorlige bivirkninger af Flagyl, herunder:
- følelsesløshed,
- prikkende,
- brændende smerte i dine hænder eller fødder,
- synsproblemer,
- smerte bag dine øjne,
- ser blink eller lys,
- muskelsvaghed,
- koordinationsbesvær,
- problemer med at tale eller forstå, hvad der bliver sagt til dig,
- anfald,
- feber,
- nakkestivhed, og
- øget lysfølsomhed
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
Disse er ikke alle de mulige bivirkninger af Flagyl. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
For at reducere udviklingen af lægemiddelresistente bakterier og bevare effektiviteten af FLAGYL® og andre antibakterielle lægemidler, bør FLAGYL® kun bruges til at behandle eller forebygge infektioner, der er bevist eller stærkt mistænkt for at være forårsaget af bakterier.
ADVARSEL
Metronidazol har vist sig at være kræftfremkaldende hos mus og rotter (se FORHOLDSREGLER ). Unødvendig brug af lægemidlet bør undgås. Dets brug bør forbeholdes de forhold, der er beskrevet i INDIKATIONER OG BRUG afsnit nedenfor.
BESKRIVELSE
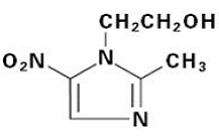
FLAGYL (metronidazol) tabletter, 250 mg eller 500 mg er en oral formulering af det syntetiske nitroimidazol antimikrobielle middel, 2-methyl-5-nitro-1H-imidazol-1-ethanol, som har følgende strukturformel:
FLAGYL (metronidazol) tabletter indeholder 250 mg eller 500 mg metronidazol. Inaktive ingredienser omfatter cellulose, FD&C Blue No. 2 Lake, hydroxypropylcellulose, hypromellose, polyethylenglycol, stearinsyre og titaniumdioxid.
INDIKATIONER
Symptomatisk trichomoniasis. FLAGYL er indiceret til behandling af T. vaginalis-infektion hos kvinder og mænd, når tilstedeværelsen af trichomonad er blevet bekræftet ved passende laboratorieprocedurer (våde udstrygninger og/eller kulturer).
Asymptomatisk trichomoniasis. FLAGYL 400mg er indiceret til behandling af asymptomatisk T. vaginalis-infektion hos kvinder, når organismen er forbundet med endocervicitis, cervicitis eller cervikal erosion. Da der er evidens for, at tilstedeværelsen af trichomonad kan interferere med nøjagtig vurdering af unormale cytologiske udstrygninger, bør yderligere udstrygninger udføres efter udryddelse af parasitten.
Behandling af asymptomatiske seksuelle partnere. T. vaginalis-infektion er en kønssygdom. Derfor bør asymptomatiske seksuelle partnere fra behandlede patienter behandles samtidigt, hvis organismen har vist sig at være til stede, for at forhindre geninfektion af partneren. Beslutningen om, hvorvidt man skal behandle en asymptomatisk mandlig partner, som har en negativ kultur eller en, for hvem der ikke er forsøgt dyrkning, er individuel. Når man træffer denne beslutning, skal det bemærkes, at der er tegn på, at en kvinde kan blive geninfektion, hvis hendes seksuelle partner ikke behandles. Da der kan være betydelige vanskeligheder med at isolere organismen fra den asymptomatiske mandlige bærer, kan der heller ikke stoles på negative udstrygninger og kulturer i denne henseende. Under alle omstændigheder bør den seksuelle partner behandles med FLAGYL i tilfælde af geninfektion.
Amebiasis. FLAGYL er indiceret til behandling af akut intestinal amebiasis (amebisk dysenteri) og amebisk leverabsces.
Ved amebisk leverabscess undgår FLAGYL-terapi ikke behovet for aspiration eller dræning af pus.
Anaerobe bakterielle infektioner. FLAGYL 200mg er indiceret til behandling af alvorlige infektioner forårsaget af modtagelige anaerobe bakterier. Indicerede kirurgiske indgreb bør udføres i forbindelse med FLAGYL-behandling. Ved en blandet aerob og anaerob infektion bør antimikrobielle stoffer, der er passende til behandling af den aerobe infektion, anvendes ud over FLAGYL.
INTRA-ABDOMINALE INFEKTIONER, herunder peritonitis, intra-abdominal byld og leverabsces, forårsaget af Bacteroides-arter, herunder B. fragilis-gruppen (B. fragilis, B. distasonis, B. ovatus, B. thetaiotaomicron, B. vulgatus), Clostridium arter, Eubacterium-arter, Peptococcus-arter og Peptostreptokok-arter.
HUD- OG HUDSTRUKTURINFEKTIONER forårsaget af Bacteroides-arter, herunder B. fragilis-gruppen, Clostridium-arter, Peptococcus-arter, Peptostreptokok-arter og Fusobacterium-arter.
GYNÆKOLOGISKE INFEKTIONER, herunder endometritis, endomyometritis, tubo-ovarie absces og postkirurgisk vaginal cuff-infektion, forårsaget af Bacteroides-arter, herunder B. fragilis-gruppen, Clostridium-arter, Peptococcus-arter, Peptostreptokok-arter og Fusobacterium-arter.
BAKTERIELT SEPTICEMI forårsaget af Bacteroides-arter, herunder B. fragilis-gruppen og Clostridium-arter.
KNOGLE- OG LEDINFEKTIONER (som supplerende terapi), forårsaget af Bacteroides-arter inklusive B. fragilis-gruppen.
INFEKTIONER I CENTRALNERVESYSTEMET (CNS), inklusive meningitis og hjerneabsces, forårsaget af Bacteroides-arter inklusive B. fragilis-gruppen.
INFEKTIONER I NEDRE LUFTVÆRER, inklusive lungebetændelse, empyem og lungeabsces, forårsaget af Bacteroides-arter, herunder B. fragilis-gruppen.
ENDOCARDITIS forårsaget af Bacteroides-arter inklusive B. fragilis-gruppen.
For at reducere udviklingen af lægemiddelresistente bakterier og bevare effektiviteten af FLAGYL 400mg og andre antibakterielle lægemidler, bør FLAGYL kun bruges til at behandle eller forebygge infektioner, der er bevist eller stærkt mistænkt for at være forårsaget af modtagelige bakterier. Når kultur- og modtagelighedsoplysninger er tilgængelige, bør de overvejes ved udvælgelse eller ændring af antibakteriel behandling. I mangel af sådanne data kan lokal epidemiologi og modtagelighedsmønstre bidrage til den empiriske udvælgelse af terapi.
DOSERING OG ADMINISTRATION
Trichomoniasis
I Hunnen
Endagsbehandling - to gram FLAGYL, givet enten som en enkelt dosis eller i to opdelte doser på et gram hver, givet samme dag.
Syv-dages behandlingsforløb - 250 mg tre gange dagligt i syv på hinanden følgende dage. Der er en vis indikation fra kontrollerede sammenlignende undersøgelser, at helbredelsesraten, bestemt af vaginale udstrygninger og tegn og symptomer, kan være højere efter et syv-dages behandlingsforløb end efter et en-dags behandlingsregime.
Dosisregimet bør individualiseres. Enkeltdosisbehandling kan sikre compliance, især hvis det administreres under opsyn, hos de patienter, som man ikke kan stole på for at fortsætte den syv-dages kur. Et syv-dages behandlingsforløb kan minimere reinfektion ved at beskytte patienten længe nok til, at de seksuelle kontakter kan opnå passende behandling. Yderligere kan nogle patienter tolerere det ene behandlingsregime bedre end det andet.
Gravide patienter bør ikke behandles i første trimester (se KONTRAINDIKATIONER ). Hos gravide patienter, for hvem alternativ behandling har været utilstrækkelig, bør en-dagsbehandlingsforløbet ikke anvendes, da det resulterer i højere serumniveauer, som kan nå fosterets kredsløb (se FORHOLDSREGLER , Graviditet ).
Når gentagne kure med lægemidlet er påkrævet, anbefales det, at der går et interval på fire til seks uger mellem kurene, og at tilstedeværelsen af trichomonad genbekræftes ved passende laboratorieforanstaltninger. Totale og differentielle leukocyttællinger bør foretages før og efter genbehandling.
Hos hannen: Behandlingen bør individualiseres, som den er for hunnen.
Amebiasis
Voksne
Ved akut intestinal amebiasis (akut amebisk dysenteri): 750 mg oralt tre gange dagligt i 5 til 10 dage.
Til amebisk leverabscess: 500 mg eller 750 mg oralt tre gange dagligt i 5 til 10 dage.
Pædiatriske patienter: 35 til 50 mg/kg/24 timer, opdelt i tre doser, oralt i 10 dage.
Anaerobe bakterielle infektioner
Ved behandling af de mest alvorlige anaerobe infektioner indgives intravenøs metronidazol sædvanligvis initialt.
Den sædvanlige orale dosis til voksne er 7,5 mg/kg hver sjette time (ca. 500 mg for en voksen på 70 kg). Et maksimum på 4 g bør ikke overskrides i en 24-timers periode.
Den sædvanlige behandlingsvarighed er 7 til 10 dage; infektioner i knogler og led, nedre luftveje og endokardium kan dog kræve længere behandling.
Dosisjusteringer
Patienter med svær leverinsufficiens
For patienter med svært nedsat leverfunktion (Child-Pugh C) bør dosis af FLAGYL reduceres med 50 % (se KLINISK FARMAKOLOGI og FORHOLDSREGLER ).
Patienter i hæmodialyse
Hæmodialyse fjerner betydelige mængder metronidazol og dets metabolitter fra den systemiske cirkulation. Clearance af metronidazol vil afhænge af den anvendte type dialysemembran, varigheden af dialysesessionen og andre faktorer. Hvis administrationen af metronidazol ikke kan adskilles fra hæmodialysesessionen, bør tilskud af metronidazoldosis efter hæmodialysesessionen overvejes, afhængigt af patientens kliniske situation (se KLINISK FARMAKOLOGI ).
HVORDAN LEVERET
FLAGYL 250 mg tabletterne er runde, blå, filmovertrukne, med SEARLE og 1831 præget på den ene side og FLAGYL og 250 på den anden side; leveres som flasker á 50 og 100 stk.
FLAGYL 500 mg tabletterne er aflange, blå, filmovertrukne, med FLAGYL præget på den ene side og 500 på den anden side; flasker á 50 og 100.
Opbevaring og stabilitet
Opbevares under 25°C (77°F) og beskyttes mod lys.
Distribueret af: Pfizer Labs, Division of Pfizre Inc., NY, NY 10017. Revideret: Dec 2021
BIVIRKNINGER
Følgende reaktioner er blevet rapporteret under behandling med metronidazol:
Centralnervesystemet
De mest alvorlige bivirkninger rapporteret hos patienter behandlet med metronidazol har været krampeanfald, encefalopati, aseptisk meningitis, optisk og perifer neuropati, sidstnævnte karakteriseret hovedsageligt af følelsesløshed eller paræstesi i en ekstremitet. Da vedvarende perifer neuropati er blevet rapporteret hos nogle patienter, der får langvarig administration af metronidazol, bør patienterne advares specifikt om disse reaktioner og skal fortælles om at stoppe med lægemidlet og straks rapportere til deres læge, hvis der opstår neurologiske symptomer. Derudover har patienter rapporteret hovedpine, synkope, svimmelhed, vertigo, ukoordination, ataksi, forvirring, dysartri, irritabilitet, depression, svaghed og søvnløshed (se ADVARSLER ).
Gastrointestinale
De mest almindelige rapporterede bivirkninger har været relateret til mave-tarmkanalen, især kvalme, nogle gange ledsaget af hovedpine, anoreksi og lejlighedsvis opkastning; diarré; epigastrisk nød; og mavekramper og forstoppelse.
Mund
En skarp, ubehagelig metallisk smag er ikke usædvanlig. Lodden tunge, glossitis og stomatitis er forekommet; disse kan være forbundet med en pludselig overvækst af Candida, som kan forekomme under behandlingen.
Dermatologisk
Erytematøst udslæt og kløe.
Hæmatopoietisk
Reversibel neutropeni (leukopeni); sjældent, reversibel trombocytopeni.
Kardiovaskulær
QT-forlængelse er blevet rapporteret, især når metronidazol blev administreret sammen med lægemidler med mulighed for at forlænge QT-intervallet. Udfladning af T-bølgen kan ses i elektrokardiografiske sporinger.
Overfølsomhed
Nældefeber, erytematøst udslæt, Stevens-Johnsons syndrom, toksisk epidermal nekrolyse, rødmen, tilstoppet næse, tørhed i munden (eller vagina eller vulva) og feber.
Renal
Dysuri, blærebetændelse, polyuri, inkontinens og en følelse af bækkentryk. Tilfælde af mørklagt urin er blevet rapporteret af ca. én patient ud af 100.000. Selvom pigmentet, som sandsynligvis er ansvarlig for dette fænomen, ikke er blevet positivt identificeret, er det næsten helt sikkert en metabolit af metronidazol og synes ikke at have nogen klinisk betydning.
Hepatisk
Tilfælde af alvorlig irreversibel levertoksicitet/akut leversvigt, herunder tilfælde med fatale udfald med meget hurtig indtræden efter påbegyndelse af systemisk brug af metronidazol, er blevet rapporteret hos patienter med Cockayne syndrom (latens fra lægemiddelstart til tegn på leversvigt så kort som 2 dage ) (se KONTRAINDIKATIONER ).
Andet
Spredning af Candida i skeden, dyspareuni, nedsat libido, proctitis og flygtige ledsmerter, der nogle gange ligner "serumsyge". Sjældne tilfælde af pancreatitis, som generelt aftog ved ophør med lægemidlet, er blevet rapporteret.
Patienter med Crohns sygdom er kendt for at have en øget forekomst af gastrointestinale og visse ekstraintestinale kræftformer. Der har været nogle rapporter i den medicinske litteratur om bryst- og tyktarmskræft hos patienter med Crohns sygdom, som er blevet behandlet med metronidazol i høje doser i længere perioder. Der er ikke etableret en årsag og virkning sammenhæng. Crohns sygdom er ikke en godkendt indikation for FLAGYL 200 mg tabletter.
DRUGSINTERAKTIONER
Disulfiram
Psykotiske reaktioner er blevet rapporteret hos alkoholiserede patienter, som bruger metronidazol og disulfiram samtidigt. Metronidazol bør ikke gives til patienter, der har taget disulfiram inden for de sidste to uger (se KONTRAINDIKATIONER ).
Alkoholiske drikkevarer
Mavekramper, kvalme, opkastning, hovedpine og rødmen kan forekomme, hvis alkoholholdige drikkevarer eller produkter, der indeholder propylenglycol, indtages under eller efter metronidazolbehandling (se KONTRAINDIKATIONER ).
Warfarin og andre orale antikoagulantia
Metronidazol er blevet rapporteret at forstærke den antikoagulerende virkning af warfarin og andre orale coumarinantikoagulanter, hvilket resulterer i en forlængelse af protrombintiden. Når FLAGYL ordineres til patienter i denne type antikoagulantbehandling, bør protrombintid og INR overvåges nøje.

Lithium
Hos patienter stabiliseret på relativt høje doser lithium er kortvarig metronidazolbehandling blevet forbundet med forhøjet serumlithium og i nogle få tilfælde tegn på lithiumtoksicitet. Serumlithium- og serumkreatininniveauer bør opnås flere dage efter påbegyndelse af metronidazol for at påvise enhver stigning, der kan gå forud for kliniske symptomer på lithiumforgiftning.
Busulfan
Metronidazol er blevet rapporteret at øge plasmakoncentrationerne af busulfan, hvilket kan resultere i en øget risiko for alvorlig busulfantoksicitet. Metronidazol bør ikke administreres samtidig med busulfan, medmindre fordelene opvejer risikoen. Hvis der ikke er tilgængelige terapeutiske alternativer til metronidazol, og samtidig administration med busulfan er medicinsk nødvendig, bør der udføres hyppig monitorering af busulfan-plasmakoncentrationen, og busulfandosis bør justeres i overensstemmelse hermed.
Lægemidler, der hæmmer CYP450-enzymer
Samtidig administration af lægemidler, der nedsætter mikrosomal leverenzymaktivitet, såsom cimetidin, kan forlænge halveringstiden og reducere plasmaclearance af metronidazol.
Lægemidler, der fremkalder CYP450-enzymer
Samtidig administration af lægemidler, der inducerer mikrosomale leverenzymer, såsom phenytoin eller phenobarbital, kan fremskynde elimineringen af metronidazol, hvilket resulterer i reducerede plasmaniveauer; nedsat clearance af phenytoin er også blevet rapporteret.
Lægemidler, der forlænger QT-intervallet
QT-forlængelse er blevet rapporteret, især når metronidazol blev administreret sammen med lægemidler med mulighed for at forlænge QT-intervallet.
ADVARSLER
Virkninger på det centrale og perifere nervesystem
Encefalopati og perifer neuropati: Tilfælde af encefalopati og perifer neuropati (inklusive optisk neuropati) er blevet rapporteret med metronidazol.
Encefalopati er blevet rapporteret i forbindelse med cerebellar toksicitet karakteriseret ved ataksi, svimmelhed og dysartri. CNS-læsioner set på MR er blevet beskrevet i rapporter om encefalopati. CNS-symptomer er generelt reversible inden for dage til uger efter seponering af metronidazol. CNS læsioner set på MR er også blevet beskrevet som reversible.
Perifer neuropati, hovedsagelig af sensorisk type, er blevet rapporteret og er karakteriseret ved følelsesløshed eller paræstesi i en ekstremitet.
Krampeanfald er blevet rapporteret hos patienter behandlet med metronidazol.
Aseptisk meningitis: Tilfælde af aseptisk meningitis er blevet rapporteret med metronidazol. Symptomer kan opstå inden for timer efter dosisadministration og forsvinder generelt efter seponering af metronidazolbehandling.
Forekomsten af unormale neurologiske tegn og symptomer kræver en hurtig evaluering af fordele/risiko-forholdet ved fortsættelse af behandlingen (se BIVIRKNINGER ).
FORHOLDSREGLER
Generel
Nedsat leverfunktion
Patienter med nedsat leverfunktion metaboliserer metronidazol langsomt, med deraf følgende akkumulering af metronidazol i plasma. Til patienter med svært nedsat leverfunktion (Child-Pugh C) anbefales en reduceret dosis af FLAGYL 400 mg. For patienter med let til moderat nedsat leverfunktion er dosisjustering ikke nødvendig, men disse patienter bør overvåges for metronidazol-relaterede bivirkninger (se KLINISK FARMAKOLOGI og DOSERING OG ADMINISTRATION ).
Nedsat nyrefunktion
Patienter med nyresygdom i slutstadiet kan udskille metronidazol og metabolitter langsomt i urinen, hvilket resulterer i betydelig akkumulering af metronidazolmetabolitter. Monitorering for metronidazol-relaterede bivirkninger anbefales (se KLINISK FARMAKOLOGI ).
Svampe superinfektioner
Kendt eller tidligere ikke-erkendt candidiasis kan give mere fremtrædende symptomer under behandling med FLAGYL og kræver behandling med et candidacidalt middel.
Brug hos patienter med bloddyskrasier
Metronidazol er en nitroimidazol og bør anvendes med forsigtighed til patienter med tegn på eller historie med bloddyskrasi. En mild leukopeni er blevet observeret under administrationen; der er dog ikke observeret vedvarende hæmatologiske abnormiteter, der kan tilskrives metronidazol, i kliniske undersøgelser. Totale og differentielle leukocyttal anbefales før og efter behandlingen.
Lægemiddelresistente bakterier og parasitter
Udskrivning af FLAGYL i fravær af en påvist eller stærkt mistænkt bakteriel eller parasitisk infektion eller en profylaktisk indikation vil sandsynligvis ikke give gavn for patienten og øger risikoen for udvikling af lægemiddelresistente bakterier og parasitter.
Interaktioner med lægemiddel/laboratorietest
Metronidazol kan interferere med visse typer af bestemmelser af serumkemiværdier, såsom aspartataminotransferase (AST, SGOT), alaninaminotransferase (ALT, SGPT), lactatdehydrogenase (LDH), triglycerider og glucosehexokinase. Værdier på nul kan observeres. Alle assays, hvor interferens er blevet rapporteret, involverer enzymatisk kobling af assayet til oxidationsreduktion af nikotinamid-adenindinukleotid (NAD+ NADH). Interferens skyldes ligheden i absorbanstoppe for NADH (340 nm) og metronidazol (322 nm) ved pH 7.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Tumorer, der påvirker lever, lunger, bryst- og lymfevæv, er blevet påvist i flere undersøgelser af metronidazol hos rotter og mus, men ikke hamstere.
Lungetumorer er blevet observeret i alle seks rapporterede undersøgelser med mus, inklusive en undersøgelse, hvor dyrene blev doseret på et intermitterende skema (kun administrering hver fjerde uge). Maligne levertumorer blev øget hos hanmus behandlet med ca. 1500 mg/m² (svarende til den maksimalt anbefalede daglige dosis, baseret på sammenligninger af kropsoverfladearealer). Maligne lymfomer og pulmonale neoplasmer blev også øget med livstids fodring af lægemidlet til mus. Mamma- og levertumorer var øget blandt hunrotter, der fik oralt metronidazol sammenlignet med samtidige kontroller. To livstidsstudier af tumorigenicitet hos hamstere er blevet udført og rapporteret at være negative.
Metronidazol har vist mutagen aktivitet i in vitro assaysystemer, herunder Ames-testen. Undersøgelser af pattedyr in vivo har ikke vist et potentiale for genetisk skade.
Metronidazol fremkaldte ikke nogen skadelig virkning på fertilitet eller testikelfunktion hos hanrotter ved doser op til 400 mg/kg/dag (svarende til den maksimalt anbefalede kliniske dosis, baseret på sammenligninger af kropsoverfladearealer) i 28 dage. Imidlertid var rotter behandlet med den samme dosis i 6 uger eller længere infertile og udviste alvorlig degeneration af sædepitel i testiklerne samt markant fald i antallet af testikelspermatider og epididymale sædceller. Fertiliteten blev genoprettet hos de fleste rotter efter en otte ugers medicinfri restitutionsperiode.
Graviditet
Teratogene virkninger
Der er ingen tilstrækkelige og velkontrollerede undersøgelser af FLAGYL hos gravide kvinder. Der er publicerede data fra case-kontrolstudier, kohortestudier og 2 metaanalyser, der omfatter mere end 5000 gravide kvinder, der brugte metronidazol under graviditeten. Mange undersøgelser inkluderede eksponeringer i første trimester. En undersøgelse viste en øget risiko for læbespalte, med eller uden ganespalte, hos spædbørn udsat for metronidazol in-utero; disse resultater blev dog ikke bekræftet. Derudover indskrev mere end ti randomiserede placebokontrollerede kliniske forsøg mere end 5000 gravide kvinder for at vurdere brugen af antibiotikabehandling (inklusive metronidazol) til bakteriel vaginose på forekomsten af præmatur fødsel. De fleste undersøgelser viste ikke en øget risiko for medfødte anomalier eller andre uønskede føtale resultater efter metronidazoleksponering under graviditet. Tre undersøgelser udført for at vurdere risikoen for spædbørnskræft efter eksponering for metronidazol under graviditet viste ikke en øget risiko; disse undersøgelsers evne til at detektere et sådant signal var imidlertid begrænset.
Metronidazol krydser placentabarrieren, og dets virkninger på den humane føtale organogenese er ikke kendt. Reproduktionsundersøgelser er blevet udført på rotter, kaniner og mus i doser svarende til den maksimalt anbefalede humane dosis baseret på sammenligninger af kropsoverfladearealer. Der var ingen tegn på skade på fosteret på grund af metronidazol.
Ammende mødre
Metronidazol er til stede i modermælk i koncentrationer svarende til moderens serumniveauer, og spædbørns serumniveauer kan være tæt på eller sammenlignelige med spædbørns terapeutiske niveauer. På grund af potentialet for tumorigenicitet vist for metronidazol hos mus og rotter
undersøgelser, bør der tages en beslutning om, hvorvidt sygeplejen skal afbrydes eller lægemidlet skal seponeres under hensyntagen til lægemidlets betydning for moderen. Alternativt kan en ammende mor vælge at pumpe og kassere modermælk under metronidazolbehandlingen og i 24 timer efter behandlingens ophør og fodre sit spædbarn med opbevaret modermælk eller modermælkserstatning.
Geriatrisk brug
Hos ældre geriatriske patienter anbefales monitorering for metronidazol-relaterede bivirkninger (se KLINISK FARMAKOLOGI , FORHOLDSREGLER ). Nedsat leverfunktion hos geriatriske patienter kan resultere i øgede koncentrationer af metronidazol, hvilket kan nødvendiggøre justering af metronidazoldosis (se DOSERING OG ADMINISTRATION ).
Pædiatrisk brug
Sikkerhed og effektivitet hos pædiatriske patienter er ikke blevet fastslået, undtagen for behandling af amebiasis.
OVERDOSIS
Enkelte orale doser af metronidazol, op til 15 g, er blevet rapporteret ved selvmordsforsøg og utilsigtede overdoser. De rapporterede symptomer omfatter kvalme, opkastning og ataksi.
Oral metronidazol er blevet undersøgt som en strålingssensibilisator i behandlingen af maligne tumorer. Neurotoksiske virkninger, herunder anfald og perifer neuropati, er blevet rapporteret efter 5 til 7 dage med doser på 6 til 10,4 g hver anden dag.
Behandling af overdosering
Der er ingen specifik modgift mod overdosering af metronidazol; Derfor bør behandlingen af patienten bestå af symptomatisk og understøttende terapi.
KONTRAINDIKATIONER
Overfølsomhed
FLAGYL tabletter er kontraindiceret til patienter med tidligere overfølsomhed over for metronidazol eller andre nitroimidazolderivater.
Hos patienter med trichomoniasis er FLAGYL 200 mg tabletter kontraindiceret under graviditetens første trimester (se FORHOLDSREGLER ).
Psykotisk reaktion med disulfiram
Brug af oral metronidazol er forbundet med psykotiske reaktioner hos alkoholiske patienter, som samtidig brugte disulfiram. Giv ikke metronidazol til patienter, der har taget disulfiram inden for de sidste to uger (se FORHOLDSREGLER , DRUGSINTERAKTIONER ).
Interaktion med alkohol
Brug af oral metronidazol er forbundet med en disulfiram-lignende reaktion på alkohol, herunder mavekramper, kvalme, opkastning, hovedpine og rødmen. Afbryd indtagelse af alkohol eller produkter indeholdende propylenglycol under og i mindst tre dage efter behandling med metronidazol (se FORHOLDSREGLER , DRUGSINTERAKTIONER ).
Cockayne syndrom
FLAGYL 400 mg tabletter er kontraindiceret til patienter med Cockayne syndrom. Svær irreversibel levertoksicitet/akut leversvigt med dødelig udgang er blevet rapporteret efter initiering af metronidazol hos patienter med Cockayne syndrom (se BIVIRKNINGER ).
KLINISK FARMAKOLOGI
Absorption
Disponeringen af metronidazol i kroppen er ens for både orale og intravenøse doseringsformer. Efter oral administration absorberes metronidazol godt, med maksimale plasmakoncentrationer mellem en og to timer efter administration.
Plasmakoncentrationer af metronidazol er proportionale med den administrerede dosis. Oral administration af 250 mg, 500 mg eller 2.000 mg gav maksimale plasmakoncentrationer på henholdsvis 6 mcg/ml, 12 mcg/ml og 40 mcg/ml. Undersøgelser viser ingen signifikante biotilgængelighedsforskelle mellem mænd og kvinder; men på grund af vægtforskelle er de resulterende plasmaniveauer hos mænd generelt lavere.
Fordeling
Metronidazol er den vigtigste komponent, der forekommer i plasmaet, og mindre mængder af metabolitter er også til stede. Mindre end 20 % af den cirkulerende metronidazol er bundet til plasmaproteiner. Metronidazol forekommer i cerebrospinalvæske, spyt og modermælk i koncentrationer svarende til dem, der findes i plasma. Baktericide koncentrationer af metronidazol er også blevet påvist i pus fra leverabscesser.
Metabolisme/udskillelse
Den vigtigste eliminationsvej for metronidazol og dets metabolitter er via urinen (60 % til 80 % af dosis), hvor fækal udskillelse udgør 6 % til 15 % af dosis. De metabolitter, der optræder i urinen, skyldes primært sidekædeoxidation [1-(ßhydroxyethyl)-2-hydroxymethyl-5-nitroimidazol og 2-methyl-5-nitroimidazol-1-yleddikesyre] og glucuronidkonjugering, med uændret metronidazolregnskab for cirka 20 % af det samlede beløb. Både moderforbindelsen og hydroxylmetabolitten har in vitro antimikrobiel aktivitet.
Renal clearance af metronidazol er ca. 10 ml/min/1,73 m². Den gennemsnitlige eliminationshalveringstid for metronidazol hos raske forsøgspersoner er otte timer.
Nedsat nyrefunktion
Nedsat nyrefunktion ændrer ikke enkeltdosis-farmakokinetikken af metronidazol.
Forsøgspersoner med nyresygdom i slutstadiet (ESRD; CLCR= 8,1±9,1 ml/min) og som fik en enkelt intravenøs infusion af metronidazol 500 mg havde ingen signifikant ændring i metronidazols farmakokinetik, men havde 2 gange højere Cmax for hydroxy-metronidazol og 5 - gange højere Cmax for metronidazolacetat sammenlignet med raske forsøgspersoner med normal nyrefunktion (CLCR= 126±16 ml/min). På grund af den potentielle akkumulering af metronidazolmetabolitter hos ESRD-patienter anbefales monitorering for metronidazolassocierede bivirkninger (se FORHOLDSREGLER ).
Effekt af dialyse
Efter en enkelt intravenøs infusion eller oral dosis af metronidazol 500 mg blev clearance af metronidazol undersøgt hos ESRD-personer, der gennemgår hæmodialyse eller kontinuerlig ambulatorisk peritonealdialyse (CAPD). En hæmodialysesession, der varede i 4 til 8 timer, fjernede 40 % til 65 % af den administrerede metronidazoldosis, afhængigt af den anvendte type dialysemembran og varigheden af dialysesessionen. Hvis administrationen af metronidazol ikke kan adskilles fra dialysesessionen, bør tilskud af metronidazoldosis efter hæmodialyse overvejes (se DOSERING OG ADMINISTRATION ). En peritonealdialysesession, der varede i 7,5 timer, fjernede ca. 10 % af den administrerede metronidazoldosis. Der er ikke behov for justering af metronidazoldosis hos ESRD-patienter, der gennemgår CAPD.
Nedsat leverfunktion
Efter en enkelt intravenøs infusion af 500 mg metronidazol var den gennemsnitlige AUC24 for metronidazol højere med 114 % hos patienter med svær (Child-Pugh C) nedsat leverfunktion og med 54 % og 53 % hos patienter med mild (Child-Pugh A). og moderat (Child-Pugh B) leverinsufficiens, henholdsvis sammenlignet med raske kontrolpersoner. Der var ingen signifikante ændringer i AUC24 for hydroxyl-metronidazol hos disse patienter med nedsat leverfunktion. En reduktion af metronidazoldosis med 50 % anbefales til patienter med svær (Child-Pugh C) nedsat leverfunktion (se DOSERING OG ADMINISTRATION ). Dosisjustering er ikke nødvendig for patienter med let til moderat nedsat leverfunktion. Patienter med let til moderat nedsat leverfunktion skal overvåges for metronidazol-relaterede bivirkninger (se FORHOLDSREGLER og DOSERING OG ADMINISTRATION ).
Geriatriske patienter
Efter en enkelt 500 mg oral eller IV-dosis af metronidazol havde forsøgspersoner >70 år uden tilsyneladende nyre- eller leverdysfunktion en 40 % til 80 % højere gennemsnitlig AUC for hydroxy-metronidazol (aktiv metabolit), uden nogen tilsyneladende stigning i gennemsnittet AUC for metronidazol (moderforbindelse) sammenlignet med unge raske kontroller FORHOLDSREGLER ).
Pædiatriske patienter
I en undersøgelse så nyfødte spædbørn ud til at vise nedsat evne til at eliminere metronidazol. Eliminationshalveringstiden, målt i løbet af de første 3 dage af livet, var omvendt relateret til gestationsalderen. Hos spædbørn, hvis svangerskabsalder var mellem 28 og 40 uger, varierede de tilsvarende eliminationshalveringstider fra 109 til 22,5 timer.
Mikrobiologi
Handlingsmekanisme
Metronidazol, en nitroimidazol, udøver antibakterielle virkninger i et anaerobt miljø mod de fleste obligate anaerober. Når først metronidazol kommer ind i organismen ved passiv diffusion og aktiveres i cytoplasmaet af modtagelige anaerobe bakterier, reduceres det; denne proces omfatter intracellulære elektrontransportproteiner såsom ferredoxin, overførsel af en elektron til nitrogruppen i metronidazolen og dannelse af et kortlivet nitroso-frit radikal. På grund af denne ændring af metronidazolmolekylet skabes og opretholdes en koncentrationsgradient, som fremmer lægemidlets intracellulære transport. Den reducerede form af metronidazol og frie radikaler kan interagere med DNA, hvilket fører til hæmning af DNA-syntese og DNA-nedbrydning, der fører til bakteriens død. Den præcise virkningsmekanisme af metronidazol er uklar.
Modstand
Der er et potentiale for udvikling af resistens mod metronidazol.
Resistens kan skyldes flere mekanismer, som omfatter nedsat optagelse af lægemidlet, ændret reduktionseffektivitet, overekspression af effluxpumperne, inaktivering af lægemidlet og/eller øget reparation af DNA-skader.
Metronidazol har ingen klinisk relevant aktivitet mod fakultative anaerober eller obligate aerober.
Antimikrobiel aktivitet
Metronidazol har vist sig at være aktiv mod de fleste isolater af følgende bakterier både in vitro og ved kliniske infektioner som beskrevet i afsnittet INDIKATIONER OG ANVENDELSE.
Gram-positive Anaerober
Clostridium-arter Eubacterium-arter Peptococcus-arter Peptostreptokok-arter
Gram-negative aaerober
Bacteroides fragilis gruppe (B. fragilis, B. distasonis, B. ovatus, B. thetaiotaomicron, B.vulgatus) Fusobacterium arter
Protozoal parasitter
Entamoeba histolytica Trichomonas vaginalis
Følgende in vitro-data er tilgængelige, men deres kliniske betydning er ukendt:
Metronidazol udviser in vitro minimale hæmmende koncentrationer (MIC'er) på 8 mcg/ml eller mindre mod de fleste (≥ 90%) isolater af følgende bakterier; Sikkerheden og effektiviteten af metronidazol til behandling af kliniske infektioner på grund af disse bakterier er imidlertid ikke blevet fastslået i tilstrækkelige og velkontrollerede kliniske forsøg.
Gram-negative Anaerober
Bacteroides fragilis gruppe (B. caccae, B. uniformis) Prevotella arter (P. bivia, P. buccae, P. disiens)
Modtagelighedstest
For specifik information om fortolkningskriterier for følsomhedstest og tilhørende testmetoder og kvalitetskontrolstandarder anerkendt af FDA for dette lægemiddel, se venligst: https://www.fda.gov/STIC.
PATIENTOPLYSNINGER
Interaktion med alkohol
Stop indtagelsen af alkoholholdige drikkevarer eller produkter, der indeholder propylenglycol, mens du tager FLAGYL 400 mg og i mindst tre dage derefter, fordi mavekramper, kvalme, opkastning, hovedpine og rødmen kan forekomme (se KONTRAINDIKATIONER og FORHOLDSREGLER , DRUGSINTERAKTIONER ).
Behandling af bakterielle og parasitære infektioner
Patienter bør rådgives om, at FLAGYL 400 mg kun bør anvendes til behandling af bakterielle og parasitære infektioner. FLAGYL 400mg behandler ikke virusinfektioner (f.eks. forkølelse). Når FLAGYL ordineres til behandling af en bakteriel infektion, skal patienterne fortælles, at selvom det er almindeligt at føle sig bedre tidligt i behandlingsforløbet, skal medicinen tages nøjagtigt som anvist. At springe doser over eller ikke fuldføre hele behandlingsforløbet kan (1) mindske effektiviteten af den øjeblikkelige behandling og (2) øge sandsynligheden for, at bakterier udvikler resistens og ikke vil kunne behandles med FLAGYL 400 mg i fremtiden.
