Zyprexa 2.5mg, 5mg, 7.5mg, 10mg, 15mg, 20mg Olanzapine Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Zyprexa 10mg, og hvordan bruges det?
Zyprexa er en receptpligtig medicin, der bruges til at behandle symptomerne på skizofreni og bipolar lidelse (manisk depression). Zyprexa kan bruges alene eller sammen med anden medicin.
- Zyprexa tilhører en klasse af lægemidler kaldet antipsykotika, 2. generation, antimaniske midler.
- Det vides ikke, om Zyprexa er sikkert og effektivt til børn under 13 år.
Hvad er de mulige bivirkninger af Zyprexa 15mg?
Zyprexa kan forårsage alvorlige bivirkninger, herunder:
- ukontrollerede muskelbevægelser i dit ansigt (tygge, læbesmaske, rynke panden, tungebevægelse, blinke eller øjenbevægelser),
- problemer med at tale eller synke,
- hævelse i hænder eller fødder,
- forvirring,
- usædvanlige tanker eller adfærd,
- hallucinationer,
- tanker om at skade dig selv,
- pludselig svaghed eller dårlig følelse,
- feber,
- kuldegysninger,
- ondt i halsen,
- hævede tandkød,
- smertefulde sår i munden,
- smerter ved synke,
- hudsår,
- symptomer på forkølelse eller influenza,
- hoste,
- føler dig meget tørstig eller varm,
- manglende evne til at tisse,
- kraftig svedtendens,
- varm eller tør hud,
- smerter i øvre mave,
- kløe,
- mistet appetiten,
- mørk urin,
- lerfarvede afføring,
- gulfarvning af huden eller øjnene (gulsot),
- øget tørst,
- øget vandladning,
- sult,
- tør mund,
- frugtig ånde lugt,
- døsighed,
- sløret syn,
- vægttab,
- meget stive muskler,
- høj feber,
- forvirring,
- hurtige eller ujævne hjerteslag,
- rystelser, og
- svimmelhed
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Zyprexa omfatter:
- vægtøgning (mere almindelig hos teenagere),
- øget appetit,
- hovedpine,
- svimmelhed,
- døsighed,
- føler sig træt eller rastløs,
- problemer med tale eller hukommelse,
- rysten eller rysten,
- følelsesløshed eller prikkende følelse,
- personlighedsændringer,
- tør mund,
- øget spytudskillelse,
- mavesmerter,
- forstoppelse, og
- smerter i dine arme eller ben
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Zyprexa. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
ØGET DØDELIGHED HOS ÆLDRE PATIENTER MED DEMENSREATERET PSYKOSE
Ældre patienter med demensrelateret psykose behandlet med antipsykotiske lægemidler har en øget risiko for at dø. Analyser af 17 placebokontrollerede forsøg (modal varighed på 10 uger), hovedsageligt hos patienter, der tog atypiske antipsykotiske lægemidler, viste en risiko for død hos lægemiddelbehandlede patienter på mellem 1,6 og 1,7 gange risikoen for død hos placebobehandlede patienter. I løbet af et typisk 10-ugers kontrolleret forsøg var dødsraten hos lægemiddelbehandlede patienter omkring 4,5 % sammenlignet med en rate på omkring 2,6 % i placebogruppen. Selvom dødsårsagerne var forskellige, så de fleste af dødsfaldene ud til at være enten kardiovaskulære (f.eks. hjertesvigt, pludselig død) eller infektiøse (f.eks. lungebetændelse) i naturen. Observationsstudier tyder på, at behandling med konventionelle antipsykotiske lægemidler i lighed med atypiske antipsykotiske lægemidler kan øge dødeligheden. Det er ikke klart, i hvilket omfang resultaterne af øget dødelighed i observationsstudier kan tilskrives det antipsykotiske lægemiddel i modsætning til nogle karakteristika hos patienterne. ZYPREXA (olanzapin) er ikke godkendt til behandling af patienter med demensrelateret psykose [se ADVARSLER OG FORHOLDSREGLER og PATIENTOPLYSNINGER ].
Når du bruger ZYPREXA 15mg og fluoxetin i kombination, henvises der også til afsnittet Advarselsboks i indlægssedlen til Symbyax.
BESKRIVELSE
ZYPREXA (olanzapin) er et atypisk antipsykotikum, der tilhører thienobenzodiazepin-klassen. Den kemiske betegnelse er 2-methyl-4-(4-methyl-1-piperazinyl)-10H-thieno[2,3-b] [1,5]benzodiazepin. Molekylformlen er C17H20N4S, hvilket svarer til en molekylvægt på 312,44. Den kemiske struktur er:
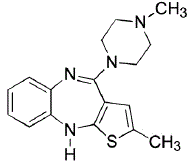
Olanzapin er et gult krystallinsk fast stof, som er praktisk talt uopløseligt i vand.
ZYPREXA 7,5 mg tabletter er kun beregnet til oral administration.
Hver tablet indeholder olanzapin svarende til 2,5 mg (8 μmol), 5 mg (16 μmol), 7,5 mg (24 μmol), 10 mg (32 μmol), 15 mg (48 μmol) eller 20 mg (64 μmol). Inaktive ingredienser er carnaubavoks, crospovidon, hydroxypropylcellulose, hypromellose, lactose, magnesiumstearat, mikrokrystallinsk cellulose og andre inaktive ingredienser. Farvebelægningen indeholder titandioxid (alle styrker), FD&C Blue No. 2 Aluminium Lake (15 mg) eller syntetisk rød jernoxid (20 mg). Tabletterne på 2,5, 5, 7,5 og 10 mg er præget med spiselig blæk, som indeholder FD&C Blue No. 2 Aluminium Lake.
ZYPREXA 2,5 mg ZYDIS (olanzapin oralt disintegrerende tabletter) er kun beregnet til oral administration.
Hver oralt desintegrerende tablet indeholder olanzapin svarende til 5 mg (16 μmol), 10 mg (32 μmol), 15 mg (48 μmol) eller 20 mg (64 μmol). Det begynder at gå i opløsning i munden inden for få sekunder, så dets indhold efterfølgende kan synkes med eller uden væske. ZYPREXA 15mg ZYDIS (olanzapin oralt disintegrerende tabletter) indeholder også følgende inaktive ingredienser: gelatine, mannitol, aspartam, natriummethylparaben og natriumpropylparaben.
ZYPREXA 2,5 mg IntraMuscular (olanzapin til injektion) er kun beregnet til intramuskulær brug.
Hvert hætteglas giver mulighed for administration af 10 mg (32 μmol) olanzapin med inaktive ingredienser 50 mg lactosemonohydrat og 3,5 mg vinsyre. Saltsyre og/eller natriumhydroxid kan være blevet tilsat under fremstillingen for at justere pH.
INDIKATIONER
Skizofreni
Oral ZYPREXA er indiceret til behandling af skizofreni. Effekten blev fastslået i tre kliniske forsøg med voksne patienter med skizofreni: to 6-ugers forsøg og et vedligeholdelsesstudie. Hos unge patienter med skizofreni (i alderen 13-17) blev effekten fastslået i et 6-ugers forsøg [se Kliniske Studier ].
Når der skal vælges blandt de alternative behandlinger, der er tilgængelige for unge, bør klinikere overveje det øgede potentiale (hos teenagere sammenlignet med voksne) for vægtøgning og dyslipidæmi. Klinikere bør overveje de potentielle langsigtede risici, når de ordinerer til unge, og i mange tilfælde kan dette få dem til at overveje at ordinere andre lægemidler først til unge [se ADVARSLER OG FORHOLDSREGLER ].
Bipolar I-lidelse (maniske eller blandede episoder)
Monoterapi
Oral ZYPREXA er indiceret til akut behandling af maniske eller blandede episoder forbundet med bipolar I lidelse og vedligeholdelsesbehandling af bipolar I lidelse. Effekten blev fastslået i tre kliniske undersøgelser med voksne patienter med maniske eller blandede episoder af bipolar I lidelse: to 3- til 4-ugers forsøg og et monoterapi vedligeholdelsesstudie. Hos unge patienter med maniske eller blandede episoder forbundet med bipolar I-lidelse (i alderen 13-17), blev effekten fastslået i et 3-ugers forsøg [se Kliniske Studier ].
Når der skal vælges blandt de alternative behandlinger, der er tilgængelige for unge, bør klinikere overveje det øgede potentiale (hos teenagere sammenlignet med voksne) for vægtøgning og dyslipidæmi. Klinikere bør overveje de potentielle langsigtede risici, når de ordinerer til unge, og i mange tilfælde kan dette få dem til at overveje at ordinere andre lægemidler først til unge [se ADVARSLER OG FORHOLDSREGLER ].
Supplerende terapi til lithium eller valproat
Oral ZYPREXA 5mg er indiceret til behandling af maniske eller blandede episoder forbundet med bipolar I lidelse som et supplement til lithium eller valproat. Effekten blev fastslået i to 6-ugers kliniske forsøg med voksne. Effektiviteten af supplerende terapi til længerevarende brug er ikke blevet systematisk evalueret i kontrollerede forsøg [se Kliniske Studier ].
Særlige overvejelser ved behandling af pædiatrisk skizofreni og bipolar lidelse I
Pædiatrisk skizofreni og bipolar lidelse I er alvorlige psykiske lidelser; diagnose kan dog være udfordrende. For pædiatrisk skizofreni kan symptomprofiler være variable, og for bipolar I-lidelse kan pædiatriske patienter have varierende mønstre af periodicitet af maniske eller blandede symptomer. Det anbefales, at medicinbehandling til pædiatrisk skizofreni og bipolar lidelse I først påbegyndes, efter at der er foretaget en grundig diagnostisk evaluering og nøje overvejet de risici, der er forbundet med medicinbehandling. Medicinbehandling af både pædiatrisk skizofreni og bipolar lidelse I bør være en del af et samlet behandlingsprogram, der ofte omfatter psykologiske, pædagogiske og sociale interventioner.
ZYPREXA 15 mg intramuskulært: Agitation forbundet med skizofreni og bipolar I-mani
ZYPREXA 15mg IntraMuscular er indiceret til behandling af akut agitation forbundet med skizofreni og bipolar I-mani.
Effekten blev påvist i 3 kortvarige (24 timers IM-behandling) placebokontrollerede forsøg med ophidsede voksne indlagte patienter med: skizofreni eller bipolar I-lidelse (maniske eller blandede episoder) [se Kliniske Studier ].
"Psykomotorisk agitation" er defineret i DSM-IV som "overdreven motorisk aktivitet forbundet med en følelse af indre spænding." Patienter, der oplever agitation, udviser ofte adfærd, der forstyrrer deres diagnose og pleje, f.eks. truende adfærd, eskalerende eller akut forstyrrende adfærd eller selvudmattende adfærd, hvilket fører klinikere til at bruge intramuskulær antipsykotisk medicin for at opnå øjeblikkelig kontrol over agitationen.
ZYPREXA og fluoxetin i kombination: Depressive episoder forbundet med bipolar I-lidelse
Oral ZYPREXA og fluoxetin i kombination er indiceret til behandling af depressive episoder forbundet med bipolar lidelse I, baseret på kliniske undersøgelser. Når du bruger ZYPREXA 10 mg og fluoxetin i kombination, henvises til afsnittet om kliniske undersøgelser i indlægssedlen til Symbyax.
ZYPREXA monoterapi er ikke indiceret til behandling af depressive episoder forbundet med bipolar I lidelse.
ZYPREXA og fluoxetin i kombination: behandlingsresistent depression
Oral ZYPREXA og fluoxetin i kombination er indiceret til behandling af behandlingsresistent depression (svær depressiv lidelse hos patienter, der ikke reagerer på 2 separate forsøg med forskellige antidepressiva af passende dosis og varighed i den aktuelle episode), baseret på kliniske undersøgelser hos voksne patienter . Når du bruger ZYPREXA og fluoxetin i kombination, henvises til afsnittet om kliniske undersøgelser i indlægssedlen til Symbyax.
ZYPREXA 5 mg monoterapi er ikke indiceret til behandling af behandlingsresistent depression.
DOSERING OG ADMINISTRATION
Skizofreni
Voksne
Dosisvalg
Oral olanzapin bør administreres én gang dagligt uden hensyntagen til måltider, normalt begyndende med 5 til 10 mg initialt, med en måldosis på 10 mg/dag inden for flere dage. Yderligere dosisjusteringer, hvis indiceret, bør generelt forekomme med intervaller på ikke mindre end 1 uge, da steady state for olanzapin ikke ville blive opnået i ca. 1 uge hos den typiske patient. Når dosisjustering er nødvendig, anbefales dosisstigninger/-reduktioner på 5 mg én gang daglig.
Effektivitet ved skizofreni blev påvist i et dosisområde på 10 til 15 mg/dag i kliniske forsøg. Doser over 10 mg/dag blev dog ikke vist at være mere effektive end dosis på 10 mg/dag. En stigning til en dosis større end måldosis på 10 mg/dag (dvs. til en dosis på 15 mg/dag eller mere) anbefales kun efter klinisk vurdering. Olanzapin er ikke indiceret til brug i doser over 20 mg/dag.
Dosering i særlige populationer
Den anbefalede startdosis er 5 mg til patienter, der er svækkede, som har en disposition for hypotensive reaktioner, som ellers udviser en kombination af faktorer, der kan resultere i langsommere metabolisme af olanzapin (f.eks. ikke-ryger kvindelige patienter ≥65 år), eller som kan være mere farmakodynamisk følsomme over for olanzapin [se ADVARSLER OG FORHOLDSREGLER , DRUGSINTERAKTIONER , og KLINISK FARMAKOLOGI ]. Når det er indiceret, bør dosiseskalering udføres med forsigtighed hos disse patienter.
Vedligeholdelsesbehandling
Effektiviteten af oral olanzapin, 10 mg/dag til 20 mg/dag, til at opretholde behandlingsrespons hos skizofrene patienter, som havde været stabile på ZYPREXA i ca. 8 uger og derefter blev fulgt for tilbagefald, er blevet påvist i et placebokontrolleret forsøg [se Kliniske Studier ]. Den sundhedsudbyder, der vælger at bruge ZYPREXA i længere perioder, bør med jævne mellemrum revurdere lægemidlets langsigtede anvendelighed for den enkelte patient.
Teenagere
Dosisvalg
Oral olanzapin bør administreres én gang dagligt uden hensyntagen til måltider med en anbefalet startdosis på 2,5 eller 5 mg, med en måldosis på 10 mg/dag. Effekt hos unge med skizofreni blev påvist baseret på et fleksibelt dosisområde på 2,5 til 20 mg/dag i kliniske forsøg med en gennemsnitlig modal dosis på 12,5 mg/dag (gennemsnitlig dosis på 11,1 mg/dag). Når dosisjustering er nødvendig, anbefales dosisstigninger/-reduktioner på 2,5 eller 5 mg.
Sikkerheden og effektiviteten af doser over 20 mg/dag er ikke blevet evalueret i kliniske forsøg [se Kliniske Studier ].
Vedligeholdelsesbehandling
Effekten af ZYPREXA til vedligeholdelsesbehandling af skizofreni i den unge population er ikke blevet systematisk evalueret; Vedligeholdelseseffektivitet kan dog ekstrapoleres fra voksnes data sammen med sammenligninger af olanzapins farmakokinetiske parametre hos voksne og unge patienter. Det anbefales derfor generelt, at responderende patienter fortsættes ud over det akutte respons, men med den laveste dosis, der er nødvendig for at opretholde remission. Patienter bør periodisk revurderes for at fastslå behovet for vedligeholdelsesbehandling.
Bipolar I-lidelse (maniske eller blandede episoder)
Voksne
Dosisvalg til monoterapi
Oral olanzapin bør administreres én gang om dagen uden hensyntagen til måltider, normalt begyndende med 10 eller 15 mg. Dosisjusteringer, hvis indiceret, bør generelt ske med intervaller på ikke mindre end 24 timer, hvilket afspejler procedurerne i de placebokontrollerede forsøg. Når dosisjustering er nødvendig, anbefales dosisstigninger/-reduktioner på 5 mg én gang daglig.
Kortvarig (3-4 uger) antimanisk effekt blev påvist i et dosisområde på 5 mg til 20 mg/dag i kliniske forsøg. Sikkerheden ved doser over 20 mg/dag er ikke blevet evalueret i kliniske forsøg [se Kliniske Studier ].
Vedligeholdelse Monoterapi
Fordelen ved at opretholde bipolar I-patienter i monoterapi med oral ZYPREXA 10 mg i en dosis på 5 til 20 mg/dag, efter at have opnået en responderstatus i en gennemsnitlig varighed på 2 uger, blev påvist i et kontrolleret forsøg [se Kliniske Studier ]. Den sundhedsudbyder, der vælger at bruge ZYPREXA i længere perioder, bør med jævne mellemrum revurdere lægemidlets langsigtede anvendelighed for den enkelte patient.
Dosisvalg til supplerende behandling
Når det administreres som supplerende behandling til lithium eller valproat, bør oral olanzapin-dosering generelt begynde med 10 mg én gang dagligt uden hensyntagen til måltider.
Antimanisk effekt blev påvist i et dosisområde på 5 mg til 20 mg/dag i kliniske forsøg [se Kliniske Studier ]. Sikkerheden ved doser over 20 mg/dag er ikke blevet evalueret i kliniske forsøg.
Teenagere
Dosisvalg
Oral olanzapin bør administreres én gang dagligt uden hensyntagen til måltider med en anbefalet startdosis på 2,5 eller 5 mg, med en måldosis på 10 mg/dag. Effekt hos unge med bipolar lidelse I (maniske eller blandede episoder) blev påvist baseret på et fleksibelt dosisområde på 2,5 til 20 mg/dag i kliniske forsøg med en gennemsnitlig modal dosis på 10,7 mg/dag (gennemsnitlig dosis på 8,9 mg/dag ). Når dosisjustering er nødvendig, anbefales dosisstigninger/-reduktioner på 2,5 eller 5 mg.
Sikkerheden og effektiviteten af doser over 20 mg/dag er ikke blevet evalueret i kliniske forsøg [se Kliniske Studier ].
Vedligeholdelsesbehandling
Effekten af ZYPREXA 7,5 mg til vedligeholdelsesbehandling af bipolar I lidelse i den unge population er ikke blevet evalueret; Vedligeholdelseseffektivitet kan dog ekstrapoleres fra voksnes data sammen med sammenligninger af olanzapins farmakokinetiske parametre hos voksne og unge patienter. Det anbefales derfor generelt, at responderende patienter fortsættes ud over det akutte respons, men med den laveste dosis, der er nødvendig for at opretholde remission. Patienter bør periodisk revurderes for at fastslå behovet for vedligeholdelsesbehandling.
Administration af ZYPREXA ZYDIS (olanzapin oralt desintegrerende tabletter)
Efter åbning af posen, skræl folien tilbage på blisterpakningen. Skub ikke tabletten gennem folie. Umiddelbart efter åbning af blisterpakningen skal du med tørre hænder fjerne tabletten og placere hele ZYPREXA 15 mg ZYDIS i munden. Tablettens opløsning sker hurtigt i spyt, så det nemt kan sluges med eller uden væske.
ZYPREXA Intramuskulær: Agitation forbundet med skizofreni og bipolar I-mani
Dosisvalg til agiterede voksne patienter med skizofreni og bipolar I-mani
Effekten af intramuskulært olanzapin til injektion til at kontrollere agitation ved disse lidelser blev påvist i et dosisområde på 2,5 mg til 10 mg. Den anbefalede dosis til disse patienter er 10 mg. En lavere dosis på 5 eller 7,5 mg kan overvejes, når kliniske faktorer berettiger det [se Kliniske Studier ]. Hvis agitation, der berettiger yderligere intramuskulære doser, fortsætter efter den indledende dosis, kan efterfølgende doser på op til 10 mg gives. Effekten af gentagne doser af intramuskulær olanzapin til injektion hos ophidsede patienter er imidlertid ikke blevet systematisk evalueret i kontrollerede kliniske forsøg. Desuden er sikkerheden ved samlede daglige doser på over 30 mg eller 10 mg injektioner givet hyppigere end 2 timer efter den indledende dosis og 4 timer efter den anden dosis ikke blevet evalueret i kliniske forsøg. Maksimal dosering af intramuskulært olanzapin (f.eks. 3 doser á 10 mg administreret med 2-4 timers mellemrum) kan være forbundet med en væsentlig forekomst af signifikant ortostatisk hypotension [se ADVARSLER OG FORHOLDSREGLER ]. Det anbefales derfor, at patienter, der har behov for efterfølgende intramuskulære injektioner, vurderes for ortostatisk hypotension før administration af eventuelle efterfølgende doser af intramuskulær olanzapin til injektion. Administration af en yderligere dosis til en patient med en klinisk signifikant postural ændring i systolisk blodtryk anbefales ikke.
Hvis igangværende olanzapinbehandling er klinisk indiceret, kan oral olanzapin påbegyndes i et interval på 5-20 mg/dag, så snart det er klinisk relevant [se Skizofreni og Bipolar I-lidelse (maniske eller blandede episoder) ].
Intramuskulær dosering i særlige populationer
En dosis på 5 mg/injektion bør overvejes til geriatriske patienter, eller når andre kliniske faktorer berettiger det. En lavere dosis på 2,5 mg/injektion bør overvejes til patienter, som ellers kunne være svækkede, være disponerede for hypotensive reaktioner eller være mere farmakodynamisk følsomme over for olanzapin [se ADVARSLER OG FORHOLDSREGLER , DRUGSINTERAKTIONER , og KLINISK FARMAKOLOGI ].
Administration af ZYPREXA intramuskulært
ZYPREXA Intra Muscular er kun beregnet til intramuskulær brug. Må ikke administreres intravenøst eller subkutant. Injicer langsomt, dybt ind i muskelmassen. Parenterale lægemidler bør inspiceres visuelt for partikler og misfarvning før administration, når opløsning og beholder tillader det.
Vejledning til fremstilling af ZYPREXA 2,5 mg intramuskulært med sterilt vand til injektion
Opløs indholdet af hætteglasset med 2,1 ml sterilt vand til injektion for at give en opløsning, der indeholder ca. 5 mg/ml olanzapin. Den resulterende opløsning skal fremstå klar og gul. ZYPREXA 7,5 mg intramuskulært rekonstitueret med sterilt vand til injektion skal anvendes umiddelbart (inden for 1 time) efter rekonstitution. Kassér enhver ubrugt portion.
Følgende tabel viser injektionsvolumener til levering af forskellige doser af intramuskulært olanzapin til injektion rekonstitueret med sterilt vand til injektion.
Oplysninger om fysisk uforenelighed
ZYPREXA 15mg IntraMuscular bør kun rekonstitueres med sterilt vand til injektion. ZYPREXA 20mg IntraMuscular bør ikke kombineres i en sprøjte med diazepam-injektion, da der forekommer udfældning, når disse produkter blandes. Lorazepam-injektion bør ikke bruges til at rekonstituere ZYPREXA IntraMuscular, da denne kombination resulterer i en forsinket rekonstitutionstid. ZYPREXA IntraMuscular bør ikke kombineres i en sprøjte med haloperidol-injektion, da den resulterende lave pH-værdi har vist sig at nedbryde olanzapin over tid.
ZYPREXA 20mg og fluoxetin i kombination: Depressive episoder forbundet med bipolar I-lidelse
Når du bruger ZYPREXA 7,5 mg og fluoxetin i kombination, se også afsnittet om kliniske undersøgelser i indlægssedlen til Symbyax.
Voksne
Oral olanzapin bør administreres i kombination med fluoxetin én gang dagligt om aftenen, uden hensyntagen til måltider, normalt begyndende med 5 mg oral olanzapin og 20 mg fluoxetin. Dosisjusteringer, hvis det er indiceret, kan foretages i henhold til effekt og tolerabilitet inden for dosisintervaller for oral olanzapin 5 til 12,5 mg og fluoxetin 20 til 50 mg. Antidepressiv effekt blev påvist med ZYPREXA 10 mg og fluoxetin i kombination hos voksne patienter med et dosisområde på olanzapin 6 til 12 mg og fluoxetin 25 til 50 mg. Sikkerheden ved samtidig administration af doser over 18 mg olanzapin og 75 mg fluoxetin er ikke blevet evalueret i kliniske studier.
Børn og unge (10-17 år)
Oral olanzapin bør administreres i kombination med fluoxetin én gang dagligt om aftenen, uden hensyntagen til måltider, normalt begyndende med 2,5 mg oral olanzapin og 20 mg fluoxetin. Dosisjusteringer, hvis indiceret, kan foretages i henhold til effektivitet og tolerabilitet. Sikkerheden ved samtidig administration af doser over 12 mg olanzapin og 50 mg fluoxetin er ikke blevet evalueret i pædiatriske kliniske undersøgelser.
Sikkerhed og effekt af ZYPREXA og fluoxetin i kombination blev bestemt i kliniske forsøg, der understøttede godkendelse af Symbyax (fast dosiskombination af ZYPREXA og fluoxetin). Symbyax doseres mellem 3 mg/25 mg (olanzapin/fluoxetin) pr. dag og 12 mg/50 mg (olanzapin/fluoxetin) pr. dag. Følgende tabel viser de passende individuelle komponentdoser af ZYPREXA 10 mg og fluoxetin versus Symbyax. Dosisjusteringer, hvis indiceret, bør foretages med de individuelle komponenter i henhold til effektivitet og tolerabilitet.
Selvom der ikke er noget bevismateriale til at besvare spørgsmålet om, hvor længe en patient behandlet med ZYPREXA og fluoxetin i kombination skal forblive på det, er det generelt accepteret, at bipolar I-lidelse, inklusive de depressive episoder forbundet med bipolar I-lidelse, er en kronisk sygdom, der kræver kronisk behandling. Sygeplejersken bør med jævne mellemrum revurdere behovet for fortsat farmakoterapi.
ZYPREXA 5 mg monoterapi er ikke indiceret til behandling af depressive episoder forbundet med bipolar I lidelse.
ZYPREXA 7,5 mg og fluoxetin i kombination: behandling af resistent depression
Når du bruger ZYPREXA og fluoxetin i kombination, se også afsnittet om kliniske undersøgelser i indlægssedlen til Symbyax.
Oral olanzapin bør administreres i kombination med fluoxetin én gang dagligt om aftenen, uden hensyntagen til måltider, normalt begyndende med 5 mg oral olanzapin og 20 mg fluoxetin. Dosisjusteringer, hvis det er indiceret, kan foretages i henhold til effekt og tolerabilitet inden for dosisintervaller for oral olanzapin 5 til 20 mg og fluoxetin 20 til 50 mg. Antidepressiv effekt blev påvist med olanzapin og fluoxetin i kombination hos voksne patienter med et dosisområde på olanzapin 6 til 18 mg og fluoxetin 25 til 50 mg.
Sikkerhed og effekt af olanzapin i kombination med fluoxetin blev bestemt i kliniske forsøg, der understøttede godkendelse af Symbyax (fast dosiskombination af olanzapin og fluoxetin). Symbyax doseres mellem 3 mg/25 mg (olanzapin/fluoxetin) pr. dag og 12 mg/50 mg (olanzapin/fluoxetin) pr. dag. Tabel 1 ovenfor viser de passende individuelle komponentdoser af ZYPREXA og fluoxetin versus Symbyax. Dosisjusteringer, hvis indiceret, bør foretages med de individuelle komponenter i henhold til effektivitet og tolerabilitet.
Selvom der ikke er noget bevis til at besvare spørgsmålet om, hvor længe en patient behandlet med ZYPREXA og fluoxetin i kombination skal forblive på det, er det generelt accepteret, at behandlingsresistent depression (større depressiv lidelse hos voksne patienter, som ikke reagerer på 2 separate forsøg med forskellige antidepressiva af passende dosis og varighed i den aktuelle episode) er en kronisk sygdom, der kræver kronisk behandling. Sygeplejersken bør med jævne mellemrum revurdere behovet for fortsat farmakoterapi.
Sikkerheden ved samtidig administration af doser over 18 mg olanzapin og 75 mg fluoxetin er ikke blevet evalueret i kliniske studier.
ZYPREXA 7,5 mg monoterapi er ikke indiceret til behandling af behandlingsresistent depression (svær depressiv lidelse hos patienter, som ikke reagerer på 2 antidepressiva af passende dosis og varighed i den aktuelle episode).
ZYPREXA 10 mg og fluoxetin i kombination: Dosering i særlige populationer
Startdosis af oral olanzapin 2,5-5 mg med fluoxetin 20 mg bør anvendes til patienter med disposition for hypotensive reaktioner, patienter med nedsat leverfunktion eller patienter, som udviser en kombination af faktorer, der kan bremse metabolismen af olanzapin eller fluoxetin i kombination. (kvindelig køn, geriatrisk alder, ikke-ryger status), eller de patienter, der kan være farmakodynamisk følsomme over for olanzapin. Dosisændring kan være nødvendig hos patienter, som udviser en kombination af faktorer, der kan bremse metabolismen. Når det er indiceret, bør dosiseskalering udføres med forsigtighed hos disse patienter. ZYPREXA og fluoxetin i kombination er ikke blevet systematisk undersøgt hos patienter over 65 år eller hos patienter under 10 år [se ADVARSLER OG FORHOLDSREGLER , DRUGSINTERAKTIONER , og KLINISK FARMAKOLOGI ].
HVORDAN LEVERET
Doseringsformer og styrker
ZYPREXA 2,5 mg, 5 mg, 7,5 mg og 10 mg tabletterne er hvide, runde og præget med blåt blæk med LILLY og tabletnummer. 15 mg tabletterne er elliptiske, blå og præget med LILLY og tabletnummer. 20 mg tabletterne er elliptiske, lyserøde og præget med LILLY og tabletnummer. Tabletter scores ikke. Tabletterne fås som følger:
ZYPREXA 10mg ZYDIS (olanzapin oralt disintegrerende tabletter) er gule, runde og præget med tabletstyrken. Tabletter scores ikke. Tabletterne fås som følger:
ZYPREXA 15 mg intramuskulært fås i 10 mg hætteglas (1s).
ZYPREXA 2,5 mg, 5 mg, 7,5 mg og 10 mg tabletterne er hvide, runde og præget med blåt blæk med LILLY og tabletnummer. 15 mg tabletterne er elliptiske, blå og præget med LILLY og tabletnummer. 20 mg tabletterne er elliptiske, lyserøde og præget med LILLY og tabletnummer. Tabletterne fås som følger:
ZYPREXA 2,5 mg ZYDIS (olanzapin oralt disintegrerende tabletter) er gule, runde og præget med tabletstyrken. Tabletterne fås som følger:
ZYPREXA Intramuskulær findes i:
NDC 0002-7597-01 (nr. VL7597) – 10 mg hætteglas (1s)
Opbevaring og håndtering
Opbevar ZYPREXA tabletter, ZYPREXA ZYDIS og ZYPREXA intramuskulære hætteglas (før rekonstitution) ved kontrolleret stuetemperatur, 20° til 25°C (68° til 77°F) [se USP ]. Rekonstitueret ZYPREXA 20mg IntraMuscular kan opbevares ved kontrolleret stuetemperatur, 20° til 25°C (68° til 77°F) [se USP i op til 1 time om nødvendigt. Kassér enhver ubrugt del af rekonstitueret ZYPREXA IntraMuscular. USP definerer kontrolleret rumtemperatur som en temperatur, der holdes termostatisk, og som omfatter det sædvanlige og sædvanlige arbejdsmiljø på 20° til 25°C (68° til 77°F); som resulterer i en kinetisk middeltemperatur beregnet til ikke at være mere end 25°C; og som giver mulighed for udflugter mellem 15° og 30°C (59° og 86°F), som er oplevet på apoteker, hospitaler og varehuse.
Beskyt ZYPREXA tabletter og ZYPREXA ZYDIS mod lys og fugt. Beskyt ZYPREXA IntraMuscular mod lys, må ikke fryses.
Markedsført af: Lilly USA, LLC, Indianapolis, IN 46285, USA. Revideret: oktober 2019
BIVIRKNINGER
Når du bruger ZYPREXA 2,5 mg og fluoxetin i kombination, se også afsnittet om bivirkninger i indlægssedlen til Symbyax.
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel, og de afspejler eller forudsiger muligvis ikke frekvenserne observeret i praksis.
Kliniske forsøg hos voksne
Oplysningerne nedenfor for olanzapin stammer fra en database med kliniske forsøg for olanzapin bestående af 10.504 voksne patienter med ca. 4765 patientårs eksponering for olanzapin plus 722 patienter med eksponering for intramuskulær olanzapin til injektion. Denne database omfatter: (1) 2500 patienter, der deltog i multidosis orale olanzapin-præmarketing-forsøg i skizofreni og Alzheimers sygdom, hvilket repræsenterer ca. 1122 patientårs eksponering pr. 14. februar 1995; (2) 182 patienter, der deltog i oral olanzapin premarketing bipolar I-lidelse (maniske eller blandede episoder), som repræsenterede ca. 66 patientårs eksponering; (3) 191 patienter, der deltog i et oralt olanzapin-forsøg med patienter med forskellige psykiatriske symptomer i forbindelse med Alzheimers sygdom, hvilket repræsenterede ca. 29 patientårs eksponering; (4) 5788 yderligere patienter fra 88 orale olanzapin kliniske forsøg pr. 31. december 2001; (5) 1843 yderligere patienter fra 41 olanzapin kliniske forsøg pr. 31. oktober 2011; og (6) 722 patienter, der deltog i intramuskulære olanzapin til injektion præmarketing-forsøg hos ophidsede patienter med skizofreni, bipolar I-lidelse (maniske eller blandede episoder) eller demens. Nedenfor er også inkluderet information fra den 6-ugers kliniske undersøgelsesdatabase for olanzapin i kombination med lithium eller valproat, som består af 224 patienter, som deltog i forsøg med bipolar I lidelse (maniske eller blandede episoder) med ca. 22 patientårs eksponering.
Betingelserne og varigheden af behandlingen med olanzapin varierede meget og omfattede (i overlappende kategorier) åbne og dobbeltblindede faser af undersøgelser, indlagte og ambulante patienter, undersøgelser med faste doser og dosistitrering og korttids- eller længerevarende eksponering. . Bivirkninger blev vurderet ved at indsamle bivirkninger, resultater af fysiske undersøgelser, vitale tegn, vægte, laboratorieanalytter, EKG'er, røntgenbilleder af thorax og resultater af oftalmologiske undersøgelser.
Visse dele af diskussionen nedenfor, der vedrører objektive eller numeriske sikkerhedsparametre, nemlig dosisafhængige bivirkninger, ændringer i vitale tegn, vægtøgning, laboratorieændringer og EKG-ændringer stammer fra undersøgelser af patienter med skizofreni og er ikke blevet duplikeret for bipolar I lidelse. (maniske eller blandede episoder) eller agitation. Denne information gælder dog også generelt for bipolar lidelse I (maniske eller blandede episoder) og agitation.
Bivirkninger under eksponering blev opnået ved spontan rapport og registreret af kliniske efterforskere ved hjælp af terminologi efter eget valg. Det er derfor ikke muligt at give et meningsfuldt skøn over andelen af personer, der oplever bivirkninger, uden først at gruppere lignende typer af reaktioner i et mindre antal standardiserede reaktionskategorier. I de efterfølgende tabeller og tabeller er MedDRA og COSTART Dictionary terminologi blevet brugt til at klassificere rapporterede bivirkninger.
De angivne frekvenser af bivirkninger repræsenterer andelen af personer, der mindst én gang oplevede en behandlingsudløst bivirkning af den angivne type. En reaktion blev betragtet som fremkommet, hvis den opstod for første gang eller forværredes under behandling efter baseline-evaluering. De rapporterede reaktioner inkluderer ikke de reaktionsbegreber, der var så generelle, at de var uinformative. Reaktioner anført andetsteds i mærkningen må ikke gentages nedenfor. Det er vigtigt at understrege, at selvom reaktionerne opstod under behandling med olanzapin, var de ikke nødvendigvis forårsaget af det. Hele etiketten bør læses for at opnå en fuldstændig forståelse af olanzapins sikkerhedsprofil.
Den ordinerende læge skal være opmærksom på, at tallene i tabellerne og tabellerne ikke kan bruges til at forudsige forekomsten af bivirkninger i løbet af sædvanlig lægepraksis, hvor patientkarakteristika og andre faktorer adskiller sig fra dem, der var fremherskende i de kliniske forsøg. Tilsvarende kan de nævnte frekvenser ikke sammenlignes med tal opnået fra andre kliniske undersøgelser, der involverer forskellige behandlinger, anvendelser og efterforskere. De citerede tal giver imidlertid den ordinerende sundhedsudbyder et vist grundlag for at estimere det relative bidrag af lægemidler og ikke-lægemiddelfaktorer til forekomsten af bivirkninger i den undersøgte befolkning.
Forekomst af bivirkninger i kortsigtede, placebokontrollerede og kombinationsforsøg
Følgende resultater er baseret på præmarketingforsøg med (1) oral olanzapin mod skizofreni, bipolar lidelse I (maniske eller blandede episoder), et efterfølgende forsøg med patienter med forskellige psykiatriske symptomer i forbindelse med Alzheimers sygdom, og præmarketing kombinationsforsøg og (2 ) intramuskulært olanzapin til injektion hos ophidsede patienter med skizofreni eller bipolar I-mani.
Bivirkninger forbundet med seponering af behandling i kortsigtede, placebokontrollerede forsøg
Skizofreni
Samlet set var der ingen forskel i forekomsten af seponering på grund af bivirkninger (5 % for oral olanzapin vs. 6 % for placebo). Seponeringer på grund af stigninger i ALAT blev dog anset for at være lægemiddelrelateret (2 % for oral olanzapin vs. 0 % for placebo).
Bipolar I lidelse (maniske eller blandede episoder) Monoterapi
Samlet set var der ingen forskel i forekomsten af seponering på grund af bivirkninger (2 % for oral olanzapin vs. 2 % for placebo).
Agitation
Samlet set var der ingen forskel i forekomsten af seponering på grund af bivirkninger (0,4 % for intramuskulært olanzapin til injektion vs. 0 % for placebo).
Bivirkninger forbundet med seponering af behandling i kortvarige kombinationsforsøg
Bipolar I lidelse (maniske eller blandede episoder), olanzapin som supplement til lithium eller valproat
I en undersøgelse af patienter, der allerede tolererede enten lithium eller valproat som monoterapi, var seponeringsraten på grund af bivirkninger 11 % for kombinationen af oral olanzapin med lithium eller valproat sammenlignet med 2 % for patienter, der forblev i lithium- eller valproatmonoterapi. Seponeringer med kombinationen af oral olanzapin og lithium eller valproat, som forekom hos mere end 1 patient, var: somnolens (3 %), vægtøgning (1 %) og perifert ødem (1 %).
Almindeligvis observerede bivirkninger i kortsigtede, placebokontrollerede forsøg
De mest almindeligt observerede bivirkninger forbundet med brugen af oral olanzapin (incidens på 5 % eller mere) og ikke observeret ved en tilsvarende hyppighed blandt placebo-behandlede patienter (olanzapin-incidens mindst det dobbelte af placebo) var:
Olanzapin intramuskulært
Der blev observeret 1 bivirkning (somnolens) med en incidens på 5 % eller mere blandt intramuskulært olanzapin til injektionsbehandlede patienter og ikke observeret ved en tilsvarende forekomst blandt placebobehandlede patienter (olanzapin-incidens mindst dobbelt så stor som for placebo) under placebo -kontrollerede præmarketing undersøgelser. Hyppigheden af somnolens i løbet af den 24 timers im-behandlingsperiode i kliniske forsøg hos ophidsede patienter med skizofreni eller bipolar I-mani var 6 % for intramuskulært olanzapin til injektion og 3 % for placebo.
Bivirkninger, der forekommer med en forekomst på 2 % eller mere blandt orale olanzapin-behandlede patienter i kortsigtede, placebokontrollerede forsøg
Tabel 11 opregner forekomsten, afrundet til nærmeste procent, af behandlingsudløste bivirkninger, der forekom hos 2 % eller flere af de patienter, der blev behandlet med oral olanzapin (doser ≥2,5 mg/dag) og med incidensen større end placebo, som deltog i den akutte fase af placebokontrollerede forsøg.
Dosisafhængighed af bivirkninger
En dosisgruppeforskel er blevet observeret for træthed, svimmelhed, vægtøgning og prolaktinstigning. I et enkelt 8-ugers randomiseret, dobbeltblindt, fastdosisstudie, der sammenlignede 10 (N=199), 20 (N=200) og 40 (N=200) mg/dag oral olanzapin hos voksne patienter med skizofreni eller skizoaffektiv lidelse, forekomst af træthed (10 mg/dag: 1,5%; 20 mg/dag: 2,1%; 40 mg/dag: 6,6%) blev observeret med signifikante forskelle mellem 10 vs 40 og 20 vs 40 mg/dag. Forekomsten af svimmelhed (10 mg/dag: 2,6%; 20 mg/dag: 1,6%; 40 mg/dag: 6,6%) blev observeret med signifikante forskelle mellem 20 og 40 mg. Dosisgruppeforskelle blev også noteret for vægtøgning og prolaktinstigning [se ADVARSLER OG FORHOLDSREGLER ].
Følgende tabel omhandler dosisrelaterede forhold for andre bivirkninger ved hjælp af data fra et skizofreniforsøg, der involverer faste dosisintervaller af oral olanzapin. Den opregner procentdelen af patienter med behandlingsudspringende bivirkninger for de 3 fastdosisgrupper og placebo. Dataene blev analyseret ved hjælp af Cochran-Armitage-testen, eksklusive placebogruppen, og tabellen inkluderer kun de bivirkninger, for hvilke der var en tendens.
Almindeligvis observerede bivirkninger i kortvarige forsøg med oralt olanzapin som supplement til lithium eller valproat
I den bipolar I-lidelse (maniske eller blandede episoder) supplerende placebokontrollerede forsøg var de mest almindeligt observerede bivirkninger forbundet med kombinationen af olanzapin og lithium eller valproat (incidens på ≥5 % og mindst to gange placebo):
Bivirkninger, der forekommer med en forekomst på 2 % eller mere blandt orale olanzapin-behandlede patienter i korttidsforsøg med olanzapin som supplement til lithium eller valproat
Tabel 14 opregner forekomsten, afrundet til nærmeste procent, af behandlingsudløste bivirkninger, der opstod hos 2 % eller flere af patienterne behandlet med kombinationen af olanzapin (doser ≥5 mg/dag) og lithium eller valproat og med en forekomst større end lithium eller valproat alene, som deltog i den akutte fase af placebokontrollerede kombinationsforsøg.
For specifik information om de bivirkninger, der er observeret med lithium eller valproat, henvises til afsnittet Bivirkninger på indlægssedlen for disse andre produkter.
Bivirkninger, der forekommer med en forekomst på 1 % eller mere blandt intramuskulært olanzapin til injektionsbehandlede patienter i kortsigtede, placebokontrollerede forsøg
Tabel 15 opregner forekomsten, afrundet til nærmeste procent, af behandlingsudspringende bivirkninger, der forekom hos 1 % eller flere af patienterne behandlet med intramuskulært olanzapin til injektion (dosisområde på 2,5-10 mg/injektion) og med forekomst større end placebo som deltog i de kortvarige, placebokontrollerede forsøg med ophidsede patienter med skizofreni eller bipolar I-mani.
Ekstrapyramidale symptomer
Følgende tabel opregner procentdelen af patienter med behandlingsfremkaldte ekstrapyramidale symptomer vurderet ved kategoriske analyser af formelle vurderingsskalaer under akut terapi i et kontrolleret klinisk forsøg, der sammenligner oral olanzapin ved 3 faste doser med placebo i behandlingen af skizofreni i en 6-ugers forsøg.
Følgende tabel opregner procentdelen af patienter med behandlingsudløste ekstrapyramidale symptomer vurderet ved spontant rapporterede bivirkninger under akut behandling i det samme kontrollerede kliniske forsøg, der sammenligner olanzapin ved 3 faste doser med placebo i behandlingen af skizofreni i et 6-ugers forsøg.
Følgende tabel opregner procentdelen af teenagere med behandlingsudspringende ekstrapyramidale symptomer vurderet ved spontant rapporterede bivirkninger under akut behandling (dosisområde: 2,5 til 20 mg/dag).
Følgende tabel opregner procentdelen af patienter med behandlingsfremkaldte ekstrapyramidale symptomer vurderet ved kategoriske analyser af formelle vurderingsskalaer under kontrollerede kliniske forsøg, der sammenligner faste doser af intramuskulært olanzapin til injektion med placebo i agitation. Patienter i hver dosisgruppe kunne modtage op til 3 injektioner under forsøgene [se Kliniske Studier ]. Patientvurderinger blev udført i løbet af 24 timer efter den indledende dosis af intramuskulær olanzapin til injektion.
Følgende tabel opregner procentdelen af patienter med behandlingsfremkaldte ekstrapyramidale symptomer vurderet ved spontant rapporterede bivirkninger i det samme kontrollerede kliniske forsøg, der sammenligner faste doser af intramuskulært olanzapin til injektion med placebo hos ophidsede patienter med skizofreni.
Dystoni, klasseeffekt
Symptomer på dystoni, langvarige unormale sammentrækninger af muskelgrupper, kan forekomme hos følsomme personer i løbet af de første par dage af behandlingen. Dystoniske symptomer omfatter: spasmer i nakkemusklerne, nogle gange udvikler sig til stram hals, synkebesvær, vejrtrækningsbesvær og/eller fremspring af tungen. Selvom disse symptomer kan forekomme ved lave doser, er hyppigheden og sværhedsgraden større med høj styrke og ved højere doser af førstegenerations antipsykotiske lægemidler. Generelt kan en forhøjet risiko for akut dystoni observeres hos mænd og yngre aldersgrupper, der får antipsykotika; Imidlertid er hændelser af dystoni blevet rapporteret sjældent (
Andre bivirkninger
Andre bivirkninger observeret under den kliniske undersøgelsesvurdering af oralt olanzapin
Følgende er en liste over bivirkninger, der opstår ved behandling, rapporteret af patienter behandlet med oral olanzapin (ved flere doser ≥1 mg/dag) i kliniske forsøg. Denne fortegnelse er ikke beregnet til at inkludere reaktioner (1) som allerede er opført i tidligere tabeller eller andre steder i mærkning, (2) hvor en lægemiddelårsag var fjern, (3) som var så generelle, at de var uinformative, (4) som ikke var anses for at have signifikante kliniske implikationer, eller (5) som forekom med en hastighed lig med eller mindre end placebo. Reaktioner klassificeres efter kropssystem ved hjælp af følgende definitioner: hyppige bivirkninger er dem, der forekommer hos mindst 1/100 patienter; sjældne bivirkninger er dem, der forekommer hos 1/100 til 1/1000 patienter; sjældne reaktioner er dem, der forekommer hos færre end 1/1000 patienter.
Kroppen som helhed - Sjælden: kulderystelser, ansigtsødem, lysfølsomhedsreaktion, selvmordsforsøg1; Sjælden: kulderystelser og feber, tømmermændseffekt, pludselig død1.
Kardiovaskulære system - Sjælden: cerebrovaskulær ulykke, vasodilatation.
Fordøjelsessystemet - Sjælden: abdominal udspilning, kvalme og opkastning, tungeødem; Sjælden: ileus, intestinal obstruktion, leverfedtaflejring.
Hemisk og lymfesystem - Sjældent: trombocytopeni.
Metaboliske og ernæringsforstyrrelser - Hyppig: øget alkalisk fosfatase; Sjælden: bilirubinæmi, hypoproteinæmi.
Muskuloskeletale system - Sjælden: osteoporose.
Nervesystem - Sjælden: ataksi, dysartri, nedsat libido, stupor; Sjælden: koma.
Åndedrætsorganerne - Sjælden: næseblod; Sjælden: lungeødem.
Hud og vedhæng - Sjældent: alopeci.
Særlige sanser - Sjælden: unormal indkvartering, tørre øjne; Sjælden: mydriasis.
Urogenitale system - Sjælden: amenoré2, brystsmerter, nedsat menstruation, impotens2, øget menstruation2, menorragi2, metrorragi2, polyuri2, vandladningsfrekvens, urinretention, urintrang, vandladningsbesvær.
1 Disse udtryk repræsenterer alvorlige bivirkninger, men opfylder ikke definitionen for bivirkninger. De er inkluderet her på grund af deres seriøsitet. 2 Justeret for køn.
Andre bivirkninger observeret under den kliniske undersøgelses evaluering af intramuskulært olanzapin til injektion
Følgende er en liste over behandlingsudspringende bivirkninger rapporteret af patienter behandlet med intramuskulært olanzapin til injektion (ved 1 eller flere doser ≥2,5 mg/injektion) i kliniske forsøg. Denne fortegnelse er ikke beregnet til at inkludere reaktioner (1) som allerede er opført i tidligere tabeller eller andre steder i mærkning, (2) hvor en lægemiddelårsag var fjern, (3) som var så generelle, at de var uinformative, (4) som ikke var anses for at have signifikante kliniske implikationer, eller (5) for hvilke forekom med en hastighed lig med eller mindre end placebo. Reaktioner klassificeres efter kropssystem ved hjælp af følgende definitioner: hyppige bivirkninger er dem, der forekommer hos mindst 1/100 patienter; sjældne bivirkninger er dem, der forekommer hos 1/100 til 1/1000 patienter.
Kroppen som helhed - Hyppig: Smerter på injektionsstedet.
Kardiovaskulære system - Sjælden: synkope.
Fordøjelsessystemet - Sjælden: kvalme.
Metaboliske og ernæringsforstyrrelser - Sjældent: øget kreatinfosfokinase.
Kliniske forsøg hos unge patienter (alder 13 til 17 år)
Almindeligvis observerede bivirkninger i orale olanzapin kortvarige, placebokontrollerede forsøg
Bivirkninger hos unge patienter behandlet med oral olanzapin (doser ≥2,5 mg) rapporteret med en incidens på 5 % eller mere og rapporteret mindst dobbelt så hyppigt som placebo-behandlede patienter er anført i tabel 21.
Bivirkninger, der forekommer med en forekomst på 2 % eller mere blandt orale olanzapin-behandlede patienter i kortvarige (3-6 uger), placebokontrollerede forsøg
Bivirkninger hos unge patienter behandlet med oral olanzapin (doser ≥2,5 mg) rapporteret med en incidens på 2 % eller mere og mere end placebo er anført i tabel 22.
Vitale tegn og laboratorieundersøgelser
Ændringer af vitale tegn
Oral olanzapin var forbundet med ortostatisk hypotension og takykardi i kliniske forsøg. Intramuskulært olanzapin til injektion var forbundet med bradykardi, hypotension og takykardi i kliniske forsøg [se ADVARSLER OG FORHOLDSREGLER ].
Laboratorieændringer
Olanzapin monoterapi hos voksne
En vurdering af præmarketing-erfaringen for olanzapin afslørede en sammenhæng med asymptomatiske stigninger i ALAT, ASAT og GGT. Inden for den oprindelige præmarketingdatabase med ca. 2400 voksne patienter med baseline-ALAT ≤90 IE/L var forekomsten af ALAT-stigninger til >200 IE/l 2 % (50/2381). Ingen af disse patienter oplevede gulsot eller andre symptomer, der kunne tilskrives leverinsufficiens, og de fleste havde forbigående forandringer, der havde en tendens til at normalisere sig, mens behandlingen med olanzapin fortsatte.
placebokontrollerede monoterapistudier med olanzapin hos voksne blev der observeret klinisk signifikante ALAT-stigninger (ændring fra
Fra en analyse af laboratoriedata i en integreret database med 41 afsluttede kliniske undersøgelser med voksne patienter behandlet med oral olanzapin, blev høje GGT-niveauer registreret hos ≥1 % (88/5245) af patienterne.
Der bør udvises forsigtighed hos patienter med tegn og symptomer på nedsat leverfunktion, hos patienter med allerede eksisterende tilstande forbundet med begrænset leverfunktionsreserve og hos patienter, der behandles med potentielt hepatotoksiske lægemidler.
Indgivelse af olanzapin var også forbundet med stigninger i serumprolaktin [se ADVARSLER OG FORHOLDSREGLER ], med en asymptomatisk forhøjelse af eosinofiltallet hos 0,3 % af patienterne og med en stigning i CPK.
Fra en analyse af laboratoriedata i en integreret database med 41 afsluttede kliniske undersøgelser med voksne patienter behandlet med oral olanzapin, blev forhøjet urinsyre registreret hos ≥3 % (171/4641) af patienterne.
Olanzapin monoterapi hos unge
placebokontrollerede kliniske forsøg med unge patienter med skizofreni eller bipolar lidelse I (maniske eller blandede episoder) blev der til enhver tid observeret højere frekvenser for følgende behandlingsfremkomne fund i laboratorieanalytter sammenlignet med placebo: forhøjet ALAT (≥3X ULN) hos patienter med ALAT ved baseline
placebokontrollerede monoterapistudier med olanzapin hos unge blev der observeret klinisk signifikante ALAT-stigninger (ændring fra
EKG ændringer
poolede undersøgelser af voksne såvel som poolede undersøgelser af unge var der ingen signifikante forskelle mellem olanzapin og placebo i andelen af patienter, der oplevede potentielt vigtige ændringer i EKG-parametre, inklusive QT, QTc (Fridericia korrigeret) og PR-intervaller. Brug af olanzapin var forbundet med en gennemsnitlig stigning i hjertefrekvens sammenlignet med placebo (voksne: +2,4 slag i minuttet vs. ingen ændring med placebo; unge: +6,3 slag i minuttet vs. -5,1 slag i minuttet med placebo). Denne stigning i hjertefrekvensen kan være relateret til olanzapins potentiale for at inducere ortostatiske forandringer [se ADVARSLER OG FORHOLDSREGLER ].
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af ZYPREXA efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det vanskeligt pålideligt at estimere deres hyppighed eller vurdere en årsagssammenhæng til lægemiddeleksponering.
Bivirkninger rapporteret siden markedsintroduktionen, som var tidsmæssigt (men ikke nødvendigvis kausalt) relateret til ZYPREXA-behandling omfatter følgende: allergisk reaktion (f.eks. anafylaktoid reaktion, angioødem, pruritus eller nældefeber), kolestatisk eller blandet leverskade, diabetisk koma, diabetisk ketoacidose, seponeringsreaktion (diaforese, kvalme eller opkastning), lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS), hepatitis, gulsot, neutropeni, pancreatitis, priapisme, udslæt, rastløse ben-syndrom, rhabdomyolyse, stammen1 og venøse tromboemboliske hændelser (lungetromboemboliske hændelser) dyb venetrombose). Tilfældige kolesterolniveauer på ≥240 mg/dL og tilfældige triglyceridniveauer på ≥1000 mg/dL er blevet rapporteret.
1 Stamming blev kun undersøgt i orale og langtidsvirkende injektionsformuleringer (LAI).
DRUGSINTERAKTIONER
Risikoen ved at bruge olanzapin i kombination med andre lægemidler er ikke blevet grundigt evalueret i systematiske undersøgelser.
Potentiale for andre lægemidler til at påvirke olanzapin
Diazepam
Samtidig administration af diazepam og olanzapin forstærkede den ortostatiske hypotension observeret med olanzapin.
Cimetidin og antacida
Enkeltdoser af cimetidin (800 mg) eller antacida indeholdende aluminium og magnesium påvirkede ikke den orale biotilgængelighed af olanzapin.
Inducere af CYP1A2
Carbamazepinbehandling (200 mg to gange dagligt) forårsager en stigning på ca. 50 % i clearance af olanzapin. Denne stigning skyldes sandsynligvis det faktum, at carbamazepin er en potent inducer af CYP1A2-aktivitet. Højere daglige doser af carbamazepin kan forårsage en endnu større stigning i olanzapin-clearance.
Alkohol
Ethanol (45 mg/70 kg enkeltdosis) havde ingen effekt på olanzapins farmakokinetik. Samtidig administration af alkohol (dvs. ethanol) med olanzapin forstærkede den ortostatiske hypotension observeret med olanzapin [se DRUGSINTERAKTIONER ].
Hæmmere af CYP1A2
Fluvoxamin
Fluvoxamin, en CYP1A2-hæmmer, nedsætter clearance af olanzapin. Dette resulterer i en gennemsnitlig stigning i olanzapin Cmax efter fluvoxamin på 54 % hos kvindelige ikke-rygere og 77 % hos mandlige rygere. Den gennemsnitlige stigning i olanzapin AUC er henholdsvis 52 % og 108 %. Lavere doser af olanzapin bør overvejes hos patienter, der får samtidig behandling med fluvoxamin.
CYP2D6-hæmmere
Fluoxetin
Fluoxetin (60 mg enkeltdosis eller 60 mg daglig dosis i 8 dage) forårsager en lille (gennemsnitlig 16 %) stigning i den maksimale koncentration af olanzapin og en lille (gennemsnitlig 16 %) reduktion i olanzapin clearance. Størrelsen af påvirkningen af denne faktor er lille sammenlignet med den samlede variabilitet mellem individer, og dosisændring anbefales derfor ikke rutinemæssigt. Når du bruger ZYPREXA og fluoxetin i kombination, se også afsnittet om lægemiddelinteraktioner i indlægssedlen til Symbyax.
Warfarin
Warfarin (20 mg enkeltdosis) påvirkede ikke olanzapins farmakokinetik.
Inducere af CYP1A2 eller Glucuronyl Transferase
Omeprazol og rifampin kan forårsage en stigning i olanzapin-clearance.
Trækul
Administration af aktivt kul (1 g) reducerede Cmax og AUC for oral olanzapin med ca. 60 %. Da maksimale olanzapinniveauer typisk ikke opnås før omkring 6 timer efter dosering, kan trækul være en nyttig behandling for overdosering af olanzapin.
Potentiale for Olanzapin til at påvirke andre lægemidler
CNS virkende lægemidler
I betragtning af olanzapins primære CNS-virkninger bør der udvises forsigtighed, når olanzapin tages i kombination med andre centralt virkende lægemidler og alkohol.
Antihypertensive midler
Olanzapin kan på grund af dets potentiale til at inducere hypotension forstærke virkningen af visse antihypertensiva.
Levodopa og dopaminagonister
Olanzapin kan modvirke virkningerne af levodopa og dopaminagonister.
Lorazepam (IM)
Administration af intramuskulær lorazepam (2 mg) 1 time efter intramuskulær olanzapin til injektion (5 mg) påvirkede ikke farmakokinetikken af olanzapin, ukonjugeret lorazepam eller total lorazepam signifikant. Denne samtidige administration af intramuskulær lorazepam og intramuskulær olanzapin til injektion føjede imidlertid til den søvnighed, der blev observeret med begge lægemidler alene [se ADVARSLER OG FORHOLDSREGLER ].
Lithium
Flere doser af olanzapin (10 mg i 8 dage) påvirkede ikke lithiums kinetik. Derfor kræver samtidig administration af olanzapin ikke dosisjustering af lithium [se ADVARSLER OG FORHOLDSREGLER ].
Valproat
Olanzapin (10 mg dagligt i 2 uger) påvirkede ikke steady state plasmakoncentrationerne af valproat. Derfor kræver samtidig administration af olanzapin ikke dosisjustering af valproat [se ADVARSLER OG FORHOLDSREGLER ].
Effekt af Olanzapin på lægemiddelmetaboliserende enzymer
In vitro undersøgelser, der anvender humane levermikrosomer, tyder på, at olanzapin har ringe potentiale til at hæmme CYP1A2, CYP2C9, CYP2C19, CYP2D6 og CYP3A. Det er derfor usandsynligt, at olanzapin forårsager klinisk vigtige lægemiddelinteraktioner medieret af disse enzymer.
Imipramin
Enkeltdoser af olanzapin påvirkede ikke farmakokinetikken af imipramin eller dets aktive metabolit desipramin.
Warfarin
Enkeltdoser af olanzapin påvirkede ikke farmakokinetikken af warfarin.
Diazepam
Olanzapin påvirkede ikke farmakokinetikken af diazepam eller dets aktive metabolit Ndesmethyldiazepam. Imidlertid øgede diazepam administreret sammen med olanzapin den ortostatiske hypotension observeret med begge lægemidler givet alene.
Alkohol
Flere doser af olanzapin påvirkede ikke kinetikken af ethanol.
Biperiden
Flere doser af olanzapin påvirkede ikke biperidens kinetik.
Theophyllin
Flere doser af olanzapin påvirkede ikke farmakokinetikken af theophyllin eller dets metabolitter.
Stofmisbrug og afhængighed
Afhængighed
undersøgelser, der prospektivt er designet til at vurdere misbrug og afhængighedspotentiale, har olanzapin vist sig at have akutte depressive CNS-effekter, men ringe eller intet potentiale for misbrug eller fysisk afhængighed hos rotter, der fik orale doser op til 15 gange den daglige orale MRHD (20 mg) og rhesusaber indgivet orale doser op til 8 gange den daglige orale MRHD baseret på mg/m² kropsoverfladeareal.
Olanzapin er ikke blevet systematisk undersøgt hos mennesker for dets potentiale for misbrug, tolerance eller fysisk afhængighed. Selvom de kliniske forsøg ikke afslørede nogen tendens til nogen lægemiddel-søgende adfærd, var disse observationer ikke systematiske, og det er ikke muligt på baggrund af denne begrænsede erfaring at forudsige, i hvilket omfang et CNS-aktivt lægemiddel vil blive misbrugt, omdirigeret , og/eller misbrugt, når den først er markedsført. Patienter bør derfor evalueres omhyggeligt for en historie med stofmisbrug, og sådanne patienter bør observeres nøje for tegn på misbrug eller misbrug af olanzapin (f.eks. udvikling af tolerance, stigning i dosis, lægemiddelsøgende adfærd).
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Når du bruger ZYPREXA 7,5 mg og fluoxetin i kombination, henvises der også til afsnittet Advarsler og forholdsregler i indlægssedlen til Symbyax.
Ældre patienter med demensrelateret psykose
Øget dødelighed
Ældre patienter med demensrelateret psykose behandlet med antipsykotiske lægemidler har en øget risiko for at dø. ZYPREXA 20mg er ikke godkendt til behandling af patienter med demensrelateret psykose [se ADVARSEL INDREMMET, Brug hos patienter med samtidig sygdom og PATIENTINFORMATION].
I placebokontrollerede kliniske forsøg med ældre patienter med demensrelateret psykose var forekomsten af dødsfald hos olanzapin-behandlede patienter signifikant større end placebo-behandlede patienter (henholdsvis 3,5 % vs. 1,5 %).
Cerebrovaskulære bivirkninger (CVAE), inklusive slagtilfælde
Cerebrovaskulære bivirkninger (f.eks. slagtilfælde, forbigående iskæmisk anfald), inklusive dødsfald, blev rapporteret hos patienter i forsøg med olanzapin hos ældre patienter med demensrelateret psykose. I placebokontrollerede forsøg var der en signifikant højere forekomst af cerebrovaskulære bivirkninger hos patienter behandlet med olanzapin sammenlignet med patienter behandlet med placebo. Olanzapin er ikke godkendt til behandling af patienter med demensrelateret psykose [se KASSET ADVARSEL og PATIENTOPLYSNINGER ].
Selvmord
Muligheden for et selvmordsforsøg er iboende i skizofreni og ved bipolar lidelse I, og tæt overvågning af højrisikopatienter bør ledsage lægemiddelbehandling. Recepter for olanzapin bør udskrives for den mindste mængde tabletter i overensstemmelse med god patientbehandling for at reducere risikoen for overdosering.
Malignt neuroleptikasyndrom (NMS)
Et potentielt dødeligt symptomkompleks, nogle gange omtalt som malignt neuroleptikasyndrom (NMS), er blevet rapporteret i forbindelse med administration af antipsykotiske lægemidler, herunder olanzapin. Kliniske manifestationer af NMS er hyperpyreksi, muskelstivhed, ændret mental status og tegn på autonom ustabilitet (uregelmæssig puls eller blodtryk, takykardi, diaforese og hjerterytmeforstyrrelser). Yderligere tegn kan omfatte forhøjet kreatininfosfokinase, myoglobinuri (rhabdomyolyse) og akut nyresvigt.
Den diagnostiske evaluering af patienter med dette syndrom er kompliceret. For at nå frem til en diagnose er det vigtigt at udelukke tilfælde, hvor den kliniske præsentation omfatter både alvorlig medicinsk sygdom (f.eks. lungebetændelse, systemisk infektion osv.) og ubehandlede eller utilstrækkeligt behandlede ekstrapyramidale tegn og symptomer (EPS). Andre vigtige overvejelser i differentialdiagnosen omfatter central antikolinerg toksicitet, hedeslag, lægemiddelfeber og primær patologi i centralnervesystemet.
Behandlingen af NMS bør omfatte: 1) øjeblikkelig seponering af antipsykotiske lægemidler og andre lægemidler, der ikke er nødvendige for samtidig behandling; 2) intensiv symptomatisk behandling og medicinsk overvågning; og 3) behandling af eventuelle samtidige alvorlige medicinske problemer, for hvilke specifikke behandlinger er tilgængelige. Der er ingen generel enighed om specifikke farmakologiske behandlingsregimer for NMS.
Hvis en patient har behov for antipsykotisk lægemiddelbehandling efter bedring fra NMS, bør den potentielle genindførelse af lægemiddelbehandling overvejes nøje. Patienten bør overvåges omhyggeligt, da tilbagefald af NMS er blevet rapporteret [se PATIENTOPLYSNINGER ].
Lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS)
Lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS) er blevet rapporteret ved eksponering for olanzapin. DRESS kan vise sig med en kutan reaktion (såsom udslæt eller eksfoliativ dermatitis), eosinofili, feber og/eller lymfadenopati med systemiske komplikationer såsom hepatitis, nefritis, pneumonitis, myocarditis og/eller pericarditis. DRESS er nogle gange fatalt. Afbryd olanzapin, hvis der er mistanke om DRESS [se PATIENTOPLYSNINGER ].
Metaboliske ændringer
Atypiske antipsykotiske lægemidler er blevet forbundet med metaboliske ændringer, herunder hyperglykæmi, dyslipidæmi og vægtøgning. Metaboliske ændringer kan være forbundet med øget kardiovaskulær/cerebrovaskulær risiko. Olanzapins specifikke metaboliske profil er præsenteret nedenfor.
Hyperglykæmi og diabetes mellitus
Sundhedsudbydere bør overveje risici og fordele, når de ordinerer olanzapin til patienter med en etableret diagnose af diabetes mellitus eller med grænseoverskridende forhøjet blodsukkerniveau (fastende 100-126 mg/dL, ikke-fastende 140-200 mg/dL). Patienter, der tager olanzapin, bør overvåges regelmæssigt for forværring af glukosekontrol. Patienter, der starter behandling med olanzapin, bør gennemgå fastende blodsukkermåling i begyndelsen af behandlingen og periodisk under behandlingen. Enhver patient, der behandles med atypiske antipsykotika, bør overvåges for symptomer på hyperglykæmi, herunder polydipsi, polyuri, polyfagi og svaghed. Patienter, som udvikler symptomer på hyperglykæmi under behandling med atypiske antipsykotika, bør gennemgå fastende blodsukkermåling. I nogle tilfælde er hyperglykæmi forsvundet, når det atypiske antipsykotikum blev seponeret; dog krævede nogle patienter fortsættelse af antidiabetisk behandling på trods af seponering af det mistænkte lægemiddel [se PATIENTOPLYSNINGER ].
Hyperglykæmi, i nogle tilfælde ekstrem og forbundet med ketoacidose eller hyperosmolær koma eller død, er blevet rapporteret hos patienter behandlet med atypiske antipsykotika, herunder olanzapin. Vurdering af sammenhængen mellem atypisk brug af antipsykotiske midler og glukoseabnormiteter kompliceres af muligheden for en øget baggrundsrisiko for diabetes mellitus hos patienter med skizofreni og den stigende forekomst af diabetes mellitus i den generelle befolkning. Epidemiologiske undersøgelser tyder på en øget risiko for behandlingsfremkaldte hyperglykæmi-relaterede bivirkninger hos patienter behandlet med de atypiske antipsykotika. Mens relative risikoestimater er inkonsekvente, ser sammenhængen mellem atypiske antipsykotika og stigninger i glukoseniveauer ud til at falde på et kontinuum, og olanzapin ser ud til at have en større sammenhæng end nogle andre atypiske antipsykotika.
Gennemsnitlige stigninger i blodsukker er blevet observeret hos patienter behandlet (median eksponering på 9,2 måneder) med olanzapin i fase 1 af Clinical Antipsychotic Trials of Intervention Effectiveness (CATIE). Den gennemsnitlige stigning i serumglukose (fastende og ikke-fastende prøver) fra baseline til gennemsnittet af de 2 højeste serumkoncentrationer var 15,0 mg/dL.
I en undersøgelse af raske frivillige havde forsøgspersoner, der fik olanzapin (N=22) i 3 uger, en gennemsnitlig stigning i fastende blodsukker sammenlignet med baseline på 2,3 mg/dL. Placebo-behandlede forsøgspersoner (N=19) havde en gennemsnitlig stigning i fastende blodsukker sammenlignet med baseline på 0,34 mg/dL.
Olanzapin monoterapi hos voksne
en analyse af 5 placebokontrollerede voksne olanzapin monoterapi undersøgelser med en median behandlingsvarighed på ca. 3 uger, var olanzapin forbundet med en større gennemsnitlig ændring i fastende glucoseniveauer sammenlignet med placebo (2,76 mg/dL versus 0,17 mg/dL). Forskellen i gennemsnitlige ændringer mellem olanzapin og placebo var større hos patienter med tegn på glukosedysregulering ved baseline (patienter diagnosticeret med diabetes mellitus eller relaterede bivirkninger, patienter behandlet med antidiabetika, patienter med et tilfældigt glukoseniveau på ≥200 mg/ dL og/eller et fastende glucoseniveau på ≥126 mg/dL ved baseline). Olanzapin-behandlede patienter havde en større gennemsnitlig HbA1c-stigning fra baseline på 0,04 % (median eksponering 21 dage), sammenlignet med et gennemsnitligt HbA1c-fald på 0,06 % hos placebo-behandlede forsøgspersoner (median eksponering 17 dage).
en analyse af 8 placebokontrollerede undersøgelser (median behandlingseksponering 4-5 uger) havde 6,1 % af de olanzapinbehandlede forsøgspersoner (N=855) behandlingsudløst glykosuri sammenlignet med 2,8 % af de placebobehandlede forsøgspersoner (N=599) . Tabel 2 viser kortsigtede og langsigtede ændringer i fastende glukoseniveauer fra voksne olanzapin monoterapiundersøgelser.
Den gennemsnitlige ændring i fastende glukose for patienter eksponeret i mindst 48 uger var 4,2 mg/dL (N=487). I analyser af patienter, der afsluttede 9-12 måneders olanzapinbehandling, fortsatte den gennemsnitlige ændring i fastende og ikke-fastende glukoseniveauer med at stige over tid.
Olanzapin monoterapi hos unge
Sikkerheden og effekten af olanzapin er ikke blevet fastslået hos patienter under 13 år. I en analyse af 3 placebokontrollerede olanzapin monoterapiundersøgelser af unge patienter, inklusive dem med skizofreni (6 uger) eller bipolar lidelse I (maniske eller blandede episoder) (3 uger), var olanzapin forbundet med en større gennemsnitlig ændring fra baseline i faste glukoseniveauer sammenlignet med placebo (2,68 mg/dL mod -2,59 mg/dL). Den gennemsnitlige ændring i fastende glukose for unge eksponeret i mindst 24 uger var 3,1 mg/dL (N=121). Tabel 3 viser kortsigtede og langsigtede ændringer i fastende blodsukker fra monoterapistudier med olanzapin hos unge.
Dyslipidæmi
Uønskede ændringer i lipider er blevet observeret ved brug af olanzapin. Klinisk monitorering, herunder baseline og periodisk opfølgning af lipidevalueringer hos patienter, der bruger olanzapin, anbefales [se PATIENTOPLYSNINGER ].
Klinisk signifikante og nogle gange meget høje (>500 mg/dL) stigninger i triglyceridniveauer er blevet observeret ved brug af olanzapin. Beskeden gennemsnitlige stigninger i total kolesterol er også set ved brug af olanzapin.
Olanzapin monoterapi hos voksne
en analyse af 5 placebokontrollerede olanzapin monoterapi undersøgelser med behandlingsvarighed op til 12 uger, havde olanzapin-behandlede patienter stigninger fra baseline i gennemsnitligt fastende totalkolesterol, LDL-kolesterol og triglycerider på 5,3 mg/dL, 3,0 mg/dL og 20,8 mg/dL henholdsvis sammenlignet med fald fra baseline i gennemsnitligt fastende totalkolesterol, LDL-kolesterol og triglycerider på 6,1 mg/dL, 4,3 mg/dL og 10,7 mg/dL for placebobehandlede patienter. For fastende HDL-kolesterol blev der ikke observeret nogen klinisk betydningsfulde forskelle mellem olanzapin-behandlede patienter og placebo-behandlede patienter. Gennemsnitlige stigninger i fastende lipidværdier (total kolesterol, LDL-kolesterol og triglycerider) var større hos patienter uden tegn på lipiddysregulering ved baseline, hvor lipiddysregulering blev defineret som patienter diagnosticeret med dyslipidæmi eller relaterede bivirkninger, patienter behandlet med lipidsænkende midler, eller patienter med høje baseline lipidniveauer.
langtidsundersøgelser (mindst 48 uger) havde patienterne stigninger fra baseline i gennemsnitligt fastende totalkolesterol, LDL-kolesterol og triglycerider på henholdsvis 5,6 mg/dL, 2,5 mg/dL og 18,7 mg/dL og en gennemsnitlig fald i fastende HDL-kolesterol på 0,16 mg/dL. I en analyse af patienter, der fuldførte 12 måneders behandling, steg det gennemsnitlige ikke-fastende totale kolesterol ikke yderligere efter ca. 4-6 måneder.
Andelen af patienter, der havde ændringer (mindst én gang) i totalt kolesterol, LDL-kolesterol eller triglycerider fra normalt eller grænseoverskridende til højt, eller ændringer i HDL-kolesterol fra normalt eller grænseoverskridende til lavt, var større i langtidsundersøgelser (mindst 48 uger) sammenlignet med korttidsstudier. Tabel 4 viser kategoriske ændringer i fastende lipidværdier.
fase 1 af Clinical Antipsychotic Trials of Intervention Effectiveness (CATIE), over en median eksponering på 9,2 måneder, var den gennemsnitlige stigning i triglycerider hos patienter, der tog olanzapin, 40,5 mg/dL. I fase 1 af CATIE var den gennemsnitlige stigning i totalt kolesterol 9,4 mg/dL.
Olanzapin monoterapi hos unge
Sikkerheden og effekten af olanzapin er ikke blevet fastslået hos patienter under 13 år. I en analyse af 3 placebokontrollerede olanzapin monoterapiundersøgelser af unge, inklusive dem med skizofreni (6 uger) eller bipolar lidelse I (maniske eller blandede episoder) (3 uger), havde olanzapinbehandlede unge stigninger fra baseline i gennemsnitligt fastende totalkolesterol, LDL kolesterol og triglycerider på henholdsvis 12,9 mg/dL, 6,5 mg/dL og 28,4 mg/dL sammenlignet med stigninger fra baseline i gennemsnitligt fastende totalkolesterol og LDL-kolesterol på 1,3 mg/dL og 1,0 mg/dL og et fald. i triglycerider på 1,1 mg/dL til placebobehandlede unge. For fastende HDL-kolesterol blev der ikke observeret nogen klinisk betydningsfulde forskelle mellem olanzapinbehandlede unge og placebobehandlede unge.
langtidsundersøgelser (mindst 24 uger) havde unge stigninger fra baseline i gennemsnitligt fastende totalkolesterol, LDL-kolesterol og triglycerider på henholdsvis 5,5 mg/dL, 5,4 mg/dL og 20,5 mg/dL og en gennemsnitlig fald i fastende HDL-kolesterol på 4,5 mg/dL. Tabel 5 viser kategoriske ændringer i fastende lipidværdier hos unge.
Vægtøgning
Potentielle konsekvenser af vægtøgning bør overvejes, før behandlingen med olanzapin påbegyndes. Patienter, der får olanzapin, bør regelmæssigt overvåges vægt [se Patientrådgivningsinformation ].
Olanzapin monoterapi hos voksne
en analyse af 13 placebokontrollerede olanzapin monoterapiundersøgelser tog olanzapinbehandlede patienter i gennemsnit 2,6 kg (5,7 lb) på sammenlignet med et gennemsnitligt vægttab på 0,3 kg (0,6 lb) hos placebobehandlede patienter med en median eksponering på 6 uger ; 22,2 % af olanzapin-behandlede patienter tog på mindst 7 % af deres baselinevægt sammenlignet med 3 % af placebo-behandlede patienter med en median eksponering for hændelsen på 8 uger; 4,2 % af olanzapinbehandlede patienter tog på mindst 15 % af deres baselinevægt sammenlignet med 0,3 % af placebobehandlede patienter med en median eksponering for hændelsen på 12 uger. Klinisk signifikant vægtøgning blev observeret på tværs af alle baseline Body Mass Index (BMI) kategorier. Seponering på grund af vægtøgning forekom hos 0,2 % af olanzapin-behandlede patienter og hos 0 % af placebo-behandlede patienter.
langtidsstudier (mindst 48 uger) var den gennemsnitlige vægtøgning 5,6 kg (12,3 lb) (median eksponering på 573 dage, N=2021). Procentdelen af patienter, der tog på mindst 7 %, 15 % eller 25 % af deres baseline kropsvægt ved langtidseksponering, var henholdsvis 64 %, 32 % og 12 %. Seponering på grund af vægtøgning forekom hos 0,4 % af olanzapinbehandlede patienter efter mindst 48 ugers eksponering.
Tabel 6 inkluderer data om vægtøgning hos voksne med olanzapin samlet fra 86 kliniske forsøg. Dataene i hver kolonne repræsenterer data for de patienter, der fuldførte behandlingsperioder af de angivne varigheder.
Dosisgruppeforskelle med hensyn til vægtøgning er blevet observeret. I et enkelt 8-ugers randomiseret, dobbeltblindt, fastdosisstudie, der sammenlignede 10 (N=199), 20 (N=200) og 40 (N=200) mg/dag oral olanzapin hos voksne patienter med skizofreni eller skizoaffektiv lidelse, gennemsnitlig stigning i vægt fra baseline til endepunkt (10 mg/dag: 1,9 kg; 20 mg/dag: 2,3 kg; 40 mg/dag: 3 kg) blev observeret med signifikante forskelle mellem 10 og 40 mg/dag.
Olanzapin monoterapi hos unge
Sikkerheden og effekten af olanzapin er ikke blevet fastslået hos patienter under 13 år. Den gennemsnitlige vægtstigning hos unge var større end hos voksne. I 4 placebokontrollerede undersøgelser forekom seponering på grund af vægtøgning hos 1 % af de olanzapinbehandlede patienter sammenlignet med 0 % af de placebobehandlede patienter.
langtidsstudier (mindst 24 uger) var den gennemsnitlige vægtøgning 11,2 kg (24,6 lb); (median eksponering på 201 dage, N=179). Procentdelen af teenagere, der tog på mindst 7 %, 15 % eller 25 % af deres baseline kropsvægt ved langtidseksponering, var henholdsvis 89 %, 55 % og 29 %. Blandt unge patienter var den gennemsnitlige vægtøgning efter baseline BMI-kategori henholdsvis 11,5 kg (25,3 lb), 12,1 kg (26,6 lb) og 12,7 kg (27,9 lb) for normal (N=106), overvægtig (N=26) og overvægtige (N=17). Seponering på grund af vægtøgning forekom hos 2,2 % af olanzapin-behandlede patienter efter mindst 24 ugers eksponering.
Tabel 8 viser data om vægtøgning hos unge med olanzapin samlet fra 6 kliniske forsøg. Dataene i hver kolonne repræsenterer data for de patienter, der fuldførte behandlingsperioder af de angivne varigheder. Der er kun få data fra kliniske forsøg om vægtøgning hos unge med olanzapin ud over 6 måneders behandling.
Tardiv dyskinesi
Et syndrom med potentielt irreversible, ufrivillige, dyskinetiske bevægelser kan udvikle sig hos patienter, der behandles med antipsykotiske lægemidler. Selvom prævalensen af syndromet ser ud til at være højest blandt ældre, især ældre kvinder, er det umuligt at stole på prævalensestimater til at forudsige, ved begyndelsen af antipsykotisk behandling, hvilke patienter der sandsynligvis vil udvikle syndromet. Hvorvidt antipsykotiske lægemidler er forskellige i deres potentiale til at forårsage tardiv dyskinesi er ukendt.
Risikoen for at udvikle tardiv dyskinesi og sandsynligheden for, at den bliver irreversibel, menes at stige, efterhånden som behandlingens varighed og den samlede kumulative dosis af antipsykotiske lægemidler administreret til patienten stiger. Syndromet kan dog udvikle sig, om end meget mindre almindeligt, efter relativt korte behandlingsperioder ved lave doser eller kan endda opstå efter seponering af behandlingen.
Tardiv dyskinesi kan forsvinde, delvist eller fuldstændigt, hvis antipsykotisk behandling seponeres. Antipsykotisk behandling kan imidlertid i sig selv undertrykke (eller delvist undertrykke) tegn og symptomer på syndromet og kan derved muligvis maskere den underliggende proces. Den effekt, som symptomatisk suppression har på det langsigtede forløb af syndromet, er ukendt.
betragtning af disse overvejelser bør olanzapin ordineres på en måde, der med størst sandsynlighed minimerer forekomsten af tardiv dyskinesi. Kronisk antipsykotisk behandling bør generelt være forbeholdt patienter (1) som lider af en kronisk sygdom, der vides at reagere på antipsykotiske lægemidler, og (2) for hvem alternative, lige så effektive, men potentielt mindre skadelige behandlinger ikke er tilgængelige eller passende. Hos patienter, som har behov for kronisk behandling, bør den mindste dosis og den korteste behandlingsvarighed, der giver et tilfredsstillende klinisk respons, søges. Behovet for fortsat behandling bør revurderes med jævne mellemrum.
Hvis der opstår tegn og symptomer på tardiv dyskinesi hos en patient på olanzapin, bør seponering af lægemidlet overvejes. Nogle patienter kan dog have behov for behandling med olanzapin på trods af tilstedeværelsen af syndromet.
For specifik information om advarslerne om lithium eller valproat henvises til afsnittet Advarsler i indlægssedlerne for disse andre produkter.
Ortostatisk hypotension
Olanzapin kan inducere ortostatisk hypotension forbundet med svimmelhed, takykardi, bradykardi og, hos nogle patienter, synkope, især i den indledende dosistitreringsperiode, hvilket sandsynligvis afspejler dets α1-adrenerge antagonistiske egenskaber [se Patientrådgivningsinformation ].
Fra en analyse af vitale tegndata i en integreret database med 41 afsluttede kliniske undersøgelser med voksne patienter behandlet med oral olanzapin, blev ortostatisk hypotension registreret hos ≥20 % (1277/6030) af patienterne.
Ved oral behandling med olanzapin kan risikoen for ortostatisk hypotension og synkope minimeres ved at påbegynde behandling med 5 mg QD [se DOSERING OG ADMINISTRATION ]. En mere gradvis titrering til måldosis bør overvejes, hvis der opstår hypotension.
Hypotension, bradykardi med eller uden hypotension, takykardi og synkope blev også rapporteret under de kliniske forsøg med intramuskulært olanzapin til injektion. I et åbent klinisk farmakologisk studie med ikke-agiterede patienter med skizofreni, hvor sikkerheden og tolerabiliteten af intramuskulært olanzapin blev evalueret under et maksimalt doseringsregime (tre 10 mg doser administreret med 4 timers mellemrum), oplevede ca. en tredjedel af disse patienter en signifikant ortostatisk fald i systolisk blodtryk (dvs. fald ≥30 mmHg) [se DOSERING OG ADMINISTRATION ]. Synkope blev rapporteret hos 0,6 % (15/2500) af olanzapin-behandlede patienter i fase 2-3 orale olanzapin-studier og hos 0,3 % (2/722) af olanzapin-behandlede patienter med agitation i de intramuskulære olanzapin-til-injektionsundersøgelser. Tre normale frivillige forsøgspersoner i fase 1-studier med intramuskulær olanzapin oplevede hypotension, bradykardi og sinuspauser på op til 6 sekunder, som spontant forsvandt (i 2 tilfælde forekom reaktionerne på intramuskulært olanzapin og i 1 tilfælde på oralt olanzapin). Risikoen for denne sekvens af hypotension, bradykardi og sinuspause kan være større hos ikke-psykiatriske patienter sammenlignet med psykiatriske patienter, som muligvis er mere tilpassede til visse virkninger af psykofarmaka. Ved intramuskulær olanzapin til injektionsbehandling skal patienter forblive liggende, hvis de er døsige eller svimle efter injektion, indtil undersøgelse har vist, at de ikke oplever postural hypotension, bradykardi og/eller hypoventilation.
Olanzapin bør anvendes med særlig forsigtighed til patienter med kendt kardiovaskulær sygdom (historie med myokardieinfarkt eller iskæmi, hjertesvigt eller ledningsabnormiteter), cerebrovaskulær sygdom og tilstande, der kan disponere patienter for hypotension (dehydrering, hypovolæmi og behandling med antihypertensiv medicin). ) hvor forekomsten af synkope eller hypotension og/eller bradykardi kan sætte patienten i øget medicinsk risiko.
Der skal udvises forsigtighed hos patienter, som får behandling med andre lægemidler, der har virkninger, der kan fremkalde hypotension, bradykardi, respirations- eller centralnervesystemets depression [se DRUGSINTERAKTIONER ]. Samtidig administration af intramuskulært olanzapin og parenteralt benzodiazepin anbefales ikke på grund af muligheden for overdreven sedation og kardiorespiratorisk depression.
Falls
ZYPREXA kan forårsage somnolens, postural hypotension, motorisk og sensorisk ustabilitet, hvilket kan føre til fald og som følge heraf brud eller andre skader. For patienter med sygdomme, tilstande eller medicin, der kan forværre disse virkninger, udfør faldrisikovurderinger ved påbegyndelse af antipsykotisk behandling og tilbagevendende for patienter i langvarig antipsykotisk behandling.
Leukopeni, Neutropeni og Agranulocytose
Klasseeffekt
I kliniske forsøg og/eller efter markedsføring er der rapporteret hændelser af leukopeni/neutropeni, der er tidsmæssigt relateret til antipsykotiske midler, inklusive ZYPREXA. Agranulocytose er også blevet rapporteret.
Mulige risikofaktorer for leukopeni/neutropeni omfatter allerede eksisterende lavt antal hvide blodlegemer (WBC) og historie med lægemiddelinduceret leukopeni/neutropeni. Patienter med en anamnese med en klinisk signifikant lav WBC eller lægemiddelinduceret leukopeni/neutropeni bør have deres fuldstændige blodtælling (CBC) monitoreret hyppigt i løbet af de første par måneder af behandlingen, og seponering af ZYPREXA bør overvejes ved det første tegn på et klinisk signifikant fald. i WBC i mangel af andre årsagsfaktorer.
Patienter med klinisk signifikant neutropeni bør overvåges omhyggeligt for feber eller andre symptomer eller tegn på infektion og behandles omgående, hvis sådanne symptomer eller tegn opstår. Patienter med svær neutropeni (absolut neutrofiltal
Dysfagi
Esophageal dysmotilitet og aspiration er blevet forbundet med antipsykotisk stofbrug. Aspirationspneumoni er en almindelig årsag til morbiditet og dødelighed hos patienter med fremskreden Alzheimers sygdom. Olanzapin er ikke godkendt til behandling af patienter med Alzheimers sygdom.
Anfald
Under præmarketingtestning forekom anfald hos 0,9 % (22/2500) af olanzapin-behandlede patienter. Der var forvirrende faktorer, der kan have bidraget til forekomsten af anfald i mange af disse tilfælde. Olanzapin bør anvendes med forsigtighed hos patienter med en historie med anfald eller med tilstande, der potentielt sænker krampetærsklen, f.eks. Alzheimers demens. Olanzapin er ikke godkendt til behandling af patienter med Alzheimers sygdom. Tilstande, der sænker anfaldstærsklen, kan være mere udbredt i en befolkning på 65 år eller ældre.
Potentiale for kognitiv og motorisk svækkelse
Somnolens var en almindeligt rapporteret bivirkning forbundet med behandling med olanzapin, som forekom med en incidens på 26 % hos olanzapinpatienter sammenlignet med 15 % hos placebopatienter. Denne bivirkning var også dosisrelateret. Somnolens førte til seponering hos 0,4 % (9/2500) af patienterne i præmarketingdatabasen.
Eftersom olanzapin har potentiale til at svække dømmekraft, tænkning eller motoriske færdigheder, bør patienter advares om at betjene farlige maskiner, inklusive biler, indtil de er rimeligt sikre på, at olanzapinbehandling ikke påvirker dem negativt [se Patientrådgivningsinformation ].
Kropstemperaturregulering
Forstyrrelse af kroppens evne til at reducere kropstemperaturen er blevet tilskrevet antipsykotiske midler. Passende pleje tilrådes ved ordinering af olanzapin til patienter, der vil opleve tilstande, der kan bidrage til en stigning i kernekropstemperaturen, f.eks. anstrengende motion, udsættelse for ekstrem varme, samtidig medicinering med antikolinerg aktivitet eller udsat for dehydrering [se PATIENTOPLYSNINGER ].
Anvendelse hos patienter med samtidig sygdom
Klinisk erfaring med olanzapin hos patienter med visse samtidige systemiske sygdomme er begrænset [se KLINISK FARMAKOLOGI ].
Olanzapin udviser in vitro muskarinreceptoraffinitet. I præmarketing kliniske forsøg med olanzapin var olanzapin forbundet med obstipation, mundtørhed og takykardi, alle bivirkninger muligvis relateret til kolinerg antagonisme. Sådanne bivirkninger var ikke ofte grundlaget for seponering af olanzapin, men olanzapin bør anvendes med forsigtighed til patienter med klinisk signifikant prostatahypertrofi, snævervinklet glaukom eller en historie med paralytisk ileus eller relaterede tilstande.
5 placebokontrollerede undersøgelser af olanzapin hos ældre patienter med demensrelateret psykose (n=1184) blev følgende behandlingsudløste bivirkninger rapporteret hos olanzapinbehandlede patienter med en incidens på mindst 2 % og signifikant højere end placebo- behandlede patienter: fald, somnolens, perifert ødem, unormal gang, urininkontinens, sløvhed, øget vægt, asteni, pyreksi, lungebetændelse, mundtørhed og synshallucinationer. Hyppigheden af seponering på grund af bivirkninger var højere med olanzapin end placebo (13 % vs. 7 %). Ældre patienter med demensrelateret psykose behandlet med olanzapin har en øget risiko for død sammenlignet med placebo. Olanzapin er ikke godkendt til behandling af patienter med demensrelateret psykose [se KASSET ADVARSEL , Ældre patienter med demensrelateret psykose , og PATIENTOPLYSNINGER ].
Olanzapin er ikke blevet evalueret eller anvendt i nævneværdigt omfang hos patienter med en nylig historie med myokardieinfarkt eller ustabil hjertesygdom. Patienter med disse diagnoser blev udelukket fra præmarketing kliniske undersøgelser. På grund af risikoen for ortostatisk hypotension med olanzapin bør der udvises forsigtighed hos hjertepatienter [se Ortostatisk hypotension ].
Hyperprolactinæmi
Som med andre lægemidler, der antagoniserer dopamin D2-receptorer, hæver olanzapin prolaktinniveauet, og stigningen fortsætter under kronisk administration. Hyperprolactinæmi kan undertrykke hypothalamus GnRH, hvilket resulterer i reduceret hypofysegonadotropinsekretion. Dette kan igen hæmme den reproduktive funktion ved at svække gonadal steroidogenese hos både kvindelige og mandlige patienter. Galaktoré, amenoré, gynækomasti og impotens er blevet rapporteret hos patienter, der får prolaktin-forhøjende stoffer. Langvarig hyperprolaktinæmi, når det er forbundet med hypogonadisme, kan føre til nedsat knogletæthed hos både kvindelige og mandlige forsøgspersoner.
Vævskulturforsøg indikerer, at ca. en tredjedel af humane brystkræfttilfælde er prolaktinafhængige in vitro, en faktor af potentiel betydning, hvis ordination af disse lægemidler overvejes til en patient med tidligere påvist brystkræft. Som det er almindeligt med forbindelser, der øger prolaktinfrigivelsen, blev der observeret en stigning i brystkirtelneoplasi i olanzapins karcinogenicitetsundersøgelser udført på mus og rotter [se Ikke-klinisk toksikologi ]. Hverken kliniske undersøgelser eller epidemiologiske undersøgelser udført til dato har vist en sammenhæng mellem kronisk administration af denne klasse af lægemidler og tumordannelse hos mennesker; den tilgængelige dokumentation anses for at være for begrænset til at være afgørende på nuværende tidspunkt.
placebokontrollerede olanzapin kliniske undersøgelser (op til 12 uger) blev der observeret ændringer fra normal til høj i prolactinkoncentrationer hos 30 % af de voksne behandlet med olanzapin sammenlignet med 10,5 % af de voksne behandlet med placebo. I en samlet analyse fra kliniske undersøgelser med 8136 voksne behandlet med olanzapin inkluderede potentielt associerede kliniske manifestationer menstruationsrelaterede hændelser1 (2 % [49/3240] af kvinder), seksuel funktionsrelaterede hændelser2 (2 % [150/8136] af kvinderne) og mænd), og brystrelaterede hændelser3 (0,7 % [23/3240] af kvinder, 0,2 % [9/4896] af mænd).
placebokontrollerede olanzapin monoterapiundersøgelser hos unge patienter (op til 6 uger) med skizofreni eller bipolar lidelse I (maniske eller blandede episoder) blev der observeret ændringer fra normal til høj prolaktinkoncentration hos 47 % af olanzapin-behandlede patienter sammenlignet med 7 % af placebo-behandlede patienter. I en samlet analyse fra kliniske forsøg med 454 unge behandlet med olanzapin inkluderede potentielt associerede kliniske manifestationer menstruationsrelaterede hændelser1 (1 % [2/168] af kvinder), seksuel funktionsrelaterede hændelser2 (0,7 % [3/454] af kvinder og mænd ), og brystrelaterede hændelser3 (2 % [3/168] af kvinder, 2 % [7/286] af mænd) [se Brug i specifikke populationer ].
1 Baseret på en søgning på følgende termer: amenoré, hypomenoré, menstruation forsinket og oligomenoré.
2 Baseret på en søgning af følgende udtryk: anorgasmi, forsinket ejakulation, erektil dysfunktion, nedsat libido, tab af libido, unormal orgasme og seksuel dysfunktion.
Baseret på en søgning på følgende udtryk: udflåd fra brystet, forstørrelse eller hævelse, galaktoré, gynækomasti og amningsforstyrrelse.
Dosisgruppeforskelle med hensyn til prolaktinstigning er blevet observeret. I et enkelt 8-ugers randomiseret, dobbeltblindt, fastdosisstudie, der sammenlignede 10 (N=199), 20 (N=200) og 40 (N=200) mg/dag oral olanzapin hos voksne patienter med skizofreni eller skizoaffektiv lidelse, forekomst af prolaktinstigning >24,2 ng/ml (hun) eller >18,77 ng/ml (mandlig) på et hvilket som helst tidspunkt under forsøget (10 mg/dag: 31,2 %; 20 mg/dag: 42,7 %; 40 mg/dag : 61,1 %) indikerede signifikante forskelle mellem 10 vs 40 mg/dag og 20 vs 40 mg/dag.
Brug i kombination med fluoxetin, lithium eller valproat
Når ZYPREXA og fluoxetin bruges i kombination, skal den ordinerende læge også henvise til afsnittet Advarsler og forholdsregler i indlægssedlen til Symbyax. Når ZYPREXA bruges i kombination med lithium eller valproat, skal den ordinerende læge henvise til afsnittene om advarsler og forholdsregler i indlægssedlen for lithium eller valproat [se DRUGSINTERAKTIONER ].
Laboratorieprøver
Fastende blodsukkermåling og lipidprofil i begyndelsen af og periodisk under behandlingen anbefales [se Metaboliske ændringer og PATIENTOPLYSNINGER ].
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( Medicinvejledning ) for de orale formuleringer.
Patienter bør informeres om følgende problemer og bedes om at advare deres ordinerende læge, hvis disse opstår, mens de tager ZYPREXA 15 mg som monoterapi eller i kombination med fluoxetin. Ring til din læge, hvis du ikke tror, du får det bedre eller er bekymret over din tilstand, mens du tager ZYPREXA 2,5 mg. Når du bruger ZYPREXA og fluoxetin i kombination, henvises der også til afsnittet Patientrådgivning i indlægssedlen til Symbyax.
Ældre patienter med demensrelateret psykose: Øget dødelighed og cerebrovaskulære bivirkninger (CVAE), inklusive slagtilfælde
Patienter og pårørende bør informeres om, at ældre patienter med demensrelateret psykose behandlet med antipsykotiske lægemidler har en øget risiko for død. Patienter og pårørende bør informeres om, at ældre patienter med demensrelateret psykose behandlet med ZYPREXA havde en signifikant højere forekomst af cerebrovaskulære bivirkninger (f.eks. slagtilfælde, forbigående iskæmisk anfald) sammenlignet med placebo.
ZYPREXA er ikke godkendt til ældre patienter med demensrelateret psykose [se KASSET ADVARSEL og ADVARSLER OG FORHOLDSREGLER ].
Malignt neuroleptikasyndrom (NMS)
Patienter og pårørende bør rådgives om, at et potentielt dødeligt symptomkompleks, nogle gange omtalt som NMS, er blevet rapporteret i forbindelse med administration af antipsykotiske lægemidler, inklusive ZYPREXA. Tegn og symptomer på NMS omfatter hyperpyreksi, muskelstivhed, ændret mental status og tegn på autonom ustabilitet (uregelmæssig puls eller blodtryk, takykardi, diaforese og hjerterytmeforstyrrelser) [se ADVARSLER OG FORHOLDSREGLER ].
Lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS)
Patienter bør rådes til at rapportere til deres sundhedsplejerske så tidligt som muligt af tegn og symptomer, der kan være forbundet med lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS) [se ADVARSLER OG FORHOLDSREGLER ].
Hyperglykæmi og diabetes mellitus
Patienter bør informeres om den potentielle risiko for hyperglykæmi-relaterede bivirkninger. Patienter bør overvåges regelmæssigt for forværring af glukosekontrol. Patienter, der har diabetes, skal følge deres læges instruktioner om, hvor ofte de skal kontrollere deres blodsukker, mens de tager ZYPREXA [se ADVARSLER OG FORHOLDSREGLER ].
Dyslipidæmi
Patienterne skal informeres om, at der er opstået dyslipidæmi under behandling med ZYPREXA. Patienter bør have deres lipidprofil overvåget regelmæssigt [se ADVARSLER OG FORHOLDSREGLER ].
Vægtøgning
Patienterne skal rådgives om, at der er sket vægtøgning under behandling med ZYPREXA. Patienter bør have deres vægt overvåget regelmæssigt [se ADVARSLER OG FORHOLDSREGLER ].
Ortostatisk hypotension
Patienter bør informeres om risikoen for ortostatisk hypotension, især i perioden med initial dosistitrering og i forbindelse med brug af samtidig medicin, der kan forstærke den ortostatiske virkning af ZYPREXA, f.eks. diazepam eller alkohol [se ADVARSLER OG FORHOLDSREGLER og DRUGSINTERAKTIONER ]. Patienter bør rådes til omhyggeligt at skifte stilling for at hjælpe med at forhindre ortostatisk hypotension og at lægge sig ned, hvis de føler sig svimmel eller besvime, indtil de føler sig bedre. Patienter bør rådes til at ringe til deres læge, hvis de oplever nogle af følgende tegn og symptomer forbundet med ortostatisk hypotension: svimmelhed, hurtig eller langsom hjerterytme eller besvimelse.
Potentiale for kognitiv og motorisk svækkelse
Da ZYPREXA har potentiale til at svække dømmekraft, tænkning eller motoriske færdigheder, bør patienter advares om at betjene farlige maskiner, inklusive biler, indtil de er rimeligt sikre på, at ZYPREXA-behandling ikke påvirker dem negativt [se ADVARSLER OG FORHOLDSREGLER ].
Kropstemperaturregulering
Patienter bør rådgives om passende pleje for at undgå overophedning og dehydrering. Patienter bør rådes til at ringe til deres læge med det samme, hvis de bliver alvorligt syge og har nogle eller alle disse symptomer på dehydrering: sveder for meget eller slet ikke, mundtørhed, meget varme, tørst, ikke i stand til at producere urin [ se ADVARSLER OG FORHOLDSREGLER ].
Samtidig medicinering
Patienter bør rådes til at informere deres sundhedspersonale, hvis de tager eller planlægger at tage Symbyax. Patienter bør også rådes til at informere deres sundhedspersonale, hvis de tager, planlægger at tage eller er holdt op med at tage receptpligtig eller håndkøbsmedicin, herunder naturlægemidler, da der er mulighed for interaktioner [se DRUGSINTERAKTIONER ].
Alkohol
Patienter skal rådes til at undgå alkohol, mens de tager ZYPREXA [se DRUGSINTERAKTIONER ].
Fenylketonurik
ZYPREXA 10mg ZYDIS (olanzapin oralt disintegrerende tabletter) indeholder phenylalanin (henholdsvis 0,34, 0,45, 0,67 eller 0,90 mg pr. 5, 10, 15 eller 20 mg tablet) [se BESKRIVELSE ].
Brug i specifikke populationer
Graviditet
Råd kvinder om at underrette deres læge, hvis de bliver gravide eller har til hensigt at blive gravide under behandling med ZYPREXA. Informer patienter om, at ZYPREXA kan forårsage ekstrapyramidale og/eller abstinenssymptomer (agitation, hypertoni, hypotoni, tremor, somnolens, åndedrætsbesvær og spiseforstyrrelser) hos en nyfødt. Rådgiv patienterne om, at der er et graviditetseksponeringsregister, der overvåger graviditetsresultater hos kvinder, der er eksponeret for ZYPREXA 7,5 mg under graviditeten [se Brug i specifikke populationer ].
Amning
Råd ammende kvinder, der bruger ZYPREXA 20 mg, til at overvåge spædbørn for overdreven sedation, irritabilitet, dårlig ernæring og ekstrapyramidale symptomer (rysten og unormale muskelbevægelser) og til at søge lægehjælp, hvis de bemærker disse tegn. [se Brug i specifikke populationer ].
Infertilitet
Informer kvinder med reproduktionspotentiale om, at ZYPREXA kan svække fertiliteten på grund af en stigning i serumprolaktinniveauet. Virkningerne på fertiliteten er reversible [se Brug i specifikke populationer ].
Pædiatrisk brug
ZYPREXA 15 mg er indiceret til behandling af skizofreni og maniske eller blandede episoder forbundet med bipolar lidelse I hos unge i alderen 13 til 17 år. Sammenlignet med patienter fra kliniske forsøg med voksne, var det sandsynligt, at unge tog mere på i vægt, oplevede øget sedation og havde større stigninger i totalt kolesterol, triglycerider, LDL-kolesterol, prolaktin og hepatiske aminotransferaseniveauer. Patienterne skal rådgives om de potentielle langsigtede risici forbundet med ZYPREXA og informeres om, at disse risici kan få dem til at overveje andre lægemidler først [se INDIKATIONER OG BRUG ]. Sikkerhed og effektivitet af ZYPREXA 5mg hos patienter under 13 år er ikke blevet fastlagt. Sikkerhed og effekt af ZYPREXA 15 mg og fluoxetin i kombination hos patienter i alderen 10 til 17 år er blevet fastslået til akut behandling af depressive episoder forbundet med bipolar I lidelse. Sikkerhed og effektivitet af ZYPREXA og fluoxetin i kombination hos patienter ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
Behov for omfattende behandlingsprogram hos pædiatriske patienter
ZYPREXA 20mg er indiceret som en integreret del af et samlet behandlingsprogram for pædiatriske patienter med skizofreni og bipolar lidelse, der kan omfatte andre foranstaltninger (psykologiske, pædagogiske, sociale) for patienter med lidelsen. Effektiviteten og sikkerheden af ZYPREXA 7,5 mg er ikke blevet fastslået hos pædiatriske patienter under 13 år. Atypiske antipsykotika er ikke beregnet til brug hos den pædiatriske patient, som udviser symptomer sekundært til miljøfaktorer og/eller andre primære psykiatriske lidelser. Passende uddannelsesplacering er afgørende, og psykosocial intervention er ofte nyttig. Beslutningen om at ordinere atypisk antipsykotisk medicin vil afhænge af sundhedsudbyderens vurdering af kroniske karakter og sværhedsgraden af patientens symptomer [se INDIKATIONER OG BRUG ].
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
Orale carcinogenicitetsundersøgelser blev udført på mus og rotter. Olanzapin blev administreret til mus i to 78-ugers undersøgelser i doser på 3, 10, 30/20 mg/kg/dag (svarende til 0,8-5 gange den daglige orale MRHD baseret på mg/m² kropsoverfladeareal) og 0,25, 2 , 8 mg/kg/dag (svarende til 0,06-2 gange den daglige orale MRHD baseret på mg/m² kropsoverfladeareal). Rotter blev doseret i 2 år i doser på 0,25, 1, 2,5, 4 mg/kg/dag (hanner) og 0,25, 1, 4, 8 mg/kg/dag (hunner) (svarende til 0,13-2 og 0,13-4 gange den daglige orale MRHD baseret på henholdsvis mg/m² kropsoverflade). Forekomsten af leverhæmangiomer og hæmangiosarkomer var signifikant øget i 1 museundersøgelse i hunmus ved 2 gange den daglige orale MRHD baseret på mg/m² kropsoverfladeareal. Disse tumorer blev ikke øget i et andet musestudie med hunner doseret op til 2-5 gange den daglige orale MRHD baseret på mg/m² kropsoverfladeareal; i denne undersøgelse var der en høj forekomst af tidlig dødelighed hos mænd i 30/20 mg/kg/dag-gruppen. Forekomsten af mælkekirteladenomer og adenokarcinomer var signifikant øget hos hunmus doseret ved ≥2 mg/kg/dag og hos hunrotter doseret ved ≥4 mg/kg/dag (0,5 og 2 gange den daglige orale MRHD baseret på mg/m²) henholdsvis kropsoverfladeareal). Det har vist sig, at antipsykotiske lægemidler kronisk hæver prolaktinniveauet hos gnavere. Serumprolaktinniveauer blev ikke målt under olanzapins karcinogenicitetsundersøgelser; målinger under subkroniske toksicitetsundersøgelser viste imidlertid, at olanzapin forhøjede serumprolaktinniveauer op til 4 gange hos rotter ved de samme doser som i karcinogenicitetsstudiet. En stigning i mælkekirtelneoplasmer er fundet hos gnavere efter kronisk administration af andre antipsykotiske lægemidler og anses for at være prolaktinmedieret. Relevansen for human risiko for fundet af prolaktin-medierede endokrine tumorer hos gnavere er ukendt [se ADVARSLER OG FORHOLDSREGLER ].
Mutagenese
Der blev ikke fundet tegn på genotoksisk potentiale for olanzapin i Ames reverse mutation test, in vivo mikronucleus test i mus, kromosomafvigelsestest i kinesisk hamster ovarieceller, ikke-planlagt DNA syntese test i rotte hepatocytter, induktion af forward mutation test i muse lymfomceller , eller in vivo søsterkromatidudvekslingstest i knoglemarv hos kinesiske hamstere.
Forringelse af fertilitet
et oralt fertilitets- og reproduktionsstudie hos rotter blev han-parringsydelsen, men ikke fertiliteten, svækket ved en dosis på 22,4 mg/kg/dag, og hunkøns fertilitet blev nedsat ved en dosis på 3 mg/kg/dag (11 og 1,5). gange den daglige orale MRHD baseret på henholdsvis mg/m² kropsoverflade). Seponering af olanzapinbehandling vendte virkningerne på mandlig parringsydelse. Hos hunrotter blev den præcoitale periode øget, og parringsindekset reduceret med 5 mg/kg/dag (2,5 gange den daglige orale MRHD baseret på mg/m² kropsoverfladeareal). Diestrous var forlænget og brunst forsinket med 1,1 mg/kg/dag (0,6 gange den daglige orale MRHD baseret på mg/m² kropsoverfladeareal); derfor kan olanzapin forårsage en forsinkelse i ægløsning.
Brug i specifikke populationer
Når du bruger ZYPREXA og fluoxetin i kombination, se også afsnittet Anvendelse i specifikke populationer i indlægssedlen til Symbyax.
Graviditet
Graviditetseksponeringsregister
Der er et graviditetseksponeringsregister, der overvåger graviditetsresultater hos kvinder, der er udsat for atypiske antipsykotika, herunder ZYPREXA, under graviditet. Sundhedsudbydere opfordres til at registrere patienter ved at kontakte National Pregnancy Registry for Atypical Antipsychotics på 1-866-961-2388 eller besøge http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/.
Risikooversigt
Nyfødte, der er udsat for antipsykotiske lægemidler, inklusive ZYPREXA, i løbet af tredje trimester er i risiko for ekstrapyramidale og/eller abstinenssymptomer efter fødslen (se Kliniske overvejelser ). Overordnede tilgængelige data fra publicerede epidemiologiske undersøgelser af gravide kvinder udsat for olanzapin har ikke påvist en lægemiddelassocieret risiko for alvorlige fødselsdefekter, abort eller uønskede maternelle eller føtale udfald (se Data ). Der er risici for moderen forbundet med ubehandlet skizofreni eller bipolar lidelse I og med eksponering for antipsykotika, herunder ZYPREXA 7,5 mg, under graviditet (se Kliniske overvejelser ).
Olanzapin var ikke teratogent, når det blev administreret oralt til gravide rotter og kaniner i doser, der er 9 og 30 gange den daglige orale maksimale anbefalede humane dosis (MRHD), baseret på mg/m² kropsoverfladeareal; nogle føtale toksiciteter blev observeret ved disse doser (se Data ).
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort for de angivne populationer er ukendt. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre ugunstige udfald. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 % til 4 % og 15 % til 20 %.
Kliniske overvejelser
Sygdomsassocieret moder- og embryo-/fosterrisiko
Der er en risiko for moderen fra ubehandlet skizofreni eller bipolar lidelse I, herunder øget risiko for tilbagefald, hospitalsindlæggelse og selvmord. Skizofreni og bipolar lidelse I er forbundet med øgede uønskede perinatale udfald, herunder for tidlig fødsel. Det vides ikke, om dette er et direkte resultat af sygdommen eller andre komorbide faktorer.
Fetale/neonatale bivirkninger
Ekstrapyramidale og/eller abstinenssymptomer, herunder agitation, hypertoni, hypotoni, tremor, somnolens, åndedrætsbesvær og spiseforstyrrelser er blevet rapporteret hos nyfødte, som blev udsat for antipsykotiske lægemidler, inklusive ZYPREXA 2,5 mg, i løbet af tredje trimester af graviditeten. Disse symptomer har varieret i sværhedsgrad. Overvåg nyfødte for ekstrapyramidale og/eller abstinenssymptomer og håndtering af symptomerne på passende vis. Nogle nyfødte kom sig inden for timer eller dage uden specifik behandling; andre krævede længere tids indlæggelse.
Data
Menneskelige data
Placental passage er blevet rapporteret i publicerede undersøgelsesrapporter; placentapassageforholdet var imidlertid meget variabelt varierende mellem 7 % og 167 % ved fødslen efter eksponering under graviditet. Den kliniske relevans af dette fund er ukendt.
Publicerede data fra observationsstudier, fødselsregistre og case-rapporter, der har evalueret brugen af atypiske antipsykotika under graviditet, fastslår ikke en øget risiko for større fødselsdefekter. Et retrospektivt kohortestudie fra en Medicaid-database med 9258 kvinder, der blev eksponeret for antipsykotika under graviditet, indikerede ikke en samlet øget risiko for alvorlige fødselsdefekter.
Dyredata
orale reproduktionsundersøgelser med rotter i doser op til 18 mg/kg/dag og i kaniner i doser op til 30 mg/kg/dag (henholdsvis 9 og 30 gange den daglige orale MRHD baseret på mg/m² kropsoverfladeareal). ingen tegn på teratogenicitet blev observeret. I et oralt teratologisk studie med rotter blev tidlige resorptioner og øget antal ikke-levedygtige fostre observeret ved en dosis på 18 mg/kg/dag (9 gange den daglige orale MRHD baseret på mg/m² kropsoverfladeareal), og drægtigheden blev forlænget ved 10. mg/kg/dag (5 gange den daglige orale MRHD baseret på mg/m² kropsoverfladeareal). I et oralt kanin-teratologisk studie forekom føtal toksicitet, der manifesterede sig som øgede resorptioner og nedsat føtal vægt, ved en modertoksisk dosis på 30 mg/kg/dag (30 gange den daglige orale MRHD baseret på mg/m² legemsoverfladeareal).
Amning
Risikooversigt
Olanzapin findes i modermælk. Der er rapporter om overdreven sedation, irritabilitet, dårlig ernæring og ekstrapyramidale symptomer (skælven og unormale muskelbevægelser) hos spædbørn, der er udsat for olanzapin gennem modermælken (se Kliniske overvejelser ). Der er ingen information om virkningen af olanzapin på mælkeproduktionen.
De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for ZYPREXA og eventuelle negative virkninger på det ammede barn fra ZYPREXA eller fra moderens underliggende tilstand.
Kliniske overvejelser
Spædbørn, der udsættes for ZYPREXA 7,5 mg, bør overvåges for overdreven sedation, irritabilitet, dårlig ernæring og ekstrapyramidale symptomer (rysten og unormale muskelbevægelser).
Hunner og mænd med reproduktionspotentiale
Infertilitet
Kvinder
Baseret på den farmakologiske virkning af olanzapin (D2-receptorantagonisme), kan behandling med ZYPREXA resultere i en stigning i serumprolaktinniveauer, hvilket kan føre til en reversibel reduktion i fertilitet hos kvinder med reproduktionspotentiale [se ADVARSLER OG FORHOLDSREGLER ].
Pædiatrisk brug
Sikkerheden og effektiviteten af oral ZYPREXA til behandling af skizofreni og maniske eller blandede episoder associeret med bipolar I-lidelse blev fastlagt i korttidsundersøgelser hos unge (i alderen 13 til 17 år). Brug af ZYPREXA til unge understøttes af beviser fra tilstrækkelige og velkontrollerede undersøgelser af ZYPREXA 5 mg, hvor 268 unge fik ZYPREXA 20 mg i et interval på 2,5 til 20 mg/dag [se Kliniske Studier ]. Den anbefalede startdosis for unge er lavere end den for voksne [se DOSERING OG ADMINISTRATION ]. Sammenlignet med patienter fra kliniske forsøg med voksne, var det sandsynligt, at teenagere ville tage mere på i vægt, opleve øget sedation og have større stigninger i totalt kolesterol, triglycerider, LDL-kolesterol, prolaktin og hepatiske aminotransferaseniveauer [se ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ]. Når der skal vælges blandt de alternative behandlinger, der er tilgængelige for unge, bør klinikere overveje det øgede potentiale (hos teenagere sammenlignet med voksne) for vægtøgning og dyslipidæmi. Klinikere bør overveje de potentielle langsigtede risici, når de ordinerer til unge, og i mange tilfælde kan dette få dem til at overveje at ordinere andre lægemidler først til unge [se INDIKATIONER OG BRUG ].
Sikkerhed og effektivitet af olanzapin hos børn PATIENTOPLYSNINGER ].
Sikkerhed og effekt af ZYPREXA 7,5 mg og fluoxetin i kombination hos børn og unge (10 til 17 år) er blevet fastslået til akut behandling af depressive episoder forbundet med bipolar I lidelse.
Sikkerhed og effektivitet af ZYPREXA og fluoxetin i kombination hos børn
Geriatrisk brug
Af de 2500 patienter i præmarketing kliniske studier med oral olanzapin var 11 % (263) 65 år eller derover. Hos patienter med skizofreni var der ingen indikation af anderledes tolerabilitet af olanzapin hos ældre sammenlignet med yngre patienter. Undersøgelser af ældre patienter med demensrelateret psykose har antydet, at der kan være en anden tolerabilitetsprofil i denne population sammenlignet med yngre patienter med skizofreni. Ældre patienter med demensrelateret psykose behandlet med olanzapin har en øget risiko for død sammenlignet med placebo. I placebokontrollerede undersøgelser af olanzapin hos ældre patienter med demensrelateret psykose var der en højere forekomst af cerebrovaskulære bivirkninger (f.eks. slagtilfælde, forbigående iskæmisk anfald) hos patienter behandlet med olanzapin sammenlignet med patienter behandlet med placebo. Olanzapin er ikke godkendt til behandling af patienter med demensrelateret psykose. Tilstedeværelsen af faktorer, der kan nedsætte farmakokinetisk clearance eller øge det farmakodynamiske respons på olanzapin, bør også føre til overvejelse af en lavere startdosis for enhver geriatrisk patient [se KASSET ADVARSEL , DOSERING OG ADMINISTRATION , og ADVARSLER OG FORHOLDSREGLER ].
Kliniske undersøgelser af ZYPREXA og fluoxetin i kombination omfattede ikke et tilstrækkeligt antal patienter ≥65 år til at afgøre, om de reagerer anderledes end yngre patienter.
OVERDOSIS
Menneskelig oplevelse
I præmarketingforsøg, der involverede mere end 3100 patienter og/eller normale forsøgspersoner, blev utilsigtet eller tilsigtet akut overdosering af olanzapin identificeret hos 67 patienter. Hos patienten, der tog den største identificerede mængde, 300 mg, var de eneste rapporterede symptomer døsighed og sløret tale. Hos det begrænsede antal patienter, der blev evalueret på hospitaler, inklusive patienten, der tog 300 mg, var der ingen observationer, der indikerede en negativ ændring i laboratorieanalytter eller EKG. Vitale tegn var normalt inden for normale grænser efter overdosering.
postmarketingrapporter om overdosering med olanzapin alene, er symptomer blevet rapporteret i de fleste tilfælde. Hos symptomatiske patienter omfattede symptomer med ≥10 % forekomst agitation/aggressivitet, dysartri, takykardi, forskellige ekstrapyramidale symptomer og nedsat bevidsthedsniveau lige fra sedation til koma. Blandt mindre almindeligt rapporterede symptomer var følgende potentielt medicinsk alvorlige reaktioner: aspiration, hjerte-lungestop, hjertearytmier (såsom supraventrikulær takykardi og 1 patient, der oplevede sinuspause med spontan genoptagelse af normal rytme), delirium, mulig neuroleptisk malignt respiratorisk depression/syndrom. , kramper, hypertension og hypotension. Eli Lilly and Company har modtaget rapporter om dødsfald i forbindelse med overdosis af olanzapin alene. I 1 tilfælde af død blev mængden af akut indtaget olanzapin muligvis rapporteret til at være så lav som 450 mg oral olanzapin; i et andet tilfælde blev en patient imidlertid rapporteret at overleve en akut olanzapinindtagelse af ca. 2 g oralt olanzapin.
Håndtering af overdosis
Kontakt et certificeret giftkontrolcenter (1-800-222-1222 eller www.poison.org) for at få aktuelle oplysninger om håndtering af ZYPREXA (olanzapin) overdosis. Muligheden for involvering af flere lægemidler bør overvejes. I tilfælde af akut overdosering skal der etableres og vedligeholdes en luftvej og sikres tilstrækkelig iltning og ventilation, hvilket kan omfatte intubation. Maveskylning (efter intubation, hvis patienten er bevidstløs) og administration af aktivt kul sammen med et afføringsmiddel bør overvejes. Administration af aktivt kul (1 g) reducerede Cmax og AUC for oral olanzapin med ca. 60 %. Da maksimale olanzapinniveauer typisk ikke opnås før omkring 6 timer efter dosering, kan trækul være en nyttig behandling for overdosering af olanzapin.
Muligheden for forstuvning, kramper eller dystoniske reaktioner i hoved og hals efter overdosering kan skabe en risiko for aspiration med fremkaldt emesis. Kardiovaskulær monitorering bør påbegyndes øjeblikkeligt og bør omfatte kontinuerlig elektrokardiografisk monitorering for at påvise mulige arytmier.
Der er ingen specifik modgift mod olanzapin. Derfor bør der iværksættes passende støtteforanstaltninger. Hypotension og kredsløbskollaps bør behandles med passende foranstaltninger såsom intravenøse væsker og/eller sympatomimetika. (Brug ikke epinephrin, dopamin eller andre sympatomimetika med beta-agonist-aktivitet, da beta-stimulering kan forværre hypotension i forbindelse med olanzapin-induceret alfa-blokade.) Tæt medicinsk overvågning og monitorering bør fortsætte, indtil patienten kommer sig.
For specifik information om overdosering med lithium eller valproat henvises til afsnittet Overdosering i indlægssedlen til disse produkter. For specifik information om overdosering med olanzapin og fluoxetin i kombination henvises til afsnittet Overdosering i indlægssedlen til Symbyax.
KONTRAINDIKATIONER
- Ingen med ZYPREXA monoterapi.
- Når du bruger ZYPREXA og fluoxetin i kombination, se også afsnittet Kontraindikationer i indlægssedlen til Symbyax.
- For specifik information om kontraindikationerne for lithium eller valproat henvises til afsnittet Kontraindikationer i indlægssedlen for disse andre produkter.
KLINISK FARMAKOLOGI
Handlingsmekanisme
Virkningsmekanismen af olanzapin i de anførte indikationer er uklar. Effekten af olanzapin ved skizofreni kan imidlertid medieres gennem en kombination af dopamin og serotonin type 2 (5HT2) antagonisme.
Farmakodynamik
Olanzapin binder sig med høj affinitet til følgende receptorer: serotonin 5HT2A/2C, 5HT6 (henholdsvis Ki=4, 11 og 5 nM), dopamin D1-4 (Ki=11-31 nM), histamin H1 (Ki=7 nM) ) og adrenerge al-receptorer (Ki=19 nM). Olanzapin er en antagonist med moderat affinitetsbinding for henholdsvis serotonin 5HT3 (Ki=57 nM) og muskarin M1-5 (Ki=73, 96, 132, 32 og 48 nM). Olanzapin binder med lav affinitet til GABAA, BZD og β-adrenerge receptorer (Ki>10 μM).
Farmakokinetik
Oral administration, monoterapi
Olanzapin absorberes godt og når maksimale koncentrationer i løbet af ca. 6 timer efter en oral dosis. Det elimineres i vid udstrækning ved first pass-metabolisme, hvor ca. 40 % af dosis metaboliseres, før det når det systemiske kredsløb. Mad påvirker ikke hastigheden eller omfanget af olanzapins absorption. Farmakokinetiske undersøgelser viste, at ZYPREXA 5 mg tabletter og ZYPREXA ZYDIS (olanzapin oralt disintegrerende tabletter) doseringsformer af olanzapin er bioækvivalente.
Olanzapin udviser lineær kinetik over det kliniske doseringsområde. Dets halveringstid varierer fra 21 til 54 timer (5. til 95. percentil; gennemsnit på 30 timer), og tilsyneladende plasmaclearance varierer fra 12 til 47 l/time (5. til 95. percentil; gennemsnit på 25 l/time).
Administration af olanzapin én gang dagligt fører til steady-state koncentrationer på ca. 1 uge, som er ca. det dobbelte af koncentrationerne efter enkeltdoser. Plasmakoncentrationer, halveringstid og clearance af olanzapin kan variere mellem individer på basis af rygestatus, køn og alder.
Olanzapin er udstrakt fordelt i hele kroppen med et distributionsvolumen på ca. 1000 l. Det er 93 % bundet til plasmaproteiner over koncentrationsområdet 7 til 1100 ng/ml, og binder primært til albumin og α1-syre glycoprotein.
Metabolisme og eliminering
Efter en enkelt oral dosis af 14C-mærket olanzapin blev 7 % af dosen af olanzapin genfundet i urinen som uændret lægemiddel, hvilket indikerer, at olanzapin er stærkt metaboliseret. Ca. 57 % og 30 % af dosis blev genfundet i henholdsvis urin og fæces. I plasma udgjorde olanzapin kun 12 % af AUC for total radioaktivitet, hvilket indikerer betydelig eksponering for metabolitter. Efter gentagen dosering var de vigtigste cirkulerende metabolitter 10-N-glucuronid, til stede ved steady state ved 44 % af koncentrationen af olanzapin, og 4´-N-desmethyl olanzapin, til stede ved steady state ved 31 % af koncentrationen af olanzapin . Begge metabolitter mangler farmakologisk aktivitet ved de observerede koncentrationer.
Direkte glucuronidering og cytochrom P450 (CYP)-medieret oxidation er de primære metaboliske veje for olanzapin. In vitro undersøgelser tyder på, at CYP 1A2 og 2D6 og det flavinholdige monooxygenasesystem er involveret i olanzapinoxidation. CYP2D6-medieret oxidation ser ud til at være en mindre metabolisk vej in vivo, fordi clearance af olanzapin ikke er reduceret hos forsøgspersoner med mangel på dette enzym.
Intramuskulær administration
ZYPREXA IntraMuscular resulterer i hurtig absorption med maksimale plasmakoncentrationer inden for 15 til 45 minutter. Baseret på en farmakokinetisk undersøgelse hos raske frivillige giver en dosis på 5 mg intramuskulært olanzapin til injektion i gennemsnit en maksimal plasmakoncentration, der er ca. 5 gange højere end den maksimale plasmakoncentration, der produceres af en dosis på 5 mg oralt olanzapin. Arealet under kurven opnået efter en intramuskulær dosis svarer til det, der opnås efter oral administration af den samme dosis. Den observerede halveringstid efter intramuskulær administration svarer til den, der observeres efter oral dosering. Farmakokinetikken er lineær over det kliniske doseringsområde. Metaboliske profiler efter intramuskulær administration svarer kvalitativt til metaboliske profiler efter oral administration.
Specifikke populationer
Nedsat nyrefunktion
Fordi olanzapin i høj grad metaboliseres før udskillelse, og kun 7 % af lægemidlet udskilles uændret, er det usandsynligt, at nyreinsufficiens alene vil have en større indvirkning på olanzapins farmakokinetik. De farmakokinetiske egenskaber for olanzapin var ens hos patienter med svært nedsat nyrefunktion og normale forsøgspersoner, hvilket indikerer, at dosisjustering baseret på graden af nedsat nyrefunktion ikke er nødvendig. Derudover fjernes olanzapin ikke ved dialyse. Virkningen af nyreinsufficiens på metabolitelimineringen er ikke blevet undersøgt.
Nedsat leverfunktion
Selvom tilstedeværelsen af nedsat leverfunktion kan forventes at reducere clearance af olanzapin, afslørede en undersøgelse af virkningen af nedsat leverfunktion hos forsøgspersoner (n=6) med klinisk signifikant (Childs Pugh Klassifikation A og B) cirrhose ringe effekt på farmakokinetikken. af olanzapin.
Geriatrisk
en undersøgelse med 24 raske forsøgspersoner var den gennemsnitlige eliminationshalveringstid for olanzapin ca. 1,5 gange større hos ældre (≥65 år) end hos ikke-ældre forsøgspersoner ( DOSERING OG ADMINISTRATION ].
Køn
Clearance af olanzapin er ca. 30 % lavere hos kvinder end hos mænd. Der var dog ingen tydelige forskelle mellem mænd og kvinder i effektivitet eller bivirkninger. Dosisændringer baseret på køn bør ikke være nødvendige.
Rygestatus
Olanzapin-clearance er omkring 40 % højere hos rygere end hos ikke-rygere, selvom dosisændringer ikke rutinemæssigt anbefales.
Race
In vivo undersøgelser har vist, at eksponeringen er ens blandt japanere, kinesere og kaukasiere, især efter normalisering for forskelle i kropsvægt. Dosisændringer for race anbefales derfor ikke.
Kombinerede effekter
De kombinerede virkninger af alder, rygning og køn kan føre til væsentlige farmakokinetiske forskelle i populationer. Clearance hos unge rygende mænd kan for eksempel være 3 gange højere end hos ældre ikke-rygende kvinder. Dosisændring kan være nødvendig hos patienter, som udviser en kombination af faktorer, der kan resultere i langsommere metabolisme af olanzapin [se DOSERING OG ADMINISTRATION ].
Unge (13 til 17 år)
I kliniske undersøgelser var de fleste unge ikke-rygere, og denne population havde en lavere gennemsnitlig kropsvægt, hvilket resulterede i højere gennemsnitlig eksponering for olanzapin sammenlignet med voksne.
Dyretoksikologi og/eller farmakologi
dyreforsøg med olanzapin var de vigtigste hæmatologiske fund reversible perifere cytopenier hos individuelle hunde doseret med 10 mg/kg (17 gange den daglige orale MRHD baseret på mg/m² kropsoverfladeareal), dosisrelaterede fald i lymfocytter og neutrofiler hos mus og lymfopeni hos rotter. Nogle få hunde behandlet med 10 mg/kg udviklede reversibel neutropeni og/eller reversibel hæmolytisk anæmi mellem 1 og 10 måneders behandling. Dosisrelaterede fald i lymfocytter og neutrofiler blev set hos mus, der fik doser på 10 mg/kg (svarende til 2 gange den daglige orale MRHD baseret på mg/m² kropsoverfladeareal) i undersøgelser af 3 måneders varighed. Uspecifik lymfopeni, i overensstemmelse med nedsat kropsvægtøgning, forekom hos rotter, der fik 22,5 mg/kg (11 gange den daglige orale MRHD baseret på mg/m² kropsoverfladeareal) i 3 måneder eller 16 mg/kg (8 gange den daglige orale MRHD baseret på på mg/m² kropsoverflade) i 6 eller 12 måneder. Der blev ikke fundet tegn på knoglemarvscytotoksicitet hos nogen af de undersøgte arter. Knoglemarv var normocellulære eller hypercellulære, hvilket indikerer, at reduktionerne i cirkulerende blodceller sandsynligvis skyldtes perifere (ikke-marvs) faktorer.
Kliniske Studier
Når du bruger ZYPREXA 7,5 mg og fluoxetin i kombination, se også afsnittet om kliniske undersøgelser i indlægssedlen til Symbyax.
Skizofreni
Voksne
Effekten af oral olanzapin til behandling af skizofreni blev fastslået i 2 kortvarige (6-ugers) kontrollerede forsøg med voksne indlagte patienter, som opfyldte DSM III-R kriterierne for skizofreni. En enkelt haloperidolarm blev inkluderet som en sammenlignende behandling i 1 af de 2 forsøg, men dette forsøg sammenlignede ikke disse 2 lægemidler på hele spektret af klinisk relevante doser for begge.
Adskillige instrumenter blev brugt til at vurdere psykiatriske tegn og symptomer i disse undersøgelser, blandt dem Brief Psychiatric Rating Scale (BPRS), en multi-item opgørelse over generel psykopatologi, der traditionelt bruges til at evaluere virkningerne af lægemiddelbehandling ved skizofreni. BPRS-psykoseklyngen (konceptuel desorganisering, hallucinatorisk adfærd, mistænksomhed og usædvanligt tankeindhold) betragtes som en særlig nyttig undergruppe til vurdering af aktivt psykotiske skizofrene patienter. En anden traditionel vurdering, Clinical Global Impression (CGI), afspejler indtrykket af en dygtig observatør, som er fuldt fortrolig med manifestationerne af skizofreni, om patientens overordnede kliniske tilstand. Desuden blev der anvendt 2 nyere udviklede vægte; disse omfattede 30-elements Positive og Negative Symptoms Scale (PANSS), hvori de 18 punkter i BPRS er indlejret, og Scale for Assessing Negative Symptoms (SANS). Forsøgsresuméerne nedenfor fokuserer på følgende resultater: PANSS total og/eller BPRS total; BPRS psykose klynge; PANSS negativ underskala eller SANS; og CGI-alvorlighed. Resultaterne af forsøgene følger:
(1) I et 6-ugers, placebokontrolleret forsøg (n=149), der involverede 2 faste olanzapin doser på 1 og 10 mg/dag (en gang dagligt program), olanzapin, ved 10 mg/dag (men ikke ved 1 mg/dag) dag), var overlegen i forhold til placebo på PANSS-totalscore (også på den ekstraherede BPRS-total), på BPRS-psykoseklyngen, på PANSS Negative-underskalaen og på CGI-alvorlighed.
(2) I et 6-ugers, placebokontrolleret forsøg (n=253), der involverede 3 faste dosisintervaller af olanzapin (5 ± 2,5 mg/dag, 10 ± 2,5 mg/dag og 15 ± 2,5 mg/dag) på en en gang dagligt skema var de 2 højeste olanzapindosisgrupper (faktiske gennemsnitsdoser på henholdsvis 12 og 16 mg/dag) overlegne end placebo på BPRS total score, BPRS psykosecluster og CGI sværhedsgradsscore; den højeste olanzapindosisgruppe var bedre end placebo på SANS. Der var ingen klar fordel for højdosisgruppen i forhold til middeldosisgruppen.
(3) I et længerevarende forsøg blev voksne ambulante patienter (n=326), som overvejende opfyldte DSM-IV-kriterierne for skizofreni, og som forblev stabile på olanzapin under åben behandling i mindst 8 uger, randomiseret til at fortsætte med deres nuværende olanzapin doser (fra 10 til 20 mg/dag) eller placebo. Opfølgningsperioden for at observere patienter for tilbagefald, defineret i form af stigninger i BPRS positive symptomer eller hospitalsindlæggelse, var planlagt til 12 måneder, men kriterierne var opfyldt for at stoppe forsøget tidligt på grund af et overskud af placebo-tilbagefald sammenlignet med olanzapin-tilbagefald , og olanzapin var overlegen i forhold til placebo til tiden til tilbagefald, det primære resultat for denne undersøgelse. Således var olanzapin mere effektivt end placebo til at opretholde effekten hos patienter stabiliseret i ca. 8 uger og fulgt i en observationsperiode på op til 8 måneder.
Undersøgelse af befolkningsundergrupper (race og køn) afslørede ikke nogen differentiel reaktionsevne på basis af disse undergrupper.
Teenagere
Effekten af oral olanzapin til akut behandling af skizofreni hos unge (i alderen 13 til 17 år) blev fastslået i et 6-ugers dobbeltblindt, placebokontrolleret, randomiseret forsøg med indlagte og ambulante patienter med skizofreni (n=107), som mødte diagnostiske kriterier i henhold til DSM-IV-TR og bekræftet af Kiddie Schedule for Affective Disorders and Schizophrenia for School Aged Children-Present and Lifetime Version (K-SADS-PL).
Det primære vurderingsinstrument, der blev brugt til at vurdere psykiatriske tegn og symptomer i dette forsøg, var den forankrede version af den samlede score for den korte psykiatriske vurderingsskala for børn (BPRS-C).
dette fleksible dosisforsøg var olanzapin 2,5 til 20 mg/dag (gennemsnitlig modal dosis 12,5 mg/dag, gennemsnitlig dosis på 11,1 mg/dag) mere effektivt end placebo til behandling af unge diagnosticeret med skizofreni, som understøttet af den statistiske signifikant større gennemsnitlig reduktion i BPRS-C totalscore for patienter i olanzapinbehandlingsgruppen end i placebogruppen.
Selvom der ikke er nogen dokumentation tilgængelig for at besvare spørgsmålet om, hvor længe den unge patient, der behandles med ZYPREXA, skal opretholdes, kan vedligeholdelseseffektiviteten ekstrapoleres fra voksne data sammen med sammenligninger af olanzapins farmakokinetiske parametre hos voksne og unge patienter. Det anbefales generelt, at responderende patienter fortsættes ud over det akutte respons, men med den laveste dosis, der er nødvendig for at opretholde remission. Patienter bør periodisk revurderes for at fastslå behovet for vedligeholdelsesbehandling.
Bipolar I-lidelse (maniske eller blandede episoder)
Voksne
Monoterapi
Effekten af oral olanzapin til behandling af maniske eller blandede episoder blev fastslået i 2 kortvarige (én 3-ugers og en 4-ugers) placebokontrollerede undersøgelser hos voksne patienter, som opfyldte DSM-IV-kriterierne for bipolar I-lidelse med maniske eller blandede episoder. Disse forsøg omfattede patienter med eller uden psykotiske træk og med eller uden et hurtigt cyklusforløb.
Det primære vurderingsinstrument, der blev brugt til at vurdere maniske symptomer i disse forsøg, var Young Mania Rating Scale (Y-MRS), en skala med 11 punkter, der traditionelt anvendes til at vurdere graden af manisk symptomatologi (irritabilitet, forstyrrende/aggressiv adfærd, søvn). , forhøjet humør, tale, øget aktivitet, seksuel interesse, sprog-/tankeforstyrrelser, tankeindhold, udseende og indsigt) i et interval fra 0 (ingen maniske træk) til 60 Â (maksimal score). Det primære resultat i disse forsøg var ændring fra baseline i Y-MRS totalscore. Resultaterne af forsøgene følger:
(1) I et 3-ugers placebokontrolleret forsøg (n=67), som involverede et dosisområde af olanzapin (5-20 mg/dag, én gang dagligt, startende ved 10 mg/dag), var olanzapin overlegen end placebo i reduktion af Y-MRS totalscore. I et identisk designet forsøg udført samtidigt med det første forsøg, viste olanzapin en lignende behandlingsforskel, men muligvis på grund af prøvestørrelse og stedvariabilitet, viste det sig ikke at være placebo overlegen med hensyn til dette resultat.
(2) I et 4-ugers placebokontrolleret forsøg (n=115), som involverede et dosisområde af olanzapin (5-20 mg/dag, én gang dagligt, startende ved 15 mg/dag), var olanzapin overlegen end placebo i reduktion af Y-MRS totalscore.
(3) I et andet forsøg, 361 patienter, der opfylder DSM-IV-kriterierne for en manisk eller blandet episode af bipolar I-lidelse, som havde reageret under en indledende åben behandlingsfase i omkring 2 uger i gennemsnit på olanzapin 5 til 20 mg/ dag blev randomiseret til enten fortsættelse af olanzapin ved deres samme dosis (n=225) eller til placebo (n=136), for observation af tilbagefald. Ca. 50 % af patienterne var seponeret fra olanzapin-gruppen på dag 59, og 50 % af placebogruppen havde seponeret på dag 23 af den dobbeltblindede behandling. Respons under den åbne fase blev defineret ved at have et fald i Y-MRS totalscore til ≤12 og HAM-D 21 til ≤8. Tilbagefald under den dobbeltblinde fase blev defineret som en stigning i Y-MRS eller HAM-D 21 totalscore til ≥15 eller at blive indlagt for enten mani eller depression. I den randomiserede fase oplevede patienter, der fik fortsat olanzapin, en signifikant længere tid til tilbagefald.
Supplement til lithium eller valproat
Effekten af oral olanzapin med samtidig lithium eller valproat til behandling af maniske eller blandede episoder blev fastslået i 2 kontrollerede forsøg med patienter, der opfyldte DSM-IV-kriterierne for bipolar I lidelse med maniske eller blandede episoder. Disse forsøg omfattede patienter med eller uden psykotiske træk og med eller uden et hurtigt cyklusforløb. Resultaterne af forsøgene følger:
(1) I et 6-ugers placebokontrolleret kombinationsforsøg blev 175 ambulante patienter i lithium- eller valproatbehandling med utilstrækkeligt kontrollerede maniske eller blandede symptomer (Y-MRS ≥16) randomiseret til at modtage enten olanzapin eller placebo i kombination med deres oprindelige behandling . Olanzapin (i et dosisområde på 5-20 mg/dag, én gang dagligt, startende ved 10 mg/dag) kombineret med lithium eller valproat (i et terapeutisk område på 0,6 mEq/L til 1,2 mEq/L eller 50 μg/ml til 125 μg/ml) var overlegen i forhold til lithium eller valproat alene i reduktionen af Y-MRS total score.
(2) I et andet 6-ugers placebokontrolleret kombinationsforsøg blev 169 ambulante patienter i lithium- eller valproatbehandling med utilstrækkeligt kontrollerede maniske eller blandede symptomer (Y-MRS ≥16) randomiseret til at modtage enten olanzapin eller placebo i kombination med deres oprindelige terapi. Olanzapin (i et dosisområde på 5-20 mg/dag, én gang dagligt, startende ved 10 mg/dag) kombineret med lithium eller valproat (i et terapeutisk område på 0,6 mEq/L til 1,2 mEq/L eller 50 μg/ml til 125 μg/ml) var overlegen i forhold til lithium eller valproat alene i reduktionen af Y-MRS total score.
Teenagere
Akut monoterapi
Effekten af oral olanzapin til behandling af akutte maniske eller blandede episoder hos unge (i alderen 13 til 17 år) blev fastslået i et 3-ugers, dobbeltblindt, placebokontrolleret, randomiseret forsøg med indlagte og ambulante unge patienter, der opfyldte diagnosen. kriterier for maniske eller blandede episoder forbundet med bipolar I lidelse (med eller uden psykotiske træk) ifølge DSM-IV-TR (n=161). Diagnosen blev bekræftet af K-SADS-PL.
Det primære vurderingsinstrument, der blev brugt til at vurdere maniske symptomer i dette forsøg, var den samlede score for adolescent Structured Young-Mania Rating Scale (Y-MRS).
dette fleksible dosisforsøg var olanzapin 2,5 til 20 mg/dag (gennemsnitlig modal dosis 10,7 mg/dag, middeldosis på 8,9 mg/dag) mere effektivt end placebo til behandling af unge med maniske eller blandede episoder forbundet med bipolar I lidelse, som understøttet af den statistisk signifikant større gennemsnitlige reduktion i Y-MRS total score for patienter i olanzapinbehandlingsgruppen end i placebogruppen.
Selvom der ikke er nogen dokumentation tilgængelig for at besvare spørgsmålet om, hvor længe den unge patient, der behandles med ZYPREXA, skal opretholdes, kan vedligeholdelseseffektiviteten ekstrapoleres fra voksne data sammen med sammenligninger af olanzapins farmakokinetiske parametre hos voksne og unge patienter. Det anbefales generelt, at responderende patienter fortsættes ud over det akutte respons, men med den laveste dosis, der er nødvendig for at opretholde remission. Patienter bør periodisk revurderes for at fastslå behovet for vedligeholdelsesbehandling.
Agitation forbundet med skizofreni og bipolar I-mani
Effekten af intramuskulært olanzapin til injektion til behandling af agitation blev fastslået i 3 kortvarige (24 timers IM-behandling) placebokontrollerede forsøg med ophidsede voksne indlagte patienter fra 2 diagnostiske grupper: skizofreni og bipolar lidelse I (maniske eller blandede episoder) . Hvert af forsøgene omfattede en enkelt aktiv komparatorbehandlingsarm af enten haloperidol-injektion (skizofreni-undersøgelser) eller lorazepam-injektion (bipolar I-mani-undersøgelse). Patienter, der var tilmeldt forsøgene skulle: (1) bedømmes af de kliniske efterforskere som klinisk ophidsede og klinisk passende kandidater til behandling med intramuskulær medicin, og (2) udvise et niveau af agitation, der opfyldte eller oversteg en tærskelscore på ≥14 pr. de 5 elementer, der omfatter positiv og negativ syndromskala (PANSS) excited komponent (dvs. dårlig impulskontrol, spænding, fjendtlighed, manglende samarbejdsvilje og spændingselementer) med mindst 1 individuel elementscore ≥4 ved brug af et 1-7 scoringssystem (1= fraværende, 4 = moderat, 7 = ekstrem). I undersøgelserne var den gennemsnitlige baseline PANSS Excited Component-score 18,4, med score fra 13 til 32 (ud af en maksimal score på 35), hvilket tyder på overvejende moderate niveauer af agitation, hvor nogle patienter oplevede milde eller svære niveauer af agitation. Det primære effektmål, der blev brugt til at vurdere agitationstegn og -symptomer i disse forsøg, var ændringen fra baseline i PANSS Excited Component 2 timer efter injektion. Patienterne kunne modtage op til 3 injektioner i løbet af de 24 timers IM-behandlingsperioder; patienterne kunne dog ikke modtage den anden injektion før efter den indledende periode på 2 timer, hvor det primære effektmål blev vurderet. Resultaterne af forsøgene følger:
(1) I et placebokontrolleret forsøg med ophidsede indlagte patienter, der opfylder DSM-IV-kriterierne for skizofreni (n=270), blev 4 faste intramuskulære olanzapin til injektionsdoser på 2,5 mg, 5 mg, 7,5 mg og 10 mg evalueret. Alle doser var statistisk overlegne end placebo på PANSS Excited Component 2 timer efter injektion. Effekten var dog større og mere konsistent for de 3 højeste doser. Der var ingen signifikante parvise forskelle for 7,5 og 10 mg doser i forhold til 5 mg dosis.
(2) I et andet placebokontrolleret forsøg med ophidsede indlagte patienter, der opfylder DSM-IV-kriterierne for skizofreni (n=311), blev 1 fast intramuskulær olanzapin til injektionsdosis på 10 mg evalueret. Olanzapin til injektion var statistisk overlegen placebo på PANSS Excited Component 2 timer efter injektion.
(3) I et placebokontrolleret forsøg med ophidsede indlagte patienter, der opfylder DSM-IV-kriterierne for bipolar lidelse I (og i øjeblikket udviser en akut manisk eller blandet episode med eller uden psykotiske træk) (n=201), 1 fast intramuskulær olanzapin til injektionsdosis på 10 mg blev vurderet. Olanzapin til injektion var statistisk overlegen placebo på PANSS Excited Component 2 timer efter injektion.
Undersøgelse af befolkningsundergrupper (alder, race og køn) afslørede ikke nogen differentiel reaktionsevne på grundlag af disse undergrupper.
PATIENTOPLYSNINGER
ZYPREXA® (zy-PREX-a) (olanzapin) tablet
ZYPREXA® ZYDIS® (zy-PREX-a ZY-dis) (olanzapin) Tablet, oralt desintegrerende
Læs medicinvejledningen, der følger med ZYPREXA, før du begynder at tage den, og hver gang du får en genopfyldning. Der kan være nye oplysninger. Denne medicinvejledning træder ikke i stedet for at tale med din læge om din medicinske tilstand eller behandling. Tal med din læge eller apotek, hvis der er noget, du ikke forstår, eller hvis du ønsker at lære mere om ZYPREXA.
Hvad er den vigtigste information, jeg bør vide om ZYPREXA?
ZYPREXA 20mg kan forårsage alvorlige bivirkninger, herunder:
Disse alvorlige bivirkninger er beskrevet nedenfor.
1. Øget risiko for død hos ældre mennesker, der er forvirrede, har hukommelsestab og har mistet kontakten til virkeligheden (demensrelateret psykose). ZYPREXA er ikke godkendt til behandling af psykose hos ældre mennesker med demens.
2. Højt blodsukker (hyperglykæmi). Højt blodsukker kan forekomme, hvis du allerede har diabetes, eller hvis du aldrig har haft diabetes. Højt blodsukker kan føre til:
- en ophobning af syre i dit blod på grund af ketoner (ketoacidose)
- koma
- død
Din læge bør foretage test for at kontrollere dit blodsukker, før du begynder at tage ZYPREXA 7,5 mg og under behandlingen. Hos personer, der ikke har diabetes, forsvinder forhøjet blodsukker nogle gange, når ZYPREXA 7,5 mg stoppes. Personer med diabetes og nogle mennesker, der ikke havde diabetes, før de tog ZYPREXA, skal tage medicin mod forhøjet blodsukker, selv efter de holder op med at tage ZYPREXA.
Hvis du har diabetes, skal du følge din læges instruktioner om, hvor ofte du skal kontrollere dit blodsukker, mens du tager ZYPREXA.
Ring til din læge hvis du har nogle af disse symptomer på forhøjet blodsukker (hyperglykæmi), mens du tager ZYPREXA:
- føler sig meget tørstig
- skal tisse mere end normalt
- føler sig meget sulten
- føler sig svag eller træt
- får ondt i maven
- føler dig forvirret, eller din ånde lugter frugtagtig
3. Høje fedtniveauer i dit blod (kolesterol og triglycerider). Høje fedtniveauer kan forekomme hos personer, der behandles med ZYPREXA 10 mg, især hos teenagere (13 til 17 år), eller når det bruges i kombination med fluoxetin til børn (10 til 17 år). Du har muligvis ingen symptomer, så din læge bør tage blodprøver for at kontrollere dit kolesterol- og triglyceridniveau, før du begynder at tage ZYPREXA og under behandlingen.
4. Vægtøgning. Vægtøgning er meget almindelig hos personer, der tager ZYPREXA. Teenagere (13 til 17 år) er mere tilbøjelige til at tage på i vægt og tage mere på end voksne. Børn (10 til 17 år) er også mere tilbøjelige til at tage på og tage mere på end voksne, når ZYPREXA 7,5 mg bruges i kombination med fluoxetin. Nogle mennesker kan tage meget på i vægt, mens de tager ZYPREXA, så du og din læge bør tjekke din vægt regelmæssigt. Tal med din læge om måder at kontrollere vægtøgning på, såsom at spise en sund, afbalanceret kost og motion.
Hvad er ZYPREXA?
ZYPREXA er en receptpligtig medicin, der bruges til at behandle:
- skizofreni hos personer på 13 år eller ældre.
- bipolar lidelse, herunder:
- maniske eller blandede episoder, der opstår med bipolar lidelse I hos personer på 13 år eller ældre.
- maniske eller blandede episoder, der opstår med bipolar lidelse I, når det bruges sammen med medicinen lithium eller valproat, hos voksne.
- langtidsbehandling af bipolar lidelse I hos voksne.
- episoder af depression, der opstår med bipolar lidelse I, når det bruges sammen med medicinen fluoxetin (Prozac®) hos personer på 10 år eller ældre.
- episoder med depression, der ikke bliver bedre efter 2 anden medicin, også kaldet behandlingsresistent depression, når de bruges sammen med medicinen fluoxetin (Prozac), hos voksne.
ZYPREXA 7,5 mg er ikke godkendt til brug hos børn under 13 år. ZYPREXA 10 mg i kombination med fluoxetin er ikke godkendt til brug hos børn under 10 år.
Symptomerne på skizofreni inkluderer at høre stemmer, se ting, der ikke er der, have overbevisninger, der ikke er sande, og være mistænksom eller tilbagetrukket.
Symptomerne på bipolar lidelse I omfatter vekslende perioder med depression og højt eller irritabelt humør, øget aktivitet og rastløshed, tanker, hurtig snak, impulsiv adfærd og et nedsat søvnbehov.
Symptomerne på behandlingsresistent depression omfatter nedsat humør, nedsat interesse, øget skyldfølelse, nedsat energi, nedsat koncentration, ændringer i appetit og selvmordstanker eller -adfærd.
Nogle af dine symptomer kan blive bedre med behandlingen. Hvis du ikke tror, du får det bedre, så ring til din læge.
Hvad skal jeg fortælle min læge, før jeg tager ZYPREXA?
ZYPREXA er muligvis ikke det rigtige for dig. Inden du starter ZYPREXA, skal du fortælle det til din læge, hvis du har eller har haft:
- hjerteproblemer
- anfald
- diabetes eller højt blodsukkerniveau (hyperglykæmi)
- højt kolesterol- eller triglyceridniveau i dit blod
- leverproblemer
- lavt eller højt blodtryk
- slagtilfælde eller "mini-slagtilfælde", også kaldet forbigående iskæmiske anfald (TIA)
- Alzheimers sygdom
- snævervinklet glaukom
- forstørret prostata hos mænd
- tarmobstruktion
- phenylketonuri, fordi ZYPREXA 5mg ZYDIS indeholder phenylalanin
- brystkræft
- tanker om selvmord eller at skade dig selv
- enhver anden medicinsk tilstand
- er gravid eller planlægger at blive gravid. Det vides ikke, om ZYPREXA 2,5 mg vil skade dit ufødte barn.
- Hvis du bliver gravid, mens du får ZYPREXA 20mg, skal du tale med din læge om tilmelding til det nationale graviditetsregister for atypiske antipsykotika. Du kan tilmelde dig ved at ringe til 1-866-961-2388 eller gå til http://womensmentalhealth.org/clinical-andresearch-programs/pregnancyregistry/.
- ammer eller planlægger at amme. ZYPREXA går over i din modermælk. Tal med din læge om den bedste måde at fodre din baby på, hvis du tager ZYPREXA.
Fortæl det til din læge, hvis du træner meget eller ofte er på varme steder.
Symptomerne på bipolar lidelse I, behandlingsresistent depression eller skizofreni kan omfatte tanker om selvmord eller at såre dig selv eller andre. Hvis du har disse tanker på noget tidspunkt, skal du fortælle det til din læge eller gå til en skadestue med det samme.
Fortæl din læge om al den medicin du tager, herunder receptpligtig og ikke-receptpligtig medicin, vitaminer og naturlægemidler. ZYPREXA 20mg og nogle lægemidler kan interagere med hinanden og virker muligvis ikke så godt eller forårsage mulige alvorlige bivirkninger. Din læge kan fortælle dig, om det er sikkert at tage ZYPREXA sammen med din anden medicin. Du må ikke starte eller stoppe nogen form for medicin, mens du tager ZYPREXA uden først at tale med din læge.
Hvordan skal jeg tage ZYPREXA 7,5 mg?
- Tag ZYPREXA nøjagtigt som foreskrevet. Din læge skal muligvis ændre (justere) dosis af ZYPREXA 15 mg, indtil den passer til dig.
- Hvis du glemmer en dosis af ZYPREXA 20 mg, skal du tage den glemte dosis, så snart du husker det. Hvis det næsten er tid til den næste dosis, skal du blot springe den glemte dosis over og tage din næste dosis på det normale tidspunkt. Tag ikke to doser ZYPREXA 10 mg på samme tid.
- For at forhindre alvorlige bivirkninger må du ikke stoppe med at tage ZYPREXA pludseligt. Hvis du skal stoppe med at tage ZYPREXA, kan din læge fortælle dig, hvordan du sikkert stopper med at tage det.
- Hvis du tager for meget ZYPREXA, skal du straks ringe til din læge eller giftkontrolcenter på 1-800-222-1222 eller få akut behandling.
- ZYPREXA 10 mg kan tages med eller uden mad.
- ZYPREXA tages normalt én gang hver dag.
- Tag ZYPREXA 20mg ZYDIS som følger:
- Vær sikker på, at dine hænder er tørre.
- Åbn brevet, og fjern folien på blisterpakningen. Skub ikke tabletten gennem folien.
- Så snart du åbner blisterpakningen, skal du fjerne tabletten og putte den i munden.
- Tabletten går hurtigt i opløsning i dit spyt, så du nemt kan sluge den med eller uden at drikke væske.
- Ring til din læge, hvis du ikke tror, du får det bedre, eller hvis du er bekymret over din tilstand, mens du tager ZYPREXA.
Hvad skal jeg undgå, mens jeg tager ZYPREXA?
- ZYPREXA kan forårsage søvnighed og kan påvirke din evne til at træffe beslutninger, tænke klart eller reagere hurtigt. Du bør ikke køre bil, betjene tunge maskiner eller udføre andre farlige aktiviteter, før du ved, hvordan ZYPREXA 7,5 mg påvirker dig.
- Undgå at drikke alkohol, mens du tager ZYPREXA. Hvis du drikker alkohol, mens du tager ZYPREXA, kan du blive mere søvnig, end hvis du tager ZYPREXA 15 mg alene.
Hvad er de mulige bivirkninger af ZYPREXA 5mg?
Alvorlige bivirkninger kan forekomme, når du tager ZYPREXA 5mg, herunder:
- Se "Hvad er den vigtigste information, jeg bør vide om ZYPREXA?", som beskriver den øgede risiko for død hos ældre mennesker med demensrelateret psykose og risikoen for højt blodsukker, højt kolesterol- og triglyceridniveau samt vægtøgning.
- Øget forekomst af slagtilfælde eller "mini-slagtilfælde" kaldet forbigående iskæmiske anfald (TIA) hos ældre mennesker med demensrelateret psykose (ældre mennesker, der har mistet kontakten til virkeligheden på grund af forvirring og hukommelsestab). ZYPREXA er ikke godkendt til disse patienter.
- Malignt neuroleptikasyndrom (NMS): NMS er en sjælden, men meget alvorlig tilstand, der kan forekomme hos personer, der tager antipsykotisk medicin, herunder ZYPREXA. NMS kan forårsage død og skal behandles på et hospital. Ring til din læge med det samme, hvis du bliver alvorligt syg og har nogle af disse symptomer:
- høj feber
- overdreven svedtendens
- stive muskler
- forvirring
- ændringer i dit åndedræt, hjerteslag og blodtryk.
- Lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS): DRESS kan forekomme med ZYPREXA. Funktioner ved DRESS kan omfatte udslæt, feber, hævede kirtler og andre indre organpåvirkninger såsom lever, nyre, lunge og hjerte. DRESS er nogle gange fatalt; Fortæl derfor straks din læge, hvis du oplever nogle af disse tegn.
- Tardiv dyskinesi: Denne tilstand forårsager kropsbevægelser, der bliver ved med at ske, og som du ikke kan kontrollere. Disse bevægelser påvirker normalt ansigtet og tungen. Tardiv dyskinesi forsvinder muligvis ikke, selvom du holder op med at tage ZYPREXA. Det kan også starte, efter du holder op med at tage ZYPREXA. Fortæl det til din læge, hvis du får kropsbevægelser, som du ikke kan kontrollere.
- Nedsat blodtryk, når du skifter stilling, med symptomer på svimmelhed, hurtig eller langsom hjerterytme eller besvimelse.
- Synkebesvær, som kan få mad eller væske til at komme ned i lungerne.
- Anfald: Fortæl det til din læge, hvis du får et anfald under behandling med ZYPREXA.
- Problemer med kontrol af kropstemperaturen: Du kan blive meget varm, for eksempel når du træner meget eller opholder dig i et område, der er meget varmt. Det er vigtigt for dig at drikke vand for at undgå dehydrering. Ring til din læge med det samme, hvis du bliver alvorligt syg og har nogle af disse symptomer på dehydrering:
- sveder for meget eller slet ikke
- tør mund
- føler sig meget varm
- føler sig tørstig
- ikke i stand til at producere urin.
Almindelige bivirkninger af ZYPREXA omfatter: mangel på energi, mundtørhed, øget appetit, søvnighed, tremor (rystelser), hård eller sjælden afføring, svimmelhed, adfærdsændringer eller rastløshed.
Andre almindelige bivirkninger hos teenagere (13-17 år) omfatter: hovedpine, smerter i maveområdet (mave), smerter i dine arme eller ben eller træthed. Teenagere oplevede større stigninger i prolaktin, leverenzymer og søvnighed sammenlignet med voksne.
Fortæl din læge om enhver bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger ved ZYPREXA. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare ZYPREXA?
- Opbevar ZYPREXA ved stuetemperatur, mellem 68°F til 77°F (20°C til 25°C).
- Hold ZYPREXA væk fra lys.
- Hold ZYPREXA 15 mg tørt og væk fra fugt.
Opbevar ZYPREXA 5mg og al medicin utilgængeligt for børn.
Generel information om ZYPREXA
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en medicinvejledning. Brug ikke ZYPREXA til en tilstand, som den ikke er ordineret til. Giv ikke ZYPREXA 5 mg til andre mennesker, selvom de har samme lidelse. Det kan skade dem.
Denne medicinvejledning opsummerer de vigtigste oplysninger om ZYPREXA. Hvis du vil have mere information, så tal med din læge. Du kan bede din læge eller apoteket om oplysninger om ZYPREXA 20mg, som er skrevet til sundhedspersonale. For mere information om ZYPREXA ring 1-800-Lilly-Rx (1-800-545-5979).
Hvad er ingredienserne i ZYPREXA?
Aktiv ingrediens: olanzapin
Inaktive ingredienser:
carnaubavoks, crospovidon, hydroxypropylcellulose, hypromellose, lactose, magnesiumstearat, mikrokrystallinsk cellulose og andre inaktive ingredienser. Farvebelægningen indeholder: Titanium Dioxide, FD&C Blue No. 2 Aluminium Lake, eller Synthetic Red Iron Oxide.
ZYDIS - gelatine, mannitol, aspartam, natriummethylparaben og natriumpropylparaben.
Denne medicinvejledning er godkendt af US Food and Drug Administration.
