Eskalith 300mg Lithium carbonate Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Eskalith og hvordan bruges det?
Eskalith 300mg er en receptpligtig medicin, der bruges til at behandle symptomer på bipolar lidelse. Eskalith 300mg kan bruges alene eller sammen med anden medicin.
Eskalith 300mg tilhører en klasse af lægemidler kaldet Bipolar Disorder Agents.
Det vides ikke, om Eskalith er sikkert og effektivt til børn under 7 år.
Hvad er de mulige bivirkninger af Eskalith?
Eskalith 300mg kan forårsage alvorlige bivirkninger, herunder:
- nældefeber,
- åndedrætsbesvær,
- hævelse af dit ansigt, læber, tunge eller hals,
- muskelsvaghed,
- trækninger,
- døsighed,
- svimmelhed,
- humørsvingninger,
- sløret syn,
- ringen for dine ører,
- uregelmæssige hjerteslag,
- forvirring,
- utydelig tale,
- klodsethed,
- vejrtrækningsbesvær,
- anfald,
- stakåndet,
- feber,
- øget tørst eller vandladning,
- svaghed,
- svimmelhed,
- snurrende fornemmelse,
- hukommelsesproblemer,
- hallucinationer,
- problemer med balance eller muskelbevægelser,
- tab af tarm- eller blærekontrol,
- anfald,
- føler dig meget tørstig eller varm,
- manglende evne til at tisse,
- kraftig svedtendens,
- varm og tør hud,
- svær hovedpine,
- ringen for dine ører,
- kvalme,
- synsproblemer,
- smerte bag dine øjne,
- agitation,
- feber
- ,
- rystende,
- hurtig puls,
- muskelstivhed,
- trækninger,
- tab af koordination, og
- diarré
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Eskalith 300mg omfatter:
- svimmelhed,
- døsighed,
- rysten i dine hænder,
- problemer med at gå,
- tør mund,
- øget tørst eller vandladning,
- kvalme,
- opkastning,
- mistet appetiten,
- mavesmerter,
- kold følelse,
- misfarvning i dine fingre eller tæer,
- udslæt, og
- sløret syn
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Eskalith. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
Lithiumtoksicitet er tæt forbundet med serumlithiumniveauer og kan forekomme ved doser tæt på terapeutiske niveauer. Faciliteter til hurtige og nøjagtige serumlithiumbestemmelser bør være tilgængelige, før behandlingen påbegyndes (se DOSERING OG ADMINISTRATION ).
BESKRIVELSE
ESKALITH indeholder lithiumcarbonat, et hvidt, let alkalisk pulver med molekylformel Li2CO3 og molekylvægt 73,89. Lithium er et grundstof i alkalimetalgruppen med atomnummer 3, atomvægt 6,94 og en emissionslinje ved 671 nm på flammefotometeret.
ESKALITH (lithiumcarbonat) kapsler: Hver kapsel, med uigennemsigtig grå hætte og uigennemsigtig gul krop, er præget med produktnavnet ESKALITH (lithiumcarbonat) og SB og indeholder lithiumcarbonat, 300 mg. Inaktive ingredienser består af benzylalkohol, cetylpyridiniumchlorid, D&C Yellow No. 10, FD&C Green No. 3, FD&C Red No. 40, FD&C Yellow No. 6, gelatine, lactose, magnesiumstearat, povidon, natriumlaurylsulfat, titaniumdioxid, og spormængder af andre inaktive ingredienser.
ESKALITH (lithiumcarbonat) CR tabletter med kontrolleret frigivelse : Hver rund, gul, bikonveks tablet, præget med SKF og J10 på den ene side og delekærv på den anden side, indeholder lithiumcarbonat, 450 mg. Inaktive ingredienser består af alginsyre, gelatine, jernoxid, magnesiumstearat og natriumstivelsesglykolat.
ESKALITH (lithiumcarbonat) CR-tabletter 450 mg er designet til at frigive en del af dosis initialt og resten gradvist; frigivelsesmønsteret af tabletterne med kontrolleret frigivelse reducerer variationen i lithium-blodniveauer, der ses med doseringsformerne med øjeblikkelig frigivelse.
INDIKATIONER
ESKALITH (lithiumcarbonat) er indiceret til behandling af maniske episoder af manio-depressiv sygdom. Vedligeholdelsesterapi forhindrer eller mindsker intensiteten af efterfølgende episoder hos de maniodepressive patienter med en historie med mani.
Typiske symptomer på mani omfatter talepres, motorisk hyperaktivitet, nedsat søvnbehov, idéflugt, storslåethed, opstemthed, dårlig dømmekraft, aggressivitet og muligvis fjendtlighed. Når det gives til en patient, der oplever en manisk episode, kan ESKALITH (lithiumcarbonat) forårsage en normalisering af symptomatologien inden for 1 til 3 uger.
DOSERING OG ADMINISTRATION
Kapsler med øjeblikkelig frigivelse gives normalt tid eller qid. Doser af tabletter med kontrolleret frigivelse gives sædvanligvis bidt (ca. 12 timers intervaller). Ved påbegyndelse af behandling med lithium med øjeblikkelig frigivelse eller kontrolleret frigivelse skal dosis individualiseres i henhold til serumniveauer og klinisk respons.
Når en patient skifter fra kapsler med øjeblikkelig frigivelse til ESKALITH (lithiumcarbonat) CR-tabletter med kontrolleret frigivelse, skal du give den samme samlede daglige dosis, når det er muligt. De fleste patienter i vedligeholdelsesbehandling er stabiliseret på 900 mg dagligt, f.eks. ESKALITH (lithiumcarbonat) CR 450 mg to gange dagligt. Når den tidligere dosis af lithium med øjeblikkelig frigivelse ikke er et multiplum af 450 mg, f.eks. 1.500 mg, påbegynd ESKALITH (lithiumcarbonat) ) CR ved multiplum af 450 mg nærmest, men under, den oprindelige daglige dosis, dvs. 1.350 mg. Når de 2 doser er ulige, giv den største dosis om aftenen. I ovenstående eksempel, med en samlet daglig dosis på 1.350 mg, bør der generelt gives 450 mg ESKALITH (lithiumcarbonat) CR om morgenen og 900 mg ESKALITH (lithiumcarbonat) CR om aftenen. Om ønsket kan den samlede daglige dosis på 1.350 mg gives i 3 lige store doser på 450 mg ESKALITH (lithiumcarbonat) CR. Disse patienter bør monitoreres med 1- til 2-ugers intervaller og dosis justeres om nødvendigt, indtil stabile og tilfredsstillende serumniveauer og klinisk tilstand er opnået.
Når patienter kræver tættere titrering end den, der er tilgængelig med doser af ESKALITH (lithiumcarbonat) CR i trin på 450 mg, bør der anvendes kapsler med øjeblikkelig frigivelse.
Akut mani: Optimal patientrespons på ESKALITH (lithiumcarbonat) kan normalt etableres og opretholdes med 1.800 mg dagligt i opdelte doser. Sådanne doser vil normalt producere det ønskede serumlithiumniveau i området mellem 1,0 og 1,5 mEq/L.
Dosis skal individualiseres i henhold til serumniveauer og klinisk respons. Regelmæssig overvågning af patientens kliniske tilstand og serumlithiumniveauer er nødvendig. Serumniveauer bør bestemmes to gange om ugen i den akutte fase, og indtil serumniveauet og patientens kliniske tilstand er stabiliseret.
Langsigtet kontrol: De ønskede serumlithiumniveauer er 0,6 til 1,2 mEq/L. Dosis vil variere fra individ til individ, men normalt vil 900 mg til 1.200 mg dagligt i opdelte doser opretholde dette niveau. Serumlithiumniveauer i ukomplicerede tilfælde, der modtager vedligeholdelsesbehandling under remission, bør monitoreres mindst hver anden måned.
Patienter, der er usædvanligt følsomme over for lithium, kan udvise toksiske tegn ved serumniveauer under 1,0 mEq/L.
NB : Blodprøver til serumlithiumbestemmelser bør udtages umiddelbart før næste dosis, når lithiumkoncentrationerne er relativt stabile (dvs. 8 til 12 timer efter den foregående dosis). Total afhængighed må ikke baseres på serumniveauer alene. Nøjagtig patientevaluering kræver både kliniske analyser og laboratorieanalyser.
Ældre patienter reagerer ofte på reduceret dosis og kan udvise tegn på toksicitet ved serumniveauer, der normalt tolereres af yngre patienter.
HVORDAN LEVERET
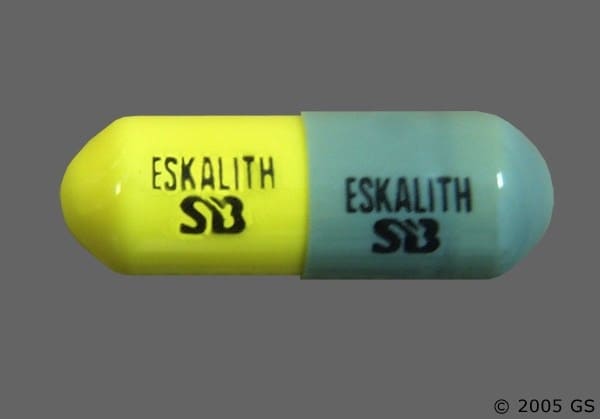
ESKALITH (lithiumcarbonat) Kapsler 300 mg er grå og gule kapsler præget med "ESKALITH (lithiumcarbonat)" og "SB" på den ene side af hver halvdel af kapslen, i flasker med 100 stk. (NDC 0007-4007-20).
ESKALITH (lithiumcarbonat) CR Tabletter 450 mg er runde, gule, bikonvekse tabletter med kontrolleret frigivelse, præget med "SKF" og "J10" på den ene side og delekærv på den anden side, i flasker på 100 (NDC 0007-4010-20).
OPBEVARINGSBETINGELSER : Opbevares ved 25°C (77°F), udflugter tilladt til 15-30°C (59-86°F) [se USP kontrolleret rumtemperatur].
Fremstillet af: Cardinal Health., Winchester, KY 40391 for GlaxoSmithKline., Research Triangle Park, NC 27709. September 2003 FDA rev.dato: 03/11/2004
BIVIRKNINGER
Forekomsten og sværhedsgraden af bivirkninger er generelt direkte relateret til serumlithiumkoncentrationer såvel som til individuelle patienters følsomhed over for lithium, og forekommer generelt hyppigere og med større alvorlighed ved højere koncentrationer.
Bivirkninger kan forekomme ved serumlithiumniveauer under 1,5 mEq/L. Milde til moderate bivirkninger kan forekomme ved niveauer fra 1,5 til 2,5 mEq/L, og moderate til alvorlige reaktioner kan ses ved niveauer på 2,0 mEq/L og derover.
Fin håndskælven, polyuri og mild tørst kan forekomme under den indledende behandling af den akutte maniske fase og kan vare ved under hele behandlingen. Forbigående og mild kvalme og generelt ubehag kan også forekomme i løbet af de første par dage af lithiumindgivelse.
Disse bivirkninger aftager normalt ved fortsat behandling eller en midlertidig reduktion eller ophør af dosis. Hvis det er vedvarende, kan det være nødvendigt at ophøre med lithiumbehandling.
Diarré, opkastning, døsighed, muskelsvaghed og manglende koordination kan være tidlige tegn på lithiumforgiftning og kan forekomme ved lithiumniveauer under 2,0 mEq/L. Ved højere niveauer kan der ses ataksi, svimmelhed, tinnitus, sløret syn og en stor mængde fortyndet urin. Serumlithiumniveauer over 3,0 mEq/L kan give et komplekst klinisk billede, der involverer flere organer og organsystemer. Serumlithiumniveauer bør ikke tillades at overstige 2,0 mEq/L under den akutte behandlingsfase.
Følgende reaktioner er blevet rapporteret og ser ud til at være relateret til serumlithiumniveauer, herunder niveauer inden for det terapeutiske område:
Neuromuskulært/Centralnervesystem Tremor, muskeloverirritabilitet (fascikulationer, trækninger, kloniske bevægelser af hele lemmer), hypertoni, ataksi, choreo-atetotiske bevægelser, hyperaktiv dyb senerefleks, ekstrapyramidale symptomer inklusive akut dystoni, tandhjulsstivhed, blackout-anfald, epileptiforme anfald, svimmelhed, anfald, svimmelhed , vertigo, nedslået nystagmus, inkontinens af urin eller afføring, somnolens, psykomotorisk retardering, rastløshed, forvirring, stupor, koma, tungebevægelser, tics, tinnitus, hallucinationer, dårlig hukommelse, nedsat intellektuel funktion, forskrækket respons, forværring af organiske hjernesyndromer, myasthenia gravis (sjældent).
Kardiovaskulær : Hjertearytmi, hypotension, perifer cirkulationskollaps, bradykardi, sinusknudedysfunktion med svær bradykardi (som kan resultere i synkope).
Gastrointestinale : Anoreksi, kvalme, opkastning, diarré, gastritis, spytkirtel hævelse, mavesmerter, overdreven savlen, flatulens, fordøjelsesbesvær.
Genitourinære Glycosuri, nedsat kreatininclearance, albuminuri, oliguri og symptomer på nefrogen diabetes insipidus inklusive polyuri, tørst og polydipsi.
Dermatologisk : Tørring og udtynding af hår, alopeci, anæstesi af hud, acne, kronisk folliculitis, xerosis cutis, psoriasis eller dets forværring, generaliseret kløe med eller uden udslæt, kutane sår, angioødem.
Autonomisk : Sløret syn, tør mund, impotens/seksuel dysfunktion.
Skjoldbruskkirtel abnormiteter : Euthyroid struma og/eller hypothyroidisme (inklusive myxedema) ledsaget af lavere T3 og T4. I131-optagelsen kan være forhøjet. (Se FORHOLDSREGLER .) Paradoksalt nok er sjældne tilfælde af hyperthyroidisme blevet rapporteret.
EEG ændringer : Diffus opbremsning, udvidelse af frekvensspektret, potensering og desorganisering af baggrundsrytmen.
Ændringer i EKG: Reversibel udfladning, isoelektricitet eller inversion af T-bølger. Diverse: Træthed, sløvhed, forbigående scotomater, exophthalmos, dehydrering, vægttab, leukocytose, hovedpine, forbigående hyperglykæmi, hypercalcæmi, hyperparathyroidisme, overdreven vægtøgning, ødematøs hævelse af ankler eller håndled, metallisk smag, dysgeusi/smagsforvrængning, smagsforstyrrelser , hævede læber, trykken for brystet, hævede og/eller smertefulde led, feber, polyartralgi, karies.
Der er modtaget nogle rapporter om nefrogen diabetes insipidus, hyperparathyroidisme og hypothyroidisme, som fortsætter efter seponering af lithium.
Der er modtaget nogle få rapporter om udvikling af smertefuld misfarvning af fingre og tæer og forkølelse af ekstremiteterne inden for en dag efter påbegyndelse af behandling med lithium. Den mekanisme, hvorigennem disse symptomer (ligner Raynauds syndrom) udviklede sig, er ikke kendt. Restitution fulgte afbrydelse.
Tilfælde af pseudotumor cerebri (forhøjet intrakranielt tryk og papilleødem) er blevet rapporteret ved brug af lithium. Hvis den ikke opdages, kan denne tilstand resultere i forstørrelse af den blinde plet, indsnævring af synsfelter og eventuel blindhed på grund af optisk atrofi. Lithium bør seponeres, hvis det er klinisk muligt, hvis dette syndrom opstår.
DRUGSINTERAKTIONER
Der bør udvises forsigtighed, når lithium og diuretika anvendes samtidigt, da diuretika-induceret natriumtab kan reducere den renale clearance af lithium og øge serumlithiumniveauerne med risiko for lithiumtoksicitet. Patienter, der får en sådan kombineret behandling, bør have serumlithiumniveauer overvåget nøje, og lithiumdosis skal justeres om nødvendigt.
Lithiumniveauer bør overvåges nøje, når patienter påbegynder eller ophører med brug af NSAID. I nogle tilfælde er lithiumtoksicitet et resultat af interaktioner mellem et NSAID og lithium. Indomethacin og piroxicam er blevet rapporteret at øge signifikant steady-state plasmalithiumkoncentrationer. Der er også bevis for, at andre ikke-steroide antiinflammatoriske midler, herunder de selektive cyclooxygenase-2 (COX-2) hæmmere, har samme virkning. I en undersøgelse udført med raske forsøgspersoner steg gennemsnitlige steady-state lithiumplasmaniveauer med ca. 17 % hos forsøgspersoner, der fik lithium 450 mg to gange dagligt med celecoxib 200 mg to gange dagligt sammenlignet med forsøgspersoner, der fik lithium alene.
Samtidig brug af metronidazol og lithium kan fremkalde lithiumtoksicitet på grund af nedsat renal clearance. Patienter, der får en sådan kombineret behandling, bør overvåges nøje.
Der er evidens for, at angiotensin-konverterende enzymhæmmere, såsom enalapril og captopril, og angiotension II-receptorantagonister, såsom losartan, kan øge steady-state plasmalithiumniveauer væsentligt, hvilket nogle gange resulterer i lithiumtoksicitet. Når sådanne kombinationer anvendes, kan det være nødvendigt at reducere lithiumdosis, og plasmalithiumniveauer bør måles oftere.
Samtidig brug af calciumkanalblokerende midler med lithium kan øge risikoen for neurotoksicitet i form af ataksi, rysten, kvalme, opkastning, diarré og/eller tinnitus. Forsigtighed anbefales.
Samtidig administration af lithium og selektive serotoningenoptagelseshæmmere bør udføres med forsigtighed, da denne kombination er blevet rapporteret at resultere i symptomer som diarré, forvirring, tremor, svimmelhed og agitation.
Følgende lægemidler kan sænke serumlithiumkoncentrationerne ved at øge urinudskillelsen af lithium: acetazolamid, urinstof, xanthinpræparater og alkaliserende midler såsom natriumbicarbonat.
Følgende har også vist sig at interagere med lithium: methyldopa, phenytoin og carbamazepin.
ADVARSLER
Lithium bør generelt ikke gives til patienter med signifikant nyre- eller kardiovaskulær sygdom, svær svækkelse eller dehydrering eller natriumdepletering, da risikoen for lithiumtoksicitet er meget høj hos sådanne patienter. Hvis den psykiatriske indikation er livstruende, og hvis en sådan patient ikke reagerer på andre foranstaltninger, kan lithiumbehandling udføres med ekstrem forsigtighed, herunder daglige serumlithiumbestemmelser og tilpasning til de sædvanligvis lave doser, som normalt tolereres af disse personer. I sådanne tilfælde er hospitalsindlæggelse en nødvendighed.
Kronisk lithiumbehandling kan være forbundet med formindskelse af nyrernes koncentrationsevne, som lejlighedsvis viser sig som nefrogen diabetes insipidus, med polyuri og polydipsi. Sådanne patienter bør behandles omhyggeligt for at undgå dehydrering med deraf følgende lithiumretention og toksicitet. Denne tilstand er normalt reversibel, når lithium seponeres.
Morfologiske ændringer med glomerulær og interstitiel fibrose og nefronatrofi er blevet rapporteret hos patienter i kronisk lithiumbehandling. Morfologiske ændringer er også set hos maniodepressive patienter, der aldrig har været udsat for lithium. Forholdet mellem nyrefunktionelle og morfologiske ændringer og deres sammenhæng med lithiumbehandling er ikke blevet fastlagt.
Når nyrefunktionen vurderes, for baseline-data før start af lithiumbehandling eller derefter, kan rutinemæssig urinanalyse og andre tests bruges til at evaluere tubulær funktion (f.eks. urinvægtfylde eller osmolalitet efter en periode med vandmangel eller 24-timers urinvolumen ) og glomerulær funktion (f.eks. serumkreatinin eller kreatininclearance). Under lithiumbehandling indikerer progressive eller pludselige ændringer i nyrefunktionen, selv inden for normalområdet, behovet for revurdering af behandlingen.
Et encefalopatisk syndrom (karakteriseret ved svaghed, sløvhed, feber, rysten og forvirring, ekstrapyramidale symptomer, leukocytose, forhøjede serumenzymer, BUN og FBS) er forekommet hos nogle få patienter behandlet med lithium plus et neuroleptika. I nogle tilfælde blev syndromet efterfulgt af irreversibel hjerneskade. På grund af en mulig årsagssammenhæng mellem disse hændelser og samtidig administration af lithium og neuroleptika, bør patienter, der får en sådan kombineret behandling, monitoreres nøje for tidlige tegn på neurologisk toksicitet, og behandlingen afbrydes omgående, hvis sådanne tegn opstår. Dette encefalopatiske syndrom kan ligne eller det samme som malignt neuroleptisk syndrom (NMS).
Lithiumtoksicitet er tæt forbundet med serumlithiumniveauer og kan forekomme ved doser tæt på terapeutiske niveauer (se DOSERING OG ADMINISTRATION ).
Ambulante patienter og deres familier bør advares om, at patienten skal afbryde lithiumkarbonatbehandlingen og kontakte sin læge, hvis sådanne kliniske tegn på lithiumtoksicitet som diarré, opkastning, tremor, mild ataksi, døsighed eller muskelsvaghed opstår.
Lithiumcarbonat kan svække mentale og/eller fysiske evner. Pas på patienterne med aktiviteter, der kræver årvågenhed (f.eks. betjening af køretøjer eller maskiner).
Lithium kan forlænge virkningen af neuromuskulære blokerende midler. Derfor bør neuromuskulært blokerende midler gives med forsigtighed til patienter, der får lithium.
FORHOLDSREGLER
Brug under graviditet: Bivirkninger på implantation hos rotter, embryolevedygtighed hos mus og metabolisme in vitro af rottetestes og humane spermatozoer er blevet tilskrevet lithium, ligesom teratogenicitet hos subpattedyr og ganespalte hos mus.
Hos mennesker kan lithiumcarbonat forårsage fosterskader, når det administreres til en gravid kvinde. Data fra lithiumfødselsregistre tyder på en stigning i hjerte- og andre anomalier, især Ebsteins anomali. Hvis dette lægemiddel anvendes til kvinder i den fødedygtige alder, eller under graviditet, eller hvis en patient bliver gravid, mens han tager dette lægemiddel, skal patienten informeres om den potentielle fare for fosteret.
Anvendelse hos ammende mødre : Lithium udskilles i modermælk. Amning bør ikke udføres under lithiumbehandling undtagen i sjældne og usædvanlige omstændigheder, hvor de potentielle fordele for moderen efter lægens opfattelse opvejer mulige farer for barnet.
Anvendelse hos pædiatriske patienter: Da information om sikkerheden og effektiviteten af lithiumcarbonat hos børn under 12 år ikke er tilgængelig, anbefales det ikke at bruge det til sådanne patienter.
Der har været en rapport om et forbigående syndrom med akut dystoni og hyperrefleksi hos et barn på 15 kg, som indtog 300 mg lithiumcarbonat.
Brug hos ældre : Ældre patienter kræver ofte lavere lithiumdoser for at opnå terapeutiske serumniveauer. De kan også udvise bivirkninger ved serumniveauer, der normalt tolereres af yngre patienter.
Generel : Evnen til at tolerere lithium er større under den akutte maniske fase og falder, når maniske symptomer aftager (se DOSERING OG ADMINISTRATION ).
Fordelingsrummet for lithium tilnærmer sig det for det samlede kropsvand. Lithium udskilles primært i urinen med ubetydelig udskillelse i fæces. Renal udskillelse af lithium er proportional med dets plasmakoncentration. Halveringstiden for elimination af lithium er ca. 24 timer. Lithium nedsætter natriumreabsorption i nyretubuli, hvilket kan føre til natriummangel. Derfor er det vigtigt for patienten at opretholde en normal kost, inklusive salt, og et tilstrækkeligt væskeindtag (2.500 til 3.000 ml) i det mindste under den indledende stabiliseringsperiode. Nedsat tolerance over for lithium er blevet rapporteret som følge af langvarig svedtendens eller diarré, og hvis en sådan forekommer, bør supplerende væske og salt administreres under omhyggeligt lægeligt tilsyn, og lithiumindtaget reduceres eller suspenderes, indtil tilstanden er løst.
Udover sved og diarré kan samtidig infektion med forhøjede temperaturer også nødvendiggøre en midlertidig reduktion eller ophør af medicin.
Tidligere eksisterende underliggende skjoldbruskkirtellidelser udgør ikke nødvendigvis en kontraindikation for lithiumbehandling; hvor hypothyroidisme eksisterer, giver omhyggelig overvågning af skjoldbruskkirtlens funktion under lithiumstabilisering og vedligeholdelse mulighed for korrektion af eventuelle ændrede thyreoideaparametre; hvor hypothyroidisme opstår under lithiumstabilisering og vedligeholdelse, kan supplerende skjoldbruskkirtelbehandling anvendes.
OVERDOSIS
De toksiske niveauer for lithium er tæt på de terapeutiske niveauer. Det er derfor vigtigt, at patienter og deres familier advares om at holde øje med tidlige toksiske symptomer og at seponere lægemidlet og informere lægen, hvis de skulle opstå. Giftige symptomer er angivet i detaljer under BIVIRKNINGER.
Behandling: Der kendes ingen specifik modgift mod lithiumforgiftning. Tidlige symptomer på lithiumtoksicitet kan sædvanligvis behandles ved reduktion eller ophør af dosis af lægemidlet og genoptagelse af behandlingen med en lavere dosis efter 24 til 48 timer. I alvorlige tilfælde af lithiumforgiftning består det første og fremmeste mål med behandlingen i eliminering af denne ion fra patienten. Behandlingen er i det væsentlige den samme som ved barbituratforgiftning: 1) maveskylning, 2) korrektion af væske- og elektrolyt-ubalance og 3) regulering af nyrefunktionen. Urinstof, mannitol og aminophyllin producerer alle signifikante stigninger i lithiumudskillelsen. Hæmodialyse er et effektivt og hurtigt middel til at fjerne ion fra den alvorligt giftige patient. Infektionsprofylakse, regelmæssig røntgen af thorax og bevarelse af tilstrækkelig respiration er afgørende.
KONTRAINDIKATIONER
Ingen oplysninger angivet.
KLINISK FARMAKOLOGI
HANDLINGER
Prækliniske undersøgelser har vist, at lithium ændrer natriumtransport i nerve- og muskelceller og bevirker et skift i retning af intraneuronal metabolisme af katekolaminer, men den specifikke biokemiske mekanisme for lithiums virkning ved mani er ukendt.
PATIENTOPLYSNINGER
Ingen oplysninger angivet. Der henvises til ADVARSLER og FORHOLDSREGLER sektioner.
