Abilify 10mg, 15mg, 20mg Aripiprazole Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.

Hvad er Abilify 20mg, og hvordan bruges det?
Abilify er en receptpligtig medicin, der bruges til at behandle symptomerne på skizofreni, bipolar lidelse I (maniodepression) og svær depressiv lidelse. Abilify 10mg kan bruges alene eller sammen med anden medicin. Abilify er et antipsykotisk, antimanisk middel.
- Det vides ikke, om Abilify er sikkert og effektivt til børn under 6 år.
Hvad er de mulige bivirkninger af Abilify 15mg?
Abilify 15mg kan forårsage alvorlige bivirkninger, herunder:
- alvorlig agitation eller angst,
- føler sig rastløs,
- trækninger eller ukontrollerbare bevægelser af dine øjne, læber, tunge, ansigt, arme eller ben,
- maskelignende udseende af ansigtet,
- synkebesvær,
- taleproblemer,
- krampeanfald (kramper),
- tanker om selvmord eller selvskade,
- stive eller stive muskler,
- høj feber,
- svedeture,
- forvirring,
- hurtige eller ujævne hjerteslag,
- rysten (rysten),
- føler sig svimmel,
- kuldegysninger,
- ondt i halsen,
- sår i munden,
- hudsår,
- hoste,
- åndedrætsbesvær,
- øget tørst,
- øget vandladning,
- mundtørhed, og
- frugtig ånde lugt
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Abilify 20mg omfatter:
- ukontrollerede muskelbevægelser,
- angst,
- føler sig rastløs,
- vægtøgning,
- kvalme,
- opkastning,
- forstoppelse,
- øget appetit,
- hovedpine,
- svimmelhed,
- døsighed,
- træthedsfornemmelse,
- søvnproblemer (søvnløshed),
- tilstoppet næse, og
- ondt i halsen
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Abilify. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
ØGET DØDELIGHED HOS ÆLDRE PATIENTER MED DEMENS-RELATERET PSYKOSE og SUICID Tanker og -adfærd med antidepressive stoffer
Ældre patienter med demensrelateret psykose behandlet med antipsykotiske lægemidler har en øget risiko for at dø. ABILIFY 20mg er ikke godkendt til behandling af patienter med demensrelateret psykose [se ADVARSLER OG FORHOLDSREGLER].
Antidepressiva øgede risikoen for selvmordstanker og -adfærd hos børn, unge og unge voksne i korttidsundersøgelser. Disse undersøgelser viste ikke en stigning i risikoen for selvmordstanker og -adfærd ved brug af antidepressiva hos patienter over 24 år; der var en reduktion i risikoen ved brug af antidepressiva hos patienter på 65 år og ældre [se ADVARSLER OG FORHOLDSREGLER].
Hos patienter i alle aldre, som er startet på antidepressiv behandling, skal du nøje overvåge for forværring og for fremkomsten af selvmordstanker og -adfærd. Rådgiv familier og pårørende om behovet for tæt observation og kommunikation med den ordinerende læge [se ADVARSLER OG FORHOLDSREGLER].
BESKRIVELSE
Aripiprazol er et psykotropt lægemiddel, der er tilgængeligt som ABILIFY® (aripiprazol) tabletter, ABILIFY DISCMELT® (aripiprazol) oralt desintegrerende tabletter, ABILIFY® (aripiprazol) oral opløsning og ABILIFY® (aripiprazol) injektion, en opløsning til intramuskulær injektion. Aripiprazol er 7-[4-[4-(2,3dichlorphenyl)-1-piperazinyl]butoxy]-3,4-dihydrocarbostyril. Den empiriske formel er C23H27Cl2N3O2 og dens molekylvægt er 448,38. Den kemiske struktur er:
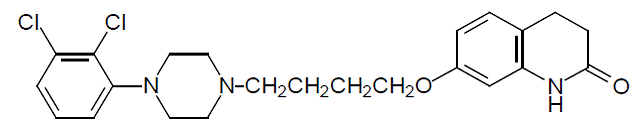
ABILIFY tabletter er tilgængelige i styrker på 2 mg, 5 mg, 10 mg, 15 mg, 20 mg og 30 mg. Inaktive ingredienser omfatter majsstivelse, hydroxypropylcellulose, lactosemonohydrat, magnesiumstearat og mikrokrystallinsk cellulose. Farvestoffer omfatter jernoxid (gul eller rød) og FD&C Blue No. 2 Aluminium Lake.
ABILIFY 20 mg DISCMELT Oralt desintegrerende tabletter fås i styrker på 10 mg og 15 mg. Inaktive ingredienser omfatter acesulfamkalium, aspartam, calciumsilicat, croscarmellosenatrium, crospovidon, creme de vanilla (naturlige og kunstige smagsstoffer), magnesiumstearat, mikrokrystallinsk cellulose, siliciumdioxid, vinsyre og xylitol. Farvestoffer omfatter jernoxid (gul eller rød) og FD&C Blue No. 2 Aluminium Lake.
ABILIFY oral opløsning er en klar, farveløs til lysegul opløsning tilgængelig i en koncentration på 1 mg/ml. De inaktive ingredienser til denne opløsning omfatter dinatriumedetat, fructose, glycerin, dl-mælkesyre, methylparaben, propylenglycol, propylparaben, natriumhydroxid, saccharose og renset vand. Den orale opløsning er tilsat naturlig appelsincreme og andre naturlige smagsstoffer.
ABILIFY Injection fås i enkeltdosishætteglas som en klar til brug, 9,75 mg/1,3 ml (7,5 mg/ml) klar, farveløs, steril, vandig opløsning kun til intramuskulær brug. Inaktive ingredienser til denne opløsning omfatter 199,5 mg sulfobutylether β-cyclodextrin (SBECD), 10,4 mg vinsyre, qs til pH 4,3 af natriumhydroxid og qs til 1,33 ml vand til injektion.
INDIKATIONER
ABILIFY orale tabletter, oralt disintegrerende tabletter og oral opløsning er indiceret til behandling af:
- Skizofreni [se Kliniske Studier ]
- Akut behandling af maniske og blandede episoder forbundet med bipolar lidelse I [se Kliniske Studier ]
- Tillægsbehandling af svær depressiv lidelse [se Kliniske Studier ]
- Irritabilitet forbundet med autistisk lidelse [se Kliniske Studier ]
- Behandling af Tourettes lidelse [se Kliniske Studier ]
ABILIFY Injection er indiceret til behandling af:
- Agitation forbundet med skizofreni eller bipolar mani [se Kliniske Studier ]
DOSERING OG ADMINISTRATION
Skizofreni
Voksne
Den anbefalede start- og måldosis for ABILIFY er 10 eller 15 mg/dag administreret én gang dagligt uden hensyntagen til måltider. ABILIFY er blevet systematisk evalueret og vist at være effektiv i et dosisområde på 10 til 30 mg/dag, når det administreres som tabletformulering; dog var doser højere end 10 eller 15 mg/dag ikke mere effektive end 10 eller 15 mg/dag. Dosisforøgelser bør generelt ikke foretages før 2 uger, den tid der er nødvendig for at opnå steady-state [se Kliniske Studier ].
Vedligeholdelsesbehandling: Opretholdelse af virkning ved skizofreni blev påvist i et forsøg med patienter med skizofreni, som havde været symptomatisk stabile på anden antipsykotisk medicin i perioder på 3 måneder eller længere. Disse patienter blev afbrudt med denne medicin og randomiseret til enten ABILIFY 15 mg/dag eller placebo og observeret for tilbagefald [se Kliniske Studier ]. Patienter bør periodisk revurderes for at fastslå det fortsatte behov for vedligeholdelsesbehandling.
Teenagere
Den anbefalede måldosis af ABILIFY er 10 mg/dag. Aripiprazol blev undersøgt hos unge patienter i alderen 13 til 17 år med skizofreni i daglige doser på 10 mg og 30 mg. Den daglige startdosis af tabletformuleringen hos disse patienter var 2 mg, som blev titreret til 5 mg efter 2 dage og til måldosis på 10 mg efter yderligere 2 dage. Efterfølgende dosisstigninger bør administreres i trin på 5 mg. Dosen på 30 mg/dag viste sig ikke at være mere effektiv end dosis på 10 mg/dag. ABILIFY kan administreres uden hensyntagen til måltider [se Kliniske Studier ]. Patienter bør periodisk revurderes for at fastslå behovet for vedligeholdelsesbehandling.
Skift fra andre antipsykotika
Der er ingen systematisk indsamlede data til specifikt at adressere skift af patienter med skizofreni fra andre antipsykotika til ABILIFY 20 mg eller vedrørende samtidig administration med andre antipsykotika. Mens øjeblikkelig seponering af den tidligere antipsykotiske behandling kan være acceptabel for nogle patienter med skizofreni, kan mere gradvis seponering være mest passende for andre. I alle tilfælde bør perioden med overlappende antipsykotisk administration minimeres.
Bipolar I lidelse
Akut behandling af maniske og blandede episoder
Voksne
Den anbefalede startdosis til voksne er 15 mg givet én gang dagligt som monoterapi og 10 mg til 15 mg givet én gang dagligt som supplerende behandling med lithium eller valproat. ABILIFY 10mg kan gives uden hensyntagen til måltider. Den anbefalede måldosis af ABILIFY er 15 mg/dag, som monoterapi eller som supplerende behandling med lithium eller valproat. Dosis kan øges til 30 mg/dag baseret på klinisk respons. Sikkerheden ved doser over 30 mg/dag er ikke blevet evalueret i kliniske forsøg.
Pædiatri
Den anbefalede startdosis til pædiatriske patienter (10 til 17 år) som monoterapi er 2 mg/dag, med titrering til 5 mg/dag efter 2 dage, og en måldosis på 10 mg/dag efter 2 yderligere dage. Den anbefalede dosering som supplerende terapi til lithium eller valproat er den samme. Efterfølgende dosisstigninger bør om nødvendigt administreres i intervaller på 5 mg/dag. ABILIFY kan gives uden hensyntagen til måltider [se Kliniske Studier ].
Tillægsbehandling af svær depressiv lidelse
Voksne
Den anbefalede startdosis for ABILIFY som supplerende behandling til patienter, der allerede tager et antidepressivum, er 2 til 5 mg/dag. Det anbefalede dosisområde er 2 til 15 mg/dag. Dosisjusteringer på op til 5 mg/dag bør ske gradvist med intervaller på ikke mindre end 1 uge [se Kliniske Studier ]. Patienter bør periodisk revurderes for at fastslå det fortsatte behov for vedligeholdelsesbehandling.
Irritabilitet forbundet med autistisk lidelse
Pædiatriske patienter (6 til 17 år)
Det anbefalede dosisinterval til behandling af pædiatriske patienter med irritabilitet forbundet med autistisk lidelse er 5 til 15 mg/dag.
Dosering bør påbegyndes med 2 mg/dag. Dosis bør øges til 5 mg/dag, med efterfølgende stigninger til 10 eller 15 mg/dag, hvis det er nødvendigt. Dosisjusteringer på op til 5 mg/dag bør ske gradvist med intervaller på ikke mindre end 1 uge [se Kliniske Studier ]. Patienter bør periodisk revurderes for at fastslå det fortsatte behov for vedligeholdelsesbehandling.
Tourettes lidelse
Pædiatriske patienter (6 til 18 år)
Det anbefalede dosisområde for Tourettes lidelse er 5 til 20 mg/dag.
For patienter, der vejer mindre end 50 kg, bør doseringen påbegyndes med 2 mg/dag med en måldosis på 5 mg/dag efter 2 dage. Dosis kan øges til 10 mg/dag hos patienter, som ikke opnår optimal kontrol af tics. Dosisjusteringer bør ske gradvist med intervaller på ikke mindre end 1 uge.
For patienter, der vejer 50 kg eller mere, bør doseringen påbegyndes med 2 mg/dag i 2 dage og derefter øges til 5 mg/dag i 5 dage med en måldosis på 10 mg/dag på dag 8. Dosis kan evt. øget op til 20 mg/dag for patienter, der ikke opnår optimal kontrol af tics. Dosisjusteringer bør ske gradvist i trin på 5 mg/dag med intervaller på ikke mindre end 1 uge. [Se Kliniske Studier ].
Patienter bør periodisk revurderes for at fastslå det fortsatte behov for vedligeholdelsesbehandling.
Agitation forbundet med skizofreni eller bipolar mani (intramuskulær injektion)
Voksne
Den anbefalede dosis til disse patienter er 9,75 mg. Det anbefalede dosisområde er 5,25 til 15 mg. Der blev ikke påvist yderligere fordele for 15 mg sammenlignet med 9,75 mg. En lavere dosis på 5,25 mg kan overvejes, når kliniske faktorer berettiger det. Hvis agitation, der berettiger en anden dosis, fortsætter efter den indledende dosis, kan kumulative doser gives op til i alt 30 mg/dag. Effekten af gentagne doser af ABILIFY 10 mg injektion hos ophidsede patienter er imidlertid ikke blevet systematisk evalueret i kontrollerede kliniske forsøg. Sikkerheden ved samlede daglige doser større end 30 mg eller injektioner givet hyppigere end hver anden time er ikke blevet tilstrækkeligt evalueret i kliniske forsøg [se Kliniske Studier ].
Hvis igangværende ABILIFY-behandling er klinisk indiceret, bør oral ABILIFY i et interval på 10 til 30 mg/dag erstatte ABILIFY-injektion så hurtigt som muligt [se DOSERING OG ADMINISTRATION ].
Administration af ABILIFY-injektion
For at indgive ABILIFY 10 mg injektion trækkes den nødvendige mængde opløsning op i sprøjten som vist i tabel 1. Kassér enhver ubrugt portion.
ABILIFY Injection er kun beregnet til intramuskulær brug. Må ikke administreres intravenøst eller subkutant. Injicer langsomt, dybt ind i muskelmassen.
Parenterale lægemidler bør inspiceres visuelt for partikler og misfarvning før administration, når opløsning og beholder tillader det.
Dosisjusteringer til Cytochrome P450-overvejelser
Dosisjusteringer anbefales til patienter, som er kendte CYP2D6-fattige metabolisatorer, og til patienter, der samtidig tager CYP3A4-hæmmere eller CYP2D6-hæmmere eller stærke CYP3A4-inducere (se tabel 2). Når det samtidig administrerede lægemiddel trækkes ud af kombinationsbehandlingen, skal ABILIFY 10 mg dosis justeres til dets oprindelige niveau. Når den samtidig administrerede CYP3A4-inducer seponeres, skal ABILIFY-dosis reduceres til det oprindelige niveau i løbet af 1 til 2 uger. Patienter, som muligvis får en kombination af stærke, moderate og svage hæmmere af CYP3A4 og CYP2D6 (f.eks. en stærk CYP3A4-hæmmer og en moderat CYP2D6-hæmmer eller en moderat CYP3A4-hæmmer med en moderat CYP2D6-hæmmer), kan dosis reduceres til én. - fjerdedel (25 %) af den sædvanlige dosis indledningsvis og derefter justeret for at opnå en gunstig klinisk respons.
Når supplerende ABILIFY administreres til patienter med svær depressiv lidelse, bør ABILIFY 10 mg administreres uden dosisjustering som specificeret i Dosering og administration (2.3).
Dosering af oral opløsning
Den orale opløsning kan erstattes af tabletter på en mg-per-mg basis op til 25 mg dosisniveauet. Patienter, der får 30 mg tabletter, skal modtage 25 mg af opløsningen [se KLINISK FARMAKOLOGI ].
Dosering af oralt disintegrerende tabletter
Doseringen for ABILIFY 10 mg oralt desintegrerende tabletter er den samme som for de orale tabletter [se ovenstående afsnit ].
HVORDAN LEVERET
Doseringsformer og styrker
ABILIFY® (aripiprazol) tabletter er tilgængelige som beskrevet i tabel 3.
ABILIFY DISCMELT® (aripiprazol) oralt desintegrerende tabletter er tilgængelige som beskrevet i tabel 4.
ABILIFY® (aripiprazol) oral opløsning (1 mg/ml) er en klar, farveløs til lysegul opløsning, som leveres i børnesikrede flasker sammen med en kalibreret oral doseringsbæger.
ABILIFY® (aripiprazol) injektion til intramuskulær brug er en klar, farveløs opløsning tilgængelig som en klar til brug, 9,75 mg/1,3 ml (7,5 mg/ml) opløsning i klare type 1 hætteglas.
Opbevaring og håndtering
ABILIFY® (aripiprazol) tabletter har markeringer på den ene side og fås i de styrker og pakninger, der er anført i tabel 32.
ABILIFY 15mg DISCMELT® (aripiprazol) oralt desintegrerende tabletter er runde tabletter med markeringer på hver side. ABILIFY 15mg DISCMELT er tilgængelig i styrkerne og pakningerne, der er angivet i tabel 33.
ABILIFY® (aripiprazol) oral opløsning (1 mg/ml) leveres i børnesikrede flasker sammen med en kalibreret oral doseringsbæger. ABILIFY 20mg oral opløsning er tilgængelig som følger:
150 mL flaske NDC 59148-013-15
ABILIFY® (aripiprazol) Injektion til intramuskulær brug er tilgængelig som en brugsklar, 9,75 mg/1,3 ml (7,5 mg/mL) opløsning i klare type 1 hætteglas som følger:
9,75 mg/1,3 mL enkeltdosis hætteglas NDC 59148-016-65
Opbevaring
Tabletter
Opbevares ved 25°C (77°F); udflugter tilladt mellem 15°C til 30°C (59°F til 86°F) [se USP kontrolleret rumtemperatur ].
Oral løsning
Opbevares ved 25°C (77°F); udflugter tilladt mellem 15°C til 30°C (59°F til 86°F) [se USP kontrolleret rumtemperatur ]. Åbnede flasker med ABILIFY oral opløsning kan bruges i op til 6 måneder efter åbning, men ikke efter udløbsdatoen på flasken. Flasken og dens indhold skal kasseres efter udløbsdatoen.
Indsprøjtning
Opbevares ved 25°C (77°F); udflugter tilladt mellem 15°C til 30°C (59°F til 86°F) [se USP kontrolleret rumtemperatur ]. Beskyt mod lys ved at opbevare i den originale beholder. Opbevar i karton indtil brug.
Distribueret og markedsført af Otsuka America Pharmaceutical, Inc., Rockville, MD 20850 USA. Otsuka America Pharmaceutical, Inc.,. rev. august 2019
BIVIRKNINGER
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Følgende bivirkninger er beskrevet mere detaljeret i andre sektioner af mærkningen:
- Øget dødelighed hos ældre patienter med demensrelateret psykose [se KASSET ADVARSEL og ADVARSLER OG FORHOLDSREGLER ]
- Cerebrovaskulære bivirkninger, herunder slagtilfælde [se ADVARSLER OG FORHOLDSREGLER ]
- Selvmordstanker og -adfærd hos børn, unge og unge voksne [se KASSET ADVARSEL og ADVARSLER OG FORHOLDSREGLER ]
- Malignt neuroleptikasyndrom (NMS) [se ADVARSLER OG FORHOLDSREGLER ]
- Tardiv dyskinesi [se ADVARSLER OG FORHOLDSREGLER ]
- Metaboliske ændringer [se ADVARSLER OG FORHOLDSREGLER ]
- Patologisk hasardspil og anden kompulsiv adfærd [se ADVARSLER OG FORHOLDSREGLER ]
- Ortostatisk hypotension [se ADVARSLER OG FORHOLDSREGLER ]
- Falder [se ADVARSLER OG FORHOLDSREGLER ]
- Leukopeni, Neutropeni og Agranulocytose [se ADVARSLER OG FORHOLDSREGLER ]
- Anfald/kramper [se ADVARSLER OG FORHOLDSREGLER ]
- Potentiale for kognitiv og motorisk svækkelse [se ADVARSLER OG FORHOLDSREGLER ]
- Kropstemperaturregulering [se ADVARSLER OG FORHOLDSREGLER ]
- Selvmord [se ADVARSLER OG FORHOLDSREGLER ]
- Dysfagi [se ADVARSLER OG FORHOLDSREGLER ]
De mest almindelige bivirkninger hos voksne patienter i kliniske forsøg (≥10%) var kvalme, opkastning, forstoppelse, hovedpine, svimmelhed, akatisi, angst, søvnløshed og rastløshed.
De mest almindelige bivirkninger i de pædiatriske kliniske forsøg (≥10%) var somnolens, hovedpine, opkastning, ekstrapyramidal lidelse, træthed, øget appetit, søvnløshed, kvalme, nasopharyngitis og vægtøgning.
ABILIFY er blevet evalueret for sikkerhed hos 13.543 voksne patienter, som deltog i kliniske forsøg med flere doser af skizofreni, bipolar lidelse, svær depressiv lidelse, demens af Alzheimers type, Parkinsons sygdom og alkoholisme, og som havde ca. 7619 patientår med eksponering for oral ABILIFY 10 mg og 749 patienter med eksponering for ABILIFY-injektion. I alt 3390 patienter blev behandlet med oral ABILIFY i mindst 180 dage, og 1933 patienter behandlet med oral ABILIFY havde mindst 1 års eksponering.
ABILIFY 15mg er blevet evalueret for sikkerhed hos 1.686 patienter (6 til 18 år), som deltog i kliniske forsøg med flere doser i skizofreni, bipolar mani, autistisk lidelse eller Tourettes lidelse, og som havde ca. 1.342 patientårs eksponering for oral ABILIFY . I alt 959 pædiatriske patienter blev behandlet med oral ABILIFY i mindst 180 dage, og 556 pædiatriske patienter behandlet med oral ABILIFY 10 mg havde mindst 1 års eksponering.
Betingelserne og varigheden af behandlingen med ABILIFY (monoterapi og supplerende terapi med antidepressiva eller humørstabilisatorer) omfattede (i overlappende kategorier) dobbeltblindede, komparative og ikke-komparative åbne undersøgelser, indlagte og ambulante undersøgelser, studier med faste og fleksible doser, og kort- og længerevarende eksponering.
Erfaring med kliniske forsøg
Voksne patienter med skizofreni
Følgende resultater er baseret på en pulje af fem placebokontrollerede forsøg (fire 4-ugers og en 6-ugers), hvor oral ABILIFY 15 mg blev administreret i doser fra 2 til 30 mg/dag.
Almindelig observerede bivirkninger
Den eneste almindeligt observerede bivirkning forbundet med brugen af ABILIFY 20 mg hos patienter med skizofreni (incidens på 5 % eller mere og ABILIFY-incidens mindst dobbelt så stor som for placebo) var akatisi (ABILIFY 8 %; placebo 4 %).
Voksne patienter med bipolar mani
Monoterapi
Følgende resultater er baseret på en pulje af 3-ugers, placebokontrollerede, bipolar mani-forsøg, hvor oral ABILIFY 15 mg blev administreret i doser på 15 eller 30 mg/dag.
Almindelig observerede bivirkninger
Almindeligvis observerede bivirkninger forbundet med brugen af ABILIFY hos patienter med bipolar mani (hyppighed på 5 % eller mere og ABILIFY 15 mg forekomst mindst det dobbelte af placebo) er vist i tabel 16.
Mindre almindelige bivirkninger hos voksne
Tabel 17 opregner den samlede forekomst, afrundet til nærmeste procent, af bivirkninger, der opstod under akut behandling (op til 6 uger ved skizofreni og op til 3 uger ved bipolar mani), inklusive kun de reaktioner, der opstod hos 2 % eller mere af patienter behandlet med ABILIFY (doser ≥2 mg/dag), og hvor forekomsten hos patienter behandlet med ABILIFY 20 mg var større end forekomsten hos patienter behandlet med placebo i det kombinerede datasæt.
En undersøgelse af befolkningsundergrupper afslørede ikke nogen klare beviser for differentiel bivirkningsincidens på basis af alder, køn eller race.
Voksne patienter med supplerende terapi med bipolar mani
Følgende resultater er baseret på et placebokontrolleret forsøg med voksne patienter med bipolar lidelse, hvor ABILIFY 15 mg blev administreret i doser på 15 eller 30 mg/dag som supplerende behandling med lithium eller valproat.
Bivirkninger forbundet med seponering af behandling
I en undersøgelse af patienter, der allerede tolererede enten lithium eller valproat som monoterapi, var seponeringsraten på grund af bivirkninger 12 % for patienter behandlet med supplerende ABILIFY sammenlignet med 6 % for patienter behandlet med supplerende placebo. De mest almindelige bivirkninger forbundet med seponering hos de supplerende ABILIFY-behandlede patienter sammenlignet med placebo-behandlede patienter var akatisi (henholdsvis 5 % og 1 %) og tremor (henholdsvis 2 % og 1 %).
Almindelig observerede bivirkninger
De almindeligt observerede bivirkninger forbundet med supplerende ABILIFY og lithium eller valproat hos patienter med bipolar mani (hyppighed på 5 % eller mere og forekomst mindst dobbelt så høj som for supplerende placebo) var: akatisi, søvnløshed og ekstrapyramidale lidelser.
Mindre almindelige bivirkninger hos voksne patienter med supplerende terapi ved bipolar mani
Tabel 18 opregner forekomsten, afrundet til nærmeste procent, af bivirkninger, der opstod under akut behandling (op til 6 uger), inklusive kun de reaktioner, der opstod hos 2 % eller flere af patienterne behandlet med tillægsmiddel ABILIFY (doser på 15 eller 30 mg/dag) og lithium eller valproat, og for hvilke incidensen hos patienter behandlet med denne kombination var større end forekomsten hos patienter behandlet med placebo plus lithium eller valproat.
Pædiatriske patienter (13 til 17 år) med skizofreni
Følgende resultater er baseret på et 6-ugers, placebokontrolleret forsøg, hvor oral ABILIFY blev administreret i doser fra 2 til 30 mg/dag.
Bivirkninger forbundet med seponering af behandling
Hyppigheden af seponering på grund af bivirkninger mellem ABILIFY-behandlede og placebo-behandlede pædiatriske patienter (13 til 17 år) var henholdsvis 5 % og 2 %.
Almindelig observerede bivirkninger
Almindeligvis observerede bivirkninger forbundet med brugen af ABILIFY 10 mg hos unge patienter med skizofreni (hyppighed på 5 % eller mere og ABILIFY-incidens mindst dobbelt så høj som for placebo) var ekstrapyramidale lidelser, somnolens og tremor.
Pædiatriske patienter (10 til 17 år) med bipolar mani
Følgende resultater er baseret på et 4-ugers, placebokontrolleret forsøg, hvor oral ABILIFY blev administreret i doser på 10 eller 30 mg/dag.
Bivirkninger forbundet med seponering af behandling
Hyppigheden af seponering på grund af bivirkninger mellem ABILIFY-behandlede og placebo-behandlede pædiatriske patienter (10 til 17 år) var henholdsvis 7 % og 2 %.
Almindelig observerede bivirkninger
Almindeligvis observerede bivirkninger forbundet med brugen af ABILIFY 20 mg hos pædiatriske patienter med bipolar mani (hyppighed på 5 % eller mere og ABILIFY-incidens mindst dobbelt så stor som for placebo) er vist i tabel 19.
Pædiatriske patienter (6 til 17 år) med autistisk lidelse
Følgende resultater er baseret på to 8-ugers placebokontrollerede forsøg, hvor oral ABILIFY 20 mg blev administreret i doser på 2 til 15 mg/dag.
Bivirkninger forbundet med seponering af behandling
Hyppigheden af seponering på grund af bivirkninger mellem ABILIFY-behandlede og placebo-behandlede pædiatriske patienter (6 til 17 år) var henholdsvis 10 % og 8 %.
Almindelig observerede bivirkninger
Almindelig observerede bivirkninger forbundet med brugen af ABILIFY hos pædiatriske patienter med autistisk lidelse (hyppighed på 5 % eller mere og ABILIFY 10 mg forekomst mindst det dobbelte af placebo) er vist i tabel 20.
Pædiatriske patienter (6 til 18 år) med Tourettes lidelse
Følgende resultater er baseret på et 8-ugers og et 10-ugers, placebo-kontrollerede forsøg, hvor oral ABILIFY 15 mg blev administreret i doser på 2 til 20 mg/dag.
Bivirkninger forbundet med seponering af behandling
Hyppigheden af seponering på grund af bivirkninger mellem ABILIFY-behandlede og placebo-behandlede pædiatriske patienter (6 til 18 år) var henholdsvis 7 % og 1 %.
Almindelig observerede bivirkninger
Almindelig observerede bivirkninger forbundet med brugen af ABILIFY hos pædiatriske patienter med Tourettes lidelse (incidens på 5 % eller mere og ABILIFY 10 mg forekomst mindst det dobbelte af placebo) er vist i Tabel 21.
Mindre almindelige bivirkninger hos pædiatriske patienter (6 til 18 år) med skizofreni, bipolar mani, autistisk lidelse eller Tourettes lidelse
Tabel 22 opregner den samlede forekomst, afrundet til nærmeste procent, af bivirkninger, der opstod under akut behandling (op til 6 uger ved skizofreni, op til 4 uger ved bipolar mani, op til 8 uger ved autistisk lidelse og op til 10 uger). ved Tourettes lidelse), inklusive kun de reaktioner, der opstod hos 2 % eller flere af pædiatriske patienter behandlet med ABILIFY (doser ≥2 mg/dag), og hvor forekomsten hos patienter behandlet med ABILIFY 10 mg var større end forekomsten hos patienter behandlet med placebo.
Voksne patienter, der modtager ABILIFY som supplerende behandling af svær depressiv lidelse
Følgende resultater er baseret på en pulje af to placebokontrollerede forsøg med patienter med svær depressiv lidelse, hvor ABILIFY 20 mg blev administreret i doser på 2 mg til 20 mg som supplerende behandling til fortsat antidepressiv behandling.
Bivirkninger forbundet med seponering af behandling
Hyppigheden af seponering på grund af bivirkninger var 6 % for patienter behandlet med supplerende ABILIFY og 2 % for patienter behandlet med supplerende placebo.
Almindelig observerede bivirkninger
De almindeligt observerede bivirkninger forbundet med brugen af supplerende ABILIFY 15 mg hos patienter med svær depressiv lidelse (hyppighed på 5 % eller mere og ABILIFY 15 mg forekomst mindst dobbelt så høj som for placebo) var: akatisi, rastløshed, søvnløshed, forstoppelse, træthed og sløret syn.
Mindre almindelige bivirkninger hos voksne patienter med svær depressiv lidelse
Tabel 23 opregner den samlede forekomst, afrundet til nærmeste procent, af bivirkninger, der opstod under akut behandling (op til 6 uger), inklusive kun de bivirkninger, der opstod hos 2 % eller flere af patienterne behandlet med supplerende ABILIFY (doser ≥2) mg/dag), og hvor forekomsten hos patienter behandlet med supplerende ABILIFY 10 mg var større end forekomsten hos patienter behandlet med supplerende placebo i det kombinerede datasæt.
Patienter med agitation forbundet med skizofreni eller bipolar mani (intramuskulær injektion)
Følgende fund er baseret på en pulje af tre placebokontrollerede forsøg med patienter med agitation forbundet med skizofreni eller bipolar mani, hvor ABILIFY 20 mg injektion blev administreret i doser på 5,25 mg til 15 mg.
Almindelig observerede bivirkninger
Der var en almindeligt observeret bivirkning (kvalme) forbundet med brugen af ABILIFY 10 mg injektion hos patienter med agitation forbundet med skizofreni og bipolar mani (hyppighed på 5 % eller mere og ABILIFY 20 mg incidens mindst det dobbelte af placebo).
Mindre almindelige bivirkninger hos patienter med agitation forbundet med skizofreni eller bipolar mani
Tabel 24 opregner den samlede forekomst, afrundet til nærmeste procent, af bivirkninger, der opstod under akut behandling (24-timers), inklusive kun de bivirkninger, der forekom hos 2 % eller flere af patienterne behandlet med ABILIFY-injektion (doser ≥5,25 mg) /dag), og hvor forekomsten hos patienter behandlet med ABILIFY 15 mg injektion var større end forekomsten hos patienter behandlet med placebo i det kombinerede datasæt.
Dosis-relaterede bivirkninger
Skizofreni
Dosis-responsforhold for forekomsten af behandlingsfremkomne bivirkninger blev evalueret ud fra fire forsøg med voksne patienter med skizofreni, der sammenlignede forskellige faste doser (2, 5, 10, 15, 20 og 30 mg/dag) af oral ABILIFY med placebo. Denne analyse, stratificeret efter undersøgelse, indikerede, at den eneste bivirkning, der havde et muligt dosis-responsforhold, og da kun mest fremtrædende med 30 mg, var somnolens [inklusive sedation]; (hyppigheden var placebo, 7,1 %; 10 mg, 8,5 %; 15 mg, 8,7 %; 20 mg, 7,5 %; 30 mg, 12,6 %).
I undersøgelsen af pædiatriske patienter (13 til 17 år) med skizofreni så tre almindelige bivirkninger ud til at have en mulig dosis-respons sammenhæng: ekstrapyramidal lidelse (hyppigheden var placebo, 5,0 %; 10 mg, 13,0 %; 30 mg, 21,6 %); somnolens (hyppigheden var placebo, 6,0 %; 10 mg, 11,0 %; 30 mg, 21,6 %); og tremor (hyppigheden var placebo, 2,0 %; 10 mg, 2,0 %; 30 mg, 11,8 %).
Bipolar mani
undersøgelsen af pædiatriske patienter (10 til 17 år) med bipolar mani havde fire almindelige bivirkninger et muligt dosis-responsforhold efter 4 uger; ekstrapyramidal lidelse (hyppigheden var placebo, 3,1 %; 10 mg, 12,2 %; 30 mg, 27,3 %); somnolens (hyppigheden var placebo, 3,1 %; 10 mg, 19,4 %; 30 mg, 26,3 %); akatisi (hyppigheden var placebo, 2,1 %; 10 mg, 8,2 %; 30 mg, 11,1 %); og spyt hypersekretion (hyppigheden var placebo, 0 %; 10 mg, 3,1 %; 30 mg, 8,1 %).
Autistisk lidelse
I en undersøgelse af pædiatriske patienter (6 til 17 år) med autistisk lidelse, havde en almindelig bivirkning et muligt dosisresponsforhold: træthed (hyppigheden var placebo, 0 %; 5 mg, 3,8 %; 10 mg, 22,0 %; 15 mg, 18,5 %).
Tourettes lidelse
I en undersøgelse af pædiatriske patienter (7 til 17 år) med Tourettes lidelse havde ingen almindelige bivirkninger et dosis-responsforhold.
Ekstrapyramidale symptomer
Skizofreni
kortvarige, placebo-kontrollerede forsøg med skizofreni hos voksne var forekomsten af rapporterede EPS-relaterede hændelser, eksklusive hændelser relateret til akatisi, for ABILIFY-behandlede patienter 13 % vs. 12 % for placebo; og forekomsten af akatisi-relaterede hændelser for ABILIFY-behandlede patienter var 8 % vs. 4 % for placebo. I det kortsigtede, placebokontrollerede forsøg med skizofreni hos pædiatriske patienter (13 til 17 år) var forekomsten af rapporterede EPS-relaterede hændelser, eksklusive hændelser relateret til akatisi, for ABILIFY-behandlede patienter 25 % vs. 7 % for placebo; og forekomsten af akatisi-relaterede hændelser for ABILIFY-behandlede patienter var 9 % vs. 6 % for placebo.
Objektivt indsamlede data fra disse forsøg blev indsamlet på Simpson Angus Rating Scale (for EPS), Barnes Akathisia Scale (for akathisia) og Assessments of Involuntary Movement Scales (for dyskinesier). I de voksne skizofreni-forsøg viste de objektivt indsamlede data ikke en forskel mellem ABILIFY 10mg og placebo, med undtagelse af Barnes Akathisia-skalaen (ABILIFY 20mg, 0,08; placebo, -0,05). I det pædiatriske (13 til 17 år) skizofreniforsøg viste de objektivt indsamlede data ikke en forskel mellem ABILIFY 20mg og placebo, med undtagelse af Simpson Angus Rating Scale (ABILIFY 20mg, 0,24; placebo, -0,29).
Tilsvarende, i et langsigtet (26-ugers), placebokontrolleret forsøg med skizofreni hos voksne, blev der objektivt indsamlet data om Simpson Angus Rating Scale (for EPS), Barnes Akathisia Scale (for akathisia) og Assessments of Involuntary. Bevægelsesskalaer (til dyskinesier) viste ingen forskel mellem ABILIFY og placebo.
Bipolar mani
de kortsigtede, placebokontrollerede forsøg med bipolar mani hos voksne var forekomsten af rapporterede EPS-relaterede hændelser, eksklusive hændelser relateret til akatisi, for ABILIFY-behandlede monoterapipatienter 16 % vs. 8 % for placebo og incidensen af akatisi-relaterede hændelser for monoterapi ABILIFY-behandlede patienter var 13 % vs. 4 % for placebo. I det 6-ugers placebokontrollerede forsøg med bipolar mani til supplerende behandling med lithium eller valproat, var forekomsten af rapporterede EPS-relaterede hændelser, eksklusive hændelser relateret til akatisi for supplerende ABILIFY-behandlede patienter, 15 % vs. 8 % for adjunkt. placebo og forekomsten af akatisi-relaterede hændelser for supplerende ABILIFY-behandlede patienter var 19 % vs. 5 % for supplerende placebo. I det kortsigtede, placebo-kontrollerede forsøg med bipolar mani hos pædiatriske (10 til 17 år) patienter var forekomsten af rapporterede EPS-relaterede hændelser, eksklusive hændelser relateret til akatisi, for ABILIFY-behandlede patienter 26 % vs. 5 % for placebo og forekomsten af akatisi-relaterede hændelser for ABILIFY-behandlede patienter var 10 % vs. 2 % for placebo.
forsøg med bipolar mani hos voksne med ABILIFY monoterapi, viste Simpson Angus Rating Scale og Barnes Akathisia Scale en signifikant forskel mellem ABILIFY 15 mg og placebo (ABILIFY, 0,50; placebo, -0,01 og ABILIFY 10mg, 0,20,0; placebo, -5). Ændringer i vurderingerne af ufrivillige bevægelsesskalaer var ens for ABILIFY 15 mg- og placebogrupperne. I forsøg med bipolar mani med ABILIFY 20mg som supplerende terapi med enten lithium eller valproat, viste Simpson Angus Rating Scale og Barnes Akathisia Scale en signifikant forskel mellem adjuvant ABILIFY og supplerende placebo (ABILIFY 20mg, 0,703, 0,70mg og placebo. 0,30; placebo, 0,11). Ændringer i vurderingerne af ufrivillige bevægelsesskalaer var ens for supplerende ABILIFY 20 mg og supplerende placebo. I det pædiatriske (10 til 17 år), kortvarige forsøg med bipolar mani, viste Simpson Angus Rating Scale en signifikant forskel mellem ABILIFY 10 mg og placebo (ABILIFY 15 mg, 0,90; placebo, -0,05). Ændringer i Barnes Akathisia-skalaen og vurderingerne af ufrivillige bevægelsesskalaer var ens for ABILIFY 20 mg- og placebogrupperne.
Større depressiv lidelse
I de kortsigtede, placebo-kontrollerede forsøg med svær depressiv lidelse var forekomsten af rapporterede EPS-relaterede hændelser, eksklusive hændelser relateret til akatisi, for patienter behandlet med ABILIFY som supplement 8 % vs. 5 % for patienter behandlet med supplerende placebo; og forekomsten af akatisi-relaterede hændelser for patienter behandlet med supplerende ABILIFY var 25 % vs. 4 % for patienter behandlet med supplerende placebo.
I forsøg med svær depressiv lidelse viste Simpson Angus Rating Scale og Barnes Akathisia Scale en signifikant forskel mellem adjuvant ABILIFY og adjuvant placebo (ABILIFY 10 mg, 0,31; placebo, 0,03 og ABILIFY, 0,22; placebo, 0,02). Ændringer i vurderingerne af ufrivillige bevægelsesskalaer var ens for de supplerende ABILIFY- og de supplerende placebogrupper.
Autistisk lidelse
de kortsigtede, placebo-kontrollerede forsøg med autistiske lidelser hos pædiatriske patienter (6 til 17 år), var forekomsten af rapporterede EPS-relaterede hændelser, eksklusive hændelser relateret til akatisi, for ABILIFY-behandlede patienter 18 % vs. 2 % for placebo og forekomsten af akatisi-relaterede hændelser for ABILIFY-behandlede patienter var 3 % vs. 9 % for placebo.
I de pædiatriske (6 til 17 år) kortvarige forsøg med autistiske lidelser viste Simpson Angus Rating Scale en signifikant forskel mellem ABILIFY og placebo (ABILIFY 20 mg, 0,1; placebo, -0,4). Ændringer i Barnes Akathisia-skalaen og vurderingerne af ufrivillige bevægelsesskalaer var ens for ABILIFY 10 mg- og placebogrupperne.
Tourettes lidelse
de kortsigtede, placebo-kontrollerede forsøg med Tourettes lidelse hos pædiatriske patienter (6 til 18 år) var forekomsten af rapporterede EPS-relaterede hændelser, eksklusive hændelser relateret til akatisi, for ABILIFY-behandlede patienter 7 % vs. 6 % for placebo og forekomsten af akatisi-relaterede hændelser for ABILIFY-behandlede patienter var 4 % vs. 6 % for placebo.
I de pædiatriske (6 til 18 år) korttidsforsøg med Tourettes lidelse var ændringer i Simpson Angus Rating Scale, Barnes Akathisia Scale og Assessments of Involuntary Movement Scale ikke klinisk meningsfuldt forskellige for ABILIFY 15 mg og placebo.
Agitation forbundet med skizofreni eller bipolar mani
de placebokontrollerede forsøg med patienter med agitation forbundet med skizofreni eller bipolar mani, var forekomsten af rapporterede EPS-relaterede hændelser eksklusive hændelser relateret til akatisi for ABILIFY-behandlede patienter 2 % vs. 2 % for placebo og forekomsten af akatisi- relaterede hændelser for ABILIFY-behandlede patienter var 2 % vs. 0 % for placebo. Objektivt indsamlede data på Simpson Angus Rating Scale (for EPS) og Barnes Akathisia Scale (for akathisia) for alle behandlingsgrupper viste ikke en forskel mellem ABILIFY 10 mg og placebo.
Dystoni
Symptomer på dystoni, langvarige unormale sammentrækninger af muskelgrupper, kan forekomme hos følsomme personer i løbet af de første par dage af behandlingen. Dystoniske symptomer omfatter: spasmer i nakkemusklerne, nogle gange udvikler sig til stram hals, synkebesvær, vejrtrækningsbesvær og/eller fremspring af tungen. Selvom disse symptomer kan forekomme ved lave doser, forekommer de hyppigere og med større sværhedsgrad med høj styrke og ved højere doser af førstegenerations antipsykotiske lægemidler. En forhøjet risiko for akut dystoni er observeret hos mænd og yngre aldersgrupper.
Yderligere fund observeret i kliniske forsøg
Bivirkninger i langsigtede, dobbeltblindede, placebokontrollerede forsøg
De bivirkninger, der blev rapporteret i et 26-ugers, dobbeltblindet forsøg, der sammenlignede oral ABILIFY 10 mg og placebo hos patienter med skizofreni, var generelt i overensstemmelse med dem, der blev rapporteret i de kortsigtede, placebo-kontrollerede forsøg, bortset fra en højere forekomst af tremor [8 % (12/153) for ABILIFY 20 mg vs. 2 % (3/153) for placebo]. I denne undersøgelse var størstedelen af tilfældene af tremor af mild intensitet (8/12 mild og 4/12 moderat), forekom tidligt i behandlingen (9/12 ≤49 dage) og var af begrænset varighed (7/12 ≤ 10 dage). Tremor førte sjældent til seponering (
Andre bivirkninger observeret under premarketing-evalueringen af ABILIFY
Følgende liste inkluderer ikke reaktioner: 1) allerede opført i tidligere tabeller eller andre steder i mærkning, 2) hvor en lægemiddelårsag var fjern, 3) som var så generelle, at de var uinformative, 4) som ikke blev anset for at have signifikant kliniske implikationer, eller 5) som forekom med en hastighed lig med eller mindre end placebo.
Reaktioner er kategoriseret efter kropssystem i henhold til følgende definitioner: hyppige bivirkninger er dem, der forekommer hos mindst 1/100 patienter; sjældne bivirkninger er dem, der forekommer hos 1/100 til 1/1000 patienter; sjældne reaktioner er dem, der forekommer hos færre end 1/1000 patienter:
Voksne - Mundtlig administration
Blod og lymfesystem lidelser: sjælden - trombocytopeni
Hjertelidelser: sjældent - bradykardi, hjertebanken, sjælden - atrieflimren, kardiorespirationsstop, atrioventrikulær blokering, atrieflimren, angina pectoris, myokardieiskæmi, myokardieinfarkt, hjerte-lungesvigt
Øjenlidelser: sjældent - fotofobi; sjælden - diplopi
Gastrointestinale lidelser: sjældent - gastroøsofageal reflukssygdom
Generelle lidelser og administrationsbetingelser: hyppig - asteni; sjældent - perifert ødem, brystsmerter; sjælden - ansigtsødem
Lever og galdeveje: sjælden - hepatitis, gulsot
Forstyrrelser i immunsystemet : sjælden - overfølsomhed
Skader, forgiftning og proceduremæssige komplikationer: sjældent - falde; sjælden - hedeslag
Undersøgelser: hyppig - vægttab, sjældent - øget leverenzym, øget blodsukker, øget lactatdehydrogenase i blodet, øget gamma-glutamyltransferase; sjælden - øget prolaktin i blodet, øget urinstof i blodet, øget blodkreatinin, øget bilirubin i blodet, forlænget elektrokardiogram QT, øget glykosyleret hæmoglobin
Metabolisme og ernæringsforstyrrelser: hyppig - anoreksi; sjælden - hypokaliæmi, hyponatriæmi, hypoglykæmi
Muskuloskeletale og bindevævslidelser: sjældent - muskelsvaghed, muskelspænding; sjælden - rabdomyolyse, nedsat mobilitet
Forstyrrelser i nervesystemet: sjældent - parkinsonisme, hukommelsessvækkelse, tandhjulsstivhed, hypokinesi, bradykinesi; sjælden - akinesi, myoklonus, unormal koordination, taleforstyrrelse, Grand Mal-kramper;
Psykiatriske lidelser: sjældent - aggression, tab af libido, delirium; sjælden - øget libido, anorgasmi, tic, mordtanker, katatoni, søvngang
Nyre- og urinvejslidelser: sjælden - urinretention, nocturi
Reproduktionssystem og brystsygdomme: sjældent - erektil dysfunktion; sjælden - gynækomasti, uregelmæssig menstruation, amenoré, brystsmerter, priapisme
Åndedræts-, thorax- og mediastinale lidelser: sjældent - tilstoppet næse, dyspnø
Hud- og subkutane vævsforstyrrelser: sjældent - udslæt, hyperhidrose, pruritus, lysfølsomhedsreaktion, alopeci; sjælden - nældefeber
Vaskulære lidelser: sjældent - hypotension, hypertension
Pædiatriske patienter - Oral administration
De fleste bivirkninger observeret i den samlede database med 1.686 pædiatriske patienter i alderen 6 til 18 år blev også observeret i den voksne population. Yderligere bivirkninger observeret i den pædiatriske population er anført nedenfor.
Øjenlidelser sjælden - okuologisk krise
Gastrointestinale lidelser: sjældent -tunge tør, tunge spasmer
Undersøgelser: hyppig - blodinsulin øget
Forstyrrelser i nervesystemet: sjældent - søvn taler
Nyre- og urinvejslidelser hyppig - enuresis
Hud- og subkutane vævsforstyrrelser: sjældent - hirsutisme
Voksne - Intramuskulær injektion
De fleste bivirkninger observeret i den samlede database med 749 voksne patienter behandlet med ABILIFY-injektion, blev også observeret i den voksne population behandlet med oral ABILIFY. Yderligere bivirkninger observeret i ABILIFY-injektionspopulationen er anført nedenfor.
Generelle lidelser og administrationsbetingelser: ≥1/100 patienter - reaktion på injektionsstedet; ≥1/1000 patienter og
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af ABILIFY efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt at fastslå en årsagssammenhæng til lægemiddeleksponering: forekomster af allergisk reaktion (anafylaktisk reaktion, angioødem, laryngospasme, pruritus/urticaria eller orofaryngeal spasmer), patologisk ludomani. , hikke og blodsukkerudsving.
DRUGSINTERAKTIONER
Lægemidler, der har klinisk vigtige interaktioner med ABILIFY
Lægemidler, der ikke har nogen klinisk vigtige interaktioner med ABILIFY
Baseret på farmakokinetiske undersøgelser er dosisjustering af ABILIFY ikke nødvendig, når det administreres samtidig med famotidin, valproat, lithium, lorazepam.
Derudover er dosisjustering ikke nødvendig for substrater af CYP2D6 (f.eks. dextromethorphan, fluoxetin, paroxetin eller venlafaxin), CYP2C9 (f.eks. warfarin), CYP2C19 (f.eks. omeprazol, warfarin, escitalopram) eller CYP3Ax4n når det administreres sammen med ABILIFY. Derudover er dosisjustering ikke nødvendig for valproat, lithium, lamotrigin, lorazepam eller sertralin, når det administreres sammen med ABILIFY [se KLINISK FARMAKOLOGI ].
Stofmisbrug og afhængighed
kontrolleret stof
ABILIFY er ikke et kontrolleret stof.
Misbrug
ABILIFY er ikke blevet systematisk undersøgt hos mennesker for dets potentiale for misbrug, tolerance eller fysisk afhængighed. Patienter bør derfor evalueres omhyggeligt for en historie med stofmisbrug, og sådanne patienter bør observeres nøje for tegn på ABILIFY 20 mg misbrug eller misbrug (f.eks. udvikling af tolerance, stigninger i dosis, stofsøgende adfærd).
Afhængighed
I fysiske afhængighedsundersøgelser hos aber blev abstinenssymptomer observeret ved pludseligt ophør af dosering. Selvom de kliniske forsøg ikke afslørede nogen tendens til nogen lægemiddelsøgende adfærd, var disse observationer ikke systematiske, og det er ikke muligt at forudsige på baggrund af denne begrænsede erfaring, i hvilket omfang et CNS-aktivt lægemiddel vil blive misbrugt, omdirigeret, og/eller misbrugt, når den først er markedsført.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Øget dødelighed hos ældre patienter med demensrelateret psykose
Øget dødelighed
Ældre patienter med demensrelateret psykose behandlet med antipsykotiske lægemidler har en øget risiko for at dø. ABILIFY (aripiprazol) er ikke godkendt til behandling af patienter med demensrelateret psykose [se ADVARSEL INDREMMET].
Sikkerhedserfaring hos ældre patienter med psykose forbundet med Alzheimers sygdom
I tre, 10-ugers, placebokontrollerede undersøgelser af ABILIFY 10mg hos ældre patienter med psykose forbundet med Alzheimers sygdom (n=938; gennemsnitsalder: 82,4 år; interval: 56-99 år), var de bivirkninger, der var rapporteret med en incidens på ≥3 % og ABILIFY 15 mg incidens mindst det dobbelte af den for placebo var sløvhed [placebo 2 %, ABILIFY 5 %], somnolens (inklusive sedation) [placebo 3 %, ABILIFY 8 %] og inkontinens (primært , urininkontinens) [placebo 1 %, ABILIFY 5 %], overdreven salivation [placebo 0 %, ABILIFY 4 %] og svimmelhed [placebo 1 %, ABILIFY 4 %].
Sikkerheden og effekten af ABILIFY 15 mg til behandling af patienter med psykose forbundet med demens er ikke blevet fastlagt. Hvis den ordinerende læge vælger at behandle sådanne patienter med ABILIFY 15 mg, skal du vurdere for forekomsten af synkebesvær eller overdreven somnolens, som kan disponere for utilsigtet skade eller aspiration [se KASSET ADVARSEL ].
Cerebrovaskulære bivirkninger, herunder slagtilfælde
I placebokontrollerede kliniske undersøgelser (to fleksible doser og et studie med fast dosis) af demensrelateret psykose var der en øget forekomst af cerebrovaskulære bivirkninger (f.eks. slagtilfælde, forbigående iskæmisk anfald), inklusive dødsfald, hos ABILIFY-behandlede patienter ( gennemsnitsalder: 84 år; interval: 78-88 år). I undersøgelsen med fast dosis var der et statistisk signifikant dosisresponsforhold for cerebrovaskulære bivirkninger hos patienter behandlet med ABILIFY. ABILIFY er ikke godkendt til behandling af patienter med demensrelateret psykose [se KASSET ADVARSEL ].
Selvmordstanker og -adfærd hos børn, unge og unge voksne
Patienter med svær depressiv lidelse (MDD), både voksne og pædiatriske, kan opleve forværring af deres depression og/eller fremkomsten af selvmordstanker og -adfærd (suicidalitet) eller usædvanlige ændringer i adfærd, uanset om de tager antidepressiv medicin eller ej, og dette risikoen kan fortsætte, indtil der indtræffer betydelig remission. Selvmord er en kendt risiko for depression og visse andre psykiatriske lidelser, og disse lidelser er i sig selv de stærkeste forudsigere for selvmord. Der har imidlertid været en langvarig bekymring for, at antidepressiva kan have en rolle i at inducere forværring af depression og fremkomsten af suicidalitet hos visse patienter i de tidlige faser af behandlingen. Samlede analyser af kortsigtede, placebokontrollerede forsøg med antidepressiva (SSRI'er og andre) viste, at disse lægemidler øger risikoen for selvmordstanker og -adfærd (suicidalitet) hos børn, unge og unge voksne (18-24 år) med MDD og andre psykiatriske lidelser. Korttidsundersøgelser viste ikke en stigning i risikoen for suicidalitet med antidepressiva sammenlignet med placebo hos voksne efter 24 år; der var en reduktion med antidepressiva sammenlignet med placebo hos voksne på 65 år og ældre.
De samlede analyser af placebokontrollerede forsøg med børn og unge med MDD, obsessiv-kompulsiv lidelse (OCD) eller andre psykiatriske lidelser omfattede i alt 24 korttidsforsøg med 9 antidepressive lægemidler hos over 4400 patienter. De samlede analyser af placebokontrollerede forsøg med voksne med MDD eller andre psykiatriske lidelser omfattede i alt 295 korttidsforsøg (median varighed på 2 måneder) med 11 antidepressive lægemidler hos over 77.000 patienter. Der var betydelig variation i risikoen for suicidalitet blandt stoffer, men en tendens til en stigning i de yngre patienter for næsten alle undersøgte stoffer. Der var forskelle i den absolutte risiko for suicidalitet på tværs af de forskellige indikationer, med den højeste forekomst af MDD. Risikoforskellene (lægemiddel vs. placebo) var dog relativt stabile inden for aldersgrupper og på tværs af indikationer. Disse risikoforskelle (lægemiddel-placebo-forskel i antallet af tilfælde af suicidalitet pr. 1000 behandlede patienter) er angivet i tabel 5.
Der forekom ingen selvmord i nogen af de pædiatriske forsøg. Der var selvmord i voksenforsøgene, men antallet var ikke tilstrækkeligt til at nå frem til nogen konklusion om lægemiddeleffekt på selvmord.
Det er uvist, om suicidalitetsrisikoen strækker sig til længerevarende brug, dvs. ud over flere måneder. Der er dog væsentlige beviser fra placebokontrollerede vedligeholdelsesforsøg hos voksne med depression, at brugen af antidepressiva kan forsinke tilbagefald af depression.
Alle patienter, der behandles med antidepressiva for enhver indikation, bør overvåges passende og observeres nøje for klinisk forværring, suicidalitet og usædvanlige ændringer i adfærd, især i løbet af de første par måneder af et lægemiddelbehandlingsforløb, eller i tidspunkter med dosisændringer, enten stigninger eller falder.
Følgende symptomer, angst, agitation, panikanfald, søvnløshed, irritabilitet, fjendtlighed, aggressivitet, impulsivitet, akatisi (psykomotorisk rastløshed), hypomani og mani, er blevet rapporteret hos voksne og pædiatriske patienter, der behandles med antidepressiva for MDD samt for andre indikationer, både psykiatriske og ikke-psykiatriske. Selvom der ikke er etableret en årsagssammenhæng mellem fremkomsten af sådanne symptomer og enten forværring af depression og/eller fremkomsten af selvmordsimpulser, er der bekymring for, at sådanne symptomer kan repræsentere forløbere for ny suicidalitet.
Det bør overvejes at ændre det terapeutiske regime, herunder eventuelt seponering af medicinen, hos patienter, hvis depression er vedvarende værre, eller som oplever ny suicidalitet eller symptomer, der kan være forløbere for forværring af depression eller suicidalitet, især hvis disse symptomer er alvorlige, pludselige i debut, eller var ikke en del af patientens fremviste symptomer.
Familier og pårørende til patienter, der behandles med antidepressiva for svær depressiv lidelse eller andre indikationer, både psykiatriske og ikke-psykiatriske, bør advares om behovet for at overvåge patienter for fremkomsten af agitation, irritabilitet, usædvanlige ændringer i adfærd og de andre symptomer beskrevet ovenfor. , samt fremkomsten af suicidalitet, og at rapportere sådanne symptomer straks til sundhedsudbydere. Sådan overvågning bør omfatte daglig observation af familier og omsorgspersoner. Recepter til ABILIFY bør udskrives for den mindste mængde tabletter i overensstemmelse med god patientbehandling for at reducere risikoen for overdosering.
Screening af patienter for bipolar lidelse
En alvorlig depressiv episode kan være den første præsentation af bipolar lidelse. Det antages generelt (dog ikke etableret i kontrollerede forsøg), at behandling af en sådan episode med et antidepressivum alene kan øge sandsynligheden for udfældning af en blandet/manisk episode hos patienter med risiko for bipolar lidelse. Hvorvidt nogen af de ovenfor beskrevne symptomer repræsenterer en sådan omdannelse er ukendt. Inden behandling med et antidepressivum påbegyndes, bør patienter med depressive symptomer dog screenes tilstrækkeligt for at afgøre, om de har risiko for bipolar lidelse; sådan screening bør omfatte en detaljeret psykiatrisk historie, herunder en familiehistorie med selvmord, bipolar lidelse og depression.
Det skal bemærkes, at ABILIFY 20mg ikke er godkendt til brug til behandling af depression hos den pædiatriske befolkning.
Malignt neuroleptikasyndrom (NMS)
Et potentielt dødeligt symptomkompleks, som nogle gange omtales som malignt neuroleptikasyndrom (NMS) kan forekomme ved administration af antipsykotiske lægemidler, herunder ABILIFY. sjældne tilfælde af NMS forekom under ABILIFY 15 mg behandling i den verdensomspændende kliniske database. Kliniske manifestationer af NMS er hyperpyreksi, muskelstivhed, ændret mental status og tegn på autonom ustabilitet (uregelmæssig puls eller blodtryk, takykardi, diaforese og hjerterytmeforstyrrelser). Yderligere tegn kan omfatte forhøjet kreatinfosfokinase, myoglobinuri (rhabdomyolyse) og akut nyresvigt.
Den diagnostiske evaluering af patienter med dette syndrom er kompliceret. For at nå frem til en diagnose er det vigtigt at udelukke tilfælde, hvor den kliniske præsentation omfatter både alvorlig medicinsk sygdom (f.eks. lungebetændelse, systemisk infektion) og ubehandlede eller utilstrækkeligt behandlede ekstrapyramidale tegn og symptomer (EPS). Andre vigtige overvejelser i differentialdiagnosen omfatter central antikolinerg toksicitet, hedeslag, lægemiddelfeber og primær patologi i centralnervesystemet.
Behandlingen af NMS bør omfatte: 1) øjeblikkelig seponering af antipsykotiske lægemidler og andre lægemidler, der ikke er nødvendige for samtidig behandling; 2) intensiv symptomatisk behandling og medicinsk overvågning; og 3) behandling af eventuelle samtidige alvorlige medicinske problemer, for hvilke specifikke behandlinger er tilgængelige. Der er ingen generel enighed om specifikke farmakologiske behandlingsregimer for ukompliceret NMS.
Hvis en patient har behov for antipsykotisk lægemiddelbehandling efter bedring fra NMS, bør den potentielle genindførelse af lægemiddelbehandling overvejes nøje. Patienten bør overvåges omhyggeligt, da tilbagefald af NMS er blevet rapporteret.
Tardiv dyskinesi
Et syndrom med potentielt irreversible, ufrivillige, dyskinetiske bevægelser kan udvikle sig hos patienter, der behandles med antipsykotiske lægemidler. Selvom prævalensen af syndromet ser ud til at være højest blandt ældre, især ældre kvinder, er det umuligt at stole på prævalensestimater til at forudsige, ved begyndelsen af antipsykotisk behandling, hvilke patienter der sandsynligvis vil udvikle syndromet. Hvorvidt antipsykotiske lægemidler er forskellige i deres potentiale til at forårsage tardiv dyskinesi er ukendt.
Risikoen for at udvikle tardiv dyskinesi og sandsynligheden for, at den bliver irreversibel, menes at stige, efterhånden som behandlingens varighed og den samlede kumulative dosis af antipsykotiske lægemidler administreret til patienten stiger. Syndromet kan dog udvikle sig, selv om det er meget sjældnere, efter relativt korte behandlingsperioder ved lave doser.
Tardiv dyskinesi kan forsvinde, delvist eller fuldstændigt, hvis antipsykotisk behandling seponeres. Antipsykotisk behandling kan imidlertid i sig selv undertrykke (eller delvist undertrykke) tegn og symptomer på syndromet og kan derved muligvis maskere den underliggende proces. Den effekt, som symptomatisk suppression har på det langsigtede forløb af syndromet, er ukendt.
betragtning af disse overvejelser bør ABILIFY ordineres på en måde, der med størst sandsynlighed minimerer forekomsten af tardiv dyskinesi. Kronisk antipsykotisk behandling bør generelt være forbeholdt patienter, der lider af en kronisk sygdom, som (1) vides at reagere på antipsykotiske lægemidler, og (2) for hvem alternative, lige så effektive, men potentielt mindre skadelige behandlinger ikke er tilgængelige eller passende. Hos patienter, som har behov for kronisk behandling, bør den mindste dosis og den korteste behandlingsvarighed, der giver et tilfredsstillende klinisk respons, søges. Behovet for fortsat behandling bør revurderes med jævne mellemrum.
Hvis der opstår tegn og symptomer på tardiv dyskinesi hos en patient på ABILIFY, bør seponering af lægemidlet overvejes. Nogle patienter kan dog have behov for behandling med ABILIFY 15 mg på trods af tilstedeværelsen af syndromet.
Metaboliske ændringer
Atypiske antipsykotiske lægemidler er blevet forbundet med metaboliske ændringer, der omfatter hyperglykæmi/diabetes mellitus, dyslipidæmi og vægtøgning. Mens alle lægemidler i klassen har vist sig at producere nogle metaboliske ændringer, har hvert lægemiddel sin egen specifikke risikoprofil.
Hyperglykæmi/diabetes mellitus
Hyperglykæmi, i nogle tilfælde ekstrem og forbundet med ketoacidose eller hyperosmolær koma eller død, er blevet rapporteret hos patienter behandlet med atypiske antipsykotika. Der har været rapporter om hyperglykæmi hos patienter behandlet med ABILIFY [se BIVIRKNINGER ]. Vurdering af sammenhængen mellem atypisk brug af antipsykotiske midler og glukoseabnormiteter kompliceres af muligheden for en øget baggrundsrisiko for diabetes mellitus hos patienter med skizofreni og den stigende forekomst af diabetes mellitus i den generelle befolkning. I betragtning af disse konfounders er forholdet mellem atypisk antipsykotisk brug og hyperglykæmi-relaterede bivirkninger ikke fuldstændigt forstået. Epidemiologiske undersøgelser tyder dog på en øget risiko for hyperglykæmi-relaterede bivirkninger hos patienter behandlet med de atypiske antipsykotika. Da ABILIFY ikke blev markedsført på det tidspunkt, hvor disse undersøgelser blev udført, vides det ikke, om ABILIFY er forbundet med denne øgede risiko. Præcise risikoestimater for hyperglykæmi-relaterede bivirkninger hos patienter behandlet med atypiske antipsykotika er ikke tilgængelige.
Patienter med en etableret diagnose af diabetes mellitus, som er startet på atypiske antipsykotika, bør monitoreres regelmæssigt for forværring af glukosekontrol. Patienter med risikofaktorer for diabetes mellitus (f.eks. fedme, familiehistorie med diabetes), som starter behandling med atypiske antipsykotika, bør gennemgå fastende blodsukkermåling i begyndelsen af behandlingen og periodisk under behandlingen. Enhver patient, der behandles med atypiske antipsykotika, bør overvåges for symptomer på hyperglykæmi, herunder polydipsi, polyuri, polyfagi og svaghed. Patienter, som udvikler symptomer på hyperglykæmi under behandling med atypiske antipsykotika, bør gennemgå fastende blodsukkermåling. I nogle tilfælde er hyperglykæmi forsvundet, når det atypiske antipsykotikum blev seponeret; dog krævede nogle patienter fortsættelse af antidiabetisk behandling på trods af seponering af det mistænkte lægemiddel.
Voksne
en analyse af 13 placebokontrollerede monoterapiforsøg hos voksne, primært med skizofreni eller bipolar lidelse, var den gennemsnitlige ændring i fastende glukose hos ABILIFY-behandlede patienter (+4,4 mg/dL; median eksponering 25 dage; N=1057) ikke signifikant anderledes end hos placebobehandlede patienter (+2,5 mg/dL; median eksponering 22 dage; N=799). Tabel 6 viser andelen af ABILIFY-behandlede patienter med normal og borderline fastende glukose ved baseline (median eksponering 25 dage), som havde behandlingsfremkomne høje fastende glukosemålinger sammenlignet med placebo-behandlede patienter (median eksponering 22 dage).
Efter 24 uger var den gennemsnitlige ændring i fastende glukose hos ABILIFY-behandlede patienter ikke signifikant anderledes end hos placebo-behandlede patienter [henholdsvis +2,2 mg/dL (n=42) og +9,6 mg/dL (n=28)] .
Den gennemsnitlige ændring i fastende glukose hos supplerende ABILIFY-behandlede patienter med svær depressiv lidelse (+0,7 mg/dL; median eksponering 42 dage; N=241) var ikke signifikant anderledes end hos placebo-behandlede patienter (+0,8 mg/dL; median eksponering 42 dage; N=246). Tabel 7 viser andelen af voksne patienter med ændringer i fastende glukoseniveauer fra to placebokontrollerede, supplerende forsøg (median eksponering 42 dage) hos patienter med svær depressiv lidelse.
Pædiatriske patienter og unge
I en analyse af to placebokontrollerede forsøg med unge med skizofreni (13 til 17 år) og pædiatriske patienter med bipolar lidelse (10 til 17 år) viste den gennemsnitlige ændring i fastende glukose hos ABILIFY-behandlede patienter (+4,8 mg/dL; med en median eksponering på 43 dage; N=259) var ikke signifikant anderledes end hos placebobehandlede patienter (+1,7 mg/dL; med en median eksponering på 42 dage; N=123).
en analyse af to placebo-kontrollerede forsøg med pædiatriske og unge patienter med irritabilitet forbundet med autistisk lidelse (6 til 17 år) med median eksponering på 56 dage, viste den gennemsnitlige ændring i fastende glukose hos ABILIFY-behandlede patienter (-0,2 mg) /dL; N=83) var ikke signifikant anderledes end hos placebobehandlede patienter (–0,6 mg/dL; N=33).
I en analyse af to placebokontrollerede forsøg med pædiatriske og unge patienter med Tourettes lidelse (6 til 18 år) med median eksponering på 57 dage, viste den gennemsnitlige ændring i fastende glukose hos ABILIFY-behandlede patienter (0,79 mg/dL; N=90) var ikke signifikant anderledes end hos placebobehandlede patienter (–1,66 mg/dL; N=58).
Tabel 8 viser andelen af patienter med ændringer i fastende glukoseniveauer fra de poolede unge skizofreni og pædiatriske bipolare patienter (median eksponering på 42-43 dage) fra to placebokontrollerede forsøg med pædiatriske patienter (6 til 17 år) med irritabilitet forbundet med autistisk lidelse (median eksponering på 56 dage) og fra de to placebokontrollerede forsøg med pædiatriske patienter (6 til 18 år) med Tourettes lidelse (median eksponering 57 dage).
Efter 12 uger i de samlede studier med skizofreni og pædiatriske bipolar lidelse var den gennemsnitlige ændring i fastende glukose hos ABILIFY-behandlede patienter ikke signifikant anderledes end hos placebobehandlede patienter [+2,4 mg/dL (n=81) og +0,1 mg /dL (n=15) henholdsvis].
Dyslipidæmi
Uønskede ændringer i lipider er blevet observeret hos patienter behandlet med atypiske antipsykotika.
Der var ingen signifikante forskelle mellem ABILIFY- og placebobehandlede patienter i andelen med ændringer fra normale til klinisk signifikante niveauer for fastende/ikke-fastende totalkolesterol, fastende triglycerider, fastende LDL'er og fastende/ikke-fastende HDL'er. Analyser af patienter med mindst 12 eller 24 ugers eksponering var begrænset af et lille antal patienter.
Voksne
Tabel 9 viser andelen af voksne patienter, primært fra poolet skizofreni og bipolar lidelse monoterapi placebo-kontrollerede forsøg, med ændringer i totalt kolesterol (poolet fra 17 forsøg; median eksponering 21 til 25 dage), fastende triglycerider (poolet fra otte forsøg; median eksponering 42 dage), fastende LDL-kolesterol (samlet fra otte forsøg; medianeksponering 39 til 45 dage, bortset fra placebo-behandlede patienter med normale fastende LDL-målinger, som havde median behandlingseksponering på 24 dage) og HDL-kolesterol (sammenlagt fra ni forsøg; median eksponering 40 til 42 dage).
monoterapiforsøg hos voksne var andelen af patienter efter 12 uger og 24 uger med ændringer fra Normal til Høj i total kolesterol (fastende/ikke-fastende), fastende triglycerider og fastende LDL-kolesterol ens for ABILIFY- og placebobehandlede patienter: kl. 12 uger, totalt kolesterol (fastende/ikke-fastende), 1/71 (1,4%) vs. 3/74 (4,1%); Fastende triglycerider, 8/62 (12,9%) vs. 5/37 (13,5%); Fastende LDL-kolesterol, henholdsvis 0/34 (0%) vs. 1/25 (4,0%); og ved 24 uger, Total Cholesterol (fastende/ikke-fastende), 1/42 (2,4%) vs. 3/37 (8,1%); Fastende triglycerider, 5/34 (14,7%) vs. 5/20 (25%); Fastende LDL-kolesterol, henholdsvis 0/22 (0%) vs. 1/18 (5,6%).
Tabel 10 viser andelen af patienter med ændringer i totalt kolesterol (fastende/ikke-fastende), fastende triglycerider, fastende LDL-kolesterol og HDL-kolesterol fra to placebokontrollerede supplerende forsøg hos voksne patienter med svær depressiv lidelse (median eksponering 42 dage).
Pædiatriske patienter og unge
Tabel 11 viser andelen af unge med skizofreni (13 til 17 år) og pædiatriske patienter med bipolar lidelse (10 til 17 år) med ændringer i totalt kolesterol og HDL-kolesterol (poolet fra to placebokontrollerede forsøg; median eksponering 42 til 43 dage ) og fastende triglycerider (poolet fra to placebokontrollerede forsøg; median eksponering 42 til 44 dage).
monoterapiforsøg med unge med skizofreni og pædiatriske patienter med bipolar lidelse var andelen af patienter efter 12 uger og 24 uger med ændringer fra normal til høj i total kolesterol (fastende/ikke-fastende), fastende triglycerider og fastende LDL-kolesterol ens mellem ABILIFY - og placebo-behandlede patienter: ved 12 uger, Total Cholesterol (fastende/ikke-fastende), 0/57 Â (0%) vs. 0/15 (0%); Fastende triglycerider, henholdsvis 2/72 (2,8%) vs. 1/14 (7,1%); og ved 24 uger, Total Cholesterol (fastende/ikke-fastende), 0/36 (0%) vs. 0/12 (0%); Fastende triglycerider, henholdsvis 1/47 (2,1%) vs. 1/10 (10,0%).
Tabel 12 viser andelen af patienter med ændringer i total kolesterol (fastende/ikke-fastende) og fastende triglycerider (median eksponering 56 dage) og HDL kolesterol (median eksponering 55 til 56 dage) fra to placebokontrollerede forsøg med pædiatriske patienter (6 til 17 dage). år) med irritabilitet forbundet med autistisk lidelse.
Tabel 13 viser andelen af patienter med ændringer i total kolesterol (fastende/ikke-fastende) og fastende triglycerider (median eksponering 57 dage) og HDL kolesterol (median eksponering 57 dage) fra to placebokontrollerede forsøg med pædiatriske patienter (6 til 18 år) med Tourettes lidelse.
Vægtøgning
Vægtøgning er blevet observeret ved atypisk antipsykotisk brug. Klinisk overvågning af vægt anbefales.
Voksne
I en analyse af 13 placebokontrollerede monoterapiforsøg, primært fra poolet skizofreni og bipolar lidelse, med en median eksponering på 21 til 25 dage, var den gennemsnitlige ændring i kropsvægt hos ABILIFY-behandlede patienter +0,3 kg (N=1673) sammenlignet med til –0,1 kg (N=1100) hos placebokontrollerede patienter. Efter 24 uger var den gennemsnitlige ændring fra baseline i kropsvægt hos ABILIFY-behandlede patienter –1,5 kg (n=73) sammenlignet med –0,2 kg (n=46) hos placebobehandlede patienter.
forsøgene med tilføjelse af ABILIFY til antidepressiva fik patienterne først 8 ugers antidepressiv behandling efterfulgt af 6 ugers supplerende ABILIFY 10 mg eller placebo ud over deres igangværende antidepressive behandling. Den gennemsnitlige ændring i kropsvægt hos patienter, der fik supplerende ABILIFY, var +1,7 kg (N=347) sammenlignet med +0,4 kg (N=330) hos patienter, der fik supplerende placebo.
Tabel 14 viser procentdelen af voksne patienter med vægtøgning ≥7 % af kropsvægten efter indikation.
Pædiatriske patienter og unge
I en analyse af to placebo-kontrollerede forsøg med unge med skizofreni (13 til 17 år) og pædiatriske patienter med bipolar lidelse (10 til 17 år) med median eksponering på 42 til 43 dage, viste den gennemsnitlige ændring i kropsvægt hos ABILIFY-behandlede patienter var +1,6 kg (N=381) sammenlignet med +0,3 kg (N=187) hos placebobehandlede patienter. Ved 24 uger var den gennemsnitlige ændring fra baseline i kropsvægt til
ABILIFY-behandlede patienter var +5,8 kg (n=62) sammenlignet med +1,4 kg (n=13) hos placebobehandlede patienter.
to kortvarige, placebo-kontrollerede forsøg med patienter (6 til 17 år) med irritabilitet forbundet med autistisk lidelse med median eksponering på 56 dage, var den gennemsnitlige ændring i kropsvægt hos ABILIFY-behandlede patienter +1,6 kg (n=209) ) sammenlignet med +0,4 kg (n=98) hos placebobehandlede patienter.
I to kortvarige, placebokontrollerede forsøg med patienter (6 til 18 år) med Tourettes lidelse med median eksponering på 57 dage, var den gennemsnitlige ændring i kropsvægt hos ABILIFY-behandlede patienter +1,5 kg (n=105) ) sammenlignet med +0,4 kg (n=66) hos placebobehandlede patienter.
Tabel 15 viser procentdelen af pædiatriske og unge patienter med vægtøgning ≥7 % af kropsvægten efter indikation.
et åbent forsøg, der inkluderede patienter fra de to placebokontrollerede forsøg med unge med skizofreni (13 til 17 år) og pædiatriske patienter med bipolar lidelse (10 til 17 år), gennemførte 73,2 % af patienterne (238/325) 26 ugers terapi med ABILIFY. Efter 26 uger tog 32,8 % af patienterne på ≥7 % af deres kropsvægt, ikke justeret for normal vækst. For at justere for normal vækst blev der udledt z-scores (målt i standardafvigelser [SD]), som normaliserer den naturlige vækst hos pædiatriske patienter og unge ved sammenligninger med alders- og kønsmatchede befolkningsstandarder. En z-score-ændring
et åbent forsøg, der inkluderede patienter fra to kortvarige, placebo-kontrollerede forsøg, patienter (6 til 17 år) med irritabilitet forbundet med autistisk lidelse, såvel som de novo patienter, gennemførte 60,3 % (199/330) en års terapi med ABILIFY. Den gennemsnitlige ændring i vægt z-score var 0,26 SD'er for patienter, der fik >9 måneders behandling.
Ved behandling af pædiatriske patienter for enhver indikation bør vægtøgning overvåges og vurderes i forhold til det forventede for normal vækst.
Patologisk hasardspil og anden kompulsiv adfærd
Caserapporter efter markedsføring tyder på, at patienter kan opleve intense drifter, især til gambling, og manglende evne til at kontrollere disse drifter, mens de tager aripiprazol. Andre kompulsive drifter, rapporteret mindre hyppigt, omfatter: seksuelle drifter, shopping, spisning eller overspisning og anden impulsiv eller tvangsmæssig adfærd. Fordi patienter måske ikke genkender denne adfærd som unormal, er det vigtigt for ordinerende læger at spørge patienterne eller deres pårørende specifikt om udviklingen af nye eller intense spilletrang, tvangsmæssige seksuelle trang, tvangsindkøb, binge eller tvangsspisning eller andre trang, mens de behandles med aripiprazol. Det skal bemærkes, at impulskontrolsymptomer kan være forbundet med den underliggende lidelse. I nogle tilfælde, men ikke alle, blev trangene rapporteret at være ophørt, når dosis blev reduceret, eller medicinen blev seponeret. Kompulsiv adfærd kan medføre skade på patienten og andre, hvis den ikke genkendes. Overvej dosisreduktion eller stop med medicinen, hvis en patient udvikler sådanne trang.
Ortostatisk hypotension
ABILIFY 20mg kan forårsage ortostatisk hypotension, måske på grund af dets α1-adrenerge receptorantagonisme. Hyppigheden af ortostatisk hypotension-associerede hændelser fra kortvarige, placebokontrollerede forsøg med voksne patienter på oral ABILIFY (n=2467) inkluderede (ABILIFY 20 mg forekomst, placeboforekomst) ortostatisk hypotension (1 %, 0,3 %), postural svimmelhed ( 0,5%, 0,3%) og synkope (0,5%, 0,4%); af pædiatriske patienter i alderen 6 til 18 år (n=732) på oral ABILIFY inkluderede ortostatisk hypotension (0,5%, 0%), postural svimmelhed (0,4%, 0%) og synkope (0,2%, 0%); og af patienter på ABILIFY-injektion (n=501) inkluderede ortostatisk hypotension (0,6 %, 0 %), postural svimmelhed (0,2 %, 0,5 %) og synkope (0,4 %, 0 %) [se BIVIRKNINGER ].
Hyppigheden af en signifikant ortostatisk ændring i blodtryk (defineret som et fald i systolisk blodtryk ≥20 mmHg ledsaget af en stigning i hjertefrekvens ≥25 slag/min ved sammenligning af stående og liggende værdier) for ABILIFY var ikke væsentligt forskellig fra placebo (ABILIFY forekomst , placeboforekomst): hos voksne orale ABILIFY-behandlede patienter (4 %, 2 %), hos pædiatriske orale
ABILIFY-behandlede patienter i alderen 6 til 18 år (0,4 %, 1 %) eller hos ABILIFY 15 mg injektionsbehandlede patienter (3 %, 2 %).
ABILIFY 20mg bør anvendes med forsigtighed til patienter med kendt kardiovaskulær sygdom (historie med myokardieinfarkt eller iskæmisk hjertesygdom, hjertesvigt eller ledningsabnormiteter), cerebrovaskulær sygdom eller tilstande, der kan disponere patienter for hypotension (dehydrering, hypovolæmi og behandling med antihypertensiva) medicin) [se DRUGSINTERAKTIONER ].
Hvis parenteral benzodiazepinbehandling anses for nødvendig ud over ABILIFY injektionsbehandling, bør patienter monitoreres for overdreven sedation og for ortostatisk hypotension [se DRUGSINTERAKTIONER ].
Falls
Antipsykotika, inklusive ABILIFY 10mg, kan forårsage døsighed, postural hypotension, motorisk og sensorisk ustabilitet, hvilket kan føre til fald og som følge heraf brud eller andre skader. For patienter med sygdomme, tilstande eller medicin, der kan forværre disse virkninger, udfør faldrisikovurderinger ved påbegyndelse af antipsykotisk behandling og tilbagevendende for patienter i langvarig antipsykotisk behandling.
Leukopeni, Neutropeni og Agranulocytose
I kliniske forsøg og/eller erfaring efter markedsføring er hændelser af leukopeni og neutropeni blevet rapporteret, der er tidsmæssigt relateret til antipsykotiske midler, inklusive ABILIFY. Agranulocytose er også blevet rapporteret.
Mulige risikofaktorer for leukopeni/neutropeni omfatter allerede eksisterende lavt antal hvide blodlegemer (WBC)/absolut neutrofiltal (ANC) og historie med lægemiddelinduceret leukopeni/neutropeni. Hos patienter med en anamnese med en klinisk signifikant lav WBC/ANC eller lægemiddelinduceret leukopeni/neutropeni, udfør en fuldstændig blodtælling (CBC) hyppigt i løbet af de første par måneder af behandlingen. Hos sådanne patienter bør seponering af ABILIFY overvejes ved det første tegn på et klinisk signifikant fald i WBC i fravær af andre årsagsfaktorer.
Overvåg patienter med klinisk signifikant neutropeni for feber eller andre symptomer eller tegn på infektion, og behandl omgående, hvis sådanne symptomer eller tegn opstår. Afbryd ABILIFY 20mg hos patienter med svær neutropeni (absolut neutrofiltal
Anfald/kramper
kortvarige, placebo-kontrollerede forsøg forekom patienter med en historie med anfald udelukket anfald/kramper hos 0,1 % (3/2467) af udiagnosticerede voksne patienter behandlet med oral ABILIFY 20 mg, hos 0,1 % (1/732) af pædiatriske patienter. (6 til 18 år) og hos 0,2 % (1/501) af voksne ABILIFY 15 mg injektionsbehandlede patienter.
Som med andre antipsykotiske lægemidler bør ABILIFY 15mg anvendes med forsigtighed til patienter med tidligere anfald eller med tilstande, der sænker krampetærsklen. Tilstande, der sænker anfaldstærsklen, kan være mere udbredt i en befolkning på 65 år eller ældre.
Potentiale for kognitiv og motorisk svækkelse
ABILIFY kan ligesom andre antipsykotika have potentiale til at svække dømmekraft, tænkning eller motorik. I kortvarige, placebo-kontrollerede forsøg blev somnolens (inklusive sedation) f.eks. rapporteret som følger (ABILIFY-incidens, placebo-incidens): hos voksne patienter (n=2467) behandlet med oral ABILIFY (11%, 6%), hos pædiatriske patienter i alderen 6 til 17 (n=611) (24%, 6%) og hos voksne patienter (n=501) på ABILIFY-injektion (9%, 6%). Somnolens (inklusive sedation) førte til seponering hos 0,3 % (8/2467) af voksne patienter og 3 % (20/732) af pædiatriske patienter (6 til 18 år) på oral ABILIFY 10 mg i kortvarige, placebokontrollerede forsøg, men førte ikke til seponering af nogen voksne patienter på ABILIFY-injektion.
På trods af den relativt beskedne øgede forekomst af disse hændelser sammenlignet med placebo, bør patienterne advares om at betjene farlige maskiner, inklusive biler, indtil de er rimeligt sikre på, at behandling med ABILIFY 15 mg ikke påvirker dem negativt.
Kropstemperaturregulering
Forstyrrelse af kroppens evne til at reducere kropstemperaturen er blevet tilskrevet antipsykotiske midler. Passende pleje tilrådes ved ordinering af ABILIFY 10 mg til patienter, som vil opleve tilstande, der kan bidrage til en stigning i kernekropstemperaturen (f.eks. motionering, udsættelse for ekstrem varme, samtidig medicinering med antikolinerg aktivitet eller udsat for dehydrering) [se BIVIRKNINGER ].
Selvmord
Muligheden for et selvmordsforsøg er iboende i psykotiske sygdomme, bipolar lidelse og svær depressiv lidelse, og tæt overvågning af højrisikopatienter bør ledsage lægemiddelbehandling. Recepter til ABILIFY bør udskrives for den mindste mængde i overensstemmelse med god patientbehandling for at reducere risikoen for overdosering [se BIVIRKNINGER ].
Dysfagi
Esophageal dysmotilitet og aspiration er blevet forbundet med brug af antipsykotiske lægemidler, herunder ABILIFY. Aspirationspneumoni er en almindelig årsag til morbiditet og dødelighed hos ældre patienter, især dem med fremskreden Alzheimers demens. ABILIFY og andre antipsykotiske lægemidler bør anvendes med forsigtighed til patienter med risiko for aspirationspneumoni [se Øget dødelighed hos ældre patienter med demensrelateret psykose  og BIVIRKNINGER ].
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( Medicinvejledning ).
Diskuter følgende problemer med patienter ordineret ABILIFY:
Klinisk forværring af depression og selvmordsrisiko
Patienter, deres familier og deres pårørende bør opmuntres til at være opmærksomme på fremkomsten af angst, agitation, panikanfald, søvnløshed, irritabilitet, fjendtlighed, aggressivitet, impulsivitet, akatisi (psykomotorisk rastløshed), hypomani, mani, andre usædvanlige ændringer i adfærd. , forværring af depression og selvmordstanker, især tidligt under antidepressiv behandling, og når dosis justeres op eller ned. Familier og pårørende til patienter bør rådes til at se efter forekomsten af sådanne symptomer på daglig basis, da ændringer kan være pludselige. Sådanne symptomer bør indberettes til patientens ordinerende læge eller sundhedspersonale, især hvis de er alvorlige, pludseligt opstået eller ikke var en del af patientens symptomer. Symptomer som disse kan være forbundet med en øget risiko for selvmordstanker og -adfærd og indikerer behov for meget tæt overvågning og muligvis ændringer i medicinen [se ADVARSLER OG FORHOLDSREGLER ].
Ordinerende læger eller andre sundhedsprofessionelle bør informere patienter, deres familier og deres pårørende om fordele og risici forbundet med behandling med ABILIFY og bør rådgive dem om dens passende brug. En patientmedicineringsvejledning med information om "Antidepressiv medicin, depression og anden alvorlig psykisk sygdom og selvmordstanker eller -handlinger" er tilgængelig for ABILIFY. Den ordinerende læge eller sundhedspersonalet bør instruere patienter, deres familier og deres pårørende i at læse medicinvejledningen og skal hjælpe dem med at forstå dens indhold. Patienterne skal have mulighed for at diskutere indholdet af medicinvejledningen og få svar på de spørgsmål, de måtte have. Det skal bemærkes, at ABILIFY ikke er godkendt som et enkelt middel til behandling af depression og ikke er blevet evalueret i pædiatrisk svær depressiv lidelse.
Patologisk hasardspil og anden kompulsiv adfærd
Informer patienter og deres pårørende om muligheden for, at de kan opleve tvangstanker til at shoppe, intens trang til at spille, tvangsmæssig seksuel trang, overspisning og/eller andre tvangsmæssige trang og manglende evne til at kontrollere disse trang, mens de tager aripiprazol. I nogle tilfælde, men ikke alle, blev trangene rapporteret at være ophørt, når dosis blev reduceret eller stoppet [se ADVARSLER OG FORHOLDSREGLER ].
Brug af oralt desintegrerende tablet
Åbn ikke blisterpakningen, før den er klar til indgivelse. For fjernelse af en enkelt tablet skal du åbne pakken og fjerne folien på blisterpakningen for at blotlægge tabletten. Skub ikke tabletten gennem folien, da dette kan beskadige tabletten. Umiddelbart efter åbning af blisterpakningen skal du med tørre hænder fjerne tabletten og placere hele ABILIFY DISCMELT oral disintegrating tablet på tungen. Tabletternes opløsning sker hurtigt i spyt. Det anbefales, at ABILIFY DISCMELT tages uden væske. Men hvis det er nødvendigt, kan det tages med væske. Forsøg ikke at opdele tabletten.
Interferens med kognitiv og motorisk ydeevne
Fordi ABILIFY kan have potentiale til at svække dømmekraft, tænkning eller motoriske færdigheder, bør patienter advares om at betjene farlige maskiner, inklusive biler, indtil de er rimeligt sikre på, at ABILIFY-terapi ikke påvirker dem negativt [se ADVARSLER OG FORHOLDSREGLER ].
Samtidig medicinering
Patienter bør rådes til at informere deres læger, hvis de tager eller planlægger at tage receptpligtig eller håndkøbsmedicin, da der er mulighed for interaktioner [se DRUGSINTERAKTIONER ].
Varmeeksponering og dehydrering
Patienter bør rådgives om passende pleje for at undgå overophedning og dehydrering [se ADVARSLER OG FORHOLDSREGLER ].
Sukkerindhold
Patienterne skal informeres om, at hver ml ABILIFY 10 mg oral opløsning indeholder 400 mg saccharose og 200 mg fruktose.
Graviditet
Rådgive patienter om at underrette deres læge, hvis de bliver gravide eller har til hensigt at blive gravide under behandling med ABILIFY. Rådgiv patienterne om, at ABILIFY 20 mg kan forårsage ekstrapyramidale og/eller abstinenssymptomer (agitation, hypertoni, hypotoni, tremor, somnolens, åndedrætsbesvær og spiseforstyrrelser) hos en nyfødt. Rådgiv patienterne om, at der er et graviditetsregister, der overvåger graviditetsresultater hos kvinder, der er udsat for ABILIFY 15 mg under graviditeten [se Brug i specifikke populationer ].
Fenylketonurik
Phenylalanin er en komponent i aspartam. Hver ABILIFY DISCMELT oral disintegrerende tablet indeholder følgende mængder: 10 mg, 1,12 mg phenylalanin og 15 mg, 1,68 mg phenylalanin.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
Livstidscarcinogenicitetsundersøgelser blev udført i ICR-mus, F344-rotter og Sprague-Dawley (SD)-rotter. Aripiprazol blev administreret i 2 år i kosten i doser på 1, 3, 10 og 30 mg/kg/dag til ICR-mus og 1, 3 og 10 mg/kg/dag til F344-rotter (0,2, 0,5, 2 og 5 gange og henholdsvis 0,3, 1 og 3 gange MRHD på 30 mg/dag baseret på mg/m² kropsoverfladeareal). Derudover blev SD-rotter doseret oralt i 2 år med 10, 20, 40 og 60 mg/kg/dag, hvilket er 3, 6, 13 og 19 gange MRHD baseret på mg/m² kropsoverfladeareal. Aripiprazol inducerede ikke tumorer hos hanmus eller hanrotter. Hos hunmus var forekomsten af hypofyseadenomer og mælkekirteladenocarcinomer og adenoacanthomer øget ved diætdoser på 3 til 30 mg/kg/dag (0,5 til 5 gange MRHD). Hos hunrotter var forekomsten af brystkirtelfibroadenomer øget ved en kostdosis på 10 mg/kg/dag (3 gange MRHD); og forekomsten af binyrebarkcarcinomer og kombinerede binyrebarkadenomer/carcinomer blev øget ved en oral dosis på 60 mg/kg/dag (19 gange MRHD).
En stigning i bryst-, hypofyse- og endokrine pancreas-neoplasmer er blevet fundet hos gnavere efter kronisk administration af andre antipsykotiske lægemidler og anses for at være medieret af forlænget dopamin D2-receptorantagonisme og hyperprolaktinæmi. Serumprolaktin blev ikke målt i aripiprazol-karcinogenicitetsundersøgelserne. Imidlertid blev stigninger i serumprolaktinniveauer observeret hos hunmus i et 13-ugers diætstudie ved de doser, der er forbundet med mælkekirtel- og hypofysetumorer. Serumprolaktin var ikke øget hos hunrotter i 4-ugers og 13-ugers diætundersøgelser ved den dosis, der er forbundet med brystkirteltumorer. Relevansen for human risiko af fund af prolaktin-medierede endokrine tumorer hos gnavere er uklar.
Mutagenese
Det mutagene potentiale af aripiprazol blev testet i in vitro bakteriel revers-mutation assay, in vitro bakteriel DNA reparation assay, in vitro forward gen mutation assay i muse lymfom celler, in vitro kromosomafvigelse assay i kinesisk hamster lunge (CHL) celler, in vivo mikronukleusassayet i mus og det ikke-planlagte DNA-synteseassay i rotter. Aripiprazol og en metabolit (2,3-DCPP) var klastogene i in vitro kromosomafvigelsesassayet i CHL-celler med og uden metabolisk aktivering. Metabolitten, 2,3DCPP, øgede numeriske aberrationer i in vitro-assayet i CHL-celler i fravær af metabolisk aktivering. Et positivt respons blev opnået i in vivo mikronukleusassayet i mus; responsen skyldtes imidlertid en mekanisme, der ikke blev anset for at være relevant for mennesker.
Forringelse af fertilitet
Hunrotter blev behandlet oralt med aripiprazol fra 2 uger før parring til og med drægtighedsdag 7 i doser på 2, 6 og 20 mg/kg/dag, som er 0,6, 2 og 6 gange MRHD på 30 mg/dag baseret på mg/m² kropsoverfladeareal. Estrus cyklus uregelmæssigheder og øget corpora lutea blev set ved alle doser, men ingen svækkelse af fertiliteten blev set. Øget præ-implantationstab blev set ved 2 og 6 gange MRHD, og nedsat fostervægt blev set ved 6 gange MRHD.
Hanrotter blev behandlet oralt med aripiprazol fra 9 uger før parring til parring med doser på 20, 40 og 60 mg/kg/dag, hvilket er 6, 13 og 19 gange MRHD på 30 mg/dag baseret på mg/ m² kropsoverflade. Forstyrrelser i spermatogenese blev set ved 19 gange MRHD, og prostataatrofi blev set ved 13 og 19 gange MRHD uden svækkelse af fertiliteten.
Brug i specifikke populationer
Graviditet
Graviditetseksponeringsregister
Der findes et graviditetseksponeringsregister, der overvåger graviditetsresultater hos kvinder, der er udsat for atypiske antipsykotika, herunder ABILIFY, under graviditet. Sundhedsudbydere opfordres til at registrere patienter ved at kontakte National Pregnancy Registry for Atypical Antipsychotics på 1-866-961-2388 eller besøge http://womensmentalhealth.org/clinical-and-researchprograms/pregnancyregistry/.
Risikooversigt
Nyfødte, der er udsat for antipsykotiske lægemidler, inklusive ABILIFY 20 mg, i tredje trimester af graviditeten er i risiko for ekstrapyramidale og/eller abstinenssymptomer efter fødslen (se Kliniske overvejelser ). Overordnede tilgængelige data fra publicerede epidemiologiske undersøgelser af gravide kvinder udsat for aripiprazol har ikke påvist en lægemiddelassocieret risiko for alvorlige fødselsdefekter, abort eller uønskede maternelle eller føtale udfald (se Data ). Der er risici for moderen forbundet med ubehandlet skizofreni, bipolar lidelse I eller svær depressiv lidelse og med eksponering for antipsykotika, herunder ABILIFY, under graviditet (se Kliniske overvejelser ).
I reproduktionsstudier på dyr producerede oral og intravenøs administration af aripiprazol under organogenese hos rotter og/eller kaniner i doser på henholdsvis 10 og 19 gange den maksimalt anbefalede humane dosis (MRHD) på 30 mg/dag baseret på mg/m² kropsoverfladeareal. fosterdød, nedsat fostervægt, ikke-nedsænkede testikler, forsinket skeletforbening, skeletabnormiteter og diafragmabrok. Oral og intravenøs administration af aripiprazol i den præ- og postnatale periode til rotter i doser på 10 gange MRHD baseret på mg/m² legemsoverflade, gav forlænget drægtighed, dødfødsler, nedsat hvalpevægt og nedsat hvalpeoverlevelse (se Data ).
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort for den angivne population er ukendt. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre ugunstige udfald. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2-4 % og 15-20 %.
Kliniske overvejelser
Sygdomsassocieret moder- og/eller embryo-/fosterrisiko
Der er en risiko for moderen fra ubehandlet skizofreni eller bipolar lidelse I, herunder øget risiko for tilbagefald, hospitalsindlæggelse og selvmord. Skizofreni og bipolar lidelse I er forbundet med øgede uønskede perinatale udfald, herunder for tidlig fødsel. Det vides ikke, om dette er et direkte resultat af sygdommen eller andre komorbide faktorer.
En prospektiv, longitudinel undersøgelse fulgte 201 gravide kvinder med en historie med svær depressiv lidelse, som var euthymic og tog antidepressiva i begyndelsen af graviditeten. De kvinder, der ophørte med antidepressiva under graviditeten, var mere tilbøjelige til at opleve tilbagefald af svær depression end kvinder, der fortsatte med antidepressiva. Overvej risikoen for ubehandlet depression ved seponering eller ændring af behandling med antidepressiv medicin under graviditet og efter fødslen.
Fetale/neonatale bivirkninger
Ekstrapyramidale og/eller abstinenssymptomer, herunder agitation, hypertoni, hypotoni, tremor, somnolens, åndedrætsbesvær og spiseforstyrrelser er blevet rapporteret hos nyfødte, som blev eksponeret for antipsykotiske lægemidler (inklusive ABILIFY) i tredje trimester af graviditeten. Disse symptomer har varieret i sværhedsgrad. Overvåg nyfødte for ekstrapyramidale og/eller abstinenssymptomer, og håndter symptomerne på passende vis. Nogle nyfødte kom sig inden for timer eller dage uden specifik behandling; andre krævede længere tids indlæggelse.
Data
Menneskelige data
Publicerede data fra observationsstudier, fødselsregistre og case-rapporter om brug af atypiske antipsykotika under graviditet rapporterer ikke en klar sammenhæng med antipsykotika og større fødselsdefekter. En retrospektiv undersøgelse fra en Medicaid-database af 9258 kvinder, der blev eksponeret for antipsykotika under graviditeten, indikerede ikke en samlet øget risiko for alvorlige fødselsdefekter.
Dyredata
dyreforsøg påviste aripiprazol udviklingstoksicitet, herunder mulige teratogene virkninger hos rotter og kaniner.
Hos drægtige rotter behandlet oralt med aripiprazol under organogenese i doser på 3, 10 og 30 mg/kg/dag, hvilket er ca. 1, 3 og 10 gange MRHD på 30 mg/dag baseret på mg/m² kropsoverfladeareal, en let forlængelse af graviditeten og forsinkelse i fosterudviklingen, som påvist ved nedsat føtal vægt og ikke-nedsænkede testikler, blev observeret ved 10 gange MRHD. Forsinket skeletforbening blev observeret ved 3 og 10 gange MRHD. Født afkom havde øget forekomst af hepatodiafragmatiske knuder, og diaphragmatisk brok blev observeret ved 10 gange MRHD (de andre dosisgrupper blev ikke undersøgt for disse fund). Postnatalt sås forsinket skedeåbning ved 3 og 10 gange MRHD. Forringet reproduktionsevne (nedsat fertilitetsrate, corpora lutea, implantater, levende fostre og øget post-implantationstab, sandsynligvis medieret gennem virkninger på kvindeligt afkom) blev observeret ved 10 gange MRHD; der var dog ingen beviser for, at disse udviklingsmæssige virkninger var sekundære til maternel toksicitet.
Hos gravide rotter, der blev injiceret intravenøst med aripiprazol under organogenese i doser på 3, 9 og 27 mg/kg/dag, som er 1, 3 og 9 gange MRHD på 30 mg/dag baseret på mg/m² kropsoverfladeareal, faldt føtal vægt og forsinket skeletforbening blev observeret ved 9 gange MRHD; denne dosis forårsagede også maternel toksicitet.
Hos drægtige kaniner behandlet oralt med aripiprazol under organogenese i doser på 10, 30 og 100 mg/kg/dag, hvilket er 6, 19 og 65 gange MRHD på 30 mg/dag baseret på mg/m² kropsoverfladeareal, nedsat maternel madforbrug og øgede aborter samt øget fosterdødelighed blev observeret ved 65 gange MHRD. Nedsat fostervægt og øget forekomst af sammenvoksede brystben blev observeret ved 19 og 65 gange MRHD.
Hos gravide kaniner, der blev injiceret intravenøst med aripiprazol under organogenese i doser på 3, 10 og 30 mg/kg/dag, hvilket er 2, 6 og 19 gange MRHD på 30 mg/dag baseret på mg/m² kropsoverfladeareal, faldt føtal vægt, øgede føtale abnormiteter (primært skelet) og nedsat føtal skelet ossifikation blev observeret ved 19 gange MRHD; denne dosis forårsagede også maternel toksicitet. Den føtale no-effect dosis var 10 mg/kg/dag, hvilket er 6 gange MRHD.
Hos rotter behandlet oralt med aripiprazol peri- og postnatalt fra drægtighedsdag 17 til postpartum dag 21 i doser på 3, 10 og 30 mg/kg/dag, som er 1, 3 og 10 gange MRHD på 30 mg/dag baseret på mg/m² legemsoverflade blev der observeret let maternel toksicitet og let forlænget graviditet ved 10 gange MHRD. En stigning i dødfødsler og fald i hvalpevægt (vedvarende i voksenalderen) og overlevelse blev også set ved denne dosis.
Hos rotter injiceret intravenøst med aripiprazol fra drægtighedsdag 6 til diegivningsdag 20 i doser på 3, 8 og 20 mg/kg/dag, hvilket er 1, 3 og 6 gange MRHD på 30 mg/dag baseret på mg/m² kropsoverfladeareal, øgede dødfødsler blev observeret ved 3 og 6 gange MRHD; og fald i tidlig postnatal hvalpevægt og overlevelse blev observeret ved 6 gange MRHD; disse doser forårsagede også en vis maternel toksicitet. Der var ingen effekter på den postnatale adfærdsmæssige og reproduktive udvikling.
Amning
Risikooversigt
Begrænsede data fra publiceret litteratur rapporterer tilstedeværelsen af aripiprazol i human modermælk ved relative spædbørnsdoser på mellem 0,7 % og 8,3 % af moderens vægtjusterede dosis. Der er rapporter om ringe vægtøgning hos ammede spædbørn udsat for aripiprazol og rapporter om utilstrækkelig mælkeforsyning hos ammende kvinder, der tager aripiprazol.
Udviklingen og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for ABILIFY og eventuelle negative virkninger på det ammede spædbarn fra ABILIFY eller fra den underliggende moderens tilstand.
Pædiatrisk brug
Sikkerhed og effektivitet hos pædiatriske patienter med svær depressiv lidelse eller agitation forbundet med skizofreni eller bipolar mani er ikke blevet fastlagt.
Farmakokinetikken for aripiprazol og dehydro-aripiprazol hos pædiatriske patienter i alderen 10 til 17 år var den samme som hos voksne efter korrektion for forskelle i kropsvægt [se KLINISK FARMAKOLOGI ].
Skizofreni
Sikkerhed og effektivitet hos pædiatriske patienter med skizofreni blev fastslået i et 6-ugers, placebo-kontrolleret klinisk forsøg med 202 pædiatriske patienter i alderen 13 til 17 år [se DOSERING OG ADMINISTRATION , BIVIRKNINGER , og Kliniske Studier ]. Selvom vedligeholdelseseffektiviteten hos pædiatriske patienter ikke er blevet systematisk evalueret, kan vedligeholdelseseffektiviteten ekstrapoleres fra voksne data sammen med sammenligninger af aripiprazols farmakokinetiske parametre hos voksne og pædiatriske patienter.
Bipolar I lidelse
Sikkerhed og effektivitet hos pædiatriske patienter med bipolar mani blev fastlagt i et 4-ugers, placebokontrolleret klinisk forsøg med 197 pædiatriske patienter i alderen 10 til 17 år [se DOSERING OG ADMINISTRATION , BIVIRKNINGER , og Kliniske Studier ]. Selvom vedligeholdelseseffektiviteten hos pædiatriske patienter ikke er blevet systematisk evalueret, kan vedligeholdelseseffektiviteten ekstrapoleres fra voksne data sammen med sammenligninger af aripiprazols farmakokinetiske parametre hos voksne og pædiatriske patienter.
Effekten af supplerende ABILIFY 10 mg med samtidig lithium eller valproat til behandling af maniske eller blandede episoder hos pædiatriske patienter er ikke blevet systematisk evalueret. En sådan effekt og mangel på farmakokinetisk interaktion mellem aripiprazol og lithium eller valproat kan dog ekstrapoleres fra voksne data sammen med sammenligninger af aripiprazols farmakokinetiske parametre hos voksne og pædiatriske patienter.
Irritabilitet forbundet med autistisk lidelse
Sikkerhed og effektivitet hos pædiatriske patienter, der udviser irritabilitet forbundet med autistisk lidelse, blev fastlagt i to 8-ugers, placebokontrollerede kliniske forsøg med 212 pædiatriske patienter i alderen 6 til 17 år [se INDIKATIONER OG BRUG , DOSERING OG ADMINISTRATION , BIVIRKNINGER , og Kliniske Studier ]. Et vedligeholdelsesforsøg blev udført med pædiatriske patienter (6 til 17 år) med irritabilitet forbundet med autistisk lidelse. Den første fase af dette forsøg var en åben, fleksibelt doseret (aripiprazol 2 til 15 mg/dag) fase, hvor patienterne var stabiliserede (defineret som > 25 % forbedring på ABC-I subskalaen og en CGI-I rating på "meget forbedret" eller "meget forbedret") på ABILIFY i 12 på hinanden følgende uger. Samlet set blev 85 patienter stabiliseret og gik ind i den anden, 16-ugers, dobbeltblinde fase, hvor de blev randomiseret til enten at fortsætte ABILIFY-behandlingen eller skifte til placebo. I dette forsøg blev effektiviteten af ABILIFY til vedligeholdelsesbehandling af irritabilitet forbundet med autistisk lidelse ikke fastslået.
Tourettes lidelse
Sikkerhed og effektivitet af aripiprazol hos pædiatriske patienter med Tourettes lidelse blev fastlagt i en 8-ugers (i alderen 7 til 17) og en 10-ugers undersøgelse (i alderen 6 til 18) med 194 pædiatriske patienter [se DOSERING OG ADMINISTRATION , BIVIRKNINGER , og Kliniske Studier ]. Vedligeholdelseseffektivitet hos pædiatriske patienter er ikke blevet systematisk evalueret.
Unge dyrestudier
Aripiprazol hos unge rotter forårsagede dødelighed, CNS kliniske tegn, svækket hukommelse og indlæring og forsinket seksuel modning, når det blev administreret i orale doser på 10, 20, 40 mg/kg/dag fra fravænning (21 dage gammel) til modenhed (80 dage gammel) . Ved 40 mg/kg/dag blev mortalitet, nedsat aktivitet, udstrakte baglemmer, krum kropsholdning, ataksi, rysten og andre CNS-tegn observeret hos begge køn. Derudover blev der observeret forsinket seksuel modning hos mænd. Ved alle doser og på en dosisafhængig måde, nedsat hukommelse og indlæring, øget motorisk aktivitet og histopatologiske ændringer i hypofysen (atrofi), binyrerne (binyrebarkhypertrofi), mælkekirtler (hyperplasi og øget sekretion) og kvindelige reproduktionsorganer ( vaginal mucifikation, endometrieatrofi, fald i ovarie corpora lutea) blev observeret. Ændringerne i kvindelige reproduktionsorganer blev anset for at være sekundære til stigningen i prolaktin serumniveauer. Et No Observed Adverse Effect Level (NOAEL) kunne ikke bestemmes, og ved den laveste testede dosis på 10 mg/kg/dag er der ingen sikkerhedsmargin i forhold til de systemiske eksponeringer (AUC0-24) for aripiprazol eller dets vigtigste aktive metabolit hos unge ved den maksimalt anbefalede pædiatriske dosis på 15 mg/dag. Alle lægemiddelrelaterede virkninger var reversible efter en 2-måneders restitutionsperiode, og de fleste lægemiddeleffekter hos unge rotter blev også observeret hos voksne rotter fra tidligere udførte undersøgelser.
Aripiprazol hos unge hunde (2 måneder gamle) forårsagede CNS kliniske tegn på rysten, hypoaktivitet, ataksi, tilbagelænethed og begrænset brug af baglemmer, når det blev administreret oralt i 6 måneder med 3, 10, 30 mg/kg/dag. Gennemsnitlig kropsvægt og vægtøgning faldt med op til 18 % hos kvinder i alle lægemiddelgrupper i forhold til kontrolværdier. En NOAEL kunne ikke bestemmes, og ved den laveste testede dosis på 3 mg/kg/dag er der ingen sikkerhedsmargin i forhold til de systemiske eksponeringer (AUC0-24) for aripiprazol eller dets vigtigste aktive metabolit hos unge ved den maksimalt anbefalede pædiatriske dosis på 15 mg/dag. Alle lægemiddelrelaterede virkninger var reversible efter en 2-måneders restitutionsperiode.
Geriatrisk brug
Ingen dosisjustering anbefales til ældre patienter [se KASSET ADVARSEL , ADVARSLER OG FORHOLDSREGLER , og KLINISK FARMAKOLOGI ].
Ud af de 13.543 patienter, der blev behandlet med oral ABILIFY 15 mg i kliniske forsøg, var 1073 (8%) ≥65 år og 799 (6%) var ≥75 år. Placebokontrollerede undersøgelser af oral ABILIFY 10 mg ved skizofreni, bipolar mani eller svær depressiv lidelse omfattede ikke et tilstrækkeligt antal forsøgspersoner på 65 år og derover til at afgøre, om de reagerer anderledes end yngre forsøgspersoner.
Af de 749 patienter, der blev behandlet med ABILIFY-injektion i kliniske forsøg, var 99 (13%) ≥65 år og 78 (10%) var ≥75 år. Placebokontrollerede undersøgelser af ABILIFY-injektion hos patienter med agitation forbundet med skizofreni eller bipolar mani omfattede ikke et tilstrækkeligt antal forsøgspersoner på 65 år og derover til at afgøre, om de reagerer anderledes end yngre forsøgspersoner.
ABILIFY 15mg er ikke godkendt til behandling af patienter med psykose forbundet med Alzheimers sygdom [se KASSET ADVARSEL og ADVARSLER OG FORHOLDSREGLER ].
CYP2D6 Dårlige metabolisatorer
Dosisjustering anbefales hos kendte CYP2D6-fattige metabolisatorer på grund af høje aripiprazolkoncentrationer. Cirka 8% af kaukasiere og 3-8% af sorte/afrikanske amerikanere kan ikke metabolisere CYP2D6-substrater og er klassificeret som dårlige metabolisatorer (PM) [se DOSERING OG ADMINISTRATION og KLINISK FARMAKOLOGI ].
Nedsat lever- og nyrefunktion
Der kræves ingen dosisjustering for ABILIFY på grundlag af en patients leverfunktion (mild til svær leverinsufficiens, Child-Pugh-score mellem 5 og 15) eller nyrefunktion (mild til svær nyreinsufficiens, glomerulær filtrationshastighed mellem 15 og 90 ml/minut) [se KLINISK FARMAKOLOGI ].
Andre specifikke populationer
Der kræves ingen dosisjustering for ABILIFY på grundlag af en patients køn, race eller rygestatus [se KLINISK FARMAKOLOGI ].
OVERDOSIS
MedDRA-terminologi er blevet brugt til at klassificere bivirkningerne.
Menneskelig oplevelse
kliniske forsøg og efter markedsføringserfaring er bivirkninger af bevidst eller utilsigtet overdosering med oral ABILIFY blevet rapporteret over hele verden. Disse omfatter overdoser med oral ABILIFY 20 mg alene og i kombination med andre stoffer. Der blev ikke rapporteret dødsfald med ABILIFY alene. Den største kendte dosis med et kendt udfald involverede akut indtagelse af 1260 mg oral ABILIFY (42 gange den maksimalt anbefalede daglige dosis) af en patient, der kom sig helt. Forsætlig eller utilsigtet overdosering blev også rapporteret hos børn (12 år og yngre), der involverede oral ABILIFY 10 mg indtagelse op til 195 mg uden dødsfald.
Almindelige bivirkninger (rapporteret i mindst 5 % af alle overdoseringstilfælde) rapporteret ved oral ABILIFY-overdosering (alene eller i kombination med andre stoffer) omfatter opkastning, somnolens og tremor. Andre klinisk vigtige tegn og symptomer observeret hos en eller flere patienter med ABILIFY-overdosering (alene eller sammen med andre stoffer) omfatter acidose, aggression, øget aspartataminotransferase, atrieflimren, bradykardi, koma, konfusionstilstand, kramper, øget blodkreatinfosfokinase, nedsat niveau af bevidsthed, hypertension, hypokaliæmi, hypotension, sløvhed, bevidsthedstab, QRS-kompleks forlænget, QT forlænget, pneumoni aspiration, respirationsstop, status epilepticus og takykardi.
Håndtering af overdosering
Der er ingen specifik information tilgængelig om behandling af overdosering med ABILIFY. Et elektrokardiogram bør tages i tilfælde af overdosering, og hvis QT-intervalforlængelse er til stede, bør hjerteovervågning iværksættes. Ellers bør håndteringen af overdosering koncentreres om understøttende behandling, opretholdelse af tilstrækkelige luftveje, iltning og ventilation og behandling af symptomer. Tæt medicinsk overvågning og overvågning bør fortsætte, indtil patienten kommer sig.
Trækul
I tilfælde af en overdosis af ABILIFY 10 mg kan en tidlig indgivelse af trækul være nyttig til delvist at forhindre absorptionen af aripiprazol. Administration af 50 g aktivt kul, en time efter en enkelt 15 mg oral dosis af ABILIFY, reducerede den gennemsnitlige AUC og Cmax for aripiprazol med 50 %.
Hæmodialyse
Selvom der ikke er information om virkningen af hæmodialyse ved behandling af en overdosis med ABILIFY, er det usandsynligt, at hæmodialyse vil være nyttig til behandling af overdosis, da aripiprazol er stærkt bundet til plasmaproteiner.
KONTRAINDIKATIONER
ABILIFY 15 mg er kontraindiceret til patienter med en anamnese med en overfølsomhedsreaktion over for aripiprazol. Reaktionerne har varieret fra pruritus/urticaria til anafylaksi [se BIVIRKNINGER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Virkningsmekanismen af aripiprazol ved skizofreni eller bipolar mani er uklar. Effekten af aripiprazol i de anførte indikationer kunne imidlertid medieres gennem en kombination af partiel agonistaktivitet ved D2- og 5-HT1A-receptorer og antagonistaktivitet ved 5-HT2A-receptorer.
Farmakodynamik
Aripiprazol udviser høj affinitet for dopamin D2 og D3, serotonin 5-HT1A- og 5-HT2A-receptorer (Ki-værdier på henholdsvis 0,34 nM, 0,8 nM, 1,7 nM og 3,4 nM), moderat affinitet for doptonamin D4-seC og HT2. 5-HT7, alpha1-adrenerge og histamin H1-receptorer (Ki-værdier på henholdsvis 44 nM, 15 nM, 39 nM, 57 nM og 61 nM) og moderat affinitet for serotoningenoptagelsesstedet (Ki=98 nM). Aripiprazol har ingen nævneværdig affinitet for kolinerge muskarine receptorer (IC50>1000 nM).
Farmakokinetik
ABILIFY-aktivitet skyldes formodentlig primært moderlægemidlet, aripiprazol, og i mindre grad dets hovedmetabolit, dehydro-aripiprazol, som har vist sig at have affiniteter til D2-receptorer svarende til moderlægemidlet og repræsenterer 40 % af moderstoffet. lægemiddeleksponering i plasma. Den gennemsnitlige eliminationshalveringstid er ca. 75 timer og 94 timer for henholdsvis aripiprazol og dehydro-aripiprazol. Steady-state-koncentrationer opnås inden for 14 dage efter dosering for begge aktive dele. Aripiprazolakkumulering er forudsigelig ud fra enkeltdosis farmakokinetik. Ved steady-state er farmakokinetikken af aripiprazol dosisproportional. Elimination af aripiprazol sker hovedsageligt gennem levermetabolisme, der involverer to P450-isozymer, CYP2D6 og CYP3A4. For CYP2D6-fattige metabolisatorer er den gennemsnitlige eliminationshalveringstid for aripiprazol ca. 146 timer.
Farmakokinetiske undersøgelser viste, at ABILIFY 10 mg DISCMELT oralt desintegrerende tabletter er bioækvivalente med ABILIFY 15 mg tabletter.
Mundtlig administration
Absorption
Tablet: Aripiprazol absorberes godt efter administration af tabletten, med maksimal plasmakoncentration inden for 3 timer til 5 timer; den absolutte orale biotilgængelighed af tabletformuleringen er 87 %. ABILIFY 10mg kan indgives med eller uden mad. Administration af en 15 mg ABILIFY-tablet sammen med et standardmåltid med højt fedtindhold påvirkede ikke signifikant Cmax eller AUC for aripiprazol eller dets aktive metabolit, dehydro-aripiprazol, men forsinkede Tmax med 3 timer for aripiprazol og 12 timer for dehydro-aripiprazol.
Oral opløsning: Aripiprazol absorberes godt, når det administreres oralt som opløsning. Ved ækvivalente doser var plasmakoncentrationerne af aripiprazol fra opløsningen højere end fra tabletformuleringen. I en relativ biotilgængelighedsundersøgelse, der sammenlignede farmakokinetikken af 30 mg aripiprazol som oral opløsning med 30 mg aripiprazol-tabletter hos raske forsøgspersoner, var forholdet mellem opløsning og tablet af geometriske gennemsnitlige Cmax- og AUC-værdier henholdsvis 122 % og 114 % [se DOSERING OG ADMINISTRATION ]. Enkeltdosisfarmakokinetikken for aripiprazol var lineær og dosisproportional mellem doserne på 5 mg til 30 mg.
Fordeling
Steady-state distributionsvolumen af aripiprazol efter intravenøs administration er høj (404 l eller 4,9 l/kg), hvilket indikerer omfattende ekstravaskulær distribution. Ved terapeutiske koncentrationer er aripiprazol og dets hovedmetabolit mere end 99 % bundet til serumproteiner, primært til albumin. Hos raske frivillige forsøgspersoner, der fik 0,5 til 30 mg/dag aripiprazol i 14 dage, var der dosisafhængig D2-receptorbelægning, hvilket indikerer hjernepenetration af aripiprazol hos mennesker.
Metabolisme og eliminering
Aripiprazol metaboliseres primært af tre biotransformationsveje: dehydrogenering, hydroxylering og N-dealkylering. Baseret på in vitro undersøgelser er CYP3A4 og CYP2D6 enzymer ansvarlige for dehydrogenering og hydroxylering af aripiprazol, og N-dealkylering katalyseres af CYP3A4. Aripiprazol er den dominerende lægemiddeldel i det systemiske kredsløb. Ved steady-state repræsenterer dehydro-aripiprazol, den aktive metabolit, omkring 40 % af aripiprazol AUC i plasma.
Efter en enkelt oral dosis af [14C]-mærket aripiprazol blev ca. 25 % og 55 % af den administrerede radioaktivitet genfundet i henholdsvis urin og fæces. Mindre end 1 % af uændret aripiprazol blev udskilt i urinen, og ca. 18 % af den orale dosis blev genfundet uændret i fæces.
Lægemiddelinteraktionsstudier
Effekter af andre lægemidler på eksponeringen af aripiprazol og dehydro-aripiprazol er opsummeret i henholdsvis figur 1 og figur 2. Baseret på simulering forventes en 4,5-fold stigning i gennemsnitlige Cmax- og AUC-værdier ved steady-state, når omfattende metabolisatorer af CYP2D6 administreres med både stærke CYP2D6- og CYP3A4-hæmmere. En 3-fold stigning i gennemsnitlige Cmax- og AUC-værdier ved steady-state forventes hos dårlige metabolisatorer af CYP2D6 administreret med stærke CYP3A4-hæmmere.
Figur 1: Virkningerne af andre lægemidler på aripiprazols farmakokinetik 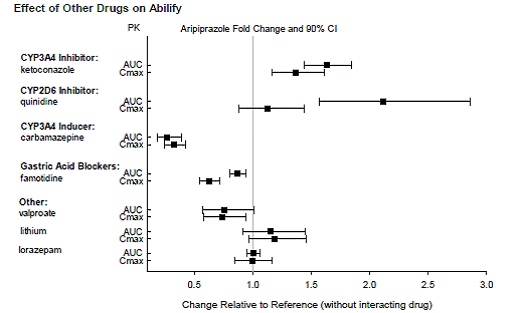
Figur 2: Virkningerne af andre lægemidler på dehydro-aripiprazols farmakokinetik 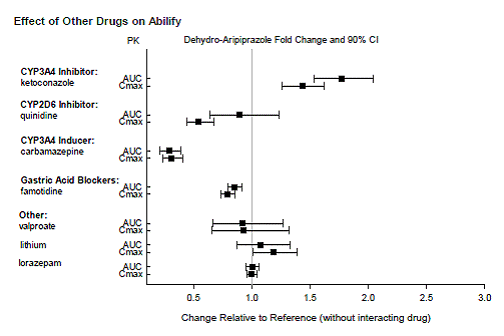
Effekterne af ABILIFY 15mg på eksponeringen af andre lægemidler er opsummeret i figur 3. En populations-PK-analyse hos patienter med svær depressiv lidelse viste ingen væsentlig ændring i plasmakoncentrationer af fluoxetin (20 eller 40 mg/dag), paroxetin CR (37,5 eller 50 mg/dag), eller sertralin (100 eller 150 mg/dag) doseret til steady-state. Steady-state plasmakoncentrationerne af fluoxetin og norfluoxetin steg med henholdsvis ca. 18 % og 36 %, og koncentrationerne af paroxetin faldt med ca. 27 %. Steady-state plasmakoncentrationerne af sertralin og desmethylsertralin blev ikke ændret væsentligt, når disse antidepressive terapier blev administreret sammen med aripiprazol.
Figur 3: Virkningerne af ABILIFY 15mg på farmakokinetik af andre lægemidler 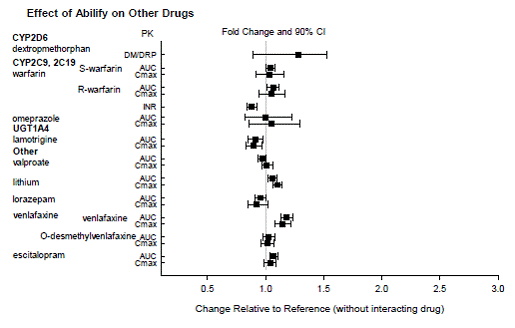
Undersøgelser i specifikke populationer
Eksponeringer af aripiprazol og dehydro-aripiprazol i specifikke populationer er opsummeret i henholdsvis figur 4 og figur 5. Hos pædiatriske patienter (10 til 17 år) administreret med ABILIFY (20 mg til 30 mg), var den kropsvægtkorrigerede aripiprazol-clearance desuden den samme som hos voksne.
Figur 4: Effekter af iboende faktorer på aripiprazols farmakokinetik 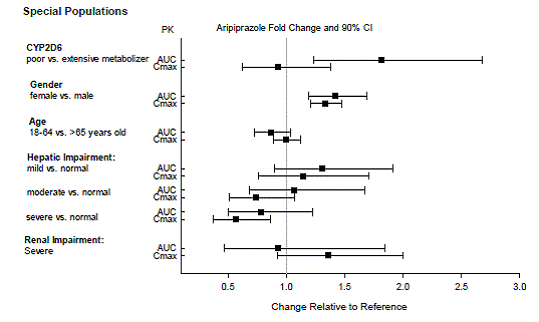
Figur 5: Effekter af iboende faktorer på dehydro-aripiprazols farmakokinetik 
Intramuskulær administration
to farmakokinetiske undersøgelser af aripiprazol-injektion administreret intramuskulært til raske forsøgspersoner, var mediantiden til maksimale plasmakoncentrationer 1 time og 3 timer. En 5 mg intramuskulær injektion af aripiprazol havde en absolut biotilgængelighed på 100 %. Den geometriske gennemsnitlige maksimale koncentration opnået efter en intramuskulær dosis var i gennemsnit 19 % højere end Cmax for den orale tablet. Mens den systemiske eksponering over 24 timer generelt var ens mellem aripiprazol-injektion givet intramuskulært og efter oral tabletadministration, var aripiprazol-AUC i de første 2 timer efter en intramuskulær injektion 90 % større end AUC efter samme dosis som en tablet. Hos stabile patienter med skizofreni eller skizoaffektiv lidelse var farmakokinetikken af aripiprazol efter intramuskulær administration lineær over et dosisområde på 1 mg til 45 mg. Selvom metabolismen af aripiprazol-injektion ikke blev systematisk evalueret, forventes den intramuskulære indgivelsesvej ikke at ændre de metaboliske veje.
Dyretoksikologi og/eller farmakologi
Aripiprazol producerede retinal degeneration hos albinorotter i et 26-ugers kronisk toksicitetsstudie ved en dosis på 60 mg/kg/dag og i et 2-årigt carcinogenicitetsstudie ved doser på 40 og 60 mg/kg/dag, som er 13 og 19 gange MRHD på 30 mg/dag baseret på mg/m² kropsoverfladeareal. Evaluering af nethinden hos albinomus og aber afslørede ikke tegn på retinal degeneration. Yderligere undersøgelser for yderligere at evaluere mekanismen er ikke blevet udført. Relevansen af dette fund for human risiko er ukendt.
Kliniske Studier
Effekten af de orale formuleringer af ABILIFY (aripiprazol) blev fastslået i følgende tilstrækkelige og velkontrollerede forsøg:
- Fire korttidsforsøg og et vedligeholdelsesforsøg med voksne patienter og et korttidsforsøg med unge (13-17 år) med skizofreni [se Kliniske Studier ]
- Fire kortvarige monoterapiforsøg og et 6-ugers supplerende forsøg med voksne patienter og et kortvarigt monoterapiforsøg hos pædiatriske patienter (alder 1017) med maniske eller blandede episoder [se Kliniske Studier ]
- Et monoterapiforsøg med vedligeholdelse og i et supplerende vedligeholdelsesforsøg hos voksne patienter med bipolar lidelse I [se Kliniske Studier ]
- To kortvarige forsøg med voksne patienter med MDD, som havde et utilstrækkeligt respons på antidepressiv behandling under den aktuelle episode [se Kliniske Studier ]
- To kortvarige forsøg med pædiatriske patienter (i alderen 6-17 år) til behandling af irritabilitet forbundet med autistisk lidelse [se Kliniske Studier ]
- To korttidsforsøg med pædiatriske patienter (i alderen 6-18 år) med Tourettes lidelse [se Kliniske Studier ]
Effekten af den injicerbare formulering af ABILIFY (aripiprazol) blev fastslået i følgende tilstrækkelige og velkontrollerede forsøg:
- Tre 24-timers forsøg med ophidsede voksne patienter med skizofreni eller maniske/blandede episoder af bipolar I lidelse [se Kliniske Studier ]
Skizofreni
Voksne
Effekten af ABILIFY 15 mg til behandling af skizofreni blev evalueret i fem kortvarige (4-ugers og 6-ugers), placebokontrollerede forsøg med akut recidiverende indlagte patienter, som overvejende opfyldte DSM-III/IV-kriterierne for skizofreni. Fire af de fem forsøg var i stand til at skelne ABILIFY fra placebo, men en undersøgelse, den mindste, gjorde det ikke. Tre af disse undersøgelser inkluderede også en aktiv kontrolgruppe bestående af enten risperidon (et forsøg) eller haloperidol (to forsøg), men de var ikke designet til at muliggøre en sammenligning af ABILIFY 20 mg og de aktive komparatorer.
de fire positive forsøg med ABILIFY 10 mg blev der brugt fire primære mål til at vurdere psykiatriske tegn og symptomer. Effektiviteten blev evalueret ved hjælp af den samlede score på Positive og Negative Syndrome Scale (PANSS). PANSS er en skala med 30 punkter, der måler positive symptomer på skizofreni (7 punkter), negative symptomer på skizofreni (7 punkter) og generel psykopatologi (16 punkter), hver vurderet på en skala fra 1 (fraværende) til 7 (ekstrem) ; samlede PANSS-score spænder fra 30 til 210. Clinical Global Impression (CGI)-vurderingen afspejler indtrykket af en dygtig observatør, som er fuldt fortrolig med manifestationerne af skizofreni, om patientens overordnede kliniske tilstand.
et 4-ugers forsøg (n=414), der sammenlignede to faste doser af ABILIFY (15 eller 30 mg/dag) med placebo, var begge doser af ABILIFY 10 mg overlegne end placebo i PANSS totalscore (undersøgelse 1 i tabel 26), PANSS positiv underskala og CGI-sværhedsscore. Derudover var dosis på 15 mg bedre end placebo i PANSS negative subskala.
I et 4-ugers forsøg (n=404), der sammenlignede to faste doser af ABILIFY (20 eller 30 mg/dag) med placebo, var begge doser af ABILIFY overlegne i forhold til placebo i PANSS total score (undersøgelse 2 i tabel 26), PANSS positiv underskala, PANSS negativ underskala og CGI-sværhedsscore.
I et 6-ugers forsøg (n=420), der sammenlignede tre faste doser af ABILIFY (10, 15 eller 20 mg/dag) med placebo, var alle tre doser af ABILIFY overlegne end placebo i PANSS-totalscore (undersøgelse 3 i tabel). 26), PANSS positiv underskala og PANSS negative underskala.
et 6-ugers forsøg (n=367), der sammenlignede tre faste doser af ABILIFY (2, 5 eller 10 mg/dag) med placebo, var 10 mg-dosis af ABILIFY overlegen i forhold til placebo i PANSS total score (undersøgelse 4 i Tabel 26), undersøgelsens primære resultatmål. Doserne på 2 og 5 mg viste ikke overlegenhed i forhold til placebo på det primære resultatmål.
Effekten af daglige doser på 10, 15, 20 og 30 mg blev således fastslået i to undersøgelser for hver dosis. Blandt disse doser var der ingen evidens for, at de højere dosisgrupper gav nogen fordel i forhold til den laveste dosisgruppe af disse undersøgelser.
En undersøgelse af befolkningsundergrupper afslørede ikke nogen klare beviser for differentiel reaktionsevne på grundlag af alder, køn eller race.
Et længerevarende forsøg omfattede 310 indlagte eller ambulante patienter, der opfyldte DSM-IV-kriterierne for skizofreni, som af historien var symptomatisk stabile på anden antipsykotisk medicin i perioder på 3 måneder eller længere. Disse patienter blev afbrudt fra deres antipsykotiske medicin og randomiseret til ABILIFY 15 mg/dag eller placebo i op til 26 ugers observation for tilbagefald. Tilbagefald under den dobbeltblinde fase blev defineret som CGI-forbedringsscore på ≥5 (minimalt værre), score ≥5 (moderat alvorligt) på fjendtligheds- eller manglende samarbejdsvilje i PANSS eller ≥20 % stigning i PANSS totalscore. Patienter, der fik ABILIFY 15 mg/dag, oplevede en signifikant længere tid til tilbagefald over de efterfølgende 26 uger sammenlignet med dem, der fik placebo (studie 5 i figur 6).
Pædiatriske patienter
Effekten af ABILIFY (aripiprazol) til behandling af skizofreni hos pædiatriske patienter (13 til 17 år) blev evalueret i et 6-ugers, placebokontrolleret forsøg med ambulante patienter, som opfyldte DSM-IV-kriterierne for skizofreni og havde en PANSS-score ≥70 ved baseline. I dette forsøg (n=302), der sammenlignede to faste doser af ABILIFY (10 eller 30 mg/dag) med placebo, blev ABILIFY 15 mg titreret startende fra 2 mg/dag til måldosis på 5 dage i 10 mg/dag-behandlingsarmen og i 11 dage i 30 mg/dag behandlingsarmen. Begge doser af ABILIFY var overlegne end placebo i PANSS-totalscore (undersøgelse 6 i tabel 26), undersøgelsens primære resultatmål. Doseringen på 30 mg/dag viste sig ikke at være mere effektiv end dosis på 10 mg/dag. Selvom vedligeholdelseseffektiviteten hos pædiatriske patienter ikke er blevet systematisk evalueret, kan vedligeholdelseseffektiviteten ekstrapoleres fra voksne data sammen med sammenligninger af aripiprazols farmakokinetiske parametre hos voksne og pædiatriske patienter.
Figur 6: Kaplan-Meier-estimering af kumulativ andel af patienter med tilbagefald (skizofreniundersøgelse 5) 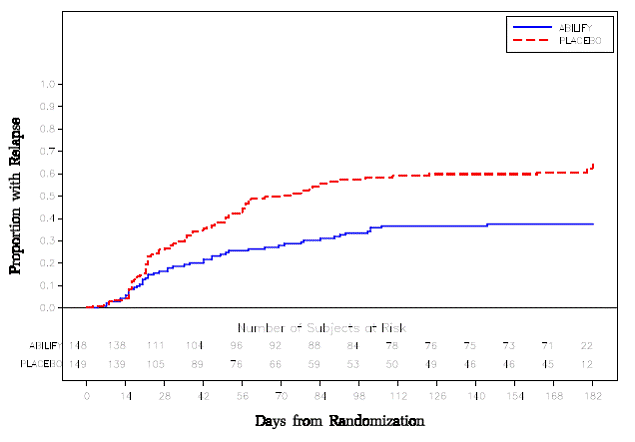
Maniodepressiv
Akut behandling af maniske og blandede episoder
Voksne
Monoterapi
Effekten af ABILIFY 10 mg som monoterapi til akut behandling af maniske episoder blev fastslået i fire 3-ugers, placebokontrollerede forsøg med indlagte patienter, som opfyldte DSM-IV-kriterierne for bipolar I lidelse med maniske eller blandede episoder. Disse undersøgelser omfattede patienter med eller uden psykotiske træk, og to af undersøgelserne omfattede også patienter med eller uden et hurtigt cyklusforløb.
Det primære instrument, der blev brugt til at vurdere maniske symptomer var Young Mania Rating Scale (Y-MRS), en 11-element kliniker-vurderet skala, der traditionelt bruges til at vurdere graden af manisk symptomatologi i et område fra 0 (ingen maniske træk) til 60 ( maksimal score). Et vigtigt sekundært instrument omfattede Clinical Global Impression-Bipolar (CGI-BP) Scale.
de fire positive, 3-ugers, placebokontrollerede forsøg (n=268; n=248; n=480; n=485), som evaluerede ABILIFY i et interval på 15 mg til 30 mg én gang dagligt (med en startdosis) på 30 mg/dag i to undersøgelser og 15 mg/dag i to undersøgelser), var ABILIFY 20 mg bedre end placebo med hensyn til reduktion af Y-MRS total score (undersøgelse 1-4 i tabel 27) og CGI-BP Sværhedsgrad af sygdom score (mani). I de to undersøgelser med en startdosis på 15 mg/dag var 48 % og 44 % af patienterne på 15 mg/dag ved endepunktet. I de to undersøgelser med en startdosis på 30 mg/dag var 86 % og 85 % af patienterne på 30 mg/dag ved endepunktet.
Adjunktiv terapi
Effekten af supplerende ABILIFY med samtidig lithium eller valproat i behandlingen af maniske eller blandede episoder blev fastslået i et 6-ugers, placebo-kontrolleret studie (n=384) med en 2-ugers indledende stemningsstabilisator monoterapifase hos voksne patienter som opfyldte DSM-IV kriterier for bipolar I lidelse. Denne undersøgelse omfattede patienter med maniske eller blandede episoder og med eller uden psykotiske træk.
Patienterne blev indledt med åbent lithium (0,6 til 1,0 mEq/L) eller valproat (50 til 125 μg/ml) ved terapeutiske serumniveauer og forblev på stabile doser i 2 uger. Ved udgangen af 2 uger blev patienter, der viste utilstrækkelig respons (YMRS total score ≥16 og ≤25 % forbedring af Y-MRS total score) på lithium eller valproat randomiseret til at modtage enten ABILIFY (15 mg/dag eller en stigning til 30) mg/dag så tidligt som dag 7) eller placebo som supplerende behandling med åbent lithium eller valproat. I den 6-ugers placebokontrollerede fase var tillægs ABILIFY startende ved 15 mg/dag med samtidig lithium eller valproat (i et terapeutisk område på henholdsvis 0,6 til 1,0 mEq/L eller 50 til 125 μg/ml) bedre end lithium eller valproat med supplerende placebo til reduktion af YMRS-totalscore (undersøgelse 5 i tabel 27) og CGI-BP-sværhedsgrad af sygdom (mani). Enoghalvfjerds procent af patienterne, der fik valproat samtidigt, og 62 % af patienterne, der fik lithium samtidigt, fik 15 mg/dag ved 6-ugers slutpunkt.
Pædiatriske patienter
Effekten af ABILIFY 15mg til behandling af bipolar I lidelse hos pædiatriske patienter (10 til 17 år) blev evalueret i et 4-ugers, placebokontrolleret forsøg (n=296) af ambulante patienter, der opfyldte DSM-IV kriterierne for bipolar I lidelse maniske eller blandede episoder med eller uden psykotiske træk og havde en Y-MRS score ≥20 ved baseline. Dette dobbeltblindede, placebokontrollerede forsøg sammenlignede to faste doser af ABILIFY (10 eller 30 mg/dag) med placebo. ABILIFY 20 mg dosis blev startet med 2 mg/dag, som blev titreret til 5 mg/dag efter 2 dage, og til måldosis efter 5 dage i 10 mg/dag behandlingsarmen og efter 13 dage i 30 mg/dag. dagbehandlingsarm. Begge doser af ABILIFY 10 mg var overlegne end placebo i ændring fra baseline til uge 4 på Y-MRS totalscore (undersøgelse 6 i tabel 27).
Vedligeholdelsesbehandling af bipolar lidelse I
Monoterapi vedligeholdelsesterapi
Et vedligeholdelsesstudie blev udført med voksne patienter, der opfylder DSM-IV-kriterierne for bipolar I lidelse med en nylig manisk eller blandet episode, som var blevet stabiliseret på åben ABILIFY 20 mg, og som havde opretholdt et klinisk respons i mindst 6 uger. Den første fase af dette forsøg var en åben stabiliseringsperiode, hvor indlagte og ambulante patienter blev klinisk stabiliseret og derefter holdt på åben ABILIFY (15 eller 30 mg/dag, med en startdosis på 30 mg/dag) i mindst 6 sammenhængende uger. 161 ambulante patienter blev derefter randomiseret på en dobbeltblind måde til enten den samme dosis af ABILIFY, som de havde ved afslutningen af stabiliserings- og vedligeholdelsesperioden eller placebo, og blev derefter overvåget for manisk eller depressivt tilbagefald. Under randomiseringsfasen var ABILIFY overlegen placebo til tiden i forhold til antallet af kombinerede affektive tilbagefald (manisk plus depressiv), det primære resultatmål for denne undersøgelse (studie 7 i figur 7). I alt 55 stemningsbegivenheder blev observeret under den dobbeltblindede behandlingsfase. Nitten var fra ABILIFY-gruppen og 36 fra placebogruppen. Antallet af observerede maniske episoder i ABILIFY 15 mg-gruppen (6) var færre end i placebogruppen (19), mens antallet af depressive episoder i ABILIFY-gruppen (9) svarede til det i placebogruppen (11). .
En undersøgelse af befolkningsundergrupper afslørede ikke nogen klare beviser for differentiel reaktionsevne på basis af alder og køn; dog var der utilstrækkeligt antal patienter i hver af de etniske grupper til tilstrækkeligt at vurdere forskelle mellem grupperne.
Figur 7: Kaplan-Meier estimering af kumulativ andel af patienter med tilbagefald (bipolær undersøgelse 7) 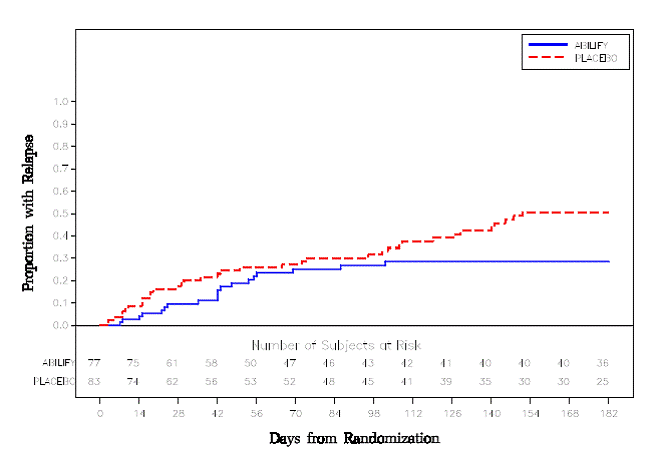
Supplerende vedligeholdelsesterapi
Et supplerende vedligeholdelsesforsøg blev udført med voksne patienter, der opfylder DSMIV-kriterierne for bipolar I lidelse med en nylig manisk eller blandet episode. Patienterne blev indledt med åbent lithium (0,6 til 1,0 mEq/L) eller valproat (50 til 125 μg/ml) ved terapeutiske serumniveauer og forblev på stabile doser i 2 uger. Efter 2 uger modtog patienter, der viste utilstrækkelig respons (Y-MRS total score ≥16 og ≤35 % forbedring af Y-MRS total score) på lithium eller valproat ABILIFY med en startdosis på 15 mg/dag med mulighed for at øge til 30 mg eller reducere til 10 mg så tidligt som dag 4, som supplerende behandling med åbent lithium eller valproat. Før randomisering var patienter på kombinationen af enkelt-blind ABILIFY og lithium eller valproat påkrævet for at opretholde stabilitet (Y-MRS og MADRS totalscore ≤12) i 12 på hinanden følgende uger. Tre hundrede og syvogtredive patienter blev derefter randomiseret på en dobbelt-blind måde, til enten den samme dosis af ABILIFY 20 mg, som de fik ved slutningen af stabiliseringsperioden eller placebo plus lithium eller valproat og blev derefter overvåget for manisk, blandet eller depressivt tilbagefald i højst 52 uger. ABILIFY 15 mg var bedre end placebo på det primære endepunkt, tid fra randomisering til tilbagefald til enhver stemningsbegivenhed (undersøgelse 8 i figur 8). En stemningsbegivenhed blev defineret som hospitalsindlæggelse for en manisk, blandet eller depressiv episode, afbrydelse af undersøgelsen på grund af manglende effekt ledsaget af Y-MRS-score >16 og/eller MADRS >16 eller en SAE af forværret sygdom ledsaget af Y- MRS-score >16 og/eller MADRS >16. I alt 68 stemningsbegivenheder blev observeret under den dobbeltblindede behandlingsfase. Femogtyve var fra ABILIFY 20 mg-gruppen og 43 fra placebogruppen. Antallet af observerede maniske episoder i ABILIFY 15 mg-gruppen (7) var færre end i placebogruppen (19), mens antallet af depressive episoder i ABILIFY-gruppen (14) svarede til det i placebogruppen (18) . Kaplan-Meier-kurverne for tiden fra randomisering til tilbagefald til enhver stemningsbegivenhed under den 52-ugers dobbeltblinde behandlingsfase for ABILIFY 10 mg og placebogrupper er vist i figur 8.
Figur 8: Kaplan-Meier-estimering af kumulativ andel af patienter med tilbagefald til enhver stemningsbegivenhed (bipolar undersøgelse 8) 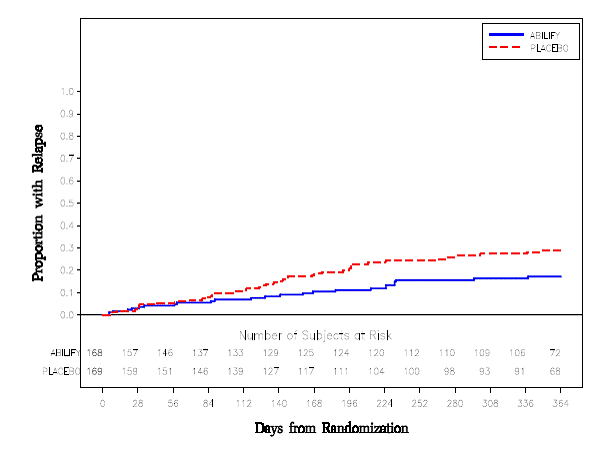
En undersøgelse af befolkningsundergrupper afslørede ikke nogen klare beviser for differentiel reaktionsevne på basis af alder og køn; dog var der utilstrækkeligt antal patienter i hver af de etniske grupper til tilstrækkeligt at vurdere forskelle mellem grupperne.
Tillægsbehandling af svær depressiv lidelse
Voksne
Effekten af ABILIFY 15 mg i den supplerende behandling af svær depressiv lidelse (MDD) blev påvist i to kortvarige (6-ugers), placebokontrollerede forsøg med voksne patienter, der opfylder DSM-IV-kriterierne for MDD, som havde haft et utilstrækkeligt respons på tidligere antidepressiv behandling (1 til 3 forløb) i den aktuelle episode, og som også havde vist et utilstrækkeligt respons på 8 ugers prospektiv antidepressiv behandling (paroxetin kontrolleret frigivelse, venlafaxin forlænget frigivelse, fluoxetin, escitalopram eller sertralin). Utilstrækkelig respons til prospektiv behandling blev defineret som mindre end 50 % forbedring i forhold til 17-element versionen af Hamilton Depression Rating Scale (HAMD17), minimal HAMD17 score på 14 og en Clinical Global Impressions Improvement rating på ikke bedre end minimal forbedring. Utilstrækkelig respons på tidligere behandling blev defineret som mindre end 50 % forbedring som opfattet af patienten efter minimum 6 ugers antidepressiv behandling ved eller over den minimale effektive dosis.
Det primære instrument, der blev brugt til at vurdere depressive symptomer, var Montgomery-Asberg Depression Rating Scale (MADRS), en 10-element kliniker-vurderet skala, der bruges til at vurdere graden af depressiv symptomatologi. Det sekundære nøgleinstrument var Sheehan Disability Scale (SDS), et selvvurderet instrument med 3 punkter, der blev brugt til at vurdere virkningen af depression på tre funktionsdomæner, hvor hvert punkt scorede fra 0 (slet ikke) til 10 (ekstremt).
I de to forsøg (n=381, n=362) var ABILIFY 15 mg bedre end placebo med hensyn til at reducere den gennemsnitlige MADRS-totalscore (studier 1, 2 i tabel 28). I en undersøgelse var ABILIFY også overlegen i forhold til placebo med hensyn til at reducere den gennemsnitlige SDS-score.
begge forsøg fik patienterne ABILIFY 15 mg som supplement til antidepressiva i en dosis på 5 mg/dag. Baseret på tolerabilitet og effekt kan doser justeres i trin på 5 mg med en uges mellemrum. Tilladte doser var: 2, 5, 10, 15 mg/dag, og for patienter, som ikke var på potente CYP2D6-hæmmere fluoxetin og paroxetin, 20 mg/dag. Den gennemsnitlige slutdosis ved slutpunktet for de to forsøg var 10,7 og 11,4 mg/dag.
En undersøgelse af populationsundergrupper afslørede ikke tegn på differentieret respons baseret på alder, valg af potentielt antidepressivt middel eller race. Med hensyn til køn blev der set en mindre gennemsnitlig reduktion af MADRS totalscore hos mænd end hos kvinder.
Irritabilitet forbundet med autistisk lidelse
Pædiatriske patienter
Effekten af ABILIFY (aripiprazol) til behandling af irritabilitet forbundet med autistisk lidelse blev fastslået i to 8-ugers, placebo-kontrollerede forsøg med pædiatriske patienter (6 til 17 år), som opfyldte DSM-IV-kriterierne for autistisk lidelse og demonstreret adfærd såsom raserianfald, aggression, selvskadende adfærd eller en kombination af disse problemer. Over 75 % af disse forsøgspersoner var under 13 år.
Effekten blev evalueret ved hjælp af to vurderingsskalaer: Aberrant Behavior Checklist (ABC) og Clinical Global Impression-Improvement (CGI-I) skalaen. Det primære resultatmål i begge undersøgelser var ændringen fra baseline til endepunkt i Irritabilitetsunderskalaen af ABC (ABC-I). ABC-I-underskalaen målte symptomer på irritabilitet ved autistisk lidelse.
Resultaterne af disse forsøg er som følger:
et af de 8-ugers placebokontrollerede forsøg fik børn og unge med autistisk lidelse (n=98), i alderen 6 til 17 år, daglige doser placebo eller ABILIFY 2 til 15 mg/dag. ABILIFY, startende ved 2 mg/dag med stigninger tilladt op til 15 mg/dag baseret på klinisk respons, forbedrede signifikant score på ABC-I-subskalaen og på CGI-I-skalaen sammenlignet med placebo. Den gennemsnitlige daglige dosis af ABILIFY 10 mg ved afslutningen af 8 ugers behandling var 8,6 mg/dag (undersøgelse 1 i tabel 29).
den anden 8-ugers placebokontrollerede undersøgelse med børn og unge med autistisk lidelse (n=218), i alderen 6 til 17 år, tre faste doser af ABILIFY (5 mg/dag, 10 mg/dag eller 15 mg/dag) dag) blev sammenlignet med placebo. ABILIFY-dosering startede ved 2 mg/dag og blev øget til 5 mg/dag efter en uge. Efter en anden uge blev den øget til 10 mg/dag for patienter i 10- og 15 mg-dosisarmene, og efter en tredje uge blev den øget til 15 mg/dag i 15 mg/dag-behandlingsarmen (studie 2 i Tabel 29). Alle tre doser af ABILIFY forbedrede signifikant score på ABC-I-subskalaen sammenlignet med placebo.
Tourettes lidelse
Pædiatriske patienter
Effekten af ABILIFY (aripiprazol) til behandling af Tourettes lidelse blev fastslået i en 8-ugers (7 til 17 års alderen) og en 10-ugers (6 til 18 års alderen), placebokontrollerede forsøg i pædiatriske patienter (6 til 18 år), som opfyldte DSM-IV-kriterierne for Tourettes lidelse og havde en Total Tic-score (TTS) ≥ 20 - 22 på Yale Global Tic Severity Scale (YGTSS). YGTSS er en fuldt valideret skala designet til at måle den aktuelle tic-sværhedsgrad. Effektiviteten blev evalueret ved hjælp af to vurderingsskalaer: 1) Total Tic-score (TTS) for YGTSS og 2) Clinical Global Impressions Scale for Tourettes Syndrome (CGI-TS), en kliniker-bestemt sammenfattende måling, der tager højde for alle tilgængelige patientoplysninger. Over 65 % af disse patienter var under 13 år.
Det primære resultatmål i begge forsøg var ændringen fra baseline til endepunkt i TTS for YGTSS. Bedømmelser for TTS er lavet ud fra 5 forskellige dimensioner på en skala fra 0 til 5 for motoriske og vokale tics hver. Sammenlægning af disse 10 point giver en TTS (dvs. 0-50).
Resultaterne af disse forsøg er som følger:
det 8-ugers placebokontrollerede forsøg med fast dosis blev børn og unge med Tourettes lidelse (n=133), i alderen 7 til 17 år, randomiseret 1:1:1 til lav dosis ABILIFY, høj dosis ABILIFY 15mg eller placebo. Måldoserne for lav- og højdosis ABILIFY 10 mg-grupperne var baseret på vægt. Patienter
Figur 9: Mindste kvadratiske middel til ændring fra baseline i YGTSS TTS efter uge (Tourettes lidelsesundersøgelse 1) 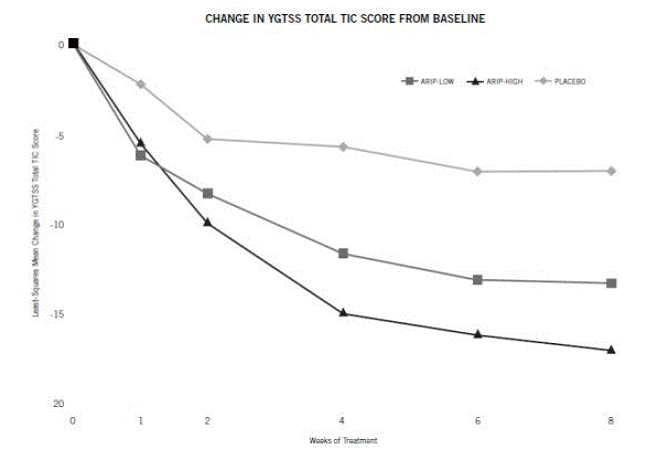
I det 10-ugers placebokontrollerede, fleksible dosisforsøg hos børn og unge med Tourettes lidelse (n=61), i alderen 6 til 18 år, fik patienterne daglige doser placebo eller ABILIFY, startende med 2 mg/ dag med stigninger tilladt op til 20 mg/dag baseret på klinisk respons. ABILIFY viste statistisk signifikant forbedrede score på YGTSS TTS-skalaen sammenlignet med placebo (undersøgelse 2 i tabel 30). Den gennemsnitlige daglige dosis af ABILIFY ved afslutningen af 10-ugers behandling var 6,54 mg/dag.
Agitation forbundet med skizofreni eller bipolar mani
Effekten af intramuskulær ABILIFY til injektion til behandling af agitation blev fastslået i tre kortvarige (24-timers), placebokontrollerede forsøg med ophidsede indlagte patienter fra to diagnostiske grupper: skizofreni og bipolar I-lidelse (maniske eller blandede episoder med eller uden psykotiske træk). Hvert af forsøgene omfattede en enkelt aktiv komparatorbehandlingsarm af enten haloperidol-injektion (skizofreni-undersøgelser) eller lorazepam-injektion (bipolar mani-undersøgelse). Patienter kunne modtage op til tre injektioner i løbet af de 24-timers behandlingsperioder; patienterne kunne dog ikke modtage den anden injektion før efter den indledende periode på 2 timer, hvor det primære effektmål blev vurderet. Patienter, der var tilmeldt forsøgene skulle: (1) bedømmes af de kliniske efterforskere som klinisk ophidsede og klinisk passende kandidater til behandling med intramuskulær medicin, og (2) udvise et niveau af agitation, der opfyldte eller oversteg en tærskelscore på ≥15 pr. de fem elementer, der omfatter Positive og Negative Syndrome Scale (PANSS) Excited Component (dvs. dårlig impulskontrol, spænding, fjendtlighed, manglende samarbejdsvilje og spændingselementer) med mindst to individuelle elementscore ≥4 ved brug af et 1-7 scoringssystem (1 = fraværende, 4 = moderat, 7 = ekstrem). I undersøgelserne var den gennemsnitlige baseline PANSS Excited Component-score 19, med score fra 15 til 34 (ud af en maksimal score på 35), hvilket tyder på overvejende moderate niveauer af agitation med nogle patienter, der oplever milde eller svære niveauer af agitation. Det primære effektmål, der blev brugt til at vurdere agitationstegn og -symptomer i disse forsøg, var ændringen fra baseline i PANSS Excited Component 2 timer efter injektion. Et centralt sekundært mål var Clinical Global Impression of Improvement (CGI-I)-skalaen. Resultaterne af forsøgene følger:
et placebokontrolleret forsøg med ophidsede indlagte patienter, der overvejende opfylder DSM-IV-kriterierne for skizofreni (n=350), blev fire faste ABILIFY 20 mg injektionsdoser på 1 mg, 5,25 mg, 9,75 mg og 15 mg evalueret. 2 timer efter injektion var 5,25 mg, 9,75 mg og 15 mg doser statistisk overlegne end placebo i PANSS Excited Component (undersøgelse 1 i tabel 31) og på CGII-skalaen.
I et andet placebokontrolleret forsøg med ophidsede indlagte patienter, der overvejende opfylder DSM-IV-kriterierne for skizofreni (n=445), blev en fast ABILIFY 15 mg injektionsdosis på 9,75 mg evalueret. 2 timer efter injektion var ABILIFY til injektion statistisk overlegen placebo i PANSS Excited Component (undersøgelse 2 i tabel 31) og på CGI-I skalaen.
et placebokontrolleret forsøg med ophidsede indlagte patienter, der opfylder DSMIV-kriterierne for bipolar I lidelse (manisk eller blandet) (n=291), blev to faste ABILIFY 10 mg injektionsdoser på 9,75 mg og 15 mg evalueret. 2 timer efter injektion var begge doser statistisk overlegne i forhold til placebo i PANSS Excited-komponenten (undersøgelse 3 i tabel 31).
Undersøgelse af befolkningsundergrupper (alder, race og køn) afslørede ikke nogen differentiel reaktionsevne på grundlag af disse undergrupper.
PATIENTOPLYSNINGER
ABILIFY® (aripiprazol) Tabletter
ABILIFY DISCMELT® (aripiprazol) Oralt disintegrerende tabletter
ABILIFY® (aripiprazol) Oral opløsning
ABILIFY® (aripiprazol) Injektion Kun til intramuskulær brug
Hvad er den vigtigste information, jeg bør vide om ABILIFY 20mg?
(For andre bivirkninger, se også "Hvad er de mulige bivirkninger ved ABILIFY?")
Alvorlige bivirkninger kan forekomme, når du tager ABILIFY, herunder:
- Øget risiko for død hos ældre patienter med demensrelateret psykose: Medicin som ABILIFY 10mg kan øge risikoen for død hos ældre mennesker, som har mistet kontakten til virkeligheden (psykose) på grund af forvirring og hukommelsestab (demens). ABILIFY er ikke godkendt til behandling af patienter med demensrelateret psykose.
- Risiko for selvmordstanker eller -handlinger: Antidepressiv medicin, depression og andre alvorlige psykiske sygdomme og selvmordstanker eller -handlinger:
1. Antidepressiv medicin kan øge selvmordstanker eller -handlinger hos nogle børn, teenagere og unge voksne inden for de første par måneder af behandlingen.
2. Depression og andre alvorlige psykiske sygdomme er de vigtigste årsager til selvmordstanker og -handlinger. Nogle mennesker kan have en særlig høj risiko for at få selvmordstanker eller -handlinger. Disse omfatter personer, der har (eller har en familiehistorie med) bipolar sygdom (også kaldet maniodepressiv sygdom) eller selvmordstanker eller -handlinger.
3. Hvordan kan jeg holde øje med og forsøge at forhindre selvmordstanker og -handlinger hos mig selv eller et familiemedlem?
- Vær meget opmærksom på ændringer, især pludselige ændringer, i humør, adfærd, tanker eller følelser. Dette er meget vigtigt, når en antidepressiv medicin startes, eller når dosis ændres.
- Ring til sundhedsudbyderen med det samme for at rapportere nye eller pludselige ændringer i humør, adfærd, tanker eller følelser.
- Hold alle opfølgende besøg hos sundhedsplejersken som planlagt. Ring til lægen mellem besøgene efter behov, især hvis du har bekymringer om symptomer.
Ring til en sundhedsudbyder med det samme, hvis du eller dit familiemedlem har nogle af følgende symptomer, især hvis de er nye, værre eller bekymrer dig:
- tanker om selvmord eller døende
- forsøg på at begå selvmord
- ny eller værre depression
- ny eller værre angst
- føler sig meget ophidset eller rastløs
- Angstanfald
- søvnbesvær (søvnløshed)
- ny eller værre irritabilitet
- opfører sig aggressivt, er vred eller voldelig
- handler på farlige impulser
- en ekstrem stigning i aktivitet og tale (mani)
- andre usædvanlige ændringer i adfærd eller humør
Hvad skal jeg ellers vide om antidepressiv medicin?
- Stop aldrig en antidepressiv medicin uden først at tale med en læge. Hvis du pludselig stopper en antidepressiv medicin, kan det forårsage andre symptomer.
- Antidepressiva er medicin, der bruges til at behandle depression og andre sygdomme. Det er vigtigt at diskutere alle risiciene ved behandling af depression og også risiciene ved ikke at behandle den. Patienter og deres familier eller andre pårørende bør diskutere alle behandlingsvalg med sundhedsudbyderen, ikke kun brugen af antidepressiva.
- Antidepressiv medicin har andre bivirkninger. Tal med lægen om bivirkningerne af den medicin, der er ordineret til dig eller dit familiemedlem.
- Antidepressiv medicin kan interagere med anden medicin. Kend alle de lægemidler, du eller dit familiemedlem tager. Hold en liste over alle lægemidler for at vise sundhedsudbyderen. Start ikke med ny medicin uden først at tjekke med din læge.
- Ikke alle antidepressive lægemidler ordineret til børn er FDA godkendt til brug hos børn. Tal med dit barns sundhedsplejerske for mere information.
Hvad er ABILIFY?
- ABILIFY 20mg orale tabletter, oralt opløselige tabletter og oral opløsning er receptpligtig medicin, der bruges til at behandle:
- Skizofreni
- maniske eller blandede episoder, der sker med bipolar lidelse I
- alvorlig depressiv lidelse (MDD), når ABILIFY 20mg bruges sammen med antidepressiv medicin
- irritabilitet forbundet med autistisk lidelse
- Tourettes lidelse
- ABILIFY Injection er en receptpligtig medicin, der bruges til at behandle:
- agitation forbundet med skizofreni eller bipolar mani
Det vides ikke, om ABILIFY 10mg er sikkert eller effektivt til børn:
- under 13 år med skizofreni
- under 10 år med bipolar lidelse I
- under 6 år med irritabilitet forbundet med autistisk lidelse
- under 6 år med Tourettes lidelse
Tag ikke ABILIFY 20mg, hvis du er allergisk over for aripiprazol eller et af indholdsstofferne i ABILIFY. Se slutningen af denne medicinvejledning for en komplet liste over ingredienser i ABILIFY.
Inden du tager ABILIFY 15mg, skal du fortælle din læge om alle dine medicinske tilstande, inklusive hvis du har eller havde:
- diabetes eller højt blodsukker hos dig eller din familie; din læge bør tjekke dit blodsukker, før du starter ABILIFY 10mg og også under behandlingen.
- kramper (kramper).
- lavt eller højt blodtryk.
- hjerteproblemer eller slagtilfælde.
- graviditet eller planer om at blive gravid. Det vides ikke, om ABILIFY vil skade dit ufødte barn.
- Hvis du bliver gravid, mens du får ABILIFY 10mg, skal du tale med din læge om tilmelding til det nationale graviditetsregister for atypiske antipsykotika. Du kan tilmelde dig ved at ringe til 1-866-961-2388 eller gå til http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
- amning eller planlægger at amme. ABILIFY går over i din modermælk. Tal med din læge om den bedste måde at fodre din baby på, hvis du får ABILIFY.
- lavt antal hvide blodlegemer.
- phenylketonuri. ABILIFY DISCMELT Oralt desintegrerende tabletter indeholder phenylalanin.
Fortæl din læge om al den medicin, du tager, herunder receptpligtig og håndkøbsmedicin, vitaminer og naturlægemidler.
ABILIFY og anden medicin kan påvirke hinanden og forårsage mulige alvorlige bivirkninger. ABILIFY kan påvirke den måde, anden medicin virker på, og anden medicin kan påvirke hvordan ABILIFY virker.
Din læge kan fortælle dig, om det er sikkert at tage ABILIFY sammen med din anden medicin. Du må ikke starte eller stoppe nogen form for medicin, mens du tager ABILIFY uden først at tale med din læge. Kend den medicin du tager. Hold en liste over dine lægemidler for at vise din læge og apotek, når du får en ny medicin.
Hvordan skal jeg tage ABILIFY 20mg?
- Tag ABILIFY 10mg nøjagtigt som din læge fortæller dig at tage det. Du må ikke selv ændre dosis eller stoppe med at tage ABILIFY.
- ABILIFY 20mg kan tages med eller uden mad.
- ABILIFY tabletter skal synkes hele.
- Hvis du glemmer en dosis af ABILIFY 20 mg, skal du tage den glemte dosis, så snart du husker det. Hvis det næsten er tid til den næste dosis, skal du blot springe den glemte dosis over og tage din næste dosis på det normale tidspunkt. Tag ikke to doser ABILIFY 10 mg på samme tid.
- Hvis du har fået ordineret ABILIFY DISCMELT, skal du tage det som følger:
- Åbn ikke blisterpakningen, før du er klar til at tage DISCMELT-tabletten.
- For at fjerne én DISCMELT-tablet skal du åbne pakken og trække folien af på blisterpakningen for at blotlægge tabletten.
- Skub ikke tabletten gennem folien, da dette kan beskadige tabletten.
- Umiddelbart efter åbning af blisterpakningen skal du med tørre hænder fjerne tabletten og placere hele ABILIFY DISCMELT oral disintegrating tablet på tungen.
- Tabletternes opløsning sker hurtigt i spyt. Det anbefales, at ABILIFY 10mg DISCMELT tages uden væske. Men hvis det er nødvendigt, kan det tages med væske.
- Forsøg ikke at opdele DISCMELT-tabletten.
- Hvis du tager for meget ABILIFY, skal du straks ringe til din læge eller giftkontrolcenter på 1-800-222-1222, eller gå til den nærmeste skadestue på hospitalet.
Hvad skal jeg undgå, mens jeg tager ABILIFY 10mg?
- Du må ikke køre bil, betjene tunge maskiner eller udføre andre farlige aktiviteter, før du ved, hvordan ABILIFY 10mg påvirker dig. ABILIFY 20mg kan gøre dig døsig.
- Undgå at blive overophedet eller dehydreret.
- Overmotion ikke.
- I varmt vejr, ophold inde på et køligt sted, hvis det er muligt.
- Hold dig væk fra solen. Brug ikke for meget eller tungt tøj.
- Drik masser af vand.
Hvad er de mulige bivirkninger af ABILIFY?
ABILIFY 10mg kan forårsage alvorlige bivirkninger, herunder:
- Se "Hvad er den vigtigste information, jeg bør vide om ABILIFY 10mg?"
- Slagtilfælde hos ældre mennesker (cerebrovaskulære problemer), der kan føre til døden
- Malignt neuroleptikasyndrom (NMS). Fortæl din læge med det samme, hvis du har nogle eller alle af følgende symptomer: høj feber, stive muskler, forvirring, svedtendens, ændringer i puls, hjertefrekvens og blodtryk. Disse kan være symptomer på en sjælden og alvorlig tilstand, der kan føre til døden. Ring til din læge med det samme, hvis du har nogle af disse symptomer.
- Ukontrollerede kropsbevægelser (tardiv dyskinesi). ABILIFY kan forårsage bevægelser, som du ikke kan kontrollere i dit ansigt, din tunge eller andre kropsdele. Tardiv dyskinesi forsvinder muligvis ikke, selvom du holder op med at få ABILIFY. Tardiv dyskinesi kan også starte, efter du holder op med at tage ABILIFY.
- Problemer med dit stofskifte såsom:
- Højt blodsukker (hyperglykæmi) og diabetes. Blodsukkerstigninger kan forekomme hos nogle mennesker, der tager ABILIFY. Ekstremt højt blodsukker kan føre til koma eller død. Hvis du har diabetes eller risikofaktorer for diabetes (såsom overvægt eller en familiehistorie med diabetes), bør din læge tjekke dit blodsukker, før du starter med ABILIFY og under din behandling.
Ring til din læge, hvis du har nogle af disse symptomer på højt blodsukker, mens du får ABILIFY:
- føler sig meget tørstig
- skal tisse mere end normalt
- føler sig meget sulten
- føler sig svag eller træt
- får ondt i maven
- føler dig forvirret, eller din ånde lugter frugtagtig
- Forhøjede fedtniveauer (kolesterol og triglycerider) i dit blod.
- Vægtøgning. Du og din læge bør tjekke din vægt regelmæssigt.
- Usædvanlige drifter. Nogle mennesker, der tager ABILIFY 15 mg, har haft usædvanlige trang, såsom gambling, overspisning eller spisning, som du ikke kan kontrollere (kompulsiv), shoppingtvang og seksuelle trang. Hvis du eller dine familiemedlemmer bemærker, at du har usædvanlige trang eller adfærd, skal du tale med din læge.
- Ortostatisk hypotension (nedsat blodtryk). Stivhed eller besvimelse kan forekomme, når man rejser sig for hurtigt fra siddende eller liggende stilling.
- Falls. ABILIFY kan gøre dig søvnig eller svimmel, kan forårsage et fald i dit blodtryk, når du skifter stilling og kan bremse din tænkning og motorik, hvilket kan føre til fald, der kan forårsage brud eller andre skader.
- Lavt antal hvide blodlegemer
- Kramper (kramper)
- Problemer med kontrol af din kropstemperatur, især når du træner meget eller er i et område, der er meget varmt. Det er vigtigt for dig at drikke vand for at undgå dehydrering. Se "Hvad skal jeg undgå, mens jeg modtager ABILIFY 15mg?"
- Synkebesvær, der kan få mad eller væske til at komme ned i lungerne.
De mest almindelige bivirkninger af ABILIFY 10mg hos voksne omfatter:
- Kvalme
- svimmelhed
- opkastning
- angst
- forstoppelse
- søvnløshed
- hovedpine
- rastløshed
- sløret syn
- øvre luftvejssygdom
- indre følelse af rastløshed/behov for at bevæge sig (akathisi)
De mest almindelige bivirkninger af ABILIFY hos børn omfatter:
- føler mig træt
- søvnløshed
- hovedpine
- kvalme
- opkastning
- tilstoppet næse
- træthed
- vægtøgning
- øget eller nedsat appetit
- ukontrollerede bevægelser såsom rastløshed, tremor
- øget spyt eller savlen
- muskelstivhed
Disse er ikke alle de mulige bivirkninger af ABILIFY.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare ABILIFY?
- Opbevar ABILIFY 15mg ved stuetemperatur, mellem 68°F til 77°F (20°C til 25°C).
- Åbnede flasker med ABILIFY 10 mg oral opløsning kan bruges i op til 6 måneder efter åbning, men ikke efter udløbsdatoen på flasken.
Opbevar ABILIFY og al medicin utilgængeligt for børn.
Generel information om sikker og effektiv brug af ABILIFY
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en medicinvejledning. Brug ikke ABILIFY 20mg til en tilstand, som den ikke er ordineret til. Giv ikke ABILIFY 20 mg til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem. Du kan bede din sundhedsudbyder eller apotek om oplysninger om ABILIFY 10mg, som er skrevet til sundhedspersonale.
Hvad er ingredienserne i ABILIFY?
Aktiv ingrediens: aripiprazol
Inaktive ingredienser:
majsstivelse, hydroxypropylcellulose, lactosemonohydrat, magnesiumstearat og mikrokrystallinsk cellulose. Farvestoffer omfatter jernoxid (gul eller rød) og FD&C Blue No. 2 Aluminium Lake
ABILIFY 10mg DISCMELT oralt desintegrerende tabletter: acesulfamkalium, aspartam (som indeholder phenylalanin), calciumsilicat, croscarmellosenatrium, crospovidon, crème de vanilla (naturlige og kunstige smagsstoffer), magnesiumstearat, mikrokrystallinsk cellulose, siliciumdioxid, vinsyre og xylitol. Farvestoffer omfatter jernoxid (gul eller rød) og FD&C Blue No. 2 Aluminium Lake
ABILIFY oral opløsning: dinatriumedetat, fructose (200 mg pr. ml), glycerin, dl-mælkesyre, methylparaben, propylenglycol, propylparaben, natriumhydroxid, saccharose (400 mg pr. ml) og renset vand. Den orale opløsning er tilsat naturlig appelsincreme og andre naturlige smagsstoffer
For mere information om ABILIFY, gå til www.abilify.com eller ring på 1-800-438-6055.
Denne medicinvejledning er godkendt af US Food and Drug Administration
