Remeron 15mg, 30mg Mirtazapine Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Remeron, og hvordan bruges det?
Remeron er en receptpligtig medicin, der bruges til at behandle symptomer på depression. Remeron 30mg kan bruges alene eller sammen med anden medicin.
Remeron tilhører en klasse af lægemidler kaldet Antidepressiva, Alpha-2-antagonister; Antidepressiva, Andet.
Det vides ikke, om Remeron 30mg er sikkert og effektivt til børn.
Hvad er de mulige bivirkninger af Remeron 30mg?
Remeron kan forårsage alvorlige bivirkninger, herunder:
- føler sig rastløs,
- race tanker,
- nedsat søvnbehov,
- usædvanlig risikoopførsel,
- følelser af ekstrem lykke eller tristhed,
- være mere snakkesalig end normalt,
- sløret syn,
- tunnelsyn,
- øjensmerter eller hævelse,
- ser glorier omkring lys,
- svimmelhed,
- feber,
- kuldegysninger,
- ondt i halsen,
- sår i munden,
- ændringer i vægt eller appetit,
- alvorligt udslæt, vabler eller hævelse på dine håndflader eller på dine fodsåler,
- kramper (anfald),
- hovedpine,
- forvirring,
- utydelig tale,
- svær svaghed,
- opkastning,
- tab af koordination, og
- føler sig ustabil
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Remeron omfatter:
- døsighed,
- svimmelhed,
- mærkelige drømme,
- tør mund,
- forstoppelse,
- øget appetit, og
- vægtøgning
Fortæl det til din læge, hvis du har en bivirkning, som generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Remeron. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Suicidalitet og antidepressive stoffer
Antidepressiva øgede risikoen sammenlignet med placebo for selvmordstanker og -adfærd (suicidalitet) hos børn, unge og unge voksne i korttidsstudier af svær depressiv lidelse (MDD) og andre psykiatriske lidelser. Enhver, der overvejer at bruge REMERON® (mirtazapin) tabletter eller ethvert andet antidepressivt middel til et barn, en teenager eller en ung voksen, skal balancere denne risiko med det kliniske behov. Korttidsundersøgelser viste ikke en stigning i risikoen for suicidalitet med antidepressiva sammenlignet med placebo hos voksne efter 24 år; der var en reduktion i risikoen med antidepressiva sammenlignet med placebo hos voksne på 65 år og derover. Depression og visse andre psykiatriske lidelser er i sig selv forbundet med øget risiko for selvmord. Patienter i alle aldre, der påbegyndes med antidepressiv behandling, bør overvåges passende og observeres nøje for klinisk forværring, suicidalitet eller usædvanlige ændringer i adfærd. Familier og pårørende bør informeres om behovet for tæt observation og kommunikation med den ordinerende læge. REMERON er ikke godkendt til brug hos pædiatriske patienter. (Se ADVARSLER: Klinisk forværring og selvmordsrisiko, PATIENTINFORMATION og FORHOLDSREGLER: Pædiatrisk brug)
BESKRIVELSE
REMERON® (mirtazapin) tabletter er et oralt indgivet lægemiddel. Mirtazapin har en tetracyklisk kemisk struktur og hører til piperazino-azepingruppen af forbindelser. Det er betegnet 1,2,3,4,10,14b-hexahydro-2-methylpyrazino[2,1-a]pyrido[2,3-c]benzazepin og har den empiriske formel C17H19N3. Dens molekylvægt er 265,36. Strukturformlen er følgende, og det er den racemiske blanding:
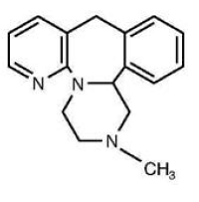
Mirtazapin er et hvidt til cremet hvidt krystallinsk pulver, som er let opløseligt i vand.
REMERON leveres til oral administration som filmovertrukne tabletter med delekærv indeholdende 15 eller 30 mg mirtazapin og filmovertrukne tabletter uden delekærv indeholdende 45 mg mirtazapin. Hver tablet indeholder også majsstivelse, hydroxypropylcellulose, magnesiumstearat, kolloid siliciumdioxid, laktose og andre inaktive ingredienser.
INDIKATIONER
REMERON (mirtazapin) tabletter er indiceret til behandling af svær depressiv lidelse.
Effekten af REMERON til behandling af svær depressiv lidelse blev fastslået i 6-ugers kontrollerede forsøg med ambulante patienter, hvis diagnoser svarede mest til Diagnostic and Statistical Manual of Mental Disorders - 3. udgave (DSM-III) kategori af svær depressiv lidelse (se KLINISK FARMAKOLOGI ).
En svær depressiv episode (DSM-IV) indebærer en fremtrædende og relativt vedvarende (næsten hver dag i mindst 2 uger) deprimeret eller dysforisk stemning, der normalt forstyrrer den daglige funktion, og omfatter mindst 5 af følgende 9 symptomer: deprimeret stemning, tab af interesse for sædvanlige aktiviteter, betydelig ændring i vægt og/eller appetit, søvnløshed eller hypersomni, psykomotorisk agitation eller retardering, øget træthed, skyldfølelse eller værdiløshed, nedsat tænkning eller nedsat koncentration, et selvmordsforsøg eller selvmordstanker.
Effektiviteten af REMERON 15 mg hos indlagte deprimerede patienter er ikke blevet tilstrækkeligt undersøgt.
Effekten af REMERON 15 mg til at opretholde et respons hos patienter med svær depressiv lidelse i op til 40 uger efter 8 til 12 ugers indledende åben behandling blev påvist i et placebokontrolleret forsøg. Ikke desto mindre bør den læge, der vælger at bruge REMERON 15mg i længere perioder, med jævne mellemrum revurdere lægemidlets langsigtede anvendelighed for den enkelte patient (se KLINISK FARMAKOLOGI ).
DOSERING OG ADMINISTRATION
Indledende behandling
Den anbefalede startdosis for REMERON (mirtazapin) tabletter er 15 mg/dag, indgivet i en enkelt dosis, helst om aftenen før du skal sove. I de kontrollerede kliniske undersøgelser, der fastslår effektiviteten af REMERON til behandling af svær depressiv lidelse, var det effektive dosisområde generelt 15 til 45 mg/dag. Mens forholdet mellem dosis og tilfredsstillende respons i behandlingen af svær depressiv lidelse for REMERON 15 mg ikke er blevet tilstrækkeligt undersøgt, kan patienter, der ikke reagerer på den initiale 15 mg dosis, have gavn af dosisforhøjelser op til maksimalt 45 mg/dag. REMERON har en eliminationshalveringstid på ca. 20 til 40 timer; dosisændringer bør derfor ikke foretages med intervaller på mindre end 1 til 2 uger for at give tilstrækkelig tid til evaluering af det terapeutiske respons på en given dosis.
Ældre og patienter med nedsat nyre- eller leverfunktion
Clearance af mirtazapin er reduceret hos ældre patienter og hos patienter med moderat til svært nedsat nyre- eller leverfunktion. Den ordinerende læge bør derfor være opmærksom på, at plasmaniveauer af mirtazapin kan være forhøjede i disse patientgrupper sammenlignet med niveauer observeret hos yngre voksne uden nedsat nyre- eller leverfunktion (se FORHOLDSREGLER og KLINISK FARMAKOLOGI ).
Vedligeholdelse/Udvidet behandling
Der er generelt enighed om, at akutte episoder af depression kræver adskillige måneder eller længere med vedvarende farmakologisk terapi ud over respons på den akutte episode. Systematisk evaluering af REMERON (mirtazapin) tabletter har vist, at dets effektivitet ved svær depressiv lidelse opretholdes i perioder på op til 40 uger efter 8 til 12 ugers indledende behandling med en dosis på 15 til 45 mg/dag (se KLINISK FARMAKOLOGI ). Baseret på disse begrænsede data er det ukendt, om den dosis REMERON 30 mg, der er nødvendig til vedligeholdelsesbehandling, er identisk med den dosis, der er nødvendig for at opnå et initialt respons. Patienter bør periodisk revurderes for at bestemme behovet for vedligeholdelsesbehandling og den passende dosis til en sådan behandling.
At skifte en patient til eller fra en monoaminoxidasehæmmer (MAOI), beregnet til at behandle psykiatriske lidelser
Der bør gå mindst 14 dage mellem seponering af en MAO-hæmmer beregnet til behandling af psykiatriske lidelser og påbegyndelse af behandling med REMERON (mirtazapin) tabletter. Omvendt bør der tillades mindst 14 dage efter ophør med REMERON 30 mg, før man starter en MAO-hæmmer beregnet til behandling af psykiatriske lidelser (se KONTRAINDIKATIONER ).
Brug af REMERON 15mg med andre MAO-hæmmere, såsom linezolid eller methylenblåt
Start ikke REMERON 15 mg hos en patient, der behandles med linezolid eller intravenøs methylenblåt, fordi der er en øget risiko for serotonergt syndrom. Hos en patient, som kræver mere akut behandling af en psykiatrisk tilstand, bør andre indgreb, herunder hospitalsindlæggelse, overvejes (se KONTRAINDIKATIONER ).
nogle tilfælde kan en patient, der allerede er i behandling med REMERON 30 mg, have behov for akut behandling med linezolid eller intravenøs methylenblåt. Hvis acceptable alternativer til linezolid eller intravenøs behandling med methylenblåt ikke er tilgængelige, og de potentielle fordele ved behandling med linezolid eller intravenøs methylenblåt vurderes at opveje risikoen for serotonergt syndrom hos en bestemt patient, skal REMERON 30 mg stoppes omgående, og linezolid eller intravenøs methylen blå kan administreres. Patienten skal overvåges for symptomer på serotonergt syndrom i 2 uger eller indtil 24 timer efter den sidste dosis linezolid eller intravenøs methylenblåt, alt efter hvad der kommer først. Behandling med REMERON 30 mg kan genoptages 24 timer efter den sidste dosis linezolid eller intravenøs methylenblåt (se ADVARSLER ).
Risikoen ved at administrere methylenblåt ad ikke-intravenøse veje (såsom orale tabletter eller ved lokal injektion) eller i intravenøse doser meget lavere end 1 mg/kg med REMERON er uklar. Lægen bør ikke desto mindre være opmærksom på muligheden for opståede symptomer på serotonergt syndrom ved sådan brug (se ADVARSLER ).
Seponering af REMERON-behandling
Symptomer forbundet med seponering eller dosisreduktion af REMERON 15 mg tabletter er blevet rapporteret. Patienter bør overvåges for disse og andre symptomer, når behandlingen seponeres eller under dosisreduktion. En gradvis reduktion af dosis over flere uger, snarere end pludselig ophør, anbefales, når det er muligt. Hvis der opstår uacceptable symptomer efter en reduktion i dosis eller efter seponering af behandlingen, skal dosistitreringen styres på grundlag af patientens kliniske respons (se FORHOLDSREGLER og BIVIRKNINGER ).
Information til patienter
Patienter bør informeres om, at indtagelse af REMERON kan forårsage mild pupiludvidelse, som hos følsomme personer kan føre til en episode med vinkel-lukkende glaukom. Eksisterende glaukom er næsten altid åbenvinklet glaukom, fordi vinkel-lukkende glaukom, når det diagnosticeres, kan behandles definitivt med iridektomi. Åbenvinklet glaukom er ikke en risikofaktor for lukkevinklet glaukom. Patienter kan ønske at blive undersøgt for at afgøre, om de er modtagelige for vinkellukning, og have en profylaktisk procedure (f.eks. iridektomi), hvis de er modtagelige.
HVORDAN LEVERET
REMERON (mirtazapin) tabletter leveres som:
15 mg tabletter - oval, delekærv, gul, belagt, med “Organon” præget på den ene side og “T3Z” på den anden side.
30 flasker NDC 0052-0105-30
30 mg tabletter - oval, ridset, rødbrun, belagt, med "Organon" præget på den ene side og "T5Z" på den anden side.
30 flasker NDC 0052-0107-30
45 mg tabletter - oval, hvid, coated, med "Organon" præget på den ene side og "T7Z" på den anden side.
30 flasker NDC 0052-0109-30
Opbevaring
Opbevares ved 20°C til 25°C (68°F til 77°F); udflugter tilladt til 15°C til 30°C (59°F til 86°F) [se USP kontrolleret rumtemperatur ]. Beskyt mod lys og fugt.
Fremstillet for: Merck Sharp & Dohme Corp., et datterselskab af Merck & Co., Inc., Whitehouse Station, NJ 08889, USA. Fremstillet af: NV Organon, Oss, Holland, et datterselskab af Merck & Co., Inc., Whitehouse Station, NJ 08889, USA. Revideret: juli 2016
BIVIRKNINGER
Forbundet med seponering af behandling
Ca. 16 % af de 453 patienter, der fik REMERON (mirtazapin) tabletter i amerikanske 6-ugers kontrollerede kliniske forsøg, afbrød behandlingen på grund af en uønsket oplevelse, sammenlignet med 7 % af de 361 placebobehandlede patienter i disse undersøgelser. De mest almindelige hændelser (≥ 1%), der er forbundet med seponering og anses for at være lægemiddelrelaterede (dvs. de hændelser, der er forbundet med frafald i en hastighed, der er mindst dobbelt så stor som placebo), er inkluderet i tabel 2.
Almindeligvis observerede bivirkninger i amerikansk kontrollerede kliniske forsøg
De mest almindeligt observerede bivirkninger forbundet med brugen af REMERON (mirtazapin) tabletter (hyppighed på 5 % eller mere) og ikke observeret med en tilsvarende hyppighed blandt placebo-behandlede patienter (REMERON-incidens mindst dobbelt så stor som for placebo) er anført i tabel 3.
Uønskede hændelser, der forekommer med en forekomst på 1 % eller mere blandt REMERON-behandlede patienter
Tabel 4 opregner bivirkninger, der forekom med en incidens på 1 % eller mere, og som var hyppigere end i placebogruppen, blandt REMERON (mirtazapin) tablet-behandlede patienter, som deltog i kortvarige amerikanske placebokontrollerede forsøg, hvor patienter blev doseret i et interval på 5 til 60 mg/dag. Denne tabel viser procentdelen af patienter i hver gruppe, der havde mindst 1 episode af en hændelse på et eller andet tidspunkt under deres behandling. Rapporterede bivirkninger blev klassificeret ved hjælp af en standard COSTART-baseret ordbogsterminologi.
Den ordinerende læge skal være opmærksom på, at disse tal ikke kan bruges til at forudsige forekomsten af bivirkninger i løbet af sædvanlig lægepraksis, hvor patientkarakteristika og andre faktorer afviger fra dem, der var fremherskende i de kliniske forsøg. Tilsvarende kan de nævnte frekvenser ikke sammenlignes med tal opnået fra andre undersøgelser, der involverer forskellige behandlinger, anvendelser og efterforskere. De citerede tal giver imidlertid den ordinerende læge et vist grundlag for at estimere det relative bidrag af lægemidler og ikke-lægemiddelfaktorer til forekomsten af bivirkninger i den undersøgte population.
EKG ændringer
Elektrokardiogrammerne for 338 patienter, der fik REMERON (mirtazapin) tabletter, og 261 patienter, der fik placebo i 6-ugers placebokontrollerede forsøg, blev analyseret. Forlængelse i QTc ≥ 500 msek blev ikke observeret blandt mirtazapin-behandlede patienter; gennemsnitlig ændring i QTc var +1,6 msek for mirtazapin og -3,1 msek for placebo. Mirtazapin var forbundet med en gennemsnitlig stigning i hjertefrekvensen på 3,4 slag/min, sammenlignet med 0,8 slag/min for placebo. Den kliniske betydning af disse ændringer er ukendt.
Effekten af REMERON (mirtazapin) på QTc-intervallet blev vurderet i et klinisk randomiseret forsøg med placebo og positive (moxifloxacin) kontroller, der involverede 54 raske frivillige ved hjælp af eksponeringsresponsanalyse. Dette forsøg viste en positiv sammenhæng mellem mirtazapinkoncentrationer og forlængelse af QTc-intervallet. Graden af QT-forlængelse observeret med både 45 mg (terapeutisk) og 75 mg (supraterapeutisk) doser af mirtazapin var imidlertid ikke på et niveau, der generelt anses for at være klinisk meningsfuldt.
Andre uønskede hændelser observeret under premarketing-evalueringen af REMERON
Under præmarketingvurderingen blev flere doser af REMERON (mirtazapin)-tabletter administreret til 2796 patienter i kliniske undersøgelser. Betingelserne og varigheden af eksponeringen for mirtazapin varierede meget og omfattede (i overlappende kategorier) åbne og dobbeltblindede undersøgelser, ukontrollerede og kontrollerede undersøgelser, indlagte og ambulante undersøgelser, undersøgelser med faste doser og titrering. Uheldige hændelser forbundet med denne eksponering blev registreret af kliniske efterforskere ved hjælp af terminologi efter eget valg. Det er derfor ikke muligt at give et meningsfuldt skøn over andelen af individer, der oplever uønskede hændelser, uden først at gruppere lignende typer af uheldige hændelser i et mindre antal standardiserede hændelseskategorier.
de efterfølgende tabeller blev rapporterede bivirkninger klassificeret ved hjælp af en standard COSTART-baseret ordbogsterminologi. De angivne frekvenser repræsenterer derfor andelen af de 2796 patienter, der blev eksponeret for flere doser REMERON, som oplevede en hændelse af den nævnte type ved mindst 1 lejlighed, mens de fik REMERON. Alle rapporterede hændelser er inkluderet med undtagelse af dem, der allerede er anført i tabel 4, de uønskede oplevelser, der er optaget under COSTART-udtryk, som enten er for generelle eller overdrevent specifikke til at være uinformative, og de hændelser, hvor en lægemiddelårsag var meget fjern.
Det er vigtigt at understrege, at selvom de rapporterede hændelser opstod under behandling med REMERON 30mg, var de ikke nødvendigvis forårsaget af det.
Hændelser er yderligere kategoriseret efter kropssystem og listet i rækkefølge efter faldende frekvens ifølge følgende definitioner: hyppige bivirkninger er dem, der forekommer ved 1 eller flere lejligheder hos mindst 1/100 patienter; sjældne bivirkninger er dem, der forekommer hos 1/100 til 1/1000 patienter; sjældne hændelser er dem, der forekommer hos færre end 1/1000 patienter. Kun de begivenheder, der ikke allerede er opført i tabel 4, vises i denne liste. Hændelser af stor klinisk betydning er også beskrevet i afsnittene ADVARSLER og FORHOLDSREGLER.
Kroppen som helhed: hyppig: utilpashed, mavesmerter, akut abdominal syndrom; sjældent: kulderystelser, feber, ansigtsødem, sår, lysfølsomhedsreaktion, nakkestivhed, nakkesmerter, forstørret mave; sjælden: cellulitis, brystsmerter substernal.
Kardiovaskulære system: hyppig: hypertension, vasodilatation; sjældent: angina pectoris, myokardieinfarkt, bradykardi, ventrikulære ekstrasystoler, synkope, migræne, hypotension; sjælden: atriel arytmi, bigeminy, vaskulær hovedpine, lungeemboli, cerebral iskæmi, kardiomegali, flebitis, venstre hjertesvigt.
Fordøjelsessystemet: hyppig: opkastning, anoreksi; sjældent: udbrud, glossitis, cholecystitis, kvalme og opkastning, tandkødsblødning, stomatitis, colitis, unormale leverfunktionsprøver; sjælden: misfarvning af tungen, ulcerøs stomatitis, spytkirtelforstørrelse, øget spytudskillelse, intestinal obstruktion, pancreatitis, aftøs stomatitis, levercirrhose, gastritis, gastroenteritis, oral moniliasis, tungeødem.
Endokrine system: sjælden: struma, hypothyroidisme.
Hemisk og lymfesystem: sjælden: lymfadenopati, leukopeni, petechia, anæmi, trombocytopeni, lymfocytose, pancytopeni.
Metaboliske og ernæringsforstyrrelser: hyppig: tørst; sjældent: dehydrering, vægttab; sjælden: gigt, øget SGOT, unormal heling, øget syrefosfatase, øget SGPT, diabetes mellitus, hyponatriæmi.
Muskuloskeletale system: hyppige: myasteni, artralgi; sjældent: arthritis, seneskedehindebetændelse; sjælden: patologisk fraktur, osteoporosefraktur, knoglesmerter, myositis, seneruptur, artrose, bursitis.
Nervesystem: hyppige: hypestesi, apati, depression, hypokinesi, vertigo, trækninger, agitation, angst, amnesi, hyperkinesi, paræstesi; sjældent: ataksi, delirium, vrangforestillinger, depersonalisering, dyskinesi, ekstrapyramidalt syndrom, øget libido, unormal koordination, dysartri, hallucinationer, manisk reaktion, neurose, dystoni, fjendtlighed, øgede reflekser, følelsesmæssig labilitet, eufori, paranoid reaktion; sjælden: afasi, nystagmus, akatisi (psykomotorisk rastløshed), stupor, demens, diplopi, lægemiddelafhængighed, lammelse, grand mal-kramper, hypotoni, myoklonus, psykotisk depression, abstinenssyndrom, serotonergt syndrom.
Åndedrætsorganerne: hyppig: øget hoste, bihulebetændelse; sjældent: epistaxis, bronkitis, astma, lungebetændelse; sjælden: asfyksi, laryngitis, pneumothorax, hikke.
Hud og vedhæng: hyppig: kløe, udslæt; sjældent: acne, eksfoliativ dermatitis, tør hud, herpes simplex, alopeci; sjælden: nældefeber, herpes zoster, hudhypertrofi, seborrhea, hudsår.
Særlige sanser: sjældent: øjensmerter, abnormitet af akkommodation, conjunctivitis, døvhed, keratoconjunctivitis, tåreforstyrrelser, vinkel-lukkende glaukom, hyperacusis, øresmerter; sjælden: blepharitis, delvis forbigående døvhed, mellemørebetændelse, smagstab, parosmi.
Urogenital system: hyppig: urinvejsinfektion; sjældent: nyresten, blærebetændelse, dysuri, urininkontinens, urinretention, vaginitis, hæmaturi, brystsmerter, amenoré, dysmenoré, leukoré, impotens; sjælden: polyuri, urethritis, metrorrhagia, menorrhagia, unormal ejakulation, brystprop, brystforstørrelse, urintrang.
Andre uønskede hændelser observeret under postmarketing-evaluering af REMERON
Bivirkninger rapporteret siden markedsintroduktionen, som var tidsmæssigt (men ikke nødvendigvis kausalt) relateret til mirtazapinbehandling, omfatter tilfælde af ventrikulær arytmi Torsades de Pointes. I de fleste af disse tilfælde var samtidig medicin impliceret. Tilfælde af alvorlige hudreaktioner, herunder Stevens-Johnsons syndrom, bulløs dermatitis, erythema multiforme og toksisk epidermal nekrolyse er også blevet rapporteret. Forhøjede kreatinkinase-blodniveauer og rabdomyolyse er også blevet rapporteret.
Stofmisbrug og afhængighed
Klasse kontrolleret stof
REMERON (mirtazapin) Tabletter er ikke et kontrolleret stof.
Fysisk og psykologisk afhængighed
REMERON (mirtazapin) tabletter er ikke blevet systematisk undersøgt hos dyr eller mennesker for dets potentiale for misbrug, tolerance eller fysisk afhængighed. Selvom de kliniske forsøg ikke afslørede nogen tendens til nogen form for lægemiddel-søgende adfærd, var disse observationer ikke systematiske, og det er ikke muligt på baggrund af denne begrænsede erfaring at forudsige, i hvilket omfang et CNS-aktivt lægemiddel vil blive misbrugt, omdirigeret og /eller misbrugt, når den først er markedsført. Patienter bør derfor evalueres omhyggeligt for historie med stofmisbrug, og sådanne patienter bør observeres nøje for tegn på REMERON misbrug eller misbrug (f.eks. udvikling af tolerance, stigninger i dosis, lægemiddelsøgende adfærd).
DRUGSINTERAKTIONER
Som med andre lægemidler er potentialet for interaktion ved en række forskellige mekanismer (f.eks. farmakodynamisk, farmakokinetisk hæmning eller forstærkning osv.) en mulighed (se KLINISK FARMAKOLOGI ).
Monoaminoxidasehæmmere
(Se KONTRAINDIKATIONER , ADVARSLER , og DOSERING OG ADMINISTRATION .)
Serotonerge lægemidler
(Se KONTRAINDIKATIONER og ADVARSLER .)
Lægemidler, der påvirker levermetabolismen
Metabolismen og farmakokinetikken af REMERON (mirtazapin) tabletter kan blive påvirket af induktion eller hæmning af lægemiddelmetaboliserende enzymer.
Lægemidler, der metaboliseres af og/eller hæmmer Cytochrom P450-enzymer
CYP enzyminducere
(disse undersøgelser brugte begge lægemidler ved steady state)
Phenytoin
Hos raske mandlige patienter (n=18) øgede phenytoin (200 mg dagligt) mirtazapin (30 mg dagligt) clearance omkring 2 gange, hvilket resulterede i et fald i den gennemsnitlige plasmakoncentration af mirtazapin på 45 %. Mirtazapin påvirkede ikke phenytoins farmakokinetik signifikant.
Carbamazepin
Hos raske mandlige patienter (n=24) øgede carbamazepin (400 mg to gange dagligt) mirtazapin (15 mg to gange dagligt) clearance omkring 2 gange, hvilket resulterede i et fald i den gennemsnitlige plasmakoncentration af mirtazapin på 60 %.
Når phenytoin, carbamazepin eller en anden inducerer af levermetabolisme (såsom rifampicin) føjes til mirtazapin-behandling, kan det være nødvendigt at øge mirtazapin-dosis. Hvis behandlingen med et sådant lægemiddel seponeres, kan det være nødvendigt at reducere mirtazapin-dosis.
CYP enzymhæmmere
Cimetidin
Hos raske mandlige patienter (n=12), når cimetidin, en svag hæmmer af CYP1A2, CYP2D6 og CYP3A4, givet 800 mg to gange dagligt ved steady state blev administreret sammen med mirtazapin (30 mg dagligt) ved steady state, arealet under kurven (AUC) af mirtazapin steg mere end 50 %. Mirtazapin forårsagede ikke relevante ændringer i cimetidins farmakokinetik. Mirtazapin-dosis skal muligvis reduceres, når samtidig behandling med cimetidin påbegyndes, eller øges, når cimetidinbehandlingen seponeres.
Ketoconazol
Hos raske, mandlige, kaukasiske patienter (n=24), øgede samtidig administration af den potente CYP3A4-hæmmer ketoconazol (200 mg dagligt i 6,5 dage) de maksimale plasmaniveauer og AUC for en enkelt 30 mg dosis mirtazapin med ca. 40 % og 50 %, hhv.
Der bør udvises forsigtighed ved samtidig administration af mirtazapin med potente CYP3A4-hæmmere, HIV-proteasehæmmere, azol-antimykotika, erythromycin eller nefazodon.
Paroxetin
I et in vivo interaktionsstudie med raske patienter med CYP2D6-ekstensiv metabolisering (n=24) forårsagede mirtazapin (30 mg/dag), ved steady state, ikke relevante ændringer i farmakokinetikken af steady state paroxetin (40 mg/dag), en CYP2D6-hæmmer.
Andre lægemiddel-lægemiddelinteraktioner
Amitriptylin
Hos raske patienter med omfattende CYP2D6-metabolisme (n=32) forårsagede amitriptylin (75 mg dagligt) ved steady state ikke relevante ændringer i farmakokinetikken af steady state mirtazapin (30 mg dagligt); mirtazapin forårsagede heller ikke relevante ændringer i farmakokinetikken af amitriptylin.
Warfarin
Hos raske mandlige forsøgspersoner (n=16) forårsagede mirtazapin (30 mg daglig) ved steady state en lille (0,2) men statistisk signifikant stigning i International Normalized Ratio (INR) hos forsøgspersoner behandlet med warfarin. Da en mere udtalt effekt ikke kan udelukkes ved en højere dosis mirtazapin, er det tilrådeligt at overvåge INR i tilfælde af samtidig behandling af warfarin og mirtazapin.
Lithium
Ingen relevante kliniske effekter eller signifikante ændringer i farmakokinetikken er blevet observeret hos raske mandlige forsøgspersoner ved samtidig behandling med subterapeutiske niveauer af lithium (600 mg/dag i 10 dage) ved steady state og en enkelt 30 mg dosis mirtazapin. Effekten af højere doser lithium på mirtazapins farmakokinetik er ukendt.
Risperidon
I et in vivo, ikke-randomiseret interaktionsstudie, viste forsøgspersoner (n=6) med behov for behandling med et antipsykotisk og antidepressivt lægemiddel, at mirtazapin (30 mg dagligt) ved steady state ikke påvirkede farmakokinetikken af risperidon (op til 3 mg). bud).
Alkohol
Samtidig administration af alkohol (svarende til 60 g) havde en minimal effekt på plasmaniveauer af mirtazapin (15 mg) hos 6 raske mandlige forsøgspersoner. Den svækkelse af kognitive og motoriske færdigheder produceret af REMERON viste sig imidlertid at være additiv til dem, der produceres af alkohol. Patienter bør derfor rådes til at undgå alkohol, mens de tager REMERON.
Diazepam
Samtidig administration af diazepam (15 mg) havde en minimal effekt på plasmaniveauer af mirtazapin (15 mg) hos 12 raske forsøgspersoner. Imidlertid har den svækkelse af motoriske færdigheder produceret af REMERON 30mg vist sig at være additiv med dem, der er forårsaget af diazepam. Patienter bør derfor rådes til at undgå diazepam og andre lignende lægemidler, mens de tager REMERON.
QTc-forlængende lægemidler
Risikoen for QT-forlængelse og/eller ventrikulære arytmier (f.eks. Torsades de Pointes) kan øges ved samtidig brug af medicin, der forlænger QTc-intervallet (f.eks. nogle antipsykotika og antibiotika) og i tilfælde af mirtazapin-overdosis (se BIVIRKNINGER og OVERDOSIS afsnit).
ADVARSLER
Klinisk forværring og selvmordsrisiko
Patienter med svær depressiv lidelse (MDD), både voksne og pædiatriske, kan opleve forværring af deres depression og/eller fremkomsten af selvmordstanker og -adfærd (suicidalitet) eller usædvanlige ændringer i adfærd, uanset om de tager antidepressiv medicin eller ej, og dette risikoen kan fortsætte, indtil der indtræffer betydelig remission. Selvmord er en kendt risiko for depression og visse andre psykiatriske lidelser, og disse lidelser er i sig selv de stærkeste forudsigere for selvmord. Der har imidlertid været en langvarig bekymring for, at antidepressiva kan have en rolle i at inducere forværring af depression og fremkomsten af suicidalitet hos visse patienter i de tidlige faser af behandlingen. Samlede analyser af kortvarige placebokontrollerede forsøg med antidepressive lægemidler (SSRI'er og andre) viste, at disse lægemidler øger risikoen for selvmordstanker og -adfærd (suicidalitet) hos børn, unge og unge voksne (i alderen 18-24) med svær depressiv. lidelse (MDD) og andre psykiatriske lidelser. Korttidsundersøgelser viste ikke en stigning i risikoen for suicidalitet med antidepressiva sammenlignet med placebo hos voksne efter 24 år; der var en reduktion i risikoen med antidepressiva sammenlignet med placebo hos voksne på 65 år og derover.
De samlede analyser af placebokontrollerede forsøg med børn og unge med MDD, obsessiv-kompulsiv lidelse (OCD) eller andre psykiatriske lidelser omfattede i alt 24 korttidsforsøg med 9 antidepressive lægemidler hos over 4400 patienter. De samlede analyser af placebokontrollerede forsøg med voksne med MDD eller andre psykiatriske lidelser omfattede i alt 295 korttidsforsøg (median varighed på 2 måneder) med 11 antidepressive lægemidler hos over 77.000 patienter. Der var betydelig variation i risikoen for suicidalitet blandt stoffer, men en tendens til en stigning i de yngre patienter for næsten alle undersøgte stoffer. Der var forskelle i absolut risiko for suicidalitet på tværs af forskellige indikationer, med den højeste forekomst af MDD. Risikoforskellene (lægemiddel vs. placebo) var dog relativt stabile inden for aldersgrupper og på tværs af indikationer. Disse risikoforskelle (lægemiddel-placebo-forskel i antallet af tilfælde af suicidalitet pr. 1000 behandlede patienter) er angivet i tabel 1.
Der forekom ingen selvmord i nogen af de pædiatriske forsøg. Der var selvmord i voksenforsøgene, men antallet var ikke tilstrækkeligt til at nå frem til nogen konklusion om lægemiddeleffekt på selvmord.
Det er uvist, om suicidalitetsrisikoen strækker sig til længerevarende brug, dvs. ud over flere måneder. Der er dog væsentlige beviser fra placebokontrollerede vedligeholdelsesforsøg hos voksne med depression, at brugen af antidepressiva kan forsinke tilbagefald af depression.
Alle patienter, der behandles med antidepressiva for enhver indikation, bør overvåges passende og observeres nøje for klinisk forværring, suicidalitet og usædvanlige ændringer i adfærd, især i løbet af de første par måneder af et lægemiddelbehandlingsforløb, eller i tidspunkter med dosisændringer, enten stigninger eller falder.
Følgende symptomer, angst, agitation, panikanfald, søvnløshed, irritabilitet, fjendtlighed, aggressivitet, impulsivitet, akatisi (psykomotorisk rastløshed), hypomani og mani er blevet rapporteret hos voksne og pædiatriske patienter, der også behandles med antidepressiva mod svær depressiv lidelse. som for andre indikationer, både psykiatriske og ikke-psykiatriske. Selvom der ikke er etableret en årsagssammenhæng mellem fremkomsten af sådanne symptomer og enten forværring af depression og/eller fremkomsten af selvmordsimpulser, er der bekymring for, at sådanne symptomer kan repræsentere forløbere for ny suicidalitet.
Det bør overvejes at ændre det terapeutiske regime, herunder eventuelt seponering af medicinen, hos patienter, hvis depression er vedvarende værre, eller som oplever ny suicidalitet eller symptomer, der kan være forløbere for forværring af depression eller suicidalitet, især hvis disse symptomer er alvorlige, pludselige i debut, eller var ikke en del af patientens tilstedeværende symptomer.
Familier og pårørende til patienter, der behandles med antidepressiva for svær depressiv lidelse eller andre indikationer, både psykiatriske og ikke-psykiatriske, bør advares om behovet for at overvåge patienter for fremkomsten af agitation, irritabilitet, usædvanlige ændringer i adfærd og de andre symptomer beskrevet ovenfor. , samt fremkomsten af suicidalitet, og at rapportere sådanne symptomer øjeblikkeligt til sundhedsudbydere. Sådan overvågning bør omfatte daglig observation af familier og omsorgspersoner. Recepter på REMERON (mirtazapin) Tabletter bør udskrives til den mindste mængde tabletter i overensstemmelse med god patientbehandling for at reducere risikoen for overdosering.
Screening af patienter for bipolar lidelse
En alvorlig depressiv episode kan være den første præsentation af bipolar lidelse. Det antages generelt (dog ikke etableret i kontrollerede forsøg), at behandling af en sådan episode med et antidepressivum alene kan øge sandsynligheden for udfældning af en blandet/manisk episode hos patienter med risiko for bipolar lidelse. Hvorvidt nogen af de ovenfor beskrevne symptomer repræsenterer en sådan omdannelse er ukendt. Inden behandling med et antidepressivum påbegyndes, bør patienter med depressive symptomer dog screenes tilstrækkeligt for at afgøre, om de har risiko for bipolar lidelse; sådan screening bør omfatte en detaljeret psykiatrisk historie, herunder en familiehistorie med selvmord, bipolar lidelse og depression. Det skal bemærkes, at REMERON (mirtazapin) tabletter ikke er godkendt til behandling af bipolar depression.
Agranulocytose
præmarketing kliniske forsøg udviklede 2 (1 med Sjögrens syndrom) ud af 2796 patienter behandlet med REMERON (mirtazapin) tabletter agranulocytose [absolut neutrofiltal (ANC)
Serotonin syndrom
Udviklingen af et potentielt livstruende serotonergt syndrom er blevet rapporteret med SNRI og SSRI, inklusive REMERON 30 mg, alene, men især ved samtidig brug af andre serotonerge lægemidler (inklusive triptaner, tricykliske antidepressiva, fentanyl, lithium, tramadol, tryptofan, buspiron, buspiron, perikon), og med lægemidler, der hæmmer metabolismen af serotonin (især MAO-hæmmere, både dem, der er beregnet til at behandle psykiatriske lidelser og også andre, såsom linezolid og intravenøs methylenblåt).
Symptomer på serotonergt syndrom kan omfatte mentale statusændringer (f.eks. agitation, hallucinationer, delirium og koma), autonom ustabilitet (f.eks. takykardi, labilt blodtryk, svimmelhed, diaforese, rødmen, hypertermi), neuromuskulære symptomer (f.eks. tremor, rigiditet, myoklonus, hyperrefleksi, inkoordination), kramper og/eller gastrointestinale symptomer (f.eks. kvalme, opkastning, diarré). Patienter bør overvåges for forekomsten af serotonergt syndrom.
Samtidig brug af REMERON 15 mg og MAO-hæmmere beregnet til behandling af psykiatriske lidelser er kontraindiceret. REMERON bør heller ikke startes hos en patient, der er i behandling med MAO-hæmmere såsom linezolid eller intravenøs methylenblåt. Alle rapporter med methylenblåt, der gav information om indgivelsesvejen, involverede intravenøs administration i dosisområdet fra 1 mg/kg til 8 mg/kg. Ingen rapporter involverede administration af methylenblåt ad andre veje (såsom orale tabletter eller lokal vævsinjektion) eller ved lavere doser. Der kan være omstændigheder, hvor det er nødvendigt at påbegynde behandling med en MAO-hæmmer såsom linezolid eller intravenøs methylenblåt hos en patient, der tager REMERON. REMERON 15 mg bør seponeres, før behandling med MAO-hæmmere påbegyndes (se KONTRAINDIKATIONER og DOSERING OG ADMINISTRATION ).
Hvis samtidig brug af REMERON 30mg med andre serotonerge lægemidler, inklusive triptaner, tricykliske antidepressiva, fentanyl, lithium, tramadol, buspiron, tryptofan og perikon er klinisk berettiget, skal du være opmærksom på en potentiel øget risiko for serotonergt syndrom, især under behandlingsstart og dosisstigninger.
Behandling med REMERON 30 mg og eventuelle samtidige serotonerge midler skal seponeres øjeblikkeligt, hvis ovennævnte hændelser opstår, og understøttende symptomatisk behandling bør påbegyndes.
Vinkel-lukkende glaukom
Pupiludvidelsen, der opstår efter brug af mange antidepressive lægemidler, herunder REMERON 15 mg, kan udløse et vinkel-lukningsanfald hos en patient med anatomisk snævre vinkler, som ikke har en patenteret iridektomi.
QT-forlængelse og torsades de pointes
Effekten af REMERON (mirtazapin) på QTc-intervallet blev vurderet i et klinisk randomiseret forsøg med placebo og positive (moxifloxacin) kontroller, der involverede 54 raske frivillige ved hjælp af eksponeringsresponsanalyse. Dette forsøg viste en positiv sammenhæng mellem mirtazapinkoncentrationer og forlængelse af QTc-intervallet. Graden af QT-forlængelse observeret med både 45 mg (terapeutisk) og 75 mg (supraterapeutisk) doser af mirtazapin var imidlertid ikke på et niveau, der generelt anses for at være klinisk meningsfuldt. Under postmarketingbrug af mirtazapin er tilfælde af QT-forlængelse, Torsades de Pointes, ventrikulær takykardi og pludselig død blevet rapporteret (se BIVIRKNINGER ). Størstedelen af indberetningerne forekom i forbindelse med overdosering eller hos patienter med andre risikofaktorer for QT-forlængelse, herunder samtidig brug af QTc-forlængende medicin (se DRUGSINTERAKTIONER og OVERDOSIS afsnit). Der bør udvises forsigtighed, når REMERON ordineres til patienter med kendt kardiovaskulær sygdom eller familiehistorie med QT-forlængelse, og ved samtidig brug med andre lægemidler, der menes at forlænge QTc-intervallet.
FORHOLDSREGLER
Generel
Seponeringssymptomer
Der har været rapporter om bivirkninger efter seponering af REMERON (mirtazapin) tabletter (især ved pludselige), herunder men ikke begrænset til følgende: svimmelhed, unormale drømme, føleforstyrrelser (inklusive paræstesi og elektrisk stød), agitation, angst, træthed, forvirring, hovedpine, tremor, kvalme, opkastning og svedtendens eller andre symptomer, som kan være af klinisk betydning. Størstedelen af de rapporterede tilfælde er milde og selvbegrænsende. Selvom disse er blevet rapporteret som bivirkninger, skal det være klart, at disse symptomer kan være relateret til underliggende sygdom.
Patienter, der i øjeblikket tager REMERON, bør IKKE afbryde behandlingen brat på grund af risikoen for seponeringssymptomer. På det tidspunkt, hvor der træffes en medicinsk beslutning om at seponere behandlingen med REMERON, anbefales en gradvis reduktion af dosis i stedet for et brat ophør.
Akatisi/psykomotorisk rastløshed
Brugen af antidepressiva har været forbundet med udviklingen af akatisi, karakteriseret ved en subjektivt ubehagelig eller ubehagelig uro og behov for at bevæge sig, ofte ledsaget af manglende evne til at sidde eller stå stille. Dette vil højst sandsynligt forekomme inden for de første par uger af behandlingen. Hos patienter, som udvikler disse symptomer, kan det være skadeligt at øge dosis.
Hyponatriæmi
Hyponatriæmi er blevet rapporteret meget sjældent ved brug af mirtazapin. Der bør udvises forsigtighed hos patienter i risikogruppen, såsom ældre patienter eller patienter, der samtidig behandles med medicin, der vides at forårsage hyponatriæmi.
Somnolens
amerikansk kontrollerede undersøgelser blev der rapporteret somnolens hos 54 % af patienterne behandlet med REMERON (mirtazapin)-tabletter sammenlignet med 18 % for placebo og 60 % for amitriptylin. I disse undersøgelser resulterede somnolens i seponering for 10,4 % af de REMERON-behandlede patienter sammenlignet med 2,2 % for placebo. Det er uklart, om der udvikles tolerance over for de somnolente virkninger af REMERON. På grund af de potentielt signifikante virkninger af REMERON 30mg på svækkelse af ydeevne, bør patienter advares om at deltage i aktiviteter, der kræver årvågenhed, indtil de har været i stand til at vurdere lægemidlets effekt på deres egen psykomotoriske ydeevne (se PATIENTOPLYSNINGER ).
Svimmelhed
I amerikansk kontrollerede undersøgelser blev svimmelhed rapporteret hos 7 % af patienterne behandlet med REMERON sammenlignet med 3 % for placebo og 14 % for amitriptylin. Det er uklart, om der udvikles tolerance over for den svimmelhed, der observeres i forbindelse med brugen af REMERON.
Øget appetit/vægtøgning
amerikanske kontrollerede undersøgelser blev appetitstigning rapporteret hos 17 % af patienterne behandlet med REMERON 30 mg sammenlignet med 2 % for placebo og 6 % for amitriptylin. I disse samme undersøgelser blev der rapporteret vægtøgning på ≥ 7 % af kropsvægten hos 7,5 % af patienterne behandlet med mirtazapin sammenlignet med 0 % for placebo og 5,9 % for amitriptylin. I en pulje af amerikanske præmarketingundersøgelser, inklusive mange patienter til langvarig, åben behandling, stoppede 8 % af patienterne, der fik REMERON 30 mg, på grund af vægtøgning. I et 8 uger langt pædiatrisk klinisk forsøg med doser mellem 15 og 45 mg/dag havde 49 % af REMERON-behandlede patienter en vægtøgning på mindst 7 % sammenlignet med 5,7 % af placebobehandlede patienter (se FORHOLDSREGLER : Pædiatrisk brug ).
Kolesterol/triglycerider
amerikansk kontrollerede undersøgelser blev ikke-fastende kolesterolstigninger til ≥ 20 % over de øvre normalgrænser observeret hos 15 % af patienterne behandlet med REMERON 30 mg sammenlignet med 7 % for placebo og 8 % for amitriptylin. I disse samme undersøgelser blev der observeret ikke-fastende triglyceridstigninger til ≥ 500 mg/dL hos 6 % af patienterne behandlet med mirtazapin sammenlignet med 3 % for placebo og 3 % for amitriptylin.
Transaminaseforhøjelser
Klinisk signifikante ALAT (SGPT) forhøjelser (≥ 3 gange den øvre grænse for normalområdet) blev observeret hos 2,0 % (8/424) af patienter, der blev eksponeret for REMERON 30 mg i en pulje af kortvarige amerikansk kontrollerede forsøg sammenlignet med 0,3 %. (1/328) af placebopatienter og 2,0 % (3/181) af amitriptylinpatienter. De fleste af disse patienter med ALAT-stigninger udviklede ikke tegn eller symptomer forbundet med kompromitteret leverfunktion. Mens nogle patienter blev seponeret på grund af ALT-stigningerne, vendte enzymniveauerne i andre tilfælde tilbage til normale trods fortsat REMERON-behandling. REMERON bør anvendes med forsigtighed til patienter med nedsat leverfunktion (se KLINISK FARMAKOLOGI og DOSERING OG ADMINISTRATION ).
Aktivering af mani/hypomani
Mani/hypomani forekom hos ca. 0,2 % (3/1299 patienter) af REMERON-behandlede patienter i amerikanske undersøgelser. Selvom forekomsten af mani/hypomani var meget lav under behandling med mirtazapin, bør det anvendes forsigtigt hos patienter med en historie med mani/hypomani.
Anfald
præmarketing kliniske forsøg blev der kun rapporteret 1 anfald blandt de 2796 amerikanske og ikke-amerikanske patienter behandlet med REMERON. Der er dog ikke udført kontrollerede undersøgelser af patienter med anfald i anamnesen. Derfor skal der udvises forsigtighed, når mirtazapin anvendes til disse patienter.
Anvendelse hos patienter med samtidig sygdom
Klinisk erfaring med REMERON hos patienter med samtidig systemisk sygdom er begrænset. Derfor tilrådes omhu ved ordinering af mirtazapin til patienter med sygdomme eller tilstande, der påvirker metabolisme eller hæmodynamiske reaktioner.
REMERON er ikke blevet systematisk evalueret eller brugt i nævneværdigt omfang til patienter med en nylig historie med myokardieinfarkt eller anden signifikant hjertesygdom. REMERON var forbundet med signifikant ortostatisk hypotension i tidlige kliniske farmakologiske forsøg med normale frivillige. Ortostatisk hypotension blev sjældent observeret i kliniske forsøg med deprimerede patienter. REMERON 15mg bør anvendes med forsigtighed til patienter med kendt kardiovaskulær eller cerebrovaskulær sygdom, der kan forværres af hypotension (historie med myokardieinfarkt, angina eller iskæmisk slagtilfælde) og tilstande, der ville disponere patienter for hypotension (dehydrering, hypovolæmi og behandling med antihypertensiva) medicin).
Mirtazapin-clearance er nedsat hos patienter med moderat [glomerulær filtrationshastighed (GFR)=11 - 39 ml/min/1,73 m²] og svær [GFR KLINISK FARMAKOLOGI og DOSERING OG ADMINISTRATION ).
Information til patienter
Ordinerende læger eller andet sundhedspersonale bør informere patienter, deres familier og deres pårørende om fordele og risici forbundet med behandling med REMERON (mirtazapin) tabletter og bør rådgive dem om dens korrekte brug. En patient Medicinvejledning om "Antidepressiv medicin, depression og andre alvorlige psykiske sygdomme og selvmordstanker eller -handlinger" er tilgængelig for REMERON. Den ordinerende læge eller sundhedspersonalet bør instruere patienter, deres familier og deres pårørende i at læse Medicinvejledning og skal hjælpe dem med at forstå indholdet. Patienterne bør have mulighed for at diskutere indholdet af Medicinvejledning og få svar på de spørgsmål, de måtte have. Den fulde tekst af Medicinvejledning er genoptrykt i slutningen af dette dokument.
Patienter skal informeres om følgende problemer og bedes om at advare deres ordinerende læge, hvis disse opstår, mens de tager REMERON.
Klinisk forværring og selvmordsrisiko
Patienter, deres familier og deres pårørende bør opmuntres til at være opmærksomme på fremkomsten af angst, agitation, panikanfald, søvnløshed, irritabilitet, fjendtlighed, aggressivitet, impulsivitet, akatisi (psykomotorisk rastløshed), hypomani, mani, andre usædvanlige ændringer i adfærd. , forværring af depression og selvmordstanker, især tidligt under antidepressiv behandling, og når dosis justeres op eller ned. Familier og pårørende til patienter bør rådes til at se efter forekomsten af sådanne symptomer på daglig basis, da ændringer kan være pludselige. Sådanne symptomer bør indberettes til patientens ordinerende læge eller sundhedspersonale, især hvis de er alvorlige, pludseligt opståede eller ikke var en del af patientens symptomer. Symptomer som disse kan være forbundet med en øget risiko for selvmordstanker og -adfærd og indikerer behov for meget tæt overvågning og muligvis ændringer i medicinen.
Agranulocytose
Patienter, der skal modtage REMERON, skal advares om risikoen for at udvikle agranulocytose. Patienter bør rådes til at kontakte deres læge, hvis de oplever tegn på infektion såsom feber, kulderystelser, ondt i halsen, slimhindesår eller andre mulige tegn på infektion. Der bør lægges særlig vægt på influenzalignende lidelser eller andre symptomer, der kan tyde på infektion.
Interferens med kognitiv og motorisk ydeevne
REMERON 15mg kan svække dømmekraften, tænkningen og især motorikken på grund af dens fremtrædende beroligende effekt. Den døsighed, der er forbundet med brug af mirtazapin, kan svække en patients evne til at køre bil, betjene maskiner eller udføre opgaver, der kræver årvågenhed. Patienter bør derfor advares om at deltage i farlige aktiviteter, indtil de er rimeligt sikre på, at REMERON-behandling ikke påvirker deres evne til at deltage i sådanne aktiviteter negativt.
Gennemførelse af terapiforløb
Selvom patienter kan mærke forbedring med REMERON 15 mg-behandling i løbet af 1 til 4 uger, bør de rådes til at fortsætte behandlingen som anvist.
Samtidig medicinering
Patienter bør rådes til at informere deres læge, hvis de tager eller har til hensigt at tage receptpligtig eller håndkøbsmedicin, da der er mulighed for, at REMERON interagerer med andre lægemidler.
Patienter bør gøres opmærksomme på en potentiel øget risiko for serotonergt syndrom, hvis samtidig brug af REMERON 15mg med andre serotonerge lægemidler, inklusive triptaner, tricykliske antidepressiva, fentanyl, lithium, tramadol, buspiron, tryptofan og perikon er klinisk berettiget, især under behandlingsstart og dosisstigninger.
Alkohol
Den svækkelse af kognitive og motoriske færdigheder produceret af REMERON har vist sig at være additiv til dem som produceres af alkohol. Patienter bør derfor rådes til at undgå alkohol, mens de tager mirtazapin.
Graviditet
Patienter bør rådes til at underrette deres læge, hvis de bliver gravide eller har til hensigt at blive gravide under REMERON-behandling.
Ammende
Patienter bør rådes til at underrette deres læge, hvis de ammer et spædbarn.
Laboratorieprøver
Der anbefales ingen rutinemæssige laboratorietests.
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
Karcinogenicitetsundersøgelser blev udført med mirtazapin givet i kosten i doser på 2, 20 og 200 mg/kg/dag til mus og 2, 20 og 60 mg/kg/dag til rotter. De højeste anvendte doser er ca. 20 og 12 gange den maksimalt anbefalede humane dosis (MRHD) på 45 mg/dag på mg/m²-basis til henholdsvis mus og rotter. Der var en øget forekomst af hepatocellulært adenom og carcinom hos hanmus ved den høje dosis. Hos rotter var der en stigning i hepatocellulært adenom hos hunner ved de mellemste og høje doser og i hepatocellulære tumorer og skjoldbruskkirtelfollikulært adenom/cystadenom og karcinom hos mænd ved den høje dosis. Dataene tyder på, at ovenstående virkninger muligvis kan medieres af ikke-genotoksiske mekanismer, hvis relevans for mennesker ikke er kendt.
Doserne anvendt i museundersøgelsen har muligvis ikke været høje nok til fuldt ud at karakterisere det karcinogene potentiale af REMERON (mirtazapin) tabletter.
Mutagenese
Mirtazapin var ikke mutagent eller klastogent og inducerede ikke generel DNA-skade som bestemt i adskillige genotoksicitetstests: Ames-test, in vitro genmutationsassay i kinesisk hamster V 79-celler, in vitro søsterkromatidudvekslingsassay i dyrkede kaninlymfocytter, in vivo knoglemarv mikronukleustest i rotter og uplanlagt DNA-synteseassay i HeLa-celler.
Forringelse af fertilitet
I et fertilitetsstudie med rotter blev mirtazapin givet i doser på op til 100 mg/kg [20 gange den maksimale anbefalede humane dosis (MRHD) på mg/m-basis]. Parring og undfangelse blev ikke påvirket af lægemidlet, men brunstcyklus blev afbrudt ved doser, der var 3 eller flere gange MRHD, og præimplantationstab forekom ved 20 gange MRHD.
Graviditet
Teratogene virkninger
Graviditetskategori C
Reproduktionsundersøgelser med gravide rotter og kaniner ved doser op til henholdsvis 100 mg/kg og 40 mg/kg [20 og 17 gange den maksimale anbefalede humane dosis (MRHD) på henholdsvis mg/m²-basis] har ikke afsløret tegn på teratogene virkninger. Hos rotter var der dog en stigning i postimplantationstab hos moderdyr behandlet med mirtazapin. Der var en stigning i hvalpedødsfald i løbet af de første 3 dage af diegivningen og et fald i hvalpenes fødselsvægt. Årsagen til disse dødsfald kendes ikke. Virkningerne forekom ved doser, der var 20 gange MRHD, men ikke ved 3 gange MRHD, på en mg/m²-basis. Der er ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder. Da reproduktionsstudier på dyr ikke altid forudsiger human respons, bør dette lægemiddel kun anvendes under graviditet, hvis det er klart nødvendigt.
Ammende mødre
Da nogle REMERON kan udskilles i modermælken, bør der udvises forsigtighed, når REMERON (mirtazapin) tabletter administreres til ammende kvinder.
Pædiatrisk brug
Sikkerhed og effektivitet i den pædiatriske population er ikke blevet fastslået (se KASSET ADVARSEL og ADVARSLER : Klinisk forværring og selvmordsrisiko ). To placebokontrollerede forsøg med 258 pædiatriske patienter med MDD er blevet udført med REMERON (mirtazapin) tabletter, og dataene var ikke tilstrækkelige til at understøtte en påstand om brug til pædiatriske patienter. Enhver, der overvejer at bruge REMERON 30 mg til et barn eller en ung, skal afveje de potentielle risici med det kliniske behov.
I et 8 uger langt pædiatrisk klinisk forsøg med doser mellem 15 og 45 mg/dag havde 49 % af de REMERON-behandlede patienter en vægtøgning på mindst 7 % sammenlignet med 5,7 % af de placebobehandlede patienter. Den gennemsnitlige vægtstigning var 4 kg (2 kg SD) for REMERON-behandlede patienter versus 1 kg (2 kg SD) for placebo-behandlede patienter (se FORHOLDSREGLER : Øget appetit/vægtøgning ).
Geriatrisk brug
Ca. 190 ældre personer (≥ 65 år) deltog i kliniske undersøgelser med REMERON (mirtazapin) tabletter. Dette lægemiddel vides at udskilles væsentligt af nyrerne (75 %), og risikoen for nedsat clearance af dette lægemiddel er større hos patienter med nedsat nyrefunktion. Da ældre patienter er mere tilbøjelige til at have nedsat nyrefunktion, bør der udvises forsigtighed ved dosisvalg. Sederende medicin kan forårsage forvirring og over-sedation hos ældre. Ingen usædvanlige uønskede aldersrelaterede fænomener blev identificeret i denne gruppe. Farmakokinetiske undersøgelser viste en nedsat clearance hos ældre. Der skal udvises forsigtighed ved administration af REMERON til ældre patienter (se KLINISK FARMAKOLOGI og DOSERING OG ADMINISTRATION ).
OVERDOSIS
Menneskelig oplevelse
Der er meget begrænset erfaring med overdosering af REMERON (mirtazapin) tabletter. I præmarketing kliniske undersøgelser var der 8 rapporter om REMERON-overdosis alene eller i kombination med andre farmakologiske midler. Den eneste overdosisdødsfald, der blev rapporteret under behandling med REMERON, var i kombination med amitriptylin og chlorprothixen i et ikke-amerikansk klinisk studie. Baseret på plasmaniveauer var REMERON 15 mg-dosis 30 til 45 mg, mens plasmaniveauer af amitriptylin og chlorprothixen viste sig at være på toksiske niveauer. Alle andre tilfælde af overdosering før markedsføring resulterede i fuld bedring. Tegn og symptomer rapporteret i forbindelse med overdosering omfattede desorientering, døsighed, nedsat hukommelse og takykardi. Der var ingen rapporter om EKG-abnormiteter, koma eller kramper efter overdosering med REMERON alene.
Baseret på rapporter efter markedsføring er der dog en mulighed for mere alvorlige udfald (inklusive dødsfald) ved doser, der er meget højere end den terapeutiske dosis, især ved blandede overdoser. I disse tilfælde er QT-forlængelse og Torsades de Pointes også blevet rapporteret (se DRUGSINTERAKTIONER og BIVIRKNINGER afsnit).
Overdosishåndtering
Behandlingen bør bestå af de generelle foranstaltninger, der anvendes til håndtering af overdosering med et hvilket som helst lægemiddel, der er effektivt til behandling af svær depressiv lidelse. Sørg for en tilstrækkelig luftvej, iltning og ventilation. Overvåg EKG-parametre (inklusive hjerterytme) og vitale tegn. Generelle støttende og symptomatiske foranstaltninger anbefales også. Induktion af emesis anbefales ikke. Maveskylning med en orogastrisk sonde med stor boring med passende luftvejsbeskyttelse, hvis det er nødvendigt, kan være indiceret, hvis det udføres kort efter indtagelse, eller hos symptomatiske patienter. Aktivt kul bør administreres. Der er ingen erfaring med brug af tvungen diurese, dialyse, hæoperfusion eller udvekslingstransfusion til behandling af mirtazapin overdosering. Der kendes ingen specifikke modgift til mirtazapin.
Ved håndtering af overdosering skal du overveje muligheden for involvering af flere lægemidler. Lægen bør overveje at kontakte et giftkontrolcenter for yderligere information om behandling af enhver overdosis. Telefonnumre til certificerede giftkontrolcentre er angivet i Physicians' Desk Reference (PDR).
KONTRAINDIKATIONER
Overfølsomhed
REMERON (mirtazapin) tabletter er kontraindiceret til patienter med kendt overfølsomhed over for mirtazapin eller over for et eller flere af hjælpestofferne.
Monoaminoxidasehæmmere
Brugen af monoaminoxidasehæmmere (MAO-hæmmere) beregnet til behandling af psykiatriske lidelser med REMERON 15 mg tabletter eller inden for 14 dage efter ophør af behandling med REMERON 15 mg er kontraindiceret på grund af en øget risiko for serotonergt syndrom. Brugen af REMERON 15 mg inden for 14 dage efter ophør med en MAO-hæmmer beregnet til behandling af psykiatriske lidelser er også kontraindiceret (se ADVARSLER og DOSERING OG ADMINISTRATION ).
Start af REMERON hos en patient, der er i behandling med MAO-hæmmere såsom linezolid eller intravenøs methylenblåt, er også kontraindiceret på grund af en øget risiko for serotonergt syndrom (se ADVARSLER og DOSERING OG ADMINISTRATION ).
KLINISK FARMAKOLOGI
Farmakodynamik
Virkningsmekanismen af REMERON (mirtazapin) tabletter, som med andre lægemidler, der er effektive til behandling af svær depressiv lidelse, er ukendt.
Evidens indsamlet i prækliniske undersøgelser tyder på, at mirtazapin øger central noradrenerg og serotonerg aktivitet. Disse undersøgelser har vist, at mirtazapin virker som en antagonist ved centrale præsynaptiske α2-adrenerge inhiberende autoreceptorer og heteroreceptorer, en virkning, der postuleres at resultere i en stigning i central noradrenerg og serotonerg aktivitet.
Mirtazapin er en potent antagonist af 5-HT2- og 5-HT3-receptorer. Mirtazapin har ingen signifikant affinitet for 5-HT1A- og 5-HT1B-receptorerne.
Mirtazapin er en potent antagonist af histamin (H1) receptorer, en egenskab, der kan forklare dets fremtrædende beroligende virkning.
Mirtazapin er en moderat perifer α-adrenerg antagonist, en egenskab, der kan forklare den lejlighedsvise ortostatiske hypotension, der er rapporteret i forbindelse med dets brug.
Mirtazapin er en moderat antagonist af muskarine receptorer, en egenskab, der kan forklare den relativt lave forekomst af antikolinerge bivirkninger forbundet med dets brug.
Farmakokinetik
REMERON (mirtazapin) tabletter absorberes hurtigt og fuldstændigt efter oral administration og har en halveringstid på ca. 20 til 40 timer. Maksimal plasmakoncentration nås inden for ca. 2 timer efter en oral dosis. Tilstedeværelsen af mad i maven har en minimal effekt på både hastigheden og omfanget af absorption og kræver ikke en dosisjustering.
Mirtazapin metaboliseres i vid udstrækning efter oral administration. De vigtigste biotransformationsveje er demethylering og hydroxylering efterfulgt af glucuronidkonjugering. In vitro-data fra humane levermikrosomer indikerer, at cytochrom 2D6 og 1A2 er involveret i dannelsen af 8-hydroxymetabolitten af mirtazapin, hvorimod cytochrom 3A anses for at være ansvarlig for dannelsen af N-desmethyl- og N-oxidmetabolitten. Mirtazapin har en absolut biotilgængelighed på omkring 50 %. Det elimineres overvejende via urin (75%) med 15% i fæces. Adskillige ukonjugerede metabolitter har farmakologisk aktivitet, men er til stede i plasmaet i meget lave niveauer. (-)-enantiomeren har en eliminationshalveringstid, der er ca. dobbelt så lang som (+)-enantiomeren og opnår derfor plasmaniveauer, der er ca. 3 gange så høje som (+)-enantiomerens.
Plasmaniveauer er lineært relateret til dosis over et dosisområde på 15 til 80 mg. Den gennemsnitlige halveringstid for mirtazapin efter oral administration varierer fra ca. 20 til 40 timer på tværs af alders- og kønsundergrupper, hvor kvinder i alle aldre udviser signifikant længere eliminationshalveringstid end mænd (gennemsnitlig halveringstid på 37 timer for kvinder vs. 26 timer). for mænd). Steady state plasmaniveauer af mirtazapin opnås inden for 5 dage med ca. 50 % akkumulering (akkumulationsforhold = 1,5).
Mirtazapin er ca. 85 % bundet til plasmaproteiner over et koncentrationsområde på 0,01 til 10 mcg/ml.
Særlige Populationer
Geriatrisk
Efter oral administration af REMERON (mirtazapin) tabletter 20 mg/dag i 7 dage til forsøgspersoner i varierende aldre (interval, 25 - 74), var oral clearance af mirtazapin reduceret hos ældre sammenlignet med de yngre forsøgspersoner. Forskellene var mest slående hos mænd med en 40 % lavere clearance hos ældre mænd sammenlignet med yngre mænd, mens clearance hos ældre kvinder kun var 10 % lavere sammenlignet med yngre kvinder. Der skal udvises forsigtighed ved administration af REMERON 30 mg til ældre patienter (se FORHOLDSREGLER og DOSERING OG ADMINISTRATION ).
Pædiatri
Sikkerhed og effektivitet af mirtazapin i den pædiatriske population er ikke blevet fastlagt (se FORHOLDSREGLER ).
Køn
Den gennemsnitlige eliminationshalveringstid for mirtazapin efter oral administration varierer fra ca. 20 til 40 timer på tværs af alders- og kønsundergrupper, hvor kvinder i alle aldre udviser signifikant længere eliminationshalveringstid end mænd (gennemsnitlig halveringstid på 37 timer for kvinder vs. 26 timer for mænd) (se Farmakokinetik ).
Race
Der har ikke været nogen kliniske undersøgelser til at evaluere effekten af race på farmakokinetikken af REMERON.
Nyreinsufficiens
Disponeringen af mirtazapin blev undersøgt hos patienter med varierende grader af nyrefunktion. Elimination af mirtazapin er korreleret med kreatininclearance. Total kropsclearance af mirtazapin blev reduceret med ca. 30 % hos patienter med moderat (Clcr=11 - 39 ml/min/1,73 m²) og ca. 50 % hos patienter med svær (Clcr= FORHOLDSREGLER og DOSERING OG ADMINISTRATION ).
Leverinsufficiens
Efter en enkelt 15 mg oral dosis af REMERON blev den orale clearance af mirtazapin reduceret med ca. 30 % hos patienter med nedsat leverfunktion sammenlignet med personer med normal leverfunktion. Der bør udvises forsigtighed ved administration af REMERON til patienter med kompromitteret leverfunktion (se FORHOLDSREGLER og DOSERING OG ADMINISTRATION ).
Kliniske forsøg, der viser effektivitet
Effekten af REMERON (mirtazapin) tabletter som behandling af svær depressiv lidelse blev fastslået i 4 placebokontrollerede, 6-ugers forsøg med voksne ambulante patienter, der opfylder DSM-III-kriterierne for svær depressiv lidelse. Patienterne blev titreret med mirtazapin fra et dosisområde på 5 mg op til 35 mg/dag. Samlet set viste disse undersøgelser, at mirtazapin er overlegen i forhold til placebo på mindst 3 af følgende 4 mål: 21-Item Hamilton Depression Rating Scale (HDRS) total score; HDRS deprimeret humør Genstand; CGI Alvorlighedsscore; og Montgomery og Asberg Depression Rating Scale (MADRS). Mirtazapins overlegenhed i forhold til placebo blev også fundet for visse faktorer af HDRS, herunder angst/somatiseringsfaktor og søvnforstyrrelsesfaktor. Den gennemsnitlige mirtazapindosis for patienter, der fuldførte disse 4 undersøgelser, varierede fra 21 til 32 mg/dag. En femte undersøgelse af lignende design brugte en højere dosis (op til 50 mg) om dagen og viste også effektivitet.
Undersøgelse af alder og køn undergrupper af befolkningen afslørede ikke nogen differentiel respons på basis af disse undergrupperinger.
I et længerevarende studie blev patienter, der opfyldte (DSM-IV) kriterier for svær depressiv lidelse, og som havde reageret under de første 8 til 12 ugers akut behandling med REMERON 30 mg randomiseret til fortsættelse af REMERON 15 mg eller placebo i op til 40 ugers behandling. observation for tilbagefald. Respons under den åbne fase blev defineret som at have opnået en HAM-D 17 total score på ≤ 8 og en CGI-forbedringsscore på 1 eller 2 ved 2 på hinanden følgende besøg begyndende med uge 6 af de 8 til 12 uger i den åbne fase. af undersøgelsen. Tilbagefald under den dobbeltblinde fase blev bestemt af de individuelle efterforskere. Patienter, der fik fortsat REMERON 30 mg-behandling, oplevede signifikant lavere tilbagefaldsrater over de efterfølgende 40 uger sammenlignet med dem, der fik placebo. Dette mønster blev påvist hos både mandlige og kvindelige patienter.
PATIENTOPLYSNINGER
REMERON® (rem' - e - ron) (mirtazapin) Tabletter
Hvad er den vigtigste information, jeg bør vide om REMERON®?
REMERON 15mg og anden antidepressiv medicin kan forårsage alvorlige bivirkninger, herunder:
1. Selvmordstanker eller -handlinger:
- REMERON 30mg og andre antidepressive lægemidler kan øge selvmordstanker eller -handlinger hos nogle børn, teenagere eller unge voksne inden for de første måneder af behandlingen, eller når dosis ændres.
- Depression eller andre alvorlige psykiske sygdomme er de vigtigste årsager til selvmordstanker eller -handlinger.
- Hold øje med disse ændringer, og ring til din læge med det samme, hvis du bemærker:
- Nye eller pludselige ændringer i humør, adfærd, handlinger, tanker eller følelser, især hvis de er alvorlige.
- Vær særlig opmærksom på sådanne ændringer, når REMERON startes, eller når dosis ændres.
Hold alle opfølgningsbesøg hos din læge, og ring mellem besøgene, hvis du er bekymret for symptomer.
Ring til din læge med det samme, hvis du har nogle af følgende symptomer, eller ring til 911, hvis en nødsituation, især hvis de er nye, værre eller bekymrer dig:
- forsøg på at begå selvmord
- handler på farlige impulser
- opfører sig aggressivt eller voldeligt
- tanker om selvmord eller døende
- ny eller værre depression
- nye eller værre angst- eller panikanfald
- føler sig ophidset, rastløs, vred eller irritabel
- problemer med at sove
- øget aktivitet eller tale mere end hvad der er normalt for dig
- andre usædvanlige ændringer i adfærd eller humør
Ring til din læge med det samme, hvis du har nogle af følgende symptomer, eller ring til 911, hvis en nødsituation. REMERON kan være forbundet med disse alvorlige bivirkninger:
2. Maniske episoder:
- stærkt øget energi
- hensynsløs opførsel
- taler mere eller hurtigere end normalt
- svære søvnbesvær
- usædvanligt store ideer
- race tanker
- overdreven lykke eller irritabilitet
3. Nedsat hvide blodlegemer kaldet neutrofiler, som er nødvendige for at bekæmpe infektioner. Fortæl det til din læge, hvis du har tegn på infektion såsom feber, kulderystelser, ondt i halsen eller mund- eller næsesår, især symptomer som er influenzalignende.
4. Serotoninsyndrom. Denne tilstand kan være livstruende og kan omfatte:
- agitation, hallucinationer, koma eller andre ændringer i mental status
- hjerteslag, højt eller lavt blodtryk
- kvalme, opkastning eller diarré
- koordinationsproblemer eller muskeltrækninger (overaktive reflekser)
- svedtendens eller feber
- muskelstivhed
5. Visuelle problemer
- øjensmerter
- ændringer i synet
- hævelse eller rødme i eller omkring øjet
Kun nogle mennesker er i fare for disse problemer. Det kan være en god idé at gennemgå en øjenundersøgelse for at se, om du er i fare, og få forebyggende behandling, hvis du er det.
6. Anfald
7. Lavt saltniveau (natrium) i blodet.
Ældre mennesker kan have større risiko for dette. Symptomer kan omfatte:
- hovedpine
- forvirring, problemer med at koncentrere sig eller tænke eller hukommelsesproblemer
- svaghed eller følelse ustabil
8. Søvnighed. Det er bedst at tage REMERON tæt på sengetid.
9. Alvorlige hudreaktioner: Ring til din læge med det samme, hvis du har nogen eller alle af følgende symptomer:
- alvorligt udslæt med hævelse af huden (inklusive på håndflader og fodsåler)
- smertefuld rødmen af huden, vabler eller sår på kroppen eller i munden
10. Alvorlige allergiske reaktioner: åndedrætsbesvær, hævelse af ansigt, tunge, øjne eller mund
- udslæt, kløende nældefeber (nældefeber) eller vabler, alene eller med feber eller ledsmerter
11. Stigning i appetit eller vægt. Børn og unge bør have højde og vægt overvåget under behandlingen.
12. Forhøjede kolesterol- og triglyceridniveauer i dit blod
Slip ikke REMERON 15mg uden først at tale med din læge. Hvis du stopper REMERON 15mg for hurtigt, kan det forårsage potentielt alvorlige symptomer, herunder:
- svimmelhed
- træthed
- prikkende fornemmelse
- unormale drømme
- forvirring
- kvalme, opkastning
- agitation
- hovedpine
- svedtendens
- angst
- ryster
Hvad er REMERON 15mg?
REMERON 15mg er en receptpligtig medicin, der bruges til at behandle depression. Det er vigtigt at tale med din sundhedsplejerske om risikoen ved at behandle depression og også risikoen ved ikke at behandle den. Du bør diskutere alle behandlingsvalg med din læge.
Tal med din læge, hvis du ikke mener, at din tilstand bliver bedre med REMERON-behandling.
Hvem bør ikke tage REMERON 15mg?
Tag ikke REMERON:
- hvis du er allergisk over for mirtazapin eller et af indholdsstofferne i REMERON. Se slutningen af denne medicinvejledning for en komplet liste over ingredienser i REMERON.
- hvis du tager en monoaminoxidasehæmmer (MAO-hæmmer). Spørg din læge eller apotekspersonalet, hvis du ikke er sikker på, om du tager en MAO-hæmmer, inklusive antibiotikummet linezolid.
- Tag ikke en MAO-hæmmer inden for 2 uger efter at du er stoppet med REMERON, medmindre din læge har bedt det om det.
- Start ikke REMERON, hvis du stoppede med at tage en MAO-hæmmer inden for de sidste 2 uger, medmindre din læge har bedt dig om det.
Personer, der tager REMERON 15mg tæt på en MAO-hæmmer, kan have alvorlige eller endda livstruende bivirkninger. Få lægehjælp med det samme, hvis du har nogle af disse symptomer:
- høj feber
- hurtige ændringer i hjertefrekvens eller blodtryk
- ukontrollerede muskelspasmer
- forvirring
- stive muskler
- tab af bevidsthed (besvimelse)
Hvad skal jeg fortælle min læge, før jeg tager REMERON?
Inden du tager REMERON, skal du fortælle din læge om alle dine medicinske tilstande, inklusive hvis du:
- tager visse lægemidler såsom:
- Triptaner bruges til at behandle migrænehovedpine
- Medicin, der bruges til at behandle humør, angst, psykotiske eller tankeforstyrrelser, herunder tricykliske, lithium, SSRI'er, SNRI'er eller antipsykotika
- Tramadol bruges til at behandle smerter
- Håndkøbs-tilskud som tryptofan eller perikon
- Phenytoin, carbamazepin eller rifampicin (disse lægemidler kan nedsætte dit blodniveau af REMERON)
- Cimetidin eller ketoconazol (disse lægemidler kan øge dit blodniveau af REMERON)
- Medicin, der kan påvirke dit hjertes rytme (såsom visse antibiotika og nogle antipsykotika)
- har eller haft:
- leverproblemer
- nyreproblemer
- hjerteproblemer eller visse tilstande, der kan ændre din hjerterytme
- anfald eller kramper
- bipolar lidelse eller mani
- en tendens til at blive svimmel eller besvime
- er gravid eller planlægger at blive gravid. Det vides ikke, om REMERON vil skade dit ufødte barn. Tal med din læge om fordelene og risiciene ved behandling af depression under graviditet
- ammer eller planlægger at amme. Nogle REMERON kan passere over i din modermælk. Tal med din læge om den bedste måde at fodre din baby på, mens du tager REMERON
Fortæl din læge om al den medicin, du tager, herunder receptpligtig og håndkøbsmedicin, vitaminer og naturlægemidler. REMERON og nogle lægemidler kan interagere med hinanden, virker muligvis ikke så godt eller kan forårsage alvorlige bivirkninger.
Din læge eller apotek kan fortælle dig, om det er sikkert at tage REMERON 15mg sammen med din anden medicin. Du må ikke starte eller stoppe nogen form for medicin, mens du tager REMERON uden først at tale med din læge. Hvis du tager REMERON 30mg, bør du ikke tage anden medicin, der indeholder mirtazapin, inklusive REMERON 30mgSolTab®.
Hvordan skal jeg tage REMERON?
- Tag REMERON nøjagtigt som foreskrevet. Din sundhedsplejerske skal muligvis ændre dosis af REMERON 15 mg, indtil det er den rigtige dosis for dig.
- Tag REMERON på samme tidspunkt hver dag, helst om aftenen ved sengetid.
- Synk REMERON 15mg som anvist.
- Det er almindeligt, at antidepressiv medicin som REMERON tager op til et par uger, før du begynder at få det bedre. Stop ikke med at tage REMERON 15mg, hvis du ikke mærker resultater med det samme.
- Du må ikke stoppe med at tage eller ændre dosis af REMERON 15 mg uden først at tale med din læge, heller ikke selvom du har det bedre.
- REMERON kan tages med eller uden mad.
- Hvis du glemmer en dosis af REMERON 30 mg, skal du tage den glemte dosis, så snart du husker det. Hvis det næsten er tid til næste dosis, skal du springe den glemte dosis over og tage din næste dosis på det normale tidspunkt. Tag ikke to doser REMERON 15 mg på samme tid.
- Hvis du tager for meget REMERON 15mg, ring med det samme til din sundhedsudbyder eller giftkontrolcenter, eller få akut behandling. Tegnene på en overdosis af REMERON (uden anden medicin eller alkohol) omfatter:
- forvirring,
- hukommelsesproblemer
- døsighed
- øget puls.
Symptomerne på en mulig overdosis kan omfatte ændringer i din hjerterytme (hurtig, uregelmæssig hjerterytme) eller besvimelse, som kan være symptomer på en livstruende tilstand kendt som Torsades de Pointes.
Hvad skal jeg undgå, mens jeg tager REMERON 15mg?
- REMERON kan forårsage søvnighed eller kan påvirke din evne til at træffe beslutninger, tænke klart eller reagere hurtigt. Du bør ikke køre bil, betjene tunge maskiner eller udføre andre farlige aktiviteter, før du ved, hvordan REMERON påvirker dig.
- Undgå at drikke alkohol eller tage diazepam (en medicin, der f.eks. bruges mod angst, søvnløshed og anfald) eller lignende medicin, mens du tager REMERON. Hvis du er usikker på, om bestemt medicin kan tages sammen med REMERON 30mg, skal du tale med din læge.
Hvad er de mulige bivirkninger af REMERON?
REMERON kan forårsage alvorlige bivirkninger:
- Se "Hvad er den vigtigste information, jeg bør vide om REMERON?"
De mest almindelige bivirkninger af REMERON omfatter:
- søvnighed
- forstoppelse
- øget appetit
- svimmelhed
- vægtøgning
- mundtørhed unormale drømme
Disse er ikke alle de mulige bivirkninger af REMERON.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg rive REMERON?
- Opbevar REMERON 15mg ved stuetemperatur mellem 68°F til 77°F (20°C til 25°C).
- Hold REMERON 15 mg væk fra lys.
- Hold REMERON 30mg flasken tæt lukket.
Opbevar REMERON 30mg og al medicin utilgængeligt for børn.
Generel information om sikker og effektiv brug af REMERON.
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en medicinvejledning. Brug ikke REMERON 15mg til en tilstand, som det ikke er ordineret til. Giv ikke REMERON til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem. Du kan bede din apoteker eller sundhedsudbyder om oplysninger om REMERON 30mg, der er skrevet til sundhedspersonale.
Hvad er ingredienserne i REMERON 15mg?
Aktiv ingrediens: mirtazapin
Inaktive ingredienser :
- 15 mg tabletter: Stivelse (majs), hydroxypropylcellulose, magnesiumstearat, kolloid siliciumdioxid, lactose, hypromellose, polyethylenglycol 8000, titaniumdioxid, ferrioxid (gul).
- 30 mg tabletter: Stivelse (majs), hydroxypropylcellulose, magnesiumstearat, kolloid siliciumdioxid, lactose, hypromellose, polyethylenglycol 8000, titaniumdioxid, ferrioxid (gul), ferrioxid (rød).
- 45 mg tabletter: Stivelse (majs), hydroxypropylcellulose, magnesiumstearat, kolloid siliciumdioxid, lactose, hypromellose, polyethylenglycol 8000, titaniumdioxid.
