Geodon 40mg, 80mg, 20mg Ziprasidone Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Geodon, og hvordan bruges det?
Geodon er en receptpligtig medicin, der bruges til at behandle symptomerne på skizofreni, akut agitation med skizofreni og bipolar I-lidelse. Geodon kan bruges alene eller sammen med anden medicin.
Geodon 20mg tilhører en klasse af medicin kaldet antipsykotika.
Det vides ikke, om Geodon er sikkert og effektivt til børn.
Hvad er mulige bivirkninger af Geodon?
Geodon 20mg kan forårsage alvorlige bivirkninger, herunder:
- hurtige eller bankende hjerteslag,
- flagrende i dit bryst,
- stakåndet,
- pludselig svimmelhed,
- ukontrollerede muskelbevægelser i dit ansigt (tygge, læbesmaske, rynke panden, tungebevægelse, blinke eller øjenbevægelser),
- ethvert hududslæt,
- feber,
- sår i munden,
- hudsår,
- ondt i halsen,
- hoste,
- vejrtrækningsbesvær,
- øget tørst,
- øget vandladning
- tør mund,
- frugtig ånde lugt,
- meget stive muskler,
- høj feber,
- svedeture,
- agitation, og
- forvirring
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Geodon 40mg omfatter:
- svimmelhed,
- døsighed,
- svaghed,
- kvalme,
- opkastning,
- synkebesvær,
- føler sig rastløs,
- rystelser,
- synsproblemer,
- løbende næse, og
- ny eller forværret hoste
Fortæl det til din læge, hvis du har en bivirkning, som generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Prometrium. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
ØGET DØDELIGHED HOS ÆLDRE PATIENTER MED DEMENSREATERET PSYKOSE
Ældre patienter med demensrelateret psykose behandlet med antipsykotiske lægemidler har en øget risiko for at dø. GEODON er ikke godkendt til behandling af demensrelateret psykose [se ADVARSLER OG FORHOLDSREGLER].
BESKRIVELSE
GEODON 40mg fås som kapsler (ziprasidonhydrochlorid) til oral administration og som en injektion (ziprasidonmesylat) kun til intramuskulær brug. Ziprasidon er et psykotropt middel, der ikke er kemisk relateret til phenothiazin eller butyrophenon antipsykotiske midler. Det har en molekylvægt på 412,94 (fri base) med følgende kemiske navn: 5-[2-[4-(1,2-benzisothiazol-3-yl)-1-piperazinyl]ethyl]-6-chlor-1 ,3-dihydro-2H-indol-2-on. Den empiriske formel for C21H21ClN4OS (fri base af ziprasidon) repræsenterer følgende strukturformel:
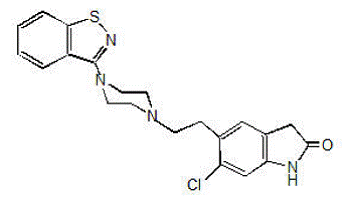
GEODON kapsler indeholder et monohydrochlorid, monohydratsalt af ziprasidon. Kemisk set er ziprasidonhydrochloridmonohydrat 5-[2-[4-(1,2-benzisothiazol-3-yl)-1-piperazinyl]ethyl]-6-chlor-1,3-dihydro-2H-indol-2-on monohydrochlorid, monohydrat. Den empiriske formel er C21H21ClN4OS• HCl• H2O og dens molekylvægt er 467,42. Ziprasidonhydrochloridmonohydrat er et hvidt til let lyserødt pulver.
GEODON 20 mg kapsler leveres til oral administration i 20 mg (blå/hvide), 40 mg (blå/blå), 60 mg (hvide/hvide) og 80 mg (blå/hvide) kapsler. GEODON 40mg kapsler indeholder ziprasidonhydrochloridmonohydrat, lactose, prægelatineret stivelse og magnesiumstearat.
GEODON til injektion indeholder en lyofiliseret form af ziprasidonmesylattrihydrat. Kemisk set er ziprasidonmesylattrihydrat 5-[2-[4-(1,2-benzisothiazol-3-yl)-1-piperazinyl]ethyl]-6-chlor-1,3-dihydro-2H-indol-2-on methansulfonat, trihydrat. Den empiriske formel er C21H21ClN4OS • CH3SO3H • 3H2O og dens molekylvægt er 563,09.
GEODON 40 mg til injektion er tilgængelig i et enkeltdosis hætteglas som ziprasidonmesylat (20 mg ziprasidon/ml, når det er rekonstitueret i henhold til etikettens instruktioner) [se DOSERING OG ADMINISTRATION ]. Hver ml ziprasidonmesylat til injektion (når rekonstitueret) indeholder 20 mg ziprasidon og 4,7 mg methansulfonsyre opløseliggjort af 294 mg sulfobutylether β-cyclodextrinnatrium (SBECD).
INDIKATIONER
GEODON er indiceret til behandling af skizofreni, som monoterapi til akut behandling af bipolar maniske eller blandede episoder, og som et supplement til lithium eller valproat til vedligeholdelsesbehandling af bipolar lidelse. GEODON intramuskulær er indiceret til akut agitation hos skizofrene patienter. Når der skal vælges blandt de alternative behandlinger, der er tilgængelige for den tilstand, der kræver behandling, bør den ordinerende læge overveje fundet af ziprasidons større kapacitet til at forlænge QT/QTc-intervallet sammenlignet med flere andre antipsykotiske lægemidler [se ADVARSLER OG FORHOLDSREGLER ]. Forlængelse af QTc-intervallet er i nogle andre lægemidler forbundet med evnen til at forårsage arytmi af torsade de pointes-typen, en potentielt dødelig polymorf ventrikulær takykardi og pludselig død. I mange tilfælde vil dette føre til den konklusion, at andre stoffer bør prøves først. Hvorvidt ziprasidon vil forårsage torsade de pointes eller øge frekvensen af pludselig død er endnu ikke kendt [se ADVARSLER OG FORHOLDSREGLER ]
Skizofreni
- GEODON er indiceret til behandling af skizofreni hos voksne [se Kliniske Studier ].
Bipolar I lidelse (akutte blandede eller maniske episoder og vedligeholdelsesbehandling som et supplement til lithium eller valproat)
- GEODON er indiceret som monoterapi til akut behandling af voksne med maniske eller blandede episoder forbundet med bipolar I lidelse [se Kliniske Studier ].
- GEODON 40mg er indiceret som et supplement til lithium eller valproat til vedligeholdelsesbehandling af bipolar I lidelse hos voksne [se Kliniske Studier ].
Akut behandling af agitation ved skizofreni
- GEODON 40 mg intramuskulært er indiceret til behandling af akut agitation hos skizofrene voksne patienter, for hvem behandling med ziprasidon er passende, og som har behov for intramuskulær antipsykotisk medicin til hurtig kontrol af agitation [se Kliniske Studier ].
Da der ikke er erfaring med sikkerheden ved intramuskulær administration af ziprasidon til skizofrene patienter, der allerede tager oral ziprasidon, anbefales det ikke at anvende samtidig administration.
DOSERING OG ADMINISTRATION
Skizofreni
Dosisvalg
GEODON 40 mg kapsler bør indgives med en indledende daglig dosis på 20 mg to gange dagligt sammen med mad. Hos nogle patienter kan den daglige dosis efterfølgende justeres på basis af individuel klinisk status op til 80 mg to gange dagligt. Dosisjusteringer, hvis indiceret, bør generelt ske med intervaller på ikke mindre end 2 dage, da steady-state opnås inden for 1 til 3 dage. For at sikre brug af den laveste effektive dosis bør patienterne normalt observeres for forbedring i flere uger før opjustering af dosis.
Effekt ved skizofreni blev påvist i et dosisområde på 20 mg til 100 mg to gange dagligt i kortvarige, placebokontrollerede kliniske forsøg. Der var tendenser til dosisrespons inden for intervallet 20 mg til 80 mg to gange dagligt, men resultaterne var ikke konsistente. En stigning til en dosis på mere end 80 mg to gange dagligt anbefales generelt ikke. Sikkerheden ved doser over 100 mg to gange dagligt er ikke blevet systematisk evalueret i kliniske forsøg [se Kliniske Studier ].
Vedligeholdelsesbehandling
Selvom der ikke er nogen dokumentation tilgængelig for at besvare spørgsmålet om, hvor længe en patient behandlet med ziprasidon skal forblive på det, viste et vedligeholdelsesstudie med patienter, som var symptomatisk stabile og derefter randomiseret til at fortsætte med ziprasidon eller skifte til placebo, en forsinkelse i tid til tilbagefald for patienter, der får GEODON [se Kliniske Studier ]. Der blev ikke påvist yderligere fordele for doser over 20 mg to gange dagligt. Patienter bør periodisk revurderes for at fastslå behovet for vedligeholdelsesbehandling.
Bipolar I lidelse (akutte blandede eller maniske episoder og vedligeholdelsesbehandling som et supplement til lithium eller valproat)
Akut behandling af maniske eller blandede episoder
Dosisudvælgelse-Oral ziprasidon bør indgives i en indledende daglig dosis på 40 mg to gange dagligt sammen med mad. Dosis kan derefter øges til 60 mg eller 80 mg to gange dagligt på den anden behandlingsdag og efterfølgende justeres på basis af tolerance og effekt inden for området 40 mg – 80 mg to gange dagligt. I de kliniske forsøg med fleksibel dosis var den gennemsnitlige daglige dosis, der blev administreret, ca. 120 mg [se Kliniske Studier ].
Vedligeholdelsesbehandling (som et supplement til lithium eller valproat)
Fortsæt behandlingen med den samme dosis, som patienten oprindeligt blev stabiliseret på, inden for intervallet 40 mg – 80 mg to gange dagligt med mad. Patienter bør periodisk revurderes for at bestemme behovet for vedligeholdelsesbehandling [se Kliniske Studier ].
Akut behandling af agitation ved skizofreni
Intramuskulær dosering
Den anbefalede dosis er 10 mg til 20 mg administreret efter behov op til en maksimal dosis på 40 mg dagligt. Doser på 10 mg kan indgives hver anden time; doser på 20 mg kan indgives hver fjerde time op til et maksimum på 40 mg/dag. Intramuskulær administration af ziprasidon i mere end tre på hinanden følgende dage er ikke blevet undersøgt.
Hvis langtidsbehandling er indiceret, bør orale ziprasidonhydrochloridkapsler erstatte den intramuskulære administration så hurtigt som muligt.
Da der ikke er erfaring med sikkerheden ved intramuskulær administration af ziprasidon til skizofrene patienter, der allerede tager oral ziprasidon, anbefales det ikke at anvende samtidig administration.
Ziprasidon intramuskulært er kun beregnet til intramuskulær brug og bør ikke administreres intravenøst.
Intramuskulær forberedelse til administration
GEODON til injektion (ziprasidonmesylat) bør kun administreres ved intramuskulær injektion og bør ikke administreres intravenøst. Enkeltdosishætteglas kræver rekonstitution før administration.
Tilsæt 1,2 mL sterilt vand til injektion til hætteglasset og ryst kraftigt, indtil alt lægemidlet er opløst. Hver ml rekonstitueret opløsning indeholder 20 mg ziprasidon. For at indgive en dosis på 10 mg trækkes 0,5 ml af den rekonstituerede opløsning op. For at indgive en dosis på 20 mg trækkes 1,0 ml af den rekonstituerede opløsning op. Enhver ubrugt portion skal kasseres. Da der ikke er noget konserveringsmiddel eller bakteriostatisk middel i dette produkt, skal der anvendes aseptisk teknik til fremstilling af den endelige opløsning. Dette lægemiddel må ikke blandes med andre lægemidler eller opløsningsmidler end sterilt vand til injektion. Parenterale lægemidler bør inspiceres visuelt for partikler og misfarvning før administration, når opløsning og beholder tillader det.
HVORDAN LEVERET
Doseringsformer og styrker
GEODON kapsler er differentieret efter kapselfarve/størrelse og er præget med sort blæk med "Pfizer og ZDX [doseringsstyrke]" eller "Pfizer" og et unikt nummer. GEODON 40 mg kapsler leveres til oral administration i 20 mg (blå/hvide), 40 mg (blå/blå), 60 mg (hvide/hvide) og 80 mg (blå/hvide) kapsler. De leveres i følgende styrker og pakkekonfigurationer:
GEODON til injektion er tilgængelig i et enkeltdosis hætteglas som ziprasidonmesylat (20 mg ziprasidon/ml, når det er rekonstitueret i henhold til instruktionerne på etiketten) [se DOSERING OG ADMINISTRATION ]. Hver ml ziprasidonmesylat til injektion (når rekonstitueret) giver en farveløs til lyserød opløsning, der indeholder 20 mg ziprasidon og 4,7 mg methansulfonsyre opløseliggjort af 294 mg sulfobutylether-β-cyclodextrinnatrium (SBECD).
Opbevaring og håndtering
GEODON kapsler er differentieret efter kapselfarve/størrelse og er præget med sort blæk med "Pfizer og ZDX [doseringsstyrke]" eller med "Pfizer" og et unikt nummer. GEODON 20 mg kapsler leveres til oral administration i 20 mg (blå/hvide), 40 mg (blå/blå), 60 mg (hvide/hvide) og 80 mg (blå/hvide) kapsler. De leveres i følgende styrker og pakkekonfigurationer:
Eller
GEODON kapsler skal opbevares ved 25°C (77°F); udflugter tilladt til 15°C til 30°C (59°F til 86°F) [se USP kontrolleret rumtemperatur ].
GEODON 80 mg til injektion er tilgængelig i et enkeltdosis hætteglas som ziprasidonmesylat (20 mg ziprasidon/ml, når det er rekonstitueret i henhold til instruktionerne på etiketten) [se DOSERING OG ADMINISTRATION ]. Hver ml ziprasidonmesylat til injektion (når rekonstitueret) giver en farveløs til lyserød opløsning, der indeholder 20 mg ziprasidon og 4,7 mg methansulfonsyre opløseliggjort af 294 mg sulfobutylether-β-cyclodextrinnatrium (SBECD).
GEODON 40mg til injektion skal opbevares ved 25°C (77°F); udflugter tilladt til 15°C til 30°C (59°F til 86°F) [se USP kontrolleret rumtemperatur i tør form. Beskyt mod lys. Efter rekonstitution kan GEODON 40 mg til injektion opbevares, når det er beskyttet mod lys, i op til 24 timer ved 15°C til 30°C (59°F til 86°F) eller op til 7 dage i køleskab, 2°C til 8 °C (36 °F til 46 °F).
Distribueret af: Roerig Division of Pfizer Inc, NY, NY 10017. Revideret: Okt 2020
BIVIRKNINGER
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Kliniske forsøg med oral ziprasidon omfattede ca. 5700 patienter og/eller normale forsøgspersoner, der blev udsat for en eller flere doser ziprasidon. Af disse 5700 var over 4800 patienter, der deltog i effektivitetsforsøg med multiple doser, og deres erfaring svarede til ca. 1831 patientår. Disse patienter omfatter: (1) 4331 patienter, der deltog i multiple-dosis forsøg, overvejende i skizofreni, hvilket repræsenterer ca. 1698 patientår med eksponering pr. 5. februar 2000; og (2) 472 patienter, der deltog i forsøg med bipolar mani, hvilket repræsenterede ca. 133 patientårs eksponering. Yderligere 127 patienter med bipolar lidelse deltog i et langsigtet vedligeholdelsesbehandlingsstudie, der repræsenterede ca. 74,7 patientårs eksponering for ziprasidon. Betingelserne og varigheden af behandlingen med ziprasidon omfattede åbne og dobbeltblindede undersøgelser, indlagte og ambulante undersøgelser og kort- og længerevarende eksponering.
Kliniske forsøg med intramuskulær ziprasidon omfattede 570 patienter og/eller normale forsøgspersoner, som fik en eller flere injektioner af ziprasidon. Over 325 af disse forsøgspersoner deltog i forsøg, der involverede administration af flere doser.
Bivirkninger under eksponering blev opnået ved at indsamle frivilligt rapporterede bivirkninger samt resultater af fysiske undersøgelser, vitale tegn, vægte, laboratorieanalyser, EKG'er og resultater af oftalmologiske undersøgelser.
De angivne frekvenser af bivirkninger repræsenterer andelen af personer, der mindst én gang oplevede en behandlingsudløst bivirkning af den angivne type. En reaktion blev betragtet som fremkommet, hvis den opstod for første gang eller forværredes under behandling efter baseline-evaluering.
Uønskede fund observeret i kortsigtede, placebokontrollerede forsøg med oral Ziprasidon
Følgende resultater er baseret på de kortvarige placebo-kontrollerede præmarketing-forsøg for skizofreni (en pulje af to 6-ugers og to 4-ugers fastdosis-forsøg) og bipolar mani (en pulje af to 3-ugers fleksible doser) forsøg), hvor ziprasidon blev administreret i doser fra 10 til 200 mg/dag.
Almindelig observerede bivirkninger i kortsigtede placebokontrollerede forsøg
Følgende bivirkninger var de hyppigst observerede bivirkninger forbundet med brugen af ziprasidon (incidens på 5 % eller mere) og ikke observeret ved en tilsvarende forekomst blandt placebobehandlede patienter (ziprasidon-incidens mindst det dobbelte af placebo):
Skizofreniforsøg (se tabel 11)
- Somnolens
- Luftvejsinfektion
Bipolære forsøg (se tabel 12)
- Somnolens
- Ekstrapyramidale symptomer, som inkluderer følgende bivirkningsbegreber: ekstrapyramidalt syndrom, hypertoni, dystoni, dyskinesi, hypokinesi, tremor, lammelse og trækninger. Ingen af disse bivirkninger forekom individuelt med en incidens på mere end 10 % i forsøg med bipolar mani.
- Svimmelhed som omfatter bivirkningsbegreberne svimmelhed og svimmelhed.
- Akathisia
- Unormalt syn
- Asteni
- Opkastning
Skizofreni
Bivirkninger forbundet med seponering af behandling i kortvarige, placebokontrollerede forsøg med oral Ziprasidon
Ca. 4,1 % (29/702) af ziprasidon-behandlede patienter i kortvarige, placebo-kontrollerede undersøgelser afbrød behandlingen på grund af en bivirkning sammenlignet med ca. 2,2 % (6/273) på placebo. Den mest almindelige reaktion i forbindelse med frafald var udslæt, inklusive 7 frafald for udslæt blandt ziprasidonpatienter (1%) sammenlignet med ingen placebopatienter [se ADVARSLER OG FORHOLDSREGLER ].
Bivirkninger, der forekommer med en forekomst på 2 % eller mere blandt Ziprasidon-behandlede patienter i kortsigtede, orale, placebokontrollerede forsøg
Tabel 11 opregner forekomsten, afrundet til nærmeste procent, af behandlingsfremkomne bivirkninger, der opstod under akut behandling (op til 6 uger) hos overvejende patienter med skizofreni, inklusive kun de reaktioner, der opstod hos 2 % eller flere af patienterne behandlet med ziprasidon, og for hvilke incidensen hos patienter behandlet med ziprasidon var større end forekomsten hos placebobehandlede patienter.
Dosisafhængighed af bivirkninger i kortsigtede, placebokontrollerede forsøg med fast dosis
En analyse for dosisrespons i skizofreni 4-undersøgelsespuljen afslørede en tilsyneladende sammenhæng mellem bivirkning og dosis for følgende reaktioner: asteni, postural hypotension, anoreksi, mundtørhed, øget spytsekretion, artralgi, angst, svimmelhed, dystoni, hypertoni, somnolens , tremor, rhinitis, udslæt og unormalt syn.
Ekstrapyramidale symptomer (EPS)
Incidensen af rapporteret EPS (som inkluderede bivirkningsbegreberne ekstrapyramidalt syndrom, hypertoni, dystoni, dyskinesi, hypokinesi, tremor, lammelser og trækninger) for ziprasidon-behandlede patienter i de kortvarige, placebokontrollerede skizofreni-forsøg var 14 % vs. 8 % for placebo. Objektivt indsamlede data fra disse forsøg på Simpson-Angus Rating Scale (for EPS) og Barnes Akathisia Scale (for akathisia) viste generelt ikke en forskel mellem ziprasidon og placebo.
Dystoni
Klasseeffekt: Symptomer på dystoni, langvarige unormale sammentrækninger af muskelgrupper, kan forekomme hos følsomme personer i løbet af de første par dage af behandlingen. Dystoniske symptomer omfatter: spasmer i nakkemusklerne, nogle gange udvikler sig til stram hals, synkebesvær, vejrtrækningsbesvær og/eller fremspring af tungen. Selvom disse symptomer kan forekomme ved lave doser, forekommer de hyppigere og med større sværhedsgrad med høj styrke og ved højere doser af førstegenerations antipsykotiske lægemidler. En forhøjet risiko for akut dystoni er observeret hos mænd og yngre aldersgrupper.
Ændringer af vitale tegn
Ziprasidon er forbundet med ortostatisk hypotension [se ADVARSLER OG FORHOLDSREGLER ]
EKG ændringer
Ziprasidon er forbundet med en stigning i QTc-intervallet [se ADVARSLER OG FORHOLDSREGLER ]. I skizofreni-forsøgene var ziprasidon forbundet med en gennemsnitlig stigning i hjertefrekvensen på 1,4 slag pr. minut sammenlignet med et fald på 0,2 slag pr. minut blandt placebopatienter.
Andre bivirkninger observeret under præmarketing-evalueringen af oral Ziprasidon
Følgende er en liste over COSTART-udtryk, der afspejler behandlingsudløste bivirkninger som defineret i introduktionen til afsnittet BIVIRKNINGER rapporteret af patienter behandlet med ziprasidon i skizofreni-forsøg med multiple doser >4 mg/dag i databasen med 3834 patienter. Alle rapporterede reaktioner er inkluderet undtagen dem, der allerede er anført i tabel 11 eller andre steder i mærkningen, de reaktionsbegreber, der var så generelle, at de var uinformative, reaktioner, der kun blev rapporteret én gang, og som ikke havde en væsentlig sandsynlighed for at være akut livstruende, reaktioner, der er en del af den sygdom, der behandles, eller er på anden måde almindelige som baggrundsreaktioner, og reaktioner anses for usandsynlige at være lægemiddelrelaterede. Det er vigtigt at understrege, at selvom de rapporterede reaktioner opstod under behandling med ziprasidon, var de ikke nødvendigvis forårsaget af det.
Bivirkninger er yderligere kategoriseret efter kropssystem og listet i rækkefølge efter faldende frekvens i henhold til følgende definitioner:
Hyppige - bivirkninger, der forekommer hos mindst 1/100 patienter (≥1,0 % af patienterne) (kun dem, der ikke allerede er opført i de tabelformede resultater fra placebokontrollerede forsøg, vises i denne liste);
Sjælden - bivirkninger forekommer hos 1/100 til 1/1000 patienter (hos 0,1-1,0 % af patienterne)
Sjælden - bivirkninger forekommer hos færre end 1/1000 patienter (
Kroppen som helhed
Hyppige mavesmerter, influenzasyndrom, feber, utilsigtet fald, ansigtsødem, kulderystelser, lysfølsomhedsreaktion, flankesmerter, hypotermi, motorkøretøjsulykke
Kardiovaskulære system
Hyppig takykardi, hypertension, postural hypotension
Sjælden bradykardi, angina pectoris, atrieflimren
Sjælden førstegrads AV-blok, bundtgrenblok, flebitis, lungeemboli, kardiomegali, cerebralt infarkt, cerebrovaskulær ulykke, dyb tromboflebitis, myocarditis, tromboflebitis
Fordøjelsessystemet
Hyppig anoreksi, opkastning
Sjælden rektal blødning, dysfagi, tungeødem
Sjælden tandkødsblødning, gulsot, fækal påvirkning, øget gamma-glutamyltranspeptidase, hæmatemese, kolestatisk gulsot, hepatitis, hepatomegali, leukoplaki i munden, fedtleveraflejringer, melena
Endokrine
Sjælden hypothyroidisme, hyperthyroidisme, thyroiditis
Hemisk og lymfesystem
Sjælden anæmi, ekkymose, leukocytose, leukopeni, eosinofili, lymfadenopati
Sjælden trombocytopeni, hypokrom anæmi, lymfocytose, monocytose, basofili, lymfødem, polycytæmi, trombocytæmi
Metaboliske og ernæringsforstyrrelser
Sjælden tørst, øget transaminase, perifert ødem, hyperglykæmi, øget kreatinfosfokinase, øget alkalisk fosfatase, hyperkolesteræmi, dehydrering, øget mælkesyredehydrogenase, albuminuri, hypokaliæmi
Sjælden BUN øget, kreatinin øget, hyperlipæmi, hypokolesteræmi, hyperkaliæmi, hypochloræmi, hypoglykæmi, hyponatriæmi, hypoproteinæmi, nedsat glukosetolerance, gigt, hyperchloræmi, hyperurikæmi, hypocalcæmi, hypoglykæmi, hypomagnesæmi, respiratorisk alkalose,
Muskuloskeletale system
Hyppig myalgi
Sjælden senehindebetændelse
Sjælden myopati
Nervesystem
Hyppighed, ekstrapyramidalt syndrom, tremor, dystoni, hypertoni, dyskinesi, fjendtlighed, trækninger, paræstesi, forvirring, vertigo, hypokinesi, hyperkinesi, unormal gang, okulogyrisk krise, hypestesi, ataksi, hukommelsestab, tandhjulsstivhed, delironi, stivhed i tandhjulet, delironi, abstinenssyndrom, buccoglossalt syndrom, choreoathetosis, diplopi, inkoordination, neuropati
Sjælden lammelse
Sjælden myoklonus, nystagmus, torticollis, cirkumoral paræstesi, opisthotonos, øgede reflekser, trismus
Åndedrætsorganerne
Hyppig dyspnø
Sjælden lungebetændelse, epistaxis
Sjælden hæmotyse, laryngismus
Hud og vedhæng
Sjældent makulopapulært udslæt, nældefeber, alopeci, eksem, eksfoliativ dermatitis, kontaktdermatitis, vesikulobulløst udslæt
Særlige sanser
Hyppig svampeeksem
Sjælden conjunctivitis, tørre øjne, tinnitus, blepharitis, grå stær, fotofobi
Sjælden øjenblødning, synsfeltdefekt, keratitis, keratoconjunctivitis
Urogenitale system
Sjælden impotens, unormal ejakulation, amenoré, hæmaturi, menorragi, kvindelig laktation, polyuri, urinretentionsmetrorragi, mandlig seksuel dysfunktion, anorgasmi, glykosuri
Sjælden gynækomasti, vaginal blødning, nocturi, oliguri, kvindelig seksuel dysfunktion, livmoderblødning
Maniodepressiv
Akut behandling af maniske eller blandede episoder
Bivirkninger forbundet med seponering af behandling på kort sigt, placebokontrollerede forsøg
Ca. 6,5 % (18/279) af ziprasidon-behandlede patienter i kortvarige, placebo-kontrollerede undersøgelser afbrød behandlingen på grund af en bivirkning sammenlignet med ca. 3,7 % (5/136) på placebo. De mest almindelige reaktioner forbundet med frafald hos de ziprasidon-behandlede patienter var akatisi, angst, depression, svimmelhed, dystoni, udslæt og opkastning, med 2 frafald for hver af disse reaktioner blandt ziprasidonpatienter (1%) sammenlignet med én placebopatient hver for dystoni og udslæt (1%) og ingen placebopatienter for de resterende bivirkninger.
Bivirkninger, der forekommer med en forekomst på 2 % eller mere blandt Ziprasidon-behandlede patienter i kortsigtede, orale, placebokontrollerede forsøg
Tabel 12 opregner forekomsten, afrundet til nærmeste procent, af behandlingsudløste bivirkninger, der opstod under akut behandling (op til 3 uger) hos patienter med bipolar mani, inklusive kun de reaktioner, der opstod hos 2 % eller flere af patienterne behandlet med ziprasidon, og for hvilke incidensen hos patienter behandlet med ziprasidon var større end forekomsten hos placebobehandlede patienter.
Undersøgelser for interaktioner på grundlag af køn afslørede ikke nogen klinisk betydningsfulde forskelle i forekomsten af bivirkninger på baggrund af denne demografiske faktor.
Intramuskulær Ziprasidon
Bivirkninger, der forekommer med en forekomst på 1 % eller mere blandt Ziprasidon-behandlede patienter i korttidsforsøg med intramuskulær Ziprasidon
Tabel 13 opregner forekomsten, afrundet til nærmeste procent, af behandlingsudløste bivirkninger, der opstod under akut behandling med intramuskulær ziprasidon hos 1 % eller flere af patienterne.
disse undersøgelser er de mest almindeligt observerede bivirkninger forbundet med brugen af intramuskulær ziprasidon (hyppighed på 5 % eller mere) og observeret med en hastighed på intramuskulær ziprasidon (i de højere dosisgrupper) mindst dobbelt så høj som for den laveste intramuskulære ziprasidon-gruppe var hovedpine (13 %), kvalme (12 %) og somnolens (20 %).
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af GEODON efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Bivirkningsindberetninger, der ikke er nævnt ovenfor, og som er modtaget siden markedsintroduktionen omfatter sjældne forekomster af følgende: Hjertelidelser: Takykardi, torsade de pointes (i nærværelse af flere forstyrrende faktorer), [se ADVARSLER OG FORHOLDSREGLER ]; Fordøjelsessystemet lidelser: hævet tunge; Reproduktionssystem og brystsygdomme: Galactorrhea, priapisme; Forstyrrelser i nervesystemet: Fald i ansigtet, malignt neuroleptisk syndrom, serotonergt syndrom (alene eller i kombination med serotonerge lægemidler), tardiv dyskinesi; Psykiatriske lidelser: Søvnløshed, mani/hypomani; Hud- og subkutane vævsforstyrrelser: Allergisk reaktion (såsom allergisk dermatitis, angioødem, orofacialt ødem, nældefeber), udslæt, lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS); Urogenitale systemlidelser: Enurese, urininkontinens; Vaskulære lidelser: Postural hypotension, synkope.
DRUGSINTERAKTIONER
Lægemiddel-lægemiddelinteraktioner kan være farmakodynamiske (kombinerede farmakologiske virkninger) eller farmakokinetiske (ændring af plasmaniveauer). Risikoen ved at bruge ziprasidon i kombination med andre lægemidler er blevet vurderet som beskrevet nedenfor. Alle interaktionsundersøgelser er blevet udført med oral ziprasidon. Baseret på den farmakodynamiske og farmakokinetiske profil af ziprasidon kan mulige interaktioner forventes:
Metabolisk vej
Omtrent to tredjedele af ziprasidon metaboliseres via en kombination af kemisk reduktion med glutathion og enzymatisk reduktion med aldehydoxidase. Der er ingen kendte klinisk relevante hæmmere eller inducere af aldehydoxidase. Mindre end en tredjedel af ziprasidon metaboliske clearance medieres af cytochrom P450-katalyseret oxidation.
In vitro undersøgelser
En in vitro-enzyminhiberingsundersøgelse med humane levermikrosomer viste, at ziprasidon havde ringe hæmmende virkning på CYP1A2, CYP2C9, CYP2C19, CYP2D6 og CYP3A4 og derfor sandsynligvis ikke ville interferere med metabolismen af lægemidler, der primært metaboliseres af disse enzymer. Der er ringe potentiale for lægemiddelinteraktioner med ziprasidon på grund af forskydning [se KLINISK FARMAKOLOGI ].
Farmakodynamiske interaktioner
Ziprasidon bør ikke anvendes sammen med noget lægemiddel, der forlænger QT-intervallet [se KONTRAINDIKATIONER ].
I betragtning af ziprasidons primære CNS-virkninger bør der udvises forsigtighed, når det tages i kombination med andre centralt virkende lægemidler.
På grund af dets potentiale til at inducere hypotension, kan ziprasidon forstærke virkningen af visse antihypertensiva.
Ziprasidon kan modvirke virkningerne af levodopa og dopaminagonister.
Farmakokinetiske interaktioner
Carbamazepin
Carbamazepin er en inducer af CYP3A4; administration af 200 mg to gange dagligt i 21 dage resulterede i et fald på ca. 35 % i AUC for ziprasidon. Denne effekt kan være større, når der indgives højere doser af carbamazepin.
Ketoconazol
Ketoconazol, en potent hæmmer af CYP3A4, øgede i en dosis på 400 mg QD i 5 dage AUC og Cmax for ziprasidon med ca. 35-40%. Andre hæmmere af CYP3A4 forventes at have lignende virkninger.
Cimetidin
Cimetidin i en dosis på 800 mg dagligt i 2 dage påvirkede ikke ziprasidons farmakokinetik.
Antacida
Samtidig administration af 30 ml Maalox® med ziprasidon påvirkede ikke ziprasidons farmakokinetik.
Lithium
Ziprasidon i en dosis på 40 mg to gange dagligt administreret samtidig med lithium i en dosis på 450 mg to gange dagligt i 7 dage påvirkede ikke steady-state niveauet eller renal clearance af lithium. Ziprasidon doseret som supplement til lithium i et vedligeholdelsesstudie med bipolære patienter påvirkede ikke de gennemsnitlige terapeutiske lithiumniveauer.
Orale præventionsmidler
In vivo undersøgelser har ikke vist nogen effekt af ziprasidon på farmakokinetikken af østrogen- eller progesteronkomponenter. Ziprasidon i en dosis på 20 mg to gange dagligt påvirkede ikke farmakokinetikken af samtidig administrerede orale antikonceptionsmidler, ethinylestradiol (0,03 mg) og levonorgestrel (0,15 mg).
Dextromethorphan
I overensstemmelse med in vitro-resultater viste en undersøgelse med normale raske frivillige, at ziprasidon ikke ændrede metabolismen af dextromethorphan, et CYP2D6-modelsubstrat, til dets hovedmetabolit, dextrorphan. Der var ingen statistisk signifikant ændring i urin-dextromethorphan/dextrorphan-forholdet.
Valproat
En farmakokinetisk interaktion mellem ziprasidon og valproat er usandsynlig på grund af manglen på fælles metaboliske veje for de to lægemidler. Ziprasidon doseret som supplement til valproat i et vedligeholdelsesstudie med bipolære patienter påvirkede ikke de gennemsnitlige terapeutiske valproatniveauer.
Anden samtidig medikamentel terapi
Populationsfarmakokinetisk analyse af skizofrene patienter inkluderet i kontrollerede kliniske forsøg har ikke afsløret tegn på nogen klinisk signifikant farmakokinetisk interaktion med benztropin, propranolol eller lorazepam.
Fødevareinteraktion
Den absolutte biotilgængelighed af en 20 mg dosis under fodrede forhold er ca. 60 %. Absorptionen af ziprasidon øges op til det dobbelte ved tilstedeværelse af mad [se KLINISK FARMAKOLOGI ].
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Øget dødelighed hos ældre patienter med demensrelateret psykose
Ældre patienter med demensrelateret psykose behandlet med antipsykotiske lægemidler har en øget risiko for at dø. Analyser af 17 placebokontrollerede forsøg (modal varighed på 10 uger), hovedsageligt hos patienter, der tog atypiske antipsykotiske lægemidler, viste en risiko for død hos lægemiddelbehandlede patienter på mellem 1,6 og 1,7 gange risikoen for død hos placebobehandlede patienter. I løbet af et typisk 10-ugers kontrolleret forsøg var dødsraten hos lægemiddelbehandlede patienter omkring 4,5 % sammenlignet med en rate på omkring 2,6 % i placebogruppen.
Selvom dødsårsagerne var forskellige, så de fleste af dødsfaldene ud til at være enten kardiovaskulære (f.eks. hjertesvigt, pludselig død) eller infektiøse (f.eks. lungebetændelse) i naturen. GEODON er ikke godkendt til behandling af patienter med demensrelateret psykose. [se KASSE ADVARSEL , Cerebrovaskulære bivirkninger, herunder slagtilfælde, hos ældre patienter med demensrelateret psykose ].
Cerebrovaskulære bivirkninger, herunder slagtilfælde, hos ældre patienter med demensrelateret psykose
I placebokontrollerede forsøg med ældre forsøgspersoner med demens havde patienter randomiseret til risperidon, aripiprazol og olanzapin en højere forekomst af slagtilfælde og forbigående iskæmisk anfald, inklusive fatalt slagtilfælde. GEODON er ikke godkendt til behandling af patienter med demensrelateret psykose [se KASSE ADVARSEL og Øget dødelighed hos ældre patienter med demensrelateret psykose ].
QT-forlængelse og risiko for pludselig død
Brug af Ziprasidon bør undgås i kombination med andre lægemidler, der vides at forlænge QTc-intervallet [se KONTRAINDIKATIONER og DRUGSINTERAKTIONER ]. Derudover bør klinikere være opmærksomme på identifikation af andre lægemidler, som konsekvent er blevet observeret for at forlænge QTc-intervallet. Sådanne lægemidler bør ikke ordineres sammen med ziprasidon. Ziprasidon bør også undgås hos patienter med medfødt langt QT-syndrom og hos patienter med tidligere hjertearytmier [se KONTRAINDIKATIONER ].
En undersøgelse, der direkte sammenlignede den QT/QTc-forlængende effekt af oral ziprasidon med adskillige andre lægemidler, der er effektive til behandling af skizofreni, blev udført hos frivillige patienter. I den første fase af forsøget blev EKG'er opnået på tidspunktet for maksimal plasmakoncentration, når lægemidlet blev administreret alene. I anden fase af forsøget blev EKG'er opnået på tidspunktet for maksimal plasmakoncentration, mens lægemidlet blev administreret sammen med en hæmmer af lægemidlets CYP4503A4-metabolisme.
den første fase af undersøgelsen blev den gennemsnitlige ændring i QTc fra baseline beregnet for hvert lægemiddel ved hjælp af en prøvebaseret korrektion, der fjerner effekten af hjertefrekvens på QT-intervallet. Den gennemsnitlige stigning i QTc fra baseline for ziprasidon varierede fra ca. 9 til 14 msek større end for fire af sammenligningslægemidlerne (risperidon, olanzapin, quetiapin og haloperidol), men var ca. 14 msek mindre end forlængelsen observeret for thioridazin.
I anden fase af undersøgelsen blev effekten af ziprasidon på QTc-længden ikke forstærket af tilstedeværelsen af en metabolisk hæmmer (ketoconazol 200 mg to gange dagligt).
placebokontrollerede forsøg øgede oral ziprasidon QTc-intervallet sammenlignet med placebo med ca. 10 msek ved den højeste anbefalede daglige dosis på 160 mg. I kliniske forsøg med oral ziprasidon afslørede elektrokardiogrammerne fra 2/2988 (0,06 %) patienter, som fik GEODON 80 mg og 1/440 (0,23 %) patienter, som fik placebo, QTc-intervaller, der oversteg den potentielt klinisk relevante tærskel på 500 msek. Hos de ziprasidon-behandlede patienter antydede ingen af tilfældene en rolle for ziprasidon. En patient havde en historie med forlænget QTc og en screeningsmåling på 489 msek; QTc var 503 msek under ziprasidonbehandling. Den anden patient havde en QTc på 391 msek ved slutningen af behandlingen med ziprasidon, og efter skift til thioridazin oplevede QTc-målinger på 518 og 593 msek.
Nogle lægemidler, der forlænger QT/QTc-intervallet, er blevet forbundet med forekomsten af torsade de pointes og med pludselig uforklarlig død. Forholdet mellem QT-forlængelse og torsade de pointes er tydeligst ved større stigninger (20 msek og mere), men det er muligt, at mindre QT/QTc-forlængelser også kan øge risikoen eller øge den hos modtagelige personer. Selvom torsade de pointes ikke er blevet observeret i forbindelse med brugen af ziprasidon i præmarketingundersøgelser, og erfaringen er for begrænset til at udelukke en øget risiko, har der været sjældne post-marketing rapporter (i nærvær af flere forvirrende faktorer) [se BIVIRKNINGER ].
En undersøgelse, der evaluerede den QT/QTc-forlængende effekt af intramuskulær ziprasidon med intramuskulær haloperidol som kontrol, blev udført hos frivillige patienter. I forsøget blev EKG'er opnået på tidspunktet for maksimal plasmakoncentration efter to injektioner af ziprasidon (20 mg og derefter 30 mg) eller haloperidol (7,5 mg og derefter 10 mg) givet med fire timers mellemrum. Bemærk, at en dosis på 30 mg intramuskulært ziprasidon er 50 % højere end den anbefalede terapeutiske dosis. Den gennemsnitlige ændring i QTc fra baseline blev beregnet for hvert lægemiddel ved hjælp af en prøvebaseret korrektion, der fjerner effekten af hjertefrekvens på QT-intervallet. Den gennemsnitlige stigning i QTc fra baseline for ziprasidon var 4,6 msek efter den første injektion og 12,8 msek efter den anden injektion. Den gennemsnitlige stigning i QTc fra baseline for haloperidol var 6,0 msek efter den første injektion og 14,7 msek efter den anden injektion. I denne undersøgelse havde ingen patienter et QTc-interval på over 500 msek.
Som med andre antipsykotiske lægemidler og placebo er der rapporteret pludselige uforklarlige dødsfald hos patienter, der tager ziprasidon i anbefalede doser. Erfaringerne før markedsføring af ziprasidon afslørede ikke en øget risiko for dødelighed for ziprasidon sammenlignet med andre antipsykotiske lægemidler eller placebo, men omfanget af eksponeringen var begrænset, især for de lægemidler, der blev brugt som aktive kontroller og placebo. Ikke desto mindre rejser ziprasidons større forlængelse af QTc-længden sammenlignet med flere andre antipsykotiske lægemidler muligheden for, at risikoen for pludselig død kan være større for ziprasidon end for andre tilgængelige lægemidler til behandling af skizofreni. Denne mulighed skal tages i betragtning, når der skal vælges mellem alternative lægemidler [se INDIKATIONER ].
Visse omstændigheder kan øge risikoen for forekomsten af torsade de pointes og/eller pludselig død i forbindelse med brugen af lægemidler, der forlænger QTc-intervallet, herunder (1) bradykardi; (2) hypokaliæmi eller hypomagnesæmi; (3) samtidig brug af andre lægemidler, der forlænger QTc-intervallet; og (4) tilstedeværelse af medfødt forlængelse af QT-intervallet.
Det anbefales, at patienter, der overvejes til ziprasidon-behandling, og som er i risiko for betydelige elektrolytforstyrrelser, især hypokaliæmi, har baseline-målinger af kalium og magnesium i serum. Hypokalæmi (og/eller hypomagnesæmi) kan øge risikoen for QT-forlængelse og arytmi. Hypokaliæmi kan skyldes diuretikabehandling, diarré og andre årsager. Patienter med lavt serumkalium og/eller magnesium bør fyldes op med disse elektrolytter, før behandlingen fortsættes. Det er vigtigt at overvåge serumelektrolytter med jævne mellemrum hos patienter, for hvem der indledes diuretikabehandling under ziprasidonbehandling. Vedvarende forlængede QTc-intervaller kan også øge risikoen for yderligere forlængelse og arytmi, men det er ikke klart, at rutinemæssige screenings-EKG-foranstaltninger er effektive til at opdage sådanne patienter. Tværtimod bør ziprasidon undgås hos patienter med historier om betydelig kardiovaskulær sygdom, f.eks. QT-forlængelse, nyligt akut myokardieinfarkt, ukompenseret hjertesvigt eller hjertearytmi. Ziprasidon bør seponeres hos patienter, som viser sig at have vedvarende QTc-målinger >500 msek.
For patienter, der tager ziprasidon, og som oplever symptomer, der kan indikere forekomsten af torsade de pointes, f.eks. svimmelhed, hjertebanken eller synkope, bør den ordinerende læge påbegynde yderligere evaluering, f.eks. kan Holter-monitorering være nyttig.
Malignt neuroleptikasyndrom (NMS)
Et potentielt dødeligt symptomkompleks, nogle gange omtalt som malignt neuroleptikasyndrom (NMS), er blevet rapporteret i forbindelse med administration af antipsykotiske lægemidler. Kliniske manifestationer af NMS er hyperpyreksi, muskelstivhed, ændret mental status og tegn på autonom ustabilitet (uregelmæssig puls eller blodtryk, takykardi, diaforese og hjerterytmeforstyrrelser). Yderligere tegn kan omfatte forhøjet kreatininfosfokinase, myoglobinuri (rhabdomyolyse) og akut nyresvigt.
Den diagnostiske evaluering af patienter med dette syndrom er kompliceret. For at nå frem til en diagnose er det vigtigt at udelukke tilfælde, hvor den kliniske præsentation omfatter både alvorlig medicinsk sygdom (f.eks. lungebetændelse, systemisk infektion osv.) og ubehandlede eller utilstrækkeligt behandlede ekstrapyramidale tegn og symptomer (EPS). Andre vigtige overvejelser i differentialdiagnosen omfatter central antikolinerg toksicitet, hedeslag, lægemiddelfeber og primær centralnervesystem (CNS) patologi.
Behandlingen af NMS bør omfatte: (1) øjeblikkelig seponering af antipsykotiske lægemidler og andre lægemidler, der ikke er nødvendige for samtidig behandling; (2) intensiv symptomatisk behandling og medicinsk overvågning; og (3) behandling af eventuelle samtidige alvorlige medicinske problemer, som specifikke behandlinger er tilgængelige for. Der er ingen generel enighed om specifikke farmakologiske behandlingsregimer for NMS.
Hvis en patient har behov for antipsykotisk lægemiddelbehandling efter bedring fra NMS, bør den potentielle genindførelse af lægemiddelbehandling overvejes nøje. Patienten bør overvåges omhyggeligt, da tilbagefald af NMS er blevet rapporteret.
Alvorlige kutane bivirkninger
Lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS)
Lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS) er blevet rapporteret ved eksponering for Ziprasidon. DRESS består af en kombination af tre eller flere af følgende: kutan reaktion (såsom udslæt eller eksfoliativ dermatitis), eosinofili, feber, lymfadenopati og en eller flere systemiske komplikationer såsom hepatitis, nefritis, pneumonitis, myocarditis og pericarditis. DRESS er nogle gange fatalt. Afbryd ziprasidon, hvis der er mistanke om DRESS.
Andre alvorlige kutane bivirkninger
Andre alvorlige kutane bivirkninger, såsom Stevens-Johnsons syndrom, er blevet rapporteret ved eksponering for ziprasidon. Alvorlige kutane bivirkninger er nogle gange fatale. Afbryd ziprasidon, hvis der er mistanke om alvorlige kutane bivirkninger.
Tardiv dyskinesi
Et syndrom med potentielt irreversible, ufrivillige, dyskinetiske bevægelser kan udvikle sig hos patienter, der gennemgår behandling med antipsykotiske lægemidler. Selvom prævalensen af syndromet ser ud til at være højest blandt ældre, især ældre kvinder, er det umuligt at stole på prævalensestimater til at forudsige, ved begyndelsen af antipsykotisk behandling, hvilke patienter der sandsynligvis vil udvikle syndromet. Hvorvidt antipsykotiske lægemidler er forskellige i deres potentiale til at forårsage tardiv dyskinesi er ukendt.
Risikoen for at udvikle tardiv dyskinesi og sandsynligheden for, at den bliver irreversibel, menes at stige, efterhånden som behandlingens varighed og den samlede kumulative dosis af antipsykotiske lægemidler administreret til patienten stiger. Syndromet kan dog udvikle sig, selv om det er meget sjældnere, efter relativt korte behandlingsperioder ved lave doser.
Der er ingen kendt behandling for etablerede tilfælde af tardiv dyskinesi, selvom syndromet kan forsvinde, delvist eller fuldstændigt, hvis antipsykotisk behandling seponeres. Antipsykotisk behandling i sig selv kan dog undertrykke (eller delvist undertrykke) tegn og symptomer på syndromet og kan derved muligvis maskere den underliggende proces. Den effekt, som symptomatisk suppression har på det langsigtede forløb af syndromet, er ukendt.
betragtning af disse overvejelser bør ziprasidon ordineres på en måde, der med størst sandsynlighed minimerer forekomsten af tardiv dyskinesi. Kronisk antipsykotisk behandling bør generelt være forbeholdt patienter, der lider af en kronisk sygdom, som (1) vides at reagere på antipsykotiske lægemidler, og (2) for hvem alternative, lige så effektive, men potentielt mindre skadelige behandlinger ikke er tilgængelige eller passende. Hos patienter, som har behov for kronisk behandling, bør den mindste dosis og den korteste behandlingsvarighed, der giver et tilfredsstillende klinisk respons, søges. Behovet for fortsat behandling bør revurderes med jævne mellemrum.
Hvis der opstår tegn og symptomer på tardiv dyskinesi hos en patient på ziprasidon, bør seponering af lægemidlet overvejes. Nogle patienter kan dog have behov for behandling med ziprasidon på trods af tilstedeværelsen af syndromet.
Metaboliske ændringer
Atypiske antipsykotiske lægemidler er blevet forbundet med metaboliske ændringer, der kan øge kardiovaskulær/cerebrovaskulær risiko. Disse metaboliske ændringer omfatter hyperglykæmi, dyslipidæmi og kropsvægtøgning. Mens alle lægemidler i klassen har vist sig at producere nogle metaboliske ændringer, har hvert lægemiddel sin egen specifikke risikoprofil.
Hyperglykæmi og diabetes mellitus
Hyperglykæmi og diabetes mellitus, i nogle tilfælde ekstrem og forbundet med ketoacidose eller hyperosmolær koma eller død, er blevet rapporteret hos patienter behandlet med atypiske antipsykotika. Der har været få rapporter om hyperglykæmi eller diabetes hos patienter behandlet med GEODON. Selvom færre patienter er blevet behandlet med GEODON, vides det ikke, om denne mere begrænsede erfaring er den eneste årsag til, at sådanne rapporter er få. Vurdering af sammenhængen mellem atypisk brug af antipsykotiske midler og glukoseabnormiteter kompliceres af muligheden for en øget baggrundsrisiko for diabetes mellitus hos patienter med skizofreni og den stigende forekomst af diabetes mellitus i den generelle befolkning. I betragtning af disse konfounders er forholdet mellem atypisk antipsykotisk brug og hyperglykæmi-relaterede bivirkninger ikke fuldstændigt forstået. Præcise risikoestimater for hyperglykæmi-relaterede bivirkninger hos patienter behandlet med atypiske antipsykotika er ikke tilgængelige.
Patienter med en etableret diagnose af diabetes mellitus, som er startet på atypiske antipsykotika, bør monitoreres regelmæssigt for forværring af glukosekontrol. Patienter med risikofaktorer for diabetes mellitus (f.eks. fedme, familiehistorie med diabetes), som starter behandling med atypiske antipsykotika, bør gennemgå fastende blodsukkermåling i begyndelsen af behandlingen og periodisk under behandlingen. Enhver patient, der behandles med atypiske antipsykotika, bør overvåges for symptomer på hyperglykæmi, herunder polydipsi, polyuri, polyfagi og svaghed. Patienter, som udvikler symptomer på hyperglykæmi under behandling med atypiske antipsykotika, bør gennemgå fastende blodsukkermåling. I nogle tilfælde er hyperglykæmi forsvundet, når det atypiske antipsykotikum blev seponeret; nogle patienter krævede dog fortsat antidiabetisk behandling på trods af seponering af det mistænkte lægemiddel.
Samlede data fra kortvarige, placebokontrollerede undersøgelser af skizofreni og bipolar lidelse er vist i tabel 1-4. Bemærk, at for de fleksible dosisundersøgelser i både skizofreni og bipolar lidelse kategoriseres hvert individ som at have modtaget enten lav (20-40 mg BID) eller høj (60-80 mg BID) dosis baseret på individets modale daglige dosis. I tabellerne, der viser kategoriske ændringer, er procenterne (% kolonne) beregnet som 100x(n/N).

I langtids (mindst 1 år), placebokontrollerede, fleksible dosis undersøgelser i skizofreni var den gennemsnitlige ændring fra baseline i tilfældig glucose for ziprasidon 20-40 mg to gange dagligt -3,4 mg/dL (N=122); for ziprasidon var 60-80 mg BID +1,3 mg/dL (N=10); og for placebo var +0,3 mg/dL (N=71).
Dyslipidæmi
Uønskede ændringer i lipider er blevet observeret hos patienter behandlet med atypiske antipsykotika. Samlede data fra kortsigtede, placebokontrollerede undersøgelser af skizofreni og bipolar lidelse er vist i tabel 5-8.
langsigtede (mindst 1 år), placebokontrollerede, fleksible dosisstudier i skizofreni var den gennemsnitlige ændring fra baseline i tilfældige triglycerider for ziprasidon 20-40 mg to gange dagligt +26,3 mg/dL (N=15); for ziprasidon var 60-80 mg BID -39,3 mg/dL (N=10); og for placebo var +12,9 mg/dL (N=9). I langsigtede (mindst 1 år), placebokontrollerede, fleksible dosisstudier i skizofreni var den gennemsnitlige ændring fra baseline i tilfældig total kolesterol for ziprasidon 20-40 mg 2D +2,5 mg/dL (N=14); for ziprasidon var 60-80 mg BID -19,7 mg/dL (N=10); og for placebo var -28,0 mg/dL (N=9).
Vægtøgning
Vægtøgning er blevet observeret ved atypisk antipsykotisk brug. Overvågning af vægt anbefales. Samlede data fra kortsigtede, placebokontrollerede undersøgelser af skizofreni og bipolar lidelse er vist i tabel 9-10.
langsigtede (mindst 1 år), placebokontrollerede, fleksible dosisstudier i skizofreni var den gennemsnitlige ændring fra baselinevægten for ziprasidon 20-40 mg BID -2,3 kg (N=124); for ziprasidon var 60-80 mg BID +2,5 kg (N=10); og for placebo var -2,9 kg (N=72). I de samme langtidsstudier var andelen af forsøgspersoner med ≥ 7 % vægtstigning fra baseline for ziprasidon 20-40 mg BID 5,6 % (N=124); for ziprasidon var 60-80 mg BID 20,0 % (N=10), og for placebo var 5,6 % (N=72). I et langtidsholdigt (mindst 1 år), placebokontrolleret, fastdosisstudie i skizofreni var den gennemsnitlige ændring fra baselinevægten for ziprasidon 20 mg 2D -2,6 kg (N=72); for ziprasidon var 40 mg BID -3,3 kg (N=69); for ziprasidon var 80 mg BID -2,8 kg (N=70) og for placebo var -3,8 kg (N=70). I det samme langtidsstudie med fast dosis skizofreni var andelen af forsøgspersoner med ≥ 7 % vægtstigning fra baseline for ziprasidon 20 mg BID 5,6 % (N=72); for ziprasidon var 40 mg BID 2,9 % (N=69); for ziprasidon var 80 mg BID 5,7 % (N=70) og for placebo var 2,9 % (N=70).
Skizofreni
Andelene af patienter, der opfylder et vægtøgningskriterium på ≥ 7 % af kropsvægten, blev sammenlignet i en pulje af fire 4- og 6-ugers placebokontrollerede kliniske skizofreni-forsøg, hvilket afslørede en statistisk signifikant større forekomst af vægtøgning for ziprasidon (10 % ) sammenlignet med placebo (4%). En median vægtøgning på 0,5 kg blev observeret hos ziprasidonpatienter sammenlignet med ingen medianvægtændring hos placebopatienter. I dette sæt af kliniske forsøg blev vægtøgning rapporteret som en bivirkning hos henholdsvis 0,4 % og 0,4 % af ziprasidon- og placebopatienter. Under langtidsbehandling med ziprasidon afslørede en kategorisering af patienter ved baseline på basis af kropsmasseindeks (BMI) den største gennemsnitlige vægtøgning og højeste forekomst af klinisk signifikant vægtøgning (> 7 % af kropsvægten) hos patienter med lav vægt. BMI (27). Der var en gennemsnitlig vægtøgning på 1,4 kg for de patienter med et "lavt" baseline BMI, ingen gennemsnitlig ændring for patienter med et "normalt" BMI og et gennemsnitligt vægttab på 1,3 kg for patienter, der kom ind i programmet med et "højt" BMI.
Maniodepressiv
et 6-måneders placebokontrolleret bipolar vedligeholdelsesstudie hos voksne med ziprasidon som supplement til lithium eller valproat var forekomsten af klinisk signifikant vægtøgning (≥ 7 % af kropsvægten) i den dobbeltblinde periode 5,6 % for både ziprasidon og placebobehandlingsgrupper, som gennemførte de 6 måneders observation for tilbagefald. Fortolkning af disse resultater bør tage i betragtning, at kun patienter, som tilstrækkeligt tolererede ziprasidon, gik ind i den dobbeltblinde fase af undersøgelsen, og der var betydelige frafald under den åbne fase.
Udslæt
præmarketingforsøg med ziprasidon udviklede omkring 5 % af patienterne udslæt og/eller nældefeber, med seponering af behandlingen i omkring en sjettedel af disse tilfælde. Forekomsten af udslæt var relateret til dosis af ziprasidon, selvom fundet også kan forklares med den længere eksponeringstid hos patienter med højere dosis. Flere patienter med udslæt havde tegn og symptomer på associeret systemisk sygdom, f.eks. forhøjede WBC'er. De fleste patienter forbedredes omgående med supplerende behandling med antihistaminer eller steroider og/eller efter seponering af ziprasidon, og alle patienter, der oplevede disse reaktioner, blev rapporteret at komme sig fuldstændigt. Ved forekomst af udslæt, for hvilke en alternativ ætiologi ikke kan identificeres, bør ziprasidon seponeres.
Ortostatisk hypotension
Ziprasidon kan inducere ortostatisk hypotension forbundet med svimmelhed, takykardi og, hos nogle patienter, synkope, især i den indledende dosistitreringsperiode, hvilket sandsynligvis afspejler dets α1-adrenerge antagonistegenskaber. Synkope blev rapporteret hos 0,6 % af patienterne behandlet med ziprasidon.
Ziprasidon bør anvendes med særlig forsigtighed til patienter med kendt kardiovaskulær sygdom (historie med myokardieinfarkt eller iskæmisk hjertesygdom, hjertesvigt eller ledningsabnormiteter), cerebrovaskulær sygdom eller tilstande, der kan disponere patienter for hypotension (dehydrering, hypovolæmi og behandling med antihypertensiva) medicin).
Falls
Antipsykotiske lægemidler (som inkluderer GEODON) kan forårsage somnolens, postural hypotension og motorisk og sensorisk ustabilitet, hvilket kan føre til fald og som følge heraf brud eller andre skader. For patienter med sygdomme, tilstande eller medicin, der kan forværre disse virkninger, udfør faldrisikovurderinger ved påbegyndelse af antipsykotisk behandling og tilbagevendende for patienter i langvarig antipsykotisk behandling.
Leukopeni, Neutropeni og Agranulocytose
I kliniske forsøg og efter markedsføring er der rapporteret hændelser af leukopeni/neutropeni, der er tidsmæssigt relateret til antipsykotiske midler. Agranulocytose (inklusive dødelige tilfælde) er også blevet rapporteret.
Mulige risikofaktorer for leukopeni/neutropeni omfatter allerede eksisterende lavt antal hvide blodlegemer (WBC) og historie med lægemiddelinduceret leukopeni/neutropeni. Patienter med et allerede eksisterende lavt hvidt blodlegeme eller en historie med lægemiddelinduceret leukopeni/neutropeni bør have deres fuldstændige blodtal (CBC) overvåget hyppigt i løbet af de første par måneder af behandlingen og bør seponere med GEODON ved det første tegn på fald i hvidt blodlegemer i fravær andre årsagsfaktorer.
Patienter med neutropeni bør overvåges omhyggeligt for feber eller andre symptomer eller tegn på infektion og behandles omgående, hvis sådanne symptomer eller tegn opstår. Patienter med svær neutropeni (absolut neutrofiltal
Anfald
Under kliniske forsøg forekom anfald hos 0,4 % af patienterne behandlet med ziprasidon. Der var forvirrende faktorer, der kan have bidraget til forekomsten af anfald i mange af disse tilfælde. Som med andre antipsykotiske lægemidler bør ziprasidon anvendes med forsigtighed hos patienter med anfald i anamnesen eller med tilstande, der potentielt sænker anfaldstærsklen, f.eks. Alzheimers demens. Tilstande, der sænker anfaldstærsklen, kan være mere udbredt i en befolkning på 65 år eller ældre.
Dysfagi
Esophageal dysmotilitet og aspiration er blevet forbundet med antipsykotisk stofbrug. Aspirationspneumoni er en almindelig årsag til morbiditet og dødelighed hos ældre patienter, især dem med fremskreden Alzheimers demens. Ziprasidon og andre antipsykotiske lægemidler bør anvendes med forsigtighed hos patienter med risiko for aspirationspneumoni [se KASSE ADVARSEL ].
Hyperprolactinæmi
Som med andre lægemidler, der antagoniserer dopamin D2-receptorer, hæver ziprasidon prolaktinniveauet hos mennesker. Forøgede prolactinniveauer blev også observeret i dyreforsøg med denne forbindelse og var forbundet med en stigning i mælkekirtelneoplasi hos mus; en lignende virkning blev ikke observeret hos rotter [se Ikke-klinisk toksikologi ]. Vævskulturforsøg indikerer, at ca. en tredjedel af humane brystkræfttilfælde er prolaktinafhængige in vitro, en faktor af potentiel betydning, hvis ordination af disse lægemidler overvejes til en patient med tidligere påvist brystkræft. Hverken kliniske undersøgelser eller epidemiologiske undersøgelser udført til dato har vist en sammenhæng mellem kronisk administration af denne klasse af lægemidler og tumordannelse hos mennesker; den tilgængelige dokumentation anses for at være for begrænset til at være afgørende på nuværende tidspunkt.
Selvom forstyrrelser såsom galaktoré, amenoré, gynækomasti og impotens er blevet rapporteret med prolaktinforøgende stoffer, er den kliniske betydning af forhøjede serumprolaktinniveauer ukendt for de fleste patienter. Langvarig hyperprolaktinæmi, når det er forbundet med hypogonadisme, kan føre til nedsat knogletæthed.
Potentiale for kognitiv og motorisk svækkelse
Somnolens var en almindeligt rapporteret bivirkning hos patienter behandlet med ziprasidon. I de 4- og 6-ugers placebokontrollerede undersøgelser blev der rapporteret somnolens hos 14 % af patienterne på ziprasidon sammenlignet med 7 % af placebopatienterne. Somnolens førte til seponering hos 0,3 % af patienterne i kortvarige kliniske forsøg. Da ziprasidon har potentiale til at svække dømmekraft, tænkning eller motoriske færdigheder, bør patienter advares om at udføre aktiviteter, der kræver mental årvågenhed, såsom at betjene et motorkøretøj (inklusive biler) eller betjene farligt maskineri, indtil de er rimeligt sikre på, at ziprasidonbehandling ikke påvirke dem negativt.
Priapisme
Et tilfælde af priapisme blev rapporteret i præmarketingdatabasen. Selvom sammenhængen mellem reaktionen på brug af ziprasidon ikke er blevet fastslået, er andre lægemidler med alfa-adrenerge blokerende virkninger blevet rapporteret at inducere priapisme, og det er muligt, at ziprasidon kan dele denne kapacitet. Svær priapisme kan kræve kirurgisk indgreb.
Kropstemperaturregulering
Selvom det ikke er rapporteret med ziprasidon i præmarketing-forsøg, er forstyrrelse af kroppens evne til at reducere kernekropstemperaturen blevet tilskrevet antipsykotiske midler. Passende pleje tilrådes, når ziprasidon ordineres til patienter, som vil opleve tilstande, som kan bidrage til en stigning i kernekropstemperaturen, f.eks. anstrengende motion, udsættelse for ekstrem varme, samtidig behandling med antikolinerg aktivitet eller udsat for dehydrering.
Selvmord
Muligheden for et selvmordsforsøg er iboende i psykotisk sygdom eller bipolar lidelse, og tæt overvågning af højrisikopatienter bør ledsage lægemiddelbehandling. Recepter for ziprasidon bør udskrives for den mindste mængde kapsler i overensstemmelse med god patientbehandling for at reducere risikoen for overdosering.
Patienter med samtidige sygdomme
Klinisk erfaring med ziprasidon hos patienter med visse samtidige systemiske sygdomme er begrænset [se Brug i specifikke populationer ].
Ziprasidon er ikke blevet evalueret eller brugt i nævneværdigt omfang hos patienter med en nylig historie med myokardieinfarkt eller ustabil hjertesygdom. Patienter med disse diagnoser blev udelukket fra præmarketing kliniske undersøgelser. På grund af risikoen for QTc-forlængelse og ortostatisk hypotension med ziprasidon bør der udvises forsigtighed hos hjertepatienter. [se QT-forlængelse og risiko for pludselig død, ortostatisk hypotension ].
Laboratorieprøver
Patienter, der overvejes til ziprasidon-behandling, og som er i risiko for betydelige elektrolytforstyrrelser, bør have baseline-målinger af kalium og magnesium i serum. Lavt serumkalium og magnesium bør erstattes, før behandlingen fortsættes. Patienter, der er startet på diuretika under Ziprasidon-behandling, har behov for periodisk monitorering af serumkalium og magnesium. Ziprasidon bør seponeres hos patienter, der viser sig at have vedvarende QTc-målinger >500 msek [se QT-forlængelse og risiko for pludselig død ].
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( PATIENTOPLYSNINGER ).
Administrationsoplysninger til kapsler
Rådgiv patienterne at tage GEODON kapsler hele. Du må ikke åbne, knuse eller tygge kapslerne. Instruer patienterne i at tage GEODON kapsler sammen med mad for optimal absorption. Absorptionen af ziprasidon øges op til det dobbelte ved tilstedeværelse af mad [se DOSERING OG ADMINISTRATION , DRUGSINTERAKTIONER , og KLINISK FARMAKOLOGI ].
QTc forlængelse
Råd patienter til at informere deres sundhedspersonale om følgende: Anamnese med QT-forlængelse; nyligt akut myokardieinfarkt; ukompenseret hjertesvigt; ordination af andre lægemidler, der har vist QT-forlængelse; risiko for betydelige elektrolytabnormiteter; og historie med hjertearytmi [se KONTRAINDIKATIONER og ADVARSLER OG FORHOLDSREGLER ].
Instruer patienterne i at rapportere indtræden af enhver tilstand, der sætter dem i fare for betydelige elektrolytforstyrrelser, især hypokaliæmi, herunder, men ikke begrænset til, påbegyndelse af diuretikabehandling eller langvarig diarré. Instruer desuden patienterne i at rapportere symptomer som svimmelhed, hjertebanken eller synkope til den ordinerende læge [se ADVARSLER OG FORHOLDSREGLER ].
Alvorlige kutane bivirkninger
Instruer patienterne i at rapportere til deres sundhedsplejerske hurtigst muligt tegn eller symptomer, der kan være forbundet med lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS) eller med alvorlige kutane bivirkninger, såsom Stevens-Johnsons syndrom [se ADVARSLER OG FORHOLDSREGLER ].
Graviditet
Rådfør gravide kvinder om at underrette deres læge, hvis de bliver gravide eller har til hensigt at blive gravide under behandling med GEODON. Rådgiv patienterne om, at GEODON kan forårsage ekstrapyramidale og/eller abstinenssymptomer (agitation, hypertoni, hypotoni, tremor, somnolens, åndedrætsbesvær og spiseforstyrrelser) hos en nyfødt. Rådgiv patienterne om, at der findes et graviditetseksponeringsregister, der overvåger graviditetsresultater hos kvinder, der er eksponeret for GEODON under graviditeten [se Brug i specifikke populationer ].
Amning
Råd ammende kvinder, der bruger GEODON 20mg til at overvåge spædbørn for overdreven sedation, irritabilitet, dårlig ernæring og ekstrapyramidale symptomer (rysten og unormale muskelbevægelser) og til at søge lægehjælp, hvis de bemærker disse tegn [se Brug i specifikke populationer ].
Infertilitet
Informer kvinder med reproduktionspotentiale om, at GEODON 80 mg kan forringe fertiliteten på grund af en stigning i serumprolaktinniveauet. Virkningerne på fertiliteten er reversible [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
Livstidscarcinogenicitetsundersøgelser blev udført med ziprasidon i Long Evans-rotter og CD-1-mus. Ziprasidon blev administreret i 24 måneder i kosten i doser på 2, 6 eller 12 mg/kg/dag til rotter og 50, 100 eller 200 mg/kg/dag til mus (0,1 til 0,6 og 1 til 5 gange maksimal anbefalet human dosis (MRHD) på 200 mg/dag baseret på henholdsvis mg/m2 kropsoverfladeareal). I rottestudiet var der ingen tegn på en øget forekomst af tumorer sammenlignet med kontroller. Hos hanmus var der ingen stigning i forekomsten af tumorer i forhold til kontroller. Hos hunmus var der dosisrelaterede stigninger i forekomsten af hypofyseadenom og karcinom og brystkirteladenokarcinom ved alle testede doser (50 til 200 mg/kg/dag eller 1 til 5 gange MRHD baseret på mg/m2 krop overfladeareal). Proliferative ændringer i hypofysen og mælkekirtlerne hos gnavere er blevet observeret efter kronisk administration af andre antipsykotiske midler og anses for at være prolaktin-medieret. Stigninger i serumprolaktin blev observeret i en 1-måneds diætundersøgelse med hunmus, men ikke hanmus, med 100 og 200 mg/kg/dag (eller 2,5 og 5 gange MRHD baseret på mg/m2 kropsoverfladeareal). Ziprasidon havde ingen effekt på serumprolaktin hos rotter i en 5-ugers diætundersøgelse ved de doser, der blev brugt i karcinogenicitetsundersøgelsen. Relevansen for human risiko af fund af prolaktin-medierede endokrine tumorer hos gnavere er ukendt [se ADVARSLER OG FORHOLDSREGLER ].
Mutagenese
Ziprasidon blev testet i Ames bakterielle mutationsassay, in vitro pattedyrcellegenmutation muse lymfom assay, in vitro kromosomafvigelsesassay i humane lymfocytter og in vivo kromosomafvigelse assay i museknoglemarv. Der var et reproducerbart mutagent respons i Ames-analysen i én stamme af S. typhimurium i fravær af metabolisk aktivering. Positive resultater blev opnået i både in vitro pattedyrscellegenmutationsassayet og in vitro kromosomafvigelsesassayet i humane lymfocytter.
Forringelse af fertilitet
Ziprasidon blev vist at øge tiden til kopulation hos Sprague-Dawley-rotter i to fertilitets- og tidlig embryonal udviklingsundersøgelser ved doser på 10 til 160 mg/kg/dag (0,5 til 8 gange MRHD på 200 mg/dag baseret på mg/m2 krop) overfladeareal). Fertilitetsraten blev reduceret med 160 mg/kg/dag (8 gange MRHD baseret på mg/m2 kropsoverfladeareal). Der var ingen effekt på fertiliteten ved 40 mg/kg/dag (2 gange MRHD baseret på mg/m2 kropsoverfladeareal). Virkningen på fertiliteten så ud til at være hos hunnen, da fertiliteten ikke blev svækket, når hanner fik 160 mg/kg/dag (8 gange MRHD baseret på mg/m2 kropsoverfladeareal) blev parret med ubehandlede hunner.
Brug i specifikke populationer
Graviditet
Graviditetseksponeringsregister
Der er et graviditetseksponeringsregister, der overvåger graviditetsresultater hos kvinder, der er udsat for atypiske antipsykotika, herunder GEODON 40 mg, under graviditet. Sundhedsudbydere opfordres til at registrere patienter ved at kontakte National Pregnancy Registry for Atypical Antipsychotics på 1-866-961-2388 eller online på http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/.
Risikooversigt
Nyfødte, der er udsat for antipsykotiske lægemidler, herunder GEODON, i tredje trimester er i risiko for ekstrapyramidale og/eller abstinenssymptomer efter fødslen (se Kliniske overvejelser ). Overordnede tilgængelige data fra publicerede epidemiologiske undersøgelser af gravide kvinder udsat for ziprasidon har ikke påvist en lægemiddelassocieret risiko for alvorlige fødselsdefekter, abort eller uønskede maternelle eller føtale udfald (se Data ). Der er risici for moderen forbundet med ubehandlet skizofreni eller bipolar lidelse I og med eksponering for antipsykotika, herunder GEODON, under graviditet (se Kliniske overvejelser ).
dyreforsøg forårsagede administration af ziprasidon til gravide rotter og kaniner under organogenese udviklingstoksicitet ved doser svarende til anbefalede humane doser og var teratogent hos kaniner ved 3 gange den maksimalt anbefalede humane dosis (MRHD). Rotter, der blev eksponeret for ziprasidon under drægtighed og diegivning, udviste øget perinatal ungdødelighed og forsinket neuroadfærdsmæssig og funktionel udvikling af afkom ved doser mindre end eller svarende til humane terapeutiske doser (se Data ).
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort for de angivne populationer er ukendt. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre ugunstige udfald. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 til 4 % og 15 til 20 %.
Kliniske overvejelser
Sygdomsrelateret risiko for moder og/eller embryo/føtal
Der er risiko for moderen fra ubehandlet skizofreni eller bipolar lidelse I, herunder øget risiko for tilbagefald, hospitalsindlæggelse og selvmord. Skizofreni og bipolar lidelse I er forbundet med øgede uønskede perinatale udfald, herunder for tidlig fødsel. Det vides ikke, om dette er et direkte resultat af sygdommen eller andre komorbide faktorer.
Fetale/neonatale bivirkninger
Ekstrapyramidale og/eller abstinenssymptomer, herunder agitation, hypertoni, hypotoni, tremor, somnolens, åndedrætsbesvær og spiseforstyrrelser er blevet rapporteret hos nyfødte, som blev eksponeret for antipsykotiske lægemidler, inklusive GEODON, under graviditetens tredje trimester. Disse symptomer har varieret i sværhedsgrad. Overvåg nyfødte for ekstrapyramidale og/eller abstinenssymptomer og håndtering af symptomerne på passende vis. Nogle nyfødte kom sig inden for timer eller dage uden specifik behandling; andre krævede længere tids indlæggelse.
Data
Menneskelige data
Publicerede data fra observationsstudier, fødselsregistre og case-rapporter om brug af atypiske antipsykotika under graviditet rapporterer ikke en klar sammenhæng med antipsykotika og større fødselsdefekter. Et retrospektivt kohortestudie fra en Medicaid-database med 9258 kvinder, der blev eksponeret for antipsykotika under graviditet, indikerede ikke en samlet øget risiko for alvorlige fødselsdefekter.
Dyredata
Når ziprasidon blev administreret til drægtige kaniner i perioden med organogenese, blev der observeret en øget forekomst af føtale strukturelle abnormiteter (ventrikulære septumdefekter og andre kardiovaskulære misdannelser og nyreændringer) ved en dosis på 30 mg/kg/dag (3 gange MRHD) på 200 mg/dag baseret på mg/m2 kropsoverflade). Der var ingen beviser for, at disse udviklingsmæssige virkninger var sekundære til maternel toksicitet. Udviklingsdosis uden effekt var 10 mg/kg/dag (svarende til MRHD baseret på et mg/m2 legemsoverfladeareal). Hos rotter blev embryoføtal toksicitet (nedsat fostervægt, forsinket skeletforbening) observeret efter administration af 10 til 160 mg/kg/dag (0,5 til 8 gange MRHD baseret på mg/m2 kropsoverfladeareal) under organogenese eller gennem hele graviditeten, men der var ingen tegn på teratogenicitet. Doser på 40 og 160 mg/kg/dag (2 og 8 gange MRHD baseret på mg/m2 kropsoverfladeareal) var forbundet med maternel toksicitet. Udviklingsdosis uden effekt er 5 mg/kg/dag (0,2 gange MRHD baseret på mg/m2 kropsoverfladeareal).
Der var en stigning i antallet af unger født døde og et fald i postnatal overlevelse gennem de første 4 dage af diegivning blandt afkommet af hunrotter behandlet under drægtighed og diegivning med doser på 10 mg/kg/dag (0,5 gange MRHD-baseret på mg/m2 kropsoverflade) eller mere. Afkoms udviklingsforsinkelser (nedsat hvalpevægt) og neuroadfærdsmæssig funktionsnedsættelse (øjenåbningsluft) blev observeret ved doser på 5 mg/kg/dag (0,2 gange MRHD baseret på mg/m2 kropsoverfladeareal) eller mere. Der blev ikke etableret et no-effekt niveau for disse effekter.
Amning
Risikooversigt
Begrænsede data fra en offentliggjort case-rapport indikerer tilstedeværelsen af ziprasidon i modermælk. Selvom der ikke er rapporter om bivirkninger på et ammet spædbarn, der er udsat for ziprasidon via modermælk, er der rapporter om overdreven sedation, irritabilitet, dårlig ernæring og ekstrapyramidale symptomer (rysten og unormale muskelbevægelser) hos spædbørn, der er udsat for andre atypiske antipsykotika gennem brystet. mælk (se Kliniske overvejelser ). Der er ingen information om virkningerne af ziprasidon på mælkeproduktionen. De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for GEODON og eventuelle negative virkninger på det ammede barn fra GEODON 20mg eller fra moderens underliggende tilstand.
Kliniske overvejelser
Spædbørn, der udsættes for GEODON, bør overvåges for overdreven sedation, irritabilitet, dårlig ernæring og ekstrapyramidale symptomer (rysten og unormale muskelbevægelser).
Hunner og mænd med reproduktionspotentiale
Infertilitet
Kvinder
Baseret på den farmakologiske virkning af ziprasidon (D2-antagonisme), kan behandling med GEODON 40 mg resultere i en stigning i serumprolaktinniveauet, hvilket kan føre til en reversibel reduktion i fertiliteten hos kvinder med reproduktionspotentiale [se ADVARSLER OG FORHOLDSREGLER og Ikke-klinisk toksikologi ].
Pædiatrisk brug
Sikkerheden og effektiviteten af ziprasidon hos pædiatriske patienter er ikke blevet fastslået.
Geriatrisk brug
Af det samlede antal forsøgspersoner i kliniske studier af ziprasidon var 2,4 procent 65 og derover. Der blev ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet mellem disse forsøgspersoner og yngre forsøgspersoner, og anden rapporteret klinisk erfaring har ikke identificeret forskelle i respons mellem ældre og yngre patienter, men større følsomhed hos nogle ældre individer kan ikke udelukkes. Ikke desto mindre bør tilstedeværelsen af flere faktorer, der kan øge det farmakodynamiske respons på ziprasidon, eller forårsage dårligere tolerance eller ortostase, føre til overvejelse af en lavere startdosis, langsommere titrering og omhyggelig overvågning under den indledende doseringsperiode for nogle ældre patienter.
Ziprasidon intramuskulært er ikke blevet systematisk evalueret hos ældre patienter (65 år og derover).
Nedsat nyrefunktion
Fordi ziprasidon er højt metaboliseret, med mindre end 1 % af lægemidlet udskilt uændret, er det usandsynligt, at nedsat nyrefunktion alene vil have en større indvirkning på ziprasidons farmakokinetik. Farmakokinetikken for ziprasidon efter 8 dage med 20 mg to gange daglig dosering var ens blandt forsøgspersoner med varierende grader af nedsat nyrefunktion (n=27) og forsøgspersoner med normal nyrefunktion, hvilket indikerer, at dosisjustering baseret på graden af nedsat nyrefunktion ikke er nødvendig. . Ziprasidon fjernes ikke ved hæmodialyse.
Intramuskulær ziprasidon er ikke blevet systematisk evalueret hos ældre patienter eller hos patienter med nedsat lever- eller nyrefunktion. Da hjælpestoffet cyclodextrin udskilles ved nyrefiltrering, bør ziprasidon intramuskulært administreres med forsigtighed til patienter med nedsat nyrefunktion [se KLINISK FARMAKOLOGI ].
Nedsat leverfunktion
Da ziprasidon udskilles væsentligt af leveren, forventes tilstedeværelsen af nedsat leverfunktion at øge AUC af ziprasidon; et flerdosisstudie på 20 mg to gange dagligt i 5 dage i forsøgspersoner (n=13) med klinisk signifikant (Childs-Pugh klasse A og B) skrumpelever afslørede en stigning i AUC 0-12 på 13 % og 34 % hos Childs- Pugh klasse A og B, henholdsvis sammenlignet med en matchet kontrolgruppe (n=14). En halveringstid på 7,1 timer blev observeret hos personer med cirrose sammenlignet med 4,8 timer i kontrolgruppen.
Effekter på alder og køn
et flerdosisstudie (8 dages behandling) med 32 forsøgspersoner var der ingen forskel i farmakokinetikken af ziprasidon mellem mænd og kvinder eller mellem ældre (>65 år) og unge (18 til 45 år) forsøgspersoner. Derudover har populationsfarmakokinetisk evaluering af patienter i kontrollerede forsøg ikke afsløret nogen tegn på klinisk signifikante alders- eller kønsrelaterede forskelle i ziprasidons farmakokinetik. Dosisændringer for alder eller køn anbefales derfor ikke.
Rygning
Baseret på in vitro undersøgelser, hvor der anvendes humane leverenzymer, er ziprasidon ikke et substrat for CYP1A2; rygning bør derfor ikke have en effekt på farmakokinetikken af ziprasidon. I overensstemmelse med disse in vitro-resultater har en populationsfarmakokinetisk evaluering ikke afsløret nogen signifikante farmakokinetiske forskelle mellem rygere og ikke-rygere.
OVERDOSIS
Menneskelig oplevelse
præmarketingforsøg, der involverede mere end 5400 patienter og/eller normale forsøgspersoner, blev utilsigtet eller tilsigtet overdosering af oral ziprasidon dokumenteret hos 10 patienter. Alle disse patienter overlevede uden følgesygdomme. Hos patienten, der tog den største bekræftede mængde, 3.240 mg, var de eneste rapporterede symptomer minimal sedation, sløret tale og forbigående hypertension (200/95).
Bivirkninger rapporteret ved overdosis af ziprasidon omfattede ekstrapyramidale symptomer, somnolens, tremor og angst. [se BIVIRKNINGER ]
Håndtering af overdosering
I tilfælde af akut overdosering skal der etableres og vedligeholdes en luftvej og sikres tilstrækkelig iltning og ventilation. Der bør etableres intravenøs adgang, og maveskylning (efter intubation, hvis patienten er bevidstløs) og administration af aktivt kul sammen med et afføringsmiddel bør overvejes. Muligheden for forstuvning, krampeanfald eller dystonisk reaktion af hoved og hals efter overdosering kan skabe en risiko for aspiration med fremkaldt emesis.
Kardiovaskulær monitorering bør påbegyndes øjeblikkeligt og bør omfatte kontinuerlig elektrokardiografisk monitorering for at påvise mulige arytmier. Hvis antiarytmisk behandling administreres, medfører disopyramid, procainamid og quinidin en teoretisk risiko for additive QT-forlængende virkninger, der kan være additive til ziprasidons.
Hypotension og kredsløbskollaps bør behandles med passende foranstaltninger såsom intravenøse væsker. Hvis der anvendes sympatomimetiske midler til vaskulær støtte, bør adrenalin og dopamin ikke anvendes, da beta-stimulering kombineret med α1-antagonisme forbundet med ziprasidon kan forværre hypotension. På samme måde er det rimeligt at forvente, at bretyliums alfa-adrenerg-blokerende egenskaber kan være additive til ziprasidons, hvilket resulterer i problematisk hypotension.
tilfælde af alvorlige ekstrapyramidale symptomer bør antikolinerg medicin gives. Der er ingen specifik modgift mod ziprasidon, og det er ikke dialyserbart. Muligheden for involvering af flere lægemidler bør overvejes. Tæt medicinsk overvågning og overvågning bør fortsætte, indtil patienten kommer sig.
KONTRAINDIKATIONER
QT forlængelse
På grund af ziprasidons dosisrelaterede forlængelse af QT-intervallet og den kendte sammenhæng mellem dødelige arytmier med QT-forlængelse af visse andre lægemidler, er ziprasidon kontraindiceret:
- hos patienter med en kendt historie med QT-forlængelse (inklusive medfødt langt QT-syndrom)
- hos patienter med nyligt akut myokardieinfarkt
- hos patienter med ukompenseret hjertesvigt
Farmakokinetiske/farmakodynamiske undersøgelser mellem ziprasidon og andre lægemidler, der forlænger QT-intervallet, er ikke blevet udført. En additiv effekt af ziprasidon og andre lægemidler, der forlænger QT-intervallet, kan ikke udelukkes. Derfor bør ziprasidon ikke gives sammen med:
- dofetilid, sotalol, quinidin, andre Klasse Ia og III antiarytmika, mesoridazin, thioridazin, chlorpromazin, droperidol, pimozid, sparfloxacin, gatifloxacin, moxifloxacin, halofantrin, mefloquin, pentamidin, pentamidin, arsen, tabulimoxid, arsen, tabulimacetat, lemetholoxid, tabulimacetat eller tabulim.
- andre lægemidler, der har påvist QT-forlængelse som en af deres farmakodynamiske virkninger og har denne effekt beskrevet i den fulde ordinationsinformation som en kontraindikation eller en advarsel med indrammet eller fed skrift [se ADVARSLER OG FORHOLDSREGLER ].
Overfølsomhed
Ziprasidon er kontraindiceret hos personer med kendt overfølsomhed over for produktet.
KLINISK FARMAKOLOGI
Handlingsmekanisme
Virkningsmekanismen af ziprasidon i behandlingen af de anførte indikationer kunne medieres gennem en kombination af dopamin type 2 (D2) og serotonin type 2 (5HT2) antagonisme.
Farmakodynamik
Ziprasidon binder med relativt høj affinitet til dopamin D2 og D3, serotonin 5HT2A, 5HT2C, 5HT1A, 5HT1D og α1-adrenerge receptorer (Ki s på henholdsvis 4,8, 7,2, 0,4, 1,3, 3,4, 2,M og 2,M). og med moderat affinitet til histamin H1-receptoren (Ki=47 nM). Ziprasidon er en antagonist ved D2-, 5HT2A- og 5HT1D-receptorerne og en agonist ved 5HT1A-receptoren. Ziprasidon hæmmede synaptisk genoptagelse af serotonin og noradrenalin. Der blev ikke udvist nogen nævneværdig affinitet for andre testede receptor/bindingssteder, inklusive den cholinerge muskarine receptor (IC50 >1 μM).
Farmakokinetik
Oral farmakokinetik
Ziprasidons aktivitet skyldes primært moderlægemidlet. Multidosis-farmakokinetikken af ziprasidon er dosisproportional inden for det foreslåede kliniske dosisområde, og ziprasidon-akkumulering er forudsigelig ved multipel dosering. Elimination af ziprasidon sker hovedsageligt via levermetabolisme med en gennemsnitlig terminal halveringstid på ca. 7 timer inden for det foreslåede kliniske dosisinterval. Steady-state-koncentrationer opnås inden for en til tre dage efter dosering. Den gennemsnitlige tilsyneladende systemiske clearance er 7,5 ml/min/kg. Det er usandsynligt, at Ziprasidon interfererer med metabolismen af lægemidler, der metaboliseres af cytokrom P450-enzymer.
Absorption
Ziprasidon absorberes godt efter oral administration og når maksimale plasmakoncentrationer efter 6 til 8 timer. Den absolutte biotilgængelighed af en 20 mg dosis under fodrede forhold er ca. 60 %. Absorptionen af ziprasidon øges op til det dobbelte ved tilstedeværelse af mad.
Fordeling
Ziprasidon har et gennemsnitligt tilsyneladende distributionsvolumen på 1,5 l/kg. Det er mere end 99 % bundet til plasmaproteiner og binder primært til albumin og α1-syreglycoprotein. In vitro plasmaproteinbindingen af ziprasidon blev ikke ændret af warfarin eller propranolol, to stærkt proteinbundne lægemidler, og ziprasidon ændrede heller ikke bindingen af disse lægemidler i humant plasma. Potentialet for lægemiddelinteraktioner med ziprasidon på grund af forskydning er således minimalt.
Metabolisme og eliminering
Ziprasidon metaboliseres i vid udstrækning efter oral administration, og kun en lille mængde udskilles i urinen (
Intramuskulær farmakokinetik
Systemisk biotilgængelighed
Biotilgængeligheden af ziprasidon administreret intramuskulært er 100 %. Efter intramuskulær administration af enkeltdoser forekommer maksimale serumkoncentrationer typisk ca. 60 minutter efter dosis eller tidligere, og den gennemsnitlige halveringstid (T½) varierer fra to til fem timer. Eksponeringen stiger på en dosisrelateret måde, og efter tre dages intramuskulær dosering observeres lille ophobning.
Metabolisme og eliminering
Selvom metabolismen og eliminationen af IM ziprasidon ikke er blevet systematisk evalueret, forventes den intramuskulære indgivelsesvej ikke at ændre de metaboliske veje.
Kliniske Studier
Skizofreni
Effekten af oral ziprasidon til behandling af skizofreni blev evalueret i 5 placebokontrollerede undersøgelser, 4 kortvarige (4- og 6-ugers) undersøgelser og et vedligeholdelsesforsøg. Alle forsøg var hos voksne indlagte patienter, hvoraf de fleste opfyldte DSM III-R kriterierne for skizofreni. Hver undersøgelse inkluderede 2 til 3 faste doser ziprasidon samt placebo. Fire af de 5 forsøg var i stand til at skelne ziprasidon fra placebo; en korttidsundersøgelse gjorde det ikke. Selvom en enkelt fastdosis haloperidolarm blev inkluderet som en sammenlignende behandling i et af de tre korttidsforsøg, var denne enkelt undersøgelse utilstrækkelig til at give en pålidelig og valid sammenligning af ziprasidon og haloperidol.
Adskillige instrumenter blev brugt til at vurdere psykiatriske tegn og symptomer i disse undersøgelser. The Brief Psychiatric Rating Scale (BPRS) og Positive and Negative Syndrome Scale (PANSS) er begge multi-item opgørelser af generel psykopatologi, der normalt bruges til at evaluere virkningerne af medikamentel behandling ved skizofreni. BPRS-psykoseklyngen (konceptuel desorganisering, hallucinatorisk adfærd, mistænksomhed og usædvanligt tankeindhold) betragtes som en særlig nyttig undergruppe til vurdering af aktivt psykotiske skizofrene patienter. En anden udbredt vurdering, Clinical Global Impression (CGI), afspejler indtrykket af en dygtig observatør, som er fuldt fortrolig med manifestationerne af skizofreni, om patientens overordnede kliniske tilstand. Derudover blev skalaen for vurdering af negative symptomer (SANS) brugt til at vurdere negative symptomer i et forsøg.
Resultaterne af de orale Ziprasidon-forsøg ved skizofreni følger
- et 4-ugers, placebo-kontrolleret forsøg (n=139), der sammenlignede 2 faste doser ziprasidon (20 og 60 mg to gange dagligt) med placebo, var kun 60 mg-dosis overlegen end placebo med hensyn til BPRS-totalscore og CGI-sværhedsgrad. score. Denne gruppe med højere dosis var ikke bedre end placebo på BPRS-psykoseklyngen eller på SANS.
- I et 6-ugers, placebo-kontrolleret forsøg (n=302), der sammenlignede 2 faste doser ziprasidon (40 og 80 mg to gange dagligt) med placebo, var begge dosisgrupper overlegne end placebo på BPRS-totalscore, BPRS-psykoseklyngen, CGI-alvorlighedsscoren og PANSS samlede og negative subskala-score. Selvom 80 mg to gange dagligt havde en numerisk større effekt end 40 mg to gange dagligt, var forskellen ikke statistisk signifikant.
- et 6-ugers, placebo-kontrolleret forsøg (n=419), der sammenlignede 3 faste doser ziprasidon (20, 60 og 100 mg to gange dagligt) med placebo, var alle tre dosisgrupper overlegne end placebo på PANSS-totalscore, dvs. BPRS total score, BPRS psykose klyngen og CGI sværhedsgraden score. Kun 100 mg to gange dagligt dosisgruppen var overlegen i forhold til placebo på PANSS negative subskala-score. Der var ingen klar evidens for et dosis-respons-forhold inden for dosisområdet 20 mg to gange dagligt til 100 mg to gange dagligt.
- I et 4-ugers, placebo-kontrolleret forsøg (n=200), der sammenlignede 3 faste doser af ziprasidon (5, 20 og 40 mg to gange dagligt), var ingen af dosisgrupperne statistisk overlegne end placebo med hensyn til noget resultat af interesse.
- En undersøgelse blev udført i stabile kroniske eller subkroniske (CGI-S ≤5 ved baseline) skizofrene indlagte patienter (n=294), som havde været indlagt i ikke mindre end to måneder. Efter en 3-dages enkelt-blind placebo-indkøring blev forsøgspersonerne randomiseret til en af 3 faste doser ziprasidon (20 mg, 40 mg eller 80 mg to gange dagligt) eller placebo og observeret for tilbagefald. Patienter blev observeret for "forestående psykotisk tilbagefald", defineret som CGI-forbedringsscore på ≤6 (meget værre eller meget værre) og/eller score ≤6 (moderat alvorligt) på fjendtligheds- eller manglende samarbejdsevne i PANSS to på hinanden følgende dage . Ziprasidon var signifikant bedre end placebo i tid til tilbagefald, uden signifikant forskel mellem de forskellige dosisgrupper. Der var utilstrækkelige data til at undersøge populationsundergrupper baseret på alder og race. Undersøgelse af befolkningsundergrupper baseret på køn afslørede ikke nogen differentiel reaktionsevne.
Bipolar I lidelse (akutte blandede eller maniske episoder og vedligeholdelsesbehandling som et supplement til lithium eller valproat)
Akut manisk og blandede episoder forbundet med bipolar I-lidelse
Effekten af ziprasidon blev fastslået i 2 placebokontrollerede, dobbeltblindede, 3-ugers monoterapiundersøgelser hos patienter, der opfylder DSM-IV-kriterierne for bipolar I lidelse, manisk eller blandet episode med eller uden psykotiske træk. Primære vurderingsinstrumenter, der blev brugt til at vurdere maniske symptomer i disse forsøg, var: (1) Mania Rating Scale (MRS), som er afledt af Schedule for Affective Disorders and Skizophrenia-Change Version (SADS-CB) med emner grupperet som manisk syndrom underskala (forhøjet humør, mindre behov for søvn, overdreven energi, overdreven aktivitet, storslåethed), Behavior and Ideation subscale (irritabilitet, motorisk hyperaktivitet, accelereret tale, racende tanker, dårlig dømmekraft) og nedsat indsigt; og (2) Clinical Global Impression-Severity of Illness Scale (CGI-S), som blev brugt til at vurdere den kliniske betydning af behandlingsrespons.
Resultaterne af de orale ziprasidon-forsøg med bipolar I-lidelse hos voksne, manisk/blandet episode følger: i et 3-ugers placebokontrolleret forsøg (n=210) var dosis af ziprasidon 40 mg to gange dagligt på dag 1 og 80 mg to gange dagligt på dag 2. Titrering inden for intervallet 40-80 mg to gange dagligt (i intervaller på 20 mg to gange dagligt) var tilladt under undersøgelsens varighed. Ziprasidon var signifikant mere effektivt end placebo til reduktion af MRS total score og CGI-S score. Den gennemsnitlige daglige dosis af ziprasidon i denne undersøgelse var 132 mg. I et andet 3-ugers placebokontrolleret forsøg (n=205) var dosis af ziprasidon 40 mg to gange dagligt på dag 1. Titrering inden for intervallet 40-80 mg to gange dagligt (i intervaller på 20 mg to gange dagligt) var tilladt for hele studiets varighed (begyndende på dag 2). Ziprasidon var signifikant mere effektivt end placebo til reduktion af MRS total score og CGI-S score. Den gennemsnitlige daglige dosis af ziprasidon i denne undersøgelse var 112 mg.
Vedligeholdelsesterapi
Effekten af ziprasidon som supplerende terapi til lithium eller valproat til vedligeholdelsesbehandling af bipolar I lidelse blev fastslået i et placebokontrolleret forsøg med patienter, der opfyldte DSM-IV-kriterierne for bipolar I lidelse. Forsøget omfattede patienter, hvis seneste episode var manisk eller blandet, med eller uden psykotiske træk. I den åbne fase skulle patienterne stabiliseres på ziprasidon plus lithium eller valproinsyre i mindst 8 uger for at blive randomiseret. I den dobbeltblinde randomiserede fase fortsatte patienterne behandlingen med lithium eller valproinsyre og blev randomiseret til at modtage enten ziprasidon (indgivet to gange dagligt i alt 80 mg til 160 mg dagligt) eller placebo. Generelt fortsatte patienterne i vedligeholdelsesfasen med den samme dosis, som de blev stabiliseret på under stabiliseringsfasen. Det primære endepunkt i denne undersøgelse var tid til gentagelse af en stemningsepisode (manisk, blandet eller deprimeret episode), der krævede intervention, hvilket blev defineret som et af følgende: seponering på grund af en stemningsepisode, klinisk intervention for en stemningsepisode (f.eks. påbegyndelse af medicin eller hospitalsindlæggelse), eller Mania Rating Scale-score ≥ 18 eller en MADRS-score ≥18 (ved 2 på hinanden følgende vurderinger med højst 10 dages mellemrum). I alt 584 forsøgspersoner blev behandlet i den åbne stabiliseringsperiode. I den dobbeltblinde randomiseringsperiode blev 127 forsøgspersoner behandlet med ziprasidon, og 112 forsøgspersoner blev behandlet med placebo. Ziprasidon var bedre end placebo med hensyn til at øge tiden til tilbagevenden af en stemningsepisode. De observerede typer tilbagefald omfattede depressive, maniske og blandede episoder. Depressive, maniske og blandede episoder udgjorde henholdsvis 53 %, 34 % og 13 % af det samlede antal tilbagefaldshændelser i undersøgelsen.
Akut behandling af agitation ved skizofreni
Effekten af intramuskulær ziprasidon til behandling af ophidsede skizofrene patienter blev fastslået i to kortvarige, dobbeltblindede forsøg med skizofrene forsøgspersoner, som af efterforskerne blev anset for at være "akut ophidsede" og havde behov for IM antipsykotisk medicin. Derudover skulle patienterne have en score på 3 eller mere på mindst 3 af følgende punkter i PANSS: angst, spænding, fjendtlighed og spænding. Effektiviteten blev evalueret ved analyse af arealet under kurven (AUC) af Behavioural Activity Rating Scale (BARS) og Clinical Global Impression (CGI) sværhedsgrad. BARS er en syv-punkts skala med score fra 1 (svær eller ude af stand til at vække) til 7 (voldelig, kræver tilbageholdenhed). Patienter' score på BARS ved baseline var for det meste 5 (tegn på åbenlys aktivitet [fysisk eller verbal], falder til ro med instruktioner) og udviste som bestemt af efterforskerne en grad af agitation, der berettigede intramuskulær terapi. Der var få patienter med en rating højere end 5 på BARS, da de mest alvorligt agiterede patienter generelt ikke var i stand til at give informeret samtykke til deltagelse i præmarketing kliniske forsøg.
Begge undersøgelser sammenlignede højere doser af ziprasidon intramuskulært med en kontroldosis på 2 mg. I en undersøgelse var den højere dosis 20 mg, som kunne gives op til 4 gange i løbet af undersøgelsens 24 timer med interdosisintervaller på ikke mindre end 4 timer. I den anden undersøgelse var den højere dosis 10 mg, som kunne gives op til 4 gange i løbet af undersøgelsens 24 timer med interdosisintervaller på ikke mindre end 2 timer.
Resultaterne af de intramuskulære Ziprasidon-forsøg følger
PATIENTOPLYSNINGER
GEODON® Kapsler (ziprasidon)
Information til patienter, der tager GEODON eller deres pårørende
Dette resumé indeholder vigtige oplysninger om GEODON. Det er ikke meningen, at det skal træde i stedet for din læges anvisninger. Læs denne information omhyggeligt, før du tager GEODON. Spørg din læge eller apoteket, hvis du ikke forstår nogen af disse oplysninger, eller hvis du vil vide mere om GEODON.
Hvad er GEODON 80mg?
GEODON er en type receptpligtig medicin kaldet psykotrop, også kendt som et atypisk antipsykotikum. GEODON kan bruges til at behandle symptomer på skizofreni og akutte maniske eller blandede episoder forbundet med bipolar lidelse. GEODON 80mg kan også bruges som vedligeholdelsesbehandling af bipolar lidelse, når det tilsættes lithium eller valproat.
Hvem skal tage GEODON 20mg?
Kun din læge kan vide, om GEODON er det rigtige for dig. GEODON 20 mg kan blive ordineret til dig, hvis du har skizofreni eller bipolar lidelse.
Symptomer på skizofreni kan omfatte:
- høre stemmer, se ting eller sanse ting, der ikke er der (hallucinationer)
- overbevisninger, der ikke er sande (vrangforestillinger)
- usædvanlig mistænksomhed (paranoia)
- at blive trukket tilbage fra familie og venner
Symptomer på maniske eller blandede episoder af bipolar lidelse kan omfatte:
- ekstremt højt eller irritabelt humør
- øget energi, aktivitet og rastløshed
- racer tanker eller taler meget hurtigt
- let distraheret
- lidt behov for søvn
Hvis du viser respons på GEODON 40mg, kan dine symptomer forbedres. Hvis du fortsætter med at tage GEODON 40 mg, er der mindre chance for, at dine symptomer vender tilbage. Stop ikke med at tage kapslerne, selv når du har det bedre uden først at have talt om det med din læge.
Det er også vigtigt at huske, at GEODON 40 mg kapsler skal tages sammen med mad.
Hvad er de vigtigste sikkerhedsoplysninger, jeg bør vide om GEODON 20mg?
GEODON er ikke godkendt til behandling af patienter med demensrelateret psykose. Ældre patienter med diagnosen psykose relateret til demens behandlet med antipsykotika har en øget risiko for død sammenlignet med patienter, der behandles med placebo (en sukkerpille).
GEODON er et effektivt lægemiddel til behandling af symptomer på skizofreni og de maniske eller blandede episoder af bipolar lidelse. En potentiel bivirkning er dog, at den kan ændre den måde, hvorpå den elektriske strøm i dit hjerte virker mere end nogle andre lægemidler. Forandringen er lille, og det vides ikke, om dette vil være skadeligt, men nogle andre stoffer, der forårsager denne form for forandringer, har i sjældne tilfælde forårsaget farlige hjerterytmeforstyrrelser. På grund af dette bør GEODON kun anvendes, efter at din læge har overvejet denne risiko for GEODON i forhold til risici og fordele ved andre tilgængelige lægemidler til behandling af skizofreni eller bipolar maniske og blandede episoder.
Din risiko for farlige ændringer i hjerterytmen kan øges, hvis du tager visse andre lægemidler, og hvis du allerede har visse unormale hjertesygdomme. Derfor er det vigtigt at fortælle din læge om enhver anden medicin, du tager, herunder ikke-receptpligtig medicin, kosttilskud og naturlægemidler. Du skal også fortælle din læge om eventuelle hjerteproblemer, du har eller har haft.
Hvem bør IKKE tage GEODON 40mg?
Ældre patienter med diagnosen psykose relateret til demens. GEODON er ikke godkendt til behandling af disse patienter.
Alt, der kan øge chancen for en hjerterytmeabnormitet, bør undgås. Tag derfor ikke GEODON 80 mg, hvis:
- Du har visse hjertesygdomme, for eksempel lang QT-syndrom, et nyligt hjerteanfald, alvorligt hjertesvigt eller visse uregelmæssigheder i hjerterytmen (diskuter detaljerne med din læge)
- Du tager i øjeblikket medicin, der ikke bør tages i kombination med ziprasidon, f.eks. dofetilid, sotalol, quinidin, andre klasse Ia og III antiarytmika, mesoridazin, thioridazin, chlorpromazin, droperidol, pimozid, sparfloxacin, gatifloxacin, halofoxiantrinacin, , mefloquin, pentamidin, arsentrioxid, levometadylacetat, dolasetronmesylat, probucol eller tacrolimus.
Hvad skal du fortælle din læge, før du starter GEODON
Kun din læge kan afgøre, om GEODON er det rigtige for dig. Før du starter GEODON, skal du fortælle det til din læge, hvis du:
- har haft problemer med den måde dit hjerte slår på eller en hjerterelateret sygdom eller sygdom
- enhver familiehistorie med hjertesygdom, herunder nyligt hjerteanfald
- har haft problemer med besvimelse eller svimmelhed
- tager eller for nylig har taget receptpligtig medicin
- tager håndkøbsmedicin, du kan købe uden recept, inklusive natur-/urtemedicin
- har haft problemer med din lever
- er gravid, kan være gravid eller planlægger at blive gravid
- ammer eller planlægger at amme
- er allergisk over for medicin
- nogensinde har haft en allergisk reaktion over for ziprasidon eller et af de øvrige indholdsstoffer i GEODON 20 mg kapsler. Spørg din læge eller apoteket om en liste over disse ingredienser
- har lave niveauer af kalium eller magnesium i dit blod
Din læge vil muligvis have dig til at få yderligere laboratorieundersøgelser for at se, om GEODON 40mg er en passende behandling for dig.
GEODON og anden medicin
Der er nogle lægemidler, som kan være usikre at bruge, når du tager GEODON, og der er nogle lægemidler, der kan påvirke, hvor godt GEODON 40mg virker. Mens du er på GEODON, skal du kontakte din læge, før du begynder på ny recept eller håndkøbsmedicin, inklusive natur-/urtemedicin.
Sådan skal du tage GEODON
- Tag kun GEODON som anvist af din læge.
- Synk GEODON kapsler hele. Du må ikke tygge, knuse eller åbne kapslerne.
- Tag GEODON 40 mg kapsler sammen med mad.
- Det er bedst at tage GEODON 80 mg på samme tidspunkt hver dag.
- GEODON 80mg kan tage et par uger at virke. Det er vigtigt at være tålmodig.
- Du må ikke ændre din dosis eller stoppe med at tage din medicin uden din læges godkendelse.
- Husk at blive ved med at tage dine kapsler, selv når du har det bedre.
Mulige bivirkninger
Fordi disse problemer kan betyde, at du har en unormal hjerterytme, skal du kontakte din læge STRAKS hvis du:
- Besvime eller miste bevidstheden
- Føl en ændring i den måde, dit hjerte slår (hjertebanken)
Almindelige bivirkninger af GEODON omfatter følgende og bør også diskuteres med din læge, hvis de opstår:
- Føler sig usædvanlig træt eller søvnig
- Kvalme eller dårlig mave
- Forstoppelse
- Svimmelhed
- Rastløshed
- Unormale muskelbevægelser, herunder tremor, shuffling og ukontrollerede ufrivillige bevægelser
- Diarré
- Udslæt
- Øget hoste / løbende næse
Hvis du udvikler bivirkninger, der bekymrer dig, skal du tale med din læge. Det er især vigtigt at fortælle det til din læge, hvis du har diarré, opkastning eller en anden sygdom, der kan få dig til at miste væske. Din læge vil måske tjekke dit blod for at sikre dig, at du har den rigtige mængde vigtige salte efter sådanne sygdomme.
For en liste over alle rapporterede bivirkninger, spørg din læge eller apoteket om GEODON Professional-indlægssedlen.
Hvad skal man gøre for en overdosis
I tilfælde af en overdosis, ring til din læge eller giftcentral med det samme eller gå til den nærmeste skadestue.
Andre vigtige sikkerhedsoplysninger
En alvorlig tilstand kaldet malignt neuroleptisk syndrom (NMS) kan forekomme med alle antipsykotiske lægemidler, inklusive GEODON. Tegn på NMS omfatter meget høj feber, stive muskler, rysten, forvirring, svedtendens eller øget hjertefrekvens og blodtryk. NMS er en sjælden, men alvorlig bivirkning, der kan være dødelig. Fortæl derfor din læge, hvis du oplever nogle af disse tegn.
Forsinket lægemiddelreaktion kaldet lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS) kan forekomme med ziprasidon. Tegn på DRESS kan omfatte udslæt, feber og hævede lymfeknuder. Andre alvorlige kutane bivirkninger (SCAR), såsom Stevens-Johnsons syndrom, kan forekomme med ziprasidon. Tegn på Stevens-Johnsons syndrom kan omfatte udslæt med blærer, som kan omfatte sår i munden, hududslip, feber og mållignende pletter i huden. KJØLE og andre AR er nogle gange fatale; Fortæl derfor straks din læge, hvis du oplever nogle af disse tegn.
Bivirkninger relateret til højt blodsukker (hyperglykæmi), nogle gange alvorlige, er blevet rapporteret hos patienter behandlet med atypiske antipsykotika. Der har været få rapporter om hyperglykæmi eller diabetes hos patienter behandlet med GEODON, og det vides ikke, om GEODON er forbundet med disse reaktioner. Patienter, der behandles med et atypisk antipsykotikum, bør overvåges for symptomer på hyperglykæmi.
Svimmelhed forårsaget af et fald i dit blodtryk kan forekomme med GEODON, især når du først begynder at tage denne medicin, eller når dosis øges. Hvis dette sker, skal du passe på ikke at rejse dig for hurtigt, og tal med din læge om problemet.
Inden du tager GEODON, skal du fortælle det til din læge, hvis du
- er gravid eller planlægger at blive gravid.
- Hvis du bliver gravid, mens du får GEODON 80mg, skal du tale med din læge om tilmelding til det nationale graviditetsregister for atypiske antipsykotika. Du kan tilmelde dig ved at ringe til 1-866-961-2388 eller gå til http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
- ammer eller planlægger at amme. GEODON 40mg kan gå over i din modermælk. Tal med din læge om den bedste måde at fodre din baby på, hvis du får GEODON.
Fordi GEODON 80mg kan forårsage søvnighed, skal du være forsigtig, når du betjener maskiner eller kører et motorkøretøj.
Da medicin af samme lægemiddelklasse som GEODON kan forstyrre kroppens evne til at tilpasse sig varme, er det bedst at undgå situationer, der involverer høj temperatur eller luftfugtighed.
Det er bedst at undgå at indtage alkoholiske drikke, mens du tager GEODON.
Ring til din læge straks hvis du tager mere end den mængde GEODON, som din læge har ordineret.
GEODON har ikke vist sig at være sikker eller effektiv til behandling af børn og teenagere under 18 år.
Opbevar GEODON 80mg og al medicin utilgængeligt for børn.
Sådan opbevares GEODON
Opbevar GEODON 20 mg kapsler ved stuetemperatur (59°F til 86°F eller 15°C til 30°C).
For mere information om GEODON
Dette ark er kun et resumé. GEODON 20mg er en receptpligtig medicin, og kun din læge kan afgøre, om det er det rigtige for dig. Hvis du har spørgsmål eller ønsker mere information om GEODON, så tal med din læge eller apotek. Du kan også besøge www.geodon.com.
Dette produkts mærkning er muligvis blevet opdateret. Besøg www.pfizer.com for at få de seneste ordinationsoplysninger
