Lexapro 10mg, 20mg, 5mg Escitalopram Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Lexapro, og hvordan bruges det?
Lexapro er en receptpligtig medicin, der bruges til at behandle symptomerne på svær depressiv lidelse og generaliseret angstlidelse. Lexapro kan bruges alene eller sammen med anden medicin.
- Lexapro tilhører en klasse af lægemidler kaldet antidepressiva, SSRI'er.
- Det vides ikke, om Lexapro 10mg er sikkert og effektivt til børn under 12 år.
Hvad er de mulige bivirkninger af Lexapro?
Lexapro kan forårsage alvorlige bivirkninger, herunder:
- Mavesmerter,
- Unormal blødning,
- Unormale drømme,
- Allergi,
- sløret syn,
- tunnelsyn,
- brystsmerter,
- nedsat koncentration,
- hæmostase,
- øjensmerter eller hævelse,
- ser glorier omkring lys,
- race tanker,
- usædvanlig risikoopførsel,
- følelser af ekstrem lykke eller tristhed,
- hovedpine,
- halsbrand,
- hedeture,
- forvirring,
- utydelig tale,
- svær svaghed,
- opkastning,
- tab af koordination,
- føler sig ustabil,
- meget stive (stive) muskler,
- høj feber,
- svedeture,
- forvirring,
- hurtig eller ujævn hjerterytme,
- rystelser, og
- svimmelhed
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Lexapro omfatter:
- svimmelhed,
- døsighed,
- svaghed,
- svedeture,
- føler sig rystende eller angst,
- søvnproblemer (søvnløshed),
- tør mund,
- mistet appetiten,
- kvalme,
- forstoppelse,
- gaber,
- vægtændringer,
- nedsat sexlyst,
- impotens, og
- svært ved at få orgasme
ADVARSEL
SUICIDALITET OG ANTIDEPRESSIVE stoffer
Antidepressiva øgede risikoen sammenlignet med placebo for selvmordstanker og -adfærd (suicidalitet) hos børn, unge og unge voksne i korttidsstudier af svær depressiv lidelse (MDD) og andre psykiatriske lidelser. Enhver, der overvejer at bruge Lexapro eller ethvert andet antidepressivum hos et barn, en teenager eller en ung voksen, skal balancere denne risiko med det kliniske behov. Korttidsundersøgelser viste ikke en stigning i risikoen for suicidalitet med antidepressiva sammenlignet med placebo hos voksne efter 24 år; der var en reduktion i risikoen med antidepressiva sammenlignet med placebo hos voksne på 65 år og derover. Depression og visse andre psykiatriske lidelser er i sig selv forbundet med øget risiko for selvmord. Patienter i alle aldre, der påbegyndes med antidepressiv behandling, bør overvåges passende og observeres nøje for klinisk forværring, suicidalitet eller usædvanlige ændringer i adfærd. Familier og pårørende bør informeres om behovet for tæt observation og kommunikation med den ordinerende læge. Lexapro 5mg er ikke godkendt til brug hos pædiatriske patienter under 12 år. [Se ADVARSLER OG FORHOLDSREGLER Klinisk forværring og selvmordsrisiko, PATIENTOPLYSNINGER , og Brug i specifikke populationer : Pædiatrisk brug].
BESKRIVELSE
Lexapro® (escitalopramoxalat) er en oralt administreret selektiv serotoningenoptagelseshæmmer (SSRI). Escitalopram er den rene Senantiomer (enkelt isomer) af det racemiske bicykliske phthalanderivat citalopram. Escitalopramoxalat er betegnet S-(+)-1-[3(dimethylamino)propyl]-1-(p-fluorphenyl)-5-phthalancarbonitriloxalat med følgende strukturformel:
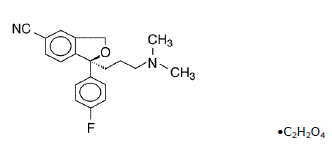
Molekylformlen er C20H21FN2O • C2H2O4 og molekylvægten er 414,40.
Escitalopramoxalat forekommer som et fint, hvidt til svagt gult pulver og er frit opløseligt i methanol og dimethylsulfoxid (DMSO), opløseligt i isotonisk saltvandsopløsning, tungtopløseligt i vand og ethanol, let opløseligt i ethylacetat og uopløseligt i heptan.
Lexapro (escitalopramoxalat) fås som tabletter eller oral opløsning.
Lexapro tabletter er filmovertrukne, runde tabletter, der indeholder escitalopramoxalat i styrker svarende til 5 mg, 10 mg og 20 mg escitalopram base. Tabletterne på 10 og 20 mg er delekærv. Tabletterne indeholder også følgende inaktive ingredienser: talkum, croscarmellosenatrium, mikrokrystallinsk cellulose/kolloid siliciumdioxid og magnesiumstearat. Filmcoatingen indeholder hypromellose, titaniumdioxid og polyethylenglycol.
Lexapro 5 mg oral opløsning indeholder escitalopramoxalat svarende til 1 mg/ml escitaloprambase. Det indeholder også følgende inaktive ingredienser: sorbitol, renset vand, citronsyre, natriumcitrat, æblesyre, glycerin, propylenglycol, methylparaben, propylparaben og naturlig pebermyntesmag.
INDIKATIONER
Større depressiv lidelse
Lexapro (escitalopram) er indiceret til akut og vedligeholdelsesbehandling af svær depressiv lidelse hos voksne og unge i alderen 12 til 17 år [se Kliniske Studier ].
En svær depressiv episode (DSM-IV) indebærer en fremtrædende og relativt vedvarende (næsten hver dag i mindst 2 uger) deprimeret eller dysforisk stemning, der normalt forstyrrer den daglige funktion, og omfatter mindst fem af følgende ni symptomer: deprimeret stemning, tab af interesse for sædvanlige aktiviteter, betydelig ændring i vægt og/eller appetit, søvnløshed eller hypersomni, psykomotorisk agitation eller retardering, øget træthed, skyldfølelse eller værdiløshed, nedsat tænkning eller nedsat koncentration, et selvmordsforsøg eller selvmordstanker.
Generaliseret angstlidelse
Lexapro 20mg er indiceret til akut behandling af generaliseret angstlidelse (GAD) hos voksne [se Kliniske Studier ].
Generaliseret angstlidelse (DSM-IV) er karakteriseret ved overdreven angst og bekymring (angstforventning), som varer ved i mindst 6 måneder, og som personen har svært ved at kontrollere. Det skal være forbundet med mindst 3 af følgende symptomer: rastløshed eller følelsen af at være spændt eller på kanten, at være let træt, koncentrationsbesvær eller at gå i stå, irritabilitet, muskelspændinger og søvnforstyrrelser.
DOSERING OG ADMINISTRATION
Lexapro 5mg bør administreres én gang dagligt, morgen eller aften, med eller uden mad.
Større depressiv lidelse
Indledende behandling
Teenagere
Den anbefalede dosis af Lexapro er 10 mg én gang dagligt. Et forsøg med fleksibel dosis af Lexapro (10 til 20 mg/dag) viste effektiviteten af Lexapro [se Kliniske Studier ]. Hvis dosis øges til 20 mg, bør dette ske efter minimum tre uger.
Voksne
Den anbefalede dosis af Lexapro 10 mg er 10 mg én gang dagligt. Et forsøg med fast dosis af Lexapro viste effektiviteten af både 10 mg og 20 mg Lexapro 5 mg, men kunne ikke påvise en større fordel af 20 mg i forhold til 10 mg [se Kliniske Studier ]. Hvis dosis øges til 20 mg, bør dette ske efter minimum en uge.
Vedligeholdelsesbehandling
Der er generelt enighed om, at akutte episoder med svær depressiv lidelse kræver adskillige måneder eller længere med vedvarende farmakologisk terapi ud over respons på den akutte episode. Systematisk evaluering af fortsat Lexapro 10 eller 20 mg/dag hos voksne patienter med svær depressiv lidelse, som reagerede, mens de tog Lexapro i løbet af en 8-ugers akut behandlingsfase, viste en fordel ved sådan vedligeholdelsesbehandling [se Kliniske Studier ]. Ikke desto mindre bør den læge, der vælger at bruge Lexapro 5mg i længere perioder, med jævne mellemrum revurdere lægemidlets langsigtede anvendelighed for den enkelte patient. Patienter bør periodisk revurderes for at fastslå behovet for vedligeholdelsesbehandling.
Generaliseret angstlidelse
Indledende behandling
Voksne
Den anbefalede startdosis af Lexapro er 10 mg én gang dagligt. Hvis dosis øges til 20 mg, bør dette ske efter minimum en uge.
Vedligeholdelsesbehandling
Generaliseret angst er anerkendt som en kronisk tilstand. Effekten af Lexapro til behandling af GAD ud over 8 uger er ikke blevet systematisk undersøgt. Den læge, der vælger at bruge Lexapro i længere perioder, bør med jævne mellemrum revurdere lægemidlets langsigtede anvendelighed for den enkelte patient.
Skærm for bipolar lidelse før start af Lexapro
Inden påbegyndelse af behandling med Lexapro eller et andet antidepressivum, screenes patienterne for en personlig familiehistorie med bipolar lidelse, mani eller hypomani [se ADVARSLER OG FORHOLDSREGLER ].
Særlige Populationer
10 mg/dag er den anbefalede dosis til de fleste ældre patienter og patienter med nedsat leverfunktion.
Dosisjustering er ikke nødvendig for patienter med let eller moderat nedsat nyrefunktion. Lexapro bør anvendes med forsigtighed til patienter med svært nedsat nyrefunktion.
Seponering af behandling med Lexapro
Symptomer forbundet med seponering af Lexapro 5mg og andre SSRI'er og SNRI'er er blevet rapporteret [se ADVARSLER OG FORHOLDSREGLER ]. Patienter bør overvåges for disse symptomer, når behandlingen afbrydes. En gradvis reduktion af dosis i stedet for pludseligt ophør anbefales, når det er muligt. Hvis der opstår uacceptable symptomer efter et fald i dosis eller efter seponering af behandlingen, kan det overvejes at genoptage den tidligere ordinerede dosis. Efterfølgende kan lægen fortsætte med at reducere dosis, men med en mere gradvis hastighed.
At skifte en patient til eller fra en monoaminoxidasehæmmer (MAOI), beregnet til at behandle psykiatriske lidelser
Der bør gå mindst 14 dage mellem seponering af en MAO-hæmmer beregnet til behandling af psykiatriske lidelser og påbegyndelse af behandling med Lexapro. Omvendt bør der tillades mindst 14 dage efter ophør med Lexapro 20 mg, før man starter en MAO-hæmmer beregnet til behandling af psykiatriske lidelser [se KONTRAINDIKATIONER ].
Brug af Lexapro med andre MAO-hæmmere såsom linezolid eller methylenblåt
Start ikke Lexapro 5mg hos en patient, der behandles med linezolid eller intravenøs methylenblåt, fordi der er en øget risiko for serotonergt syndrom. Hos en patient, som kræver mere akut behandling af en psykiatrisk tilstand, bør andre indgreb, herunder hospitalsindlæggelse, overvejes [se KONTRAINDIKATIONER ].
nogle tilfælde kan en patient, der allerede modtager Lexapro 10 mg-behandling, have behov for akut behandling med linezolid eller intravenøs methylenblåt. Hvis acceptable alternativer til linezolid eller intravenøs methylenblåt behandling ikke er tilgængelige, og de potentielle fordele ved linezolid eller intravenøs methylenblåt behandling vurderes at opveje risikoen for serotonergt syndrom hos en bestemt patient, bør Lexapro stoppes omgående, og linezolid eller intravenøs methylenblåt kan administreres. Patienten skal overvåges for symptomer på serotonergt syndrom i 2 uger eller indtil 24 timer efter den sidste dosis linezolid eller intravenøs methylenblåt, alt efter hvad der kommer først. Behandling med Lexapro kan genoptages 24 timer efter den sidste dosis linezolid eller intravenøs methylenblåt [se ADVARSLER OG FORHOLDSREGLER ].
Risikoen ved at administrere methylenblåt ad ikke-intravenøse veje (såsom orale tabletter eller ved lokal injektion) eller i intravenøse doser meget lavere end 1 mg/kg med Lexapro 10 mg er uklar. Lægen bør ikke desto mindre være opmærksom på muligheden for opståede symptomer på serotonergt syndrom ved sådan brug [se ADVARSLER OG FORHOLDSREGLER ].
HVORDAN LEVERET
Doseringsformer og styrker
Tabletter
Lexapro 10 mg tabletter er filmovertrukne, runde tabletter, der indeholder escitalopramoxalat i styrker svarende til 5 mg, 10 mg og 20 mg escitalopram base. Tabletterne på 10 og 20 mg er delekærv. Præget med "FL" på den ene side og enten "5", "10" eller "20" på den anden side i henhold til deres respektive styrker.
Oral løsning
Lexapro oral opløsning indeholder escitalopramoxalat svarende til 1 mg/ml escitaloprambase (markedsføres ikke i øjeblikket).
Opbevaring og håndtering
Tabletter
5 mg tabletter
Flaske med 100 - NDC # 0456-2005-01
Hvid til råhvid, rund, ikke-skåret, filmbelagt. Tryk "FL" på den ene side af tabletten og "5" på den anden side.
10 mg tabletter
Flaske med 100 - NDC 0456-2010-01 10 x 10 enhedsdosis - NDC # 0456-2010-63
Hvid til råhvid, rund, ridset, filmbelagt. Aftryk på siden med delekærv med "F" på venstre side og "L" på højre side. Påtryk på den ikke-skårede side med "10".
20 mg tabletter
Flaske med 100 - NDC # 0456-2020-01 10 x 10 enhedsdosis - NDC # 0456-2020-63
Hvid til råhvid, rund, ridset, filmbelagt. Aftryk på siden med delekærv med "F" på venstre side og "L" på højre side. Påtryk på den ikke-skårede side med "20".
Oral løsning
5 mg/5 ml, pebermyntesmag (240 ml) - NDC # 0456-2101-08. Den orale opløsning markedsføres i øjeblikket ikke.
Opbevaring og håndtering
Opbevares ved 20°C til 25°C (68°F til 77°F); udflugter tilladt til 15 til 30°C (59° til 86°F).
Distribueret af: Allergan USA, Inc. Madison, NJ 07940. Revideret: sep. 2021
BIVIRKNINGER
Erfaring med kliniske forsøg
Fordi kliniske undersøgelser udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske undersøgelser af et lægemiddel ikke direkte sammenlignes med frekvenser i de kliniske undersøgelser af et andet lægemiddel og afspejler muligvis ikke frekvenserne observeret i praksis.
Datakilder til kliniske forsøg
Pædiatri (6-17 år)
Bivirkninger blev indsamlet hos 576 pædiatriske patienter (286 Lexapro 5 mg, 290 placebo) med svær depressiv lidelse i dobbeltblinde placebokontrollerede undersøgelser. Sikkerhed og effektivitet af Lexapro 5mg hos pædiatriske patienter under 12 år er ikke blevet fastlagt.
Voksne
Bivirkningsoplysninger for Lexapro 5 mg blev indsamlet fra 715 patienter med svær depressiv lidelse, som blev eksponeret for escitalopram, og fra 592 patienter, der blev eksponeret for placebo i dobbeltblindede, placebokontrollerede forsøg. Yderligere 284 patienter med svær depressiv lidelse blev nyligt eksponeret for escitalopram i åbne forsøg. Bivirkningsoplysningerne for Lexapro hos patienter med GAD blev indsamlet fra 429 patienter eksponeret for escitalopram og fra 427 patienter eksponeret for placebo i dobbeltblindede, placebokontrollerede forsøg.
Uønskede hændelser under eksponering blev primært opnået ved generel forespørgsel og registreret af kliniske efterforskere ved hjælp af terminologi efter eget valg. Det er derfor ikke muligt at give et meningsfuldt skøn over andelen af personer, der oplever uønskede hændelser, uden først at gruppere lignende typer hændelser i et mindre antal standardiserede hændelseskategorier. I de efterfølgende tabeller og tabeller er standardterminologien fra Verdenssundhedsorganisationen (WHO) blevet brugt til at klassificere rapporterede bivirkninger.
De angivne frekvenser af bivirkninger repræsenterer andelen af individer, der mindst én gang oplevede en behandlingsudspringende bivirkning af den angivne type. En hændelse blev betragtet som behandlingsudløst, hvis den opstod for første gang eller forværredes under behandling efter baseline-evaluering.
Uønskede hændelser forbundet med seponering af behandling
Større depressiv lidelse
Pædiatri (6-17 år)
Bivirkninger var forbundet med seponering af 3,5 % af 286 patienter, der fik Lexapro, og 1 % af 290 patienter, der fik placebo. Den mest almindelige bivirkning (hyppighed mindst 1 % for Lexapro 10 mg og mere end placebo) forbundet med seponering var søvnløshed (1 % Lexapro, 0 % placebo).
Voksne
Blandt de 715 deprimerede patienter, som fik Lexapro i placebokontrollerede forsøg, afbrød 6 % behandlingen på grund af en bivirkning sammenlignet med 2 % af 592 patienter, der fik placebo. I to undersøgelser med faste doser var frekvensen af seponering for bivirkninger hos patienter, der fik 10 mg/dag Lexapro 20 mg, ikke signifikant forskellig fra frekvensen af seponering for bivirkninger hos patienter, der fik placebo. Hyppigheden af seponering for bivirkninger hos patienter, der fik en fast dosis på 20 mg/dag Lexapro, var 10 %, hvilket var signifikant forskellig fra frekvensen af seponering for bivirkninger hos patienter, der fik 10 mg/dag Lexapro (4 %) og placebo (3%). Bivirkninger, der var forbundet med seponering af mindst 1 % af patienterne behandlet med Lexapro 5 mg, og hvor hyppigheden var mindst dobbelt så høj som placebo, var kvalme (2 %) og ejakulationsforstyrrelser (2 % af mandlige patienter).
Generaliseret angstlidelse
Voksne
Blandt de 429 GAD-patienter, der fik Lexapro 10-20 mg/dag i placebokontrollerede forsøg, afbrød 8 % behandlingen på grund af en bivirkning sammenlignet med 4 % af 427 patienter, der fik placebo. Bivirkninger, der var forbundet med seponering af mindst 1 % af patienterne behandlet med Lexapro 20 mg, og hvor hyppigheden var mindst det dobbelte af placebofrekvensen, var kvalme (2 %), søvnløshed (1 %) og træthed (1 %). %).
Forekomst af bivirkninger i placebokontrollerede kliniske forsøg
Større depressiv lidelse
Pædiatri (6-17 år)
Den overordnede profil af bivirkninger hos pædiatriske patienter svarede generelt til den, der blev set i voksne undersøgelser, som vist i tabel 2. De følgende bivirkninger (undtagen dem, der er vist i tabel 2, og dem, for hvilke de kodede udtryk var uinformative eller vildledende) ) blev rapporteret med en incidens på mindst 2 % for Lexapro og mere end placebo: rygsmerter, urinvejsinfektion, opkastning og tilstoppet næse.
Voksne
De mest almindeligt observerede bivirkninger hos Lexapro 10 mg-patienter (hyppighed på ca. 5 % eller mere og ca. dobbelt så stor forekomst hos placebopatienter) var søvnløshed, ejakulationsforstyrrelser (primært ejakulatorisk forsinkelse), kvalme, øget svedtendens, træthed og somnolens.
Tabel 2 opregner forekomsten, afrundet til nærmeste procent, af behandlingsudspringende bivirkninger, der forekom blandt 715 deprimerede patienter, som fik Lexapro 20 mg i doser fra 10 til 20 mg/dag i placebokontrollerede forsøg. Hændelser inkluderet er dem, der forekommer hos 2 % eller flere af patienterne behandlet med Lexapro 20 mg, og for hvilke forekomsten hos patienter behandlet med Lexapro 10 mg var større end forekomsten hos placebobehandlede patienter.
TABEL 2 Behandlings-opståede bivirkninger observeret med en frekvens på ≥ 2 % og mere end placebo for svær depressiv lidelse
Generaliseret angstlidelse
Voksne
De mest almindeligt observerede bivirkninger hos Lexapro-patienter (hyppighed på ca. 5 % eller mere og ca. dobbelt så stor forekomst hos placebopatienter) var kvalme, ejakulationsforstyrrelser (primært ejakulatorisk forsinkelse), søvnløshed, træthed, nedsat libido og anorgasmi.
opregner forekomsten, afrundet til den nærmeste procent af behandlingsfremkomne bivirkninger, der forekom blandt 429 GAD-patienter, som fik Lexapro 10 til 20 mg/dag i placebokontrollerede forsøg. Hændelser inkluderet er dem, der forekommer hos 2 % eller flere af patienterne behandlet med Lexapro, og hvor forekomsten hos patienter behandlet med Lexapro var større end forekomsten hos placebobehandlede patienter.
TABEL 3 Behandlings-opståede bivirkninger observeret med en frekvens på ≥ 2 % og mere end placebo for generaliseret angstlidelse
Dosisafhængighed af bivirkninger
Den potentielle dosisafhængighed af almindelige bivirkninger (defineret som en incidensrate på ≥5 % i enten 10 mg eller 20 mg Lexapro-gruppen) blev undersøgt på basis af den kombinerede forekomst af bivirkninger i to fastdosisforsøg. Den samlede forekomst af bivirkninger hos 10 mg Lexapro-behandlede patienter (66 %) svarede til den for de placebo-behandlede patienter (61 %), mens incidensraten hos 20 mg/dag Lexapro-behandlede patienter var højere (86 %). Tabel 4 viser almindelige bivirkninger, der forekom i 20 mg/dag Lexapro-gruppen med en forekomst, der var cirka dobbelt så stor som for 10 mg/dag Lexapro 10 mg-gruppen og cirka det dobbelte af placebogruppen.
TABEL 4 Forekomst af almindelige bivirkninger hos patienter med svær depressiv lidelse
Mandlig og kvindelig seksuel dysfunktion med SSRI'er
Selvom ændringer i seksuel lyst, seksuel ydeevne og seksuel tilfredsstillelse ofte forekommer som manifestationer af en psykiatrisk lidelse, kan de også være en konsekvens af farmakologisk behandling. Især tyder nogle beviser på, at SSRI'er kan forårsage sådanne uheldige seksuelle oplevelser.
Pålidelige skøn over forekomsten og sværhedsgraden af uheldige oplevelser, der involverer seksuel lyst, præstation og tilfredshed, er dog vanskelige at opnå, delvist fordi patienter og læger kan være tilbageholdende med at diskutere dem. Følgelig vil estimater af forekomsten af uønsket seksuel oplevelse og ydeevne, der er nævnt i produktmærkning, sandsynligvis undervurdere deres faktiske forekomst.
TABEL 5 Forekomst af seksuelle bivirkninger i placebokontrollerede kliniske forsøg
Der er ingen tilstrækkeligt designede undersøgelser, der undersøger seksuel dysfunktion med escitaloprambehandling.
Priapisme er blevet rapporteret med alle SSRI'er.
Selvom det er svært at kende den præcise risiko for seksuel dysfunktion forbundet med brugen af SSRI'er, bør læger rutinemæssigt forespørge om sådanne mulige bivirkninger.
Ændringer af vitale tegn
Lexapro 5 mg og placebogrupper blev sammenlignet med hensyn til (1) gennemsnitlig ændring fra baseline i vitale tegn (puls, systolisk blodtryk og diastolisk blodtryk) og (2) forekomsten af patienter, der opfylder kriterierne for potentielt klinisk signifikante ændringer fra baseline i disse variabler. Disse analyser afslørede ikke nogen klinisk vigtige ændringer i vitale tegn forbundet med Lexapro 20 mg behandling. Desuden indikerede en sammenligning af liggende og stående måling af vitale tegn hos forsøgspersoner, der fik Lexapro 20 mg, at Lexapro-behandling ikke er forbundet med ortostatiske forandringer.
Vægtændringer
Patienter behandlet med Lexapro i kontrollerede forsøg adskilte sig ikke fra placebobehandlede patienter med hensyn til klinisk vigtig ændring i kropsvægt.
Laboratorieændringer
Lexapro 5 mg og placebogrupper blev sammenlignet med hensyn til (1) gennemsnitlig ændring fra baseline i forskellige serumkemi-, hæmatologi- og urinanalysevariabler og (2) forekomsten af patienter, der opfylder kriterierne for potentielt klinisk signifikante ændringer fra baseline i disse variable. Disse analyser afslørede ingen klinisk vigtige ændringer i laboratorietestparametre forbundet med Lexapro-behandling.
EKG ændringer
Elektrokardiogrammer fra grupperne Lexapro (N=625) og placebo (N=527) blev sammenlignet med hensyn til outliers defineret som forsøgspersoner med QTc-ændringer over 60 msek fra baseline eller absolutte værdier over 500 msek efter dosis, og forsøgspersoner med hjertefrekvensstigninger til over 100 bpm eller falder til mindre end 50 bpm med en 25 % ændring fra baseline (henholdsvis takykardiske eller bradykardiske outliers). Ingen af patienterne i Lexapro 20 mg-gruppen havde et QTcF-interval >500 msek eller en forlængelse >60 msek sammenlignet med 0,2 % af patienterne i placebogruppen. Forekomsten af takykardiske outliers var 0,2 % i Lexapro 5 mg og placebogruppen. Forekomsten af bradykardiske outliers var 0,5 % i Lexapro 10 mg-gruppen og 0,2 % i placebogruppen.
QTcF-interval blev evalueret i et randomiseret, placebo og aktivt (moxifloxacin 400 mg) kontrolleret cross-over, eskalerende multiple-dosis studie med 113 raske forsøgspersoner. Den maksimale gennemsnitlige (95 % øvre konfidensgrænse) forskel fra placebo-armen var 4,5 (6,4) og 10,7 (12,7) msek for henholdsvis 10 mg og supraterapeutisk 30 mg escitalopram givet én gang dagligt. Baseret på det etablerede eksponering-respons-forhold er den forudsagte QTcF-ændring fra placebo-armen (95 % konfidensinterval) under Cmax for en dosis på 20 mg 6,6 (7,9) msek. Escitalopram 30 mg givet én gang dagligt resulterede i en gennemsnitlig Cmax på 1,7 gange højere end den gennemsnitlige Cmax for den maksimalt anbefalede terapeutiske dosis ved steady state (20 mg). Eksponeringen under supraterapeutisk 30 mg dosis svarer til de steady state-koncentrationer, der forventes hos CYP2C19-fattige metabolisatorer efter en terapeutisk dosis på 20 mg.
Andre reaktioner observeret under premarketing-evalueringen af Lexapro
Følgende er en liste over behandlingsudspringende bivirkninger, som defineret i introduktionen til BIVIRKNINGER sektion, rapporteret af de 1428 patienter, der blev behandlet med Lexapro i perioder på op til et år i dobbeltblindede eller åbne kliniske forsøg under præmarketing-evalueringen. Listen inkluderer ikke de hændelser, der allerede er opført i de hændelser, hvor en lægemiddelårsag var fjern og med en hastighed på mindre end 1 % eller lavere end placebo, de hændelser, der var så generelle, at de var uinformative, og de hændelser, der kun blev rapporteret én gang, ikke havde en væsentlig sandsynlighed for at være akut livstruende. Begivenheder er kategoriseret efter kropssystem. Begivenheder af større klinisk betydning er beskrevet i ADVARSLER OG FORHOLDSREGLER afsnit.
Kardiovaskulær -hypertension, hjertebanken.
Centrale og perifere nervesystem lidelser - svimmelhed, migræne.
Gastrointestinale lidelser -mavekramper, halsbrand, gastroenteritis.
Generel - allergi, brystsmerter, feber, hedeture, smerter i lemmer.
Metaboliske og ernæringsforstyrrelser -øget vægt.
Sygdomme i bevægeapparatet - artralgi, myalgi kæbe stivhed.
Psykiatriske lidelser øget appetit, nedsat koncentration, irritabilitet.
Reproduktionsforstyrrelser/Kvinde - menstruationssmerter, menstruationsforstyrrelser.
Forstyrrelser i åndedrætssystemet - bronkitis, hoste, tilstoppet næse, tilstoppet bihule, hovedpine i bihulerne.
Hud- og vedhængsforstyrrelser - udslæt.
Særlige sanser - sløret syn, tinnitus.
Urinvejslidelser -hyppighed af urin, urinvejsinfektion.
Post-marketing oplevelse
Bivirkninger rapporteret efter markedsføringen af Escitalopram
Følgende bivirkninger er blevet identificeret under brug af Lexapro efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Blod og lymfesystem lidelser: anæmi, agranulocytis, aplastisk anæmi, hæmolytisk anæmi, idiopatisk trombocytopeni purpura, leukopeni, trombocytopeni.
Hjertelidelser: atrieflimren, bradykardi, hjertesvigt, myokardieinfarkt, takykardi, torsade de pointes, ventrikulær arytmi, ventrikulær takykardi.
Øre- og labyrintlidelser: svimmelhed
Endokrine lidelser: diabetes mellitus, hyperprolactinæmi, SIADH.
Øjenlidelser: vinkellukkende glaukom, diplopi, mydriasis, synsforstyrrelser.
Gastrointestinale lidelser: dysfagi, gastrointestinal blødning, gastroøsofageal refluks, pancreatitis, rektal blødning.
Generelle lidelser og administrationsbetingelser: unormal gang, asteni, ødem, fald, unormal følelse, utilpashed.
Lever og galdeveje: fulminant hepatitis, leversvigt, hepatisk nekrose, hepatitis.
Forstyrrelser i immunsystemet: allergisk reaktion, anafylaksi.
Undersøgelser: øget bilirubin, nedsat vægt, elektrokardiogram QT-forlængelse, øget leverenzymer, hyperkolesterolæmi, øget INR, nedsat protrombin.
Metabolisme og ernæringsforstyrrelser: hyperglykæmi, hypoglykæmi, hypokaliæmi, hyponatriæmi.
Muskuloskeletale og bindevævslidelser: muskelkramper, muskelstivhed, muskelsvaghed, rabdomyolyse.
Forstyrrelser i nervesystemet: akatisi, hukommelsestab, ataksi, choreoatetose, cerebrovaskulær ulykke, dysartri, dyskinesi, dystoni, ekstrapyramidale lidelser, grand mal-anfald (eller kramper), hypoæstesi, myoklonus, nystagmus, Parkinsonisme, rastløse ben, anfald, rysten, synkope.
Graviditet, puerperium og perinatale tilstande: spontan abort.
Psykiatriske lidelser: akut psykose, aggression, agitation, vrede, angst, apati, fuldført selvmord, forvirring, depersonalisering, forværret depression, delirium, vrangforestillinger, desorientering, uvirkelig følelse, hallucinationer (visuelle og auditive), humørsvingninger, nervøsitet, mareridt, panikreaktion, paranoia , rastløshed, selvskade eller tanker om selvskade, selvmordsforsøg, selvmordstanker, selvmordstendens.
Nyre- og urinvejslidelser: akut nyresvigt, dysuri, urinretention.
Reproduktionssystem og brystsygdomme: menorragi, priapisme.
Åndedræts-, thorax- og mediastinale lidelser: dyspnø, epistaxis, lungeemboli, pulmonal hypertension hos den nyfødte. Hud- og subkutane vævsforstyrrelser: alopeci, angioødem, dermatitis, ekkymose, erythema multiforme, lysfølsomhedsreaktion, Stevens Johnsons syndrom, toksisk epidermal nekrolyse, nældefeber.
Vaskulære lidelser: dyb venetrombose, rødmen, hypertensiv krise, hypotension, ortostatisk hypotension, flebitis, trombose.
DRUGSINTERAKTIONER
Monoaminoxidasehæmmere (MAO-hæmmere)
[Se DOSERING OG ADMINISTRATION og , KONTRAINDIKATIONER og ADVARSLER OG FORHOLDSREGLER ].
Serotonerge lægemidler
[Se DOSERING OG ADMINISTRATION og , KONTRAINDIKATIONER og ADVARSLER OG FORHOLDSREGLER ].
Triptaner
Der har været sjældne rapporter efter markedsføring om serotonergt syndrom ved brug af en SSRI og en triptan. Hvis samtidig behandling af Lexapro 10 mg og en triptan er klinisk berettiget, tilrådes omhyggelig observation af patienten, især under behandlingsstart og dosisstigninger [se ADVARSLER OG FORHOLDSREGLER ].
CNS-lægemidler
I betragtning af de primære CNS-effekter af escitalopram bør der udvises forsigtighed, når det tages i kombination med andre centralt virkende lægemidler.
Alkohol
Selvom Lexapro ikke forstærkede de kognitive og motoriske virkninger af alkohol i et klinisk forsøg, som med andre psykotrope lægemidler, anbefales det ikke at bruge alkohol hos patienter, der tager Lexapro.
Lægemidler, der interfererer med hæmostase (NSAID, aspirin, warfarin osv.)
Serotoninfrigivelse af blodplader spiller en vigtig rolle i hæmostase. Epidemiologiske undersøgelser af case-control og kohortedesign, der har vist en sammenhæng mellem brug af psykotrope lægemidler, der interfererer med serotonin-genoptagelse og forekomsten af øvre gastrointestinale blødninger, har også vist, at samtidig brug af et NSAID eller aspirin kan forstærke risikoen for blødning. Ændrede antikoagulerende virkninger, herunder øget blødning, er blevet rapporteret, når SSRI'er og SNRI'er administreres sammen med warfarin. Patienter, der får warfarinbehandling, bør overvåges nøje, når Lexapro påbegyndes eller seponeres.
Cimetidin
Hos forsøgspersoner, der havde fået 21 dage med 40 mg/dag racemisk citalopram, resulterede kombineret administration af 400 mg cimetidin to gange dagligt i 8 dage i en stigning i citalopram AUC og Cmax på henholdsvis 43 % og 39 %. Den kliniske betydning af disse fund er ukendt.
Digoxin
Hos forsøgspersoner, der havde modtaget 21 dage med 40 mg/dag racemisk citalopram, påvirkede kombineret administration af citalopram og digoxin (enkeltdosis på 1 mg) ikke signifikant farmakokinetikken af hverken citalopram eller digoxin.
Lithium
Samtidig administration af racemisk citalopram (40 mg/dag i 10 dage) og lithium (30 mmol/dag i 5 dage) havde ingen signifikant effekt på farmakokinetikken af citalopram eller lithium. Ikke desto mindre bør plasmalithiumniveauer monitoreres med passende justering til lithiumdosis i overensstemmelse med standard klinisk praksis. Da lithium kan forstærke de serotonerge virkninger af escitalopram, bør der udvises forsigtighed, når Lexapro 5 mg og lithium administreres samtidigt.
Pimozide og Celexa
en kontrolleret undersøgelse var en enkelt dosis pimozid 2 mg administreret sammen med racemisk citalopram 40 mg givet én gang dagligt i 11 dage forbundet med en gennemsnitlig stigning i QTc-værdier på ca. 10 msek sammenlignet med pimozid givet alene. Racemisk citalopram ændrede ikke den gennemsnitlige AUC eller Cmax for pimozid. Mekanismen bag denne farmakodynamiske interaktion er ikke kendt.
Sumatriptan
Der har været sjældne postmarketingrapporter, der beskriver patienter med svaghed, hyperrefleksi og inkoordinering efter brug af et SSRI og sumatriptan. Hvis samtidig behandling med sumatriptan og et SSRI (f.eks. fluoxetin, fluvoxamin, paroxetin, sertralin, citalopram, escitalopram) er klinisk berettiget, tilrådes passende observation af patienten.
Theophyllin
Kombineret administration af racemisk citalopram (40 mg/dag i 21 dage) og CYP1A2-substratet theophyllin (enkeltdosis på 300 mg) påvirkede ikke theophyllins farmakokinetik. Effekten af theophyllin på farmakokinetikken af citalopram blev ikke evalueret.
Warfarin
Administration af 40 mg/dag racemisk citalopram i 21 dage påvirkede ikke farmakokinetikken af warfarin, et CYP3A4-substrat. Protrombintiden blev øget med 5 %, hvis kliniske betydning er ukendt.
Carbamazepin
Kombineret administration af racemisk citalopram (40 mg/dag i 14 dage) og carbamazepin (titreret til 400 mg/dag i 35 dage) påvirkede ikke signifikant farmakokinetikken af carbamazepin, et CYP3A4-substrat. Selvom de laveste plasmaniveauer af citalopram var upåvirkede, i betragtning af carbamazepins enzyminducerende egenskaber, bør muligheden for, at carbamazepin kan øge clearance af escitalopram overvejes, hvis de to lægemidler administreres samtidigt.
Triazolam
Kombineret administration af racemisk citalopram (titreret til 40 mg/dag i 28 dage) og CYP3A4-substratet triazolam (enkeltdosis på 0,25 mg) påvirkede ikke farmakokinetikken af hverken citalopram eller triazolam signifikant.
Ketoconazol
Kombineret administration af racemisk citalopram (40 mg) og ketoconazol (200 mg), en potent CYP3A4-hæmmer, reducerede Cmax og AUC for ketoconazol med henholdsvis 21 % og 10 % og påvirkede ikke citaloprams farmakokinetik signifikant.
Ritonavir
Kombineret administration af en enkelt dosis ritonavir (600 mg), både et CYP3A4-substrat og en potent hæmmer af CYP3A4, og escitalopram (20 mg) påvirkede ikke farmakokinetikken af hverken ritonavir eller escitalopram.
CYP3A4- og -2C19-hæmmere
In vitro undersøgelser indikerede, at CYP3A4 og -2C19 er de primære enzymer involveret i metabolismen af escitalopram. Samtidig administration af escitalopram (20 mg) og ritonavir (600 mg), en potent hæmmer af CYP3A4, påvirkede imidlertid ikke escitaloprams farmakokinetik signifikant. Da escitalopram metaboliseres af flere enzymsystemer, kan hæmning af et enkelt enzym muligvis ikke nedsætte escitalopram-clearance mærkbart.
Lægemidler metaboliseret af Cytochrome P4502D6
In vitro undersøgelser afslørede ikke en hæmmende effekt af escitalopram på CYP2D6. Derudover var steady state-niveauer af racemisk citalopram ikke signifikant forskellige hos dårlige metabolisatorer og omfattende CYP2D6-metabolisatorer efter administration af citalopram i flere doser, hvilket tyder på, at samtidig administration, med escitalopram, af et lægemiddel, der hæmmer CYP2D6, sandsynligvis ikke vil have klinisk signifikante effekter på escitalopram metabolisme. Der er imidlertid begrænsede in vivo-data, der tyder på en beskeden CYP2D6-hæmmende effekt for escitalopram, dvs. samtidig administration af escitalopram (20 mg/dag i 21 dage) med det tricykliske antidepressivum desipramin (enkeltdosis på 50 mg), et substrat for CYP2D6, resulterede i. i en 40 % stigning i Cmax og en 100 % stigning i AUC for desipramin. Den kliniske betydning af dette fund er ukendt. Ikke desto mindre er forsigtighed indiceret ved samtidig administration af escitalopram og lægemidler metaboliseret af CYP2D6.
Metoprolol
Administration af 20 mg/dag Lexapro 20 mg i 21 dage hos raske frivillige resulterede i en 50 % stigning i Cmax og 82 % stigning i AUC for den beta-adrenerge blokker metoprolol (givet i en enkelt dosis på 100 mg). Forhøjede metoprolol plasmaniveauer er blevet forbundet med nedsat kardioselektivitet. Samtidig administration af Lexapro 5mg og metoprolol havde ingen klinisk signifikant effekt på blodtryk eller hjertefrekvens.
Elektrokonvulsiv terapi (ECT)
Der er ingen kliniske undersøgelser af den kombinerede brug af ECT og escitalopram.
Stofmisbrug og afhængighed
Misbrug og afhængighed
Fysisk og psykologisk afhængighed
Dyreforsøg tyder på, at risikoen for misbrug af racemisk citalopram er lav. Lexapro 10mg er ikke blevet systematisk undersøgt hos mennesker for dets potentiale for misbrug, tolerance eller fysisk afhængighed. Den kliniske erfaring med Lexapro før markedsføring afslørede ikke nogen lægemiddelsøgende adfærd. Disse observationer var dog ikke systematiske, og det er ikke muligt på baggrund af denne begrænsede erfaring at forudsige, i hvilket omfang et CNS-aktivt lægemiddel vil blive misbrugt, omdirigeret og/eller misbrugt, når det først er markedsført. Derfor bør læger omhyggeligt vurdere Lexapro-patienter for historie med stofmisbrug og følge sådanne patienter nøje, observere dem for tegn på misbrug eller misbrug (f.eks. udvikling af tolerance, stigninger i dosis, lægemiddel-søgende adfærd).
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Selvmordstanker og -adfærd hos unge og unge voksne
poolede analyser af placebo-kontrollerede forsøg med antidepressiva (SSRI'er og andre antidepressiva klasser), der omfattede ca. 77.000 voksne patienter og 4.500 pædiatriske patienter, var forekomsten af selvmordstanker og -adfærd hos de antidepressiva-behandlede patienter i alderen 24 år og yngre større end hos placebobehandlede patienter. Der var betydelig variation i risikoen for selvmordstanker og -adfærd blandt stoffer, men der var en øget risiko identificeret hos unge patienter for de fleste undersøgte stoffer. Der var forskelle i den absolutte risiko for selvmordstanker og -adfærd på tværs af de forskellige indikationer, med den højeste forekomst hos patienter med MDD. Lægemiddel-placebo-forskellene i antallet af tilfælde af selvmordstanker og -adfærd pr. 1000 behandlede patienter er angivet i
Det er ukendt, om risikoen for selvmordstanker og -adfærd hos børn, unge og unge voksne strækker sig til længerevarende brug, dvs. ud over fire måneder. Der er dog væsentlige beviser fra placebokontrollerede vedligeholdelsesforsøg hos voksne med MDD, at antidepressiva forsinker tilbagefald af depression, og at depression i sig selv er en risikofaktor for selvmordstanker og -adfærd.
Overvåg alle antidepressiva-behandlede patienter for enhver indikation for klinisk forværring og fremkomst af selvmordstanker og -adfærd, især i løbet af de første par måneder med lægemiddelbehandling og ved dosisændringer. Rådgive familiemedlemmer eller pårørende til patienter til at overvåge for ændringer i adfærd og advare sundhedsplejersken. Overvej at ændre det terapeutiske regime, herunder eventuelt seponering af Lexapro, hos patienter, hvis depression er vedvarende værre, eller som oplever nye selvmordstanker eller -adfærd.
Serotonin syndrom
Udvikling af et potentielt livstruende serotonergt syndrom er blevet rapporteret med SNRI og SSRI, inklusive Lexapro, alene, men især ved samtidig brug af andre serotonerge lægemidler (inklusive triptaner, tricykliske antidepressiva, fentanyl, lithium, tramadol, tryptofan, buspiron, amfetamin, og perikon) og med lægemidler, der hæmmer metabolismen af serotonin (især MAO-hæmmere, både dem, der er beregnet til at behandle psykiatriske lidelser og også andre, såsom linezolid og intravenøs methylenblåt).
Symptomer på serotonergt syndrom kan omfatte mentale statusændringer (f.eks. agitation, hallucinationer, delirium og koma), autonom ustabilitet (f.eks. takykardi, labilt blodtryk, svimmelhed, diaforese, rødmen, hypertermi), neuromuskulære symptomer (f.eks. tremor, rigiditet, myoklonus, hyperrefleksi, inkoordination) anfald og/eller gastrointestinale symptomer (f.eks. kvalme, opkastning, diarré). Patienter bør overvåges for forekomsten af serotonergt syndrom.
Samtidig brug af Lexapro 10 mg og MAO-hæmmere beregnet til behandling af psykiatriske lidelser er kontraindiceret. Lexapro 5mg bør heller ikke påbegyndes hos en patient, der er i behandling med MAO-hæmmere såsom linezolid eller intravenøs methylenblåt. Alle rapporter med methylenblåt, der gav information om indgivelsesvejen, involverede intravenøs administration i dosisområdet fra 1 mg/kg til 8 mg/kg. Ingen rapporter involverede administration af methylenblåt ad andre veje (såsom orale tabletter eller lokal vævsinjektion) eller ved lavere doser. Der kan være omstændigheder, hvor det er nødvendigt at påbegynde behandling med en MAO-hæmmer såsom linezolid eller intravenøs methylenblåt hos en patient, der tager Lexapro. Lexapro bør seponeres, før behandling med MAO-hæmmeren påbegyndes [se KONTRAINDIKATIONER og DOSERING OG ADMINISTRATION ].
Hvis samtidig brug af Lexapro 5mg med andre serotonerge lægemidler, herunder triptaner, tricykliske antidepressiva, fentanyl, lithium, tramadol, buspiron, tryptofan, amfetamin og perikon er klinisk berettiget, skal patienterne gøres opmærksomme på en potentiel øget risiko for serotonergt syndrom. , især under behandlingsstart og dosisstigninger.
Behandling med Lexapro og eventuelle samtidige serotonerge midler skal seponeres øjeblikkeligt, hvis ovennævnte hændelser opstår, og understøttende symptomatisk behandling bør påbegyndes.
Seponering af behandling med Lexapro
Under markedsføringen af Lexapro og andre SSRI'er og SNRI'er (serotonin- og noradrenalin-genoptagelseshæmmere) har der været spontane rapporter om bivirkninger, der er opstået efter seponering af disse lægemidler, især ved pludseligt ophør, herunder følgende: dysforisk stemning, irritabilitet, agitation, svimmelhed, sensorisk forstyrrelser (f.eks. paræstesier såsom elektrisk stød), angst, forvirring, hovedpine, sløvhed, følelsesmæssig labilitet, søvnløshed og hypomani. Selvom disse hændelser generelt er selvbegrænsende, har der været rapporter om alvorlige seponeringssymptomer.
Patienter bør overvåges for disse symptomer, når behandlingen med Lexapro afbrydes. En gradvis reduktion af dosis i stedet for pludseligt ophør anbefales, når det er muligt. Hvis der opstår uacceptable symptomer efter et fald i dosis eller efter seponering af behandlingen, kan det overvejes at genoptage den tidligere ordinerede dosis. Efterfølgende kan lægen fortsætte med at reducere dosis, men med en mere gradvis hastighed [se DOSERING OG ADMINISTRATION ].
Anfald
Selvom antikonvulsive virkninger af racemisk citalopram er blevet observeret i dyreforsøg, er Lexapro ikke blevet systematisk evalueret hos patienter med krampeanfald. Disse patienter blev udelukket fra kliniske undersøgelser under produktets præmarketingtest. I kliniske forsøg med Lexapro 5mg er tilfælde af kramper blevet rapporteret i forbindelse med Lexapro-behandling. Ligesom andre lægemidler, der er effektive til behandling af svær depressiv lidelse, bør Lexapro 20 mg introduceres med forsigtighed hos patienter med tidligere anfald.
Aktivering af mani eller hypomani
Hos patienter med bipolar lidelse kan behandling af en depressiv episode med Lexapro eller et andet antidepressivum udløse en blandet/manisk episode. I placebokontrollerede forsøg med Lexapro 20 mg til svær depressiv lidelse blev aktivering af mani/hypomani rapporteret hos én (0,1 %) af 715 patienter behandlet med Lexapro 20 mg og hos ingen af de 592 patienter behandlet med placebo. Et yderligere tilfælde af hypomani er blevet rapporteret i forbindelse med Lexapro 10 mg behandling. Aktivering af mani/hypomani er også blevet rapporteret hos en lille del af patienter med alvorlige affektive lidelser behandlet med racemisk citalopram og andre markedsførte lægemidler, der er effektive til behandling af svær depressiv lidelse. Inden behandling med Lexapro påbegyndes, skal du screene patienter for enhver personlig eller familiehistorie med bipolar lidelse, mani eller hypomani [se DOSERING OG ADMINISTRATION ].
Hyponatriæmi
Hyponatriæmi kan forekomme som følge af behandling med SSRI og SNRI, inklusive Lexapro. I mange tilfælde ser denne hyponatriæmi ud til at være resultatet af syndromet med uhensigtsmæssig antidiuretisk hormonsekretion (SIADH) og var reversibel, da Lexapro 20 mg blev seponeret. Tilfælde med serumnatrium lavere end 110 mmol/L er blevet rapporteret. Ældre patienter kan have større risiko for at udvikle hyponatriæmi med SSRI'er og SNRI'er. Patienter, der tager diuretika, eller som på anden måde er udtømte, kan have større risiko [se Geriatrisk brug ]. Seponering af Lexapro bør overvejes hos patienter med symptomatisk hyponatriæmi, og passende medicinsk intervention bør iværksættes.
Tegn og symptomer på hyponatriæmi omfatter hovedpine, koncentrationsbesvær, hukommelsessvækkelse, forvirring, svaghed og ustabilitet, som kan føre til fald. Tegn og symptomer forbundet med mere alvorlige og/eller akutte tilfælde har inkluderet hallucinationer, synkope, krampeanfald, koma, åndedrætsstop og død.
Unormal blødning
SSRI'er og SNRI'er, inklusive Lexapro 20 mg, kan øge risikoen for blødninger. Samtidig brug af aspirin, ikke-steroide antiinflammatoriske lægemidler, warfarin og andre antikoagulantia kan øge risikoen. Caserapporter og epidemiologiske undersøgelser (case-kontrol og kohortedesign) har vist en sammenhæng mellem brug af lægemidler, der interfererer med serotonin-genoptagelse og forekomsten af gastrointestinal blødning. Blødningshændelser relateret til brug af SSRI'er og SNRI'er har varieret fra ekkymoser, hæmatomer, epistaxis og petekkier til livstruende blødninger.
Patienter bør advares om risikoen for blødning forbundet med samtidig brug af Lexapro 20 mg og NSAID'er, aspirin eller andre lægemidler, der påvirker koagulationen.
Interferens med kognitiv og motorisk ydeevne
en undersøgelse med normale frivillige forårsagede Lexapro 10 mg/dag ikke svækkelse af intellektuel funktion eller psykomotorisk ydeevne. Fordi ethvert psykoaktivt stof kan svække dømmekraft, tænkning eller motoriske færdigheder, bør patienter dog advares om at betjene farlige maskiner, inklusive biler, indtil de er rimeligt sikre på, at Lexapro-terapi ikke påvirker deres evne til at deltage i sådanne aktiviteter.
Vinkellukning glaukom
Vinkellukningsglaukom: Pupiludvidelsen, der opstår efter brug af mange antidepressiva, inklusive Lexapro 20 mg, kan udløse et vinkellukkeangreb hos en patient med anatomisk snævre vinkler, som ikke har en patenteret iridektomi.
Anvendelse hos patienter med samtidig sygdom
Klinisk erfaring med Lexapro hos patienter med visse samtidige systemiske sygdomme er begrænset. Forsigtighed tilrådes ved brug af Lexapro 5mg til patienter med sygdomme eller tilstande, der forårsager ændret metabolisme eller hæmodynamiske reaktioner.
Lexapro er ikke blevet systematisk evalueret hos patienter med en nylig historie med myokardieinfarkt eller ustabil hjertesygdom. Patienter med disse diagnoser blev generelt udelukket fra kliniske undersøgelser under produktets præmarketingtest.
Hos personer med nedsat leverfunktion var clearance af racemisk citalopram nedsat, og plasmakoncentrationerne blev øget. Den anbefalede dosis af Lexapro til patienter med nedsat leverfunktion er 10 mg/dag [se DOSERING OG ADMINISTRATION ].
Da escitalopram metaboliseres omfattende, er udskillelse af uomdannet lægemiddel i urinen en mindre eliminationsvej. Indtil tilstrækkeligt antal patienter med svær nyreinsufficiens er blevet evalueret under kronisk behandling med Lexapro 20 mg, bør det dog anvendes med forsigtighed til sådanne patienter [se DOSERING OG ADMINISTRATION ].
Seksuel dysfunktion
Brug af SSRI'er, inklusive Lexapro, kan forårsage symptomer på seksuel dysfunktion [se BIVIRKNINGER ]. Hos mandlige patienter kan brug af SSRI resultere i ejakulatorisk forsinkelse eller svigt, nedsat libido og erektil dysfunktion. Hos kvindelige patienter kan brug af SSRI resultere i nedsat libido og forsinket eller manglende orgasme.
Det er vigtigt for ordinerende læger at forespørge om seksuel funktion før påbegyndelse af Lexapro og at spørge specifikt om ændringer i seksuel funktion under behandlingen, fordi seksuel funktion muligvis ikke spontant rapporteres. Ved evaluering af ændringer i seksuel funktion er det vigtigt at få en detaljeret anamnese (inklusive tidspunktet for symptomdebut), fordi seksuelle symptomer kan have andre årsager, herunder den underliggende psykiatriske lidelse. Diskuter potentielle ledelsesstrategier til at støtte patienter i at træffe informerede beslutninger om behandling.
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( Medicinvejledning ).
Selvmordstanker og -adfærd
Rådgiv patienter, deres familier og pårørende til at se efter fremkomsten af selvmordstanker og -adfærd, især under behandlingen, og når dosis justeres op eller ned, og instruer dem om at rapportere sådanne symptomer til deres læge [se KASSE ADVARSEL og ADVARSLER OG FORHOLDSREGLER ].
Serotonin syndrom
Patienter bør advares om risikoen for serotonergt syndrom ved samtidig brug af Lexapro med andre serotonerge lægemidler, herunder triptaner, tricykliske antidepressiva, fentanyl, lithium, tramadol, tryptofan, buspiron, amfetamin og perikon og med lægemidler, der hæmmer stofskiftet af perikon. serotonin (især MAO-hæmmere, både dem, der er beregnet til at behandle psykiatriske lidelser og også andre, såsom linezolid) [se ADVARSLER OG FORHOLDSREGLER ].
Aktivering af mani eller hypomani
Råd til patienter og deres pårørende om at observere for tegn på aktivering af mani/hypomani og instruer dem i at rapportere sådanne symptomer til sundhedspersonalet [se ADVARSLER OG FORHOLDSREGLER ].
Unormal blødning
Patienter bør advares om samtidig brug af Lexapro 5mg og NSAID'er, aspirin, warfarin eller andre lægemidler, der påvirker koagulationen, da kombineret brug af psykotrope lægemidler, der interfererer med serotonin-genoptagelsen, og disse midler har været forbundet med en øget risiko for blødning [se ADVARSLER OG FORHOLDSREGLER ].
Vinkellukning glaukom
Patienter bør informeres om, at indtagelse af Lexapro 5mg kan forårsage mild pupiludvidelse, som hos følsomme personer kan føre til en episode med lukket vinkelglaukom. Eksisterende glaukom er næsten altid åbenvinklet glaukom, fordi vinkellukket glaukom, når det diagnosticeres, kan behandles definitivt med iridektomi. Åbenvinklet glaukom er ikke en risikofaktor for lukkevinklet glaukom. Patienter kan ønske at blive undersøgt for at afgøre, om de er modtagelige for vinkellukning, og have en profylaktisk procedure (f.eks. iridektomi), hvis de er modtagelige [se ADVARSLER OG FORHOLDSREGLER ].
Seksuel dysfunktion
Rådgiv patienterne om, at brug af Lexapro kan forårsage symptomer på seksuel dysfunktion hos både mandlige og kvindelige patienter. Informer patienterne om, at de bør diskutere eventuelle ændringer i seksuel funktion og potentielle håndteringsstrategier med deres sundhedsplejerske [se ADVARSLER OG FORHOLDSREGLER ].
Samtidig medicinering
Da escitalopram er den aktive isomer af racemisk citalopram (Celexa), bør de to midler ikke administreres samtidigt. Patienter bør rådes til at informere deres læge, hvis de tager eller planlægger at tage receptpligtig eller håndkøbsmedicin, da der er mulighed for interaktioner.
Fortsættelse af den ordinerede terapi
Selvom patienter kan mærke forbedring med Lexapro 10 mg-behandling i løbet af 1 til 4 uger, bør de rådes til at fortsætte behandlingen som anvist.
Interferens med psykomotorisk ydeevne
Fordi psykoaktive stoffer kan svække dømmekraft, tænkning eller motoriske færdigheder, bør patienter advares om at betjene farlige maskiner, herunder biler, indtil de er rimeligt sikre på, at Lexapro-terapi ikke påvirker deres evne til at deltage i sådanne aktiviteter.
Alkohol
Patienterne skal fortælles, at selvom Lexapro 5 mg ikke er blevet vist i forsøg med normale forsøgspersoner at øge de mentale og motoriske svækkelser forårsaget af alkohol, frarådes samtidig brug af Lexapro 20 mg og alkohol hos deprimerede patienter.
Graviditet
Råd gravide kvinder om at underrette deres læger, hvis de bliver gravide eller har til hensigt at blive gravide under behandling med LEXAPRO. Rådgiv patienterne om, at LEXAPRO 10 mg brug senere i graviditeten kan føre til øget risiko for neonatale komplikationer, der kræver langvarig hospitalsindlæggelse, respiratorisk støtte, sondeernæring og/eller vedvarende pulmonal hypertension (PPHN) hos den nyfødte [se Brug i specifikke populationer ].
Informer kvinder om, at der er et graviditetseksponeringsregister, der overvåger graviditetsresultater hos kvinder, der er eksponeret for LEXAPRO under graviditeten [se Brug i specifikke populationer ].
Amning
Råd ammende kvinder, der bruger LEXAPRO, til at overvåge spædbørn for overdreven sedation, rastløshed, agitation, dårlig ernæring og ringe vægtøgning og til at søge lægehjælp, hvis de bemærker disse tegn [se Brug i specifikke populationer ].
Behov for omfattende behandlingsprogram
Lexapro 20mg er indiceret som en integreret del af et samlet behandlingsprogram for MDD, der kan omfatte andre foranstaltninger (psykologiske, pædagogiske, sociale) for patienter med dette syndrom. Lægemiddelbehandling er muligvis ikke indiceret til alle unge med dette syndrom. Sikkerhed og effektivitet af Lexapro 10 mg ved MDD er ikke blevet fastslået hos pædiatriske patienter under 12 år. Antidepressiva er ikke beregnet til brug hos den unge, der udviser symptomer sekundært til miljøfaktorer og/eller andre primære psykiatriske lidelser. Passende uddannelsesplacering er afgørende, og psykosocial intervention er ofte nyttig. Når afhjælpende foranstaltninger alene er utilstrækkelige, vil beslutningen om at ordinere antidepressiv medicin afhænge af lægens vurdering af kroniske karakter og sværhedsgrad af patientens symptomer.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
Racemisk citalopram blev indgivet i kosten til NMRI/BOM-stammemus og COBS WI-stammerotter i henholdsvis 18 og 24 måneder. Der var ingen evidens for carcinogenicitet af racemisk citalopram hos mus, der fik op til 240 mg/kg/dag. Der var en øget forekomst af tyndtarmskarcinom hos rotter, der fik 8 eller 24 mg/kg/dag racemisk citalopram. En dosis uden effekt for dette fund blev ikke etableret. Relevansen af disse fund for mennesker er ukendt.
Mutagenese
Racemisk citalopram var mutagent i in vitro bakteriel revers mutationsanalyse (Ames test) i 2 af 5 bakteriestammer (Salmonella TA98 og TA1537) i fravær af metabolisk aktivering. Det var klastogent i in vitro kinesisk hamster-lungecelleassay for kromosomafvigelser i nærvær og fravær af metabolisk aktivering. Racemisk citalopram var ikke mutagent i in vitro mammalian forward gene mutation assay (HPRT) i muse lymfomceller eller i en koblet in vitro/in vivo unscheduled DNA-syntese (UDS) assay i rottelever. Det var ikke klastogent i in vitro kromosomafvigelsesassay i humane lymfocytter eller i to in vivo muse mikronucleus assays.
Forringelse af fertilitet
Når racemisk citalopram blev administreret oralt til 16 han- og 24 hunrotter før og under parring og drægtighed i doser på 32, 48 og 72 mg/kg/dag, blev parringen nedsat ved alle doser, og fertiliteten blev nedsat ved doser ≥ 32 mg/kg/dag. Drægtighedsvarigheden blev øget med 48 mg/kg/dag.
Brug i specifikke populationer
Graviditet
Graviditetseksponeringsregister
Der er et graviditetseksponeringsregister, der overvåger graviditetsresultater hos kvinder, der udsættes for antidepressiva under graviditeten. Sundhedsudbydere opfordres til at registrere patienter ved at ringe til National Pregnancy Registry for Antidepressants på 1-844-405-6185 eller besøge online på https://womensmentalhealth.org/clnical-and-research-programs/pregnancyregistry/antidepressants/
Risikooversigt
Tilgængelige data fra offentliggjorte epidemiologiske undersøgelser og rapporter efter markedsføring har ikke påvist en øget risiko for alvorlige fødselsdefekter eller abort. Der er risiko for vedvarende pulmonal hypertension hos den nyfødte (PPHN) (se Data ) og dårlig neonatal tilpasning (se Kliniske overvejelser ) med eksponering for selektive serotoningenoptagelseshæmmere (SSRI'er), inklusive LEXAPRO 5 mg, under graviditet. Der er risici forbundet med ubehandlet depression under graviditet (se Kliniske overvejelser ).
reproduktionsstudier på dyr har både escitalopram og racemisk citalopram vist sig at have uønskede virkninger på embryo/føtal og postnatal udvikling, herunder føtale strukturelle abnormiteter, når de administreres i doser, der er større end humane terapeutiske doser (se Data ).
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort for den angivne population er ukendt. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre ugunstige udfald. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i de klinisk anerkendte graviditeter henholdsvis 2 til 4 % og 15 til 20 %.
Kliniske overvejelser
Sygdomsrelateret moderrisiko og/eller embryo/føtal risiko
Kvinder, der ophører med antidepressiva, er mere tilbøjelige til at opleve tilbagefald af svær depression end kvinder, der fortsætter med antidepressiva. Dette fund er fra en prospektiv longitudinel undersøgelse af 201 gravide kvinder med en historie med svær depression, som var euthymic og tog antidepressiva i begyndelsen af graviditeten. Overvej risikoen for ubehandlet depression ved seponering eller ændring af behandling med antidepressiv medicin under graviditet og efter fødslen.
Fetale/neonatale bivirkninger
Nyfødte, der er udsat for SSRI'er eller SNRI'er, inklusive Lexapro 5mg, sent i tredje trimester har udviklet komplikationer, der kræver længere tids indlæggelse, respiratorisk støtte og sondeernæring. Sådanne komplikationer kan opstå umiddelbart efter levering. Rapporterede kliniske fund har inkluderet åndedrætsbesvær, cyanose, apnø, kramper, temperaturustabilitet, ernæringsbesvær, opkastning, hypoglykæmi, hypotoni, hypertoni, hyperrefleksi, tremor, nervøsitet, irritabilitet og konstant gråd. Disse egenskaber stemmer overens med enten en direkte toksisk virkning af SSRI'er og SNRI'er eller muligvis et lægemiddelafbrydelsessyndrom. Det skal bemærkes, at det kliniske billede i nogle tilfælde stemmer overens med serotonergt syndrom [se ADVARSLER OG FORHOLDSREGLER ].
Data
Menneskelige data
Eksponering for SSRI'er, især senere i graviditeten, kan øge risikoen for PPHN. PPHN forekommer hos 1-2 ud af 1000 levendefødte i den generelle befolkning og er forbundet med betydelig neonatal morbiditet og dødelighed.
Dyredata
et rotteembryo-/fosterudviklingsstudie resulterede oral administration af escitalopram (56, 112 eller 150 mg/kg/dag) til drægtige dyr i perioden med organogenese i nedsat føtal kropsvægt og tilhørende forsinkelser i ossifikationen ved de to højere doser [ca. ≥ 55 gange den maksimale anbefalede humane dosis (MRHD) på 20 mg/dag på mg/m2-basis]. Maternel toksicitet (kliniske tegn og nedsat kropsvægtøgning og fødeindtagelse), mild ved 56 mg/kg/dag, var til stede ved alle dosisniveauer. Udviklingsdosis uden effekt på 56 mg/kg/dag er ca. 27 gange MRHD på 20 mg på mg/m2-basis. Der blev ikke observeret misdannelser ved nogen af de testede doser (så høje som 73 gange MRHD på mg/m2-basis).
Når hunrotter blev behandlet med escitalopram (6, 12, 24 eller 48 mg/kg/dag) under drægtighed og ved fravænning, blev der observeret en let øget afkomsdødelighed og væksthæmning ved 48 mg/kg/dag, hvilket er ca. 23 gange højere end MRHD på 20 mg på mg/m2-basis. Let maternel toksicitet (kliniske tegn og nedsat kropsvægtøgning og fødeindtagelse) blev set ved denne dosis. En let øget afkomsdødelighed blev også set ved 24 mg/kg/dag. Dosis uden effekt var 12 mg/kg/dag, hvilket er ca. 6 gange MRHD på 20 mg på mg/m2-basis.
to rotteembryo/føtale udviklingsstudier resulterede oral administration af racemisk citalopram (32, 56 eller 112 mg/kg/dag) til drægtige dyr i løbet af organogeneseperioden i nedsat embryo/føtal vækst og overlevelse og en øget forekomst af foster. abnormiteter (herunder kardiovaskulære og skeletdefekter) ved den høje dosis, som er ca. 18 gange MRHD på 60 mg/dag på mg/m2-basis. Denne dosis var også forbundet med maternel toksicitet (kliniske tegn, nedsat kropsvægtøgning). Udviklingsdosis uden effekt var 56 mg/kg/dag er ca. 9 gange MRHD på mg/m2-basis. I en kaninundersøgelse blev der ikke observeret nogen bivirkninger på embryo/føtal udvikling ved doser af racemisk citalopram på op til 16 mg/kg/dag eller ca. 5 gange MRHD på mg/m2-basis. Således blev udviklingseffekter af racemisk citalopram observeret ved en maternal toksisk dosis hos rotter og blev ikke observeret hos kanin.
Når hunrotter blev behandlet med racemisk citalopram (4,8, 12,8 eller 32 mg/kg/dag) fra sen drægtighed til fravænning, blev der observeret øget afkomsdødelighed i de første 4 dage efter fødslen og vedvarende væksthæmning af afkom ved den højeste dosis, som er ca. 5 gange MRHD på 60 mg på mg/m2-basis. Ingen effektdosis var 12,8 mg/kg/dag er ca. 2 gange MRHD på mg/m2-basis. Lignende virkninger på afkomsdødelighed og -vækst sås, når moderdyrene blev behandlet gennem hele drægtighedsperioden og tidlig laktation med doser ≥ 24 mg/kg/dag, ca. 4 gange MRHD på mg/m2-basis. En dosis uden effekt blev ikke bestemt i denne undersøgelse.
Amning
Risikooversigt
Data fra den publicerede litteratur rapporterer tilstedeværelsen af escitalopram og desmethylescitalopram i modermælk (se Data ). Der er rapporter om overdreven sedation, rastløshed, agitation, dårlig ernæring og ringe vægtøgning hos spædbørn, der er udsat for escitalopram via modermælk (se Kliniske overvejelser ),. Der er ingen data om virkningerne af escitalopram eller dets metabolitter på mælkeproduktionen. De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for LEXAPRO 5mg og eventuelle negative virkninger på det ammede barn fra LEXAPRO eller fra den underliggende moderens tilstand.
Kliniske overvejelser
Spædbørn, der eksponeres for LEXAPRO 20 mg, skal overvåges for overdreven sedation, rastløshed, agitation, dårlig ernæring og ringe vægtøgning.
Data
En undersøgelse af 8 ammende mødre på escitalopram med daglige doser på 10-20 mg/dag viste, at udelukkende ammede spædbørn får ca. 3,9 % af moderens vægtjusterede dosis af escitalopram og 1,7 % af moderens vægtjusterede dosis desmethylcitalopram .
Pædiatrisk brug
Sikkerheden og effektiviteten af Lexapro 10 mg er blevet fastslået hos unge (12 til 17 år) til behandling af svær depressiv lidelse [se Kliniske Studier ]. Selvom vedligeholdelseseffektiviteten hos unge patienter med svær depressiv lidelse ikke er blevet systematisk evalueret, kan vedligeholdelseseffektiviteten ekstrapoleres fra voksne data sammen med sammenligninger af escitaloprams farmakokinetiske parametre hos voksne og unge patienter.
Sikkerheden og effektiviteten af Lexapro er ikke blevet fastslået hos pædiatriske (yngre end 12 år) patienter med svær depressiv lidelse. I et 24 ugers åbent sikkerhedsstudie med 118 børn (i alderen 7 til 11 år), som havde svær depressiv lidelse, var sikkerhedsresultaterne i overensstemmelse med den kendte sikkerheds- og tolerabilitetsprofil for Lexapro.
Sikkerhed og effektivitet af Lexapro er ikke blevet fastslået hos pædiatriske patienter under 18 år med generaliseret angst.
Nedsat appetit og vægttab er blevet observeret i forbindelse med brugen af SSRI'er. Derfor bør der udføres regelmæssig monitorering af vægt og vækst hos børn og unge behandlet med et SSRI såsom Lexapro.
Geriatrisk brug
Ca. 6 % af de 1144 patienter, der fik escitalopram i kontrollerede forsøg med Lexapro 10 mg ved svær depressiv lidelse og GAD, var 60 år eller ældre; ældre patienter i disse forsøg fik daglige doser af Lexapro mellem 10 og 20 mg. Antallet af ældre patienter i disse undersøgelser var utilstrækkeligt til tilstrækkeligt at vurdere mulig differentiel effekt og sikkerhedsforanstaltninger på basis af alder. Ikke desto mindre kan større følsomhed hos nogle ældre personer over for virkningerne af Lexapro ikke udelukkes.
SSRI'er og SNRI'er, inklusive Lexapro 5mg, er blevet forbundet med tilfælde af klinisk signifikant hyponatriæmi hos ældre patienter, som kan have større risiko for denne bivirkning [se Hyponatriæmi ].
to farmakokinetiske undersøgelser blev escitaloprams halveringstid øget med ca. 50 % hos ældre forsøgspersoner sammenlignet med unge forsøgspersoner, og Cmax var uændret [se KLINISK FARMAKOLOGI ]. 10 mg/dag er den anbefalede dosis til ældre patienter [se DOSERING OG ADMINISTRATION ].
Ud af 4422 patienter i kliniske undersøgelser af racemisk citalopram var 1357 60 og derover, 1034 var 65 og derover, og 457 var 75 og derover. Der blev ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet mellem disse forsøgspersoner og yngre forsøgspersoner, og anden rapporteret klinisk erfaring har ikke identificeret forskelle i respons mellem ældre og yngre patienter, men igen kan større følsomhed hos nogle ældre individer ikke udelukkes.
OVERDOSIS
Følgende er blevet rapporteret ved overdosering af Lexapro tabletter:
- Anfald, som kan være forsinkede, og ændret mental status inklusive koma.
- Kardiovaskulær toksicitet, som kan være forsinket, herunder QRS- og QTc-intervalforlængelse, brede komplekse takyarytmier og torsade de pointes. Hypertension ses oftest, men kan sjældent se hypotension alene eller med samtidig indtagelse af alkohol.
- Serotonergt syndrom (patienter med en overdosering af flere lægemidler med andre proserotonerge lægemidler kan have en højere risiko).
Længerevarende hjerteovervågning anbefales ved indtagelse af overdosering af Lexapro på grund af risikoen for arytmi.
Gastrointestinal dekontaminering med aktivt kul bør overvejes hos patienter, der melder sig tidligt efter en Lexapro-overdosis.
Overvej at kontakte et giftcenter (1-800-221-2222) eller en medicinsk toksikolog for anbefalinger til overdosering.
KONTRAINDIKATIONER
Monoaminoxidasehæmmere (MAO-hæmmere)
Brugen af MAO-hæmmere beregnet til behandling af psykiatriske lidelser med Lexapro eller inden for 14 dage efter ophør af behandling med Lexapro 5 mg er kontraindiceret på grund af en øget risiko for serotonergt syndrom. Brugen af Lexapro 20 mg inden for 14 dage efter ophør med en MAO-hæmmer beregnet til behandling af psykiatriske lidelser er også kontraindiceret [se DOSERING OG ADMINISTRATION , og ADVARSLER OG FORHOLDSREGLER ].
Begyndelse af Lexapro 20 mg hos en patient, der er i behandling med MAO-hæmmere såsom linezolid eller intravenøs methylenblåt, er også kontraindiceret på grund af en øget risiko for serotonergt syndrom [se DOSERING OG ADMINISTRATION , og ADVARSLER OG FORHOLDSREGLER ].
Pimozid
Samtidig brug hos patienter, der tager pimozid, er kontraindiceret [se DRUGSINTERAKTIONER ].
Overfølsomhed over for Escitalopram eller Citalopram
Lexapro 20mg er kontraindiceret til patienter med overfølsomhed over for escitalopram eller citalopram eller et af de inaktive ingredienser i Lexapro.
KLINISK FARMAKOLOGI
Handlingsmekanisme
Mekanismen for antidepressiv virkning af escitalopram, S-enantiomeren af racemisk citalopram, formodes at være forbundet med forstærkning af serotonerg aktivitet i centralnervesystemet (CNS) som følge af dets hæmning af CNS-neuronal genoptagelse af serotonin (5-HT).
Farmakodynamik
In vitro og in vivo dyreforsøg tyder på, at escitalopram er en meget selektiv serotoningenoptagelseshæmmer (SSRI) med minimal effekt på noradrenalin og neuronal genoptagelse af dopamin. Escitalopram er mindst 100 gange mere potent end R-enantiomeren med hensyn til hæmning af 5-HT-genoptagelse og hæmning af 5-HT-neuronal affyringshastighed. Tolerance over for en model for antidepressiv effekt hos rotter blev ikke induceret af langtidsbehandling (op til 5 uger) med escitalopram. Escitalopram har ingen eller meget lav affinitet til serotonerge (5-HT1-7) eller andre receptorer, herunder alfa- og beta-adrenerge, dopamin (D1-5), histamin (H1-3), muskarin (M1-5) og benzodiazepin receptorer. Escitalopram binder heller ikke til eller har lav affinitet for forskellige ionkanaler, herunder Na+, K+, Cl- og Ca++ kanaler. Antagonisme af muskarine, histaminerge og adrenerge receptorer er blevet antaget at være forbundet med forskellige antikolinerge, beroligende og kardiovaskulære bivirkninger af andre psykotrope lægemidler.
Farmakokinetik
Enkelt- og flerdosisfarmakokinetikken for escitalopram er lineær og dosisproportional i et dosisområde på 10 til 30 mg/dag. Biotransformation af escitalopram er hovedsageligt hepatisk med en gennemsnitlig terminal halveringstid på ca. 27-32 timer. Ved dosering én gang dagligt opnås steady state plasmakoncentrationer inden for ca. en uge. Ved steady state var omfanget af akkumulering af escitalopram i plasma hos unge raske forsøgspersoner 2,2-2,5 gange de plasmakoncentrationer, der blev observeret efter en enkelt dosis. Tabletten og den orale opløsning af escitalopramoxalat er bioækvivalente.
Absorption og distribution
Efter en enkelt oral dosis (20 mg tablet eller opløsning) af escitalopram opnås maksimale blodniveauer efter ca. 5 timer. Absorption af escitalopram påvirkes ikke af mad.
Den absolutte biotilgængelighed af citalopram er omkring 80 % i forhold til en intravenøs dosis, og distributionsvolumenet af citalopram er omkring 12 l/kg. Data, der er specifikke for escitalopram, er ikke tilgængelige.
Bindingen af escitalopram til humane plasmaproteiner er ca. 56 %.
Metabolisme og eliminering
Efter oral administration af escitalopram er andelen af lægemidlet, der genfindes i urinen som escitalopram og S-demethylcitalopram (S-DCT), henholdsvis ca. 8 % og 10 %. Den orale clearance af escitalopram er 600 ml/min, hvor ca. 7 % af clearance skyldes renal clearance.
Escitalopram metaboliseres til S-DCT og S-didemethylcitalopram (S-DDCT). Hos mennesker er uændret escitalopram den dominerende forbindelse i plasma. Ved steady state er koncentrationen af escitaloprammetabolitten S-DCT i plasma ca. en tredjedel af escitaloprams. Niveauet af S-DDCT var ikke sporbart i de fleste forsøgspersoner. In vitro undersøgelser viser, at escitalopram er mindst 7 og 27 gange mere potent end henholdsvis S-DCT og S-DDCT til hæmning af serotonin-genoptagelse, hvilket tyder på, at metabolitterne af escitalopram ikke bidrager signifikant til escitaloprams antidepressive virkning. S-DCT og SDDCT har heller ingen eller meget lav affinitet for serotonerge (5-HT1-7) eller andre receptorer, herunder alfa- og beta-adrenerge, dopamin (D1-5), histamin (H1-3), muskarin (M1- 5) og benzodiazepinreceptorer. S-DCT og S-DDCT binder heller ikke til forskellige ionkanaler, herunder Na+, K+, Cl- og Ca++ kanaler.
In vitro undersøgelser med humane levermikrosomer indikerede, at CYP3A4 og CYP2C19 er de primære isozymer involveret i N-demethyleringen af escitalopram.
Befolkningsundergrupper
Alder
Teenagere
I et enkeltdosisstudie med 10 mg escitalopram faldt AUC for escitalopram med 19 %, og Cmax steg med 26 % hos raske unge (12 til 17 år) sammenlignet med voksne. Efter gentagen dosering af 40 mg/dag citalopram var escitaloprams eliminationshalveringstid, steady-state Cmax og AUC ens hos patienter med MDD (12 til 17 år) sammenlignet med voksne patienter. Det er ikke nødvendigt at justere dosis hos unge patienter.
Ældre
Escitaloprams farmakokinetik hos forsøgspersoner ≥ 65 år blev sammenlignet med yngre forsøgspersoner i et enkelt-dosis- og et multiple-dosis-studie. Escitalopram AUC og halveringstid blev øget med ca. 50 % hos ældre forsøgspersoner, og Cmax var uændret. 10 mg er den anbefalede dosis til ældre patienter [se DOSERING OG ADMINISTRATION ].
Køn
Baseret på data fra enkelt- og flerdosisundersøgelser, der måler escitalopram hos ældre, unge voksne og unge, er det ikke nødvendigt at justere dosis på grundlag af køn.
Nedsat leverfunktion
Citalopram oral clearance blev reduceret med 37 %, og halveringstiden blev fordoblet hos patienter med nedsat leverfunktion sammenlignet med normale forsøgspersoner. 10 mg er den anbefalede dosis af escitalopram til de fleste patienter med nedsat leverfunktion [se DOSERING OG ADMINISTRATION ].
Nedsat nyrefunktion
Hos patienter med let til moderat nedsat nyrefunktion blev oral clearance af citalopram reduceret med 17 % sammenlignet med normale forsøgspersoner. Ingen justering af dosis til sådanne patienter anbefales. Der er ingen tilgængelig information om escitaloprams farmakokinetik hos patienter med alvorligt nedsat nyrefunktion (kreatininclearance
Lægemiddel-lægemiddelinteraktioner
In vitro enzymhæmningsdata afslørede ikke en hæmmende effekt af escitalopram på CYP3A4, -1A2, -2C9, -2C19 og -2E1. Baseret på in vitro data forventes escitalopram at have ringe hæmmende effekt på in vivo metabolisme medieret af disse cytochromer. Mens in vivo-data til at løse dette spørgsmål er begrænsede, tyder resultater fra lægemiddelinteraktionsstudier på, at escitalopram i en dosis på 20 mg ikke har nogen 3A4-hæmmende virkning og en beskeden 2D6-hæmmende effekt. Se DRUGSINTERAKTIONER for mere detaljeret information om tilgængelige lægemiddelinteraktionsdata.
Dyretoksikologi og/eller farmakologi
Nethindeforandringer hos rotter
Patologiske ændringer (degeneration/atrofi) blev observeret i nethinden hos albinorotter i det 2-årige karcinogenicitetsstudie med racemisk citalopram. Der var en stigning i både forekomst og sværhedsgrad af retinal patologi hos både han- og hunrotter, der fik 80 mg/kg/dag. Lignende fund var ikke til stede hos rotter, der modtog 24 mg/kg/dag racemisk citalopram i to år, hos mus, der fik op til 240 mg/kg/dag racemisk citalopram i 18 måneder, eller hos hunde, der fik op til 20 mg/kg/ dag med racemisk citalopram i et år.
Yderligere undersøgelser for at undersøge mekanismen for denne patologi er ikke blevet udført, og den potentielle betydning af denne effekt hos mennesker er ikke blevet fastslået.
Kardiovaskulære ændringer hos hunde
et etårigt toksikologisk studie døde 5 ud af 10 beaglehunde, der fik orale racemiske citalopramdoser på 8 mg/kg/dag, pludselig mellem uge 17 og 31 efter påbegyndelse af behandlingen. Pludselige dødsfald blev ikke observeret hos rotter ved doser af racemisk citalopram op til 120 mg/kg/dag, som producerede plasmaniveauer af citalopram og dets metabolitter demethylcitalopram og didemethylcitalopram (DDCT) svarende til dem, der blev observeret hos hunde ved 8 mg/kg/dag. En efterfølgende intravenøs doseringsundersøgelse viste, at racemisk DDCT hos beaglehunde forårsagede QT-forlængelse, en kendt risikofaktor for det observerede resultat hos hunde.
Kliniske Studier
Større depressiv lidelse
Teenagere
Effekten af Lexapro som akut behandling af svær depressiv lidelse hos unge patienter blev fastslået i en 8-ugers, fleksibel dosis, placebokontrolleret undersøgelse, der sammenlignede Lexapro 10-20 mg/dag med placebo hos ambulante patienter i alderen 12 til 17 år. inklusive, som opfyldte DSM-IV-kriterierne for svær depressiv lidelse. Det primære resultat var ændring fra baseline til endepunkt i Children's Depression Rating Scale - Revised (CDRS-R). I denne undersøgelse viste Lexapro 5mg en statistisk signifikant større gennemsnitlig forbedring sammenlignet med placebo på CDRS-R.
Effekten af Lexapro til akut behandling af svær depressiv lidelse hos unge blev til dels fastslået på basis af ekstrapolation fra det 8-ugers, fleksible dosis placebokontrollerede studie med racemisk citalopram 20-40 mg/dag. I dette ambulante studie med børn og unge i alderen 7 til 17 år, som opfyldte DSM-IV-kriterierne for svær depressiv lidelse, viste citaloprambehandling en statistisk signifikant større gennemsnitlig forbedring fra baseline sammenlignet med placebo på CDRS-R; de positive resultater for dette forsøg kom i vid udstrækning fra den unge undergruppe.
To yderligere fleksible doser, placebokontrollerede MDD-studier (et Lexapro-studie med patienter i alderen 7 til 17 og et citalopram-studie med unge) viste ikke effekt.
Selvom vedligeholdelseseffektiviteten hos unge patienter ikke er blevet systematisk evalueret, kan vedligeholdelseseffektiviteten ekstrapoleres fra voksne data sammen med sammenligninger af escitaloprams farmakokinetiske parametre hos voksne og unge patienter.
Voksne
Effekten af Lexapro 5mg som behandling af svær depressiv lidelse blev fastslået i tre, 8-ugers, placebokontrollerede undersøgelser udført i ambulante patienter mellem 18 og 65 år, som opfyldte DSM-IV-kriterierne for svær depressiv lidelse. Det primære resultat i alle tre undersøgelser var ændring fra baseline til endepunkt i Montgomery Asberg Depression Rating Scale (MADRS).
Et studie med fast dosis sammenlignede 10 mg/dag Lexapro og 20 mg/dag Lexapro med placebo og 40 mg/dag citalopram. Behandlingsgrupperne med 10 mg/dag og 20 mg/dag Lexapro 5 mg viste statistisk signifikant større gennemsnitlig forbedring sammenlignet med placebo på MADRS. 10 mg og 20 mg Lexapro-grupperne var ens på dette resultatmål.
I en anden fastdosisundersøgelse af 10 mg/dag Lexapro og placebo viste 10 mg/dag Lexapro-behandlingsgruppen statistisk signifikant større gennemsnitlig forbedring sammenlignet med placebo på MADRS.
et studie med fleksibel dosis, der sammenlignede Lexapro 20 mg, titreret mellem 10 og 20 mg/dag, med placebo og citalopram, titreret mellem 20 og 40 mg/dag, viste Lexapro 5 mg-behandlingsgruppen statistisk signifikant større gennemsnitlig forbedring sammenlignet med placebo på MADRS.
Analyser af sammenhængen mellem behandlingsresultat og alder, køn og race antydede ikke nogen differentiel respons på basis af disse patientkarakteristika.
I et længerevarende forsøg blev 274 patienter, der opfyldte (DSM-IV) kriterier for svær depressiv lidelse, og som havde reageret i løbet af en indledende 8 ugers åben behandlingsfase med Lexapro 10 eller 20 mg/dag, randomiseret til fortsat behandling med Lexapro i samme dosis eller placebo i op til 36 ugers observation for tilbagefald. Respons under den åbne fase blev defineret ved at have et fald i MADRS total score til ≤ 12. Tilbagefald under den dobbeltblinde fase blev defineret som en stigning af MADRS total score til ≥ 22, eller seponering på grund af utilstrækkelig klinisk respons . Patienter, der fik fortsat Lexapro, oplevede en statistisk signifikant længere tid til tilbagefald sammenlignet med dem, der fik placebo.
Generaliseret angstlidelse
Effekten af Lexapro 5 mg til akut behandling af generaliseret angstlidelse (GAD) blev påvist i tre, 8-ugers, multicenter, fleksible dosis, placebokontrollerede undersøgelser, der sammenlignede Lexapro 10-20 mg/dag med placebo hos voksne ambulante patienter mellem kl. 18 og 80 år, der opfyldte DSM-IV kriterier for GAD. I alle tre undersøgelser viste Lexapro en statistisk signifikant større gennemsnitlig forbedring sammenlignet med placebo på Hamilton Anxiety Scale (HAM-A).
Der var for få patienter i forskellige etniske grupper og aldersgrupper til tilstrækkeligt at kunne vurdere, hvorvidt Lexapro har forskellige virkninger i disse grupper. Der var ingen forskel i respons på Lexapro mellem mænd og kvinder.
PATIENTOPLYSNINGER
Lexapro® (leks-a-pro) (escitalopram) Tabletter/oral opløsning
Læs medicinvejledningen, der følger med Lexapro, før du begynder at tage den, og hver gang du får genopfyldning. Der kan være nye oplysninger. Denne medicinvejledning træder ikke i stedet for at tale med din læge om din medicinske tilstand eller behandling. Tal med din sundhedsplejerske, hvis der er noget, du ikke forstår eller ønsker at lære mere om.
Hvad er den vigtigste information, jeg bør vide om Lexapro 20mg?
Lexapro 10mg og anden antidepressiv medicin kan forårsage alvorlige bivirkninger, herunder:
Hold alle opfølgningsbesøg hos din læge, og ring mellem besøgene, hvis du er bekymret for symptomer.
Ring til din læge med det samme, hvis du har nogle af følgende symptomer, eller ring til 911, hvis en nødsituation, især hvis de er nye, værre eller bekymrer dig:
Ring til din læge med det samme, hvis du har nogle af følgende symptomer, eller ring til 911, hvis en nødsituation. Lexapro kan være forbundet med disse alvorlige bivirkninger:
Symptomer hos mænd kan omfatte:
Symptomer hos kvinder kan omfatte:
Tal med din læge, hvis du udvikler ændringer i din seksuelle funktion, eller hvis du har spørgsmål eller bekymringer om seksuelle problemer under behandling med Lexapro. Der kan være behandlinger, som din sundhedsudbyder kan foreslå.
- Lexapro 5mg og anden antidepressiv medicin kan øge selvmordstanker eller -handlinger hos nogle børn, teenagere eller unge voksne inden for første par måneders behandling eller når dosis ændres.
- Depression eller andre alvorlige psykiske sygdomme er de vigtigste årsager til selvmordstanker eller -handlinger.
- Hold øje med disse ændringer, og ring til din læge med det samme, hvis du bemærker:
- Nye eller pludselige ændringer i humør, adfærd, handlinger, tanker eller følelser, især hvis de er alvorlige.
- Vær særlig opmærksom på sådanne ændringer, når Lexapro 5mg startes, eller når dosis ændres.
- forsøg på at begå selvmord
- handler på farlige impulser
- opfører sig aggressivt eller voldeligt
- tanker om selvmord eller døende
- ny eller værre depression
- nye eller værre angst- eller panikanfald
- føler sig ophidset, rastløs, vred eller irritabel
- problemer med at sove
- øget aktivitet eller tale mere end hvad der er normalt for dig
- andre usædvanlige ændringer i adfærd eller humør
- agitation, hallucinationer, koma eller andre ændringer i mental status
- koordinationsproblemer eller muskeltrækninger (overaktive reflekser)
- hjerteslag, højt eller lavt blodtryk
- svedtendens eller feber
- kvalme, opkastning eller diarré
- muskelstivhed
- vejrtrækningsbesvær
- hævelse af ansigt, tunge, øjne eller mund
- udslæt, kløende nældefeber (nældefeber) eller vabler, alene eller med feber eller ledsmerter
- kraftigt øget energi
- svære søvnbesvær
- race tanker
- hensynsløs opførsel
- usædvanligt store ideer
- overdreven lykke eller irritabilitet
- taler mere eller hurtigere end normalt
- hovedpine
- svaghed eller følelse ustabil
- forvirring, problemer med at koncentrere sig eller tænke eller hukommelsesproblemer
Kun nogle mennesker er i fare for disse problemer. Det kan være en god idé at gennemgå en øjenundersøgelse for at se, om du er i fare, og få forebyggende behandling, hvis du er det.
- øjensmerter
- ændringer i synet
- hævelse eller rødme i eller omkring øjet
- Forsinket sædafgang eller manglende evne til at få sædafgang
- Nedsat sexlyst
- Problemer med at få eller bevare erektion
- Nedsat sexlyst
- Forsinket orgasme eller manglende evne til at få orgasme
Stop ikke Lexapro uden først at tale med din læge. Stoppe Lexapro 5mg for hurtigt kan forårsage alvorlige symptomer, herunder:
- angst, irritabilitet, højt eller lavt humør, rastløshed eller ændringer i søvnvaner
- hovedpine, svedtendens, kvalme, svimmelhed
- elektrisk stød-lignende fornemmelser, rysten, forvirring
Hvad er Lexapro?
Lexapro 20mg er en receptpligtig medicin, der bruges til at behandle depression. Det er vigtigt at tale med din sundhedsplejerske om risikoen ved at behandle depression og også risikoen ved ikke at behandle den. Du bør diskutere alle behandlingsvalg med din læge. Lexapro bruges også til at behandle:
- Major Depressive Disorder (MDD)
- Generaliseret angstlidelse (GAD)
Tal med din læge, hvis du ikke tror, at din tilstand bliver bedre med Lexapro-behandling.
Hvem bør ikke tage Lexapro 5mg?
Tag ikke Lexapro 10 mg, hvis du:
Personer, der tager Lexapro 20mg tæt på en MAO-hæmmer, kan have alvorlige eller endda livstruende bivirkninger. Få lægehjælp med det samme, hvis du har nogle af disse symptomer:
- er allergisk over for escitalopram eller citalopram eller et af indholdsstofferne i Lexapro. Se slutningen af denne medicinvejledning for en komplet liste over ingredienser i Lexapro.
- Tag en monoaminoxidasehæmmer (MAOI). Spørg din læge eller apoteket, hvis du ikke er sikker på, om du tager en MAO-hæmmer, inklusive linezolid.
- Tag ikke en MAO-hæmmer inden for 2 uger efter at have stoppet Lexapro 10mg, medmindre din læge har bedt det
- Start ikke Lexapro 20mg, hvis du stoppede med at tage en MAO-hæmmer inden for de sidste 2 uger, medmindre din læge har bedt dig om det.
- høj feber
- ukontrollerede muskelspasmer
- stive muskler
- hurtige ændringer i hjertefrekvens eller blodtryk
- forvirring
- tab af bevidsthed (besvimelse)
- Tag ikke Lexapro med Orap® (pimozid), da det kan forårsage alvorlige hjerteproblemer at tage disse to lægemidler sammen.
Hvad skal jeg fortælle min sundhedsplejerske, før jeg tager Lexapro 20mg? Spørg hvis du ikke er sikker.
Inden du starter Lexapro 20mg, skal du fortælle din læge, hvis du:
- Tager visse lægemidler såsom:
- Triptaner bruges til at behandle migrænehovedpine
- Medicin, der bruges til at behandle humør, angst, psykotiske eller tankeforstyrrelser, herunder tricykliske, lithium, SSRI'er, SNRI'er, amfetaminer eller antipsykotika
- Tramadol
- Håndkøbs-tilskud som tryptofan eller perikon
- har leverproblemer
- har nyreproblemer
- har hjerteproblemer
- har eller haft anfald eller kramper
- har bipolar lidelse eller mani
- har lave natriumniveauer i dit blod
- har en historie med et slagtilfælde
- har forhøjet blodtryk
- har eller haft blødningsproblemer
- er gravid eller planlægger at blive gravid. Indtagelse af LEXAPRO sent i graviditeten kan føre til en øget risiko for visse problemer hos din nyfødte. Tal med din læge om fordelene og risiciene ved behandling af depression under graviditet
- Hvis du bliver gravid, mens du tager LEXAPRO, skal du tale med din læge om tilmelding til det nationale graviditetsregister for antidepressiva. Du kan tilmelde dig ved at ringe på 1-844-405-6185 eller gå til https://womensmentalhealth.org/clinicaland- researchprograms/ pregnancyregistry/antidepressants/
- ammer eller planlægger at amme. Lexapro kan passere over i din modermælk. Tal med din læge om den bedste måde at fodre din baby på, hvis du tager Lexapro.
Fortæl din læge om al den medicin, du tager, herunder receptpligtig og ikke-receptpligtig medicin, vitaminer og naturlægemidler. Lexapro 10mg og nogle lægemidler kan interagere med hinanden, virker muligvis ikke så godt eller kan forårsage alvorlige bivirkninger.
Din læge eller apotek kan fortælle dig, om det er sikkert at tage Lexapro 20 mg sammen med din anden medicin. Du må ikke starte eller stoppe nogen form for medicin, mens du tager Lexapro 10 mg uden først at tale med din læge.
Hvis du tager Lexapro, bør du ikke tage anden medicin, der indeholder escitalopram eller citalopram, herunder: Celexa.
Hvordan skal jeg tage Lexapro?
- Tag Lexapro nøjagtigt som foreskrevet. Din sundhedsplejerske skal muligvis ændre dosis af Lexapro, indtil den er den rigtige dosis for dig.
- Lexapro 5mg kan tages med eller uden mad.
- Hvis du glemmer en dosis af Lexapro, skal du tage den glemte dosis, så snart du husker det. Hvis det næsten er tid til næste dosis, skal du springe den glemte dosis over og tage din næste dosis på det normale tidspunkt. Tag ikke to doser Lexapro på samme tid.
- Hvis du tager for meget Lexapro, skal du straks ringe til din læge eller giftkontrolcenter eller få akut behandling.
Hvad skal jeg undgå, mens jeg tager Lexapro?
Lexapro 5mg kan forårsage søvnighed eller kan påvirke din evne til at træffe beslutninger, tænke klart eller reagere hurtigt. Du bør ikke køre bil, betjene tunge maskiner eller udføre andre farlige aktiviteter, før du ved, hvordan Lexapro påvirker dig. Drik ikke alkohol, mens du bruger Lexapro.
Hvad er de mulige bivirkninger af Lexapro 20mg?
Lexapro 10mg kan forårsage alvorlige bivirkninger, inklusive alle af dem, der er beskrevet i afsnittet med titlen "Hvad er den vigtigste information, jeg bør vide om Lexapro?"
Almindelige mulige bivirkninger hos personer, der tager Lexapro 5mg omfatter:
- Kvalme
- Søvnighed
- Svaghed
- Svimmelhed
- Føler sig angst
- Søvnbesvær
- Seksuelle problemer
- Svedende
- Ryster
- Føler sig ikke sulten
- Tør mund
- Forstoppelse
- Infektion
- Gaber
Andre bivirkninger hos børn og unge omfatter:
- øget tørst
- unormal stigning i muskelbevægelser eller agitation
- næseblod
- vanskelig vandladning
- kraftige menstruationer
- mulig nedsat væksthastighed og vægtændring. Dit barns højde og vægt bør overvåges under behandling med Lexapro.
Fortæl din læge, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder. Disse er ikke alle de mulige bivirkninger af Lexapro. For mere information, spørg din læge eller apotek.
RING DIN LÆGE FOR LÆGE RÅDGIVNING OM BIVIRKNINGER. DU KAN RAPPORTERE BIVIRKNINGER TIL FDA PÅ 1-800-FDA-1088.
Hvordan skal jeg opbevare Lexapro 20mg?
- Opbevar Lexapro ved 68°F til 77°F (20°C til 25°C); udflugter tilladt til 59°F til 86°F (15°C til 30°C).
- Hold Lexapro-flasken tæt lukket.
Opbevar Lexapro 10mg og al medicin utilgængeligt for børn.
Generel information om Lexapro
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en medicinvejledning. Brug ikke Lexapro til en tilstand, som det ikke er ordineret til. Giv ikke Lexapro 10 mg til andre mennesker, selvom de har samme lidelse. Det kan skade dem.
Denne medicinvejledning opsummerer de vigtigste oplysninger om Lexapro. Hvis du vil have mere information, så tal med din sundhedsplejerske. Du kan bede din sundhedsudbyder eller apotek om oplysninger om Lexapro, som er skrevet til sundhedspersonale.
For mere information om Lexapro 20mg ring 1-800-678-1605 eller gå til www.Lexapro.com.
Hvad er ingredienserne i Lexapro 20mg?
Aktiv ingrediens: escitalopram oxalat Inaktive ingredienser:
- talkum, croscarmellosenatrium, mikrokrystallinsk cellulose/kolloid siliciumdioxid og magnesiumstearat. Filmcoatingen indeholder hypromellose, titaniumdioxid og polyethylenglycol.
- Oral løsning: sorbitol, renset vand, citronsyre, natriumcitrat, æblesyre, glycerin, propylenglycol, methylparaben, propylparaben og naturlig pebermyntesmag (oral opløsning markedsføres ikke i øjeblikket).
Denne medicinvejledning er godkendt af US Food and Drug Administration.
