Cymbalta 20mg, 30mg, 40mg, 60mg Duloxetine Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Cymbalta, og hvordan bruges det?
Cymbalta er en receptpligtig medicin, der bruges til at behandle symptomer på svær depressiv lidelse, diabetisk perifer neuropatisk smerte, generaliseret angstlidelse, fibromyalgi og kroniske muskelsmerter. Cymbalta kan bruges alene eller sammen med andre lægemidler.
- Cymbalta tilhører en klasse af lægemidler kaldet antidepressiva, SNRI'er, fibromyalgimidler.
- Det vides ikke, om Cymbalta er sikkert og effektivt til børn under 7 år.
Hvad er de mulige bivirkninger af Cymbalta 20mg?
Cymbalta kan forårsage alvorlige bivirkninger, herunder:
- bankende hjerteslag eller flagrende i dit bryst,
- svimmelhed,
- let blå mærker,
- usædvanlig blødning,
- synsforandringer,
- smertefuld eller vanskelig vandladning,
- impotens,
- seksuelle problemer,
- højresidet øvre mavesmerter,
- kløe,
- mørk urin,
- gulfarvning af huden eller øjnene (gulsot),
- hovedpine,
- forvirring,
- utydelig tale,
- svær svaghed,
- opkastning,
- tab af koordination,
- føler sig ustabil,
- race tanker,
- øget energi,
- hensynsløs opførsel,
- føler dig ekstrem glad eller irritabel,
- taler mere end normalt, og
- alvorlige søvnproblemer
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Cymbalta omfatter:
- døsighed,
- kvalme,
- forstoppelse,
- mistet appetiten,
- mundtørhed, og
- øget svedtendens
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Cymbalta. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
SELVmordstanker og -adfærd
Antidepressiva øgede risikoen for selvmordstanker og -adfærd hos børn, unge og unge voksne i korttidsundersøgelser. Disse undersøgelser viste ikke en stigning i risikoen for selvmordstanker og -adfærd ved brug af antidepressiva hos patienter over 24 år; der var en reduktion i risiko ved brug af antidepressiva hos patienter i alderen 65 og ældre [se ADVARSLER OG FORHOLDSREGLER ].
Hos patienter i alle aldre, som er startet på antidepressiv behandling, skal du nøje overvåge for forværring og for fremkomsten af selvmordstanker og -adfærd. Rådgive familier og pårørende om behovet for tæt observation og kommunikation med den ordinerende læge [se ADVARSLER OG FORHOLDSREGLER ].
BESKRIVELSE
CYMBALTA® (duloxetin kapsler med forsinket frigivelse) er en selektiv serotonin- og noradrenalin-genoptagelseshæmmer (SSNRI) til oral administration. Dens kemiske betegnelse er (+)-(S)-N-methyl-y-(1-naphthyloxy)-2-thiophenpropylamin-hydrochlorid. Den empiriske formel er C18H19NOS•HCl, hvilket svarer til en molekylvægt på 333,88. Strukturformlen er:
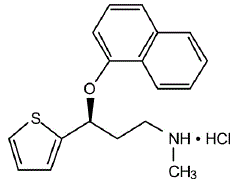
Duloxetinhydrochlorid er et hvidt til let brunligt hvidt fast stof, som er let opløseligt i vand.
Hver kapsel indeholder enterisk coatede pellets på henholdsvis 22,4, 33,7 eller 67,3 mg duloxetinhydrochlorid svarende til 20, 30 eller 60 mg duloxetin. Disse enterisk-coatede pellets er designet til at forhindre nedbrydning af lægemidlet i det sure miljø i maven. Inaktive ingredienser omfatter FD&C Blue No. 2, gelatine, hypromellose, hydroxypropylmethylcelluloseacetatsuccinat, natriumlaurylsulfat, saccharose, sukkerkugler, talkum, titaniumdioxid og triethylcitrat. 20 og 60 mg kapslerne indeholder også gul jernoxid.
INDIKATIONER
CYMBALTA® er indiceret til behandling af:
- Svær depressiv lidelse hos voksne
- Generaliseret angstlidelse hos voksne og pædiatriske patienter 7 år og ældre
- Diabetisk perifer neuropatisk smerte hos voksne
- Fibromyalgi hos voksne og pædiatriske patienter 13 år og ældre
- kroniske muskel- og skeletsmerter hos voksne
DOSERING OG ADMINISTRATION
Vigtige administrationsinstruktioner
Administrer CYMBALTA oralt (med eller uden måltider) og synk hele. Du må ikke tygge eller knuse, og du må ikke åbne kapslen med forsinket frigivelse og drys dens indhold på mad eller bland med væske, da disse handlinger kan påvirke den enteriske belægning. Hvis en dosis af CYMBALTA 20 mg er glemt, skal du tage den glemte dosis, så snart den huskes. Hvis det næsten er tid til den næste dosis, skal du springe den glemte dosis over og tage den næste dosis på det normale tidspunkt. Tag ikke to doser CYMBALTA 60 mg på samme tid.
Dosering til behandling af svær depressiv lidelse hos voksne
Den anbefalede startdosis til voksne med MDD er 40 mg/dag (givet som 20 mg to gange dagligt) til 60 mg/dag (givet enten én gang dagligt eller som 30 mg to gange dagligt). For nogle patienter kan det være ønskeligt at starte med 30 mg én gang dagligt i 1 uge, for at give patienterne mulighed for at tilpasse sig CYMBALTA 30 mg, før de øges til 60 mg én gang dagligt. Selvom en dosis på 120 mg/dag har vist sig at være effektiv, er der ingen beviser for, at doser større end 60 mg/dag giver nogen yderligere fordele. Revurder med jævne mellemrum for at bestemme behovet for vedligeholdelsesbehandling og den passende dosis til en sådan behandling.
Dosering til behandling af generaliseret angstlidelse
Anbefalet dosering til voksne under 65 år
For de fleste voksne under 65 år med GAD, påbegyndes CYMBALTA 60 mg én gang dagligt. For nogle patienter kan det være ønskeligt at starte med 30 mg én gang dagligt i 1 uge, for at give patienterne mulighed for at tilpasse sig CYMBALTA 40 mg, før de øges til 60 mg én gang dagligt. Mens en dosis på 120 mg én gang dagligt har vist sig at være effektiv, er der ingen beviser for, at doser større end 60 mg/dag giver yderligere fordele. Ikke desto mindre, hvis der træffes en beslutning om at øge dosis ud over 60 mg én gang dagligt, øges dosis i trin på 30 mg én gang dagligt. Revurder med jævne mellemrum for at bestemme det fortsatte behov for vedligeholdelsesbehandling og den passende dosis til en sådan behandling.
Anbefalet dosering til geriatriske patienter
Hos geriatriske patienter med GAD skal CYMBALTA påbegyndes med en dosis på 30 mg én gang dagligt i 2 uger, før en øgning til måldosis på 60 mg/dag overvejes. Derefter kan patienter drage fordel af doser over 60 mg én gang dagligt. Hvis det besluttes at øge dosis ud over 60 mg én gang dagligt, øges dosis i trin på 30 mg én gang dagligt. Den maksimale undersøgte dosis var 120 mg pr. dag.
Anbefalet dosering til pædiatriske patienter i alderen 7 til 17 år
Påbegynd CYMBALTA 30 mg hos pædiatriske patienter i alderen 7 til 17 år med GAD i en dosis på 30 mg én gang dagligt i 2 uger, før man overvejer en stigning til 60 mg én gang dagligt. Det anbefalede dosisområde er 30 til 60 mg én gang dagligt. Nogle patienter kan have gavn af doser over 60 mg én gang dagligt. Hvis det besluttes at øge dosis ud over 60 mg én gang dagligt, øges dosis i trin på 30 mg én gang dagligt. Den maksimale undersøgte dosis var 120 mg pr. dag.
Dosering til behandling af diabetisk perifer neuropatisk smerte hos voksne
Administrer 60 mg én gang dagligt til voksne med diabetisk perifer neuropatisk smerte. Der er ingen evidens for, at doser højere end 60 mg én gang dagligt giver yderligere betydelig fordel, og den højere dosis tolereres klart mindre godt. For patienter, for hvem tolerabilitet er et problem, kan en lavere startdosis overvejes.
Da diabetes ofte kompliceres af nyresygdom, overvej en lavere startdosis og gradvis stigning i dosis til patienter med nedsat nyrefunktion [se Dosering til patienter med nedsat leverfunktion eller svær nyreinsufficiens og Brug i specifikke populationer ].
Dosering til behandling af fibromyalgi
Anbefalet dosering til voksne
Den anbefalede CYMBALTA-dosis er 60 mg én gang dagligt hos voksne med fibromyalgi. Begynd behandlingen med 30 mg én gang dagligt i 1 uge for at give patienterne mulighed for at tilpasse sig CYMBALTA 20 mg, før de øges til 60 mg én gang dagligt. Nogle patienter kan reagere på startdosis. Der er ingen evidens for, at doser større end 60 mg/dag giver yderligere fordele, selv hos patienter, der ikke reagerer på en 60 mg/dag dosis, og højere doser var forbundet med en højere frekvens af bivirkninger.
Anbefalet dosering til pædiatriske patienter i alderen 13 til 17 år
Den anbefalede startdosis CYMBALTA 60 mg til pædiatriske patienter i alderen 13-17 år med fibromyalgi er 30 mg én gang dagligt. Dosis kan øges til 60 mg én gang dagligt baseret på respons og tolerabilitet.
Dosering til behandling af kronisk muskuloskeletale smerter hos voksne
Den anbefalede dosis CYMBALTA er 60 mg én gang dagligt hos voksne med kroniske smerter i bevægeapparatet. Begynd behandlingen med 30 mg én gang dagligt i en uge for at give patienterne mulighed for at tilpasse sig CYMBALTA, før de øges til 60 mg én gang dagligt. Der er ingen evidens for, at højere doser giver yderligere fordele, selv hos patienter, der ikke reagerer på en dosis på 60 mg én gang dagligt, og højere doser er forbundet med en højere frekvens af bivirkninger [se Kliniske Studier ].
Dosering til patienter med nedsat leverfunktion eller svær nyreinsufficiens
Undgå brug til patienter med kronisk leversygdom eller cirrhose [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
Undgå brug til patienter med svært nedsat nyrefunktion, GFR ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
Ophører med CYMBALTA
Bivirkninger efter seponering af CYMBALTA, efter brat eller tilspidset seponering, omfatter: svimmelhed, hovedpine, kvalme, diarré, paræstesi, irritabilitet, opkastning, søvnløshed, angst, hyperhidrose og træthed. En gradvis reduktion af dosis i stedet for pludseligt ophør anbefales, når det er muligt [se ADVARSLER OG FORHOLDSREGLER ].
At skifte en patient til eller fra en monoaminoxidasehæmmer (MAOI), beregnet til at behandle psykiatriske lidelser
Der bør gå mindst 14 dage mellem seponering af en MAO-hæmmer beregnet til behandling af psykiatriske lidelser og påbegyndelse af behandling med CYMBALTA. Omvendt bør der tillades mindst 5 dage efter ophør med CYMBALTA 60 mg, før man starter en MAO-hæmmer beregnet til behandling af psykiatriske lidelser [se KONTRAINDIKATIONER ].
Brug af CYMBALTA med andre MAO-hæmmere såsom linezolid eller methylenblåt
Start ikke CYMBALTA hos en patient, der er i behandling med linezolid eller intravenøs methylenblåt, da der er en øget risiko for serotonergt syndrom. Hos en patient, som kræver mere akut behandling af en psykiatrisk tilstand, bør andre indgreb, herunder hospitalsindlæggelse, overvejes [se KONTRAINDIKATIONER ].
nogle tilfælde kan en patient, der allerede modtager CYMBALTA-behandling, have behov for akut behandling med linezolid eller intravenøs methylenblåt. Hvis acceptable alternativer til linezolid eller intravenøs methylenblåt behandling ikke er tilgængelige, og de potentielle fordele ved linezolid eller intravenøs methylenblåt behandling vurderes at opveje risikoen for serotonergt syndrom hos en bestemt patient, skal CYMBALTA stoppes omgående, og linezolid eller intravenøs methylenblåt kan administreres. Patienten skal overvåges for symptomer på serotonergt syndrom i 5 dage eller indtil 24 timer efter den sidste dosis linezolid eller intravenøs methylenblåt, alt efter hvad der kommer først. Behandling med CYMBALTA kan genoptages 24 timer efter den sidste dosis linezolid eller intravenøs methylenblåt [se ADVARSLER OG FORHOLDSREGLER ].
Risikoen ved at administrere methylenblåt ad ikke-intravenøse veje (såsom orale tabletter eller ved lokal injektion) eller i intravenøse doser meget lavere end 1 mg/kg med CYMBALTA er uklar. Lægen bør ikke desto mindre være opmærksom på muligheden for opståede symptomer på serotonergt syndrom ved sådan brug [se ADVARSLER OG FORHOLDSREGLER ].
HVORDAN LEVERET
Doseringsformer og styrker
CYMBALTA fås som kapsler med forsinket frigivelse:
- 20 mg uigennemsigtige grønne kapsler præget med "Lilly 3235 20mg"
- 30 mg uigennemsigtige hvide og blå kapsler påtrykt "Lilly 3240 30mg"
- 60 mg uigennemsigtige grønne og blå kapsler præget med "Lilly 3270 60mg"
CYMBALTA (duloxetin kapsler med forsinket frigivelse) fås i følgende styrker, farver, aftryk og præsentationer:
Opbevaring og håndtering
Opbevares ved 25°C (77°F); udflugter tilladt til 15-30°C (59-86°F) [se USP kontrolleret rumtemperatur].
Markedsført af: Lilly USA, LLC Indianapolis, IN 46285, USA. Revideret: juli 2021
BIVIRKNINGER
Følgende alvorlige bivirkninger er beskrevet nedenfor og andetsteds i mærkningen:
- Selvmordstanker og -adfærd hos børn, unge og unge voksne [se KASSE ADVARSEL og ADVARSLER OG FORHOLDSREGLER ]
- Hepatotoksicitet [se ADVARSLER OG FORHOLDSREGLER ]
- Ortostatisk hypotension, fald og synkope [se ADVARSLER OG FORHOLDSREGLER ]
- Serotoninsyndrom [se ADVARSLER OG FORHOLDSREGLER ]
- Øget risiko for blødning [se ADVARSLER OG FORHOLDSREGLER ]
- Alvorlige hudreaktioner [se ADVARSLER OG FORHOLDSREGLER ]
- Afbrydelsessyndrom [se ADVARSLER OG FORHOLDSREGLER ]
- Aktivering af mani/hypomani [se ADVARSLER OG FORHOLDSREGLER ]
- Vinkel-lukkende glaukom [se ADVARSLER OG FORHOLDSREGLER ]
- Anfald [se ADVARSLER OG FORHOLDSREGLER ]
- Stigning i blodtryk [se ADVARSLER OG FORHOLDSREGLER ]
- Klinisk vigtige lægemiddelinteraktioner [se ADVARSLER OG FORHOLDSREGLER ]
- Hyponatriæmi [se ADVARSLER OG FORHOLDSREGLER ]
- Urin tøven og retention [se ADVARSLER OG FORHOLDSREGLER ]
- Seksuel dysfunktion [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
De angivne frekvenser af bivirkninger repræsenterer andelen af patienter, der mindst én gang oplevede én behandlingsudløst bivirkning af den angivne type. En reaktion blev betragtet som behandlingsudløst, hvis den opstod for første gang eller forværredes under behandling efter baseline-evaluering.
Bivirkninger hos voksne
Database for kliniske forsøg for voksne
Dataene beskrevet nedenfor afspejler eksponering for CYMBALTA i placebokontrollerede voksenforsøg for MDD (N=3779), GAD (N=1018), OA (N=503), CLBP (N=600), DPNP (N=906), og FM (N=1294). Aldersintervallet i denne puljede befolkning var 17 til 89 år. I denne poolede population var 66 %, 61 %, 61 %, 43 % og 94 % af voksne patienter kvinder; og 82 %, 73 %, 85 %, 74 % og 86 % af voksne patienter var kaukasiske i henholdsvis MDD-, GAD-, OA- og CLBP-, DPNP- og FM-populationerne. De fleste patienter fik CYMBALTA doser på i alt 60 til 120 mg dagligt [se Kliniske Studier ]. Dataene nedenfor inkluderer ikke resultaterne af forsøget, der evaluerede effektiviteten af CYMBALTA 30 mg til behandling af GAD hos patienter ≥65 år (undersøgelse GAD-5) [se Kliniske Studier ]; de bivirkninger, der blev observeret i denne geriatriske population, svarede dog generelt til bivirkninger i den samlede voksne population.
Bivirkninger, der fører til seponering af behandling i placebokontrollerede forsøg med voksne
Større depressiv lidelse
Ca. 8,4 % (319/3779) af CYMBALTA-behandlede patienter i placebokontrollerede voksenforsøg for MDD afbrød behandlingen på grund af en bivirkning sammenlignet med 4,6 % (117/2536) af placebobehandlede patienter. Kvalme (CYMBALTA 1,1 %, placebo 0,4 %) var den eneste bivirkning, der blev rapporteret som årsag til seponering og blev anset for at være lægemiddelrelateret (dvs. seponering forekommer hos mindst 1 % af de CYMBALTA-behandlede patienter og med en hastighed på kl. mindst det dobbelte af placebo-behandlede patienter).
Generaliseret angstlidelse
Ca. 13,7 % (139/1018) af de CYMBALTA-behandlede patienter i placebokontrollerede voksenforsøg for GAD afbrød behandlingen på grund af en bivirkning sammenlignet med 5 % (38/767) for placebobehandlede patienter. Almindelige bivirkninger rapporteret som årsag til seponering og anset for at være lægemiddelrelaterede (som defineret ovenfor) omfattede kvalme (CYMBALTA 3,3 %, placebo 0,4 %) og svimmelhed (CYMBALTA 1,3 %, placebo 0,4 %).
Diabetisk perifer neuropatisk smerte
Ca. 12,9 % (117/906) af de CYMBALTA-behandlede patienter i placebokontrollerede voksenforsøg for DPNP afbrød behandlingen på grund af en bivirkning sammenlignet med 5,1 % (23/448) for placebobehandlede patienter. Almindelige bivirkninger rapporteret som årsag til seponering og anset for at være lægemiddelrelaterede (som defineret ovenfor) omfattede kvalme (CYMBALTA 3,5 %, placebo 0,7 %), svimmelhed (CYMBALTA 1,2 %, placebo 0,4 %) og døsighed (CYMBALTA 1,1 % , placebo 0 %).
Fibromyalgi
Ca. 17,5 % (227/1294) af de CYMBALTA-behandlede patienter i 3- til 6-måneders placebokontrollerede voksenforsøg for FM afbrød behandlingen på grund af en bivirkning sammenlignet med 10,1 % (96/955) for placebo-behandlede patienter . Bivirkninger rapporteret som årsag til seponering og anset for at være lægemiddelrelaterede (som defineret ovenfor) omfattede kvalme (CYMBALTA 2,0 %, placebo 0,5 %), hovedpine (CYMBALTA 1,2 %, placebo 0,3 %), døsighed (CYMBALTA 1,1 %, placebo 0 %) og træthed (CYMBALTA 1,1 %, placebo 0,1 %).
Kroniske smerter på grund af slidgigt
Ca. 15,7 % (79/503) af de CYMBALTA-behandlede patienter i 13-ugers placebokontrollerede voksenforsøg for kroniske smerter på grund af OA afbrød behandlingen på grund af en bivirkning, sammenlignet med 7,3 % (37/508) for placebo- behandlede patienter. Bivirkninger rapporteret som årsag til seponering og anset for at være lægemiddelrelaterede (som defineret ovenfor) omfattede kvalme (CYMBALTA 2,2 %, placebo 1 %).
Kroniske lændesmerter
Ca. 16,5 % (99/600) af de CYMBALTA-behandlede patienter i 13-ugers placebokontrollerede voksenforsøg for CLBP afbrød behandlingen på grund af en bivirkning sammenlignet med 6,3 % (28/441) for placebobehandlede patienter. Bivirkninger rapporteret som årsag til seponering og anset for at være lægemiddelrelaterede (som defineret ovenfor) omfattede kvalme (CYMBALTA 3 %, placebo 0,7 %) og døsighed (CYMBALTA 1 %, placebo 0 %).
Mest almindelige bivirkninger i forsøg med voksne
De mest almindeligt observerede bivirkninger hos CYMBALTA-behandlede patienter (som defineret ovenfor) var:
- Diabetisk perifer neuropati: kvalme, somnolens, nedsat appetit, forstoppelse, hyperhidrose og mundtørhed.
- Fibromyalgi: kvalme, mundtørhed, forstoppelse, somnolens, nedsat appetit, hyperhidrose og agitation.
- Kroniske smerter på grund af slidgigt: kvalme, træthed, forstoppelse, mundtørhed, søvnløshed, somnolens og svimmelhed.
- Kroniske lændesmerter: kvalme, mundtørhed, søvnløshed, somnolens, forstoppelse, svimmelhed og træthed.
De mest almindeligt observerede bivirkninger hos CYMBALTA-behandlede patienter i alle de poolede voksne populationer (dvs. MDD, GAD, DPNP, FM, OA og CLBP) (incidens på mindst 5 % og mindst to gange forekomsten hos placebobehandlede patienter) var kvalme, mundtørhed, somnolens, forstoppelse, nedsat appetit og hyperhidrose.
Tabel 2 viser forekomsten af bivirkninger i placebokontrollerede forsøg for godkendte voksne populationer (dvs. MDD, GAD, DPNP, FM, OA og CLBP), som forekom hos 5 % eller flere af CYMBALTA-behandlede patienter og med en højere forekomst end placebobehandlede patienter.
Bivirkninger i poolede MDD- og GAD-forsøg hos voksne
Tabel 3 viser forekomsten af bivirkninger i MDD og GAD placebokontrollerede voksenforsøg, der forekom hos 2 % eller flere af CYMBALTA-behandlede patienter og med en højere hyppighed end placebobehandlede patienter.
Bivirkninger i DPNP-, FM-, OA- og CLBP-voksenforsøgene
Tabel 4 viser forekomsten af bivirkninger, der forekom hos 2 % eller flere af CYMBALTA-behandlede patienter (bestemt før afrunding) i den akutte fase før markedsføring af DPNP, FM, OA og CLBP placebokontrollerede voksenforsøg og med en højere hyppighed end placebobehandlede patienter.
Effekter på mandlig og kvindelig seksuel funktion hos voksne med MDD
Ændringer i seksuel lyst, seksuel præstation og seksuel tilfredsstillelse forekommer ofte som manifestationer af psykiatriske lidelser eller diabetes, men de kan også være en konsekvens af farmakologisk behandling. Fordi uønskede seksuelle reaktioner formodes at være frivilligt underrapporterede, blev Arizona Sexual Experience Scale (ASEX), et valideret mål designet til at identificere seksuelle bivirkninger, brugt prospektivt i 4 MDD placebokontrollerede voksenforsøg (studier MDD-1, MDD-2 , MDD-3 og MDD-4) [se Kliniske Studier ]. ASEX-skalaen omfatter fem spørgsmål, der vedrører følgende aspekter af seksuel funktion: 1) sexlyst, 2) let ophidselse, 3) evne til at opnå erektion (mænd) eller smøring (kvinder), 4) let at nå orgasme og 5) orgasmetilfredshed. Positive tal angiver en forværring af seksuel funktion fra baseline. Negative tal angiver en forbedring fra et grundlæggende niveau af dysfunktion, som almindeligvis ses hos deprimerede patienter.
disse forsøg oplevede CYMBALTA-behandlede mandlige patienter signifikant mere seksuel dysfunktion, målt ved den samlede score på ASEX og evnen til at opnå orgasme, end placebo-behandlede mandlige patienter (se ). CYMBALTA-behandlede kvindelige patienter oplevede ikke mere seksuel dysfunktion end placebo-behandlede kvindelige patienter målt ved ASEX total score. Sundhedsudbydere bør rutinemæssigt forhøre sig om mulige seksuelle bivirkninger hos CYMBALTA-behandlede patienter.
Vitale tegnændringer hos voksne
I placebokontrollerede kliniske forsøg på tværs af godkendte voksne populationer for ændring fra baseline til endepunkt havde CYMBALTA-behandlede patienter gennemsnitlige stigninger på 0,23 mm Hg i systolisk blodtryk (SBP) og 0,73 mm Hg i diastolisk blodtryk (DBP) sammenlignet med gennemsnitlige fald på 1,09 mm Hg i SBP og 0,55 mm Hg i DBP hos placebobehandlede patienter. Der var ingen signifikant forskel i hyppigheden af vedvarende (3 på hinanden følgende besøg) forhøjet blodtryk [se ADVARSLER OG FORHOLDSREGLER ].
CYMBALTA 20 mg behandling, i op til 26 uger i placebokontrollerede forsøg på tværs af godkendte voksne populationer, forårsagede typisk en lille stigning i hjertefrekvensen for ændring fra baseline til endpoint sammenlignet med placebo på op til 1,37 slag i minuttet (stigning på 1,20 slag i minuttet) hos CYMBALTA-behandlede patienter, et fald på 0,17 slag i minuttet hos placebo-behandlede patienter).
Laboratorieændringer hos voksne
CYMBALTA-behandling i placebokontrollerede kliniske forsøg på tværs af godkendte voksne populationer var forbundet med små gennemsnitlige stigninger fra baseline til endepunkt i ALAT, ASAT, CPK og alkalisk fosfatase; sjældne, beskedne, forbigående, abnorme værdier blev observeret for disse analytter hos CYMBALTA-behandlede patienter sammenlignet med placebo-behandlede patienter [se ADVARSLER OG FORHOLDSREGLER ]. Højt bicarbonat, kolesterol og unormalt (højt eller lavt) kalium blev observeret hyppigere hos CYMBALTA-behandlede patienter sammenlignet med placebo-behandlede patienter.
Andre bivirkninger observeret under den kliniske undersøgelsesvurdering af CYMBALTA hos voksne
Følgende er en liste over bivirkninger rapporteret af patienter behandlet med CYMBALTA 40 mg i kliniske studier med voksne. I kliniske forsøg med alle godkendte voksne populationer blev 34.756 patienter behandlet med CYMBALTA. Af disse tog 27 % (9337) CYMBALTA 60 mg i mindst 6 måneder, og 12 % (4317) tog CYMBALTA i mindst et år. Den følgende liste er ikke beregnet til at inkludere reaktioner (1) som allerede er anført i tidligere tabeller eller andre steder i mærkning, (2) hvor en lægemiddelårsag var fjern, (3) som var så generelle, at de var uinformative, (4) som var ikke anses for at have signifikante kliniske implikationer, eller (5) som forekom med en hastighed lig med eller mindre end placebo.
Reaktioner er kategoriseret efter kropssystem i henhold til følgende definitioner: hyppige bivirkninger er dem, der forekommer hos mindst 1/100 patienter; sjældne bivirkninger er dem, der forekommer hos 1/100 til 1/1000 patienter; sjældne reaktioner er dem, der forekommer hos færre end 1/1000 patienter.
- Hjertelidelser - Hyppig: hjertebanken; Sjælden: myokardieinfarkt, takykardi og Takotsubo kardiomyopati.
- Øre- og labyrintlidelser - Hyppig: svimmelhed; Sjælden: øresmerter og tinnitus.
- Endokrine lidelser - Sjældent: hypothyroidisme.
- Øjenlidelser - Hyppig: sløret syn; Sjældent: diplopi, tørre øjne og synsnedsættelse.
- Gastrointestinale lidelser - Hyppig: flatulens; Sjælden: dysfagi, eruktion, gastritis, gastrointestinal blødning, halitosis og stomatitis; Sjælden: mavesår.
- Generelle lidelser og betingelser for administrationsstedet - Hyppig: kulderystelser/strabadser; Sjældent: fald, unormal følelse, varm og/eller kold følelse, utilpashed og tørst; Sjælden: gangforstyrrelse.
- Infektioner og angreb - Sjælden: gastroenteritis og laryngitis.
- Undersøgelser Hyppig: vægt steget, vægt faldet; Sjældent: forhøjet kolesterol i blodet.
- Metabolisme og ernæringsforstyrrelser - Sjældent: dehydrering og hyperlipidæmi; Sjælden: dyslipidæmi.
- Muskuloskeletale og bindevævslidelser - Hyppig: muskuloskeletale smerter; Sjælden: muskelspænding og muskeltrækninger.
- Forstyrrelser i nervesystemet - Hyppig: dysgeusi, sløvhed og paræstesi/hypæstesi; Sjældent: opmærksomhedsforstyrrelse, dyskinesi, myoklonus og dårlig søvnkvalitet; Sjælden: dysartri.
- Psykiatriske lidelser - Hyppige: unormale drømme og søvnforstyrrelser; Sjælden: apati, bruxisme, desorientering/forvirringstilstand, irritabilitet, humørsvingninger og selvmordsforsøg; Sjælden: fuldført selvmord.
- Nyre- og urinvejslidelser - Hyppig: vandladningsfrekvens; Sjældent: dysuri, akut vandladning, nocturi, polyuri og unormal urinlugt.
- Reproduktionssystem og brystlidelser - Hyppig: anorgasmi/orgasme unormal; Sjælden: menopausale symptomer, seksuel dysfunktion og testikelsmerter; Sjælden: menstruationsforstyrrelser.
- Åndedræts-, thorax- og mediastinale lidelser Hyppig: gaben, orofaryngeal smerte; Sjælden: stram hals.
- Hud- og subkutane vævsforstyrrelser - Hyppig: kløe; Sjældent: koldsved, dermatitiskontakt, erytem, øget tendens til blå mærker, nattesved og lysfølsomhedsreaktion; Sjælden: ekkymose.
- Vaskulære lidelser - Hyppig: hedeture; Sjældent: rødmen, ortostatisk hypotension og perifer kulde.
Bivirkninger observeret i placebokontrollerede kliniske forsøg hos pædiatriske patienter
Pædiatrisk klinisk forsøgsdatabase
Dataene beskrevet nedenfor afspejler eksponering for CYMBALTA (N=567) hos pædiatriske patienter i alderen 7 til 18 år fra to 10-ugers placebokontrollerede forsøg med patienter med MDD (N=341) (studier MDD-6 og MDD- 7), et 10-ugers placebokontrolleret forsøg i GAD (N=135) (studie GAD-6) og et 13-ugers forsøg i fibromyalgi (N=91). CYMBALTA 60mg er ikke godkendt til behandling af MDD hos pædiatriske patienter [se Brug i specifikke populationer ]. Af de CYMBALTA-behandlede patienter i disse undersøgelser var 36 % i alderen 7 til 11 år (64 % var mellem 12 og 18 år), 55 % var kvinder, og 69 % var kaukasiske. Patienterne fik 30 til 120 mg CYMBALTA dagligt under placebokontrollerede akutte behandlingsstudier. I de pædiatriske MDD-, GAD- og fibromyalgi-forsøg op til 40 uger lange var der 988 CYMBALTA-behandlede pædiatriske patienter i alderen 7 til 17 år (de fleste patienter fik 30-120 mg dagligt) – 35 % var 7 til 11 år. alder (65 % var 12 til 17 år gamle) og 56 % var kvinder.
Mest almindelige bivirkninger i pædiatriske forsøg
De mest almindelige bivirkninger (≥5 % hos CYMBALTA-behandlede patienter og mindst to gange forekomsten af placebo-behandlede patienter) i alle poolede pædiatriske populationer (MDD, GAD og fibromyalgi) var nedsat vægt, nedsat appetit, kvalme, opkastning, træthed og diarré.
Bivirkninger hos pædiatriske patienter i alderen 7 til 17 år med MDD og GAD
Bivirkningsprofilen observeret i kliniske forsøg hos pædiatriske patienter i alderen 7 til 18 år med MDD og GAD var i overensstemmelse med bivirkningsprofilen observeret i kliniske forsøg med voksne. De mest almindelige (≥5 % og 2 gange placebo) bivirkninger observeret i disse pædiatriske kliniske forsøg omfattede: kvalme, diarré, vægttab og svimmelhed.
Tabel 6 viser forekomsten af bivirkninger i MDD og GAD pædiatriske placebokontrollerede forsøg, som forekom hos mere end 2 % af patienterne behandlet med CYMBALTA og med en forekomst højere end hos patienter behandlet med placebo. CYMBALTA er ikke godkendt til behandling af MDD hos pædiatriske patienter [se Brug i specifikke populationer ].
Andre bivirkninger, der forekom med en incidens på mindre end 2 % og blev rapporteret af flere CYMBALTA-behandlede patienter end placebo-behandlede patienter i pædiatriske MDD og GAD kliniske forsøg inkluderede: unormale drømme (inklusive mareridt), angst, rødmen (inklusive hedeture ), hyperhidrose, hjertebanken, øget puls og tremor (CYMBALTA 20mg er ikke godkendt til behandling af pædiatriske patienter med MDD).
De mest almindeligt rapporterede symptomer efter seponering af CYMBALTA 30 mg i pædiatriske MDD og GAD kliniske forsøg omfattede hovedpine, svimmelhed, søvnløshed og mavesmerter [se ADVARSLER OG FORHOLDSREGLER ].
Vækst (højde og vægt) hos pædiatriske patienter 7 til 17 år gamle med GAD og MDD
Nedsat appetit og vægttab er blevet observeret i forbindelse med brugen af SSRI og SNRI. CYMBALTA-behandlede pædiatriske patienter i kliniske forsøg oplevede et gennemsnitligt vægttab på 0,1 kg efter 10 uger sammenlignet med en gennemsnitlig vægtøgning på ca. 0,9 kg hos placebobehandlede pædiatriske patienter. Andelen af patienter, der oplevede et klinisk signifikant fald i vægt (≥3,5 %) var større i CYMBALTA-gruppen end i placebogruppen (henholdsvis 16 % og 6 %). Efterfølgende, over de 4 til 6-måneders ukontrollerede forlængelsesperioder, havde CYMBALTA-behandlede patienter i gennemsnit tendens til at komme sig til deres forventede baseline-vægtpercentil baseret på populationsdata fra alders- og kønsmatchede jævnaldrende.
studier op til 9 måneder oplevede CYMBALTA-behandlede pædiatriske patienter en stigning i højden på 1,7 cm i gennemsnit (2,2 cm stigning hos patienter i alderen 7 til 11 år og 1,3 cm stigning hos patienter i alderen 12 til 17 år). Mens der blev observeret en stigning i højden under disse undersøgelser, blev der observeret et gennemsnitligt fald på 1 % i højdepercentilen (fald på 2 % hos patienter i alderen 7 til 11 år og stigning på 0,3 % hos patienter i alderen 12 til 17 år). Vægt og højde bør overvåges regelmæssigt hos pædiatriske patienter behandlet med CYMBALTA [se Brug i specifikke populationer ].
Bivirkninger hos pædiatriske patienter i alderen 13 til 17 år med fibromyalgi
Tabel 7 viser forekomsten af bivirkninger i et fibromyalgi pædiatrisk placebokontrolleret forsøg (studie FM-4), som forekom hos mere end 5 % af patienterne behandlet med CYMBALTA 30 mg og med en forekomst større end hos patienter behandlet med placebo [se Kliniske Studier ].
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af CYMBALTA efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Bivirkninger rapporteret siden markedsintroduktionen, som var tidsmæssigt relateret til behandling med CYMBALTA 40 mg og ikke nævnt andetsteds i mærkningen, omfatter: akut pancreatitis, anafylaktisk reaktion, aggression og vrede (især tidligt i behandlingen eller efter behandlingsophør), angioneurotisk ødem, vinkel-lukkende glaukom, colitis (mikroskopisk eller uspecificeret), kutan vaskulitis (nogle gange forbundet med systemisk involvering), ekstrapyramidal lidelse, galaktorrhea, gynækologisk blødning, hallucinationer, hyperglykæmi, hyperprolaktinæmi, overfølsomhed, hypertensiv krise, muskelspasmer, udslæt, rastløse bens syndrom efter behandling, krampeanfald, supraventrikulær arytmi, tinnitus (ved seponering af behandlingen), trismus og nældefeber.
DRUGSINTERAKTIONER
Både CYP1A2 og CYP2D6 er ansvarlige for duloxetin metabolisme.
Hæmmere af CYP1A2
Når CYMBALTA 60 mg blev administreret sammen med fluvoxamin 100 mg, en potent CYP1A2-hæmmer, til mandlige forsøgspersoner (n=14), var duloxetin AUC øget ca. 6 gange, Cmax blev øget ca. 2,5 gange, og duloxetin t1/2 var øget steget ca. 3 gange. Andre lægemidler, der hæmmer CYP1A2-metabolisme, omfatter cimetidin og quinolonantimikrobielle stoffer såsom ciprofloxacin og enoxacin [se ADVARSLER OG FORHOLDSREGLER ].
CYP2D6-hæmmere
Samtidig brug af CYMBALTA (40 mg én gang dagligt) og paroxetin (20 mg én gang dagligt) øgede koncentrationen af duloxetin AUC med ca. 60 %, og højere grader af hæmning forventes med højere doser af paroxetin. Lignende virkninger kan forventes med andre potente CYP2D6-hæmmere (f.eks. fluoxetin, quinidin) [se ADVARSLER OG FORHOLDSREGLER ].
Dobbelt hæmning af CYP1A2 og CYP2D6
Samtidig administration af CYMBALTA 40 mg to gange dagligt med fluvoxamin 100 mg, en potent CYP1A2-hæmmer, til forsøgspersoner med dårligt CYP2D6-metabolisme (n=14) resulterede i en 6-fold stigning i duloxetin AUC og Cmax.
Lægemidler, der interfererer med hæmostase (fx NSAID'er, aspirin og warfarin)
Serotoninfrigivelse af blodplader spiller en vigtig rolle i hæmostase. Epidemiologiske undersøgelser af case-control og kohortedesign, der har vist en sammenhæng mellem brug af psykotrope lægemidler, der interfererer med serotonin-genoptagelse og forekomsten af øvre gastrointestinale blødninger, har også vist, at samtidig brug af et NSAID eller aspirin kan forstærke denne risiko for blødning. Ændrede antikoagulerende virkninger, herunder øget blødning, er blevet rapporteret, når SSRI'er eller SNRI'er administreres sammen med warfarin. Samtidig administration af warfarin (2-9 mg én gang dagligt) under steady state-betingelser med CYMBALTA 60 eller 120 mg én gang dagligt i op til 14 dage hos raske forsøgspersoner (n=15) ændrede ikke signifikant INR fra baseline (gennemsnitlige INR-ændringer varierede fra 0,05 til +0,07). Den totale warfarin (proteinbundet plus frit lægemiddel) farmakokinetik (AUCτ,ss, Cmax,ss eller tmax,ss) for både R- og S-warfarin blev ikke ændret af duloxetin. På grund af den potentielle virkning af duloxetin på blodplader, bør patienter, der får warfarinbehandling, monitoreres nøje, når CYMBALTA påbegyndes eller seponeres [se ADVARSLER OG FORHOLDSREGLER ].
Lorazepam
Under steady-state-betingelser for CYMBALTA (60 mg Q 12 timer) og lorazepam (2 mg Q 12 timer) blev duloxetins farmakokinetik ikke påvirket af samtidig administration.
Temazepam
Under steady-state-betingelser for CYMBALTA (20 mg qhs) og temazepam (30 mg qhs) blev duloxetins farmakokinetik ikke påvirket af samtidig administration.
Lægemidler, der påvirker mavesyre
CYMBALTA har en enterisk belægning, der modstår opløsning, indtil den når et segment af mave-tarmkanalen, hvor pH-værdien overstiger 5,5. Under ekstremt sure forhold kan CYMBALTA 20mg, ubeskyttet af den enteriske coating, undergå hydrolyse for at danne naphthol. Forsigtighed tilrådes ved brug af CYMBALTA 30 mg til patienter med tilstande, der kan forsinke mavetømningen (f.eks. nogle diabetikere). Lægemidler, der hæver den gastrointestinale pH-værdi, kan føre til en tidligere frigivelse af duloxetin. Imidlertid havde samtidig administration af CYMBALTA 60mg med aluminium- og magnesiumholdige antacida (51 mEq) eller CYMBALTA med famotidin ingen signifikant effekt på hastigheden eller omfanget af duloxetin-absorption efter administration af en 40 mg oral
Lægemidler metaboliseret af CYP1A2
In vitro lægemiddelinteraktionsstudier viser, at duloxetin ikke inducerer CYP1A2-aktivitet. Derfor forventes en stigning i metabolismen af CYP1A2-substrater (f.eks. theophyllin, koffein) som følge af induktion ikke, selvom kliniske undersøgelser af induktion ikke er blevet udført. Duloxetin er en hæmmer af CYP1A2 isoformen i in vitro undersøgelser, og i to kliniske undersøgelser var den gennemsnitlige (90 % konfidensinterval) stigning i theophyllin AUC 7 % (1 %-15 %) og 20 % (13 %-27 %) når det administreres sammen med CYMBALTA (60 mg to gange dagligt).
Lægemidler metaboliseret af CYP2D6
Duloxetin er en moderat hæmmer af CYP2D6. Når CYMBALTA blev administreret (i en dosis på 60 mg to gange dagligt) sammen med en enkelt 50 mg dosis af desipramin, et CYP2D6-substrat, steg AUC for desipramin 3 gange [se ADVARSLER OG FORHOLDSREGLER ].
Lægemidler metaboliseret af CYP2C9
Resultater af in vitro undersøgelser viser, at duloxetin ikke hæmmer aktiviteten. I et klinisk studie blev farmakokinetikken af S-warfarin, et CYP2C9-substrat, ikke signifikant påvirket af duloxetin [se Lægemidler, der interfererer med hæmostase (f.eks. NSAID'er, aspirin og warfarin) ].
Lægemidler metaboliseret af CYP3A
Resultater af in vitro undersøgelser viser, at duloxetin ikke hæmmer eller inducerer CYP3A-aktivitet. En stigning eller et fald i metabolismen af CYP3A-substrater (f.eks. orale præventionsmidler og andre steroide midler) som følge af induktion eller hæmning forventes derfor ikke, selvom der ikke er udført kliniske undersøgelser.
Lægemidler metaboliseret af CYP2C19
Resultater af in vitro undersøgelser viser, at duloxetin ikke hæmmer CYP2C19-aktivitet ved terapeutiske koncentrationer. Hæmning af metabolismen af CYP2C19-substrater forventes derfor ikke, selvom der ikke er udført kliniske undersøgelser.
Monoaminoxidasehæmmere (MAO-hæmmere)
[Se DOSERING OG ADMINISTRATION , KONTRAINDIKATIONER , og ADVARSLER OG FORHOLDSREGLER ].
Serotonerge lægemidler
[Se DOSERING OG ADMINISTRATION , KONTRAINDIKATIONER , og ADVARSLER OG FORHOLDSREGLER ].
Alkohol
Når CYMBALTA 40 mg og ethanol blev indgivet med flere timers mellemrum, således at maksimale koncentrationer af hver ville falde sammen, øgede CYMBALTA ikke svækkelsen af mentale og motoriske færdigheder forårsaget af alkohol.
I CYMBALTA-databasen over kliniske forsøg havde tre CYMBALTA-behandlede patienter en leverskade, som manifesteret ved ALT og total bilirubinstigninger, med tegn på obstruktion. Der var betydelig intercurrent ethanolbrug til stede i hvert af disse tilfælde, og dette kan have bidraget til de observerede abnormiteter [se ADVARSLER OG FORHOLDSREGLER ].
CNS-lægemidler
[Se ADVARSLER OG FORHOLDSREGLER ].
Lægemidler stærkt bundet til plasmaprotein
Da duloxetin er stærkt bundet til plasmaprotein, kan administration af CYMBALTA 30 mg til en patient, der tager et andet lægemiddel, som er stærkt proteinbundet, forårsage øgede frie koncentrationer af det andet lægemiddel, hvilket potentielt kan resultere i bivirkninger. Men samtidig administration af CYMBALTA (60 eller 120 mg) med warfarin (2-9 mg), et stærkt proteinbundet lægemiddel, resulterede ikke i signifikante ændringer i INR og i farmakokinetikken af hverken total S- eller total R- warfarin (proteinbundet plus frit lægemiddel) [se Lægemidler, der interfererer med hæmostase (f.eks. NSAID'er, aspirin og warfarin) ].
Stofmisbrug og afhængighed
Misbrug
I dyreforsøg viste duloxetin ikke barbituratlignende (depressivt) misbrugspotentiale.
Selvom CYMBALTA ikke er blevet systematisk undersøgt hos mennesker for dets potentiale for misbrug, var der ingen indikation af lægemiddelsøgende adfærd i de kliniske forsøg. Det er dog ikke muligt at forudsige på basis af erfaringer fra før markedsføring, i hvilket omfang et CNS-aktivt lægemiddel vil blive misbrugt, omdirigeret og/eller misbrugt, når det først er markedsført. Derfor bør læger omhyggeligt vurdere patienterne for en historie med stofmisbrug og følge sådanne patienter nøje, observere dem for tegn på misbrug eller misbrug af CYMBALTA (f.eks. udvikling af tolerance, stigning i dosis, lægemiddelsøgende adfærd).
Afhængighed
I undersøgelser af lægemiddelafhængighed viste duloxetin ikke afhængighedsproducerende potentiale hos rotter.
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Selvmordstanker og -adfærd hos børn, unge og unge voksne
Patienter med svær depressiv lidelse (MDD), både voksne og pædiatriske, kan opleve forværring af deres depression og/eller fremkomsten af selvmordstanker og -adfærd (suicidalitet) eller usædvanlige ændringer i adfærd, uanset om de tager antidepressiv medicin eller ej, og dette risikoen kan fortsætte, indtil der indtræffer betydelig remission. Selvmord er en kendt risiko for depression og visse andre psykiatriske lidelser, og disse lidelser er i sig selv de stærkeste forudsigere for selvmord. Der har imidlertid været en langvarig bekymring for, at antidepressiva kan have en rolle i at inducere forværring af depression og fremkomsten af suicidalitet hos visse patienter i de tidlige faser af behandlingen.
Poolede analyser af kortvarige placebokontrollerede forsøg med antidepressive lægemidler (SSRI'er og andre) viste, at disse lægemidler øger risikoen for selvmordstanker og -adfærd (suicidalitet) hos børn, unge og unge voksne (alder 1824) med svær depressiv lidelse ( MDD) og andre psykiatriske lidelser. Korttidsundersøgelser viste ikke en stigning i risikoen for suicidalitet med antidepressiva sammenlignet med placebo hos voksne efter 24 år; der var en reduktion med antidepressiva sammenlignet med placebo hos voksne på 65 år og ældre.
De samlede analyser af placebokontrollerede forsøg med børn og unge med MDD, obsessiv-kompulsiv lidelse (OCD) eller andre psykiatriske lidelser omfattede i alt 24 korttidsforsøg med 9 antidepressive lægemidler hos over 4400 patienter. De samlede analyser af placebokontrollerede forsøg med voksne med MDD eller andre psykiatriske lidelser omfattede i alt 295 korttidsforsøg (median varighed på 2 måneder) med 11 antidepressive lægemidler hos over 77.000 patienter. Der var betydelig variation i risikoen for suicidalitet blandt stoffer, men en tendens til en stigning i de yngre patienter for næsten alle undersøgte stoffer. Der var forskelle i den absolutte risiko for suicidalitet på tværs af de forskellige indikationer, med den højeste forekomst af MDD. Risikoen for forskelle (lægemiddel versus placebo) var imidlertid relativt stabil inden for aldersgrupper og på tværs af indikationer. Disse risikoforskelle (lægemiddel-placebo-forskel i antallet af tilfælde af suicidalitet pr. 1000 behandlede patienter) er angivet i tabel 1.
Der forekom ingen selvmord i nogen af de pædiatriske CYMBALTA-undersøgelser. Der var selvmord i CYMBALTA 20 mg-forsøgene for voksne, men antallet var ikke tilstrækkeligt til at nå frem til nogen konklusion om CYMBALTAs effekt på selvmord.
Det er uvist, om suicidalitetsrisikoen strækker sig til længerevarende brug, dvs. ud over flere måneder. Der er dog væsentlige beviser fra placebokontrollerede vedligeholdelsesforsøg hos voksne med depression, at brugen af antidepressiva kan forsinke tilbagefald af depression.
Alle patienter, der behandles med antidepressiva for enhver indikation, bør overvåges passende og observeres nøje for klinisk forværring, suicidalitet og usædvanlige ændringer i adfærd, især i løbet af de første par måneder af et lægemiddelbehandlingsforløb, eller i tidspunkter med dosisændringer, enten stigninger eller falder.
Følgende symptomer, angst, agitation, panikanfald, søvnløshed, irritabilitet, fjendtlighed, aggressivitet, impulsivitet, akatisi (psykomotorisk rastløshed), hypomani og mani er blevet rapporteret hos voksne og pædiatriske patienter, der også behandles med antidepressiva mod svær depressiv lidelse. som for andre indikationer, både psykiatriske og ikke-psykiatriske. Selvom der ikke er etableret en årsagssammenhæng mellem fremkomsten af sådanne symptomer og enten forværring af depression og/eller fremkomsten af selvmordsimpulser, er der bekymring for, at sådanne symptomer kan repræsentere forløbere for ny suicidalitet.
Det bør overvejes at ændre det terapeutiske regime, herunder eventuelt seponering af medicinen, hos patienter, hvis depression er vedvarende værre, eller som oplever ny suicidalitet eller symptomer, der kan være forløbere for forværring af depression eller suicidalitet, især hvis disse symptomer er alvorlige, pludselige i debut, eller var ikke en del af patientens tilstedeværende symptomer.
Hvis der er truffet beslutning om at afbryde behandlingen, bør medicinen nedtrappes så hurtigt som muligt, men med erkendelse af, at seponering kan være forbundet med visse symptomer [se DOSERING OG ADMINISTRATION og Afbrydelsessyndrom ] for beskrivelser af risikoen ved seponering af CYMBALTA.
Familier og pårørende til patienter, der behandles med antidepressiva for svær depressiv lidelse eller andre indikationer, både psykiatriske og ikke-psykiatriske, bør advares om behovet for at overvåge patienter for fremkomsten af agitation, irritabilitet, usædvanlige ændringer i adfærd og de andre symptomer beskrevet ovenfor. , samt fremkomsten af suicidalitet, og at rapportere sådanne symptomer omgående til sundhedsudbydere. Sådan overvågning bør omfatte daglig observation af familier og omsorgspersoner. Recepter til CYMBALTA bør udskrives for den mindste mængde kapsler i overensstemmelse med god patientbehandling for at reducere risikoen for overdosering.
Screening af patienter for bipolar lidelse
En alvorlig depressiv episode kan være den første præsentation af bipolar lidelse. Det antages generelt (dog ikke etableret i kontrollerede forsøg), at behandling af en sådan episode med et antidepressivum alene kan øge sandsynligheden for udfældning af en blandet/manisk episode hos patienter med risiko for bipolar lidelse. Hvorvidt nogen af de ovenfor beskrevne symptomer repræsenterer en sådan omdannelse er ukendt. Inden behandling med et antidepressivum påbegyndes, bør patienter med depressive symptomer dog screenes tilstrækkeligt for at afgøre, om de har risiko for bipolar lidelse; sådan screening bør omfatte en detaljeret psykiatrisk historie, herunder en familiehistorie med selvmord, bipolar lidelse og depression. Det skal bemærkes, at CYMBALTA ikke er godkendt til behandling af bipolar depression.
Hepatotoksicitet
Der har været rapporter om leversvigt, nogle gange fatalt, hos patienter behandlet med CYMBALTA. Disse tilfælde har vist sig som hepatitis med mavesmerter, hepatomegali og forhøjelse af transaminaseniveauer til mere end tyve gange den øvre grænse for normal (ULN) med eller uden gulsot, hvilket afspejler et blandet eller hepatocellulært mønster af leverskade. CYMBALTA 30 mg bør seponeres hos patienter, som udvikler gulsot eller andre tegn på klinisk signifikant leverdysfunktion og bør ikke genoptages, medmindre en anden årsag kan fastslås.
Tilfælde af kolestatisk gulsot med minimal forhøjelse af transaminaseniveauer er også blevet rapporteret. Andre postmarketing-rapporter indikerer, at forhøjede transaminaser, bilirubin og alkalisk fosfatase er forekommet hos patienter med kronisk leversygdom eller cirrhose.
CYMBALTA øgede risikoen for forhøjede serumtransaminaseniveauer i kliniske forsøg med udviklingsprogram. Forhøjelser af levertransaminase resulterede i seponering af 0,3 % (92/34.756) af CYMBALTA-behandlede patienter. Hos de fleste patienter var mediantiden til påvisning af transaminaseforhøjelsen omkring to måneder. I placebokontrollerede voksne undersøgelser for patienter med normale og unormale baseline ALAT-værdier forekom stigning i ALAT >3 gange ULN hos 1,25 % (144/11.496) af CYMBALTA-behandlede patienter sammenlignet med 0,45 % (39/8716) af placebo -behandlede patienter. I placebokontrollerede voksne studier med et fast dosisdesign var der tegn på en CYMBALTA dosis-respons sammenhæng for ALAT- og ASAT-forhøjelser på henholdsvis >3 gange ULN og >5 gange ULN.
Fordi det er muligt, at CYMBALTA og alkohol kan interagere og forårsage leverskade, eller at CYMBALTA 20 mg kan forværre allerede eksisterende leversygdom, bør CYMBALTA ikke ordineres til patienter med betydeligt alkoholforbrug eller tegn på kronisk leversygdom.
Ortostatisk hypotension, fald og synkope
Ortostatisk hypotension, fald og synkope er blevet rapporteret hos patienter behandlet med de anbefalede CYMBALTA-doser. Synkope og ortostatisk hypotension har en tendens til at opstå inden for den første uge af behandlingen, men kan forekomme på ethvert tidspunkt under CYMBALTA-behandling, især efter dosisstigninger. Risikoen for at falde ser ud til at være relateret til graden af ortostatisk fald i blodtrykket (BP) samt andre faktorer, der kan øge den underliggende risiko for fald.
en analyse af patienter fra alle placebokontrollerede forsøg rapporterede patienter behandlet med CYMBALTA 20 mg en højere faldfrekvens sammenlignet med patienter behandlet med placebo. Risiko synes at være relateret til tilstedeværelsen af ortostatisk fald i BP. Risikoen for BP-fald kan være større hos patienter, der samtidig tager medicin, der inducerer ortostatisk hypotension (såsom antihypertensiva) eller er potente CYP1A2-hæmmere [se ADVARSLER OG FORHOLDSREGLER og Klinisk vigtige lægemiddelinteraktioner ] og hos patienter, der tager CYMBALTA 20 mg i doser over 60 mg dagligt. Det bør overvejes at reducere dosis eller seponering af CYMBALTA hos patienter, som oplever symptomatisk ortostatisk hypotension, fald og/eller synkope under CYMBALTA 40 mg-behandling.
Risikoen for at falde syntes også at være proportional med en patients underliggende risiko for fald og så ud til at stige støt med alderen. Da geriatriske patienter har en tendens til at have en højere underliggende risiko for fald på grund af en højere forekomst af risikofaktorer såsom brug af flere lægemidler, medicinske følgesygdomme og gangforstyrrelser, er virkningen af stigende alder i sig selv uklar. Fald med alvorlige konsekvenser, herunder frakturer og hospitalsindlæggelser, er blevet rapporteret ved brug af CYMBALTA 30 mg [se BIVIRKNINGER ].
Serotonin syndrom
Udviklingen af et potentielt livstruende serotonergt syndrom er blevet rapporteret med SNRI og SSRI, inklusive CYMBALTA 60 mg, alene, men især ved samtidig brug af andre serotonerge lægemidler (inklusive triptaner, tricykliske antidepressiva, fentanyl, lithium, tramadolspiron, busfetamin, tryptofan, , og perikon) og med lægemidler, der hæmmer metabolismen af serotonin (især MAO-hæmmere, både dem, der er beregnet til at behandle psykiatriske lidelser og også andre, såsom linezolid og intravenøs methylenblåt).
Symptomer på serotonergt syndrom kan omfatte mentale statusændringer (f.eks. agitation, hallucinationer, delirium og koma), autonom ustabilitet (f.eks. takykardi, labilt blodtryk, svimmelhed, diaforese, rødmen, hypertermi), neuromuskulære symptomer (f.eks. tremor, rigiditet, myoklonus, hyperrefleksi, inkoordination), kramper og/eller gastrointestinale symptomer (f.eks. kvalme, opkastning, diarré). Patienter bør overvåges for forekomsten af serotonergt syndrom.
Samtidig brug af CYMBALTA 30 mg og MAO-antidepressiva er kontraindiceret. CYMBALTA 60 mg bør heller ikke startes hos en patient, der behandles med MAO-hæmmere såsom linezolid eller intravenøs methylenblåt. Alle rapporter med methylenblåt, der gav information om indgivelsesvejen, involverede intravenøs administration i dosisområdet fra 1 mg/kg til 8 mg/kg. Ingen rapporter involverede administration af methylenblåt ad andre veje (såsom orale tabletter eller lokal vævsinjektion) eller ved lavere doser. Der kan være omstændigheder, hvor det er nødvendigt at påbegynde behandling med en MAO-hæmmer såsom linezolid eller intravenøs methylenblåt hos en patient, der tager CYMBALTA. CYMBALTA bør seponeres, før behandling med MAO-hæmmeren påbegyndes [se DOSERING OG ADMINISTRATION og KONTRAINDIKATIONER ].
Hvis samtidig brug af CYMBALTA 20mg med andre serotonerge lægemidler, herunder triptaner, tricykliske antidepressiva, fentanyl, lithium, tramadol, buspiron, tryptofan, amfetamin og perikon er klinisk berettiget, skal patienterne gøres opmærksomme på en potentiel øget risiko for serotoninsyndrom. , især under behandlingsstart og dosisstigninger. Behandling med CYMBALTA 60 mg og eventuelle samtidige serotonerge midler skal seponeres omgående, hvis ovennævnte hændelser opstår, og understøttende symptomatisk behandling bør påbegyndes.
Øget risiko for blødning
Lægemidler, der interfererer med hæmning af serotoningenoptagelse, inklusive CYMBALTA, kan øge risikoen for blødningshændelser. Caserapporter og epidemiologiske undersøgelser (case-kontrol og kohortedesign) har vist en sammenhæng mellem brug af lægemidler, der interfererer med serotonin-genoptagelse og forekomsten af gastrointestinal blødning. En post-marketing undersøgelse viste en højere forekomst af postpartum blødning hos mødre, der tog CYMBALTA. Andre blødningshændelser relateret til SSRI- og SNRI-brug har varieret fra ekkymoser, hæmatomer, epistaxis og petekkier til livstruende blødninger. Samtidig brug af aspirin, ikke-steroide antiinflammatoriske lægemidler (NSAID'er), warfarin og andre antikoagulantia kan øge denne risiko.
Informer patienterne om risikoen for blødning forbundet med samtidig brug af CYMBALTA og NSAID'er, aspirin eller andre lægemidler, der påvirker koagulationen [se DRUGSINTERAKTIONER ].
Alvorlige hudreaktioner
Alvorlige hudreaktioner, herunder erythema multiforme og Stevens-Johnsons syndrom (SJS), kan forekomme med CYMBALTA. Rapporteringsraten for SJS forbundet med CYMBALTA-brug overstiger den generelle befolkningsbaggrundshyppighed for denne alvorlige hudreaktion (1 til 2 tilfælde pr. million personår). Indberetningsprocenten er generelt accepteret som en undervurdering på grund af underrapportering.
CYMBALTA bør seponeres ved første forekomst af blærer, afskalningsudslæt, slimhindeerosion eller andre tegn på overfølsomhed, hvis ingen anden ætiologi kan identificeres.
Afbrydelsessyndrom
Seponeringssymptomer er blevet systematisk evalueret hos patienter, der tager CYMBALTA. Efter brat eller nedtrappet seponering i placebokontrollerede kliniske undersøgelser for voksne forekom følgende symptomer med 1 % eller mere og med en signifikant højere frekvens hos CYMBALTA-behandlede patienter sammenlignet med dem, der ophørte med placebo: svimmelhed, hovedpine, kvalme, diarré, paræstesi, irritabilitet, opkastning, søvnløshed, angst, hyperhidrose og træthed.
Under markedsføringen af andre SSRI'er og SNRI'er (serotonin- og noradrenalin-genoptagelseshæmmere) har der været spontane rapporter om bivirkninger, der er opstået efter seponering af disse lægemidler, især når de er pludselige, herunder følgende: dysforisk stemning, irritabilitet, agitation, svimmelhed, føleforstyrrelser ( paræstesier såsom elektrisk stød), angst, forvirring, hovedpine, sløvhed, følelsesmæssig labilitet, søvnløshed, hypomani, tinnitus og anfald. Selvom disse hændelser generelt er selvbegrænsende, er nogle blevet rapporteret at være alvorlige.
Patienter bør overvåges for disse symptomer, når behandlingen med CYMBALTA afbrydes. En gradvis reduktion af dosis i stedet for pludseligt ophør anbefales, når det er muligt. Hvis der opstår uacceptable symptomer efter et fald i dosis eller efter seponering af behandlingen, kan det overvejes at genoptage den tidligere ordinerede dosis. Efterfølgende kan lægen fortsætte med at reducere dosis, men med en mere gradvis hastighed [se DOSERING OG ADMINISTRATION ].
Aktivering af mani/hypomani
placebokontrollerede voksne studier med patienter med MDD blev aktivering af mani eller hypomani rapporteret hos 0,1 % (4/3779) af CYMBALTA-behandlede patienter og 0,04 % (1/2536) af placebobehandlede patienter. Ingen aktivering af mani eller hypomani blev rapporteret i placebokontrollerede forsøg med DPNP, GAD, fibromyalgi eller kroniske muskuloskeletale smerter. Aktivering af mani eller hypomani er blevet rapporteret hos en lille del af patienter med humørsygdomme, som blev behandlet med andre markedsførte lægemidler, der er effektive til behandling af svær depressiv lidelse. Som med disse andre midler bør CYMBALTA 60 mg anvendes med forsigtighed til patienter med en historie med mani.
Vinkel-lukkende glaukom
Pupiludvidelsen, der opstår efter brug af mange antidepressive lægemidler, herunder CYMBALTA, kan udløse et vinkellukkeangreb hos en patient med anatomisk snævre vinkler, som ikke har en patenteret iridektomi.
Anfald
CYMBALTA er ikke blevet systematisk evalueret hos patienter med krampeanfald, og sådanne patienter blev udelukket fra kliniske studier. I placebokontrollerede kliniske studier for voksne forekom anfald/kramper hos 0,02 % (3/12.722) af patienter behandlet med CYMBALTA 60 mg og 0,01 % (1/9513) af patienter behandlet med placebo. CYMBALTA bør ordineres med forsigtighed til patienter med anfald af anfald.
Stigning i blodtryk
placebokontrollerede kliniske forsøg med voksne på tværs af de godkendte voksne populationer fra baseline til endpoint var CYMBALTA-behandling forbundet med gennemsnitlige stigninger på 0,5 mm Hg i systolisk blodtryk og 0,8 mm Hg i diastolisk blodtryk sammenlignet med gennemsnitlige fald på 0,6 mm Hg systolisk og 0,3 mm Hg diastolisk hos placebobehandlede patienter. Der var ingen signifikant forskel i hyppigheden af vedvarende (3 på hinanden følgende besøg) forhøjet blodtryk. I et klinisk farmakologisk studie designet til at evaluere virkningen af CYMBALTA 60 mg på forskellige parametre, herunder blodtryk ved supraterapeutiske doser med en accelereret dosistitrering, var der tegn på stigninger i liggende blodtryk ved doser op til 200 mg to gange dagligt (ca. 3,3 gange dagligt) den maksimalt anbefalede dosis). Ved den højeste dosis på 200 mg to gange daglig var stigningen i gennemsnitlig puls 5,0 til 6,8 slag, og stigninger i gennemsnitlig blodtryk var 4,7 til 6,8 mm Hg (systolisk) og 4,5 til 7 mm Hg (diastolisk) op til 12 timer efter dosering .
Blodtrykket skal måles før påbegyndelse af behandling og regelmæssigt måles under hele behandlingen [se BIVIRKNINGER ].
Klinisk vigtige lægemiddelinteraktioner
Både CYP1A2 og CYP2D6 er ansvarlige for CYMBALTA-metabolismen.
Potentiale for andre lægemidler til at påvirke CYMBALTA
CYP1A2-hæmmere
Samtidig administration af CYMBALTA 40 mg og potente CYP1A2-hæmmere bør undgås [se DRUGSINTERAKTIONER ].
CYP2D6-hæmmere
Fordi CYP2D6 er involveret i CYMBALTA-metabolismen, forventes samtidig brug af CYMBALTA med potente CYP2D6-hæmmere at og vil resultere i højere koncentrationer (i gennemsnit på 60%) af CYMBALTA [se DRUGSINTERAKTIONER ].
Potentiale for CYMBALTA 30mg til at påvirke andre lægemidler
Lægemidler metaboliseret af CYP2D6
Samtidig administration af CYMBALTA 20mg med lægemidler, der i vid udstrækning metaboliseres af CYP2D6, og som har et snævert terapeutisk indeks, herunder visse antidepressiva (tricykliske antidepressiva [TCA], såsom nortriptylin, amitriptylin og imipramin), phenothiaziner og type 1C antiarrhytmi (f.eks. propafenon, flecainid), bør behandles med forsigtighed. Plasma-TCA-koncentrationer skal muligvis overvåges, og dosis af TCA skal muligvis reduceres, hvis en TCA administreres sammen med CYMBALTA. På grund af risikoen for alvorlige ventrikulære arytmier og pludselig død potentielt forbundet med forhøjede plasmaniveauer af thioridazin, bør CYMBALTA 30 mg og thioridazin ikke administreres samtidigt [se DRUGSINTERAKTIONER ].
Andre klinisk vigtige lægemiddelinteraktioner
Alkohol
Brug af CYMBALTA 40 mg samtidig med kraftigt alkoholindtag kan være forbundet med alvorlig leverskade. Af denne grund bør CYMBALTA 60mg ikke ordineres til patienter med stort alkoholforbrug [se Hepatotoksicitet og LÆGEMIDDELINTERAKTIONER ].
CNS virkende lægemidler
I betragtning af de primære CNS-effekter af CYMBALTA, bør det bruges med forsigtighed, når det tages i kombination med eller erstattes af andre centralt virkende lægemidler, inklusive dem med en lignende virkningsmekanisme [se Klinisk vigtige lægemiddelinteraktioner og DRUGSINTERAKTIONER ].
Hyponatriæmi
Hyponatriæmi kan forekomme som følge af behandling med SSRI og SNRI, inklusive CYMBALTA. I mange tilfælde ser denne hyponatriæmi ud til at være resultatet af syndromet med uhensigtsmæssig antidiuretisk hormonsekretion (SIADH). Tilfælde med serumnatrium lavere end 110 mmol/L er blevet rapporteret ved brug af CYMBALTA 40 mg og så ud til at være reversible, da CYMBALTA blev seponeret. Geriatriske patienter kan have større risiko for at udvikle hyponatriæmi med SSRI og SNRI. Patienter, der tager diuretika, eller som på anden måde er udtømte, kan have større risiko [se Brug i specifikke populationer ]. Seponering af CYMBALTA bør overvejes hos patienter med symptomatisk hyponatriæmi, og passende medicinsk intervention bør iværksættes.
Tegn og symptomer på hyponatriæmi omfatter hovedpine, koncentrationsbesvær, hukommelsessvækkelse, forvirring, svaghed og ustabilitet, som kan føre til fald. Mere alvorlige og/eller akutte tilfælde er blevet forbundet med hallucinationer, synkope, krampeanfald, koma, åndedrætsstop og død.
Anvendelse hos patienter med samtidig sygdom
Klinisk erfaring med CYMBALTA hos patienter med samtidige systemiske sygdomme er begrænset. Der er ingen information om den effekt, som ændringer i gastrisk motilitet kan have på stabiliteten af CYMBALTA's enteriske belægning. Under ekstremt sure forhold kan CYMBALTA, ubeskyttet af den enteriske coating, undergå hydrolyse for at danne naphthol. Forsigtighed tilrådes ved brug af CYMBALTA hos patienter med tilstande, der kan forsinke mavetømningen (f.eks. nogle diabetikere).
CYMBALTA 30 mg er ikke blevet systematisk evalueret hos patienter med en nylig historie med myokardieinfarkt eller ustabil koronararteriesygdom. Patienter med disse diagnoser blev generelt udelukket fra kliniske undersøgelser under produktets præmarketingtest.
Nedsat leverfunktion
Undgå brug til patienter med kronisk leversygdom eller cirrhose [se DOSERING OG ADMINISTRATION , Hepatotoksicitet , og Brug i specifikke populationer ].
Svært nedsat nyrefunktion
Undgå brug til patienter med svært nedsat nyrefunktion, GFR DOSERING OG ADMINISTRATION og Brug i specifikke populationer ].
Glykæmisk kontrol hos patienter med diabetes
Som observeret i DPNP-undersøgelser forværrede behandling med CYMBALTA 30 mg den glykæmiske kontrol hos nogle patienter med diabetes. I tre kliniske forsøg med CYMBALTA til behandling af neuropatisk smerte forbundet med diabetisk perifer neuropati [se Kliniske Studier ], var den gennemsnitlige varighed af diabetes ca. 12 år, den gennemsnitlige baseline fastende blodsukker var 176 mg/dL, og den gennemsnitlige baseline hæmoglobin A1c (HbA1c) var 7,8 %. I den 12-ugers akutte behandlingsfase af disse undersøgelser var CYMBALTA forbundet med en lille stigning i gennemsnitlig fastende blodsukker sammenlignet med placebo. I forlængelsesfasen af disse undersøgelser, som varede op til 52 uger, steg den gennemsnitlige fastende blodsukker med 12 mg/dL i CYMBALTA 40 mg-gruppen og faldt med 11,5 mg/dL i rutineplejegruppen. HbA1c steg med 0,5 % i CYMBALTA 40 mg-gruppen og med 0,2 % i rutinebehandlingsgruppen.
Urin tøven og retention
CYMBALTA 60mg er i en klasse af lægemidler, der vides at påvirke urethral modstand. Hvis symptomer på urintøven udvikler sig under behandling med CYMBALTA 20 mg, bør det overvejes, om de kan være lægemiddelrelaterede.
Efter markedsføring er der observeret tilfælde af urinretention. I nogle tilfælde af urinretention i forbindelse med brug af CYMBALTA 60 mg har indlæggelse og/eller kateterisering været nødvendig.
Seksuel dysfunktion
Brug af SNRI'er, inklusive CYMBALTA 60 mg, kan forårsage symptomer på seksuel dysfunktion [se BIVIRKNINGER ]. Hos mandlige patienter kan brug af SNRI resultere i ejakulatorisk forsinkelse eller svigt, nedsat libido og erektil dysfunktion. Hos kvindelige patienter kan brug af SNRI resultere i nedsat libido og forsinket eller manglende orgasme.
Det er vigtigt for ordinerende læger at forespørge om seksuel funktion før påbegyndelse af CYMBALTA 40 mg og at spørge specifikt om ændringer i seksuel funktion under behandlingen, fordi seksuel funktion muligvis ikke spontant rapporteres. Ved evaluering af ændringer i seksuel funktion er det vigtigt at få en detaljeret anamnese (inklusive tidspunktet for symptomdebut), fordi seksuelle symptomer kan have andre årsager, herunder den underliggende psykiatriske lidelse. Diskuter potentielle ledelsesstrategier til at støtte patienter i at træffe informerede beslutninger om behandling.
Patientrådgivning Information
Råd patienten til at læse den FDA-godkendte patientmærkning ( Medicinvejledning ).
Selvmordstanker og -adfærd
Rådgiv patienter, deres familier og deres pårørende til at se efter fremkomsten af selvmordstanker og selvmordsadfærd, især under behandling, og når dosis justeres op eller ned, og instruer dem om at rapportere sådanne symptomer til deres læge [se KASSE ADVARSEL og ADVARSLER OG FORHOLDSREGLER ].
Administration
Råd til patienter om at sluge CYMBALTA 20 mg hel og ikke tygge, knuse eller åbne kapslen (undlad at drysse indholdet på mad eller blandet med væsker), da disse handlinger kan påvirke den enteriske belægning.
Hepatotoksicitet
Informer patienterne om, at alvorlige leverproblemer, nogle gange fatale, er blevet rapporteret hos patienter behandlet med CYMBALTA. Instruer patienterne i at tale med deres læge, hvis de udvikler kløe, smerter i øverste højre del af maven, mørk urin eller gul hud/øjne, mens de tager CYMBALTA, hvilket kan være tegn på leverproblemer. Instruer patienterne i at tale med deres læge om deres alkoholforbrug. Brug af CYMBALTA med stort alkoholindtag kan være forbundet med alvorlig leverskade [se ADVARSLER OG FORHOLDSREGLER ].
Alkohol
Selvom CYMBALTA ikke øger svækkelsen af mentale og motoriske færdigheder forårsaget af alkohol, kan brug af CYMBALTA samtidig med stort alkoholindtag være forbundet med alvorlig leverskade [se ADVARSLER OG FORHOLDSREGLER og DRUGSINTERAKTIONER ].
Ortostatisk hypotension, fald og synkope
Rådgiv patienterne om risikoen for ortostatisk hypotension, fald og synkope, især i perioden med initial brug og efterfølgende dosiseskalering og i forbindelse med brug af samtidig medicin, der kan forstærke den ortostatiske virkning af CYMBALTA [se ADVARSLER OG FORHOLDSREGLER ].
Serotonin syndrom
Advar patienter med risikoen for serotonergt syndrom ved samtidig brug af CYMBALTA 30 mg og andre serotonerge midler, herunder triptaner, tricykliske antidepressiva, fentanyl, lithium, tramadol, buspiron, tryptofan, amfetamin og perikon [se perikon [se] KONTRAINDIKATIONER , ADVARSLER OG FORHOLDSREGLER , og DRUGSINTERAKTIONER ]. Rådgiv patienterne om tegn og symptomer forbundet med serotonergt syndrom, som kan omfatte ændringer i mental status (f.eks. agitation, hallucinationer, delirium og koma), autonom ustabilitet (f.eks. takykardi, labilt blodtryk, svimmelhed, diaforese, rødmen, hypertermi), neuromuskulære forandringer (f.eks. tremor, rigiditet, myoklonus, hyperrefleksi, inkoordination), kramper og/eller gastrointestinale symptomer (f.eks. kvalme, opkastning, diarré). Forsigtig patienter til at søge læge med det samme, hvis de oplever disse symptomer.
Øget risiko for blødning
Pas på patienterne ved samtidig brug af CYMBALTA 30 mg og NSAID'er, aspirin, warfarin eller andre lægemidler, der påvirker koagulationen, siden kombineret brug af psykotrope lægemidler, der interfererer med serotonin-genoptagelsen, og disse midler har været forbundet med en øget risiko for blødning [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
Alvorlige hudreaktioner
Pas på patienterne, at CYMBALTA kan forårsage alvorlige hudreaktioner. Dette skal muligvis behandles på et hospital og kan være livstruende. Råd patienterne til at ringe til deres læge med det samme eller få akut hjælp, hvis de har blærer på huden, afskallede udslæt, sår i munden, nældefeber eller andre allergiske reaktioner [se ADVARSLER OG FORHOLDSREGLER ].
Afbrydelse af behandling
Instruer patienterne i, at seponering af CYMBALTA 30 mg kan være forbundet med symptomer som svimmelhed, hovedpine, kvalme, diarré, paræstesi, irritabilitet, opkastning, søvnløshed, angst, hyperhidrose og træthed, og bør rådes til ikke at ændre deres doseringsregime eller stoppe. tager CYMBALTA uden at konsultere deres læge [se ADVARSLER OG FORHOLDSREGLER ].
Aktivering af mani eller hypomani
Patienter med depressive symptomer skal screenes tilstrækkeligt for risiko for bipolar lidelse (f.eks. familiehistorie med selvmord, bipolar lidelse og depression) før påbegyndelse af behandling med CYMBALTA. Råd patienterne til at rapportere tegn eller symptomer på en manisk reaktion såsom stærkt øget energi, alvorlige søvnbesvær, racende tanker, hensynsløs adfærd, at tale mere eller hurtigere end normalt, usædvanligt store ideer og overdreven lykke eller irritabilitet [se ADVARSLER OG FORHOLDSREGLER ].
Vinkel-lukkende glaukom
Rådfør patienterne om, at indtagelse af CYMBALTA 40 mg kan forårsage mild pupiludvidelse, som hos følsomme personer kan føre til en episode med vinkel-lukkende glaukom. Eksisterende glaukom er næsten altid åbenvinklet glaukom, fordi vinkel-lukkende glaukom, når det diagnosticeres, kan behandles definitivt med iridektomi. Åbenvinklet glaukom er ikke en risikofaktor for lukkevinklet glaukom. Patienter kan ønske at blive undersøgt for at afgøre, om de er modtagelige for vinkellukning, og have en profylaktisk procedure (f.eks. iridektomi), hvis de er modtagelige [se ADVARSLER OG FORHOLDSREGLER ].
Anfald
Råd patienter til at informere deres sundhedsplejerske, hvis de har en historie med krampeanfald [se ADVARSLER OG FORHOLDSREGLER ].
Effekter på blodtryk
Pas patienter på, at CYMBALTA 60 mg kan forårsage en stigning i blodtrykket [se ADVARSLER OG FORHOLDSREGLER ].
Samtidig medicinering
Rådgive patienter om at informere deres læge, hvis de tager eller planlægger at tage receptpligtig eller håndkøbsmedicin, da der er mulighed for interaktioner [se DOSERING OG ADMINISTRATION , KONTRAINDIKATIONER , ADVARSLER OG FORHOLDSREGLER , og DRUGSINTERAKTIONER ].
Hyponatriæmi
Informer patienter om, at hyponatriæmi er blevet rapporteret som følge af behandling med SNRI og SSRI, inklusive CYMBALTA. Rådgiv patienterne om tegn og symptomer på hyponatriæmi [se ADVARSLER OG FORHOLDSREGLER ].

Samtidige sygdomme
Råd patienter til at informere deres sundhedsplejerske om alle deres medicinske tilstande [se ADVARSLER OG FORHOLDSREGLER ].
Urin tøven og retention
CYMBALTA er i en klasse af lægemidler, der kan påvirke vandladning. Instruer patienterne i at rådføre sig med deres læge, hvis de udvikler problemer med urinstrømmen [se ADVARSLER OG FORHOLDSREGLER ].
Seksuel dysfunktion
Informer patienter om, at brug af CYMBALTA 40 mg kan forårsage symptomer på seksuel dysfunktion hos både mandlige og kvindelige patienter. Informer patienterne om, at de bør diskutere eventuelle ændringer i seksuel funktion og potentielle håndteringsstrategier med deres sundhedsplejerske [se ADVARSLER OG FORHOLDSREGLER ].
Graviditet
- Råd kvinder om at underrette deres læge, hvis de bliver gravide eller har til hensigt at blive gravide under behandling med CYMBALTA.
- Rådfør gravide kvinder eller patienter, som har til hensigt at blive gravide, om, at brug af CYMBALTA 40 mg i løbet af måneden før fødslen kan føre til en øget risiko for postpartum blødning og kan øge risikoen for neonatale komplikationer, der kræver langvarig hospitalsindlæggelse, respiratorisk støtte og sondeernæring.
- Rådgiv gravide, at der er risiko for tilbagefald ved seponering af antidepressiva.
- Rådgiv patienterne om, at der er et graviditetseksponeringsregister, der overvåger graviditetsresultater hos kvinder, der er udsat for duloxetin under graviditeten [se Brug i specifikke populationer ].
Amning
Råd ammende kvinder, der bruger CYMBALTA 30 mg til at overvåge spædbørn for sedation, dårlig fodring og dårlig vægtøgning og til at søge lægehjælp, hvis de bemærker disse tegn [se Brug i specifikke populationer ].
Interferens med psykomotorisk ydeevne
CYMBALTA 30mg kan være forbundet med sedation og svimmelhed. Forsigtig derfor patienterne med at betjene farligt maskineri, inklusive biler, indtil de er rimeligt sikre på, at CYMBALTA-behandling ikke påvirker deres evne til at deltage i sådanne aktiviteter.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
Duloxetin blev indgivet i kosten til mus og rotter i 2 år.
Hos hunmus, der fik duloxetin med 140 mg/kg/dag (3 gange den maksimale anbefalede humane dosis (MRHD) på 120 mg/dag givet til børn på mg/m2-basis), var der en øget forekomst af hepatocellulære adenomer og carcinomer. Dosis uden effekt var 50 mg/kg/dag (1 gang MRHD givet til børn). Tumorincidensen var ikke øget hos hanmus, der fik duloxetin i doser op til 100 mg/kg/dag (2 gange MRHD givet til børn).
Hos rotter øgede diætdoser af duloxetin op til 27 mg/kg/dag hos hunner (1 gang MRHD givet til børn) og op til 36 mg/kg/dag hos hanner (1,4 gange MRHD givet til børn) ikke forekomst af tumorer.
Mutagenese
Duloxetin var ikke mutagent i in vitro bakteriel revers mutation assay (Ames test) og var ikke klastogent i en in vivo kromosomafvigelsestest i museknoglemarvsceller. Derudover var duloxetin ikke genotoksisk i et in vitro pattedyrs fremadgående genmutationsassay i muselymfomceller eller i et in vitro unscheduled DNA-syntese (UDS) assay i primære rottehepatocytter og inducerede ikke søsterkromatidudveksling i kinesisk hamster knoglemarv in vivo .
Forringelse af fertilitet
Duloxetin administreret oralt til enten han- eller hunrotter før og under parring i doser på op til 45 mg/kg/dag (3 gange MRHD givet til unge på mg/m2-basis) ændrede ikke parring eller fertilitet.
Brug i specifikke populationer
Graviditet
Graviditetseksponeringsregister
Der er et graviditetseksponeringsregister, der overvåger graviditetsresultaterne hos kvinder, der er eksponeret for CYMBALTA under graviditet. For at tilmelde dig skal du kontakte CYMBALTA Pregnancy Registry på 1-866-814-6975 eller www.cymbalta 20mgpregnancyregistry.com.
Risikooversigt
Data fra en postmarketing retrospektiv kohorteundersøgelse indikerer, at brug af duloxetin i måneden før fødslen kan være forbundet med en øget risiko for postpartum blødning. Data fra publiceret litteratur og fra et postmarketing retrospektivt kohortestudie har ikke identificeret en klar lægemiddelassocieret risiko for alvorlige fødselsdefekter eller andre ugunstige udviklingsresultater (se Data ). Der er risici forbundet med ubehandlet depression og fibromyalgi under graviditet og med eksponering for SNRI og SSRI, inklusive CYMBALTA, under graviditet (se Kliniske overvejelser ).
Hos rotter og kaniner behandlet med duloxetin i organogeneseperioden var fostervægten faldet, men der var ingen tegn på udviklingsmæssige effekter ved doser op til henholdsvis 3 og 6 gange den maksimalt anbefalede humane dosis (MRHD) på 120 mg/dag givet. til unge på mg/m2-basis. Når duloxetin blev administreret oralt til gravide rotter gennem hele drægtighed og diegivning, blev hvalpevægten ved fødslen og hvalpeoverlevelse reduceret til 1 dag efter fødslen ved en dosis på 2 gange MRHD givet til unge på mg/m2-basis. Ved denne dosis blev ungernes adfærd i overensstemmelse med øget reaktivitet, såsom øget forskrækkelsesreaktion på støj og nedsat tilvænning af lokomotorisk aktivitet, observeret. Væksten efter fravænning blev ikke påvirket negativt.
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort for den angivne population er ukendt. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre ugunstige udfald. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 til 4 % og 15 til 20 %.
Kliniske overvejelser
Sygdomsassocieret moder- og/eller embryo-/fosterrisiko
Kvinder, der stopper med antidepressiva under graviditeten, er mere tilbøjelige til at opleve et tilbagefald af svær depression end kvinder, der fortsætter med antidepressiva. Dette fund er fra en prospektiv, longitudinel undersøgelse, der fulgte 201 gravide kvinder med en historie med svær depressiv lidelse, som var euthymic og tog antidepressiva i begyndelsen af graviditeten. Overvej risikoen for ubehandlet depression ved seponering eller ændring af behandling med antidepressiv medicin under graviditet og efter fødslen.
Gravide kvinder med fibromyalgi har øget risiko for uønskede udfald hos mødre og spædbørn, herunder for tidligt for tidligt brud på membraner, for tidlig fødsel, lille for svangerskabsalderen, intrauterin vækstbegrænsning, placentaforstyrrelser og venøs trombose. Det vides ikke, om disse ugunstige moder- og føtale udfald er et direkte resultat af fibromyalgi eller andre komorbide faktorer.
Maternelle bivirkninger
Brug af duloxetin i måneden før fødslen kan være forbundet med en øget risiko for postpartum blødning [se ADVARSLER OG FORHOLDSREGLER ].
Fetal/neonatal bivirkning
Nyfødte, der er udsat for CYMBALTA og andre SNRI'er eller SSRI'er sent i tredje trimester, har udviklet komplikationer, der kræver længere tids indlæggelse, respiratorisk støtte og sondeernæring. Sådanne komplikationer kan opstå umiddelbart efter levering. Rapporterede kliniske fund har inkluderet åndedrætsbesvær, cyanose, apnø, kramper, temperaturustabilitet, ernæringsbesvær, opkastning, hypoglykæmi, hypotoni, hypertoni, hyperrefleksi, tremor, nervøsitet, irritabilitet og konstant gråd. Disse resultater stemmer overens med enten en direkte toksisk virkning af SNRI'erne eller SSRI'erne eller muligvis et lægemiddelafbrydelsessyndrom. Det skal bemærkes, at det kliniske billede i nogle tilfælde stemmer overens med serotonergt syndrom [se ADVARSLER OG FORHOLDSREGLER ].
Data
Menneskelige data
Data fra en postmarketing retrospektiv påstandsbaseret kohorteundersøgelse fandt en øget risiko for postpartum blødning blandt 955 gravide kvinder, der blev eksponeret for duloxetin i den sidste måned af graviditeten sammenlignet med 4.128.460 ueksponerede gravide kvinder (justeret relativ risiko: 1,53; 18,08-2: 18% CI. ). Det samme studie fandt ikke en klinisk meningsfuld stigning i risikoen for alvorlige fødselsdefekter i sammenligningen af 2532 kvinder, der blev eksponeret for duloxetin i graviditetens første trimester med 1.284.827 ueksponerede kvinder efter justering for adskillige konfoundere. Metodiske begrænsninger omfatter mulige resterende forvirring, fejlklassificering af eksponering og resultater, mangel på direkte mål for sygdommens sværhedsgrad og mangel på information om alkoholforbrug, ernæring og eksponering for håndkøbsmedicin.
Dyredata
I reproduktionsstudier på dyr har duloxetin vist sig at have uønskede virkninger på embryo/føtal og postnatal udvikling.
Når duloxetin blev indgivet oralt til drægtige rotter og kaniner i løbet af organogeneseperioden, var der ingen tegn på misdannelser eller udviklingsvariationer ved doser op til 45 mg/kg/dag [henholdsvis 3 og 6 gange MRHD på 120 mg/dag givet til unge på mg/m2-basis]. Fostervægten blev dog reduceret ved denne dosis med en dosis uden effekt på 10 mg/kg/dag (ca. lig med MRHD hos rotter og 2 gange MRHD hos kaniner).
Når duloxetin blev administreret oralt til drægtige rotter gennem hele drægtighed og diegivning, blev overlevelsen af hvalpe til 1 dag efter fødslen og hvalpenes kropsvægt ved fødslen og under diegivningsperioden reduceret med en dosis på 30 mg/kg/dag (2 gange MRHD givet til unge på mg/m2-basis); dosis uden effekt var 10 mg/kg/dag. Desuden blev adfærd i overensstemmelse med øget reaktivitet, såsom øget forskrækkelsesreaktion på støj og nedsat tilvænning af bevægelsesaktivitet, observeret hos unger efter maternel eksponering for 30 mg/kg/dag. Vækst og reproduktionsevne efter fravænning af afkommet blev ikke påvirket negativt af maternal duloxetinbehandling.
Amning
Risikooversigt
Data fra publiceret litteratur rapporterer tilstedeværelsen af duloxetin i modermælk (se Data ). Der er rapporter om sedation, dårlig fodring og ringe vægtøgning hos spædbørn, der er udsat for duloxetin gennem modermælken (se Kliniske overvejelser ). Der er ingen data om virkningen af duloxetin på mælkeproduktionen.
De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for CYMBALTA og eventuelle negative virkninger på det ammede barn fra CYMBALTA eller fra den underliggende moderens tilstand.
Kliniske overvejelser
Spædbørn, der udsættes for CYMBALTA, skal overvåges for sedation, dårlig ernæring og ringe vægtøgning.
Data
Disponering af CYMBALTA 60 mg blev undersøgt hos 6 ammende kvinder, som var mindst 12 uger efter fødslen og havde valgt at fravænne deres spædbørn. Kvinderne fik 40 mg CYMBALTA 60 mg to gange dagligt i 3,5 dage. Den maksimale koncentration målt i modermælk forekom med en median på 3 timer efter dosis. Mængden af CYMBALTA i modermælk var ca. 7 mcg/dag, mens du fik den dosis; den estimerede daglige spædbarnsdosis var ca. 2 mcg/kg/dag, hvilket er mindre end 1 % af moderens dosis. Tilstedeværelsen af CYMBALTA 40 mg metabolitter i modermælk blev ikke undersøgt.
Pædiatrisk brug
Sikkerheden og effektiviteten af CYMBALTA 60 mg er blevet fastslået til behandling af generaliseret angstlidelse (GAD) hos patienter i alderen 7 til 17 år og til behandling af juvenil fibromyalgisyndrom hos patienter i alderen 13 til 17 år. Sikkerheden og effektiviteten af CYMBALTA 20 mg er ikke blevet fastslået hos pædiatriske patienter med svær depressiv lidelse (MDD), diabetisk perifer neuropatisk smerte eller kronisk muskuloskeletale smerte.
Antidepressiva øgede risikoen for selvmordstanker og -adfærd hos pædiatriske patienter. Overvåg alle pædiatriske patienter, der behandles med antidepressiva for klinisk forværring og fremkomst af selvmordstanker og -adfærd, især i løbet af de første par måneder af behandlingen eller ved dosisændringer [se ADVARSLER OG FORHOLDSREGLER ]. Udfør regelmæssig overvågning af vægt og vækst hos pædiatriske patienter behandlet med CYMBALTA [se BIVIRKNINGER ].
Generaliseret angstlidelse
Brug af CYMBALTA til behandling af GAD hos patienter i alderen 7 til 17 år understøttes af et 10-ugers placebokontrolleret forsøg (GAD-6). Undersøgelsen omfattede 272 pædiatriske patienter med GAD, hvoraf 47 % var i alderen 7 til 11 år (53 % var i alderen 12 til 17 år). CYMBALTA viste overlegenhed i forhold til placebo målt ved større forbedring i Pediatric Anxiety Rating Scale (PARS) for GAD-sværhedsscore [se Kliniske Studier ].
Sikkerheden og effektiviteten af CYMBALTA 20 mg til behandling af GAD hos pædiatriske patienter under 7 år er ikke blevet fastlagt.
Fibromyalgi
Anvendelse af CYMBALTA til behandling af fibromyalgi hos patienter i alderen 13 til 17 år understøttes af et 13-ugers placebokontrolleret forsøg med 184 patienter med juvenil fibromyalgisyndrom (studie FM-4). CYMBALTA viste forbedring i forhold til placebo på det primære endepunkt, ændring fra baseline til end-of-behandling på Brief Pain Inventory (BPI) – Modificeret Kort Form: Adolescent Version 24-timers gennemsnitlig smertesværhedsvurdering [se Kliniske Studier ].
Sikkerheden og effektiviteten af CYMBALTA til behandling af fibromyalgi hos patienter under 13 år er ikke blevet fastlagt.
Større depressiv lidelse
Sikkerheden og effektiviteten af CYMBALTA er ikke blevet fastslået hos pædiatriske patienter til behandling af MDD.
Effekten af CYMBALTA blev ikke påvist i to 10-ugers placebokontrollerede forsøg med 800 pædiatriske patienter i alderen 7 til 17 år med MDD (MDD-6 og MDD-7). Hverken CYMBALTA eller en aktiv kontrol (godkendt til behandling af pædiatrisk MDD) var placebo overlegen.
De hyppigst observerede bivirkninger i de pædiatriske kliniske forsøg med MDD omfattede kvalme, hovedpine, vægttab og mavesmerter. Nedsat appetit og vægttab er blevet observeret i forbindelse med brugen af SSRI og SNRI.
Toksikologiske data for unge dyr
Duloxetin-administration til unge rotter fra post-natal dag 21 (fravænning) til post-natal dag 90 (voksen) resulterede i nedsatte kropsvægte, som fortsatte i voksenalderen, men kom sig, når lægemiddelbehandlingen blev afbrudt; let forsinket (~1,5 dage) kønsmodning hos hunner, uden nogen indvirkning på fertiliteten; og en forsinkelse i indlæringen af en kompleks opgave i voksenalderen, som ikke blev observeret efter at medicinbehandlingen var afbrudt. Disse virkninger blev observeret ved den høje dosis på 45 mg/kg/dag (2 gange MRHD for et barn); niveauet uden effekt var 20 mg/kg/dag (≈1 gange MRHD, for et barn).
Geriatrisk brug
Geriatrisk eksponering i præmarketing kliniske forsøg med CYMBALTA
- Af de 2.418 patienter i MDD-undersøgelser var 6% (143) 65 år eller derover.
- Af de 1041 patienter i CLBP-undersøgelser var 21 % (221) 65 år eller derover.
- Af de 487 patienter i OA-studier var 41 % (197) 65 år eller derover.
- Af de 1.074 patienter i DPNP-undersøgelserne var 33 % (357) 65 år eller derover.
- Af de 1.761 patienter i FM-forsøg var 8% (140) 65 år eller derover.
I MDD-, GAD-, DPNP-, FM-, OA- og CLBP-undersøgelserne blev der generelt ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet mellem disse patienter og yngre voksne patienter, og anden rapporteret klinisk erfaring har ikke identificeret forskelle i respons mellem disse geriatriske og yngre patienter. voksne patienter, men større følsomhed hos nogle ældre patienter kan ikke udelukkes.
SSRI'er og SNRI'er, inklusive CYMBALTA er blevet forbundet med klinisk signifikant hyponatriæmi hos geriatriske patienter, som kan have større risiko for denne bivirkning [se ADVARSLER OG FORHOLDSREGLER ].
en analyse af data fra alle placebokontrollerede forsøg rapporterede CYMBALTA-behandlede patienter en højere faldfrekvens sammenlignet med placebo-behandlede patienter. Den øgede risiko ser ud til at være proportional med en patients underliggende risiko for fald. Den underliggende risiko ser ud til at stige støt med alderen. Da geriatriske patienter har en tendens til at have en højere forekomst af risikofaktorer for fald såsom medicin, medicinske følgesygdomme og gangforstyrrelser, er virkningen af stigende alder i sig selv på fald under behandling med CYMBALTA 30 mg uklar. Fald med alvorlige konsekvenser, herunder knoglebrud og hospitalsindlæggelser, er blevet rapporteret ved brug af CYMBALTA [se ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ].
Duloxetins farmakokinetik efter en enkelt dosis på 40 mg blev sammenlignet hos raske ældre kvinder (65 til 77 år) og raske midaldrende kvinder (32 til 50 år). Der var ingen forskel i Cmax, men AUC for duloxetin var noget (ca. 25%) højere og halveringstiden ca. 4 timer længere hos ældre kvinder. Populationsfarmakokinetiske analyser tyder på, at de typiske værdier for clearance falder med ca. 1 % for hvert alderen mellem 25 og 75 år; men alder som en forudsigelig faktor tegner sig kun for en lille procentdel af variationen mellem patienter. Dosisjustering baseret på den voksne patients alder er ikke nødvendig.
Køn
Duloxetins halveringstid er ens hos mænd og kvinder. Dosisjustering baseret på køn er ikke nødvendig.
Rygestatus
Duloxetins biotilgængelighed (AUC) ser ud til at være reduceret med omkring en tredjedel hos rygere. Dosisændringer anbefales ikke til rygere.
Race
Der blev ikke udført nogen specifik farmakokinetisk undersøgelse for at undersøge virkningerne af race.
Nedsat leverfunktion
Patienter med klinisk tydeligt nedsat leverfunktion har nedsat duloxetin-metabolisme og -eliminering. Efter en enkelt 20 mg dosis af CYMBALTA 20 mg havde 6 cirrosepatienter med moderat nedsat leverfunktion (Child-Pugh klasse B) en gennemsnitlig plasma-duloxetin-clearance på ca. 15 % af den for alders- og kønsvarende raske forsøgspersoner, med en 5-fold stigning i gennemsnitlig eksponering (AUC). Selvom Cmax svarede til det normale hos de cirrotiske patienter, var halveringstiden ca. 3 gange længere [se DOSERING OG ADMINISTRATION og ADVARSLER OG FORHOLDSREGLER ].
Svært nedsat nyrefunktion
Der er begrænsede data tilgængelige om virkningen af CYMBALTA 40 mg hos patienter med nyresygdom i slutstadiet (ESRD). Efter en enkelt 60 mg dosis af CYMBALTA 20 mg var Cmax- og AUC-værdier ca. 100 % højere hos patienter med ESRD, der fik kronisk intermitterende hæmodialyse, end hos personer med normal nyrefunktion. Eliminationshalveringstiden var imidlertid ens i begge grupper. AUC'erne for de vigtigste cirkulerende metabolitter, 4-hydroxy duloxetin glucuronid og 5-hydroxy, 6methoxy duloxetin sulfat, som i vid udstrækning udskilles i urinen, var ca. 7 til 9 gange højere og forventes at stige yderligere ved gentagen dosering. Populations PK-analyser tyder på, at milde til moderate grader af nedsat nyrefunktion (estimeret CrCl 30-80 ml/min) ikke har nogen signifikant effekt på duloxetins tilsyneladende clearance [se DOSERING OG ADMINISTRATION og ADVARSLER OG FORHOLDSREGLER ].
OVERDOSIS
Tegn og symptomer
Efter markedsføring er der rapporteret fatale udfald for akutte CYMBALTA 60 mg overdoser, primært med blandede overdoser, men også med CYMBALTA 20 mg kun, inklusive 1000 mg CYMBALTA (ca. 8,3 gange den maksimalt anbefalede dosis). Tegn og symptomer på overdosering (CYMBALTA alene eller sammen med blandede lægemidler) omfattede døsighed, koma, serotonergt syndrom, kramper, synkope, takykardi, hypotension, hypertension og opkastning.
Håndtering af overdosis
Der er ingen specifik modgift mod en CYMBALTA 60 mg overdosering, men hvis serotonergt syndrom opstår, kan specifik behandling (såsom med cyproheptadin og/eller temperaturkontrol) overvejes.
tilfælde af akut overdosering med CYMBALTA 30mg, bør behandlingen bestå af de generelle foranstaltninger, der anvendes i håndteringen af overdosering med et hvilket som helst lægemiddel, såsom sikring af tilstrækkelige luftveje, iltning og ventilation og overvågning af hjerterytme og vitale tegn. Maveskylning med en orogastrisk sonde med stor boring med passende luftvejsbeskyttelse, hvis det er nødvendigt, kan være indiceret, hvis det udføres kort efter indtagelse eller hos symptomatiske patienter. Induktion af emesis anbefales ikke.
Aktivt kul kan være nyttigt til at begrænse absorptionen af duloxetin fra mave-tarmkanalen. Administration af aktivt kul har vist sig at reducere duloxetins AUC og Cmax med gennemsnitligt en tredjedel, selvom nogle patienter havde en begrænset effekt af aktivt kul. På grund af det store distributionsvolumen af duloxetin er det usandsynligt, at forceret diurese, dialyse, hæoperfusion og udvekslingstransfusion vil være gavnlige.
Ved håndtering af overdosering bør muligheden for flere lægemiddelinvolvering overvejes. En særlig forsigtighed involverer patienter, der overdoserer med CYMBALTA 60 mg og tricykliske antidepressiva. I et sådant tilfælde kan nedsat clearance af det modertricykliske stof og/eller dets aktive metabolit øge muligheden for klinisk signifikante følgesygdomme og forlænge den tid, der er nødvendig for nøje medicinsk observation [se ADVARSLER OG FORHOLDSREGLER og DRUGSINTERAKTIONER ].
Overvej at kontakte et giftkontrolcenter (1-800-222-1222 eller www.poison.org) for yderligere information om behandling af overdosering.
KONTRAINDIKATIONER
Brugen af MAO-hæmmere beregnet til behandling af psykiatriske lidelser med CYMBALTA 40 mg eller inden for 5 dage efter ophør af behandlingen med CYMBALTA er kontraindiceret på grund af en øget risiko for serotonergt syndrom. Brugen af CYMBALTA inden for 14 dage efter seponering af en MAO-hæmmer beregnet til behandling af psykiatriske lidelser er kontraindiceret [se DOSERING OG ADMINISTRATION og ADVARSLER OG FORHOLDSREGLER ].
Start med CYMBALTA 30 mg hos en patient, der er i behandling med MAO-hæmmere såsom linezolid eller intravenøs methylenblåt, er også kontraindiceret på grund af en øget risiko for serotonergt syndrom [se DOSERING OG ADMINISTRATION og ADVARSLER OG FORHOLDSREGLER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Selvom de nøjagtige mekanismer af det antidepressive middel, centrale smertehæmmende og anxiolytiske virkninger af duloxetin hos mennesker er ukendte, menes disse virkninger at være relateret til dets forstærkning af serotonerge og noradrenerge aktivitet i CNS.
Farmakodynamik
Prækliniske undersøgelser har vist, at duloxetin er en potent hæmmer af neuronal serotonin- og noradrenalin-genoptagelse og en mindre potent hæmmer af dopamin-genoptagelse. Duloxetin har ingen signifikant affinitet for dopaminerge, adrenerge, kolinerge, histaminerge, opioid-, glutamat- og GABA-receptorer in vitro. Duloxetin hæmmer ikke monoaminoxidase (MAO).
CYMBALTA er i en klasse af lægemidler, der vides at påvirke urethral modstand [se ADVARSLER OG FORHOLDSREGLER ].
Hjerteelektrofysiologi
Effekten af CYMBALTA 160 mg og 200 mg administreret to gange dagligt (henholdsvis 2,7 og 3,3 gange den maksimalt anbefalede dosis) til steady state blev evalueret i et randomiseret, dobbelt-blindet, to-vejs crossover-studie med 117 raske kvindelige voksne forsøgspersoner. Der blev ikke påvist nogen forlængelse af QT-intervallet. CYMBALTA 40 mg ser ud til at være forbundet med koncentrationsafhængig, men ikke klinisk meningsfuld QT-forkortelse.
Farmakokinetik
Duloxetin har en eliminationshalveringstid på ca. 12 timer (interval 8 til 17 timer), og dets farmakokinetik er dosisproportional over det terapeutiske område. Steady-state plasmakoncentrationer opnås typisk efter 3 dages dosering. Elimination af duloxetin sker hovedsageligt gennem levermetabolisme, der involverer to P450-isozymer, CYP1A2 og CYP2D6.
Absorption
Efter oral administration af CYMBALTA 30 mg absorberes duloxetinhydrochlorid godt. Der er en median forsinkelse på 2 timer, indtil absorptionen begynder (Tlag), med maksimal plasmakoncentration (Cmax) af duloxetin 6 timer efter dosis. Der er en 3 timers forsinkelse i absorptionen og en tredjedel stigning i tilsyneladende clearance af duloxetin efter en aftendosis sammenlignet med en morgendosis.
Effekt af mad
Mad påvirker ikke Cmax for duloxetin, men forsinker tiden til at nå topkoncentrationen fra 6 til 10 timer, og det reducerer absorptionsgraden (AUC) marginalt med ca. 10 %.
Fordeling
Det tilsyneladende distributionsvolumen er i gennemsnit ca. 1640 l. Duloxetin er stærkt bundet (>90%) til proteiner i humant plasma og binder primært til albumin og α1-syreglycoprotein. Interaktionen mellem duloxetin og andre stærkt proteinbundne lægemidler er ikke blevet fuldt ud evalueret. Plasmaproteinbinding af duloxetin påvirkes ikke af nedsat nyre- eller leverfunktion.
Elimination
Metabolisme
Biotransformation og disposition af duloxetin hos mennesker er blevet bestemt efter oral administration af 14C-mærket duloxetin. Duloxetin udgør omkring 3 % af det samlede radioaktivt mærkede materiale i plasmaet, hvilket indikerer, at det undergår omfattende metabolisme til adskillige metabolitter. De vigtigste biotransformationsveje for duloxetin involverer oxidation af naphthylringen efterfulgt af konjugation og yderligere oxidation. Både CYP1A2 og CYP2D6 katalyserer oxidationen af naphthylringen in vitro. Metabolitter fundet i plasma omfatter 4-hydroxy duloxetin glucuronid og 5 hydroxy, 6-methoxy duloxetin sulfat.
Udskillelse
Mange yderligere metabolitter er blevet identificeret i urinen, nogle repræsenterer kun mindre udskillelsesveje. Kun spor (
Specifikke populationer
Pædiatriske patienter
Duloxetin steady-state plasmakoncentration var sammenlignelig hos pædiatriske patienter i alderen 7 til 17 år og voksne patienter. Den gennemsnitlige steady-state duloxetinkoncentration var ca. 30 % lavere i denne pædiatriske population i forhold til voksne patienter. De modelforudsagte steady state-plasmakoncentrationer af duloxetin hos pædiatriske patienter i alderen 7 til 17 år var for det meste inden for det koncentrationsområde, der blev observeret hos voksne patienter, og oversteg ikke koncentrationsområdet hos voksne.
Kliniske Studier
Oversigt over de kliniske forsøg
Virkningen af CYMBALTA 60 mg er blevet fastslået i følgende populationer i tilstrækkelige og velkontrollerede forsøg:
Major Depressive Disorder (MDD)
4 kortvarige (studier MDD-1, MDD-2, MDD-3 og MDD-4) og 1 vedligeholdelsesforsøg (studie MDD-5) hos voksne [se Større depressiv lidelse hos voksne ].
Generaliseret angstlidelse (GAD)
3 korttidsforsøg hos voksne (studier GAD-1, GAD-2 og GAD-3), 1 vedligeholdelsesforsøg i voksne (studie GAD-4), 1 korttidsforsøg med geriatriske patienter (studie GAD-5), og 1 korttidsforsøg med pædiatriske patienter i alderen 7 til 17 år (undersøgelse GAD-6) [se Generaliseret angstlidelse ].
Diabetisk perifer neuropati (DPNP)
To 12-ugers forsøg med voksne (undersøgelser DPNP-1 og DPNP-2) [se Diabetisk perifer neuropatisk smerte hos voksne ].
Fibromyalgi (FM)
To forsøg med voksne (et af 3 måneders varighed og et af 6 måneders varighed) (studier FM-1 og FM-2) og et 13-ugers forsøg med pædiatriske patienter i alderen 13 til 17 år (undersøgelse FM-4) [se Fibromyalgi ].
Kroniske muskuloskeletale smerter
To 12- til 13-ugers forsøg med voksne patienter med kroniske lænderygsmerter (CLBP) (studier CLBP-1 og CLBP-3) og et 13-ugers forsøg med voksne patienter med kroniske smerter på grund af slidgigt (OA) (studie OA) -1) [se Kroniske muskuloskeletale smerter hos voksne ].
Derudover er et resumé af følgende forsøg, der ikke viste effekt, præsenteret nedenfor: Undersøgelse FM-3 (et 16 ugers forsøg med voksne patienter med fibromyalgi), undersøgelse CLBP-2 (et 13-ugers forsøg med voksne patienter med CLBP) og Studie OA-2 (et 13-ugers forsøg med voksne patienter med kroniske smerter på grund af OA).
Større depressiv lidelse hos voksne
Effekten af CYMBALTA som behandling for MDD hos voksne blev fastslået i 4 randomiserede, dobbeltblindede, placebokontrollerede, fastdosisforsøg hos voksne ambulante patienter (18 til 83 år), der opfylder DSM-IV-kriterierne for MDD:
- undersøgelserne MDD-1 og MDD-2 blev patienterne randomiseret til CYMBALTA 60 mg én gang dagligt (henholdsvis N=123 og N=128) eller placebo (henholdsvis N=122 og N=139) i 9 uger
- I undersøgelse MDD-3 blev patienterne randomiseret til CYMBALTA 20 eller 40 mg to gange dagligt (henholdsvis N=86 og N=91) eller placebo (N=89) i 8 uger
- I studie MDD-4 blev patienterne randomiseret til CYMBALTA 40 eller 60 mg to gange dagligt (henholdsvis N=95 og N=93) eller placebo (N=93) i 8 uger.
I alle fire forsøg udviste CYMBALTA 40 mg overlegenhed i forhold til placebo målt ved forbedring af Hamilton Depression Rating Scale (HAMD-17) med 17 elementer (se ). Der er ingen evidens for, at doser større end 60 mg/dag giver yderligere fordele.
I alle disse kliniske forsøg antydede analyser af sammenhængen mellem behandlingsresultat og alder, køn og race ikke nogen differentiel respons på basis af disse patientkarakteristika.
Undersøgelse MDD-1 CYMBALTA (60 mg/dag)b Placebo 21,5 (4,10) 21,1 (3,71) -10,9 (0,70) -6,1 (0,69) -4,9 (-6,8, -2,9) --
I undersøgelse MDD-5 fik 533 voksne patienter, der opfylder DSM-IV-kriterierne for MDD, CYMBALTA 60 mg én gang dagligt i en indledende 12-ugers åben behandlingsfase. To hundrede og otteoghalvfjerds patienter, som reagerede på åben behandling [defineret som at opfylde følgende kriterier i uge 10 og 12: en HAMD-17 total score ≤9, Clinical Global Impressions of Severity (CGI-S) ≤2, og ikke der opfylder DSM-IV-kriterierne for MDD] blev tilfældigt tildelt fortsættelse af CYMBALTA i samme dosis (N=136) eller til placebo (N=142) i 6 måneder.
I undersøgelse MDD-5 oplevede patienter på CYMBALTA en statistisk signifikant længere tid til tilbagefald af depression end patienter på placebo (se figur 1 ). Tilbagefald blev defineret som en stigning i CGI-S-scoren på ≥2 point sammenlignet med den opnåede i uge 12, samt opfyldelse af DSM-IV-kriterierne for MDD ved 2 på hinanden følgende besøg med mindst 2 ugers mellemrum, hvor de 2-ugers Det tidsmæssige kriterium skulle kun være opfyldt ved det andet besøg.
Figur 1: Kumulativ andel af voksne patienter med MDD-tilbagefald (undersøgelse MDD-5)
Generaliseret angstlidelse
GAD-forsøg hos voksne (herunder geriatriske patienter)
Effekten af CYMBALTA 20 mg til behandling af generaliseret angstlidelse (GAD) blev fastslået i 1 fast-dosis randomiseret, dobbelt-blindet, placebo-kontrolleret forsøg og 2 fleksible-dosis randomiserede, dobbelt-blinde, placebo-kontrollerede forsøg i voksne ambulante patienter mellem 18 og 83 år, der opfylder DSM-IV-kriterierne for GAD (undersøgelser henholdsvis GAD-1, GAD-2 og GAD-3).
studierne GAD-1 og GAD-2 var startdosis 60 mg én gang dagligt (nedtitrering til 30 mg én gang dagligt var tilladt af tolerabilitetsgrunde; dosis kunne øges til 60 mg én gang dagligt). Femten procent af patienterne blev nedtitreret. Studie GAD-3 havde en startdosis på 30 mg én gang dagligt i 1 uge, før den blev øget til 60 mg én gang dagligt.
Studierne GAD-2 og GAD-3 involverede dosistitrering med CYMBALTA-doser i området fra 60 mg én gang dagligt til 120 mg én gang dagligt (N=168 og N=162) sammenlignet med placebo (N=159 og N=161) over en 10- uges behandlingsperiode. Den gennemsnitlige dosis for fuldførere ved endpoint i disse forsøg var 104,8 mg/dag. Studie GAD-1 evaluerede CYMBALTA 60 mg doser på 60 mg én gang dagligt (N=168) og 120 mg én gang dagligt (N=170) sammenlignet med placebo (N=175) over en 9-ugers behandlingsperiode. Selvom en dosis på 120 mg/dag viste sig at være effektiv, er der ingen beviser for, at doser større end 60 mg/dag giver yderligere fordele.
alle 3 forsøg udviste CYMBALTA overlegenhed i forhold til placebo målt ved større forbedring i Hamilton Anxiety Scale (HAM-A) totalscore (se ) og ved Sheehan Disability Scale (SDS) globale funktionsnedsættelsesscore. SDS er en sammensat måling af, i hvor høj grad følelsesmæssige symptomer forstyrrer patientens funktion i 3 livsdomæner: arbejde/skole, socialt liv/fritidsaktiviteter og familieliv/hjemansvar.
undersøgelse GAD-4 modtog 887 patienter, der opfylder DSM-IV-TR-kriterierne for GAD, CYMBALTA 60 mg til 120 mg én gang dagligt i en indledende 26-ugers åben behandlingsfase. Fire hundrede og niogtyve patienter, som reagerede på åben behandling [defineret som at opfylde følgende kriterier i uge 24 og 26: et fald fra baseline HAM-A total score med mindst 50 % til en score ikke højere end 11, og en Clinical Global Impressions of Improvement-score (CGI-Improvement) på 1 eller 2] blev tilfældigt tildelt til fortsættelse af CYMBALTA 30 mg ved samme dosis (N=216) eller til placebo (N=213) og blev observeret for tilbagefald. Af de randomiserede patienter havde 73 % været i en responder-status i mindst 10 uger. Tilbagefald blev defineret som en stigning i CGI-alvorlighedsscore på mindst 2 point til en score ≥4 og en MINI (Mini-International Neuropsykiatrisk Interview) diagnose af GAD (eksklusive varighed) eller seponering på grund af manglende effekt. Patienter, der tog CYMBALTA, oplevede en statistisk signifikant længere tid til tilbagefald af GAD end patienter, der fik placebo (se Figur 2 ).
Undergruppeanalyser indikerede ikke, at der var forskelle i behandlingsresultater som funktion af alder eller køn.
GAD-forsøg hos geriatriske patienter
Effekten af CYMBALTA til behandling af patienter ≥65 år med GAD blev fastslået i et 10-ugers fleksibelt dosis, randomiseret, dobbeltblindet, placebokontrolleret forsøg med voksne ≥65 år, der opfylder DSM-IV-kriterierne for GAD (Undersøgelse GAD-5). I undersøgelse GAD-5 var startdosis 30 mg én gang dagligt i 2 uger, før yderligere dosisstigninger i trin på 30 mg i behandlingsuge 2, 4 og 7 op til 120 mg én gang dagligt blev tilladt baseret på investigatorens vurdering af klinisk respons og tolerabilitet. Den gennemsnitlige dosis for patienter, der afsluttede den 10-ugers akutte behandlingsfase, var 51 mg. Patienter behandlet med CYMBALTA (N=151) viste signifikant større forbedring sammenlignet med placebo (N=140) på gennemsnitlig ændring fra baseline til endepunkt målt ved HAM-A totalscore (se ).
GAD-forsøg hos pædiatriske patienter i alderen 7 til 17 år
Effekten af CYMBALTA til behandling af pædiatriske patienter i alderen 7 til 17 år med GAD blev fastslået i 1 fleksible dosis randomiseret, dobbelt-blindt, placebokontrolleret forsøg i ambulante pædiatriske patienter med GAD (baseret på DSM-IV kriterier) (Studie) GAD-6).
I undersøgelse GAD-6 var startdosis 30 mg én gang dagligt i 2 uger. Yderligere dosisstigninger i trin på 30 mg op til 120 mg én gang dagligt blev tilladt baseret på investigatorens vurdering af klinisk respons og tolerabilitet. Den gennemsnitlige dosis for patienter, der afsluttede den 10-ugers behandlingsfase, var 57,6 mg/dag. I denne undersøgelse viste CYMBALTA (N=135) overlegenhed i forhold til placebo (N=137) fra baseline til endepunkt målt ved større forbedring i Pediatric Anxiety Rating Scale (PARS) for GAD-sværhedsgradsscore (se ).
Figur 2: Kumulativ andel af voksne patienter med GAD-tilbagefald (undersøgelse GAD-4)
Diabetisk perifer neuropatisk smerte hos voksne
Effekten af CYMBALTA 30 mg til behandling af neuropatisk smerte forbundet med diabetisk perifer neuropati hos voksne blev fastslået i 2 randomiserede, 12-ugers, dobbeltblindede, placebokontrollerede, fastdosisforsøg hos voksne patienter med diabetisk perifer neuropatisk smerte (DPNP) ) i mindst 6 måneder (undersøgelse DPNP-1 og undersøgelse DPNP-2). Disse forsøg omfattede i alt 791 patienter, hvoraf 592 (75%) gennemførte forsøgene. De inkluderede patienter havde type I eller II diabetes mellitus med diagnosen smertefuld distal symmetrisk sensorimotorisk polyneuropati i mindst 6 måneder. Patienterne havde en baseline smertescore på ≥4 på en 11-punkts skala fra 0 (ingen smerte) til 10 (værst mulig smerte). Patienterne fik tilladelse til op til 4 gram acetaminophen om dagen efter behov for smerte, ud over CYMBALTA. Patienterne noterede deres smerter dagligt i en dagbog.
Begge forsøg sammenlignede CYMBALTA 60 mg én gang dagligt eller 60 mg to gange dagligt med placebo. Undersøgelse DPNP-1 sammenlignede desuden CYMBALTA 20 mg med placebo. I alt 457 patienter (342 CYMBALTA, 115 placebo) blev inkluderet i undersøgelse DPNP-1, og i alt 334 patienter (226 CYMBALTA, 108 placebo) blev inkluderet i undersøgelse DPNP-2.
Behandling med CYMBALTA 60 mg en eller to gange dagligt forbedrede statistisk signifikant den gennemsnitlige smertescore fra baseline og øgede andelen af patienter med mindst 50 % reduktion i smertescore fra baseline. For forskellige grader af forbedring af smerte fra baseline til undersøgelsens endepunkt viser figur 3 og 4 den del af patienter, der opnår den grad af forbedring i henholdsvis undersøgelser DPNP-1 og DPNP-2. Tallene er kumulative, således at patienter, hvis ændring fra baseline er f.eks. 50 %, også er inkluderet ved alle forbedringsniveauer under 50 %. Patienter, der ikke fuldførte forsøget, blev tildelt 0 % forbedring. Nogle patienter oplevede et fald i smerte så tidligt som i uge 1, som varede ved gennem hele forsøget.
Figur 3: Procentdel af DPNP voksne patienter, der opnår forskellige niveauer af smertelindring målt ved 24-timers gennemsnitlig smertesværhedsgrad (undersøgelse DPNP-1)
Figur 4: Procentdel af DPNP voksne patienter, der opnår forskellige niveauer af smertelindring målt ved 24-timers gennemsnitlig smertesværhedsgrad (undersøgelse DPNP-2)
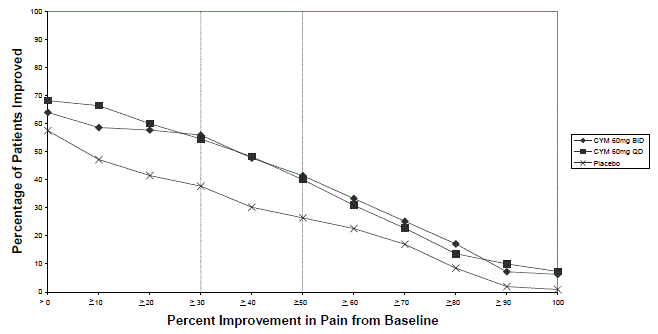
Fibromyalgi
Voksenforsøg i fibromyalgi
Effekten af CYMBALTA til behandling af fibromyalgi hos voksne blev fastslået i to randomiserede, dobbeltblindede, placebokontrollerede, fastdosisforsøg hos voksne patienter, der opfylder American College of Rheumatology-kriterierne for fibromyalgi (en historie med udbredt smerte i 3 måneder) og smerter til stede på 11 eller flere af de 18 specifikke ømme punkter). Undersøgelsen FM-1 var af tre måneders varighed og omfattede kun kvindelige patienter. Studiet FM-2 var af seks måneders varighed og omfattede mandlige og kvindelige patienter. Cirka 25 % af deltagerne havde en komorbid diagnose MDD. Studier FM1 og FM-2 inkluderede i alt 874 patienter, hvoraf 541 (62%) fuldførte forsøgene. I alt 354 patienter (234 CYMBALTA 40 mg, 120 placebo) blev inkluderet i undersøgelse FM-1, og i alt 520 patienter (376 CYMBALTA, 144 placebo) blev inkluderet i undersøgelse FM-2 (5 % mænd, 95 % kvinder). Patienterne havde en baseline smertescore på 6,5 på en 11-punkts skala fra 0 (ingen smerte) til 10 (værre mulig smerte).
Studierne FM-1 og FM-2 sammenlignede CYMBALTA 60 mg én gang dagligt eller 120 mg dagligt (givet i opdelte doser i undersøgelse FM-1 og som en enkelt daglig dosis i undersøgelse FM-2) med placebo. Studie FM-2 sammenlignede desuden CYMBALTA 20 mg med placebo i de første tre måneder af et seks måneders forsøg.
Behandling med CYMBALTA 60 mg eller 120 mg dagligt forbedrede statistisk signifikant den gennemsnitlige smertescore fra baseline og øgede andelen af patienter med mindst 50 % reduktion i smertescore fra baseline. Smertereduktion blev observeret hos patienter både med og uden komorbid MDD. Graden af smertereduktion kan dog være større hos patienter med komorbid MDD. For forskellige grader af forbedring af smerte fra baseline til undersøgelsens endepunkt viser figur 5 og 6 den del af patienter, der opnår den grad af forbedring i henholdsvis undersøgelser FM-1 og FM-2. Tallene er kumulative, således at patienter, hvis ændring fra baseline er f.eks. 50 %, også inkluderes ved alle forbedringsniveauer under 50 %. Patienter, der ikke fuldførte forsøget, blev tildelt 0 % forbedring. Nogle patienter oplevede et fald i smerte så tidligt som i uge 1, som varede ved gennem hele forsøget. Forbedring blev også påvist på mål for funktion (Fibromyalgi Impact Questionnaires) og patientens globale indtryk af forandring (PGI). Ingen af forsøgene viste en fordel på 120 mg sammenlignet med 60 mg, og en højere dosis var forbundet med flere bivirkninger og for tidlig seponering af behandlingen.
Figur 5: Procentdel af voksne fibromyalgipatienter, der opnår forskellige niveauer af smertelindring ved undersøgelsens endepunkt målt ved 24-timers gennemsnitlig smertesværhed (undersøgelse FM-1)
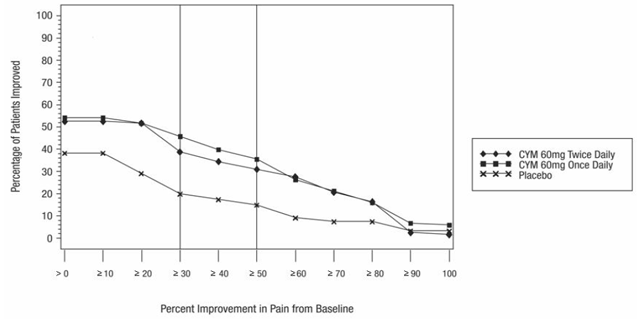
Figur 6: Procentdel af voksne fibromyalgipatienter, der opnår forskellige niveauer af smertelindring ved undersøgelsens endepunkt målt ved 24-timers gennemsnitlig smertesværhedsgrad (undersøgelse FM-2)
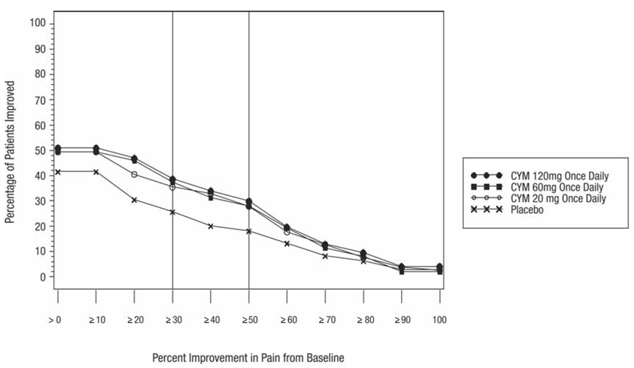
Derudover blev fordelen ved optitrering hos ikke-responderende på CYMBALTA ved 60 mg/dag evalueret i et separat forsøg (studie FM-3). Voksne patienter blev oprindeligt behandlet med CYMBALTA 60 mg én gang dagligt i otte uger på åben måde. Efterfølgende blev personer, der fuldførte denne fase, randomiseret til dobbeltblind behandling med CYMBALTA på enten 60 mg én gang dagligt eller 120 mg én gang dagligt. Responders blev defineret som patienter, der havde mindst 30 % reduktion i smertescore fra baseline ved afslutningen af den 8-ugers behandling. Patienter, der ikke reagerede efter 8 uger, var ikke mere tilbøjelige til at opfylde responskriterierne ved slutningen af 60 ugers behandling, hvis de blev titreret blindt til CYMBALTA 120 mg sammenlignet med dem, der blev blindt fortsat på CYMBALTA 60 mg.
Pædiatrisk forsøg i fibromyalgi
CYMBALTA blev undersøgt hos 184 pædiatriske patienter i alderen 13 til 17 år med juvenil fibromyalgisyndrom i et 13-ugers, placebokontrolleret forsøg (studie FM-4). I undersøgelse FM-4 gennemførte 149 (81%) patienter forsøget. CYMBALTA (N=91) blev påbegyndt med en dosis på 30 mg én gang dagligt i en uge og titreret til 60 mg én gang dagligt i 12 uger, som tolereret. Den gennemsnitlige dosis for patienter, der fuldførte den 12-ugers behandlingsfase, var 49 mg/dag. CYMBALTA viste forbedring i forhold til placebo på det primære endepunkt [ændring fra baseline til end-of-treatment på Brief Pain Inventory (BPI) – Modified Short Form: Adolescent Version 24-timers gennemsnitlig smertesværhedsgrad] med en p-værdi på 0,052 fra den præspecificerede primære analyse og p-værdier, der spænder fra 0,011-0,020 fra sensitivitetsanalyser, som tildelte basislinjeværdier, til manglende vurderinger af nogle patienter, som af forskellige årsager ikke gennemførte forsøget. Patienterne havde en baseline BPI på 5,7. For forskellige grader af forbedring af smerte fra baseline til undersøgelsens endepunkt viser figur 7 den del af patienter, der opnår den grad af forbedring i undersøgelse FM-4.
Figur 7: Procentdel af pædiatriske patienter i alderen 13 til 17 år med juvenil fibromyalgisyndrom, der opnår forskellige niveauer af smertelindring i uge 12 (undersøgelse FM-4)a
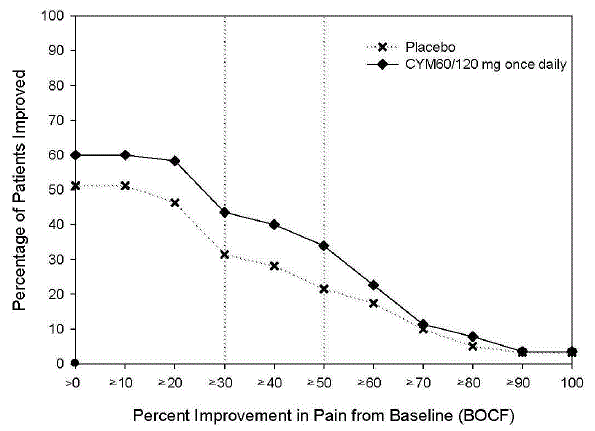
Kroniske muskuloskeletale smerter hos voksne
CYMBALTA er indiceret til behandling af kroniske muskuloskeletale smerter hos voksne. Dette er blevet fastslået i forsøg med voksne patienter med kroniske lændesmerter og kroniske smerter på grund af slidgigt.
Forsøg med kroniske lænderygsmerter hos voksne
Effekten af CYMBALTA 60 mg til kroniske lænderygsmerter (CLBP) hos voksne blev vurderet i to dobbeltblindede, placebokontrollerede, randomiserede kliniske forsøg af 13 ugers varighed (studier CLBP-1 og CLBP-2) og et af 12 -ugers varighed (CLBP-3). Studier CLBP-1 og CLBP-3 påviste effektiviteten af CYMBALTA i behandlingen af CLBP. Patienter i alle forsøg havde ingen tegn på radikulopati eller spinal stenose.
Undersøg CLBP-1
To hundrede seksogtredive voksne patienter (N=115 på CYMBALTA 40 mg, N=121 på placebo) blev indskrevet og 182 (77 %) gennemførte en 13-ugers behandlingsfase. Efter 7 ugers behandling fik CYMBALTA-behandlede patienter med mindre end 30 % reduktion i den gennemsnitlige daglige smerte, og som var i stand til at tolerere 60 mg én gang dagligt, deres CYMBALTA-dosis på en dobbeltblindet måde øget til 120 mg én gang dagligt. resten af retssagen. Patienterne havde en gennemsnitlig baseline smertevurdering på 6 på en numerisk vurderingsskala fra 0 (ingen smerte) til 10 (værst mulig smerte). Efter 13 ugers behandling havde patienter, der tog CYMBALTA 60-120 mg dagligt, en signifikant større smertereduktion sammenlignet med patienter, der fik placebo. Randomisering blev stratificeret efter patienternes baseline NSAID-brugsstatus. Undergruppeanalyser indikerede ikke, at der var forskelle i behandlingsresultater som funktion af NSAID-brug.
Undersøg CLBP-2
Fire hundrede og fire patienter blev randomiseret til at modtage faste doser af CYMBALTA 60 mg dagligt eller en matchende placebo (N=59 på CYMBALTA 20 mg, N=116 på CYMBALTA 60 mg, N=112 på CYMBALTA 120 mg, N=117 på placebo) og 267 (66%) fuldførte hele forsøget på 13 uger. Efter 13 ugers behandling viste ingen af de tre CYMBALTA 30 mg doser en statistisk signifikant forskel i smertereduktion sammenlignet med placebo.
Undersøg CLBP-3
Fire hundrede og én patienter blev randomiseret til at modtage faste doser af CYMBALTA 60 mg dagligt eller placebo (N=198 på CYMBALTA 20 mg, N=203 på placebo), og 303 (76 %) fuldførte forsøget. Patienterne havde en gennemsnitlig baseline smertevurdering på 6 på en numerisk vurderingsskala fra 0 (ingen smerte) til 10 (værst mulig smerte). Efter 12 ugers behandling havde patienter, der tog CYMBALTA 60 mg dagligt, signifikant større smertereduktion sammenlignet med patienter, der fik placebo.
For forskellige grader af forbedring af smerte fra baseline til undersøgelsens endepunkt viser figur 8 og 9 andelen af patienter i undersøgelserne CLBP-1 og CLBP-3, der opnår den grad af forbedring, henholdsvis. Tallene er kumulative, således at patienter, hvis ændring fra baseline er f.eks. 50 %, også er inkluderet ved alle forbedringsniveauer under 50 %. Patienter, der ikke fuldførte forsøget, fik tildelt værdien 0 % forbedring.
Figur 8: Procentdel af voksne patienter med CLBP, der opnår forskellige niveauer af smertelindring målt ved 24 timers gennemsnitlig smertesværhedsgrad (studie CLBP-1)
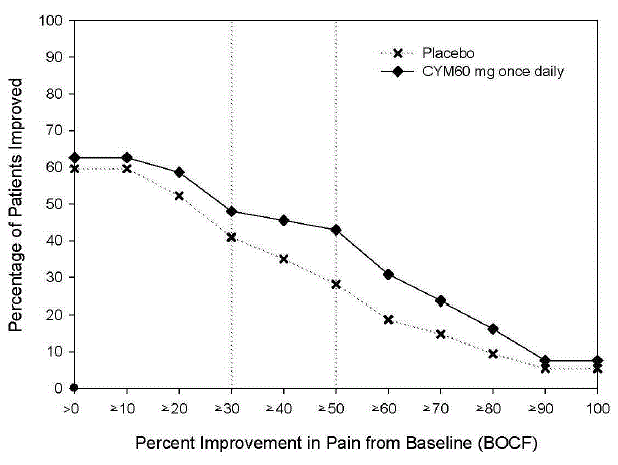
Figur 9: Procentdel af voksne patienter med CLBP, der opnår forskellige niveauer af smertelindring målt ved 24 timers gennemsnitlig smertesværhedsgrad (studie CLBP-3)
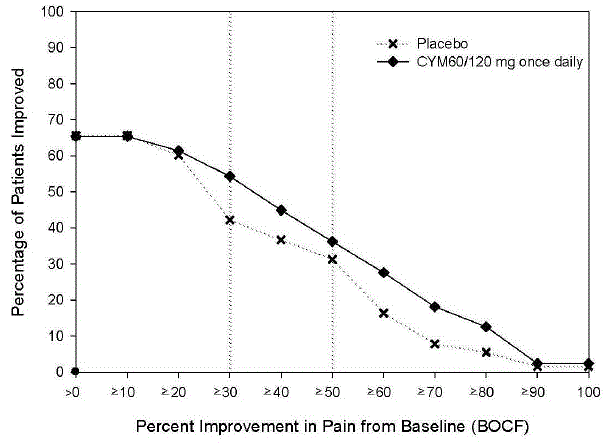
Forsøg med kroniske smerter på grund af slidgigt hos voksne
Virkningen af CYMBALTA ved kroniske smerter på grund af slidgigt (OA) hos voksne blev vurderet i 2 dobbeltblindede, placebokontrollerede, randomiserede kliniske forsøg af 13 ugers varighed (studie OA-1 og undersøgelse OA-2). Alle patienter i begge forsøg opfyldte de kliniske og radiografiske ACR-kriterier for klassificering af idiopatisk OA i knæet. Randomisering blev stratificeret efter patienternes baseline NSAID-brugsstatus.
Patienter tildelt CYMBALTA startede behandlingen i begge forsøg med en dosis på 30 mg én gang dagligt i en uge. Efter den første uge blev dosis af CYMBALTA øget til 60 mg én gang dagligt. Efter 7 ugers behandling med CYMBALTA 60 mg én gang dagligt, i undersøgelse OA-1 patienter med suboptimalt respons på behandlingen (
Undersøg OA-1
To hundrede og seksoghalvtreds patienter (N=128 på CYMBALTA 30 mg, N=128 på placebo) indrullerede og 204 (80 %) fuldførte forsøget. Patienterne havde en gennemsnitlig baseline smertevurdering på 6 på en numerisk vurderingsskala fra 0 (ingen smerte) til 10 (værst mulig smerte). Efter 13 ugers behandling havde patienter, der tog CYMBALTA 20 mg, signifikant større smertereduktion end patienter, der fik placebo. Undergruppeanalyser indikerede ikke, at der var forskelle i behandlingsresultater som funktion af NSAID-brug.
Undersøgelse OA-2
To hundrede enogtredive patienter (N=111 på CYMBALTA 30 mg, N=120 på placebo) indrullerede og 173 (75 %) fuldførte forsøget. Patienterne havde en gennemsnitlig baseline smerte på 6 på en numerisk vurderingsskala fra 0 (ingen smerte) til 10 (værst mulig smerte). Efter 13 ugers behandling viste patienter, der tog CYMBALTA 20 mg, ikke en signifikant større smertereduktion end patienter, der fik placebo.
undersøgelse OA-1, for forskellige grader af forbedring af smerte fra baseline til undersøgelsesendepunkt, viser figur 10 fraktionen af patienter, der opnår den grad af forbedring. Tallet er kumulativt, således at patienter, hvis ændring fra baseline er f.eks. 50 %, også inkluderes ved alle forbedringsniveauer under 50 %. Patienter, der ikke fuldførte forsøget, fik tildelt værdien 0 % forbedring.
Figur 10: Procentdel af voksne patienter med OA, der opnår forskellige niveauer af smertelindring målt ved 24-timers gennemsnitlig smertesværhedsgrad (undersøgelse OA-1)
PATIENTOPLYSNINGER
Cymbalta® [sim-BALL-tah] (duloxetin kapsler med forsinket frigivelse)
Læs denne medicinvejledning, før du begynder at tage Cymbalta®, og hver gang du får en genopfyldning. Der kan være nye oplysninger. Disse oplysninger træder ikke i stedet for at tale med din sundhedsplejerske om din medicinske tilstand eller behandling.
Tal med din sundhedsplejerske om:
- alle risici og fordele ved behandling med antidepressiv medicin
- alle behandlingsvalg for depression eller anden alvorlig psykisk sygdom
Hvad er den vigtigste information, jeg bør vide om antidepressiv medicin, depression, andre alvorlige psykiske sygdomme og selvmordstanker eller -handlinger?
- Vær meget opmærksom på ændringer i humør, adfærd, handlinger, tanker eller følelser, især pludselige ændringer. Dette er meget vigtigt, når en antidepressiv medicin påbegyndes, eller når dosis ændres.
- Ring med det samme til din sundhedsudbyder for at rapportere nye eller pludselige ændringer i humør, adfærd, tanker eller følelser.
- Hold alle opfølgende besøg hos din sundhedsplejerske som planlagt. Ring til din sundhedsplejerske mellem besøgene efter behov, især hvis du har bekymringer om symptomer.
Ring til din læge med det samme, hvis du har nogle af følgende symptomer eller følelser, især hvis de er nye, værre eller bekymrer dig. I nødstilfælde skal du ringe til 911.
- forsøg på at begå selvmord
- handler på farlige impulser
- opfører sig aggressivt, er vred eller voldelig
- tanker om selvmord eller døende
- ny eller værre depression
- ny eller værre angst
- Angstanfald
- føler sig meget ophidset eller rastløs
- ny eller værre irritabilitet
- problemer med at sove
- en ekstrem stigning i aktivitet eller tale (mani)
- andre usædvanlige ændringer i adfærd eller humør
Hvad skal jeg ellers vide om antidepressiv medicin?
- Stop aldrig en antidepressiv medicin uden først at tale med en læge. Hvis du pludselig stopper en antidepressiv medicin, kan det forårsage andre symptomer.
- Antidepressiva er medicin, der bruges til at behandle depression og andre sygdomme. Det er vigtigt at diskutere alle risiciene ved behandling af depression og også risiciene ved ikke at behandle den. Patienter bør diskutere alle behandlingsvalg med din læge, ikke kun brugen af antidepressiva.
- Antidepressiv medicin har andre bivirkninger. Tal med din sundhedsplejerske om bivirkningerne af den medicin, der er ordineret til dig eller dit familiemedlem.
- Antidepressiv medicin kan interagere med anden medicin. Kend alle de lægemidler, du eller dit familiemedlem tager. Hold en liste over alle lægemidler for at vise din sundhedsudbyder. Start ikke med ny medicin uden først at tjekke med din læge.
Hvad er Cymbalta 60mg?
Cymbalta er en receptpligtig medicin, der bruges til at behandle en bestemt type depression kaldet Major Depressive Disorder (MDD). Cymbalta 20mg tilhører en klasse af lægemidler kendt som SNRI'er (orserotonin-norepinephrin-genoptagelseshæmmere).
Cymbalta 60mg bruges også til at behandle eller håndtere:
- Generaliseret angstlidelse (GAD)
- Diabetisk perifer neuropati (DPNP)
- Fibromyalgi (FM)
- Kroniske muskuloskeletale smerter
Hvem bør ikke tage Cymbalta?
Tag ikke Cymbalta 20 mg, hvis du:
- tage en monoaminoxidasehæmmer (MAOI). Spørg din læge eller apoteket, hvis du ikke er sikker på, om du tager en MAO-hæmmer, inklusive antibiotikum linezolid eller intravenøs methylenblåt.
- Tag ikke en MAO-hæmmer inden for 5 dage efter at have stoppet Cymbalta, medmindre din sundhedsplejerske har bedt det om det.
- Start ikke med Cymbalta, hvis du stoppede med at tage en MAO-hæmmer inden for de sidste 14 dage, medmindre din læge har bedt dig om det.
Personer, der tager Cymbalta 60mg tæt på en MAO-hæmmer, kan have et alvorligt problem kaldet serotoninsyndrom (se "Hvad er de mulige bivirkninger af Cymbalta 60mg?").
Hvad skal jeg fortælle min sundhedsplejerske, før jeg tager Cymbalta?
Inden du starter Cymbalta, skal du fortælle din læge, hvis du:
- har hjerteproblemer eller forhøjet blodtryk
- har diabetes (Cymbalta 40mg-behandling gør det sværere for nogle mennesker med diabetes at kontrollere deres blodsukker)
- har leverproblemer
- har nyreproblemer
- har glaukom
- har eller haft anfald eller kramper
- har bipolar lidelse eller mani
- har lave natriumniveauer i dit blod
- har forsinket mavetømning
- har eller haft blødningsproblemer
- er gravid eller planlægger at blive gravid. Cymbalta kan skade dit ufødte barn. Tal med din læge om risikoen for dit ufødte barn, hvis du tager Cymbalta under graviditet.
- Fortæl din læge med det samme, hvis du bliver gravid eller tror, du er gravid under behandling med Cymbalta.
- Hvis du bliver gravid, mens du tager Cymbalta 30mg, skal du tale med din læge om tilmelding til Cymbalta Pregnancy Registry. Du kan tilmelde dig ved at ringe til 1-866-8146975 eller ved at besøge www.cymbalta 40mgpregnancyregistry.com. Formålet med dette register er at overvåge graviditetsresultaterne hos kvinder, der er blevet behandlet med Cymbalta på et hvilket som helst tidspunkt under graviditeten.
- ammer eller planlægger at amme. Cymbalta går over i din modermælk og kan skade din baby. Tal med din læge om den bedste måde at fodre din baby på, mens du tager Cymbalta.
Fortæl din læge om al den medicin, du tager, herunder receptpligtig og håndkøbsmedicin, vitaminer og naturlægemidler. Cymbalta og nogle lægemidler kan interagere med hinanden, virker muligvis ikke så godt eller kan forårsage alvorlige bivirkninger.
Fortæl især din læge, hvis du tager:
- triptaner til behandling af migrænehovedpine
- medicin, der bruges til at behandle humør, angst, psykotiske eller tankeforstyrrelser, herunder tricykliske, lithium, buspiron, SSRI, SNRI eller MAO-hæmmere
- tramadol og fentanyl
- amfetamin
- cimetidin
- antibiotika ciprofloxacin, enoxacin
- medicin til behandling af uregelmæssig hjertefrekvens (såsom propafenon, flecainid, quinidin)
- theophyllin
- det blodfortyndende warfarin (Coumadin, Jantoven)
- ikke-steroide antiinflammatoriske lægemidler (NSAID) (som ibuprofen, naproxen eller aspirin).
- håndkøb kosttilskud såsom tryptofan eller perikon
- thioridazin (Mellaril). Mellaril sammen med Cymbalta kan forårsage alvorlige hjerterytmeproblemer eller pludselig død.
Spørg din sundhedsudbyder om en liste over disse lægemidler, hvis du ikke er sikker.
Tag ikke Cymbalta sammen med anden medicin, der indeholder duloxetin.
Hvordan skal jeg tage Cymbalta 60mg?
- Tag Cymbalta nøjagtigt som din læge fortæller dig at tage det. Din sundhedsplejerske skal muligvis ændre dosis af Cymbalta 20 mg, indtil den er den rigtige dosis for dig.
- Slug Cymbalta hel. Cymbalta må ikke tygges eller knuses.
- Åbn ikke kapslen og drys ikke på mad eller bland med væske. Åbning af kapslen kan påvirke, hvor godt Cymbalta virker.
- Cymbalta kan tages med eller uden mad.
- Hvis du glemmer en dosis af Cymbalta 30 mg, skal du tage den glemte dosis, så snart du husker det. Hvis det næsten er tid til næste dosis, skal du springe den glemte dosis over og tage din næste dosis på det normale tidspunkt. Tag ikke to doser Cymbalta 30 mg på samme tid.
- Hvis du tager for meget Cymbalta, skal du straks ringe til din læge eller giftkontrolcenter på 1800-222-1222 eller få akut behandling.
- Når du skifter fra et andet antidepressivum til Cymbalta, vil din læge måske sænke dosis af det indledende antidepressivum først for potentielt at undgå bivirkninger.
Hvad skal jeg undgå, mens jeg tager Cymbalta?
- Cymbalta kan forårsage søvnighed eller kan påvirke din evne til at træffe beslutninger, tænke klart eller reagere hurtigt. Du bør ikke køre bil, betjene tunge maskiner eller udføre andre farlige aktiviteter, før du ved, hvordan Cymbalta påvirker dig.
- Brug af Cymbalta samtidig med stort alkoholindtag kan være forbundet med alvorlig leverskade. Undgå kraftigt alkoholforbrug, mens du tager Cymbalta.
Hvad er de mulige bivirkninger af Cymbalta?
Cymbalta 30mg kan forårsage alvorlige bivirkninger, herunder: Se "Hvad er den vigtigste information, jeg bør vide om Cymbalta?"
Almindelige mulige bivirkninger hos personer, der tager Cymbalta 20mg omfatter:
Symptomer hos mænd kan omfatte:
Symptomer hos kvinder kan omfatte:
Tal med din sundhedsplejerske, hvis du udvikler ændringer i din seksuelle funktion, eller hvis du har spørgsmål eller bekymringer om seksuelle problemer under behandling med CYMBALTA. Der kan være behandlinger, som din sundhedsplejerske kan foreslå.
- kløe
- højre øvre mavesmerter
- mørk urin
- gul hud eller øjne
- forstørret lever
- øgede leverenzymer
- øge dit blodtryk.
- sænke dit blodtryk, når du står og forårsage svimmelhed eller besvimelse, mest når du starter med Cymbalta, eller når du øger dosis.
- øge risikoen for fald, især hos ældre.
- agitation, hallucinationer, koma eller andre ændringer i mental status
- koordinationsproblemer eller muskeltrækninger (overaktive reflekser)
- hjerteslag, højt eller lavt blodtryk
- svedtendens eller feber
- kvalme, opkastning eller diarré
- muskelstivhed
- svimmelhed
- rødmen
- rysten
- anfald
- angst
- irritabilitet
- træthed eller problemer med at sove
- hovedpine
- svedtendens
- svimmelhed
- elektrisk stød-lignende fornemmelser
- opkastning eller kvalme
- diarré
- stærkt øget energi
- svære søvnbesvær
- race tanker
- hensynsløs opførsel
- usædvanligt store ideer
- overdreven lykke eller irritabilitet
- taler mere eller hurtigere end normalt
Kun nogle mennesker er i fare for disse problemer. Du ønsker måske at gennemgå en øjenundersøgelse for at se, om du er i fare, og modtage forebyggende behandling, hvis du er det.
- øjensmerter
- ændringer i synet
- hævelse eller rødme i eller omkring øjet
- hovedpine
- svaghed eller følelse ustabil
- forvirring, problemer med at koncentrere sig eller tænke eller hukommelsesproblemer
- øget uringennemstrømning
- ude af stand til at tisse
- forsinket udløsning eller manglende evne til at få en udløsning
- nedsat sexlyst
- problemer med at få eller bevare erektion
- nedsat sexlyst
- forsinket orgasme eller manglende evne til at få orgasme
De mest almindelige bivirkninger af Cymbalta 20mg omfatter:
- kvalme
- tør mund
- søvnighed
- træthed
- forstoppelse
- mistet appetiten
- øget svedtendens
- svimmelhed
Almindelige mulige bivirkninger hos børn og unge, der tager Cymbalta 20mg omfatter:
- kvalme
- nedsat vægt
- svimmelhed
Bivirkninger hos voksne kan også forekomme hos børn og unge, der tager Cymbalta. Børn og unge bør have højde og vægt overvåget under behandlingen.
Fortæl din læge, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Cymbalta. For mere information, spørg din læge eller apotek.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til 1800-FDA-1088.
Hvordan skal jeg opbevare Cymbalta 40mg?
Opbevar Cymbalta ved stuetemperatur mellem 68°F til 77°F (20°C til 25°C).
Opbevar Cymbalta og al medicin utilgængeligt for børn.
Generel information om sikker og effektiv brug af Cymbalta.
Medicin er nogle gange ordineret til andre formål end dem, der er anført i en medicinvejledning. Brug ikke Cymbalta til en tilstand, som den ikke er ordineret til. Giv ikke Cymbalta 20 mg til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Denne medicinvejledning opsummerer de vigtigste oplysninger om Cymbalta. Hvis du vil have mere information, så tal med din sundhedsplejerske. Du kan bede din sundhedsudbyder på apoteket om oplysninger om Cymbalta, som er skrevet til sundhedspersonale.
For mere information, ring på 1-800-545-5979.
Hvad er ingredienserne i Cymbalta 30mg?
Aktiv ingrediens: duloxetinhydrochlorid
Inaktive ingredienser:
FD&C Blue No. 2, gelatine, hypromellose, hydroxypropylmethylcelluloseacetatsuccinat, natriumlaurylsulfat, saccharose, sukkerkugler, talkum, titaniumdioxid og triethylcitrat. 20 og 60 mg kapslerne indeholder også gul jernoxid.
Denne medicinvejledning er godkendt af US Food and Drug Administration.
