Effexor 37.5mg, 75mg Venlafaxine Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
PATIENTOPLYSNINGER
Effexor (venlafaxin) (ven-la-fax-een) Tabletter, USP
Læs medicinvejledningen, der følger med venlafaxintabletter, USP, før du begynder at tage det, og hver gang du får en refill. Der kan være nye oplysninger. Denne medicinvejledning træder ikke i stedet for at tale med din læge om din medicinske tilstand eller behandling. Tal med din sundhedsplejerske, hvis der er noget, du ikke forstår eller ønsker at lære mere om.
Hvad er den vigtigste information, jeg bør vide om Venlafaxin Tabletter, USP?
Venlafaxin-tabletter, USP og andre antidepressive lægemidler kan forårsage alvorlige bivirkninger, herunder:
1. Selvmordstanker eller -handlinger:
- Venlafaxin-tabletter, USP og andre antidepressive lægemidler kan øge selvmordstanker eller -handlinger hos nogle børn, teenagere eller unge voksne inden for de første måneder af behandlingen, eller når dosis ændres.
- Depression eller andre alvorlige psykiske sygdomme er de vigtigste årsager til selvmordstanker eller -handlinger.
- Hold øje med disse ændringer, og ring til din læge med det samme, hvis du bemærker:
- Nye eller pludselige ændringer i humør, adfærd, handlinger, tanker eller følelser, især hvis de er alvorlige.
- Vær særlig opmærksom på sådanne ændringer, når venlafaxin tabletter, USP startes, eller når dosis ændres.
Hold alle opfølgningsbesøg hos din læge, og ring mellem besøgene, hvis du er bekymret for symptomer.
Ring til din læge med det samme, hvis du har nogle af følgende symptomer, eller ring til 911, hvis en nødsituation, især hvis de er nye, værre eller bekymrer dig:
- forsøg på at begå selvmord
- handler på farlige impulser
- opfører sig aggressivt eller voldeligt
- tanker om selvmord eller døende
- ny eller værre depression
- nye eller værre angst- eller panikanfald
- føler sig ophidset, rastløs, vred eller irritabel
- problemer med at sove
- øget aktivitet eller tale mere end hvad der er normalt for dig
- andre usædvanlige ændringer i adfærd eller humør
Ring til din læge med det samme, hvis du har nogle af følgende symptomer, eller ring til 911, hvis en nødsituation. Venlafaxin tabletter, USP kan være forbundet med disse alvorlige bivirkninger:
2. Serotoninsyndrom
Denne tilstand kan være livstruende og kan omfatte:
- agitation, hallucinationer, koma eller andre ændringer i mental status
- koordinationsproblemer eller muskeltrækninger (overaktive reflekser)
- hjerteslag, højt eller lavt blodtryk
- svedtendens eller feber
- kvalme, opkastning eller diarré
- muskelstivhed
3. Ændringer i blodtrykket. Venlafaxin tabletter, USP kan:
- øge dit blodtryk. Kontroller højt blodtryk, før behandlingen påbegyndes, og overvåg blodtrykket regelmæssigt
4. Forstørrede pupiller (mydriasis).
5. Angst og søvnløshed.
6. Ændringer i appetit eller vægt.
- børn og unge bør have højde og vægt overvåget under behandlingen
7. Maniske/hypomane episoder:
- stærkt øget energi
- svære søvnbesvær
- race tanker
- hensynsløs opførsel
- usædvanligt store ideer
- overdreven lykke eller irritabilitet
- taler mere eller hurtigere end normalt
8. Lavt saltniveau (natrium) i blodet.
Ældre mennesker kan have større risiko for dette. Symptomer kan omfatte:
- hovedpine
- svaghed eller følelse ustabil
- forvirring, problemer med at koncentrere sig eller tænke eller hukommelsesproblemer
9. Anfald eller kramper.
10. Unormal blødning: venlafaxintabletter, USP og anden antidepressiv medicin kan øge din risiko for blødning eller blå mærker, især hvis du tager blodfortyndende warfarin (Coumadin®, Jantoven®), et ikke-steroidt antiinflammatorisk lægemiddel (NSAID'er, som f.eks. ibuprofen eller naproxen) eller aspirin.
11. Forhøjet kolesterol.
12. Lungesygdom og lungebetændelse: venlafaxintabletter, USP kan forårsage sjældne lungeproblemer. Symptomerne omfatter:
- forværring af åndenød
- hoste
- ubehag i brystet
13. Alvorlige allergiske reaktioner:
- vejrtrækningsbesvær
- hævelse af ansigt, tunge, øjne eller mund
- udslæt, kløende nældefeber (nældefeber) eller vabler, alene eller med feber eller ledsmerter
14. Visuelle problemer:
- øjensmerter
- ændringer i synet
- hævelse eller rødme i eller omkring øjet
Kun nogle mennesker er i fare for disse problemer. Det kan være en god idé at gennemgå en øjenundersøgelse for at se, om du er i fare, og få forebyggende behandling, hvis du er det.
Stop ikke Venlafaxine Tablets, USP uden først at tale med din læge. Stoppe venlafaxintabletter, USP for hurtigt eller skift fra et andet antidepressivum for hurtigt kan forårsage alvorlige symptomer, herunder:
- angst, irritabilitet
- føler sig træt, rastløs eller søvnproblemer
- hovedpine, svedtendens, svimmelhed
- elektrisk stød-lignende fornemmelser, rysten, forvirring, mareridt
- opkastning, kvalme, diarré
Hvad er Venlafaxin Tabletter, USP?
Venlafaxin tabletter, USP er en receptpligtig medicin, der bruges til at behandle depression. Det er vigtigt at tale med din sundhedsplejerske om risikoen ved at behandle depression og også risikoen ved ikke at behandle den. Du bør diskutere alle behandlingsvalg med din læge.
Tal med din læge, hvis du ikke tror, at din tilstand bliver bedre med venlafaxin-tabletter, USP-behandling.
Hvem bør ikke tage Venlafaxin Tabletter, USP?
- Tag ikke venlafaxin tabletter, USP, hvis du:
- er allergisk over for venlafaxintabletter, USP eller nogen af indholdsstofferne i venlafaxintabletter, USP. Se slutningen af denne medicinvejledning for en komplet liste over ingredienser i venlafaxintabletter, USP.
- har ukontrolleret snævervinklet glaukom
- tage en monoaminoxidasehæmmer (MAOI). Spørg din læge eller apotekspersonalet, hvis du ikke er sikker på, om du tager en MAO-hæmmer, inklusive antibiotikummet linezolid.
- Tag ikke en MAO-hæmmer inden for 7 dage efter at have stoppet venlafaxin-tabletter, USP, medmindre din læge har bedt det om det.
- Start ikke med venlafaxin tabletter, USP, hvis du stoppede med at tage en MAO-hæmmer inden for de sidste 2 uger, medmindre din læge har bedt dig om det.
Personer, der tager Venlafaxin Tabletter, USP tæt på en MAO-hæmmer, kan have alvorlige eller endda livstruende bivirkninger. Få lægehjælp med det samme, hvis du har nogle af disse symptomer:
- høj feber
- ukontrollerede muskelspasmer
- stive muskler
- hurtige ændringer i hjertefrekvens eller blodtryk
- forvirring
- tab af bevidsthed (besvimelse)
Hvad skal jeg fortælle min sundhedsplejerske, før jeg tager Venlafaxin Tablets, USP? Spørg hvis du ikke er sikker.
Inden du starter med venlafaxin tabletter, USP, skal du fortælle din læge, hvis du:
- Tager visse lægemidler såsom:
- Medicin til behandling af migrænehovedpine såsom:
- triptaner
- Medicin, der bruges til at behandle humør, angst, psykotiske eller tankeforstyrrelser, såsom:
- tricykliske antidepressiva
- lithium
- SSRI'er
- SNRI'er
- antipsykotiske lægemidler
- Medicin, der bruges til at behandle smerter, såsom:
- tramadol
- Medicin, der bruges til at fortynde dit blod, såsom:
- warfarin
- Medicin til behandling af halsbrand såsom:
- Cimetidin
- Håndkøbsmedicin eller kosttilskud såsom:
- Aspirin eller andre NSAID'er
- Tryptofan
- St. John's Wort
- har hjerteproblemer
- har diabetes
- har leverproblemer
- har nyreproblemer
- har problemer med skjoldbruskkirtlen
- har glaukom
- har eller haft anfald eller kramper
- har bipolar lidelse eller mani
- har lave natriumniveauer i dit blod
- har forhøjet blodtryk
- har højt kolesteroltal
- har eller haft blødningsproblemer
- er gravid eller planlægger at blive gravid. Det vides ikke, om venlafaxin tabletter, USP vil skade dit ufødte barn. Tal med din læge om fordelene og risiciene ved behandling af depression under graviditet
- ammer eller planlægger at amme. Nogle venlafaxintabletter, USP kan passere over i din modermælk. Tal med din sundhedsplejerske om den bedste måde at fodre din baby på, mens du tager venlafaxin-tabletter, USP.
Fortæl din sundhedsudbyder om al den medicin, du tager, inklusive receptpligtig og ikke-receptpligtig medicin, vitaminer og naturlægemidler. Venlafaxin-tabletter, USP og nogle lægemidler kan interagere med hinanden, virker muligvis ikke så godt eller kan forårsage alvorlige bivirkninger.
Din læge eller apotek kan fortælle dig, om det er sikkert at tage venlafaxin tabletter, USP sammen med din anden medicin. Du må ikke starte eller stoppe nogen form for medicin, mens du tager venlafaxin tabletter, USP uden først at tale med din læge.
Hvis du tager venlafaxin tabletter, USP, bør du ikke tage anden medicin, der indeholder (venlafaxin), herunder: venlafaxin HCl.
Hvordan skal jeg tage Venlafaxin Tabletter, USP?
- Tag venlafaxin tabletter, USP nøjagtigt som foreskrevet. Din sundhedsplejerske skal muligvis ændre dosis af venlafaxintabletter, USP, indtil det er den rigtige dosis for dig.
- Venlafaxin tabletter, USP skal tages sammen med mad.
- Hvis du glemmer en dosis venlafaxintabletter, USP, skal du tage den glemte dosis, så snart du husker det. Hvis det næsten er tid til næste dosis, skal du springe den glemte dosis over og tage din næste dosis på det normale tidspunkt. Tag ikke to doser venlafaxintabletter, USP på samme tid.
- Hvis du tager for meget venlafaxin-tabletter, USP, skal du straks ringe til din læge eller giftkontrolcenter eller få akut behandling.
- Når du skifter fra et andet antidepressivum til venlafaxin-tabletter, vil din læge muligvis sænke dosis af det initiale antidepressivum først for at undgå bivirkninger
Hvad skal jeg undgå, mens jeg tager Venlafaxin Tabletter, USP?
Venlafaxin tabletter, USP kan forårsage søvnighed eller kan påvirke din evne til at træffe beslutninger, tænke klart eller reagere hurtigt.
Du bør ikke køre bil, betjene tunge maskiner eller udføre andre farlige aktiviteter, før du ved, hvordan venlafaxin tabletter, USP påvirker dig. Drik ikke alkohol, mens du bruger venlafaxintabletter, USP.
Hvad er de mulige bivirkninger af Venlafaxin Tabletter, USP?
Venlafaxin tabletter, USP kan forårsage alvorlige bivirkninger, herunder:
- Se "Hvad er den vigtigste information, jeg bør vide om Venlafaxin Tablets, USP?"
- Forhøjet kolesterol - få dit kolesterol tjekket regelmæssigt
- Nyfødte, hvis mødre tager venlafaxin-tabletter, USP i tredje trimester, kan have problemer lige efter fødslen, herunder:
- problemer med at spise og trække vejret
- anfald
- rysten, nervøsitet eller konstant gråd
- Snævervinklet glaukom/forstørrede pupiller.
Tjek øjentrykket regelmæssigt, hvis du:
- har en historie med øget øjentryk
- er i risiko for visse typer grøn stær
Almindelige mulige bivirkninger hos personer, der tager venlafaxin tabletter, USP inkluderer:
usædvanlige drømme
- seksuelle problemer
- tab af appetit, forstoppelse, diarré, kvalme eller opkastning eller mundtørhed
- føler sig træt, træt eller alt for søvnig
- ændring i søvnvaner, søvnproblemer
- gaber
- rysten eller rysten
- svimmelhed, sløret syn
- svedtendens
- føler sig angst, nervøs eller nervøs
- hovedpine
- stigning i puls
Fortæl din læge, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af venlafaxin tabletter, USP.
For mere information, spørg din læge eller apotek.
RING DIN LÆGE FOR LÆGE RÅDGIVNING OM BIVIRKNINGER. DU KAN RAPPORTERE BIVIRKNINGER TIL FDA PÅ 1-800-FDA-1088.
Hvordan skal jeg opbevare Venlafaxin Tabletter, USP?
- Opbevares ved 20° til 25°C (68° til 77°F) tilladte udflugter 15° til 30°C (59° til 86°F) [Se USP kontrolleret rumtemperatur ].
- Opbevar velafaxin tabletter, USP på et tørt sted.
Opbevar Venlafaxin Tabletter, USP og al medicin utilgængeligt for børn.
Generel information om venlafaxintabletter, USP Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en medicinvejledning. Brug ikke venlafaxin tabletter, USP til en tilstand, som det ikke er ordineret til. Giv ikke venlafaxin tabletter, USP til andre mennesker, selvom de har samme tilstand. Det kan skade dem.
Denne medicinvejledning opsummerer de vigtigste oplysninger om venlafaxintabletter, USP. Hvis du vil have mere information, så tal med din sundhedsplejerske. Du kan bede din læge eller apotek om oplysninger om venlafaxin-tabletter, USP, der er skrevet til sundhedspersonale.
Kontakt Sun Pharmaceutical Industries, Inc. på 1-800-818-4555 for at rapportere FORSINKTE BIVIRKNINGER.
Hvad er ingredienserne i Venlafaxin Tablets, USP?
Aktiv ingrediens: (venlafaxin)
Inaktive ingredienser:
- Tabletter: mikrokrystallinsk cellulose, lactosemonohydrat, prægelatineret stivelse, natriumstivelsesglykolat, rød jernoxid, gul jernoxid, kolloid siliciumdioxid og magnesiumstearat
Denne medicinvejledning er godkendt af US Food and Drug Administration for alle antidepressiva.
INDIKATIONER
Større depressiv lidelse
Effexor XR (venlafaxinhydrochlorid) kapsler med forlænget frigivelse er indiceret til behandling af svær depressiv lidelse (MDD). Effekten blev fastslået i tre kortsigtede (4, 8 og 12 uger) og to langsigtede vedligeholdelsesforsøg.
Generaliseret angstlidelse
Effexor XR er indiceret til behandling af generaliseret angstlidelse (GAD). Effekten blev fastslået i to 8-ugers og to 26-ugers placebokontrollerede forsøg.
Social angst
Effexor XR er indiceret til behandling af social angstlidelse (SAD), også kendt som social fobi. Effekten blev fastslået i fire 12-ugers og et 26-ugers, placebo-kontrollerede forsøg.
Paniklidelse
Effexor XR er indiceret til behandling af panikangst (PD), med eller uden agorafobi. Effekten blev fastslået i to 12-ugers placebokontrollerede forsøg.
DOSERING OG ADMINISTRATION
Effexor 37,5 mg XR bør administreres i en enkelt dosis sammen med mad, enten om morgenen eller om aftenen på omtrent samme tidspunkt hver dag [se KLINISK FARMAKOLOGI ]. Hver kapsel skal sluges hel med væske og ikke deles, knuses, tygges eller anbringes i vand, eller den kan indgives ved forsigtigt at åbne kapslen og drysse hele indholdet på en skefuld æblemos. Denne medicin/fødevareblanding skal sluges øjeblikkeligt uden at tygge og efterfølges med et glas vand for at sikre fuldstændig synkning af pellets (sfæroider).
Større depressiv lidelse
For de fleste patienter er den anbefalede startdosis for Effexor 37,5 mg XR 75 mg dagligt, administreret i en enkelt dosis. For nogle patienter kan det være ønskeligt at starte med 37,5 mg pr. dag i 4 til 7 dage for at give nye patienter mulighed for at tilpasse sig medicinen, før de øges til 75 mg pr. dag. Patienter, der ikke reagerer på den indledende dosis på 75 mg dagligt, kan have gavn af dosisstigninger til maksimalt 225 mg dagligt. Dosisforøgelser bør ske i trin på op til 75 mg dagligt efter behov og bør foretages med intervaller på ikke mindre end 4 dage, da steady-state plasmaniveauer af venlafaxin og dets hovedmetabolitter opnås hos de fleste patienter på dag 4 [se KLINISK FARMAKOLOGI ]. I de kliniske undersøgelser, der fastslår effektivitet, var opadtitrering tilladt med intervaller på 2 uger eller mere.
Det skal bemærkes, at mens den maksimalt anbefalede dosis for moderat deprimerede ambulante patienter også er 225 mg dagligt for Effexor (øjeblikkelig frigivelse), reagerede mere alvorligt deprimerede indlagte patienter i en undersøgelse af udviklingsprogrammet for det pågældende produkt på en gennemsnitlig dosis på 350 mg pr. dag (interval fra 150 til 375 mg pr. dag). Hvorvidt højere doser af Effexor 37,5 mg XR er nødvendige for mere alvorligt deprimerede patienter er ukendt; dog er erfaringen med Effexor 75 mg XR doser højere end 225 mg dagligt meget begrænset.
Generaliseret angstlidelse
For de fleste patienter er den anbefalede startdosis for Effexor XR 75 mg dagligt givet i en enkelt dosis. For nogle patienter kan det være ønskeligt at starte med 37,5 mg pr. dag i 4 til 7 dage for at give nye patienter mulighed for at tilpasse sig medicinen, før de øges til 75 mg pr. dag. Patienter, der ikke reagerer på den indledende dosis på 75 mg dagligt, kan have gavn af dosisstigninger til maksimalt 225 mg dagligt. Dosisforøgelser bør ske i trin på op til 75 mg dagligt efter behov og bør foretages med intervaller på ikke mindre end 4 dage, da steady-state plasmaniveauer af venlafaxin og dets hovedmetabolitter opnås hos de fleste patienter på dag 4 [se KLINISK FARMAKOLOGI ].
Social angst (social fobi)
Den anbefalede dosis er 75 mg dagligt, indgivet i en enkelt dosis. Der var ingen evidens for, at højere doser giver nogen yderligere fordel.
Paniklidelse
Den anbefalede startdosis er 37,5 mg pr. dag af Effexor 75 mg XR i 7 dage. Patienter, der ikke reagerer på 75 mg dagligt, kan have gavn af dosisstigninger til maksimalt ca. 225 mg dagligt. Dosisforøgelser bør ske i trin på op til 75 mg dagligt efter behov og bør foretages med intervaller på ikke mindre end 7 dage.
Skift patient fra Effexor 37,5 mg tabletter
Deprimerede patienter, som i øjeblikket behandles med en terapeutisk dosis med Effexor (øjeblikkelig frigivelse), kan skiftes til Effexor 37,5 mg XR ved den nærmeste ækvivalente dosis (mg pr. dag), f.eks. 37,5 mg venlafaxin to gange dagligt til 75 mg Effexor 75 mg XR en gang dagligt. Individuelle dosisjusteringer kan dog være nødvendige.
Specifikke populationer
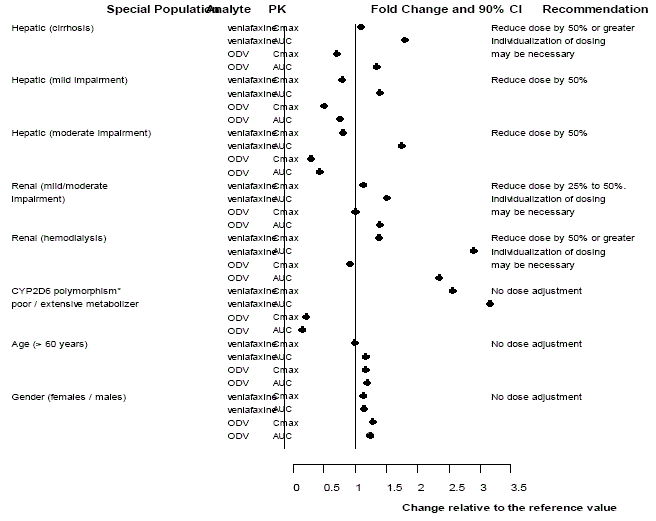
Patienter med nedsat leverfunktion
Den samlede daglige dosis bør reduceres med 50 % hos patienter med let (Child-Pugh=5-6) til moderat (Child-Pugh=7-9) nedsat leverfunktion. Hos patienter med svært nedsat leverfunktion (Child-Pugh=10-15) eller levercirrhose kan det være nødvendigt at reducere dosis med 50 % eller mere [se Brug i specifikke populationer ].
Patienter med nedsat nyrefunktion
Den samlede daglige dosis bør reduceres med 25 % til 50 % hos patienter med let (CLcr=60-89 ml/min) eller moderat (CLcr=30-59 ml/min) nyrefunktion. Hos patienter, der gennemgår hæmodialyse eller med alvorlig nyreinsufficiens (CLcr Brug i specifikke populationer ].
Vedligeholdelsesbehandling
Der er ingen dokumentation tilgængelig fra kontrollerede undersøgelser, der indikerer, hvor længe patienter med MDD, GAD, SAD eller PD skal behandles med Effexor 75mg XR.
Der er generelt enighed om, at akutte episoder med MDD kræver adskillige måneder eller længere med vedvarende farmakologisk terapi ud over respons på den akutte episode. Effexor XR/Effexor har vist fortsat respons i kliniske undersøgelser i op til 52 uger ved den samme dosis, som patienterne reagerede på under den indledende behandling [se Kliniske Studier ]. Det vides ikke, om den dosis af Effexor XR, der er nødvendig til vedligeholdelsesbehandling, er identisk med den dosis, der er nødvendig for at opnå et initialt respons. Patienter bør periodisk revurderes for at bestemme behovet for vedligeholdelsesbehandling og den passende dosis til en sådan behandling.
Hos patienter med GAD og SAD har Effexor 37,5 mg XR vist sig at være effektiv i 6-måneders kliniske undersøgelser. Behovet for fortsat medicinering hos patienter med GAD og SAD, som forbedres med Effexor XR-behandling, bør periodisk revurderes.
I et klinisk studie for PD oplevede patienter, der fortsatte med Effexor 75 mg XR i den samme dosis, som de reagerede på i løbet af de første 12 ugers behandling, en statistisk signifikant længere tid til tilbagefald end patienter randomiseret til placebo [se Kliniske Studier ]. Behovet for fortsat medicinering hos patienter med PD, som forbedres med Effexor XR-behandling, bør periodisk revurderes.
Afbrydelse af Effexor XR
En gradvis reduktion af dosis i stedet for pludseligt ophør anbefales, når behandlingen med Effexor 37,5 mg XR afbrydes. I kliniske undersøgelser med Effexor 37,5 mg XR blev nedtrapning opnået ved at reducere den daglige dosis med 75 mg med en uges intervaller. Individualisering af nedtrapning kan være nødvendig [se ADVARSLER OG FORHOLDSREGLER ]. Hos nogle patienter kan det være nødvendigt at seponere behandlingen over en periode på flere måneder.
At skifte patienter til eller fra en monoaminoxidasehæmmer (MAOI), beregnet til at behandle psykiatriske lidelser
Der bør gå mindst 14 dage mellem seponering af en MAO-hæmmer (beregnet til behandling af psykiatriske lidelser) og påbegyndelse af behandling med Effexor XR. Derudover bør der tillades mindst 7 dage efter ophør med Effexor XR, før man starter en MAO-hæmmer beregnet til behandling af psykiatriske lidelser [se KONTRAINDIKATIONER , ADVARSLER OG FORHOLDSREGLER , og DRUGSINTERAKTIONER ].
Brug af Effexor XR med andre MAO-hæmmere såsom Linezolid eller Intravenøs Methylene Blue
Start ikke Effexor 75mg XR hos en patient, der behandles med linezolid eller intravenøs methylenblåt, da der er en øget risiko for serotonergt syndrom. Hos en patient, som kræver mere akut behandling af en psykiatrisk tilstand, bør andre indgreb, herunder hospitalsindlæggelse overvejes [se KONTRAINDIKATIONER ].
nogle tilfælde kan en patient, der allerede får Effexor 37,5 mg XR-behandling, have behov for akut behandling med linezolid eller intravenøs methylenblåt. Hvis acceptable alternativer til linezolid eller intravenøs methylenblåt ikke er tilgængelige, og de potentielle fordele ved linezolid eller intravenøs methylenblåt behandling vurderes at opveje risikoen for serotonergt syndrom hos en bestemt patient, skal Effexor XR stoppes omgående, og linezolid eller intravenøs methylenblåt kan administreres. Overvåg patienten for symptomer på serotonergt syndrom i 7 dage eller indtil 24 timer efter den sidste dosis linezolid eller intravenøs methylenblåt, alt efter hvad der kommer først. Behandling med Effexor 75 mg XR kan genoptages 24 timer efter den sidste dosis linezolid eller intravenøs methylenblåt [se ADVARSLER OG FORHOLDSREGLER ].
Risikoen ved at administrere methylenblåt ad ikke-intravenøse veje (såsom orale tabletter eller ved lokal injektion) eller i intravenøse doser meget lavere end 1 mg/kg samtidig med Effexor XR er uklar. Lægen bør ikke desto mindre være opmærksom på muligheden for opståede symptomer på serotonergt syndrom ved sådan brug [se ADVARSLER OG FORHOLDSREGLER ].
HVORDAN LEVERET
Doseringsformer og styrker
Effexor 37,5 mg XR® (venlafaxinhydrochlorid) kapsler med forlænget frigivelse er tilgængelige i følgende styrker:
- 37,5 mg kapsler (grå hætte/fersken krop med "W" og "Effexor 75mg XR" på hætten og "37,5" på underdelen)
- 75 mg kapsler (fersken hætte og krop med "W" og "Effexor 37,5mg XR" på hætten og "75" på kroppen)
- 150 mg kapsler (mørk orange hætte og krop med "W" og "Effexor 75mg XR" på hætten og "150" på kroppen)
Opbevaring og håndtering
Effexor XR® (venlafaxinhydrochlorid) kapsler med forlænget frigivelse er tilgængelige som følger:
NDC 0008-0837-20, flaske med 15 kapsler i en enhedspakke. NDC 0008-0837-21, flaske med 30 kapsler i en enhedspakning. NDC 0008-0837-22, flaske med 90 kapsler i en enhedsemballage. NDC 0008-0837-03, karton med 10 Redipak® blisterstrimler med hver 10 kapsler.
NDC 0008-0833-20, flaske med 15 kapsler i en enhedspakke. NDC 0008-0833-21, flaske med 30 kapsler i en enhedspakke. NDC 0008-0833-22, flaske med 90 kapsler i en enhedspakke. NDC 0008-0833-03, karton med 10 Redipak®-blister med 10 kapsler hver.
NDC 0008-0836-20, flaske med 15 kapsler i en enhedspakning. NDC 0008-0836-21, flaske med 30 kapsler i en enhedspakke. NDC 0008-0836-22, flaske med 90 kapsler i en enhedsemballage. NDC 0008-0836-03, karton med 10 Redipak® blisterstrimler med hver 10 kapsler.
- 37,5 mg , grå hætte/fersken krop med "W" og "Effexor XR" på hætten og "37.5" på kroppen.
- 75 mg , fersken hætte og krop med "W" og "Effexor 37.5mg XR" på hætten og "75" på kroppen.
- 150 mg mørk orange hætte og krop med "W" og "Effexor XR" på hætten og "150" på kroppen.
Opbevares ved kontrolleret stuetemperatur, 20° til 25°C (68° til 77°F).
Pakken til brugsenhed er beregnet til at blive dispenseret som en enhed.
Distribueret af: Wyeth Pharmaceuticals LLC, Et datterselskab af Pfizer Inc, Philadelpia, PA 19101. Revideret: nov 2021
BIVIRKNINGER
Følgende bivirkninger er beskrevet mere detaljeret i andre sektioner af etiketten:
- Overfølsomhed [se KONTRAINDIKATIONER ]
- Selvmordstanker og -adfærd hos børn, unge og voksne [se ADVARSLER OG FORHOLDSREGLER ]
- Serotoninsyndrom [se ADVARSLER OG FORHOLDSREGLER ]
- Forhøjelser i blodtryk [se ADVARSLER OG FORHOLDSREGLER ]
- Unormal blødning [se ADVARSLER OG FORHOLDSREGLER ]
- Vinkellukningsglaukom [se ADVARSLER OG FORHOLDSREGLER ]
- Aktivering af mani/hypomani [se ADVARSLER OG FORHOLDSREGLER ]
- Afbrydelsessyndrom [se ADVARSLER OG FORHOLDSREGLER ]
- Anfald [se ADVARSLER OG FORHOLDSREGLER ]
- Hyponatriæmi [se ADVARSLER OG FORHOLDSREGLER ]
- Vægt- og højdeændringer hos pædiatriske patienter [se ADVARSLER OG FORHOLDSREGLER ]
- Appetitændringer hos pædiatriske patienter [se ADVARSLER OG FORHOLDSREGLER ]
- Interstitiel lungesygdom og eosinofil lungebetændelse [se ADVARSLER OG FORHOLDSREGLER ]
- Seksuel dysfunktion [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske studier
Fordi kliniske undersøgelser udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske undersøgelser af et lægemiddel ikke direkte sammenlignes med frekvenser i de kliniske undersøgelser af et andet lægemiddel og afspejler muligvis ikke frekvenserne observeret i praksis.
Mest almindelige bivirkninger
De mest almindeligt observerede bivirkninger i den kliniske undersøgelsesdatabase hos Effexor XR-behandlede patienter i MDD, GAD, SAD og PD (hyppighed ≥ 5 % og mindst dobbelt så høj som placebo) var: kvalme (30,0 %), somnolens (15,3). %), mundtørhed (14,8%), svedtendens (11,4%), unormal ejakulation (9,9%), anoreksi (9,8%), forstoppelse (9,3%), impotens (5,3%) og nedsat libido (5,1%).
Bivirkninger rapporteret som årsager til seponering af behandling
Kombineret på tværs af kortvarige, placebo-kontrollerede præmarketingundersøgelser for alle indikationer, afbrød 12 % af de 3.558 patienter, der fik Effexor XR (37,5-225 mg), behandlingen på grund af en uønsket oplevelse sammenlignet med 4 % af de 2.197 placebobehandlede patienter i de undersøgelser.De mest almindelige bivirkninger, der førte til seponering hos ≥ 1 % af de Effexor XR-behandlede patienter i korttidsundersøgelserne (op til 12 uger) på tværs af indikationerne er vist i tabel 7.
Almindelige bivirkninger i placebokontrollerede undersøgelser
Antallet af patienter, der fik flere doser Effexor XR under præmarketingvurderingen for hver godkendt indikation, er vist i tabel 8. Betingelserne og varigheden af eksponering for venlafaxin i alle udviklingsprogrammer varierede meget og inkluderede (i overlappende kategorier) åbne og dobbelt- blinde undersøgelser, ukontrollerede og kontrollerede undersøgelser, indlagte (kun Effexor) og ambulante undersøgelser, fastdosis- og titreringsundersøgelser.
Hyppigheden af almindelige bivirkninger (dem, der forekom hos ≥ 2 % af Effexor XR-behandlede patienter [357 MDD-patienter, 1.381 GAD-patienter, 819 SAD-patienter og 1.001 PD-patienter] og hyppigere end placebo) hos Effexor XR-behandlede patienter. - sigte, placebokontrollerede, faste og fleksible kliniske studier (doser 37,5 til 225 mg pr. dag) er vist i tabel 9.
Bivirkningsprofilen afveg ikke væsentligt mellem de forskellige patientpopulationer.
Andre bivirkninger observeret i kliniske undersøgelser
Kroppen som helhed: Lysfølsomhedsreaktion, kulderystelser
Kardiovaskulære system: Postural hypotension, synkope, hypotension, takykardi
Fordøjelsessystemet: Gastrointestinal blødning [se ADVARSLER OG FORHOLDSREGLER ],
bruxisme Hemisk/lymfesystem: Ekkymose [se ADVARSLER OG FORHOLDSREGLER ]
Metabolisk/ernæringsmæssig: Hyperkolesterolæmi, vægtøgning [se ADVARSLER OG FORHOLDSREGLER ], vægttab [se ADVARSLER OG FORHOLDSREGLER ]
Nervesystem: Anfald [se ADVARSLER OG FORHOLDSREGLER ], manisk reaktion [se ADVARSLER OG FORHOLDSREGLER ], agitation, forvirring, akatisi, hallucinationer, hypertoni, myoklonus, depersonalisering, apati
Hud og vedhæng: Nældefeber, kløe, udslæt, alopeci
Særlige sanser: Mydriasis, abnormitet af akkommodation, tinnitus, smagsforstyrrelser
Urogenital system: Urinretention, nedsat vandladning, urininkontinens, øget vandladningsfrekvens, menstruationsforstyrrelser forbundet med øget blødning eller øget uregelmæssig blødning (f.eks. menorragi, metrorragi)
Ændringer af vitale tegn
placebokontrollerede præmarketingundersøgelser var der stigninger i det gennemsnitlige blodtryk (se tabel 10). På tværs af de fleste indikationer var en dosisrelateret stigning i det gennemsnitlige systoliske og diastoliske blodtryk på ryggen tydelig hos patienter behandlet med Effexor 37,5 mg XR. På tværs af alle kliniske studier i MDD, GAD, SAD og PD oplevede 1,4 % af patienterne i Effexor XR-grupperne en stigning i SDBP på ≥15 mm Hg sammen med et blodtryk ≥ 105 mm Hg sammenlignet med 0,9 % af patienterne i placebo grupper. Tilsvarende oplevede 1 % af patienterne i Effexor 37,5 mg XR-grupperne en stigning i SSBP på ≥ 20 mm Hg med et blodtryk ≥ 180 mm Hg sammenlignet med 0,3 % af patienterne i placebogrupperne.
Effexor 37,5 mg XR-behandling var forbundet med vedvarende hypertension (defineret som behandlingsudløst diastolisk blodtryk [SDBP] ≥ 90 mm Hg og ≥ 10 mm Hg over baseline for tre på hinanden følgende behandlingsbesøg (se tabel 11). af patienterne modtog middeldoser af Effexor XR over 300 mg dagligt i kliniske undersøgelser for fuldt ud at evaluere forekomsten af vedvarende stigninger i blodtrykket ved disse højere doser.
Effexor 37,5 mg XR var forbundet med gennemsnitlige stigninger i pulsfrekvens sammenlignet med placebo i placebokontrollerede undersøgelser før markedsføring (se tabel 12) [se ADVARSLER OG FORHOLDSREGLER ].
Laboratorieændringer
Serum kolesterol
Effexor XR var forbundet med gennemsnitlige endelige stigninger i serumkolesterolkoncentrationer sammenlignet med gennemsnitlige endelige fald for placebo i præmarketing MDD, GAD, SAD og PD kliniske undersøgelser (tabel 13).
Effexor 75 mg XR (venlafaxinhydrochlorid) depotkapsler, behandling i op til 12 uger i præmarketing placebokontrollerede undersøgelser for svær depressiv lidelse var forbundet med en gennemsnitlig endelig stigning i serumkolesterolkoncentrationen under behandling på ca. 1,5 mg/dL sammenlignet med en gennemsnitligt endeligt fald på 7,4 mg/dL for placebo. Effexor XR-behandling i op til 8 uger og op til 6 måneder i placebokontrollerede GAD-forsøg før markedsføring var forbundet med gennemsnitlige endelige stigninger i serumkolesterolkoncentrationen på henholdsvis ca. gennemsnitlige endelige fald på henholdsvis 4,9 mg/dL og 7,7 mg/dL. Effexor XR-behandling i op til 12 uger og op til 6 måneder i præmarketing placebokontrollerede studier med social angst var forbundet med gennemsnitlige endelige stigninger i serumkolesterolkoncentrationen på henholdsvis ca. 7,9 mg/dL og 5,6 mg/dL sammenlignet med behandlingen med gennemsnitlige endelige fald på henholdsvis 2,9 og 4,2 mg/dL for placebo. Effexor XR-behandling i op til 12 uger i placebokontrollerede forsøg med panikangst før markedsføring var forbundet med gennemsnitlige endelige stigninger i serumkolesterolkoncentrationen på ca. 5,8 mg/dL på ca. 5,8 mg/dL sammenlignet med et gennemsnitligt endeligt fald på 3,7 mg/dL for placebo.
Patienter behandlet med Effexor (øjeblikkelig frigivelse) i mindst 3 måneder i placebokontrollerede 12-måneders forlængelsesforsøg havde en gennemsnitlig stigning i total kolesterol under behandlingen på 9,1 mg/dL sammenlignet med et fald på 7,1 mg/dL blandt placebo- behandlede patienter. Denne stigning var varighedsafhængig over undersøgelsesperioden og havde en tendens til at være større med højere doser. Klinisk relevante stigninger i serumkolesterol, defineret som 1) en endelig stigning i serumkolesterol under behandling ≥50 mg/dL fra baseline og til en værdi ≥261 mg/dL, eller 2) en gennemsnitlig stigning i serumkolesterol under behandling ≥ 50 mg/dL fra baseline og til en værdi ≥261 mg/dL blev registreret hos 5,3 % af venlafaxinbehandlede patienter og 0,0 % af placebobehandlede patienter.
Serum triglycerider
Effexor 75mg XR var forbundet med gennemsnitlige endelige stigninger i fastende serumtriglycerider sammenlignet med placebo i præmarketing kliniske undersøgelser af SAD og PD op til 12 uger (poolede data) og 6 måneders varighed (tabel 14).
Pædiatriske patienter
Generelt var bivirkningsprofilen for venlafaxin (i placebokontrollerede kliniske undersøgelser) hos børn og unge (i alderen 6 til 17) den samme som for voksne. Som hos voksne blev der observeret nedsat appetit, vægttab, forhøjet blodtryk og forhøjet serumkolesterol [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
I pædiatriske kliniske undersøgelser blev bivirkningen, selvmordstanker, observeret.
Især blev følgende bivirkninger observeret hos pædiatriske patienter: mavesmerter, agitation, dyspepsi, ekkymose, epistaxis og myalgi.
Bivirkninger identificeret under brug efter godkendelse
Følgende bivirkninger er blevet identificeret under brug af Effexor XR efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering:
Kroppen som helhed: Anafylaksi, angioødem
Kardiovaskulære system: QT-forlængelse, ventrikulær fibrillation, ventrikulær takykardi (inklusive torsade de pointes), takotsubo kardiomyopati
Fordøjelsessystemet: Pancreatitis
Hemisk/lymfesystem: Slimhindeblødning [se ADVARSLER OG FORHOLDSREGLER ], bloddyskrasier (herunder agranulocytose, aplastisk anæmi, neutropeni og pancytopeni), forlænget blødningstid, trombocytopeni
Metabolisk/ernæringsmæssig: Hyponatriæmi [se ADVARSLER OG FORHOLDSREGLER ], Syndrom af uhensigtsmæssig sekretion af antidiuretisk hormon (SIADH) [se ADVARSLER OG FORHOLDSREGLER ], unormale leverfunktionsprøver, hepatitis, øget prolaktin
Muskuloskeletale: Rhabdomyolyse
Nervesystem: Malignt neuroleptikasyndrom (NMS) [se ADVARSLER OG FORHOLDSREGLER ], serotonergt syndrom [se ADVARSLER OG FORHOLDSREGLER ], delirium, ekstrapyramidale reaktioner (herunder dystoni og dyskinesi), nedsat koordination og balance, tardiv dyskinesi
Åndedrætsorganerne: Dyspnø, interstitiel lungesygdom, pulmonal eosinofili [se ADVARSLER OG FORHOLDSREGLER ]
Hud og vedhæng: Stevens-Johnsons syndrom, toksisk epidermal nekrolyse, erythema multiforme
Særlige sanser: Vinkel-lukkende glaukom [se ADVARSLER OG FORHOLDSREGLER ]
DRUGSINTERAKTIONER
Centralnervesystemet (CNS)-aktive lægemidler
Risikoen ved at bruge venlafaxin i kombination med andre CNS-aktive lægemidler er ikke blevet systematisk vurderet. Derfor tilrådes forsigtighed, når Effexor XR tages i kombination med andre CNS-aktive lægemidler.
Monoaminoxidasehæmmere
Bivirkninger, hvoraf nogle var alvorlige, er blevet rapporteret hos patienter, som for nylig er blevet seponeret på grund af en MAO-hæmmer og er begyndt på antidepressiva med farmakologiske egenskaber svarende til Effexor XR (SNRI'er eller SSRI'er), eller som for nylig har haft SNRI- eller SSRI-behandling afbrudt før til initiering af en MAOI [se DOSERING OG ADMINISTRATION , KONTRAINDIKATIONER og ADVARSLER OG FORHOLDSREGLER ].
Serotonerge lægemidler
Baseret på virkningsmekanismen af Effexor XR og potentialet for serotoninsyndrom tilrådes forsigtighed, når Effexor XR administreres sammen med andre lægemidler, der kan påvirke de serotonerge neurotransmittersystemer, såsom triptaner, SSRI'er, andre SNRI'er, linezolid (et antibiotikum, som er en reversibel ikke-selektiv MAO-hæmmer), lithium, tramadol eller perikon. Hvis samtidig behandling med Effexor XR og disse lægemidler er klinisk berettiget, tilrådes omhyggelig observation af patienten, især under behandlingsstart og dosisstigninger. Samtidig brug af Effexor 75mg XR med tryptofantilskud anbefales ikke [se DOSERING OG ADMINISTRATION , KONTRAINDIKATIONER , og ADVARSLER OG FORHOLDSREGLER ].
Lægemidler, der interfererer med hæmostase (f.eks. NSAID'er, aspirin og warfarin)
Serotoninfrigivelse af blodplader spiller en vigtig rolle i hæmostase. Brugen af psykotrope lægemidler, der interfererer med serotonin-genoptagelsen, er forbundet med forekomsten af øvre gastrointestinale blødninger, og samtidig brug af et NSAID eller aspirin kan forstærke denne blødningsrisiko [se ADVARSLER OG FORHOLDSREGLER ]. Ændrede antikoagulerende virkninger, herunder øget blødning, er blevet rapporteret, når SSRI'er og SNRI'er administreres sammen med warfarin. Patienter, der får warfarinbehandling, bør overvåges nøje, når Effexor 37,5 mg XR påbegyndes eller seponeres.
Vægttabsmidler
Sikkerheden og effekten af venlafaxinbehandling i kombination med vægttabsmidler, inklusive phentermin, er ikke blevet fastlagt. Samtidig administration af Effexor XR og vægttabsmidler anbefales ikke. Effexor XR er ikke indiceret til vægttab alene eller i kombination med andre produkter.
Virkninger af andre lægemidler på Effexor XR
Figur 1: Effekt af interagerende lægemidler på farmakokinetikken af venlafaxin og den aktive metabolit O-desmethylvenlafaxin (ODV).
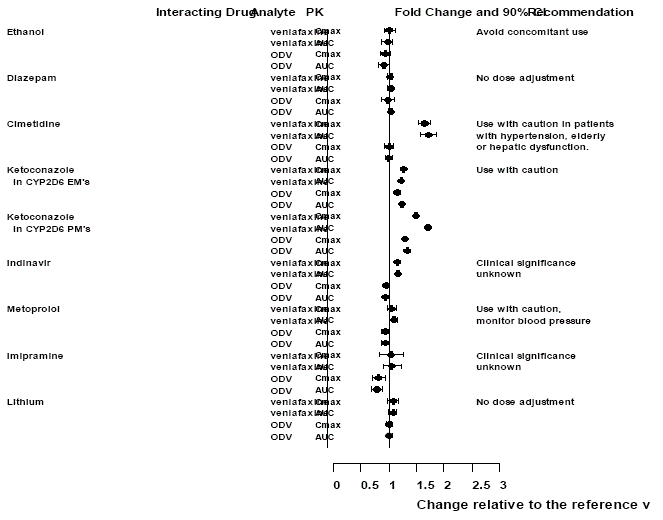
Effekter af Effexor XR på andre lægemidler
Figur 2: Effekt af venlafaxin på de farmakokinetiske interagerende lægemidler og deres aktive metabolitter.
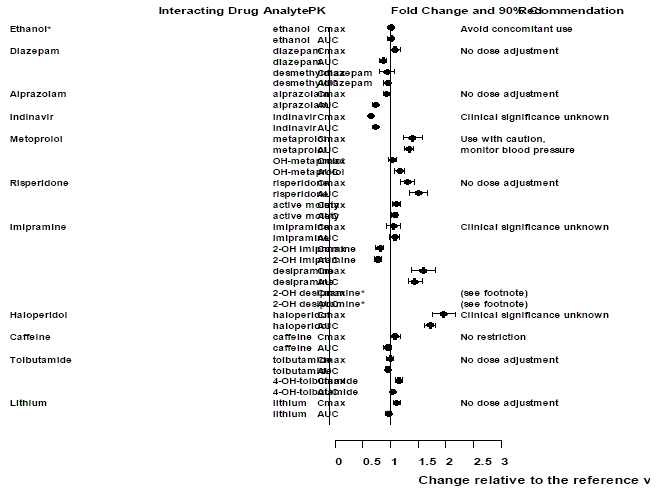
Bemærk
Administration af venlafaxin i et stabilt regime overdrev ikke de psykomotoriske og psykometriske virkninger induceret af ethanol hos de samme personer, når de ikke fik venlafaxin.
Interaktioner med lægemiddel-laboratorietest
Falsk-positive urinimmunoassay-screeningstest for phencyclidin (PCP) og amfetamin er blevet rapporteret hos patienter, der tager venlafaxin. Dette skyldes manglende specificitet af screeningstestene. Falske positive testresultater kan forventes i flere dage efter seponering af venlafaxinbehandling. Bekræftende test, såsom gaskromatografi/massespektrometri, vil skelne venlafaxin fra PCP og amfetamin.
Stofmisbrug og afhængighed
kontrolleret stof
Effexor 75mg XR er ikke et kontrolleret stof.
Misbrug
Mens venlafaxin ikke er blevet systematisk undersøgt i kliniske undersøgelser for dets potentiale for misbrug, var der ingen indikation af lægemiddelsøgende adfærd i de kliniske undersøgelser. Det er dog ikke muligt at forudsige på baggrund af erfaringer fra før markedsføring, i hvilket omfang et CNS-aktivt lægemiddel vil blive misbrugt, omdirigeret og/eller misbrugt, når det først er markedsført. Derfor bør læger omhyggeligt vurdere patienterne for historie med stofmisbrug og følge sådanne patienter nøje, observere dem for tegn på misbrug eller misbrug af venlafaxin (f.eks. udvikling af tolerance, stigning i dosis, lægemiddelsøgende adfærd).
Afhængighed
In vitro undersøgelser afslørede, at venlafaxin praktisk talt ikke har nogen affinitet til opiat-, benzodiazepin-, phencyclidin- (PCP) eller N-methyl-D-asparaginsyre (NMDA)-receptorer.
Venlafaxin viste sig ikke at have nogen signifikant CNS-stimulerende aktivitet hos gnavere. I studier med diskrimination af primater viste venlafaxin ingen signifikant risiko for misbrug af stimulerende eller depressive midler.
Seponeringsvirkninger er blevet rapporteret hos patienter, der får venlafaxin [se DOSERING OG ADMINISTRATION ].
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Selvmordstanker og -adfærd hos børn, unge og unge voksne
Patienter med svær depressiv lidelse (MDD), både voksne og pædiatriske, kan opleve forværring af deres depression og/eller fremkomsten af selvmordstanker og -adfærd (suicidalitet) eller usædvanlige ændringer i adfærd, uanset om de tager antidepressiv medicin eller ej, og dette risikoen kan fortsætte, indtil der indtræffer betydelig remission. Selvmord er en kendt risiko for depression og visse andre psykiatriske lidelser, og disse lidelser er i sig selv de stærkeste forudsigere for selvmord. Der har imidlertid været en langvarig bekymring for, at antidepressiva kan have en rolle i at inducere forværring af depression og fremkomsten af suicidalitet hos visse patienter i de tidlige faser af behandlingen. Samlede analyser af korttids placebokontrollerede undersøgelser af antidepressive lægemidler (SSRI'er og andre) viste, at disse lægemidler øger risikoen for selvmordstanker og -adfærd (suicidalitet) hos børn, unge og unge voksne (alder 18-24) med MDD og andre psykiatriske lidelser. Korttidsundersøgelser viste ikke en stigning i risikoen for suicidalitet med antidepressiva sammenlignet med placebo hos voksne efter 24 år; der var en reduktion med antidepressiva sammenlignet med placebo hos voksne på 65 år og ældre.
De samlede analyser af placebokontrollerede undersøgelser af børn og unge med MDD, obsessiv-kompulsiv lidelse (OCD) eller andre psykiatriske lidelser omfattede i alt 24 korttidsstudier af 9 antidepressive lægemidler hos over 4.400 patienter. De samlede analyser af placebokontrollerede undersøgelser hos voksne med MDD eller andre psykiatriske lidelser omfattede i alt 295 korttidsstudier (median varighed på 2 måneder) af 11 antidepressive lægemidler hos over 77.000 patienter. Der var betydelig variation i risikoen for suicidalitet blandt stoffer, men en tendens til en stigning i de yngre patienter for næsten alle undersøgte stoffer. Der var forskelle i den absolutte risiko for suicidalitet på tværs af de forskellige indikationer, med den højeste forekomst af MDD. Risikoforskellene (lægemiddel versus placebo) var imidlertid relativt stabile inden for aldersgrupper og på tværs af indikationer. Disse risikoforskelle (lægemiddel-placebo-forskel i antallet af tilfælde af suicidalitet pr. 1.000 behandlede patienter) er angivet i tabel 1.
Der forekom ingen selvmord i nogen af de pædiatriske undersøgelser. Der var selvmord i voksenundersøgelserne, men antallet var ikke tilstrækkeligt til at nå frem til nogen konklusion om lægemiddeleffekt på selvmord.
Det er ukendt, om suicidalitetsrisikoen strækker sig til længerevarende brug, dvs. ud over flere måneder. Der er dog væsentlige beviser fra placebokontrollerede vedligeholdelsesundersøgelser hos voksne med depression, at brugen af antidepressiva kan forsinke tilbagefald af depression.
Alle patienter, der behandles med antidepressiva for enhver indikation, bør overvåges passende og observeres nøje for klinisk forværring, suicidalitet og usædvanlige ændringer i adfærd, især i løbet af de første par måneder af et lægemiddelbehandlingsforløb, eller i tidspunkter med dosisændringer, enten stigninger eller falder.
Følgende symptomer, angst, agitation, panikanfald, søvnløshed, irritabilitet, fjendtlighed, aggressivitet, impulsivitet, akatisi (psykomotorisk rastløshed), hypomani og mani, er blevet rapporteret hos voksne og pædiatriske patienter, der behandles med antidepressiva mod MDD, samt for andre indikationer, både psykiatriske og ikke-psykiatriske. Selvom der ikke er etableret en årsagssammenhæng mellem fremkomsten af sådanne symptomer og enten forværring af depression og/eller fremkomsten af selvmordsimpulser, er der bekymring for, at sådanne symptomer kan repræsentere forløbere for ny suicidalitet.
Det bør overvejes at ændre det terapeutiske regime, herunder eventuelt seponering af medicinen, hos patienter, hvis depression er vedvarende værre, eller som oplever ny suicidalitet eller symptomer, der kan være forløbere for forværring af depression eller suicidalitet, især hvis disse symptomer er alvorlige, pludselige påbegyndt, eller var ikke en del af patientens symptomer.
Hvis der er truffet beslutning om at afbryde behandlingen, skal medicinen nedtrappes så hurtigt som muligt, men med erkendelse af, at pludselig seponering kan være forbundet med visse symptomer [se Afbrydelsessyndrom og DOSERING OG ADMINISTRATION ].
Familier og pårørende til patienter, der behandles med antidepressiva for MDD eller andre indikationer, både psykiatriske og ikke-psykiatriske, bør advares om behovet for at overvåge patienter for fremkomsten af agitation, irritabilitet, usædvanlige ændringer i adfærd og de andre symptomer beskrevet ovenfor, som f. samt fremkomsten af suicidalitet, og at rapportere sådanne symptomer straks til sundhedsudbydere. Sådan overvågning bør omfatte daglig observation af familier og omsorgspersoner. Recepter til Effexor XR bør udskrives for den mindste mængde kapsler i overensstemmelse med god patientbehandling for at reducere risikoen for overdosering.
Screening af patienter for bipolar lidelse
En alvorlig depressiv episode kan være den første præsentation af bipolar lidelse. Det antages generelt (dog ikke fastslået i kontrollerede undersøgelser), at behandling af en sådan episode med et antidepressivum alene kan øge sandsynligheden for udfældning af en blandet/manisk episode hos patienter med risiko for bipolar lidelse. Hvorvidt nogen af de ovenfor beskrevne symptomer repræsenterer en sådan omdannelse er ukendt. Inden behandling med et antidepressivum påbegyndes, bør patienter med depressive symptomer dog screenes tilstrækkeligt for at afgøre, om de har risiko for bipolar lidelse; sådan screening bør omfatte en detaljeret psykiatrisk historie, herunder en familiehistorie med selvmord, bipolar lidelse og depression. Det skal bemærkes, at Effexor XR ikke er godkendt til behandling af bipolar depression.
Serotonin syndrom
Udviklingen af et potentielt livstruende serotonergt syndrom er blevet rapporteret med serotonin-noradrenalin genoptagelseshæmmere (SNRI) og SSRI, inklusive Effexor XR alene, men især ved samtidig brug af andre serotonerge lægemidler (herunder triptaner, tricykliske antidepressiva, lithium, lithium, tramadol, tryptofan, buspiron, amfetamin og perikon) og med lægemidler, der hæmmer metabolismen af serotonin især, MAO-hæmmere, både dem, der er beregnet til at behandle psykiatriske lidelser og andre, såsom linezolid eller intravenøs methylenblåt).
Symptomer på serotoninsyndrom kan omfatte mentale statusændringer (f.eks. agitation, hallucinationer, delirium, koma) autonom ustabilitet (f.eks. takykardi, labilt blodtryk, hypertermi, diaforese, rødmen og svimmelhed), neuromuskulære symptomer (f.eks. tremor, rigiditet, myoklonus). , hyperrefleksi, inkoordination); kramper og gastrointestinale symptomer (f.eks. kvalme, opkastning, diarré). Patienter bør overvåges for forekomsten af serotonergt syndrom.
Samtidig brug af Effexor XR og MAO-hæmmere (beregnet til behandling af psykiatriske lidelser) er kontraindiceret. Effexor XR bør heller ikke påbegyndes hos en patient, der er i behandling med MAO-hæmmere såsom linezolid eller intravenøs methylenblåt. Alle rapporter med methylenblåt, der gav information om indgivelsesvejen, involverede intravenøs administration i dosisområdet fra 1 mg/kg til 8 mg/kg. Ingen rapporter involverede administration af methylenblåt ad andre veje (såsom orale tabletter eller lokal vævsinjektion) eller ved lavere doser. Der kan være omstændigheder, hvor det er nødvendigt at påbegynde behandling med en MAO-hæmmer såsom linezolid eller intravenøs methylenblåt hos en patient, der tager Effexor 37,5 mg XR. Effexor XR bør seponeres, før behandling med MAO-hæmmeren påbegyndes [se KONTRAINDIKATIONER , DOSERING OG ADMINISTRATION , og DRUGSINTERAKTIONER ].
Hvis samtidig brug af Effexor 37,5 mg XR med andre serotonerge lægemidler (f.eks. triptaner, tricykliske antidepressiva, mirtazapin, fentanyl, lithium, tramadol, buspiron, amfetamin, tryptofan eller perikon) er klinisk berettiget, omhyggelig observation af patienten tilrådes, især under behandlingsstart og dosisstigninger [se DRUGSINTERAKTIONER ]. Patienter bør gøres opmærksomme på den potentielle risiko for serotonergt syndrom. Behandling med Effexor XR og eventuelle samtidige serotonerge midler bør seponeres øjeblikkeligt, hvis ovennævnte hændelser opstår, og understøttende symptomatisk behandling bør påbegyndes.
Forhøjelser i blodtryk
I kontrollerede forsøg var der dosisrelaterede stigninger i systolisk og diastolisk blodtryk, såvel som tilfælde af vedvarende hypertension [se BIVIRKNINGER ].
Overvåg blodtrykket før påbegyndelse af behandling med Effexor 37,5 mg XR og regelmæssigt under behandlingen. Kontroller allerede eksisterende hypertension før påbegyndelse af behandling med Effexor 75mg XR. Vær forsigtig ved behandling af patienter med allerede eksisterende hypertension eller kardiovaskulære eller cerebrovaskulære tilstande, der kan blive kompromitteret af stigninger i blodtrykket. Vedvarende blodtryksforhøjelse kan føre til uønskede resultater. Tilfælde af forhøjet blodtryk, der kræver øjeblikkelig behandling, er blevet rapporteret med Effexor XR. Overvej dosisreduktion eller seponering af behandling for patienter, som oplever en vedvarende stigning i blodtrykket.
På tværs af alle kliniske studier med Effexor 37,5 mg oplevede 1,4 % af patienterne i de Effexor XR-behandlede grupper en stigning på ≥15 mm Hg i liggende diastolisk blodtryk (SDBP) ≥ 105 mm Hg sammenlignet med 0,9 % af patienterne i placebogrupperne. Tilsvarende oplevede 1 % af patienterne i de Effexor 75 mg XR-behandlede grupper en stigning på ≥ 20 mm Hg i liggende systolisk blodtryk (SSBP) med blodtryk ≥ 180 mm Hg sammenlignet med 0,3 % af patienterne i placebogrupperne [se tabel 10 i BIVIRKNINGER ]. Effexor 75 mg XR-behandling var forbundet med vedvarende hypertension (defineret som behandlingsudløst SDBP ≥ 90 mm Hg og ≥ 10 mm Hg over baseline for tre på hinanden følgende behandlingsbesøg [se tabel 11 i BIVIRKNINGER ]. Et utilstrækkeligt antal patienter modtog middeldoser af Effexor 37,5 mg XR over 300 mg dagligt i kliniske undersøgelser til fuldt ud at evaluere forekomsten af vedvarende stigninger i blodtrykket ved disse højere doser.
Unormal blødning
SSRI'er og SNRI'er, inklusive Effexor 37,5 mg XR, kan øge risikoen for blødningshændelser, lige fra ekkymoser, hæmatomer, epistaxis, petekkier og gastrointestinale blødninger til livstruende blødninger. Samtidig brug af aspirin, ikke-steroide antiinflammatoriske lægemidler (NSAID'er), warfarin og andre antikoagulantia eller andre lægemidler, der vides at påvirke blodpladefunktionen, kan øge denne risiko. Caserapporter og epidemiologiske undersøgelser (case-kontrol og kohortedesign) har vist en sammenhæng mellem brug af lægemidler, der interfererer med serotonin-genoptagelse og forekomsten af gastrointestinal blødning. Pas på patienterne med risikoen for blødning forbundet med samtidig brug af Effexor 75mg XR og NSAID'er, aspirin eller andre lægemidler, der påvirker koagulationen.
Vinkel-lukkende glaukom
Pupiludvidelsen, der opstår efter brug af mange antidepressive lægemidler, inklusive Effexor XR, kan udløse et vinkellukkeangreb hos en patient med anatomisk snævre vinkler, som ikke har en patenteret iridektomi.
Aktivering af mani/hypomani
Mani eller hypomani blev rapporteret hos Effexor 37,5 mg XR-behandlede patienter i præmarketingundersøgelserne i MDD, SAD og PD (se tabel 2). Mani/hypomani er også blevet rapporteret hos en lille del af patienter med humørsygdomme, som blev behandlet med andre markedsførte lægemidler til behandling af MDD. Effexor 37,5 mg XR bør anvendes med forsigtighed til patienter med en historie med mani eller hypomani.
Afbrydelsessyndrom
Seponeringssymptomer er blevet systematisk evalueret hos patienter, der tager venlafaxin, herunder prospektive analyser af kliniske studier i GAD og retrospektive undersøgelser af studier i MDD og SAD. Pludselig seponering eller dosisreduktion af venlafaxin ved forskellige doser har vist sig at være forbundet med forekomsten af nye symptomer, hvis hyppighed steg med øget dosisniveau og med længere behandlingsvarighed. Rapporterede symptomer omfatter agitation, anoreksi, angst, forvirring, nedsat koordination og balance, diarré, svimmelhed, mundtørhed, dysforisk stemning, fascikulation, træthed, influenzalignende symptomer, hovedpine, hypomani, søvnløshed, kvalme, nervøsitet, mareridt, føleforstyrrelser ( inklusive stødlignende elektriske fornemmelser), somnolens, svedtendens, rysten, svimmelhed og opkastning.
Der har efter markedsføring været rapporter om alvorlige seponeringssymptomer, som kan være langvarige og alvorlige. Fuldført selvmord, selvmordstanker, aggression og voldelig adfærd er blevet observeret hos patienter under reduktion af Effexor 75 mg XR-dosis, herunder under seponering. Andre postmarketing-rapporter beskriver visuelle ændringer (såsom sløret syn eller problemer med at fokusere) og øget blodtryk efter at have stoppet eller reduceret dosis af Effexor XR.
Under markedsføringen af Effexor XR, andre SNRI'er og SSRI'er har der været spontane rapporter om andre bivirkninger, der opstår efter seponering af disse lægemidler, især ved pludselige forløb, herunder følgende: irritabilitet, sløvhed, følelsesmæssig labilitet, tinnitus og anfald.
Patienter bør overvåges for disse symptomer, når behandlingen med Effexor XR afbrydes. En gradvis reduktion af dosis i stedet for pludseligt ophør anbefales. Hvis der opstår uacceptable symptomer efter et fald i dosis eller efter seponering af behandlingen, kan det overvejes at genoptage den tidligere ordinerede dosis. Efterfølgende kan lægen fortsætte med at reducere dosis, men med en mere gradvis hastighed. Hos nogle patienter kan det være nødvendigt at seponere behandlingen over en periode på flere måneder [se DOSERING OG ADMINISTRATION ].
Anfald
Anfald er opstået med venlafaxinbehandling. Effexor 75mg XR bør, ligesom mange antidepressiva, anvendes med forsigtighed til patienter med anfald i anamnesen og bør seponeres hos enhver patient, der udvikler anfald. [Skal mindske risikoen: Risikofaktorer, samtidig medicin, der sænker anfaldstærsklen.]
Hyponatriæmi
Hyponatriæmi kan opstå som følge af behandling med SSRI'er og SNRI'er, inklusive Effexor 37,5 mg XR. I mange tilfælde ser hyponatriæmien ud til at være resultatet af syndromet af uhensigtsmæssig antidiuretisk hormon (SIADH) sekretion. Tilfælde med serumnatrium lavere end 110 mmol/L er blevet rapporteret. Ældre patienter kan have større risiko for at udvikle hyponatriæmi med SSRI'er og SNRI'er [se Brug i specifikke populationer ]. Også patienter, der tager diuretika, eller dem, der på anden måde er volumen-depleterede, kan have større risiko. Overvej seponering af Effexor 37,5 mg XR hos patienter med symptomatisk hyponatriæmi, og indled passende medicinsk intervention.
Tegn og symptomer på hyponatriæmi omfatter hovedpine, koncentrationsbesvær, hukommelsessvækkelse, forvirring, svaghed og ustabilitet, som kan føre til fald. Tegn og symptomer forbundet med mere alvorlige og/eller akutte tilfælde har inkluderet hallucinationer, synkope, krampeanfald, koma, åndedrætsstop og død.
Vægt- og højdeændringer hos pædiatriske patienter
Vægtændringer
Den gennemsnitlige ændring i kropsvægt og forekomst af vægttab (procentdel af patienter, der tabte 3,5 % eller mere) i de placebokontrollerede pædiatriske undersøgelser i MDD, GAD og SAD er vist i tabel 3 og 4.
Vægttab var ikke begrænset til patienter med behandlingsudløst anoreksi [se Appetitændringer hos pædiatriske patienter ].
Risici forbundet med længerevarende brug af Effexor 75 mg XR blev vurderet i et åbent MDD-studie af børn og unge, som fik Effexor XR i op til seks måneder. Børnene og de unge i undersøgelsen havde vægtstigninger, der var mindre end forventet, baseret på data fra alders- og kønsmatchede jævnaldrende. Forskellen mellem observeret vægtøgning og forventet vægtøgning var større for børn (
Højdeændringer
Tabel 5 viser den gennemsnitlige højdestigning hos pædiatriske patienter i de kortvarige, placebokontrollerede MDD-, GAD- og SAD-studier. Forskellene i højdestigninger i GAD- og MDD-undersøgelser var mest bemærkelsesværdige hos patienter yngre end tolv.
I den seks måneder lange, åbne MDD-undersøgelse havde børn og unge højdeforøgelser, der var mindre end forventet, baseret på data fra jævnaldrende alders- og kønsmatchede. Forskellen mellem observerede og forventede vækstrater var større for børn (
Appetitændringer hos pædiatriske patienter
Nedsat appetit (rapporteret som behandlingsudløst anoreksi) blev mere almindeligt observeret hos Effexor XR-behandlede patienter versus placebo-behandlede patienter i præmarketingevalueringen af Effexor XR for MDD, GAD og SAD (se tabel 6).
Interstitiel lungesygdom og eosinofil lungebetændelse
Interstitiel lungesygdom og eosinofil lungebetændelse forbundet med venlafaxinbehandling er sjældent blevet rapporteret. Muligheden for disse uønskede hændelser bør overvejes hos venlafaxinbehandlede patienter, som viser fremadskridende dyspnø, hoste eller ubehag i brystet. Sådanne patienter bør gennemgå en omgående medicinsk evaluering, og seponering af venlafaxinbehandling bør overvejes.
Seksuel dysfunktion
Brug af SNRI'er, inklusive Effexor XR, kan forårsage symptomer på seksuel dysfunktion [se BIVIRKNINGER ]. Hos mandlige patienter kan brug af SNRI resultere i ejakulatorisk forsinkelse eller svigt, nedsat libido og erektil dysfunktion. Hos kvindelige patienter kan brug af SNRI resultere i nedsat libido og forsinket eller manglende orgasme.
Det er vigtigt for ordinerende læger at forespørge om seksuel funktion før påbegyndelse af Effexor 37,5 mg XR og at spørge specifikt om ændringer i seksuel funktion under behandlingen, fordi seksuel funktion muligvis ikke spontant rapporteres. Ved evaluering af ændringer i seksuel funktion er det vigtigt at få en detaljeret anamnese (inklusive tidspunktet for symptomdebut), fordi seksuelle symptomer kan have andre årsager, herunder den underliggende psykiatriske lidelse. Diskuter potentielle ledelsesstrategier til at støtte patienter i at træffe informerede beslutninger om behandling.
Patientrådgivningsinformation
Se FDA-godkendt PATIENTOPLYSNINGER ( Medicinvejledning ).
Ordinerende læger eller andet sundhedspersonale bør informere patienter, deres familier og deres pårørende om fordele og risici forbundet med behandling med Effexor 37,5 mg XR og bør rådgive dem om dens korrekte brug. En patientmedicineringsvejledning om "Antidepressiv medicin, depression og andre alvorlige psykiske sygdomme og selvmordstanker eller -handlinger" er tilgængelig for Effexor 75mg XR. Den ordinerende læge eller sundhedspersonalet bør instruere patienter, deres familier og deres pårørende i at læse medicinvejledningen og skal hjælpe dem med at forstå dens indhold. Patienterne skal have mulighed for at diskutere indholdet af medicinvejledningen og få svar på de spørgsmål, de måtte have. Hele teksten til medicinvejledningen er genoptrykt i slutningen af dette dokument. Patienter bør informeres om følgende problemer og bør bedes om at advare deres ordinerende læge, hvis disse opstår, mens de tager Effexor XR.
Selvmordstanker og -adfærd
Rådgiv patienter, deres familier og pårørende til at se efter fremkomsten af suicidalitet, forværring af depression og andre psykiatriske symptomer (angst, agitation, panikanfald, søvnløshed, irritabilitet, fjendtlighed, aggressivitet, impulsivitet, akatisi, psykomotorisk rastløshed, hypomani, mani, andre usædvanlige ændringer i adfærd), især tidligt under behandlingen, og når dosis justeres op eller ned. Sådanne symptomer bør rapporteres til patientens ordinerende læge eller sundhedspersonale, især hvis de er alvorlige, pludseligt opstået eller ikke var en del af patientens symptomer. Symptomer som disse kan være forbundet med en øget risiko for selvmordstanker og -adfærd og indikerer et behov for meget tæt overvågning [se KASSE ADVARSEL og ADVARSLER OG FORHOLDSREGLER ].
Samtidig medicinering
Råd til patienter, der tager Effexor XR, om ikke at bruge andre produkter, der indeholder venlafaxin eller desvenlafaxin samtidigt. Sundhedspersonale bør instruere patienterne i ikke at tage Effexor XR med en MAO-hæmmer eller inden for 14 dage efter seponering af en MAO-hæmmer og at tillade 7 dage efter ophør med Effexor XR, før de starter en MAO-hæmmer [se KONTRAINDIKATIONER ].
Serotonin syndrom
Patienter skal advares om risikoen for serotonergt syndrom ved samtidig brug af Effexor 75mg XR og triptaner, tramadol, amfetaminer, tryptofantilskud, med antipsykotika eller andre dopaminantagonister eller andre serotonerge midler [se ADVARSLER OG FORHOLDSREGLER og DRUGSINTERAKTIONER ].
Forhøjet blodtryk
Rådgiv patienterne om, at de skal have regelmæssig monitorering af blodtrykket, når de tager Effexor XR [se ADVARSLER OG FORHOLDSREGLER ].
Unormal blødning
Patienter bør advares om samtidig brug af Effexor 75mg XR og NSAID'er, aspirin, warfarin eller andre lægemidler, der påvirker koagulationen, da kombineret brug af psykotrope lægemidler, der interfererer med serotonin-genoptagelse, og disse midler har været forbundet med en øget risiko for blødning [se ADVARSLER OG FORHOLDSREGLER ].
Vinkellukning glaukom
Patienter bør informeres om, at indtagelse af Effexor XR kan forårsage mild pupilleudvidelse, som hos følsomme personer kan føre til en episode med vinkelglaukom. Eksisterende glaukom er næsten altid åbenvinklet glaukom, fordi vinkellukket glaukom, når det diagnosticeres, kan behandles definitivt med iridektomi. Åbenvinklet glaukom er ikke en risikofaktor for lukkevinklet glaukom. Patienter kan ønske at blive undersøgt for at afgøre, om de er modtagelige for vinkellukning, og have en profylaktisk procedure (f.eks. iridektomi), hvis de er modtagelige [se ADVARSLER OG FORHOLDSREGLER ].
Aktivering af mani/hypomani
Rådgiv patienter, deres familier og pårørende til at observere for tegn på aktivering af mani/hypomani [se ADVARSLER OG FORHOLDSREGLER ].
Kardiovaskulær/cerebrovaskulær sygdom
Forsigtighed tilrådes ved administration af Effexor XR til patienter med kardiovaskulære, cerebrovaskulære eller lipidmetabolismeforstyrrelser [se BIVIRKNINGER ].
Forhøjelse af serumkolesterol og triglycerider
Rådgiv patienterne om, at der kan forekomme stigninger i totalt kolesterol, LDL og triglycerider, og at måling af serumlipider kan overvejes [se ADVARSLER OG FORHOLDSREGLER ].
Afbrydelsessyndrom
Rådgive patienter om ikke at stoppe med at tage Effexor 75mg XR uden først at tale med deres sundhedspersonale. Patienter skal være opmærksomme på, at seponeringseffekter kan forekomme, når de stopper med Effexor XR [se ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ].
Seksuel dysfunktion
Rådfør patienterne om, at brug af Effexor XR kan forårsage symptomer på seksuel dysfunktion hos både mandlige og kvindelige patienter. Informer patienterne om, at de bør diskutere eventuelle ændringer i seksuel funktion og potentielle håndteringsstrategier med deres sundhedsplejerske [se ADVARSLER OG FORHOLDSREGLER ].
Interferens med kognitiv og motorisk ydeevne
Pas på patienterne med at betjene farlige maskiner, inklusive biler, indtil de er rimeligt sikre på, at Effexor 37,5 mg XR-behandling ikke påvirker deres evne til at deltage i sådanne aktiviteter negativt.
Alkohol
Rådgive patienter om at undgå alkohol, mens de tager Effexor 37,5 mg XR [se DRUGSINTERAKTIONER ].
Allergiske reaktioner
Råd patienter til at underrette deres læge, hvis de udvikler allergiske fænomener såsom udslæt, nældefeber, hævelse eller åndedrætsbesvær.
Graviditet
Råd patienter til at underrette deres læge, hvis de bliver gravide eller har til hensigt at blive gravide under behandlingen [se Brug i specifikke populationer ].
Ammende
Råd patienter til at underrette deres læge, hvis de ammer et spædbarn [se Brug i specifikke populationer ].
Resterende sfæroider
Effexor XR indeholder sfæroider, som frigiver lægemidlet langsomt til fordøjelseskanalen. Den uopløselige del af disse sfæroider elimineres, og patienter kan bemærke, at sfæroider passerer i afføringen eller via kolostomi. Patienterne skal informeres om, at den aktive medicin allerede er absorberet, når patienten ser sfæroiderne.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
Tumorer blev ikke øget ved venlafaxinbehandling hos mus eller rotter. Venlafaxin blev givet oralt til mus i 18 måneder i doser op til 120 mg/kg pr. dag, hvilket var 1,7 gange den maksimalt anbefalede humane dosis på mg/m2-basis. Venlafaxin blev også givet til rotter ved oral sonde i 24 måneder i doser op til 120 mg/kg pr. dag. Hos rotter, der fik en dosis på 120 mg/kg, var plasmakoncentrationerne af venlafaxin ved obduktion 1 gange (hanrotter) og 6 gange (hunrotter) plasmakoncentrationerne hos patienter, der fik den maksimalt anbefalede humane dosis. Plasmaniveauer af O-desmethylmetabolitten (ODV) var lavere hos rotter end hos patienter, der fik den maksimalt anbefalede dosis. O-desmethylvenlafaxin (ODV), den vigtigste humane metabolit af venlafaxin, administreret ved oral sondeernæring til mus og rotter i 2 år, øgede ikke forekomsten af tumorer i nogen af undersøgelserne. Mus modtog ODV i doser op til 500/300 mg/kg/dag (dosis sænket efter 45 ugers dosering). Eksponeringen ved dosis på 300 mg/kg/dag er 9 gange større end en human dosis på 225 mg/dag. Rotter modtog ODV i doser op til 300 mg/kg/dag (hanner) eller 500 mg/kg/dag (hunner). Eksponeringen ved den højeste dosis er ca. 8 (mænd) eller 11 (kvinder) gange større end en human dosis på 225 mg/dag.
Mutagenese
Venlafaxin og den vigtigste humane metabolit, ODV, var ikke mutagent i Ames reverse mutation assay i Salmonella-bakterier eller kinesisk hamster ovarie/HGPRT pattedyrcelle forward gene mutation assay. Venlafaxin var heller ikke mutagent eller klastogent i in vitro BALB/c-3T3 musecelletransformationsanalysen, søsterkromatidudvekslingsassayet i dyrkede kinesiske hamsterovarieceller eller i in vivo kromosomafvigelsesassayet i rotteknoglemarv. ODV var ikke klastogen i in vitro-kromosomafvigelsesanalysen af kinesisk hamster-ovariecelle eller i in vivo-kromosomafvigelsesanalysen hos rotter.
Forringelse af fertilitet
Reproduktions- og fertilitetsundersøgelser af venlafaxin hos rotter viste ingen bivirkninger af venlafaxin på mandlig eller kvindelig fertilitet ved orale doser på op til 2 gange den maksimalt anbefalede humane dosis på 225 mg/dag på mg/m2-basis. Der blev dog observeret nedsat fertilitet i et studie, hvor han- og hunrotter blev behandlet med O-desmethylvenlafaxin (ODV), den vigtigste humane metabolit af venlafaxin, før og under parring og drægtighed. Dette skete ved en ODV-eksponering (AUC) ca. 2 til 3 gange den, der var forbundet med en human venlafaxindosis på 225 mg/dag.
Brug i specifikke populationer
Graviditet
Teratogene virkninger
Graviditetskategori C
Venlafaxin forårsagede ikke misdannelser hos afkom fra rotter eller kaniner, der fik doser op til 2,5 gange (rotte) eller 4 gange (kanin) den maksimale anbefalede daglige dosis til mennesker på mg/m2-basis. Hos rotter var der dog et fald i hvalpevægten, en stigning i dødfødte hvalpe og en stigning i hvalpedødsfald i løbet af de første 5 dage af diegivningen, hvor doseringen begyndte under drægtighed og fortsatte indtil fravænning. Årsagen til disse dødsfald kendes ikke. Disse virkninger opstod ved 2,5 gange (mg/m2) den maksimale humane daglige dosis. Ingen effektdosis for rotteungers dødelighed var 0,25 gange den humane dosis på mg/m2-basis. I reproduktionsmæssige udviklingsstudier hos rotter og kaniner med O-desmethylvenlafaxin (ODV), den vigtigste humane metabolit af venlafaxin, blev der ikke observeret tegn på teratogenicitet ved eksponeringsmarginer på 13 hos rotter og 0,3 hos kaniner. Der er ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder. Effexor XR bør kun anvendes under graviditet, hvis den potentielle fordel opvejer den potentielle risiko for fosteret. Da reproduktionsstudier på dyr ikke altid forudsiger human respons, bør dette lægemiddel kun anvendes under graviditet, hvis det er klart nødvendigt.
Ikke-teratogene virkninger
Nyfødte, der er udsat for Effexor 37,5 mg XR, andre SNRI'er eller SSRI'er sent i tredje trimester har udviklet komplikationer, der kræver langvarig hospitalsindlæggelse, respiratorisk støtte og sondeernæring. Sådanne komplikationer kan opstå umiddelbart efter levering. Rapporterede kliniske fund har inkluderet åndedrætsbesvær, cyanose, apnø, kramper, temperaturustabilitet, ernæringsbesvær, opkastning, hypoglykæmi, hypotoni, hypertoni, hyperrefleksi, tremor, nervøsitet, irritabilitet og konstant gråd. Disse egenskaber stemmer overens med enten en direkte toksisk virkning af SSRI'er og SNRI'er eller muligvis et lægemiddelafbrydelsessyndrom. Det skal bemærkes, at det kliniske billede i nogle tilfælde stemmer overens med serotonergt syndrom [se ADVARSLER OG FORHOLDSREGLER og DRUGSINTERAKTIONER ]. Ved behandling af en gravid kvinde med Effexor XR i tredje trimester, bør lægen nøje overveje de potentielle risici og fordele ved behandlingen.
Arbejde og levering
Effekten af venlafaxin på fødsel og fødsel hos mennesker er ukendt.
Ammende mødre
Venlafaxin og ODV er blevet rapporteret at blive udskilt i modermælk. På grund af risikoen for alvorlige bivirkninger hos ammende spædbørn fra Effexor XR, bør der tages en beslutning om, hvorvidt amningen skal ophøre eller om at seponere lægemidlet, idet der tages hensyn til lægemidlets betydning for moderen.
Pædiatrisk brug
To placebokontrollerede forsøg med 766 pædiatriske patienter med MDD og to placebokontrollerede forsøg med 793 pædiatriske patienter med GAD er blevet udført med Effexor XR, og dataene var ikke tilstrækkelige til at understøtte en påstand om brug til pædiatriske patienter.
Enhver, der overvejer at bruge Effexor XR til et barn eller en teenager, skal balancere de potentielle risici med det kliniske behov [se KASSE ADVARSEL , ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ].
Selvom ingen undersøgelser er designet til primært at vurdere Effexor 37,5 mg XR's indvirkning på børn og unges vækst, udvikling og modning, tyder de udførte undersøgelser på, at Effexor XR kan påvirke vægt og højde negativt [se ADVARSLER OG FORHOLDSREGLER ]. Hvis der træffes beslutning om at behandle en pædiatrisk patient med Effexor XR, anbefales regelmæssig monitorering af vægt og højde under behandlingen, især hvis behandlingen skal fortsættes over længere tid [se ADVARSLER OG FORHOLDSREGLER ]. Sikkerheden af Effexor 75 mg XR-behandling til pædiatriske patienter er ikke blevet systematisk vurderet for kronisk behandling af længere varighed end seks måneder. I de undersøgelser, der blev udført med pædiatriske patienter (i alderen 6-17), var forekomsten af blodtryks- og kolesterolstigninger, der anses for at være klinisk relevante hos pædiatriske patienter, den samme som den, der blev observeret hos voksne patienter. Forholdsreglerne for voksne gælder derfor for pædiatriske patienter [se ADVARSLER OG FORHOLDSREGLER ].
Geriatrisk brug
Procentdelen af patienter i kliniske undersøgelser for Effexor 37,5 mg XR for MDD, GAD, SAD og PD, som var 65 år eller ældre, er vist i tabel 15.
Der blev ikke observeret nogen overordnede forskelle i effektivitet eller sikkerhed mellem geriatriske patienter og yngre patienter, og anden rapporteret klinisk erfaring har generelt ikke identificeret forskelle i respons mellem ældre og yngre patienter. Større følsomhed hos nogle ældre individer kan dog ikke udelukkes. SSRI'er og SNRI'er, inklusive Effexor XR, er blevet forbundet med tilfælde af klinisk signifikant hyponatriæmi hos ældre patienter, som kan have større risiko for denne bivirkning [se ADVARSLER OG FORHOLDSREGLER ].
Farmakokinetikken af venlafaxin og ODV er ikke væsentligt ændret hos ældre [se KLINISK FARMAKOLOGI ] (se figur 3). Ingen dosisjustering anbefales til ældre alene på basis af alder, selvom andre kliniske omstændigheder, hvoraf nogle kan være mere almindelige hos ældre, såsom nedsat nyre- eller leverfunktion, kan berettige en dosisreduktion [se DOSERING OG ADMINISTRATION ].
Alder Og Køn
En farmakokinetisk populationsanalyse af 404 Effexor-behandlede patienter fra to undersøgelser, der involverede regimer både to gange dagligt og tre gange dagligt, viste, at dosisnormaliserede dalplasmaniveauer af enten venlafaxin eller ODV var uændrede af alders- eller kønsforskelle. Dosisjustering baseret på en patients alder eller køn er generelt ikke nødvendig [se DOSERING OG ADMINISTRATION ] (se tabel 15).
Brug i patientundergrupper
Figur 3: Farmakokinetik af venlafaxin og dets metabolit O-desmethylvenlafaxin (ODV) i særlige populationer.
OVERDOSIS
Menneskelig oplevelse
Under præmarketingevalueringerne af Effexor 75 mg XR (for MDD, GAD, SAD og PD) og Effexor (for MDD) var der tyve rapporter om akut overdosering med Effexor (henholdsvis 6 og 14 rapporter hos Effexor XR og Effexor 75 mg patienter) , enten alene eller i kombination med andre stoffer og/eller alkohol.
Somnolens var det hyppigst rapporterede symptom. Blandt de andre rapporterede symptomer var paræstesi af alle fire lemmer, moderat svimmelhed, kvalme, følelsesløse hænder og fødder og varme-kulde anfald 5 dage efter overdoseringen. I de fleste tilfælde var der ingen tegn eller symptomer forbundet med overdosering. Størstedelen af rapporterne involverede indtagelse, hvor den samlede dosis af venlafaxin blev estimeret til ikke at være mere end flere gange højere end den sædvanlige terapeutiske dosis. En patient, der indtog 2,75 g venlafaxin, blev observeret at have to generaliserede kramper og en forlængelse af QTc til 500 msek sammenlignet med 405 msek ved baseline. Mild sinustakykardi blev rapporteret hos to af de andre patienter.
Tiltag for at behandle overdoseringen omfattede ingen behandling, hospitalsindlæggelse og symptomatisk behandling og hospitalsindlæggelse plus behandling med aktivt kul. Alle patienter kom sig.
Efter markedsføringserfaring er overdosering med venlafaxin overvejende forekommet i kombination med alkohol og/eller andre lægemidler. De mest almindeligt rapporterede hændelser ved overdosering omfatter takykardi, ændringer i bevidsthedsniveau (lige fra døsighed til koma), mydriasis, kramper og opkastninger.
Elektrokardiogramforandringer (f.eks. forlængelse af QT-interval, bundtgrenblok, QRS-forlængelse), ventrikulær takykardi, bradykardi, hypotension, rhabdomyolyse, vertigo, levernekrose, serotonergt syndrom og død er blevet rapporteret.
Publicerede retrospektive undersøgelser rapporterer, at overdosering af venlafaxin kan være forbundet med en øget risiko for dødelige udfald sammenlignet med den, der er observeret med SSRI-antidepressiva, men lavere end for tricykliske antidepressiva. Epidemiologiske undersøgelser har vist, at venlafaxin-behandlede patienter har en højere allerede eksisterende byrde af selvmordsrisikofaktorer end SSRI-behandlede patienter. Det er ikke klart, i hvilket omfang fundet af en øget risiko for dødelige udfald kan tilskrives venlafaxins toksicitet ved overdosering, i modsætning til nogle karakteristika hos venlafaxinbehandlede patienter. Recepter til Effexor 75 mg XR bør udskrives for den mindste mængde kapsler i overensstemmelse med god patientbehandling for at reducere risikoen for overdosering.
Håndtering af overdosering
Kontakt et certificeret giftkontrolcenter for at få opdateret vejledning og rådgivning (1-800-222-1222 eller www.poison.org). I tilfælde af en overdosis, yde støttende pleje, herunder tæt medicinsk overvågning og overvågning. Behandlingen bør bestå af de generelle foranstaltninger, der anvendes til håndtering af overdosering med et hvilket som helst lægemiddel. Overvej muligheden for overdosering af flere lægemidler. Sørg for en tilstrækkelig luftvej, iltning og ventilation. Overvåg hjerterytmen og vitale tegn. Giv støttende og symptomatiske foranstaltninger.
KONTRAINDIKATIONER
Overfølsomhed
Overfølsomhed over for venlafaxinhydrochlorid, desvenlafaxinsuccinat eller over for hjælpestoffer i formuleringen
Samtidig brug med monoaminoxidasehæmmere (MAO-hæmmere)
Brug af MAO-hæmmere (beregnet til behandling af psykiatriske lidelser) samtidig med Effexor 75 mg XR eller inden for 7 dage efter seponering af behandling med Effexor XR er kontraindiceret på grund af en øget risiko for serotonergt syndrom. Brugen af Effexor 37,5 mg XR inden for 14 dage efter seponering af behandling med en MAO-hæmmer (beregnet til behandling af psykiatriske lidelser) er også kontraindiceret [se DOSERING OG ADMINISTRATION , ADVARSLER OG FORHOLDSREGLER , og DRUGSINTERAKTIONER ].
Start af Effexor XR hos en patient, der er i behandling med en MAO-hæmmer såsom linezolid eller intravenøs methylenblåt, er også kontraindiceret på grund af en øget risiko for serotonergt syndrom [se DOSERING OG ADMINISTRATION , ADVARSLER OG FORHOLDSREGLER , og DRUGSINTERAKTIONER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Den nøjagtige mekanisme for venlafaxins antidepressive virkning hos mennesker er ukendt, men menes at være relateret til forstærkningen af serotonin og noradrenalin i centralnervesystemet gennem hæmning af deres genoptagelse. Ikke-kliniske undersøgelser har vist, at venlafaxin og dets aktive metabolit, ODV, er potente og selektive hæmmere af neuronal serotonin- og noradrenalin-genoptagelse og svage hæmmere af dopamin-genoptagelse.
Farmakodynamik
Venlafaxin og ODV har ingen signifikant affinitet for muskarin-cholinerge, H1-histaminerge eller α1-adrenerge receptorer in vitro. Farmakologisk aktivitet ved disse receptorer antages at være forbundet med de forskellige antikolinerge, beroligende og kardiovaskulære virkninger, der ses med andre psykotrope stoffer. Venlafaxin og ODV har ikke monoaminoxidase (MAO)-hæmmende aktivitet.
Hjerteelektrofysiologi
Effekten af venlafaxin på QT-intervallet blev evalueret i et randomiseret, dobbeltblindt, placebo- og positivt kontrolleret tre-perioders crossover grundigt QT-studie med 54 raske voksne forsøgspersoner. Der blev ikke påvist nogen signifikant QT-forlængende effekt af venlafaxin 450 mg.
Farmakokinetik
Steady-state koncentrationer af venlafaxin og ODV i plasma opnås inden for 3 dage efter oral flerdosisbehandling. Venlafaxin og ODV udviste lineær kinetik over dosisområdet 75 til 450 mg pr. dag. Gennemsnitlig ± SD steady-state plasmaclearance af venlafaxin og ODV er henholdsvis 1,3±0,6 og 0,4±0,2 l/time/kg; tilsyneladende eliminationshalveringstid er henholdsvis 5±2 og 11±2 timer; og tilsyneladende (steady-state) fordelingsvolumen er henholdsvis 7,5±3,7 og 5,7±1,8 l/kg. Venlafaxin og ODV er minimalt bundet i terapeutiske koncentrationer til plasmaproteiner (henholdsvis 27 % og 30 %).
Absorption og distribution
Venlafaxin absorberes godt og metaboliseres i udstrakt grad i leveren. ODV er den vigtigste aktive metabolit. På basis af massebalanceundersøgelser absorberes mindst 92 % af en enkelt oral dosis venlafaxin. Den absolutte biotilgængelighed af venlafaxin er ca. 45 %.
Administration af Effexor 37,5 mg XR (150 mg én gang dagligt) resulterede generelt i lavere Cmax og senere Tmax værdier end for Effexor (øjeblikkelig frigivelse) administreret to gange dagligt (tabel 16). Når lige store daglige doser af venlafaxin blev administreret som enten en tablet med øjeblikkelig frigivelse eller kapslen med forlænget frigivelse, var eksponeringen for både venlafaxin og ODV ens for de to behandlinger, og udsvinget i plasmakoncentrationerne var lidt lavere med Effexor 37,5 mg XR kapsel. Derfor giver Effexor XR en langsommere absorptionshastighed, men samme grad af absorption sammenlignet med tabletten med øjeblikkelig frigivelse.
Mad påvirkede ikke biotilgængeligheden af venlafaxin eller dets aktive metabolit, ODV. Indgivelsestidspunktet (AM versus PM) påvirkede ikke farmakokinetikken af venlafaxin og ODV fra 75 mg Effexor 75 mg XR-kapslen.
Venlafaxin er ikke i høj grad bundet til plasmaproteiner; derfor bør administration af Effexor 37,5 mg XR til en patient, der tager et andet lægemiddel, som er stærkt proteinbundet, ikke forårsage øgede frie koncentrationer af det andet lægemiddel.
Metabolisme og eliminering
Efter absorption gennemgår venlafaxin omfattende præsystemisk metabolisme i leveren, primært til ODV, men også til N-desmethylvenlafaxin, N,O-didesmethylvenlafaxin og andre mindre metabolitter. In vitro undersøgelser indikerer, at dannelsen af ODV katalyseres af CYP2D6; dette er blevet bekræftet i et klinisk studie, der viser, at patienter med lave CYP2D6-niveauer (dårlige metabolisatorer) havde øgede niveauer af venlafaxin og reducerede niveauer af ODV sammenlignet med personer med normale CYP2D6-niveauer (udstrakte metabolisatorer) [se Brug i specifikke populationer ].
Ca. 87 % af en venlafaxindosis genfindes i urinen inden for 48 timer som uændret venlafaxin (5 %), ukonjugeret ODV (29 %), konjugeret ODV (26 %) eller andre mindre inaktive metabolitter (27 %). Renal elimination af venlafaxin og dets metabolitter er således den primære udskillelsesvej.
Kliniske Studier
Større depressiv lidelse
Effekten af Effexor 75mg XR (venlafaxinhydrochlorid) depotkapsler som behandling af svær depressiv lidelse (MDD) blev fastlagt i to placebokontrollerede, kortvarige (8 uger for undersøgelse 1; 12 uger for undersøgelse 2), fleksible -dosisundersøgelser, med doser startende ved 75 mg pr. dag og varierende til 225 mg pr. dag hos voksne ambulante patienter, der opfylder DSM-III-R eller DSM-IV kriterierne for MDD. Hos moderat deprimerede ambulante patienter var startdosis venlafaxin 75 mg dagligt. I begge undersøgelser viste Effexor XR overlegenhed i forhold til placebo på det primære effektmål defineret som ændring fra baseline i HAM-D-21 totalscore til endepunktsbesøget, Effexor XR viste også overlegenhed i forhold til placebo på det vigtigste sekundære effektmål, det kliniske Global Impressions (CGI) Alvorlighedsskala for sygdom. Undersøgelse af kønsundergrupper af den undersøgte befolkning afslørede ikke nogen differentiel reaktionsevne på grundlag af køn.
En 4-ugers undersøgelse af indlagte patienter, der opfylder DSM-III-R-kriterierne for MDD med melankoli, ved brug af Effexor 37,5 mg i et interval på 150 til 375 mg om dagen (opdelt i et skema tre gange om dagen) viste Effexors overlegenhed i forhold til placebo baseret på HAM-D-21 totalscore. Gennemsnitsdosis hos fuldbyrdede personer var 350 mg dagligt (undersøgelse 3).
et længerevarende studie blev voksne ambulante patienter med MDD, som havde reageret under et 8-ugers åbent studie med Effexor 37,5 mg XR (75, 150 eller 225 mg, én gang dagligt hver morgen), randomiseret til at fortsætte med deres samme Effexor XR dosis eller placebo i op til 26 ugers observation for tilbagefald. Respons under den åbne fase blev defineret som en CGI Sværhedsgrad af Sygdom-elementscore på ≤3 og en HAM-D-21 totalscore på ≤10 ved dag 56-evalueringen. Tilbagefald under den dobbeltblinde fase blev defineret som følger: (1) en genkomst af svær depressiv lidelse som defineret af DSM-IV kriterier og en CGI Severity of Illness item score på ≥4 (moderat syg), (2) 2 på hinanden følgende CGI Sværhedsgrad af sygdom punktscore på ≥4 eller (3) en endelig CGI Sværhedsgrad af sygdom punktscore på ≥4 for enhver patient, der trak sig fra undersøgelsen af en eller anden grund. Patienter, der fik fortsat Effexor 37,5 mg XR-behandling, oplevede statistisk signifikant lavere tilbagefaldsrater over de efterfølgende 26 uger sammenlignet med dem, der fik placebo (undersøgelse 4).
et andet længerevarende forsøg, voksne ambulante patienter med MDD, tilbagevendende type, som havde reageret (HAM-D21 total score ≤ 12 ved evalueringen på dag 56) og fortsatte med at blive forbedret [defineret som følgende kriterier blev opfyldt for dag 56 til 180 : (1) ingen HAM-D-21 total score ≥ 20; (2) ikke mere end 2 HAM39 D-21 totalscore > 10, og (3) ingen enkelt CGI Sværhedsgrad af Sygdom item score ≥ 4 (moderat syg)] i løbet af de første 26 ugers behandling på Effexor [100 til 200 mg pr. dag, på et skema to gange dagligt] blev randomiseret til fortsættelse af deres samme Effexor-dosis eller til placebo. Opfølgningsperioden for at observere patienter for tilbagefald, defineret som en CGI-sværhedsgrad af sygdom item-score ≥ 4, var i op til 52 uger. Patienter, der fik fortsat Effexor-behandling, oplevede statistisk signifikant lavere tilbagefaldsrater over de efterfølgende 52 uger sammenlignet med dem, der fik placebo (undersøgelse 5).
Generaliseret angstlidelse
Effekten af Effexor XR som behandling af generaliseret angstlidelse (GAD) blev fastslået i to 8-ugers placebokontrollerede studier med fast dosis (75 til 225 mg dagligt), et 6-måneders, placebokontrolleret, fleksibelt -dosisundersøgelse (75 til 225 mg pr. dag) og en 6-måneders, placebokontrolleret, fastdosisundersøgelse (37,5, 75 og 150 mg pr. dag) hos voksne ambulante patienter, der opfylder DSM-IV-kriterierne for GAD.
en 8-ugers undersøgelse viste Effexor XR overlegenhed i forhold til placebo for 75, 150 og 225 mg daglige doser målt ved Hamilton Rating Scale for Anxiety (HAM-A) totalscore, både HAM-A angst og spænding elementer og Clinical Global Impressions (CGI) skalaen. Doserne på 75 og 150 mg pr. dag var dog ikke så konsekvent effektive som den højeste dosis (undersøgelse 1). En anden 8-ugers undersøgelse, der evaluerede doser på 75 og 150 mg dagligt og placebo viste, at begge doser var mere effektive end placebo på nogle af de samme resultater; dog var dosis på 75 mg pr. dag mere konsekvent effektiv end dosis på 150 mg pr. dag (undersøgelse 2). En dosis-respons sammenhæng for effektivitet i GAD blev ikke klart etableret i det undersøgte dosisområde på 75 til 225 mg pr. dag.
To 6-måneders undersøgelser, hvoraf den ene evaluerede Effexor 75 mg XR doser på 37,5, 75 og 150 mg dagligt (undersøgelse 3) og den anden evaluerede Effexor XR doser på 75 til 225 mg dagligt (undersøgelse 4), viste, at daglige doser af 75 mg eller højere var mere effektive end placebo på HAM-A-total, både HAM-A-angst- og spændingspunkterne og CGI-skalaen under 6 måneders behandling. Selvom der også var evidens for overlegenhed i forhold til placebo for 37,5 mg daglig dosis, var denne dosis ikke så konsekvent effektiv som de højere doser.
Undersøgelse af kønsundergrupper af den undersøgte befolkning afslørede ikke nogen differentiel reaktionsevne på grundlag af køn.
Social angst (også kendt som social fobi)
Effekten af Effexor 37,5 mg XR som behandling af social angstlidelse (SAD) blev fastslået i fire dobbeltblindede, parallelgruppe, 12-ugers, multicenter, placebokontrollerede, fleksible dosisundersøgelser (undersøgelse 1-4) og et dobbeltblindt, parallel-gruppe, 6-måneders, placebokontrolleret, fast/fleksibel dosis studie, som omfattede doser i et interval på 75 til 225 mg dagligt hos voksne ambulante patienter, der opfylder DSM-IV kriterierne for SAD (undersøgelse 5 ).
I disse fem undersøgelser var Effexor 75 mg XR statistisk signifikant mere effektiv end placebo ved ændring fra baseline til endepunkt på Liebowitz Social Anxiety Scale (LSAS) totalscore. Der var ingen evidens for nogen større effektivitet af 150 til 225 mg per dag-gruppen sammenlignet med 75 mg per dag-gruppen i 6-måneders undersøgelsen.
Undersøgelse af undergrupper af den undersøgte population afslørede ikke nogen differentiel reaktionsevne på grundlag af køn. Der var utilstrækkelig information til at bestemme effekten af alder eller race på resultatet i disse undersøgelser.
Paniklidelse
Effekten af Effexor XR som behandling af panikangst (PD) blev fastslået i to dobbeltblindede, 12-ugers, multicenter, placebokontrollerede undersøgelser hos voksne ambulante patienter, der opfylder DSM-IV-kriterierne for PD, med eller uden agorafobi. Patienterne fik faste doser på 75 eller 150 mg pr. dag i den ene undersøgelse (undersøgelse 1) og 75 eller 225 mg pr. dag i den anden undersøgelse (undersøgelse 2).
Effekten blev vurderet på basis af resultater i tre variabler: (1) procentdel af patienter fri for fuld-symptom panikanfald på Panic and Anticipatory Anxiety Scale (PAAS); (2) gennemsnitlig ændring fra baseline til endepunkt på Panic Disorder Severity Scale (PDSS) totalscore; og (3) procentdel af patienter vurderet som respondere (meget forbedret eller meget forbedret) på Clinical Global Impressions (CGI) Improvement-skalaen. I disse to undersøgelser var Effexor XR statistisk signifikant mere effektiv end placebo (for hver fast dosis) på alle tre endepunkter, men en dosis-respons sammenhæng var ikke klart fastlagt.
Undersøgelse af undergrupper af den undersøgte population afslørede ikke nogen differentiel reaktionsevne på grundlag af køn. Der var utilstrækkelig information til at bestemme effekten af alder eller race på resultatet i disse undersøgelser.
et længerevarende studie (undersøgelse 3) blev voksne ambulante patienter, der opfylder DSM-IV-kriterierne for PD, som havde reageret i en 12-ugers åben fase med Effexor 75 mg XR (75 til 225 mg pr. dag), tilfældigt tildelt til at fortsætte den samme Effexor 75 mg. XR dosis (75, 150 eller 225 mg) eller skift til placebo til observation for tilbagefald under dobbeltblinde tilstande. Respons under den åbne fase blev defineret som ≤ 1 fuldsymptom panikanfald om ugen i løbet af de sidste 2 uger af den åbne fase og en CGI-forbedringsscore på 1 (meget forbedret) eller 2 (meget forbedret). Tilbagefald under den dobbeltblinde fase blev defineret som at have 2 eller flere fuldsymptomiske panikanfald om ugen i 2 på hinanden følgende uger eller at have afbrudt på grund af tab af effektivitet som bestemt af investigatorerne under undersøgelsen. Randomiserede patienter var i responsstatus i en gennemsnitlig periode på 34 dage før de blev randomiseret. I den randomiserede fase efter den 12-ugers åbne periode oplevede patienter, der fik fortsat Effexor 75 mg XR, en statistisk signifikant længere tid til tilbagefald.
Pædiatriske patienter
To placebokontrollerede undersøgelser med 766 pædiatriske patienter med MDD og to placebokontrollerede undersøgelser med 793 pædiatriske patienter med GAD er blevet udført med Effexor XR, og dataene var ikke tilstrækkelige til at understøtte en påstand om brug til pædiatriske patienter.
Hvad er Effexor, og hvordan bruges det?
Effexor er en receptpligtig medicin, der bruges til at behandle symptomer på depression, generaliseret angst, social angst og panikangst. Effexor kan bruges alene eller sammen med anden medicin.
Effexor tilhører en klasse af lægemidler kaldet antidepressiva, selektiv serotonin og noradrenalin genoptagelseshæmmer (SNRI).
Hvad er de mulige bivirkninger af Effexor 37,5 mg?
Effexor kan forårsage alvorlige bivirkninger, herunder:
- sløret syn,
- tunnelsyn,
- øjensmerter eller hævelse,
- ser glorier runde lys,
- let blå mærker eller blødninger (næseblod, blødende tandkød),
- blod i din urin eller afføring,
- hoste blod op,
- hoste,
- trykken for brystet,
- vejrtrækningsbesvær,
- kramper (anfald),
- hovedpine,
- forvirring,
- utydelig tale,
- svær svaghed,
- opkastning,
- tab af koordination,
- føler sig ustabil,
- meget stiv (stiv) muskel,
- høj feber,
- svedeture,
- forvirring,
- hurtige eller ujævne hjerteslag,
- rystelser, og
- svimmelhed
- Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
- De mest almindelige bivirkninger af Effexor omfatter:
- svimmelhed,
- døsighed,
- angst,
- føler sig nervøs,
- søvnproblemer (søvnløshed),
- synsforandringer,
- kvalme,
- opkastning,
- diarré,
- ændringer i vægt eller appetit,
- tør mund,
- gaber,
- øget svedtendens,
- nedsat sexlyst,
- impotens,
- unormal ejakulation, og
- svært ved at få orgasme
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Effexor. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
Suicidalitet og antidepressive stoffer
Antidepressiva øgede risikoen sammenlignet med placebo for selvmordstanker og -adfærd (suicidalitet) hos børn, unge og unge voksne i kortvarige undersøgelser af Major Depressive Disorder (MDD) og andre psykiatriske lidelser. Enhver, der overvejer at bruge venlafaxin-tabletter, USP eller ethvert andet antidepressivt middel til et barn, en teenager eller en ung voksen, skal balancere denne risiko med det kliniske behov. Korttidsundersøgelser viste ikke en stigning i risikoen for suicidalitet med antidepressiva sammenlignet med placebo hos voksne efter 24 år; der var en reduktion i risikoen med antidepressiva sammenlignet med placebo hos voksne på 65 år og derover. Depression og visse andre psykiatriske lidelser er i sig selv forbundet med øget risiko for selvmord. Patienter i alle aldre, der påbegyndes med antidepressiv behandling, bør overvåges passende og observeres nøje for klinisk forværring, suicidalitet eller usædvanlige ændringer i adfærd. Familier og pårørende bør informeres om behovet for tæt observation og kommunikation med den ordinerende læge. Venlafaxin tabletter, USP er ikke godkendt til brug hos pædiatriske patienter. (Se ADVARSLER : Klinisk forværring og selvmordsrisiko , PATIENTOPLYSNINGER , og FORHOLDSREGLER : Pædiatrisk brug ).
BESKRIVELSE
Venlafaxin tabletter, USP er et strukturelt nyt antidepressivum til oral administration. Det betegnes (R/S)-1-[2-(dimethylamino)-1-(4-methoxyphenyl)ethyl]cyclohexanolhydrochlorid eller (±)-1-[α-[(dimethylamino)methyl]-p- methoxybenzyl]cyclohexanolhydrochlorid og har den empiriske formel C17H27NO2 HCl. Dens molekylvægt er 313,87. Strukturformlen er vist nedenfor.
Venlafaxinhydrochlorid er et hvidt til råhvidt krystallinsk fast stof med en opløselighed på 572 mg/ml i vand (justeret til ionstyrke på 0,2 M med natriumchlorid). Dens oktanol:vand (0,2 M natriumchlorid) fordelingskoefficient er 0,43.
Komprimerede tabletter indeholder venlafaxinhydrochlorid, USP svarende til 25 mg, 37,5 mg, 50 mg, 75 mg eller 100 mg venlafaxinbase og følgende inaktive ingredienser: mikrokrystallinsk cellulose, lactosemonohydrat, prægelatineret stivelse, natriumstivelsesglycolat, jernoxidrødt gul jernoxid, kolloid siliciumdioxid og magnesiumstearat.
