Seroquel 25mg, 50mg, 100mg, 200mg, 300mg Quetiapine Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Seroquel 100mg, og hvordan bruges det?
Seroquel 50mg er en receptpligtig medicin, der bruges til at behandle symptomerne på skizofreni, bipolar I lidelse, mani; Bipolar lidelse, depressive episoder; Bipolar I lidelse, vedligeholdelse; og svær depressiv lidelse. Seroquel 50mg kan bruges alene eller sammen med anden medicin.
Seroquel tilhører en klasse af lægemidler kaldet Antipsykotika, 2. generation; Antimaniske midler.
Det vides ikke, om Seroquel 200mg er sikkert og effektivt til børn under 12 år.
Hvad er de mulige bivirkninger af Seroquel 50mg?
Seroquel kan forårsage alvorlige bivirkninger, herunder:
- ukontrollerede muskelbevægelser i dit ansigt (tygge, læbesmaske, rynke panden, tungebevægelse, blinke eller øjenbevægelser),
- maskelignende udseende af ansigtet,
- synkebesvær,
- problemer med tale,
- svimmelhed,
- svær forstoppelse,
- smertefuld eller vanskelig vandladning,
- sløret syn,
- tunnelsyn,
- øjensmerter,
- ser glorier omkring lys,
- meget stive (stive) muskler,
- høj feber,
- svedeture,
- forvirring,
- hurtige eller ujævne hjerteslag,
- rystelser,
- besvimelse,
- øget tørst,
- øget vandladning,
- tør mund,
- frugtig ånde lugt,
- feber,
- kuldegysninger,
- sår i munden,
- hudsår,
- ondt i halsen,
- hoste, og
- vejrtrækningsbesvær
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Seroquel omfatter:
- taleproblemer,
- svimmelhed,
- døsighed,
- træthed,
- mangel på energi,
- hurtige hjerteslag,
- tilstoppet næse,
- øget appetit,
- vægtøgning,
- dårlig mave,
- opkastning,
- forstoppelse,
- mundtørhed, og
- unormal leverfunktionstest
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Seroquel. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
ØGET DØDELIGHED HOS ÆLDRE PATIENTER MED DEMENSREATERET PSYKOSE; og SELVmordstanker og -adfærd
Øget dødelighed hos ældre patienter med demensrelateret psykose
Ældre patienter med demensrelateret psykose behandlet med antipsykotiske lægemidler har en øget risiko for død [se ADVARSLER OG FORHOLDSREGLER]. SEROQUEL er ikke godkendt til behandling af patienter med demensrelateret psykose [se ADVARSLER OG FORHOLDSREGLER].
Selvmordstanker og -adfærd
Antidepressiva øgede risikoen for selvmordstanker og -adfærd hos børn, unge og unge voksne i korttidsundersøgelser. Disse undersøgelser viste ikke en stigning i risikoen for selvmordstanker og -adfærd ved brug af antidepressiva hos patienter over 24 år; der var en reduktion i risikoen ved brug af antidepressiva hos patienter på 65 år og ældre [se ADVARSLER OG FORHOLDSREGLER].
Hos patienter i alle aldre, som er startet på antidepressiv behandling, skal du nøje overvåge for forværring og for fremkomsten af selvmordstanker og -adfærd. Rådgiv familier og pårørende om behovet for tæt observation og kommunikation med den ordinerende læge [se ADVARSLER OG FORHOLDSREGLER].
SEROQUEL 50mg er ikke godkendt til brug hos pædiatriske patienter under ti år [se Anvendelse i specifikke populationer].
BESKRIVELSE
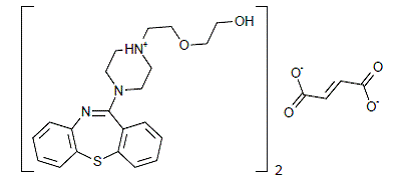
SEROQUEL® (quetiapinfumarat) er et psykotropt middel, der tilhører en kemisk klasse, dibenzothiazepinderivaterne. Den kemiske betegnelse er 2-[2-(4-dibenzo[b,f][1,4]thiazepin-11-yl-1-piperazinyl)ethoxy]-ethanolfumarat (2:1) (salt). Det er til stede i tabletter som fumaratsaltet. Alle doser og tabletstyrker er udtrykt som milligram base, ikke som fumaratsalt. Dens molekylære formel er C42H50N6O4S2•C4H4O4, og den har en molekylvægt på 883,11 (fumaratsalt). Strukturformlen er:
Quetiapinfumarat er et hvidt til råhvidt krystallinsk pulver, som er moderat opløseligt i vand.
SEROQUEL leveres til oral administration som 25 mg (rund, fersken), 50 mg (rund, hvid), 100 mg (rund, gul), 200 mg (rund, hvid), 300 mg (kapselformet, hvid) og 400 mg (kapselformede, gule) tabletter.
Inaktive ingredienser er povidon, dibasisk dicalciumphosphatdihydrat, mikrokrystallinsk cellulose, natriumstivelsesglycolat, lactosemonohydrat, magnesiumstearat, hypromellose, polyethylenglycol og titaniumdioxid.
25 mg tabletterne indeholder rødt jernoxid og gult jernoxid, og 100 mg og 400 mg tabletterne indeholder kun gult jernoxid.
INDIKATIONER
Skizofreni
SEROQUEL XR er indiceret til behandling af skizofreni. Effekten af SEROQUEL XR til skizofreni blev fastslået i et 6-ugers og et vedligeholdelsesstudie hos voksne med skizofreni. Effekten blev understøttet af tre 6-ugers forsøg med voksne med skizofreni og et 6-ugers forsøg med unge med skizofreni (13-17 år) behandlet med SEROQUEL [se Kliniske Studier ].
Maniodepressiv
SEROQUEL 25 mg XR er indiceret til akut behandling af maniske eller blandede episoder forbundet med bipolar lidelse I, både som monoterapi og som et supplement til lithium eller divalproex. Effekten af SEROQUEL XR ved maniske eller blandede episoder af bipolar I lidelse blev fastslået i et 3-ugers forsøg hos voksne med maniske eller blandede episoder forbundet med bipolar I lidelse. Effekten blev understøttet af to 12-ugers monoterapiforsøg og et 3-ugers supplerende forsøg hos voksne med maniske episoder forbundet med bipolar I lidelse samt et 3-ugers monoterapiforsøg hos børn og unge (10 - 17 år) med maniske episoder forbundet med med bipolar lidelse I behandlet med SEROQUEL [se Kliniske Studier ].
SEROQUEL 100mg XR er indiceret til akut behandling af depressive episoder forbundet med bipolar lidelse. Effekten af SEROQUEL XR blev fastslået i et 8-ugers forsøg med voksne med bipolar I- eller II-lidelse og understøttet af to 8-ugers forsøg med voksne med bipolar I- eller II-lidelse behandlet med SEROQUEL [se Kliniske Studier ].
SEROQUEL 100 mg XR er indiceret til vedligeholdelsesbehandling af bipolar lidelse I, som et supplement til lithium eller divalproex. Effekten blev ekstrapoleret fra to vedligeholdelsesforsøg hos voksne med bipolar lidelse I behandlet med SEROQUEL. Effektiviteten af monoterapi til vedligeholdelsesbehandling af bipolar lidelse I er ikke blevet systematisk evalueret i kontrollerede kliniske forsøg [se Kliniske Studier ].
Tillægsbehandling af svær depressiv lidelse (MDD)
SEROQUEL 100mg XR er indiceret til brug som supplerende terapi til antidepressiva til behandling af MDD. Effekten af SEROQUEL XR som tillægsbehandling til antidepressiva ved MDD blev fastslået i to 6-ugers forsøg med voksne med MDD, som havde et utilstrækkeligt respons på antidepressiv behandling [se Kliniske Studier ].
Særlige overvejelser ved behandling af pædiatrisk skizofreni og bipolar lidelse I
Pædiatrisk skizofreni og bipolar lidelse I er alvorlige psykiske lidelser, men diagnosen kan være udfordrende. For pædiatrisk skizofreni kan symptomprofiler være variable, og for bipolar I-lidelse kan patienter have varierende mønstre af periodicitet af maniske eller blandede symptomer. Det anbefales, at medicinbehandling til pædiatrisk skizofreni og bipolar lidelse I først påbegyndes, efter at der er foretaget en grundig diagnostisk evaluering og nøje overvejet de risici, der er forbundet med medicinbehandling. Medicinbehandling til både pædiatrisk skizofreni og bipolar lidelse I er indiceret som en del af et samlet behandlingsprogram, der ofte omfatter psykologiske, pædagogiske og sociale interventioner.
DOSERING OG ADMINISTRATION
Vigtige administrationsinstruktioner
SEROQUEL XR tabletter skal sluges hele og ikke deles, tygges eller knuses.
Det anbefales, at SEROQUEL 50 mg XR tages uden mad eller sammen med et let måltid (ca. 300 kalorier) [se KLINISK FARMAKOLOGI ].
SEROQUEL 25mg XR bør administreres én gang dagligt, helst om aftenen.
Anbefalet dosering
Den anbefalede startdosis, titrering, dosisområde og maksimal SEROQUEL 50 mg XR dosis for hver godkendt indikation er vist i tabel 1 nedenfor. Efter indledende dosering kan justeringer foretages opad eller nedad, hvis det er nødvendigt, afhængigt af patientens kliniske respons og tolerabilitet [se Kliniske Studier ].
Vedligeholdelsesbehandling for skizofreni og bipolar lidelse I
Vedligeholdelsesbehandling
Patienter bør periodisk revurderes for at bestemme behovet for vedligeholdelsesbehandling og den passende dosis til en sådan behandling [se Kliniske Studier ].
Dosisændringer hos ældre patienter
Det bør overvejes at lave en langsommere dosistitreringshastighed og en lavere måldosis hos ældre og hos patienter, som er svækkede, eller som har en disposition for hypotensive reaktioner [se Brug i specifikke populationer , og KLINISK FARMAKOLOGI ]. Når det er indiceret, bør dosiseskalering udføres med forsigtighed hos disse patienter.
Ældre patienter bør startes med SEROQUEL XR 50 mg/dag, og dosis kan øges i trin på 50 mg/dag afhængigt af den enkelte patients kliniske respons og tolerabilitet.
Dosisændringer hos patienter med nedsat leverfunktion
Patienter med nedsat leverfunktion bør startes med SEROQUEL XR 50 mg/dag. Dosis kan øges dagligt i trin på 50 mg/dag til en effektiv dosis, afhængigt af patientens kliniske respons og tolerabilitet.
Dosisændringer ved brug sammen med CYP3A4-hæmmere
SEROQUEL XR-dosis bør reduceres til en sjettedel af den oprindelige dosis, når den samtidig medicineres med en potent CYP3A4-hæmmer (f.eks. ketoconazol, itraconazol, indinavir, ritonavir, nefazodon osv.). Når CYP3A4-hæmmeren seponeres, bør dosis af SEROQUEL XR øges med 6 gange [se KLINISK FARMAKOLOGI og DRUGSINTERAKTIONER ].
Dosisændringer ved brug med CYP3A4-inducere
SEROQUEL XR dosis bør øges op til 5 gange den oprindelige dosis, når den anvendes i kombination med en kronisk behandling (f.eks. mere end 7-14 dage) af en potent CYP3A4 inducer (f.eks. phenytoin, carbamazepin, rifampin, avasimibe, St. John's wort osv.). Dosis bør titreres baseret på den enkelte patients kliniske respons og tolerance. Når CYP3A4-induceren seponeres, bør dosis af SEROQUEL 100 mg XR reduceres til det oprindelige niveau inden for 7-14 dage [se KLINISK FARMAKOLOGI og DRUGSINTERAKTIONER ].
Genopstart af behandling hos patienter, der tidligere er afbrudt
Selvom der ikke er nogen data, der specifikt vedrører genoptagelse af behandlingen, anbefales det, at den indledende doseringsplan følges, når behandlingen genoptages af patienter, som har været ude af SEROQUEL 50 mg XR i mere end en uge. Ved genstart af patienter, der har været ude af SEROQUEL 300 mg XR i mindre end en uge, er det muligvis ikke nødvendigt med gradvis dosisoptrapning, og vedligeholdelsesdosis kan genoptages.
Skift af patienter fra SEROQUEL 50 mg tabletter til SEROQUEL 100 mg XR tabletter
Patienter, der i øjeblikket behandles med SEROQUEL (formulering med øjeblikkelig frigivelse), kan skiftes til SEROQUEL XR med den ækvivalente samlede daglige dosis taget én gang dagligt. Individuelle dosisjusteringer kan være nødvendige.
Skift fra antipsykotika
Der er ingen systematisk indsamlede data til specifikt at adressere skift af patienter fra andre antipsykotika til SEROQUEL 200mg XR eller vedrørende samtidig administration med andre antipsykotika. Mens øjeblikkelig seponering af den tidligere antipsykotiske behandling kan være acceptabel for nogle patienter, kan mere gradvis seponering være mest passende for andre. I alle tilfælde bør perioden med overlappende antipsykotisk administration minimeres. Ved skift af patienter fra depotantipsykotika, hvis det er medicinsk hensigtsmæssigt, påbegyndes SEROQUEL XR-behandling i stedet for den næste planlagte injektion. Behovet for at fortsætte eksisterende ekstrapyramidalt syndrommedicin bør revurderes med jævne mellemrum.
HVORDAN LEVERET
Doseringsformer og styrker
- 50 mg depottabletter er ferskenfarvede, filmovertrukne, kapselformede, bikonvekse, opblødte tabletter med "XR 50" på den ene side og almindelig på den anden side
- 150 mg tabletter med forlænget frigivelse er hvide, filmovertrukne, kapselformede, bikonvekse, intagliterede tabletter med "XR 150" på den ene side og almindelig på den anden side
- 200 mg tabletter med forlænget frigivelse er gule, filmovertrukne, kapselformede, bikonvekse, intagliterede tabletter med "XR 200" på den ene side og almindelig på den anden side
- 300 mg tabletter med forlænget frigivelse er lysegule, filmovertrukne, kapselformede, bikonvekse, intagliterede tabletter med "XR 300" på den ene side og almindelig på den anden side
- 400 mg tabletter med forlænget frigivelse er hvide, filmovertrukne, kapselformede, bikonvekse, intagliterede tabletter med "XR 400" på den ene side og almindelig på den anden side
Opbevaring og håndtering
50 mg tabletter ( NDC 0310-0280-60) fersken, filmovertrukken, kapselformet, bikonveks, intagliteret tablet med "XR 50" på den ene side og almindelig på den anden side, leveres i flasker med 60 tabletter.
150 mg tabletter ( NDC 0310-0281-60) hvid, filmovertrukken, kapselformet, bikonveks, intagliteret tablet med "XR 150" på den ene side og almindelig på den anden side, leveres i flasker med 60 tabletter.
200 mg tabletter ( NDC 0310-0282-60) gul, filmovertrukken, kapselformet, bikonveks, intagliteret tablet med "XR 200" på den ene side og almindelig på den anden, leveres i flasker med 60 tabletter.
300 mg tabletter ( NDC 0310-0283-60) lysegul, filmovertrukken, kapselformet, bikonveks, indbrændt tablet med "XR 300" på den ene side og almindelig på den anden side, leveres i flasker med 60 tabletter.
400 mg tabletter ( NDC 0310-0284-60) hvid, filmovertrukken, kapselformet, bikonveks, intagliteret tablet med "XR 400" på den ene side og almindelig på den anden side, leveres i flasker med 60 tabletter.
Opbevar SEROQUEL XR ved 25°C (77°F); udflugter tilladt til 15-30°C (59-86°F) [Se USP ].
Distribueret af: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850. Revideret: Mar 2020
BIVIRKNINGER
Følgende bivirkninger er beskrevet mere detaljeret i andre sektioner af mærkningen:
- Øget dødelighed hos ældre patienter med demensrelateret psykose [se ADVARSLER OG FORHOLDSREGLER ]
- Selvmordstanker og -adfærd hos unge og unge voksne [se ADVARSLER OG FORHOLDSREGLER ]
- Cerebrovaskulære bivirkninger, herunder slagtilfælde hos ældre patienter med demensrelateret psykose [se ADVARSLER OG FORHOLDSREGLER ]
- Malignt neuroleptikasyndrom (NMS) [se ADVARSLER OG FORHOLDSREGLER ]
- Metaboliske ændringer (hyperglykæmi, dyslipidæmi, vægtøgning) [se ADVARSLER OG FORHOLDSREGLER ]
- Tardiv dyskinesi [se ADVARSLER OG FORHOLDSREGLER ]
- Hypotension [se ADVARSLER OG FORHOLDSREGLER ]
- Falder [se ADVARSLER OG FORHOLDSREGLER ]
- Blodtryksstigninger (børn og unge) [se ADVARSLER OG FORHOLDSREGLER ]
- Leukopeni, neutropeni og agranulocytose [se ADVARSLER OG FORHOLDSREGLER ]
- Grå stær [se ADVARSLER OG FORHOLDSREGLER ]
- QT-forlængelse [se ADVARSLER OG FORHOLDSREGLER ]
- Anfald [se ADVARSLER OG FORHOLDSREGLER ]
- Hypothyroidisme [se ADVARSLER OG FORHOLDSREGLER ]
- Hyperprolactinæmi [se ADVARSLER OG FORHOLDSREGLER ]
- Potentiale for kognitiv og motorisk svækkelse [se ADVARSLER OG FORHOLDSREGLER ]
- Kropstemperaturregulering [se ADVARSLER OG FORHOLDSREGLER ]
- Dysfagi [se ADVARSLER OG FORHOLDSREGLER ]
- Afbrydelsessyndrom [se ADVARSLER OG FORHOLDSREGLER ]
- Anticholinerge (antimuskarine) virkninger [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med klinisk undersøgelse
Fordi kliniske undersøgelser udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske undersøgelser af et lægemiddel ikke direkte sammenlignes med frekvenser i de kliniske undersøgelser af et andet lægemiddel og afspejler muligvis ikke frekvenserne observeret i praksis.
Voksne
Oplysningerne nedenfor er afledt af en database med kliniske forsøg for SEROQUEL 200 mg bestående af over 4300 patienter. Denne database omfatter 698 patienter eksponeret for SEROQUEL til behandling af bipolar depression, 405 patienter eksponeret for SEROQUEL 200 mg til behandling af akut bipolar mani (monoterapi og supplerende terapi), 646 patienter eksponeret for SEROQUEL til vedligeholdelsesbehandling af bipolar I lidelse som supplement behandling og ca. 2600 patienter og/eller normale forsøgspersoner udsat for 1 eller flere doser SEROQUEL 200 mg til behandling af skizofreni.
Af disse cirka 4.300 forsøgspersoner var cirka 4000 (2300 i skizofreni, 405 i akut bipolar mani, 698 i bipolar depression og 646 til vedligeholdelsesbehandling af bipolar I lidelse) patienter, der deltog i multiple dosis effektivitetsforsøg, og deres erfaring svarede til cirka 2400 patientår. Betingelserne og varigheden af behandlingen med SEROQUEL 200 mg varierede meget og omfattede (i overlappende kategorier) åbne og dobbeltblindede faser af undersøgelser, indlagte og ambulante patienter, fastdosis- og dosistitreringsundersøgelser og kortsigtede eller længerevarende undersøgelser eksponering. Bivirkninger blev vurderet ved at indsamle bivirkninger, resultater af fysiske undersøgelser, vitale tegn, vægte, laboratorieanalyser, EKG'er og resultater af oftalmologiske undersøgelser.
De angivne frekvenser af bivirkninger repræsenterer andelen af personer, der mindst én gang oplevede en bivirkning af den angivne type.
Bivirkninger forbundet med seponering af behandling i kortsigtede, placebokontrollerede forsøg
Skizofreni
Samlet set var der lille forskel i forekomsten af seponering på grund af bivirkninger (4 % for SEROQUEL vs. 3 % for placebo) i en pulje af kontrollerede forsøg. Seponeringer på grund af somnolens (0,8 % SEROQUEL 100 mg vs. 0 % placebo) og hypotension (0,4 % SEROQUEL 200 mg vs. 0 % placebo) blev dog anset for at være lægemiddelrelateret [se ADVARSLER OG FORHOLDSREGLER ].
Maniodepressiv
Mani
Samlet set var seponeringer på grund af bivirkninger 5,7 % for SEROQUEL 25 mg vs. 5,1 % for placebo i monoterapi og 3,6 % for SEROQUEL vs. 5,9 % for placebo i supplerende behandling.
Depression
Samlet set var seponeringer på grund af bivirkninger 12,3 % for SEROQUEL 300 mg vs. 19,0 % for SEROQUEL 600 mg og 5,2 % for placebo.
Almindelig observerede bivirkninger i kortvarige, placebokontrollerede forsøg
forsøg med akut behandling af skizofreni (op til 6 uger) og bipolar mani (op til 12 uger) var de mest almindeligt observerede bivirkninger forbundet med brugen af SEROQUEL monoterapi (incidens på 5 % eller mere) og observeret med en hastighed på SEROQUEL mindst det dobbelte af placebo var somnolens (18 %), svimmelhed (11 %), mundtørhed (9 %), forstoppelse (8 %), øget ALAT (5 %), vægtøgning (5 %) og dyspepsi ( 5 %).
Bivirkninger, der forekommer med en forekomst på 2 % eller mere blandt SEROQUEL-behandlede patienter i kortvarige, placebokontrollerede forsøg
Den ordinerende læge skal være opmærksom på, at tallene i tabellerne og tabellerne ikke kan bruges til at forudsige forekomsten af bivirkninger i løbet af sædvanlig lægepraksis, hvor patientkarakteristika og andre faktorer adskiller sig fra dem, der var fremherskende i de kliniske forsøg. Tilsvarende kan de nævnte frekvenser ikke sammenlignes med tal opnået fra andre kliniske undersøgelser, der involverer forskellige behandlinger, anvendelser og efterforskere. De citerede tal giver imidlertid den ordinerende læge et vist grundlag for at estimere det relative bidrag af lægemidler og ikke-lægemiddelfaktorer til forekomsten af bivirkninger i den undersøgte population.
Tabel 9 opregner forekomsten, afrundet til nærmeste procent, af bivirkninger, der opstod under akut behandling af skizofreni (op til 6 uger) og bipolar mani (op til 12 uger) hos 2 % eller mere af patienter behandlet med SEROQUEL (doser varierende fra 75 til 800 mg/dag), hvor incidensen hos patienter behandlet med SEROQUEL var større end forekomsten hos placebobehandlede patienter.
I undersøgelser med akut supplerende behandling af bipolar mani (op til 3 uger) var de mest almindeligt observerede bivirkninger forbundet med brugen af SEROQUEL (hyppighed på 5 % eller mere) og observeret med en hastighed på SEROQUEL mindst det dobbelte af placebo. somnolens (34%), mundtørhed (19%), asteni (10%), forstoppelse (10%), mavesmerter (7%), postural hypotension (7%), pharyngitis (6%) og vægtøgning (6%) %).
Tabel 10 opregner forekomsten, afrundet til nærmeste procent, af bivirkninger, der opstod under behandling (op til 3 uger) af akut mani hos 2 % eller mere af de anvendte patienter behandlet med SEROQUEL (doser fra 100 til 800 mg/dag). som tillægsbehandling til lithium og divalproex, hvor incidensen hos patienter behandlet med SEROQUEL var større end forekomsten hos placebobehandlede patienter.
I undersøgelser af bipolar depression (op til 8 uger) var de mest almindeligt observerede bivirkninger forbundet med brugen af SEROQUEL (hyppighed på 5 % eller mere) og observeret i en hastighed på SEROQUEL 200 mg mindst det dobbelte af placebo somnolens (57 % ), mundtørhed (44 %), svimmelhed (18 %), forstoppelse (10 %) og sløvhed (5 %).
Tabel 11 opregner forekomsten, afrundet til nærmeste procent, af bivirkninger, der opstod under behandling (op til 8 uger) af bipolar depression hos 2 % eller mere af patienter behandlet med SEROQUEL (doser på 300 og 600 mg/dag), hvor incidensen hos patienter behandlet med SEROQUEL var større end forekomsten hos placebobehandlede patienter.
Undersøgelser for interaktioner på grundlag af køn, alder og race afslørede ikke nogen klinisk betydningsfulde forskelle i forekomsten af bivirkninger på basis af disse demografiske faktorer.
Dosisafhængighed af bivirkninger i kortvarige, placebokontrollerede forsøg
Dosis-relaterede bivirkninger
Spontant fremkaldte bivirkningsdata fra et studie af skizofreni, hvor fem faste doser af SEROQUEL (75 mg, 150 mg, 300 mg, 600 mg og 750 mg/dag) blev sammenlignet med placebo, blev undersøgt for dosisrelaterede bivirkninger. Logistiske regressionsanalyser afslørede et positivt dosisrespons (p
Bivirkninger i kliniske forsøg med quetiapin og ikke anført andetsteds på etiketten:
Følgende bivirkninger er også blevet rapporteret med quetiapin: mareridt, overfølsomhed og stigninger i serumkreatinfosfokinase (ikke forbundet med NMS), galaktoré, bradykardi (som kan forekomme ved eller tæt på behandlingsstart og være forbundet med hypotension og/eller synkope ) nedsat blodplader, somnambulisme (og andre relaterede hændelser), stigninger i gamma-GT-niveauer, hypotermi, dyspnø, eosinofili, urinretention, intestinal obstruktion og priapisme.
Ekstrapyramidale symptomer (EPS)
Dystoni
Klasseeffekt
Symptomer på dystoni, langvarige unormale sammentrækninger af muskelgrupper, kan forekomme hos følsomme personer i løbet af de første par dage af behandlingen. Dystoniske symptomer omfatter: spasmer i nakkemusklerne, nogle gange udvikler sig til stram hals, synkebesvær, vejrtrækningsbesvær og/eller fremspring af tungen. Selvom disse symptomer kan forekomme ved lave doser, forekommer de hyppigere og med større sværhedsgrad med høj styrke og ved højere doser af førstegenerations antipsykotiske lægemidler. En forhøjet risiko for akut dystoni er observeret hos mænd og yngre aldersgrupper.
Fire metoder blev brugt til at måle EPS: (1) Simpson-Angus total score (gennemsnitlig ændring fra baseline), som evaluerer Parkinsonisme og akatisi, (2) Barnes Akathisia Rating Scale (BARS) Global Assessment Score, (3) forekomst af spontane klager af EPS (akathisi, akinesi, tandhjulsstivhed, ekstrapyramidalt syndrom, hypertoni, hypokinesi, nakkestivhed og tremor) og (4) brug af antikolinerg medicin til behandling af EPS.
Voksne
Data fra et 6-ugers klinisk forsøg med skizofreni, der sammenlignede fem faste doser af SEROQUEL (75, 150, 300, 600, 750 mg/dag) gav bevis for manglen på ekstrapyramidale symptomer (EPS) og dosis-relateret for EPS forbundet med SEROQUEL 100mg behandling. Tre metoder blev brugt til at måle EPS: (1) Simpson-Angus totalscore (gennemsnitlig ændring fra baseline), som evaluerer Parkinsonisme og akatisi, (2) forekomst af spontane klager af EPS (akathisi, akinesi, tandhjulsstivhed, ekstrapyramidalt syndrom, hypertoni, hypokinesi, nakkestivhed og tremor), og (3) brug af antikolinerg medicin mod EPS.
tabel 12 inkluderede dystoniske hændelser nakkestivhed, hypertoni, dystoni, muskelstivhed, okulogyration; parkinsonisme inkluderede tandhjulsstivhed, tremor, savlen, hypokinesi; akatisi inkluderede akatisi, psykomotorisk agitation; dyskinetisk hændelse inkluderede tardiv dyskinesi, dyskinesi, choreoathetosis; og andre ekstrapyramidale hændelser inkluderede rastløshed, ekstrapyramidale lidelser, bevægelsesforstyrrelser.
Hyppighedsrater for Parkinsonisme målt ved Simpson-Angus totalscore for placebo og de fem faste doser (75, 150, 300, 600, 750 mg/dag) var: -0,6; -1,0, -1,2; -1,6; -1,8 og -1,8. Andelen af antikolinerg medicin til behandling af EPS for placebo og de fem faste doser var: 14 %; 11%; 10%; 8%; 12 % og 11 %.
seks yderligere placebokontrollerede kliniske forsøg (3 ved akut mani og 3 ved skizofreni) med variable doser af SEROQUEL var der ingen forskelle mellem SEROQUEL- og placebobehandlingsgrupperne i forekomsten af EPS, som vurderet ved Simpson-Angus totalscore, spontane klager over EPS og brug af samtidig antikolinerg medicin til behandling af EPS.
I to placebokontrollerede kliniske undersøgelser til behandling af bipolar depression med 300 mg og 600 mg SEROQUEL 100 mg, var forekomsten af bivirkninger potentielt relateret til EPS 12 % i begge dosisgrupper og 6 % i placebogruppen. I disse undersøgelser var forekomsten af de individuelle bivirkninger (akathisi, ekstrapyramidal lidelse, tremor, dyskinesi, dystoni, rastløshed, ufrivillige muskelsammentrækninger, psykomotorisk hyperaktivitet og muskelstivhed) generelt lav og oversteg ikke 4 % i nogen behandlingsgruppe.
De 3 behandlingsgrupper var ens i gennemsnitlig ændring i SAS total score og BARS Global Assessment score ved afslutningen af behandlingen. Brugen af samtidig antikolinerg medicin var sjælden og ens på tværs af de tre behandlingsgrupper.
Børn Og Unge
Oplysningerne nedenfor er afledt af en database med kliniske forsøg for SEROQUEL 200 mg bestående af over 1000 pædiatriske patienter. Denne database omfatter 677 patienter eksponeret for SEROQUEL 200 mg til behandling af skizofreni og 393 børn og unge (10-17 år) eksponeret for SEROQUEL til behandling af akut bipolar mani.
Bivirkninger forbundet med seponering af behandling i kortvarige, placebokontrollerede forsøg
Skizofreni
Hyppigheden af seponering på grund af bivirkninger for quetiapin-behandlede og placebo-behandlede patienter var henholdsvis 8,2 % og 2,7 %. Den uønskede hændelse, der førte til seponering hos 1 % eller flere af patienterne på SEROQUEL og med en højere forekomst end placebo, var somnolens (2,7 % og 0 % for placebo).
Bipolar I Mani
Hyppigheden af seponering på grund af bivirkninger for quetiapin-behandlede og placebo-behandlede patienter var henholdsvis 11,4 % og 4,4 %. Bivirkningerne, der førte til seponering hos 2 % eller flere af patienterne i behandling med SEROQUEL og med en højere forekomst end placebo, var somnolens (4,1 % vs. 1,1 %) og træthed (2,1 % vs. 0).
Almindelig observerede bivirkninger i kortvarige, placebokontrollerede forsøg
I behandling for skizofreni (op til 6 uger) var de hyppigst observerede bivirkninger forbundet med brugen af quetiapin hos unge (hyppighed på 5 % eller mere og quetiapin-incidens mindst dobbelt så høj som for placebo) somnolens (34 %), svimmelhed (12%), mundtørhed (7%), takykardi (7%).
Ved behandling med bipolar mani (op til 3 uger) var de hyppigst observerede bivirkninger forbundet med brugen af quetiapin hos børn og unge (hyppighed på 5 % eller mere og quetiapin-incidens mindst dobbelt så høj som for placebo) somnolens (53 %). svimmelhed (18 %), træthed (11 %), øget appetit (9 %), kvalme (8 %), opkastning (8 %), takykardi (7 %), mundtørhed (7 %) og øget vægt (6 % ).
I et akut (8-ugers) SEROQUEL 100 mg XR-forsøg hos børn og unge (10-17 år) med bipolar depression, hvor virkning ikke blev fastslået, var de mest almindeligt observerede bivirkninger forbundet med brugen af SEROQUEL XR (hyppighed på 5 % eller mere og mindst det dobbelte af placebo) var svimmelhed 7 %, diarré 5 %, træthed 5 % og kvalme 5 %.
Bivirkninger, der forekommer med en forekomst på ≥ 2 % blandt SEROQUEL 300 mg behandlede patienter i kortvarige, placebokontrollerede forsøg
Skizofreni (unge, 13-17 år)
Følgende fund var baseret på et 6-ugers placebokontrolleret forsøg, hvor quetiapin blev administreret i enten doser på 400 eller 800 mg/dag.
Tabel 13 opregner forekomsten, afrundet til nærmeste procent, af bivirkninger, der opstod under behandling (op til 6 uger) af skizofreni hos 2 % eller mere af patienter behandlet med SEROQUEL (doser på 400 eller 800 mg/dag), hvor forekomsten hos patienter behandlet med SEROQUEL var mindst to gange hyppigheden hos placebobehandlede patienter.
Bivirkninger, der potentielt var dosisrelaterede med højere frekvens i 800 mg-gruppen sammenlignet med 400 mg-gruppen, omfattede svimmelhed (8 % vs. 15 %), mundtørhed (4 % vs. 10 %) og takykardi (6 % vs. 11 %).
Bipolar I-mani (børn og unge 10-17 år)
Følgende fund var baseret på et 3-ugers placebokontrolleret forsøg, hvor quetiapin blev administreret i enten doser på 400 eller 600 mg/dag.
Almindelig observerede bivirkninger
Ved behandling med bipolar mani (op til 3 uger) var de hyppigst observerede bivirkninger forbundet med brugen af quetiapin hos børn og unge (hyppighed på 5 % eller mere og quetiapin-incidens mindst dobbelt så høj som for placebo) somnolens (53 %). svimmelhed (18 %), træthed (11 %), øget appetit (9 %), kvalme (8 %), opkastning (8 %), takykardi (7 %), mundtørhed (7 %) og øget vægt (6 % ).
Tabel 14 opregner forekomsten, afrundet til nærmeste procent, af bivirkninger, der opstod under behandling (op til 3 uger) af bipolar mani hos 2 % eller mere af patienter behandlet med SEROQUEL (doser på 400 eller 600 mg/dag), hvor incidensen hos patienter behandlet med SEROQUEL var større end forekomsten hos placebobehandlede patienter.
Bivirkninger, der potentielt var dosisrelaterede med højere frekvens i 600 mg-gruppen sammenlignet med 400 mg-gruppen, omfattede døsighed (50 % vs. 57 %), kvalme (6 % vs. 10 %) og takykardi (6 % vs. 9 %).
Ekstrapyramidale symptomer
et kortvarigt placebokontrolleret monoterapiforsøg med unge patienter med skizofreni (6 ugers varighed) var den samlede forekomst af ekstrapyramidale symptomer 12,9 % (19/147) for SEROQUEL 100 mg og 5,3 % (4/75) for placebo, selvom forekomsten af de individuelle bivirkninger (akatisi, tremor, ekstrapyramidale lidelser, hypokinesi, rastløshed, psykomotorisk hyperaktivitet, muskelstivhed, dyskinesi) ikke oversteg 4,1 % i nogen behandlingsgruppe. I et kortvarigt placebokontrolleret monoterapiforsøg med børn og unge patienter med bipolar mani (3 ugers varighed) var den samlede forekomst af ekstrapyramidale symptomer 3,6 % (7/193) eller SEROQUEL og 1,1 % (1/90) for placebo.
Tabel 15 viser en liste over patienter med bivirkninger potentielt forbundet med ekstrapyramidale symptomer i det kortvarige placebokontrollerede monoterapiforsøg hos unge patienter med skizofreni (6 ugers varighed).
tabel 15-16 inkluderede dystoniske hændelser nakkestivhed, hypertoni og muskelstivhed; parkinsonisme omfattede tandhjulsstivhed og rysten; akatisi omfattede kun akatisi; dyskinetisk hændelse inkluderede tardiv dyskinesi, dyskinesi og choreoathetosis; og andre ekstrapyramidale hændelser inkluderede rastløshed og ekstrapyramidal lidelse.
Tabel 16 viser en liste over patienter med bivirkninger forbundet med ekstrapyramidale symptomer i et kortvarigt placebokontrolleret monoterapiforsøg hos børn og unge patienter med bipolar mani (3 ugers varighed).
Laboratorie-, EKG- og vitale tegnændringer observeret i kliniske undersøgelser
Laboratorieændringer
Neutrofiltal
Voksne
placebokontrollerede kliniske monoterapiforsøg, der involverede 3368 patienter på quetiapinfumarat og 1515 på placebo, var forekomsten af mindst én forekomst af neutrofiltal ADVARSLER OG FORHOLDSREGLER ].
Transaminaseforhøjelser
Voksne
Asymptomatiske, forbigående og reversible stigninger i serumtransaminaser (primært ALAT) er blevet rapporteret. I skizofreniundersøgelser hos voksne var andelen af patienter med transaminaseforhøjelser på >3 gange de øvre grænser for det normale referenceområde i en pulje af 3 til 6 ugers placebokontrollerede undersøgelser ca. 6 % (29/483) for SEROQUEL sammenlignet med 1 % (3/194) for placebo. I forsøg med akut bipolar mani hos voksne var andelen af patienter med transaminaseforhøjelser på >3 gange de øvre grænser for det normale referenceområde i en pulje af 3 til 12 ugers placebokontrollerede forsøg ca. 1 % for både SEROQUEL (3 /560) og placebo (3/294). Disse hepatiske enzymforhøjelser forekom normalt inden for de første 3 uger af lægemiddelbehandling og vendte omgående tilbage til niveauerne før undersøgelsen med igangværende behandling med SEROQUEL. I forsøg med bipolar depression var andelen af patienter med transaminaseforhøjelser på >3 gange de øvre grænser for det normale referenceområde i to 8-ugers placebokontrollerede forsøg 1 % (5/698) for SEROQUEL 50 mg og 2 % (6/ 347) for placebo.
Nedsat hæmoglobin
Voksne
I kortvarige placebokontrollerede forsøg forekom fald i hæmoglobin til ≤13 g/dL mænd, ≤12 g/dL kvinder ved mindst én lejlighed hos 8,3 % (594/7155) af quetiapin-behandlede patienter sammenlignet med 6,2 % ( 219/3536) af patienter behandlet med placebo. I en database med kontrollerede og ukontrollerede kliniske forsøg forekom fald i hæmoglobin til ≤13 g/dL mænd, ≤12 g/dL kvinder ved mindst én lejlighed hos 11 % (2277/20729) af quetiapin-behandlede patienter.
Interferens med Urin Drug Screens
Der har været litteraturrapporter, der tyder på falske positive resultater i urinenzymimmunoassays for metadon og tricykliske antidepressiva hos patienter, der har taget quetiapin. Der bør udvises forsigtighed ved fortolkningen af positive urinlægemiddelscreeningsresultater for disse lægemidler, og bekræftelse med alternativ analyseteknik (f.eks. kromatografiske metoder) bør overvejes.
EKG ændringer
Voksne
Sammenligninger mellem grupper for poolede placebokontrollerede forsøg viste ingen statistisk signifikante SEROQUEL/placebo-forskelle i andelen af patienter, der oplever potentielt vigtige ændringer i EKG-parametre, herunder QT, QTc og PR-intervaller. Imidlertid blev andelen af patienter, der opfylder kriterierne for takykardi, sammenlignet i fire 3- til 6-ugers placebokontrollerede kliniske forsøg til behandling af skizofreni, der afslørede en 1 % (4/399) incidens for SEROQUEL 100 mg sammenlignet med 0,6 % (1) /156) forekomst for placebo. I forsøg med akut (monoterapi) bipolar mani var andelen af patienter, der opfylder kriterierne for takykardi, 0,5 % (1/192) for SEROQUEL 200 mg sammenlignet med 0 % (0/178) forekomst for placebo. I akut bipolar mani (adjunct) forsøg var andelen af patienter, der opfylder de samme kriterier, 0,6 % (1/166) for SEROQUEL 100 mg sammenlignet med 0 % (0/171) forekomst for placebo. I forsøg med bipolar depression havde ingen patienter hjertefrekvensstigninger til >120 slag i minuttet. Brug af SEROQUEL 50 mg var forbundet med en gennemsnitlig stigning i hjertefrekvensen, vurderet ved EKG, på 7 slag pr. minut sammenlignet med en gennemsnitlig stigning på 1 slag pr. minut blandt placebopatienter. Denne lille tendens til takykardi hos voksne kan være relateret til SEROQUEL's potentiale for at inducere ortostatiske forandringer [se ADVARSLER OG FORHOLDSREGLER ].
Børn og unge
I det akutte (6-ugers) skizofreniforsøg hos unge forekom stigninger i hjertefrekvens (>110 slag/min) hos 5,2 % (3/73) af patienterne, der fik SEROQUEL 400 mg, og 8,5 % (5/74) af patienterne, der fik SEROQUEL 800 mg sammenlignet med 0 % (0/75) af patienterne, der fik placebo. Gennemsnitlig stigning i hjertefrekvensen var 3,8 bpm og 11,2 bpm for henholdsvis SEROQUEL 400 mg og 800 mg grupper sammenlignet med et fald på 3,3 bpm i placebogruppen [se ADVARSLER OG FORHOLDSREGLER ].
I forsøget med akut (3-ugers) bipolar mani hos børn og unge forekom stigninger i hjertefrekvens (>110 slag/min) hos 1,1 % (1/89) af patienterne, der fik SEROQUEL 400 mg og 4,7 % (4/85) af patienterne modtog SEROQUEL 600 mg sammenlignet med 0 % (0/98) af patienterne, der fik placebo. Gennemsnitlig stigning i hjertefrekvensen var 12,8 bpm og 13,4 bpm for henholdsvis SEROQUEL 400 mg og 600 mg grupper sammenlignet med et fald på 1,7 bpm i placebogruppen [se ADVARSLER OG FORHOLDSREGLER ].
et akut (8-ugers) SEROQUEL XR-forsøg hos børn og unge (10-17 år) med bipolar depression, hvor effekt ikke blev fastslået, øgede hjertefrekvensen (>110 slag/min 10-12 år og 13-17 år) år) forekom hos 0 % af patienterne, der fik SEROQUEL XR, og 1,2 % af patienterne, der fik placebo. Gennemsnitlig stigning i hjertefrekvensen var 3,4 bpm for SEROQUEL XR sammenlignet med 0,3 bpm i placebogruppen [se ADVARSLER OG FORHOLDSREGLER ].
Postmarketing oplevelse
Følgende bivirkninger blev identificeret efter godkendelse af SEROQUEL. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Bivirkninger rapporteret siden markedsintroduktionen, som var tidsmæssigt relateret til behandling med quetiapin, omfatter anafylaktisk reaktion, kardiomyopati, lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS), hyponatriæmi, myocarditis, natlig enuresis, pancreatitis, retrograd amnesi, rhabdomediuretisk syndrom af inappropriture-hormon, rhabdomediolyse, (SIADH), Stevens-Johnsons syndrom (SJS), toksisk epidermal nekrolyse (TEN), nedsat trombocyttal, alvorlige leverreaktioner (inklusive hepatitis, levernekrose og leversvigt), agranulocytose, intestinal obstruktion, ileus, colon iskæmi, urinretention , søvnapnø og akut generaliseret eksantematøs pustulose (AGEP).
DRUGSINTERAKTIONER
Virkning af andre lægemidler på Quetiapin
Risikoen ved at bruge SEROQUEL i kombination med andre lægemidler er ikke blevet grundigt evalueret i systematiske undersøgelser. I betragtning af de primære CNS-effekter af SEROQUEL bør der udvises forsigtighed, når det tages i kombination med andre centralt virkende lægemidler. SEROQUEL 300 mg forstærkede de kognitive og motoriske virkninger af alkohol i et klinisk forsøg med forsøgspersoner med udvalgte psykotiske lidelser, og alkoholholdige drikkevarer bør begrænses, mens de tager quetiapin.
Eksponering for quetiapin øges af prototypen CYP3A4-hæmmere (f.eks. ketoconazol, itraconazol, indinavir, ritonavir, nefazodon osv.) og mindskes af prototypen af CYP3A4-inducere (f.eks. phenytoin, carbamazepin, rifampin, avasimibe, perikon, etc.) . Dosisjustering af quetiapin vil være nødvendig, hvis det administreres sammen med potente CYP3A4-inducere eller -hæmmere.
CYP3A4-hæmmere
Samtidig administration af ketoconazol, en potent hæmmer af cytochrom CYP3A4, resulterede i signifikant stigning i eksponeringen for quetiapin. Dosis af SEROQUEL 200 mg bør reduceres til en sjettedel af den oprindelige dosis, hvis den administreres sammen med en stærk CYP3A4-hæmmer [se DOSERING OG ADMINISTRATION og KLINISK FARMAKOLOGI ].
CYP3A4 inducere
Samtidig administration af quetiapin og phenytoin, en CYP3A4-inducer, øgede den gennemsnitlige orale clearance af quetiapin med 5 gange. Øgede doser af SEROQUEL 50 mg op til 5 gange kan være nødvendige for at opretholde kontrol over symptomer på skizofreni hos patienter, der får quetiapin og phenytoin eller andre kendte potente CYP3A4-inducere [se DOSERING OG ADMINISTRATION og KLINISK FARMAKOLOGI ]. Når CYP3A4-induceren seponeres, bør dosis af SEROQUEL 25 mg reduceres til det oprindelige niveau inden for 7-14 dage [se DOSERING OG ADMINISTRATION ].
De potentielle virkninger af flere samtidige lægemidler på quetiapins farmakokinetik blev undersøgt [se KLINISK FARMAKOLOGI ].
Virkning af Quetiapin på andre lægemidler
På grund af dets potentiale for at inducere hypotension, kan SEROQUEL 50 mg forstærke virkningen af visse antihypertensiva.
SEROQUEL 25 mg kan modvirke virkningerne af levodopa og dopaminagonister.
Der er ingen klinisk relevante farmakokinetiske interaktioner af Seroquel på andre lægemidler baseret på CYP-vejen. Seroquel 50 mg og dets metabolitter er ikke-hæmmere af hovedmetaboliserende CYP'er (1A2, 2C9, 2C19, 2D6 og 3A4).
Stofmisbrug og afhængighed
kontrolleret stof
SEROQUEL er ikke et kontrolleret stof.
Misbrug
SEROQUEL er ikke blevet systematisk undersøgt, hos dyr eller mennesker, for dets potentiale for misbrug, tolerance eller fysisk afhængighed. Selvom de kliniske forsøg ikke afslørede nogen tendens til nogen lægemiddelsøgende adfærd, var disse observationer ikke systematiske, og det er ikke muligt at forudsige på baggrund af denne begrænsede erfaring, i hvilket omfang et CNS-aktivt lægemiddel vil blive misbrugt, omdirigeret, og/eller misbrugt, når den først er markedsført. Patienter bør derfor evalueres omhyggeligt for en historie med stofmisbrug, og sådanne patienter bør observeres nøje for tegn på misbrug eller misbrug af SEROQUEL, f.eks. udvikling af tolerance, stigning i dosis, lægemiddelsøgende adfærd.
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Øget dødelighed hos ældre patienter med demensrelateret psykose
Ældre patienter med demensrelateret psykose behandlet med antipsykotiske lægemidler har en øget risiko for at dø. Analyse af 17 placebokontrollerede forsøg (modal varighed på 10 uger), hovedsagelig hos patienter, der tog atypiske antipsykotiske lægemidler, viste en risiko for død hos lægemiddelbehandlede patienter på mellem 1,6 og 1,7 gange risikoen for død hos placebobehandlede patienter. I løbet af et typisk 10-ugers kontrolleret forsøg var dødsraten hos lægemiddelbehandlede patienter omkring 4,5 % sammenlignet med en rate på omkring 2,6 % i placebogruppen. Selvom dødsårsagerne var forskellige, så de fleste af dødsfaldene ud til at være enten kardiovaskulære (f.eks. hjertesvigt, pludselig død) eller infektiøse (f.eks. lungebetændelse) i naturen. Observationsstudier tyder på, at behandling med konventionelle antipsykotiske lægemidler i lighed med atypiske antipsykotiske lægemidler kan øge dødeligheden. Det er ikke klart, i hvilket omfang resultaterne af øget dødelighed i observationsstudier kan tilskrives det antipsykotiske lægemiddel i modsætning til nogle karakteristika hos patienterne. SEROQUEL er ikke godkendt til behandling af patienter med demensrelateret psykose [se KASSET ADVARSEL ].
Selvmordstanker og -adfærd hos unge og unge voksne
Patienter med svær depressiv lidelse (MDD), både voksne og pædiatriske, kan opleve forværring af deres depression og/eller fremkomsten af selvmordstanker og -adfærd (suicidalitet) eller usædvanlige ændringer i adfærd, uanset om de tager antidepressiv medicin eller ej, og dette risikoen kan fortsætte, indtil der indtræffer betydelig remission. Selvmord er en kendt risiko for depression og visse andre psykiatriske lidelser, og disse lidelser er i sig selv de stærkeste forudsigere for selvmord. Der har imidlertid været en langvarig bekymring for, at antidepressiva kan have en rolle i at inducere forværring af depression og fremkomsten af suicidalitet hos visse patienter i de tidlige faser af behandlingen. Samlede analyser af kortvarige placebokontrollerede forsøg med antidepressive lægemidler (SSRI'er og andre) viste, at disse lægemidler øger risikoen for selvmordstanker og -adfærd (suicidalitet) hos børn, unge og unge voksne (18-24 år) med svær depression. lidelse (MDD) og andre psykiatriske lidelser. Korttidsundersøgelser viste ikke en stigning i risikoen for suicidalitet med antidepressiva sammenlignet med placebo hos voksne efter 24 år; der var en reduktion med antidepressiva sammenlignet med placebo hos voksne på 65 år og ældre.
De samlede analyser af placebokontrollerede forsøg med børn og unge med MDD, obsessiv-kompulsiv lidelse (OCD) eller andre psykiatriske lidelser omfattede i alt 24 korttidsforsøg med 9 antidepressive lægemidler hos over 4400 patienter. De samlede analyser af placebokontrollerede forsøg med voksne med MDD eller andre psykiatriske lidelser omfattede i alt 295 korttidsforsøg (median varighed på 2 måneder) med 11 antidepressive lægemidler hos over 77.000 patienter. Der var betydelig variation i risikoen for suicidalitet blandt stoffer, men en tendens til en stigning i de yngre patienter for næsten alle undersøgte stoffer. Der var forskelle i den absolutte risiko for suicidalitet på tværs af de forskellige indikationer, med den højeste forekomst af MDD. Risikoforskellene (lægemiddel vs. placebo) var dog relativt stabile inden for aldersgrupper og på tværs af indikationer. Disse risikoforskelle (lægemiddel-placebo-forskel i antallet af tilfælde af suicidalitet pr. 1000 behandlede patienter) er angivet i tabel 2.
Der forekom ingen selvmord i nogen af de pædiatriske forsøg. Der var selvmord i voksenforsøgene, men antallet var ikke tilstrækkeligt til at nå frem til nogen konklusion om lægemiddeleffekt på selvmord.
Det er uvist, om suicidalitetsrisikoen strækker sig til længerevarende brug, dvs. ud over flere måneder. Der er dog væsentlige beviser fra placebokontrollerede vedligeholdelsesforsøg hos voksne med depression, at brugen af antidepressiva kan forsinke tilbagefald af depression.
Alle patienter, der behandles med antidepressiva for enhver indikation, bør overvåges passende og observeres nøje for klinisk forværring, suicidalitet og usædvanlige ændringer i adfærd, især i løbet af de første par måneder af et lægemiddelbehandlingsforløb, eller i tidspunkter med dosisændringer, enten stigninger eller falder.
Følgende symptomer, angst, agitation, panikanfald, søvnløshed, irritabilitet, fjendtlighed, aggressivitet, impulsivitet, akatisi (psykomotorisk rastløshed), hypomani og mani er blevet rapporteret hos voksne og pædiatriske patienter, der også behandles med antidepressiva mod svær depressiv lidelse. som for andre indikationer, både psykiatriske og ikke-psykiatriske. Selvom der ikke er etableret en årsagssammenhæng mellem fremkomsten af sådanne symptomer og enten forværring af depression og/eller fremkomsten af selvmordsimpulser, er der bekymring for, at sådanne symptomer kan repræsentere forløbere for ny suicidalitet.
Det bør overvejes at ændre det terapeutiske regime, herunder eventuelt seponering af medicinen, hos patienter, hvis depression er vedvarende værre, eller som oplever ny suicidalitet eller symptomer, der kan være forløbere for forværring af depression eller suicidalitet, især hvis disse symptomer er alvorlige, pludselige påbegyndt, eller var ikke en del af patientens symptomer.
Familier og pårørende til patienter, der behandles med antidepressiva for svær depressiv lidelse eller andre indikationer, både psykiatriske og ikke-psykiatriske, bør advares om behovet for at overvåge patienter for fremkomsten af agitation, irritabilitet, usædvanlige ændringer i adfærd og de andre symptomer beskrevet ovenfor, såvel som fremkomsten af suicidalitet, og at rapportere sådanne symptomer straks til sundhedsudbydere. Sådan overvågning bør omfatte daglig observation af familier og omsorgspersoner. Recepter til SEROQUEL bør udskrives for den mindste mængde tabletter i overensstemmelse med god patientbehandling for at reducere risikoen for overdosering.
Screening af patienter for bipolar lidelse
En alvorlig depressiv episode kan være den første præsentation af bipolar lidelse. Det antages generelt (dog ikke etableret i kontrollerede forsøg), at behandling af en sådan episode med et antidepressivum alene kan øge sandsynligheden for udfældning af en blandet/manisk episode hos patienter med risiko for bipolar lidelse. Hvorvidt nogen af de ovenfor beskrevne symptomer repræsenterer en sådan omdannelse er ukendt. Men før påbegyndelse af behandling med et antidepressivum, inklusive SEROQUEL, bør patienter med depressive symptomer screenes tilstrækkeligt for at afgøre, om de er i risiko for bipolar lidelse; sådan screening bør omfatte en detaljeret psykiatrisk historie, herunder en familiehistorie med selvmord, bipolar lidelse og depression.
Cerebrovaskulære bivirkninger, herunder slagtilfælde, hos ældre patienter med demensrelateret psykose
I placebokontrollerede undersøgelser med risperidon, aripiprazol og olanzapin hos ældre forsøgspersoner med demens var der en højere forekomst af cerebrovaskulære bivirkninger (cerebrovaskulære ulykker og forbigående iskæmiske anfald) inklusive dødsfald sammenlignet med placebo-behandlede forsøgspersoner. SEROQUEL er ikke godkendt til behandling af patienter med demensrelateret psykose [se også KASSET ADVARSEL og Øget dødelighed hos ældre patienter med demensrelateret psykose ].
Malignt neuroleptikasyndrom (NMS)
Et potentielt dødeligt symptomkompleks, der nogle gange omtales som malignt neuroleptikasyndrom (NMS) er blevet rapporteret i forbindelse med administration af antipsykotiske lægemidler, inklusive SEROQUEL. Sjældne tilfælde af NMS er blevet rapporteret med SEROQUEL. Kliniske manifestationer af NMS er hyperpyreksi, muskelstivhed, ændret mental status og tegn på autonom ustabilitet (uregelmæssig puls eller blodtryk, takykardi, diaforese og hjerterytmeforstyrrelser). Yderligere tegn kan omfatte forhøjet kreatininfosfokinase, myoglobinuri (rhabdomyolyse) og akut nyresvigt.
Den diagnostiske evaluering af patienter med dette syndrom er kompliceret. For at nå frem til en diagnose er det vigtigt at udelukke tilfælde, hvor den kliniske præsentation omfatter både alvorlig medicinsk sygdom (f.eks. lungebetændelse, systemisk infektion osv.) og ubehandlede eller utilstrækkeligt behandlede ekstrapyramidale tegn og symptomer (EPS). Andre vigtige overvejelser i differentialdiagnosen omfatter central antikolinerg toksicitet, hedeslag, lægemiddelfeber og primær centralnervesystem (CNS) patologi.
Behandlingen af NMS bør omfatte: 1) øjeblikkelig seponering af antipsykotiske lægemidler og andre lægemidler, der ikke er nødvendige for samtidig behandling; 2) intensiv symptomatisk behandling og medicinsk overvågning; og 3) behandling af eventuelle samtidige alvorlige medicinske problemer, for hvilke specifikke behandlinger er tilgængelige. Der er ingen generel enighed om specifikke farmakologiske behandlingsregimer for NMS.
Hvis en patient har behov for antipsykotisk lægemiddelbehandling efter bedring fra NMS, bør den potentielle genindførelse af lægemiddelbehandling overvejes nøje. Patienten bør overvåges omhyggeligt, da tilbagefald af NMS er blevet rapporteret.
Metaboliske ændringer
Atypiske antipsykotiske lægemidler er blevet forbundet med metaboliske ændringer, der omfatter hyperglykæmi/diabetes mellitus, dyslipidæmi og vægtøgning. Mens alle lægemidler i klassen har vist sig at producere nogle metaboliske ændringer, har hvert lægemiddel sin egen specifikke risikoprofil. Hos nogle patienter blev der observeret en forværring af mere end én af de metaboliske parametre vægt, blodsukker og lipider i kliniske undersøgelser. Ændringer i disse metaboliske profiler bør håndteres som klinisk hensigtsmæssigt.
Hyperglykæmi og diabetes mellitus
Hyperglykæmi, i nogle tilfælde ekstrem og forbundet med ketoacidose eller hyperosmolær koma eller død, er blevet rapporteret hos patienter behandlet med atypiske antipsykotika, herunder quetiapin. Vurdering af sammenhængen mellem atypisk brug af antipsykotiske midler og glukoseabnormiteter kompliceres af muligheden for en øget baggrundsrisiko for diabetes mellitus hos patienter med skizofreni og den stigende forekomst af diabetes mellitus i den generelle befolkning. I betragtning af disse konfounders er forholdet mellem atypisk antipsykotisk brug og hyperglykæmi-relaterede bivirkninger ikke fuldstændigt forstået. Epidemiologiske undersøgelser tyder dog på en øget risiko for hyperglykæmi-relaterede bivirkninger hos patienter behandlet med de atypiske antipsykotika. Præcise risikoestimater for hyperglykæmi-relaterede bivirkninger hos patienter behandlet med atypiske antipsykotika er ikke tilgængelige.
Patienter med en etableret diagnose af diabetes mellitus, som er startet på atypiske antipsykotika, bør monitoreres regelmæssigt for forværring af glukosekontrol. Patienter med risikofaktorer for diabetes mellitus (f.eks. fedme, familiehistorie med diabetes), som starter behandling med atypiske antipsykotika, bør gennemgå fastende blodsukkermåling i begyndelsen af behandlingen og periodisk under behandlingen. Enhver patient, der behandles med atypiske antipsykotika, bør overvåges for symptomer på hyperglykæmi, herunder polydipsi, polyuri, polyfagi og svaghed. Patienter, som udvikler symptomer på hyperglykæmi under behandling med atypiske antipsykotika, bør gennemgå fastende blodsukkermåling. I nogle tilfælde er hyperglykæmi forsvundet, når det atypiske antipsykotikum blev seponeret; dog krævede nogle patienter fortsættelse af antidiabetisk behandling på trods af seponering af det mistænkte lægemiddel.
Voksne
et 24-ugers forsøg (aktivt kontrolleret, 115 patienter behandlet med SEROQUEL) designet til at evaluere glykæmisk status med oral glukosetolerancetestning af alle patienter, var forekomsten af et post-glucoseprovokation glukoseniveau ≥200 mg/dL i uge 24 1,7 %, og forekomsten af et fastende blodsukkerniveau ≥126 mg/dL var 2,6 %. Den gennemsnitlige ændring i fastende glukose fra baseline var 3,2 mg/dL, og den gennemsnitlige ændring i 2-timers glukose fra baseline var -1,8 mg/dL for quetiapin.
2 langtids placebokontrollerede, randomiserede kliniske seponeringsundersøgelser for vedligeholdelse af bipolar I lidelse, gennemsnitlig eksponering på 213 dage for SEROQUEL (646 patienter) og 152 dage for placebo (680 patienter), var den gennemsnitlige ændring i glukose fra baseline +5,0 mg /dL for SEROQUEL 100 mg og –0,05 mg/dL for placebo. Den eksponeringsjusterede hastighed for ethvert forhøjet blodsukkerniveau (≥126 mg/dL) for patienter mere end 8 timer siden et måltid (dog kan nogle patienter ikke have været udelukket fra kalorieindtag fra væske under fasteperioden) var 18,0 pr. patientår for SEROQUEL (10,7 % af patienterne; n=556) og 9,5 for placebo pr. 100 patientår (4,6 % af patienterne; n=581).
Børn og unge
et placebokontrolleret SEROQUEL 25 mg monoterapistudie af unge patienter (13-17 år) med skizofreni (6 ugers varighed), den gennemsnitlige ændring i fastende glukoseniveauer for SEROQUEL (n=138) sammenlignet med placebo (n=67) var – 0,75 mg/dL mod –1,70 mg/dL. I et placebokontrolleret SEROQUEL 300 mg monoterapistudie af børn og unge patienter (10-17 år) med bipolar mani (3 ugers varighed), den gennemsnitlige ændring i fastende glukoseniveau for SEROQUEL (n=170) sammenlignet med placebo (n) =81) var 3,62 mg/dL mod –1,17 mg/dL. Ingen patient i hverken undersøgelse med et baseline normalt fastende glukoseniveau (
et placebokontrolleret SEROQUEL XR monoterapistudie (8 ugers varighed) af børn og unge patienter (1017 år) med bipolar depression, hvor effekt ikke blev fastslået, var den gennemsnitlige ændring i fastende glukoseniveauer for SEROQUEL 300mg XR (n= 60) sammenlignet med placebo (n=62) var 1,8 mg/dL versus 1,6 mg/dL. I denne undersøgelse var der ingen patienter i SEROQUEL XR eller placebo-behandlede grupper med et baseline normalt fastende glucoseniveau (126 mg/dL. Der var én patient i SEROQUEL 25 mg XR-gruppen med et baseline-grænseværdi for fastende glucoseniveau (>100 mg/dL og 126 mg/dL sammenlignet med nul patienter i placebo gruppe.
Dyslipidæmi
Voksne
Tabel 4 viser procentdelen af voksne patienter med ændringer i totalt kolesterol, triglycerider, LDL-kolesterol og HDL-kolesterol fra baseline efter indikation i kliniske forsøg med SEROQUEL.
Børn og unge
Tabel 5 viser procentdelen af børn og unge med ændringer i totalt kolesterol, triglycerider, LDL-kolesterol og HDL-kolesterol fra baseline i kliniske forsøg med SEROQUEL.
I et placebokontrolleret SEROQUEL XR monoterapistudie (8 ugers varighed) af børn og unge patienter (1017 år) med bipolar depression, hvor effekt ikke blev fastslået, viste procentdelen af børn og unge med skift i total kolesterol (≥200) mg/dL), triglycerider (≥150 mg/dL), LDL-kolesterol (≥ 130 mg/dL) og HDL-kolesterol (≤40 mg/dL) fra baseline til klinisk signifikante niveauer var: total kolesterol 8% (7) /83) for SEROQUEL 50 mg XR vs. 6 % (5/84) for placebo; triglycerider 28 % (22/80) for SEROQUEL 100 mg XR vs. 9 % (7/82) for placebo; LDL-kolesterol 2% (2/86) for SEROQUEL XR vs. 4% (3/85) for placebo og HDL-kolesterol 20% (13/65) for SEROQUEL XR vs. 15% (11/74) for placebo.
Vægtøgning
Vægtstigninger er blevet observeret i kliniske forsøg. Patienter, der får quetiapin, bør regelmæssigt monitoreres.
Voksne
I kliniske forsøg med SEROQUEL 50 mg er følgende stigninger i vægt blevet rapporteret.
Børn og unge
I to kliniske forsøg med SEROQUEL 25 mg, et ved bipolar mani og et ved skizofreni, er rapporterede vægtstigninger inkluderet i tabel 7.
Den gennemsnitlige ændring i kropsvægt i skizofreni-forsøget var 2,0 kg i SEROQUEL 25 mg-gruppen og -0,4 kg i placebogruppen og i bipolar mani-studiet var den 1,7 kg i SEROQUEL 200 mg-gruppen og 0,4 kg i placebogruppen.
et åbent studie, der inkluderede patienter fra de to ovennævnte pædiatriske forsøg, gennemførte 63 % af patienterne (241/380) 26 ugers behandling med SEROQUEL. Efter 26 ugers behandling var den gennemsnitlige stigning i kropsvægt 4,4 kg. 45 procent af patienterne tog på ≥7 % af deres kropsvægt, ikke justeret for normal vækst. For at justere for normal vækst over 26 uger blev en stigning på mindst 0,5 standardafvigelse fra baseline i BMI brugt som et mål for en klinisk signifikant ændring; 18,3 % af patienterne på SEROQUEL opfyldte dette kriterium efter 26 ugers behandling.
I et klinisk forsøg med SEROQUEL XR hos børn og unge (10-17 år) med bipolar depression, hvor effekt ikke blev fastslået, var procentdelen af patienter med vægtøgning ≥7 % af kropsvægten på noget tidspunkt 15 % ( 14/92) for SEROQUEL 25 mg XR vs. 10 % (10/100) for placebo. Den gennemsnitlige ændring i kropsvægt var 1,4 kg i SEROQUEL 50 mg XR-gruppen mod 0,6 kg i placebogruppen.
Ved behandling af pædiatriske patienter med SEROQUEL 50 mg for enhver indikation, bør vægtøgning vurderes i forhold til den forventede for normal vækst.
Tardiv dyskinesi
Et syndrom med potentielt irreversible, ufrivillige, dyskinetiske bevægelser kan udvikle sig hos patienter, der behandles med antipsykotiske lægemidler, herunder quetiapin. Selvom prævalensen af syndromet ser ud til at være højest blandt ældre, især ældre kvinder, er det umuligt at stole på prævalensestimater til at forudsige, ved begyndelsen af antipsykotisk behandling, hvilke patienter der sandsynligvis vil udvikle syndromet. Hvorvidt antipsykotiske lægemidler er forskellige i deres potentiale til at forårsage tardiv dyskinesi er ukendt.
Risikoen for at udvikle tardiv dyskinesi og sandsynligheden for, at den bliver irreversibel, menes at stige, efterhånden som behandlingens varighed og den samlede kumulative dosis af antipsykotiske lægemidler administreret til patienten stiger. Syndromet kan dog udvikle sig, om end meget mindre almindeligt, efter relativt korte behandlingsperioder ved lave doser eller kan endda opstå efter seponering af behandlingen.
Tardiv dyskinesi kan forsvinde, delvist eller fuldstændigt, hvis antipsykotisk behandling seponeres. Antipsykotisk behandling kan imidlertid i sig selv undertrykke (eller delvist undertrykke) tegn og symptomer på syndromet og kan derved muligvis maskere den underliggende proces. Den effekt, som symptomatisk suppression har på det langsigtede forløb af syndromet, er ukendt.
betragtning af disse overvejelser bør SEROQUEL 50 mg ordineres på en måde, der med størst sandsynlighed minimerer forekomsten af tardiv dyskinesi. Kronisk antipsykotisk behandling bør generelt være forbeholdt patienter, der ser ud til at lide af en kronisk sygdom, som (1) vides at reagere på antipsykotiske lægemidler, og (2) for hvem alternative, lige så effektive, men potentielt mindre skadelige behandlinger ikke er tilgængelige eller passende . Hos patienter, som har behov for kronisk behandling, bør den mindste dosis og den korteste behandlingsvarighed, der giver et tilfredsstillende klinisk respons, søges. Behovet for fortsat behandling bør revurderes med jævne mellemrum.

Hvis der opstår tegn og symptomer på tardiv dyskinesi hos en patient på SEROQUEL 200 mg, bør seponering af lægemidlet overvejes. Nogle patienter kan dog have behov for behandling med SEROQUEL 200 mg på trods af tilstedeværelsen af syndromet.
Hypotension
Quetiapin kan inducere ortostatisk hypotension forbundet med svimmelhed, takykardi og, hos nogle patienter, synkope, især i den indledende dosistitreringsperiode, hvilket sandsynligvis afspejler dets α1-adrenerge antagonistegenskaber. Synkope blev rapporteret hos 1 % (28/3265) af patienterne behandlet med SEROQUEL sammenlignet med 0,2 % (2/954) på placebo og omkring 0,4 % (2/527) på aktive kontrollægemidler. Ortostatisk hypotension, svimmelhed og synkope kan føre til fald.
SEROQUEL 25mg bør anvendes med særlig forsigtighed til patienter med kendt kardiovaskulær sygdom (historie med myokardieinfarkt eller iskæmisk hjertesygdom, hjertesvigt eller ledningsabnormiteter), cerebrovaskulær sygdom eller tilstande, der kan disponere patienter for hypotension (dehydrering, hypovolæmi og behandling med antihypertensiv medicin). Risikoen for ortostatisk hypotension og synkope kan minimeres ved at begrænse startdosis til 25 mg to gange dagligt [se DOSERING OG ADMINISTRATION ]. Hvis der opstår hypotension under titrering til måldosis, er en tilbagevenden til den tidligere dosis i titreringsskemaet passende.
Falls
Atypiske antipsykotiske lægemidler, inklusive SEROQUEL, kan forårsage somnolens, postural hypotension, motorisk og sensorisk ustabilitet, hvilket kan føre til fald og som følge heraf frakturer eller andre skader. For patienter med sygdomme, tilstande eller medicin, der kan forværre disse virkninger, udfør faldrisikovurderinger ved påbegyndelse af antipsykotisk behandling og tilbagevendende for patienter i langvarig antipsykotisk behandling.
Stigning i blodtryk (børn og unge)
placebokontrollerede forsøg med børn og unge med skizofreni (6 ugers varighed) eller bipolar mani (3 ugers varighed), var forekomsten af stigninger på et hvilket som helst tidspunkt i systolisk blodtryk (≥20 mmHg) 15,2 % (51/335) ) for SEROQUEL 50 mg og 5,5 % (9/163) for placebo; forekomsten af stigninger til enhver tid i diastolisk blodtryk (≥10 mmHg) var 40,6 % (136/335) for SEROQUEL og 24,5 % (40/163) for placebo. I det 26-ugers åbne kliniske forsøg oplevede et barn med en rapporteret historie om hypertension en hypertensiv krise. Blodtrykket hos børn og unge bør måles i begyndelsen af og periodisk under behandlingen.
et placebokontrolleret klinisk forsøg med SEROQUEL XR (8 ugers varighed) hos børn og unge (10-17 år) med bipolar depression, hvor virkningen ikke blev fastslået, var forekomsten af stigninger på noget tidspunkt i det systoliske blodtryk (≥ 20 mmHg) var 6,5 % (6/92) for SEROQUEL XR og 6,0 % (6/100) for placebo; forekomsten af stigninger til enhver tid i diastolisk blodtryk (≥10 mmHg) var 46,7 % (43/92) for SEROQUEL 25 mg XR og 36,0 % (36/100) for placebo.
Leukopeni, Neutropeni og Agranulocytose
I kliniske forsøg og efter markedsføring er der rapporteret hændelser af leukopeni/neutropeni, der er tidsmæssigt relateret til atypiske antipsykotiske midler, inklusive SEROQUEL. Agranulocytose er blevet rapporteret.
Agranulocytose (defineret som absolut neutrofiltal
Mulige risikofaktorer for leukopeni/neutropeni omfatter allerede eksisterende lavt antal hvide blodlegemer (WBC) og historie med lægemiddelinduceret leukopeni/neutropeni. Patienter med et allerede eksisterende lavt WBC eller en historie med lægemiddelinduceret leukopeni/neutropeni bør have deres fuldstændige blodtal (CBC) overvåget hyppigt i løbet af de første par måneder af behandlingen og bør seponere SeROQUEL 50 mg ved det første tegn på et fald i WBC i fravær af andre årsagsfaktorer.
Patienter med neutropeni bør overvåges omhyggeligt for feber eller andre symptomer eller tegn på infektion og behandles omgående, hvis sådanne symptomer eller tegn opstår. Patienter med svær neutropeni (absolut neutrofiltal
Grå stær
Udviklingen af grå stær blev observeret i forbindelse med behandling med quetiapin i kroniske hundestudier [se Ikke-klinisk toksikologi ]. Linseforandringer er også blevet observeret hos voksne, børn og unge under langvarig behandling med SEROQUEL 100 mg, men en årsagssammenhæng til brug af SEROQUEL 200 mg er ikke fastlagt. Ikke desto mindre kan muligheden for lentikulære ændringer ikke udelukkes på nuværende tidspunkt. Derfor anbefales undersøgelse af linsen ved hjælp af metoder, der er tilstrækkelige til at påvise kataraktdannelse, såsom spaltelampeundersøgelse eller andre passende følsomme metoder, ved påbegyndelse af behandlingen eller kort derefter, og med 6-måneders intervaller under kronisk behandling.
QT forlængelse
kliniske forsøg var quetiapin ikke forbundet med en vedvarende stigning i QT-intervaller. QT-effekten blev dog ikke systematisk evalueret i et grundigt QT-studie. Efter markedsføringserfaring er der rapporteret tilfælde af QT-forlængelse hos patienter, der overdoserede quetiapin [se OVERDOSIS ], hos patienter med samtidig sygdom og hos patienter, der tager medicin, der vides at forårsage elektrolytforstyrrelser eller øge QT-intervallet [se DRUGSINTERAKTIONER ].
Brugen af quetiapin bør undgås i kombination med andre lægemidler, der vides at forlænge QTc, inklusive klasse 1A antiarytmika (f.eks. quinidin, procainamid) eller klasse III antiarytmika (f.eks. amiodaron, sotalol), antipsykotisk medicin (f.eks. ziprasidon, chlorpromazin, thioridazin), antibiotika (f.eks. gatifloxacin, moxifloxacin) eller enhver anden klasse af medicin, der vides at forlænge QTc-intervallet (f.eks. pentamidin, levometadylacetat, metadon).
Quetiapin bør også undgås under omstændigheder, der kan øge risikoen for forekomst af torsade de pointes og/eller pludselig død, herunder (1) en anamnese med hjertearytmier såsom bradykardi; (2) hypokaliæmi eller hypomagnesæmi; (3) samtidig brug af andre lægemidler, der forlænger QTc-intervallet; og (4) tilstedeværelse af medfødt forlængelse af QT-intervallet.
Der bør også udvises forsigtighed, når quetiapin ordineres til patienter med øget risiko for QT-forlængelse (f.eks. kardiovaskulær sygdom, familiehistorie med QT-forlængelse, ældre, kongestiv hjertesvigt og hjertehypertrofi).
Anfald
Under kliniske forsøg forekom anfald hos 0,5 % (20/3490) af patienter behandlet med SEROQUEL sammenlignet med 0,2 % (2/954) på placebo og 0,7 % (4/527) på aktive kontrollægemidler. Som med andre antipsykotika bør SEROQUEL 25 mg anvendes med forsigtighed til patienter med anfald i anamnesen eller med tilstande, der potentielt sænker krampetærsklen, f.eks. Alzheimers demens. Tilstande, der sænker anfaldstærsklen, kan være mere udbredt i en befolkning på 65 år eller ældre.
Hypothyroidisme
Voksne
Kliniske forsøg med quetiapin viste dosisrelaterede fald i thyreoideahormonniveauer. Reduktionen i total og fri thyroxin (T4) på ca. 20 % i den højere ende af det terapeutiske dosisområde var maksimal i de første seks uger af behandlingen og opretholdt uden tilpasning eller progression under mere kronisk behandling. I næsten alle tilfælde var ophør af quetiapinbehandling forbundet med en reversering af virkningerne på total og fri T4, uanset behandlingens varighed. Den mekanisme, hvormed quetiapin påvirker skjoldbruskkirtlens akse, er uklar. Hvis der er en effekt på hypothalamus-hypofyse-aksen, kan måling af TSH alene ikke afspejle en patients skjoldbruskkirtelstatus nøjagtigt. Derfor bør både TSH og fri T4, udover klinisk vurdering, måles ved baseline og ved opfølgning.
mani-tillægsundersøgelserne, hvor SEROQUEL 50 mg blev tilføjet til lithium eller divalproex, havde 12 % (24/196) af SEROQUEL 200 mg-behandlede patienter sammenlignet med 7 % (15/203) af placebo-behandlede patienter forhøjede TSH-niveauer. Af de SEROQUEL 300 mg-behandlede patienter med forhøjede TSH-niveauer havde 3 samtidig lave frie T4-niveauer (fri T4
Omkring 0,7 % (26/3489) af SEROQUEL-patienterne oplevede TSH-stigninger i monoterapiundersøgelser. Nogle patienter med TSH-stigninger havde behov for erstatningsbehandling af skjoldbruskkirtlen.
I alle quetiapin-forsøg var forekomsten af skift i skjoldbruskkirtelhormoner og TSH 1: fald i fri T4 (5 mIU/L), 4,9 % (956/19412). Hos otte patienter, hvor TBG blev målt, var niveauet af TBG uændret.
Tabel 8 viser forekomsten af disse skift i kortvarige placebokontrollerede kliniske forsøg.
I kortvarige placebokontrollerede monoterapiforsøg var forekomsten af gensidige skift i T3 og TSH 0,0 % for både quetiapin (1/4800) og placebo (0/2190), og for T4 og TSH var skift 0,1 % (7) /6154) for quetiapin versus 0,0 % (1/3007) for placebo.
Børn Og Unge
I akutte placebo-kontrollerede forsøg med børn og unge patienter med skizofreni (6 ugers varighed) eller bipolar mani (3 ugers varighed), forekomsten af ændringer i skjoldbruskkirtelfunktionsværdier til enhver tid for SEROQUEL 100 mg behandlede patienter og placebobehandlede patienter for forhøjet TSH var henholdsvis 2,9 % (8/280) vs. 0,7 % (1/138), og for nedsat total thyroxin var henholdsvis 2,8 % (8/289) vs. 0 % (0/145). Af de SEROQUEL-behandlede patienter med forhøjede TSH-niveauer havde 1 samtidig lavt frit T4-niveau ved behandlingens afslutning.
Hyperprolactinæmi
Voksne
Under kliniske forsøg med quetiapin forekom forekomsten af skift i prolaktinniveauer til en klinisk signifikant værdi hos 3,6 % (158/4416) af patienter behandlet med quetiapin sammenlignet med 2,6 % (51/1968) på placebo.
Børn Og Unge
I akutte placebokontrollerede forsøg med børn og unge patienter med bipolar mani (3 ugers varighed) eller skizofreni (6 ugers varighed) var forekomsten af skift i prolaktinniveauer til en værdi (>20 μg/L mænd; >26 μg /L kvinder til enhver tid) var 13,4 % (18/134) for SEROQUEL sammenlignet med 4 % (3/75) for placebo hos mænd og 8,7 % (9/104) for SEROQUEL 25 mg sammenlignet med 0 % (0/39) for placebo hos kvinder.
Ligesom andre lægemidler, der antagoniserer dopamin D2-receptorer, hæver SEROQUEL 300 mg prolaktinniveauet hos nogle patienter, og stigningen kan vedvare under kronisk administration. Hyperprolactinæmi, uanset ætiologi, kan undertrykke hypothalamus GnRH, hvilket resulterer i reduceret hypofysegonadotrophinsekretion. Dette kan igen hæmme den reproduktive funktion ved at svække gonadal steroidogenese hos både kvindelige og mandlige patienter. Galaktoré, amenoré, gynækomasti og impotens er blevet rapporteret hos patienter, der får prolaktin-forhøjende stoffer. Langvarig hyperprolaktinæmi, når det er forbundet med hypogonadisme, kan føre til nedsat knogletæthed hos både kvindelige og mandlige forsøgspersoner.
Vævskulturforsøg indikerer, at cirka en tredjedel af humane brystkræfttilfælde er prolaktinafhængige in vitro, en faktor af potentiel betydning, hvis ordination af disse lægemidler overvejes hos en patient med tidligere påvist brystkræft. Som det er almindeligt med forbindelser, der øger prolaktinfrigivelsen, blev brystkirtel- og pancreas-ø-celle-neoplasi (mammære adenokarcinomer, hypofyse- og pancreasadenomer) observeret i carcinogenicitetsundersøgelser udført i mus og rotter. Hverken kliniske undersøgelser eller epidemiologiske undersøgelser udført til dato har vist en sammenhæng mellem kronisk administration af denne klasse af lægemidler og tumordannelse hos mennesker, men den tilgængelige evidens er for begrænset til at være afgørende [se Ikke-klinisk toksikologi ].
Potentiale for kognitiv og motorisk svækkelse
Somnolens var en almindeligt rapporteret bivirkning rapporteret hos patienter behandlet med SEROQUEL, især i løbet af den 3-5 dages periode med initial dosistitrering. I skizofrenistudier blev der rapporteret somnolens hos 18 % (89/510) af patienterne på SEROQUEL 200 mg sammenlignet med 11 % (22/206) af placebopatienterne. I forsøg med akut bipolar mani med SEROQUEL 200 mg som monoterapi blev der rapporteret somnolens hos 16 % (34/209) af patienterne på SEROQUEL 300 mg sammenlignet med 4 % af placebopatienterne. I forsøg med akut bipolar mani med SEROQUEL som supplerende terapi blev der rapporteret somnolens hos 34 % (66/196) af patienterne på SEROQUEL sammenlignet med 9 % (19/203) af placebopatienterne. I forsøg med bipolar depression blev der rapporteret somnolens hos 57 % (398/698) af patienterne på SEROQUEL 50 mg sammenlignet med 15 % (51/347) af placebopatienterne. Da SEROQUEL 25mg har potentiale til at svække dømmekraft, tænkning eller motoriske færdigheder, bør patienter advares om at udføre aktiviteter, der kræver mental årvågenhed, såsom at betjene et motorkøretøj (inklusive biler) eller betjene farligt maskineri, indtil de er rimeligt sikre på, at SEROQUEL-terapi gør ikke påvirke dem negativt. Somnolens kan føre til fald.
Kropstemperaturregulering
Selvom det ikke er rapporteret med SEROQUEL 100mg, er forstyrrelse af kroppens evne til at reducere kropstemperaturen blevet tilskrevet antipsykotiske midler. Passende omhu tilrådes ved ordinering af SEROQUEL 300 mg til patienter, som vil opleve tilstande, der kan bidrage til en stigning i kernekropstemperaturen, f.eks. anstrengende motion, udsættelse for ekstrem varme, samtidig medicinering med antikolinerg aktivitet eller udsat for dehydrering.
Dysfagi
Esophageal dysmotilitet og aspiration er blevet forbundet med antipsykotisk stofbrug. Aspirationspneumoni er en almindelig årsag til morbiditet og dødelighed hos ældre patienter, især dem med fremskreden Alzheimers demens. SEROQUEL 100mg og andre antipsykotiske lægemidler bør anvendes med forsigtighed til patienter med risiko for aspirationspneumoni.
Afbrydelsessyndrom
Akutte abstinenssymptomer, såsom søvnløshed, kvalme og opkastning, er blevet beskrevet efter pludseligt ophør med atypiske antipsykotiske lægemidler, inklusive SEROQUEL. I korttids placebokontrollerede, kliniske monoterapiforsøg med SEROQUEL 25 mg XR, der inkluderede en seponeringsfase, som evaluerede seponeringssymptomer, var den samlede forekomst af patienter, der oplevede et eller flere seponeringssymptomer efter pludseligt ophør, 12,1 % (241/1993) for SEROQUEL XR. og 6,7 % (71/1065) for placebo. Hyppigheden af de individuelle bivirkninger (dvs. søvnløshed, kvalme, hovedpine, diarré, opkastning, svimmelhed og irritabilitet) oversteg ikke 5,3 % i nogen behandlingsgruppe og forsvandt sædvanligvis efter 1 uge efter seponering. Gradvis tilbagetrækning tilrådes. [se Brug i specifikke populationer ]
Anticholinerge (antimuskarine) virkninger
Norquetiapin, en aktiv metabolit af quetiapin, har moderat til stærk affinitet til adskillige muskarinreceptorsubtyper. Dette bidrager til antikolinerge bivirkninger, når SEROQUEL 25 mg anvendes i terapeutiske doser, tages samtidig med andre antikolinerge lægemidler eller tages i overdosis. SEROQUEL bør anvendes med forsigtighed til patienter, der får medicin med antikolinerge (antimuskarine) virkninger [se OVERDOSIS og KLINISK FARMAKOLOGI ].
Forstoppelse var en almindeligt rapporteret bivirkning hos patienter behandlet med quetiapin og repræsenterer en risikofaktor for intestinal obstruktion. Intestinal obstruktion er blevet rapporteret med quetiapin, herunder dødelige rapporter hos patienter, som fik flere samtidige lægemidler, der nedsætter tarmmotiliteten.
SEROQUEL 300 mg bør anvendes med forsigtighed til patienter med en aktuel diagnose eller tidligere urinretention, klinisk signifikant prostatahypertrofi, forstoppelse eller øget intraokulært tryk.
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning (medicinvejledning).
Patienter skal informeres om følgende problemer og bedes om at advare deres ordinerende læge, hvis disse opstår, mens de tager SEROQUEL.
Øget dødelighed hos ældre patienter med demensrelateret psykose Patienter og pårørende bør informeres om, at ældre patienter med demensrelateret psykose behandlet med atypiske antipsykotiske lægemidler har øget risiko for død sammenlignet med placebo. Quetiapin er ikke godkendt til ældre patienter med demensrelateret psykose [se ADVARSLER OG FORHOLDSREGLER ].
Selvmordstanker og -adfærd
Patienter, deres familier og deres pårørende bør opmuntres til at være opmærksomme på fremkomsten af angst, agitation, panikanfald, søvnløshed, irritabilitet, fjendtlighed, aggressivitet, impulsivitet, akatisi (psykomotorisk rastløshed), hypomani, mani, andre usædvanlige ændringer i adfærd. , forværring af depression og selvmordstanker, især tidligt under antidepressiv behandling, og når dosis justeres op eller ned. Familier og pårørende til patienter bør rådes til at se efter forekomsten af sådanne symptomer på daglig basis, da ændringer kan være pludselige. Sådanne symptomer bør rapporteres til patientens ordinerende læge eller sundhedspersonale, især hvis de er alvorlige, pludseligt opstået eller ikke var en del af patientens symptomer. Symptomer som disse kan være forbundet med en øget risiko for selvmordstanker og -adfærd og indikerer behov for meget tæt overvågning og muligvis ændringer i medicinen [se ADVARSLER OG FORHOLDSREGLER ].
Malignt neuroleptikasyndrom (NMS)
Patienter bør rådes til at rapportere til deres læge alle tegn eller symptomer, der kan være relateret til NMS. Disse kan omfatte muskelstivhed og høj feber [se ADVARSLER OG FORHOLDSREGLER ].
Hyperglykæmi og diabetes mellitus
Patienter skal være opmærksomme på symptomerne på hyperglykæmi (højt blodsukker) og diabetes mellitus. Patienter, der er diagnosticeret med diabetes, dem med risikofaktorer for diabetes eller dem, der udvikler disse symptomer under behandlingen, bør have deres blodsukker overvåget i begyndelsen af og periodisk under behandlingen [se ADVARSLER OG FORHOLDSREGLER ].
Hyperlipidæmi
Patienter bør informeres om, at stigninger i total kolesterol, LDL-kolesterol og triglycerider og fald i HDL-kolesterol kan forekomme. Patienter bør have deres lipidprofil overvåget i begyndelsen af og periodisk under behandlingen [se ADVARSLER OG FORHOLDSREGLER ].
Vægtøgning
Patienter bør informeres om, at de kan opleve vægtøgning. Patienter bør have deres vægt overvåget regelmæssigt [se ADVARSLER OG FORHOLDSREGLER ].
Ortostatisk hypotension
Patienter bør informeres om risikoen for ortostatisk hypotension (symptomer omfatter svimmelhed eller svimmelhed ved stående stilling, hvilket kan føre til fald), især i perioden med initial dosistitrering og også ved genstart af behandling eller stigninger i dosis [ se ADVARSLER OG FORHOLDSREGLER ].
Forhøjet blodtryk hos børn og unge
Børn og unge patienter skal have deres blodtryk målt i begyndelsen af og periodisk under behandlingen [se ADVARSLER OG FORHOLDSREGLER ].
Leukopeni/Neutropeni
Patienter med et allerede eksisterende lavt WBC eller en historie med lægemiddelinduceret leukopeni/neutropeni bør informeres om, at de skal have deres CBC overvåget, mens de tager SEROQUEL. Patienter bør rådes til at tale med deres læge så hurtigt som muligt, hvis de har feber, influenzalignende symptomer, ondt i halsen eller enhver anden infektion, da dette kan være et resultat af et meget lavt hvidt blodlegeme, hvilket kan kræve, at SeROQUEL 100 mg stoppet og/eller behandling skal gives [se ADVARSLER OG FORHOLDSREGLER ].
Interferens med kognitiv og motorisk ydeevne
Patienter bør informeres om risikoen for døsighed eller sedation (som kan føre til fald), især i perioden med initial dosistitrering. Patienter bør advares om at udføre enhver aktivitet, der kræver mental årvågenhed, såsom at betjene et motorkøretøj (inklusive biler) eller betjene maskiner, indtil de er rimelig sikre på, at quetiapinbehandling ikke påvirker dem negativt [se ADVARSLER OG FORHOLDSREGLER ].
Varmeeksponering og dehydrering
Patienter bør rådgives om passende pleje for at undgå overophedning og dehydrering [se ADVARSLER OG FORHOLDSREGLER ].
Samtidig medicinering
Som med andre lægemidler bør patienter rådes til at underrette deres læger, hvis de tager eller planlægger at tage receptpligtig eller håndkøbsmedicin [se DRUGSINTERAKTIONER ].
Graviditet
Råd gravide kvinder om at underrette deres læge, hvis de bliver gravide eller har til hensigt at blive gravide under behandling med SEROQUEL. Rådfør patienterne om, at SEROQUEL kan forårsage ekstrapyramidale og/eller abstinenssymptomer (agitation, hypertoni, hypotoni, tremor, somnolens, åndedrætsbesvær og spiseforstyrrelser) hos en nyfødt. Rådgiv patienterne om, at der er et graviditetsregister, der overvåger graviditetsresultater hos kvinder, der er eksponeret for SEROQUEL 25 mg under graviditeten [se Brug i specifikke populationer ].
Infertilitet
Informer kvinder med reproduktionspotentiale om, at SEROQUEL kan svække fertiliteten på grund af en stigning i serumprolaktinniveauet. Virkningerne på fertiliteten er reversible [se Brug i specifikke populationer ].
Behov for omfattende behandlingsprogram
SEROQUEL er indiceret som en integreret del af et samlet behandlingsprogram for unge med skizofreni og pædiatrisk bipolar lidelse, der kan omfatte andre foranstaltninger (psykologiske, pædagogiske og sociale). Effektiviteten og sikkerheden af SEROQUEL 100 mg er ikke blevet fastslået hos pædiatriske patienter under 13 år for skizofreni eller under 10 år for bipolar mani. Passende uddannelsesplacering er afgørende, og psykosocial intervention er ofte nyttig. Beslutningen om at ordinere atypisk antipsykotisk medicin vil afhænge af lægens vurdering af kroniskheden og sværhedsgraden af patientens symptomer [se INDIKATIONER ].
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
Carcinogenicitetsundersøgelser blev udført i C57BL-mus og Wistar-rotter. Quetiapin blev indgivet i kosten til mus i doser på 20, 75, 250 og 750 mg/kg og til rotter ved sondemad i doser på 25, 75 og 250 mg/kg i to år. Disse doser svarer til 0,1, 0,5, 1,5 og 4,5 gange MRHD på 800 mg/dag baseret på mg/m2 kropsoverfladeareal (mus) eller 0,3, 1 og 3 gange MRHD baseret på mg/m2 kropsoverfladeareal (rotter). Der var statistisk signifikante stigninger i skjoldbruskkirtelfollikulære adenomer hos hanmus ved doser på 1,5 og 4,5 gange MRHD baseret på mg/m2 kropsoverfladeareal og hos hanrotter ved en dosis på 3 gange MRHD på mg/m2 kropsoverfladeareal. Mælkekirteladenokarcinomer var statistisk signifikant øget hos hunrotter ved alle testede doser (0,3, 1 og 3 gange MRHD baseret på mg/m2 kropsoverfladeareal).
Skjoldbruskkirtelfollikulære celleadenomer kan være et resultat af kronisk stimulering af skjoldbruskkirtlen med thyreoideastimulerende hormon (TSH) som følge af øget metabolisme og clearance af thyroxin fra gnaverlever. Ændringer i TSH, thyroxin og thyroxin-clearance i overensstemmelse med denne mekanisme blev observeret i subkroniske toksicitetsundersøgelser hos rotter og mus og i et 1-årigt toksicitetsstudie med rotter; resultaterne af disse undersøgelser var dog ikke endelige. Relevansen af stigningerne i follikulære celleadenomer i skjoldbruskkirtlen for menneskelig risiko, uanset hvilken mekanisme, er ukendt.
Det har vist sig, at antipsykotiske lægemidler kronisk hæver prolaktinniveauet hos gnavere. Serummålinger i et 1-årigt toksicitetsstudie viste, at quetiapin øgede mediane serumprolaktinniveauer maksimalt 32- og 13-fold hos henholdsvis han- og hunrotter. Forøgelser i brystneoplasmer er fundet hos gnavere efter kronisk administration af andre antipsykotiske lægemidler og anses for at være prolaktin-medieret. Relevansen af denne øgede forekomst af prolaktin-medierede brystkirteltumorer hos rotter for menneskelig risiko er ukendt [se ADVARSLER OG FORHOLDSREGLER ].
Mutagenese
Quetiapin var ikke mutagent eller klastogent i standard genotoksicitetstests. Quetiapins mutagene potentiale blev testet i in vitro Ames bakterielle genmutationsassay og i in vitro pattedyrs genmutationsassay i kinesisk hamster ovarieceller. Det klastogene potentiale af quetiapin blev testet i in vitro kromosomafvigelsesassay i dyrkede humane lymfocytter og i in vivo knoglemarvsmikronukleusassay hos rotter op til 500 mg/kg, hvilket er 6 gange den maksimale anbefalede humane dosis baseret på mg/m2 kropsoverfladeareal.
Forringelse af fertilitet
Quetiapin nedsatte parring og fertilitet hos Sprague-Dawley hanrotter ved orale doser på 50 og 150 mg/kg eller ca. 1 og 3 gange MRHD på 800 mg/dag baseret på mg/m2 kropsoverfladeareal. Lægemiddelrelaterede effekter omfattede stigninger i interval til parring og i antallet af parringer, der kræves for vellykket imprægnering. Disse virkninger fortsatte med at blive observeret ved 3 gange MRHD selv efter en to-ugers periode uden behandling. Ingen effektdosis for svækket parring og fertilitet hos hanrotter var 25 mg/kg eller 0,3 gange MRHD-dosis baseret på mg/m2 kropsoverfladeareal. Quetiapin påvirkede parring og fertilitet negativt hos Sprague-Dawley hunrotter ved en oral dosis ca. 1 gange MRHD på 800 mg/dag baseret på mg/m2 kropsoverfladeareal. Lægemiddelrelaterede effekter omfattede fald i parringer og i parringer, der resulterede i graviditet, og en stigning i parringsintervallet. En stigning i uregelmæssige brunstcyklusser blev observeret ved doser på 10 og 50 mg/kg eller ca. 0,1 og 1 gange MRHD på 800 mg/dag baseret på mg/m2 kropsoverfladeareal. Ingen effektdosis hos hunrotter var 1 mg/kg eller 0,01 gange MRHD på 800 mg/dag baseret på mg/m2 kropsoverfladeareal.
Brug i specifikke populationer
Graviditet
Graviditetseksponeringsregister
Der findes et graviditetseksponeringsregister, der overvåger graviditetsresultater hos kvinder, der er udsat for atypiske antipsykotika, herunder SEROQUEL 50 mg, under graviditet. Sundhedsudbydere opfordres til at registrere patienter ved at kontakte National Pregnancy Registry for Atypical Antipsychotics på 1-866-961-2388 eller online på http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
Risikooversigt
Nyfødte udsat for antipsykotiske lægemidler (inklusive SEROQUEL) i tredje trimester har risiko for ekstrapyramidale og/eller abstinenssymptomer efter fødslen (se Kliniske overvejelser ). Overordnede tilgængelige data fra publicerede epidemiologiske undersøgelser af gravide kvinder udsat for quetiapin har ikke påvist en lægemiddelassocieret risiko for alvorlige fødselsdefekter, abort eller uønskede maternelle eller føtale udfald (se Data ). Der er risici for moderen forbundet med ubehandlet skizofreni, bipolar I eller svær depressiv lidelse og med eksponering for antipsykotika, herunder SEROQUEL 200 mg, under graviditet (se Kliniske overvejelser ).
I dyreforsøg forekom embryo-føtal toksicitet, herunder forsinkelser i skeletforbening ved ca. 1 og 2 gange den maksimale anbefalede humane dosis (MRHD) på 800 mg/dag hos både rotter og kaniner, og en øget forekomst af karpal/tarsal flexur (mindre) bløddelsanomali) hos kaninfostre ved ca. 2 gange MRHD. Derudover blev fostervægten faldet hos begge arter. Maternel toksicitet (observeret som nedsat kropsvægt og/eller død) forekom ved 2 gange MRHD hos rotter og ca. 1-2 gange MRHD hos kaniner.
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort for de angivne populationer er ukendt. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre ugunstige udfald. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 til 4 % og 15 til 20 %.
Kliniske overvejelser
Sygdomsrelateret moder- og/eller fosterrisiko
Der er en risiko for moderen fra ubehandlet skizofreni eller bipolar lidelse I, herunder øget risiko for tilbagefald, hospitalsindlæggelse og selvmord. Skizofreni og bipolar lidelse I er forbundet med øgede uønskede perinatale udfald, herunder for tidlig fødsel. Det vides ikke, om dette er et direkte resultat af sygdommen eller andre komorbide faktorer.
En prospektiv, longitudinel undersøgelse fulgte 201 gravide kvinder med en historie med svær depressiv lidelse, som var euthymic og tog antidepressiva i begyndelsen af graviditeten. De kvinder, der ophørte med antidepressiva under graviditeten, var mere tilbøjelige til at opleve tilbagefald af svær depression end kvinder, der fortsatte med antidepressiva. Overvej risikoen for ubehandlet depression ved seponering eller ændring af behandling med antidepressiv medicin under graviditet og efter fødslen.
Fetale/neonatale bivirkninger
Ekstrapyramidale og/eller abstinenssymptomer, herunder agitation, hypertoni, hypotoni, tremor, somnolens, åndedrætsbesvær og spiseforstyrrelser er blevet rapporteret hos nyfødte, som blev eksponeret for antipsykotiske lægemidler, inklusive SEROQUEL 50 mg, i løbet af graviditetens tredje trimester. Disse symptomer varierede i sværhedsgrad. Overvåg nyfødte for ekstrapyramidale og/eller abstinenssymptomer og håndtering af symptomerne på passende vis. Nogle nyfødte kom sig inden for timer eller dage uden specifik behandling; andre krævede længere tids indlæggelse.
Data
Menneskelige data
Publicerede data fra observationsstudier, fødselsregistre og case-rapporter om brug af atypiske antipsykotika under graviditet rapporterer ikke en klar sammenhæng med antipsykotika og større fødselsdefekter. Et retrospektivt kohortestudie fra en Medicaid-database med 9258 kvinder udsat for antipsykotika under graviditeten indikerede ikke en samlet øget risiko for alvorlige fødselsdefekter.
Dyredata
Når gravide rotter og kaniner blev eksponeret for quetiapin under organogenese, var der ingen teratogene virkning hos fostre. Doserne var 25, 50 og 200 mg/kg hos rotter og 25, 50 og 100 mg/kg hos kaniner, hvilket er ca. 0,3, 0,6 og 2 gange (rotter) og 0,6, 1 og 2 gange (kaniner) MRHD for skizofreni på 800 mg/dag baseret på mg/m2 kropsoverfladeareal. Der var dog tegn på embryo-føtal toksicitet, herunder forsinkelser i skeletforbening ved ca. 1 og 2 gange MRHD på 800 mg/dag hos både rotter og kaniner, og en øget forekomst af karpal/tarsal bøjning (mindre bløddelsanomali) i kaninfostre ved ca. 2 gange MRHD. Derudover blev fostervægten faldet hos begge arter. Maternel toksicitet (observeret som nedsat kropsvægt og/eller død) forekom ved 2 gange MRHD hos rotter og ca. 1-2 gange MRHD (alle testede doser) hos kaniner.
et peri/postnatalt reproduktionsstudie med rotter blev der ikke observeret nogen lægemiddelrelaterede virkninger, når gravide kvinder blev behandlet med quetiapin i doser på 0,01, 0,1 og 0,2 gange MRHD på 800 mg/dag baseret på mg/m2 kropsoverfladeareal. I en foreløbig peri/postnatal undersøgelse var der dog stigninger i føtal og hvalpedød og fald i gennemsnitlig kuldvægt ved 3 gange MRHD.
Amning
Risikooversigt
Begrænsede data fra publiceret litteratur rapporterer tilstedeværelsen af quetiapin i human modermælk ved en relativ spædbørnsdosis på
Hunner og mænd med reproduktionspotentiale
Infertilitet
Kvinder
Baseret på den farmakologiske virkning af quetiapin (D2-antagonisme), kan behandling med SEROQUEL resultere i en stigning i serumprolaktinniveauet, hvilket kan føre til en reversibel reduktion i fertiliteten hos kvinder med reproduktionspotentiale [se ADVARSLER OG FORHOLDSREGLER ].
Pædiatrisk brug
Generelt var de bivirkninger, der blev observeret hos børn og unge under de kliniske forsøg, de samme som dem i den voksne befolkning med få undtagelser. Forhøjelser i systolisk og diastolisk blodtryk forekom hos børn og unge og forekom ikke hos voksne. Ortostatisk hypotension forekom hyppigere hos voksne (4-7 %) sammenlignet med børn og unge ( ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ].
Skizofreni
Effekten og sikkerheden af SEROQUEL 50 mg til behandling af skizofreni hos unge i alderen 13-17 år blev påvist i et 6-ugers, dobbeltblindt, placebokontrolleret forsøg [se INDIKATIONER , DOSERING OG ADMINISTRATION , BIVIRKNINGER , og Kliniske Studier ].
Sikkerhed og effektivitet af SEROQUEL 300 mg hos pædiatriske patienter under 13 år med skizofreni er ikke blevet fastlagt.
Vedligeholdelse
Sikkerheden og effektiviteten af SEROQUEL til vedligeholdelsesbehandling af bipolar lidelse er ikke blevet fastslået hos pædiatriske patienter under 18 år. Sikkerheden og effektiviteten af SEROQUEL til vedligeholdelsesbehandling af skizofreni er ikke blevet fastslået hos nogen patientpopulation, herunder pædiatriske patienter.
Bipolar mani
Effekten og sikkerheden af SEROQUEL til behandling af mani hos børn og unge i alderen 10-17 år med bipolar lidelse I blev påvist i et 3-ugers, dobbeltblindt, placebokontrolleret, multicenterforsøg [se INDIKATIONER , DOSERING OG ADMINISTRATION , BIVIRKNINGER , og Kliniske Studier ]. Sikkerhed og effektivitet af SEROQUEL hos pædiatriske patienter under 10 år med bipolar mani er ikke blevet fastlagt.
Bipolar depression
Sikkerhed og effektivitet af SEROQUEL 300 mg hos pædiatriske patienter under 18 år med bipolar depression er ikke blevet fastlagt. Et klinisk forsøg med SEROQUEL XR blev udført hos børn og unge (10-17 år) med bipolar depression. Effekten blev ikke fastslået.
Nogle forskelle i quetiapins farmakokinetik blev observeret mellem børn/unge (10-17 år) og voksne. Når der blev justeret for vægt, var AUC og Cmax for quetiapin henholdsvis 41 % og 39 % lavere hos børn og unge sammenlignet med voksne. Farmakokinetikken af den aktive metabolit, norquetiapin, var ens for børn/unge og voksne efter justering for vægt [se KLINISK FARMAKOLOGI ].
Geriatrisk brug
Af de ca. 3700 patienter i kliniske studier med SEROQUEL 300 mg var 7% (232) 65 år eller derover. Generelt var der ingen indikation af en anderledes tolerabilitet af SEROQUEL hos ældre sammenlignet med yngre voksne. Ikke desto mindre bør tilstedeværelsen af faktorer, der kan nedsætte farmakokinetisk clearance, øge det farmakodynamiske respons på SEROQUEL 200 mg eller forårsage dårligere tolerance eller ortostase, føre til overvejelse af en lavere startdosis, langsommere titrering og omhyggelig overvågning i den indledende doseringsperiode i ældre. Den gennemsnitlige plasmaclearance af SEROQUEL 25 mg blev reduceret med 30 % til 50 % hos ældre patienter sammenlignet med yngre patienter [se KLINISK FARMAKOLOGI og DOSERING OG ADMINISTRATION ].
Nedsat nyrefunktion
Klinisk erfaring med SEROQUEL hos patienter med nedsat nyrefunktion er begrænset [se KLINISK FARMAKOLOGI ].
Nedsat leverfunktion
Da quetiapin i vid udstrækning metaboliseres af leveren, forventes højere plasmaniveauer hos patienter med nedsat leverfunktion. I denne population anbefales en lav startdosis på 25 mg/dag, og dosis kan øges i trin på 25 mg/dag-50 mg/dag [se DOSERING OG ADMINISTRATION og KLINISK FARMAKOLOGI ].
OVERDOSIS
Menneskelig oplevelse
I kliniske forsøg er overlevelse blevet rapporteret ved akutte overdoser på op til 30 gram quetiapin. De fleste patienter, der overdoserede, oplevede ingen bivirkninger eller kom sig fuldstændigt fra de rapporterede hændelser. Dødsfald er blevet rapporteret i et klinisk forsøg efter en overdosis på 13,6 gram quetiapin alene. Generelt var rapporterede tegn og symptomer dem, der var resultatet af en overdrivelse af lægemidlets kendte farmakologiske virkninger, dvs. døsighed, sedation, takykardi, hypotension og antikolinerg toksicitet inklusive koma og delirium. Patienter med allerede eksisterende alvorlig kardiovaskulær sygdom kan have en øget risiko for virkningerne af overdosering [se ADVARSLER OG FORHOLDSREGLER ]. Et tilfælde, der involverede en estimeret overdosis på 9600 mg, var forbundet med hypokaliæmi og førstegrads hjerteblokade. Efter markedsføring er der rapporteret tilfælde af QT-forlængelse med overdosering.
Håndtering af overdosering
Etabler og vedligehold en luftvej og sørg for tilstrækkelig iltning og ventilation. Kardiovaskulær monitorering bør påbegyndes øjeblikkeligt og bør omfatte kontinuerlig elektrokardiografisk monitorering for at påvise mulige arytmier.
Passende støtteforanstaltninger er grundpillen i ledelsen. Kontakt et certificeret regionalt giftkontrolcenter (1-800-222-1222) for at få de seneste oplysninger om håndtering af Seroquel XR-overdosering.
KONTRAINDIKATIONER
Overfølsomhed over for quetiapin eller andre hjælpestoffer i SEROQUEL XR-formuleringen. Anafylaktiske reaktioner er blevet rapporteret hos patienter behandlet med SEROQUEL XR.
KLINISK FARMAKOLOGI
Handlingsmekanisme
Virkningsmekanismen for quetiapin i de anførte indikationer er uklar. Effekten af quetiapin ved disse indikationer kan imidlertid medieres gennem en kombination af dopamin type 2 (D2) og serotonin type 2 (5HT2) antagonisme. Den aktive metabolit, N-desalkylquetiapin (norquetiapin), har lignende aktivitet ved D2, men større aktivitet ved 5HT2A-receptorer, end moderlægemidlet (quetiapin).
Farmakodynamik
Quetiapin og dets metabolit, norquetiapin, har affinitet til flere neurotransmitterreceptorer med norquetiapinbinding med højere affinitet end quetiapin generelt. Ki-værdierne for quetiapin og norquetiapin ved dopamin D1 er 428/99,8 nM, ved D2 626/489 nM, ved serotonin 5HT1A 1040/191 nM ved 5HT2A 38/2,9 nM, ved histamin H1 . 38,3 nM, og ved adrenerg alb 14,6/46,4 nM og ved a2-receptorer henholdsvis 617/1290 nM. Quetiapin og norquetiapin mangler mærkbar affinitet til benzodiazepinreceptorerne.
Effekt på QT-interval
kliniske forsøg var quetiapin ikke forbundet med en vedvarende stigning i QT-intervaller. QT-effekten blev dog ikke systematisk evalueret i et grundigt QT-studie. Efter markedsføringserfaring er der rapporteret tilfælde af QT-forlængelse hos patienter, der overdoserede quetiapin [se OVERDOSIS ], hos patienter med samtidig sygdom og hos patienter, der tager medicin, der vides at forårsage elektrolytforstyrrelser eller øge QT-intervallet.
Farmakokinetik
Voksne
Quetiapinfumarataktivitet skyldes primært moderlægemidlet. Quetiapins farmakokinetik til flere doser er dosisproportional inden for det foreslåede kliniske dosisinterval, og quetiapinakkumulering er forudsigelig ved gentagen dosering. Elimination af quetiapin sker hovedsageligt via levermetabolisme med en gennemsnitlig terminal halveringstid på ca. 6 timer inden for det foreslåede kliniske dosisinterval. Steady-state-koncentrationer forventes at blive opnået inden for to dage efter dosering. Det er usandsynligt, at quetiapin interfererer med metabolismen af lægemidler, der metaboliseres af cytokrom P450-enzymer.
Børn Og Unge
Ved steady state var moderstoffets farmakokinetik hos børn og unge (10-17 år) den samme som hos voksne. Men når der blev justeret for dosis og vægt, var AUC og Cmax for moderstoffet henholdsvis 41 % og 39 % lavere hos børn og unge end hos voksne. For den aktive metabolit, norquetiapin, var AUC og Cmax henholdsvis 45 % og 31 % højere hos børn og unge end hos voksne. Når der blev justeret for dosis og vægt, var farmakokinetikken af metabolitten, norquetiapin, ens for børn og unge og voksne [se Brug i specifikke populationer ].
Absorption
Quetiapinfumarat absorberes hurtigt efter oral administration og når maksimal plasmakoncentration efter 1,5 timer. Tabletformuleringen er 100 % biotilgængelig i forhold til opløsning. Biotilgængeligheden af quetiapin påvirkes marginalt af administration sammen med mad, med Cmax- og AUC-værdier øget med henholdsvis 25 % og 15 %.
Fordeling
Quetiapin er bredt fordelt i hele kroppen med et tilsyneladende fordelingsvolumen på 10±4 l/kg. Det er 83 % bundet til plasmaproteiner i terapeutiske koncentrationer. In vitro påvirkede quetiapin ikke bindingen af warfarin eller diazepam til humant serumalbumin. Til gengæld ændrede hverken warfarin eller diazepam bindingen af quetiapin.
Metabolisme og eliminering
Efter en enkelt oral dosis af 14C-quetiapin blev mindre end 1 % af den administrerede dosis udskilt som uændret lægemiddel, hvilket indikerer, at quetiapin er stærkt metaboliseret. Ca. 73 % og 20 % af dosis blev genfundet i henholdsvis urin og fæces.
Quetiapin metaboliseres i vid udstrækning i leveren. De vigtigste metaboliske veje er sulfoxidation til sulfoxidmetabolitten og oxidation til modersyremetabolitten; begge metabolitter er farmakologisk inaktive. In vitro undersøgelser med humane levermikrosomer viste, at cytochrom P450 3A4 isoenzymet er involveret i metabolismen af quetiapin til dets vigtigste, men inaktive, sulfoxidmetabolit og i metabolismen af dets aktive metabolit N-desalkylquetiapin.
Alder
Oral clearance af quetiapin blev reduceret med 40 % hos ældre patienter (≥ 65 år, n=9) sammenlignet med unge patienter (n=12), og dosisjustering kan være nødvendig [se DOSERING OG ADMINISTRATION ].
Køn
Der er ingen kønspåvirkning på quetiapins farmakokinetik.
Race
Der er ingen raceeffekt på quetiapins farmakokinetik.
Rygning
Rygning har ingen effekt på den orale clearance af quetiapin.
Nyreinsufficiens
Patienter med svært nedsat nyrefunktion (Clcr=10-30 mL/min/1,73 m2, n=8) havde en 25 % lavere gennemsnitlig oral clearance end normale forsøgspersoner (Clcr > 80 mL/min/1,73 m2, n=8), men Plasmakoncentrationer af quetiapin hos forsøgspersoner med nyreinsufficiens var inden for det koncentrationsområde, der ses hos normale forsøgspersoner, der fik den samme dosis. Dosisjustering er derfor ikke nødvendig hos disse patienter [se Brug i specifikke populationer ].
Leverinsufficiens
Patienter med nedsat leverfunktion (n=8) havde en 30 % lavere gennemsnitlig oral clearance af quetiapin end normale forsøgspersoner. Hos to af de 8 patienter med nedsat leverfunktion var AUC og Cmax 3 gange højere end dem, der typisk observeres hos raske forsøgspersoner. Da quetiapin i vid udstrækning metaboliseres af leveren, forventes højere plasmaniveauer i den leversvigte population, og dosisjustering kan være nødvendig [se DOSERING OG ADMINISTRATION og BRUG I SPECIFIKKE BEFOLKNINGER ].
Lægemiddel-lægemiddelinteraktionsstudier
In vivo-vurderingerne af virkningen af andre lægemidler på quetiapins farmakokinetik er opsummeret i tabel 17 [se DOSERING OG ADMINISTRATION og DRUGSINTERAKTIONER ].
In vitro enzymhæmningsdata tyder på, at quetiapin og 9 af dets metabolitter ville have ringe hæmmende effekt på in vivo metabolisme medieret af cytochromerne CYP 1A2, 2C9, 2C19, 2D6 og 3A4. Quetiapin i doser på 750 mg/dag påvirkede ikke enkeltdosisfarmakokinetikken af antipyrin, lithium eller lorazepam (tabel 18) [se DRUGSINTERAKTIONER ].
Dyretoksikologi og/eller farmakologi
Quetiapin forårsagede en dosisrelateret stigning i pigmentaflejring i skjoldbruskkirtlen i toksicitetsstudier med rotter, som varede 4 uger eller længere, og i et 2-årigt karcinogenicitetsstudie hos mus. Doserne var 10, 25, 50, 75, 150 og 250 mg/kg i rotteundersøgelser, som er ca. 0,1, 0,3, 0,6, 1, 2 og 3 gange MRHD på 800 mg/dag baseret på mg/m2 kropsoverfladeareal , henholdsvis. Doser i musekarcinogenicitetsundersøgelsen var 20, 75, 250 og 750 mg/kg, hvilket er ca. 0,1, 0,5, 1,5 og 4,5 gange MRHD på 800 mg/dag baseret på mg/m2 kropsoverfladeareal. Pigmentaflejring viste sig at være irreversibel hos rotter. Pigmentets identitet kunne ikke bestemmes, men blev fundet at være co-lokaliseret med quetiapin i follikulære epitelceller i skjoldbruskkirtlen. De funktionelle virkninger og relevansen af dette fund for human risiko er ukendt.
Hos hunde, der fik quetiapin i 6 eller 12 måneder, men ikke i 1 måned, forekom fokal trekantet grå stær ved samlingen af posteriore suturer i den ydre cortex af linsen med en dosis på 100 mg/kg eller 4 gange MRHD på 800 mg/dag baseret på mg/m2 kropsoverfladeareal. Dette fund kan skyldes quetiapins hæmning af kolesterolbiosyntesen. Quetiapin forårsagede en dosisrelateret reduktion i plasmakolesterolniveauer i undersøgelser med gentagne doser af hunde og aber; dog var der ingen sammenhæng mellem plasmakolesterol og tilstedeværelsen af grå stær hos individuelle hunde. Forekomsten af delta-8-cholestanol i plasma er i overensstemmelse med hæmning af et sent stadium i kolesterolbiosyntesen hos disse arter. Der var også en reduktion på 25 % i kolesterolindholdet i linsens ydre cortex observeret i en særlig undersøgelse med quetiapinbehandlede hunhunde. Lægemiddelrelateret grå stær er ikke set hos nogen anden art; I et 1-årigt studie med aber blev der dog påvist et stribet udseende af den forreste linseoverflade hos 2/7 hunner ved en dosis på 225 mg/kg eller 5,5 gange MRHD på 800 mg/dag baseret på mg/m2 krop overfladeareal.
Kliniske Studier
Skizofreni
Kortvarige forsøg - Voksne
Effekten af SEROQUEL 50 mg til behandling af skizofreni blev fastslået i 3 kortvarige (6-ugers) kontrollerede forsøg med indlagte patienter med skizofreni, som opfyldte DSM III-R kriterierne for skizofreni. Selvom en enkelt fastdosis haloperidol-arm blev inkluderet som en sammenlignende behandling i et af de tre forsøg, var denne enkelt haloperidol-dosisgruppe utilstrækkelig til at give en pålidelig og valid sammenligning af SEROQUEL 200mg og haloperidol.
Adskillige instrumenter blev brugt til at vurdere psykiatriske tegn og symptomer i disse undersøgelser, blandt dem Brief Psychiatric Rating Scale (BPRS), en multi-item opgørelse over generel psykopatologi, der traditionelt bruges til at evaluere virkningerne af lægemiddelbehandling ved skizofreni. BPRS-psykoseklyngen (konceptuel desorganisering, hallucinatorisk adfærd, mistænksomhed og usædvanligt tankeindhold) betragtes som en særlig nyttig undergruppe til vurdering af aktivt psykotiske skizofrene patienter. En anden traditionel vurdering, Clinical Global Impression (CGI), afspejler indtrykket af en dygtig observatør, som er fuldt fortrolig med manifestationerne af skizofreni, om patientens overordnede kliniske tilstand.
Resultaterne af forsøgene følger:
De primære effektivitetsresultater af disse tre undersøgelser i behandling af skizofreni hos voksne er vist i tabel 19.
Undersøgelse af befolkningsundergrupper (race, køn og alder) afslørede ikke nogen differentiel reaktionsevne på basis af race eller køn, med en tilsyneladende større effekt hos patienter under 40 år sammenlignet med dem, der er ældre end 40. Den kliniske betydning af dette fund er ukendt.
Unge (13-17 år)
Effekten af SEROQUEL 300 mg til behandling af skizofreni hos unge (13-17 år) blev påvist i et 6-ugers, dobbeltblindt, placebokontrolleret forsøg (studie 4). Patienter, der opfyldte DSM-IV diagnostiske kriterier for skizofreni, blev randomiseret i en af tre behandlingsgrupper: SEROQUEL 400 mg/dag (n=73), SEROQUEL 800 mg/dag (n=74) eller placebo (n=75). Studiemedicin blev påbegyndt med 50 mg/dag og på dag 2 øget til 100 mg/dag (delt og givet to eller tre gange dagligt). Efterfølgende blev dosis titreret til måldosis på 400 mg/dag eller 800 mg/dag ved hjælp af trin på 100 mg/dag, delt og givet to eller tre gange dagligt. Den primære effektvariabel var den gennemsnitlige ændring fra baseline i total positiv og negativ syndromskala (PANSS).
SEROQUEL ved 400 mg/dag og 800 mg/dag var bedre end placebo med hensyn til reduktion af PANSS total score. De primære effektivitetsresultater af denne undersøgelse i behandlingen af skizofreni hos unge er præsenteret i tabel 19.
Maniodepressiv
Bipolar I-lidelse, maniske eller blandede episoder
Voksne
Effekten af SEROQUEL til akut behandling af maniske episoder blev fastslået i 3 placebokontrollerede forsøg med patienter, der opfyldte DSM-IV-kriterierne for bipolar I lidelse med maniske episoder. Disse forsøg omfattede patienter med eller uden psykotiske træk og udelukkede patienter med hurtig cykling og blandede episoder. Af disse forsøg var 2 monoterapi (12 uger) og 1 var supplerende behandling (3 uger) til enten lithium eller divalproex. Nøgleresultater i disse forsøg var ændring fra baseline i Young Mania Rating Scale (YMRS)-score efter 3 og 12 uger for monoterapi og efter 3 uger for supplerende behandling. Supplerende behandling er defineret som samtidig påbegyndelse eller efterfølgende administration af SEROQUEL 100 mg med lithium eller divalproex.
Det primære vurderingsinstrument, der blev brugt til at vurdere maniske symptomer i disse forsøg, var YMRS, en 11-punkts kliniker-vurderet skala, der traditionelt bruges til at vurdere graden af manisk symptomatologi (irritabilitet, forstyrrende/aggressiv adfærd, søvn, forhøjet humør, tale, øget aktivitet, seksuel interesse, sprog-/tankeforstyrrelser, tankeindhold, udseende og indsigt) i et interval fra 0 (ingen maniske træk) til 60 (maksimal score).
Resultaterne af forsøgene følger:
Monoterapi
Effekten af SEROQUEL til akut behandling af bipolar mani blev fastslået i 2 placebokontrollerede forsøg. I to 12-ugers forsøg (n=300, n=299), der sammenlignede SEROQUEL med placebo, var SEROQUEL 300 mg bedre end placebo med hensyn til reduktion af YMRS-totalscore i uge 3 og 12. Størstedelen af patienterne i disse undersøgelser, der tog SEROQUEL 100 mg blev doseret i et interval mellem 400 mg/dag og 800 mg pr. dag (undersøgelse 1 og 2 i tabel 20).
Supplerende terapi
dette 3-ugers placebokontrollerede forsøg blev 170 patienter med bipolar mani (YMRS ≥20) randomiseret til at modtage SEROQUEL 100 mg eller placebo som supplerende behandling til lithium eller divalproex. Patienter kan have modtaget et passende behandlingsforløb med lithium eller divalproex før randomisering. SEROQUEL 50 mg var bedre end placebo, når det blev tilføjet til lithium eller divalproex alene i reduktionen af YMRS total score (undersøgelse 3 i tabel 20).
Størstedelen af patienterne i dette forsøg, der tog SEROQUEL 25 mg, blev doseret i et interval mellem 400 mg/dag og 800 mg pr. dag. I et tilsvarende designet forsøg (n=200) var SEROQUEL forbundet med en forbedring af YMRS-score, men viste ikke overlegenhed i forhold til placebo, muligvis på grund af en højere placeboeffekt.
De primære effektivitetsresultater af disse undersøgelser til behandling af mani hos voksne er vist i tabel 20.
Børn og unge (10-17 år)
Effekten af SEROQUEL til akut behandling af maniske episoder forbundet med bipolar I lidelse hos børn og unge (10-17 år) blev påvist i et 3-ugers, dobbeltblindt, placebokontrolleret, multicenterforsøg (studie 4 i Tabel 20). Patienter, der opfyldte DSM-IV diagnostiske kriterier for en manisk episode, blev randomiseret i en af tre behandlingsgrupper: SEROQUEL 400 mg/dag (n=95), SEROQUEL 600 mg/dag (n=98) eller placebo (n=91) . Studiemedicin blev påbegyndt med 50 mg/dag og på dag 2 øget til 100 mg/dag (delte doser givet to eller tre gange dagligt). Efterfølgende blev dosis titreret til en måldosis på 400 mg/dag eller 600 mg/dag ved hjælp af trin på 100 mg/dag, givet i opdelte doser to eller tre gange dagligt. Den primære effektvariabel var den gennemsnitlige ændring fra baseline i den samlede YMRS-score.
SEROQUEL 400 mg/dag og 600 mg/dag var bedre end placebo med hensyn til reduktion af YMRS total score (tabel 20).
Bipolar lidelse, depressive episoder
Voksne
Effekten af SEROQUEL 25 mg til akut behandling af depressive episoder forbundet med bipolar lidelse blev fastslået i 2 identisk designede 8-ugers, randomiserede, dobbeltblindede, placebokontrollerede undersøgelser (N=1045) (undersøgelse 5 og 6 i tabel 21) . Disse undersøgelser omfattede patienter med enten bipolar I- eller II-lidelse og dem med eller uden et hurtigt cyklusforløb. Patienter randomiseret til SEROQUEL 200 mg fik faste doser på enten 300 mg eller 600 mg én gang dagligt.
Det primære vurderingsinstrument, der blev brugt til at vurdere depressive symptomer i disse undersøgelser, var Montgomery-Asberg Depression Rating Scale (MADRS), en 10-elements kliniker-vurderet skala med score fra 0 til 60. Det primære endepunkt i begge undersøgelser var ændringen fra baseline i MADRS-score i uge 8. I begge undersøgelser var SEROQUEL 50 mg bedre end placebo med hensyn til reduktion af MADRS-score. Forbedring af symptomer, målt ved ændring i MADRS-score i forhold til placebo, blev set i begge undersøgelser på dag 8 (uge 1) og fremefter. I disse undersøgelser blev der ikke set yderligere fordele ved 600 mg dosis. For 300 mg-dosisgruppen blev der set statistisk signifikante forbedringer i forhold til placebo i den generelle livskvalitet og tilfredshed relateret til forskellige funktionsområder, målt ved hjælp af Q-LES-Q(SF).
De primære effektresultater af disse undersøgelser i den akutte behandling af depressive episoder forbundet med bipolar lidelse hos voksne er vist i tabel 21.
Vedligeholdelsesbehandling som supplement til lithium eller divalproex
Effekten af SEROQUEL 100 mg til vedligeholdelsesbehandling af bipolar I-lidelse blev fastslået i 2 placebokontrollerede forsøg med patienter (n=1326), som opfyldte DSM-IV-kriterierne for bipolar I-lidelse (undersøgelse 7 og 8 i figur 1 og 2). Forsøgene omfattede patienter, hvis seneste episode var manisk, deprimeret eller blandet, med eller uden psykotiske træk. I den åbne fase skulle patienterne være stabile på SEROQUEL plus lithium eller divalproex i mindst 12 uger for at blive randomiseret. I gennemsnit blev patienterne stabiliseret i 15 uger. I randomiseringsfasen fortsatte patienterne behandlingen med lithium eller divalproex og blev randomiseret til at modtage enten SEROQUEL (indgivet to gange dagligt i alt 400 mg/dag til 800 mg/dag) eller placebo. Ca. 50 % af patienterne var seponeret fra SEROQUEL-gruppen på dag 280, og 50 % af placebogruppen havde seponeret på dag 117 af den dobbeltblindede behandling. Det primære endepunkt i disse undersøgelser var tid til gentagelse af en stemningsbegivenhed (manisk, blandet eller deprimeret episode). En stemningsbegivenhed blev defineret som påbegyndelse af medicin eller hospitalsindlæggelse for en stemningsepisode; YMRS-score≥20 eller MADRS-score≥20 ved 2 på hinanden følgende vurderinger; eller studiestop på grund af en stemningsbegivenhed (Figur 1 og Figur 2).
begge undersøgelser var SEROQUEL placebo overlegen med hensyn til at øge tiden til gentagelse af enhver stemningsbegivenhed. Behandlingseffekten var til stede i stigende tid til tilbagefald af både maniske og depressive episoder. Virkningen af SEROQUEL var uafhængig af nogen specifik undergruppe (tildelt humørstabilisator, køn, alder, race, seneste bipolar episode eller hurtig cykling).
Figur 1: Kaplan-Meier-kurver over tid til gentagelse af en stemningsbegivenhed (undersøgelse 7)
Figur 2: Kaplan-Meier-kurver over tid til gentagelse af en stemningsbegivenhed (undersøgelse 8)
PATIENTOPLYSNINGER
SEROQUEL (SER-oh-kwell)(quetiapinfumarat) Tabletter
Læs denne medicinvejledning, før du begynder at tage SEROQUEL, og hver gang du får en genopfyldning. Der kan være nye oplysninger. Disse oplysninger træder ikke i stedet for at tale med din sundhedsplejerske om din medicinske tilstand eller din behandling.
Hvad er den vigtigste information, jeg bør vide om SEROQUEL?
SEROQUEL 100mg kan forårsage alvorlige bivirkninger, herunder:
- Tal med din eller dit familiemedlems sundhedsplejerske om:
- alle risici og fordele ved behandling med antidepressiv medicin.
- alle behandlingsvalg for depression eller anden alvorlig psykisk sygdom
- Antidepressiv medicin kan øge selvmordstanker eller -handlinger hos nogle børn, teenagere og unge voksne inden for de første par måneder af behandlingen.
- Depression og andre alvorlige psykiske sygdomme er de vigtigste årsager til selvmordstanker og -handlinger. Nogle mennesker kan have en særlig høj risiko for at få selvmordstanker eller -handlinger. Disse omfatter personer, der har (eller har en familiehistorie med) depression, bipolar sygdom (også kaldet maniodepressiv sygdom) eller selvmordstanker eller -handlinger.
- Hvordan kan jeg holde øje med og forsøge at forhindre selvmordstanker og -handlinger hos mig selv eller et familiemedlem?
- Vær meget opmærksom på ændringer, især pludselige ændringer, i humør, adfærd, tanker eller følelser. Dette er meget vigtigt, når en antidepressiv medicin startes, eller når dosis ændres.
- Ring til sundhedsudbyderen med det samme for at rapportere nye eller pludselige ændringer i humør, adfærd, tanker eller følelser.
- Hold alle opfølgende besøg hos sundhedsplejersken som planlagt. Ring til lægen mellem besøgene efter behov, især hvis du har bekymringer om symptomer.
Ring til en sundhedsudbyder med det samme, hvis du eller dit familiemedlem har nogle af følgende symptomer, især hvis de er nye, værre eller bekymrer dig:
- tanker om selvmord eller døende
- forsøg på at begå selvmord
- ny eller værre depression
- ny eller værre angst
- føler sig meget ophidset eller rastløs
- Angstanfald
- søvnbesvær (søvnløshed)
- ny eller værre irritabilitet
- opfører sig aggressivt, er vred eller voldelig
- handler på farlige impulser
- en ekstrem stigning i aktivitet og tale (mani)
- andre usædvanlige ændringer i adfærd eller humør
Hvad skal jeg ellers vide om antidepressiv medicin?
- Stop aldrig en antidepressiv medicin uden først at tale med din læge. Hvis du pludselig stopper en antidepressiv medicin, kan det forårsage andre symptomer.
- Antidepressiva er medicin, der bruges til at behandle depression og andre sygdomme. Det er vigtigt at diskutere alle risiciene ved behandling af depression, og også risiciene ved ikke at behandle den. Patienter og deres familier eller andre pårørende bør diskutere alle behandlingsvalg med sundhedsudbyderen, ikke kun brugen af antidepressiva.
- Antidepressiv medicin har andre bivirkninger. Tal med lægen om bivirkningerne af den medicin, der er ordineret til dig eller dit familiemedlem.
- Antidepressiv medicin kan interagere med anden medicin. Kend alle de lægemidler, du eller dit familiemedlem tager. Hold en liste over alle lægemidler for at vise sundhedsudbyderen. Start ikke med ny medicin uden først at tjekke med din læge.
- Ikke alle antidepressive lægemidler ordineret til børn er FDA godkendt til brug hos børn. Tal med dit barns sundhedsplejerske for mere information.
Hvad er SEROQUEL 300mg?
SEROQUEL 100mg er en receptpligtig medicin, der bruges til at behandle:
- skizofreni hos personer 13 år eller ældre
- bipolar lidelse hos voksne, herunder:
- depressive episoder forbundet med bipolar lidelse
- maniske episoder forbundet med bipolar lidelse I alene eller med lithium eller divalproex
- langtidsbehandling af bipolar lidelse I med lithium eller divalproex
- maniske episoder forbundet med bipolar lidelse I hos børn i alderen 10-17 år
Det vides ikke, om SEROQUEL 100mg er sikkert og effektivt til børn under 10 år.
Hvad skal jeg fortælle min læge, før jeg tager SEROQUEL 100mg?
Inden du tager SEROQUEL 200 mg, skal du fortælle det til din læge, hvis du har eller har haft:
- diabetes eller højt blodsukker hos dig eller din familie. Din læge bør tjekke dit blodsukker, før du starter med SEROQUEL 300mg, og også under behandlingen
- høje niveauer af totalt kolesterol, triglycerider eller LDL-kolesterol, eller lave niveauer af HDL-kolesterol
- lavt eller højt blodtryk
- lavt antal hvide blodlegemer
- grå stær
- anfald
- unormale skjoldbruskkirtelprøver
- høje prolaktinniveauer
- hjerteproblemer
- leverproblemer
- enhver anden medicinsk tilstand
- graviditet eller planer om at blive gravid. Det vides ikke, om SEROQUEL 100mg vil skade dit ufødte barn.
- Hvis du bliver gravid, mens du får SEROQUEL, skal du tale med din læge om tilmelding til det nationale graviditetsregister for atypiske antipsykotika. Du kan tilmelde dig ved at ringe til 1-866-961-2388 eller gå til http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
- amning eller planlægger at amme. SEROQUEL kan gå over i din modermælk. Tal med din læge om den bedste måde at fodre din baby på, hvis du får SEROQUEL.
- hvis du har eller har haft en tilstand, hvor du ikke kan tømme blæren helt (urinretention), har en forstørret prostata eller forstoppelse eller øget tryk i øjnene.
Fortæl lægen om al den medicin, du tager eller for nylig har taget herunder receptpligtig medicin, håndkøbsmedicin, naturlægemidler og vitaminer.
SEROQUEL 300mg og anden medicin kan påvirke hinanden og forårsage alvorlige bivirkninger. SEROQUEL 200mg kan påvirke den måde, anden medicin virker på, og anden medicin kan påvirke, hvordan SEROQUEL 200mg virker.
Fortæl det til din læge, hvis du har en urinmedicinsk screening, da SEROQUEL kan påvirke dine testresultater. Fortæl dem, der tager testen, at du tager SEROQUEL.
Hvordan skal jeg tage SEROQUEL?
- Tag SEROQUEL nøjagtigt som din læge fortæller dig at tage det. Du må ikke selv ændre dosis.
- Tag SEROQUEL 25 mg gennem munden, med eller uden mad.
- Hvis du føler, du skal stoppe med SEROQUEL 25 mg, skal du først tale med din læge. Hvis du pludselig holder op med at tage SEROQUEL, kan du få bivirkninger såsom søvnbesvær eller søvnbesvær (søvnløshed), kvalme og opkastning.
- Hvis du glemmer en dosis af SEROQUEL 25 mg, skal du tage den, så snart du husker det. Hvis du er tæt på din næste dosis, skal du springe den glemte dosis over. Tag blot den næste dosis på dit normale tidspunkt. Tag ikke 2 doser på samme tid, medmindre din læge fortæller dig det. Ring til din læge, hvis du ikke er sikker på din dosering.
Hvad skal jeg undgå, mens jeg tager SEROQUEL 100mg?
- Du må ikke køre bil, betjene maskiner eller udføre andre farlige aktiviteter, før du ved, hvordan SEROQUEL påvirker dig. SEROQUEL kan gøre dig døsig.
- Undgå at blive overophedet eller dehydreret.
- Overmotion ikke.
- I varmt vejr, ophold inde på et køligt sted, hvis det er muligt.
- Hold dig væk fra solen. Brug ikke for meget eller tungt tøj.
- Drik masser af vand.
- Drik ikke alkohol, mens du tager SEROQUEL. Det kan forværre nogle bivirkninger af SEROQUEL.
Hvad er mulige bivirkninger af SEROQUEL 300mg?
SEROQUEL 200mg kan forårsage alvorlige bivirkninger, herunder:
- Se "Hvad er den vigtigste information, jeg bør vide om SEROQUEL 200mg?"
- slagtilfælde, der kan føre til døden, kan forekomme hos ældre mennesker med demens, som tager medicin som SEROQUEL
- malignt neuroleptisk syndrom (NMS). NMS er en sjælden, men meget alvorlig tilstand, der kan forekomme hos personer, der tager antipsykotisk medicin, herunder SEROQUEL. NMS kan forårsage død og skal behandles på et hospital. Ring til din læge med det samme, hvis du bliver alvorligt syg og har nogle eller alle disse symptomer:
- høj feber
- overdreven svedtendens
- stive muskler
- forvirring
- ændringer i dit åndedræt, hjerteslag og blodtryk
- falder kan forekomme hos nogle personer, der tager SEROQUEL. Disse fald kan forårsage alvorlige skader.
- højt blodsukker (hyperglykæmi). Højt blodsukker kan forekomme, hvis du allerede har diabetes, eller hvis du aldrig har haft diabetes. Højt blodsukker kan føre til:
- ophobning af syre i dit blod på grund af ketoner (ketoacidose)
- koma
- død
Blodsukkerstigninger kan forekomme hos nogle mennesker, der tager SEROQUEL. Ekstremt højt blodsukker kan føre til koma eller død. Hvis du har diabetes eller risikofaktorer for diabetes (såsom overvægt eller en familiehistorie med diabetes), bør din læge kontrollere dit blodsukker, før du starter med SEROQUEL 50 mg og under behandlingen. Ring til din læge, hvis du har nogle af disse symptomer på forhøjet blodsukker (hyperglykæmi), mens du tager SEROQUEL:
- føler sig meget tørstig
- skal tisse mere end normalt
- føler sig meget sulten
- føler sig svag eller træt
- får ondt i maven
- føler dig forvirret, eller din ånde lugter frugtagtig
- højt fedtindhold i dit blod (forhøjet kolesterol og triglycerider). Høje fedtniveauer kan forekomme hos personer, der behandles med SEROQUEL. Du har muligvis ingen symptomer, så din læge kan beslutte at tjekke dit kolesterol og triglycerider under din behandling med SEROQUEL.
- stigning i vægt (vægtøgning). Vægtøgning er almindelig hos personer, der tager SEROQUEL, så du og din læge bør tjekke din vægt regelmæssigt. Tal med din sundhedsudbyder om måder at kontrollere vægtøgning på, såsom at spise en sund, afbalanceret kost og motion.
- bevægelser, du ikke kan kontrollere i dit ansigt, din tunge eller andre kropsdele (tardiv dyskinesi). Disse kan være tegn på en alvorlig tilstand. Tardiv dyskinesi forsvinder muligvis ikke, selvom du holder op med at tage SEROQUEL. Tardiv dyskinesi kan også starte, efter du holder op med at tage SEROQUEL.
- nedsat blodtryk (ortostatisk hypotension), herunder svimmelhed eller besvimelse forårsaget af en pludselig ændring i hjertefrekvens og blodtryk, når man stiger for hurtigt fra siddende eller liggende stilling.
- stigninger i blodtrykket hos børn og teenagere. Din læge bør kontrollere blodtrykket hos børn og unge, før du starter med SEROQUEL og under behandlingen.
- lavt antal hvide blodlegemer. Fortæl din læge så hurtigt som muligt, hvis du har feber, influenzalignende symptomer eller enhver anden infektion, da dette kan være et resultat af et meget lavt antal hvide blodlegemer. Din sundhedsplejerske kan kontrollere dit niveau af hvide blodlegemer for at afgøre, om yderligere behandling eller anden handling er nødvendig.
- grå stær
- anfald
- unormale skjoldbruskkirtelprøver. Din sundhedsplejerske kan tage blodprøver for at kontrollere dit skjoldbruskkirtelhormonniveau.
- stigninger i prolaktinniveauer
- søvnighed, døsighed, træthed, besvær med at tænke og udføre normale aktiviteter
- øget kropstemperatur
- synkebesvær
- søvnbesvær eller problemer med at blive ved med at sove (søvnløshed), kvalme eller opkastning, hvis du pludselig holder op med at tage SEROQUEL. Disse symptomer bliver normalt bedre 1 uge efter, du er begyndt at have dem.
De mest almindelige bivirkninger af SEROQUEL 50mg omfatter:
Hos voksne:
- døsighed
- pludseligt blodtryksfald, når du står op
- vægtøgning
- træghed
- unormale leverprøver
- dårlig mave
- tør mund
- svimmelhed
- svaghed
- mavesmerter
- forstoppelse
- ondt i halsen
Hos børn og unge:
- døsighed
- svimmelhed
- træthed
- kvalme
- tør mund
- vægtøgning
- øget appetit
- opkastning
- hurtig hjerterytme
Disse er ikke alle de mulige bivirkninger af SEROQUEL. For mere information, spørg din læge eller apotek.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare SEROQUEL 100mg?
- Opbevar SEROQUEL 100mg ved stuetemperatur, mellem 68°F til 77°F (20°C til 25°C).
- Opbevar SEROQUEL og al medicin utilgængeligt for børn.
Generel information om sikker og effektiv brug af SEROQUEL
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en medicinvejledning. Brug ikke SEROQUEL til en tilstand, som den ikke er ordineret til. Giv ikke SEROQUEL til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Denne medicinvejledning opsummerer de vigtigste oplysninger om SEROQUEL. Hvis du vil have mere information, så tal med din sundhedsplejerske. Du kan bede din apoteker eller sundhedsudbyder om oplysninger om SEROQUEL 100mg, der er skrevet til sundhedspersonale.
For mere information, gå til www.SEROQUEL.com , eller ring på 1-800-236-9933.
Hvad er ingredienserne i SEROQUEL 200mg?
Aktiv ingrediens: quetiapinfumarat
Inaktive ingredienser: povidon, dibasisk dicalciumphosphatdihydrat, mikrokrystallinsk cellulose, natriumstivelsesglycolat, lactosemonohydrat, magnesiumstearat, hypromellose, polyethylenglycol og titaniumdioxid. 25 mg tabletterne indeholder rødt og gult jernoxid. 100 mg og 400 mg tabletterne indeholder kun gult jernoxid.
Denne medicinvejledning er godkendt af US Food and Drug Administration.
