Medicin mod depression: Celexa 10mg, 20mg Citalopram Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Celexa, og hvordan bruges det?
Celexa er en receptpligtig medicin, der bruges til at behandle symptomer på depression. Celexa kan bruges alene eller sammen med anden medicin.
Celexa 20mg tilhører en klasse af lægemidler kaldet antidepressiva, SSRI'er.
Hvad er de mulige bivirkninger af Celexa?
Celexa kan forårsage alvorlige bivirkninger, herunder:
- svimmelhed,
- sløret syn,
- tunnelsyn,
- øjensmerter eller hævelse,
- ser glorier omkring lys,
- hovedpine med brystsmerter og svær svimmelhed,
- besvimelse,
- hurtig eller bankende hjerteslag,
- meget stive (stive) muskler,
- feber eller høj feber,
- svedeture,
- forvirring,
- rystelser,
- agitation,
- hallucinationer,
- overaktive reflekser,
- kvalme,
- opkastning,
- diarré,
- tab af koordination,
- hovedpine,
- utydelig tale,
- alvorlig svaghed, og
- føler sig ustabil
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Celexa 20mg omfatter:
- hukommelsesproblemer,
- koncentrationsbesvær,
- hovedpine,
- døsighed,
- tør mund,
- øge svedtendens,
- følelsesløshed eller prikken,
- øget appetit,
- kvalme,
- diarré,
- gas,
- hurtige hjerteslag,
- føler sig rystende,
- søvnproblemer (søvnløshed),
- træthedsfornemmelse,
- forkølelsessymptomer (tilstoppet næse, nysen, ondt i halsen),
- vægtændringer, og
- svært ved at få orgasme
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Celexa. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Suicidalitet og antidepressive stoffer
Antidepressiva øgede risikoen sammenlignet med placebo for selvmordstanker og -adfærd (suicidalitet) hos børn, unge og unge voksne i korttidsstudier af svær depressiv lidelse (MDD) og andre psykiatriske lidelser. Enhver, der overvejer at bruge Celexa eller ethvert andet antidepressivt middel til et barn, en teenager eller en ung voksen, skal balancere denne risiko med det kliniske behov. Korttidsundersøgelser viste ikke en stigning i risikoen for suicidalitet med antidepressiva sammenlignet med placebo hos voksne efter 24 år; der var en reduktion i risikoen med antidepressiva sammenlignet med placebo hos voksne på 65 år og derover. Depression og visse andre psykiatriske lidelser er i sig selv forbundet med øget risiko for selvmord. Patienter i alle aldre, der påbegyndes med antidepressiv behandling, bør overvåges passende og observeres nøje for klinisk forværring, suicidalitet eller usædvanlige ændringer i adfærd. Familier og pårørende bør informeres om behovet for tæt observation og kommunikation med ordinatoren. Celexa 10mg er ikke godkendt til brug hos pædiatriske patienter. (Se ADVARSLER: Klinisk forværring og selvmordsrisiko, PATIENTINFORMATION og FORHOLDSREGLER: Pædiatrisk brug.)
BESKRIVELSE
Celexa® (citalopram HBr) er en oralt administreret selektiv serotoningenoptagelseshæmmer (SSRI) med en kemisk struktur, der ikke er relateret til strukturen af andre SSRI'er eller tricykliske, tetracykliske eller andre tilgængelige antidepressive midler. Citalopram HBr er et racemisk bicyklisk phthalanderivat betegnet (±)-1-(3-dimethylaminopropyl)-1-(4-fluorphenyl)-1,3-dihydroisobenzofuran-5-carbonitril, HBr med følgende strukturformel:
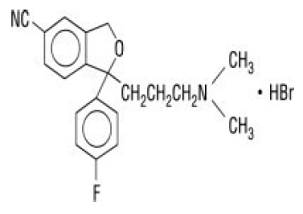
Molekylformlen er C20H22BrFN2O og dens molekylvægt er 405,35.
Citalopram HBr forekommer som et fint, hvidt til råhvidt pulver. Citalopram HBr er tungtopløseligt i vand og opløseligt i ethanol.
Celexa (citalopramhydrobromid) er kun tilgængelig i tabletdoseringsform.
Celexa 10 mg er filmovertrukne, ovale tabletter indeholdende citalopram HBr i styrker svarende til 10 mg citalopram base. Celexa 20 mg og 40 mg er filmovertrukne, ovale tabletter med delekærv, der indeholder citalopram HBr i styrker svarende til 20 mg eller 40 mg citalopram base. Tabletterne indeholder også følgende inaktive ingredienser: copolyvidon, majsstivelse, crosscarmellosenatrium, glycerin, lactosemonohydrat, magnesiumstearat, hypromellose, mikrokrystallinsk cellulose, polyethylenglycol og titaniumdioxid. Jernoxider bruges som farvestoffer i de beige (10 mg) og lyserøde (20 mg) tabletter.
INDIKATIONER
CELEXA 20mg er indiceret til behandling af svær depressiv lidelse (MDD) hos voksne [se Kliniske Studier ].
DOSERING OG ADMINISTRATION
Anbefalet dosering
Administrer CELEXA én gang dagligt, med eller uden mad, i en startdosis på 20 mg én gang dagligt, med en stigning til en maksimal dosis på 40 mg én gang dagligt med et interval på ikke mindre end én uge.
Doser over 40 mg én gang dagligt anbefales ikke på grund af risikoen for QT-forlængelse [se ADVARSLER OG FORHOLDSREGLER ].
Skærm for bipolar lidelse før start af CELEXA
Inden påbegyndelse af behandling med CELEXA 20mg eller et andet antidepressivum skal patienter screenes for en personlig eller familiehistorie med bipolar lidelse, mani eller hypomani [Se ADVARSLER OG FORHOLDSREGLER ].
Anbefalet dosering til specifikke populationer
Den maksimalt anbefalede dosis af CELEXA 10 mg til patienter over 60 år, patienter med nedsat leverfunktion og for CYP2C19-fattige metabolisatorer er 20 mg én gang dagligt [se ADVARSLER OG FORHOLDSREGLER , KLINISK FARMAKOLOGI ].
Dosisændringer ved samtidig brug af CYP2C19-hæmmere
Den maksimale anbefalede dosis af CELEXA 20 mg, når den bruges samtidig med en CYP2C19-hæmmer, er 20 mg én gang dagligt [se ADVARSLER OG FORHOLDSREGLER , DRUGSINTERAKTIONER ].
Skift af patienter til eller fra et monoaminoxidasehæmmer antidepressivt middel
Der skal gå mindst 14 dage mellem seponering af et monoaminoxidasehæmmer (MAOI) antidepressivum og påbegyndelse af behandling med CELEXA. Omvendt skal der gå mindst 14 dage efter ophør med CELEXA, før man starter et MAO-antidepressivum [se KONTRAINDIKATIONER og ADVARSLER OG FORHOLDSREGLER ].
Afbrydelse af behandling med CELEXA
Bivirkninger kan forekomme ved seponering af CELEXA [se ADVARSLER OG FORHOLDSREGLER ]. Reducer gradvist dosis i stedet for at stoppe CELEXA brat, når det er muligt.
HVORDAN LEVERET
Doseringsformer og styrker
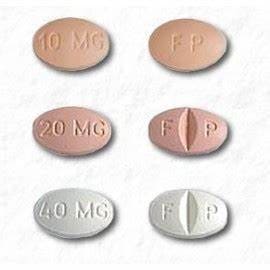
CELEXA 10 mg tabletter fås som:
- 10 mg: beige, oval med "FP" påtrykt på den ene side, "10 mg" påtrykt på den anden side
- 20 mg: pink, oval, mærket med "F" påtrykt på venstre side af delekærv og "P" påtrykt højre side af delekærv, "20 mg" påtrykt på side uden skær
- 40 mg: hvid, oval, mærket med "F" påtrykt på venstre side af delekærv og "P" påtrykt højre side af delekærv, "40 mg" påtrykt på side uden skær
CELEXA (citalopram) tabletter leveres som følger:
Opbevaring og håndtering
CELEXA 10 mg tabletter skal opbevares ved 20-25°C (68 til 77°F); udflugter tilladt mellem 15 og 30°C (59-86°F) [se USP kontrolleret rumtemperatur ].
Distribueret af: Allergan USA, Inc. Revideret: feb 2022
BIVIRKNINGER
Følgende bivirkninger er beskrevet mere detaljeret i andre afsnit af mærkningen:
- Overfølsomhedsreaktioner [se KONTRAINDIKATIONER ]
- Selvmordstanker og -adfærd hos unge og unge voksne [se ADVARSLER OG FORHOLDSREGLER ]
- QT-forlængelse og torsade de pointes [se ADVARSLER OG FORHOLDSREGLER ]
- Serotonin syndrom [se ADVARSLER OG FORHOLDSREGLER ]
- Øget risiko for blødning [se ADVARSLER OG FORHOLDSREGLER ]
- Aktivering af mani eller hypomani [se ADVARSLER OG FORHOLDSREGLER ]
- Seponeringssyndrom [se ADVARSLER OG FORHOLDSREGLER ]
- Anfald [se ADVARSLER OG FORHOLDSREGLER ]
- Vinkel-lukkende glaukom [se ADVARSLER OG FORHOLDSREGLER ]
- Hyponatriæmi [se ADVARSLER OG FORHOLDSREGLER ]
- Seksuel dysfunktion [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkninger observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med frekvenser i de kliniske undersøgelser af et andet lægemiddel og afspejler muligvis ikke frekvenserne observeret i klinisk praksis.
Sikkerheden for CELEXA 20 mg inkluderede citaloprameksponeringer hos patienter og/eller raske forsøgspersoner fra 3 forskellige grupper af undersøgelser: 429 raske forsøgspersoner i klinisk farmakologi/farmakokinetiske undersøgelser; 4.422 eksponeringer fra patienter i kontrollerede og ukontrollerede kliniske forsøg, svarende til cirka 1.370 patienteksponeringsår. Der var desuden over 19.000 eksponeringer fra for det meste åbne europæiske postmarketing-undersøgelser. Betingelserne og varigheden af behandlingen med CELEXA 10 mg varierede meget og omfattede (i overlappende kategorier) åbne og dobbeltblindede undersøgelser, indlagte og ambulante undersøgelser, studier med faste doser og dosistitrering samt korttids- og langtidseksponering. .
Bivirkninger forbundet med seponering af behandling
Blandt 1.063 patienter med MDD, som fik CELEXA 10 mg i doser fra 10 mg til 80 mg én gang dagligt i placebokontrollerede forsøg af op til 6 ugers varighed, afbrød 16 % behandlingen på grund af en bivirkning sammenlignet med 8 % af 446 patienter får placebo. Bivirkningerne forbundet med seponering (dvs. forbundet med seponering hos mindst 1 % af CELEXA-behandlede patienter med en hastighed på mindst det dobbelte af placebo) er vist i tabel 2.
Tabel 3 opregner forekomsten af bivirkninger, der opstod blandt 1.063 patienter med MDD, som fik CELEXA 20 mg i doser fra 10 mg til 80 mg én gang dagligt i placebokontrollerede forsøg af op til 6 ugers varighed.
Den mest almindelige bivirkning, der opstod hos CELEXA-behandlede patienter med en incidens på 5 % eller mere og mindst to gange forekomsten hos placebopatienter, var ejakulationsforstyrrelser (primært ejakulatorisk forsinkelse) hos mandlige patienter (se tabel 3).
Dosisafhængige bivirkninger
Det potentielle forhold mellem dosis af CELEXA 10 mg og forekomsten af bivirkninger blev undersøgt i et fastdosisstudie hos patienter med MDD, der fik placebo eller CELEXA 10 mg, 20 mg 40 mg eller 60 mg (1,5 gange den maksimalt anbefalede dosis) . Et positivt dosisrespons (p
Mandlig og kvindelig seksuel dysfunktion med SSRI'er
Selvom ændringer i seksuel lyst, seksuel præstation og seksuel tilfredsstillelse ofte forekommer som manifestationer af en psykiatrisk lidelse, kan de også være en konsekvens af SSRI-behandling. Pålidelige skøn over forekomsten og sværhedsgraden af uheldige oplevelser, der involverer seksuel lyst, ydeevne og tilfredshed, er imidlertid vanskelige at opnå, til dels fordi patienter og sundhedsudbydere kan være tilbageholdende med at diskutere dem. Følgelig kan skøn over forekomsten af uønsket seksuel oplevelse og ydeevne, der er nævnt i mærkningen, undervurdere deres faktiske forekomst.
Tabel 4 viser forekomsten af seksuelle bivirkninger rapporteret af mindst 2 % af mandlige patienter, der tog CELEXA 20 mg i en pulje af placebokontrollerede kliniske forsøg hos patienter med depression.
Hos kvindelige deprimerede patienter, der fik CELEXA 20 mg, var den rapporterede forekomst af nedsat libido og anorgasmi henholdsvis 1,3 % (n=638 kvinder) og 1,1 % (n=252 kvinder).
Vægtændringer
Patienter behandlet med CELEXA i kontrollerede forsøg oplevede et vægttab på ca. 0,5 kg sammenlignet med ingen ændring for placebopatienter.
EKG ændringer
I et grundigt QT-studie blev CELEXA fundet at være forbundet med en dosisafhængig stigning i QTc-intervallet.
Elektrokardiogrammer fra grupperne CELEXA (N=802) og placebo (N=241) blev sammenlignet med hensyn til afvigende værdier defineret som forsøgspersoner med QTc-ændringer over 60 msek fra baseline eller absolutte værdier over 500 msek efter dosis, og forsøgspersoner med hjertefrekvensstigninger til over 100 bpm eller falder til mindre end 50 bpm med en 25 % ændring fra baseline (henholdsvis takykardiske eller bradykardiske outliers). I CELEXA-gruppen havde 1,9 % af patienterne en ændring fra baseline i QTcF >60 msek sammenlignet med 1,2 % af patienterne i placebogruppen. Ingen af patienterne i placebogruppen havde en post-dosis QTcF >500 msek sammenlignet med 0,5 % af patienterne i CELEXA 10 mg-gruppen. Forekomsten af takykardiske outliers var 0,5 % i CELEXA-gruppen og 0,4 % i placebogruppen. Forekomsten af afvigende bradykardi var 0,9 % i CELEXA 10 mg-gruppen og 0,4 % i placebogruppen.
Andre bivirkninger observeret under premarketing-evalueringen af CELEXA
Følgende liste over bivirkninger omfatter ikke reaktioner, der er: 1) inkluderet i tabel 3 eller andre steder i mærkningen, 2) hvor en lægemiddelårsag var fjern, 3) som var så generelle, at de ikke er informative, og dem, der kun forekommer i én patient.
Bivirkninger er kategoriseret efter kropssystem og listet i rækkefølge efter faldende frekvens i henhold til følgende definitioner: hyppige bivirkninger er dem, der opstår ved en eller flere lejligheder hos mindst 1/100 patienter; sjældne bivirkninger er dem, der forekommer hos mindre end 1/100 patienter til 1/1000 patienter; sjældne bivirkninger er dem, der forekommer hos færre end 1/1000 patienter.
Kardiovaskulær - Hyppig: takykardi, postural hypotension, hypotension. Sjælden: hypertension, bradykardi, ødem (ekstremiteter), angina pectoris, ekstrasystoler, hjertesvigt, rødmen, myokardieinfarkt, cerebrovaskulær ulykke, myokardieiskæmi. Sjælden: forbigående iskæmisk anfald, flebitis, atrieflimren, hjertestop, grenblok.
Centrale og perifere nervesystem lidelser - Hyppig: paræstesi, migræne. Sjælden: hyperkinesi, vertigo, hypertoni, ekstrapyramidal lidelse, kramper i benene, ufrivillige muskelsammentrækninger, hypokinesi, neuralgi, dystoni, unormal gang, hypoæstesi, ataksi. Sjælden: unormal koordination, hyperæstesi, ptosis, stupor.
Endokrine lidelser - Sjælden: hypothyroidisme, struma, gynækomasti.
Gastrointestinale lidelser -Hyppig: øget spyt, flatulens. Sjælden: gastritis, gastroenteritis, stomatitis, udbrud, hæmorider, dysfagi, tænderskæren, tandkødsbetændelse, esophagitis. Sjælden: colitis, mavesår, cholecystitis, kolelithiasis, duodenalsår, gastroøsofageal refluks, glossitis, gulsot, diverticulitis, rektal blødning, hikke.
Generelt - Sjældent : hedeture, rigor, alkoholintolerance, synkope, influenzalignende symptomer. Sjælden: høfeber.
Hemiske og lymfatiske lidelser - Sjælden: purpura, anæmi, epistaxis, leukocytose, leukopeni, lymfadenopati. Sjælden: lungeemboli, granulocytopeni, lymfocytose, lymfopeni, hypokrom anæmi, koagulationsforstyrrelser, tandkødsblødninger.
Metaboliske og ernæringsforstyrrelser -Hyppig: nedsat vægt, øget vægt. Sjældent: øgede leverenzymer, tørst, tørre øjne, øget alkalisk fosfatase, unormal glucosetolerance. Sjælden: bilirubinæmi, hypokaliæmi, fedme, hypoglykæmi, hepatitis, dehydrering.
Sygdomme i bevægeapparatet - Sjælden: gigt, muskelsvaghed, skeletsmerter. Sjælden: bursitis, osteoporose.
Psykiatriske lidelser -Hyppig: nedsat koncentrationsevne, hukommelsestab, apati, depression, øget appetit, forværret depression, selvmordsforsøg, forvirring. Sjælden: øget libido, aggressiv reaktion, paroniria, stofafhængighed, depersonalisering, hallucinationer, eufori, psykotisk depression, vrangforestillinger, paranoid reaktion, følelsesmæssig labilitet, panikreaktion, psykose. Sjælden: Katatonisk reaktion, melankoli.
Reproduktionsforstyrrelser/Kvinde* -Hyppig: amenoré. Sjælden: galaktoré, brystsmerter, brystforstørrelse, vaginal blødning. (* % kun baseret på kvindelige forsøgspersoner: 2955)
Forstyrrelser i åndedrætssystemet -Hyppig: hoste. Sjælden: bronkitis, dyspnø, lungebetændelse. Sjælden: astma, laryngitis, bronkospasme, pneumonitis, øget sputum.
Hud- og vedhængsforstyrrelser - Hyppig: udslæt, kløe. Sjælden: lysfølsomhedsreaktion, nældefeber, akne, misfarvning af huden, eksem, alopeci, dermatitis, tør hud, psoriasis. Sjælden: hypertrichosis, nedsat svedtendens, melanose, keratitis, cellulitis, pruritus ani.
Særlige sanser - Hyppig: unormal indkvartering, smagsforstyrrelser. Sjælden: tinnitus, conjunctivitis, øjensmerter. Sjælden: mydriasis, fotofobi, diplopi, unormal tåredannelse, grå stær, smagstab.
Urinvejslidelser - Hyppig: polyuri. Sjælden: vandladningsfrekvens, urininkontinens, urinretention, dysuri. Sjælden: ansigtsødem, hæmaturi, oliguri, pyelonefritis, nyresten, nyresmerter.
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af citalopram, racematet eller escitalopram, S-enantiomeren af citalopram efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Blod og lymfesystem lidelser: hæmolytisk anæmi, trombocytopeni, nedsat protrombin
Hjertelidelser: torsade de pointes, ventrikulær arytmi, QT forlænget
Endokrine lidelser: hyperprolaktinæmi
Øjenlidelser: vinkel-lukkende glaukom
Gastrointestinale lidelser: gastrointestinal blødning, pancreatitis
Generelle lidelser og administrative webstedsbetingelser: abstinenssyndrom
Lever og galdeveje: hepatisk nekrose
Forstyrrelser i immunsystemet: anafylaksi, allergisk reaktion
Muskuloskeletale og bindevævslidelser: rhabdomyolyse
Forstyrrelser i nervesystemet: grand mal-kramper, myoklonus, choreoathetosis, dyskinesi, akatisi, nystagmus
Graviditet, puerperium og perinatale tilstande: spontan abort
Psykiatriske lidelser: delirium
Nyre- og urinvejslidelser: akut nyresvigt
Reproduktionssystem og brystsygdomme: priapisme
Hud- og subkutane vævsforstyrrelser: Stevens Johnson Syndrom, epidermal nekrolyse, angioødem, erythema multiforme, ekkymose
Vaskulære lidelser: trombose
DRUGSINTERAKTIONER
Tabel 5 viser klinisk vigtige lægemiddelinteraktioner med CELEXA.
Stofmisbrug og afhængighed
kontrolleret stof
CELEXA (citalopram HBr) er ikke et kontrolleret stof.
Misbrug
Dyreforsøg tyder på, at risikoen for misbrug af CELEXA 20mg er lav. CELEXA er ikke blevet systematisk undersøgt hos mennesker for dets potentiale for misbrug, tolerance eller fysisk afhængighed. Den kliniske erfaring med CELEXA før markedsføring afslørede ikke nogen lægemiddelsøgende adfærd. Disse observationer var imidlertid ikke systematiske, og det er ikke muligt på baggrund af denne begrænsede erfaring at forudsige, i hvilket omfang et CNS-aktivt lægemiddel vil blive misbrugt, omdirigeret og/eller misbrugt, når det først er markedsført. Derfor bør sundhedspersonale omhyggeligt vurdere CELEXA 20 mg-patienter for historie med stofmisbrug og følge sådanne patienter nøje, observere dem for tegn på misbrug eller misbrug (f.eks. udvikling af tolerance, stigninger i dosis, stof-søgende adfærd).
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Selvmordstanker og -adfærd hos unge og unge voksne
poolede analyser af placebo-kontrollerede forsøg med antidepressiva (SSRI'er og andre antidepressiva klasser), der omfattede ca. 77.000 voksne patienter og 4.500 pædiatriske patienter, var forekomsten af selvmordstanker og -adfærd hos antidepressiva-behandlede patienter i alderen 24 år og yngre større end hos placebobehandlede patienter. Der var betydelig variation i risikoen for selvmordstanker og -adfærd blandt stoffer, men der var en øget risiko identificeret hos unge patienter for de fleste undersøgte stoffer. Der var forskelle i den absolutte risiko for selvmordstanker og -adfærd på tværs af de forskellige indikationer, med den højeste forekomst hos patienter med MDD. Lægemiddel-placebo-forskellene i antallet af tilfælde af selvmordstanker og -adfærd pr. 1000 behandlede patienter er angivet i tabel 1.
Det er ukendt, om risikoen for selvmordstanker og -adfærd hos børn, unge og unge voksne strækker sig til længerevarende brug, dvs. ud over fire måneder. Der er dog væsentlige beviser fra placebokontrollerede vedligeholdelsesforsøg hos voksne med MDD, at antidepressiva forsinker tilbagefald af depression, og at depression i sig selv er en risikofaktor for selvmordstanker og -adfærd.
Overvåg alle antidepressiva-behandlede patienter for klinisk forværring og fremkomst af selvmordstanker og -adfærd, især i løbet af de første par måneder med lægemiddelbehandling og ved dosisændringer. Rådgive familiemedlemmer eller pårørende til patienter til at overvåge for ændringer i adfærd og advare sundhedsplejersken. Overvej at ændre det terapeutiske regime, herunder eventuelt seponering af CELEXA, hos patienter, hvis depression er vedvarende værre, eller som oplever nye selvmordstanker eller -adfærd.
QT-forlængelse og Torsade De Pointes
CELEXA forårsager dosisafhængig QTc-forlængelse, en EKG-abnormitet, der har været forbundet med Torsade de Pointes (TdP), ventrikulær takykardi og pludselig død, som alle er blevet observeret i postmarketingrapporter for citalopram [se BIVIRKNINGER ].
På grund af risikoen for QTc-forlængelse ved højere CELEXA 20 mg doser, anbefales det, at CELEXA ikke gives i doser over 40 mg én gang dagligt [se DOSERING OG ADMINISTRATION , KLINISK FARMAKOLOGI ].
CELEXA bør undgås hos patienter med medfødt langt QT-syndrom, bradykardi, hypokaliæmi eller hypomagnesæmi, nyligt akut myokardieinfarkt eller ukompenseret hjertesvigt, medmindre fordelene opvejer risiciene for en bestemt patient. CELEXA bør også undgås hos patienter, der tager andre lægemidler, der forlænger QTc-intervallet [se DRUGSINTERAKTIONER ]. Sådanne lægemidler omfatter klasse 1A (f.eks. quinidin, procainamid) eller klasse III (f.eks. amiodaron, sotalol) antiarytmiske lægemidler, antipsykotiske lægemidler (f.eks. chlorpromazin, thioridazin), antibiotika (f.eks. gatifloxacin, moxifloxacin) eller enhver anden klasse af lægemidler kendt for at forlænge QTc-intervallet (f.eks. pentamidin, levomethadylacetat, metadon).
Citalopram-dosis bør begrænses i visse populationer. Den maksimale dosis bør begrænses til 20 mg én gang dagligt hos patienter, som er CYP2C19-fattige metabolisatorer, eller de patienter, der samtidig får cimetidin eller en anden CYP2C19-hæmmer, da højere citalopram-eksponeringer kan forventes. Den maksimale dosis bør også begrænses til 20 mg én gang dagligt hos patienter med nedsat leverfunktion og hos patienter, der er over 60 år på grund af forventet højere eksponering [se DOSERING OG ADMINISTRATION , DRUGSINTERAKTIONER , Brug i specifikke populationer , KLINISK FARMAKOLOGI ].
Elektrolyt- og/eller EKG-monitorering anbefales under visse omstændigheder. Patienter, der overvejes til behandling med CELEXA 20 mg, og som er i risiko for betydelige elektrolytforstyrrelser, skal have baseline-målinger af serumkalium og magnesium med periodisk overvågning. Hypokalæmi (og/eller hypomagnesiæmi) kan øge risikoen for QTc-forlængelse og arytmi, og bør korrigeres før påbegyndelse af behandling og overvåges periodisk. EKG-monitorering anbefales til patienter, hvor CELEXA 10 mg ikke anbefales, medmindre fordelene klart opvejer risiciene for en bestemt patient (se over ). Disse omfatter de patienter med de hjertesygdomme, der er nævnt ovenfor, og dem, der tager andre lægemidler, der kan forlænge QTc-intervallet.
Afbryd CELEXA 10 mg hos patienter, der viser sig at have vedvarende QTc-målinger >500 ms. Hvis patienter, der tager CELEXA, oplever symptomer, der kan indikere forekomsten af hjertearytmier, f.eks. svimmelhed, hjertebanken eller synkope, bør den ordinerende læge påbegynde yderligere evaluering, herunder hjerteovervågning.
Serotonin syndrom
SSRI'er, inklusive CELEXA 20 mg, kan fremkalde serotonergt syndrom, en potentielt livstruende tilstand. Risikoen øges ved samtidig brug af andre serotonerge lægemidler (herunder triptaner, tricykliske antidepressiva, fentanyl, lithium, tramadol, tryptofan, buspiron, amfetamin og perikon) og med lægemidler, der hæmmer metabolismen af serotonin, dvs. MAO-hæmmere [se KONTRAINDIKATIONER , DRUGSINTERAKTIONER ]. Serotonergt syndrom kan også forekomme, når disse lægemidler bruges alene. Symptomer på serotonergt syndrom blev observeret hos 0,1 % af MDD-patienter behandlet med CELEXA 20 mg i præmarketing kliniske forsøg.
Tegn og symptomer på serotoninsyndrom kan omfatte mentale statusændringer (f.eks. agitation, hallucinationer, delirium og koma), autonom ustabilitet (f.eks. takykardi, labilt blodtryk, svimmelhed, diaforese, rødmen, hypertermi), neuromuskulære symptomer (f.eks. tremor, stivhed, myoklonus, hyperrefleksi, inkoordination), kramper og gastrointestinale symptomer (f.eks. kvalme, opkastning, diarré).
Samtidig brug af CELEXA og MAO-hæmmere er kontraindiceret. Derudover må CELEXA 20 mg ikke påbegyndes hos en patient, der behandles med MAO-hæmmere såsom linezolid eller intravenøs methylenblåt. Ingen rapporter involverede administration af methylenblåt ad andre veje (såsom orale tabletter eller lokal vævsinjektion). Hvis det er nødvendigt at påbegynde behandling med en MAO-hæmmer såsom linezolid eller intravenøs methylenblåt hos en patient, der tager CELEXA 10mg, skal CELEXA 20mg afbrydes, før behandling med MAO-hæmmeren påbegyndes [se KONTRAINDIKATIONER , DRUGSINTERAKTIONER ].
Overvåg alle patienter, der tager CELEXA 20 mg, for forekomsten af serotonergt syndrom. Afbryd behandlingen med CELEXA og eventuelle samtidige serotonerge midler omgående, hvis ovenstående symptomer opstår, og påbegynd understøttende symptomatisk behandling. Hvis samtidig brug af CELEXA med andre serotonerge lægemidler er klinisk berettiget, skal du informere patienterne om den øgede risiko for serotonergt syndrom og overvåge for symptomer.
Øget risiko for blødning
Lægemidler, der interfererer med hæmning af serotoningenoptagelse, inklusive CELEXA 20mg, øger risikoen for blødningshændelser. Samtidig brug af aspirin, ikke-steroide antiinflammatoriske lægemidler (NSAIDS), andre trombocythæmmende lægemidler, warfarin og andre antikoagulantia kan øge denne risiko. Caserapporter og epidemiologiske undersøgelser (case-kontrol og kohortedesign) har vist en sammenhæng mellem brug af lægemidler, der interfererer med serotonin-genoptagelse og forekomsten af gastrointestinal blødning. Blødningshændelser relateret til lægemidler, der interfererer med serotonin-genoptagelsen, har varieret fra ekkymose, hæmatom, epistaxis og petekkier til livstruende blødninger.
Informer patienterne om den øgede risiko for blødning forbundet med samtidig brug af CELEXA 20 mg og blodpladehæmmende midler eller antikoagulantia. For patienter, der tager warfarin, skal du nøje overvåge det internationale normaliserede forhold [se DRUGSINTERAKTIONER ].
Aktivering af mani eller hypomani
Hos patienter med bipolar lidelse kan behandling af en depressiv episode med CELEXA eller et andet antidepressivum udløse en blandet/manisk episode. I kontrollerede kliniske forsøg blev patienter med bipolar lidelse udelukket; der blev dog rapporteret symptomer på mani eller hypomani hos 0,1 % af udiagnosticerede patienter behandlet med CELEXA. Inden påbegyndelse af behandling med CELEXA 10mg, screenes patienter for enhver personlig eller familiehistorie med bipolar lidelse, mani eller hypomani [se DOSERING OG ADMINISTRATION ].
Afbrydelsessyndrom
Bivirkninger efter seponering af serotonerge antidepressiva, især efter brat seponering, omfatter: kvalme, svedtendens, dysforisk stemning, irritabilitet, agitation, svimmelhed, føleforstyrrelser (f.eks. paræstesi, såsom elektrisk stød), tremor, angst, forvirring, hovedpine, sløvhed, følelsesmæssig labilitet, søvnløshed, hypomani, tinnitus og anfald. En gradvis reduktion af dosis i stedet for pludseligt ophør anbefales, når det er muligt [se DOSERING OG ADMINISTRATION ].
Anfald
CELEXA 20mg er ikke blevet systematisk evalueret hos patienter med krampeanfald. Patienter med anfald i anamnesen blev udelukket fra kliniske undersøgelser. I kliniske forsøg med CELEXA 20 mg forekom anfald hos 0,3 % af patienterne behandlet med CELEXA (en frekvens på én patient pr. 98 års eksponering) og 0,5 % af patienterne behandlet med placebo (en hyppighed på én patient pr. 50 års eksponering). CELEXA 10 mg bør ordineres med forsigtighed til patienter med krampeanfald.
Vinkellukkende glaukom
Pupiludvidelsen, der opstår efter brug af mange antidepressive lægemidler, inklusive CELEXA, kan udløse et vinkellukkeangreb hos en patient med anatomisk snævre vinkler, som ikke har en patenteret iridektomi. Undgå brug af antidepressiva, inklusive CELEXA, hos patienter med ubehandlede anatomisk snævre vinkler.
Hyponatriæmi
Hyponatriæmi kan forekomme som følge af behandling med SSRI'er, herunder CELEXA. Tilfælde af serumnatrium lavere end 110 mmol/L er blevet rapporteret. Tegn og symptomer på hyponatriæmi omfatter hovedpine, koncentrationsbesvær, hukommelsessvækkelse, forvirring, svaghed og ustabilitet, som kan føre til fald. Tegn og symptomer forbundet med mere alvorlige og/eller akutte tilfælde har inkluderet hallucinationer, synkope, krampeanfald, koma, åndedrætsstop og død. I mange tilfælde ser denne hyponatriæmi ud til at være resultatet af syndromet med uhensigtsmæssig antidiuretisk hormonsekretion (SIADH).
Hos patienter med symptomatisk hyponatriæmi skal CELEXA afbrydes og passende medicinsk indgreb igangsættes. Ældre patienter, patienter, der tager diuretika, og dem, der er volumenfattige, kan have større risiko for at udvikle hyponatriæmi med SSRI'er [se Brug i specifikke populationer ].
Seksuel dysfunktion
Brug af SSRI'er, inklusive CELEXA, kan forårsage symptomer på seksuel dysfunktion [se BIVIRKNINGER ]. Hos mandlige patienter kan brug af SSRI resultere i ejakulatorisk forsinkelse eller svigt, nedsat libido og erektil dysfunktion. Hos kvindelige patienter kan brug af SSRI resultere i nedsat libido og forsinket eller manglende orgasme.
Det er vigtigt for ordinerende læger at forespørge om seksuel funktion inden påbegyndelse af CELEXA og at spørge specifikt om ændringer i seksuel funktion under behandlingen, fordi seksuel funktion muligvis ikke spontant rapporteres. Ved evaluering af ændringer i seksuel funktion er det vigtigt at få en detaljeret anamnese (inklusive tidspunktet for symptomdebut), fordi seksuelle symptomer kan have andre årsager, herunder den underliggende psykiatriske lidelse. Diskuter potentielle ledelsesstrategier til at støtte patienter i at træffe informerede beslutninger om behandling.
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( Medicinvejledning ).
Selvmordstanker og -adfærd
Rådgiv patienter og pårørende om at se efter fremkomsten af suicidalitet, især tidligt under behandlingen, og når dosis justeres op eller ned, og instruer dem om at rapportere sådanne symptomer til sundhedspersonalet [se KASSET ADVARSEL , ADVARSLER OG FORHOLDSREGLER ].
QT-forlængelse og Torsade De Pointes
Råd patienter om at konsultere deres læge med det samme, hvis de føler sig besvimet, mister bevidstheden eller har hjertebanken. Instruer patienterne i at informere deres læge om, at de tager CELEXA, før de tager nogen ny medicin [se ADVARSLER OG FORHOLDSREGLER , DRUGSINTERAKTIONER ].
Serotonin syndrom
Pas på patienter med risikoen for serotonergt syndrom, især ved samtidig brug af CELEXA 20mg med andre serotonerge lægemidler, herunder triptaner, tricykliske antidepressiva, fentanyl, lithium, tramadol, tryptofan, buspiron, amfetamin, perikon og med lægemidler, der hæmmer metabolismen af serotonin (især MAO-hæmmere, både dem, der er beregnet til at behandle psykiatriske lidelser og også andre, såsom linezolid). Instruer patienterne i at kontakte deres læge eller rapportere til skadestuen, hvis de oplever tegn eller symptomer på serotonergt syndrom [se ADVARSLER OG FORHOLDSREGLER , DRUGSINTERAKTIONER ].
Øget risiko for blødning
Informer patienterne om samtidig brug af CELEXA 10 mg og aspirin, NSAID'er, andre trombocythæmmende lægemidler, warfarin eller andre antikoagulantia, fordi den kombinerede brug har været forbundet med en øget risiko for blødning. Råd patienter til at informere deres sundhedspersonale, hvis de tager eller planlægger at tage receptpligtig eller håndkøbsmedicin, der øger risikoen for blødning [se ADVARSLER OG FORHOLDSREGLER ].
Aktivering af mani eller hypomani
Råd til patienter og deres pårørende om at observere for tegn på aktivering af mani/hypomani og instruer dem i at rapportere sådanne symptomer til sundhedspersonalet [se ADVARSLER OG FORHOLDSREGLER ].
Afbrydelsessyndrom
Rådgiv patienterne om ikke at stoppe med CELEXA brat og at diskutere eventuelle nedtrapningsregimer med deres læge. Informer patienterne om, at der kan opstå bivirkninger, når CELEXA 20 mg seponeres [Se ADVARSLER OG FORHOLDSREGLER ].
Seksuel dysfunktion
Informer patienter om, at brug af CELEXA kan forårsage symptomer på seksuel dysfunktion hos både mandlige og kvindelige patienter. Informer patienterne om, at de bør diskutere eventuelle ændringer i seksuel funktion og potentielle håndteringsstrategier med deres sundhedsplejerske [se ADVARSLER OG FORHOLDSREGLER ].
Graviditet
- Rådgive patienter om at underrette deres læge, hvis de bliver gravide eller har til hensigt at blive gravide under behandling med CELEXA [se Brug i specifikke populationer ].
- Rådgiv patienterne om, at brug af CELEXA sent i graviditeten kan føre til en øget risiko for neonatale komplikationer, der kræver langvarig hospitalsindlæggelse, respiratorisk støtte, sondeernæring og/eller vedvarende pulmonal hypertension hos den nyfødte (PPHN) [se Brug i specifikke populationer ].
- Rådgiv kvinder om, at der er et graviditetseksponeringsregister, der overvåger graviditetsresultater hos kvinder, der er udsat for citalopram under graviditeten [se Brug i specifikke populationer ].
Amning
Råd ammende kvinder til at overvåge spædbørn for overdreven sedation, rastløshed, agitation, dårlig fodring og dårlig vægtøgning og til at søge lægehjælp, hvis de bemærker disse tegn [se Brug i specifikke populationer ].
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
Citalopram øgede forekomsten af tyndtarmcarcinom hos rotter behandlet i 24 måneder med doser på 8 og 24 mg/kg/dag i kosten, hvilket er cirka 2 og 6 gange den maksimale anbefalede humane dosis (MRHD) på henholdsvis 40 mg, baseret på mg/m² kropsoverfladeareal. Et no-effect level (NOEL) for dette fund blev ikke etableret.
Citalopram øgede ikke forekomsten af tumorer hos mus behandlet i 18 måneder ved doser op til 240 mg/kg/dag i kosten, hvilket er ca. 30 gange MRDH på 40 mg baseret på mg/m² kropsoverfladeareal.
Mutagenese
Citalopram var mutagent i in vitro bakteriel revers mutationsanalyse (Ames test) i 2 af 5 bakteriestammer (Salmonella TA98 og TA1537) i fravær af metabolisk aktivering. Det var klastogent i in vitro kinesisk hamster-lungecelleassay for kromosomafvigelser i nærvær og fravær af metabolisk aktivering. Citalopram var ikke mutagent i in vitro mammalian forward gene mutation assay (HPRT) i muse lymfomceller eller i in vitro/in vivo unscheduled DNA-syntese (UDS) assay i rottelever. Det var ikke klastogent i in vitro kromosomafvigelsesassay i humane lymfocytter eller i to in vivo muse mikronucleus assays.
Forringelse af fertilitet
Citalopram blev administreret oralt til hun- og hanrotter i doser på 32, 48 og 72 mg/kg/dag før og under hele parringen og fortsat til drægtighed. Disse doser er ca. 8, 12 og 17 gange MRHD på 40 mg baseret på mg/m² kropsoverfladeareal. Parring og fertilitet blev nedsat ved doser ≥ 32 mg/kg/dag, hvilket er ca. 8 gange MRHD.
Drægtighedsvarigheden blev øget med 48 mg/kg/dag, hvilket er cirka 12 gange MRHD.
Brug i specifikke populationer
Graviditet
Graviditetseksponeringsregister
Der er et graviditetseksponeringsregister, der overvåger graviditetsresultater hos kvinder, der udsættes for antidepressiva under graviditeten. Sundhedsudbydere opfordres til at registrere patienter ved at ringe til National Pregnancy Registry for Antidepressants på 1-844-405-6185 eller besøge online på https://womensmentalhealth.org/research/pregnancyregistry/antidepressants.
Risikooversigt
Tilgængelige data fra offentliggjorte epidemiologiske undersøgelser og postmarketingrapporter med brug af citalopram under graviditet har ikke påvist en øget risiko for alvorlige fødselsdefekter eller abort. Publicerede undersøgelser viste, at citalopram-niveauer i både navlestrengsblod og fostervand svarer til dem, der observeres i moderens serum. Der er risiko for vedvarende pulmonal hypertension hos den nyfødte (PPHN) (se Data ) og/eller dårlig neonatal tilpasning med eksponering for selektive serotoningenoptagelseshæmmere (SSRI'er), inklusive CELEXA, under graviditet. Der er også risici forbundet med ubehandlet depression under graviditet (se Kliniske overvejelser ).
I reproduktionsstudier på dyr forårsagede citalopram uønskede embryo/føtale virkninger ved doser, der forårsagede maternel toksicitet (se Data ).
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort for den angivne population er ukendt. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre ugunstige udfald. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i de klinisk anerkendte graviditeter henholdsvis 2 % til 4 % og 15 % til 20 %.
Kliniske overvejelser
Sygdomsassocieret moder- og/eller embryo-/fosterrisiko
Kvinder, der stopper med antidepressiva under graviditeten, er mere tilbøjelige til at opleve et tilbagefald af svær depression end kvinder, der fortsætter med antidepressiva. Dette fund er fra en prospektiv longitudinel undersøgelse af 201 gravide kvinder med en historie med svær depressiv lidelse, som var euthymic og tog antidepressiva i begyndelsen af graviditeten. Overvej risikoen for ubehandlet depression ved seponering eller ændring af behandling med antidepressiv medicin under graviditet og efter fødslen.
Fetale/neonatale bivirkninger
Nyfødte, der er udsat for CELEXA og andre SSRI-præparater sent i tredje trimester, har udviklet komplikationer, der kræver længere tids indlæggelse, respiratorisk støtte og sondeernæring. Sådanne komplikationer kan opstå umiddelbart efter levering. Rapporterede kliniske fund har inkluderet åndedrætsbesvær, cyanose, apnø, kramper, temperaturustabilitet, ernæringsbesvær, opkastning, hypoglykæmi, hypotoni, hypertoni, hyperrefleksi, tremor, nervøsitet, irritabilitet og konstant gråd. Disse fund er i overensstemmelse med enten en direkte toksisk virkning af SSRI'er eller muligvis et lægemiddelafbrydelsessyndrom. Det skal bemærkes, at det kliniske billede i nogle tilfælde stemmer overens med serotonergt syndrom [se ADVARSLER OG FORHOLDSREGLER ].
Data
Menneskelige data
Eksponering for SSRI'er under sen graviditet kan have en øget risiko for vedvarende pulmonal hypertension hos den nyfødte (PPHN). PPHN forekommer hos 1-2 ud af 1.000 levendefødte i den generelle befolkning og er forbundet med betydelig neonatal morbiditet og dødelighed.
Dyredata
Citalopram blev administreret oralt til gravide rotter i løbet af organogeneseperioden i doser på 32, 56 og 112 mg/kg/dag, hvilket er ca. 8, 14 og 27 gange den maksimale anbefalede humane dosis (MRHD) på 40 mg, baseret på på mg/m² kropsoverflade. Citalopram forårsagede maternel toksicitet af CNS kliniske tegn og nedsat vægtøgning ved 112 mg/kg/dag, hvilket er 27 gange MRHD. Ved denne modertoksiske dosis nedsatte citalopram embryo/føtal vækst og overlevelse og øgede føtale abnormiteter (inklusive kardiovaskulære og skeletdefekter). Niveauet for ingen observeret bivirkninger (NOAEL) for maternel og embryoføtal toksicitet er 56 mg/kg/dag, hvilket er cirka 14 gange MRHD.
Citalopram blev administreret oralt til drægtige kaniner i løbet af organogeneseperioden i doser på op til 16 mg/kg/dag, hvilket er ca. 8 gange MRHD på 40 mg, baseret på mg/m² kropsoverfladeareal. Ingen maternel eller embryoføtal toksicitet blev observeret. NOAEL for maternel og embryoføtal toksicitet er 16 mg/kg/dag, hvilket er ca. 8 gange MRHD.
Citalopram blev administreret oralt til gravide rotter under sen drægtighed og diegivningsperioder i doser på 4,8, 12,8 og 32 mg/kg/dag, hvilket er ca. 1, 3 og 8 gange MRHD på 40 mg, baseret på mg/m² krop overfladeareal. Citalopram øgede afkomsdødeligheden i løbet af de første 4 dage af fødslen og nedsatte afkomsvæksten ved 32 mg/kg/dag, hvilket er ca. 8 gange MRHD. NOAEL for udviklingstoksicitet er 12,8 mg/kg/dag, hvilket er ca. 3 gange MRHD. I en separat undersøgelse blev der set lignende effekter på afkomsdødelighed og vækst, når moderdyr blev behandlet gennem hele drægtighedsperioden og tidlig diegivning med doser ≥ 24 mg/kg/dag, hvilket er ca. 6 gange MRHD. En NOAEL blev ikke bestemt i denne undersøgelse.
Amning
Risikooversigt
Data fra den publicerede litteratur rapporterer tilstedeværelsen af citalopram i modermælk ved relative spædbørnsdoser på mellem 0,7 til 9,4 % af den modervægtjusterede dosis og et mælk/plasma-forhold på mellem 0,78 og 4,3. Der er rapporter om ammede spædbørn udsat for citalopram, der har oplevet irritabilitet, rastløshed, overdreven døsighed, nedsat fødeindtagelse og vægttab (se Kliniske overvejelser ). Der er ingen information om virkningerne af citalopram på mælkeproduktionen.
De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for CELEXA 20mg og eventuelle negative virkninger på det ammede barn fra CELEXA 20mg eller fra den underliggende moderens tilstand.
Kliniske overvejelser
Overvåg ammende spædbørn for bivirkninger, såsom irritabilitet, rastløshed, overdreven somnolens, nedsat fødeindtagelse og vægttab.
Pædiatrisk brug
Sikkerheden og effektiviteten af CELEXA er ikke blevet fastslået hos pædiatriske patienter. To placebokontrollerede forsøg med 407 pædiatriske patienter med MDD er blevet udført med CELEXA 20 mg, og dataene var ikke tilstrækkelige til at understøtte brugen til pædiatriske patienter.
Antidepressiva øger risikoen for selvmordstanker og -adfærd hos pædiatriske patienter [se KASSET ADVARSEL , ADVARSLER OG FORHOLDSREGLER ]. Nedsat appetit og vægttab er blevet observeret i forbindelse med brugen af SSRI hos pædiatriske patienter.
Geriatrisk brug
Ud af 4422 patienter i kliniske studier med CELEXA 20 mg var 1357 60 og derover, 1034 var 65 og derover, og 457 var 75 og derover. I to farmakokinetiske undersøgelser blev citalopram AUC øget med henholdsvis 23 % og 30 % hos forsøgspersoner ≥ 60 år sammenlignet med yngre forsøgspersoner, og dets halveringstid blev øget med henholdsvis 30 % og 50 % [se KLINISK FARMAKOLOGI ]. Derfor er den maksimalt anbefalede dosis til patienter 60 år og ældre lavere end yngre patienter [se DOSERING OG ADMINISTRATION , ADVARSLER OG FORHOLDSREGLER ].
SSRI'er, inklusive CELEXA, er blevet forbundet med tilfælde af klinisk signifikant hyponatriæmi hos ældre patienter, som kan have større risiko for denne bivirkning [se ADVARSLER OG FORHOLDSREGLER ].
Nedsat leverfunktion
Øget eksponering for citalopram forekommer hos patienter med nedsat leverfunktion. Den maksimalt anbefalede dosis af CELEXA 10 mg er lavere hos patienter med nedsat leverfunktion [se DOSERING OG ADMINISTRATION , KLINISK FARMAKOLOGI ].
OVERDOSIS
Følgende er blevet rapporteret ved overdosering af Celexa tabletter:
- Anfald, som kan være forsinkede, og ændret mental status inklusive koma.
- Kardiovaskulær toksicitet, som kan være forsinket, herunder QRS- og QTc-intervalforlængelse, brede komplekse takyarytmier og torsade de pointes. Hypertension ses oftest, men kan sjældent se hypotension alene eller med samtidig indtagelse af alkohol.
- Serotonergt syndrom (patienter med en overdosering af flere lægemidler med andre proserotonerge lægemidler kan have en højere risiko).
Længerevarende hjerteovervågning anbefales ved indtagelse af Celexa-overdosering på grund af risikoen for arytmi. Gastrointestinal dekontaminering med aktivt kul bør overvejes hos patienter, der melder sig tidligt efter en Celexa 10 mg overdosis. Overvej at kontakte et giftcenter (1-800-221-2222) eller en medicinsk toksikolog for yderligere anbefalinger til håndtering af overdosering.
KONTRAINDIKATIONER
CELEXA er kontraindiceret til patienter:
- tager eller inden for 14 dage efter ophør med MAO-hæmmere (inklusive MAO-hæmmere såsom linezolid eller intravenøs methylenblåt) på grund af en øget risiko for serotonergt syndrom [se ADVARSLER OG FORHOLDSREGLER , DRUGSINTERAKTIONER ].
- tager pimozid på grund af risiko for QT-forlængelse [se DRUGSINTERAKTIONER ].
- med kendt overfølsomhed over for citalopram eller nogen af de inaktive ingredienser i CELEXA. Reaktioner har inkluderet angioødem og anafylaksi [se BIVIRKNINGER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Virkningsmekanismen af citalopram er uklar, men formodes at være relateret til forstærkning af serotonerg aktivitet i centralnervesystemet (CNS) som følge af dets hæmning af CNS neuronal genoptagelse af serotonin (5-HT).
Farmakodynamik
In vitro og in vivo undersøgelser på dyr tyder på, at citalopram er en selektiv serotoningenoptagelseshæmmer (SSRI) med minimal effekt på noradrenalin (NE) og dopamin (DA) neuronal genoptagelse.
Citalopram har ingen eller meget lav affinitet for 5-HT1A, 5-HT2A, dopamin D1 og D2, α1-, α2- og β-adrenerge, histamin H1, gamma-aminosmørsyre (GABA), muskarine cholinerge og benzodiazepinreceptorer.
Hjerteelektrofysiologi
Individuelt korrigeret QTc (QTcNi) interval blev evalueret i et randomiseret, placebo og aktivt (moxifloxacin 400 mg) kontrolleret cross-over, eskalerende multiple-dosis studie med 119 raske forsøgspersoner. Den maksimale middelværdi (øvre grænse af 95 % ensidigt konfidensinterval) forskel fra placebo var 8,5 (10,8) og 18,5 (21,0) msek for henholdsvis 20 mg og 60 mg (1,5 gange den maksimalt anbefalede dosis) citalopram. Baseret på det etablerede eksponering-respons-forhold er den forudsagte QTcNi-ændring fra placebo (øvre grænse af 95 % ensidigt konfidensinterval) under Cmax for dosis på 40 mg 12,6 (14,3) msek [se ADVARSLER OG FORHOLDSREGLER ].
Farmakokinetik
Enkelt- og flerdosisfarmakokinetikken for citalopram er lineær og dosisproportional i et dosisområde på 10 til 40 mg/dag. Biotransformation af citalopram er hovedsageligt hepatisk med en gennemsnitlig terminal halveringstid på ca. 35 timer. Ved dosering én gang dagligt opnås steady state plasmakoncentrationer inden for ca. en uge. Ved steady state forventes omfanget af akkumulering af citalopram i plasma, baseret på halveringstiden, at være 2,5 gange plasmakoncentrationerne observeret efter en enkelt dosis.
Absorption
Efter en enkelt oral dosis (40 mg tablet) af citalopram forekommer maksimale blodniveauer efter ca. 4 timer. Den absolutte biotilgængelighed af citalopram var omkring 80 % i forhold til en intravenøs dosis, og absorptionen påvirkes ikke af mad.
Fordeling
Fordelingsvolumenet af citalopram er ca. 12 l/kg, og bindingen af citalopram (CT), demethylcitalopram (DCT) og didemethylcitalopram (DDCT) til humane plasmaproteiner er ca. 80 %.
Elimination
Metabolisme
Citalopram metaboliseres til demethylcitalopram (DCT), didemethylcitalopram (DDCT), citalopram-N-oxid og et deamineret propionsyrederivat. Hos mennesker er uændret citalopram den dominerende forbindelse i plasma. Ved steady state er koncentrationerne af citaloprams metabolitter, DCT og DDCT, i plasma henholdsvis ca. halvdelen og en tiendedel af moderlægemidlet. In vitro undersøgelser viser, at citalopram er mindst 8 gange mere potent end dets metabolitter i hæmningen af serotonin-genoptagelse, hvilket tyder på, at de evaluerede metabolitter sandsynligvis ikke bidrager signifikant til citaloprams antidepressive virkning.
In vitro undersøgelser med humane levermikrosomer indikerede, at CYP3A4 og CYP2C19 er de primære isozymer involveret i N-demethyleringen af citalopram.
Udskillelse
Efter intravenøs administration af citalopram var andelen af lægemidlet, der blev genfundet i urinen som citalopram og DCT, henholdsvis ca. 10 % og 5 %. Den systemiske clearance af citalopram var 330 ml/min, hvor ca. 20 % af clearance skyldtes renal clearance.
Specifikke populationer
Geriatriske patienter
Citaloprams farmakokinetik hos forsøgspersoner ≥ 60 år blev sammenlignet med yngre forsøgspersoner i to normale forsøg med frivillige. I et enkeltdosisstudie blev citaloprams AUC og halveringstid øget hos forsøgspersoner ≥ 60 år med henholdsvis 30 % og 50 %, mens de i et flerdosisstudie blev øget med henholdsvis 23 % og 30 %[ se DOSERING OG ADMINISTRATION , ADVARSLER OG FORHOLDSREGLER , Brug i specifikke populationer ].
Mandlige og kvindelige patienter
I tre farmakokinetiske undersøgelser (total N=32) var citalopram AUC hos kvinder halvanden til to gange højere end hos mænd. Denne forskel blev ikke observeret i fem andre farmakokinetiske undersøgelser (i alt N=114). I kliniske undersøgelser blev der ikke set forskelle i steady state serumcitalopram-niveauer mellem mænd (N=237) og kvinder (N=388). Der var ingen kønsforskelle i farmakokinetikken af DCT og DDCT.
Patienter med nedsat leverfunktion
Citalopram oral clearance blev reduceret med 37 %, og halveringstiden blev fordoblet hos patienter med nedsat leverfunktion sammenlignet med normale forsøgspersoner [se DOSERING OG ADMINISTRATION , ADVARSLER OG FORHOLDSREGLER , Brug i specifikke populationer ].
Patienter med nedsat nyrefunktion
Hos patienter med let til moderat nedsat nyrefunktion blev oral clearance af citalopram reduceret med 17 % sammenlignet med normale forsøgspersoner. Ingen justering af dosis til sådanne patienter anbefales. Der er ingen tilgængelig information om citaloprams farmakokinetik hos patienter med svært nedsat nyrefunktion (kreatininclearance
CYP2C19 Dårlige metabolisatorer
Hos CYP2C19-fattige metabolisatorer var citalopram steady state Cmax og AUC øget med henholdsvis 68 % og 107 % [se DOSERING OG ADMINISTRATION , ADVARSLER OG FORHOLDSREGLER ].
CYP2D6 Dårlige metabolisatorer
Citalopram-steady state-niveauer var ikke signifikant forskellige hos dårlige metabolisatorer og omfattende metabolisatorer af CYP2D6.
Lægemiddelinteraktionsstudier
In vitro-enzyminhiberingsdata afslørede ikke en hæmmende effekt af citalopram på CYP3A4, -2C9 eller -2E1, men antydede, at det er en svag hæmmer af CYP1A2, -2D6 og -2C19. Citalopram forventes at have ringe hæmmende virkning på in vivo metabolisme medieret af disse enzymer. Imidlertid er in vivo-data til at løse dette spørgsmål begrænsede.
CYP3A4- og CYP2C19-hæmmere
Da CYP3A4 og CYP2C19 er de primære enzymer, der er involveret i metabolismen af citalopram, forventes det, at potente CYP3A4-hæmmere (f.eks. ketoconazol, itraconazol og makrolidantibiotika) og CYP2C19-hæmmere (f.eks. omeprazol) kan nedsætte clearance af cimetidin. citalopram. Samtidig administration af citalopram og den potente CYP3A4-hæmmer ketoconazol påvirkede imidlertid ikke citaloprams farmakokinetik signifikant. 20 mg/dag er den maksimalt anbefalede citalopramdosis til patienter, der samtidig tager cimetidin eller en anden CYP2C19-hæmmer, på grund af risikoen for QT-forlængelse [se DOSERING OG ADMINISTRATION , ADVARSLER OG FORHOLDSREGLER ].
Cimetidin
Hos forsøgspersoner, der havde fået 21 dage på 40 mg/dag CELEXA 10 mg, resulterede kombineret administration af 400 mg cimetidin to gange dagligt i 8 dage i en stigning i citalopram AUC og Cmax på henholdsvis 43 % og 39 % [se DOSERING OG ADMINISTRATION , ADVARSLER OG FORHOLDSREGLER , DRUGSINTERAKTIONER ].
CYP2D6-hæmmere
Samtidig administration af et lægemiddel, der hæmmer CYP2D6, med citalopram vil næppe have klinisk signifikante virkninger på citaloprams metabolisme, baseret på undersøgelsesresultaterne hos CYP2D6-fattige metabolisatorer.
Digoxin
Hos forsøgspersoner, der havde fået 21 dage på 40 mg/dag CELEXA 20 mg, påvirkede kombineret administration af CELEXA og digoxin (enkeltdosis på 1 mg) ikke farmakokinetikken af hverken citalopram eller digoxin signifikant.
Lithium
Samtidig administration af CELEXA (40 mg/dag i 10 dage) og lithium (30 mmol/dag i 5 dage) havde ingen signifikant effekt på farmakokinetikken af citalopram eller lithium.
Pimozid
en kontrolleret undersøgelse var en enkelt dosis pimozid 2 mg administreret sammen med citalopram 40 mg givet én gang dagligt i 11 dage forbundet med en gennemsnitlig stigning i QTc-værdier på ca. 10 msek sammenlignet med pimozid givet alene. Citalopram ændrede ikke den gennemsnitlige AUC eller Cmax for pimozid. Mekanismen bag denne farmakodynamiske interaktion er ikke kendt [se KONTRAINDIKATIONER , ADVARSLER OG FORHOLDSREGLER ].
Theophyllin
Kombineret administration af CELEXA (40 mg/dag i 21 dage) og CYP1A2-substratet theophyllin (enkeltdosis på 300 mg) påvirkede ikke theophyllins farmakokinetik. Effekten af theophyllin på farmakokinetikken af citalopram blev ikke evalueret.
Warfarin
Administration af 40 mg/dag CELEXA i 21 dage påvirkede ikke farmakokinetikken af warfarin, et CYP3A4-substrat. Protrombintiden blev øget med 5 %, hvis kliniske betydning er ukendt.
Carbamazepin
Kombineret administration af CELEXA (40 mg/dag i 14 dage) og carbamazepin (titreret til 400 mg/dag i 35 dage) påvirkede ikke signifikant farmakokinetikken af carbamazepin, et CYP3A4-substrat. Selvom de laveste citalopram-plasmaniveauer var upåvirkede, i betragtning af carbamazepins enzyminducerende egenskaber, bør muligheden for, at carbamazepin kan øge clearance af citalopram overvejes, hvis de to lægemidler administreres samtidigt.
Triazolam
Kombineret administration af CELEXA (titreret til 40 mg/dag i 28 dage) og CYP3A4-substratet triazolam (enkeltdosis på 0,25 mg) påvirkede ikke farmakokinetikken af hverken citalopram eller triazolam signifikant.
Ketoconazol
Kombineret administration af CELEXA (40 mg) og ketoconazol (200 mg) reducerede Cmax og AUC for ketoconazol med henholdsvis 21 % og 10 % og påvirkede ikke farmakokinetikken af citalopram signifikant.
Metoprolol
Administration af 40 mg/dag CELEXA 20 mg i 22 dage resulterede i en fordobling af plasmaniveauerne af den betaadrenerge blokker metoprolol. Forhøjede metoprolol plasmaniveauer er blevet forbundet med nedsat kardioselektivitet. Samtidig administration af CELEXA 10 mg og metoprolol havde ingen klinisk signifikant effekt på blodtryk eller hjertefrekvens.
Imipramin og andre tricykliske antidepressiva (TCA'er)
In vitro undersøgelser tyder på, at citalopram er en relativt svag hæmmer af CYP2D6. Samtidig administration af CELEXA (40 mg/dag i 10 dage) med TCA imipramin (enkeltdosis på 100 mg), et substrat for CYP2D6, påvirkede ikke plasmakoncentrationerne af imipramin eller citalopram signifikant. Koncentrationen af imipraminmetabolitten desipramin blev dog øget med ca. 50 %. Den kliniske betydning af desipraminændringen er ukendt.
Dyretoksikologi og/eller farmakologi
Nethindeforandringer hos rotter
Patologiske ændringer (degeneration/atrofi) blev observeret i nethinden hos albinorotter i det 2-årige karcinogenicitetsstudie med citalopram. Der var en stigning i både forekomst og sværhedsgrad af retinal patologi hos både han- og hunrotter, der fik 80 mg/kg/dag, hvilket er ca. 19 gange MRHD på 40 mg baseret på mg/m² kropsoverfladeareal. Lignende fund var ikke til stede hos rotter behandlet i to år med en dosis på 24 mg/kg/dag, hos mus behandlet i 18 måneder med doser op til 240 mg/kg/dag eller hos hunde behandlet i et år med doser op til 20 mg/kg/dag, hvilket er henholdsvis ca. 6, 29 og 17 gange MRHD baseret på mg/m² kropsoverfladeareal.
Yderligere undersøgelser for at undersøge mekanismen for denne patologi er ikke blevet udført, og den potentielle betydning af denne effekt hos mennesker er ikke blevet fastslået.
Kliniske Studier
Effekten af CELEXA som behandling af svær depressiv lidelse blev fastslået i to placebokontrollerede undersøgelser (af 4 til 6 ugers varighed) hos voksne ambulante patienter (i alderen 18-66), der opfylder DSM-III eller DSM-III-R kriterierne for svær depressiv. lidelse (MDD) (undersøgelse 1 og 2).
Studie 1, et 6-ugers forsøg, hvor patienter fik faste CELEXA 10 mg doser på 10 mg, 20 mg, 40 mg og 60 mg dagligt, viste, at CELEXA 40 dagligt og 60 mg dagligt (1,5 gange den maksimale anbefalede daglige dosis) var effektiv målt ved Hamilton Depression Rating Scale (HAMD) totalscore, det primære effektmål. HAMD-17 er en 17-elements, kliniker-vurderet skala, der bruges til at vurdere sværhedsgraden af depressive symptomer. Scoringer på HAMD-17 varierer fra 0 til 52, med højere score, der indikerer mere alvorlig depression. Denne undersøgelse viste ingen klar effekt af 10 mg og 20 mg daglige doser, og 60 mg daglig dosis var ikke mere effektiv end 40 mg daglig dosis. På grund af risikoen for QTc-forlængelse og ventrikulære arytmier er den maksimalt anbefalede dosis af CELEXA 10 mg 40 mg én gang dagligt.
undersøgelse 2, et 4-ugers, placebokontrolleret forsøg med patienter med MDD, var startdosis 20 mg dagligt efterfulgt af titrering til den maksimalt tolererede dosis eller en maksimal dosis på 80 mg dagligt (2 gange den maksimalt anbefalede daglige dosis) ). Patienter behandlet med CELEXA 20 mg viste en statistisk signifikant større forbedring end placebopatienter på HAMD total score, det primære effektmål. I tre yderligere placebokontrollerede forsøg med patienter med MDD var forskellen i respons på behandlingen mellem patienter, der fik CELEXA, og patienter, der fik placebo, ikke statistisk signifikant.
to langtidsstudier blev patienter med MDD, som havde reageret på CELEXA 10 mg i løbet af de første 6 eller 8 ugers akut behandling, randomiseret til fortsættelse af CELEXA 10 mg eller placebo. I et studie fik patienterne faste doser af CELEXA 20 mg eller 40 mg dagligt, og i det andet studie fik patienterne fleksible doser af CELEXA 20 mg dagligt til 60 mg dagligt (1,5 gange den maksimalt anbefalede daglige dosis). I begge undersøgelser oplevede patienter, der fik fortsat CELEXA-behandling, statistisk signifikant lavere tilbagefaldsrater over de efterfølgende 6 måneder sammenlignet med dem, der fik placebo. I undersøgelsen med fast dosis var den nedsatte frekvens af tilbagefald af depression ens hos patienter, der fik 20 mg eller 40 mg dagligt CELEXA. På grund af risikoen for QTc-forlængelse og ventrikulære arytmier er den maksimalt anbefalede dosis af CELEXA 20 mg 40 mg én gang dagligt.
Analyser af sammenhængen mellem behandlingsresultat og alder, køn og race antydede ikke nogen differentiel respons på basis af disse patientkarakteristika.
PATIENTOPLYSNINGER
CELEXA® (Suh-leks-uh) (citalopram) Tabletter, til oral brug
Hvad er den vigtigste information, jeg bør vide om CELEXA?
CELEXA 20mg kan forårsage alvorlige bivirkninger, herunder:
- Øget risiko for selvmordstanker og -handlinger. CELEXA 10mg og anden antidepressiv medicin kan øge selvmordstanker og -handlinger hos nogle børn, unge og unge voksne især inden for de første få måneder af behandlingen, eller når dosis ændres. CELEXA må ikke bruges til børn.
- Depression og andre psykiske sygdomme er de vigtigste årsager til selvmordstanker og -handlinger.
Hvordan kan jeg holde øje med og forsøge at forhindre selvmordstanker og -handlinger hos mig selv eller et familiemedlem?
- Vær meget opmærksom på ændringer, især pludselige ændringer i humør, adfærd, tanker eller følelser, eller hvis du udvikler selvmordstanker eller -handlinger. Dette er meget vigtigt, når en antidepressiv medicin startes, eller når dosis ændres.
- Ring til din læge med det samme for at rapportere nye eller pludselige ændringer i humør, adfærd, tanker eller følelser.
- Hold alle opfølgende besøg hos din sundhedsplejerske som planlagt. Ring til din læge mellem besøgene efter behov, især hvis du har bekymringer om symptomer.
Ring til din sundhedsudbyder eller få akut lægehjælp med det samme, hvis du eller dit familiemedlem har nogle af følgende symptomer, især hvis de er nye, værre eller bekymrer dig:
- tanker om selvmord eller døende
- ny eller værre depression
- føler sig meget ophidset eller rastløs
- søvnbesvær (søvnløshed)
- opfører sig aggressivt, er vred eller voldelig
- en ekstrem stigning i aktivitet eller tale (mani)
- forsøg på at begå selvmord
- ny eller værre angst
- handler på farlige impulser
- Angstanfald
- ny eller værre irritabilitet
- andre usædvanlige ændringer i adfærd eller humør
Hvad er CELEXA?
CELEXA 10mg er en receptpligtig medicin, der bruges til at behandle en bestemt type depression kaldet Major Depressive Disorder (MDD) hos voksne.
Det vides ikke, om CELEXA 10mg er sikkert og effektivt til brug hos børn.
Hvem bør ikke tage CELEXA?
Tag ikke CELEXA, hvis du:
- tage en monoaminoxidasehæmmer (MAOI)
- er holdt op med at tage en MAO-hæmmer inden for de sidste 14 dage
- behandles med antibiotikum linezolid eller intravenøs methylenblåt
- tage pimozid
- er allergisk over for citalopram eller et af indholdsstofferne i CELEXA. Se slutningen af denne medicinvejledning for en komplet liste over ingredienser i CELEXA.
Spørg din læge eller apotek, hvis du ikke er sikker på, om du tager en MAO-hæmmer, inklusive MAO-hæmmere såsom linezolid eller intravenøs methylenblåt.
Begynd ikke at tage en MAO-hæmmer i mindst 14 dage efter, at du stopper behandlingen med CELEXA.
Inden du tager CELEXA, skal du fortælle din læge om alle dine medicinske tilstande, inklusive hvis du:
- har eller har en familiehistorie med selvmord, depression, bipolar lidelse, mani eller hypomani
- har en unormal hjerterytme kaldet QT-forlængelse
- har eller haft hjerteproblemer, inklusive et hjerteanfald, hjertesvigt, unormal hjerterytme eller lang QT-syndrom
- har lavt indhold af kalium, magnesium eller natrium i dit blod
- har eller haft blødningsproblemer
- har eller haft anfald (kramper)
- har højt tryk i øjet (grøn stær)
- har eller haft nyre- eller leverproblemer
- er gravid eller planlægger at blive gravid. CELEXA 20mg kan skade dit ufødte barn. Hvis du tager CELEXA sent i graviditeten, kan det føre til en øget risiko for visse problemer hos din nyfødte. Tal med din sundhedsplejerske om risici og fordele ved at behandle depression under graviditet.
- Fortæl din læge med det samme, hvis du bliver gravid eller tror, du kan være gravid under behandlingen med CELEXA.
- Der er et graviditetsregister for kvinder, der er eksponeret for CELEXA under graviditeten. Formålet med registret er at indsamle oplysninger om sundheden hos kvinder, der er udsat for CELEXA, og deres baby. Hvis du bliver gravid under behandling med CELEXA 10mg, skal du tale med din læge om tilmelding til det nationale graviditetsregister for antidepressiva. Du kan tilmelde dig ved at ringe til 1-844-405-6185 eller besøge online på https://womensmentalhealth.org/research/pregnancyregistry/antidepressants.
- ammer eller planlægger at amme. Det vides ikke, om CELEXA udskilles i din modermælk. Tal med din læge om den bedste måde at fodre din baby på under behandlingen med CELEXA.
- Hvis du ammer under behandling med CELEXA 20 mg, skal du kontakte din læge med det samme, hvis din baby udvikler søvnighed eller kræsenhed, eller ikke spiser eller tager godt på i vægt.
Fortæl din læge om al den medicin, du tager, herunder receptpligtig og håndkøbsmedicin, vitaminer og naturlægemidler.
CELEXA 10mg og anden medicin kan påvirke hinanden og forårsage mulige alvorlige bivirkninger. CELEXA kan påvirke den måde, anden medicin virker på, og anden medicin kan påvirke den måde, CELEXA virker på.
Fortæl især din læge, hvis du tager:
- medicin til behandling af migrænehovedpine kendt som triptaner
- tricykliske antidepressiva
- fentanyl
- lithium
- tramadol
- tryptofan
- buspiron
- amfetamin
- St. John's Wort
- medicin, der kan påvirke blodpropper såsom aspirin, ikke-steroide antiinflammatoriske lægemidler (NSAID) og warfarin
- diuretika
- metadon
- gatifloxacin eller moxifloxacin
- medicin, der bruges til at kontrollere din puls eller rytme (antiarytmika)
- medicin, der bruges til at behandle humør, angst, psykotiske lidelser eller tankeforstyrrelser, herunder selektive serotoningenoptagshæmmere (SSRI'er) og serotonin noradrenalin genoptagelseshæmmere (SNRI'er)
Spørg din læge, hvis du ikke er sikker på, om du tager nogen af disse lægemidler. Din læge kan fortælle dig, om det er sikkert at tage CELEXA 10 mg sammen med din anden medicin.
Du må ikke starte eller stoppe anden medicin under behandling med CELEXA uden først at tale med din læge. Hvis du pludselig stopper CELEXA, kan det få dig til at få alvorlige bivirkninger. Se, "Hvad er de mulige bivirkninger af CELEXA?"
Kend den medicin du tager. Hold en liste over dem for at vise til din sundhedsplejerske og apotek, når du får en ny medicin.
Hvordan skal jeg tage CELEXA 10mg?
- Tag CELEXA 20mg nøjagtigt som din læge fortæller dig at tage det. Du må ikke ændre din dosis eller stoppe med at tage CELEXA uden først at tale med din læge.
- Din sundhedsplejerske skal muligvis ændre dosis af CELEXA, indtil den er den rigtige dosis for dig.
- Tag CELEXA 1 gang hver dag med eller uden mad.
- Hvis du tager for meget CELEXA 20mg, skal du ringe til din læge eller giftkontrolcenter på 1-800-222-1222, eller gå til den nærmeste skadestue på hospitalet med det samme.
Hvad er de mulige bivirkninger af CELEXA 20mg?
CELEXA kan forårsage alvorlige bivirkninger, herunder:
- Se, "Hvad er den vigtigste information, jeg bør vide om CELEXA?"
- Hjerterytmeproblemer. CELEXA kan forårsage en alvorlig ændring i dit hjerteslag (en hurtig eller uregelmæssig hjerterytme), som kan forårsage død. Fortæl din læge med det samme, hvis du føler dig besvimet eller besvimer, eller hvis du har en ændring i dit hjerteslag.
- Serotonin syndrom. At tage CELEXA kan forårsage et potentielt livstruende problem kaldet serotonergt syndrom. Risikoen for at udvikle serotonergt syndrom er øget, når CELEXA 20 mg tages sammen med visse andre lægemidler. Se, "Hvem bør ikke tage CELEXA?" Ring til din sundhedsplejerske eller gå til den nærmeste skadestue med det samme hvis du har nogle af følgende tegn og symptomer på serotonergt syndrom:
- agitation
- se eller høre ting, der ikke er ægte (hallucinationer)
- forvirring
- koma
- hurtig hjerterytme
- blodtryksændringer
- svimmelhed
- svedtendens
- rødmen
- høj kropstemperatur (hypertermi)
- rysten, stive muskler eller muskeltrækninger
- tab af koordination
- anfald
- kvalme, opkastning, diarré
- Øget risiko for blødning. Indtagelse af CELEXA 20 mg sammen med aspirin, ikke-steroide antiinflammatoriske lægemidler (NSAID'er), warfarin eller blodfortyndende medicin kan øge denne risiko. Fortæl din læge med det samme om enhver usædvanlig blødning eller blå mærker.
- Maniske episoder. Maniske episoder kan forekomme hos personer med bipolar lidelse, som tager CELEXA. Symptomer kan omfatte:
- stærkt øget energi
- svære søvnbesvær
- race tanker
- hensynsløs opførsel
- usædvanligt store ideer
- overdreven lykke eller irritabilitet
- taler mere eller hurtigere end normalt
- Afbrydelsessyndrom. Hvis du pludselig stopper med CELEXA 20 mg, kan det få dig til at få alvorlige bivirkninger. Din læge vil måske nedsætte din dosis langsomt. Symptomer kan omfatte:
- kvalme
- svedtendens
- ændringer i dit humør
- hovedpine
- irritabilitet og agitation
- træthed
- svimmelhed
- problemer med at sove
- elektrisk stødfornemmelse (paræstesi)
- hypomani
- angst
- ringen for dine ører (tinnitus)
- forvirring
- anfald
- Kramper (kramper).
- Øjenproblemer (lukkende grøn stær). Mange antidepressive lægemidler, herunder CELEXA, kan forårsage en bestemt type øjenproblemer kaldet vinkel-lukkende glaukom. Ring til din læge, hvis du har ændringer i dit syn eller øjensmerter.
- Lavt natriumniveau i dit blod (hyponatriæmi). Lavt natriumniveau i dit blod kan være alvorligt og kan forårsage død. Ældre mennesker kan have større risiko for dette. Fortæl det straks til din læge, hvis du udvikler tegn eller symptomer på lave natriumniveauer i blodet under behandling med CELEXA. Tegn og symptomer på lavt natriumniveau i dit blod kan omfatte:
- hovedpine
- koncentrationsbesvær
- hukommelsesændringer
- forvirring
- svaghed og ustabilitet på dine fødder, som kan føre til fald
I alvorlige eller mere pludselige tilfælde omfatter tegn og symptomer:
-
- hallucinationer (at se eller høre ting, der ikke er ægte)
- besvimelse
- anfald
- koma
- at stoppe vejrtrækningen
- død
- Seksuelle problemer (dysfunktion). Indtagelse af selektive serotoningenoptagshæmmere (SSRI), inklusive CELEXA, kan forårsage seksuelle problemer.
Symptomer hos mænd kan omfatte:
- Forsinket sædafgang eller manglende evne til at få sædafgang
- Nedsat sexlyst
- Problemer med at få eller bevare erektion
Symptomer hos kvinder kan omfatte:
- Nedsat sexlyst
- Forsinket orgasme eller manglende evne til at få orgasme
Tal med din læge, hvis du udvikler ændringer i din seksuelle funktion, eller hvis du har spørgsmål eller bekymringer om seksuelle problemer under behandlingen med DRIZALMA SPRINKLE. Der kan være behandlinger, som din sundhedsudbyder kan foreslå.
Den mest almindelige bivirkning af CELEXA er forsinket ejakulation.
Disse er ikke alle de mulige bivirkninger af CELEXA.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare CELEXA?
- Opbevar CELEXA ved stuetemperatur mellem 68°F til 77°F (20°C til 25°C).
- Opbevar CELEXA 20mg og al medicin utilgængeligt for børn.
Generel information om sikker og effektiv brug af CELEXA
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en medicinvejledning. Brug ikke CELEXA 20 mg til en tilstand, som den ikke er ordineret til. Giv ikke CELEXA til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem. Du kan bede din sundhedsplejerske eller apotek om oplysninger om CELEXA, som er skrevet til sundhedspersonale.
Hvad er ingredienserne i CELEXA?
Aktiv ingrediens: citalopram hydrobromid
Inaktive ingredienser: copolyvidon, majsstivelse, crosscarmellosenatrium, glycerin, lactosemonohydrat, magnesiumstearat, hypromellose, mikrokrystallinsk cellulose, polyethylenglycol, titaniumdioxid og jerndioxid til farvning.
Denne medicinvejledning er godkendt af US Food and Drug Administration.
