Voltaren 100mg, 50mg Diclofenac Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Voltaren, og hvordan bruges det?
Voltaren bruges til at behandle symptomer på smerte forbundet med reumatoid arthritis, slidgigt, ankyloserende spondylitis, dysmenoré og mild til moderat smerte. Voltaren 100mg kan bruges alene eller sammen med anden medicin.
Voltaren tilhører en klasse af lægemidler kaldet ikke-steroide antiinflammatoriske lægemidler (NSAID'er).
Hvad er de mulige bivirkninger af Voltaren 50mg?
Voltaren kan forårsage alvorlige bivirkninger, herunder:
- hovedpine,
- sult,
- svedeture,
- irritabilitet,
- svimmelhed,
- kvalme,
- hurtig puls,
- føler sig angst eller rystende,
- følelsesløshed eller prikken i dine hænder, arme, ben eller fødder,
- svaghed i dine arme, hænder, ben eller fødder,
- brændende smerte i dine arme, hænder, ben eller fødder,
- alvorlige humør- eller adfærdsændringer,
- nervøsitet,
- forvirring,
- agitation,
- paranoia,
- hallucinationer,
- hukommelsesproblemer,
- koncentrationsbesvær,
- tanker om selvmord,
- seneruptur,
- pludselig smerte,
- hævelse,
- blå mærker,
- ømhed,
- stivhed,
- bevægelsesproblemer,
- en snappende eller knaldende lyd i nogen af dine led,
- stærke mavesmerter,
- diarré, der er vandig eller blodig,
- flagrende i dit bryst,
- stakåndet,
- udslæt,
- vejrtrækningsproblemer,
- kramper (kramper),
- svær hovedpine,
- synsproblemer,
- smerte bag dine øjne,
- smerter i øvre mave,
- mistet appetiten,
- mørk urin,
- lerfarvede afføring, og
- gulfarvning af huden eller øjnene (gulsot)
et lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Voltaren omfatter:
- dårlig fordøjelse,
- gas,
- mavesmerter,
- kvalme,
- opkastning,
- diarré,
- forstoppelse,
- hovedpine,
- svimmelhed,
- døsighed,
- tilstoppet næse,
- kløe,
- øget svedtendens,
- forhøjet blodtryk, og
- hævelse eller smerter i dine arme eller ben
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Voltaren. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
LEVERTOKSICITET, HJERTETOKSICITET, EMBRYO-FØTALTOKSICITET
Kardiovaskulære trombotiske hændelser
- Ikke-steroide antiinflammatoriske lægemidler (NSAID'er) forårsager en øget risiko for alvorlige kardiovaskulære trombotiske hændelser, herunder myokardieinfarkt og slagtilfælde, som kan være dødelige. Denne risiko kan opstå tidligt i behandlingen og kan øges med varigheden af brugen (se ADVARSLER).
- VOLTAREN® er kontraindiceret i forbindelse med koronar bypassoperation (CABG) (se KONTRAINDIKATIONER, ADVARSLER).
Gastrointestinal blødning, ulceration og perforering
- NSAID'er forårsager en øget risiko for alvorlige gastrointestinale (GI) bivirkninger, herunder blødning, ulceration og perforering af maven eller tarmene, som kan være dødelige. Disse hændelser kan forekomme når som helst under brug og uden advarselssymptomer. Ældre patienter og patienter med en tidligere anamnese med mavesår og/eller GI-blødning har større risiko for alvorlige GI-hændelser. (se ADVARSLER).
BESKRIVELSE
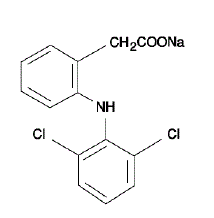
VOLTAREN® (diclofenacnatrium enterisk overtrukne tabletter) er et benzen-eddikesyrederivat. VOLTAREN 50 mg er tilgængelig som tabletter med forsinket frigivelse (enterisk overtrukne) på 75 mg (lyserød) til oral administration. Diclofenacnatrium er et hvidt eller let gulligt krystallinsk pulver og er tungtopløseligt i vand ved 25°C. Det kemiske navn er 2-[(2,6-dichlorphenyl)amino]benzeneddikesyre, mononatriumsalt. Molekylvægten er 318,14. Dens molekylære formel er C14H10Cl2NNaO2, og den har følgende strukturformel
De inaktive ingredienser i VOLTAREN omfatter: hydroxypropylmethylcellulose, jernoxid, lactose, magnesiumstearat, methacrylsyrecopolymer, mikrokrystallinsk cellulose, polyethylenglycol, povidon, propylenglycol, natriumhydroxid, natriumstivelsesglycolat, talkum, titaniumdioxid.
INDIKATIONER
Overvej omhyggeligt de potentielle fordele og risici ved VOLTAREN® (diclofenacnatrium enterisk overtrukne tabletter) og andre behandlingsmuligheder, før du beslutter dig for at bruge VOLTAREN. Brug den laveste effektive dosis til den korteste varighed i overensstemmelse med individuelle patientbehandlingsmål (se ADVARSLER ; Gastrointestinal blødning , Sårdannelse , og Perforering ).
VOLTAREN er angivet:
- til lindring af tegn og symptomer på slidgigt
- til lindring af tegn og symptomer på reumatoid arthritis
- til akut eller langvarig brug til lindring af tegn og symptomer på ankyloserende spondylitis
DOSERING OG ADMINISTRATION
Overvej omhyggeligt de potentielle fordele og risici ved VOLTAREN® (diclofenacnatrium enterisk overtrukne tabletter) og andre behandlingsmuligheder, før du beslutter dig for at bruge VOLTAREN. Brug den laveste effektive dosis til den korteste varighed i overensstemmelse med individuelle patientbehandlingsmål (se ADVARSLER ; Gastrointestinal blødning, ulceration og perforation ).
Efter observation af responsen på den indledende behandling med VOLTAREN 100 mg, bør dosis og frekvens justeres, så den passer til den enkelte patients behov.
Til lindring af slidgigt er den anbefalede dosis 100 til 150 mg/dag i opdelte doser (50 mg to gange dagligt eller tre gange dagligt eller 75 mg to gange dagligt).
Til lindring af leddegigt er den anbefalede dosis 150 til 200 mg/dag i opdelte doser (50 mg tre gange dagligt eller fire gange dagligt eller 75 mg to gange dagligt).
Til lindring af ankyloserende spondylitis er den anbefalede dosis 100 til 125 mg/dag, administreret som 25 mg fire gange dagligt, med en ekstra 25 mg dosis ved sengetid, hvis det er nødvendigt.
Forskellige formuleringer af diclofenac [VOLTAREN® (diclofenacnatrium enterisk overtrukne tabletter); VOLTAREN®ÂXR (diclofenacnatrium tabletter med forlænget frigivelse); CATAFLAM® (diclofenac-kalium tabletter med øjeblikkelig frigivelse)] er ikke nødvendigvis bioækvivalente, selvom milligramstyrken er den samme.
HVORDAN LEVERET
VOLTAREN® (diclofenacnatrium enterisk overtrukne tabletter) - 75 mg
Lyserøde, bikonvekse, trekantede, enterisk overtrukne tabletter (påtrykt "VOLTAREN 75" på den ene side med sort blæk)
100 flasker NDC 0028-0264-01
Opbevares ved stuetemperatur 20°C til 25°C (68°F til 77°F); udflugter tilladt mellem 15°C og 30°C (59°F og 86°F) [se USP kontrolleret rumtemperatur ].
Beskyt mod fugt. Dispenser i tæt beholder (USP).
Distribueret af: Novartis Pharmaceuticals Corporation East Hanover, NJ 07936. Revideret: apr 2021
BIVIRKNINGER
Følgende bivirkninger er beskrevet mere detaljeret i andre afsnit af mærkningen:
- Kardiovaskulære trombotiske hændelser (se ADVARSLER )
- GI-blødning, ulceration og perforation (se ADVARSLER )
- Hepatotoksicitet (se ADVARSLER )
- Hypertension (se ADVARSLER )
- Hjertesvigt og ødem (se ADVARSLER )
- Nyretoksicitet og hyperkaliæmi (se ADVARSLER )
- Anafylaktiske reaktioner (se ADVARSLER )
- Alvorlige hudreaktioner (se ADVARSLER )
- Hæmatologisk toksicitet (se ADVARSLER )
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Hos patienter, der tager VOLTAREN® (diclofenacnatrium entero-overtrukne tabletter) eller andre NSAID'er, er de hyppigst rapporterede bivirkninger, der forekommer hos ca. 1 % til 10 % af patienterne: Gastrointestinale oplevelser, herunder: mavesmerter, forstoppelse, diarré, dyspepsi, flatulens, grov blødning/perforation, halsbrand, kvalme, mave-/duodenal-sår og opkastning.
Unormal nyrefunktion, anæmi, svimmelhed, ødem, forhøjede leverenzymer, hovedpine, øget blødningstid, pruritus, udslæt og tinnitus. Yderligere bivirkninger rapporteret lejlighedsvis omfatter:
Kroppen som helhed: feber, infektion, sepsis
Kardiovaskulære system: kongestiv hjertesvigt, hypertension, takykardi, synkope
Fordøjelsessystemet: mundtørhed, esophagitis, mavesår/mavesår, gastritis, gastrointestinal blødning, glossitis, hæmatemese, hepatitis, gulsot
Hemisk og lymfesystem: ekkymose, eosinofili, leukopeni, melena, purpura, rektal blødning, stomatitis, trombocytopeni
Metabolisk og ernæringsmæssig: vægtændringer
Nervesystem: angst, asteni, forvirring, depression, drømmeabnormiteter, døsighed, søvnløshed, utilpashed, nervøsitet, paræstesi, somnolens, rysten, vertigo
Åndedrætsorganerne: astma, dyspnø
Hud og vedhæng: alopeci, lysfølsomhed, øget svedtendens
Særlige sanser: sløret syn
Urogenital system: blærebetændelse, dysuri, hæmaturi, interstitiel nefritis, oliguri/polyuri, proteinuri, nyresvigt
Andre bivirkninger, som forekommer sjældent, er:
Kroppen som helhed: anafylaktiske reaktioner, appetitændringer, død
Kardiovaskulære system: arytmi, hypotension, myokardieinfarkt, hjertebanken, vaskulitis
Fordøjelsessystemet: colitis, udbrud, fulminant hepatitis med og uden gulsot, leversvigt, levernekrose, pancreatitis
Hemisk og lymfesystem: agranulocytose, hæmolytisk anæmi, aplastisk anæmi, lymfadenopati, pancytopeni
Metabolisk og ernæringsmæssig: hyperglykæmi
Nervesystem: kramper, koma, hallucinationer, meningitis
Åndedrætsorganerne: respirationsdepression, lungebetændelse
Hud og vedhæng: angioødem, toksisk epidermal nekrolyse, erythema multiforme, eksfoliativ dermatitis, Stevens-Johnsons syndrom, nældefeber
Særlige sanser: konjunktivitis, hørenedsættelse
OVERDOSIS
Symptomer efter akutte NSAID-overdoseringer har typisk været begrænset til sløvhed, døsighed, kvalme, opkastning og epigastriske smerter, som generelt har været reversible med støttende behandling. Der er opstået gastrointestinal blødning. Hypertension, akut nyresvigt, respirationsdepression og koma er forekommet, men var sjældne (se ADVARSLER ; Kardiovaskulære trombotiske hændelser, gastrointestinal blødning, ulceration og hypertension, nyretoksicitet og hyperkaliæmi ).
Håndter patienter med symptomatisk og understøttende behandling efter en NSAID-overdosering. Der er ingen specifikke modgifte. Overvej emeser og/eller aktivt kul (60 til 100 gram hos voksne, 1 til 2 gram pr. kg kropsvægt hos pædiatriske patienter) og/eller osmotisk katarsis hos symptomatiske patienter set inden for fire timer efter indtagelse eller hos patienter med en stor overdosis ( 5 til 10 gange den anbefalede dosis). Tvungen diurese, alkalinisering af urin, hæmodialyse eller hemoperfusion er muligvis ikke nyttige på grund af høj proteinbinding.
For yderligere information om overdoseringsbehandling, kontakt et giftkontrolcenter (1-800-222-1222).
DRUGSINTERAKTIONER
Se tabel 2 for klinisk signifikante lægemiddelinteraktioner med diclofenac.
ADVARSLER
Kardiovaskulære trombotiske hændelser
Kliniske forsøg med flere COX-2 selektive og ikke-selektive NSAID'er af op til 3 års varighed har vist en øget risiko for alvorlige kardiovaskulære (CV) trombotiske hændelser, herunder myokardieinfarkt (MI) og slagtilfælde, som kan være fatale. Baseret på tilgængelige data er det uklart, at risikoen for CV-trombotiske hændelser er ens for alle NSAID'er. Den relative stigning i alvorlige CV-trombotiske hændelser over baseline forårsaget af NSAID-brug synes at være ens hos dem med og uden kendt CV-sygdom eller risikofaktorer for CV-sygdom. Patienter med kendt CV-sygdom eller risikofaktorer havde dog en højere absolut forekomst af overskydende alvorlige CV-trombotiske hændelser på grund af deres øgede baseline-rate. Nogle observationsstudier viste, at denne øgede risiko for alvorlige CV-trombotiske hændelser begyndte allerede i de første uger af behandlingen. Stigningen i CV-trombotisk risiko er blevet observeret mest konsekvent ved højere doser.
For at minimere den potentielle risiko for en uønsket CV-hændelse hos NSAID-behandlede patienter skal du bruge den laveste effektive dosis i den kortest mulige varighed. Læger og patienter bør forblive opmærksomme på udviklingen af sådanne hændelser under hele behandlingsforløbet, selv i fravær af tidligere CV-symptomer. Patienter bør informeres om symptomerne på alvorlige CV-hændelser og de skridt, der skal tages, hvis de opstår.
Der er ingen konsekvent evidens for, at samtidig brug af aspirin mindsker den øgede risiko for alvorlige CV-trombotiske hændelser forbundet med NSAID-brug. Samtidig brug af aspirin og et NSAID, såsom diclofenac, øger risikoen for alvorlige gastrointestinale (GI) hændelser (se ADVARSLER ; Gastrointestinal blødning , Sårdannelse , og Perforering ).
Status Post Koronararterie Bypass Graft (CABG) kirurgi
To store, kontrollerede, kliniske forsøg med et COX-2-selektivt NSAID til behandling af smerte i de første 10 til 14 dage efter CABG-operation fandt en øget forekomst af myokardieinfarkt og slagtilfælde. NSAID'er er kontraindiceret i forbindelse med CABG (se KONTRAINDIKATIONER ).
Post-MI-patienter
Observationsundersøgelser udført i det danske folkeregister har vist, at patienter behandlet med NSAID i post-MI-perioden havde øget risiko for reinfarkt, CV-relateret død og dødelighed af alle årsager begyndende i den første uge af behandlingen. I denne samme kohorte var forekomsten af dødsfald i det første år efter MI 20 pr. 100 personår hos NSAID-behandlede patienter sammenlignet med 12 pr. 100 personår hos ikke-NSAID-eksponerede patienter. Selvom den absolutte dødsrate faldt noget efter det første år efter MI, var den øgede relative risiko for død hos NSAID-brugere ved i mindst de næste fire års opfølgning.
Undgå brugen af VOLTAREN hos patienter med nylig MI, medmindre fordelene forventes at opveje risikoen for tilbagevendende CV-trombotiske hændelser. Hvis VOLTAREN anvendes til patienter med nylig MI, skal patienter overvåges for tegn på hjerteiskæmi.
Gastrointestinal blødning, ulceration og perforering
NSAID'er, herunder diclofenac, forårsager alvorlige gastrointestinale (GI) bivirkninger, herunder betændelse, blødning, ulceration og perforering af spiserøret, maven, tyndtarmen eller tyktarmen, hvilket kan være dødeligt. Disse alvorlige bivirkninger kan forekomme til enhver tid, med eller uden advarselssymptomer, hos patienter behandlet med NSAID'er. Kun én ud af fem patienter, som udvikler en alvorlig øvre GI-bivirkning under NSAID-behandling, er symptomatisk. Øvre mavesår, grov blødning eller perforation forårsaget af NSAID'er forekom hos ca. 1 % af patienterne behandlet i 3 til 6 måneder og hos ca. 2 % til 4 % af patienterne behandlet i et år. Men selv kortvarig terapi er ikke uden risiko.
Risikofaktorer for GI-blødning, ulceration og perforering
Patienter med en tidligere anamnese med mavesår og/eller GI-blødninger, som bruger NSAID'er, havde en større end 10 gange øget risiko for at udvikle GI-blødning sammenlignet med patienter uden disse risikofaktorer. Andre faktorer, der øger risikoen for GI-blødning hos patienter, der behandles med NSAID'er, omfatter længere varighed af NSAID-behandling, samtidig brug af orale kortikosteroider, aspirin, antikoagulantia eller selektive serotoningenoptagelseshæmmere (SSRI'er); rygning, brug af alkohol, ældre alder og dårlig generel sundhedstilstand. De fleste postmarketingrapporter om fatale gastrointestinale hændelser forekom hos ældre eller svækkede patienter. Derudover har patienter med fremskreden leversygdom og/eller koagulopati øget risiko for GI-blødning.
Strategier TIL AT MINIMERE GI-risiciene hos NSAID-behandlede patienter
- Brug den laveste effektive dosis i den kortest mulige varighed.
- Undgå administration af mere end ét NSAID ad gangen
- Undgå brug til patienter med højere risiko, medmindre fordelene forventes at opveje den øgede risiko for blødning. For sådanne patienter, såvel som dem med aktiv gastrointestinale blødning, bør du overveje alternative behandlinger, bortset fra NSAID'er.
- Vær opmærksom på tegn og symptomer på GI-ulceration og blødning under NSAID-behandling.
- Hvis der er mistanke om en alvorlig GI-bivirkning, påbegynd omgående evaluering og behandling og seponér VOLTAREN 50 mg, indtil en alvorlig GI-bivirkning er udelukket.
- Ved samtidig brug af lavdosis aspirin til hjerteprofylakse skal patienterne overvåges tættere for tegn på GI-blødning (se FORHOLDSREGLER ; Lægemiddelinteraktioner ).
Hepatotoksicitet
I kliniske forsøg med diclofenac-holdige produkter blev der observeret betydningsfulde forhøjelser (dvs. mere end 3 gange den øvre grænse for normal [ULN]) af aspartataminotransferase (AST) (også kendt som SGOT) hos ca. 2 % af ca. 5700 patienter kl. nogen tid under diclofenacbehandling (alaninaminotransferase [ALT] blev ikke målt i alle undersøgelser).
et stort, åbent, kontrolleret forsøg med 3700 patienter behandlet med oralt diclofenacnatrium i 2 til 6 måneder, blev patienterne overvåget først efter 8 uger, og 1200 patienter blev monitoreret igen efter 24 uger. Betydningsfulde forhøjelser af ALAT og/eller ASAT forekom hos omkring 4 % af patienterne og omfattede markante forhøjelser (større end 8 gange ULN) hos omkring 1 % af de 3700 patienter. I det åbne studie blev der observeret en højere forekomst af grænseoverskridende (mindre end 3 gange ULN), moderat (3 til 8 gange ULN) og markant (større end 8 gange ULN) forhøjelser af ALAT eller ASAT hos patienter får diclofenac sammenlignet med andre NSAID'er. Forhøjelser i transaminaser blev set hyppigere hos patienter med slidgigt end hos patienter med reumatoid arthritis.
Næsten alle betydningsfulde stigninger i transaminaser blev påvist, før patienterne blev symptomatiske. Unormale tests forekom i løbet af de første 2 måneders behandling med diclofenac hos 42 af de 51 patienter i alle forsøg, som udviklede markante transaminaseforhøjelser.
I postmarketingrapporter er tilfælde af lægemiddelinduceret hepatotoksicitet blevet rapporteret i den første måned og i nogle tilfælde de første 2 måneder af behandlingen, men kan forekomme på ethvert tidspunkt under behandling med diclofenac. Overvågning efter markedsføring har rapporteret tilfælde af alvorlige leverreaktioner, herunder levernekrose, gulsot, fulminant hepatitis med og uden gulsot og leversvigt. Nogle af disse rapporterede tilfælde resulterede i dødsfald eller levertransplantation.
et europæisk retrospektivt populationsbaseret, case-kontrolleret studie, var 10 tilfælde af diclofenac-associeret lægemiddelinduceret leverskade med nuværende brug sammenlignet med manglende brug af diclofenac forbundet med en statistisk signifikant 4 gange justeret odds ratio for leverskade. I denne særlige undersøgelse, baseret på et samlet antal på 10 tilfælde af leverskade forbundet med diclofenac, steg den justerede odds ratio yderligere med kvindeligt køn, doser på 150 mg eller mere og varighed af brug i mere end 90 dage.
Læger bør måle transaminaser ved baseline og med jævne mellemrum hos patienter, der får langtidsbehandling med diclofenac, fordi alvorlig levertoksicitet kan udvikle sig uden en prodrom med karakteristiske symptomer. De optimale tidspunkter for at foretage de første og efterfølgende transaminasemålinger kendes ikke. Baseret på data fra kliniske forsøg og erfaringer efter markedsføring, bør transaminaser monitoreres inden for 4 til 8 uger efter påbegyndelse af behandling med diclofenac. Alvorlige leverreaktioner kan dog forekomme når som helst under behandling med diclofenac.
Hvis unormale leverprøver fortsætter eller forværres, hvis der udvikles kliniske tegn og/eller symptomer, der er forenelige med leversygdom, eller hvis der opstår systemiske manifestationer (f.eks. eosinofili, udslæt, mavesmerter, diarré, mørk urin osv.), skal VOLTAREN seponeres øjeblikkeligt. .
Informer patienterne om advarselstegn og symptomer på hepatotoksicitet (f.eks. kvalme, træthed, sløvhed, diarré, kløe, gulsot, ømhed i højre øvre kvadrant og "influenzalignende" symptomer). Hvis der udvikles kliniske tegn og symptomer, der er forenelige med leversygdom, eller hvis der opstår systemiske manifestationer (f.eks. eosinofili, udslæt osv.), skal du straks afbryde behandlingen med VOLTAREN og udføre en klinisk evaluering af patienten.
For at minimere den potentielle risiko for en uønsket leverrelateret hændelse hos patienter behandlet med VOLTAREN, skal du bruge den laveste effektive dosis i den kortest mulige varighed. Udvis forsigtighed, når du ordinerer VOLTAREN 100 mg sammen med lægemidler, der er kendt for at være potentielt hepatotoksiske (f.eks. acetaminophen, antibiotika, antiepileptika).
Forhøjet blodtryk
NSAID'er, inklusive VOLTAREN 100 mg, kan føre til ny opstået hypertension eller forværring af allerede eksisterende hypertension, som begge kan bidrage til den øgede forekomst af CV-hændelser. Patienter, der tager angiotensin-konverterende enzym (ACE)-hæmmere, thiaziddiuretika eller loop-diuretika, kan have nedsat respons på disse behandlinger, når de tager NSAID'er (se FORHOLDSREGLER ; DRUGSINTERAKTIONER ).
Overvåg blodtrykket (BP) under påbegyndelse af NSAID-behandling og under hele behandlingsforløbet.
Hjertesvigt og ødem
Coxib og traditionelle NSAID Trialists' Collaboration meta-analyse af randomiserede kontrollerede forsøg viste en ca. 2 gange stigning i hospitalsindlæggelse for hjertesvigt hos COX-2 selektivt behandlede patienter og ikke-selektive NSAID-behandlede patienter sammenlignet med placebo-behandlede patienter. I et dansk folkeregisterundersøgelse af patienter med hjertesvigt øgede NSAID-brug risikoen for MI, hospitalsindlæggelse for hjertesvigt og død.
Derudover er væskeretention og ødem blevet observeret hos nogle patienter behandlet med NSAID'er. Brug af diclofenac kan sløve CV-effekterne af flere terapeutiske midler, der bruges til at behandle disse medicinske tilstande (f.eks. diuretika, ACE-hæmmere eller angiotensinreceptorblokkere [ARB'er]) (se DRUGSINTERAKTIONER ).
Undgå brugen af VOLTAREN til patienter med alvorlig hjerteinsufficiens, medmindre fordelene forventes at opveje risikoen for forværring af hjerteinsufficiens. Hvis VOLTAREN 50 mg anvendes til patienter med alvorligt hjertesvigt, skal patienterne overvåges for tegn på forværret hjerteinsufficiens.
Nyretoksicitet og hyperkaliæmi
Renal toksicitet
Langvarig administration af NSAID'er har resulteret i nyrepapillær nekrose og anden nyreskade.
Renal toksicitet er også set hos patienter, hvor renale prostaglandiner har en kompenserende rolle i opretholdelsen af renal perfusion. Hos disse patienter kan administration af et NSAID forårsage en dosisafhængig reduktion i prostaglandindannelsen og sekundært i renal blodgennemstrømning, hvilket kan fremkalde åbenlys nyreinsufficiens. Patienter med størst risiko for denne reaktion er dem med nedsat nyrefunktion, dehydrering, hypovolæmi, hjertesvigt, leverdysfunktion, dem, der tager diuretika og ACE-hæmmere eller ARB'er, og ældre. Seponering af NSAID-behandling efterfølges sædvanligvis af genopretning til forbehandlingstilstanden.
Der er ingen tilgængelig information fra kontrollerede kliniske undersøgelser vedrørende brugen af VOLTAREN 100 mg til patienter med fremskreden nyresygdom. De renale virkninger af VOLTAREN 50 mg kan fremskynde udviklingen af nyreinsufficiens hos patienter med allerede eksisterende nyresygdom.
Korrekt volumenstatus hos dehydrerede eller hypovolæmiske patienter før påbegyndelse af VOLTAREN. Overvåg nyrefunktionen hos patienter med nedsat nyre- eller leverfunktion, hjertesvigt, dehydrering eller hypovolæmi under brug af VOLTAREN (se DRUGSINTERAKTIONER ). Undgå brugen af VOLTAREN til patienter med fremskreden nyresygdom, medmindre fordelene forventes at opveje risikoen for forværring af nyrefunktionen. Hvis VOLTAREN 50 mg anvendes til patienter med fremskreden nyresygdom, skal patienterne overvåges for tegn på forværret nyrefunktion.
Hyperkaliæmi
Stigninger i serumkaliumkoncentrationen, inklusive hyperkaliæmi, er blevet rapporteret ved brug af NSAID'er, selv hos nogle patienter uden nedsat nyrefunktion. Hos patienter med normal nyrefunktion er disse virkninger blevet tilskrevet en tilstand af hyporeninemisk-hypoaldosteronisme.
Anafylaktiske reaktioner
Diclofenac er blevet forbundet med anafylaktiske reaktioner hos patienter med og uden kendt overfølsomhed over for diclofenac og hos patienter med aspirinfølsom astma (se KONTRAINDIKATIONER , ADVARSLER ; Forværring af astma relateret til aspirinfølsomhed ).
Forværring af astma relateret til aspirinfølsomhed
En underpopulation af patienter med astma kan have aspirinfølsom astma, som kan omfatte kronisk rhinosinusitis kompliceret af næsepolypper; alvorlig, potentielt dødelig bronkospasme; og/eller intolerance over for aspirin og andre NSAID'er. Fordi krydsreaktivitet mellem aspirin og andre NSAID'er er blevet rapporteret hos sådanne aspirinfølsomme patienter, er VOLTAREN 100 mg kontraindiceret hos patienter med denne form for aspirinfølsomhed (se KONTRAINDIKATIONER ). Når VOLTAREN 100 mg anvendes til patienter med allerede eksisterende astma (uden kendt aspirinfølsomhed), skal patienter overvåges for ændringer i tegn og symptomer på astma.
Alvorlige hudreaktioner
NSAID'er, inklusive diclofenac, kan forårsage alvorlige hudbivirkninger, såsom eksfoliativ dermatitis, Stevens-Johnsons syndrom (SJS) og toksisk epidermal nekrolyse (TEN), som kan være dødelig. Disse alvorlige hændelser kan forekomme uden varsel. Informer patienterne om tegn og symptomer på alvorlige hudreaktioner og om at stoppe brugen af VOLTAREN ved første forekomst af hududslæt eller andre tegn på overfølsomhed. VOLTAREN er kontraindiceret til patienter med tidligere alvorlige hudreaktioner på NSAID'er (se KONTRAINDIKATIONER ).
Lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS)
Lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS) er blevet rapporteret hos patienter, der tager NSAID'er, såsom VOLTAREN. Nogle af disse hændelser har været fatale eller livstruende. DRESS viser sig typisk, men ikke udelukkende, med feber, udslæt, lymfadenopati og/eller hævelse i ansigtet. Andre kliniske manifestationer kan omfatte hepatitis, nefritis, hæmatologiske abnormiteter, myocarditis eller myositis. Nogle gange kan symptomer på DRESS minde om en akut virusinfektion. Eosinofili er ofte til stede. Fordi denne lidelse er variabel i sin præsentation, kan andre organsystemer, der ikke er nævnt her, være involveret. Det er vigtigt at bemærke, at tidlige manifestationer af overfølsomhed, såsom feber eller lymfadenopati, kan være til stede, selvom udslæt ikke er tydeligt. Hvis sådanne tegn eller symptomer er til stede, skal du afbryde behandlingen med VOLTAREN 50mg og straks evaluere patienten.
Føtal toksicitet
For tidlig lukning af føtal ductus arteriosus
Undgå brug af NSAID'er, inklusive VOLTAREN 50mg, hos gravide kvinder ved ca. 30 ugers graviditet og senere. NSAID'er, inklusive VOLTAREN 50 mg, øger risikoen for for tidlig lukning af fosterets ductus arteriosus ved omtrent denne svangerskabsalder.
Oligohydramnios/neonatal nyreinsufficiens
Brug af NSAID'er, inklusive VOLTAREN, ved ca. 20 ugers graviditet eller senere i graviditeten kan forårsage føtal nyreinsufficiens, hvilket fører til oligohydramnios og i nogle tilfælde neonatal nyreinsufficiens. Disse uønskede resultater ses i gennemsnit efter dage til ugers behandling, selvom oligohydramnios sjældent er blevet rapporteret så snart som 48 timer efter NSAID-start. Oligohydramnios er ofte, men ikke altid, reversibel med seponering af behandlingen. Komplikationer af forlænget oligohydramnios kan for eksempel omfatte lemmerkontrakturer og forsinket lungemodning. I nogle tilfælde efter markedsføring af nedsat nyrefunktion hos nyfødte var invasive procedurer, såsom udvekslingstransfusion eller dialyse, påkrævet.
Hvis NSAID-behandling er nødvendig mellem ca. 20 uger og 30 ugers svangerskab, begrænses brugen af VOLTAREN til den lavest mulige effektive dosis og kortest mulige varighed. Overvej ultralydsovervågning af fostervand, hvis VOLTAREN 50 mg behandling strækker sig ud over 48 timer. Stop med VOLTAREN 100 mg, hvis der opstår oligohydramnios, og følg op i henhold til klinisk praksis (se FORHOLDSREGLER ; Graviditet ).
Hæmatologisk toksicitet
Anæmi er forekommet hos NSAID-behandlede patienter. Dette kan skyldes okkult eller groft blodtab, væskeophobning eller en ufuldstændigt beskrevet effekt på erytropoiese. Hvis en patient, der behandles med VOLTAREN, har tegn eller symptomer på anæmi, skal du overvåge hæmoglobin eller hæmatokrit.
NSAID'er, inklusive VOLTAREN 100 mg, kan øge risikoen for blødningshændelser. Komorbide tilstande, såsom koagulationsforstyrrelser, samtidig brug af warfarin, andre antikoagulantia, trombocythæmmende midler (f.eks. aspirin), serotoningenoptagelseshæmmere (SSRI'er) og serotonin-noradrenalin-genoptagelseshæmmere (SNRI'er) kan øge denne risiko. Overvåg disse patienter for tegn på blødning (se DRUGSINTERAKTIONER ).
FORHOLDSREGLER
Generel
VOLTAREN® (diclofenacnatrium enterisk overtrukne tabletter) kan ikke forventes at erstatte kortikosteroider eller at behandle kortikosteroidinsufficiens. Pludselig seponering af kortikosteroider kan føre til sygdomsforværring. Patienter i langvarig kortikosteroidbehandling skal nedtrappes langsomt, hvis der træffes beslutning om at seponere kortikosteroider, og patienten skal observeres nøje for tegn på bivirkninger, herunder binyrebarkinsufficiens og forværring af symptomer på arthritis.
Den farmakologiske aktivitet af VOLTAREN 50 mg til at reducere feber og inflammation kan mindske anvendeligheden af disse diagnostiske tegn til påvisning af komplikationer af formodede ikke-infektiøse, smertefulde tilstande.

Information til patienter
Råd patienten til at læse den FDA-godkendte patientmærkning ( Medicinvejledning ), der følger med hver udleveret recept. Informer patienter, familier eller deres pårørende om følgende information, før behandling med VOLTAREN påbegyndes og med jævne mellemrum i løbet af den igangværende behandling.
Kardiovaskulære trombotiske hændelser
Rådgiv patienterne om at være opmærksomme på symptomerne på kardiovaskulære trombotiske hændelser, herunder brystsmerter, åndenød, svaghed eller sløret tale, og at rapportere ethvert af disse symptomer til deres læge med det samme (se ADVARSLER ; Kardiovaskulære trombotiske hændelser ).
Gastrointestinal blødning, ulceration og perforering
Rådgiv patienterne om at rapportere symptomer på ulcerationer og blødninger, herunder epigastriske smerter, dyspepsi, melena og hæmatemese til deres læge. I forbindelse med samtidig brug af lavdosis aspirin til hjerteprofylakse, informere patienterne om den øgede risiko for tegn og symptomer på GI-blødning (se ADVARSEL ; Gastrointestinal blødning , Sårdannelse , og Perforering ).
Hepatotoksicitet
Informer patienterne om advarselstegn og symptomer på hepatotoksicitet (f.eks. kvalme, træthed, sløvhed, kløe, diarré, gulsot, ømhed i højre øvre kvadrant og "influenzalignende" symptomer). Hvis disse opstår, instruer patienterne i at stoppe med VOLTAREN 50 mg og søge øjeblikkelig medicinsk behandling (se ADVARSLER ; Hepatotoksicitet ).
Hjertesvigt og ødem
Rådgiv patienterne om at være opmærksomme på symptomer på kongestiv hjertesvigt, herunder åndenød, uforklarlig vægtøgning eller ødem og at kontakte deres læge, hvis sådanne symptomer opstår (se ADVARSLER ; Hjertesvigt og ødem ).
Anafylaktiske reaktioner
Informer patienterne om tegn på en anafylaktisk reaktion (f.eks. åndedrætsbesvær, hævelse af ansigt eller hals). Instruer patienterne i at søge øjeblikkelig nødhjælp, hvis disse opstår (se ADVARSLER ; Anafylaktiske reaktioner ).
Alvorlige hudreaktioner, inklusive DRESS
Rådgiv patienterne om at stoppe med VOLTAREN 50 mg omgående, hvis de udvikler nogen form for udslæt eller feber, og kontakt deres læge så hurtigt som muligt (se ADVARSLER ; Alvorlige hudreaktioner ).
Kvindelig fertilitet
Informer kvinder med reproduktionspotentiale, som ønsker graviditet, at NSAID'er, inklusive VOLTAREN 50 mg, kan være forbundet med en reversibel forsinkelse i ægløsning (se FORHOLDSREGLER ; Karcinogenese, mutagenese, svækkelse af fertilitet ).
Føtal toksicitet
Informer gravide kvinder om at undgå brug af VOLTAREN og andre NSAID'er, startende ved 30. graviditetsuge på grund af risikoen for for tidlig lukning af fosterets ductus arteriosus. Hvis behandling med VOLTAREN er nødvendig for en gravid kvinde mellem ca. 20 og 30 ugers graviditet, skal du rådgive hende om, at hun muligvis skal overvåges for oligohydramnios, hvis behandlingen fortsætter i mere end 48 timer. (se ADVARSLER ; Føtal toksicitet , FORHOLDSREGLER , Graviditet ).
Undgå samtidig brug af NSAID'er
Informer patienterne om, at samtidig brug af VOLTAREN 50 mg og andre NSAID'er eller salicylater (f.eks. diflunisal, salsalat) ikke anbefales på grund af den øgede risiko for gastrointestinal toksicitet og ringe eller ingen stigning i effektivitet (se ADVARSLER ; Gastrointestinal blødning , Sårdannelse , og Perforering og lægemiddelinteraktioner ). Advarer patienter om, at NSAID'er kan være til stede i "håndkøbsmedicin" til behandling af forkølelse, feber eller søvnløshed.
Brug af NSAID og lavdosis aspirin
Informer patienterne om ikke at bruge lavdosis aspirin samtidig med VOLTAREN, før de taler med deres læge (se DRUGSINTERAKTIONER ).
Maskering af betændelse og feber
Den farmakologiske aktivitet af VOLTAREN til at reducere inflammation og muligvis feber, kan mindske anvendeligheden af diagnostiske tegn til påvisning af infektioner.
Laboratorieovervågning
Da alvorlig GI-blødning, levertoksicitet og nyreskade kan forekomme uden advarselssymptomer eller tegn, bør du overveje at overvåge patienter i langvarig NSAID-behandling med en CBC og en kemiprofil med jævne mellemrum (se ADVARSLER ; Gastrointestinal blødning , Ulceration og Perforation , og Hepatotoksicitet ).
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
Langsigtede karcinogenicitetsundersøgelser hos rotter, der fik diclofenacnatrium op til 2 mg/kg/dag (ca. 0,1 gange den maksimale anbefalede humane dosis (MRHD) af VOLTAREN 50 mg, 200 mg/dag, baseret på kropsoverfladeareal (BSA) sammenligning) har afsløret ingen signifikant stigning i tumorforekomst. Et 2-årigt carcinogenicitetsstudie udført i mus, der anvender diclofenacnatrium i doser op til 0,3 mg/kg/dag (ca. 0,007 gange MRHD baseret på BSA-sammenligning) hos hanner og 1 mg/kg/dag (ca. 0,02 gange MRHD baseret på BSA-sammenligning) hos kvinder afslørede ikke noget onkogent potentiale.
Mutagenese
Diclofenacnatrium udviste ikke mutagen aktivitet i in vitro punktmutationsassays i pattedyrs- (muslymfom) og mikrobielle (gær, Ames) testsystemer og var ikke-mutagen i adskillige pattedyrs in vitro- og in vivo-tests, inklusive dominant letale og mandlige germinale epitel-kromosomale undersøgelser i mus, og nucleus anomali og kromosomafvigelser undersøgelser i kinesiske hamstere.
Forringelse af fertilitet
Diclofenacnatrium administreret til han- og hunrotter med 4 mg/kg/dag (ca. 0,2 gange MRHD baseret på BSA-sammenligning) påvirkede ikke fertiliteten.
Baseret på virkningsmekanismen kan brugen af prostaglandin-medierede NSAID'er, inklusive VOLTAREN 100mg, forsinke eller forhindre brud på ovariefollikler, som er blevet forbundet med reversibel infertilitet hos nogle kvinder. Publicerede dyreforsøg har vist, at administration af prostaglandinsyntesehæmmere har potentialet til at forstyrre prostaglandin-medieret follikulær ruptur, der er nødvendig for ægløsning. Små undersøgelser af kvinder behandlet med NSAID'er har også vist en reversibel forsinkelse i ægløsning. Overvej seponering af NSAID'er, inklusive VOLTAREN 100 mg, hos kvinder, som har svært ved at blive gravide, eller som er under undersøgelse af infertilitet.
Graviditet
Risikooversigt
Brug af NSAID'er, inklusive VOLTAREN, kan forårsage for tidlig lukning af føtal ductus arteriosus og føtal nyreinsufficiens, hvilket fører til oligohydramnios og i nogle tilfælde neonatal nyreinsufficiens. På grund af disse risici skal du begrænse dosis og varighed af VOLTAREN-brug mellem ca. 20 og 30 uger af graviditeten, og undgå brug af VOLTAREN ved ca. 30 uger af graviditeten og senere i graviditeten (se ADVARSLER ; Føtal toksicitet ).
For tidlig lukning af føtal ductus arteriosus
Brug af NSAID'er, inklusive VOLTAREN 100 mg, ved ca. 30 ugers graviditet eller senere i graviditeten øger risikoen for for tidlig lukning af fosterets ductus arteriosus.
Oligohydramnios/neonatal nyreinsufficiens
Brug af NSAID'er ved omkring 20 ugers graviditet eller senere i graviditeten har været forbundet med tilfælde af føtal nyreinsufficiens, der fører til oligohydramnios og i nogle tilfælde neonatal nyreinsufficiens.
Der er ingen tilstrækkelige og velkontrollerede undersøgelser af VOLTAREN 100mg hos gravide kvinder.
Data fra observationsstudier vedrørende potentielle embryo-føtale risici ved NSAID-brug hos kvinder i graviditetens første eller andet trimester er ikke konklusive.
dyrereproduktionsundersøgelser blev der ikke observeret tegn på teratogenicitet hos mus, rotter eller kaniner, der fik diclofenac i løbet af organogeneseperioden i doser op til henholdsvis ca. 0,5, 0,5 og 1 gange den maksimale anbefalede humane dosis (MRHD) af VOLTAREN , 200 mg/dag, på trods af tilstedeværelsen af maternel og føtal toksicitet ved disse doser (se Data ).
Baseret på offentliggjorte dyredata har prostaglandiner vist sig at have en vigtig rolle i endometrievaskulær permeabilitet, blastocystimplantation og decidualisering. I dyreforsøg resulterede administration af prostaglandinsyntesehæmmere, såsom diclofenac, i øget præ- og postimplantationstab. Prostaglandiner har også vist sig at have en vigtig rolle i fosterets nyreudvikling. I publicerede dyreforsøg er prostaglandinsyntesehæmmere blevet rapporteret at hæmme nyreudviklingen, når de administreres i klinisk relevante doser.
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort for de(n) angivne population(er) er ukendt. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre ugunstige udfald. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 % til 4 % og 15 % til 20 %.
Kliniske overvejelser
Fetale/neonatale bivirkninger
For tidlig lukning af føtal Ductus Arteriosus:
Undgå brug af NSAID'er hos kvinder ved ca. 30. svangerskabsuge og senere i graviditeten, da NSAID'er, inklusive VOLTAREN, kan forårsage for tidlig lukning af føtal ductus arteriosus (se ADVARSLER ; Føtal toksicitet ).
Oligohydramnios/neonatal nyreinsufficiens:
Hvis et NSAID er nødvendigt ved ca. 20 ugers graviditet eller senere i graviditeten, skal du begrænse brugen til den laveste effektive dosis og kortest mulige varighed. Hvis VOLTAREN 50 mg behandling strækker sig ud over 48 timer, overvej monitorering med ultralyd for oligohydramnios. Hvis der opstår oligohydramnios, seponeres VOLTAREN og følges op i henhold til klinisk praksis (se ADVARSLER ; Føtal toksicitet ).
Data
Menneskelige data
For tidlig lukning af føtal Ductus Arteriosus:
Publiceret litteratur rapporterer, at brugen af NSAID'er ved ca. 30 ugers graviditet og senere i graviditeten kan forårsage for tidlig lukning af føtal ductus arteriosus.
Oligohydramnios/neonatal nyreinsufficiens:
Publicerede undersøgelser og post-marketing rapporter beskriver moderbrug af NSAID ved ca. 20 ugers svangerskab eller senere i graviditeten forbundet med føtal nyreinsufficiens, der fører til oligohydramnios og i nogle tilfælde neonatal nyreinsufficiens. Disse uønskede resultater ses i gennemsnit efter dage til ugers behandling, selvom oligohydramnios sjældent er blevet rapporteret så snart som 48 timer efter NSAID-start. I mange tilfælde, men ikke alle, var faldet i fostervand forbigående og reversibelt med ophør af lægemidlet. Der har været et begrænset antal case-rapporter af moderbrug af NSAID og neonatal nyreinsufficiens uden oligohydramnios, hvoraf nogle var irreversible. Nogle tilfælde af neonatal nyredysfunktion krævede behandling med invasive procedurer, såsom udvekslingstransfusion eller dialyse.
Metodiske begrænsninger af disse postmarketing undersøgelser og rapporter omfatter mangel på en kontrolgruppe; begrænset information om dosis, varighed og tidspunkt for lægemiddeleksponering; og samtidig brug af anden medicin. Disse begrænsninger udelukker etablering af et pålideligt estimat af risikoen for uønskede føtale og neonatale resultater ved brug af NSAID hos moderen. Da de offentliggjorte sikkerhedsdata om neonatale udfald hovedsageligt involverede præmature spædbørn, er generaliserbarheden af visse rapporterede risici for fuldbårne spædbørn, der er udsat for NSAID'er gennem moderbrug, usikker.
Dyredata
Reproduktions- og udviklingsundersøgelser på dyr viste, at administration af diclofenacnatrium under organogenese ikke fremkaldte teratogenicitet på trods af induktion af maternel toksicitet og føtal toksicitet hos mus ved orale doser op til 20 mg/kg/dag (ca. 0,5 gange den maksimalt anbefalede humane dosis [MRHD) ] af VOLTAREN, 200 mg/dag, baseret på kropsoverfladeareal (BSA) sammenligning), og hos rotter og kaniner ved orale doser op til 10 mg/kg/dag (henholdsvis ca. 0,5 og 1 gange MRHD baseret på BSA) sammenligning). I en undersøgelse, hvor gravide rotter fik oralt 2 eller 4 mg/kg diclofenac (0,1 og 0,2 gange MRHD baseret på BSA) fra drægtighedsdag 15 til og med diegivningsdag 21, blev der noteret signifikant maternel toksicitet (peritonitis, dødelighed). Disse modertoksiske doser var forbundet med dystoci, forlænget graviditet, reduceret fostervægt og -vækst og nedsat fosteroverlevelse. Diclofenac har vist sig at krydse placentabarrieren hos mus, rotter og mennesker.
Arbejde eller levering
Der er ingen undersøgelser af virkningerne af VOLTAREN under fødsel eller fødsel. I dyreforsøg hæmmer NSAID'er, herunder diclofenac, prostaglandinsyntesen, forårsager forsinket fødsel og øger forekomsten af dødfødsler.
Ammende mødre
Risikooversigt
Baseret på tilgængelige data kan diclofenac forekomme i modermælk. De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for VOLTAREN og eventuelle negative virkninger på det ammede spædbarn fra VOLTAREN 100 mg eller fra den underliggende moderens tilstand.
Data
En kvinde behandlet oralt med et diclofenacsalt, 150 mg/dag, havde et mælkediclofenacniveau på 100 mcg/l, svarende til en spædbarnsdosis på ca. 0,03 mg/kg/dag. Diclofenac var ikke påviselig i modermælk hos 12 kvinder, der brugte diclofenac (efter enten 100 mg/dag oralt i 7 dage eller en enkelt 50 mg intramuskulær dosis administreret i den umiddelbare postpartum periode).
Pædiatrisk brug
Sikkerhed og effektivitet hos pædiatriske patienter er ikke blevet fastslået.
Geriatrisk brug
Ældre patienter, sammenlignet med yngre patienter, har større risiko for NSAID-associerede alvorlige kardiovaskulære, gastrointestinale og/eller renale bivirkninger. Hvis den forventede fordel for den ældre patient opvejer disse potentielle risici, skal du begynde at dosere i den lave ende af doseringsområdet og overvåge patienterne for bivirkninger (se ADVARSLER ; Kardiovaskulære trombotiske hændelser , Gastrointestinale Blødning, ulceration og perforation, hepatotoksicitet, nyretoksicitet og hyperkaliæmi, FORHOLDSREGLER; Laboratorieovervågning).
Diclofenac er kendt for at udskilles væsentligt af nyrerne, og risikoen for bivirkninger af dette lægemiddel kan være større hos patienter med nedsat nyrefunktion. Da ældre patienter er mere tilbøjelige til at have nedsat nyrefunktion, bør der udvises forsigtighed ved dosisvalg, og det kan være nyttigt at overvåge nyrefunktionen (se KLINISK FARMAKOLOGI , BIVIRKNINGER ).
OVERDOSIS
Ingen oplysninger givet
KONTRAINDIKATIONER
VOLTAREN® er kontraindiceret til følgende patienter:
- Kendt overfølsomhed (f.eks. anafylaktiske reaktioner og alvorlige hudreaktioner) over for diclofenac eller andre komponenter i lægemidlet (se ADVARSLER ; Anafylaktiske reaktioner , Alvorlige hudreaktioner ).
- Anamnese med astma, nældefeber eller andre allergiske reaktioner efter indtagelse af aspirin eller andre NSAID'er. Alvorlige, nogle gange fatale, anafylaktiske reaktioner på NSAID'er er blevet rapporteret hos sådanne patienter (se ADVARSLER ; Anafylaktisk reaktion , Forværring af astma relateret til aspirinfølsomhed ).
- I forbindelse med koronar bypassoperation (CABG) (se ADVARSLER ; Kardiovaskulære trombotiske hændelser ).
KLINISK FARMAKOLOGI
Handlingsmekanisme
Diclofenac har smertestillende, antiinflammatoriske og antipyretiske egenskaber.
Virkningsmekanismen for VOLTAREN 100 mg, ligesom andre NSAID'er, er ikke fuldstændigt forstået, men involverer hæmning af cyclooxygenase (COX-1 og COX-2).
Diclofenac er en potent hæmmer af prostaglandinsyntese in vitro. Diclofenac-koncentrationer opnået under behandling har fremkaldt in vivo-effekter. Prostaglandiner sensibiliserer afferente nerver og forstærker virkningen af bradykinin til at inducere smerte i dyremodeller. Prostaglandiner er mediatorer af inflammation. Fordi diclofenac er en hæmmer af prostaglandinsyntese, kan dets virkemåde skyldes et fald i prostaglandiner i perifert væv.
Farmakokinetik
Absorption
Diclofenac absorberes 100 % efter oral administration sammenlignet med intravenøs (IV) administration målt ved uringenvinding. Men på grund af first-pass metabolisme er kun omkring 50 % af den absorberede dosis systemisk tilgængelig (se tabel 1). Mad har ingen signifikant effekt på omfanget af diclofenac-absorption. Der er dog sædvanligvis en forsinkelse i begyndelsen af absorptionen på 1 til 4,5 timer og en reduktion i maksimale plasmaniveauer på mindre end 20 %.
Fordeling
Det tilsyneladende fordelingsvolumen (V/F) af diclofenacnatrium er 1,4 l/kg.
Diclofenac er mere end 99 % bundet til humane serumproteiner, primært til albumin. Serumproteinbinding er konstant over koncentrationsområdet (0,15 til 105 mcg/ml) opnået med anbefalede doser.
Diclofenac diffunderer ind og ud af ledvæsken. Diffusion ind i leddet sker, når plasmaniveauerne er højere end i ledvæsken, hvorefter processen vender, og ledvæskeniveauerne er højere end plasmaniveauerne. Det vides ikke, om diffusion ind i leddet spiller en rolle for effektiviteten af diclofenac.
Elimination
Metabolisme
Fem diclofenac-metabolitter er blevet identificeret i humant plasma og urin. Metabolitterne omfatter 4'Âhydroxy-, 5-hydroxy-, 3'-hydroxy-, 4',5-dihydroxy- og 3'hydroxy-4'-methoxy-diclofenac. Den vigtigste diclofenac-metabolit, 4'-hydroxy-diclofenac, har meget svag farmakologisk aktivitet. Dannelsen af 4’hydroxydiclofenac medieres primært af CYP2C9. Både diclofenac og dets oxidative metabolitter gennemgår glucuronidering eller sulfatering efterfulgt af galdeudskillelse. Acylglucuronidering medieret af UGT2B7 og oxidation medieret af CYP2C8 kan også spille en rolle i diclofenac metabolisme. CYP3A4 er ansvarlig for dannelsen af mindre metabolitter, 5-hydroxy- og 3’-hydroxy-diclofenac. Hos patienter med nyreinsufficiens var maksimale koncentrationer af metabolitterne 4'-hydroxy- og 5-hydroxy-diclofenac ca. 50 % og 4 % af moderstoffet efter en enkelt oral dosering sammenlignet med 27 % og 1 % hos normale raske forsøgspersoner.
Udskillelse
Diclofenac elimineres gennem metabolisme og efterfølgende urin- og galdeudskillelse af glucuronid og metabolitternes sulfatkonjugater. Lidt eller ingen fri uændret diclofenac udskilles i urinen. Ca. 65 % af dosis udskilles i urinen og ca. 35 % i galden som konjugater af uændret diclofenac plus metabolitter. Da renal elimination ikke er en signifikant eliminationsvej for uændret diclofenac, er dosisjustering hos patienter med mild til moderat nyreinsufficiens ikke nødvendig. Den terminale halveringstid for uændret diclofenac er ca. 2 timer.
Særlige Populationer
Pædiatrisk
Farmakokinetikken af VOLTAREN er ikke blevet undersøgt hos pædiatriske patienter.
Race
Farmakokinetiske forskelle på grund af race er ikke blevet identificeret.
Nedsat leverfunktion
Levermetabolisme tegner sig for næsten 100 % af VOLTAREN 100 mg eliminering, så patienter med leversygdom kan have behov for reducerede doser af VOLTAREN 50 mg sammenlignet med patienter med normal leverfunktion.
Nedsat nyrefunktion
Diclofenacs farmakokinetik er blevet undersøgt hos personer med nyreinsufficiens. Der er ikke påvist nogen forskelle i diclofenacs farmakokinetik i undersøgelser af patienter med nedsat nyrefunktion. Hos patienter med nedsat nyrefunktion (inulinclearance 60 til 90, 30 til 60 og mindre end 30 ml/min; N = 6 i hver gruppe) var værdierne for area under kurven (AUC) og eliminationshastigheden sammenlignelige med dem hos raske forsøgspersoner .
Lægemiddelinteraktionsundersøgelser
Voriconazol
Når det administreres sammen med voriconazol (hæmmer af CYP2C9, 2C19 og 3A4 enzym), steg Cmax og AUC for diclofenac med henholdsvis 114 % og 78 % (se DRUGSINTERAKTIONER ).
Aspirin
Når NSAID'er blev administreret sammen med aspirin, blev proteinbindingen af NSAID'er reduceret, selvom clearance af frit NSAID ikke blev ændret. Den kliniske betydning af denne interaktion er ikke kendt. Se tabel 2 for klinisk signifikante lægemiddelinteraktioner af NSAID'er med aspirin (se DRUGSINTERAKTIONER ).
PATIENTOPLYSNINGER
Medicinvejledning
VOLTAREN® (Vowl-tar-uhn) (diclofenacnatrium) overtrukne tabletter
Hvad er den vigtigste information, jeg bør vide om medicin kaldet ikke-steroide antiinflammatoriske lægemidler (NSAID'er)?
NSAID'er kan forårsage alvorlige bivirkninger, herunder:
- Øget risiko for et hjerteanfald eller slagtilfælde, der kan føre til døden. Denne risiko kan opstå tidligt i behandlingen og kan øge:
- med stigende doser af NSAID'er
- ved længere brug af NSAID
Tag ikke NSAID'er lige før eller efter en hjerteoperation kaldet "koronararterie bypassgraft (CABG)." Undgå at tage NSAID'er efter et nyligt hjerteanfald, medmindre din læge fortæller dig det. Du kan have en øget risiko for endnu et hjerteanfald, hvis du tager NSAID'er efter et nyligt hjerteanfald.
- Øget risiko for blødning, sår og rifter (perforering) af spiserøret (rør der fører fra munden til maven), mave og tarme:
- når som helst under brug
- uden advarselssymptomer
- der kan forårsage død
Risikoen for at få et sår eller blødning øges med:
- tidligere historie med mavesår, eller mave- eller tarmblødninger ved brug af NSAID'er
- tager medicin kaldet "kortikosteroider", "antikoagulantia", "SSRI" eller "SNRI"
- stigende doser af NSAID'er
- længere brug af NSAID
- rygning
- drikke alkohol
- ældre alder
- dårligt helbred
- fremskreden leversygdom
- blødningsproblemer
NSAID bør kun anvendes:
- præcis som foreskrevet
- ved den lavest mulige dosis til din behandling
- for den kortest nødvendige tid
Hvad er NSAID'er?
NSAID'er bruges til at behandle smerter og rødme, hævelse og varme (betændelse) fra medicinske tilstande, såsom forskellige typer gigt, menstruationssmerter og andre typer kortvarige smerter.
Hvem bør ikke tage NSAID'er?
Tag ikke NSAID'er:
- hvis du havde et astmaanfald, nældefeber eller anden allergisk reaktion med aspirin eller andre NSAID'er.
- lige før eller efter en bypassoperation.
Inden du tager NSAID'er, skal du fortælle din læge om alle dine medicinske tilstande, herunder hvis du:
- har lever- eller nyreproblemer
- har forhøjet blodtryk
- har astma
- er gravid eller planlægger at blive gravid. Hvis du tager NSAID'er omkring 20 uger af graviditeten eller senere, kan det skade dit ufødte barn. Hvis du har brug for at tage NSAID'er i mere end 2 dage, når du er mellem 20 og 30 uger af graviditeten, skal din læge muligvis overvåge mængden af væske i din livmoder omkring din baby. Du bør ikke tage NSAID'er efter omkring 30 ugers graviditet.
- ammer eller planlægger at amme.
Fortæl din sundhedsudbyder om al den medicin, du tager, inklusive receptpligtig eller håndkøbsmedicin, vitaminer eller naturlægemidler. NSAID'er og nogle andre lægemidler kan interagere med hinanden og forårsage alvorlige bivirkninger. Begynd ikke at tage ny medicin uden først at tale med din læge.
Hvad er de mulige bivirkninger af NSAID'er?
NSAID'er kan forårsage alvorlige bivirkninger, herunder:
Se "Hvad er den vigtigste information, jeg bør vide om medicin kaldet ikke-steroide antiinflammatoriske lægemidler (NSAID'er)?"
- nyt eller værre forhøjet blodtryk
- hjertefejl
- leverproblemer, herunder leversvigt
- nyreproblemer, herunder nyresvigt
- lavt antal røde blodlegemer (anæmi)
- livstruende hudreaktioner
- livstruende allergiske reaktioner
- Andre bivirkninger af NSAID omfatter: mavesmerter, forstoppelse, diarré, gas, halsbrand, kvalme, opkastning, svimmelhed
Få akut hjælp med det samme, hvis du har nogle af følgende symptomer:
- åndenød eller åndedrætsbesvær
- brystsmerter
- svaghed i en del eller side af din krop
- utydelig tale
- hævelse af ansigt eller hals
Stop med at tage dit NSAID og ring til din læge med det samme, hvis du får nogle af følgende symptomer:
- kvalme
- opkast blod
- mere træt eller svagere end normalt
- diarré
- kløe
- der er blod i din afføring, eller den er sort og klistret som tjære
- din hud eller øjne ser gule ud
- fordøjelsesbesvær eller mavesmerter
- influenzalignende symptomer
- usædvanlig vægtøgning
- hududslæt eller blærer med feber
- hævelse af arme og ben, hænder og fødder
Hvis du tager for meget af dit NSAID, skal du kontakte din læge eller få lægehjælp med det samme.
Disse er ikke alle de mulige bivirkninger af NSAID'er. For mere information, spørg din læge eller apotek om NSAID'er. Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA1088
Andre oplysninger om NSAID'er.
- Aspirin er et NSAID-lægemiddel, men det øger ikke chancen for et hjerteanfald. Aspirin kan forårsage blødninger i hjernen, maven og tarmene. Aspirin kan også forårsage sår i maven og tarmene.
- Nogle NSAID'er sælges i lavere doser uden recept (håndkøb). Tal med din læge, før du bruger NSAID'er i mere end 10 dage.
Generel information om sikker og effektiv brug af NSAID'er.
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en medicinvejledning. Brug ikke NSAID til en tilstand, som det ikke er ordineret til. Giv ikke NSAID til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Hvis du ønsker mere information om NSAID'er, så tal med din læge. Du kan bede din apoteker eller sundhedsplejerske om oplysninger om NSAID'er, der er skrevet til sundhedspersonale.
Denne medicinvejledning er godkendt af US Food and Drug Administration. Revideret: april 2021
