Imuran 50mg, 25mg Azathioprine Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Imuran, og hvordan bruges det?
Imuran 25mg er en receptpligtig medicin, der bruges til at behandle symptomerne på leddegigt og som forebyggelse af transplantatafstødning. Imuran kan bruges alene eller sammen med anden medicin.
Imuran 25mg tilhører en klasse af lægemidler kaldet DMARDs, immunmodulatorer; Immunsuppressiva.
Hvad er de mulige bivirkninger af Imuran?
Imuran 25mg kan forårsage alvorlige bivirkninger, herunder:
- feber,
- hævede kirtler,
- kropssmerter,
- nattesved,
- har det ikke godt,
- bleg hud,
- udslæt,
- let blå mærker eller blødning,
- kolde hænder og fødder,
- svimmelhed,
- stakåndet,
- smerter i din øvre mave, der kan sprede sig til din skulder,
- mæthed efter kun at have spist en lille mængde,
- vægttab,
- tegn på infektion (feber, kulderystelser, svaghed, influenzasymptomer, ondt i halsen, hoste, smerter eller svie, når du tisser),
- svær kvalme,
- opkastning,
- diarré,
- hurtige hjerteslag,
- mørk urin, og
- gulfarvning af huden eller øjnene (gulsot)
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Imuran 50mg omfatter:
- kvalme,
- diarré,
- mavesmerter,
- hårtab, og
- udslæt
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Imuran. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
Malignitet
Kronisk immunsuppression med IMURAN, en purin-antimetabolit, øger risikoen for malignitet hos mennesker. Rapporter om malignitet omfatter post-transplantation lymfom og hepatosplenisk T-celle lymfom (HSTCL) hos patienter med inflammatorisk tarmsygdom. Læger, der bruger dette lægemiddel, bør være meget fortrolige med denne risiko såvel som med det mutagene potentiale for både mænd og kvinder og med mulige hæmatologiske toksiciteter. Læger bør informere patienter om risikoen for malignitet med IMURAN. Se ADVARSLER .
BESKRIVELSE
IMURAN (azathioprin), en immunsuppressiv antimetabolit, er tilgængelig i tabletform til oral administration. Hver tablet med delekærv indeholder 50 mg azathioprin og de inaktive ingredienser laktose, magnesiumstearat, kartoffelstivelse, povidon og stearinsyre.
Azathioprin er kemisk 6-[(1-methyl-4-nitro-1H-imidazol-5-yl)thio]-1H-purin. Strukturformlen for azathioprin er:
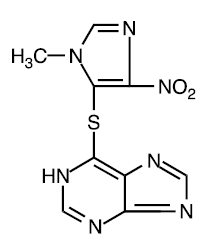
Det er et imidazolylderivat af 6-mercaptopurin, og mange af dets biologiske virkninger svarer til moderforbindelsens.
Azathioprin er uopløseligt i vand, men kan opløses ved tilsætning af en molær ækvivalent alkali. Azathioprin er stabil i opløsning ved neutral eller sur pH, men hydrolyse til mercaptopurin forekommer i overskud af natriumhydroxid (0,1 N), især ved opvarmning. Omdannelse til mercaptopurin sker også i nærvær af sulfhydrylforbindelser såsom cystein, glutathion og hydrogensulfid.
INDIKATIONER
IMURAN er indiceret som et supplement til forebyggelse af afstødning ved nyrehomotransplantation. Det er også indiceret til behandling af aktiv reumatoid arthritis for at reducere tegn og symptomer.
Renal homotransplantation
IMURAN er indiceret som et supplement til forebyggelse af afstødning ved nyrehomotransplantation. Erfaring med over 16.000 transplantationer viser en 5-årig patientoverlevelse på 35 % til 55 %, men dette afhænger af donor, match for HLA antigener, antidonor eller anti-B-celle alloantigen antistof og andre variabler. Effekten af IMURAN på disse variabler er ikke blevet testet i kontrollerede forsøg.
Rheumatoid arthritis
IMURAN er indiceret til behandling af aktiv reumatoid arthritis (RA) for at reducere tegn og symptomer. Aspirin, ikke-steroide antiinflammatoriske lægemidler og/eller lavdosis glukokortikoider kan fortsættes under behandling med IMURAN. Den kombinerede brug af IMURAN 25mg med sygdomsmodificerende anti-rheumatiske lægemidler (DMARDs) er ikke blevet undersøgt for hverken ekstra fordel eller uventede bivirkninger. Brugen af IMURAN sammen med disse midler kan ikke anbefales.
DOSERING OG ADMINISTRATION
TPMT-TEST KAN IKKE ERSTATTE FOR OVERVÅGNING AF KOMPLET BLODTAL (CBC) HOS PATIENTER, DER MODTAGER IMURAN. TPMT genotyping eller fænotyping kan bruges til at identificere patienter med manglende eller reduceret TPMT aktivitet. Patienter med lav eller manglende TPMT-aktivitet har en øget risiko for at udvikle alvorlig, livstruende myelotoksicitet fra IMURAN, hvis der gives konventionelle doser. Læger kan overveje alternative behandlinger til patienter, der har lav eller manglende TPMT-aktivitet (homozygot for ikke-funktionelle alleler). IMURAN 25 mg bør administreres med forsigtighed til patienter med én ikke-funktionel allel (heterozygot), som er i risiko for nedsat TPMT-aktivitet, som kan føre til toksicitet, hvis der gives konventionelle doser. Dosisreduktion anbefales til patienter med nedsat TPMT-aktivitet. Tidlig seponering af lægemidlet kan overvejes hos patienter med unormale CBC-resultater, som ikke reagerer på dosisreduktion.
Renal homotransplantation
Den dosis af IMURAN 50 mg, der kræves for at forhindre afstødning og minimere toksicitet, vil variere med individuelle patienter; dette kræver omhyggelig styring. Startdosis er sædvanligvis 3 til 5 mg/kg dagligt, begyndende på tidspunktet for transplantationen. IMURAN gives normalt som en enkelt daglig dosis på dagen for, og i et mindretal af tilfældene 1 til 3 dage før, transplantationen. Dosisreduktion til vedligeholdelsesniveauer på 1 til 3 mg/kg dagligt er normalt mulig. Dosis af IMURAN 50 mg bør ikke øges til toksiske niveauer på grund af truende afstødning. Seponering kan være nødvendig på grund af alvorlig hæmatologisk eller anden toksicitet, selvom afvisning af homotransplantatet kan være en konsekvens af medicinabstinenser.
Rheumatoid arthritis
IMURAN 50 mg gives normalt på daglig basis. Startdosis bør være ca. 1,0 mg/kg (50 til 100 mg) givet som en enkelt dosis eller to gange dagligt. Dosis kan øges, begyndende ved 6 til 8 uger og derefter trinvist med 4-ugers intervaller, hvis der ikke er alvorlige toksiciteter, og hvis den initiale respons er utilfredsstillende. Dosisstigninger bør være 0,5 mg/kg dagligt, op til en maksimal dosis på 2,5 mg/kg pr. dag. Terapeutisk respons opstår efter flere ugers behandling, sædvanligvis 6 til 8; et tilstrækkeligt forsøg bør vare mindst 12 uger. Patienter, der ikke er forbedret efter 12 uger, kan betragtes som refraktære. IMURAN 50 mg kan fortsættes i lang tid hos patienter med klinisk respons, men patienterne bør overvåges omhyggeligt, og gradvis dosisreduktion bør forsøges for at reducere risikoen for toksicitet.
Vedligeholdelsesterapi bør være ved den laveste effektive dosis, og den givne dosis kan sænkes dekrementelt med ændringer på 0,5 mg/kg eller ca. 25 mg dagligt hver 4. uge, mens anden behandling holdes konstant. Den optimale varighed af vedligeholdelse IMURAN 50mg er ikke blevet bestemt. IMURAN kan seponeres brat, men forsinkede virkninger er mulige.
Brug ved nyreinsufficiens
Relativt oliguriske patienter, især dem med tubulær nekrose i den umiddelbare postcadaveriske transplantationsperiode, kan have forsinket clearance af IMURAN eller dets metabolitter, kan være særligt følsomme over for dette lægemiddel og får normalt lavere doser.
Procedurer for korrekt håndtering og bortskaffelse af dette immunsuppressive antimetabolitlægemiddel bør overvejes. Der er udgivet flere retningslinjer om dette emne.25-31 Der er ingen generel enighed om, at alle de procedurer, der anbefales i retningslinjerne, er nødvendige eller passende.
HVORDAN LEVERET
50 mg overlappende cirkelformede, gule til råhvide tabletter med delekærv præget med "IMURAN" og "50" på hver tablet; flaske 100 ( NDC 65483-590-10).
Opbevares ved 15° til 25°C (59° til 77°F) på et tørt sted og beskyt mod lys.
REFERENCER
25. Anbefalinger for sikker håndtering af parenterale antineoplastiske lægemidler. Washington, DC: Sikkerhedsafdelingen; Klinisk Center Apoteksafdeling og Kræftsygepleje, National Institute of Health; 1992. US Department of Health and Human Services. Public Health Service Publication NIH 92-2621.
26. AMA Council on Scientific Affairs. Retningslinjer for håndtering af parenterale antineoplastik. JAMA. 1985; 253:15901592.
27. National undersøgelseskommission for cytotoksisk eksponering. Anbefalinger til håndtering af cytotoksiske midler. 1987. Tilgængelig fra Louis P. Jeffrey, formand, National Study Commission on Cytotoxic Exposure. Massachusetts College of Pharmacy and Allied Health Sciences, 179 Longwood Avenue, Boston, MA 02115.
28. Clinical Oncological Society of Australia. Retningslinjer og anbefalinger for sikker håndtering af antineoplastiske midler. Med J Aust. 1983; 1:426-428.
29. Jones RB, Frank R, Mass T. Sikker håndtering af kemoterapeutiske midler: en rapport fra Mount Sinai Medical Center. CA Cancer J for klinikere. 1983; 33:258-263.
30. American Society of Hospital Pharmacists. ASHP teknisk assistance bulletin om håndtering af cytotoksiske og farlige lægemidler. Am J Hosp Pharm. 1990; 47:1033-1049.
31. Yodaiken RE, Bennett D. OSHA Work-Practice retningslinjer for personale, der beskæftiger sig med cytotoksiske (antineoplastiske) lægemidler. Am J Hosp Pharm, 1996; 43:1193-1204.
Fremstillet af Pharmaceutics International, Inc. Hunt Valley, MD 21031 for Prometheus Laboratories Inc. San Diego, CA 92121. Revideret: feb 2014
BIVIRKNINGER
De vigtigste og potentielt alvorlige toksiske virkninger af IMURAN er hæmatologiske og gastrointestinale. Risikoen for sekundær infektion og malignitet er også betydelig (se ADVARSLER ). Hyppigheden og sværhedsgraden af bivirkninger afhænger af dosis og varighed af IMURAN samt af patientens underliggende sygdom eller samtidige behandlinger. Forekomsten af hæmatologisk toksicitet og neoplasi hos grupper af nyrehomograft-recipienter er signifikant højere end i undersøgelser, der anvender IMURAN 25 mg til reumatoid arthritis. Den relative forekomst i kliniske undersøgelser er opsummeret nedenfor:
Hæmatologisk
Leukopeni og/eller trombocytopeni er dosisafhængige og kan forekomme sent i behandlingsforløbet med IMURAN. Dosisreduktion eller midlertidig seponering kan resultere i reversering af disse toksiciteter. Infektion kan forekomme som en sekundær manifestation af knoglemarvssuppression eller leukopeni, men forekomsten af infektion ved nyrehomotransplantation er 30 til 60 gange højere end ved reumatoid arthritis. Anæmi, herunder makrocytisk anæmi og/eller blødning, er blevet rapporteret.
TPMT-genotypning eller fænotypning kan hjælpe med at identificere patienter med lav eller fraværende TPMT-aktivitet (homozygot for ikke-funktionelle alleler), som har øget risiko for alvorlig, livstruende myelosuppression fra IMURAN. Se KLINISK FARMAKOLOGI , ADVARSLER og FORHOLDSREGLER : Laboratorieprøver . Dødsfald forbundet med pancytopeni er blevet rapporteret hos patienter med manglende TPMT-aktivitet, der fik azathioprin.6,20
Gastrointestinale
Kvalme og opkastning kan forekomme inden for de første par måneder af behandlingen med IMURAN 50 mg og forekom hos ca. 12 % af 676 patienter med reumatoid arthritis. Hyppigheden af maveforstyrrelser kan ofte reduceres ved administration af lægemidlet i opdelte doser og/eller efter måltider. Men hos nogle patienter kan kvalme og opkastning være alvorlig og kan være ledsaget af symptomer som diarré, feber, utilpashed og myalgi (se FORHOLDSREGLER ). Opkastning med mavesmerter kan forekomme sjældent med en overfølsomhedsbetændelse i pancreatitis. Levertoksicitet manifesteret ved forhøjelse af serum alkalisk phosphatase, bilirubin og/eller serumtransaminaser vides at forekomme efter brug af azathioprin, primært hos allograft-recipienter. Levertoksicitet har været ualmindelig (mindre end 1%) hos patienter med reumatoid arthritis. Hepatotoksicitet efter transplantation forekommer oftest inden for 6 måneder efter transplantation og er generelt reversibel efter afbrydelse af IMURAN. En sjælden, men livstruende hepatisk venookklusiv sygdom forbundet med kronisk administration af azathioprin er blevet beskrevet hos transplanterede patienter og hos en patient, der fik IMURAN for panuveitis.21,22,23 Periodisk måling af serumtransaminaser, alkalisk fosfatase og bilirubin er indiceret til tidlig påvisning af hepatotoksicitet. Hvis der er klinisk mistanke om hepatisk venookklusiv sygdom, bør IMURAN seponeres permanent.
Andre
Yderligere bivirkninger af lav frekvens er blevet rapporteret. Disse omfatter hududslæt, alopeci, feber, artralgi, diarré, steatorrhea, negativ nitrogenbalance, reversibel interstitiel pneumonitis, hepatosplenisk T-celle lymfom (se ADVARSLER – Malignitet ), og Sweets syndrom (akut febril neutrofil dermatose).
DRUGSINTERAKTIONER
Brug sammen med Allopurinol
En af veje til inaktivering af azathioprin hæmmes af allopurinol. Patienter, der får IMURAN 50 mg og allopurinol samtidigt, bør have en dosisreduktion på 50 mg IMURAN til ca. 1/3 til 1/4 af den sædvanlige dosis. Det anbefales, at en yderligere dosisreduktion eller alternative behandlinger overvejes til patienter med lav eller manglende TPMT-aktivitet, der får IMURAN 50 mg og allopurinol, fordi både TPMT- og XO-inaktiveringsveje er påvirket. Se KLINISK FARMAKOLOGI , ADVARSLER , FORHOLDSREGLER : Laboratorieprøver og BIVIRKNINGER sektioner.
Brug sammen med aminosalicylater
Der er in vitro-evidens for, at aminosalicylatderivater (f.eks. sulfasalazin, mesalazin eller olsalazin) hæmmer TPMT-enzymet. Samtidig brug af disse midler og IMURAN 50 mg bør ske med forsigtighed.
Brug sammen med andre midler, der påvirker myelopoese
Lægemidler, som kan påvirke leukocytproduktionen, herunder cotrimoxazol, kan føre til overdreven leukopeni, især hos nyretransplanterede.
Brug sammen med angiotensin-konverterende enzymhæmmere
Brugen af angiotensin-konverterende enzymhæmmere til at kontrollere hypertension hos patienter på azathioprin er blevet rapporteret at inducere anæmi og svær leukopeni.
Brug sammen med Warfarin
IMURAN kan hæmme den antikoagulerende virkning af warfarin.
Brug sammen med ribavirin
Brugen af ribavirin til hepatitis C hos patienter, der får azathioprin, er blevet rapporteret at inducere alvorlig pancytopeni og kan øge risikoen for azathioprin-relateret myelotoksicitet. Inosinmonophosphatdehydrogenase (IMDH) er nødvendig for en af azathioprins metaboliske veje. Ribavirin er kendt for at hæmme IMDH, hvilket fører til akkumulering af en azathioprin-metabolit, 6-methylthioionosinmonophosphat (6MTITP), som er forbundet med myelotoksicitet (neutropeni, trombocytopeni og anæmi). Patienter, der får azathioprin sammen med ribavirin, skal have fuldstændige blodtællinger, inklusive trombocyttal, overvåget ugentligt i den første måned, to gange om måneden i den anden og tredje måned af behandlingen, derefter månedligt eller oftere, hvis dosis eller andre behandlingsændringer er nødvendige.
REFERENCER
6. Data på fil, Prometheus Laboratories Inc.
20. Schutz E, Gummert J, Mohr F, Oellerich M. Azathioprin-induceret myelosuppression hos thiopurinmethyltransferase-mangelfulde hjertetransplantationspatienter. Lancet. 1993; 341:436.
21. Læs AE, Wiesner RH, LaBrecque DR, et al. Hepatisk venookklusiv sygdom forbundet med nyretransplantation og azathioprinbehandling. Ann Praktikant Med. 1986; 104:651-655.
22. Katzka DA, Saul SH, Jorkasky D, et al. Azathioprin og hepatisk veno-okklusiv sygdom hos nyretransplanterede patienter. Gastroenterologi. 1986; 90:446-454.
23. Weitz H, Gokel JM, Loeshke K, et al. Veno-okklusiv sygdom i leveren hos patienter, der får immunsuppressiv behandling. Virchows Arch A Pathol Anat Histol. 1982; 395:245-256.
ADVARSLER
Malignitet
Patienter, der får immunsuppressiva, inklusive IMURAN 50mg, har øget risiko for at udvikle lymfom og andre maligne sygdomme, især i huden. Læger bør informere patienter om risikoen for malignitet med IMURAN. Som sædvanligt for patienter med øget risiko for hudkræft bør eksponering for sollys og ultraviolet lys begrænses ved at bære beskyttelsestøj og bruge en solcreme med en høj beskyttelsesfaktor.
Efter transplantation
Nyretransplanterede patienter er kendt for at have en øget risiko for malignitet, overvejende hudkræft og retikulumcelle- eller lymfomatøse tumorer. Risikoen for post-transplantation lymfomer kan være øget hos patienter, som får aggressiv behandling med immunsuppressive lægemidler, herunder IMURAN. Derfor bør immunsuppressiv lægemiddelbehandling opretholdes på de laveste effektive niveauer.
Rheumatoid arthritis
Der findes oplysninger om risikoen for malignitet ved brug af IMURAN 50mg til reumatoid arthritis (se BIVIRKNINGER ). Det har ikke været muligt at definere den præcise risiko for malignitet på grund af IMURAN. Dataene tyder på, at risikoen kan være forhøjet hos patienter med reumatoid arthritis, dog lavere end for nyretransplanterede patienter. Akut myeloid leukæmi samt solide tumorer er imidlertid blevet rapporteret hos patienter med leddegigt, som har fået IMURAN.
Inflammatorisk tarmsygdom
Postmarketing tilfælde af hepatosplenisk T-celle lymfom (HSTCL), en sjælden type T-celle lymfom, er blevet rapporteret hos patienter behandlet med IMURAN. Disse tilfælde har haft et meget aggressivt sygdomsforløb og har været dødelige. Størstedelen af rapporterede tilfælde er forekommet hos patienter med Crohns sygdom eller colitis ulcerosa, og størstedelen var hos unge og unge voksne mænd. Nogle af patienterne blev behandlet med IMURAN som monoterapi, og nogle havde modtaget samtidig behandling med en TNFα-blokker ved eller før diagnosen. Sikkerheden og effekten af IMURAN 25 mg til behandling af Crohns sygdom og colitis ulcerosa er ikke blevet fastlagt.
Cytopenier
Svær leukopeni, trombocytopeni, anæmi inklusive makrocytisk anæmi og/eller pancytopeni kan forekomme hos patienter, der behandles med IMURAN. Alvorlig knoglemarvssuppression kan også forekomme. Patienter med intermediær thiopurin S-methyltransferase (TPMT) aktivitet kan have en øget risiko for myelotoksicitet, hvis de får konventionelle doser af IMURAN. Patienter med lav eller manglende TPMT-aktivitet har en øget risiko for at udvikle alvorlig, livstruende myelotoksicitet, hvis de får konventionelle doser af IMURAN. TPMT genotypebestemmelse eller fænotypning kan hjælpe med at identificere patienter, der har en øget risiko for at udvikle IMURAN 50 mg toksicitet.2-9 (se FORHOLDSREGLER : Laboratorieprøver ). Hæmatologisk toksicitet er dosisrelaterede og kan være mere alvorlig hos nyretransplanterede patienter, hvis homograft er under afstødning. Det foreslås, at patienter på IMURAN har fuldstændige blodtællinger, inklusive blodpladetal, ugentligt i løbet af den første måned, to gange om måneden i den anden og tredje måned af behandlingen, derefter månedligt eller oftere, hvis dosisændringer eller andre behandlingsændringer er nødvendige. Forsinket hæmatologisk suppression kan forekomme. Hurtig reduktion af dosis eller midlertidig seponering af lægemidlet kan være nødvendig, hvis der er et hurtigt fald i eller vedvarende lavt leukocyttal eller andre tegn på knoglemarvsdepression. Leukopeni korrelerer ikke med terapeutisk effekt; derfor bør dosis ikke øges bevidst for at sænke antallet af hvide blodlegemer.
Alvorlige infektioner
Patienter, der får immunsuppressiva, inklusive Imuran 25 mg, har øget risiko for bakterielle, virale, svampe-, protozo- og opportunistiske infektioner, herunder reaktivering af latente infektioner. Disse infektioner kan føre til alvorlige, herunder dødelige udfald.
Progressiv multifokal leukoencefalopati
Tilfælde af JC-virus-associeret infektion, der resulterer i progressiv multifokal leukoencefalopati (PML), nogle gange fatal, er blevet rapporteret hos patienter behandlet med immunsuppressiva, inklusive Imuran. Risikofaktorer for PML omfatter behandling med immunsuppressive terapier og svækkelse af immunfunktionen. Overvej diagnosticering af PML hos enhver patient, der har nye neurologiske manifestationer, og overvej konsultation med en neurolog som klinisk indiceret. Overvej at reducere mængden af immunsuppression hos patienter, der udvikler PML. Overvej risikoen for, at den reducerede immunsuppression udgør for transplantatet hos transplanterede patienter.
Effekt på sæd hos dyr
IMURAN er blevet rapporteret at forårsage midlertidig depression i spermatogenese og reduktion i sædlevedygtighed og sædceller hos mus ved doser på 10 gange den humane terapeutiske dosis;10 en reduceret procentdel af fertile parringer fandt sted, når dyr fik 5 mg/kg.11
Graviditet
Graviditetskategori D
IMURAN kan forårsage fosterskader, når det administreres til en gravid kvinde. IMURAN 50mg bør ikke gives under graviditet uden omhyggelig afvejning af risiko i forhold til fordel. Når det er muligt, bør brug af IMURAN til gravide patienter undgås. Dette lægemiddel bør ikke bruges til behandling af reumatoid arthritis hos gravide kvinder.12
IMURAN er teratogent hos kaniner og mus, når det gives i doser svarende til den humane dosis (5 mg/kg dagligt). Abnormiteter omfattede skeletmisdannelser og viscerale anomalier.11
Begrænsede immunologiske og andre abnormiteter er forekommet hos nogle få spædbørn født af nyre-allotransplanterede modtagere på IMURAN. I en detaljeret case-rapport 13 blev der observeret lymfopeni, nedsatte IgG- og IgM-niveauer, CMV-infektion og en nedsat skygge i thymus hos et spædbarn født af en mor, der fik 150 mg azathioprin og 30 mg prednison dagligt gennem hele graviditeten. Efter 10 uger var de fleste funktioner normaliseret. DeWitte et al rapporterede pancytopeni og alvorlig immundefekt hos et for tidligt født spædbarn, hvis mor fik 125 mg azathioprin og 12,5 mg prednison dagligt.14 Der har været to publicerede rapporter om unormale fysiske fund. Williamson og Karp beskrev et spædbarn født med præaksial polydaktyli, hvis mor fik azathioprin 200 mg dagligt og prednison 20 mg hver anden dag under graviditeten.15 Tallent et al beskrev et spædbarn med en stor myelomeningocele i den øvre lænderegion, bilaterale dislokerede hofter og bilaterale hofter. talipes equinovarus. Faderen var i langtidsbehandling med azathioprin.16
Fordel versus risiko skal vejes omhyggeligt før brug af IMURAN til patienter med reproduktionspotentiale. Der er ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder. Hvis dette lægemiddel bruges under graviditet, eller hvis patienten bliver gravid, mens han tager dette lægemiddel, skal patienten informeres om den potentielle fare for fosteret. Kvinder i den fødedygtige alder bør rådes til at undgå at blive gravide.
FORHOLDSREGLER
Generel
En gastrointestinal overfølsomhedsreaktion karakteriseret ved svær kvalme og opkastning er blevet rapporteret. Disse symptomer kan også være ledsaget af diarré, udslæt, feber, utilpashed, myalgi, forhøjede leverenzymer og lejlighedsvis hypotension. Symptomer på gastrointestinal toksicitet udvikler sig oftest inden for de første adskillige uger af behandlingen med IMURAN 25 mg og er reversible ved seponering af lægemidlet. Reaktionen kan gentage sig inden for timer efter genudfordring med en enkelt dosis IMURAN.
Laboratorieprøver
Overvågning af komplet blodtælling (CBC).
Patienter på IMURAN 25 mg bør have fuldstændige blodtællinger, inklusive trombocyttal, ugentligt i den første måned, to gange om måneden i den anden og tredje måned af behandlingen, derefter månedligt eller oftere, hvis dosisændringer eller andre behandlingsændringer er nødvendige.
TPMT test
Det anbefales, at der tages hensyn til enten genotype- eller fænotypepatienter for TPMT. Fænotyping og genotypemetoder er kommercielt tilgængelige. De mest almindelige ikke-funktionelle alleler forbundet med reducerede niveauer af TPMT-aktivitet er TPMT*2, TPMT*3A og TPMT*3C. Patienter med to ikke-funktionelle alleler (homozygote) har lav eller fraværende TPMT-aktivitet, og patienter med én ikke-funktionel allel (heterozygot) har mellemaktivitet. Nøjagtig fænotypebestemmelse (TPMT-aktivitet af røde blodlegemer) er ikke mulige hos patienter, som for nylig har modtaget blodtransfusioner. TPMT-testning kan også overvejes hos patienter med unormale CBC-resultater, som ikke reagerer på dosisreduktion. Tidlig seponering af lægemidlet hos disse patienter er tilrådeligt. TPMT-TEST KAN IKKE ERSTATTE FOR OVERVÅGNING AF KOMPLET BLODTAL (CBC) HOS PATIENTER, DER MODTAGER IMURAN. Se KLINISK FARMAKOLOGI , ADVARSLER , BIVIRKNINGER og DOSERING OG ADMINISTRATION sektioner.
Karcinogenese, mutagenese, svækkelse af fertilitet
Se ADVARSLER afsnit.
Graviditet
Teratogene virkninger
Graviditetskategori D. Se ADVARSLER afsnit.
Ammende mødre
Brug af IMURAN 25mg til ammende mødre frarådes. Azathioprin eller dets metabolitter overføres i lave niveauer, både transplacentalt og i modermælk.17,18,19 På grund af potentialet for tumorigenicitet, der er vist for azathioprin, bør der tages en beslutning om, hvorvidt amningen skal afbrydes eller lægemidlet skal seponeres under hensyntagen til lægemidlets betydning for moderen.
Pædiatrisk brug
Sikkerhed og effekt af azathioprin hos pædiatriske patienter er ikke blevet fastlagt.
REFERENCER
2. Weinshilboum R. Thiopurin farmakogenetik: kliniske og molekylære undersøgelser af thiopurin methyltransferase. Drug Metab Dispos. 2001;29:601-605.
3. McLeod HL, Siva C. Thiopurin S-methyltransferase gen-locus - implikationer for klinisk farmakogenomik. Farmakogenomi. 2002;3:89-98.
4. Anstey A, Lennard L, Mayou SC, et al. Pancytopeni relateret til azathioprin - en enzymmangel forårsaget af en almindelig genetisk polymorfi: en gennemgang. JR Soc Med. 1992; 85:752-756.
5. Stolk JN, Beorbooms AM, de Abreu RA, et al. Reduceret thiopurinmethyltransferaseaktivitet og udvikling af bivirkninger ved azathioprinbehandling hos patienter med leddegigt. Gigt Rheum. 1998; 41:18581866.
6. Data på fil, Prometheus Laboratories Inc.
7. Yates CR, Krynetski EY, Loennechen T, et al. Molekylær diagnose af thiopurin S-methyltransferase mangel: genetisk grundlag for azathioprin og mercaptopurin intolerance. Ann Praktikant Med. 1997; 126:608-614.
8. Black AJ, McLeod HL, Capell HA, et al. Thiopurin methyltransferase genotype forudsiger behandlingsbegrænsende alvorlig toksicitet fra azathioprin. Ann Praktikant Med. 1998; 129:716-718.
9. Clunie GP, Lennard L. Relevansen af thiopurin-methyltransferase-status hos reumatologiske patienter, der får azathioprin. Reumatologi. 2004; 43:13-18.
10. Clark JM. Mutageniciteten af azathioprin i mus, Drosophila melanogaster og Neurospora crassa. Mutat Res. 1975; 28:87-99.
11. Data på fil, Prometheus Laboratories Inc.
12. Tagatz GE, Simmons RL. Graviditet efter nyretransplantation. Ann Praktikant Med. 1975; 82:113-114. Redaktionelle bemærkninger.
13. Cote' CJ, Meuwissen HJ, Pickering RJ. Virkninger på nyfødt af prednison og azathioprin administreret til moderen under graviditeten. J Pædiatr. 1974; 85:324-328.
14. DeWitte DB, Buick MK, Cyran SE, et al. Neonatal pancytopeni og alvorlig kombineret immundefekt forbundet med prænatal administration af azathioprin og prednison. J Pædiatr. 1984; 105:625-628.
15. Williamson RA, Karp LE. Azathioprin teratogenicitet: gennemgang af litteraturen og case-rapporten. Obstet Gynecol. 1981; 58:247-250.
16. Tallent MB, Simmons RL, Najarian JS. Fødselsdefekter hos barn af mandlig modtager af nyretransplantation. JAMA. 1970; 211: 1854-1855.
17. Data på fil, Prometheus Laboratories Inc.
18. Saarikoski S, Seppälä M. Immunsuppression under graviditet: overførsel af azathioprin og dets metabolitter fra moderen til fosteret. Am J Obstet Gynecol. 1973; 115:1100-1106.
19. Coulam CB, Moyer TP, Jiang NS, et al. Amning efter nyretransplantation. Transplantation Proc. 1982; 14: 605-609.
OVERDOSIS
De orale LD50'er for enkeltdoser af IMURAN 50 mg til mus og rotter er henholdsvis 2500 mg/kg og 400 mg/kg. Meget store doser af denne antimetabolit kan føre til marvhypoplasi, blødning, infektion og død. Ca. 30 % af IMURAN er bundet til serumproteiner, men ca. 45 % fjernes under en 8-timers hæmodialyse.24 Der er rapporteret et enkelt tilfælde af en nyretransplanteret patient, som indtog en enkelt dosis på 7500 mg IMURAN. De umiddelbare toksiske reaktioner var kvalme, opkastning og diarré efterfulgt af mild leukopeni og milde abnormiteter i leverfunktionen. Antallet af hvide blodlegemer, SGOT og bilirubin vendte tilbage til det normale 6 dage efter overdoseringen.
KONTRAINDIKATIONER
IMURAN 25 mg bør ikke gives til patienter, der har vist overfølsomhed over for lægemidlet. IMURAN bør ikke anvendes til behandling af reumatoid arthritis hos gravide kvinder. Patienter med leddegigt, der tidligere er behandlet med alkylerende midler (cyclophosphamid, chlorambucil, melphalan eller andre), kan have en uoverkommelig risiko for malignitet, hvis de behandles med IMURAN.
REFERENCER
24. Schusziarra V, Ziekursch V, Schlamp R, et al. Farmakokinetik af azathioprin under hæmodialyse. Int J Clin Pharmacol Biopharm. 1976; 14:298-302.
KLINISK FARMAKOLOGI
Azathioprin absorberes godt efter oral administration. Maksimal serumradioaktivitet forekommer 1 til 2 timer efter oral 35S-azathioprin og henfalder med en halveringstid på 5 timer. Dette er ikke et skøn over halveringstiden for selve azathioprin, men er nedbrydningshastigheden for alle 35S-holdige metabolitter af lægemidlet. På grund af omfattende metabolisme er kun en brøkdel af radioaktiviteten til stede som azathioprin. Sædvanlige doser producerer blodniveauer af azathioprin og af mercaptopurin afledt deraf, som er lave ( OVERDOSERING .
Azathioprin metaboliseres til 6-mercaptopurin (6-MP). Begge forbindelser elimineres hurtigt fra blodet og oxideres eller methyleres i erytrocytter og lever; ingen azathioprin eller mercaptopurin kan påvises i urinen efter 8 timer. Aktivering af 6-mercaptopurin sker via hypoxanthin-guanin-phosphoribosyltransferase (HGPRT) og en række multi-enzymatiske processer, der involverer kinaser for at danne 6-thioguanin-nukleotider (6-TGN'er) som hovedmetabolitter (se Metabolismeskema i figur 1 ). Cytotoksiciteten af azathioprin skyldes til dels inkorporeringen af 6-TGN i DNA.
6-MP gennemgår to store inaktiveringsruter (figur 1). Den ene er thiolmethylering, som katalyseres af enzymet thiopurin S-methyltransferase (TPMT), for at danne den inaktive metabolit methyl-6-MP (6-MeMP). TPMT-aktivitet styres af en genetisk polymorfi.1,2,3 For kaukasiere og afroamerikanere arver ca. 10% af befolkningen en ikke-funktionel TPMT-allel (heterozygot), der giver mellemliggende TPMT-aktivitet, og 0,3% arver to TPMT-ikke-funktionelle alleler (homozygote) for lav eller fraværende TPMT-aktivitet. Ikke-funktionelle alleler er mindre almindelige hos asiater. TPMT-aktivitet korrelerer omvendt med 6-TGN-niveauer i erytrocytter og formentlig andre hæmatopoietiske væv, da disse celler har ubetydelige xanthinoxidase-aktiviteter (involveret i den anden inaktiveringsvej), hvilket efterlader TPMT-methylering som den eneste inaktiveringsvej. Patienter med mellemliggende TPMT-aktivitet kan have øget risiko for myelotoksicitet, hvis de får konventionelle doser af IMURAN. Patienter med lav eller manglende TPMT-aktivitet har en øget risiko for at udvikle alvorlig, livstruende myelotoksicitet, hvis de får konventionelle doser af IMURAN.4-9 TPMT-genotypebestemmelse eller fænotypebestemmelse (røde blodlegemers TPMT-aktivitet) kan hjælpe med at identificere patienter, som har en øget risiko for at udvikle IMURAN 25mg toksicitet.2,3,7,8,9 Nøjagtig fænotyping (TPMT-aktivitet af røde blodlegemer) er ikke mulige hos patienter, som for nylig har modtaget blodtransfusioner. Se ADVARSLER , FORHOLDSREGLER : DRUGSINTERAKTIONER , FORHOLDSREGLER : Laboratorieprøver og BIVIRKNINGER sektioner.
figur 1 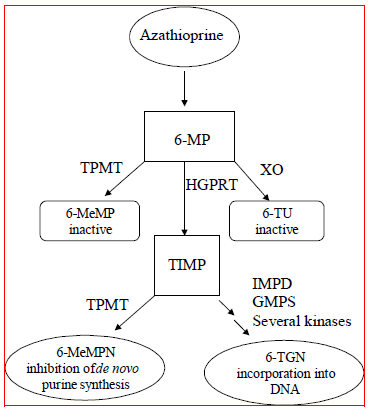 Figur 1. Metabolismevej for azathioprin: konkurrerende veje resulterer i inaktivering af TPMT eller XO eller inkorporering af cytotoksiske nukleotider i DNA.
Figur 1. Metabolismevej for azathioprin: konkurrerende veje resulterer i inaktivering af TPMT eller XO eller inkorporering af cytotoksiske nukleotider i DNA.
GMPS: Guanosinmonophosphatsyntetase; HGPRT: Hypoxanthin-guanin-phosphoribosyl-transferase; IMPD: Inosinmonophosphatdehydrogenase; MeMP: Methylmercaptopurin; MeMPN: Methylmercaptopurin-nukleotid; TGN: Thioguanin-nukleotider; TIMP: Thioinosinmonophosphat; TPMT: Thiopurin S-methyltransferase; TU thioursyre; XO: Xanthinoxidase (tilpasset fra Pharmacogenomics 2002; 3:89-98; og Cancer Res 2001; 61:5810-5816.)
En anden inaktiveringsvej er oxidation, som katalyseres af xanthinoxidase (XO) til dannelse af 6-thioursyre. Hæmningen af xanthinoxidase hos patienter, der får allopurinol (ZYLOPRIM®), er grundlaget for den azathioprin-dosisreduktion, der kræves hos disse patienter (se FORHOLDSREGLER : DRUGSINTERAKTIONER ). Proportionerne af metabolitter er forskellige hos individuelle patienter, og dette tegner sig formentlig for variabel størrelse og varighed af lægemiddeleffekter. Renal clearance er sandsynligvis ikke vigtig for at forudsige biologisk effektivitet eller toksicitet, selvom dosisreduktion praktiseres hos patienter med dårlig nyrefunktion.
Homograft overlevelse
Anvendelsen af azathioprin til inhibering af renal homograftafstødning er veletableret, mekanismerne for denne virkning er noget uklare. Lægemidlet undertrykker overfølsomhed af den cellemedierede type og forårsager variable ændringer i antistofproduktionen. Undertrykkelse af T-celle-effekter, herunder ablation af T-celle-undertrykkelse, er afhængig af det tidsmæssige forhold til antigen stimulus eller engraftment. Dette middel har ringe effekt på etablerede transplantatafstødninger eller sekundære reaktioner.
Ændringer i specifikke immunresponser eller immunologiske funktioner hos transplanterede modtagere er vanskelige at relatere specifikt til immunsuppression af azathioprin. Disse patienter har subnormale responser på vacciner, lavt antal af T-celler og abnorm fagocytose fra perifere blodceller, men deres mitogene responser, serumimmunoglobuliner og sekundære antistofresponser er sædvanligvis normale.
Immuninflammatorisk respons
Azathioprin undertrykker sygdomsmanifestationer såvel som underliggende patologi i dyremodeller af autoimmun sygdom. For eksempel reduceres sværhedsgraden af adjuverende arthritis af azathioprin.
De mekanismer, hvorved azathioprin påvirker autoimmune sygdomme, kendes ikke. Azathioprin er immunsuppressiv, forsinket overfølsomheds- og cellulære cytotoksicitetstest undertrykkes i højere grad end antistofresponser. I rottemodellen for adjuverende arthritis har azathioprin vist sig at hæmme lymfeknudehyperplasien, som går forud for begyndelsen af sygdommens tegn. Både de immunsuppressive og terapeutiske virkninger i dyremodeller er dosis-relaterede. Azathioprin betragtes som et langsomt virkende lægemiddel, og virkningerne kan vedvare, efter at lægemidlet er seponeret.
REFERENCER
1. Lennard L. Den kliniske farmakologi af 6-mercaptopurin. Eur J Clin Pharmacol. 1992;43:329-339.
2. Weinshilboum R. Thiopurin farmakogenetik: kliniske og molekylære undersøgelser af thiopurin methyltransferase. Drug Metab Dispos. 2001;29:601-605.
3. McLeod HL, Siva C. Thiopurin S-methyltransferase gen-locus - implikationer for klinisk farmakogenomik. Farmakogenomi. 2002;3:89-98.
4. Anstey A, Lennard L, Mayou SC, et al. Pancytopeni relateret til azathioprin - en enzymmangel forårsaget af en almindelig genetisk polymorfi: en gennemgang. JR Soc Med. 1992; 85:752-756.
5. Stolk JN, Beorbooms AM, de Abreu RA, et al. Reduceret thiopurinmethyltransferaseaktivitet og udvikling af bivirkninger ved azathioprinbehandling hos patienter med leddegigt. Gigt Rheum. 1998; 41:18581866.
6. Data på fil, Prometheus Laboratories Inc.
7. Yates CR, Krynetski EY, Loennechen T, et al. Molekylær diagnose af thiopurin S-methyltransferase mangel: genetisk grundlag for azathioprin og mercaptopurin intolerance. Ann Praktikant Med. 1997; 126:608-614.
8. Black AJ, McLeod HL, Capell HA, et al. Thiopurin methyltransferase genotype forudsiger behandlingsbegrænsende alvorlig toksicitet fra azathioprin. Ann Praktikant Med. 1998; 129:716-718.
9. Clunie GP, Lennard L. Relevansen af thiopurin-methyltransferase-status hos reumatologiske patienter, der får azathioprin. Reumatologi. 2004; 43:13-18.
PATIENTOPLYSNINGER
Patienter, der starter på IMURAN, bør informeres om nødvendigheden af periodiske blodtællinger, mens de får lægemidlet, og bør opfordres til at rapportere enhver usædvanlig blødning eller blå mærker til deres læge. De skal informeres om infektionsfaren, mens de får IMURAN, og bedt om at rapportere tegn og symptomer på infektion til deres læge. Omhyggelige doseringsinstruktioner bør gives til patienten, især når IMURAN administreres ved tilstedeværelse af nedsat nyrefunktion eller samtidig med allopurinol (se DRUGSINTERAKTIONER underafsnit og DOSERING OG ADMINISTRATION ). Patienter bør informeres om de potentielle risici ved brug af IMURAN 50 mg under graviditet og i ammeperioden. Den øgede risiko for malignitet efter behandling med IMURAN bør forklares for patienten.
