Imitrex 100mg, 25mg, 50mg Sumatriptan Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Imitrex 25mg, og hvordan bruges det?
Imitrex 100mg er en receptpligtig medicin, der bruges til at behandle symptomerne på migrænehovedpine og klyngehovedpine. Imitrex kan bruges alene eller sammen med anden medicin.
Imitrex 50mg er et antimigrænemiddel, seratonin 5-HT-receptoragonist.
Det vides ikke, om Imitrex 50mg er sikkert og effektivt til børn under 18 år, og brug anbefales ikke til geriatriske patienter.
Hvad er de mulige bivirkninger af Imitrex 50mg?
Imitrex 25mg kan forårsage alvorlige bivirkninger, herunder:
- pludselige, stærke mavesmerter,
- diarré med eller uden tilstedeværelse af blod,
- stærke brystsmerter,
- smerter i din kæbe eller skulder,
- stakåndet,
- uregelmæssige hjerteslag,
- krampeanfald (kramper),
- kramper i benene,
- følelsesløshed eller prikken i dine ben eller fødder,
- brændende smerter i dine ben eller fødder,
- kold følelse i dine ben eller fødder,
- farveændringer i dine ben eller fødder,
- hoftesmerter,
- kvalme,
- opkastning,
- sveder eller ryster,
- agitation,
- hallucinationer,
- feber,
- muskelstivhed,
- tab af koordination,
- pludselig følelsesløshed eller svaghed på den ene side af kroppen,
- utydelig tale,
- svært ved at se,
- dårlig balance, og
- pludselig kraftig hovedpine
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Imitrex omfatter:
- smerter eller trykken i brystet, halsen eller kæben,
- tryk i enhver del af din krop,
- følelsesløshed eller prikken,
- føler sig varm eller kold,
- svimmelhed,
- døsighed,
- svaghed,
- ubehagelig smag efter brug af næsemedicinen,
- smerte, svie, følelsesløshed eller prikken i din næse eller hals efter brug af næsemedicinen, og
- løbende eller tilstoppet næse efter brug af næsemedicinen
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Imitrex. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
IMITREX 50 mg injektion indeholder sumatriptansuccinat, en selektiv 5-HT1B/1D-receptoragonist. Sumatriptansuccinat er kemisk betegnet som 3-[2-(dimethylamino)ethyl]-N-methyl-indol5-methansulfonamidsuccinat (1:1), og det har følgende struktur:
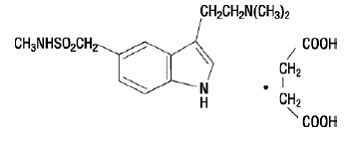
Den empiriske formel er C14H21N3O2S•C4H6O4, hvilket repræsenterer en molekylvægt på 413,5. Sumatriptan succinat er et hvidt til råhvidt pulver, der er letopløseligt i vand og saltvand.
IMITREX injektion er en klar, farveløs til bleggul, steril, ikke-pyrogen opløsning til subkutan injektion. Hver 0,5 ml IMITREX injektion 8 mg/ml opløsning indeholder 4 mg sumatriptan (base) som succinatsaltet og 3,8 mg natriumchlorid, USP i vand til injektion, USP. Hver 0,5 ml IMITREX injektion 12 mg/ml opløsning indeholder 6 mg sumatriptan (base) som succinatsaltet og 3,5 mg natriumchlorid, USP i vand til injektion, USP. pH-området for begge opløsninger er ca. 4,2 til 5,3. Osmolaliteten af begge injektioner er 291 mOsmol.
INDIKATIONER
IMITREX® Injection er indiceret til voksne til (1) akut behandling af migræne, med eller uden aura, og (2) akut behandling af klyngehovedpine.
Brugsbegrænsninger
- Brug kun, hvis en klar diagnose af migræne eller klyngehovedpine er blevet etableret. Hvis en patient ikke reagerer på det første migræne- eller klyngehovedpineanfald behandlet med IMITREX 50 mg injektion, skal diagnosen genovervejes, før IMITREX Injection administreres for at behandle eventuelle efterfølgende anfald.
- IMITREX Injection er ikke indiceret til forebyggelse af migræne eller klyngehovedpineanfald.
DOSERING OG ADMINISTRATION
Doseringsoplysninger
Den maksimale enkelt anbefalede voksendosis af IMITREX 25 mg injektion til akut behandling af migræne eller klyngehovedpine er 6 mg injiceret subkutant. Til behandling af migræne, hvis bivirkninger er dosisbegrænsende, kan lavere doser (1 mg til 5 mg) anvendes [se Kliniske Studier ]. Til behandling af klyngehovedpine er effektiviteten af lavere doser ikke blevet fastslået.
Den maksimale kumulative dosis, der kan gives i løbet af 24 timer, er 12 mg, to 6 mg-injektioner adskilt af mindst 1 time. En anden dosis på 6 mg bør kun overvejes, hvis der blev observeret en vis respons på en første injektion.
Administration ved hjælp af IMITREX STATdose Pen®
En autoinjektoranordning (IMITREX 25 mg STATdose Pen) er tilgængelig til brug med 4 mg og 6 mg fyldte sprøjtepatroner. Med denne enhed trænger nålen ca. 1/4 tomme (5 til 6 mm). Injektionen er beregnet til at blive givet subkutant, og intramuskulær eller intravaskulær levering skal undgås. Instruer patienterne i den korrekte brug af IMITREX 100 mg STATdose Pen og instruer dem til at bruge injektionssteder med en passende hud og subkutan tykkelse til at passe til nålens længde.
Administration af andre doser af IMITREX end 4 eller 6 mg
Til patienter, der får andre doser end 4 mg eller 6 mg, skal du bruge 6-mg enkeltdosis hætteglasset; Brug ikke IMITREX 50 mg STATdose Pen. Inspicer hætteglasset visuelt for partikler og misfarvning før administration. Må ikke anvendes, hvis der er observeret partikler og misfarvninger.
HVORDAN LEVERET
Doseringsformer og styrker
- Injektion: 4 mg og 6 mg enkeltdosis fyldte sprøjtepatroner til brug med IMITREX STATdose Pen.
- Injektion: 6 mg enkeltdosis hætteglas.
Opbevaring og håndtering
IMITREX 100mg injektion indeholder sumatriptan (base) som succinatsaltet og leveres som en klar, farveløs til bleggul, steril, ikke-pyrogen opløsning som følger:
Forfyldt sprøjte og/eller autoinjektorpen
Hver pakke indeholder en patientinformation og en patientbrugsanvisning.
IMITREX 100mg STATdose System®, 4 mg , indeholdende 1 IMITREX 25 mg STATdosis Pen, 2 fyldte enkeltdosis sprøjtepatroner og 1 bæretaske ( NDC 0173-0739-00).
IMITREX 100mg STATdosissystem, 6 mg indeholdende 1 IMITREX STATdosispen, 2 fyldte enkeltdosissprøjtepatroner og 1 bæretaske ( NDC 0173-0479-00).
To 4 mg enkeltdosis fyldte sprøjter patroner til brug med IMITREX STATdose System ( NDC 0173-0739-02).
To 6 mg enkeltdosis fyldte sprøjter patroner til brug med IMITREX 25mg STATdose System ( NDC 0173-0478-00).
Enkeltdosis hætteglas
IMITREX 25 mg enkeltdosis hætteglas til injektion (6 mg/0,5 ml) i kartoner indeholdende 5 hætteglas ( NDC 01730449-02).
Opbevares mellem 2° og 30°C (36° og 86°F). Beskyt mod lys.
GlaxoSmithKline, Research Triangle Park, NC 27709
BIVIRKNINGER
Følgende alvorlige bivirkninger er beskrevet nedenfor og andetsteds i mærkningen:
- Myokardieiskæmi, myokardieinfarkt og Prinzmetals angina [se ADVARSLER OG FORHOLDSREGLER ]
- Arytmier [se ADVARSLER OG FORHOLDSREGLER ]
- Bryst-, hals-, nakke- og/eller kæbesmerter/tæthed/tryk [se ADVARSLER OG FORHOLDSREGLER ]
- Cerebrovaskulære hændelser [se ADVARSLER OG FORHOLDSREGLER ]
- Andre vasospasmereaktioner [se ADVARSLER OG FORHOLDSREGLER ]
- Medicinoverforbrug hovedpine [se ADVARSLER OG FORHOLDSREGLER ]
- Serotonin syndrom [se ADVARSLER OG FORHOLDSREGLER ]
- Forhøjelse af blodtrykket [se ADVARSLER OG FORHOLDSREGLER ]
- Overfølsomhedsreaktioner [se KONTRAINDIKATIONER , ADVARSLER OG FORHOLDSREGLER ]
- Anfald [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan de bivirkninger, der er observeret i de kliniske forsøg med et lægemiddel, ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Migræne Hovedpine
Tabel 1 viser bivirkninger, der opstod i 2 amerikanske placebokontrollerede kliniske forsøg med migrænepatienter (undersøgelse 2 og 3) efter enten en enkelt 6 mg dosis af IMITREX 100 mg injektion eller placebo. Kun reaktioner, der opstod med en frekvens på 2 % eller mere i grupper behandlet med IMITREX Injection 6 mg, og som opstod med en frekvens, der var større end placebogruppen, er inkluderet i tabel 1.
Hyppigheden af bivirkninger i kontrollerede kliniske forsøg var ikke påvirket af køn eller alder på patienterne. Der var utilstrækkelige data til at vurdere racens indvirkning på forekomsten af bivirkninger.
Klyngehovedpine
I de kontrollerede kliniske undersøgelser, der vurderede effektiviteten af IMITREX 50 mg injektion som behandling af klyngehovedpine (undersøgelse 4 og 5), blev der ikke påvist nye signifikante bivirkninger, som ikke allerede var blevet identificeret i forsøg med IMITREX 100 mg hos patienter med migræne.
Samlet set var hyppigheden af bivirkninger rapporteret i forsøgene med klyngehovedpine generelt lavere end i migræneforsøgene. Undtagelser omfatter rapporter om paræstesi (5 % IMITREX, 0 % placebo), kvalme og opkastning (4 % IMITREX, 0 % placebo) og bronkospasme (1 % IMITREX 50 mg, 0 % placebo).
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af IMITREX 50 mg tabletter, IMITREX næsespray og IMITREX 50 mg injektion efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Kardiovaskulær
Hypotension, hjertebanken.
Neurologisk
Dystoni, tremor.
DRUGSINTERAKTIONER
Ergotholdige lægemidler
Ergotholdige lægemidler er blevet rapporteret at forårsage langvarige vasospastiske reaktioner. Da disse virkninger kan være additive, er brug af ergotaminholdige eller ergot-type medicin (såsom dihydroergotamin eller methysergid) og IMITREX 25 mg injektion inden for 24 timer efter hinanden kontraindiceret.
Monoaminoxidase-A-hæmmere
MAO-A-hæmmere øger den systemiske eksponering 2 gange. Derfor er brugen af IMITREX Injection hos patienter, der får MAO-A-hæmmere, kontraindiceret [se KLINISK FARMAKOLOGI ].
Andre 5-HT1-agonister
Da deres vasospastiske virkninger kan være additive, er samtidig administration af IMITREX Injection og andre 5-HT1-agonister (f.eks. triptaner) inden for 24 timer efter hinanden kontraindiceret.
Selektive serotonin-genoptagelseshæmmere/serotonin-noradrenalin-genoptagelseshæmmere og serotoninsyndrom
Tilfælde af serotonergt syndrom er blevet rapporteret under samtidig administration af triptaner og SSRI'er, SNRI'er, TCA'er og MAO-hæmmere [se ADVARSLER OG FORHOLDSREGLER ].
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Myokardieiskæmi, myokardieinfarkt og Prinzmetals angina
Brugen af IMITREX Injection er kontraindiceret hos patienter med iskæmisk eller vasospastisk CAD. Der har været sjældne rapporter om alvorlige hjertebivirkninger, herunder akut myokardieinfarkt, som er opstået inden for få timer efter administration af IMITREX Injection. Nogle af disse reaktioner opstod hos patienter uden kendt CAD. IMITREX 100mg injektion kan forårsage koronararterievasospasme (Prinzmetals angina), selv hos patienter uden en historie med CAD.
Udfør en kardiovaskulær evaluering hos triptan-naive patienter, som har flere kardiovaskulære risikofaktorer (f.eks. øget alder, diabetes, hypertension, rygning, fedme, stærk familiehistorie med CAD), før de får IMITREX-injektion. Hvis der er tegn på CAD eller koronar arterie vasospasme, er IMITREX 100 mg injektion kontraindiceret. For patienter med flere kardiovaskulære risikofaktorer, som har en negativ kardiovaskulær evaluering, bør du overveje at administrere den første dosis af IMITREX-injektion i en medicinsk overvåget indstilling og udføre et elektrokardiogram (EKG) umiddelbart efter administration af IMITREX-injektion. For sådanne patienter, overvej periodisk kardiovaskulær evaluering hos intermitterende langtidsbrugere af IMITREX 100 mg injektion.
Arytmier
Livstruende forstyrrelser af hjerterytmen, herunder ventrikulær takykardi og ventrikulær fibrillering, der fører til døden, er blevet rapporteret inden for få timer efter administration af 5-HT1-agonister. Afbryd IMITREX-injektion, hvis disse forstyrrelser opstår. IMITREX Injection er kontraindiceret hos patienter med Wolff-Parkinson-White syndrom eller arytmier forbundet med andre hjertetilbehørsforstyrrelser i ledningsvejen.
Bryst-, hals-, nakke- og/eller kæbesmerter/tæthed/tryk
Fornemmelser af stramhed, smerte, tryk og tyngde i precordium, hals, nakke og kæbe opstår almindeligvis efter behandling med IMITREX Injection og er normalt ikke-kardielt. Udfør dog en hjerteevaluering, hvis disse patienter har høj hjerterisiko. Brugen af IMITREX Injection er kontraindiceret hos patienter med CAD og dem med Prinzmetals variant angina.
Cerebrovaskulære begivenheder
Cerebral blødning, subaraknoidal blødning og slagtilfælde er forekommet hos patienter behandlet med 5-HT1-agonister, og nogle har resulteret i dødsfald. I en række tilfælde synes det muligt, at de cerebrovaskulære hændelser var primære, idet 5-HT1-agonisten var blevet administreret i den ukorrekte tro, at de oplevede symptomer var en konsekvens af migræne, når de ikke var det. Patienter med migræne kan også have øget risiko for visse cerebrovaskulære hændelser (f.eks. slagtilfælde, blødning, TIA). Afbryd IMITREX-injektion, hvis der opstår en cerebrovaskulær hændelse.
Før behandling af hovedpine hos patienter, der ikke tidligere er diagnosticeret med migræne eller klyngehovedpine, eller hos patienter, som viser atypiske symptomer, skal andre potentielt alvorlige neurologiske tilstande udelukkes. IMITREX Injection er kontraindiceret til patienter med en anamnese med slagtilfælde eller TIA.
Andre vasospasmereaktioner
IMITREX 25mg injektion kan forårsage ikke-koronare vasospastiske reaktioner, såsom perifer vaskulær iskæmi, gastrointestinal vaskulær iskæmi og infarkt (der viser sig med mavesmerter og blodig diarré), miltinfarkt og Raynauds syndrom. Hos patienter, som oplever symptomer eller tegn, der tyder på ikke-koronar vasospasmereaktion efter brug af en hvilken som helst 5-HT1-agonist, skal en vasospastisk reaktion udelukkes, før de får yderligere IMITREX-injektioner.
Rapporter om forbigående og permanent blindhed og betydeligt delvist synstab er blevet rapporteret ved brug af 5-HT1-agonister. Da synsforstyrrelser kan være en del af et migræneanfald, er en årsagssammenhæng mellem disse hændelser og brugen af 5-HT1-agonister ikke klarlagt.
Medicin Overforbrug Hovedpine
Overforbrug af lægemidler til akut migræne (f.eks. ergotamin, triptaner, opioider eller kombinationer af disse lægemidler i 10 eller flere dage om måneden) kan føre til forværring af hovedpine (hovedpine for overforbrug af medicin). Medicinoverforbrugshovedpine kan vise sig som migrænelignende daglig hovedpine eller som en markant stigning i hyppigheden af migræneanfald. Afgiftning af patienter, herunder seponering af de overforbrugte lægemidler, og behandling af abstinenssymptomer (som ofte omfatter en forbigående forværring af hovedpine) kan være nødvendig.
Serotonin syndrom
Serotoninsyndrom kan forekomme med IMITREX-injektion, især under samtidig administration med selektive serotoningenoptagshæmmere (SSRI'er), serotonin-noradrenalin-genoptagelseshæmmere (SNRI'er), tricykliske antidepressiva (TCA'er) og MAO-hæmmere [se DRUGSINTERAKTIONER ]. Symptomer på serotoninsyndrom kan omfatte mentale statusændringer (f.eks. agitation, hallucinationer, koma), autonom ustabilitet (f.eks. takykardi, labilt blodtryk, hypertermi), neuromuskulære aberrationer (f.eks. hyperrefleksi, ukoordination) og/eller gastrointestinale symptomer (f.eks. kvalme, opkastning, diarré). Begyndelsen af symptomer opstår normalt inden for minutter til timer efter modtagelse af en ny eller en større dosis af en serotonerg medicin. Afbryd IMITREX-injektion, hvis der er mistanke om serotonergt syndrom.
Forøgelse i blodtryk
Signifikant forhøjelse af blodtrykket, herunder hypertensiv krise med akut svækkelse af organsystemer, er blevet rapporteret i sjældne tilfælde hos patienter behandlet med 5-HT1-agonister, herunder patienter uden hypertension i anamnesen. Overvåg blodtrykket hos patienter, der behandles med IMITREX. IMITREX Injection er kontraindiceret til patienter med ukontrolleret hypertension.
Anafylaktiske/anafylaktiske reaktioner
Anafylaktiske/anafylaktoide reaktioner er forekommet hos patienter, der får IMITREX. Sådanne reaktioner kan være livstruende eller dødelige. Generelt er anafylaktiske reaktioner på lægemidler mere tilbøjelige til at forekomme hos personer med en historie med følsomhed over for flere allergener. IMITREX 50 mg injektion er kontraindiceret til patienter med en historie med overfølsomhedsreaktion over for IMITREX.
Anfald
Kramper er blevet rapporteret efter administration af IMITREX. Nogle er forekommet hos patienter med enten en historie med anfald eller samtidige tilstande, der er disponeret for anfald. Der er også rapporter om patienter, hvor sådanne prædisponerende faktorer ikke er synlige. IMITREX Injection bør anvendes med forsigtighed til patienter med epilepsi i anamnesen eller tilstande forbundet med en nedsat anfaldstærskel.
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( PATIENTINFORMATION og brugsanvisning ).
Risiko for myokardieiskæmi og/eller infarkt, Prinzmetals angina, andre vasospasme-relaterede hændelser, arytmier og cerebrovaskulære hændelser
Informer patienterne om, at IMITREX 50 mg injektion kan forårsage alvorlige kardiovaskulære bivirkninger såsom myokardieinfarkt eller slagtilfælde. Selvom alvorlige kardiovaskulære hændelser kan forekomme uden advarselssymptomer, bør patienter være opmærksomme på tegn og symptomer på brystsmerter, åndenød, uregelmæssig hjerterytme, signifikant stigning i blodtryk, svaghed og sløret tale, og bør bede om lægehjælp, hvis ethvert vejledende tegn eller symptomer observeres. Oplys patienterne om vigtigheden af denne opfølgning [se ADVARSLER OG FORHOLDSREGLER ].
Anafylaktiske/anafylaktiske reaktioner
Informer patienterne om, at der er opstået anafylaktiske/anafylaktoide reaktioner hos patienter, der får IMITREX 100 mg injektion. Sådanne reaktioner kan være livstruende eller dødelige. Generelt er anafylaktiske reaktioner på lægemidler mere tilbøjelige til at forekomme hos personer med en historie med følsomhed over for flere allergener [se KONTRAINDIKATIONER , ADVARSLER OG FORHOLDSREGLER ].
Samtidig brug med andre triptaner eller ergotmedicin
Informer patienterne om, at brug af IMITREX 50 mg injektion inden for 24 timer efter en anden triptan eller en ergot-type medicin (inklusive dihydroergotamin eller methysergid) er kontraindiceret [se KONTRAINDIKATIONER , DRUGSINTERAKTIONER ].
Serotonin syndrom
Pas på patienter med risikoen for serotonergt syndrom ved brug af IMITREX Injection eller andre triptaner, især ved kombineret brug med SSRI'er, SNRI'er, TCA'er og MAO-hæmmere [se ADVARSLER OG FORHOLDSREGLER , DRUGSINTERAKTIONER ].
Medicin Overforbrug Hovedpine
Informer patienterne om, at brug af akutte migrænemidler i 10 eller flere dage om måneden kan føre til en forværring af hovedpine og opmuntre patienterne til at registrere hovedpinefrekvens og stofbrug (f.eks. ved at føre en hovedpinedagbog) [se ADVARSLER OG FORHOLDSREGLER ].
Graviditet
Informer patienterne om, at IMITREX 25mg Injection ikke bør anvendes under graviditet, medmindre den potentielle fordel opvejer den potentielle risiko for fosteret [se Brug i specifikke populationer ].
Ammende mødre
Råd patienter til at underrette deres sundhedsplejerske, hvis de ammer eller planlægger at amme [se Brug i specifikke populationer ].
Evne til at udføre komplekse opgaver
Behandling med IMITREX 25 mg injektion kan forårsage døsighed og svimmelhed; instruere patienterne i at vurdere deres evne til at udføre komplekse opgaver efter administration af IMITREX 25 mg injektion.
Sådan bruges IMITREX 100mg injektion
Giv patienterne instruktion om korrekt brug af IMITREX 100 mg injektion, hvis de er i stand til selv at administrere IMITREX 50 mg injektion i medicinske situationer uden opsyn.
Informer patienterne om, at nålen i IMITREX STATdose Pen penetrerer ca. 1/4 tomme (5 til 6 mm). Informer patienterne om, at injektionen er beregnet til at blive givet subkutant, og intramuskulær eller intravaskulær levering bør undgås. Instruer patienterne i at bruge injektionssteder med en passende hud og subkutan tykkelse til at passe til nålens længde.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
carcinogenicitetsundersøgelser hos mus og rotter, hvor sumatriptan blev administreret oralt i henholdsvis 78 uger og 104 uger i doser op til 160 mg/kg/dag (den højeste dosis hos rotter blev reduceret fra 360 mg/kg/dag i uge 21 ). Den højeste dosis til mus og rotter var ca. 130 og 260 gange den enkelte MRHD på 6 mg administreret subkutant på mg/m²-basis. Der var ingen tegn på en stigning i tumorer relateret til sumatriptan-administration hos nogen af arterne.
Mutagenese
Sumatriptan var negativ i in vitro (bakteriel revers mutation [Ames], gencellemutation i kinesisk hamster V79/HGPRT, kromosomafvigelse i humane lymfocytter) og in vivo (rotte mikronucleus) assays.
Forringelse af fertilitet
Når sumatriptan blev administreret som subkutan injektion til han- og hunrotter før og gennem hele parringsperioden, var der ingen tegn på nedsat fertilitet ved doser op til 60 mg/kg/dag eller ca. 100 gange den enkelte humane dosis på 6 mg på en mg/m² basis. Når sumatriptan (5, 50, 500 mg/kg/dag) blev administreret oralt til han- og hunrotter før og gennem hele parringsperioden, var der et behandlingsrelateret fald i fertilitet sekundært til et fald i parring hos dyr behandlet med doser mere end 5 mg/kg/dag. Det er ikke klart, om dette fund skyldtes en effekt på mænd eller kvinder eller begge dele.
Brug i specifikke populationer
Graviditet
Graviditetskategori C
Der er ingen tilstrækkelige og velkontrollerede forsøg med IMITREX 50 mg injektion hos gravide kvinder. I udviklingstoksicitetsundersøgelser hos rotter og kaniner var oral administration af sumatriptan til drægtige dyr forbundet med embryodødelighed, føtale abnormiteter og hvalpedødelighed. Ved intravenøs administration til drægtige kaniner var sumatriptan embryoletalt. IMITREX 100mg Injection bør kun anvendes under graviditet, hvis den potentielle fordel opvejer den potentielle risiko for fosteret.
Oral administration af sumatriptan til drægtige rotter i løbet af organogeneseperioden resulterede i en øget forekomst af abnormiteter i føtale blodkar (cervicothoracale og umbilical). Den højeste dosis uden effekt for embryoføtal udviklingstoksicitet i rater var 60 mg/kg/dag eller ca. 100 gange den maksimale anbefalede enkeltdosis til mennesker (MRHD) på 6 mg administreret subkutant på mg/m²-basis. Oral administration af sumatriptan til drægtige kaniner i løbet af organogeneseperioden resulterede i øget forekomst af embryoletalitet og føtale cervicothoracale vaskulære og skeletabnormaliteter. Intravenøs administration af sumatriptan til drægtige kaniner i organogeneseperioden resulterede i en øget forekomst af embryodødelighed. De højeste orale og intravenøse ingen-effektdoser for udviklingstoksicitet hos kaniner var 15 og 0,75 mg/kg/dag eller henholdsvis ca. 50 og 2 gange den enkelte MRHD på 6 mg administreret subkutant på mg/m²-basis.
Oral administration af sumatriptan til rotter før og under hele graviditeten resulterede i embryoføtal toksicitet (nedsat kropsvægt, nedsat ossifikation, øget forekomst af skeletabnormaliteter). Den højeste dosis uden effekt var 50 mg/kg/dag eller ca. 80 gange den enkelte MRHD på 6 mg administreret subkutant på mg/m²-basis. Hos afkom af drægtige rotter behandlet oralt med sumatriptan under organogenese var der et fald i hvalpeoverlevelse. Den højeste dosis uden effekt for denne effekt var 60 mg/kg/dag eller ca. 100 gange den enkelte MRHD på 6 mg administreret subkutant på mg/m²-basis. Oral behandling af drægtige rotter med sumatriptan i den sidste del af drægtighedsperioden og under hele diegivningen resulterede i et fald i hvalpenes overlevelse. Den højeste dosis uden effekt for dette fund var 100 mg/kg/dag eller ca. 160 gange den enkelte MRHD på 6 mg administreret subkutant på mg/m²-basis.
Ammende mødre
Sumatriptan udskilles i modermælk efter subkutan administration. Spædbørns eksponering for sumatriptan kan minimeres ved at undgå amning i 12 timer efter behandling med IMITREX 50 mg injektion.
Pædiatrisk brug
Sikkerhed og effektivitet hos pædiatriske patienter er ikke blevet fastslået. IMITREX 100 mg injektion anbefales ikke til patienter under 18 år.
To kontrollerede kliniske forsøg evaluerede IMITREX næsespray (5 til 20 mg) hos 1.248 pædiatriske migrænere i alderen 12 til 17 år, som behandlede et enkelt anfald. Forsøgene påviste ikke effekten af IMITREX næsespray sammenlignet med placebo til behandling af migræne hos pædiatriske patienter. De bivirkninger, der blev observeret i disse kliniske forsøg, svarede til dem, der blev rapporteret i kliniske forsøg med voksne.
Fem kontrollerede kliniske forsøg (2 forsøg med enkeltangreb, 3 forsøg med multiple angreb), der evaluerede oral IMITREX (25 til 100 mg) hos pædiatriske patienter i alderen 12 til 17 år inkluderede i alt 701 pædiatriske migrænikere. Disse forsøg påviste ikke effektiviteten af oral IMITREX 25 mg sammenlignet med placebo til behandling af migræne hos pædiatriske patienter. De bivirkninger, der blev observeret i disse kliniske forsøg, svarede til dem, der blev rapporteret i kliniske forsøg med voksne. Hyppigheden af alle bivirkninger hos disse patienter så ud til at være både dosis- og aldersafhængige, hvor yngre patienter rapporterede reaktioner mere almindeligt end ældre pædiatriske patienter.
Erfaring efter markedsføring dokumenterer, at der er opstået alvorlige bivirkninger i den pædiatriske population efter brug af subkutan, oral og/eller intranasal IMITREX. Disse rapporter omfatter reaktioner, der ligner dem, der sjældent er rapporteret hos voksne, herunder slagtilfælde, synstab og død. Et myokardieinfarkt er blevet rapporteret hos en 14-årig mand efter brug af oral IMITREX; kliniske tegn opstod inden for 1 dag efter lægemiddeladministration. Kliniske data til bestemmelse af hyppigheden af alvorlige bivirkninger hos pædiatriske patienter, som kan få subkutan, oral eller intranasal IMITREX, er ikke tilgængelige på nuværende tidspunkt.
Geriatrisk brug
Kliniske forsøg med IMITREX 100 mg injektion inkluderede ikke et tilstrækkeligt antal patienter på 65 år og ældre til at afgøre, om de reagerer anderledes end yngre patienter. Andre rapporterede kliniske erfaringer har ikke identificeret forskelle i respons mellem ældre og yngre patienter. Generelt bør dosisvalg for en ældre patient være forsigtigt, sædvanligvis begyndende i den lave ende af doseringsområdet, hvilket afspejler den større hyppighed af nedsat lever-, nyre- eller hjertefunktion og af samtidig sygdom eller anden lægemiddelbehandling.
En kardiovaskulær evaluering anbefales til geriatriske patienter, som har andre kardiovaskulære risikofaktorer (f.eks. diabetes, hypertension, rygning, fedme, stærk familiehistorie med CAD) før de får IMITREX-injektion [se ADVARSLER OG FORHOLDSREGLER ].
OVERDOSIS
Koronar vasospasme blev observeret efter intravenøs administration af IMITREX 50 mg injektion [se KONTRAINDIKATIONER ]. Overdosering forventes ud fra dyredata (hunde på 0,1 g/kg, rotter på 2 g/kg) muligvis at forårsage kramper, tremor, inaktivitet, erytem i ekstremiteterne, nedsat respirationsfrekvens, cyanose, ataksi, mydriasis, reaktioner på injektionsstedet ( afskalning, hårtab og skorpedannelse) og lammelser.
Eliminationshalveringstiden for sumatriptan er ca. 2 timer [se KLINISK FARMAKOLOGI ]; monitorering af patienter efter overdosering med IMITREX Injection bør derfor fortsætte i mindst 10 timer, eller mens symptomer eller tegn varer ved.
Det er ukendt, hvilken effekt hæmodialyse eller peritonealdialyse har på serumkoncentrationerne af sumatriptan.
KONTRAINDIKATIONER
IMITREX Injection er kontraindiceret til patienter med:
- Iskæmisk koronararteriesygdom (CAD) (angina pectoris, historie med myokardieinfarkt eller dokumenteret tavs iskæmi) eller koronararterievasospasme, herunder Prinzmetals angina [se ADVARSLER OG FORHOLDSREGLER ].
- Wolff-Parkinson-Whites syndrom eller arytmier forbundet med andre hjerte-accessoriske overledningsforstyrrelser [se ADVARSLER OG FORHOLDSREGLER ].
- Anamnese med slagtilfælde eller forbigående iskæmisk anfald (TIA) eller anamnese med hemiplegisk eller basilær migræne, fordi disse patienter har en højere risiko for slagtilfælde [se ADVARSLER OG FORHOLDSREGLER ].
- Perifer vaskulær sygdom [se ADVARSLER OG FORHOLDSREGLER ].
- Iskæmisk tarmsygdom [se ADVARSLER OG FORHOLDSREGLER ].
- Ukontrolleret hypertension [se ADVARSLER OG FORHOLDSREGLER ].
- Nylig brug (dvs. inden for 24 timer) af ergotaminholdig medicin, medicin af ergot-typen (såsom dihydroergotamin eller methysergid) eller en anden 5-hydroxytryptamin1 (5-HT1) agonist [se DRUGSINTERAKTIONER ].
- Samtidig administration af en monoaminoxidase (MAO)-A-hæmmer eller nylig (inden for 2 uger) brug af en MAO-A-hæmmer [se DRUGSINTERAKTIONER , KLINISK FARMAKOLOGI ].
- Overfølsomhed over for IMITREX (angioødem og anafylaksi set) [se ADVARSLER OG FORHOLDSREGLER ].
- Svært nedsat leverfunktion [se KLINISK FARMAKOLOGI ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Sumatriptan binder med høj affinitet til humane klonede 5-HT1B/1D-receptorer. Sumatriptan udøver formentlig sin terapeutiske virkning i behandlingen af migræne og klyngehovedpine gennem agonistvirkninger ved 5-HT1B/1D-receptorerne på intrakranielle blodkar og sensoriske nerver i trigeminussystemet, hvilket resulterer i kraniekarkonstriktion og hæmning af pro-inflammatorisk neuropeptid frigøre.
Farmakodynamik
Blodtryk
Signifikant forhøjelse af blodtrykket, inklusive hypertensiv krise, er blevet rapporteret hos patienter med og uden en anamnese med hypertension [se ADVARSLER OG FORHOLDSREGLER ].
Perifere (små) arterier
Hos raske frivillige (N = 18) kunne et forsøg, der evaluerede sumatriptans virkning på perifer (små kar) arteriel reaktivitet, ikke påvise en klinisk signifikant stigning i perifer modstand.
Hjerterytme
Forbigående stigninger i blodtrykket observeret hos nogle patienter i kliniske forsøg udført under sumatriptans udvikling som behandling af migræne, var ikke ledsaget af nogen klinisk signifikante ændringer i hjertefrekvensen.
Farmakokinetik
Absorption og biotilgængelighed
Biotilgængeligheden af sumatriptan via subkutan injektion på stedet til 18 raske mandlige forsøgspersoner var 97 % ± 16 % af den opnåede efter intravenøs injektion.
Efter en enkelt 6 mg subkutan manuel injektion i deltoideusområdet af armen hos 18 raske mænd (alder: 24 ± 6 år, vægt: 70 kg), var den maksimale serumkoncentration (Cmax) af sumatriptan (gennemsnit ± standardafvigelse) 74 ± 15 ng/ml, og tiden til maksimal koncentration (Tmax) var 12 minutter efter injektion (interval: 5 til 20 minutter). I dette forsøg gav den samme dosis, der blev injiceret subkutant i låret, en Cmax på 61 ± 15 ng/ml ved manuel injektion versus 52 ± 15 ng/ml ved autoinjektorteknikker. Tmax eller absorberet mængde blev ikke ændret væsentligt af hverken injektionsstedet eller -teknikken.
Fordeling
Proteinbinding, bestemt ved ligevægtsdialyse over koncentrationsområdet fra 10 til 1.000 ng/ml er lav, ca. 14% til 21%. Effekten af sumatriptan på proteinbindingen af andre lægemidler er ikke blevet evalueret.
Efter en 6-mg subkutan injektion i deltoidområdet af armen hos 9 mænd (gennemsnitsalder: 33 år, middelvægt: 77 kg) var sumatriptans centrale distributionsvolumen 50 ± 8 liter, og distributionshalveringstiden var 15 ± 2 minutter.
Metabolisme
In vitro undersøgelser med humane mikrosomer tyder på, at sumatriptan metaboliseres af MAO, overvejende A-isoenzymet. Det meste af en radioaktivt mærket dosis af sumatriptan, der udskilles i urinen, er hovedmetabolitten indoleddikesyre (IAA) eller IAA glucuronid, som begge er inaktive.
Elimination
Efter en enkelt 6 mg subkutan dosis blev 22 % ± 4 % udskilt i urinen som uændret sumatriptan og 38 % ± 7 % som IAA-metabolitten.
Efter en 6-mg subkutan injektion i deltoidområdet af armen var den systemiske clearance af sumatriptan 1.194 ± 149 ml/min, og den terminale halveringstid var 115 ± 19 minutter.
Specifikke populationer
Alder
Sumatriptans farmakokinetik hos ældre (gennemsnitsalder: 72 år, 2 mænd og 4 kvinder) og hos forsøgspersoner med migræne (gennemsnitsalder: 38 år, 25 mænd og 155 kvinder) svarede til den hos raske mandlige forsøgspersoner (gennemsnitsalder: 30 år).
Nedsat leverfunktion
Effekten af mild til moderat leversygdom på farmakokinetikken af subkutant indgivet sumatriptan er blevet evalueret. Der var ingen signifikante forskelle i farmakokinetikken af subkutant indgivet sumatriptan hos moderat nedsat leverfunktion sammenlignet med raske kontroller. Farmakokinetikken af subkutant indgivet sumatriptan hos patienter med svært nedsat leverfunktion er ikke blevet undersøgt. Brugen af IMITREX Injection til denne population er kontraindiceret [se KONTRAINDIKATIONER ].
Race
Den systemiske clearance og Cmax for subkutan sumatriptan var ens hos sorte (n = 34) og kaukasiske (n = 38) raske mandlige forsøgspersoner.
Lægemiddelinteraktionsstudier
Monoaminoxidase-A-hæmmere
et forsøg med 14 raske kvinder reducerede forbehandling med en MAO-A-hæmmer clearance af subkutan sumatriptan, hvilket resulterede i en 2-fold stigning i arealet under sumatriptan plasmakoncentration-tid-kurven (AUC), svarende til en stigning på 40 %. i eliminationshalveringstid.
Dyretoksikologi og/eller farmakologi
Hornhindeopaciteter
Hunde, der fik oral sumatriptan, udviklede uklarheder i hornhinden og defekter i hornhindens epitel. Hornhindeopacitet blev set ved den laveste testede dosis, 2 mg/kg/dag, og var til stede efter 1 måneds behandling. Defekter i hornhindens epitel blev noteret i en 60-ugers undersøgelse. Tidligere undersøgelser for disse toksiciteter blev ikke udført, og ingen effektdoser blev ikke etableret; dog var den relative plasmaeksponering ved den laveste testede dosis ca. 3 gange den humane eksponering efter en 6 mg subkutan dosis.
Kliniske Studier
Migræne
kontrollerede kliniske forsøg, der inkluderede mere end 1.000 patienter under migræneanfald, som oplevede moderate eller svære smerter og 1 eller flere af symptomerne opregnet i tabel 3, begyndte lindring så tidligt som 10 minutter efter en 6 mg IMITREX 50 mg injektion. Lavere doser af IMITREX 100 mg injektion kan også vise sig at være effektive, selvom andelen af patienter, der opnåede tilstrækkelig lindring, blev reduceret, og latensen til denne lindring er større med lavere doser.
I undersøgelse 1 blev 6 forskellige doser af IMITREX 100 mg injektion (n = 30 hver gruppe) sammenlignet med placebo (n = 62), i et enkelt-angreb, parallel-gruppe design, blev dosis-respons forholdet fundet at være som vist i tabel 2.
2 randomiserede, placebo-kontrollerede kliniske forsøg med IMITREX 25 mg injektion 6 mg hos 1.104 patienter med moderate eller svære migrænesmerter (undersøgelse 2 og 3), begyndte lindring af mindre end 10 minutter. Hovedpinelindring, som defineret ved en reduktion af smerte fra svær eller moderat svær til mild eller ingen hovedpine, blev opnået hos 70 % af patienterne inden for 1 time efter en enkelt 6 mg subkutan dosis af IMITREX Injection. Cirka 82 % og 65 % af patienterne behandlet med IMITREX 6 mg havde hovedpinelindring og var smertefri inden for henholdsvis 2 timer.
Tabel 3 viser 1- og 2-timers effektivitetsresultater for IMITREX-injektion 6 mg i undersøgelse 2 og 3.
IMITREX 100mg Injection lindrede også fotofobi, fonofobi (lydfølsomhed), kvalme og opkastninger forbundet med migræneanfald. Tilsvarende effekt blev set, når patienter selv administrerede IMITREX 50 mg injektion ved hjælp af IMITREX 100 mg STATdose Pen.
Effekten af IMITREX Injection var upåvirket af, om migrænen var forbundet med aura eller ej, anfaldets varighed, køn eller alder på patienten eller samtidig brug af almindelige migræneprofylaktiske lægemidler (f.eks. betablokkere).
Klyngehovedpine
Effekten af IMITREX Injection til akut behandling af klyngehovedpine blev påvist i 2 randomiserede, dobbeltblindede, placebokontrollerede, 2-perioders crossover-forsøg (studie 4 og 5). Patienter i alderen 21 til 65 år blev indskrevet og blev instrueret i at behandle en moderat til meget svær hovedpine inden for 10 minutter efter debut. Hovedpinelindring blev defineret som en reduktion af hovedpinesværhedsgraden til mild eller ingen smerte. I begge forsøg var andelen af individer, der fik lindring efter 10 eller 15 minutter, signifikant større blandt patienter, der fik 6 mg IMITREX-injektion sammenlignet med dem, der fik placebo (se tabel 4).
Et estimat af den kumulative sandsynlighed for, at en patient med klyngehovedpine opnår lindring efter at være blevet behandlet med enten IMITREX 25 mg injektion eller placebo er vist i figur 1.
Figur 1: Tid til lindring af klyngehovedpine fra tidspunkt for injektion 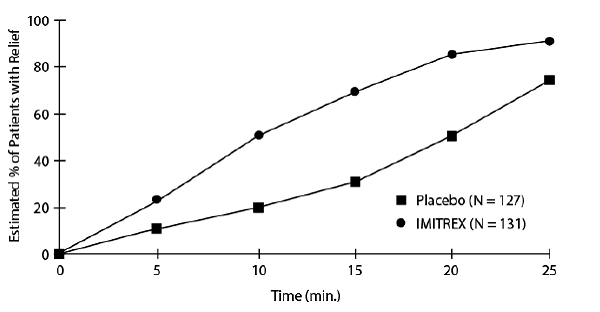
aFiguren bruger Kaplan-Meier (produktgrænse) Survivorship Plot. Patienter, der tog redningsmedicin, blev censureret efter 15 minutter.
Plottet blev konstrueret med data fra patienter, som enten oplevede lindring eller ikke havde behov for (anmodede om) redningsmedicin inden for en periode på 2 timer efter behandlingen. Som en konsekvens heraf er dataene i plottet kun afledt af en undergruppe af de 258 behandlede hovedpine (redningsmedicin var påkrævet i 52 af de 127 placebobehandlede hovedpine og 18 af de 131 hovedpine behandlet med IMITREX 50 mg injektion).
Andre data tyder på, at behandling med IMITREX 25 mg injektion ikke er forbundet med en stigning i tidligt tilbagefald af hovedpine og har ringe effekt på forekomsten af senere forekommende hovedpine (dvs. dem, der opstår efter 2, men før 18 eller 24 timer).
PATIENTOPLYSNINGER
IMITREX® (IM-i-trex) (sumatriptan succinat) Injektion
Læs denne patientinformation, før du begynder at tage IMITREX, og hver gang du får en genopfyldning. Der kan være nye oplysninger. Disse oplysninger træder ikke i stedet for at tale med din sundhedsplejerske om din medicinske tilstand eller behandling.
Hvad er den vigtigste information, jeg bør vide om IMITREX?
IMITREX kan forårsage alvorlige bivirkninger, herunder:
Hjerteanfald og andre hjerteproblemer. Hjerteproblemer kan føre til døden.
Stop med at tage IMITREX 25mg og få akut lægehjælp med det samme, hvis du har nogle af følgende symptomer på et hjerteanfald:
- ubehag i midten af dit bryst, der varer i mere end et par minutter, eller som går væk og vender tilbage
- svær trykken, smerte, tryk eller tyngde i brystet, halsen, nakken eller kæben
- smerter eller ubehag i dine arme, ryg, nakke, kæbe eller mave
- åndenød med eller uden ubehag i brystet
- bryder ud i koldsved
- kvalme eller opkastning
- føler sig svimmel
IMITREX er ikke til personer med risikofaktorer for hjertesygdomme, medmindre en hjerteundersøgelse er udført og ikke viser noget problem. Du har en højere risiko for hjertesygdomme, hvis du:
- har forhøjet blodtryk
- har højt kolesteroltal
- røg
- er overvægtige
- har diabetes
- har en familiehistorie med hjertesygdomme
Hvad er IMITREX?
IMITREX Injection er et receptpligtigt lægemiddel, der bruges til at behandle akut migrænehovedpine med eller uden aura og akut klyngehovedpine hos voksne, som er blevet diagnosticeret med migræne eller klyngehovedpine.
IMITREX 50mg bruges ikke til at behandle andre typer hovedpine såsom hemiplegisk (der gør dig ude af stand til at bevæge dig på den ene side af kroppen) eller basilær (sjælden form for migræne med aura) migræne.
IMITREX 100mg bruges ikke til at forebygge eller mindske antallet af migræne- eller klyngehovedpine, du har.
Det vides ikke, om IMITREX 100mg er sikkert og effektivt til børn under 18 år.
Hvem bør ikke tage IMITREX 100mg?
Tag ikke IMITREX 50 mg, hvis du har:
- hjerteproblemer eller en historie med hjerteproblemer
- forsnævring af blodkar til dine ben, arme, mave eller nyrer (perifer vaskulær sygdom)
- ukontrolleret højt blodtryk
- alvorlige leverproblemer
- hemiplegisk migræne eller basilær migræne. Hvis du ikke er sikker på, om du har disse typer migræne, så spørg din læge.
- haft et slagtilfælde, forbigående iskæmiske anfald (TIA) eller problemer med din blodcirkulation
- taget nogen af følgende lægemidler inden for de sidste 24 timer:
- almotriptan (AXERT®)
- eletriptan (RELPAX®)
- frovatriptan (FROVA®)
- naratriptan (AMERGE®)
- rizatriptan (MAXALT®, MAXALT-MLT®)
- sumatriptan og naproxen (TREXIMET®)
- ergotaminer (CAFERGOT®, ERGOMAR®, MIGERGOT®)
- dihydroergotamin (DHE 45®, MIGRANAL®) Spørg din læge, hvis du ikke er sikker på, om din medicin er anført ovenfor.
- en allergi over for sumatriptan eller et af indholdsstofferne i IMITREX. Se slutningen af denne indlægsseddel for en komplet liste over ingredienser i IMITREX.
Hvad skal jeg fortælle min læge, før jeg tager IMITREX?
Inden du tager IMITREX, skal du fortælle din læge om alle dine medicinske tilstande, inklusive hvis du:
- har forhøjet blodtryk
- har højt kolesteroltal
- har diabetes
- røg
- er overvægtige
- har hjerteproblemer eller familiehistorie med hjerteproblemer eller slagtilfælde
- har nyreproblemer
- har leverproblemer
- har haft epilepsi eller anfald
- ikke bruger effektiv prævention
- blive gravid, mens du tager IMITREX
- ammer eller planlægger at amme. IMITREX 25mg passerer over i din modermælk og kan skade din baby. Tal med din læge om den bedste måde at fodre din baby på, hvis du tager IMITREX.
Fortæl din læge om al den medicin, du tager, herunder receptpligtig og ikke-receptpligtig medicin, vitaminer og naturlægemidler.
IMITREX og visse andre lægemidler kan påvirke hinanden og forårsage alvorlige bivirkninger.
Fortæl især din sundhedsplejerske, hvis du tager antidepressiv medicin kaldet:
- selektive serotoningenoptagshæmmere (SSRI'er)
- serotonin noradrenalin genoptagelseshæmmere (SNRI'er)
- tricykliske antidepressiva (TCA)
- monoaminoxidasehæmmere (MAO-hæmmere)
Spørg din sundhedsudbyder eller apoteket om en liste over disse lægemidler, hvis du ikke er sikker.
Kend den medicin du tager. Hold en liste over dem for at vise din læge eller apotek, når du får en ny medicin.
Hvordan skal jeg tage IMITREX 100mg?
- Visse personer bør tage deres første dosis af IMITREX 25 mg på deres læges kontor eller i andre medicinske omgivelser. Spørg din læge, om du skal tage din første dosis i medicinske omgivelser.
- Brug IMITREX 50mg nøjagtigt som din læge fortæller dig at bruge det.
- Din læge kan ændre din dosis. Du må ikke ændre din dosis uden først at tale med din læge.
- For voksne er den sædvanlige dosis en enkelt injektion givet lige under huden.
- Du bør give en indsprøjtning, så snart symptomerne på din hovedpine begynder, men den kan gives når som helst under et migræne- eller klyngehovedpineanfald.
- Hvis du ikke fik nogen lindring efter den første injektion, må du ikke give en ny injektion uden først at tale med din læge.
- Hvis din hovedpine kommer tilbage, eller du først får en vis lindring efter din første injektion, kan du tage en ny injektion 1 time efter den første injektion, men ikke før.
- Tag ikke mere end 12 mg i en 24-timers periode.
- Hvis du bruger for meget IMITREX 25mg, skal du kontakte din læge eller gå til nærmeste skadestue med det samme.
- Du bør skrive ned, hvornår du har hovedpine, og hvornår du tager IMITREX, så du kan tale med din læge om, hvordan IMITREX 25mg virker for dig.
Hvad skal jeg undgå, mens jeg tager IMITREX?
IMITREX kan forårsage svimmelhed, svaghed eller døsighed. Hvis du har disse symptomer, må du ikke køre bil, bruge maskiner eller gøre noget, hvor du skal være opmærksom.
Hvad er de mulige bivirkninger af IMITREX 25mg?
IMITREX kan forårsage alvorlige bivirkninger. Se "Hvad er den vigtigste information, jeg bør vide om IMITREX?"
Disse alvorlige bivirkninger omfatter:
- ændringer i farve eller fornemmelse i dine fingre og tæer (Raynauds syndrom)
- mave- og tarmproblemer (gastrointestinale og coloniskæmiske hændelser). Symptomer på gastrointestinale og coloniskæmiske hændelser omfatter:
- pludselige eller stærke mavesmerter
- mavesmerter efter måltider
- vægttab
- kvalme eller opkastning
- forstoppelse eller diarré
- blodig diarré
- feber
- problemer med blodcirkulationen til dine ben og fødder (perifer vaskulær iskæmi). Symptomer på perifer vaskulær iskæmi omfatter:
- kramper og smerter i dine ben eller hofter
- følelse af tyngde eller stramhed i dine benmuskler
- brændende eller ømme smerter i dine fødder eller tæer, mens du hviler
- følelsesløshed, snurren eller svaghed i dine ben
- kold følelse eller farveændringer i 1 eller begge ben eller fødder
- nældefeber (kløende knopper); hævelse af din tunge, mund eller svælg
- overforbrug af medicin hovedpine. Nogle mennesker, der bruger for mange IMITREX 100 mg-injektioner, kan have værre hovedpine (overforbrugshovedpine). Hvis din hovedpine bliver værre, kan din læge beslutte at stoppe din behandling med IMITREX.
- serotonin syndrom. Serotonergt syndrom er et sjældent, men alvorligt problem, der kan forekomme hos personer, der bruger IMITREX, især hvis IMITREX 50 mg bruges sammen med antidepressiv medicin kaldet SSRI eller SNRI. Ring til din læge med det samme, hvis du har nogle af følgende symptomer på serotonergt syndrom:
- mentale ændringer såsom at se ting, der ikke er der (hallucinationer), agitation eller koma
- hurtig hjerterytme
- ændringer i blodtrykket
- høj kropstemperatur
- stramme muskler
- problemer med at gå
- anfald. Anfald er forekommet hos personer, der tager IMITREX, som aldrig har haft anfald før. Tal med din læge om din chance for at få anfald, mens du tager IMITREX.
De mest almindelige bivirkninger af IMITREX 50mg Injection omfatter:
- smerte eller rødme på dit injektionssted
- prikken eller følelsesløshed i dine fingre eller tæer
- svimmelhed
- varm, varm, brændende følelse i dit ansigt (rødmen)
- ubehag eller stivhed i nakken
- føler sig svag, døsig eller træt
Fortæl din læge, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af IMITREX. For mere information, spørg din læge eller apotek.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare IMITREX Injection?
- Opbevar IMITREX mellem 36°F til 86°F (2°C til 30°C).
- Opbevar din medicin væk fra lys.
- Opbevar din medicin i den medfølgende emballage eller bæretaske.
Opbevar IMITREX og al medicin utilgængeligt for børn.
Generel information om sikker og effektiv brug af IMITREX
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i patientinformationsfoldere. Brug ikke IMITREX til en tilstand, som det ikke er ordineret til. Giv ikke IMITREX 25 mg til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Denne patientinformationsfolder opsummerer de vigtigste oplysninger om IMITREX. Hvis du vil have mere information, så tal med din sundhedsplejerske. Du kan bede din sundhedsplejerske eller apotek om oplysninger om IMITREX, som er skrevet til sundhedspersonale.
For mere information, gå til www.gsk.com eller ring på 1-888-825-5249.
Hvad er ingredienserne i IMITREX Injection?
Aktiv ingrediens: sumatriptan succinat
Inaktive ingredienser: natriumklorid, vand til injektion
Denne patientinformation og brugsanvisning er godkendt af US Food and Drug Administration.
Patientbrugsanvisning
IMITREX STAT dosissystem
Læs denne patientbrugsanvisning, før du begynder at bruge IMITREX STATdose-systemet. Der kan være nye oplysninger. Disse oplysninger træder ikke i stedet for at tale med din sundhedsplejerske om din medicinske tilstand eller behandling. Du og din læge bør tale om IMITREX 25mg Injection, når du begynder at tage det og ved regelmæssige kontroller.
Opbevar IMITREX STATdose-systemet utilgængeligt for børn.
Før du bruger IMITREX STATdose-systemet
Første gang du åbner IMITREX 25mg STATdose System-boksen, er patronpakken og IMITREX STATdose Pen® allerede i bæretasken for din bekvemmelighed.
Den grå og blå Bæretaske bruges til at opbevare den tomme pen og patronpakken, når de ikke er i brug.
Det Patronpakke holder 2 individuelt forseglede Sprøjtepatroner Hver sprøjtepatron indeholder 1 dosis IMITREX® (sumatriptan succinat) injektion. Patronpakken til 4 mg styrken af denne medicin er gul, og patronpakken til 6 mg styrken er blå (som vist). Refill Cartridge Packs er tilgængelige.
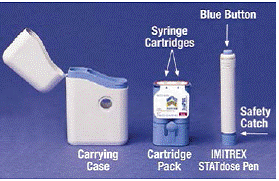
Den grå og blå Pen bruges til automatisk at injicere 1 dosis medicin fra en sprøjtepatron. Rør ikke ved Blå knap indtil du har trykket pennen mod din hud for at give en dosis. Hvis du trykker på den på et andet tidspunkt, kan du miste en dosis. Det Sikkerhedsfang forhindrer, at pennen affyres ved et uheld, indtil du er klar. Pennen virker kun, når du skyder den grå del af cylinderen ned til den blå del. Kontroller altid, at den hvide primerstang ikke stikker ud fra enden af pennen (som vist i figur B), før du isætter en ny sprøjtepatron. Hvis det stikker ud, vil du miste den dosis.
Sådan indlæses IMITREX STATdose Pen
Fyld ikke pennen, før du er klar til at give dig selv en injektion. Rør ikke ved den blå knap oven på pennen (se figur A), mens du isætter pennen.
Figur A 
Figur B 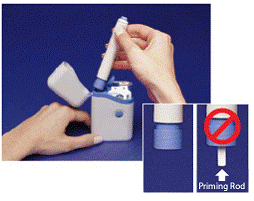
1. Åbn låget på bæretasken. De manipulationssikre forseglinger over de 2 sprøjtepatroner er mærket "A" og "B" (se Figur A indsat ).
Brug altid sprøjtepatronen mærket "A" før den, der er mærket "B", for at hjælpe dig med at holde styr på dine doser. Må ikke bruges, hvis en af forseglingen er brudt eller mangler, når du først åbner bæretasken.
2. Riv en af de manipulationssikre forseglinger af (se Figur A ). Smid forseglingen væk. Åbn låget over sprøjtepatronen.
3. Hold pennen i kammene øverst. Tag pennen ud af bæretasken (se Figur B ).
Kontroller, at den hvide primerstang ikke stikker ud fra den nederste ende af pennen (se Figur B indsat ). Hvis den stikker ud, skal du sætte pennen tilbage i bæretasken og trykke fast, indtil du mærker, at den klikker. Tag pennen ud af bæretasken.
Figur C 
4. Læg pennen i patronpakken. Drej den til højre (med uret), indtil den ikke vil dreje mere (ca. en halv omgang) (se Figur C ).
5. Hold den fyldte pen i kanterne, og træk den lige ud (se Figur D ). Det kan være nødvendigt at trække hårdt i pennen, men det er normalt. Tryk ikke på den blå knap endnu.
Figur D 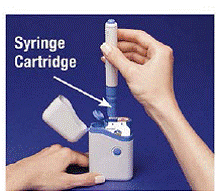
Pennen er nu klar til brug. Lade være med sæt den fyldte pen tilbage i bæretasken, da det vil beskadige nålen.
Sådan bruger du IMITREX STAT dosispennen til at tage din medicin
Inden du injicerer din medicin, skal du vælge et område med et fedtvævslag (se figur E eller figur F). Spørg din sundhedsplejerske, hvis du har spørgsmål om, hvor du skal injicere din medicin.
For at forberede det hudområde, hvor IMITREX skal injiceres, skal du tørre injektionsstedet af med en spritserviet. Rør ikke ved dette område igen, før du giver injektionen.
Figur E eller Figur F Figur G 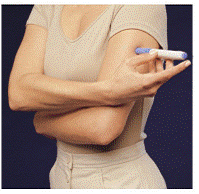
6. Uden at trykke på den blå knap, tryk den fyldte pen fast mod huden, så den grå cylinder glider ned mod den blå sektion, der holder sprøjtepatronen (se Figur D ). (Dette frigiver sikkerhedsfanget, der forhindrer pennen i at skyde ved en fejl, indtil du er klar.)
7. Tryk på den blå knap. Hold pennen stille for mindst 5 sekunder . Hvis pennen tages væk fra huden for tidligt, vil ikke al medicinen komme ud.
8 Efter 5 sekunder , tag forsigtigt pennen væk fra din hud. Nålen vil blive vist (se Figur G ). Rør ikke ved nålen.
Sådan tømmes IMITREX STAT dosispennen efter at have taget din medicin
Lige efter du har taget en dosis med pennen, skal du returnere den brugte sprøjtepatron til patronpakken.
Figur H Figur I og Figur J 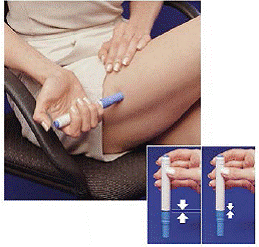
9. Skub pennen ned i den tomme side af patronpakken så langt den kan komme (se Figur H ).
10. Drej pennen til venstre (mod uret) omkring en halv omgang, indtil den frigøres fra sprøjtepatronen (se Figur I ).
11. Træk den tomme pen ud af patronpakken (se Figur J ).
Fordi pennen nu er blevet brugt, vil den hvide primerstang stikke ud fra den nederste ende af pennen (se Figur J ).
12. Luk låget til patronpakningen over den brugte sprøjtepatron. Når de brugte sprøjtepatroner er indsat korrekt, er patronpakken en beskyttende engangsetui, der hjælper dig med at undgå nålestik og bruge sprøjterne korrekt.
13. Sæt pennen tilbage i bæretasken, og tryk den fast, indtil du mærker, at den klikker. Luk bæretaskens låg. Dette gør pennen klar til næste brug.
Hvis låget ikke lukker, skal du skubbe pennen ned, indtil du mærker, at den klikker. Luk derefter låget.
Sådan tager du en brugt patronpakke ud
Når begge sprøjtepatroner er blevet brugt, tages patronpakken ud af bæretasken. Genbrug eller genbrug aldrig en sprøjtepatron.
Figur K Figur L 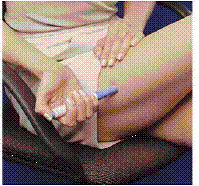
14. Åbn bæretaskens låg.
15. Hold bæretasken med én hånd, og tryk på de 2 knapper på hver side af bæretasken (se Figur K ).
16. Træk forsigtigt patronpakken ud med den anden hånd (se Figur L ).
17. Smid patronpakken væk eller bortskaf den som instrueret af din læge. Der kan være særlige statslige og lokale love for bortskaffelse af brugte kanyler og sprøjter. Opbevar altid utilgængeligt for børn.
Sådan indsætter du en ny patronpakke
Figur M Figur N og Figur O 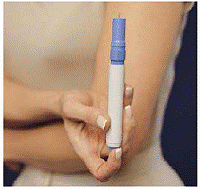
18. Tag den nye patronpakke ud af æsken. Tag ikke de manipulationssikre forseglinger af (se figur M).
19. Læg patronpakken i bæretasken. Skub den jævnt ned (se Figur N ).
20. Patronpakken klikker på plads, når de 2 knapper vises gennem hullerne i bæretasken (se Figur O ). Luk låget.
Denne patientinformation og brugsanvisning er godkendt af US Food and Drug Administration.
