Maxalt 5mg, 10mg Rizatriptan Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Maxalt, og hvordan bruges det?
Maxalt er en receptpligtig medicin, der bruges til at behandle symptomerne på migrænehovedpine. Maxalt 10mg kan bruges alene eller sammen med anden medicin.
Maxalt tilhører en klasse af lægemidler kaldet serotonin 5-HT-receptoragonister; Antimigrænemidler.
Det vides ikke, om Maxalt 5mg er sikkert og effektivt til børn under 6 år.
Hvad er de mulige bivirkninger af Maxalt?
Maxalt kan forårsage alvorlige bivirkninger, herunder:
- pludselige og stærke mavesmerter,
- blodig diarré,
- kold følelse,
- følelsesløshed i dine fødder og hænder,
- svær hovedpine,
- sløret syn,
- dunkende i nakken eller ørerne,
- brystsmerter eller tryk,
- smerte breder sig til din kæbe eller skulder,
- kvalme,
- svedeture,
- agitation,
- hallucinationer,
- feber,
- rystende,
- hurtig puls,
- muskelstivhed,
- trækninger,
- tab af koordination,
- kvalme,
- tab af koordination,
- opkastning,
- diarré,
- pludselig følelsesløshed eller svaghed (især på den ene side af kroppen),
- pludselig kraftig hovedpine,
- sløret tale, og
- problemer med syn eller balance
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Maxalt omfatter:
- svimmelhed,
- døsighed,
- føler sig træt, og
- smerte eller følelse af tryk i halsen eller brystet
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Maxalt. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
MAXALT 10mg indeholder rizatriptanbenzoat, en selektiv 5-hydroxytryptamin1B/1D (5-HT1B/1D) receptoragonist.
Rizatriptanbenzoat beskrives kemisk som: N,N-dimethyl-5-(1H-1,2,4-triazol-1-ylmethyl)-1Hindol-3-ethanaminmonobenzoat og dets strukturformel er:
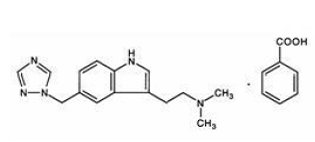
Dens empiriske formel er C15H19N5•C7H6O2, hvilket repræsenterer en molekylvægt af den frie base på 269,4. Rizatriptanbenzoat er et hvidt til råhvidt, krystallinsk fast stof, der er opløseligt i vand ved ca. 42 mg pr. ml (udtrykt som fri base) ved 25°C.
MAXALT 5 mg tabletter og MAXALT-MLT oralt disintegrerende tabletter er tilgængelige til oral administration i styrker på 5 og 10 mg (svarende til henholdsvis 7,265 mg eller 14,53 mg af benzoatsaltet). Hver komprimeret tablet indeholder følgende inaktive ingredienser: lactosemonohydrat, mikrokrystallinsk cellulose, prægelatineret stivelse, jernoxid (rødt) og magnesiumstearat. Hver lyofiliseret oralt desintegrerende tablet indeholder følgende inaktive ingredienser: gelatine, mannitol, glycin, aspartam og pebermyntesmag.
INDIKATIONER
MAXALT® og MAXALT-MLT® er indiceret til akut behandling af migræne med eller uden aura hos voksne og pædiatriske patienter i alderen 6 til 17 år.
Brugsbegrænsninger
- MAXALT bør kun anvendes, hvor der er etableret en klar diagnose af migræne. Hvis en patient ikke har noget respons på det første migræneanfald behandlet med MAXALT 10 mg, bør diagnosen migræne genovervejes, før MAXALT 5 mg administreres til behandling af efterfølgende anfald.
- MAXALT 10mg er ikke indiceret til behandling af hemiplegisk eller basilær migræne [se KONTRAINDIKATIONER ].
- MAXALT 10mg er ikke indiceret til forebyggelse af migræneanfald.
- Sikkerhed og effektivitet af MAXALT 5mg er ikke blevet fastslået for klyngehovedpine.
DOSERING OG ADMINISTRATION
Doseringsoplysninger hos voksne
Den anbefalede startdosis af MAXALT er enten 5 mg eller 10 mg til akut behandling af migræne hos voksne. 10 mg dosis kan give en større effekt end 5 mg dosis, men kan have større risiko for bivirkninger [se Kliniske Studier ].
Gendosering hos voksne
Selvom effektiviteten af en anden dosis eller efterfølgende doser ikke er blevet fastslået i placebokontrollerede forsøg, kan en anden dosis gives 2 timer efter den første dosis, hvis migrænehovedpinen vender tilbage. Den maksimale daglige dosis bør ikke overstige 30 mg i nogen 24-timers periode. Sikkerheden ved at behandle i gennemsnit mere end fire hovedpine i en 30-dages periode er ikke blevet fastslået.
Doseringsoplysninger hos pædiatriske patienter (alder 6 til 17 år)
Dosering til pædiatriske patienter er baseret på patientens kropsvægt. Den anbefalede dosis af MAXALT 10 mg er 5 mg til patienter, der vejer mindre end 40 kg (88 lb), og 10 mg til patienter, der vejer 40 kg (88 lb) eller mere.
Effekten og sikkerheden af behandling med mere end én dosis MAXALT inden for 24 timer hos pædiatriske patienter i alderen 6 til 17 år er ikke blevet fastlagt.
Administration af MAXALT-MLT oralt desintegrerende tabletter
For MAXALT-MLT oralt desintegrerende tabletter er administration med væske ikke nødvendig. Oralt desintegrerende tabletter er pakket i en blisterpakning i en ydre aluminiumspose, og patienter bør ikke fjerne blisterpakningen fra den ydre pose før lige før dosering. Blisterpakningen skal derefter skrælles op med tørre hænder og den oralt desintegrerende tablet placeres på tungen, hvor den opløses og sluges sammen med spyttet.
Dosisjustering for patienter på propranolol
Voksne patienter
Hos voksne patienter, der tager propranolol, anbefales kun 5 mg dosis af MAXALT 5 mg, op til maksimalt 3 doser i en 24-timers periode (15 mg) [se DRUGSINTERAKTIONER og KLINISK FARMAKOLOGI ].
Pædiatriske patienter
Til pædiatriske patienter, der vejer 40 kg (88 lb) eller mere, der tager propranolol, anbefales kun en enkelt 5-mg dosis af MAXALT (maksimal dosis på 5 mg i en 24-timers periode). MAXALT bør ikke ordineres til propranolol-behandlede pædiatriske patienter, der vejer mindre end 40 kg (88 lb) [se DRUGSINTERAKTIONER og KLINISK FARMAKOLOGI ].
HVORDAN LEVERET
Doseringsformer og styrker
MAXALT tabletter
- mg tabletter er lyserøde, kapselformede, komprimerede tabletter mærket MRK på den ene side og 266 på den anden.
- 10 mg tabletter er lyserøde, kapselformede, komprimerede tabletter kodet MAXALT 5 mg på den ene side og MRK 267 på den anden.
MAXALT-MLT oralt desintegrerende tabletter
- 5 mg oralt desintegrerende tabletter er hvide til råhvide, runde frysetørrede tabletter præget med en modificeret trekant på den ene side.
- 10 mg oralt desintegrerende tabletter er hvide til råhvide, runde frysetørrede tabletter præget med en modificeret firkant på den ene side.
Opbevaring og håndtering
nr. 3732 - MAXALT Tabletter, 5 mg , er lyserøde, kapselformede, komprimerede tabletter kodet
MRK på den ene side og 266 på den anden:
NDC 0006-0266-18, karton med 18 tabletter.
nr. 3733 - MAXALT 5mg Tabletter, 10 mg , er lyserøde, kapselformede, komprimerede tabletter kodet MAXALT 10mg på den ene side og MRK 267 på den anden:
NDC 0006-0267-18, karton med 18 tabletter.
nr. 3800 - MAXALT-MLT oralt desintegrerende tabletter, 5 mg er hvide til råhvide, runde frysetørrede oralt desintegrerende tabletter præget med en modificeret trekant på den ene side og måler 10,0-11,5 mm (side-til-side) med en pebermyntesmag. Hver oralt desintegrerende tablet er individuelt pakket i en blisterpakning inde i en aluminiumspose (pose). De leveres som følger:
NDC 0006-3800-18, 6 x brugsenhed bæretaske med 3 oralt desintegrerende tabletter (18 tabletter i alt).
nr. 3801 - MAXALT-MLT oralt desintegrerende tabletter, 10 mg , er hvide til råhvide, runde frysetørrede oralt desintegrerende tabletter præget med en modificeret firkant på den ene side og måler 12,0-13,8 mm (side-til-side) med en pebermyntesmag. Hver oralt desintegrerende tablet er individuelt pakket i en blisterpakning inde i en aluminiumspose (pose). De leveres som følger:
NDC 0006-3801-18, 6 x brugsenhed bæretaske med 3 oralt desintegrerende tabletter (18 tabletter i alt).
Opbevaring
Opbevar MAXALT 5mg tabletter ved stuetemperatur, 15°C-30°C (59°F-86°F).
Opbevar MAXALT-MLT oralt desintegrerende tabletter ved stuetemperatur, 15°C-30°C (59°F-86°F).
Distribueret af: Merck Sharp & Dohme Corp., et datterselskab af MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Revideret: oktober 2019
BIVIRKNINGER
Følgende bivirkninger er beskrevet mere detaljeret i andre sektioner af mærkningen:
- Myokardieiskæmi, myokardieinfarkt og Prinzmetals angina [se ADVARSLER OG FORHOLDSREGLER ].
- Arytmier [se ADVARSLER OG FORHOLDSREGLER ].
- Bryst-, hals-, nakke- og/eller kæbesmerter/tæthed/tryk [se ADVARSLER OG FORHOLDSREGLER ].
- Cerebrovaskulære begivenheder [se ADVARSLER OG FORHOLDSREGLER ].
- Andre vasospasmereaktioner [se ADVARSLER OG FORHOLDSREGLER ].
- Medicinoverforbrug Hovedpine [se ADVARSLER OG FORHOLDSREGLER ].
- Serotoninsyndrom [se ADVARSLER OG FORHOLDSREGLER ].
- Forøgelse af blodtrykket [se ADVARSLER OG FORHOLDSREGLER ].
Erfaring med kliniske forsøg
Fordi kliniske undersøgelser udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske undersøgelser af et lægemiddel ikke direkte sammenlignes med frekvenser i de kliniske undersøgelser af et andet lægemiddel og afspejler muligvis ikke frekvenserne observeret i praksis.
Voksne
Forekomst i kontrollerede kliniske forsøg
Bivirkninger af MAXALT blev vurderet i kontrollerede kliniske undersøgelser, som omfattede over 3700 voksne patienter, som fik enkelte eller flere doser af MAXALT-tabletter. De mest almindelige bivirkninger under behandling med MAXALT (≥5 % i begge behandlingsgrupper og større end placebo) var asteni/træthed, somnolens, smerte/trykfornemmelse og svimmelhed. Disse bivirkninger så ud til at være dosisrelaterede.
Tabel 1 viser bivirkningerne (hyppighed ≥2 % og større end placebo) efter en enkelt dosis MAXALT 5 mg til voksne.
Hyppigheden af bivirkninger i kliniske forsøg steg ikke, når der blev taget op til tre doser inden for 24 timer. Bivirkningsfrekvensen var også uændret ved samtidig brug af lægemidler, der almindeligvis tages til migræneprofylakse (inklusive propranolol), orale præventionsmidler eller analgetika. Hyppigheden af bivirkninger var ikke påvirket af alder eller køn. Der var utilstrækkelige data til at vurdere racens indvirkning på forekomsten af bivirkninger.
Andre begivenheder observeret i forbindelse med administrationen af MAXALT hos voksne
det følgende afsnit præsenteres hyppigheden af mindre almindeligt rapporterede bivirkninger, som ikke blev rapporteret i andre afsnit af mærkningen. Da rapporterne inkluderer hændelser observeret i åbne undersøgelser, kan MAXALT 5 mgs rolle i deres årsagssammenhæng ikke bestemmes pålideligt. Ydermere begrænser variabilitet i forbindelse med rapportering af uønskede hændelser, den terminologi, der bruges til at beskrive uønskede hændelser, værdien af de kvantitative frekvensestimater. Hændelsesfrekvenser beregnes som antallet af patienter, der brugte MAXALT og rapporterede en hændelse divideret med det samlede antal patienter, der blev eksponeret for MAXALT (N=3716). Alle rapporterede hændelser forekom med en incidens på ≥1 % eller menes at være rimeligt forbundet med brugen af lægemidlet. Hændelser er yderligere klassificeret inden for kropssystemkategorier og opregnet i rækkefølge efter faldende frekvens ved hjælp af følgende definitioner: hyppige bivirkninger er dem, der er defineret som dem, der forekommer hos mindst (>)1/100 patienter; sjældne bivirkninger er dem, der forekommer hos 1/100 til 1/1000 patienter; og sjældne bivirkninger er dem, der forekommer hos færre end 1/1000 patienter.
Generel: Sjældent var ansigtsødem. Sjældne var synkope og ødem/hævelse.
Atypiske fornemmelser: Hyppige var varme fornemmelser.
Kardiovaskulær: Hyppigt var hjertebanken. Sjældne var takykardi, kolde ekstremiteter og bradykardi.
Fordøjelse: Hyppigt var diarré og opkastning. Sjældne var dyspepsi, tungeødem og abdominal udspilning.
Muskuloskeletale: Sjældne var muskelsvaghed, stivhed, myalgi og muskelkramper/spasmer.
Neurologisk/psykiatrisk: Hyppige var hypoæstesi, eufori og tremor. Sjældne var vertigo, søvnløshed, forvirring/desorientering, gangabnormitet, hukommelsessvækkelse og agitation.
Åndedræt: Hyppig var dyspnø. Sjældent var svælgødem.
Særlige sanser: Sjældent var sløret syn og tinnitus. Sjældent var øjenhævelse.
Hud og hudvedhæng: Hyppig var rødmen. Sjældent var svedtendens, kløe, udslæt og nældefeber. Sjældent var erytem, hedeture.
Bivirkningsprofilen set med MAXALT-MLT oralt desintegrerende tabletter svarede til den set med MAXALT 10 mg tabletter.
Pædiatriske patienter i alderen 6 til 17 år
Forekomst i kontrollerede kliniske forsøg hos pædiatriske patienter
Bivirkninger af MAXALT-MLT blev vurderet i et kontrolleret klinisk forsøg i akut behandling af migræne (undersøgelse 7), som omfattede i alt 1382 pædiatriske patienter i alderen 6-17 år, hvoraf 977 (72 %) fik mindst én dosis undersøgelsesbehandling (MAXALT-MLT og/eller placebo) [se Kliniske Studier ]. Hyppigheden af bivirkninger rapporteret for pædiatriske patienter i det akutte kliniske forsøg var ens hos patienter, der fik MAXALT, som dem, der fik placebo. Bivirkningsmønsteret hos pædiatriske patienter forventes at være det samme som hos voksne.
Andre hændelser observeret i forbindelse med administration af MAXALT-MLT hos pædiatriske patienter
det følgende afsnit præsenteres hyppigheden af mindre almindeligt rapporterede bivirkninger. Da rapporterne inkluderer hændelser observeret i åbne undersøgelser, kan MAXALT-MLT's rolle i deres årsagssammenhæng ikke bestemmes pålideligt. Ydermere begrænser variabilitet i forbindelse med rapportering af uønskede hændelser, den terminologi, der bruges til at beskrive uønskede hændelser, værdien af de kvantitative frekvensestimater.
Hændelseshyppigheden er beregnet som antallet af pædiatriske patienter i alderen 6 til 17 år, der brugte MAXALT-MLT og rapporterede en hændelse divideret med det samlede antal patienter, der blev eksponeret for MAXALT-MLT (N=1068). Alle rapporterede hændelser forekom med en incidens på ≥1 % eller menes at være rimeligt forbundet med brugen af lægemidlet. Hændelser er yderligere klassificeret inden for systemorganklasse og opregnet i rækkefølge efter faldende frekvens ved hjælp af følgende definitioner: hyppige bivirkninger er dem, der forekommer hos (>)1/100 pædiatriske patienter; sjældne bivirkninger er dem, der forekommer hos 1/100 til 1/1000 pædiatriske patienter; og sjældne bivirkninger er dem, der forekommer hos færre end 1/1000 patienter.
Generel: Hyppig var træthed.
Øre- og labyrintlidelser: Sjældent var hypoakusis.
Gastrointestinale lidelser: Hyppigt var ubehag i maven.
Forstyrrelser i nervesystemet: Sjældne var unormal koordination, forstyrrelse i opmærksomhed og præsynkope.
Psykiatriske lidelser: Sjældent var hallucinationer.
Postmarketing oplevelse
Det følgende afsnit opregner potentielt vigtige bivirkninger, der er opstået i klinisk praksis, og som er blevet rapporteret spontant til forskellige overvågningssystemer. De opregnede hændelser omfatter alle undtagen dem, der allerede er anført i andre sektioner af mærkningen eller dem, der er for generelle til at være informative. Fordi rapporterne citerer hændelser, der er rapporteret spontant fra verdensomspændende erfaring efter markedsføring, kan hyppigheden af hændelser og MAXALT 5 mgs rolle i deres årsagssammenhæng ikke bestemmes pålideligt.
Neurologisk/psykiatrisk: Anfald.
Generel: Allergiske tilstande, herunder anafylaksi/anafylaktoid reaktion, angioødem, hvæsende vejrtrækning og toksisk epidermal nekrolyse [se KONTRAINDIKATIONER ].
Særlige sanser: Dysgeusi.
DRUGSINTERAKTIONER
Propranolol
Dosis af MAXALT 5 mg bør justeres hos propranolol-behandlede patienter, da propranolol har vist sig at øge plasma-AUC af rizatriptan med 70 % [se DOSERING OG ADMINISTRATION og KLINISK FARMAKOLOGI ].
Ergotholdige lægemidler
Ergotholdige lægemidler er blevet rapporteret at forårsage langvarige vasospastiske reaktioner. Fordi disse virkninger kan være additive, er brug af ergotaminholdig eller ergot-type medicin (som dihydroergotamin eller methysergid) og MAXALT 5 mg inden for 24 timer kontraindiceret [se KONTRAINDIKATIONER ].
Andre 5-HT1-agonister
Da deres vasospastiske virkninger kan være additive, er samtidig administration af MAXALT 10mg og andre 5-HT1-agonister inden for 24 timer efter hinanden kontraindiceret [se KONTRAINDIKATIONER ].
SSRI/SNRI og Serotonin Syndrom
Tilfælde af serotonergt syndrom er blevet rapporteret under samtidig administration af triptaner og selektive serotonin-genoptagelseshæmmere (SSRI'er) eller serotonin-noradrenalin-genoptagelseshæmmere (SNRI'er) [se ADVARSLER OG FORHOLDSREGLER ].
Monoaminoxidasehæmmere
MAXALT er kontraindiceret til patienter, der tager MAO-A-hæmmere og ikke-selektive MAO-hæmmere. En specifik MAO-A-hæmmer øgede den systemiske eksponering af rizatriptan og dets metabolit [se KONTRAINDIKATIONER og KLINISK FARMAKOLOGI ].
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Myokardieiskæmi, myokardieinfarkt og Prinzmetals angina
MAXALT bør ikke gives til patienter med iskæmisk eller vasospastisk koronararteriesygdom. Der har været sjældne rapporter om alvorlige hjertebivirkninger, inklusive akut myokardieinfarkt, som er opstået inden for få timer efter administration af MAXALT. Nogle af disse reaktioner opstod hos patienter uden kendt koronararteriesygdom (CAD). 5-HT1-agonister, inklusive MAXALT 5mg, kan forårsage koronararterievasospasme (Prinzmetals angina), selv hos patienter uden en historie med CAD.
Triptan-naive patienter, som har flere kardiovaskulære risikofaktorer (f.eks. øget alder, diabetes, hypertension, rygning, fedme, stærk familiehistorie med CAD) bør have en kardiovaskulær evaluering inden de får MAXALT. Hvis der er tegn på CAD eller koronararterievasospasme, bør MAXALT ikke administreres [se KONTRAINDIKATIONER ]. For patienter, som har en negativ kardiovaskulær evaluering, bør det overvejes at administrere den første dosis af MAXALT i et medicinsk overvåget miljø og at udføre et elektrokardiogram (EKG) umiddelbart efter administration af MAXALT 10 mg. Periodisk kardiovaskulær evaluering bør overvejes hos intermitterende langtidsbrugere af MAXALT, som har kardiovaskulære risikofaktorer.
Arytmier
Livstruende forstyrrelser af hjerterytmen, herunder ventrikulær takykardi og ventrikulær fibrillering, der fører til døden, er blevet rapporteret inden for få timer efter administration af 5-HT1-agonister. Afbryd MAXALT 10 mg, hvis disse forstyrrelser opstår.
Bryst-, hals-, nakke- og/eller kæbesmerter/tæthed/tryk
Som med andre 5-HT1-agonister opstår fornemmelser af stramhed, smerte, tryk og tyngde i precordium, hals, nakke og kæbe almindeligvis efter behandling med MAXALT 5mg og er normalt ikke-kardielt. Men hvis der er mistanke om en hjertesygdom, bør patienterne vurderes. Patienter, der har vist sig at have CAD, og patienter med Prinzmetals variant angina bør ikke modtage 5-HT1-agonister.
Cerebrovaskulære begivenheder
Cerebral blødning, subaraknoidal blødning og slagtilfælde er forekommet hos patienter behandlet med 5-HT1-agonister, og nogle har resulteret i dødsfald. I en række tilfælde forekommer det muligt, at de cerebrovaskulære hændelser var primære, idet 5-HT1-agonisten var blevet administreret i den ukorrekte tro, at de oplevede symptomer var en konsekvens af migræne, mens de ikke var det. Patienter med migræne kan også have øget risiko for visse cerebrovaskulære hændelser (f.eks. slagtilfælde, blødning, forbigående iskæmisk anfald). Seponer MAXALT, hvis der opstår en cerebrovaskulær hændelse.
Som ved andre akutte migrænebehandlinger bør man, før hovedpine behandles hos patienter, der ikke tidligere er diagnosticeret som migrænikere, og hos migrænikere, der har atypiske symptomer, udvises for at udelukke andre potentielt alvorlige neurologiske tilstande. MAXALT bør ikke administreres til patienter med en anamnese med slagtilfælde eller forbigående iskæmisk anfald [se KONTRAINDIKATIONER ].
Andre vasospasmereaktioner
5-HT1-agonister, inklusive MAXALT, kan forårsage ikke-koronare vasospastiske reaktioner, såsom perifer vaskulær iskæmi, gastrointestinal vaskulær iskæmi og infarkt (som viser sig med mavesmerter og blodig diarré), miltinfarkt og Raynauds syndrom. Hos patienter, som oplever symptomer eller tegn, der tyder på ikke-koronar vasospasmereaktion efter brug af en hvilken som helst 5-HT1-agonist, bør den formodede vasospasmereaktion udelukkes, før de får yderligere MAXALT 10 mg doser.
Rapporter om forbigående og permanent blindhed og betydeligt delvist synstab er blevet rapporteret ved brug af 5-HT1-agonister. Da synsforstyrrelser kan være en del af et migræneanfald, er en årsagssammenhæng mellem disse hændelser og brugen af 5-HT1-agonister ikke klarlagt.
Medicin Overforbrug Hovedpine
Overforbrug af lægemidler til akut migræne (f.eks. ergotamin, triptaner, opioider eller en kombination af lægemidler i 10 eller flere dage om måneden) kan føre til forværring af hovedpine (overforbrugshovedpine). Medicinoverforbrugshovedpine kan vise sig som migrænelignende daglig hovedpine eller som en markant stigning i hyppigheden af migræneanfald. Afgiftning af patienter, herunder seponering af de overforbrugte lægemidler, og behandling af abstinenssymptomer (som ofte omfatter en forbigående forværring af hovedpine) kan være nødvendig.
Serotonin syndrom
Serotonergt syndrom kan forekomme med triptaner, herunder MAXALT 10 mg, især under samtidig administration med selektive serotonin-genoptagelseshæmmere (SSRI'er), serotonin-noradrenalin-genoptagelseshæmmere (SNRI'er), tricykliske antidepressiva (TCA'er) og MAO-hæmmere [se DRUGSINTERAKTIONER ]. Symptomer på serotonergt syndrom kan omfatte ændringer i mental status (f.eks. agitation, hallucinationer, koma), autonom ustabilitet (f.eks. takykardi, labilt blodtryk, hypertermi), neuromuskulære afvigelser (f.eks. hyperrefleksi, ukoordination) og/eller gastrointestinale symptomer (f.eks. kvalme) , opkastning, diarré). Begyndelsen af symptomer kan forekomme inden for minutter til timer efter at have modtaget en ny eller en større dosis af en serotonerg medicin. Behandling med MAXALT bør seponeres, hvis der er mistanke om serotonergt syndrom [se DRUGSINTERAKTIONER og PATIENTOPLYSNINGER ].
Forøgelse i blodtryk
Signifikant forhøjelse af blodtrykket, herunder hypertensiv krise med akut svækkelse af organsystemer, er blevet rapporteret i sjældne tilfælde hos patienter med og uden en anamnese med hypertension, der fik 5-HT1-agonister, inklusive MAXALT. Hos raske unge voksne mandlige og kvindelige patienter, som fik maksimale doser af MAXALT (10 mg hver 2. time for 3 doser), blev der observeret let stigning i blodtrykket (ca. 2-3 mmHg). MAXALT er kontraindiceret til patienter med ukontrolleret hypertension [se KONTRAINDIKATIONER ].
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( PATIENTOPLYSNINGER ).
Risiko for myokardieiskæmi og/eller infarkt, Prinzmetals angina, andre vasospasme-relaterede hændelser og cerebrovaskulære hændelser
Informer patienterne om, at MAXALT kan forårsage alvorlige kardiovaskulære bivirkninger såsom myokardieinfarkt eller slagtilfælde. Selvom alvorlige kardiovaskulære hændelser kan opstå uden advarselssymptomer, bør patienter være opmærksomme på tegn og symptomer på brystsmerter, åndenød, svaghed, sløret tale og bør bede om lægehjælp, når de observerer ethvert vejledende tegn eller symptomer. Patienterne bør informeres om vigtigheden af denne opfølgning [se ADVARSLER OG FORHOLDSREGLER ].
Serotonin syndrom
Patienter bør advares om risikoen for serotonergt syndrom ved brug af MAXALT 10 mg eller andre triptaner, især ved kombineret brug med selektive serotoningenoptagshæmmere (SSRI'er) eller serotonin noradrenalin genoptagelseshæmmere (SNRI'er) [se ADVARSLER OG FORHOLDSREGLER , DRUGSINTERAKTIONER , og KLINISK FARMAKOLOGI ].
Graviditet
Informer patienterne om, at MAXALT ikke bør anvendes under graviditet, medmindre den potentielle fordel opvejer den potentielle risiko for fosteret [se Brug i specifikke populationer ].
Amning
Råd patienter til at underrette deres sundhedsplejerske, hvis de ammer eller planlægger at amme [se Brug i specifikke populationer ].
Evne til at udføre komplekse opgaver
Da migræne eller behandling med MAXALT 10 mg kan forårsage døsighed og svimmelhed, instruer patienterne i at vurdere deres evne til at udføre komplekse opgaver under migræneanfald og efter administration af MAXALT.
Medicin Overforbrug Hovedpine
Informer patienterne om, at brug af akutte migrænemidler i 10 eller flere dage om måneden kan føre til en forværring af hovedpine, og tilskynd patienterne til at registrere hovedpinefrekvens og stofbrug (f.eks. ved at føre en hovedpinedagbog) [se ADVARSLER OG FORHOLDSREGLER ].
Håndtering af oralt disintegrerende tabletpakker
Instruer patienterne i ikke at fjerne blisteren fra den ydre aluminiumspose, før de er klar til at bruge den oralt desintegrerende tablet indeni [se DOSERING OG ADMINISTRATION ].
Patienter med phenylketonuri
Informer phenylketonuriske patienter om, at MAXALT-MLT oralt desintegrerende tabletter indeholder phenylalanin (en komponent i aspartam). Hver 5 mg oralt desintegrerende tablet indeholder 1,1 mg phenylalanin, og hver 10 mg oralt desintegrerende tablet indeholder 2,1 mg phenylalanin [se Brug i specifikke populationer ].
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
Orale karcinogenicitetsundersøgelser af rizatriptan blev udført på mus (100 uger) og rotter (106 uger) i doser på op til 125 mg/kg/dag. Der var ingen tegn på en stigning i tumorincidens relateret til rizatriptan hos nogen af arterne. Plasmaeksponeringer (AUC) ved den højeste testede dosis var ca. 150 (mus) og 240 gange (rotter) end hos mennesker ved den maksimalt anbefalede humane dosis (MRHD) på 30 mg/dag.
Mutagenese
Rizatriptan var hverken mutagen eller klastogen i en række af in vitro og in vivo genetiske toksicitetsundersøgelser, herunder: mikrobiel mutagenese (Ames) assay, in vitro pattedyrcelle mutagenese og kromosomafvigelsesassay og in vivo kromosomafvigelsesassay hos mus.
Forringelse af fertilitet
Oral administration af rizatriptan (0, 2, 10 eller 100 mg/kg/dag) til hunrotter før og under parring og fortsatte gennem drægtighed og laktation resulterede ikke i nogen effekt på fertiliteten; dog blev der observeret ændret brunstcyklicitet og forsinkelser i tid til parring ved den højeste testede dosis. Plasmaeksponeringen ved dosis uden effekt (10 mg/kg/dag) for reproduktionstoksicitet var ca. 15 gange større end hos mennesker ved MRHD.
Oral administration af rizatriptan (0, 5, 35 eller 250 mg/kg/dag) til hanrotter før og under parring resulterede ikke i nogen svækkelse af fertilitet eller reproduktionsevne. Plasmaeksponering (AUC) ved den højeste testede dosis var ca. 550 gange større end hos mennesker ved MRHD.
Brug i specifikke populationer
Graviditet
Risikooversigt
Tilgængelige humane data om brugen af MAXALT til gravide kvinder er ikke tilstrækkelige til at drage konklusioner om lægemiddelassocieret risiko for alvorlige fødselsdefekter og abort.
dyreforsøg blev der observeret udviklingstoksicitet efter oral administration af rizatriptan under graviditet (nedsat føtal kropsvægt hos rotter) eller under hele graviditeten og amning (øget dødelighed, nedsat kropsvægt og neuroadfærdsnedsættelse hos rotteafkom) ved maternal plasmaeksponeringer større end forventes ved terapeutiske doser til mennesker [se Dyredata ].
I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 % til 4 % og 15 % til 20 %. Den rapporterede frekvens af større fødselsdefekter blandt fødsler til kvinder med migræne varierer fra 2,2 % til 2,9 %, og den rapporterede frekvens af abort var 17 %, hvilket svarer til frekvenserne rapporteret hos kvinder uden migræne.
Kliniske overvejelser
Sygdomsassocieret moder- og/eller embryo-/fosterrisiko
Hos kvinder med migræne er der en øget risiko for uønskede perinatale udfald hos moderen, herunder præeklampsi og svangerskabshypertension.
Data
Menneskelige data
Graviditetsregistret for MAXALT identificerede ikke noget mønster af medfødte anomalier eller andre uønskede fødselsudfald i perioden 1998 til 2018. Manglen på identifikation af ethvert mønster skal dog ses med forsigtighed, da antallet af fremtidige rapporter med udfaldsoplysninger var lav og gav ikke tilstrækkelig kraft til at opdage en øget risiko for individuelle fødselsdefekter forbundet med brugen af MAXALT. Derudover var der et betydeligt tab af opfølgning i de prospektive graviditetsrapporter, hvilket yderligere komplicerede denne vurdering af en sammenhæng mellem MAXALT og ethvert mønster af medfødte anomalier eller andre uønskede fødselsudfald.
en undersøgelse, der brugte data fra det svenske medicinske fødselsregister, blev levendefødte kvinder, der rapporterede om brug af triptaner eller ergoter under graviditet, sammenlignet med kvinder, der ikke gjorde det. Af de 157 fødsler med eksponering for rizatriptan i første trimester, blev 7 spædbørn født med misdannelser (relativ risiko 1,01 [95 % CI: 0,40 til 2,08]). En undersøgelse, der brugte forbundne data fra Medical Birth Registry of Norway til den norske receptdatabase, sammenlignede graviditetsudfald hos kvinder, der indløste recepter på triptaner under graviditeten, såvel som en sammenligningsgruppe for migrænesygdomme, der kun indløste recepter på triptaner før graviditeten, sammenlignet med en befolkningskontrolgruppe. Af de 310 kvinder, der indløste recepter på rizatriptan i løbet af første trimester, havde 10 spædbørn med alvorlige medfødte misdannelser (OR 1,03 [95 % CI: 0,55 til 1,93]), mens for de 271 kvinder, der indløste recepter på rizatriptan før, men ikke under , graviditet, havde 12 spædbørn med store medfødte misdannelser (OR 1,48 [95 % CI: 0,83 til 2,64]), hver sammenlignet med befolkningssammenligningsgruppen.
Dyredata
Når rizatriptan (0, 2, 10 eller 100 mg/kg/dag) blev administreret oralt til drægtige rotter under hele organogenesen, blev der observeret et fald i føtal kropsvægt ved de højeste testede doser. Ved den midterste dosis (10 mg/kg/dag), som var en dosis uden effekt for uønskede virkninger på embryoføtal udvikling, var plasmaeksponeringen (AUC) ca. 15 gange større end hos mennesker ved den maksimalt anbefalede humane dosis (MRHD) på 30 mg/dag. Når rizatriptan (0, 5, 10 eller 50 mg/kg/dag) blev administreret oralt til drægtige kaniner under hele organogenesen, blev der ikke observeret nogen uønskede fostereffekter. Plasmaeksponering (AUC) ved den højeste testede dosis var 115 gange den hos mennesker ved MRHD. Placental overførsel af lægemiddel til fosteret blev påvist i begge arter.
Oral administration af rizatriptan (0, 2, 10 eller 100 mg/kg/dag) til hunrotter før og under parring og fortsatte gennem drægtighed og diegivning resulterede i reduceret kropsvægt hos afkom fra fødslen og gennem hele diegivningen overhovedet, men den laveste dosis testet (2 mg/kg/dag). Plasmaeksponering (AUC) ved dosis uden effekt (2 mg/kg/dag) for bivirkninger på postnatal udvikling svarede til den hos mennesker ved MRHD.
Oral administration af rizatriptan (0, 5, 100 eller 250 mg/kg/dag) gennem hele organogenese og laktation resulterede i neonatal dødelighed, reduceret kropsvægt (som fortsatte i voksenalderen) og nedsat neuroadfærdsfunktion hos afkom overhovedet, men den laveste dosis testet. Plasmaeksponering (AUC) ved dosis uden effekt for bivirkninger på postnatal udvikling (5 mg/kg/dag) var ca. 8 gange den hos mennesker ved MRHD.
Amning
Risikooversigt
Der er ingen data om tilstedeværelsen af rizatriptan eller nogen aktive metabolitter i modermælk eller om virkningen af rizatriptan på det ammede spædbarn eller på mælkeproduktionen.
Rizatriptan blev udskilt i rottemælk med niveauer i mælk ca. 6 gange højere end i moderens plasma.
De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for MAXALT eller MAXALT-MLT og eventuelle negative virkninger på det ammede spædbarn fra MAXALT eller MAXALT-MLT eller fra den underliggende moderens tilstand.
Data
Efter oral administration af rizatriptan til diegivende rotter i en dosis på 100 mg/kg/dag, oversteg lægemiddelkoncentrationerne af rizatriptan i mælkeprøver maternelle plasma-lægemiddelkoncentrationer med ca. 6 gange.
Pædiatrisk brug
Sikkerhed og effektivitet hos pædiatriske patienter under 6 år er ikke blevet fastlagt. Effekten og sikkerheden af MAXALT 5 mg til akut behandling af migræne hos patienter i alderen 6 til 17 år blev fastslået i et tilstrækkeligt og velkontrolleret studie [se Kliniske Studier ].
Hyppigheden af bivirkninger rapporteret for pædiatriske patienter i det akutte kliniske forsøg var ens hos patienter, der fik MAXALT 5 mg, som dem, der fik placebo. Bivirkningsmønsteret hos pædiatriske patienter forventes at være det samme som hos voksne.
Geriatrisk brug
Kliniske undersøgelser af MAXALT 5 mg inkluderede ikke et tilstrækkeligt antal forsøgspersoner på 65 år og derover til at afgøre, om de reagerer anderledes end yngre forsøgspersoner. Andre rapporterede kliniske erfaringer har ikke identificeret forskelle i respons mellem ældre og yngre patienter.
Selvom farmakokinetikken for rizatriptan var ens hos ældre (i alderen ≥ 65 år) og hos yngre voksne (n=17), bør dosisvalg for ældre patienter generelt være forsigtigt, begyndende i den lave ende af dosisområdet. Dette afspejler den større hyppighed af nedsat lever-, nyre- eller hjertefunktion og af samtidig sygdom eller anden medikamentel behandling.
Geriatriske patienter, som har andre kardiovaskulære risikofaktorer (f.eks. diabetes, hypertension, rygning, fedme, stærk familiehistorie med koronararteriesygdom) bør have en kardiovaskulær evaluering inden de får MAXALT [se ADVARSLER OG FORHOLDSREGLER ].
Patienter med phenylketonuri
Oralt disintegrerende tabletter indeholder phenylalanin (en komponent af aspartam). De 5- og 10-mg oralt desintegrerende tabletter indeholder henholdsvis 1,1 og 2,1 mg phenylalanin.
OVERDOSIS
Ingen overdosering af MAXALT blev rapporteret under kliniske forsøg med voksne.
Nogle voksne patienter, som fik 40 mg MAXALT 5 mg enten en enkelt dosis eller som to doser med et 2-timers interdosis interval, havde svimmelhed og somnolens.
I et klinisk farmakologisk studie, hvor 12 voksne forsøgspersoner fik MAXALT 5 mg, i samlede kumulative doser på 80 mg (givet inden for fire timer), oplevede to af forsøgspersonerne synkope, svimmelhed, bradykardi inklusive tredje grads AV-blok, opkastning og/eller inkontinens .
I det langsigtede, åbne studie, der involverede 606 behandlede pædiatriske migrænikere i alderen 12 til 17 år (hvoraf 432 blev behandlet i mindst 12 måneder), tog 151 patienter (25 %) to 10 mg doser MAXALT-MLT inden for en 24-timers periode. Bivirkninger for 3 af disse patienter omfattede abdominalt ubehag, træthed og dyspnø.
Baseret på farmakologien for MAXALT 10 mg kan der desuden forekomme hypertension eller myokardieiskæmi efter overdosering. Gastrointestinal dekontaminering (dvs. maveskylning efterfulgt af aktivt kul) bør overvejes hos patienter, der mistænkes for en overdosis med MAXALT. Klinisk og elektrokardiografisk monitorering bør fortsættes i mindst 12 timer, selvom der ikke observeres kliniske symptomer.
Virkningen af hæmo- eller peritonealdialyse på serumkoncentrationen af rizatriptan er ukendt.
KONTRAINDIKATIONER
MAXALT 5mg er kontraindiceret til patienter med:
- Iskæmisk koronararteriesygdom (angina pectoris, anamnese med myokardieinfarkt eller dokumenteret stille iskæmi) eller anden væsentlig underliggende kardiovaskulær sygdom [se ADVARSLER OG FORHOLDSREGLER ].
- Koronararterievasospasme inklusive Prinzmetals angina [se ADVARSLER OG FORHOLDSREGLER ].
- Anamnese med slagtilfælde eller forbigående iskæmisk anfald (TIA) [se ADVARSLER OG FORHOLDSREGLER ].
- Perifer vaskulær sygdom (PVD) [se ADVARSLER OG FORHOLDSREGLER ].
- Iskæmisk tarmsygdom [se ADVARSLER OG FORHOLDSREGLER ].
- Ukontrolleret hypertension [se ADVARSLER OG FORHOLDSREGLER ].
- Nylig brug (dvs. inden for 24 timer) af en anden 5-HT1-agonist, ergotaminholdig medicin eller medicin af ergot-typen (såsom dihydroergotamin eller methysergid) [se DRUGSINTERAKTIONER ].
- Hemiplegisk eller basilær migræne [se INDIKATIONER ].
- Samtidig administration eller nylig seponering (dvs. inden for 2 uger) af en MAO-A-hæmmer [se DRUGSINTERAKTIONER og KLINISK FARMAKOLOGI ].
- Overfølsomhed over for rizatriptan eller et eller flere af hjælpestofferne (se angioødem og anafylaksi) [se BIVIRKNINGER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Rizatriptan binder med høj affinitet til humane klonede 5-HT1B/1D-receptorer. MAXALT 10mg udøver formentlig sin terapeutiske virkning i behandlingen af migrænehovedpine ved at binde sig til 5-HT1B/1D-receptorer placeret på intrakranielle blodkar og sensoriske nerver i trigeminussystemet.
Farmakokinetik
Absorption
Rizatriptan absorberes fuldstændigt efter oral administration. Den gennemsnitlige orale absolutte biotilgængelighed af MAXALT 10 mg tabletten er ca. 45 %, og den gennemsnitlige maksimale plasmakoncentration (Cmax) nås på ca. 1-1,5 timer (Tmax). Tilstedeværelsen af migrænehovedpine så ikke ud til at påvirke absorptionen eller farmakokinetikken af rizatriptan. Mad har ingen signifikant effekt på biotilgængeligheden af rizatriptan, men forsinker tiden til at nå maksimal koncentration med en time. I kliniske forsøg blev MAXALT 10 mg administreret uden hensyntagen til mad.
Biotilgængeligheden og Cmax for rizatriptan var ens efter administration af MAXALT tabletter og MAXALT-MLT oralt disintegrerende tabletter, men absorptionshastigheden er noget langsommere med MAXALT-MLT, med Tmax forsinket med op til 0,7 time. AUC for rizatriptan er ca. 30 % højere hos kvinder end hos mænd. Der opstod ingen akkumulering ved gentagen dosering.
Fordeling
Det gennemsnitlige distributionsvolumen er ca. 140 liter hos mandlige forsøgspersoner og 110 liter hos kvindelige forsøgspersoner. Rizatriptan er minimalt (14%) bundet til plasmaproteiner.
Metabolisme
Rizatriptans primære metabolismevej er via oxidativ deaminering af monoaminoxidase-A (MAO-A) til indoleddikesyremetabolitten, som ikke er aktiv ved 5-HT1B/1D-receptoren. N-monodesmethyl-rizatriptan, en metabolit med aktivitet svarende til moderforbindelsens aktivitet på 5-HT1B/1D-receptoren, dannes i mindre grad. Plasmakoncentrationer af N-monodesmethyl-rizatriptan er ca. 14 % af moderforbindelsens koncentrationer, og det elimineres med en tilsvarende hastighed. Andre mindre metabolitter, N-oxidet, 6-hydroxyforbindelsen og sulfatkonjugatet af 6-hydroxymetabolitten, er ikke aktive ved 5-HT1B/1D-receptoren.
Elimination
Den samlede radioaktivitet af den administrerede dosis genfundet over 120 timer i urin og fæces var henholdsvis 82 % og 12 % efter en enkelt 10 mg oral administration af 14C-rizatriptan. Efter oral administration af 14C-rizatriptan tegnede rizatriptan sig for ca. 17 % af den cirkulerende plasmaradioaktivitet. Ca. 14 % af en oral dosis udskilles i urinen som uændret rizatriptan, mens 51 % udskilles som indoleddikesyremetabolit, hvilket indikerer betydelig first-pass metabolisme.
Plasmahalveringstiden for rizatriptan hos mænd og kvinder er i gennemsnit 2-3 timer.
Cytokrom P450 isoformer
Rizatriptan er ikke en hæmmer af aktiviteten af human levercytokrom P450 isoform 3A4/5, 1A2, 2C9, 2C19 eller 2E1; rizatriptan er en kompetitiv hæmmer (Ki=1400 nM) af cytochrom P450 2D6, men kun ved høje, klinisk irrelevante koncentrationer.
Særlige Populationer
Geriatrisk
Rizatriptans farmakokinetik hos raske ældre frivillige uden migræne (alder 65-77 år) var den samme som hos yngre frivillige uden migræne (18-45 år).
Pædiatrisk
Rizatriptans farmakokinetik blev bestemt hos pædiatriske migrænikere i alderen 6 til 17 år. Eksponeringer efter enkeltdosisadministration af 5 mg MAXALT-MLT til pædiatriske patienter, der vejede 20-39 kg (44-87 lb) eller 10 mg MAXALT-MLT til pædiatriske patienter, der vejede ≥40 kg (88 lb) svarede til dem, der blev observeret efter enkeltdosis administration af 10 mg MAXALT-MLT til voksne.
Køn
Den gennemsnitlige AUC0-∞ og Cmax for rizatriptan (10 mg oralt) var henholdsvis ca. 30 % og 11 % højere hos kvinder sammenlignet med mænd, mens Tmax forekom på omtrent samme tidspunkt.
Nedsat leverfunktion
Efter oral administration til patienter med nedsat leverfunktion forårsaget af mild til moderat alkoholisk levercirrhose, var plasmakoncentrationerne af rizatriptan ens hos patienter med mild leverinsufficiens sammenlignet med en kontrolgruppe af forsøgspersoner med normal leverfunktion; Plasmakoncentrationer af rizatriptan var ca. 30 % højere hos patienter med moderat leverinsufficiens.
Nedsat nyrefunktion
Hos patienter med nedsat nyrefunktion (kreatininclearance 10-60 ml/min/1,73 m2) var AUC0-∞ for rizatriptan ikke signifikant anderledes end hos personer med normal nyrefunktion. Hos hæmodialysepatienter (kreatininclearance
Race
Farmakokinetiske data viste ingen signifikante forskelle mellem afroamerikanske og kaukasiske forsøgspersoner.
Lægemiddelinteraktioner
[Se også DRUGSINTERAKTIONER ]
Monoaminoxidasehæmmere
Rizatriptan metaboliseres hovedsageligt via monoaminoxidase, 'A'-undertype (MAO-A). Plasmakoncentrationer af rizatriptan kan øges af lægemidler, der er selektive MAO-A-hæmmere (f.eks. moclobemid) eller ikke-selektive MAO-hæmmere [type A og B] (f.eks. isocarboxazid, phenelzin, tranylcypromin og pargylin). I et lægemiddelinteraktionsstudie, hvor MAXALT 10 mg blev administreret til forsøgspersoner (n=12), der fik samtidig behandling med den selektive, reversible MAO-A-hæmmer, moclobemid 150 mg tid, var der gennemsnitlige stigninger i rizatriptan AUC og Cmax på 119 % og 41% henholdsvis; og AUC for den aktive N-monodesmethyl-metabolit af rizatriptan var øget med mere end 400 %. Interaktionen forventes at være større med irreversible MAO-hæmmere. Der forventes ingen farmakokinetisk interaktion hos patienter, der får selektive MAO-B-hæmmere [se KONTRAINDIKATIONER og DRUGSINTERAKTIONER ].
Propranolol
en undersøgelse af samtidig administration af propranolol 240 mg/dag og en enkelt dosis rizatriptan 10 mg til raske voksne forsøgspersoner (n=11), blev den gennemsnitlige plasma-AUC for rizatriptan øget med 70 % under propranolol-administration og en fire gange stigning blev observeret i et emne. AUC for den aktive N-monodesmethylmetabolit af rizatriptan blev ikke påvirket af propranolol [se DOSERING OG ADMINISTRATION og DRUGSINTERAKTIONER ].
Nadolol/Metoprolol
I et lægemiddelinteraktionsstudie blev virkningerne af flere doser af nadolol 80 mg eller metoprolol 100 mg hver 12. time på farmakokinetikken af en enkelt dosis på 10 mg rizatriptan evalueret hos raske forsøgspersoner (n=12). Der blev ikke observeret nogen farmakokinetiske interaktioner.
Paroxetin
I en undersøgelse af interaktionen mellem den selektive serotoningenoptagshæmmer (SSRI) paroxetin 20 mg/dag i to uger og en enkelt dosis MAXALT 10 mg hos raske forsøgspersoner (n=12), hverken plasmakoncentrationerne af rizatriptan eller dets sikkerhedsprofil var påvirket af paroxetin [se ADVARSLER OG FORHOLDSREGLER , DRUGSINTERAKTIONER , og PATIENTOPLYSNINGER ].
Orale præventionsmidler
en undersøgelse af samtidig administration af et oralt præventionsmiddel i 6 dages administration af MAXALT (10-30 mg/dag) hos raske kvindelige frivillige (n=18), påvirkede rizatriptan ikke plasmakoncentrationerne af ethinylestradiol eller norethindron.
Kliniske Studier
Voksne
Effekten af MAXALT 5 mg tabletter blev fastslået i fire multicenter, randomiserede, placebokontrollerede forsøg. Patienter inkluderet i disse undersøgelser var primært kvinder (84 %) og kaukasiske (88 %) med en gennemsnitsalder på 40 år (interval fra 18 til 71). Patienterne blev instrueret i at behandle en moderat til svær hovedpine. Hovedpinerespons, defineret som en reduktion af moderate eller svære hovedpinesmerter til ingen eller milde hovedpinesmerter, blev vurderet i op til 2 timer (undersøgelse 1) eller op til 4 timer efter dosering (undersøgelse 2, 3 og 4). Tilknyttede symptomer på kvalme, fotofobi og fonofobi og opretholdelse af respons op til 24 timer efter dosis blev evalueret. En anden dosis af MAXALT 10 mg tabletter blev tilladt 2 til 24 timer efter dosering til behandling af tilbagevendende hovedpine i undersøgelse 1 og 2. Yderligere analgetika og/eller antiemetika blev tilladt 2 timer efter indledende behandling til redning i alle fire undersøgelser.
alle undersøgelser var procentdelen af patienter, der opnåede hovedpinerespons 2 timer efter behandling, signifikant større hos patienter, der fik enten MAXALT 5 eller 10 mg sammenlignet med dem, der fik placebo. I en separat undersøgelse var doser på 2,5 mg ikke forskellige fra placebo. Doser større end 10 mg var forbundet med en øget forekomst af bivirkninger. Resultaterne fra de fire kontrollerede undersøgelser er opsummeret i tabel 2.
Sammenligninger af lægemiddelydelse baseret på resultater opnået i forskellige kliniske forsøg er muligvis ikke pålidelige. Fordi undersøgelser udføres på forskellige tidspunkter, med forskellige prøver af patienter, af forskellige efterforskere, der anvender forskellige kriterier og/eller forskellige fortolkninger af de samme kriterier, under forskellige betingelser (dosis, doseringsregime osv.), kvantitative estimater af behandlingsrespons og tidspunktet for respons kan forventes at variere betydeligt fra undersøgelse til undersøgelse.
Den estimerede sandsynlighed for at opnå et indledende hovedpinerespons inden for 2 timer efter behandling i de samlede undersøgelser 1, 2, 3 og 4 er afbildet i figur 1.
Figur 1: Estimeret sandsynlighed for at opnå en indledende hovedpinerespons med 2 timer i poolede undersøgelser 1, 2, 3 og 4* 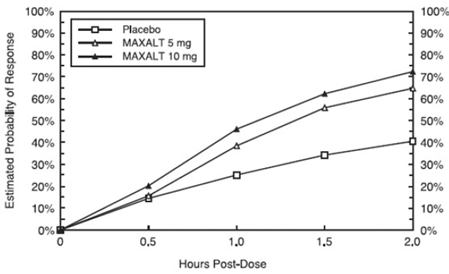
For patienter med migræne-associeret fotofobi, fonofobi og kvalme ved baseline var der en nedsat forekomst af disse symptomer efter administration af MAXALT sammenlignet med placebo.
To til 24 timer efter den indledende dosis af undersøgelsesbehandlingen fik patienterne lov til at bruge yderligere behandling for smerterespons i form af en anden dosis undersøgelsesbehandling eller anden medicin. Den estimerede sandsynlighed for, at patienter tager en anden dosis eller anden medicin mod migræne i løbet af 24 timer efter den indledende dosis af undersøgelsesbehandlingen er opsummeret i figur 2.
Figur 2: Estimeret sandsynlighed for, at patienter tager en anden dosis MAXALT 10 mg tabletter eller anden medicin mod migræne i løbet af de 24 timer efter den indledende dosis af undersøgelsesbehandling i poolede undersøgelser 1, 2, 3 og 4* 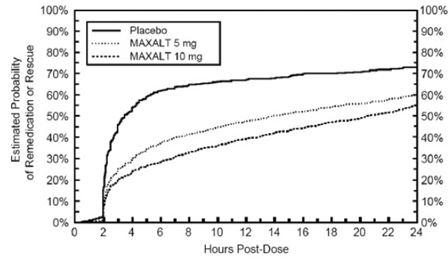
Effektiviteten var upåvirket af tilstedeværelsen af aura; efter patientens køn eller alder; eller ved samtidig brug af almindelige migræneprofylaktiske lægemidler (f.eks. betablokkere, calciumkanalblokkere, tricykliske antidepressiva) eller orale præventionsmidler. I yderligere to lignende undersøgelser var effekten upåvirket af forholdet til menstruation. Der var utilstrækkelige data til at vurdere racens indvirkning på effekten.
MAXALT-MLT oralt desintegrerende tabletter
Effekten af MAXALT-MLT blev fastslået i to multicenter, randomiserede, placebokontrollerede undersøgelser, som i design svarede til forsøgene med MAXALT-tabletter (studie 5 og 6). Patienterne blev instrueret i at behandle en moderat til svær hovedpine. Patienter behandlet i disse undersøgelser var primært kvinder (88 %) og kaukasiske (95 %) med en gennemsnitsalder på 42 år (interval 18-72).
begge undersøgelser var procentdelen af patienter, der opnåede hovedpinerespons 2 timer efter behandling, signifikant større hos patienter, der fik enten MAXALT-MLT 5 eller 10 mg sammenlignet med dem, der fik placebo. Resultaterne fra undersøgelse 5 og 6 er opsummeret i tabel 3.
Den estimerede sandsynlighed for at opnå et indledende hovedpinerespons inden for 2 timer efter behandling med MAXALT-MLT i de samlede undersøgelser 5 og 6 er afbildet i figur 3.
Figur 3: Estimeret sandsynlighed for at opnå en indledende hovedpinerespons med MAXALT-MLT med 2 timer i poolede undersøgelser 5 og 6* 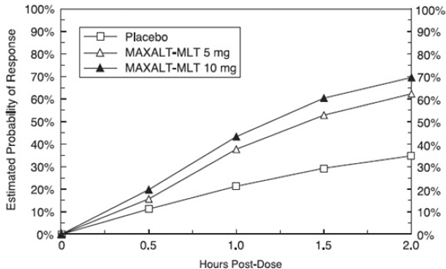
For patienter med migræne-associeret fotofobi og fonofobi ved baseline var der en nedsat forekomst af disse symptomer efter administration af MAXALT-MLT sammenlignet med placebo.
To til 24 timer efter den indledende dosis af undersøgelsesbehandlingen fik patienterne lov til at bruge yderligere behandling for smerterespons i form af en anden dosis undersøgelsesbehandling eller anden medicin. Den estimerede sandsynlighed for, at patienter tager en anden dosis eller anden medicin mod migræne i løbet af 24 timer efter den indledende dosis af undersøgelsesbehandlingen er opsummeret i figur 4.
Figur 4: Estimeret sandsynlighed for, at patienter tager en anden dosis MAXALT-MLT eller anden medicin mod migræne i løbet af 24 timer efter den indledende dosis af undersøgelsesbehandling i poolede undersøgelser 5 og 6* 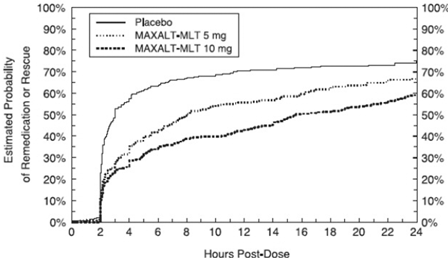
Pædiatriske patienter i alderen 6 til 17 år
Effekten af MAXALT-MLT hos pædiatriske patienter i alderen 6 til 17 år blev evalueret i et multicenter, randomiseret, dobbelt-blindt, placebokontrolleret, parallelgruppe klinisk forsøg (studie 7). Patienterne skulle have mindst en 6-måneders historie med migræneanfald (med eller uden aura), som normalt varede 3 timer eller mere (når de ikke blev behandlet). Patientpopulationen har historisk set ikke reageret på NSAID'er og acetaminophenbehandling.
Patienterne blev instrueret i at behandle et enkelt migræneanfald med hovedpinesmerter af moderat til svær intensitet. Behandlingsfasen af undersøgelsen havde to faser. Trin 1 blev brugt til at identificere placebo-non-responders, som derefter gik ind i trin 2, hvor patienterne blev randomiseret til MAXALT-MLT eller placebo. Ved at bruge en vægtbaseret doseringsstrategi fik patienter på 20 kg til
Gennemsnitsalderen for den undersøgte patientpopulation var 13 år. 61 procent af patienterne var kaukasiske, og 56 procent af patienterne var kvinder. Procentdelen af patienter, der opnåede det primære effektmål med ingen hovedpinesmerter 2 timer efter behandling, var signifikant højere hos patienter, der fik MAXALT-MLT, sammenlignet med dem, der fik placebo (33 % vs. 24 %). Resultaterne af undersøgelse 7 er opsummeret i tabel 4.
Den observerede procentdel af pædiatriske patienter, der ikke opnår hovedpinesmerter inden for 2 timer efter indledende behandling med MAXALT-MLT, er vist i figur 5.
Figur 5: Observeret procentdel af patienter, der ikke rapporterer hovedpinesmerter 2 timer efter dosis i undersøgelse 7 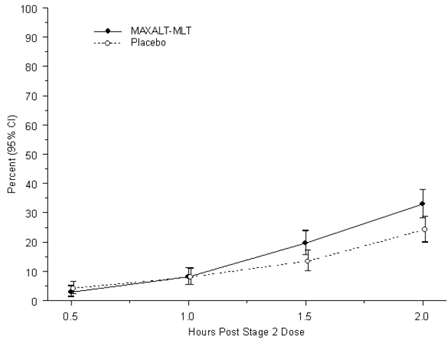
Prævalensen af de eksplorative endepunkter med fravær af migræne-associerede symptomer (kvalme, fotofobi og fonofobi) 2 timer efter indtagelse af dosis var ikke statistisk signifikant forskellig mellem patienter, der fik MAXALT-MLT, og dem, der fik placebo.
PATIENTOPLYSNINGER
MAXALT® (max-awlt)
MAXALT-MLT® (rizatriptanbenzoat) Tabletter og oralt desintegrerende tabletter
Læs denne patientinformation, før du begynder at tage MAXALT®, og hver gang du får en genopfyldning. Der kan være nye oplysninger. Disse oplysninger træder ikke i stedet for at tale med din læge om din medicinske tilstand eller din behandling.
Medmindre andet er angivet, gælder oplysningerne i denne indlægsseddel for både MAXALT 10 mg tabletter og for MAXALT-MLT® oralt desintegrerende tabletter.
Hvad er MAXALT?
MAXALT er et receptpligtigt lægemiddel, der tilhører en klasse af lægemidler kaldet triptaner. MAXALT fås som en traditionel tablet (MAXALT) og som en oralt desintegrerende tablet (MAXALT-MLT).
MAXALT 5mg og MAXALT-MLT bruges til at behandle migræneanfald med eller uden aura hos voksne og børn i alderen 6 til 17 år.
MAXALT 5mg må ikke bruges til at forhindre migræneanfald.
MAXALT er ikke til behandling af hemiplegisk eller basilær migræne.
Det vides ikke, om MAXALT er sikkert og effektivt til behandling af klyngehovedpine.
Det vides ikke, om det er sikkert og effektivt at tage mere end 1 dosis MAXALT på 24 timer hos børn i alderen 6 til 17 år.
Det vides ikke, om MAXALT er sikkert og effektivt til børn under 6 år.
Hvem bør ikke tage MAXALT?
Tag ikke MAXALT, hvis du:
- har eller har haft hjerteproblemer
- har eller har haft et slagtilfælde eller et forbigående iskæmisk anfald (TIA)
- har eller har haft problemer med blodkar, herunder iskæmisk tarmsygdom
- har ukontrolleret forhøjet blodtryk
- har taget anden Triptan-medicin inden for de sidste 24 timer
- har taget ergotholdig medicin inden for de seneste 24 timer
- har hemiplegisk eller basilær migræne
- tage monoaminoxidase (MAO)-hæmmer eller har taget en MAO-hæmmer inden for de sidste 2 uger
- er allergisk over for rizatriptanbenzoat eller et af indholdsstofferne i MAXALT. Se slutningen af denne indlægsseddel for en komplet liste over ingredienser i MAXALT.
Tal med din læge, før du tager denne medicin, hvis du har en af ovenstående tilstande, eller hvis du ikke er sikker på, om du tager nogen af disse lægemidler.
Hvad skal jeg fortælle min læge, før jeg tager MAXALT?
Før du tager MAXALT, fortæl din læge, hvis du:
- har eller har haft hjerteproblemer, forhøjet blodtryk, brystsmerter eller åndenød
- har nogen risikofaktorer for hjerteproblemer eller blodkarproblemer såsom:
- højt blodtryk
- højt kolesteroltal
- rygning
- fedme
- diabetes
- familiehistorie med hjerteproblemer
- du er efter overgangsalderen
- du er en mand over 40
- har phenylketonuri (PKU). MAXALT-MLT oralt desintegrerende tabletter indeholder phenylalanin.
- har nyre- eller leverproblemer
- har nogen anden medicinsk tilstand
- er gravid eller planlægger at blive gravid. Det vides ikke, om MAXALT vil skade dit ufødte barn. Hvis du bliver gravid, mens du tager MAXALT 5mg, skal du tale med din læge.
- ammer eller planlægger at amme. Det vides ikke, om MAXALT 10 mg udskilles i din modermælk. Tal med din læge om den bedste måde at fodre din baby på, hvis du tager MAXALT.
Fortæl din læge om al den medicin du tager, herunder receptpligtig og ikke-receptpligtig medicin, vitaminer og naturlægemidler.
MAXALT 10mg og anden medicin kan påvirke hinanden og forårsage bivirkninger. MAXALT kan påvirke den måde, anden medicin virker på, og anden medicin kan påvirke, hvordan MAXALT 5mg virker.
Fortæl det især din læge, hvis du tager:
- medicin indeholdende propranolol såsom Inderal®, Inderal® LA eller Innopran® XL
- medicin, der bruges til at behandle humørsygdomme, herunder selektive serotoningenoptagelseshæmmere (SSRI'er) eller serotonin-noradrenalin-genoptagelseshæmmere (SNRI'er).
Spørg din læge eller apoteket om en liste over disse lægemidler, hvis du er i tvivl.
Kend den medicin du tager. Hold en liste over dem for at vise din læge og apotek, når du får en ny medicin.
Hvordan skal jeg tage MAXALT?
- Tag MAXALT nøjagtigt som din læge fortæller dig at tage det.
- Din læge vil fortælle dig, hvor meget MAXALT 5 mg du skal tage, og hvornår du skal tage det.
- Sådan tager du MAXALT-MLT:
- Lad MAXALT-MLT oralt desintegrerende tabletter blive i pakken, den kommer i, indtil du er klar til at tage den. Når du er klar til at tage det:
- Fjern blisteren fra folieposen. Skub ikke den oralt opløselige MAXALT-MLT-tablet gennem blisterpakningen.
- Fjern blisterpakningen med tørre hænder, og læg den oralt opløselige MAXALT-MLT-tablet på din tunge. Tabletten vil opløses og blive synket sammen med dit spyt. Ingen væske er nødvendig for at tage den oralt desintegrerende tablet.
- Lad MAXALT-MLT oralt desintegrerende tabletter blive i pakken, den kommer i, indtil du er klar til at tage den. Når du er klar til at tage det:
- Hvis din hovedpine kommer tilbage efter din første MAXALT 10 mg dosis:
- Til voksne: en anden dosis kan tages 2 timer efter den første dosis. Tag ikke mere end 30 mg MAXALT i en 24-timers periode (tag f.eks. ikke mere end 3 10-mg tabletter i en 24-timers periode).
- Til børn i alderen 6 til 17 år: Det vides ikke, om det er sikkert og effektivt at tage mere end 1 dosis MAXALT 5 mg på 24 timer. Tal med din læge om, hvad du skal gøre, hvis din hovedpine ikke forsvinder eller vender tilbage.
- Hvis du tager for meget MAXALT 5 mg, skal du straks kontakte din læge eller gå til den nærmeste skadestue.
Hvad skal jeg undgå, mens jeg tager MAXALT?
MAXALT 5mg kan forårsage svimmelhed, svaghed eller besvimelse. Hvis du har disse symptomer, må du ikke køre bil, bruge maskiner eller gøre noget, der kræver, at du er opmærksom.
Hvad er de mulige bivirkninger af MAXALT 5mg?
MAXALT 5mg kan forårsage alvorlige bivirkninger. Ring til din læge eller gå til den nærmeste skadestue med det samme, hvis du tror, du har nogen af de alvorlige bivirkninger ved MAXALT, herunder:
- hjerteanfald. Symptomer på et hjerteanfald kan omfatte:
- ubehag i brystet i midten af dit bryst, der varer i mere end et par minutter, eller som går væk og vender tilbage
- ubehag i brystet, der føles som ubehageligt tryk, klem, mæthed eller smerte
- smerter eller ubehag i dine arme, ryg, nakke, kæbe eller mave
- åndenød med eller uden ubehag i brystet
- bryder ud i koldsved
- kvalme eller opkastning
- føler sig svimmel
- slag. Symptomer på et slagtilfælde kan omfatte følgende pludselige symptomer:
- følelsesløshed eller svaghed i dit ansigt, arm eller ben, især på den ene side af din krop
- forvirring, problemer med at tale eller forstå
- problemer med at se på det ene eller begge dine øjne
- problemer med at gå, svimmelhed, tab af balance eller koordination
- svær hovedpine uden kendt årsag
- problemer med blodkar. Symptomer på problemer med blodkar kan omfatte:
- mavesmerter
- blodig diarré
- synsproblemer
- kulde og følelsesløshed i hænder og fødder
- serotonin syndrom. En tilstand kaldet serotonergt syndrom kan opstå, når Triptan-medicin såsom MAXALT tages sammen med visse andre lægemidler. Symptomer på serotonergt syndrom kan omfatte:
- agitation
- hallucinationer
- koma
- hurtig hjerterytme
- hurtige ændringer i dit blodtryk
- øget kropstemperatur
- muskelspasme
- tab af koordination
- kvalme, opkastning eller diarré
- øget blodtryk.
De mest almindelige bivirkninger af MAXALT hos voksne omfatter:
- føler sig søvnig eller træt
- smerter eller tryk i brystet eller halsen
- svimmelhed
Fortæl det til din læge, hvis du har en bivirkning, som generer dig, eller som ikke forsvinder.
Hvis du tager MAXALT 10 mg for ofte, kan det resultere i, at du får kronisk hovedpine. I sådanne tilfælde skal du kontakte din læge, da du muligvis skal stoppe med at tage MAXALT.
Disse er ikke alle de mulige bivirkninger af MAXALT. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA1088.
Hvordan skal jeg opbevare MAXALT?
- Opbevar MAXALT ved stuetemperatur mellem 59°F til 86°F (15°C til 30°C).
- Smid sikkert medicin ud, der er forældet eller ikke længere er nødvendigt.
Opbevar MAXALT 10mg og al medicin utilgængeligt for børn.
Generel information om sikker og effektiv brug af MAXALT.
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en patientinformationsfolder. Brug ikke MAXALT til en tilstand, som den ikke er ordineret til. Giv ikke MAXALT til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Denne patientinformationsfolder opsummerer de vigtigste oplysninger om MAXALT. Hvis du vil have mere information, så tal med din læge. Du kan bede din apoteker eller læge om oplysninger om MAXALT, som er skrevet til sundhedspersonale.
For mere information, gå til www.maxalt.com.
Hvad er ingredienserne i MAXALT?
Aktiv ingrediens i MAXALT 10mg og MAXALT-MLT oralt desintegrerende tabletter:
rizatriptanbenzoat.
Inaktive ingredienser i MAXALT: lactosemonohydrat, mikrokrystallinsk cellulose, prægelatineret stivelse, ferrioxid (rødt) og magnesiumstearat.
Inaktive ingredienser i MAXALT-MLT oralt desintegrerende tabletter: gelatine, mannitol, glycin, aspartam og pebermynte smag.
MAXALT-MLT oralt desintegrerende tabletter indeholder aspartam, en kilde til phenylalanin.
Fenylketonurik:
MAXALT-MLT oralt desintegrerende tabletter 5 mg indeholder 1,1 mg phenylalanin. MAXALT-MLT oralt desintegrerende tabletter 10 mg indeholder 2,1 mg phenylalanin.
Denne patientinformation er blevet godkendt af US Food and Drug Administration.
