Neurontin 100mg, 300mg, 400mg, 600mg Gabapentin Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Neurontin, og hvordan bruges det?
Neurontin 400mg er en receptpligtig medicin, der bruges til at behandle symptomer på nervesmerter og kramper. Neurontin kan bruges alene eller sammen med anden medicin.
Neurontin er et GABA Analogt, anti-epileptisk lægemiddel.
Det vides ikke, om Neurontin er sikkert og effektivt til børn under 3 år.
Hvad er de mulige bivirkninger af Neurontin 400mg?
Neurontin kan forårsage alvorlige bivirkninger, herunder:
- øgede anfald
- alvorlig svaghed eller træthed
- problemer med balance eller muskelbevægelse
- smerter i øvre mave
- brystsmerter
- ny eller forværret hoste med feber
- vejrtrækningsbesvær
- svær prikken eller følelsesløshed
- Hurtig øjenbevægelse
- lidt eller ingen vandladning
- smertefuldt eller vandladningsbesvær
- hævelse i dine fødder eller ankler
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Neurontin omfatter:
- hovedpine
- svimmelhed
- døsighed
- træthed
- hævelse i dine hænder eller fødder
- problemer med dine øjne
- koordinationsproblemer
- De mest almindelige bivirkninger af Neurontin 600mg hos børn omfatter:
- feber
- kvalme
- opkastning
- ændringer i adfærd
- hukommelsesproblemer
- koncentrationsbesvær
- opfører sig rastløst, fjendtligt eller aggressivt
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Neurontin. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
Den aktive ingrediens i NEURONTIN kapsler, tabletter og oral opløsning er gabapentin, som har det kemiske navn 1-(aminomethyl)cyclohexaneddikesyre.
Molekylformlen for gabapentin er C9H17NO2 og molekylvægten er 171,24. Strukturformlen for gabapentin er:
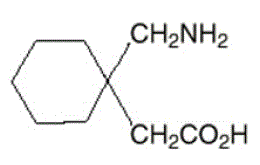
Gabapentin er et hvidt til råhvidt krystallinsk fast stof med en pKa1 på 3,7 og en pKa2 på 10,7. Det er frit opløseligt i vand og både basiske og sure vandige opløsninger. Logaritmen af fordelingskoefficienten (noctanol/0,05M fosfatbuffer) ved pH 7,4 er –1,25.
Hver Neurontin 100 mg kapsel indeholder 100 mg, 300 mg eller 400 mg gabapentin og følgende inaktive ingredienser: laktose, majsstivelse, talkum, gelatine, titaniumdioxid, FD&C Blue No. 2, gul jernoxid (kun 300 mg og 400 mg) og rødt jernoxid (kun 400 mg).
Hver Neurontin-tablet indeholder 600 mg eller 800 mg gabapentin og følgende inaktive ingredienser: poloxamer 407, copovidon, majsstivelse, magnesiumstearat, hydroxypropylcellulose, talkum og candelillavoks
Neurontin oral opløsning indeholder 250 mg gabapentin pr. 5 ml (50 mg pr. ml) og følgende inaktive ingredienser: glycerin, xylitol, renset vand og kunstig kølig jordbæranis.
INDIKATIONER
NEURONTIN® er indiceret til:
- Behandling af postherpetisk neuralgi hos voksne
- Supplerende terapi til behandling af partielle anfald, med og uden sekundær generalisering, hos voksne og pædiatriske patienter 3 år og ældre med epilepsi
DOSERING OG ADMINISTRATION
Dosering til postherpetisk neuralgi
Hos voksne med postherpetisk neuralgi kan NEURONTIN påbegyndes på dag 1 som en enkelt dosis på 300 mg, på dag 2 som 600 mg/dag (300 mg to gange dagligt) og på dag 3 som 900 mg/dag (300 mg tre). gange om dagen). Dosis kan efterfølgende titreres efter behov for smertelindring til en dosis på 1800 mg/dag (600 mg tre gange dagligt). I kliniske undersøgelser blev effekt påvist over en række doser fra 1800 mg/dag til 3600 mg/dag med sammenlignelige virkninger på tværs af dosisområdet; i disse kliniske undersøgelser blev den yderligere fordel ved at bruge doser større end 1800 mg/dag dog ikke påvist.
Dosering til epilepsi med partielle anfald
Patienter i alderen 12 år og derover
Startdosis er 300 mg tre gange dagligt. Den anbefalede vedligeholdelsesdosis af NEURONTIN er 300 mg til 600 mg tre gange dagligt. Doser op til 2400 mg/dag er blevet godt tolereret i langtids kliniske undersøgelser. Doser på 3600 mg/dag er også blevet administreret til et lille antal patienter i relativt kort varighed og er blevet godt tolereret. Administrer NEURONTIN tre gange dagligt med 300 mg eller 400 mg kapsler eller 600 mg eller 800 mg tabletter. Den maksimale tid mellem doser bør ikke overstige 12 timer.
Pædiatriske patienter i alderen 3 til 11 år
Startdosisområdet er 10 mg/kg/dag til 15 mg/kg/dag, givet i tre opdelte doser, og den anbefalede vedligeholdelsesdosis nås ved opadgående titrering over en periode på ca. 3 dage. Den anbefalede vedligeholdelsesdosis af NEURONTIN til patienter i alderen 3 til 4 år er 40 mg/kg/dag, givet i tre opdelte doser. Den anbefalede vedligeholdelsesdosis af NEURONTIN 100 mg til patienter i alderen 5 til 11 år er 25 mg/kg/dag til 35 mg/kg/dag, givet i tre opdelte doser. NEURONTIN 300 mg kan indgives som oral opløsning, kapsel eller tablet eller ved at bruge kombinationer af disse formuleringer. Doser op til 50 mg/kg/dag er blevet godt tolereret i et langtids klinisk studie. Det maksimale tidsinterval mellem doser bør ikke overstige 12 timer.
Dosisjustering hos patienter med nedsat nyrefunktion
Dosisjustering hos patienter på 12 år og ældre med nedsat nyrefunktion eller i hæmodialyse anbefales som følger (se dosisanbefalinger ovenfor for effektive doser til hver indikation):
TABEL 1: NEURONTIN-dosering baseret på nyrefunktion
Kreatininclearance (CLCr) er vanskelig at måle hos ambulante patienter. Hos patienter med stabil nyrefunktion kan kreatininclearance estimeres rimeligt godt ved hjælp af ligningen for Cockcroft og Gault:
Brugen af NEURONTIN til patienter under 12 år med nedsat nyrefunktion er ikke blevet undersøgt.
Dosering hos ældre
Da ældre patienter er mere tilbøjelige til at have nedsat nyrefunktion, bør der udvises forsigtighed ved dosisvalg, og dosis bør justeres baseret på kreatininclearance-værdier hos disse patienter.
Administrationsoplysninger
Administrer NEURONTIN oralt med eller uden mad.
NEURONTIN 100 mg kapsler skal synkes hele med vand.
Informer patienterne om, at hvis de deler 600 mg eller 800 mg NEURONTIN-tabletten for at administrere en halvtablet, skal de tage den ubrugte halvtablet som næste dosis. Halve tabletter, der ikke er brugt inden for 28 dage efter deling af tabletten med delekærv, skal kasseres.
Hvis NEURONTIN-dosis reduceres, seponeres eller erstattes med en alternativ medicin, bør dette gøres gradvist over mindst 1 uge (en længere periode kan være nødvendig efter ordinerende læges skøn).
HVORDAN LEVERET
Doseringsformer og styrker
Kapsler
- 100 mg: hvide hårde gelatinekapsler trykt med "PD" på kroppen og "Neurontin/100 mg" på hætten
- 300 mg: gule hårde gelatinekapsler trykt med "PD" på kroppen og "Neurontin/300 mg" på hætten
- 400 mg: orange hårde gelatinekapsler trykt med "PD" på kroppen og "Neurontin/400 mg" på hætten
Tabletter
- 600 mg: hvide elliptiske filmovertrukne tabletter med delekærv præget med "NT" og "16" på den ene side
- 800 mg: hvide elliptiske filmovertrukne tabletter med delekærv præget med "NT" og "26" på den ene side
Oral opløsning
- 250 mg pr. 5 ml (50 mg pr. ml), klar farveløs til let gul opløsning
Opbevaring og håndtering
NEURONTIN (gabapentin) kapsler, tabletter og oral opløsning leveres som følger:
100 mg kapsler
Hvide hårde gelatinekapsler trykt med "PD" på kroppen og "Neurontin/100 mg" på hætten; tilgængelig i:
100 flasker: NDC 0071-0803-24
300 mg kapsler
Gule hårde gelatinekapsler trykt med "PD" på kroppen og "Neurontin/300 mg" på hætten; tilgængelig i:
100 flasker: NDC 0071-0805-24 Enhedsdosis 50's: NDC 0071-0805-40
400 mg kapsler
Orange hårde gelatinekapsler trykt med "PD" på kroppen og "Neurontin/400 mg" på hætten; tilgængelig i:
100 flasker: NDC 0071-0806-24 Enhedsdosis 50's: NDC 0071-0806-40
600 mg tabletter
Hvide elliptiske filmovertrukne tabletter med delekærv præget med "NT" og "16" på den ene side; tilgængelig i:
100 flasker: NDC 0071-0513-24
800 mg tabletter
Hvide elliptiske filmovertrukne tabletter med delekærv præget med "NT" og "26" på den ene side; tilgængelig i:
100 flasker: NDC 0071-0401-24
250 mg pr. 5 ml oral opløsning
Klar farveløs til svagt gul opløsning; hver 5 ml oral opløsning indeholder 250 mg gabapentin; tilgængelig i:
Glasflasker indeholdende 470 ml: NDC 0071-2012-23 Flasker indeholdende 470 ml: NDC 0071-2012-44
Opbevar NEURONTIN 400mg tabletter og kapsler ved 25°C (77°F); udflugter tilladt mellem 15°C til 30°C (59°F til 86°F) [se USP kontrolleret rumtemperatur ].
Opbevar NEURONTIN oral opløsning på køl, 2°C til 8°C (36°F til 46°F).
Distribueret af: Parke-Davis, Division of Pfizer Inc., NY, NY 10017. Revideret: Dec 2020
BIVIRKNINGER
Følgende alvorlige bivirkninger diskuteres mere detaljeret i andre afsnit:
- Lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS)/multiorganoverfølsomhed [se ADVARSLER OG FORHOLDSREGLER ]
- Anafylaksi og angioødem [se ADVARSLER OG FORHOLDSREGLER ]
- Somnolens/Sedation og Svimmelhed [se ADVARSLER OG FORHOLDSREGLER ]
- Tilbagetrækning Udløst anfald, Status Epilepticus [se ADVARSLER OG FORHOLDSREGLER ]
- Selvmordsadfærd og idéer [se ADVARSLER OG FORHOLDSREGLER ]
- Respirationsdepression [se ADVARSLER OG FORHOLDSREGLER ]
- Neuropsykiatriske bivirkninger (pædiatriske patienter i alderen 3 til 12 år) [se ADVARSLER OG FORHOLDSREGLER ]
- Pludselig og uforklarlig død hos patienter med epilepsi [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Postherpetisk neuralgi
De mest almindelige bivirkninger forbundet med brugen af NEURONTIN hos voksne, som ikke ses med en tilsvarende hyppighed blandt placebo-behandlede patienter, var svimmelhed, døsighed og perifert ødem.
de 2 kontrollerede forsøg med postherpetisk neuralgi afbrød 16 % af de 336 patienter, der fik NEURONTIN, og 9 % af de 227 patienter, der fik placebo, behandlingen på grund af en bivirkning. De bivirkninger, der oftest førte til seponering hos patienter behandlet med NEURONTIN, var svimmelhed, somnolens og kvalme.
Tabel 3 viser bivirkninger, der forekom hos mindst 1 % af NEURONTIN-behandlede patienter med postherpetisk neuralgi, der deltog i placebokontrollerede forsøg, og som var numerisk hyppigere i NEURONTIN-gruppen end i placebogruppen.
TABEL 3: Bivirkninger i poolede placebokontrollerede forsøg i postherpetisk neuralgi
Andre reaktioner hos mere end 1 % af patienterne, men ligeså eller hyppigere i placebogruppen, omfattede smerter, tremor, neuralgi, rygsmerter, dyspepsi, dyspnø og influenzasyndrom.
Der var ingen klinisk vigtige forskelle mellem mænd og kvinder i typen og forekomsten af bivirkninger. Da der var få patienter, hvis race blev rapporteret som en anden end hvid, er der ikke tilstrækkelige data til at understøtte en erklæring om fordelingen af bivirkninger efter race.
Epilepsi med partielle anfald (tillægsterapi)
De mest almindelige bivirkninger med NEURONTIN 300 mg i kombination med andre antiepileptiske lægemidler hos patienter >12 år, som ikke ses med en tilsvarende hyppighed blandt placebo-behandlede patienter, var somnolens, svimmelhed, ataksi, træthed og nystagmus.
De mest almindelige bivirkninger med NEURONTIN i kombination med andre antiepileptika hos pædiatriske patienter i alderen 3 til 12 år, som ikke ses i samme hyppighed blandt placebo-behandlede patienter, var virusinfektion, feber, kvalme og/eller opkastning, somnolens og fjendtlighed [se ADVARSLER OG FORHOLDSREGLER ].
Ca. 7 % af de 2074 patienter >12 år og ca. 7 % af de 449 pædiatriske patienter i alderen 3 til 12 år, som fik NEURONTIN i præmarketing kliniske forsøg, afbrød behandlingen på grund af en bivirkning. De bivirkninger, der oftest er forbundet med abstinenser hos patienter >12 år, var somnolens (1,2 %), ataksi (0,8 %), træthed (0,6 %), kvalme og/eller opkastning (0,6 %) og svimmelhed (0,6 %). . De bivirkninger, der oftest er forbundet med abstinenser hos pædiatriske patienter, var følelsesmæssig labilitet (1,6 %), fjendtlighed (1,3 %) og hyperkinesi (1,1 %).
Tabel 4 viser bivirkninger, der forekom hos mindst 1 % af NEURONTIN-behandlede patienter >12 år med epilepsi, der deltog i placebokontrollerede forsøg og var numerisk mere almindelige i NEURONTIN-gruppen. I disse undersøgelser blev enten NEURONTIN 300 mg eller placebo tilføjet til patientens nuværende antiepileptiske lægemiddelbehandling.
TABEL 4: Bivirkninger i poolede placebokontrollerede tilføjelsesforsøg hos epilepsipatienter >12 år gamle
Blandt de bivirkninger, der optrådte med en incidens på mindst 10 % hos NEURONTIN-behandlede patienter, så somnolens og ataksi ud til at udvise en positiv dosis-respons sammenhæng.
Den samlede forekomst af bivirkninger og typerne af bivirkninger var ens blandt mænd og kvinder behandlet med NEURONTIN. Hyppigheden af bivirkninger steg lidt med stigende alder hos patienter behandlet med enten NEURONTIN eller placebo. Da kun 3 % af patienterne (28/921) i placebokontrollerede undersøgelser blev identificeret som ikke-hvide (sort eller andet), er der utilstrækkelige data til at understøtte en udsagn om fordelingen af bivirkninger efter race.
Tabel 5 viser bivirkninger, der forekom hos mindst 2 % af NEURONTIN-behandlede patienter i alderen 3 til 12 år med epilepsi, der deltog i placebokontrollerede forsøg, og som var numerisk mere almindelige i NEURONTIN-gruppen.
TABEL 5: Bivirkninger i et placebokontrolleret tilføjelsesforsøg hos pædiatriske epilepsipatienter i alderen 3 til 12 år
Andre reaktioner hos mere end 2 % af pædiatriske patienter i alderen 3 til 12 år, men ligeså hyppige eller hyppigere i placebogruppen inkluderede: pharyngitis, øvre luftvejsinfektion, hovedpine, rhinitis, kramper, diarré, anoreksi, hoste og mellemørebetændelse.
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af NEURONTIN efter markedsføring. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Lever og galdevejslidelser: gulsot
Undersøgelser: forhøjet kreatinkinase, forhøjede leverfunktionsprøver
Metabolisme og ernæringsforstyrrelser: hyponatriæmi
Muskel- og bindevævssygdomme: rhabdomyolyse
Forstyrrelser i nervesystemet: bevægelsesforstyrrelse
Psykiatriske lidelser: agitation
Reproduktionssystem og brystsygdomme: brystforstørrelse, ændringer i libido, ejakulationsforstyrrelser og anorgasmi
Hud- og subkutane vævssygdomme: angioødem [se ADVARSLER OG FORHOLDSREGLER ], bulløs pemfigoid, erythema multiforme, Stevens-Johnsons syndrom.
Der er postmarketingrapporter om livstruende eller fatal respirationsdepression hos patienter, der tager NEURONTIN sammen med opioider eller andre CNS-depressive midler, eller i forbindelse med underliggende respiratorisk svækkelse [se ADVARSLER OG FORHOLDSREGLER ].
Bivirkninger efter pludselig seponering af gabapentin er også blevet rapporteret. De hyppigst rapporterede reaktioner var angst, søvnløshed, kvalme, smerter og svedtendens.
DRUGSINTERAKTIONER
Opioider
Respirationsdepression og sedation, nogle gange med døden til følge, er blevet rapporteret efter samtidig administration af gabapentin og opioider (f.eks. morfin, hydrocodon, oxycodon, buprenorphin) [se ADVARSLER OG FORHOLDSREGLER ].
Hydrocodon
Samtidig administration af NEURONTIN 300 mg og hydrocodon reducerer eksponeringen af hydrocodon [se KLINISK FARMAKOLOGI ]. Potentialet for ændring i hydrocodoneksponering og effekt bør overvejes, når NEURONTIN 100 mg påbegyndes eller seponeres hos en patient, der tager hydrocodon.
Morfin
Når gabapentin administreres sammen med morfin, skal patienterne observeres for tegn på CNS-depression, såsom somnolens, sedation og respirationsdepression [se KLINISK FARMAKOLOGI ].
Andre antiepileptiske lægemidler
Gabapentin metaboliseres ikke nævneværdigt og interfererer heller ikke med metabolismen af almindeligt administrerede antiepileptika [se KLINISK FARMAKOLOGI ].
Maalox® (aluminiumhydroxid, magnesiumhydroxid)
Den gennemsnitlige biotilgængelighed af gabapentin blev reduceret med ca. 20 % ved samtidig brug af et antacidum (Maalox) indeholdende magnesium- og aluminiumhydroxider. Det anbefales, at gabapentin tages mindst 2 timer efter administration af Maalox [se KLINISK FARMAKOLOGI ].
Interaktioner med lægemiddel/laboratorietest
Da der blev rapporteret falsk positive aflæsninger med Ames N-Multistix SG dipstick-testen for urinprotein, når gabapentin blev tilsat andre antiepileptika, anbefales den mere specifikke sulfosalicylsyreudfældningsprocedure for at bestemme tilstedeværelsen af urinprotein.
Stofmisbrug og afhængighed
kontrolleret stof
Gabapentin er ikke et planlagt lægemiddel.
Misbrug
Misbrug er bevidst, ikke-terapeutisk brug af et stof, selv én gang, for dets ønskelige psykologiske eller fysiologiske virkninger. Misbrug er bevidst brug, til terapeutiske formål, af et lægemiddel af en person på en anden måde end foreskrevet af en sundhedsudbyder, eller til hvem det ikke er ordineret.
Gabapentin udviser ikke affinitet til benzodiazepin-, opioid- (mu, delta eller kappa) eller cannabinoid 1-receptorsteder. Misbrug og misbrug af gabapentin er blevet rapporteret efter markedsføring og offentliggjort litteratur. De fleste af de personer, der er beskrevet i disse rapporter, havde en historie med polysubstansmisbrug. Nogle af disse personer tog højere end anbefalede doser af gabapentin til ikke-godkendte anvendelser. Når du ordinerer NEURONTIN, skal du omhyggeligt evaluere patienterne for en historie med stofmisbrug og observere dem for tegn og symptomer på misbrug eller misbrug af gabapentin (f.eks. selvdosisoptrapning og stofsøgende adfærd). Misbrugspotentialet af gabapentin er ikke blevet evalueret i humane undersøgelser.
Afhængighed
Fysisk afhængighed er en tilstand, der udvikler sig som et resultat af fysiologisk tilpasning som reaktion på gentagen medicinbrug, manifesteret ved abstinenstegn og symptomer efter brat seponering eller en betydelig dosisreduktion af et lægemiddel. Der er sjældne rapporter efter markedsføring om personer, der oplever abstinenssymptomer kort efter seponering af højere end anbefalede doser af gabapentin, der bruges til at behandle sygdomme, som lægemidlet ikke er godkendt til. Sådanne symptomer omfattede agitation, desorientering og forvirring efter pludselig ophør med gabapentin, som forsvandt efter genstart med gabapentin. Afhængighedspotentialet af gabapentin er ikke blevet evalueret i humane studier.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS)/multiorganoverfølsomhed
Lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS), også kendt som multiorgan-overfølsomhed, er forekommet med NEURONTIN. Nogle af disse reaktioner har været dødelige eller livstruende. DRESS viser sig typisk, men ikke udelukkende, med feber, udslæt og/eller lymfadenopati i forbindelse med involvering af andre organsystemer, såsom hepatitis, nefritis, hæmatologiske abnormiteter, myocarditis eller myositis, der nogle gange ligner en akut virusinfektion. Eosinofili er ofte til stede. Denne lidelse er variabel i dens udtryk, og andre organsystemer, der ikke er nævnt her, kan være involveret.
Det er vigtigt at bemærke, at tidlige manifestationer af overfølsomhed, såsom feber eller lymfadenopati, kan være til stede, selvom udslæt ikke er tydeligt. Hvis sådanne tegn eller symptomer er til stede, skal patienten straks evalueres. NEURONTIN bør seponeres, hvis en alternativ ætiologi for tegnene eller symptomerne ikke kan fastslås.
Anafylaksi og angioødem
NEURONTIN kan forårsage anafylaksi og angioødem efter den første dosis eller på et hvilket som helst tidspunkt under behandlingen. Tegn og symptomer i rapporterede tilfælde har omfattet vejrtrækningsbesvær, hævelse af læber, hals og tunge og hypotension, der kræver akut behandling. Patienter bør instrueres i at seponere NEURONTIN 300 mg og søge omgående lægehjælp, hvis de oplever tegn eller symptomer på anafylaksi eller angioødem.
Virkninger på kørsel og betjening af tunge maskiner
Patienter, der tager NEURONTIN, bør ikke køre bil, før de har opnået tilstrækkelig erfaring til at vurdere, om NEURONTIN 100 mg forringer deres evne til at køre bil. Køreevneundersøgelser udført med et prodrug af gabapentin (gabapentin enacarbil-tablet, forlænget frigivelse) indikerer, at gabapentin kan forårsage betydelig kørselsforstyrrelse. Forskrivere og patienter skal være opmærksomme på, at patienter' evne til at vurdere deres egen kørekompetence, såvel som deres evne til at vurdere graden af somnolens forårsaget af NEURONTIN, kan være ufuldkommen. Varigheden af nedsat kørsel efter start af behandling med NEURONTIN 300 mg er ukendt. Om funktionsnedsættelsen er relateret til somnolens [se ADVARSLER OG FORHOLDSREGLER ] eller andre virkninger af NEURONTIN er ukendt.
Desuden, fordi NEURONTIN 300mg forårsager døsighed og svimmelhed [se ADVARSLER OG FORHOLDSREGLER ], bør patienter rådes til ikke at betjene komplekse maskiner, før de har opnået tilstrækkelig erfaring med NEURONTIN til at vurdere, om NEURONTIN 300 mg svækker deres evne til at udføre sådanne opgaver.
Søvnighed/Sedation Og Svimmelhed
Under de kontrollerede epilepsiforsøg hos patienter ældre end 12 år, der fik doser af NEURONTIN 100 mg op til 1800 mg dagligt, blev søvnighed, svimmelhed og ataksi rapporteret i højere grad hos patienter, der fik NEURONTIN sammenlignet med placebo: dvs. 19 % i lægemidlet. versus 9 % i placebo for døsighed, 17 % i lægemiddel versus 7 % i placebo for svimmelhed og 13 % i lægemiddel versus 6 % i placebo for ataksi. I disse undersøgelser var søvnighed, ataksi og træthed almindelige bivirkninger, der førte til seponering af NEURONTIN hos patienter over 12 år, hvor henholdsvis 1,2 %, 0,8 % og 0,6 % ophørte på grund af disse hændelser.
Under de kontrollerede forsøg med patienter med post-herpetisk neuralgi blev der rapporteret somnolens og svimmelhed i højere grad end placebo hos patienter, der fik NEURONTIN, i doser op til 3600 mg dagligt: dvs. 21 % hos NEURONTIN-behandlede patienter versus 5 % hos placebobehandlede patienter for somnolens og 28 % hos NEURONTIN-behandlede patienter versus 8 % hos placebobehandlede patienter for svimmelhed. Svimmelhed og somnolens var blandt de mest almindelige bivirkninger, der førte til seponering af NEURONTIN.
Patienter bør observeres omhyggeligt for tegn på depression af centralnervesystemet (CNS), såsom somnolens og sedation, når NEURONTIN 400 mg anvendes sammen med andre lægemidler med beroligende egenskaber på grund af potentiel synergi. Derudover kan patienter, som kræver samtidig behandling med morfin, opleve stigninger i gabapentinkoncentrationer og kan kræve dosisjustering [se DRUGSINTERAKTIONER ].
Tilbagetrækning Udløst anfald, Status Epilepticus
Antiepileptika bør ikke seponeres brat på grund af muligheden for at øge hyppigheden af anfald.
I de placebokontrollerede epilepsistudier hos patienter >12 år var forekomsten af status epilepticus hos patienter, der fik NEURONTIN, 0,6 % (3 ud af 543) mod 0,5 % hos patienter, der fik placebo (2 ud af 378). Blandt de 2074 patienter >12 år, der blev behandlet med NEURONTIN 300 mg på tværs af alle epilepsistudier (kontrollerede og ukontrollerede), havde 31 (1,5 %) status epilepticus. Af disse havde 14 patienter ingen tidligere historie med status epilepticus, hverken før behandlingen eller mens de fik anden medicin. Fordi tilstrækkelige historiske data ikke er tilgængelige, er det umuligt at sige, hvorvidt behandling med NEURONTIN er forbundet med en højere eller lavere forekomst af status epilepticus, end det ville forventes at forekomme i en lignende population, der ikke er behandlet med NEURONTIN.
Selvmordsadfærd og idéer
Antiepileptika (AED'er), herunder NEURONTIN 100 mg, øger risikoen for selvmordstanker eller -adfærd hos patienter, der tager disse lægemidler til enhver indikation. Patienter, der behandles med en AED for enhver indikation, bør overvåges for opkomst eller forværring af depression, selvmordstanker eller -adfærd og/eller usædvanlige ændringer i humør eller adfærd.
Poolede analyser af 199 placebokontrollerede kliniske forsøg (mono- og supplerende terapi) af 11 forskellige AED'er viste, at patienter randomiseret til en af AED'erne havde cirka dobbelt så stor risiko (justeret relativ risiko 1,8, 95 % CI: 1,2, 2,7) for selvmordstanker. tænkning eller adfærd sammenlignet med patienter randomiseret til placebo. I disse forsøg, som havde en median behandlingsvarighed på 12 uger, var den estimerede forekomst af selvmordsadfærd eller -forestillinger blandt 27.863 AED-behandlede patienter 0,43 % sammenlignet med 0,24 % blandt 16.029 placebobehandlede patienter, hvilket repræsenterer en stigning på ca. tilfælde af selvmordstanker eller -adfærd for hver 530 behandlede patienter. Der var fire selvmord hos lægemiddelbehandlede patienter i forsøgene og ingen hos placebobehandlede patienter, men tallet er for lille til at tillade nogen konklusion om lægemidlets effekt på selvmord.
Den øgede risiko for selvmordstanker eller -adfærd med AED'er blev observeret så tidligt som en uge efter påbegyndelse af lægemiddelbehandling med AED'er og varede ved i den vurderede behandlingsvarighed. Da de fleste forsøg inkluderet i analysen ikke strakte sig ud over 24 uger, kunne risikoen for selvmordstanker eller -adfærd ud over 24 uger ikke vurderes.
Risikoen for selvmordstanker eller -adfærd var generelt konsistent blandt stofferne i de analyserede data. Fundet af øget risiko med AED'er med forskellige virkningsmekanismer og på tværs af en række indikationer tyder på, at risikoen gælder for alle AED'er, der anvendes til enhver indikation. Risikoen varierede ikke væsentligt efter alder (5-100 år) i de analyserede kliniske forsøg. Tabel 2 viser absolut og relativ risiko efter indikation for alle evaluerede AED'er.
TABEL 2: Risiko efter indikation for antiepileptiske lægemidler i den samlede analyse
Den relative risiko for selvmordstanker eller -adfærd var højere i kliniske forsøg for epilepsi end i kliniske forsøg for psykiatriske eller andre tilstande, men de absolutte risikoforskelle var ens for epilepsi og psykiatriske indikationer.
Enhver, der overvejer at ordinere NEURONTIN 100mg eller en hvilken som helst anden hjertestarter, skal balancere risikoen for selvmordstanker eller -adfærd med risikoen for ubehandlet sygdom. Epilepsi og mange andre sygdomme, som AED'er er ordineret til, er i sig selv forbundet med sygelighed og dødelighed og en øget risiko for selvmordstanker og -adfærd. Hvis selvmordstanker og -adfærd dukker op under behandlingen, skal den ordinerende læge overveje, om disse symptomers fremkomst hos en given patient kan være relateret til den sygdom, der behandles.
Patienter, deres pårørende og familier bør informeres om, at AED'er øger risikoen for selvmordstanker og selvmordsadfærd og bør informeres om behovet for at være opmærksom på opståen eller forværring af tegn og symptomer på depression, eventuelle usædvanlige ændringer i humør eller adfærd. , eller fremkomsten af selvmordstanker, adfærd eller tanker om selvskade. Bekymringsadfærd skal straks rapporteres til sundhedsudbydere.
Respirationsdepression
Der er evidens fra case-rapporter, humane undersøgelser og dyreforsøg, der forbinder gabapentin med alvorlig, livstruende eller fatal respirationsdepression, når det administreres sammen med CNS-depressive midler, inklusive opioider, eller i forbindelse med underliggende respiratorisk svækkelse. Når det besluttes at ordinere NEURONTIN 100 mg sammen med et andet CNS-depressivt middel, især et opioid, eller at ordinere NEURONTIN 100 mg til patienter med underliggende åndedrætsnedsættelse, skal patienterne overvåges for symptomer på respirationsdepression og sedation og overveje at starte NEURONTIN med en lav dosis . Håndteringen af respirationsdepression kan omfatte tæt observation, støttende foranstaltninger og reduktion eller seponering af CNS-depressiva (inklusive NEURONTIN).
Neuropsykiatriske bivirkninger (pædiatriske patienter i alderen 3 til 12 år)
Brug af gabapentin til pædiatriske patienter med epilepsi i alderen 3 til 12 år er forbundet med forekomsten af CNS-relaterede bivirkninger. De mest betydningsfulde af disse kan klassificeres i følgende kategorier: 1) følelsesmæssig labilitet (primært adfærdsproblemer), 2) fjendtlighed, herunder aggressiv adfærd, 3) tankeforstyrrelse, herunder koncentrationsproblemer og ændringer i skolepræstationer, og 4) hyperkinesi ( primært rastløshed og hyperaktivitet). Blandt de gabapentin-behandlede patienter var de fleste af reaktionerne milde til moderate i intensitet.
kontrollerede kliniske epilepsiforsøg hos pædiatriske patienter i alderen 3 til 12 år var forekomsten af disse bivirkninger: følelsesmæssig labilitet 6 % (gabapentinbehandlede patienter) versus 1,3 % (placebobehandlede patienter); fjendtlighed 5,2% mod 1,3%; hyperkinesi 4,7% versus 2,9%; og tankeforstyrrelse 1,7 % mod 0 %. En af disse reaktioner, en rapport om fjendtlighed, blev betragtet som alvorlig. Seponering af gabapentinbehandling forekom hos 1,3 % af patienterne, der rapporterede følelsesmæssig labilitet og hyperkinesi, og 0,9 % af de gabapentinbehandlede patienter rapporterede fjendtlighed og tankeforstyrrelser. Én placebobehandlet patient (0,4%) trak sig tilbage på grund af følelsesmæssig labilitet.
Tumorogent potentiale
I et oralt karcinogenicitetsstudie øgede gabapentin forekomsten af acinarcelletumorer i bugspytkirtlen hos rotter [se Ikke-klinisk toksikologi ]. Den kliniske betydning af dette fund er ukendt. Klinisk erfaring under gabapentins præmarketingudvikling giver ingen direkte måde at vurdere dets potentiale for at inducere tumorer hos mennesker.
I kliniske undersøgelser af supplerende terapi ved epilepsi omfattende 2.085 patientårs eksponering hos patienter >12 år, blev nye tumorer rapporteret hos 10 patienter (2 bryst, 3 hjerner, 2 lunger, 1 binyre, 1 non-Hodgkin' s lymfom, 1 endometriecarcinom in situ) og allerede eksisterende tumorer forværredes hos 11 patienter (9 hjerner, 1 bryst, 1 prostata) under eller op til 2 år efter seponering af NEURONTIN. Uden viden om baggrundsforekomsten og recidiv i en tilsvarende population, der ikke er behandlet med NEURONTIN 100 mg, er det umuligt at vide, om forekomsten set i denne kohorte er eller ikke er påvirket af behandling.
Pludselig og uforklarlig død hos patienter med epilepsi
løbet af præmarketingudviklingen af NEURONTIN 400 mg blev der registreret 8 pludselige og uforklarlige dødsfald blandt en kohorte på 2203 epilepsipatienter behandlet (2103 patientårs eksponering) med NEURONTIN.
Nogle af disse kunne repræsentere anfaldsrelaterede dødsfald, hvor anfaldet ikke blev observeret, fx om natten. Dette repræsenterer en incidens på 0,0038 dødsfald pr. patientår. Selvom denne frekvens overstiger det, der forventes i en rask befolkning matchet for alder og køn, er den inden for intervallet for estimater for forekomsten af pludselige uforklarlige dødsfald hos patienter med epilepsi, der ikke får NEURONTIN (spænder fra 0,0005 for den generelle population af epileptikere til 0,003 for epilepsipatienter. en klinisk forsøgspopulation svarende til den i NEURONTIN-programmet, til 0,005 for patienter med refraktær epilepsi). Om disse tal er betryggende eller giver anledning til yderligere bekymring, afhænger derfor af sammenligneligheden af de populationer, der rapporteres til NEURONTIN-kohorten, og nøjagtigheden af de angivne estimater.
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( Medicinvejledning ).
Administrationsoplysninger
Informer patienterne om, at NEURONTIN tages oralt med eller uden mad. Informer patienterne om, at hvis de deler tabletten på 600 mg eller 800 mg for at indgive en halvtablet, skal de tage den ubrugte halvtablet som næste dosis. Råd patienter om at kassere halvtabletter, der ikke er brugt, inden for 28 dage efter deling af tabletten med delekærv.
Lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS)/multiorganoverfølsomhed
Inden påbegyndelse af behandling med NEURONTIN, instruer patienterne om, at udslæt eller andre tegn eller symptomer på overfølsomhed (såsom feber eller lymfadenopati) kan varsle en alvorlig medicinsk hændelse, og at patienten straks skal rapportere en sådan hændelse til en læge [se ADVARSLER OG FORHOLDSREGLER ].
Anafylaksi og angioødem
Råd patienter til at seponere NEURONTIN 300 mg og søge lægehjælp, hvis de udvikler tegn eller symptomer på anafylaksi eller angioødem [se ADVARSLER OG FORHOLDSREGLER ].
Svimmelhed og somnolens og virkninger på kørsel og betjening af tunge maskiner
Rådgiv patienterne, at NEURONTIN 100 mg kan forårsage svimmelhed, døsighed og andre symptomer og tegn på CNS-depression. Andre lægemidler med beroligende egenskaber kan øge disse symptomer. I overensstemmelse hermed, selvom patienter' evnen til at bestemme deres niveau af funktionsnedsættelse kan være upålidelig, råde dem til hverken at køre bil eller betjene andre komplekse maskiner, før de har opnået tilstrækkelig erfaring med NEURONTIN til at vurdere, om det påvirker deres mentale og/eller motoriske ydeevne negativt eller ej. Informer patienterne om, at det ikke vides, hvor længe denne virkning varer [se ADVARSLER OG FORHOLDSREGLER og ADVARSLER OG FORHOLDSREGLER ].
Selvmordstanker og -adfærd
Rådgiv patienten, deres pårørende og familier om, at AED'er, inklusive NEURONTIN, kan øge risikoen for selvmordstanker og -adfærd. Rådgiv patienterne om behovet for at være opmærksomme på opståen eller forværring af symptomer på depression, eventuelle usædvanlige ændringer i humør eller adfærd eller fremkomsten af selvmordstanker, adfærd eller tanker om selvskade. Instruer patienterne til straks at rapportere bekymringsfuld adfærd til sundhedsudbydere [se ADVARSLER OG FORHOLDSREGLER ].
Respirationsdepression
Informer patienterne om risikoen for respirationsdepression. Inkluder oplysninger om, at risikoen er størst for dem, der samtidig bruger CNS-depressiva (såsom opioidanalgetika) eller dem med underliggende åndedrætsnedsættelse. Lær patienter, hvordan de genkender respirationsdepression, og råd dem til straks at søge lægehjælp, hvis det opstår [se ADVARSLER OG FORHOLDSREGLER ].
Brug under graviditet
Instruer patienterne i at underrette deres læge, hvis de bliver gravide eller har til hensigt at blive gravide under behandlingen, og at underrette deres læge, hvis de ammer eller agter at amme under behandlingen [se Brug i specifikke populationer ].
Tilskynd patienter til at tilmelde sig NAAEDs graviditetsregister, hvis de bliver gravide. Dette register indsamler oplysninger om sikkerheden ved antiepileptika under graviditet. For at tilmelde sig kan patienter ringe til det gratis nummer 1-888-233-2334 [se Brug i specifikke populationer ].
Dette produkts mærkning er muligvis blevet opdateret. Besøg www.pfizer.com for at få de seneste ordinationsoplysninger.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
Gabapentin blev indgivet oralt til mus og rotter i 2-årige karcinogenicitetsundersøgelser. Der blev ikke observeret tegn på lægemiddelrelateret carcinogenicitet hos mus behandlet med doser op til 2000 mg/kg/dag. Ved 2000 mg/kg var plasmagabapentineksponeringen (AUC) hos mus ca. 2 gange større end hos mennesker ved MRHD på 3600 mg/dag. Hos rotter blev der fundet stigninger i forekomsten af pancreas acinarcelleadenom og carcinom hos hanrotter, der fik den højeste dosis (2000 mg/kg), men ikke ved doser på 250 eller 1000 mg/kg/dag. Ved 1000 mg/kg var plasmagabapentineksponeringen (AUC) hos rotter ca. 5 gange større end hos mennesker ved MRHD.
Undersøgelser designet til at undersøge mekanismen for gabapentin-induceret pancreascarcinogenese hos rotter indikerer, at gabapentin stimulerer DNA-syntese i pancreas-acinarceller hos rotter in vitro og derfor kan virke som en tumorpromotor ved at øge mitogen aktivitet. Det vides ikke, om gabapentin har evnen til at øge celleproliferation i andre celletyper eller hos andre arter, herunder mennesker.
Mutagenese
Gabapentin udviste ikke mutagent eller genotoksisk potentiale in vitro (Ames-test, HGPRT-forward mutation-assay i kinesisk hamster-lungeceller) og in vivo (kromosomafvigelse og mikronukleustest i kinesisk hamster-knoglemarv, muse-mikronerne, uplanlagt DNA-syntese i rotte-hepatocytter) analyser.
Forringelse af fertilitet
Ingen bivirkninger på fertilitet eller reproduktion blev observeret hos rotter ved doser op til 2000 mg/kg. Ved 2000 mg/kg er plasmagabapentineksponeringen (AUC) hos rotter ca. 8 gange større end hos mennesker ved MRHD.
Brug i specifikke populationer
Graviditet
Graviditetseksponeringsregister
Der er et graviditetseksponeringsregister, der overvåger graviditetsresultater hos kvinder, der er udsat for antiepileptika (AED'er), såsom NEURONTIN 300 mg, under graviditet. Tilskynd kvinder, der tager NEURONTIN under graviditeten, til at tilmelde sig det nordamerikanske antiepileptiske lægemiddel (NAAED) Pregnancy Registry ved at ringe til det gratis nummer 1-888-233-2334 eller besøge http://www.aedpregnancyregistry.org/.
Risikooversigt
Der er ikke tilstrækkelige data om udviklingsrisici forbundet med brugen af NEURONTIN til gravide kvinder. I ikke-kliniske undersøgelser med mus, rotter og kaniner var gabapentin udviklingstoksisk (øgede føtale skelet- og viscerale abnormiteter og øget embryoføtal dødelighed), når det blev administreret til drægtige dyr i doser svarende til eller lavere end dem, der blev anvendt klinisk [se Data ].
den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 til 4 % og 15 til 20 %. Baggrundsrisikoen for alvorlige fødselsdefekter og abort for den angivne population er ukendt.
Data
Dyredata
Når gravide mus fik orale doser af gabapentin (500, 1000 eller 3000 mg/kg/dag) i løbet af organogeneseperioden, blev embryoføtal toksicitet (øget forekomst af skeletvariationer) observeret ved de to højeste doser. No-effect dosis for embryoføtal udviklingstoksicitet hos mus (500 mg/kg/dag) er mindre end den maksimalt anbefalede humane dosis (MRHD) på 3600 mg på basis af kropsoverfladeareal (mg/m²).
I undersøgelser, hvor rotter fik orale doser af gabapentin (500 til 2000 mg/kg/dag) under graviditeten, blev der observeret en negativ effekt på afkommets udvikling (øget forekomst af hydroureter og/eller hydronefrose) ved alle doser. Den laveste testede dosis svarer til MRHD på mg/m²-basis.
Når drægtige kaniner blev behandlet med gabapentin i organogeneseperioden, blev der observeret en stigning i embryoføtal dødelighed ved alle testede doser (60, 300 eller 1500 mg/kg). Den laveste testede dosis er mindre end MRHD på mg/m²-basis.
I en publiceret undersøgelse blev gabapentin (400 mg/kg/dag) administreret ved intraperitoneal injektion til neonatale mus i løbet af den første postnatale uge, en periode med synaptogenese hos gnavere (svarende til det sidste trimester af graviditeten hos mennesker). Gabapentin forårsagede et markant fald i neuronal synapsedannelse i hjerner fra intakte mus og unormal neuronal synapsedannelse i en musemodel for synaptisk reparation. Gabapentin har vist sig in vitro at interferere med aktiviteten af α2δ-underenheden af spændingsaktiverede calciumkanaler, en receptor involveret i neuronal synaptogenese. Den kliniske betydning af disse fund er ukendt.
Amning
Risikooversigt
Gabapentin udskilles i modermælk efter oral administration. Virkningerne på det ammede spædbarn og på mælkeproduktionen er ukendte. De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for NEURONTIN og eventuelle negative virkninger på det ammede spædbarn fra NEURONTIN eller fra den underliggende moderens tilstand.
Pædiatrisk brug
Sikkerhed og effektivitet af NEURONTIN 600 mg til behandling af postherpetisk neuralgi hos pædiatriske patienter er ikke blevet fastlagt.
Sikkerhed og effektivitet som supplerende terapi til behandling af partielle anfald hos pædiatriske patienter under 3 år er ikke blevet fastslået [se Kliniske Studier ].
Geriatrisk brug
Det samlede antal patienter behandlet med NEURONTIN i kontrollerede kliniske forsøg med patienter med postherpetisk neuralgi var 336, hvoraf 102 (30 %) var 65 til 74 år, og 168 (50 %) var 75 år og ældre. Der var en større behandlingseffekt hos patienter på 75 år og ældre sammenlignet med yngre patienter, der fik samme dosis. Da gabapentin næsten udelukkende elimineres ved renal udskillelse, kan den større behandlingseffekt, der er observeret hos patienter ≥75 år, være en konsekvens af øget gabapentineksponering for en given dosis, som skyldes et aldersrelateret fald i nyrefunktionen. Andre faktorer kan dog ikke udelukkes. Typerne og forekomsten af bivirkninger var ens på tværs af aldersgrupper med undtagelse af perifert ødem og ataksi, som havde en tendens til at stige i forekomst med alderen.
Kliniske undersøgelser af NEURONTIN til epilepsi omfattede ikke et tilstrækkeligt antal forsøgspersoner på 65 år og derover til at afgøre, om de reagerede anderledes end yngre forsøgspersoner. Andre rapporterede kliniske erfaringer har ikke identificeret forskelle i respons mellem ældre og yngre patienter. Generelt bør dosisvalg for en ældre patient være forsigtigt, sædvanligvis begyndende i den lave ende af doseringsområdet, hvilket afspejler den større hyppighed af nedsat lever-, nyre- eller hjertefunktion og af samtidig sygdom eller anden lægemiddelbehandling.
Dette lægemiddel vides at udskilles væsentligt af nyrerne, og risikoen for toksiske reaktioner på dette lægemiddel kan være større hos patienter med nedsat nyrefunktion. Da ældre patienter er mere tilbøjelige til at have nedsat nyrefunktion, bør der udvises forsigtighed ved dosisvalg, og dosis bør justeres baseret på kreatininclearance-værdier hos disse patienter [se DOSERING OG ADMINISTRATION , BIVIRKNINGER , og KLINISK FARMAKOLOGI ].
Nedsat nyrefunktion
Dosisjustering hos voksne patienter med nedsat nyrefunktion er nødvendig [se DOSERING OG ADMINISTRATION og KLINISK FARMAKOLOGI ]. Pædiatriske patienter med nyreinsufficiens er ikke blevet undersøgt.
Dosisjustering hos patienter i hæmodialyse er nødvendig [se DOSERING OG ADMINISTRATION og KLINISK FARMAKOLOGI ].
OVERDOSIS
Tegn på akut toksicitet hos dyr omfattede ataksi, besværlig vejrtrækning, ptosis, sedation, hypoaktivitet eller excitation.
Akutte orale overdoser af NEURONTIN 300 mg er blevet rapporteret. Symptomerne har inkluderet dobbeltsyn, tremor, sløret tale, døsighed, ændret mental status, svimmelhed, sløvhed og diarré. Fatal respirationsdepression er blevet rapporteret med NEURONTIN 400 mg overdosis, alene og i kombination med andre CNS-depressiva.
Gabapentin kan fjernes ved hæmodialyse.
Hvis der opstår overeksponering, skal du ringe til dit giftkontrolcenter på 1-800-222-1222.
KONTRAINDIKATIONER
NEURONTIN er kontraindiceret til patienter, der har udvist overfølsomhed over for lægemidlet eller dets ingredienser.
KLINISK FARMAKOLOGI
Handlingsmekanisme
De præcise mekanismer, hvorved gabapentin producerer dets analgetiske og antiepileptiske virkninger, er ukendte. Gabapentin er strukturelt relateret til neurotransmitteren gamma-aminosmørsyre (GABA), men har ingen effekt på GABA-binding, optagelse eller nedbrydning. In vitro undersøgelser har vist, at gabapentin binder med høj affinitet til α2δ-underenheden af spændingsaktiverede calciumkanaler; men forholdet mellem denne binding og de terapeutiske virkninger af gabapentin er ukendt.
Farmakokinetik
Alle farmakologiske virkninger efter administration af gabapentin skyldes aktiviteten af moderforbindelsen; gabapentin metaboliseres ikke nævneværdigt hos mennesker.
Oral biotilgængelighed
Gabapentins biotilgængelighed er ikke dosisproportional; dvs. efterhånden som dosis øges, falder biotilgængeligheden. Biotilgængeligheden af gabapentin er ca. 60 %, 47 %, 34 %, 33 % og 27 % efter henholdsvis 900, 1200, 2400, 3600 og 4800 mg/dag givet i 3 opdelte doser. Mad har kun en lille effekt på hastigheden og omfanget af absorption af gabapentin (14 % stigning i AUC og Cmax).
Fordeling
Mindre end 3 % af gabapentin cirkulerer bundet til plasmaprotein. Det tilsyneladende distributionsvolumen af gabapentin efter 150 mg intravenøs administration er 58±6 L (gennemsnit ±SD). Hos patienter med epilepsi var steady-state predose (Cmin) koncentrationer af gabapentin i cerebrospinalvæske ca. 20 % af de tilsvarende plasmakoncentrationer.
Elimination
Gabapentin elimineres fra det systemiske kredsløb ved renal udskillelse som uændret lægemiddel. Gabapentin metaboliseres ikke nævneværdigt hos mennesker.
Gabapentins eliminationshalveringstid er 5 til 7 timer og er uændret af dosis eller efter gentagen dosering. Gabapentins eliminationshastighedskonstant, plasmaclearance og renal clearance er direkte proportionale med kreatininclearance. Hos ældre patienter og hos patienter med nedsat nyrefunktion er gabapentins plasmaclearance reduceret. Gabapentin kan fjernes fra plasma ved hæmodialyse.
Specifikke populationer
Alder
Effekten af alder blev undersøgt hos forsøgspersoner i alderen 20-80 år. Tilsyneladende oral clearance (CL/F) af gabapentin faldt med alderen, fra ca. 225 ml/min hos personer under 30 år til ca. 125 ml/min hos personer over 70 år. Renal clearance (CLr) og CLr justeret for kropsoverfladeareal faldt også med alderen; dog kan faldet i den renale clearance af gabapentin med alderen i vid udstrækning forklares med faldet i nyrefunktionen. [se DOSERING OG ADMINISTRATION og Brug i specifikke populationer ].
Køn
Selvom der ikke er udført nogen formel undersøgelse for at sammenligne gabapentins farmakokinetik hos mænd og kvinder, ser det ud til, at de farmakokinetiske parametre for mænd og kvinder er ens, og der er ingen signifikante kønsforskelle.
Race
Farmakokinetiske forskelle på grund af race er ikke blevet undersøgt. Da gabapentin primært udskilles renalt, og der ikke er væsentlige raceforskelle i kreatininclearance, forventes farmakokinetiske forskelle på grund af race ikke.
Pædiatrisk
Gabapentins farmakokinetik blev bestemt hos 48 pædiatriske forsøgspersoner mellem 1 måned og 12 år efter en dosis på ca. 10 mg/kg. Maksimal plasmakoncentrationer var ens i hele aldersgruppen og forekom 2 til 3 timer efter dosis. Generelt opnåede pædiatriske forsøgspersoner mellem 1 måned og
En populationsfarmakokinetisk analyse blev udført hos 253 pædiatriske forsøgspersoner mellem 1 måned og 13 år. Patienterne fik 10 til 65 mg/kg/dag givet tre gange dagligt. Tilsyneladende oral clearance (CL/F) var direkte proportional med kreatininclearance, og dette forhold var ens efter en enkelt dosis og ved steady-state. Højere orale clearance-værdier blev observeret hos børn
Disse farmakokinetiske data indikerer, at den effektive daglige dosis hos pædiatriske patienter med epilepsi i alderen 3 og 4 år bør være 40 mg/kg/dag for at opnå gennemsnitlige plasmakoncentrationer svarende til dem, der opnås hos patienter på 5 år og ældre, der får gabapentin på 30 mg/dag. kg/dag [se DOSERING OG ADMINISTRATION ].
Voksne patienter med nedsat nyrefunktion
Forsøgspersoner (N=60) med nedsat nyrefunktion (gennemsnitlig kreatininclearance varierende fra 13-114 ml/min) fik enkelte 400 mg orale doser gabapentin. Den gennemsnitlige halveringstid for gabapentin varierede fra ca. 6,5 timer (patienter med kreatininclearance >60 ml/min) til 52 timer (kreatininclearance 60 ml/min. gruppe) til ca. 10 ml/min ( DOSERING OG ADMINISTRATION og Brug i specifikke populationer ]. Pædiatriske patienter med nyreinsufficiens er ikke blevet undersøgt.
Hæmodialyse
en undersøgelse med anuriske voksne forsøgspersoner (N=11) var den tilsyneladende eliminationshalveringstid for gabapentin på dage uden dialyse ca. 132 timer; under dialyse blev den tilsyneladende halveringstid for gabapentin reduceret til 3,8 timer. Hæmodialyse har således en signifikant effekt på gabapentin-eliminering hos anuriske forsøgspersoner [se DOSERING OG ADMINISTRATION og Brug i specifikke populationer ].
Hepatisk sygdom
Da gabapentin ikke metaboliseres, blev der ikke udført undersøgelser med patienter med nedsat leverfunktion.
Lægemiddelinteraktioner
In vitro undersøgelser
In vitro undersøgelser blev udført for at undersøge gabapentins potentiale til at hæmme de vigtigste cytochrom P450-enzymer (CYP1A2, CYP2A6, CYP2C9, CYP2C19, CYP2D6, CYP2E1 og CYP3A4), som medierer lægemiddel- og xenobiotiske præparatmetabolisme med isomobiotisk liver-metabolisme ved hjælp af isomobiotiske præparater. . Kun ved den højeste testede koncentration (171 mcg/ml; 1 mM) blev der observeret en lille grad af hæmning (14 % til 30 %) af isoform CYP2A6. Ingen hæmning af nogen af de andre testede isoformer blev observeret ved gabapentinkoncentrationer på op til 171 mcg/ml (ca. 15 gange C ved 3600 mg/dag) observeret isoform CYP2A6. Ingen hæmning af nogen af de andre testede isoformer blev observeret ved gabapentinkoncentrationer op til 171 mcg/ml (ca. 15 gange Cmax ved 3600 mg/dag).
In vivo studier
De lægemiddelinteraktionsdata, der er beskrevet i dette afsnit, er opnået fra undersøgelser, der involverer raske voksne og voksne patienter med epilepsi.
Phenytoin
et enkelt (400 mg) og multiple doser (400 mg tre gange dagligt) undersøgelse af NEURONTIN 400 mg hos epileptiske patienter (N=8) vedligeholdt på phenytoin monoterapi i mindst 2 måneder, havde gabapentin ingen effekt på steady-state bundfaldet plasmakoncentrationer af phenytoin og phenytoin havde ingen effekt på gabapentins farmakokinetik.
Carbamazepin
Steady-state dalplasma carbamazepin og carbamazepin 10, 11 epoxidkoncentrationer blev ikke påvirket af samtidig administration af gabapentin (400 mg tre gange dagligt; N=12). Ligeledes var gabapentins farmakokinetik uændret ved administration af carbamazepin.
Valproinsyre
De gennemsnitlige steady-state laveste serum-valproinsyrekoncentrationer før og under samtidig administration af gabapentin (400 mg tre gange dagligt; N=17) var ikke forskellige, og gabapentins farmakokinetiske parametre var heller ikke påvirket af valproinsyre.
Fenobarbital
Estimater af steady-state farmakokinetiske parametre for phenobarbital eller gabapentin (300 mg tre gange dagligt; N=12) er identiske, uanset om lægemidlerne administreres alene eller sammen.
Naproxen
Samtidig administration (N=18) af naproxennatriumkapsler (250 mg) med NEURONTIN (125 mg) ser ud til at øge mængden af absorberet gabapentin med 12 % til 15 %. Gabapentin havde ingen effekt på naproxens farmakokinetiske parametre. Disse doser er lavere end de terapeutiske doser for begge lægemidler. Størrelsen af interaktion inden for de anbefalede dosisintervaller for begge lægemidler kendes ikke.
Hydrocodon
Samtidig administration af NEURONTIN (125 til 500 mg; N=48) reducerer hydrocodon (10 mg; N=50) Cmax og AUC værdier på en dosisafhængig måde i forhold til administration af hydrocodon alene; Cmax- og AUC-værdier er henholdsvis 3 % til 4 % lavere efter administration af 125 mg NEURONTIN og 21 % til 22 % lavere efter administration af 500 mg NEURONTIN. Mekanismen for denne interaktion er ukendt. Hydrocodon øger gabapentins AUC-værdier med 14 %. Størrelsen af interaktion ved andre doser kendes ikke.
Morfin
En litteraturartikel rapporterede, at når en 60 mg morfinkapsel med kontrolleret frigivelse blev administreret 2 timer før en 600 mg NEURONTIN-kapsel (N=12), steg den gennemsnitlige AUC for gabapentin med 44 % sammenlignet med gabapentin administreret uden morfin. Morfins farmakokinetiske parameterværdier blev ikke påvirket af administration af NEURONTIN 2 timer efter morfin. Størrelsen af interaktion ved andre doser kendes ikke.
Cimetidin
nærvær af cimetidin på 300 mg fire gange dagligt (N=12), faldt den gennemsnitlige tilsyneladende orale clearance af gabapentin med 14 % og kreatininclearance faldt med 10 %. Således syntes cimetidin at ændre den renale udskillelse af både gabapentin og kreatinin, en endogen markør for nyrefunktionen. Dette lille fald i udskillelsen af gabapentin med cimetidin forventes ikke at være af klinisk betydning. Virkningen af gabapentin på cimetidin blev ikke evalueret.
Oral prævention
Baseret på AUC og halveringstid var flerdosis farmakokinetiske profiler for norethindron og ethinylestradiol efter administration af tabletter indeholdende 2,5 mg norethindronacetat og 50 mcg ethinylestradiol ens med og uden samtidig administration af gabapentin (400 mg tre gange dagligt; N=13). Cmax for norethindron var 13 % højere, når det blev administreret sammen med gabapentin; denne interaktion forventes ikke at være af klinisk betydning.
Antacida (Maalox®) (aluminiumhydroxid, magnesiumhydroxid)
Antacida (Maalox®) indeholdende magnesium- og aluminiumhydroxider reducerede den gennemsnitlige biotilgængelighed af gabapentin (N=16) med ca. 20%. Dette fald i biotilgængelighed var ca. 10 %, når gabapentin blev administreret 2 timer efter Maalox.
Probenecid
Probenecid er en blokering af renal tubulær sekretion. Gabapentins farmakokinetiske parametre uden og med probenecid var sammenlignelige. Dette indikerer, at gabapentin ikke gennemgår renal tubulær sekretion via den vej, der blokeres af probenecid.
Kliniske Studier
Postherpetisk neuralgi
NEURONTIN blev evalueret til behandling af postherpetisk neuralgi (PHN) i to randomiserede, dobbeltblindede, placebokontrollerede multicenterundersøgelser. Intent-to-treat-populationen (ITT) bestod af i alt 563 patienter med smerter i mere end 3 måneder efter heling af herpes zoster-hududslæt (tabel 6).
TABEL 6. Kontrollerede PHN-undersøgelser: Varighed, doser og antal patienter
Hver undersøgelse omfattede en 7- eller 8-ugers dobbeltblind fase (3 eller 4 ugers titrering og 4 ugers fast dosis). Patienterne påbegyndte behandlingen med titrering til maksimalt 900 mg/dag gabapentin over 3 dage. Doserne skulle derefter titreres i intervaller på 600 til 1200 mg/dag med 3- til 7-dages intervaller til måldosis over 3 til 4 uger. Patienterne registrerede deres smerter i en daglig dagbog ved hjælp af en 11-punkts numerisk smertevurderingsskala fra 0 (ingen smerte) til 10 (værst mulig smerte). En gennemsnitlig smertescore under baseline på mindst 4 var påkrævet for randomisering. Analyser blev udført ved hjælp af ITT-populationen (alle randomiserede patienter, som modtog mindst én dosis undersøgelsesmedicin).
Begge undersøgelser viste effekt sammenlignet med placebo ved alle testede doser.
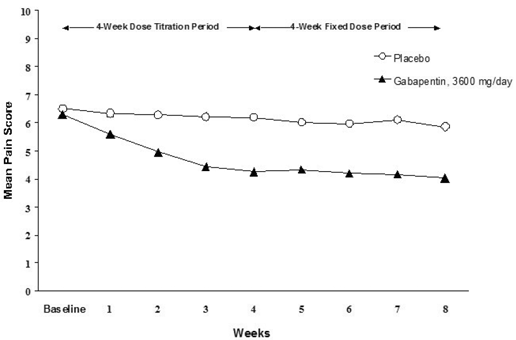
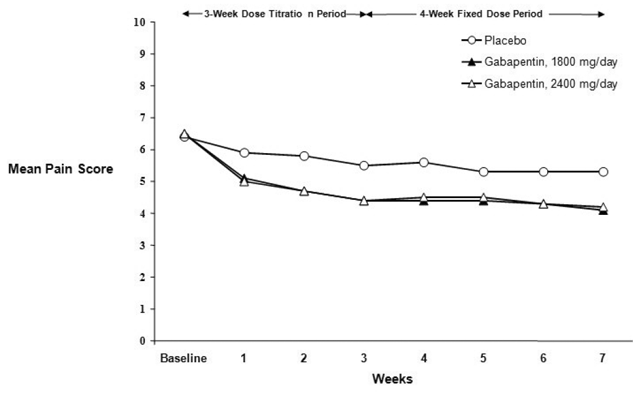
Reduktionen i ugentlige gennemsnitlige smertescore blev set ved uge 1 i begge undersøgelser og blev opretholdt til slutningen af behandlingen. Sammenlignelige behandlingseffekter blev observeret i alle aktive behandlingsarme. Farmakokinetisk/farmakodynamisk modellering gav bekræftende bevis for effektivitet på tværs af alle doser. Figur 1 og 2 viser smerteintensitetsscore over tid for undersøgelse 1 og 2.
Figur 1. Ugentlige gennemsnitlige smertescore (observerede tilfælde i ITT-population): Undersøgelse 1
Figur 2. Ugentlige gennemsnitlige smertescore (observerede tilfælde i ITT-population): Undersøgelse 2
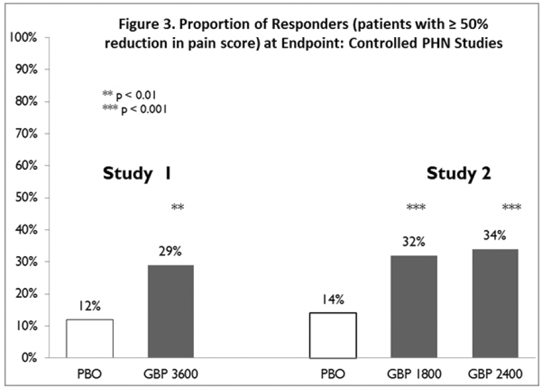
Andelen af respondere (de patienter, der rapporterede mindst 50 % forbedring i endepunktssmertescore sammenlignet med baseline) blev beregnet for hver undersøgelse (figur 3).
Figur 3. Andel af respondenter (patienter med ≥50 % reduktion i smertescore) ved endepunkt: kontrollerede PHN-studier
Epilepsi for partielle anfald (tillægsbehandling)
Effektiviteten af NEURONTIN 400 mg som tillægsbehandling (tilsat andre antiepileptiske lægemidler) blev fastslået i multicenter placebokontrollerede, dobbeltblindede, parallelgruppe kliniske forsøg med voksne og pædiatriske patienter (3 år og ældre) med refraktære partielle anfald.
Bevis på effektivitet blev opnået i tre forsøg udført med 705 patienter (12 år og derover) og et forsøg udført med 247 pædiatriske patienter (3 til 12 år). De indskrevne patienter havde en historie på mindst 4 partielle anfald om måneden på trods af at de fik et eller flere antiepileptika på terapeutiske niveauer og blev observeret på deres etablerede antiepileptiske lægemiddelregime i en 12-ugers baseline-periode (6 uger i undersøgelsen af pædiatriske lægemidler). patienter). Hos patienter, der fortsætter med at have mindst 2 (eller 4 i nogle undersøgelser) anfald om måneden, blev NEURONTIN 300 mg eller placebo derefter tilføjet til den eksisterende behandling i løbet af en 12-ugers behandlingsperiode. Effektiviteten blev primært vurderet på basis af procentdelen af patienter med en 50 % eller større reduktion i anfaldsfrekvensen fra baseline til behandling ("responderfrekvensen") og et afledt mål kaldet responsratio, et mål for forandring defineret som (T - B)/(T + B), hvor B er patientens baseline anfaldshyppighed og T er patientens anfaldsfrekvens under behandling. Svarforholdet er fordelt inden for området -1 til +1. En nulværdi indikerer ingen ændring, mens fuldstændig eliminering af anfald ville give en værdi på -1; øgede beslaglæggelsesrater ville give positive værdier. Et responsforhold på -0,33 svarer til en 50 % reduktion i anfaldshyppigheden. Resultaterne nedenfor er for alle partielle anfald i intention-to-treat-populationen (alle patienter, der modtog nogen behandlingsdoser) i hver undersøgelse, medmindre andet er angivet.
En undersøgelse sammenlignede NEURONTIN 1200 mg/dag i tre opdelte doser med placebo. Svarfrekvensen var 23 % (14/61) i NEURONTIN 600 mg-gruppen og 9 % (6/66) i placebogruppen; forskellen mellem grupperne var statistisk signifikant. Responsratioen var også bedre i NEURONTIN-gruppen (-0,199) end i placebogruppen (-0,044), en forskel, der også opnåede statistisk signifikans.
En anden undersøgelse sammenlignede primært NEURONTIN 1200 mg/dag i tre opdelte doser (N=101) med placebo (N=98). Yderligere mindre NEURONTIN 300 mg dosisgrupper (600 mg/dag, N=53; 1800 mg/dag, N=54) blev også undersøgt for at få information om dosisrespons. Svarfrekvensen var højere i NEURONTIN 1200 mg/dag-gruppen (16 %) end i placebogruppen (8 %), men forskellen var ikke statistisk signifikant. Responsraten ved 600 mg (17 %) var heller ikke signifikant højere end hos placebo, men responderfrekvensen i 1800 mg-gruppen (26 %) var statistisk signifikant bedre end placebofrekvensen. Responsratio var bedre i NEURONTIN 1200 mg/dag-gruppen (-0,103) end i placebogruppen (-0,022); men denne forskel var heller ikke statistisk signifikant (p = 0,224). Et bedre respons blev set i NEURONTIN 600 mg/dag-gruppen (-0,105) og 1800 mg/dag-gruppen (-0,222) end i 1200 mg/dag-gruppen, hvor 1800 mg/dag-gruppen opnåede statistisk signifikans sammenlignet med placebo. gruppe.
En tredje undersøgelse sammenlignede NEURONTIN 900 mg/dag i tre opdelte doser (N=111) og placebo (N=109). En yderligere NEURONTIN 1200 mg/dag dosisgruppe (N=52) gav dosis-responsdata. En statistisk signifikant forskel i responderfrekvens blev set i NEURONTIN 900 mg/dag-gruppen (22%) sammenlignet med den i placebogruppen (10%). Responsratioen var også statistisk signifikant overlegen i NEURONTIN 900 mg/dag-gruppen (-0,119) sammenlignet med den i placebogruppen (-0,027), ligesom responsratioen i 1200 mg/dag NEURONTIN (-0,184) var sammenlignet med placebo.
Analyser blev også udført i hver undersøgelse for at undersøge effekten af NEURONTIN 300 mg på forebyggelse af sekundært generaliserede tonisk-kloniske anfald. Patienter, der oplevede et sekundært generaliseret tonisk-klonisk anfald i enten baseline eller i behandlingsperioden i alle tre placebokontrollerede undersøgelser, blev inkluderet i disse analyser. Der var flere sammenligninger af responsratio, der viste en statistisk signifikant fordel for NEURONTIN sammenlignet med placebo og gunstige tendenser for næsten alle sammenligninger.
Analyse af responderrate ved brug af kombinerede data fra alle tre undersøgelser og alle doser (N=162, NEURONTIN; N=89, placebo) viste også en signifikant fordel for NEURONTIN i forhold til placebo ved at reducere hyppigheden af sekundært generaliserede tonisk-kloniske anfald.
to af de tre kontrollerede undersøgelser blev der brugt mere end én dosis NEURONTIN. Inden for hver undersøgelse viste resultaterne ikke en konsekvent øget respons på dosis. Men ser man på tværs af undersøgelser, er en tendens i retning af at øge effektiviteten med stigende dosis tydelig (se figur 4).
Figur 4. Responderfrekvens hos patienter, der modtager NEURONTIN 600 mg udtrykt som en forskel fra placebo efter dosis og undersøgelse: Adjuvante terapiundersøgelser hos patienter ≥12 år med partielle anfald
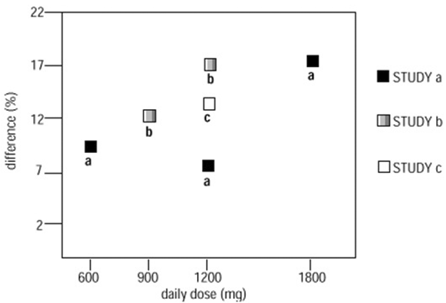
I figuren er behandlingseffektens størrelse, målt på Y-aksen i form af forskellen i andelen af gabapentin- og placebo-tildelte patienter, der opnår en 50 % eller større reduktion i anfaldshyppigheden fra baseline, afbildet mod den daglige dosis af gabapentin administreret. (X-akse).
Selvom der ikke er udført nogen formel analyse efter køn, indikerer estimater af respons (responsforhold) afledt af kliniske forsøg (398 mænd, 307 kvinder) ingen vigtige kønsforskelle. Der var intet konsistent mønster, der indikerer, at alder havde nogen effekt på responsen på NEURONTIN. Der var utilstrækkeligt antal patienter af andre racer end kaukasiske til at tillade en sammenligning af effektivitet blandt racegrupper.
En fjerde undersøgelse med pædiatriske patienter i alderen 3 til 12 år sammenlignede 25-35 mg/kg/dag NEURONTIN (N=118) med placebo (N=127). For alle partielle anfald i intention-to-treat-populationen var responsratioen statistisk signifikant bedre for NEURONTIN-gruppen (-0,146) end for placebogruppen (-0,079). For den samme population var responsraten for NEURONTIN (21 %) ikke signifikant forskellig fra placebo (18 %).
En undersøgelse med pædiatriske patienter i alderen 1 måned til 3 år sammenlignede 40 mg/kg/dag NEURONTIN (N=38) med placebo (N=38) hos patienter, der fik mindst ét markedsført antiepileptika og havde mindst ét delvist anfald under screeningsperioden (inden for 2 uger før baseline). Patienterne havde op til 48 timers baseline og op til 72 timers dobbeltblind video EEG-monitorering for at registrere og tælle forekomsten af anfald. Der var ingen statistisk signifikante forskelle mellem behandlinger i hverken responsratio eller responderrate.
PATIENTOPLYSNINGER
NEURONTIN (Neu ron' tin) (Gabapentin) Kapsler, tabletter og oral opløsning
Hvad er den vigtigste information, jeg bør vide om NEURONTIN?
Stop ikke med at tage NEURONTIN 300mg uden først at tale med din læge.
Pludselig standsning af NEURONTIN kan forårsage alvorlige problemer.
NEURONTIN 400mg kan forårsage alvorlige bivirkninger, herunder:
1. Selvmordstanker. Som andre antiepileptika kan NEURONTIN 100 mg forårsage selvmordstanker eller -handlinger hos et meget lille antal mennesker, omkring 1 ud af 500.
Ring til en sundhedsudbyder med det samme, hvis du har nogle af disse symptomer, især hvis de er nye, værre eller bekymrer dig:
- tanker om selvmord eller døende
- forsøg på at begå selvmord
- ny eller værre depression
- ny eller værre angst
- føler sig ophidset eller rastløs
- Angstanfald
- søvnbesvær (søvnløshed)
- ny eller værre irritabilitet
- opfører sig aggressivt, er vred eller voldelig
- handler på farlige impulser
- en ekstrem stigning i aktivitet og tale (mani)
- andre usædvanlige ændringer i adfærd eller humør
Hvordan kan jeg holde øje med tidlige symptomer på selvmordstanker og -handlinger?
- Vær opmærksom på ændringer, især pludselige ændringer, i humør, adfærd, tanker eller følelser.
- Hold alle opfølgende besøg hos din sundhedsplejerske som planlagt.
Ring til din læge mellem besøgene efter behov, især hvis du er bekymret for symptomer.
Stop ikke med at tage NEURONTIN uden først at tale med en læge.
- Hvis du pludselig stopper NEURONTIN 100mg, kan det forårsage alvorlige problemer. Pludselig standsning af en anfaldsmedicin hos en patient, der har epilepsi, kan forårsage anfald, der ikke stopper (status epilepticus).
- Selvmordstanker eller -handlinger kan være forårsaget af andre ting end medicin. Hvis du har selvmordstanker eller -handlinger, kan din sundhedsplejerske undersøge for andre årsager.
2. Ændringer i adfærd og tænkning - Brug af NEURONTIN 100mg til børn i alderen 3 til 12 år kan forårsage følelsesmæssige ændringer, aggressiv adfærd, problemer med koncentration, rastløshed, ændringer i skolepræstationer og hyperaktivitet.
3. NEURONTIN kan forårsage alvorlige eller livstruende allergiske reaktioner som kan påvirke din hud eller andre dele af din krop, såsom din lever eller blodceller. Dette kan medføre, at du bliver indlagt eller stopper med NEURONTIN. Du har muligvis udslæt med en allergisk reaktion forårsaget af NEURONTIN. Ring til en sundhedsudbyder med det samme, hvis du har nogle af følgende symptomer:
- udslæt
- nældefeber
- åndedrætsbesvær
- feber
- hævede kirtler, der ikke går væk
- hævelse af dit ansigt, læber, hals eller tunge
- gulfarvning af din hud eller det hvide i øjnene
- usædvanlige blå mærker eller blødninger
- svær træthed eller svaghed
- uventede muskelsmerter
- hyppige infektioner
Disse symptomer kan være de første tegn på en alvorlig reaktion. En sundhedsudbyder bør undersøge dig for at beslutte, om du skal fortsætte med at tage NEURONTIN.
4. Alvorlige vejrtrækningsproblemer. Alvorlige vejrtrækningsproblemer kan opstå, når NEURONTIN tages sammen med anden medicin, der kan forårsage alvorlig søvnighed eller nedsat opmærksomhed, eller når det tages af en person, der allerede har vejrtrækningsproblemer. Hold øje med øget søvnighed eller nedsat vejrtrækning, når du starter med NEURONTIN 300 mg, eller når dosis øges. Få hjælp med det samme, hvis der opstår vejrtrækningsproblemer.
Hvad er NEURONTIN 400mg?
NEURONTIN 400mg er en receptpligtig medicin, der bruges til at behandle:
- Smerter fra beskadigede nerver (postherpetisk smerte), der følger efter heling af helvedesild (et smertefuldt udslæt, der kommer efter en herpes zoster-infektion) hos voksne.
- Delvise anfald, når det tages sammen med anden medicin hos voksne og børn på 3 år og ældre med anfald.
Hvem bør ikke tage NEURONTIN?
Tag ikke NEURONTIN, hvis du er allergisk over for gabapentin eller et af de øvrige indholdsstoffer i NEURONTIN. Se slutningen af denne medicinvejledning for en komplet liste over ingredienser i NEURONTIN.
Hvad skal jeg fortælle min sundhedsplejerske, før jeg tager NEURONTIN 300mg?
Inden du tager NEURONTIN 400mg, skal du fortælle det til din læge, hvis du:
- har eller har haft nyreproblemer eller er i hæmodialyse
- har eller har haft depression, humørproblemer eller selvmordstanker eller -adfærd
- har diabetes
- har vejrtrækningsproblemer
- er gravid eller planlægger at blive gravid. Det vides ikke, om NEURONTIN kan skade dit ufødte barn. Fortæl din læge med det samme, hvis du bliver gravid, mens du tager NEURONTIN. Du og din læge vil beslutte, om du skal tage NEURONTIN 100 mg, mens du er gravid. Graviditetsregister: Hvis du bliver gravid, mens du tager NEURONTIN, skal du tale med din læge om tilmelding til det nordamerikanske antiepileptiske lægemiddel (NAAED) Pregnancy Registry. Formålet med dette register er at indsamle oplysninger om sikkerheden af antiepileptika under graviditet. Du kan tilmelde dig dette register ved at ringe til 1-888-233-2334.
- ammer eller planlægger at amme. NEURONTIN kan gå over i modermælken. Du og din læge bør beslutte, hvordan du vil fodre din baby, mens du tager NEURONTIN.
Fortæl din læge om al den medicin, du tager, herunder receptpligtig og håndkøbsmedicin, vitaminer og naturlægemidler. Fortæl det især til din læge, hvis du tager opioid smertestillende medicin (såsom oxycodon), medicin mod angst (såsom lorazepam) eller søvnløshed (såsom zolpidem) eller medicin, der gør dig søvnig.
Du kan have større chance for svimmelhed, søvnighed eller vejrtrækningsproblemer, hvis disse lægemidler tages sammen med NEURONTIN.
At tage NEURONTIN 100 mg sammen med visse andre lægemidler kan forårsage bivirkninger eller påvirke, hvor godt de virker. Du må ikke starte eller stoppe anden medicin uden at tale med din læge.
Kend den medicin du tager. Hold en liste over dem, og vis den til din læge og apotek, når du får en ny medicin.
Hvordan skal jeg tage NEURONTIN 400mg?
- Tag NEURONTIN nøjagtigt som foreskrevet. Din læge vil fortælle dig, hvor meget NEURONTIN 600 mg du skal tage.
- Du må ikke ændre din dosis af NEURONTIN uden at tale med din læge.
- Hvis du tager NEURONTIN-tabletter og deler en tablet i to, skal den ubrugte halvdel af tabletten tages ved din næste planlagte dosis. Halve tabletter, der ikke er brugt inden for 28 dage efter brud, skal kasseres.
- Tag NEURONTIN kapsler med vand.
- NEURONTIN tabletter kan tages med eller uden mad. Hvis du tager et antacidum indeholdende aluminium og magnesium, såsom Maalox®, Mylanta®, Gelusil®, Gaviscon® eller Di-Gel®, skal du vente mindst 2 timer, før du tager din næste dosis NEURONTIN. Hvis du tager for meget NEURONTIN 600mg, skal du straks ringe til din læge eller dit lokale giftkontrolcenter på 1-800-222-1222.
Hvad skal jeg undgå, mens jeg tager NEURONTIN?
- Drik ikke alkohol eller tag anden medicin, der gør dig søvnig eller svimmel, mens du tager NEURONTIN uden først at tale med din læge. Hvis du tager NEURONTIN 600 mg sammen med alkohol eller stoffer, der forårsager søvnighed eller svimmelhed, kan din søvnighed eller svimmelhed blive værre.
- Du må ikke køre bil, betjene tunge maskiner eller udføre andre farlige aktiviteter, før du ved, hvordan NEURONTIN 100 mg påvirker dig. NEURONTIN 600mg kan bremse din tænkning og motorik.
Hvad er de mulige bivirkninger af NEURONTIN 300mg?
NEURONTIN 100mg kan forårsage alvorlige bivirkninger, herunder:
Se "Hvad er den vigtigste information, jeg bør vide om NEURONTIN?"
- problemer med at køre, mens du bruger NEURONTIN. Se "Hvad skal jeg undgå, mens jeg tager Neurontin 600mg?"
- søvnighed og svimmelhed, hvilket kan øge forekomsten af utilsigtet skade, herunder fald
- De mest almindelige bivirkninger af NEURONTIN 100mg omfatter:
- manglende koordinering
- virusinfektion
- føler sig døsig
- kvalme og opkast
- svært ved at tale
- rysten
- hævelse, normalt af ben og fødder
- træthedsfornemmelse
- feber
- rykkede bevægelser
- vanskeligheder med koordination
- Dobbelt syn
- usædvanlige øjenbevægelser
Fortæl din læge, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle mulige bivirkninger af NEURONTIN. For mere information, spørg din læge eller apotek.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare NEURONTIN?
- Opbevar NEURONTIN 400mg kapsler og tabletter mellem 68°F til 77°F (20°C til 25°C).
- Opbevar NEURONTIN 400mg oral opløsning i køleskabet mellem 36°F til 46°F (2°C til 8°C).
Opbevar NEURONTIN 600mg og al medicin utilgængeligt for børn.
Generel information om sikker og effektiv brug af NEURONTIN
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en medicinvejledning. Brug ikke NEURONTIN 300mg til en tilstand, som det ikke er ordineret til. Giv ikke NEURONTIN til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Denne medicinvejledning opsummerer de vigtigste oplysninger om NEURONTIN. Hvis du vil have mere information, så tal med din sundhedsplejerske. Du kan bede din sundhedsplejerske eller apotek om oplysninger om NEURONTIN 100mg, der er skrevet til sundhedspersonale.
For mere information gå til http://www.pfizer.com eller ring på 1-800-438-1985.
Hvad er ingredienserne i NEURONTIN 400mg?
Aktiv ingrediens: gabapentin
Inaktive ingredienser i kapslerne: laktose, majsstivelse, talkum, gelatine, titaniumdioxid og FD&C Blue No. 2.
Kapselskallen på 300 mg indeholder også: gul jernoxid.
Kapselskallen på 400 mg indeholder også: rød jernoxid og gul jernoxid.
Inaktive ingredienser i tabletterne: poloxamer 407, copovidon, majsstivelse, magnesiumstearat, hydroxypropylcellulose, talkum og candelillavoks
Inaktive ingredienser i den orale opløsning: glycerin, xylitol, renset vand og kunstig smag.
Denne medicinvejledning er godkendt af US Food and Drug Administration.
