Imdur 40mg, 20mg, 30mg, 60mg Isosorbide Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Imdur 30mg, og hvordan bruges det?
Imdur 30mg er en receptpligtig medicin, der bruges til at behandle symptomerne på brystsmerter (Angina Pectoris). Imdur 30mg kan bruges alene eller sammen med anden medicin.
Imdur 20mg tilhører en klasse af lægemidler kaldet nitrater, angina.
Det vides ikke, om Imdur 60mg er sikkert og effektivt til børn.
Hvad er mulige bivirkninger af Imdur?
Bivirkninger af Imdur omfatter:
- besvimelse,
- hurtige, uregelmæssige eller bankende hjerteslag,
- udslæt,
- kløe,
- hævelse i ansigt, tunge og svælg,
- svær svimmelhed, og
- vejrtrækningsbesvær
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Imdur 30mg omfatter:
- hovedpine,
- svimmelhed,
- svimmelhed, og
- kvalme
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Imdur. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
Isosorbidmononitrat (ISMN), et organisk nitrat og den væsentligste biologisk aktive metabolit af isosorbiddinitrat (ISDN), er en vasodilator med virkning på både arterier og vener.
IMDUR®-tabletter, til oral administration, indeholder enten 30 mg, 60 mg eller 120 mg isosorbidmononitrat i en formulering med forlænget frigivelse. Derudover indeholder hver tablet følgende inaktive ingredienser: kolloid siliciumdioxid, hydrogeneret ricinusolie, hypromellose, lactosemonohydrat, magnesiumstearat, mikrokrystallinsk cellulose og talkum.
Molekylformlen for ISMN er C6H9NO6 og molekylvægten er 191,14. Det kemiske navn for ISMN er 1,4:3,6-dianhydro-,D-glucitol-5-nitrat; forbindelsen har følgende strukturformel:
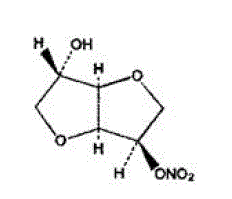
ISMN er en hvid, krystallinsk, lugtfri forbindelse, som er stabil i luft og i opløsning, har et smeltepunkt på omkring 90°C og en optisk rotation på +144° (2% i vand, 20°C).
Isosorbidmononitrat er frit opløseligt i vand, ethanol, methanol, chloroform, ethylacetat og dichlormethan.
INDIKATIONER
IMDUR-tabletter er indiceret til forebyggelse af angina pectoris på grund af koronararteriesygdom. Virkningen af oral isosorbidmononitrat er ikke tilstrækkelig hurtig til, at dette produkt kan være nyttigt til at afbryde en akut angina episode.
DOSERING OG ADMINISTRATION
Den anbefalede startdosis af IMDUR tabletter er 30 mg (givet som en enkelt 30 mg tablet eller som 1/2 af en 60 mg tablet) eller 60 mg (givet som en enkelt tablet) én gang dagligt. Efter flere dage kan dosis øges til 120 mg (givet som en enkelt 120 mg tablet eller som to 60 mg tabletter) én gang dagligt. I sjældne tilfælde kan 240 mg være påkrævet. Den daglige dosis af IMDUR-tabletter skal tages om morgenen, når den står op. IMDUR Extended Release-tabletter må ikke tygges eller knuses og skal sluges sammen med et halvt glas væske. Bræk ikke 30 mg tabletten.
HVORDAN LEVERET
IMDUR tabletter med forlænget frigivelse 30 mg er hvide, kapselformede tabletter med delekærv på den ene side og indgraveret "IMDUR" på siden uden delekærv. De leveres som følger:
100 flasker NDC 0085-1374-01
IMDUR tabletter med forlænget frigivelse 60 mg er hvide, kapselformede tabletter med delekærv på den ene side med quot;60-60" og indgraveret "IMDUR" på siden uden delekærv. De leveres som følger:
100 flasker NDC 0085-2028-01
IMDUR 30 mg tabletter med forlænget frigivelse 120 mg er hvide, kapselformede tabletter præget "IMDUR" på den ene side og "120" på den anden side. De leveres som følger:
100 flasker NDC 0085-0091-01
Opbevares ved kontrolleret stuetemperatur 20°-25°C (68°-77°F) [Se USP].
Fremstillet af: Kremers urban pharmaceuticals inc, seymour,IN47274,USA. Revideret: december 2010
BIVIRKNINGER
Tabellen nedenfor viser frekvensen af de bivirkninger, der forekom hos >5 % af forsøgspersonerne i tre placebokontrollerede nordamerikanske undersøgelser, hvor patienter i den aktive behandlingsarm fik 30 mg, 60 mg, 120 mg eller 240 mg isosorbid mononitrat som IMDUR 60 mg tabletter én gang dagligt. I parentes viser den samme tabel, hvor hyppigt disse bivirkninger var forbundet med seponering af behandlingen. Samlet set afbrød 8 % af de patienter, der fik 30 mg, 60 mg, 120 mg eller 240 mg isosorbidmononitrat i de tre placebokontrollerede nordamerikanske undersøgelser, behandlingen på grund af bivirkninger. De fleste af disse stoppede på grund af hovedpine. Svimmelhed var sjældent forbundet med tilbagetrækning fra disse undersøgelser. Da hovedpine ser ud til at være en dosisrelateret bivirkning og har en tendens til at forsvinde ved fortsat behandling, anbefales det, at IMDUR-behandling påbegyndes ved lave doser i flere dage, før den øges til de ønskede niveauer.
FREKVENS OG BIVIRKNINGER (AFBUDET) *
Derudover blev de tre nordamerikanske forsøg samlet med 11 kontrollerede forsøg udført i Europa. Blandt de 14 kontrollerede forsøg blev i alt 711 patienter randomiseret til IMDUR-tabletter. Når de samlede data blev gennemgået, var hovedpine og svimmelhed de eneste bivirkninger, der blev rapporteret af >5 % af patienterne. Andre bivirkninger, hver rapporteret af ≤5 % af de eksponerede patienter, og i mange tilfælde af usikker relation til lægemiddelbehandling, var:
Autonome nervesystem lidelser : Mundtørhed, hedeture.
Kroppen som helhed : Asteni, rygsmerter, brystsmerter, ødem, træthed, feber, influenzalignende symptomer, utilpashed, stivhed.
Kardiovaskulære lidelser, generelt : Hjertesvigt, hypertension, hypotension.
Centrale og perifere nervesystem lidelser : Svimmelhed, hovedpine, hypoæstesi, migræne, neuritis, pareser, paræstesi, ptosis, tremor, vertigo.
Forstyrrelser i mave-tarmsystemet Mavesmerter, forstoppelse, diarré, dyspepsi, flatulens, mavesår, gastritis, glossitis, hæmoragisk mavesår, hæmorider, løs afføring, melena, kvalme, opkastning.
Høre- og vestibulære lidelser : Ørepine, tinnitus, perforering af trommehinden.
Hjertefrekvens og rytmeforstyrrelser : Arytmi, arytmi atriel, atrieflimren, bradykardi, grenblok, ekstrasystole, hjertebanken, takykardi, ventrikulær takykardi.
Lever- og galdevejssygdomme : SGOT-stigning, SGPT-stigning.
Metaboliske og ernæringsforstyrrelser : Hyperurikæmi, hypokaliæmi.
Sygdomme i bevægeapparatet : Artralgi, frossen skulder, muskelsvaghed, muskuloskeletale smerter, myalgi, myositis, senelidelse, torticollis.
Myo-, endo-, perikardie- og klaplidelser : Angina pectoris forværret, hjertemislyd, unormal hjertelyd, myokardieinfarkt, Q-bølge abnormitet.
Blodplade-, blødnings- og koagulationsforstyrrelser : Purpura, trombocytopeni.
Psykiatriske lidelser Angst, nedsat koncentrationsevne, forvirring, nedsat libido, depression, impotens, søvnløshed, nervøsitet, paroniria, somnolens.
Røde blodlegemer lidelse : Hypokrom anæmi.
Reproduktionsforstyrrelser, kvinde : Atrofisk vaginitis, brystsmerter.
Forstyrrelser i modstandsmekanismen : Bakteriel infektion, moniliasis, virusinfektion.
Forstyrrelser i åndedrætssystemet : Bronkitis, bronkospasme, hoste, dyspnø, øget sputum, tilstoppet næse, pharyngitis, lungebetændelse, lungeinfiltration, rhinitis, bihulebetændelse.
Hud- og vedhængsforstyrrelser : Acne, unormal hårstruktur, øget svedtendens, kløe, udslæt, hudknude.
Urinvejslidelser : Polyuri, nyresten, urinvejsinfektion.
Vaskulære (ekstracardiale) lidelser : Rødmen, claudicatio intermittens, bensår, åreknuder.
Synsforstyrrelser : Konjunktivitis, fotofobi, unormalt syn.
Derudover er følgende spontane bivirkninger blevet rapporteret under markedsføringen af isosorbidmononitrat: synkope.
DRUGSINTERAKTIONER
De vasodilaterende virkninger af isosorbidmononitrat kan være additive med virkningerne af andre vasodilatorer. Især alkohol har vist sig at udvise additive virkninger af denne sort.
Udtalt symptomatisk ortostatisk hypotension er blevet rapporteret, når calciumkanalblokkere og organiske nitrater blev brugt i kombination. Dosisjusteringer af begge klasser af midler kan være nødvendige.
Interaktioner med lægemiddel/laboratorietest
Nitrater og nitritter kan interferere med Zlatkis-Zak-farvereaktionen og forårsage falsk lave aflæsninger i serumkolesterolbestemmelser.
ADVARSLER
Amplifikation af IMDURs vasodilaterende virkning med sildenafil kan resultere i alvorlig hypotension. Tidsforløbet og dosisafhængigheden af denne interaktion er ikke blevet undersøgt. Passende støttebehandling er ikke blevet undersøgt, men det forekommer rimeligt at behandle dette som en nitratoverdosis, med forhøjede ekstremiteter og med central volumenudvidelse.
Fordelene ved ISMN hos patienter med akut myokardieinfarkt eller kongestiv hjertesvigt er ikke blevet fastlagt; fordi virkningerne af isosorbidmononitrat er vanskelige at afslutte hurtigt, anbefales dette lægemiddel ikke i disse indstillinger.
Hvis isosorbidmononitrat anvendes under disse forhold, skal der anvendes omhyggelig klinisk eller hæmodynamisk overvågning for at undgå farerne ved hypotension og takykardi.
FORHOLDSREGLER
Generel
Alvorlig hypotension, især med oprejst stilling, kan forekomme med selv små doser af isosorbidmononitrat. Dette lægemiddel bør derfor anvendes med forsigtighed til patienter, der kan være volumendepleteret, eller som af en eller anden grund allerede er hypotensive. Hypotension induceret af isosorbidmononitrat kan være ledsaget af paradoksal bradykardi og øget angina pectoris.
Nitratbehandling kan forværre angina forårsaget af hypertrofisk kardiomyopati.
Hos industriarbejdere, der har været langvarig udsat for ukendte (formodentlig høje) doser af organiske nitrater, forekommer tolerance tydeligt. Brystsmerter, akut myokardieinfarkt og endda pludselig død er forekommet under midlertidig tilbagetrækning af nitrater fra disse arbejdere, hvilket viser eksistensen af ægte fysisk afhængighed. Betydningen af disse observationer for rutinemæssig, klinisk brug af oralt isosorbidmononitrat er ikke kendt.
Karcinogenese, mutagenese, svækkelse af fertilitet
Der blev ikke observeret tegn på carcinogenicitet hos rotter, der blev eksponeret for isosorbidmononitrat i deres kost i doser på op til 900 mg/kg/dag i de første 6 måneder og 500 mg/kg/dag i den resterende varighed af en undersøgelse, hvor hanner blev doseret i op til 121 uger og hunner blev doseret i op til 137 uger. Der blev ikke observeret tegn på carcinogenicitet hos mus, der blev eksponeret for isosorbidmononitrat i deres kost i op til 104 uger ved doser på op til 900 mg/kg/dag.
Isosorbidmononitrat producerede ikke genmutationer (Ames-test, muselymfomtest) eller kromosomafvigelser (humane lymfocyt- og musemikronukleustest) ved biologisk relevante koncentrationer.
Der blev ikke observeret nogen effekt på fertiliteten i et studie, hvor han- og hunrotter fik doser på op til 750 mg/kg/dag begyndende hos hanner 9 uger før parring og hos hunner 2 uger før parring.
Graviditet
Teratogene virkninger
Graviditetskategori B
undersøgelser designet til at påvise virkninger af isosorbidmononitrat på embryo-føtal udvikling var doser på op til 240 eller 248 mg/kg/dag, administreret til gravide rotter og kaniner, ikke forbundet med tegn på sådanne virkninger. Disse dyredoser er omkring 100 gange den maksimalt anbefalede humane dosis (120 mg hos en kvinde på 50 kg), når sammenligning er baseret på kropsvægt; når sammenligning er baseret på kropsoverfladeareal, er rottedosis ca. 17 gange den humane dosis, og kanindosis er ca. 38 gange den humane dosis. Der er dog ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder. Da reproduktionsundersøgelser hos dyr ikke altid forudsiger human respons, bør IMDUR tabletter kun anvendes under graviditet, hvis det er klart nødvendigt.
Ikke-ratatogene virkninger
Neonatal overlevelse og udvikling og forekomst af dødfødsler blev negativt påvirket, når drægtige rotter fik orale doser på 750 (men ikke 300) mg isosorbidmononitrat/kg/dag under sen drægtighed og laktation. Denne dosis (ca. 312 gange den humane dosis, når sammenligning er baseret på kropsvægt og 54 gange den humane dosis, når sammenligning er baseret på kropsoverflade) var forbundet med fald i moderens vægtøgning og motorisk aktivitet og tegn på svækket amning.
Ammende mødre
Det vides ikke, om dette lægemiddel udskilles i modermælk. Da mange lægemidler udskilles i modermælk, bør der udvises forsigtighed, når ISMN administreres til en ammende mor.
Pædiatrisk brug
Sikkerheden og effektiviteten af ISMN hos pædiatriske patienter er ikke blevet fastslået.
Geriatrisk brug
Kliniske undersøgelser af IMDUR 60 mg tabletter inkluderede ikke tilstrækkelig information om patienter på 65 år og derover til at afgøre, om de reagerer anderledes end yngre patienter. Anden rapporteret klinisk erfaring med IMDUR 20 mg har ikke identificeret forskelle i respons mellem ældre og yngre patienter. Klinisk erfaring for organiske nitrater rapporteret i litteraturen identificerede et potentiale for alvorlig hypotension og øget følsomhed over for nitrater hos ældre. Generelt bør dosisvalg for en ældre patient være forsigtigt, sædvanligvis begyndende i den lave ende af doseringsområdet, hvilket afspejler den større hyppighed af nedsat lever-, nyre- eller hjertefunktion og af samtidig sygdom eller anden lægemiddelbehandling.
Ældre patienter kan have nedsat baroreceptorfunktion og kan udvikle svær ortostatisk hypotension, når vasodilatorer anvendes. IMDUR 60mg bør derfor anvendes med forsigtighed til ældre patienter, som kan være volumenmangel, på flere lægemidler, eller som af en eller anden grund allerede er hypotensive. Hypotension induceret af isosorbidmononitrat kan være ledsaget af paradoksal bradykardi og øget angina pectoris.
Ældre patienter kan være mere modtagelige for hypotension og kan have større risiko for at falde ved terapeutiske doser af nitroglycerin.
Nitratbehandling kan forværre angina forårsaget af hypertrofisk kardiomyopati, især hos ældre.
OVERDOSIS
Hæmodynamiske effekter
De dårlige virkninger af overdosering af isosorbidmononitrat er generelt resultatet af isosorbidmononitrats evne til at inducere vasodilatation, venøs pooling, reduceret hjertevolumen og hypotension. Disse hæmodynamiske ændringer kan have protean-manifestationer, herunder øget intrakranielt tryk, med enhver eller alle af vedvarende bankende hovedpine, forvirring og moderat feber; svimmelhed, hjertebanken; synsforstyrrelser; kvalme og opkastning (muligvis med kolik og endda blodig diarré); synkope (især i opretstående stilling); luftsult og dyspnø, senere efterfulgt af reduceret respirationsanstrengelse; diaforese, med huden enten rød eller kold og klam; hjerteblok og bradykardi; lammelse; koma; anfald og død.
Laboratoriebestemmelser af serumniveauer af isosorbidmononitrat og dets metabolitter er ikke almindeligt tilgængelige, og sådanne bestemmelser har under alle omstændigheder ingen etableret rolle i håndteringen af isosorbidmononitratoverdosis.
Der er ingen data, der tyder på, hvilken dosis isosorbidmononitrat, der sandsynligvis er livstruende hos mennesker. Hos rotter og mus er der signifikant dødelighed ved doser på henholdsvis 2000 mg/kg og 3000 mg/kg.
Der er ingen tilgængelige data, der tyder på fysiologiske manøvrer (f.eks. manøvrer til at ændre urinens pH), som kan fremskynde elimineringen af isosorbidmononitrat. Især er dialyse kendt for at være ineffektiv til at fjerne isosorbidmononitrat fra kroppen.
Der kendes ingen specifik antagonist til de vasodilatoriske virkninger af isosorbidmononitrat, og ingen intervention Der kendes ingen specifik antagonist til de vasodilatoriske virkninger af isosorbidmononitrat, og ingen intervention har været genstand for kontrollerede undersøgelser som behandling af isosorbidmononitratoverdosering. Fordi hypotensionen forbundet med isosorbidmononitratoverdosering er resultatet af venodilatation og arteriel hypovolæmi, bør forsigtig behandling i denne situation rettes mod en stigning i central væskevolumen. Passiv hævning af patientens ben kan være tilstrækkelig, men intravenøs infusion af normalt saltvand eller lignende væske kan også være nødvendig.
Brugen af epinephrin eller andre arterielle vasokonstriktorer i denne indstilling vil sandsynligvis gøre mere skade end gavn.
Hos patienter med nyresygdom eller kongestiv hjerteinsufficiens er behandling, der resulterer i central volumenudvidelse, ikke uden fare. Behandling af isosorbidmononitrat overdosis hos disse patienter kan være subtil og vanskelig, og invasiv monitorering kan være påkrævet.
Methæmoglobinæmi
Methæmoglobinæmi er blevet rapporteret hos patienter, der får andre organiske nitrater, og det kan sandsynligvis også forekomme som en bivirkning af isosorbidmononitrat. Bestemt kan nitrationer, der frigives under metabolisme af isosorbidmononitrat, oxidere hæmoglobin til methæmoglobin. Selv hos patienter helt uden cytochrom b-reduktaseaktivitet, og selv hvis det antages, at nitratdelen af isosorbidmononitrat anvendes kvantitativt til oxidation af hæmoglobin, bør der kræves ca. 2 mg/kg isosorbidmononitrat, før nogen af disse patienter viser sig klinisk signifikant ( ≥10 %) methæmoglobinæmi. Hos patienter med normal reduktasefunktion bør signifikant produktion af methæmoglobin kræve endnu større doser af isosorbidmononitrat. I en undersøgelse, hvor 36 patienter modtog 2-4 ugers kontinuerlig nitroglycerinbehandling med 3,1 til 4,4 mg/time (svarende, i samlet administreret dosis af nitrationer, til 7,8-11,1 mg isosorbidmononitrat pr. time), var det gennemsnitlige methæmoglobinniveau målt var 0,2%; dette var sammenligneligt med det, der blev observeret hos parallelle patienter, som fik placebo.
På trods af disse observationer er der case-rapporter om signifikant methæmoglobinæmi i forbindelse med moderate overdoser af organiske nitrater. Ingen af de ramte patienter var blevet anset for at være usædvanligt modtagelige.
Methæmoglobinniveauer er tilgængelige fra de fleste kliniske laboratorier. Diagnosen bør mistænkes hos patienter, som udviser tegn på nedsat ilttilførsel på trods af tilstrækkeligt hjertevolumen og tilstrækkelig arteriel pO2. Klassisk beskrives methæmoglobinemisk blod som chokoladebrunt uden farveændring ved udsættelse for luft. Når methæmoglobinæmi diagnosticeres, er den foretrukne behandling methylenblåt, 1-2 mg/kg intravenøst.
KONTRAINDIKATIONER
IMDUR 20 mg tabletter er kontraindiceret til patienter, der har vist overfølsomhed eller idiosynkratiske reaktioner over for andre nitrater eller nitritter.
KLINISK FARMAKOLOGI
Handlingsmekanisme
IMDUR-produktet er en oral formulering med forlænget frigivelse af ISMN, den vigtigste aktive metabolit af isosorbiddinitrat; det meste af dinitratets kliniske aktivitet kan tilskrives mononitratet.
Den primære farmakologiske virkning af ISMN og alle organiske nitrater generelt er afslapning af vaskulær glat muskulatur, hvilket producerer udvidelse af perifere arterier og vener, især sidstnævnte. Udvidelse af venerne fremmer perifer samling af blod, mindsker venøs tilbagevenden til hjertet og reducerer derved venstre ventrikulær endediastolisk tryk og pulmonært kapillærkiletryk (preload). Arteriolær afslapning reducerer systemisk vaskulær modstand, systolisk arterielt tryk og middelarterielt tryk (efterbelastning). Dilatation af kranspulsårerne forekommer også. Den relative betydning af forbelastningsreduktion, efterbelastningsreduktion og koronar dilatation forbliver udefineret.
Farmakodynamik
Doseringsregimer for de fleste kronisk anvendte lægemidler er designet til at give plasmakoncentrationer, der konstant er større end en minimalt effektiv koncentration. Denne strategi er uhensigtsmæssig for organiske nitrater. Adskillige velkontrollerede kliniske forsøg har brugt træningstest til at vurdere antianginal effektiviteten af kontinuerligt leverede nitrater. I det store flertal af disse forsøg kunne aktive stoffer ikke skelnes fra placebo efter 24 timers (eller mindre) kontinuerlig behandling. Forsøg på at overvinde tolerance ved dosiseskalering, selv til doser langt over dem, der anvendes akut, har konsekvent mislykkedes. Først efter at nitrater har været fraværende fra kroppen i flere timer, er deres antianginal virkning blevet genoprettet. IMDUR-tabletter fortsatte under langtidsbrug over 42 dage doseret med 120 mg én gang dagligt med at forbedre træningspræstationen 4 timer og 12 timer efter dosering, men dens virkninger (selvom bedre end placebo) er mindre end eller i bedste fald lig med virkninger af den første dosis på 60 mg.
Farmakokinetik og metabolisme
Efter oral administration af ISMN som opløsning eller tabletter med øjeblikkelig frigivelse opnås maksimale plasmakoncentrationer af ISMN på 30 til 60 minutter med en absolut biotilgængelighed på ca. 100 %. Efter intravenøs administration fordeles ISMN i hele kropsvandet på ca. 9 minutter med et distributionsvolumen på ca. 0,6-0,7 l/kg. Isosorbidmononitrat er ca. 5 % bundet til humane plasmaproteiner og fordeles i blodceller og spyt. Isosorbidmononitrat metaboliseres primært af leveren, men i modsætning til oralt isosorbiddinitrat er det ikke genstand for first-pass metabolisme. Isosorbidmononitrat udskilles ved denitrering til isosorbid og glukuronidering som mononitrat, hvor 96 % af den administrerede dosis udskilles i urinen inden for 5 dage og kun ca. 1 % elimineres i fæces. Mindst seks forskellige forbindelser er blevet påvist i urinen, hvor omkring 2 % af dosis udskilles som det uændrede lægemiddel og mindst fem metabolitter. Metabolitterne er ikke farmakologisk aktive. Renal clearance udgør kun omkring 4 % af den samlede kropsclearance. Den gennemsnitlige plasmaelimineringshalveringstid for ISMN er ca. 5 timer.
Disponeringen af ISMN hos patienter med forskellige grader af nyreinsufficiens, levercirrhose eller hjertedysfunktion blev evalueret og fundet at svare til den, der er observeret hos raske forsøgspersoner. Eliminationshalveringstiden for ISMN var ikke forlænget, og der var ingen lægemiddelakkumulering hos patienter med kronisk nyresvigt efter flere orale doseringer.
Farmakokinetikken og/eller biotilgængeligheden af IMDUR 40 mg tabletter er blevet undersøgt hos både normale frivillige og patienter efter enkelt- og multiple-dosis administration. Data fra disse undersøgelser tyder på, at farmakokinetikken af ISMN administreret som IMDUR-tabletter er ens hos normale raske frivillige og patienter med angina pectoris. I enkelt- og flerdosisundersøgelser var farmakokinetikken af ISMN dosisproportional mellem 30 mg og 240 mg.
et flerdosisstudie blev effekten af alder på den farmakokinetiske profil af IMDUR 60 mg og 120 mg (2 × 60 mg) evalueret hos personer ≥45 år. Resultaterne af denne undersøgelse indikerer, at der ikke er signifikante forskelle i nogen af de farmakokinetiske variabler af ISMN mellem ældre (≥65 år) og yngre personer (45-64 år) for IMDUR 60 mg dosis. Administration af IMDUR tabletter 120 mg (2 × 60 mg tabletter hver 24. time i 7 dage) gav en dosisproportional stigning i Cmax og AUC uden ændringer i Tmax eller den terminale halveringstid. Den ældre gruppe (65-74 år) viste 30 % lavere tilsyneladende oral clearance (Cl/F) efter den højere dosis, dvs. 120 mg, sammenlignet med den yngre gruppe (45-64 år); Cl/F var ikke forskellig mellem de to grupper efter 60 mg-kuren. Mens Cl/F var uafhængig af dosis i den yngre gruppe, viste den ældre gruppe lidt lavere Cl/F efter 120 mg-kuren sammenlignet med 60 mg-kuren. Forskelle mellem de to aldersgrupper var dog ikke statistisk signifikante. I samme undersøgelse viste kvinder en let (15 %) reduktion i clearance, når dosis blev øget. Kvinder viste højere AUC'er og Cmax sammenlignet med mænd, men disse forskelle skyldtes forskelle i kropsvægt mellem de to grupper. Når dataene blev analyseret med alder som variabel, viste resultaterne, at der ikke var signifikante forskelle i nogen af de farmakokinetiske variabler af ISMN mellem ældre (≥65 år) og yngre personer (45-64 år). Resultaterne af denne undersøgelse skal dog ses med forsigtighed på grund af det lille antal forsøgspersoner i hver aldersundergruppe og følgelig manglen på tilstrækkelig statistisk kraft.
Følgende tabel opsummerer de vigtigste farmakokinetiske parametre for ISMN efter enkelt- og multipledoseadministration af ISMN som oral opløsning eller IMDUR-tabletter:
Mad effekter
Fødevarers indflydelse på biotilgængeligheden af ISMN efter enkeltdosisadministration af IMDUR-tabletter 60 mg blev evalueret i tre forskellige undersøgelser, der involverede enten en "let" morgenmad eller en morgenmad med højt kalorieindhold og højt fedtindhold. Resultater af disse undersøgelser indikerer, at samtidig fødeindtagelse kan reducere hastigheden (stigningen i Tmax), men ikke omfanget (AUC) af absorption af ISMN.
Kliniske forsøg
Kontrollerede forsøg med IMDUR-tabletter har vist antianginal aktivitet efter akut og kronisk dosering. Administration af IMDUR 40 mg tabletter én gang dagligt, taget tidligt om morgenen, når de står op, forudsat mindst 12 timers antianginal aktivitet.
et placebokontrolleret parallelt studie blev 30, 60, 120 og 240 mg IMDUR 60 mg tabletter administreret én gang dagligt i op til 6 uger. Før randomisering gennemførte alle patienter en 1- til 3-ugers enkelt-blind placebofase for at demonstrere nitratrespons og total reproducerbarhed af træningsløbebånd. Træningstolerancetest ved brug af Bruce-protokollen blev udført før og 4 og 12 timer efter morgendosis på dag 1, 7, 14, 28 og 42 i den dobbeltblindede periode. IMDUR 60 mg tabletter 30 og 60 mg (kun doser vurderet akut) viste en signifikant stigning fra baseline i den samlede løbebåndstid i forhold til placebo 4 og 12 timer efter administration af den første dosis. På dag 42 viste 120 og 240 mg dosis af IMDUR 40 mg tabletter en signifikant stigning i den samlede løbebåndstid 4 og 12 timer efter dosering, men på dag 42 var 30 og 60 mg doserne ikke længere differentiable fra placebo. Under kronisk dosering blev rebound ikke observeret i nogen IMDUR-behandlingsgruppe.
Samlede data fra to andre forsøg, der sammenlignede IMDUR 40 mg tabletter 60 mg én gang dagligt, ISDN 30 mg QID og placebo QID hos patienter med kronisk stabil angina ved brug af et randomiseret, dobbeltblindt, tre-vejs crossover-design, fandt statistisk signifikante stigninger i træningstolerance gange for IMDUR 20 mg tabletter sammenlignet med placebo på time 4, 8 og 12 og til ISDN på time 4. Forøgelserne i træningstolerance på dag 14, selvom det er statistisk signifikant sammenlignet med placebo, var omkring halvdelen af det, der blev set på dag 1 af forsøget .
PATIENTOPLYSNINGER
Patienterne skal informeres om, at den antianginale virkning af IMDUR 60 mg tabletter kan opretholdes ved nøje at følge den foreskrevne doseringsplan. For de fleste patienter kan dette opnås ved at tage dosis, når den opstår.
Som med andre nitrater, ledsager daglig hovedpine nogle gange behandling med isosorbidmononitrat. Hos patienter, der får disse hovedpine, er hovedpinen en markør for lægemidlets aktivitet. Patienter bør modstå fristelsen til at undgå hovedpine ved at ændre tidsplanen for deres behandling med isosorbidmononitrat, da tab af hovedpine kan være forbundet med samtidig tab af antianginal effekt. Aspirin eller acetaminophen lindrer ofte med succes isosorbidmononitrat-induceret hovedpine uden skadelig virkning på isosorbidmononitrats antianginale effekt.
Behandling med isosorbidmononitrat kan være forbundet med svimmelhed ved stående stilling, især lige efter at have rejst sig fra liggende eller siddende stilling. Denne effekt kan være hyppigere hos patienter, der også har indtaget alkohol.
