Smertestillende medicin: Lioresal 10mg, 25mg Baclofen Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Lioresal 10mg Intrathecal, og hvordan bruges det?
Lioresal Intrathecal er en receptpligtig medicin, der bruges til at behandle symptomer på spasticitet. Lioresal Intrathecal kan bruges alene eller sammen med anden medicin.
Lioresal Intrathecal tilhører en klasse af lægemidler kaldet skeletmuskelafslappende midler.
Det vides ikke, om Lioresal Intrathecal er sikkert og effektivt til børn under 12 år.
Hvad er de mulige bivirkninger af Lioresal 25mg Intrathecal?
Lioresal 10mg Intrathecal kan forårsage alvorlige bivirkninger, herunder:
- nældefeber,
- åndedrætsbesvær,
- hævelse af dit ansigt, læber, tunge eller hals,
- svær døsighed,
- svag eller overfladisk vejrtrækning,
- forvirring,
- hallucinationer,
- kløe, snurren eller trækninger i dine hænder, arme, fødder eller ben,
- feber, og
- anfald
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Lioresal 25mg Intrathecal omfatter:
- døsighed,
- svimmelhed,
- svaghed,
- træthed,
- hovedpine,
- søvnproblemer (søvnløshed),
- kvalme,
- forstoppelse, og
- vandladning oftere end normalt
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Lioresal Intrathecal. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Pludselig seponering af intrathecal baclofen, uanset årsagen, har resulteret i følgesygdomme, der omfatter høj feber, ændret mental status, overdreven rebound spasticitet og muskelstivhed, som i sjældne tilfælde har udviklet sig til rhabdomyolyse, multipel organsystemsvigt og død.
Forebyggelse af brat seponering af intrathekal baclofen kræver omhyggelig opmærksomhed på programmering og overvågning af infusionssystemet, genopfyldningsplanlægning og -procedurer samt pumpealarmer. Patienter og plejere bør informeres om vigtigheden af at holde planlagte genopfyldningsbesøg og bør oplyses om de tidlige symptomer på baclofenabstinenser. Særlig opmærksomhed bør gives til patienter med tilsyneladende risiko (f.eks. rygmarvsskader ved T-6 eller derover, kommunikationsbesvær, anamnese med abstinenssymptomer fra oral eller intrathecal baclofen). Se den tekniske manual til det implanterbare infusionssystem for yderligere postimplantatlæger og patientoplysninger (se ADVARSLER ).
BESKRIVELSE
LIORESAL INTRATHECAL (baclofen-injektion) er et muskelafslappende og antispastisk middel. Dens kemiske navn er 4-amino-3-(4-chlorphenyl) butansyre, og dens strukturformel er:
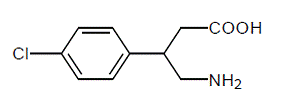
Baclofen er et hvidt til råhvidt, lugtfrit eller praktisk talt lugtfrit krystallinsk pulver med en molekylvægt på 213,66. Det er lidt opløseligt i vand, meget lidt opløseligt i methanol og uopløseligt i chloroform.
LIORESAL INTRATHECAL er en steril, pyrogenfri, isotonisk opløsning fri for antioxidanter, konserveringsmidler eller andre potentielt neurotoksiske tilsætningsstoffer, der kun er indiceret til intratekal administration. Lægemidlet er stabilt i opløsning ved 37°C og kompatibelt med CSF. Hver milliliter LIORESAL INTRATHECAL indeholder baclofen USP 50 mcg, 500 mcg eller 2000 mcg og natriumchlorid 9 mg i vand til injektion; pH-området er 5,0 - 7,0. Hver ampul er KUN beregnet til ENKELBRUG. Kassér enhver ubrugt portion. AUTOKLAVE IKKE.
INDIKATIONER
LIORESAL 10mg INTRATHECAL (baclofen-injektion) er indiceret til brug ved behandling af svær spasticitet. Patienter bør først reagere på en screeningsdosis af intrathekal baclofen før overvejelse af langtidsinfusion via en implanterbar pumpe. For spasticitet af rygmarvsoprindelse bør kronisk infusion af LIORESAL INTRATHECAL via en implanterbar pumpe reserveres til patienter, der ikke reagerer på oral baclofenbehandling, eller dem, som oplever utålelige CNS-bivirkninger ved effektive doser. Patienter med spasticitet på grund af traumatisk hjerneskade bør vente mindst et år efter skaden, før de overvejer langvarig intratekal baclofenbehandling. LIORESAL INTRATHECAL er beregnet til intratekal brug i enkelt bolustestdoser (via spinalkateter eller lumbalpunktur) og, til kronisk brug, kun i implanterbare pumper godkendt af FDA specifikt til administration af LIORESAL INTRATHECAL i det intrathecale rum.
Spasticitet af rygmarvsoprindelse
Beviser, der understøtter effektiviteten af LIORESAL INTRATHECAL, blev opnået i randomiserede, kontrollerede undersøgelser, der sammenlignede virkningerne af enten en enkelt intrathekal dosis eller en tre dages intrathekal infusion af LIORESAL INTRATHECAL med placebo hos patienter med svær spasticitet og spasmer på grund af enten rygmarvstraumer eller multiple sklerose. LIORESAL 10mg INTRATHECAL var overlegen i forhold til placebo på begge de primære resultatmål, der blev anvendt: ændring fra baseline i Ashworth-vurderingen af spasticitet og hyppigheden af spasmer.
Spasticitet af cerebral oprindelse
Effekten af LIORESAL INTRATHECAL blev undersøgt i tre kontrollerede kliniske forsøg; to indskrevne patienter med cerebral parese og en indskrevne patienter med spasticitet på grund af tidligere hjerneskade. Det første studie, et randomiseret kontrolleret cross-over forsøg med 51 patienter med cerebral parese, gav stærke, statistisk signifikante resultater; LIORESAL INTRATHECAL var bedre end placebo med hensyn til at reducere spasticitet målt ved Ashworth-skalaen. En anden cross-over undersøgelse blev udført med 11 patienter med spasticitet som følge af hjerneskade. På trods af den lille stikprøvestørrelse gav undersøgelsen en næsten signifikant teststatistik (p=0,066) og gav retningsbestemt gunstige resultater. Den sidste undersøgelse gav dog ikke data, der kunne analyseres pålideligt.
LIORESAL 10 mg INTRATHEKAL behandling kan betragtes som et alternativ til destruktive neurokirurgiske procedurer. Før implantation af en anordning til kronisk intrathekal infusion af LIORESAL 10mg INTRATHECAL, skal patienter vise respons på LIORESAL 10mg INTRATHECAL i et screeningsforsøg (se DOSERING OG ADMINISTRATION ).
DOSERING OG ADMINISTRATION
Se producentens manual for den implanterbare pumpe, der er godkendt til intrathekal infusion, for specifikke instruktioner og forholdsregler for programmering af pumpen og/eller genopfyldning af reservoiret. Der findes forskellige pumper med varierende reservoirvolumener, og der findes forskellige genopfyldningssæt. Det er vigtigt at være bekendt med alle disse produkter for at vælge det passende genopfyldningssæt til den pågældende pumpe.
Screeningsfase
Før pumpeimplantation og påbegyndelse af kronisk infusion af LIORESAL INTRATHECAL (baclofen-injektion), skal patienter demonstrere et positivt klinisk respons på en LIORESAL INTRATHECAL bolusdosis administreret intratekalt i et screeningsforsøg. Screeningsforsøget anvender LIORESAL INTRATHECAL i en koncentration på 50 mcg/ml. En 1 mL ampul (50 mcg/mL) er tilgængelig til brug i screeningsforsøget. Screeningsproceduren er som følger. En initial bolus indeholdende 50 mikrogram i et volumen på 1 milliliter indgives i det intrathecale rum ved barbotage over en periode på ikke mindre end et minut. Patienten observeres over de efterfølgende 4 til 8 timer. Et positivt svar består af et signifikant fald i muskeltonus og/eller hyppighed og/eller sværhedsgrad af spasmer. Hvis det initiale respons er mindre end ønsket, kan en anden bolusinjektion gives 24 timer efter den første. Den anden screeningsbolusdosis består af 75 mikrogram i 1,5 milliliter. Igen skal patienten observeres i et interval på 4 til 8 timer. Hvis responsen stadig er utilstrækkelig, kan en endelig bolusscreeningsdosis på 100 mikrogram i 2 milliliter administreres 24 timer senere.
Pædiatriske patienter
Startdosis for screening for pædiatriske patienter er den samme som for voksne patienter, dvs. 50 mcg. For meget små patienter kan en screeningsdosis på 25 mcg dog prøves først. Patienter, der ikke reagerer på en 100 mcg intratekal bolus, bør ikke betragtes som kandidater til en implanteret pumpe til kronisk infusion.
Post-implantat dosistitreringsperiode
For at bestemme den indledende totale daglige dosis af LIORESAL INTRATHECAL efter implantation, bør screeningsdosis, der gav en positiv effekt, fordobles og administreres over en 24-timers periode, medmindre effekten af bolusdosis blev opretholdt i mere end 8 timer, hvor i tilfælde af, at den daglige startdosis skal være screeningsdosis, der leveres over en 24-timers periode. Ingen dosisforøgelser bør gives i de første 24 timer (dvs. indtil steady state er opnået).
Voksne patienter med spasticitet af rygmarvsoprindelse
Efter de første 24 timer, for voksne patienter, bør den daglige dosis øges langsomt med 10-30 % trin og kun én gang hver 24. time, indtil den ønskede kliniske effekt er opnået.
Voksne patienter med spasticitet af cerebral oprindelse
Efter de første 24 timer bør den daglige dosis øges langsomt med 5-15 % kun én gang hver 24. time, indtil den ønskede kliniske effekt er opnået.
Pædiatriske patienter
Efter de første 24 timer bør den daglige dosis øges langsomt med 5-15 % kun én gang hver 24. time, indtil den ønskede kliniske effekt er opnået. Hvis der ikke er en væsentlig klinisk respons på stigninger i den daglige dosis, skal du kontrollere, om pumpen fungerer korrekt og kateteret er åben. Patienter skal overvåges nøje i et fuldt udstyret og bemandet miljø under screeningsfasen og dosistitreringsperioden umiddelbart efter implantation. Genoplivningsudstyr bør være umiddelbart tilgængeligt til brug i tilfælde af livstruende eller utålelige bivirkninger.
Vedligeholdelsesterapi
Spasticitet hos patienter med oprindelse i rygmarv
Det kliniske mål er at opretholde muskeltonus så tæt på normal som muligt, og at minimere hyppigheden og sværhedsgraden af spasmer i det omfang det er muligt, uden at fremkalde uacceptable bivirkninger. Meget ofte skal vedligeholdelsesdosis justeres i løbet af de første par måneder af behandlingen, mens patienter tilpasser sig ændringer i livsstil på grund af lindring af spasticitet. Ved periodisk genopfyldning af pumpen kan den daglige dosis øges med 10-40 %, men ikke mere end 40 %, for at opretholde tilstrækkelig symptomkontrol. Den daglige dosis kan reduceres med 10-20 %, hvis patienter oplever bivirkninger. De fleste patienter kræver gradvise stigninger i dosis over tid for at opretholde optimal respons under kronisk behandling. Et pludseligt stort behov for dosiseskalering tyder på en kateterkomplikation (dvs. kateterknæk eller forskydning).
Vedligeholdelsesdosis til langtidskontinuerlig infusion af LIORESAL 10 mg INTRATHECAL (baclofen-injektion) har varieret fra 12 mcg/dag til 2003 mcg/dag, hvor de fleste patienter er tilstrækkeligt opretholdt på 300 mikrogram til 800 mikrogram pr. dag. Der er begrænset erfaring med daglige doser større end 1000 mcg/dag. Bestemmelse af den optimale LIORESAL INTRATHECAL dosis kræver individuel titrering. Den laveste dosis med optimal respons bør anvendes.
Spasticitet hos patienter med cerebral oprindelse
Det kliniske mål er at opretholde muskeltonus så tæt på normal som muligt og at minimere hyppigheden og sværhedsgraden af spasmer i det omfang det er muligt, uden at fremkalde uacceptable bivirkninger, eller at titrere dosis til den ønskede grad af muskeltonus for optimale funktioner. Meget ofte skal vedligeholdelsesdosis justeres i løbet af de første par måneder af behandlingen, mens patienter tilpasser sig ændringer i livsstil på grund af lindring af spasticitet. Ved periodisk genopfyldning af pumpen kan den daglige dosis øges med 5-20 %, men ikke mere end 20 %, for at opretholde tilstrækkelig symptomkontrol. Den daglige dosis kan reduceres med 10-20 %, hvis patienter oplever bivirkninger. Mange patienter kræver gradvise stigninger i dosis over tid for at opretholde optimal respons under kronisk behandling. Et pludseligt stort behov for dosiseskalering tyder på en kateterkomplikation (dvs. kateterknæk eller forskydning).
Vedligeholdelsesdosis for langtidskontinuerlig infusion af LIORESAL 25 mg INTRATHECAL (baclofen-injektion) har varieret fra 22 mcg/dag til 1400 mcg/dag, med de fleste patienter tilstrækkeligt opretholdt på 90 mikrogram til 703 mikrogram pr. dag. I kliniske forsøg krævede kun 3 ud af 150 patienter daglige doser på mere end 1000 mcg/dag.
Pædiatriske patienter
Brug samme doseringsanbefalinger til patienter med spasticitet af cerebral oprindelse. Pædiatriske patienter under 12 år syntes at kræve en lavere daglig dosis i kliniske forsøg. Den gennemsnitlige daglige dosis for patienter under 12 år var 274 mcg/dag med et interval på 24 til 1199 mcg/dag. Dosiskravet til pædiatriske patienter over 12 år ser ikke ud til at være anderledes end for voksne patienter. Bestemmelse af den optimale LIORESAL INTRATHECAL dosis kræver individuel titrering. Den laveste dosis med optimal respons bør anvendes.
Potentielt behov for dosisjusteringer ved kronisk brug
Under langtidsbehandling bliver ca. 5 % (28/627) af patienterne refraktære over for stigende doser. Der er ikke tilstrækkelig erfaring til at komme med klare anbefalinger til tolerancebehandling; denne "tolerance" er dog lejlighedsvis blevet behandlet på hospitalet med en "medicinferie" bestående af en gradvis reduktion af LIORESAL 25 mg INTRATHECAL over en periode på 2 til 4 uger og skift til alternative metoder til spasticitetsbehandling. Efter "medicinferien" kan LIORESAL INTRATHECAL genoptages ved den indledende kontinuerlige infusionsdosis.
Stabilitet
Parenterale lægemidler bør inspiceres for partikler og misfarvning før administration, når opløsning og beholder tillader det.
Leveringsspecifikationer
Den specifikke koncentration, der skal anvendes, afhænger af den samlede daglige dosis, der kræves samt pumpens leveringshastighed. LIORESAL 10mg INTRATHECAL kan kræve fortynding, når det bruges sammen med visse implanterbare pumper. Se venligst producentens manual for specifikke anbefalinger.
Forberedelsesinstruktion
Screening
Brug kun 1 mL screeningsampullen (50 mcg/ml) til bolusinjektion i det subaraknoideale rum. Til en 50 mcg bolusdosis skal du bruge 1 ml af screeningsampullen. Brug 1,5 mL 50 mcg/ml baclofen-injektion til en 75 mcg bolusdosis. Til den maksimale screeningsdosis på 100 mcg, brug 2 mL 50 mcg/mL baclofen-injektion (2 screeningsampuller).
Vedligeholdelse
Til patienter, som kræver andre koncentrationer end 500 mcg/ml eller 2000 mcg/ml, LIORESAL INTRATHECAL skal fortyndes .
LIORESAL 10mg INTRATHEKAL skal fortyndes med sterilt konserveringsmiddelfrit natriumklorid til injektion, USP
Leveringsregime
LIORESAL 10mg INTRATHECAL administreres oftest i en kontinuerlig infusionstilstand umiddelbart efter implantation. For de patienter implanteret med programmerbare pumper, som har opnået relativt tilfredsstillende kontrol ved kontinuerlig infusion, kan der opnås yderligere fordele ved at bruge mere komplekse skemaer for LIORESAL INTRATHECAL levering. For eksempel kan patienter, der har øgede spasmer om natten, kræve en stigning på 20 % i deres timelige infusionshastighed. Ændringer i flowhastigheden skal programmeres til at starte to timer før tidspunktet for den ønskede kliniske effekt.
HVORDAN LEVERET
LIORESAL INTRATHECAL (baclofen injektion) er pakket i ampuller til engangsbrug, der indeholder 0,05 mg/1 ml (50 mcg/ml), 10 mg/20 mL (500 mcg/ml), 10 mg/5 mL (2000 mcg/ml) eller 40 mg/20 mL ( 2000 mcg/mL) leveres som følger:
Screeningsdosis (model 8563s): fem ampuller, der hver indeholder 0,05 mg/1 ml (50 mcg/ml) ( NDC 70257-562-55).
LIORESAL INTRATHECAL (baclofen injektion) genopfyldningssæt Hvert genopfyldningssæt inkluderer den angivne mængde LIORESAL INTRATHECAL, et lægemiddelforberedelseskit, et pumpeopfyldningssæt med tilbehør, der er kompatibelt med Medtronic SynchroMed® infusionssystemer, og tilhørende instruktioner.
Model 8561 : en ampul indeholdende 10 mg/20 ml (500 mcg/mL) ( NDC 70257-560-01).
Model 8562 : to ampuller, hver indeholder 10 mg/5 ml (2000 mcg/mL) ( NDC 70257-561-02).
Model 8564 : en ampul indeholdende 40 mg/20 ml (2000 mcg/ml) ( NDC 70257-563-01).
Model 8565 : to ampuller, hver indeholder 10 mg/20 ml (500 mcg/mL) ( NDC 70257-560-02).
Model 8566 : to ampuller, hver indeholder 40 mg/20 ml (2000 mcg/mL) ( NDC 70257-563-02).
Opbevaring
Kræver ikke nedkøling.
Må ikke opbevares over 86°F (30°C).
Må ikke fryses.
Må ikke varmesteriliseres.
Distribueret af: Saol Therapeutics Inc. Saol Therapeutics Inc., Roswell, GA 30076. Revideret: Jan 2019
BIVIRKNINGER
Spasticitet af rygmarvsoprindelse - kliniske undersøgelser
Almindeligvis observeret hos patienter med spasticitet af spinal oprindelse
I kliniske forsøg før og efter markedsføring var de mest almindeligt observerede bivirkninger forbundet med brugen af LIORESAL 25 mg INTRATHECAL (baclofen-injektion), som ikke blev set med en tilsvarende hyppighed blandt placebotbehandlede patienter: somnolens, svimmelhed, kvalme, hypotension, hovedpine, kramper og hypotoni.
Forbundet med seponering af behandling
8/474 patienter med spasticitet af rygmarvsoprindelse, der fik langtidsinfusion af LIORESAL 25 mg INTRATHECAL i præ- og post-marketing kliniske studier i USA, afbrød behandlingen på grund af bivirkninger. Disse omfatter: pumpelommeinfektioner (3), meningitis (2), såropløsning (1), gynækologiske fibromer (1) og pumpeovertryk (1) med ukendt, om nogen, følgesygdomme. Elleve patienter, som udviklede koma sekundært til overdosering, fik deres behandling midlertidigt suspenderet, men alle blev efterfølgende genoptaget og blev derfor ikke anset for at være ægte seponeringer.
Dødsfald
Se ADVARSLER .
Forekomst i kontrollerede forsøg
Erfaring med LIORESAL INTRATHECAL (baclofen-injektion) opnået i parallelle, placebokontrollerede, randomiserede undersøgelser giver kun et begrænset grundlag for at estimere forekomsten af bivirkninger, fordi undersøgelserne var af meget kort varighed (op til tre dages infusion) og kun involverede en i alt 63 patienter. Følgende hændelser forekom blandt de 31 patienter, der fik LIORESAL INTRATHECAL (baclofen-injektion) i to randomiserede, placebo-kontrollerede forsøg: hypotension (2), svimmelhed (2), hovedpine (2), dyspnø (1). Ingen bivirkninger blev rapporteret blandt de 32 patienter, der fik placebo i disse undersøgelser.
Hændelser observeret under evalueringen af LIORESAL INTRATHECAL før og efter markedsføring
Bivirkninger forbundet med brugen af LIORESAL 25 mg INTRATHECAL afspejler erfaringer opnået med 576 patienter fulgt prospektivt i USA. De modtog LIORESAL INTRATHECAL i perioder på en dag (screening) (N = 576) til over otte år (vedligeholdelse) (N = 10). Den sædvanlige screeningsbolusdosis administreret før pumpeimplantation i disse undersøgelser var typisk 50 mcg. Vedligeholdelsesdosis varierede fra 12 mcg til 2003 mcg pr. dag. På grund af oplevelsens åbne, ukontrollerede karakter kan en årsagssammenhæng mellem observerede hændelser og administration af LIORESAL INTRATHECAL ikke vurderes pålideligt i mange tilfælde, og mange af de rapporterede bivirkninger vides at forekomme i forbindelse med de underliggende tilstande, der behandles. Ikke desto mindre forekommer mange af de mere almindeligt rapporterede reaktioner - hypotoni, somnolens, svimmelhed, paræstesi, kvalme/opkastning og hovedpine - klart lægemiddelrelaterede.
Bivirkninger rapporteret under alle amerikanske undersøgelser (både kontrollerede og ukontrollerede) er vist i følgende tabel. Otte ud af 474 patienter, som fik kronisk infusion via implanterede pumper, havde bivirkninger, som førte til afbrydelse af langtidsbehandling i præ- og post-marketing undersøgelserne.
FOREKOMST AF FYKSTE (≥1 %) BIVIRKNINGER HOS PATIENTER MED SPASTICITET AF SPINAL OPRINDELSE I PROSPEKTIVT OVERVÅGTE KLINISKE FORSØG
Ud over de mere almindelige (1 % eller flere) bivirkninger rapporteret hos de prospektivt fulgte 576 indenlandske patienter i præ- og postmarketingundersøgelser, har erfaringer fra yderligere 194 patienter eksponeret for LIORESAL 25 mg INTRATHECAL (baclofen-injektion) fra udenlandske undersøgelser. blevet rapporteret. Følgende uønskede hændelser, som ikke er beskrevet i tabellen, og arrangeret i faldende frekvens og klassificeret efter kropssystem, blev rapporteret:
Nervesystem: Unormal gang, unormal tænkning, tremor, hukommelsestab, trækninger, vasodilitation, cerebrovaskulær ulykke, nystagmus, personlighedsforstyrrelse, psykotisk depression, cerebral iskæmi, følelsesmæssig labilitet, eufori, hypertoni, ileus, stofafhængighed, inkoordination, paranoid reaktion og ptose.
Fordøjelsessystemet: Flatulens, dysfagi, dyspepsi og gastroenteritis.
Kardiovaskulær: Postural hypotension, bradykardi, hjertebanken, synkope, arytmi ventrikulær, dyb tromboflebitis, bleghed og takykardi.
Åndedræt: Luftvejsforstyrrelser, aspirationspneumoni, hyperventilation, lungeemboli og rhinitis.
Urogenital: Hæmaturi og nyresvigt.
Hud og vedhæng: Alopeci og svedtendens.
Metaboliske og ernæringsforstyrrelser: Vægttab, albuminuri, dehydrering og hyperglykæmi.
Særlige sanser: Unormalt syn, unormal akkommodation, fotofobi, smagstab og tinnitus.
Kroppen som helhed: Selvmord, manglende lægemiddeleffekt, mavesmerter, hypotermi, nakkestivhed, brystsmerter, kulderystelser, ansigtsødem, influenzasyndrom og overdosis.
Hemisk og lymfesystem: Anæmi.
Spasticitet af cerebral oprindelse - kliniske undersøgelser
Almindelig observeret
I præ-marketing kliniske forsøg omfattede de mest almindeligt observerede bivirkninger forbundet med brugen af LIORESAL 25 mg INTRATHECAL (baclofen-injektion), som ikke blev set med en tilsvarende hyppighed blandt placebo-behandlede patienter: agitation, forstoppelse, somnolens, leukocytose, kulderystelser, urinvejr. retention og hypotoni.
Forbundet med seponering af behandling
Ni ud af 211 patienter, der fik LIORESAL INTRATHECAL i præ-marketing kliniske undersøgelser i USA, afbrød langtidsinfusion på grund af bivirkninger forbundet med intratekal behandling.
De ni bivirkninger, der førte til seponering, var: infektion (3), CSF-lækager (2), meningitis (2), drænage (1) og uoverskuelig trunkkontrol (1).
Dødsfald
Tre dødsfald, hvoraf ingen blev tilskrevet LIORESAL 10 mg INTRATHECAL, blev rapporteret hos patienter i kliniske forsøg med patienter med spasticitet af cerebral oprindelse. Se Advarsler om andre dødsfald rapporteret hos patienter med spinal spasticitet .
Forekomst i kontrollerede forsøg
Erfaring med LIORESAL INTRATHECAL (baclofen-injektion) opnået i parallelle, placebokontrollerede, randomiserede undersøgelser giver kun et begrænset grundlag for at estimere forekomsten af bivirkninger, fordi undersøgelserne involverede i alt 62 patienter, der blev eksponeret for en enkelt 50 mcg intratekal bolus. Følgende hændelser forekom blandt de 62 patienter, der fik LIORESAL 10 mg INTRATHECAL i to randomiserede, placebokontrollerede undersøgelser, der involverede henholdsvis cerebral parese og hovedskadepatienter: agitation, forstoppelse, somnolens, leukocytose, kvalme, opkastning, nystagmus, nystagmus, kulde hypotoni.
Hændelser observeret under præ-marketing evalueringen af LIORESAL 25mg INTRATHECAL
Bivirkninger forbundet med brugen af LIORESAL INTRATHECAL afspejler erfaringer opnået med i alt 211 amerikanske patienter med spasticitet af cerebral oprindelse, hvoraf 112 var pædiatriske patienter (under 16 år ved indskrivning). De fik LIORESAL INTRATHECAL i perioder på en dag (screening) (N= 211) til 84 måneder (vedligeholdelse) (N= 1). Den sædvanlige screeningsbolusdosis administreret før pumpeimplantation i disse undersøgelser var 50-75 mcg. Vedligeholdelsesdosis varierede fra 22 mcg til 1400 mcg pr. dag. Doser anvendt i denne patientpopulation til langtidsinfusion er generelt lavere end dem, der kræves til patienter med spasticitet af rygmarvsoprindelse.
På grund af oplevelsens åbne, ukontrollerede karakter kan en årsagssammenhæng mellem observerede hændelser og administration af LIORESAL INTRATHECAL ikke vurderes pålideligt i mange tilfælde. Ikke desto mindre forekommer mange af de mere almindeligt rapporterede reaktioner - somnolens, svimmelhed, hovedpine, kvalme, hypotension, hypotoni og koma - klart lægemiddelrelaterede.
De hyppigste (≥1%) bivirkninger rapporteret under alle kliniske forsøg er vist i følgende tabel. Ni patienter afbrød langtidsbehandling på grund af bivirkninger.
FOREKOMST AF FYKSTE (≥ 1 %) BIVIRKNINGER HOS PATIENTER MED SPASTICITET AF CEREBRAL OPRINDELSE I PROSPECTIVE OVERVÅGTE KLINISKE FORSØG
De mere almindelige (1 % eller flere) bivirkninger rapporteret hos de prospektivt fulgte 211 patienter, der blev eksponeret for LIORESAL 25 mg INTRATHECAL (baclofen-injektion), er blevet rapporteret. I den samlede kohorte blev følgende uønskede hændelser, som ikke er beskrevet i tabellen, og arrangeret i faldende hyppighed og klassificeret efter kropssystem, rapporteret:
Nervesystem: Akatisi, ataksi, forvirring, depression, opisthotonos, amnesi, angst, hallucinationer, hysteri, søvnløshed, nystagmus, personlighedsforstyrrelse, nedsatte reflekser og vasodilitation.
Fordøjelsessystemet: Dysfagi, fækal inkontinens, gastrointestinal blødning og tungelidelse.
Kardiovaskulær: Bradykardi.
Åndedræt: Apnø, dyspnø og hyperventilation.
Urogenital: Unormal ejakulation, nyresten, oliguri og vaginitis.
Hud og vedhæng: Udslæt, svedtendens, alopeci, kontaktdermatitis og hudsår.
Særlige sanser: Unormal indkvartering.
Kroppen som helhed: Dødsfald, feber, mavesmerter, karcinom, utilpashed og hypotermi.
Hemisk og lymfesystem: Leukocytose og petechialt udslæt.
Postmarketing oplevelse
Følgende bivirkninger er blevet rapporteret under brug af LIORESAL INTRATHECAL efter godkendelse. Fordi disse hændelser rapporteres frivilligt fra en population af usikker størrelse, er det ikke muligt pålideligt at estimere deres hyppighed.
Muskuloskeletale
Begyndelsen af skoliose eller forværring af en allerede eksisterende skoliose er blevet rapporteret.
Urogenital
Seksuel dysfunktion hos mænd og kvinder, herunder nedsat libido og orgasmesysfunktion, er blevet rapporteret. Erektil dysfunktion hos mænd er også blevet rapporteret. Priapisme er blevet rapporteret efter tilbagetrækning af baclofen.
DRUGSINTERAKTIONER
Der er utilstrækkelig systematisk erfaring med brugen af LIORESAL INTRATHECAL i kombination med andre lægemidler til at forudsige specifikke lægemiddel-interaktioner. Interaktioner, der tilskrives den kombinerede brug af LIORESAL INTRATHECAL og epidural morfin, omfatter hypotension og dyspnø.
ADVARSLER
LIORESAL INTRATHECAL er til brug i enkeltbolus intrathekale injektioner (via et kateter placeret i det lumbale intrathecale rum eller injektion ved lumbalpunktur) og i implanterbare pumper godkendt af FDA specifikt til intrathekal administration af baclofen. På grund af muligheden for potentielt livstruende CNS-depression, kardiovaskulær kollaps og/eller respirationssvigt, skal læger være tilstrækkeligt trænet og uddannet i kronisk intratekal infusionsbehandling.
Pumpesystemet bør ikke implanteres, før patientens respons på bolus LIORESAL 10 mg INTRATHECAL-injektion er tilstrækkeligt evalueret. Evaluering (bestående af en screeningsprocedure: se DOSERING OG ADMINISTRATION kræver, at LIORESAL 25mg INTRATHECAL indgives i det intrathecale rum via et kateter eller lumbalpunktur. På grund af de risici, der er forbundet med screeningsproceduren og justeringen af dosis efter pumpeimplantation, skal disse faser udføres i et lægeligt overvåget og tilstrækkeligt udstyret miljø efter instruktionerne beskrevet i afsnittet Dosering og administration.
Genoplivningsudstyr skal være tilgængeligt.
Efter kirurgisk implantation af pumpen, især i de indledende faser af pumpebrug, skal patienten overvåges nøje, indtil det er sikkert, at patientens respons på infusionen er acceptabel og rimelig stabil.
Hver gang pumpens doseringshastighed og/eller koncentrationen af LIORESAL INTRATHECAL (baclofen-injektion) i reservoiret justeres, kræves tæt medicinsk overvågning, indtil det er sikkert, at patientens respons på infusionen er acceptabel og rimelig stabil.
Det er obligatorisk, at patienten, alle patientplejere og de læger, der er ansvarlige for patienten, modtager tilstrækkelig information om risiciene ved denne behandlingsform. Alt medicinsk personale og plejepersonale bør instrueres i 1) tegn og symptomer på overdosering, 2) procedurer, der skal følges i tilfælde af overdosering og 3) korrekt hjemmepleje af pumpen og indføringsstedet.
Overdosis
Tegn på overdosering kan opstå pludseligt eller snigende. Akut massiv overdosis kan vise sig som koma. Mindre pludselige og/eller mindre alvorlige former for overdosering kan vise sig med tegn på døsighed, svimmelhed, svimmelhed, somnolens, respirationsdepression, kramper, rostral progression af hypotoni og bevidsthedstab, der udvikler sig til koma. Hvis overdosering forekommer sandsynlig, skal patienten straks bringes til et hospital til vurdering og tømning af pumpebeholderen. I tilfælde rapporteret til dato har overdosering generelt været relateret til pumpefejl, utilsigtet subkutan injektion eller doseringsfejl. (Se Lægemiddeloverdosis Symptomer og behandling .)
Der skal udvises ekstrem forsigtighed ved påfyldning af en FDA godkendt implanterbar pumpe. Sådanne pumper bør kun genopfyldes gennem reservoirgenopfyldningsseptumet. Utilsigtet injektion i det subkutane væv kan forekomme, hvis reservoirgenopfyldningsseptumet ikke er korrekt tilgængeligt. Nogle pumper er også udstyret med en kateteradgangsport, der giver direkte adgang til det intrathekale kateter. Direkte injektion i denne kateteradgangsport eller utilsigtet injektion i det subkutane væv kan forårsage en livstruende overdosis.
Tilbagetrækning
Pludselig seponering af intrathecal baclofen, uanset årsagen, har resulteret i følgesygdomme, der omfattede høj feber, ændret mental status, overdreven rebound spasticitet og muskelstivhed, der i sjældne tilfælde udviklede sig til rhabdomyolyse, multipel organsystemsvigt og død. I de første 9 års erfaring efter markedsføring blev der rapporteret 27 tilfælde af abstinenser, der var midlertidigt relateret til ophør af baclofenbehandling; seks patienter døde. I de fleste tilfælde optrådte abstinenssymptomer inden for timer til få dage efter afbrydelse af baclofen-behandlingen. Almindelige årsager til brat afbrydelse af intrathekal baclofen-terapi omfattede fejlfunktion af kateteret (især frakobling), lavt volumen i pumpereservoiret og udløbet af pumpens batterilevetid; menneskelige fejl kan have spillet en årsagsmæssig eller medvirkende rolle i nogle tilfælde. Tilfælde af intrathekal masse i spidsen af det implanterede kateter, der fører til abstinenssymptomer, er også blevet rapporteret, de fleste af dem involverer apotekskomponerede analgetikablandinger (se FORHOLDSREGLER ).
Forebyggelse af brat seponering af intrathekal baclofen kræver omhyggelig opmærksomhed på programmering og overvågning af infusionssystemet, genopfyldningsplanlægning og -procedurer samt pumpealarmer. Patienter og plejere bør informeres om vigtigheden af at holde planlagte genopfyldningsbesøg og bør oplyses om de tidlige symptomer på baclofenabstinenser.
Alle patienter, der får intratekal baclofenbehandling, er potentielt i risiko for abstinenser. Tidlige symptomer på tilbagetrækning af baclofen kan omfatte tilbagevenden af baseline spasticitet, pruritus, hypotension og paræstesier. Priapisme kan udvikle sig eller gentage sig, hvis behandlingen med intrathecal baclofen afbrydes. Nogle kliniske karakteristika ved det fremskredne intratekale baclofenabstinenssyndrom kan ligne autonom dysrefleksi, infektion (sepsis), malign hypertermi, neuroleptika-malignt syndrom eller andre tilstande forbundet med en hypermetabolisk tilstand eller udbredt rabdomyolyse.
Hurtig, præcis diagnose og behandling på en skadestue eller intensivafdeling er vigtig for at forhindre de potentielt livstruende centralnervesystem og systemiske virkninger af intrathekal baclofenabstinenser. Den foreslåede behandling for intrathecal baclofenabstinens er genoprettelse af intrathecal baclofen ved eller tæt på den samme dosis som før behandlingen blev afbrudt. Men hvis genoprettelse af intratekal levering forsinkes, kan behandling med GABA-erge agonistlægemidler såsom oral eller enteral baclofen eller orale, enterale eller intravenøse benzodiazepiner forhindre potentielt fatale følgesygdomme. Der bør ikke stoles på oral eller enteral baclofen alene for at standse progressionen af intratekal baclofenabstinens.
Kramper er blevet rapporteret under overdosering og ved ophør med LIORESAL 25mg INTRATHECAL såvel som hos patienter, der fastholdes på terapeutiske doser af LIORESAL INTRATHECAL.
Dødsfald
Spasticitet af rygmarvsoprindelse
Der blev rapporteret 16 dødsfald blandt de 576 amerikanske patienter behandlet med LIORESAL 10 mg INTRATHECAL (baclofen-injektion) i præ- og post-marketing undersøgelser evalueret i december 1992. Fordi disse patienter blev behandlet under ukontrollerede kliniske omgivelser, er det umuligt at afgøre definitivt, hvad rolle, hvis nogen, LIORESAL INTRATHECAL spillede i deres død.
Som gruppe var de patienter, der døde, relativt unge (gennemsnitsalderen var 47 med et interval fra 25 til 63), men størstedelen led af svær spasticitet af mange års varighed, var nonambulatoriske, havde forskellige medicinske komplikationer såsom lungebetændelse, urinveje infektioner og decubiti og/eller havde fået flere samtidig medicin. En gennemgang fra sag til sag af det kliniske forløb for de 16 patienter, der døde, afslørede ikke nogen unikke tegn, symptomer eller laboratorieresultater, der tyder på, at behandling med LIORESAL INTRATHECAL forårsagede deres død. To patienter led dog pludselig og uventet død inden for 2 uger efter pumpeimplantation, og en patient døde uventet efter screening.
En patient, en 44-årig mand med MS, døde på hospitalet den anden dag efter pumpeimplantation. En obduktion viste alvorlig fibrose af det koronare ledningssystem. En anden patient, en 52-årig kvinde med MS og en historie med et myokardieinfarkt i væggen, blev fundet død i sengen 12 dage efter pumpeimplantation, 2 timer efter at have haft dokumenterede normale vitale tegn. En obduktion afslørede pulmonal overbelastning og bilaterale pleurale effusioner. Det er umuligt at afgøre, om LIORESAL INTRATHECAL bidrog til disse dødsfald. Den tredje patient gennemgik tre baclofen-screeningsforsøg. Hans sygehistorie omfattede SCI, aspirationspneumoni, septisk shock, dissemineret intravaskulær koagulopati, svær metabolisk acidose, hepatisk toksicitet og status epilepticus. Tolv dage efter screening (han blev ikke implanteret) oplevede han igen status epilepticus med efterfølgende betydelig neurologisk forværring. Baseret på forudgående instruktion blev der ikke iværksat ekstraordinære genoplivningsforanstaltninger, og patienten døde.
Spasticitet af cerebral oprindelse
Der forekom tre dødsfald blandt de 211 patienter, der blev behandlet med LIORESAL INTRATHECAL i præ-marketingundersøgelser i marts 1996. Disse dødsfald blev ikke tilskrevet terapien.
Overinfusion
Indgivelse af mere lægemiddelvolumen end den programmerede hastighed (overinfusion) kan resultere i uventet overdosis eller tilbagetrækning forårsaget af tidlig tømning af pumpereservoiret. Se producentens pumpemanual og instruktioner til genopfyldning af reservoiret.
FORHOLDSREGLER
Børn skal have tilstrækkelig kropsmasse til at rumme den implanterbare pumpe til kronisk infusion. Se venligst pumpeproducentens manual for specifikke anbefalinger.
Sikkerhed og effektivitet hos pædiatriske patienter under 4 år er ikke blevet fastlagt.
Screening
Patienter bør være infektionsfrie før screeningsundersøgelsen med LIORESAL INTRATHECAL (baclofen-injektion), fordi tilstedeværelsen af en systemisk infektion kan interferere med en vurdering af patientens respons på bolus LIORESAL 10 mg INTRATHECAL.
Pumpeimplantation
Patienter bør være infektionsfri før pumpeimplantation, fordi tilstedeværelsen af infektion kan øge risikoen for kirurgiske komplikationer. Desuden kan en systemisk infektion komplicere doseringen.
Justering og titrering af pumpedosis
Hos de fleste patienter vil det være nødvendigt at øge dosis gradvist over tid for at opretholde effektiviteten; et pludseligt behov for væsentlig dosiseskalering indikerer typisk en kateterkomplikation (dvs. kateterknæk eller forskydning).
Beholdergenopfyldning skal udføres af fuldt uddannet og kvalificeret personale efter anvisningerne fra pumpeproducenten. Utilsigtet injektion i det subkutane væv kan forekomme, hvis reservoirgenopfyldningsseptumet ikke er korrekt tilgængeligt. Subkutan injektion kan resultere i symptomer på en systemisk overdosis eller tidlig udtømning af reservoiret. Genopfyldningsintervaller bør beregnes omhyggeligt for at forhindre udtømning af reservoiret, da dette ville resultere i tilbagevenden af alvorlig spasticitet og muligvis abstinenssymptomer.
Streng aseptisk teknik til påfyldning er påkrævet for at undgå bakteriel kontaminering og alvorlig infektion. En observationsperiode, der passer til den kliniske situation, bør følge hver genopfyldning eller manipulation af lægemiddelreservoiret.
Der skal udvises ekstrem forsigtighed ved fyldning af en FDA godkendt implanterbar pumpe udstyret med en injektionsport, der giver direkte adgang til det intrathekale kateter. Direkte injektion i kateteret gennem kateterets adgangsport kan forårsage en livstruende overdosis.
Yderligere overvejelser vedrørende dosisjustering
Det kan være vigtigt at titrere dosis for at opretholde en vis grad af muskeltonus og tillade lejlighedsvise spasmer at: 1) hjælpe med at understøtte kredsløbsfunktionen, 2) muligvis forhindre dannelsen af dyb venetrombose, 3) optimere dagligdagens aktiviteter og nem pleje .
Bortset fra i nødstilfælde i forbindelse med overdosis, bør dosis af LIORESAL 25 mg INTRATHECAL normalt reduceres langsomt, hvis lægemidlet af en eller anden grund seponeres.
Der bør gøres et forsøg på at seponere samtidig oral antispasticitetsmedicin for at undgå mulig overdosis eller uønskede lægemiddelinteraktioner, enten før screening eller efter implantation og påbegyndelse af kronisk LIORESAL INTRATHECAL infusion. Reduktion og seponering af orale antispasmotika bør ske langsomt og med omhyggelig overvågning af lægen. Pludselig reduktion eller seponering af samtidige antispastika bør undgås.
Døsighed
Døsighed er blevet rapporteret hos patienter på LIORESAL INTRATHECAL. Patienter bør advares med hensyn til betjening af biler eller andre farlige maskiner, og aktiviteter, der gøres farlige på grund af nedsat årvågenhed. Patienter skal også advares om, at de centralnervesystemsdempende virkninger af LIORESAL INTRATHECAL (baclofen-injektion) kan være additive til virkningerne af alkohol og andre CNS-depressiva.
Intrathekal messe
Tilfælde af intrathekal masse ved spidsen af det implanterede kateter er blevet rapporteret, de fleste af dem involverer apotekskomponerede analgetiske blandinger. De hyppigste symptomer forbundet med intrathecal masse er: 1) nedsat terapeutisk respons (forværret spasticitet, tilbagevenden af spasticitet, når den tidligere var velkontrolleret, abstinenssymptomer, dårlig respons på eskalerende doser eller hyppige eller store dosisstigninger), 2) smerte, 3) neurologisk underskud/dysfunktion. Klinikere bør overvåge patienter i intraspinal behandling omhyggeligt for nye neurologiske tegn eller symptomer. Overvej en neurokirurgisk konsultation hos patienter med nye neurologiske tegn eller symptomer, der tyder på en intratekal masse, da mange af symptomerne på inflammatorisk masse ikke er ulig de symptomer, som patienter med svær spasticitet oplever fra deres sygdom. I nogle tilfælde kan udførelse af en billeddiagnostisk procedure være passende for at bekræfte eller udelukke diagnosen af en intratekal masse.
Forholdsregler i særlige patientpopulationer
Omhyggelig dosistitrering af LIORESAL 10mg INTRATHECAL er nødvendig, når spasticitet er nødvendig for at opretholde oprejst kropsholdning og balance i bevægelse, eller når spasticitet bruges for at opnå optimal funktion og pleje.
Patienter, der lider af psykotiske lidelser, skizofreni eller konfusionstilstande, bør behandles forsigtigt med LIORESAL INTRATHECAL og holdes under nøje overvågning, da forværring af disse tilstande er blevet observeret ved oral administration.
LIORESAL INTRATHECAL bør anvendes med forsigtighed til patienter med en historie med autonom dysrefleksi. Tilstedeværelsen af nociceptive stimuli eller brat seponering af LIORESAL 10mg INTRATHECAL (baclofen-injektion) kan forårsage en autonom dysrefleksiv episode.
Da LIORESAL primært udskilles uændret via nyrerne, bør det gives med forsigtighed til patienter med nedsat nyrefunktion, og det kan være nødvendigt at reducere dosis.
Laboratorieprøver
Ingen specifikke laboratorietests anses for at være nødvendige for behandlingen af patienter på LIORESAL INTRATHECAL.
Karcinogenese, mutagenese og svækkelse af fertilitet
Ingen stigning i tumorer blev set hos rotter, der fik baclofen oralt i to år. Der er ikke udført tilstrækkelige genotoksicitetsanalyser af baclofen.
Graviditet
Der er ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder. I dyreforsøg havde baclofen negative virkninger på embryoføtal udvikling, når det blev administreret oralt til gravide rotter. LIORESAL 25mg INTRATHECAL bør kun anvendes under graviditet, hvis den potentielle fordel opvejer den potentielle risiko for fosteret.
Baclofen givet oralt øgede forekomsten af føtale strukturelle abnormiteter (omphaloceles) hos rotter. Reduktioner i fødeindtagelse og vægtøgning blev observeret i moderdyrene. Fetale strukturelle abnormiteter blev ikke observeret hos mus eller kaniner
Ammende mødre
Hos mødre behandlet med oral LIORESAL (baclofen USP) i terapeutiske doser, går det aktive stof over i mælken. Det vides ikke, om påviselige niveauer af lægemiddel er til stede i mælk fra ammende mødre, der får LIORESAL 25 mg INTRATHECAL. Som en generel regel bør sygepleje kun udføres, mens en patient får LIORESAL 25 mg INTRATHECAL, hvis den potentielle fordel retfærdiggør de potentielle risici for spædbarnet.
Pædiatrisk brug
Børn skal have tilstrækkelig kropsmasse til at rumme den implanterbare pumpe til kronisk infusion. Se venligst pumpeproducentens manual for specifikke anbefalinger.
Sikkerhed og effektivitet hos pædiatriske patienter under 4 år er ikke blevet fastlagt.
Overvejelser baseret på erfaring med oral LIORESAL (baclofen USP)
En dosisrelateret stigning i forekomsten af ovariecyster blev observeret hos hunrotter behandlet kronisk med oral LIORESAL. Ovariecyster er blevet fundet ved palpation hos omkring 4 % af de multipel sklerosepatienter, som blev behandlet med oral LIORESAL 25 mg i op til et år. I de fleste tilfælde forsvandt disse cyster spontant, mens patienterne fortsatte med at modtage lægemidlet. Ovariecyster anslås at forekomme spontant hos ca. 1 % til 5 % af den normale kvindelige befolkning.
OVERDOSIS
Der skal lægges særlig vægt på at genkende tegn og symptomer på overdosering, især under den indledende screenings- og dosistitreringsfase af behandlingen, men også under genintroduktion af LIORESAL INTRATHECAL efter en periode med afbrydelse af behandlingen.
Symptomer på LIORESAL INTRATHEKAL overdosis
Døsighed, svimmelhed, svimmelhed, somnolens, respirationsdepression, hypotermi, kramper, rostral progression af hypotoni og bevidsthedstab, der udvikler sig til koma på op til 72 timer. varighed. I de fleste rapporterede tilfælde var koma reversibel uden følgesygdomme, efter at lægemidlet var seponeret. Symptomer på LIORESAL 25 mg INTRATHECAL overdosis blev rapporteret hos en følsom voksen patient efter at have modtaget en 25 mcg intrathekal bolus.
Behandlingsforslag til overdosering
Der er ingen specifik modgift til behandling af overdoser af LIORESAL INTRATHECAL (baclofen-injektion); dog skal følgende trin normalt udføres:
Hvis lumbalpunktur ikke er kontraindiceret, bør det overvejes at udtage 30-40 ml CSF for at reducere CSF-baclofenkoncentrationen.
KONTRAINDIKATIONER
Overfølsomhed over for baclofen. LIORESAL INTRATHECAL anbefales ikke til intravenøs, intramuskulær, subkutan eller epidural administration.
KLINISK FARMAKOLOGI
Den præcise virkningsmekanisme af baclofen som et muskelafslappende middel og antispasticitetsmiddel er ikke fuldt ud forstået. Baclofen hæmmer både monosynaptiske og polysynaptiske reflekser på spinal niveau, muligvis ved at reducere excitatorisk neurotransmitterfrigivelse fra primære afferente terminaler, selvom virkninger på supraspinale steder også kan forekomme og bidrage til dets kliniske effekt. Baclofen er en strukturel analog af den hæmmende neurotransmitter gamma-aminosmørsyre (GABA) og kan udøve sine virkninger ved stimulering af GABAB-receptorundertypen.
LIORESAL INTRATHECAL, når det introduceres direkte i det intrathecale rum, muliggør opnåelse af effektive CSF-koncentrationer med resulterende plasmakoncentrationer 100 gange mindre end dem, der forekommer ved oral administration.
Hos mennesker såvel som hos dyr har baclofen vist sig at have generelle CNS-depressive egenskaber som indikeret ved produktion af sedation med tolerance, somnolens, ataksi og respiratorisk og kardiovaskulær depression.
Farmakodynamik af LIORESAL INTRATHEKAL
Intratekal bolus
Voksne patienter
Virkningen begynder normalt en halv time til en time efter en intratekal bolus. Den maksimale spasmolytiske effekt ses cirka fire timer efter dosering, og virkningerne kan vare fire til otte timer. Debut, maksimal respons og virkningsvarighed kan variere med individuelle patienter afhængigt af dosis og symptomernes sværhedsgrad.
Pædiatriske patienter
Begyndelsen, maksimal respons og virkningsvarighed svarer til dem, der ses hos voksne patienter.
Kontinuerlig infusion
LIORESAL 25mg INTRATHECALs antispastiske virkning ses først 6 til 8 timer efter påbegyndelse af kontinuerlig infusion. Maksimal aktivitet observeres i 24 til 48 timer.
Kontinuerlig infusion
Der er ingen yderligere information tilgængelig for pædiatriske patienter.
Farmakokinetik af LIORESAL 25mg INTRATHECAL
Farmakokinetikken for CSF-clearance af LIORESAL 25 mg INTRATHECAL beregnet ud fra intrathekale bolus- eller kontinuerlige infusionsundersøgelser tilnærmer CSF-omsætningen, hvilket tyder på, at elimination sker ved bulk-flow-fjernelse af CSF.
Intratekal bolus
Efter en lumbal bolusinjektion på 50 eller 100 mcg LIORESAL 10 mg INTRATHECAL hos syv patienter var den gennemsnitlige CSF-elimineringshalveringstid 1,51 timer i løbet af de første fire timer, og den gennemsnitlige CSF-clearance var ca. 30 ml/time.
Kontinuerlig infusion
Den gennemsnitlige CSF-clearance for LIORESAL 10 mg INTRATHECAL (baclofen-injektion) var ca. 30 ml/time i en undersøgelse, der involverede ti patienter i kontinuerlig intrathekal infusion. Samtidige plasmakoncentrationer af baclofen under intratekal administration forventes at være lave (0-5 ng/ml).
Begrænsede farmakokinetiske data tyder på, at en lumbal-cisternal koncentrationsgradient på ca. 4:1 etableres langs neuroaksen under infusion af baclofen. Dette er baseret på samtidig CSF-prøvetagning via cisternal og lumbal tap hos 5 patienter, der modtager kontinuerlig baclofen-infusion på lændeniveau ved doser forbundet med terapeutisk effekt; variabiliteten mellem patienter var stor. Gradienten blev ikke ændret af position.
Seks pædiatriske patienter (alder 8-18 år), der fik kontinuerlig intrathekal baclofeninfusion i doser på 77-400 mcg/dag, havde plasmabaclofenniveauer nær eller under 10 ng/ml.
PATIENTOPLYSNINGER
PrLIORESAL Intrathecal (baclofen) Injektion 0,05 mg/ml, 0,5 mg/ml og 2 mg/ml
Kun til intratekal injektion og infusion
Denne folder er del III af en tredelt "Produktmonografi", der blev offentliggjort, da LIORESAL IT blev godkendt til salg i Canada og er designet specifikt til forbrugere. Denne folder er et resumé og fortæller dig ikke alt om LIORESAL 10mg IT. Kontakt din læge eller apotek, hvis du har spørgsmål om lægemidlet.
OM DENNE MEDICIN
Hvad medicinen bruges til:
LIORESAL 25mg Intrathecal tilhører en gruppe lægemidler, der kaldes muskelafslappende midler. Det bruges til at reducere og lindre overdreven stivhed og/eller spasmer, der opstår ved forskellige sygdomme, såsom for eksempel multipel sklerose, sygdomme eller skader i rygmarven og visse hjernesygdomme.
Hvad det gør:
Opløsningen injiceres eller infunderes i væskerummet omkring rygmarven ved hjælp af en speciel pumpe, som implanteres under huden på din mave. Fra pumpen tilføres en konstant mængde af opløsningen til væskerummet omkring rygmarven gennem et lille rør.
På grund af den gavnlige effekt på muskelsammentrækninger og den deraf følgende lindring af smerte, forbedrer LIORESAL Intrathecal din mobilitet og din evne til at klare dine daglige aktiviteter uden hjælp. LIORESAL 25mg hjælper dig også med at få mere ud af fysioterapi.
Når det ikke skal bruges:
Du bør ikke behandles med LIORESALIT, hvis du:
- er allergisk (overfølsom) over for LIORESAL 25mg Intrathecal eller et af de øvrige indholdsstoffer i LIORESAL 10mg Intrathecal, som er anført nedenfor.
Hvad er den medicinske ingrediens:
baclofen.
Hvad er de ikke-medicinske ingredienser:
LIORESAL 25mg IT indeholder: natriumklorid og vand til injektion
Hvilke doseringsformer kommer det i:
LIORESAL 25mg Intrathecal (baclofen-injektion) 0,05 mg/ml: Hver 1 ml ampul indeholder 0,05 mg baclofen til intrathekal administration.
LIORESAL Intrathecal (baclofen injektion) 0,5 mg/ml: Hver 20 ml ampul indeholder 10 mg baclofen til intrathekal administration.
LIORESAL 25 mg intrathecal (baclofen injektion) 2 mg/ml: Hver 5 ml ampul indeholder 10 mg baclofen til intratekal administration.
ADVARSLER OG FORHOLDSREGLER
LIORESAL 10mg Intrathecal er velegnet til mange, men ikke alle, patienter med muskelspasmer.
FØR du bruger LIORESAL 25mgIT, tal med din læge eller apotek, hvis du:
- har nogen form for infektion
- har Parkinsons sygdom eller visse psykiske sygdomme ledsaget af forvirring
- har epilepsi (anfald)
- har diabetes
- nogensinde har haft hjerteproblemer
- nogensinde har haft nyreproblemer
- har vejrtrækningsproblemer
- har akutte smerter i maven eller tarmen
- har forstyrret blodcirkulationen i din hjerne
- nogensinde har oplevet pludselige episoder med forhøjet blodtryk, angst, overdreven svedtendens, "gåsekød", bankende hovedpine og usædvanlig langsom hjerterytme på grund af en overreaktion af dit nervesystem på stimuli såsom udspilning af blære og tarm, hudirritation og smerte
Hvis nogen af disse gælder for dig, vil din læge muligvis ikke give dig denne medicin eller tage særlige forholdsregler. Hvis du ikke har fortalt din læge om nogen af disse ting, skal du fortælle ham/hende det, før du starter LIORESAL 25 mg intratekal behandling.
Hvis du tror, du kan være allergisk, så spørg din læge til råds.
Kørsel og brug af maskiner: LIORESAL Intrathecal kan få dig til at føle dig søvnig eller svimmel. Vær forsigtig, når du kører bil eller bruger en maskine eller gør ting, der kræver omhyggelig opmærksomhed, indtil du føler dig normal igen.
INTERAKTIONER MED DENNE MEDICIN
Fortæl det til lægen eller apoteket, hvis du tager eller for nylig har taget anden medicin, herunder naturlægemidler og ikke-receptpligtig medicin (i håndkøb). Nogle andre lægemidler kan interagere med LIORESAL 10mgIT. Din læge kan ændre doseringen eller nogle gange stoppe en af lægemidlerne. Dette er især vigtigt for følgende lægemidler:
- anden medicin mod din spastiske tilstand
- medicin mod Parkinsons sygdom
- medicin mod epilepsi
- medicin, der bruges til at behandle humørsygdomme såsom antidepressiva og lithium
- medicin mod forhøjet blodtryk
- andre lægemidler, som påvirker nyrerne, fx ibuprofen
- opiater til smertelindring
- medicin, der bruges til at hjælpe dig med at sove eller berolige dig
- medicin, der bremser centralnervesystemet, fx antihistaminer og beroligende midler (nogle af disse kan købes i håndkøb)
Fortæl altid din læge eller sygeplejerske om al den medicin, du tager. Det vil sige medicin, du selv har købt, samt medicin på recept fra din læge.
Vær forsigtig, hvis du drikker alkoholiske drikke under behandling med LIORESAL 25mg Intrathecal, da du kan føle dig mere søvnig eller svimmel end normalt.
KORREKT BRUG AF DENNE MEDICIN
Sædvanlig dosis
LIORESAL Intrathecal kan kun gives af erfarne læger, der bruger specielt medicinsk udstyr. Du bliver nødt til at blive på hospitalet, i det mindste i begyndelsen af behandlingen.
Din læge vil injicere en lille mængde LIORESAL Intrathecal i din rygmarv for at se, om det forbedrer dine muskelspasmer. Hvis det gør det, vil en speciel pumpe blive implanteret under din hud. Pumpen vil give dig en lille mængde medicin hele tiden.
Det kan tage flere dage at finde ud af den mængde medicin, der passer dig bedst, din læge vil holde nøje øje med dig i denne tid.
Derefter vil din læge stadig gerne se dig regelmæssigt for at kontrollere dine fremskridt og sikre, at din pumpe fungerer godt.
DET ER AF VIGTIGSTE VIGTIGHED, AT AFTALER TIL AT FYLDELSE AF PUMPE OVERHOLDES, ELLER KAN SPASMER GENTAGES, FORDI DU IKKE FÅR EN HØJ NOG DOSIS AF LIORESAL INTRATHEKAL. MUSKELSPASTICITET MÅSKE IKKE FORBEDRES ELLER FORVÆRRE SOM RESULTAT.
Hvis muskelspasticiteten ikke forbedres, eller hvis du begynder at få spasmer igen, enten gradvist eller pludseligt, skal du straks kontakte din læge.
Se venligst pumpeproducentens litteratur for information om korrekt hjemmepleje af pumpen og indføringsstedet.
Monitorering under behandling med LIORESAL 10mg Intrathecal
Du vil blive overvåget tæt i et fuldt udstyret og bemandet miljø under screeningsfasen og dosistitreringsperioden umiddelbart efter pumpeimplantation. Du vil regelmæssigt blive vurderet for dine dosiskrav, for mulige bivirkninger eller tegn på infektion. Leveringssystemets funktion vil også blive kontrolleret.
Graviditet og amning
Du bør fortælle det til din læge, hvis du er gravid eller planlægger at blive gravid, da LIORESAL 25mg Intrathecal ikke bør bruges under graviditet, eller hvis du ammer. Spørg din læge eller apoteket til råds, før du tager nogen form for medicin.
Din læge vil diskutere med dig den potentielle risiko ved at tage LIORESAL 25mg Intrathecal under graviditet.
Lægen vil afgøre, om du må få LIORESAL 10mg Intrathecal i disse særlige situationer. Kun meget små mængder LIORESAL 10mg passerer over i modermælken. Spørg din læge, hvis du ønsker at amme.
Overdosis
I tilfælde af overdosering skal du straks kontakte en læge, hospitalets skadestue eller regionalt giftkontrolcenter, selvom der ikke er symptomer.
Tegn på overdosering kan opstå pludseligt eller snigende, f.eks. ved en fejlfunktion af pumpen. Det er meget vigtigt, at du og dem, der plejer dig, genkender tegn på overdosering. Hvis du oplever et eller flere af følgende symptomer, skal du straks fortælle det til din læge, da mængden af medicin, du får, kan være for høj:
- usædvanlig muskelsvaghed (for lidt muskeltonus)
- søvnighed
- svimmelhed eller svimmelhed
- overdreven salivation
- kvalme eller opkastning
- åndedrætsbesvær, anfald eller bevidsthedstab
- unormal lav kropstemperatur
Glemt dosis
Brat ophør af LIORESAL 10mg Intrathecal kan resultere i alvorlige medicinske problemer og har i sjældne tilfælde været dødelig.
Tegn på, at din pumpe ikke fungerer korrekt, eller at den ikke afgiver den rigtige mængde medicin omfatter en stigning eller tilbagevenden af spasticitet, kløe, lavt blodtryk, svimmelhed, prikkende fornemmelse, høj feber, ændret mental status og muskelstivhed eller ny muskelsvaghed eller lammelse. Det er vigtigt at fortælle det til din læge med det samme, hvis du oplever nogen af ovenstående symptomer.
BIVIRKNINGER OG HVAD MAN GØR VED DEM
Som med al anden medicin kan patienter, der behandles med LIORESAL 25mg Intrathecal, opleve nogle bivirkninger, selvom ikke alle får dem. Disse forekommer oftere i starten af behandlingen under dit hospitalsophold, men de kan også forekomme senere og bør tjekkes med din læge.
Meget normal: Døsighed, muskelsvaghed
Almindelige: Følelse af angst, sedation og træthed (udmattelse), svaghed i benene, stivhed i musklerne, svimmelhed/ørhed i hovedet, hovedpine, søvnighed, kvalme og/eller opkastning, snurren i hænder og fødder, søvnløshed, sløret tale, lungebetændelse , svaghed, kulderystelser, træthed, smerte, mundtørhed, hududslæt og/eller kløe, hævelse af ankler, fødder eller underben, hævet ansigt, usædvanlig nervøsitet eller rastløshed, forvirring/desorientering, forstoppelse, diarré, nedsat appetit, overdreven savlen, feber/gysten, vandladningsproblemer, seksuelle vanskeligheder.
Ualmindelig: Humør eller mentale ændringer, paranoia, følelse af ekstrem lykke (eufori), tab af muskelkoordination (ataksi), unormalt lav kropstemperatur, hukommelsestab, vedvarende ukontrollerbare øjenbevægelser, nedsat smagssans, synkebesvær, mavesmerter, hårtab, overdreven svedtendens.
Sjælden: Rastløshed, unormalt langsom vejrtrækningshastighed.
Fortæl det til din læge, hvis du bemærker anden effekt. Nogle bivirkninger kan være forbundet med leveringssystemet.
ALVORLIGE BIVIRKNINGER, HVOR OFTE SKÆR DE, OG HVAD SKAL MAN GØRE VED DEM
Dette er ikke en komplet liste over bivirkninger. Kontakt din læge eller apotek for uventede bivirkninger, mens du tager LIORESAL IT.
SÅDAN OPBEVARER DU DET
Opbevar LIORESAL 10mg IT ampuller mellem 15-30°C (beskyt mod varme). Må ikke fryses. Må ikke varmesteriliseres.
Opbevar al medicin utilgængeligt for børn.
Denne medicin er ordineret til dit specifikke medicinske problem og kun til eget brug. Giv ikke til andre mennesker.
Brug ikke forældet medicin. Kassér dem sikkert uden for børns rækkevidde, eller tag dem til din apotek, som vil bortskaffe dem for dig.
RAPPORTERING AF FORSIGTIGE BIVIRKNINGER
Du kan rapportere alle formodede bivirkninger forbundet med brugen af sundhedsprodukter til Canada Vigilance Program på en af følgende 3 måder:
- Rapporter online på www.healthcanada.gc.ca/medeffect
- Ring gratis på 1-866-234-2345
- Udfyld en Canada Vigilance-rapporteringsformular og:
- Fax gratis til 1-866-678-6789, eller
- Mail til: Canada Vigilance Program, Health Canada, Postal Locator 0701E, Ottawa, Ontario, K1A 0K9
Portobetalte etiketter, Canada Vigilance Reporting Form og retningslinjerne for rapportering af bivirkninger er tilgængelige på MedEffect™ Canadas websted på www.healthcanada.gc.ca/medeffect.
BEMÆRK: Hvis du har brug for information relateret til behandling af bivirkninger, skal du kontakte din sundhedspersonale. Canada Vigilance Program yder ikke medicinsk rådgivning.
MERE INFORMATION
Dette dokument plus den fulde produktmonografi, udarbejdet til sundhedspersonale, kan findes på: http://www.novartis.ca eller ved at kontakte sponsoren, Novartis Pharmaceuticals Canada Inc., på: 1-800-363-8883
