Provera 5mg, 10mg Medroxyprogesterone Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Provera, og hvordan bruges det?
Provera 10mg er en receptpligtig medicin, der bruges til at behandle symptomerne kraftig menstruationsblødning, manglende eller uregelmæssig menstruationsblødning og som prævention. Provera 10mg kan bruges alene eller sammen med anden medicin.
Provera 5mg tilhører en klasse af lægemidler kaldet Antineoplastik, Hormoner, Progestiner.
Det vides ikke, om Provera er sikkert og effektivt til børn.
Hvad er de mulige bivirkninger af Provera 10mg?
Provera 5mg kan forårsage alvorlige bivirkninger, herunder:
- vaginal blødning (hvis du allerede har været i overgangsalderen),
- svimmelhed,
- brystklump,
- depression,
- søvnproblemer (søvnløshed),
- svimmelhed,
- humørsvingninger,
- hovedpine,
- feber,
- gulfarvning af huden eller øjnene (gulsot),
- hævelse i dine hænder, ankler eller fødder,
- brystsmerter eller tryk,
- smerte breder sig til din kæbe eller skulder,
- kvalme,
- svedeture,
- pludselig følelsesløshed eller svaghed,
- pludselig kraftig hovedpine,
- utydelig tale,
- synsproblemer,
- problemer med din balance,
- pludselig hoste,
- hvæsen,
- hurtig vejrtrækning,
- hoste blod op, og
- smerter i benet (eller begge dele) med hævelse, varme og rødme
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Provera 10mg omfatter:
- pletblødning eller gennembrudsblødning,
- ændringer i dine menstruationer,
- vaginal kløe eller udflåd,
- ømhed eller udflåd i brysterne,
- hovedpine,
- svimmelhed,
- føler sig nervøs eller deprimeret,
- blå mærker eller hævelse af dine vener,
- oppustethed,
- væskeophobning,
- humørsvingninger,
- søvnproblemer (søvnløshed),
- kløe,
- udslæt,
- acne,
- hårvækst,
- tab af hovedhår,
- ubehag i maven,
- oppustethed,
- kvalme,
- vægtøgning, og
- synsforandringer eller besvær med at bruge kontaktlinser
ADVARSEL
Hjerte- og karlidelser, BRYSTCANCER OG MULIG DEMENS TIL ØTROGEN PLUS PROGESTINTERAPI
Kardiovaskulære lidelser og sandsynlig demens
Behandling med østrogen plus gestagen bør ikke anvendes til forebyggelse af hjerte-kar-sygdomme eller demens. (Se Kliniske Studier og ADVARSLER , Kardiovaskulære lidelser og sandsynlig demens .)
Women's Health Initiative (WHI) østrogen plus gestagen underundersøgelse rapporterede en øget risiko for dyb venetrombose (DVT), lungeemboli (PE), slagtilfælde og myokardieinfarkt (MI) hos postmenopausale kvinder (50 til 79 år) ) i løbet af 5,6 års behandling med daglige orale konjugerede østrogener (CE) [0,625 mg] kombineret med medroxyprogesteronacetat (MPA) [2,5 mg] i forhold til placebo. (Se Kliniske Studier og ADVARSLER , Kardiovaskulære lidelser .)
WHI Memory Study (WHIMS) østrogen plus gestagen supplerende undersøgelse rapporterede en øget risiko for at udvikle sandsynlig demens hos postmenopausale kvinder 65 år eller ældre i løbet af 4 års behandling med daglig CE (0,625 mg) kombineret med MPA (2,5 mg), relativt til placebo. Det vides ikke, om dette fund gælder for yngre postmenopausale kvinder. (Se Kliniske Studier og ADVARSLER , Sandsynlig demens og FORHOLDSREGLER , Geriatrisk brug .)
Brystkræft
WHI østrogen plus progestin underundersøgelsen viste en øget risiko for invasiv brystkræft. (Se Kliniske Studier og ADVARSLER , Ondartet neoplasma , Brystkræft .)
I mangel af sammenlignelige data bør disse risici antages at være ens for andre doser af CE og MPA og andre kombinationer og doseringsformer af østrogener og progestiner.
Progestiner med østrogener bør ordineres i de laveste effektive doser og i den korteste varighed i overensstemmelse med behandlingsmål og risici for den enkelte kvinde.
BESKRIVELSE
PROVERA® tabletter indeholder medroxyprogesteronacetat, som er et derivat af progesteron. Det er et hvidt til råhvidt, lugtfrit krystallinsk pulver, stabilt i luft, smelter mellem 200 og 210°C. Det er frit opløseligt i chloroform, opløseligt i acetone og i dioxan, tungtopløseligt i alkohol og i methanol, let opløseligt i ether og uopløseligt i vand.
Det kemiske navn for medroxyprogesteronacetat er pregn-4-en-3, 20-dion, 17-(acetyloxy)-6-methyl-, (6α)-. Strukturformlen er:
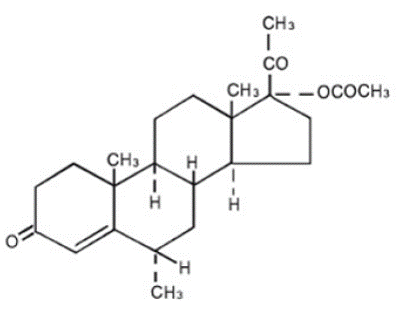
Hver PROVERA 5 mg tablet til oral administration indeholder 2,5 mg, 5 mg eller 10 mg medroxyprogesteronacetat og følgende inaktive ingredienser: calciumstearat, majsstivelse, laktose, mineralolie, sorbinsyre, saccharose og talkum. 2,5 mg tabletten indeholder FD&C Yellow No. 6.
INDIKATIONER
PROVERA 5 mg tabletter er indiceret til behandling af sekundær amenoré og unormal uterinblødning på grund af hormonel ubalance i fravær af organisk patologi, såsom fibromer eller livmoderkræft. De er også indiceret til anvendelse til forebyggelse af endometriehyperplasi hos ikke-hysterektomiserede postmenopausale kvinder, som dagligt får orale konjugerede østrogener 0,625 mg tabletter.
DOSERING OG ADMINISTRATION
Sekundær amenoré
PROVERA 10 mg tabletter kan gives i doser på 5 eller 10 mg dagligt i 5 til 10 dage. En dosis til at inducere en optimal sekretorisk transformation af et endometrium, der er blevet tilstrækkeligt primet med enten endogent eller eksogent østrogen, er 10 mg PROVERA 10 mg dagligt i 10 dage. I tilfælde af sekundær amenoré kan behandlingen påbegyndes når som helst. Blødning med progestinabstinenser opstår normalt inden for tre til syv dage efter seponering af PROVERA 10 mg-behandling.
Unormal livmoderblødning på grund af hormonel ubalance i fravær af organisk patologi
Fra den beregnede 16. eller 21. dag i menstruationscyklussen kan der gives 5 eller 10 mg PROVERA 10 mg dagligt i 5 til 10 dage. For at producere en optimal sekretorisk transformation af et endometrium, der er blevet tilstrækkeligt primet med enten endogent eller eksogent østrogen, foreslås 10 mg PROVERA 10 mg dagligt i 10 dage begyndende på den 16. dag i cyklussen. Blødning med progestinabstinenser opstår sædvanligvis inden for tre til syv dage efter seponering af behandling med PROVERA. Patienter med en tidligere historie med tilbagevendende episoder med unormal uterinblødning kan have gavn af planlagt menstruationscyklus med PROVERA.
Reduktion af endometriehyperplasi hos postmenopausale kvinder, der dagligt modtager 0,625 mg konjugerede østrogener
Når østrogen ordineres til en postmenopausal kvinde med livmoder, bør der også påbegyndes et gestagen for at reducere risikoen for endometriecancer. En kvinde uden livmoder har ikke brug for gestagen. Anvendelse af østrogen, alene eller i kombination med et gestagen, bør være med den laveste effektive dosis og i den korteste varighed i overensstemmelse med behandlingens mål og risici for den enkelte kvinde. Patienterne bør revurderes med jævne mellemrum, alt efter hvad der er klinisk passende (f.eks. 3 til 6 måneders intervaller) for at afgøre, om behandling stadig er nødvendig (se ADVARSLER ). For kvinder, der har en livmoder, bør passende diagnostiske foranstaltninger, såsom endometrieprøvetagning, når det er indiceret, udføres for at udelukke malignitet i tilfælde af udiagnosticeret vedvarende eller tilbagevendende unormal vaginal blødning.
PROVERA-tabletter kan gives i doser på 5 eller 10 mg dagligt i 12 til 14 på hinanden følgende dage pr. måned, til postmenopausale kvinder, der dagligt får 0,625 mg konjugerede østrogener, enten begyndende på den 1. dag i cyklussen eller den 16. dag i cyklussen.
Patienter bør startes med den laveste dosis.
Den laveste effektive dosis af PROVERA er ikke blevet bestemt.
HVORDAN LEVERET
PROVERA 10mg tabletter fås i følgende styrker og pakkestørrelser:
2,5 mg (scoret, rund, orange)
30 flasker NDC 0009-0064-06 Flasker med 100 stk NDC 0009-0064-04
5 mg (scoret, sekskantet, hvid)
100 flasker NDC 0009-0286-03
10 mg (scoret, rund, hvid)
100 flasker NDC 0009-0050-02 Flasker med 500 stk NDC 0009-0050-11
Opbevares ved kontrolleret stuetemperatur 20° til 25°C (68° til 77°F) [se USP ].
"Holde utilgængeligt for børn"
Distribueret af: Pharmacia & Upjohn Company, Division of Pfizer Inc., NY, NY 10017. Revideret: Aug 2015
BIVIRKNINGER
Se ADVARSLER I BOKS , ADVARSLER , og FORHOLDSREGLER .
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Følgende bivirkninger er blevet rapporteret hos kvinder, der tager PROVERA 10 mg tabletter uden samtidig østrogenbehandling:
Genitourinært system
Unormal uterinblødning (uregelmæssig, stigning, fald), ændring i menstruationsflow, gennembrudsblødning, pletblødning, amenoré, ændringer i cervikal erosion og cervikal sekret.
Bryster
Brystømhed, mastodyni eller galaktoré er blevet rapporteret.
Kardiovaskulær
Tromboemboliske lidelser inklusive tromboflebitis og lungeemboli er blevet rapporteret.
Gastrointestinale
Kvalme, kolestatisk gulsot.
Hud
Følsomhedsreaktioner bestående af nældefeber, pruritus, ødem og generaliseret udslæt er forekommet. Acne, følsomhedsreaktioner bestående af nældefeber, pruritus, ødem og generaliseret udslæt er forekommet. Acne, alopeci og hirsutisme er blevet rapporteret.
Øjne
Neuro-okulære læsioner, for eksempel retinal trombose og optisk neuritis.
Centralnervesystemet
Psykisk depression, søvnløshed, somnolens, svimmelhed, hovedpine, nervøsitet.
Diverse
Overfølsomhedsreaktioner (f.eks. anafylaksi og anafylaktoide reaktioner, angioødem), udslæt (allergisk) med og uden kløe, ændring i vægt (stigning eller fald), pyreksi, ødem/væskeretention, træthed, nedsat glukosetolerance.
Følgende bivirkninger er blevet rapporteret ved behandling med østrogen plus gestagen.
Genitourinært system
Unormal uterin blødning/pletter eller flow; gennembrudsblødning; spotte; dysmenoré/bækkensmerter; stigning i størrelsen af uterin leiomyomata; vaginitis, herunder vaginal candidiasis; ændring i mængden af cervikal sekretion; ændringer i cervikal ektropion; livmoderhalskræft; endometriehyperplasi; endometriecancer.
Bryster
Ømhed, forstørrelse, smerte, udflåd fra brystvorten, galaktoré; fibrocystiske brystforandringer; brystkræft.
Kardiovaskulær
Dyb og overfladisk venøs trombose; lungeemboli; tromboflebitis; myokardieinfarkt; slag; stigning i blodtrykket.
Gastrointestinale
Kvalme, opkastning; mavekramper, oppustethed; kolestatisk gulsot; øget forekomst af galdeblæresygdom; pancreatitis; forstørrelse af hepatiske hæmangiomer.
Hud
Chloasma eller melasma, der kan vare ved, når lægemidlet seponeres; erythema multiforme; erythema nodosum; hæmoragisk udbrud; tab af hovedhår; hirsutisme; kløe, udslæt.
Øjne
Retinal vaskulær trombose, intolerance over for kontaktlinser.
Centralnervesystemet
Hovedpine; migræne; svimmelhed; mental depression; chorea; nervøsitet; humørforstyrrelser; irritabilitet; forværring af epilepsi, demens.
Diverse
Forøgelse eller fald i vægt; reduceret kulhydrattolerance; forværring af porfyri; ødem; arthalgier; kramper i benene; ændringer i libido; nældefeber, angioødem, anafylaktiske/anafylaktiske reaktioner; hypocalcæmi; forværring af astma; øgede triglycerider.
DRUGSINTERAKTIONER
Interaktioner med lægemiddel-laboratorietest
Følgende laboratorieresultater kan ændres ved brug af østrogen plus gestagenbehandling:
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
Se ADVARSLER I BOKS .
Kardiovaskulære lidelser
En øget risiko for PE, DVT, slagtilfælde og MI er blevet rapporteret ved behandling med østrogen plus gestagen. Hvis nogen af disse hændelser opstår eller er mistanke om, bør østrogen plus gestagenbehandling seponeres øjeblikkeligt.
Risikofaktorer for arteriel vaskulær sygdom (f.eks. hypertension, diabetes mellitus, tobaksbrug, hyperkolesterolæmi og fedme) og/eller venøs tromboemboli (VTE) (f.eks. personlig historie eller familiehistorie med VTE, fedme og systemisk lupus erythematosus) skal forvaltes korrekt.
Slag
WHI østrogen plus progestin-substudiet blev der rapporteret en statistisk signifikant øget risiko for slagtilfælde hos kvinder i alderen 50 til 79 år, der fik CE (0,625 mg) plus MPA (2,5 mg) sammenlignet med kvinder i samme aldersgruppe, der fik placebo (33 versus 25 pr. 10.000 kvindeår). (Se Kliniske Studier .) Risikostigningen blev påvist efter det første år og varede ved. Hvis der opstår et slagtilfælde eller er mistanke om, bør østrogen plus gestagenbehandling seponeres øjeblikkeligt.
Koronar hjertesygdom
I WHI østrogen plus progestin-substudiet var der en statistisk ikke-signifikant øget risiko for CHD-hændelser rapporteret hos kvinder, der fik daglig CE (0,625 mg) plus MPA (2,5 mg) sammenlignet med kvinder, der fik placebo (41 versus 34 pr. 10.000 kvindeår) ). En stigning i relativ risiko blev påvist i år 1, og en tendens til faldende relativ risiko blev rapporteret i år 2 til 5.
Hos postmenopausale kvinder med dokumenteret hjertesygdom (n = 2.763, gennemsnitlig 66,7 år), i et kontrolleret klinisk forsøg med sekundær forebyggelse af kardiovaskulær sygdom (hjerte- og østrogen/progestinerstatningsundersøgelse [HERS]), behandling med daglig CE (0,625 mg) ) plus MPA (2,5 mg) viste ingen kardiovaskulær fordel. I løbet af en gennemsnitlig opfølgning på 4,1 år reducerede behandling med CE plus MPA ikke den samlede frekvens af CHD-hændelser hos postmenopausale kvinder med etableret koronar hjertesygdom. Der var flere CHD-hændelser i den CE plus MPA-behandlede gruppe end i placebogruppen i år 1, men ikke i de efterfølgende år. To tusinde tre hundrede og enogtyve (2.321) kvinder fra det oprindelige HERS-forsøg indvilligede i at deltage i en åben udvidelse af HERS, HERS II. Den gennemsnitlige opfølgning i HERS II var yderligere 2,7 år, i alt 6,8 år samlet. Hyppigheden af CHD-hændelser var sammenlignelige blandt kvinder i CE plus MPA-gruppen og placebogruppen i HERS, HERS II og generelt.
Venøs tromboembolisme
WHI østrogen plus progestin-substudiet blev der rapporteret en statistisk signifikant 2 gange større frekvens af VTE (DVT og PE) hos kvinder, der fik daglig CE (0,625 mg) plus MPA (2,5 mg) sammenlignet med kvinder, der fik placebo (35 versus 17 pr. 10.000 kvindeår). Statistisk signifikante stigninger i risikoen for både DVT (26 versus 13 pr. 10.000 kvindeår) og PE (18 versus 8 pr. 10.000 kvindeår) blev også påvist. Stigningen i VTE-risiko blev påvist i løbet af det første år og fortsatte. (Se Kliniske Studier .) Hvis der opstår en VTE eller er mistanke om, bør østrogen plus gestagenbehandling seponeres øjeblikkeligt.
Hvis det er muligt, bør østrogener plus progestiner seponeres mindst 4 til 6 uger før operation af den type, der er forbundet med en øget risiko for tromboemboli, eller i perioder med længerevarende immobilisering.
Maligne neoplasmer
Brystkræft
Det vigtigste randomiserede kliniske forsøg, der giver information om brystkræft hos østrogen plus gestagenbrugere, er WHI-underundersøgelsen af daglig CE (0,625 mg) plus MPA (2,5 mg). Efter en gennemsnitlig opfølgning på 5,6 år rapporterede østrogen plus progestin-subundersøgelsen en øget risiko for invasiv brystkræft hos kvinder, der tog dagligt CE plus MPA.
denne delundersøgelse blev tidligere brug af østrogen-alene eller østrogen plus progestin-terapi rapporteret af 26 procent af kvinderne. Den relative risiko for invasiv brystkræft var 1,24, og den absolutte risiko var 41 versus 33 tilfælde pr. 10.000 kvindeår for CE plus MPA sammenlignet med placebo. Blandt kvinder, der rapporterede tidligere brug af hormonbehandling, var den relative risiko for invasiv brystkræft 1,86, og den absolutte risiko var 46 versus 25 tilfælde pr. 10.000 kvindeår for CE plus MPA sammenlignet med placebo. Blandt kvinder, der ikke rapporterede nogen tidligere brug af hormonbehandling, var den relative risiko for invasiv brystkræft 1,09, og den absolutte risiko var 40 versus 36 tilfælde pr. 10.000 kvindeår for CE plus MPA sammenlignet med placebo. I det samme delstudie var invasive brystkræftformer større, var mere tilbøjelige til at være nodepositive og blev diagnosticeret på et mere fremskredent stadium i CE (0,625 mg) plus MPA (2,5 mg) gruppen sammenlignet med placebogruppen. Metastatisk sygdom var sjælden uden nogen åbenbar forskel mellem de to grupper. Andre prognostiske faktorer såsom histologisk undertype, grad og hormonreceptorstatus var ikke forskellige mellem grupperne. (Se Kliniske Studier .)
overensstemmelse med WHI kliniske forsøg har observationsstudier også rapporteret en øget risiko for brystkræft for østrogen plus gestagenbehandling og en mindre risiko for østrogen-alene behandling efter flere års brug. Risikoen steg med varigheden af brugen og så ud til at vende tilbage til baseline i løbet af ca. 5 år efter behandlingens ophør (kun observationsstudierne har væsentlige data om risikoen efter ophør). Observationsundersøgelser tyder også på, at risikoen for brystkræft var større og blev tydelig tidligere med østrogen plus gestagenbehandling sammenlignet med østrogen-alene behandling. Disse undersøgelser har imidlertid ikke fundet signifikant variation i risikoen for brystkræft blandt forskellige kombinationer af østrogen plus gestagen eller administrationsveje.
Brugen af østrogen plus gestagen er blevet rapporteret at resultere i en stigning i unormale mammografier, der kræver yderligere evaluering. Alle kvinder bør modtage årlige brystundersøgelser af en sundhedsudbyder og udføre månedlige brystselvundersøgelser. Derudover bør mammografiundersøgelser planlægges baseret på patientens alder, risikofaktorer og tidligere mammografiresultater.
Endometriecancer
En øget risiko for endometriecancer er blevet rapporteret ved brug af uopsættelig østrogenbehandling hos kvinder med livmoder. Den rapporterede risiko for endometriecancer blandt østrogenbrugere uden modstand er omkring 2 til 12 gange større end hos ikke-brugere og synes afhængig af behandlingens varighed og østrogendosis. De fleste undersøgelser viser ingen signifikant øget risiko forbundet med brugen af østrogener i mindre end 1 år. Den største risiko ser ud til at være forbundet med langvarig brug, med øget risiko på 15 til 24 gange i 5 til 10 år eller mere. Denne risiko har vist sig at vedvare i mindst 8 til 15 år efter, at østrogenbehandlingen er afbrudt.
Klinisk overvågning af alle kvinder, der bruger østrogen plus gestagenbehandling er vigtig. Der bør udføres passende diagnostiske foranstaltninger, herunder endometrieprøver, når det er indiceret, for at udelukke malignitet i alle tilfælde af udiagnosticeret vedvarende eller tilbagevendende unormal genital blødning. Der er ingen beviser for, at brugen af naturlige østrogener resulterer i en anden endometrierisikoprofil end syntetiske østrogener med tilsvarende østrogendosis. Tilføjelse af et gestagen til østrogenbehandling har vist sig at reducere risikoen for endometriehyperplasi, som kan være en forløber for endometriecancer.
Livmoderhalskræft
WHI østrogen plus gestagen underundersøgelse rapporterede en statistisk ikke-signifikant øget risiko for ovariecancer. Efter en gennemsnitlig opfølgning på 5,6 år var den relative risiko for ovariecancer for CE plus MPA versus placebo 1,58 (95 procent CI, 0,77-3,24). Den absolutte risiko for CE plus MPA var 4 versus 3 tilfælde pr. 10.000 kvindeår. I nogle epidemiologiske undersøgelser har brugen af østrogen plus progestin og østrogen-kun produkter, især i 5 eller flere år, været forbundet med øget risiko for ovariecancer. Varigheden af eksponering forbundet med øget risiko er imidlertid ikke konsistent på tværs af alle epidemiologiske undersøgelser, og nogle rapporterer ingen sammenhæng.
Sandsynlig demens
WHIMS estrogen plus progestin hjælpestudie af WHI blev en population på 4.532 postmenopausale kvinder i alderen 65 til 79 år randomiseret til daglig CE (0,625 mg) plus MPA (2,5 mg) eller placebo. Efter en gennemsnitlig opfølgning på 4 år blev 40 kvinder i CE plus MPA-gruppen og 21 kvinder i placebogruppen diagnosticeret med sandsynlig demens. Den relative risiko for sandsynlig demens for CE plus MPA versus placebo var 2,05 (95 procent CI, 1,21-3,48). Den absolutte risiko for sandsynlig demens for CE plus MPA versus placebo var 45 versus 22 tilfælde pr. 10.000 kvindeår. Det er uvist, om disse resultater gælder for yngre postmenopausale kvinder. (Se Kliniske Studier og FORHOLDSREGLER , Geriatrisk brug .)
Visuelle abnormiteter
Afbryd østrogen plus gestagenbehandling i afventning af undersøgelse, hvis der er pludselig delvist eller fuldstændigt tab af synet, eller en pludselig indtræden af proptose, diplopi eller migræne. Hvis undersøgelse afslører papilleødem eller retinale vaskulære læsioner, bør østrogen plus gestagenbehandling seponeres permanent.
FORHOLDSREGLER
Generel
Tilsætning af et gestagen, når en kvinde ikke har fået foretaget en hysterektomi
Undersøgelser af tilsætning af et progestin i 10 eller flere dage af en cyklus med østrogenadministration eller dagligt med østrogen i et kontinuerligt regime har rapporteret en lavere forekomst af endometriehyperplasi, end det ville være induceret af østrogenbehandling alene. Endometriehyperplasi kan være en forløber for endometriecancer.
Der er dog mulige risici, der kan være forbundet med brugen af progestiner med østrogener sammenlignet med østrogen-alene regimer. Disse omfatter en øget risiko for brystkræft.
Uventet unormal vaginal blødning
I tilfælde af uventet unormal vaginal blødning er passende diagnostiske foranstaltninger indiceret.
Forhøjet blodtryk
Blodtrykket bør overvåges med regelmæssige intervaller med østrogen plus gestagenbehandling.
Hypertriglyceridæmi
Hos kvinder med allerede eksisterende hypertriglyceridæmi kan behandling med østrogen plus progestin være forbundet med forhøjede plasmatriglycerider, der fører til pancreatitis. Overvej at afbryde behandlingen, hvis der opstår pancreatitis.
Nedsat leverfunktion og/eller tidligere historie med kolestatisk gulsot
Østrogener plus gestagen kan være dårligt metaboliseret hos kvinder med nedsat leverfunktion. For kvinder med en historie med kolestatisk gulsot i forbindelse med tidligere østrogenbrug eller med graviditet, bør der udvises forsigtighed, og i tilfælde af tilbagefald bør medicineringen seponeres.
Væskeretention
Progestiner kan forårsage en vis grad af væskeretention. Kvinder, der har tilstande, der kan være påvirket af denne faktor, såsom hjerte- eller nyreinsufficiens, kræver omhyggelig observation, når østrogen plus gestagen ordineres.
Hypokalcæmi
Behandling med østrogen plus gestagen bør anvendes med forsigtighed hos kvinder med hypoparathyroidisme, da østrogen-induceret hypocalcæmi kan forekomme.
Forværring af andre tilstande
Behandling med østrogen plus gestagen kan forårsage en forværring af astma, diabetes mellitus, epilepsi, migræne, porfyri, systemisk lupus erythematosus og hepatiske hæmangiomer og bør anvendes med forsigtighed hos kvinder med disse tilstande.
Patientinformation
Læger rådes til at diskutere PATIENTOPLYSNINGER folder med kvinder, som de ordinerer PROVERA til.
Der kan være en øget risiko for mindre fødselsdefekter hos børn, hvis mødre er udsat for gestagen under graviditetens første trimester. Den mulige risiko for den mandlige baby er hypospadi, en tilstand, hvor åbningen af penis er på undersiden snarere end på spidsen af penis. Denne tilstand forekommer naturligt i cirka 5 til 8 ud af 1000 mandlige fødsler. Risikoen kan øges ved eksponering for PROVERA. Forstørrelse af klitoris og sammensmeltning af skamlæberne kan forekomme hos kvindelige babyer. En klar sammenhæng mellem hypospadi, klitorisforstørrelse og labial fusion ved brug af PROVERA er imidlertid ikke blevet fastlagt.
Informer patienten om vigtigheden af at rapportere eksponering for PROVERA 5mg tidligt i graviditeten.
Karcinogenese, mutagenese, svækkelse af fertilitet
Kræftfremkaldende egenskaber
Langvarig intramuskulær administration af medroxyprogesteronacetat har vist sig at producere brysttumorer hos beaglehunde. Der var ingen tegn på en karcinogen effekt forbundet med oral administration af medroxyprogesteronacetat til rotter og mus.
Langvarig kontinuerlig administration af østrogen plus gestagenbehandling har vist en øget risiko for brystkræft og ovariecancer. (Se ADVARSLER og FORHOLDSREGLER .)
Genotoksicitet
Medroxyprogesteronacetat var ikke mutagent i en række in vitro eller in vivo genetiske toksicitetsassays.
Fertilitet
Medroxyprogesteronacetat i høje doser er et antifertilitetslægemiddel, og høje doser forventes at forringe fertiliteten indtil behandlingens ophør.
Graviditet
Graviditetskategori X
PROVERA bør ikke anvendes under graviditet. (Se KONTRAINDIKATIONER .)
Der kan være øget risiko for hypospadi, klitorisforstørrelse og labial fusion hos børn, hvis mødre er udsat for PROVERA 10 mg i graviditetens første trimester. Der er dog ikke etableret en klar sammenhæng mellem disse tilstande med brug af PROVERA.
Ammende mødre
PROVERA bør ikke anvendes under amning. Påviselige mængder gestagen er blevet identificeret i modermælken hos ammende mødre, der får gestagen.
Pædiatrisk brug
PROVERA 10 mg tabletter er ikke indiceret til børn. Der er ikke udført kliniske undersøgelser i den pædiatriske population.
Geriatrisk brug
Der har ikke været et tilstrækkeligt antal geriatriske kvinder involveret i kliniske undersøgelser med PROVERA alene til at afgøre, om de over 65 år adskiller sig fra yngre forsøgspersoner i deres respons på PROVERA alene.
Kvindesundhedsinitiativet undersøgelser
I WHI østrogen plus progestin-subundersøgelsen (daglig CE [0,625 mg] plus MPA [2,5 mg] versus placebo) var der en højere relativ risiko for ikke-fatalt slagtilfælde og invasiv brystkræft hos kvinder over 65 år. (Se Kliniske Studier .)
Kvindesundhedsinitiativet Hukommelsesundersøgelse
I WHIMS supplerende undersøgelser af postmenopausale kvinder i alderen 65 til 79 år var der en øget risiko for at udvikle sandsynlig demens hos kvinder, der fik østrogen alene eller østrogen plus progestin sammenlignet med placebo. (Se ADVARSLER , Sandsynlig demens .)
Da begge supplerende undersøgelser blev udført på kvinder i alderen 65 til 79 år, er det uvist, om disse resultater gælder for yngre postmenopausale kvinder. (Se ADVARSLER , Sandsynlig demens .)
OVERDOSIS
Overdosering af østrogen plus gestagenbehandling kan forårsage kvalme og opkastning, ømhed i brysterne, svimmelhed, mavesmerter, døsighed/træthed og abstinensblødninger kan forekomme hos kvinder. Behandling af overdosering består af seponering af CE plus MPA sammen med indførelse af passende symptomatisk behandling.
KONTRAINDIKATIONER
PROVERA 10mg er kontraindiceret til kvinder med nogen af følgende tilstande:
KLINISK FARMAKOLOGI
Medroxyprogesteronacetat (MPA) administreret oralt eller parenteralt i de anbefalede doser til kvinder med tilstrækkelig endogent østrogen, transformerer proliferativt til sekretorisk endometrium. Androgene og anabolske virkninger er blevet bemærket, men stoffet er tilsyneladende blottet for betydelig østrogen aktivitet. Mens parenteralt indgivet MPA hæmmer produktionen af gonadotropin, hvilket igen forhindrer follikulær modning og ægløsning, indikerer tilgængelige data, at dette ikke sker, når den sædvanligvis anbefalede orale dosis gives som enkelt daglige doser.
Farmakokinetik
Farmakokinetikken af MPA blev bestemt hos 20 postmenopausale kvinder efter en enkeltdosis administration af otte PROVERA 2,5 mg tabletter eller en enkelt administration af to PROVERA 10 mg tabletter under fastende forhold. I en anden undersøgelse blev steady-state farmakokinetikken af MPA bestemt under fastende forhold hos 30 postmenopausale kvinder efter daglig administration af én PROVERA 10 mg tablet i 7 dage. I begge undersøgelser blev MPA kvantificeret i serum ved hjælp af en valideret gaskromatografi-massespektrometri (GC-MS) metode. Estimater af de farmakokinetiske parametre for MPA efter enkelt- og multiple doser af PROVERA-tabletter var meget variable og er opsummeret i tabel 1.
Absorption
Der er ikke udført nogen specifik undersøgelse af den absolutte biotilgængelighed af MPA hos mennesker. MPA absorberes hurtigt fra mave-tarmkanalen, og maksimale MPA-koncentrationer opnås mellem 2 til 4 timer efter oral administration.
Administration af PROVERA sammen med mad øger biotilgængeligheden af MPA. En 10 mg dosis af PROVERA 10 mg, taget umiddelbart før eller efter et måltid, øgede MPA Cmax (50 til 70 %) og AUC (18 til 33 %). Halveringstiden for MPA blev ikke ændret med mad.
Fordeling
MPA er ca. 90 % proteinbundet, primært til albumin; ingen MPA-binding forekommer med kønshormonbindende globulin.
Metabolisme
Efter oral dosering metaboliseres MPA i udstrakt grad i leveren via hydroxylering med efterfølgende konjugering og eliminering i urinen.
Udskillelse
De fleste MPA-metabolitter udskilles i urinen som glucuronidkonjugater med kun mindre mængder udskilt som sulfater.
Specifikke populationer
Leverinsufficiens
MPA elimineres næsten udelukkende via levermetabolisme. Hos 14 patienter med fremskreden leversygdom var MPA-dispositionen signifikant ændret (reduceret elimination). Hos patienter med fedtlever var den gennemsnitlige procentvise dosis udskilt i 24-timers urinen som intakt MPA efter en dosis på 10 mg eller 100 mg henholdsvis 7,3 % og 6,4 %.
Nyreinsufficiens
Virkningen af nedsat nyrefunktion på farmakokinetikken af PROVERA 5mg er ikke blevet undersøgt.
Lægemiddelinteraktioner
Medroxyprogesteronacetat (MPA) metaboliseres in vitro primært ved hydroxylering via CYP3A4. Specifikke lægemiddel-lægemiddelinteraktionsstudier, der evaluerer de kliniske virkninger med CYP3A4-inducere eller -hæmmere på MPA, er ikke blevet udført. Inducere og/eller hæmmere af CYP3A4 kan påvirke metabolismen af MPA.
Kliniske Studier
Virkninger på Endometriet
I en 3-årig, dobbeltblind, placebokontrolleret undersøgelse af 356 ikke-hysterektomiserede, postmenopausale kvinder mellem 45 og 64 år randomiseret til at modtage placebo (n=119), kun 0,625 mg konjugeret østrogen (n=119) eller 0,625 mg konjugeret østrogen plus cyklisk PROVERA (n=118), resultater viste en reduceret risiko for endometriehyperplasi i behandlingsgruppen, der fik 10 mg PROVERA 5 mg plus 0,625 mg konjugerede østrogener sammenlignet med gruppen, der kun fik 0,625 mg konjugerede østrogener. Se tabel 2.
en anden 1-årig undersøgelse blev 832 postmenopausale kvinder mellem 45 og 65 år behandlet med dagligt 0,625 mg konjugeret østrogen (dage 1-28) plus enten 5 mg cyklisk PROVERA eller 10 mg cyklisk PROVERA (dage 15-28), eller dagligt kun 0,625 mg konjugeret østrogen. Behandlingsgrupperne, der modtog 5 eller 10 mg cyklisk PROVERA (dage 15-28) plus daglige konjugerede østrogener, viste en signifikant lavere forekomst af hyperplasi sammenlignet med gruppen med kun konjugerede østrogener. Se tabel 3.
Kvinders sundhedsinitiativ undersøgelser
WHI indskrev ca. 27.000 overvejende raske postmenopausale kvinder i to delstudier for at vurdere risici og fordele ved daglig oral CE (0,625 mg) alene eller i kombination med MPA (2,5 mg) sammenlignet med placebo i forebyggelsen af visse kroniske sygdomme. Det primære endepunkt var forekomsten af koronar hjertesygdom (CHD) (defineret som ikke-fatal MI, stille MI og CHD død), med invasiv brystkræft som det primære uønskede resultat. Et "globalt indeks" inkluderede den tidligste forekomst af CHD, invasiv brystkræft, slagtilfælde, PE, endometriecancer (kun i CE plus MPA-underundersøgelsen), kolorektal cancer, hoftebrud eller død på grund af anden årsag. Disse delstudier evaluerede ikke virkningerne af CE-alene eller CE plus MPA på menopausale symptomer.
WHI østrogen plus gestagen underundersøgelse
WHI østrogen plus progestin underundersøgelsen blev stoppet tidligt. Ifølge den foruddefinerede stopregel, efter en gennemsnitlig opfølgning på 5,6 års behandling, oversteg den øgede risiko for invasiv brystkræft og kardiovaskulære hændelser de specificerede fordele inkluderet i det "globale indeks". Den absolutte overrisiko for hændelser inkluderet i det "globale indeks" var 19 pr. 10.000 kvindeår.
For de resultater inkluderet i WHI "globale indeks", som nåede statistisk signifikans efter 5,6 års opfølgning, var de absolutte overrisici pr. 10.000 kvindeår i gruppen behandlet med CE plus MPA 7 flere CHD-hændelser, 8 flere slagtilfælde, 10 flere PE'er og 8 flere invasive brystkræfttilfælde, mens den absolutte risikoreduktion pr. 10.000 kvindeår var 6 færre kolorektale cancere og 5 færre hoftebrud.
Resultaterne af CE plus MPA-underundersøgelsen, som omfattede 16.608 kvinder (gennemsnit 63 år, spænder fra 50 til 79; 83,9 procent hvide, 6,8 procent sorte, 5,4 procent latinamerikanske, 3,9 procent andre) er vist i tabel 4. Disse resultater afspejler centralt. bedømte data efter en gennemsnitlig opfølgning på 5,6 år.
Tidspunktet for påbegyndelse af østrogen plus progestinbehandling i forhold til starten af overgangsalderen kan påvirke den overordnede risiko-benefit-profil. WHI østrogen plus progestin-substudiet stratificeret efter alder viste hos kvinder i alderen 50 til 59 år en ikke-signifikant tendens mod reduceret risiko i den samlede dødelighed [hazard ration (HR) 0,69 (95 procent CI, 0,44-1,07)].
Women's Health Initiative Memory Study
WHIMS estrogen plus progestin-undersøgelsen af WHI indskrev 4.532 overvejende raske postmenopausale kvinder 65 år og ældre (47 procent var i alderen 65 til 69 år, 35 procent var 70 til 74 år og 18 procent var 75 år gamle alder og ældre) for at evaluere virkningerne af daglig CE (0,625 mg) plus MPA (2,5 mg) på forekomsten af sandsynlig demens (primært resultat) sammenlignet med placebo.
Efter en gennemsnitlig opfølgning på 4 år var den relative risiko for sandsynlig demens for CE plus MPA versus placebo 2,05 (95 procent CI, 1,21-3,48). Den absolutte risiko for sandsynlig demens for CE plus MPA versus placebo var 45 versus 33 pr. 10.000 kvindeår. Sandsynlig demens som defineret i denne undersøgelse inkluderede Alzheimers sygdom (AD), vaskulær demens (VaD) og blandet type (med træk af både AD og VaD). Den mest almindelige klassificering af sandsynlig demens i behandlingsgruppen og placebogruppen var AD. Da den supplerende undersøgelse blev udført med kvinder i alderen 65 til 79 år, er det uvist, om disse resultater gælder for yngre postmenopausale kvinder. (Se ADVARSLER , Sandsynlig demens og FORHOLDSREGLER , Geriatrisk brug ).
PATIENTOPLYSNINGER
PROVERA (pro-VE-rah) (medroxyprogesteronacetat) tabletter, USP
Læs denne patientinformation, før du begynder at tage PROVERA, og læs, hvad du får, hver gang du genopfylder din PROVERA-recept. Der kan være nye oplysninger. Disse oplysninger træder ikke i stedet for at tale med din sundhedsplejerske om din medicinske tilstand eller din behandling.
Hvad er den vigtigste information, jeg bør vide om PROVERA (et gestagenhormon)?
- Brug ikke østrogener med gestagen for at forhindre hjertesygdomme, hjerteanfald, slagtilfælde eller demens (nedgang i hjernens funktion).
- Brug af østrogener med gestagen kan øge din chance for at få hjerteanfald, slagtilfælde, brystkræft og blodpropper.
- Brug af østrogener med gestagen kan øge din chance for at få demens, baseret på en undersøgelse af kvinder i alderen 65 år eller ældre.
- Du og din sundhedsplejerske bør regelmæssigt tale om, hvorvidt du stadig har brug for behandling med PROVERA.
Hvad er PROVERA 10mg?
PROVERA er et lægemiddel, der indeholder medroxyprogesteronacetat, et progestinhormon.
Hvad bruges PROVERA 5mg til?
PROVERA bruges til:
- Behandl menstruationsperioder, der er stoppet, eller for at behandle unormal uterinblødning. Kvinder med en livmoder, som ikke er gravid, som holder op med at have regelmæssige menstruationer, eller som begynder at få uregelmæssige menstruationer, kan få et fald i deres progesteronniveau. Tal med din sundhedsplejerske om, hvorvidt PROVERA 10mg er det rigtige for dig.
- Reducer dine chancer for at få kræft i livmoderen (livmoderen). Hos postmenopausale kvinder med en livmoder, som bruger østrogener, vil indtagelse af gestagen i kombination med østrogen reducere din chance for at få kræft i livmoderen (livmoderen).
Hvem bør ikke tage PROVERA?
Begynd ikke at tage PROVERA, hvis du:
- har usædvanlig vaginal blødning
- i øjeblikket har eller har haft visse kræftformer Østrogen plus gestagen kan øge din chance for at få visse typer kræft, herunder brystkræft. Hvis du har eller har haft kræft, skal du tale med din læge om, hvorvidt du skal bruge PROVERA.
- havde et slagtilfælde eller hjerteanfald
- i øjeblikket har eller har haft blodpropper
- i øjeblikket har eller har haft leverproblemer
- er allergiske over for PROVERA 10mg eller nogen af dets ingredienser Se listen over ingredienser i PROVERA i slutningen af denne indlægsseddel.
- tror du kan være gravid PROVERA er ikke til gravide kvinder. Hvis du tror, du kan være gravid, bør du tage en graviditetstest og kende resultaterne. Brug ikke PROVERA, hvis testen er positiv, og tal med din læge. Der kan være en øget risiko for mindre fødselsdefekter hos børn, hvis mødre tager PROVERA i løbet af de første 4 måneder af graviditeten. PROVERA bør ikke bruges som en graviditetstest.
Hvad skal jeg fortælle min sundhedsplejerske, før jeg tager PROVERA 10mg? Inden du tager PROVERA 5mg, skal du fortælle det til din læge, hvis du:
- har andre medicinske problemer Din sundhedsplejerske skal muligvis tjekke dig mere omhyggeligt, hvis du har visse tilstande såsom astma (hvæsen), epilepsi (anfald), diabetes, migræne, endometriose (svære bækkensmerter), lupus eller problemer med dit hjerte, lever, skjoldbruskkirtel, nyrer eller har højt calcium i blodet.
- skal opereres eller ligge i seng Din læge vil fortælle dig, hvis du skal stoppe med at tage PROVERA.
- ammer Hormonet i PROVERA kan gå over i din modermælk.
Fortæl din læge om al den medicin, du tager herunder receptpligtig og ikke-receptpligtig medicin, vitaminer og naturlægemidler. Nogle lægemidler kan påvirke, hvordan PROVERA virker. PROVERA kan også påvirke, hvordan anden medicin virker.
Hvordan skal jeg tage PROVERA 10mg?
Start med den laveste dosis og tal med din læge om, hvor godt den dosis virker for dig. Den laveste effektive dosis af PROVERA er ikke blevet bestemt. Du og din læge bør tale regelmæssigt (hver 3. til 6. måned) om den dosis, du tager, og om du stadig har brug for behandling med PROVERA.
Hvad er de mulige bivirkninger af PROVERA?
Følgende bivirkninger er blevet rapporteret ved brug af PROVERA 10 mg alene:
- ømhed i brysterne
- modermælkssekretion
- gennembrudsblødning
- pletblødning (mindre vaginal blødning)
- uregelmæssige menstruationer
- amenoré (fravær af menstruation)
- vaginalt sekret
- hovedpine
- nervøsitet
- svimmelhed
- depression
- søvnløshed, søvnighed, træthed
- præmenstruelt syndrom-lignende symptomer
- tromboflebitis (betændte vener)
- blodprop
- kløe, nældefeber, hududslæt
- acne
- hårtab, hårvækst
- ubehag i maven
- kvalme
- oppustethed
- feber
- stigning i vægt
- hævelse
- ændringer i synet og følsomhed over for kontaktlinser
Ring til din læge med det samme, hvis du får nældefeber, vejrtrækningsproblemer, hævelse af ansigt, mund, tunge eller hals
Følgende bivirkninger er blevet rapporteret ved brug af PROVERA 5mg med et østrogen.
Bivirkninger er grupperet efter, hvor alvorlige de er, og hvor ofte de opstår, når du bliver behandlet.
Alvorlige, men mindre almindelige bivirkninger omfatter:
- hjerteanfald
- slag
- blodpropper
- demens
- brystkræft
- kræft i livmoderen
- kræft i æggestokkene
- højt blodtryk
- højt blodsukker
- galdeblære sygdom
- leverproblemer
- ændringer i dine thyreoideahormonniveauer
- forstørrelser af godartede tumorer ("fibromer")
Ring til din læge med det samme, hvis du får nogle af følgende advarselstegn eller andre usædvanlige symptomer, der bekymrer dig:
- nye brystklumper
- usædvanlig vaginal blødning
- ændringer i syn og tale
- pludselig ny kraftig hovedpine
- svære smerter i brystet eller benene med eller uden åndenød, svaghed og træthed
- hukommelsestab eller forvirring
Mindre alvorlige, men almindelige bivirkninger omfatter:
- hovedpine
- brystsmerter
- uregelmæssig vaginal blødning eller pletblødning
- mave- eller mavekramper, oppustethed
- kvalme og opkast
- hårtab
- væskeophobning
- vaginal gærinfektion
Disse er ikke alle de mulige bivirkninger af PROVERA med eller uden østrogen. For mere information, spørg din læge eller apotek om råd om bivirkninger. Fortæl din læge, hvis du har en bivirkning, der generer dig eller ikke forsvinder. Du kan rapportere bivirkninger til Pfizer på 1-800-438-1985 eller FDA på 1-800-FDA-1088.
Hvad kan jeg gøre for at mindske mine chancer for en alvorlig bivirkning med PROVERA 10mg?
- Tal med din sundhedsplejerske regelmæssigt om, hvorvidt du skal fortsætte med at tage PROVERA. Tilsætning af et gestagen anbefales generelt til kvinder med en livmoder for at mindske chancen for at få kræft i livmoderen (livmoderen).
- Kontakt din læge med det samme, hvis du får vaginal blødning, mens du tager PROVERA.
- Få en bækkenundersøgelse, brystundersøgelse og mammografi (brystrøntgen) hvert år, medmindre din læge fortæller dig noget andet. Hvis medlemmer af din familie har haft brystkræft, eller hvis du nogensinde har haft brystklumper eller en unormal mammografi, skal du muligvis have brystundersøgelser oftere.
- Hvis du har forhøjet blodtryk, højt kolesterol (fedt i blodet), diabetes, er overvægtig, eller hvis du bruger tobak, kan du have større chance for at få hjertesygdomme. Spørg din sundhedsplejerske om måder at reducere din chance for at få hjertesygdomme.
Generel information om sikker og effektiv brug af PROVERA
- Lægemidler ordineres nogle gange til tilstande, der ikke er nævnt i indlægssedler.
- Tag ikke PROVERA til tilstande, som det ikke er ordineret til.
- Giv ikke PROVERA til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Opbevar PROVERA 10mg utilgængeligt for børn.
Denne folder giver en oversigt over de vigtigste oplysninger om PROVERA. Hvis du vil have mere information, så tal med din læge eller apotek. Du kan bede om information om PROVERA 10mg, der er skrevet til sundhedspersonale. Du kan få flere oplysninger ved at ringe til det gratisnummer, 1-800-438-1985.
Hvad er ingredienserne i PROVERA?
Hver PROVERA 5 mg tablet til oral administration indeholder 2,5 mg, 5 mg eller 10 mg medroxyprogesteronacetat.
Inaktive ingredienser: calciumstearat, majsstivelse, laktose, mineralolie, sorbinsyre, saccharose, talkum. 2,5 mg tabletten indeholder FD&C Yellow No. 6.
Dette produkts etiket er muligvis blevet opdateret. Besøg www.pfizer.com for aktuel fuld ordinationsinformation
