Prometrium 100mg, 200mg Progesterone Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Prometrium 100mg, og hvordan bruges det?
Prometrium 200mg er en receptpligtig medicin, der bruges til at forebygge behandling af symptomer på endometriehyperplasi og symptomer på sekundær amenoré (fravær af menstruation eller menstruation). Prometrium kan bruges alene eller sammen med anden medicin.
Prometrium tilhører en klasse af lægemidler kaldet progestiner.
Det vides ikke, om Prometrium 200mg er sikkert og effektivt til børn.
Hvad er mulige bivirkninger af Prometrium?
Prometrium kan forårsage alvorlige bivirkninger, herunder:
- usædvanlig vaginal blødning,
- smerte eller svie ved vandladning,
- brystklump,
- pludselige synsproblemer,
- svær hovedpine,
- smerte bag øjnene,
- depression,
- søvnproblemer,
- svaghed,
- humørsvingninger,
- svær svimmelhed,
- døsighed,
- snurrende fornemmelse,
- forvirring,
- stakåndet,
- brystsmerter eller tryk,
- smerte breder sig til kæben eller skulderen,
- kvalme,
- svedeture,
- smerter i øvre mave,
- kløe,
- træthed,
- mistet appetiten,
- mørk farvet urin,
- lerfarvede afføring,
- gulfarvning af huden eller øjnene (gulsot),
- pludselig følelsesløshed eller svaghed,
- pludselig kraftig hovedpine,
- utydelig tale ,
- svært ved at tale eller balancere,
- pludselig hoste,
- hvæsen,
- hurtig vejrtrækning,
- hoste blod op,
- smerter i benene,
- hævelse i benet, og
- varme eller rødme i et eller begge ben
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Prometrium 100mg omfatter:
- døsighed,
- svimmelhed,
- brystsmerter,
- humørsvingninger,
- hovedpine,
- forstoppelse,
- diarré,
- halsbrand,
- oppustethed,
- hævelse i dine hænder eller fødder,
- ledsmerter,
- hedeture, og
- vaginalt udflåd
Fortæl det til din læge, hvis du har en bivirkning, som generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Prometrium. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
Hjerte- og karlidelser, BRYSTCANCER og MULIG DEMENS TIL ØTROGEN PLUS PROGESTINTERAPI
Kardiovaskulære lidelser og sandsynlig demens
Østrogener plus gestagenbehandling bør ikke anvendes til forebyggelse af kardiovaskulær sygdom eller demens. (Se Kliniske Studier og ADVARSLER , Kardiovaskulære lidelser og Sandsynlig demens. )
Women's Health Initiative (WHI) østrogen plus gestagen underundersøgelse rapporterede øgede risici for dyb venetrombose, lungeemboli, slagtilfælde og myokardieinfarkt hos postmenopausale kvinder (50 til 79 år) i løbet af 5,6 års behandling med daglig oral konjugeret østrogener (CE) [0,625 mg] kombineret med medroxyprogesteronacetat (MPA) [2,5 mg] i forhold til placebo. (Se Kliniske Studier og ADVARSLER , Kardiovaskulære lidelser. )
WHI Memory Study (WHIMS) østrogen plus gestagen supplerende undersøgelse af WHI rapporterede en øget risiko for at udvikle sandsynlig demens hos postmenopausale kvinder 65 år eller ældre i løbet af 4 års behandling med daglig CE (0,625 mg) kombineret med MPA (2,5 mg) ), i forhold til placebo. Det vides ikke, om dette fund gælder for yngre postmenopausale kvinder. (Se Kliniske Studier og ADVARSLER , Sandsynlig demens og FORHOLDSREGLER , Geriatrisk brug .)
Brystkræft
WHI østrogen plus progestin underundersøgelsen viste også en øget risiko for invasiv brystkræft. (Se Kliniske Studier og ADVARSLER , Ondartede neoplasmer, brystkræft .)
I mangel af sammenlignelige data bør disse risici antages at være ens for andre doser af CE og MPA og andre kombinationer og doseringsformer af østrogener og progestiner.
Progestiner med østrogener bør ordineres i de laveste effektive doser og i den korteste varighed i overensstemmelse med behandlingsmål og risici for den enkelte kvinde.
BESKRIVELSE
PROMETRIUM (progesteron, USP) Kapsler indeholder mikroniseret progesteron til oral administration. Progesteron har en molekylvægt på 314,47 og en molekylformel på C21H30O2. Progesteron (pregn-4-ene-3, 20-dion) er et hvidt eller cremehvidt, lugtfrit, krystallinsk pulver praktisk talt uopløseligt i vand, opløseligt i alkohol, acetone og dioxan og tungtopløseligt i vegetabilske olier, stabilt i luft, smeltende mellem kl. 126° og 131°C. Strukturformlen er:
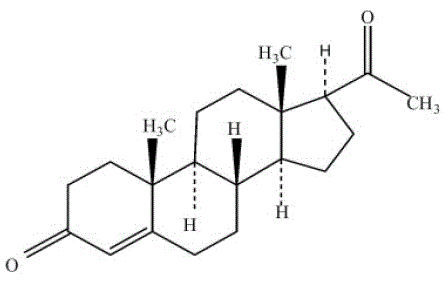
Progesteron er syntetiseret fra et udgangsmateriale fra en plantekilde og er kemisk identisk med progesteron af human ovarieoprindelse. PROMETRIUM-kapsler fås i flere styrker for at give doseringsfleksibilitet for optimal håndtering. PROMETRIUM kapsler indeholder 100 mg eller 200 mg mikroniseret progesteron.
De inaktive ingredienser til PROMETRIUM Kapsler 100 mg inkluderer: jordnøddeolie NF, gelatine NF, glycerin USP, lecithin NF, titaniumdioxid USP, FD&C Red No. 40 og D&C Yellow No. 10. De inaktive ingredienser til PROMETRIUM 100 mg Capsules inkluderer 200 mg Capsules : jordnøddeolie NF, gelatine NF, glycerin USP, lecithin NF, titaniumdioxid USP, D&C Yellow No. 10 og FD&C Yellow No. 6.
INDIKATIONER
PROMETRIUM 200 mg kapsler er indiceret til brug til forebyggelse af endometriehyperplasi hos ikke-hysterektomiserede postmenopausale kvinder, som får konjugerede østrogentabletter. De er også indiceret til brug ved sekundær amenoré.
DOSERING OG ADMINISTRATION
Forebyggelse af endometriehyperplasi
PROMETRIUM 100 mg kapsler bør gives som en enkelt daglig dosis ved sengetid, 200 mg oralt i 12 dage sekventielt pr. 28-dages cyklus, til en postmenopausal kvinde med en uterus, som får daglige konjugerede østrogentabletter.
Behandling af sekundær amenoré
PROMETRIUM 100 mg kapsler kan gives som en enkelt daglig dosis på 400 mg ved sengetid i 10 dage.
Nogle kvinder kan opleve besvær med at sluge PROMETRIUM-kapsler. For disse kvinder skal PROMETRIUM-kapsler tages med et glas vand, mens de står i stående stilling.
HVORDAN LEVERET
PROMETRIUM (progesteron, USP) Kapsler 100 mg er runde, ferskenfarvede kapsler mærket med sort præg "SV".
NDC 0032-1708-01 (flaske med 100)
PROMETRIUM (progesteron, USP) Kapsler 200 mg er ovale, lysegul-farvede kapsler mærket med sort præg "SV2".
NDC 0032-1711-01 (flaske med 100)
Opbevares ved 25°C (77°F); udflugter tilladt til 15° til 30°C (59° til 86°F) [Se USP kontrolleret rumtemperatur].
Beskyt mod overdreven fugt.
Dispenser i tæt, lysbestandig beholder som defineret i USP/NF, ledsaget af en patientindsats.
Holde utilgængeligt for børn.
Fremstillet af: Catalent Pharma Solutions, St. Petersburg, FL 33716. Revideret: Sep 2013
BIVIRKNINGER
Se KASSE ADVARSEL , ADVARSLER og FORHOLDSREGLER .
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
I et multicenter, randomiseret, dobbeltblindt, placebokontrolleret klinisk forsøg blev virkningen af PROMETRIUM 100 mg kapsler på endometriet undersøgt hos i alt 875 postmenopausale kvinder. Tabel 6 viser bivirkninger større end eller lig med 2 procent af kvinder, der fik cykliske PROMETRIUM-kapsler 200 mg dagligt (12 dage pr. kalendermånedscyklus) med 0,625 mg konjugerede østrogener eller placebo.
TABEL 6. Bivirkninger (≥ 2 %) rapporteret i et placebokontrolleret forsøg med 875 patienter i postmenopausale kvinder over en 3-årig periode [Procentdel (%) af rapporterede patienter]
Virkninger på sekundær amenoré
I et multicenter, randomiseret, dobbeltblindt, placebokontrolleret klinisk forsøg blev virkningerne af PROMETRIUM Kapsler på sekundær amenoré undersøgt hos 49 østrogen-primede postmenopausale kvinder. Tabel 7 viser bivirkninger større end eller lig med 5 procent af kvinder, der fik PROMETRIUM 100 mg kapsler eller placebo.
TABEL 7. Bivirkninger (≥ 5%) rapporteret hos patienter, der bruger 400 mg/dag i et placebokontrolleret forsøg med østrogen-primede postmenopausale kvinder
et multicenter, parallel-gruppe, åbent postmarketing doseringsstudie bestående af tre på hinanden følgende 28-dages behandlingscyklusser, blev 220 præmenopausale kvinder med sekundær amenoré randomiseret til at modtage daglig konjugeret østrogenerbehandling (0,625 mg konjugerede østrogener) og PROMETRIUM 3 mg, 0mg, 0mg, 0mg, 0mg, 0mg. dag (n=113) eller PROMETRIUM-kapsler, 400 mg/dag (n=107) i 10 dage af hver behandlingscyklus. Samlet set var de hyppigst rapporterede behandlingsudløste bivirkninger, rapporteret hos mere end eller lig med 5 procent af forsøgspersonerne, kvalme, træthed, vaginal mykose, nasopharyngitis, øvre luftvejsinfektion, hovedpine, svimmelhed, ømhed i brysterne, udspilet mave, akne , dysmenoré, humørsvingninger og urinvejsinfektion.
Postmarketing oplevelse
Følgende yderligere bivirkninger er blevet rapporteret med PROMETRIUM 200 mg kapsler. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere hyppigheden eller etablere en årsagssammenhæng til lægemiddeleksponering.
Genitourinært system
endometriekarcinom, hypospadi, intra-uterin død, menorragi, menstruationsforstyrrelser, metrorragi, ovariecyste, spontan abort.
Kardiovaskulær
kredsløbskollaps, medfødt hjertesygdom (herunder ventrikulær septumdefekt og patent ductus arteriosus), hypertension, hypotension, takykardi.
Gastrointestinale
akut pancreatitis, kolestase, kolestatisk hepatitis, dysfagi, leversvigt, levernekrose, hepatitis, øgede leverfunktionsprøver (inklusive øget alaninaminotransferase, øget aspartataminotransferase, øget gamma-glutamyltransferase), gulsot, hævet tunge.
Hud
alopeci, pruritus, nældefeber.
Øjne
sløret syn, diplopi, synsforstyrrelser.
Centralnervesystemet
aggression, kramper, depersonalisering, deprimeret bevidsthed, desorientering, dysartri, bevidsthedstab, paræstesi, sedation, stupor, synkope (med og uden hypotension), forbigående iskæmisk anfald, selvmordstanker.
Under den indledende behandling har nogle få kvinder oplevet en konstellation af mange eller alle følgende symptomer: ekstrem svimmelhed og/eller døsighed, sløret syn, sløret tale, gangbesvær, bevidsthedstab, svimmelhed, forvirring, desorientering, følelse af fuld og stakåndet.
Diverse
unormal gang, anafylaktisk reaktion, artralgi, øget blodsukker, kvælning, læbespalte, ganespalte, gangbesvær, dyspnø, ansigtsødem, unormal følelse, fuldfølelse, overfølsomhed, astma, muskelkramper, stram hals, tinnitus, svimmelhed, vægttab , vægt steget.
DRUGSINTERAKTIONER
Interaktioner med lægemiddel-laboratorietest
Følgende laboratorieresultater kan ændres ved brug af østrogen plus gestagenbehandling:
- Øget sulfobromophthalein-retention og andre leverfunktionstests.
- Koagulationstest: stigning i protrombinfaktorer VII, VIII, IX og X.
- Pregnanediol bestemmelse.
- Skjoldbruskkirtelfunktion: stigning i PBI og butanol ekstraherbart proteinbundet jod og fald i T3 optagelsesværdier.
ADVARSLER
Se KASSE ADVARSEL .
Kardiovaskulære lidelser
En øget risiko for lungeemboli, dyb venetrombose (DVT), slagtilfælde og myokardieinfarkt er blevet rapporteret ved behandling med østrogen plus gestagen. Hvis nogen af disse forekommer eller er mistanke om, bør østrogen med gestagenbehandling afbrydes øjeblikkeligt.
Risikofaktorer for arteriel vaskulær sygdom (for eksempel hypertension, diabetes mellitus, tobaksbrug, hyperkolesterolæmi og fedme) og/eller venøs tromboemboli (for eksempel personlig historie eller familiehistorie med venøs tromboemboli [VTE], fedme og systemisk lupus erythematosus ) skal administreres korrekt.
Slag
I Women's Health Initiative (WHI) østrogen plus progestin-underundersøgelse blev der rapporteret en statistisk signifikant øget risiko for slagtilfælde hos kvinder i alderen 50 til 79 år, der fik daglig CE (0,625 mg) plus MPA (2,5 mg) sammenlignet med kvinder i samme alder. gruppe, der fik placebo (33 versus 25 pr. 10.000 kvindeår). Stigningen i risiko blev påvist efter det første år og fortsatte. (Se Kliniske Studier .) Hvis der opstår et slagtilfælde eller er mistanke om, bør østrogen plus gestagenbehandling afbrydes øjeblikkeligt.
Koronar hjertesygdom
WHI østrogen plus progestin-substudiet var der en statistisk ikke-signifikant øget risiko for koronar hjertesygdom (CHD) hændelser (defineret som ikke-fatalt myokardieinfarkt [MI], stille MI eller CHD-død) hos kvinder, der fik daglig CE (0,625) mg) plus MPA (2,5 mg) sammenlignet med kvinder, der fik placebo (41 mod 34 pr. 10.000 kvindeår). En stigning i relativ risiko blev påvist i år 1, og en tendens til faldende relativ risiko blev rapporteret i år 2 til 5. (Se Kliniske Studier .)
Hos postmenopausale kvinder med dokumenteret hjertesygdom (n = 2.763, gennemsnitsalder 66,7 år), i et kontrolleret klinisk forsøg med sekundær forebyggelse af kardiovaskulær sygdom (hjerte- og østrogen-/progestinerstatningsundersøgelse [HERS]), behandling med daglig CE (0,625 mg) plus MPA (2,5 mg) viste ingen kardiovaskulær fordel. I løbet af en gennemsnitlig opfølgning på 4,1 år reducerede behandling med CE plus MPA ikke den samlede frekvens af CHD-hændelser hos postmenopausale kvinder med etableret koronar hjertesygdom. Der var flere CHD-hændelser i den CE plus MPA-behandlede gruppe end i placebogruppen i år 1, men ikke i de efterfølgende år. To tusinde, tre hundrede og enogtyve (2.321) kvinder fra det oprindelige HERS-forsøg indvilligede i at deltage i en åben udvidelse af HERS, HERS II. Den gennemsnitlige opfølgning i HERS II var yderligere 2,7 år, i alt 6,8 år samlet. Hyppigheden af CHD-hændelser var sammenlignelige blandt kvinder i CE plus MPA-gruppen og placebogruppen i HERS, HERS II og generelt.
Venøs tromboembolisme
I WHI østrogen plus progestin-substudiet blev der rapporteret en statistisk signifikant 2 gange større frekvens af VTE (DVT og lungeemboli [PE]) hos kvinder, der fik daglig CE (0,625 mg) plus MPA (2,5 mg) sammenlignet med kvinder, der fik placebo ( 35 mod 17 pr. 10.000 kvindeår). Statistisk signifikante stigninger i risikoen for både DVT (26 versus 13 pr. 10.000 kvindeår) og PE (18 versus 8 pr. 10.000 kvindeår) blev også påvist. Stigningen i VTE-risiko blev påvist i løbet af det første år og fortsatte. (Se Kliniske Studier .) Hvis der opstår en VTE eller er mistanke om, bør østrogen plus gestagenbehandling seponeres øjeblikkeligt.
Hvis det er muligt, bør østrogener med progestiner seponeres mindst 4 til 6 uger før operation af den type, der er forbundet med en øget risiko for tromboemboli, eller i perioder med længerevarende immobilisering.
Maligne neoplasmer
Brystkræft
Det vigtigste randomiserede kliniske forsøg, der giver information om brystkræft hos østrogen plus progestinbrugere, er Women's Health Initiative (WHI) underundersøgelse af daglig CE (0,625 mg) plus MPA (2,5 mg). Efter en gennemsnitlig opfølgning på 5,6 år rapporterede østrogen plus progestin-subundersøgelsen en øget risiko for invasiv brystkræft hos kvinder, der tog dagligt CE plus MPA. I denne delundersøgelse blev tidligere brug af østrogen-alene eller østrogen plus progestin-terapi rapporteret af 26 procent af kvinderne. Den relative risiko for invasiv brystkræft var 1,24 (95 procent nCI, 1,01-1,54), og den absolutte risiko var 41 versus 33 tilfælde pr. 10.000 kvindeår for CE plus MPA sammenlignet med placebo. Blandt kvinder, der rapporterede tidligere brug af hormonbehandling, var den relative risiko for invasiv brystkræft 1,86, og den absolutte risiko var 46 versus 25 tilfælde pr. 10.000 kvindeår for østrogen plus gestagen sammenlignet med placebo. Blandt kvinder, der ikke rapporterede nogen tidligere brug af hormonbehandling, var den relative risiko for invasiv brystkræft 1,09, og den absolutte risiko var 40 versus 36 tilfælde pr. 10.000 kvindeår for CE plus MPA sammenlignet med placebo. I det samme delstudie var invasive brystkræftformer større, var mere tilbøjelige til at være nodepositive og blev diagnosticeret på et mere fremskredent stadium i CE (0,625 mg) plus MPA (2,5 mg) gruppen sammenlignet med placebogruppen. Metastatisk sygdom var sjælden, uden nogen åbenbar forskel mellem de to grupper. Andre prognostiske faktorer såsom histologisk undertype, grad og hormonreceptorstatus var ikke forskellige mellem grupperne. (Se Kliniske Studier .)
overensstemmelse med WHI's kliniske forsøg har observationsstudier også rapporteret en øget risiko for brystkræft for østrogen plus gestagenbehandling og en mindre øget risiko for østrogen-alene behandling efter flere års brug. Risikoen steg med varigheden af brugen og så ud til at vende tilbage til baseline i løbet af ca. 5 år efter behandlingens ophør (kun observationsstudierne har væsentlige data om risikoen efter ophør). Observationsundersøgelser tyder også på, at risikoen for brystkræft var større og blev tydelig tidligere med østrogen plus gestagenbehandling sammenlignet med østrogen-alene behandling. Disse undersøgelser har dog generelt ikke fundet signifikant variation i risikoen for brystkræft blandt forskellige østrogen plus gestagen kombinationer, doser eller administrationsveje.
Brugen af østrogen plus gestagen er blevet rapporteret at resultere i en stigning i unormale mammografier, der kræver yderligere evaluering. Alle kvinder bør modtage årlige brystundersøgelser af en sundhedsudbyder og udføre månedlige brystselvundersøgelser. Derudover bør mammografiundersøgelser planlægges baseret på patientens alder, risikofaktorer og tidligere mammografiresultater.
Endometriecancer
En øget risiko for endometriecancer er blevet rapporteret ved brug af østrogenbehandling uden modsætning til en kvinde med en livmoder. Den rapporterede risiko for endometriecancer blandt østrogenbrugere uden modstand er omkring 2 til 12 gange større end hos ikke-brugere og synes afhængig af behandlingens varighed og østrogendosis. De fleste undersøgelser viser ingen signifikant øget risiko forbundet med brugen af østrogener i mindre end 1 år. Den største risiko ser ud til at være forbundet med langvarig brug, med øget risiko på 15 til 24 gange i 5 til 10 år eller mere, og denne risiko har vist sig at vedvare i mindst 8 til 15 år efter, at østrogenbehandlingen er afbrudt.
Klinisk overvågning af alle kvinder, der bruger østrogen plus gestagenbehandling er vigtig. Der bør udføres passende diagnostiske foranstaltninger, herunder rettet eller tilfældig endometrieprøvetagning, når det er indiceret, for at udelukke malignitet i alle tilfælde af udiagnosticeret vedvarende eller tilbagevendende unormal genital blødning. Der er ingen beviser for, at brugen af naturlige østrogener resulterer i en anden endometrierisikoprofil end syntetiske østrogener med tilsvarende østrogendosis. Tilføjelse af et gestagen til østrogenbehandling hos postmenopausale kvinder har vist sig at reducere risikoen for endometriehyperplasi, som kan være en forløber for endometriecancer.
Livmoderhalskræft
WHI østrogen plus gestagen underundersøgelse rapporterede en statistisk ikke-signifikant øget risiko for ovariecancer. Efter en gennemsnitlig opfølgning på 5,6 år var den relative risiko for ovariecancer for CE plus MPA versus placebo 1,58 (95 procent nCI, 0,77 – 3,24). Den absolutte risiko for CE plus MPA versus placebo var 4 versus 3 tilfælde pr. 10.000 kvindeår. I nogle epidemiologiske undersøgelser har brugen af østrogen plus progestin og østrogen-kun produkter, især i 5 eller flere år, været forbundet med en øget risiko for kræft i æggestokkene. Varigheden af eksponering forbundet med øget risiko er imidlertid ikke konsistent på tværs af alle epidemiologiske undersøgelser, og nogle rapporterer ingen sammenhæng.
Sandsynlig demens
I estrogen plus progestin Women's Health Initiative Memory Study (WHIMS), en supplerende undersøgelse af WHI, blev en population på 4.532 postmenopausale kvinder i alderen 65 til 79 år randomiseret til daglig CE (0,625 mg) plus MPA (2,5 mg) eller placebo.
WHIMS estrogen plus progestin accessorary-undersøgelsen, efter en gennemsnitlig opfølgning på 4 år, blev 40 kvinder i CE plus MPA-gruppen og 21 kvinder i placebogruppen diagnosticeret med sandsynlig demens. Den relative risiko for sandsynlig demens for østrogen plus gestagen versus placebo var 2,05 (95 procent CI, 1,21-3,48). Den absolutte risiko for sandsynlig demens for CE plus MPA versus placebo var 45 versus 22 tilfælde pr. 10.000 kvindeår. Det er uvist, om disse resultater gælder for yngre postmenopausale kvinder. (Se Kliniske Studier og FORHOLDSREGLER , Geriatrisk brug .)
Synsforstyrrelser
Retinal vaskulær trombose er blevet rapporteret hos patienter, der får østrogen. Afbryd østrogen plus gestagenbehandling i afventning af undersøgelse, hvis der er pludselig delvist eller fuldstændigt synstab, eller hvis der er en pludselig indtræden af proptose, diplopi eller migræne. Hvis undersøgelse afslører papilleødem eller retinale vaskulære læsioner, bør østrogen plus gestagenbehandling seponeres permanent.
FORHOLDSREGLER
Generel
Tilsætning af et gestagen, når en kvinde ikke har fået foretaget en hysterektomi
Undersøgelser af tilsætning af et progestin i 10 eller flere dage af en cyklus med østrogenadministration eller dagligt med østrogen i et kontinuerligt regime har rapporteret en lavere forekomst af endometriehyperplasi, end det ville være induceret af østrogenbehandling alene. Endometriehyperplasi kan være en forløber for endometriecancer.
Der er dog mulige risici, der kan være forbundet med brugen af progestiner med østrogener sammenlignet med østrogen-alene regimer. Disse omfatter en øget risiko for brystkræft.
Væskeretention
Progesteron kan forårsage en vis grad af væskeophobning. Kvinder med tilstande, der kan være påvirket af denne faktor, såsom hjerte- eller nyredysfunktion, kræver omhyggelig observation.
Svimmelhed og døsighed
PROMETRIUM Kapsler kan forårsage forbigående svimmelhed og døsighed og bør bruges med forsigtighed, når du fører motorkøretøj eller betjener maskiner. PROMETRIUM Kapsler bør tages som en enkelt daglig dosis ved sengetid.
Patientinformation
Generel
Dette produkt indeholder jordnøddeolie og bør ikke bruges, hvis du er allergisk over for jordnødder.
Læger rådes til at diskutere indholdet af patientinformationsfolderen med patienter, som de ordinerer PROMETRIUM 100 mg kapsler til.
Karcinogenese, mutagenese, svækkelse af fertilitet
Progesteron er ikke blevet testet for carcinogenicitet hos dyr ad oral administrationsvej. Når det blev implanteret i hunmus, producerede progesteron brystkarcinomer, ovariegranulosacelletumorer og endometriale stromale sarkomer. Hos hunde frembragte langvarige intramuskulære injektioner nodulær hyperplasi og benigne og ondartede brysttumorer. Subkutane eller intramuskulære injektioner af progesteron reducerede latensperioden og øgede forekomsten af brysttumorer hos rotter tidligere behandlet med et kemisk carcinogen.
Progesteron viste ikke tegn på genotoksicitet i in vitro undersøgelser for punktmutationer eller for kromosombeskadigelse. In vivo undersøgelser for kromosomskader har givet positive resultater hos mus ved orale doser på 1000 mg/kg og 2000 mg/kg. Eksogent administreret progesteron har vist sig at hæmme ægløsning hos en række arter, og det forventes, at høje doser givet i længere tid vil forringe fertiliteten indtil behandlingens ophør.
Graviditet
PROMETRIUM kapsler bør ikke anvendes under graviditet. (Se KONTRAINDIKATIONER ).
Graviditetskategori B
Reproduktionsundersøgelser er blevet udført på mus i doser på op til 9 gange den humane orale dosis, på rotter i doser op til 44 gange den humane orale dosis, på kaniner i en dosis på 10 mcg/dag leveret lokalt i livmoderen med en implanteret enhed , hos marsvin i doser på cirka halvdelen af den orale humane dosis og hos rhesusaber i doser cirka den humane dosis, alt baseret på kropsoverfladeareal, og har afsløret få eller ingen tegn på nedsat fertilitet eller skade på fosteret pga. progesteron.
Sygeplejerske Kvinder
Påviselige mængder gestagen er blevet identificeret i mælken hos ammende kvinder, der får gestagen. Der skal udvises forsigtighed, når PROMETRIUM 100 mg kapsler administreres til en ammende kvinde.
Pædiatrisk brug
PROMETRIUM kapsler er ikke indiceret til børn. Der er ikke udført kliniske undersøgelser i den pædiatriske population.
Geriatrisk brug
Der har ikke været et tilstrækkeligt antal geriatriske kvinder involveret i kliniske undersøgelser med PROMETRIUM-kapsler til at afgøre, om de over 65 år adskiller sig fra yngre forsøgspersoner i deres respons på PROMETRIUM 200 mg kapsler.
Kvindesundhedsinitiativets undersøgelse
I Women's Health Initiative (WHI) østrogen plus progestin underundersøgelse (daglig CE [0,625 mg] plus MPA [2,5 mg] versus placebo) var der en højere relativ risiko for ikke-dødelig slagtilfælde og invasiv brystkræft hos kvinder over 65 år. . (Se Kliniske Studier og ADVARSLER , Kardiovaskulære lidelser og Ondartede neoplasmer. )
Kvindesundhedsinitiativet Hukommelsesundersøgelse
I Women's Health Initiative Memory Study (WHIMS) af postmenopausale kvinder i alderen 65 til 79 år var der en øget risiko for at udvikle sandsynlig demens i østrogen plus progestin hjælpeundersøgelsen sammenlignet med placebo. (Se Kliniske Studier og ADVARSLER , Sandsynlig demens. )
OVERDOSIS
Der er ikke udført undersøgelser af overdosering hos mennesker. I tilfælde af overdosering skal PROMETRIUM kapsler seponeres, og patienten skal behandles symptomatisk.
KONTRAINDIKATIONER
PROMETRIUM kapsler bør ikke anvendes til kvinder med nogen af følgende tilstande:
KLINISK FARMAKOLOGI
PROMETRIUM 200mg kapsler er en oral doseringsform af mikroniseret progesteron, som er kemisk identisk med progesteron af ovarie oprindelse. Den orale biotilgængelighed af progesteron øges gennem mikronisering.
Farmakokinetik
Absorption
Efter oral administration af progesteron som en mikroniseret blød gelatinekapselformulering blev maksimale serumkoncentrationer opnået inden for 3 timer. Den absolutte biotilgængelighed af mikroniseret progesteron kendes ikke. Tabel 1 opsummerer de gennemsnitlige farmakokinetiske parametre hos postmenopausale kvinder efter fem orale daglige doser af PROMETRIUM Kapsler 100 mg som en mikroniseret blød gelatinekapselformulering.
TABEL 1. Farmakokinetiske parametre for PROMETRIUM 200 mg kapsler
Serumprogesteronkoncentrationer forekom lineære og dosisproportionale efter administration af flere doser af PROMETRIUM 200 mg kapsler 100 mg over dosisområdet 100 mg dagligt til 300 mg dagligt hos postmenopausale kvinder. Selvom doser over 300 mg pr. dag ikke blev undersøgt hos kvinder, så serumkoncentrationer fra en undersøgelse med mandlige frivillige lineære ud og dosisproportionale mellem 100 mg pr. dag og 400 mg pr. dag. De farmakokinetiske parametre hos mandlige frivillige var generelt i overensstemmelse med dem, der ses hos postmenopausale kvinder.
Fordeling
Progesteron er omkring 96 procent til 99 procent bundet til serumproteiner, primært til serumalbumin (50 til 54 procent) og transcortin (43 til 48 procent).
Metabolisme
Progesteron metaboliseres primært af leveren, hovedsageligt til pregnanedioler og pregnanoloner. Pregnandioler og pregnanoloner konjugeres i leveren til glucuronid- og sulfatmetabolitter. Progesteronmetabolitter, som udskilles i galden, kan dekonjugeres og kan metaboliseres yderligere i tarmen via reduktion, dehydroxylering og epimerisering.
Udskillelse
Glucuronid- og sulfatkonjugaterne af pregnandiol og pregnanolon udskilles i galden og urinen. Progesteronmetabolitter elimineres hovedsageligt af nyrerne. Progesteronmetabolitter, som udskilles i galden, kan gennemgå enterohepatisk recirkulering eller kan udskilles i fæces.
Særlige Populationer
Farmakokinetikken af PROMETRIUM kapsler er ikke blevet vurderet hos patienter med lav kropsvægt eller overvægtige.
Leverinsufficiens
Virkningen af nedsat leverfunktion på farmakokinetikken af PROMETRIUM 100 mg kapsler er ikke blevet undersøgt.
Nyreinsufficiens
Virkningen af nedsat nyrefunktion på farmakokinetikken af PROMETRIUM kapsler er ikke blevet undersøgt.
Interaktion mellem fødevarer og lægemidler
Samtidig fødeindtagelse øgede biotilgængeligheden af PROMETRIUM 100 mg kapsler i forhold til en fastende tilstand, når det blev givet til postmenopausale kvinder i en dosis på 200 mg.
Lægemiddelinteraktioner
Metabolismen af progesteron af humane levermikrosomer blev hæmmet af ketoconazol (IC50
Samtidig administration af konjugerede østrogener og PROMETRIUM 200 mg kapsler til 29 postmenopausale kvinder over en 12-dages periode resulterede i en stigning i de samlede østronkoncentrationer (Cmax 3,68 ng/ml til 4,93 ng/ml) og totale equilinkoncentrationer til 7 ng/mL max. ng/ml) og et fald i cirkulerende 17β østradiolkoncentrationer (Cmax 0,037 ng/ml til 0,030 ng/ml). Halveringstiden for de konjugerede østrogener var ens ved samtidig administration af PROMETRIUM-kapsler. Tabel 2 opsummerer de farmakokinetiske parametre.
TABEL 2. Gennemsnitlige (± SD) farmakokinetiske parametre for østradiol, østron og equilin efter samtidig administration af konjugerede østrogener 0,625 mg og PROMETRIUM-kapsler 200 mg i 12 dage til postmenopausale kvinder
Kliniske Studier
Virkninger på Endometriet
et randomiseret, dobbeltblindt klinisk forsøg modtog 358 postmenopausale kvinder, hver med en intakt livmoder, behandling i op til 36 måneder. Behandlingsgrupperne var: PROMETRIUM-kapsler i en dosis på 200 mg pr. dag i 12 dage pr. 28-dages cyklus i kombination med konjugerede østrogener 0,625 mg pr. dag (n=120); kun konjugerede østrogener 0,625 mg pr. dag (n=119); eller placebo (n=119). Forsøgspersonerne i alle tre behandlingsgrupper var primært kaukasiske kvinder (87 procent eller mere af hver gruppe). Resultaterne for forekomsten af endometriehyperplasi hos kvinder, der modtog op til 3 års behandling, er vist i tabel 3. En sammenligning af behandlingsgruppen PROMETRIUM Kapsler plus konjugerede østrogener med gruppen kun med konjugerede østrogener viste en signifikant lavere forekomst af hyperplasi (6 pct. kombinationsprodukt versus 64 procent østrogen alene) i behandlingsgruppen PROMETRIUM Kapsler plus konjugerede østrogener gennem 36 måneders behandling.
TABEL 3. Forekomst af endometriehyperplasi hos kvinder, der modtager 3 års behandling
Tiderne til diagnose af endometriehyperplasi over 36 måneders behandling er vist i figur 1. Denne figur illustrerer grafisk, at andelen af patienter med hyperplasi var signifikant større for gruppen med konjugerede østrogener (64 procent) sammenlignet med gruppen med konjugerede østrogener plus PROMETRIUM Kapsler. (6 procent).
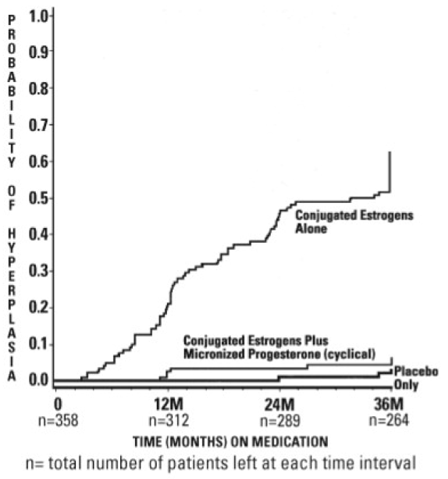
Figur 1. Tid til hyperplasi hos kvinder, der modtager op til 36 måneders behandling
Seponeringshyppigheden på grund af hyperplasi i løbet af de 36 måneders behandling er som vist i tabel 4. For enhver grad af hyperplasi var seponeringshyppigheden for patienter, der fik konjugerede østrogener plus PROMETRIUM 100 mg kapsler, den samme som for gruppen med kun placebo, mens Seponeringsraten for patienter, der modtog konjugerede østrogener alene, var signifikant højere. Kvinder, der permanent ophørte med behandlingen på grund af hyperplasi, svarede demografisk til den samlede undersøgelsespopulation.
TABEL 4. Seponeringshyppighed på grund af hyperplasi over 36 måneders behandling
Virkninger på sekundær amenoré
et enkeltcenter, randomiseret, dobbeltblindt klinisk studie, der omfattede præmenopausale kvinder med sekundær amenoré i mindst 90 dage, resulterede administration af 10 dages behandling med PROMETRIUM 200 mg kapsler i, at 80 procent af kvinderne oplevede abstinensblødninger inden for 7 dage efter den sidste dosis af PROMETRIUM 100 mg kapsler, 300 mg dagligt (n=20), sammenlignet med 10 procent af kvinderne, der oplever abstinensblødninger i placebogruppen (n=21).
I et multicenter, parallel-gruppe, åbent, postmarketing doseringsstudie, der omfattede præmenopausale kvinder med sekundær amenoré i mindst 90 dage, administration af 10 dages PROMETRIUM 100 mg kapsler i to 28-dages behandlingscyklusser, 300 mg dagligt (n= 107) eller 400 mg om dagen (n=99), resulterede i, at henholdsvis 73,8 procent og 76,8 procent af kvinderne oplevede abstinensblødninger.
Hastigheden af sekretorisk transformation blev evalueret i et multicenter, randomiseret, dobbeltblindt klinisk studie med østrogen-primede postmenopausale kvinder. PROMETRIUM 100 mg kapsler administreret oralt i 10 dage med 400 mg dagligt (n=22) inducerede fuldstændige sekretoriske ændringer i endometriet hos 45 procent af kvinderne sammenlignet med 0 procent i placebogruppen (n=23).
Et andet multicenter, parallel-gruppe, åbent postmarketing doseringsstudie i præmenopausale kvinder med sekundær amenoré i mindst 90 dage evaluerede også hastigheden af sekretorisk transformation. Alle forsøgspersoner modtog daglige orale konjugerede østrogener over 3 på hinanden følgende 28-dages behandlingscyklusser og PROMETRIUM-kapsler, 300 mg pr. dag (n=107) eller 400 mg pr. dag (n=99) i 10 dage af hver behandlingscyklus. Hastigheden af fuldstændig sekretorisk transformation var henholdsvis 21,5 procent og 28,3 procent.
Kvinders sundhedsinitiativ undersøgelser
Women's Health Initiative (WHI) indskrev ca. 27.000 overvejende raske postmenopausale kvinder i to delstudier for at vurdere risici og fordele ved daglige orale konjugerede østrogener (CE) [0,625 mg]-alene eller i kombination med medroxyprogesteronacetat (MPA) [2,5 mg] sammenlignet med placebo i forebyggelsen af visse kroniske sygdomme. Det primære endepunkt var forekomsten af koronar hjertesygdom [(CHD) defineret som nonfatal myokardieinfarkt (MI), stille MI og CHD død], med invasiv brystkræft som det primære uønskede resultat. Et "globalt indeks" inkluderede den tidligste forekomst af CHD, invasiv brystkræft, slagtilfælde, lungeemboli (PE), endometriecancer (kun i CE plus MPA-underundersøgelsen), kolorektal cancer, hoftebrud eller død på grund af anden årsag. Disse delstudier evaluerede ikke virkningerne af CE-alene eller CE plus MPA på menopausale symptomer.
WHI østrogen plus gestagen underundersøgelse
WHI østrogen plus progestin underundersøgelsen blev stoppet tidligt. Ifølge den foruddefinerede stopregel, efter en gennemsnitlig opfølgning på 5,6 års behandling, oversteg den øgede risiko for brystkræft og kardiovaskulære hændelser de specificerede fordele inkluderet i det "globale indeks." Den absolutte overrisiko for hændelser i det "globale indeks" var 19 pr. 10.000 kvindeår.
For de resultater inkluderet i WHI "globale indeks", som nåede statistisk signifikans efter 5,6 års opfølgning, var de absolutte overrisici pr. 10.000 kvindeår i gruppen behandlet med CE plus MPA 7 flere CHD-hændelser, 8 flere slagtilfælde, 10 flere PE'er og 8 flere invasive brystkræfttilfælde, mens de absolutte risikoreduktioner pr. 10.000 kvindeår var 6 færre kolorektale cancere og 5 færre hoftebrud.
Resultaterne af østrogen plus progestin-underundersøgelsen, som omfattede 16.608 kvinder (gennemsnitlig 63 år, spænder fra 50 til 79; 83,9 procent hvide, 6,8 procent sorte, 5,4 procent latinamerikanske, 3,9 procent andre) er vist i tabel 5. Disse resultater afspejler centralt. bedømte data efter en gennemsnitlig opfølgning på 5,6 år.
TABEL 5. Relativ og absolut risiko set i Estrogen Plus Progestin-substudiet af WHI ved et gennemsnit på 5,6 år a, b
Tidspunktet for påbegyndelse af østrogen plus progestinbehandling i forhold til starten af overgangsalderen kan påvirke den overordnede risiko-benefit-profil. WHI østrogen plus progestin-substudiet stratificeret for alder viste hos kvinder i alderen 50 til 59 år en ikke-signifikant tendens til at reducere risikoen for overordnet dødelighed [hazard ratio (HR) 0,69 (95 procent CI, 0,44-1,07)].
Women's Health Initiative Memory Study
Østrogen plus gestagen Women's Health Initiative Memory Study (WHIMS), en supplerende undersøgelse af WHI, indskrev 4.532 overvejende raske postmenopausale kvinder 65 år og ældre (47 procent var 65 til 69 år; 35 procent var 70 til 74 år gamle). alder, og 18 procent var 75 år og ældre) for at evaluere virkningerne af daglig CE (0,625 mg) plus MPA (2,5 mg) på forekomsten af sandsynlig demens (primært resultat) sammenlignet med placebo.
Efter en gennemsnitlig opfølgning på 4 år var den relative risiko for sandsynlig demens for CE plus MPA versus placebo 2,05 (95 procent CI, 1,21 – 3,48). Den absolutte risiko for sandsynlig demens for CE plus MPA versus placebo var 45 versus 22 pr. 10.000 kvindeår. Sandsynlig demens som defineret i denne undersøgelse inkluderede Alzheimers sygdom (AD), vaskulær demens (VaD) og blandet type (med træk af både AD og VaD). Den mest almindelige klassificering af sandsynlig demens i behandlingsgruppen og placebogruppen var AD. Da den supplerende undersøgelse blev udført med kvinder i alderen 65 til 79 år, er det uvist, om disse resultater gælder for yngre postmenopausale kvinder. (Se ADVARSLER , Sandsynlig demens og FORHOLDSREGLER , Geriatrisk brug .)
PATIENTOPLYSNINGER
PROMETRIUM® (progesteron, USP) Kapsler 100 mg & 200 mg
Læs denne PATIENTINFORMATION, før du begynder at tage PROMETRIUM 200 mg kapsler, og læs, hvad du får, hver gang du genopfylder din recept på din PROMETRIUM 100 mg kapsler. Der kan være nye oplysninger. Disse oplysninger træder ikke i stedet for at tale med din sundhedsplejerske om din medicinske tilstand eller din behandling.
HVAD ER DE VIGTIGSTE OPLYSNINGER JEG BØR VIDE OM PROMETRIUM 100mg KAPSLER (et progesteronhormon)?
- Progestiner med østrogener bør ikke bruges til at forebygge hjertesygdomme, hjerteanfald, slagtilfælde eller demens.
- Brug af progestiner med østrogener kan øge din chance for at få hjerteanfald, slagtilfælde, brystkræft og blodpropper.
- Brug af progestiner med østrogener kan øge din chance for at få demens, baseret på en undersøgelse af kvinder i alderen 65 år og ældre.
- Du og din sundhedsplejerske bør regelmæssigt tale om, hvorvidt du stadig har brug for behandling med PROMETRIUM 100mg kapsler.
DETTE PRODUKT INDEHOLDER PEANNØDDEOLIE OG BØR IKKE ANVENDES, HVIS DU ER ALLERGISK OVER FOR PEANUTS.
Hvad er PROMETRIUM 200mg kapsler?
PROMETRIUM 100mg kapsler indeholder det kvindelige hormon kaldet progesteron.
Hvad bruges PROMETRIUM 100mg kapsler til?
Behandling af menstruationsforstyrrelser
PROMETRIUM 200mg kapsler bruges til behandling af sekundær amenoré (fravær af menstruation hos kvinder, der tidligere har haft menstruation) på grund af et fald i progesteron. Når du ikke producerer nok progesteron, kan der opstå menstruationsuregelmæssigheder. Hvis din læge har fastslået, at din krop ikke producerer nok progesteron alene, kan PROMETRIUM 200 mg kapsler ordineres til at give den progesteron, du har brug for.
Beskyttelse af endometrium (slimhinden i livmoderen)
PROMETRIUM 200mg kapsler bruges i kombination med østrogenholdig medicin hos en postmenopausal kvinde med livmoder (livmoder). At tage østrogen alene øger chancen for at udvikle en tilstand kaldet endometriehyperplasi, der kan føre til kræft i livmoderslimhinden (livmoderen). Tilsætning af et gestagen anbefales generelt til en kvinde med en livmoder for at mindske chancen for at få kræft i livmoderen (livmoderen).
Hvem bør ikke tage PROMETRIUM kapsler?
Begynd ikke at tage PROMETRIUM kapsler, hvis du:
- Er allergisk over for jordnødder
- Har usædvanlig vaginal blødning
- Har i øjeblikket eller har haft visse kræftformer Behandling med østrogen plus gestagen kan øge chancen for at få visse typer kræft, herunder kræft i brystet eller livmoderen. Hvis du har eller har haft kræft, skal du tale med din læge om, hvorvidt du skal tage PROMETRIUM Capsules.
- Havde et slagtilfælde eller hjerteanfald
- Har i øjeblikket eller har haft blodpropper
- Har i øjeblikket eller har haft leverproblemer
- Er allergisk over for PROMETRIUM-kapsler eller nogen af dets ingredienser Se listen over ingredienser i PROMETRIUM 200mg kapsler i slutningen af denne indlægsseddel.
- Tror du kan være gravid
Fortæl din sundhedsplejerske:
- Hvis du ammer. Hormonet i PROMETRIUM 100 mg kapsler kan passere over i din modermælk.
- Om alle dine medicinske problemer. Din sundhedsplejerske skal muligvis tjekke dig mere omhyggeligt, hvis du har visse tilstande, såsom astma (hvæsen), epilepsi (anfald), diabetes, migræne, endometriose, lupus, problemer med dit hjerte, lever, skjoldbruskkirtel eller nyrer, eller har høje calciumniveauer i dit blod.
- Om al den medicin, du tager. Dette omfatter receptpligtig og ikke-receptpligtig medicin, vitaminer og naturlægemidler. Nogle lægemidler kan påvirke, hvordan PROMETRIUM 100mg kapsler virker. PROMETRIUM Kapsler kan også påvirke, hvordan din anden medicin virker.
Hvordan skal jeg tage PROMETRIUM 200mg kapsler?
Hvad er de mulige bivirkninger af PROMETRIUM kapsler?
Bivirkninger er grupperet efter, hvor alvorlige de er, og hvor ofte de opstår, når du bliver behandlet:
Alvorlige, men mindre almindelige bivirkninger omfatter:
- Risiko for fosteret: Tilfælde af ganespalte, læbespalte, hypospadi, ventrikulær septaldefekt, patent ductus arteriosus og andre medfødte hjertefejl.
- Unormal blodkoagulation: Slagtilfælde, hjerteanfald, lungeemboli, synstab eller blindhed.
Nogle af advarselstegnene på alvorlige bivirkninger omfatter:
- Ændringer i syn eller tale
- Pludselig ny kraftig hovedpine
- Alvorlige smerter i brystet eller benene med eller uden åndenød, svaghed og træthed
- Svimmelhed og besvimelse
- Opkastning
Ring til din læge med det samme, hvis du får nogle af disse advarselstegn eller andre usædvanlige symptomer, der bekymrer dig.
Mindre alvorlige, men almindelige bivirkninger omfatter:
- Hovedpine
- Brystsmerter
- Uregelmæssig vaginal blødning eller pletblødning
- Mave- eller mavekramper, oppustethed
- Kvalme og opkast
- Hårtab
- Væskeretention
- Vaginal gærinfektion
Disse er ikke alle de mulige bivirkninger af PROMETRIUM 200 mg kapsler. For mere information, spørg din læge eller apotek om råd om bivirkninger. Du kan rapportere bivirkninger til AbbVie Inc. på 1-800-633-9110 eller til FDA på 1-800-FDA-1088.
Hvad kan jeg gøre for at mindske mine chancer for at få en alvorlig bivirkning med PROMETRIUM 100mg kapsler?
- Tal med din læge regelmæssigt om, hvorvidt du skal fortsætte med at tage PROMETRIUM 100 mg kapsler.
- Kontakt din læge med det samme, hvis du får usædvanlig vaginal blødning, mens du tager PROMETRIUM Capsules.
- Få en bækkenundersøgelse, brystundersøgelse og mammografi (brystrøntgen) hvert år, medmindre din læge fortæller dig noget andet. Hvis medlemmer af din familie har haft brystkræft, eller hvis du nogensinde har haft brystklumper eller en unormal mammografi, skal du muligvis have brystundersøgelser oftere.
- Hvis du har forhøjet blodtryk, højt kolesterol (fedt i blodet), diabetes, er overvægtig, eller hvis du bruger tobak, kan du have større chancer for at få hjertesygdom. Spørg din sundhedsudbyder om måder at reducere dine chancer for at få hjertesygdomme.
Generel information om sikker og effektiv brug af PROMETRIUM kapsler
- Lægemidler ordineres nogle gange til tilstande, der ikke er nævnt i indlægssedler. Tag ikke PROMETRIUM kapsler til tilstande, som det ikke er ordineret til.
- Din sundhedsplejerske har ordineret dette lægemiddel til dig og dig alene. Giv ikke PROMETRIUM kapsler til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
- PROMETRIUM 200 mg kapsler bør tages som en enkelt daglig dosis ved sengetid. Nogle kvinder kan opleve ekstrem svimmelhed og/eller døsighed under den indledende behandling. I nogle få tilfælde kan symptomer omfatte sløret syn, talebesvær, gangbesvær og unormal følelse. Hvis du oplever disse symptomer, skal du straks drøfte dem med din læge.
- Vær forsigtig, når du kører motorkøretøj eller betjener maskiner, da svimmelhed eller døsighed kan forekomme.
Opbevar PROMETRIUM kapsler utilgængeligt for børn.
Denne folder giver en oversigt over de vigtigste oplysninger om PROMETRIUM 100 mg kapsler. Hvis du vil have mere information, så tal med din læge eller apotek. Du kan bede om information om PROMETRIUM 100mg kapsler, der er skrevet til sundhedspersonale. Du kan få flere oplysninger ved at ringe til det gratis nummer 1-800-633-9110.
Hvad er ingredienserne i PROMETRIUM kapsler?
Aktiv ingrediens: 100 mg eller 200 mg mikroniseret progesteron
De inaktive ingredienser til PROMETRIUM Kapsler 100 mg inkluderer: jordnøddeolie NF, gelatine NF, glycerin USP, lecithin NF, titaniumdioxid USP, FD&C Red No. 40 og D&C Yellow No. 10.
De inaktive ingredienser til PROMETRIUM Kapsler 200 mg inkluderer: jordnøddeolie NF, gelatine NF, glycerin USP, lecithin NF, titaniumdioxid USP, D&C Yellow No. 10 og FD&C Yellow No. 6.
HVORDAN LEVERET
PROMETRIUM 200mg Kapsler 100 mg er runde, ferskenfarvede kapsler mærket med sort præg "SV".
PROMETRIUM 100 mg kapsler 200 mg er ovale, lysegul-farvede kapsler mærket med sort præg "SV2".
Opbevares ved 25°C (77°F); udflugter tilladt til 15° til 30°C (59° til 86°F) [Se USP kontrolleret rumtemperatur].
