Arimidex 1mg Anastrozole Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Arimidex, og hvordan bruges det?
Arimidex 1mg er en receptpligtig medicin, der bruges til at behandle symptomer på brystkræft hos postmenopausale kvinder. Arimidex kan bruges alene eller sammen med anden medicin.
Arimidex tilhører en klasse af lægemidler kaldet antineoplastik, aromataseinhibitor.
Det vides ikke, om Arimidex er sikkert og effektivt til børn.
Hvad er de mulige bivirkninger af Arimidex?
Arimidex kan forårsage alvorlige bivirkninger, herunder:
- stakåndet,
- knoglebrud,
- hævede kirtler,
- kvalme,
- smerter i øvre mave,
- kløe,
- træthed,
- mistet appetiten,
- mørk urin,
- lerfarvede afføring,
- gulfarvning af huden eller øjnene (gulsot),
- pludselig følelsesløshed eller svaghed (især på den ene side af kroppen),
- pludselig kraftig hovedpine,
- utydelig tale,
- problemer med syn eller balance,
- feber,
- ondt i halsen,
- hævelse i dit ansigt eller tunge,
- brændende i dine øjne,
- hudsmerter og
- rødt eller lilla hududslæt, der breder sig (især i ansigtet eller overkroppen) med blærer og afskalning
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Arimidex omfatter:
- svaghed,
- hedeture,
- følelsesløshed eller prikkende fornemmelse i din hud,
- hævelse i dine ankler eller fødder,
- ledsmerter eller stivhed,
- problemer med dine fingre, mens du griber,
- ondt i halsen,
- hovedpine,
- rygsmerte,
- knoglesmerter,
- depression,
- humørsvingninger,
- søvnproblemer (søvnløshed),
- højt blodtryk,
- svær hovedpine,
- sløret syn,
- dunkende i nakken eller ørerne,
- kvalme,
- opkastning, og
- mildt udslæt
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Arimidex. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
ARIMIDEX (anastrozol) tabletter til oral administration indeholder 1 mg anastrozol, en ikke-steroid aromatasehæmmer. Det er kemisk beskrevet som 1,3-benzendiacetonitril, a, a, a', a'-tetramethyl-5-(1H-1,2,4-triazol-1-ylmethyl). Dens molekylære formel er C17H19N5 og dens strukturformel er:
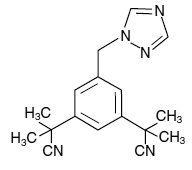
Anastrozol er et råhvidt pulver med en molekylvægt på 293,4. Anastrozol har moderat vandopløselighed (0,5 mg/ml ved 25°C); opløseligheden er uafhængig af pH i det fysiologiske område. Anastrozol er frit opløseligt i methanol, acetone, ethanol og tetrahydrofuran og meget opløseligt i acetonitril.
Hver tablet indeholder som inaktive ingredienser: lactose, magnesiumstearat, hydroxypropylmethylcellulose, polyethylenglycol, povidon, natriumstivelsesglykolat og titaniumdioxid.
INDIKATIONER
Adjuverende behandling
ARIMIDEX er indiceret til adjuverende behandling af postmenopausale kvinder med hormonreceptorpositiv tidlig brystkræft.
Første linje behandling
ARIMIDEX 1mg er indiceret til førstelinjebehandling af postmenopausale kvinder med hormonreceptor-positiv eller hormonreceptor ukendt lokalt fremskreden eller metastatisk brystkræft.
Second-line behandling
ARIMIDEX 1mg er indiceret til behandling af fremskreden brystkræft hos postmenopausale kvinder med sygdomsprogression efter tamoxifenbehandling. Patienter med ER-negativ sygdom og patienter, der ikke reagerede på tidligere tamoxifenbehandling, reagerede sjældent på ARIMIDEX.
DOSERING OG ADMINISTRATION
Anbefalet dosis
Dosis af ARIMIDEX er én 1 mg tablet taget én gang dagligt. For patienter med fremskreden brystkræft bør ARIMIDEX 1 mg fortsættes indtil tumorprogression. ARIMIDEX kan tages med eller uden mad.
Til adjuverende behandling af tidlig brystkræft hos postmenopausale kvinder er den optimale behandlingsvarighed ukendt. I ATAC-studiet blev ARIMIDEX 1 mg administreret i fem år [se Kliniske Studier ].
Dosisjustering er ikke nødvendig for patienter med nedsat nyrefunktion eller til ældre patienter [se Brug i specifikke populationer ].
Patienter med nedsat leverfunktion
Ingen ændringer i dosis anbefales til patienter med let til moderat nedsat leverfunktion. ARIMIDEX er ikke blevet undersøgt hos patienter med svært nedsat leverfunktion [se Brug i specifikke populationer ].
HVORDAN LEVERET
Doseringsformer og styrker
Tabletterne er hvide, bikonvekse, filmovertrukne og indeholder 1 mg anastrozol. Tabletterne er præget på den ene side med et logo bestående af et bogstav "A" (stort bogstav) med en pilespids fastgjort til foden af det forlængede højre ben på "A" og på bagsiden med tabletstyrkemærket "Adx 1" ”.
Opbevaring og håndtering
Disse tabletter leveres i flasker med 30 tabletter ( NDC 0310-0201-30).
Opbevaring
Opbevares ved kontrolleret stuetemperatur, 20-25°C (68-77°F) [se USP ].
Distribueret af: AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. Revideret: maj 2014
BIVIRKNINGER
Alvorlige bivirkninger med ARIMIDEX, der forekommer hos mindre end 1 ud af 10.000 patienter, er: 1) hudreaktioner såsom læsioner, sår eller blærer; 2) allergiske reaktioner med hævelse af ansigt, læber, tunge og/eller hals. Dette kan forårsage besvær med at synke og/eller trække vejret; og 3) ændringer i blodprøver af leverfunktionen, herunder betændelse i leveren med symptomer, der kan omfatte en generel følelse af ikke at have det godt, med eller uden gulsot, leversmerter eller leverhævelse.
Almindelige bivirkninger (forekommer med en forekomst på ≥ 10 %) hos kvinder, der tog ARIMIDEX 1 mg inkluderet: hedeture, asteni, gigt, smerter, artralgi, hypertension, depression, kvalme og opkastning, udslæt, osteoporose, frakturer, rygsmerter, søvnløshed, hovedpine, knoglesmerter, perifert ødem, øget hoste, dyspnø, pharyngitis og lymfødem.
ATAC-studiet var den mest almindelige rapporterede bivirkning (> 0,1 %), der førte til seponering af behandlingen for begge behandlingsgrupper, hedeture, selvom der var færre patienter, der afbrød behandlingen som følge af hedeture i ARIMIDEX 1 mg-gruppen.
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Erfaring med kliniske forsøg
Adjuverende terapi
Bivirkningsdata for adjuverende terapi er baseret på ATAC-studiet [se Kliniske Studier ]. Medianvarigheden af adjuverende behandling til sikkerhedsevaluering var 59,8 måneder og 59,6 måneder for patienter, der fik henholdsvis ARIMIDEX 1 mg og tamoxifen 20 mg.
Bivirkninger, der forekommer med en forekomst på mindst 5 % i begge behandlingsgrupper under behandlingen eller inden for 14 dage efter behandlingens afslutning, er vist i tabel 1.
Visse bivirkninger og kombinationer af bivirkninger blev prospektivt specificeret til analyse baseret på de to lægemidlers kendte farmakologiske egenskaber og bivirkningsprofiler (se tabel 2).
Iskæmiske kardiovaskulære hændelser
Mellem behandlingsarme i den samlede population på 6186 patienter var der ingen statistisk forskel i iskæmiske kardiovaskulære hændelser (4 % ARIMIDEX vs. 3 % tamoxifen).
I den samlede population blev angina pectoris rapporteret hos 71/3092 (2,3 %) patienter i ARIMIDEX 1 mg-armen og 51/3094 (1,6 %) patienter i tamoxifen-armen; myokardieinfarkt blev rapporteret hos 37/3092 (1,2%) patienter i ARIMIDEX 1 mg-armen og 34/3094 (1,1%) patienter i tamoxifen-armen.
Hos kvinder med allerede eksisterende iskæmisk hjertesygdom 465/6186 (7,5 %) var forekomsten af iskæmiske kardiovaskulære hændelser 17 % hos patienter på ARIMIDEX og 10 % hos patienter på tamoxifen. I denne patientpopulation blev angina pectoris rapporteret hos 25/216 (11,6 %) patienter, der fik ARIMIDEX, og 13/249 (5,2 %) patienter, der fik tamoxifen; myokardieinfarkt blev rapporteret hos 2/216 (0,9 %) patienter, der fik ARIMIDEX, og 8/249 (3,2 %) patienter, der fik tamoxifen.
Fund af knoglemineraltæthed
Resultater fra ATAC-forsøgets knoglesubundersøgelse efter 12 og 24 måneder viste, at patienter, der fik ARIMIDEX 1 mg, havde et gennemsnitligt fald i både lændehvirvelsøjlen og total hofteknoglemineraltæthed (BMD) sammenlignet med baseline. Patienter, der fik tamoxifen, havde en gennemsnitlig stigning i både lændehvirvelsøjlen og total hofte-BMD sammenlignet med baseline.
Fordi ARIMIDEX sænker cirkulerende østrogenniveauer, kan det forårsage en reduktion i knoglemineraltætheden.
Et post-marketing-forsøg vurderede den kombinerede effekt af ARIMIDEX 1 mg og bisphosphonat-risedronat på ændringer fra baseline i BMD og markører for knogleresorption og -dannelse hos postmenopausale kvinder med hormonreceptor-positiv tidlig brystkræft. Alle patienter fik tilskud af calcium og D-vitamin. Efter 12 måneder blev der observeret små reduktioner i lændehvirvelsøjlens knoglemineraltæthed hos patienter, der ikke fik bisfosfonater. Bisphosphonatbehandling bevarede knogletætheden hos de fleste patienter med risiko for fraktur.
Postmenopausale kvinder med tidlig brystkræft, der er planlagt til at blive behandlet med ARIMIDEX 1mg, bør have deres knoglestatus styret i overensstemmelse med de behandlingsretningslinjer, der allerede er tilgængelige for postmenopausale kvinder med lignende risiko for skrøbelighedsfraktur.
Kolesterol
Under ATAC-studiet blev flere patienter, der fik ARIMIDEX 1 mg, rapporteret at have et forhøjet serumkolesterol sammenlignet med patienter, der fik tamoxifen (henholdsvis 9 % versus 3,5 %).
Et post-marketing-forsøg evaluerede også eventuelle potentielle virkninger af ARIMIDEX på lipidprofilen. I den primære analysepopulation for lipider (ARIMIDEX 1 mg alene) var der ingen klinisk signifikant ændring i LDL-C fra baseline til 12 måneder og HDL-C fra baseline til 12 måneder.
I den sekundære population for lipider (ARIMIDEX+risedronat) var der heller ingen klinisk signifikant ændring i LDL-C og HDL-C fra baseline til 12 måneder.
begge populationer for lipider var der ingen klinisk signifikant forskel i total kolesterol (TC) eller serum triglycerider (TG) efter 12 måneder sammenlignet med baseline.
I dette forsøg havde behandling i 12 måneder med ARIMIDEX 1 mg alene en neutral effekt på lipidprofilen. Kombinationsbehandling med ARIMIDEX og risedronat havde også en neutral effekt på lipidprofilen.
Forsøget giver bevis for, at postmenopausale kvinder med tidlig brystkræft, der er planlagt til at blive behandlet med ARIMIDEX 1mg, bør behandles ved hjælp af de nuværende retningslinjer for det nationale kolesteroluddannelsesprogram for kardiovaskulær risiko-baseret behandling af individuelle patienter med LDL-forhøjelser.
Andre bivirkninger
Patienter, der fik ARIMIDEX, havde en stigning i ledlidelser (inklusive arthritis, artrose og artralgi) sammenlignet med patienter, der fik tamoxifen. Patienter, der fik ARIMIDEX, havde en stigning i forekomsten af alle frakturer (specifikt brud på rygsøjlen, hoften og håndleddet) [315 (10%)] sammenlignet med patienter, der fik tamoxifen [209 (7%)].
Patienter, der fik ARIMIDEX 1 mg, havde en højere forekomst af karpaltunnelsyndrom [78 (2,5 %)] sammenlignet med patienter, der fik tamoxifen [22 (0,7 %)].
Vaginal blødning forekom hyppigere hos de tamoxifen-behandlede patienter i forhold til de ARIMIDEX-behandlede patienter, henholdsvis 317 (10 %) versus 167 (5 %).
Patienter, der fik ARIMIDEX, havde en lavere forekomst af hedeture, vaginal blødning, vaginalt udflåd, endometriecancer, venøse tromboemboliske hændelser og iskæmiske cerebrovaskulære hændelser sammenlignet med patienter, der fik tamoxifen.
10-års median opfølgningssikkerhedsresultater fra ATAC-forsøget
Resultaterne stemmer overens med de tidligere analyser.
Alvorlige bivirkninger var ens mellem ARIMIDEX (50 %) og tamoxifen (51 %).
- Kardiovaskulære hændelser var i overensstemmelse med de kendte sikkerhedsprofiler for ARIMIDEX og tamoxifen.
- Den kumulative forekomst af alle første frakturer (både alvorlige og ikke-alvorlige, opstået enten under eller efter behandling) var højere i ARIMIDEX-gruppen (15 %) sammenlignet med tamoxifen-gruppen (11 %). Denne øgede hyppighed af første fraktur under behandlingen fortsatte ikke i opfølgningsperioden efter behandlingen.
- Den kumulative forekomst af nye primære cancerformer var ens i ARIMIDEX 1 mg-gruppen (13,7 %) sammenlignet med tamoxifen-gruppen (13,9 %). I overensstemmelse med de tidligere analyser var endometriecancer højere i tamoxifen-gruppen (0,8 %) sammenlignet med ARIMIDEX-gruppen (0,2 %).
- Det samlede antal dødsfald (under eller uden for forsøg) var ens mellem behandlingsgrupperne. Der var flere dødsfald relateret til brystkræft i tamoxifen end i ARIMIDEX 1 mg-behandlingsgruppen.
Førstelinje terapi
Bivirkninger, der forekommer med en forekomst på mindst 5 % i begge behandlingsgrupper af forsøg 0030 og 0027 under eller inden for 2 uger efter behandlingens afslutning er vist i tabel 3.
Mindre hyppige bivirkninger rapporteret hos patienter, der fik ARIMIDEX 1 mg l mg i enten forsøg 0030 eller forsøg 0027, svarede til dem, der blev rapporteret for andenlinjesbehandling.
Baseret på resultater fra andenlinjebehandling og den etablerede sikkerhedsprofil for tamoxifen, blev forekomsten af 9 forudspecificerede kategorier af bivirkninger, der potentielt kausalt relateret til en eller begge behandlinger på grund af deres farmakologi, statistisk analyseret. Der blev ikke set signifikante forskelle mellem behandlingsgrupperne.
Second-line terapi
ARIMIDEX 1 mg blev tolereret i to kontrollerede kliniske forsøg (dvs. forsøg 0004 og 0005), hvor mindre end 3,3 % af de ARIMIDEX-behandlede patienter og 4,0 % af de megestrolacetat-behandlede patienter trak sig tilbage på grund af en bivirkning.
Den primære bivirkning, der var mere almindelig med ARIMIDEX end megestrolacetat, var diarré. Bivirkninger rapporteret hos mere end 5 % af patienterne i nogen af behandlingsgrupperne i disse to kontrollerede kliniske forsøg, uanset årsagssammenhæng, er præsenteret nedenfor:
Kroppen som helhed: Influenza syndrom; feber; nakke smerter; utilpashed; utilsigtet skade; infektion
Kardiovaskulær: Forhøjet blodtryk; tromboflebitis
Hepatisk: Gamma GT steg; SGOT steg; SGPT øget Hæmatologisk: Anæmi; leukopeni
Metabolisk og ernæringsmæssig: Alkalisk fosfatase øget; vægttab
Gennemsnitlige totalkolesterolniveauer i serum steg med 0,5 mmol/L blandt patienter, der fik ARIMIDEX. Forøgelser i LDL-kolesterol har vist sig at bidrage til disse ændringer.
Muskuloskeletale: Myalgi; artralgi; patologisk fraktur
Nervøs: Somnolens; forvirring; søvnløshed; angst; nervøsitet
Åndedræt: bihulebetændelse; bronkitis; rhinitis
Hud og vedhæng: Hårudtynding (alopeci); kløe
Urogenital: Urinvejsinfektion; brystsmerter
Hyppigheden af følgende bivirkningsgrupper, der potentielt er kausalt relateret til en eller begge behandlinger på grund af deres farmakologi, blev statistisk analyseret: vægtøgning, ødem, tromboembolisk sygdom, gastrointestinale forstyrrelser, hedeture og vaginal tørhed. Disse seks grupper, og de bivirkninger, der blev registreret i grupperne, blev defineret prospektivt. Resultaterne er vist i tabellen nedenfor.
Post-marketing oplevelse
Disse bivirkninger rapporteres frivilligt fra en population af usikker størrelse. Derfor er det ikke altid muligt at estimere deres hyppighed pålideligt eller etablere en årsagssammenhæng til lægemiddeleksponering. Følgende er blevet rapporteret efter brug af Arimidex efter godkendelse:
- Hepatobiliære hændelser, herunder stigninger i alkalisk phosphatase, alaninaminotransferase, aspartataminotransferase, gamma-GT og bilirubin; hepatitis
- Udslæt inklusive tilfælde af slimhindelidelser såsom erythema multiforme og Stevens-Johnsons syndrom
- Tilfælde af allergiske reaktioner, herunder angioødem, nældefeber og anafylaksi [se KONTRAINDIKATIONER ]
- Myalgi, triggerfinger og hypercalcæmi (med eller uden stigning i parathyreoideahormon)
DRUGSINTERAKTIONER
Tamoxifen
Samtidig administration af anastrozol og tamoxifen til brystkræftpatienter reducerede plasmakoncentrationen af anastrozol med 27 %. Samtidig administration af anastrozol og tamoxifen påvirkede dog ikke farmakokinetikken af tamoxifen eller N-desmethyltamoxifen. Ved en median opfølgning på 33 måneder viste kombinationen af ARIMIDEX og tamoxifen ikke nogen effektfordel sammenlignet med tamoxifen hos alle patienter såvel som i den hormonreceptor-positive subpopulation. Denne behandlingsarm blev afbrudt fra forsøget [se Kliniske Studier ]. Baseret på kliniske og farmakokinetiske resultater fra ATAC-studiet bør tamoxifen ikke administreres sammen med anastrozol.
Østrogen
Østrogenholdige behandlinger bør ikke anvendes sammen med ARIMIDEX 1 mg, da de kan formindske dets farmakologiske virkning.
Warfarin
en undersøgelse udført med 16 mandlige frivillige ændrede anastrozol ikke eksponeringen (målt ved Cmax og AUC) og antikoagulerende aktivitet (målt ved protrombintid, aktiveret partiel tromboplastintid og thrombintid) af både R- og S- warfarin.
Cytokrom P450 Baseret på in vitro og in vivo resultater er det usandsynligt, at samtidig administration af ARIMIDEX 1 mg vil påvirke andre lægemidler som følge af hæmning af cytokrom P450 [se KLINISK FARMAKOLOGI ].
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Iskæmiske kardiovaskulære hændelser
Hos kvinder med allerede eksisterende iskæmisk hjertesygdom blev der observeret en øget forekomst af iskæmiske kardiovaskulære hændelser med ARIMIDEX i ATAC-studiet (17 % af patienterne på ARIMIDEX 1 mg og 10 % af patienterne på tamoxifen). Overvej risici og fordele ved ARIMIDEX-behandling hos patienter med allerede eksisterende iskæmisk hjertesygdom [se BIVIRKNINGER ]
Knogleeffekter
Resultater fra ATAC-forsøgets knoglesubundersøgelse efter 12 og 24 måneder viste, at patienter, der fik ARIMIDEX, havde et gennemsnitligt fald i både lændehvirvelsøjlen og total hofteknoglemineraltæthed (BMD) sammenlignet med baseline. Patienter, der fik tamoxifen, havde en gennemsnitlig stigning i både lændehvirvelsøjlen og total hofte-BMD sammenlignet med baseline. Overvej overvågning af knoglemineraltæthed hos patienter behandlet med ARIMIDEX [se BIVIRKNINGER ].
Kolesterol
Under ATAC-studiet blev flere patienter, der fik ARIMIDEX 1 mg, rapporteret at have forhøjet serumkolesterol sammenlignet med patienter, der fik tamoxifen (henholdsvis 9 % versus 3,5 %) [se BIVIRKNINGER ].
Patientrådgivningsinformation
Se FDA godkendt patientmærkning (PATIENTINFORMATION).
Graviditet
Patienter bør informeres om, at ARIMIDEX 1 mg kan forårsage fosterskader. De bør også informeres om, at ARIMIDEX 1mg ikke er til brug hos præmenopausale kvinder; derfor, hvis de bliver gravide, skal de stoppe med at tage ARIMIDEX og straks kontakte deres læge.
Allergiske (overfølsomheds) reaktioner
Patienter bør informeres om muligheden for alvorlige allergiske reaktioner med hævelse af ansigt, læber, tunge og/eller svælg (angioødem), som kan forårsage synke- og/eller vejrtrækningsbesvær, og straks søge lægehjælp.
Iskæmiske kardiovaskulære hændelser
Patienter med allerede eksisterende iskæmisk hjertesygdom skal informeres om, at der er observeret en øget forekomst af kardiovaskulære hændelser ved brug af ARIMIDEX 1 mg sammenlignet med brug af tamoxifen. Hvis patienter har nye eller forværrede brystsmerter eller åndenød, skal de straks søge lægehjælp.
Knogleeffekter
Patienterne skal informeres om, at ARIMIDEX sænker niveauet af østrogen. Dette kan føre til et tab af mineralindholdet i knogler, hvilket kan reducere knoglestyrken. En mulig konsekvens af nedsat mineralindhold i knogler er en stigning i risikoen for brud.
Kolesterol
Patienterne skal informeres om, at et forhøjet kolesterolniveau kan ses, mens de får ARIMIDEX.
Kildren, snurren eller følelsesløshed
Patienter bør informeres om, at hvis de oplever kilden, prikken eller følelsesløshed, skal de underrette deres læge.
Tamoxifen
Patienter bør rådes til ikke at tage ARIMIDEX sammen med Tamoxifen.
Glemte doser
Informer patienterne om, at hvis de glemmer en dosis, skal de tage den, så snart de husker det. Hvis det næsten er tid til deres næste dosis, skal du springe den glemte dosis over og tage den næste regelmæssige planlagte dosis. Patienter bør ikke tage to doser på samme tid.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
En konventionel karcinogeneseundersøgelse i rotter i doser på 1,0 til 25 mg/kg/dag (ca. 10 til 243 gange den daglige maksimale anbefalede humane dosis på mg/m²-basis) indgivet ved oral sonde i op til 2 år viste en stigning i forekomst af hepatocellulært adenom og karcinom og uterine stromale polypper hos kvinder og thyreoideaadenom hos mænd ved den høje dosis. En dosisrelateret stigning blev observeret i forekomsten af ovarie- og uterinhyperplasi hos kvinder. Ved 25 mg/kg/dag var plasma-AUC0-24 timers niveauer hos rotter 110 til 125 gange højere end niveauet udvist hos postmenopausale frivillige ved den anbefalede dosis. En separat carcinogenicitetsundersøgelse i mus ved orale doser på 5 til 50 mg/kg/dag (ca. 24 til 243 gange den daglige maksimale anbefalede humane dosis på mg/m²-basis) i op til 2 år frembragte en stigning i forekomsten af benigne ovariestromale, epiteliale og granulosacelletumorer ved alle dosisniveauer. En dosisrelateret stigning i forekomsten af ovariehyperplasi blev også observeret hos hunmus. Disse ovarieforandringer anses for at være gnaverspecifikke virkninger af aromatasehæmning og er af tvivlsom betydning for mennesker. Forekomsten af lymfosarkom var øget hos mænd og kvinder ved den høje dosis. Ved 50 mg/kg/dag var plasma-AUC-niveauer i mus 35 til 40 gange højere end niveauet udvist hos postmenopausale frivillige ved den anbefalede dosis.
ARIMIDEX 1mg har ikke vist sig at være mutagent i in vitro-tests (Ames og E. coli-bakterietest, CHO-K1-genmutationsanalyse) eller klastogene hverken in vitro (kromosomafvigelser i humane lymfocytter) eller in vivo (mikronukleustest i rotter) .
Oral administration af anastrozol til hunrotter (fra 2 uger før parring til drægtighedsdag 7) gav signifikant forekomst af infertilitet og reducerede antallet af levedygtige drægtigheder ved 1 mg/kg/dag (ca. 10 gange den anbefalede humane dosis på mg/m²-basis) og 9 gange højere end AUC0-24 timer fundet hos postmenopausale frivillige ved den anbefalede dosis). Præ-implantationstab af æg eller foster blev øget ved doser lig med eller større end 0,02 mg/kg/dag (ca. en femtedel af den anbefalede humane dosis på mg/m²-basis). Genopretning af fertilitet blev observeret efter en 5-ugers ikke-doseringsperiode, som fulgte efter 3 ugers dosering. Det vides ikke, om disse virkninger observeret hos hunrotter er tegn på nedsat fertilitet hos mennesker.
Multiple-dosis undersøgelser med rotter, der fik anastrozol i 6 måneder i doser lig med eller større end 1 mg/kg/dag (som producerede plasma anastrozol Cssmax og AUC 0-24 timer, der var 19 og 9 gange højere end de respektive værdier fundet i postmenopausal frivillige i den anbefalede dosis) resulterede i hypertrofi af æggestokkene og tilstedeværelsen af follikulære cyster. Derudover blev hyperplastisk livmoder observeret i 6-måneders undersøgelser med hunhunde, der fik doser lig med eller større end 1 mg/kg/dag (som producerede plasma anastrozol Cssmax og AUC0-24 timer, der var 22 gange og 16 gange højere end de respektive værdier fundet hos postmenopausale kvinder ved den anbefalede dosis). Det vides ikke, om disse virkninger på dyrs reproduktionsorganer er forbundet med nedsat fertilitet hos præmenopausale kvinder.
Brug i specifikke populationer
Graviditet
Graviditetskategori X [se KONTRAINDIKATIONER ]
ARIMIDEX kan forårsage fosterskader, når det administreres til en gravid kvinde og giver ingen klinisk fordel for præmenopausale kvinder med brystkræft. ARIMIDEX er kontraindiceret til kvinder, der er eller kan blive gravide. I dyreforsøg forårsagede anastrozol svangerskabssvigt, øget graviditetstab og tegn på forsinket fosterudvikling. Der er ingen undersøgelser af brug af ARIMIDEX 1 mg til gravide kvinder. Hvis ARIMIDEX 1mg anvendes under graviditet, eller hvis patienten bliver gravid, mens hun får dette lægemiddel, skal patienten informeres om den potentielle fare for fosteret og den potentielle risiko for graviditetstab.
reproduktionsstudier på dyr fik gravide rotter og kaniner anastrozol under organogenese i doser lig med eller større end 1 (rotter) og 1/3 (kaniner) af den anbefalede humane dosis på mg/m²-basis. Hos begge arter krydsede anastrozol placenta, og der var øget graviditetstab (øget før- og/eller post-implantationstab, øget resorption og reduceret antal levende fostre). Hos rotter var disse virkninger dosisrelaterede, og placentavægten var signifikant øget. Føtotoksicitet, herunder forsinket fosterudvikling (dvs. ufuldstændig knogledannelse og nedsat føtal kropsvægt), forekom hos rotter ved anastrozoldoser, der producerede maksimale plasmaniveauer 19 gange højere end serumniveauer hos mennesker ved den terapeutiske dosis (AUC 0-24 timer 9 gange højere) . Hos kaniner forårsagede anastrozol graviditetssvigt ved doser lig med eller større end 16 gange den anbefalede humane dosis på mg/m²-basis [se dyretoksikologi og/eller farmakologi ].
Ammende mødre
Det vides ikke, om anastrozol udskilles i modermælk. Da mange lægemidler udskilles i modermælk og på grund af den tumorogenicitet, der er vist for anastrozol i dyreforsøg, eller potentialet for alvorlige bivirkninger hos ammende spædbørn, bør der tages en beslutning om at afbryde amningen eller at seponere lægemidlet under hensyntagen til lægemidlets betydning for moderen.
Pædiatrisk brug
Kliniske undersøgelser med pædiatriske patienter inkluderede et placebokontrolleret forsøg med pubertetsdrenge i teenagere med gynækomasti og et enkeltarms forsøg med piger med McCune-Albright syndrom og progressiv tidlig pubertet. Effekten af ARIMIDEX 1 mg til behandling af pubertal gynækomasti hos unge drenge og til behandling af tidlig pubertet hos piger med McCune-Albright syndrom er ikke blevet påvist.
Gynækomasti undersøgelse
Et randomiseret, dobbeltblindt, placebokontrolleret, multicenterstudie omfattede 80 drenge med pubertal gynækomasti i alderen 11 til 18 år. Patienterne blev randomiseret til et dagligt regime med enten ARIMIDEX 1 mg eller placebo. Efter 6 måneders behandling var der ingen statistisk signifikant forskel i procentdelen af patienter, der oplevede en ≥ 50 % reduktion i gynækomasti (primær effektivitetsanalyse). Sekundære effektivitetsanalyser (absolut ændring i brystvolumen, procentdelen af patienter, der havde nogen reduktion i det beregnede volumen af gynækomasti, opløsning af brystsmerter) var i overensstemmelse med den primære effektivitetsanalyse. Serum østradiolkoncentrationer ved behandlingsmåned 6 blev reduceret med 15,4 % i ARIMIDEX-gruppen og 4,5 % i placebogruppen.
Bivirkninger, der blev vurderet som behandlingsrelaterede af efterforskerne, forekom hos 16,3 % af de ARIMIDEX-behandlede patienter og 8,1 % af de placebo-behandlede patienter, hvor de hyppigste var acne (7 % ARIMIDEX og 2,7 % placebo) og hovedpine (7 % ARIMIDEX 1 mg og 0 % placebo); alle andre bivirkninger viste små forskelle mellem behandlingsgrupperne. En patient behandlet med ARIMIDEX 1 mg afbrød forsøget på grund af testikelforstørrelse. Den gennemsnitlige baseline-subtraherede ændring i testikelvolumen efter 6 måneders behandling var + 6,6 ± 7,9 cm³ hos de ARIMIDEX-behandlede patienter og + 5,2 ± 8,0 cm³ i placebogruppen.
McCune-Albright syndrom undersøgelse
Et multicenter, enkelt-arm, åbent studie blev udført i 28 piger med McCune-Albright syndrom og progressiv tidlig pubertet i alderen 2 til
Fem patienter (18%) oplevede bivirkninger, der blev anset for at være muligvis relateret til ARIMIDEX. Disse var kvalme, akne, smerter i en ekstremitet, øget alanintransaminase og aspartattransaminase og allergisk dermatitis.
Farmakokinetik hos pædiatriske patienter
Efter 1 mg én gang daglig multipel administration til pædiatriske patienter var den gennemsnitlige tid til at nå den maksimale anastrozolkoncentration 1 time. De gennemsnitlige (område) dispositionsparametre for anastrozol hos pædiatriske patienter blev beskrevet ved en CL/F på 1,54 L/t (0,77-4,53 L/t) og V/F på 98,4 L (50,7-330,0 L). Den terminale eliminationshalveringstid var 46,8 timer, hvilket svarede til det, der blev observeret hos postmenopausale kvinder behandlet med anastrozol mod brystkræft. Baseret på en populationsfarmakokinetisk analyse var anastrozols farmakokinetik ens hos drenge med pubertal gynækomasti og piger med McCune-Albright syndrom.
Geriatrisk brug
undersøgelserne 0030 og 0027 var omkring 50 % af patienterne 65 år eller ældre. Patienter ≥ 65 år havde moderat bedre tumorrespons og tid til tumorprogression end patienter
I ATAC-studiet var 45 % af patienterne 65 år eller ældre. Effekten af ARIMIDEX 1 mg sammenlignet med tamoxifen hos patienter, der var 65 år eller ældre (N=1413 for ARIMIDEX og N=1410 for tamoxifen, hazard ratio for sygdomsfri overlevelse var 0,93 [95 % CI: 0,80, 1,08]) mindre end effekt observeret hos patienter under 65 år (N=1712 for ARIMIDEX og N=1706 for tamoxifen, hazard ratio for sygdomsfri overlevelse var 0,79 [95 % CI: 0,67, 0,94]).
Anastrozols farmakokinetik påvirkes ikke af alder.
Nedsat nyrefunktion
Da kun ca. 10 % af anastrozol udskilles uændret i urinen, påvirker nyrefunktionsnedsættelsen ikke den totale kropsclearance. Dosisjustering hos patienter med nedsat nyrefunktion er ikke nødvendig [se DOSERING OG ADMINISTRATION og KLINISK FARMAKOLOGI ].
Nedsat leverfunktion
Plasmaanastrozolkoncentrationerne hos forsøgspersoner med levercirrhose var inden for det koncentrationsområde, der ses hos normale forsøgspersoner i alle kliniske forsøg. Derfor er dosisjustering heller ikke nødvendig hos patienter med stabil levercirrhose. ARIMIDEX er ikke blevet undersøgt hos patienter med svært nedsat leverfunktion [se DOSERING OG ADMINISTRATION og KLINISK FARMAKOLOGI ].
OVERDOSIS
Kliniske forsøg er blevet udført med ARIMIDEX, op til 60 mg i en enkelt dosis givet til raske mandlige frivillige og op til 10 mg dagligt givet til postmenopausale kvinder med fremskreden brystkræft; disse doser blev tolereret. En enkelt dosis ARIMIDEX 1 mg, der resulterer i livstruende symptomer, er ikke blevet fastlagt. Der er ingen specifik modgift mod overdosering, og behandlingen skal være symptomatisk. Ved håndtering af en overdosis skal du overveje, at flere midler kan være blevet taget. Opkastning kan fremkaldes, hvis patienten er opmærksom. Dialyse kan være nyttig, fordi ARIMIDEX ikke er stærkt proteinbundet. Generel understøttende behandling, herunder hyppig overvågning af vitale tegn og tæt observation af patienten, er indiceret.
KONTRAINDIKATIONER
Graviditet og præmenopausale kvinder
ARIMIDEX 1mg kan forårsage fosterskader, når det administreres til en gravid kvinde og giver ingen klinisk fordel for præmenopausale kvinder med brystkræft. ARIMIDEX 1mg er kontraindiceret til kvinder, der er eller kan blive gravide. Der er ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder, der bruger ARIMIDEX. Hvis ARIMIDEX 1mg anvendes under graviditet, eller hvis patienten bliver gravid, mens du tager dette lægemiddel, skal patienten informeres om den potentielle fare for et foster eller den potentielle risiko for tab af graviditeten [se Brug i specifikke populationer ].
Overfølsomhed
ARIMIDEX 1mg er kontraindiceret til enhver patient, der har vist en overfølsomhedsreaktion over for lægemidlet eller over for et eller flere af hjælpestofferne. Observerede reaktioner omfatter anafylaksi, angioødem og nældefeber [se BIVIRKNINGER ]
KLINISK FARMAKOLOGI
Handlingsmekanisme
Væksten af mange brystkræftformer stimuleres eller vedligeholdes af østrogener.
Hos postmenopausale kvinder er østrogener hovedsageligt afledt af virkningen af aromatase-enzymet, som omdanner binyreandrogener (primært androstenedion og testosteron) til østron og østradiol. Undertrykkelsen af østrogenbiosyntese i perifere væv og i selve cancervævet kan derfor opnås ved specifikt at hæmme aromatase-enzymet.
Anastrozol er en selektiv ikke-steroid aromatasehæmmer. Det sænker serumøstradiolkoncentrationerne signifikant og har ingen påviselig effekt på dannelsen af binyrekortikosteroider eller aldosteron.
Farmakodynamik
Virkning på østradiol
Gennemsnitlige serumkoncentrationer af østradiol blev evalueret i flere daglige doseringsforsøg med 0,5, 1, 3, 5 og 10 mg ARIMIDEX hos postmenopausale kvinder med fremskreden brystkræft. Klinisk signifikant suppression af serumøstradiol blev set med alle doser. Doser på 1 mg og højere resulterede i suppression af gennemsnitlige serumkoncentrationer af østradiol til den nedre detektionsgrænse (3,7 pmol/L). Den anbefalede daglige dosis, ARIMIDEX 1 mg, reducerede østradiol med ca. 70 % inden for 24 timer og med ca. 80 % efter 14 dages daglig dosering. Undertrykkelse af serumøstradiol blev opretholdt i op til 6 dage efter ophør af daglig dosering med ARIMIDEX 1 mg.
Effekten af ARIMIDEX 1 mg hos præmenopausale kvinder med tidlig eller fremskreden brystkræft er ikke blevet undersøgt. Fordi aromatisering af binyreandrogener ikke er en signifikant kilde til østradiol hos præmenopausale kvinder, forventes ARIMIDEX ikke at sænke østradiolniveauet hos præmenopausale kvinder.
Effekt på kortikosteroider
flere daglige doseringsforsøg med 3, 5 og 10 mg blev anastrozols selektivitet vurderet ved at undersøge virkninger på kortikosteroidsyntese. For alle doser påvirkede anastrozol ikke cortisol- eller aldosteronsekretionen ved baseline eller som respons på ACTH. Ingen glukokortikoid- eller mineralkortikoid-substitutionsbehandling er nødvendig med anastrozol.
Andre endokrine effekter
I flere daglige doseringsforsøg med 5 og 10 mg blev thyroidstimulerende hormon (TSH) målt; der var ingen stigning i TSH under administration af ARIMIDEX. ARIMIDEX har ikke direkte progestogen, androgen eller østrogen aktivitet hos dyr, men forstyrrer de cirkulerende niveauer af progesteron, androgener og østrogener.
Farmakokinetik
Absorption
Hæmning af aromataseaktivitet skyldes primært anastrozol, moderlægemidlet. Absorptionen af anastrozol er hurtig, og maksimale plasmakoncentrationer forekommer typisk inden for 2 timer efter dosering under fastende forhold. Undersøgelser med radioaktivt mærket lægemiddel har vist, at oralt administreret anastrozol absorberes godt i det systemiske kredsløb. Mad reducerer hastigheden, men ikke det samlede omfang af anastrozolabsorption. Den gennemsnitlige C max for anastrozol faldt med 16 %, og median Tmax blev forsinket fra 2 til 5 timer, når anastrozol blev administreret 30 minutter efter mad. Farmakokinetikken for anastrozol er lineær over dosisområdet 1 til 20 mg og ændres ikke ved gentagen dosering. Farmakokinetikken for anastrozol var ens hos patienter og raske frivillige.
Fordeling
Steady-state plasmaniveauer er ca. 3-4 gange højere end niveauer observeret efter en enkelt dosis ARIMIDEX. Plasmakoncentrationer nærmer sig steady-state niveauer ved ca. 7 dage med dosering én gang dagligt. Anastrozol er 40 % bundet til plasmaproteiner i det terapeutiske område.
Metabolisme
Metabolisme af anastrozol sker ved N-dealkylering, hydroxylering og glucuronidering. Tre metabolitter af anastrozol (triazol, et glucuronidkonjugat af hydroxyanastrozol og et glucuronidkonjugat af anastrozol selv) er blevet identificeret i humant plasma og urin. Den vigtigste cirkulerende metabolit af anastrozol, triazol, mangler farmakologisk aktivitet.
Anastrozol hæmmede reaktioner katalyseret af cytochrom P450 1A2, 2C8/9 og 3A4 in vitro med Ki-værdier, som var ca. 30 gange højere end de gennemsnitlige steady-state Cmax-værdier observeret efter en daglig dosis på 1 mg. Anastrozol havde ingen hæmmende effekt på reaktioner katalyseret af cytochrom P450 2A6 eller 2D6 in vitro. Administration af en enkelt 30 mg/kg eller flere 10 mg/kg doser af anastrozol til raske forsøgspersoner havde ingen effekt på clearance af antipyrin eller uringenvinding af antipyrin metabolitter.
Udskillelse
85 procent af radioaktivt mærket anastrozol blev genfundet i fæces og urin. Hepatisk metabolisme tegner sig for ca. 85 % af anastrozol-elimineringen. Renal elimination tegner sig for ca. 10 % af den totale clearance. Den gennemsnitlige eliminationshalveringstid for anastrozol er 50 timer.
Effekt af køn og alder
Anastrozols farmakokinetik er blevet undersøgt hos postmenopausale kvindelige frivillige og patienter med brystkræft. Der blev ikke set nogen aldersrelaterede effekter i området 80 år.
Effekt af Race
Serumniveauerne for østradiol og østronsulfat var ens for japanske og kaukasiske postmenopausale kvinder, som fik 1 mg anastrozol dagligt i 16 dage. Anastrozols gennemsnitlige steady-state minimum plasmakoncentration hos kaukasiske og japanske postmenopausale kvinder var henholdsvis 25,7 og 30,4 ng/ml.
Virkning af nedsat nyrefunktion
Anastrozols farmakokinetik er blevet undersøgt hos personer med nedsat nyrefunktion. Anastrozol-nyreclearance faldt proportionalt med kreatininclearance og var ca. 50 % lavere hos frivillige med svært nedsat nyrefunktion (kreatininclearance DOSERING OG ADMINISTRATION og Brug i specifikke populationer ].
Virkning af nedsat leverfunktion
Anastrozols farmakokinetik er blevet undersøgt hos personer med levercirrose relateret til alkoholmisbrug. Den tilsyneladende orale clearance (CL/F) af anastrozol var ca. 30 % lavere hos personer med stabil levercirrhose end hos kontrolpersoner med normal leverfunktion. Disse plasmakoncentrationer var dog stadig med det interval af værdier, der blev observeret hos normale forsøgspersoner. Virkningen af alvorlig leverinsufficiens blev ikke undersøgt. Ingen dosisjustering er nødvendig for stabil levercirrhose [se DOSERING OG ADMINISTRATION og Brug i specifikke populationer ].
Dyretoksikologi og/eller farmakologi
Reproduktiv toksikologi
Anastrozol har vist sig at krydse placenta efter oral administration af 0,1 mg/kg til rotter og kaniner (henholdsvis ca. 1 og 1,9 gange den anbefalede humane dosis på mg/m²-basis). Undersøgelser med både rotter og kaniner med doser lig med eller større end henholdsvis 0,1 og 0,02 mg/kg/dag (henholdsvis ca. 1 og 1/3, den anbefalede humane dosis på mg/m²-basis), administreret i perioden med organogenese viste, at anastrozol øgede graviditetstab (øget tab før og/eller efter implantation, øget resorption og reduceret antal levende fostre); effekter var dosisrelaterede hos rotter. Placentalvægten var signifikant øget hos rotter ved doser på 0,1 mg/kg/dag eller mere.
Tegn på føtotoksicitet, herunder forsinket fosterudvikling (dvs. ufuldstændig knogledannelse og nedsat føtal kropsvægt), blev observeret hos rotter, der fik doser på 1 mg/kg/dag (som producerede plasmaanastrozol Cssmax og AUC 0-24 timer, der var 19 gange og 9 gange højere end de respektive værdier fundet hos postmenopausale frivillige ved den anbefalede dosis). Der var ingen tegn på teratogenicitet hos rotter, der fik doser på op til 1,0 mg/kg/dag. Hos kaniner forårsagede anastrozol graviditetssvigt ved doser lig med eller større end 1,0 mg/kg/dag (ca. 16 gange den anbefalede humane dosis på mg/m²-basis); der var ingen tegn på teratogenicitet hos kaniner, der fik 0,2 mg/kg/dag (ca. 3 gange den anbefalede humane dosis på mg/m²-basis).
Kliniske Studier
Adjuverende behandling af brystkræft hos postmenopausale kvinder
Et multicenter, dobbeltblindet forsøg (ATAC) randomiserede 9.366 postmenopausale kvinder med operabel brystkræft til adjuverende behandling med ARIMIDEX 1 mg dagligt, tamoxifen 20 mg dagligt eller en kombination af de to behandlinger i fem år eller indtil tilbagevenden af sygdommen.
Det primære endepunkt for forsøget var sygdomsfri overlevelse (dvs. tid til forekomst af fjernt eller lokalt tilbagefald eller kontralateral brystkræft eller død af enhver årsag). Sekundære endepunkter i forsøget omfattede fjern sygdomsfri overlevelse, forekomsten af kontralateral brystkræft og samlet overlevelse. Ved en median opfølgning på 33 måneder viste kombinationen af ARIMIDEX og tamoxifen ingen effektfordel sammenlignet med tamoxifen hos alle patienter såvel som i den hormonreceptor-positive subpopulation. Denne behandlingsarm blev afbrudt fra forsøget. Baseret på kliniske og farmakokinetiske resultater fra ATAC-studiet bør tamoxifen ikke administreres sammen med anastrozol [se DRUGSINTERAKTIONER ].
Demografiske og andre baseline-karakteristika var ens blandt de tre behandlingsgrupper (se tabel 7).
Patienter i de to monoterapiarme i ATAC-studiet blev behandlet i en median på 60 måneder (5 år) og fulgt i en median på 68 måneder. Sygdomsfri overlevelse i intention-to-treat-populationen var statistisk signifikant forbedret [Hazard Ratio (HR) = 0,87, 95 % CI: 0,78, 0,97, p=0,0127] i ARIMIDEX-armen sammenlignet med tamoxifen-armen. I den hormonreceptor-positive subpopulation, der repræsenterer omkring 84 % af forsøgspatienterne, var sygdomsfri overlevelse også statistisk signifikant forbedret (HR = 0,83, 95 % CI: 0,73, 0,94, p=0,0049) i ARIMIDEX 1 mg-armen sammenlignet med tamoxifen arm.
Figur 1: Sygdomsfri overlevelse Kaplan Meier overlevelseskurve for alle patienter randomiseret til ARIMIDEX 1mg eller Tamoxifen monoterapi i ATAC-studiet (Intent-to-Treat) 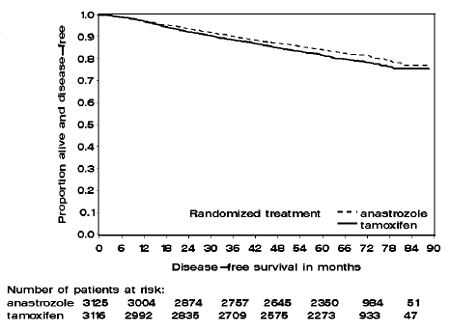
Figur 2: Sygdomsfri overlevelse for hormonreceptorpositiv subpopulation af patienter randomiseret til ARIMIDEX eller Tamoxifen monoterapi i ATAC-forsøget 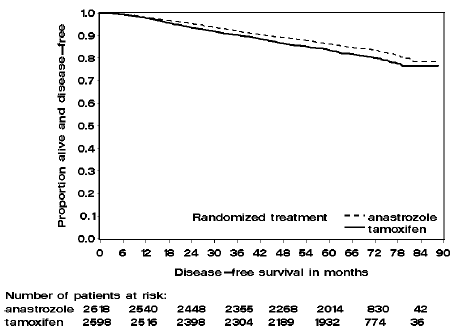
Overlevelsesdata med 68 måneders opfølgning er vist i tabel 9.
I gruppen af patienter, som havde tidligere adjuverende kemoterapi (N=698 for ARIMIDEX 1 mg og N=647 for tamoxifen), var hazard ratio for sygdomsfri overlevelse 0,91 (95 % CI: 0,73 til 1,13) i ARIMIDEX-armen sammenlignet med tamoxifenarmen.
Hyppigheden af individuelle hændelser i intention-to-treat-populationen og den hormonreceptor-positive subpopulation er beskrevet i tabel 8.
En oversigt over undersøgelsens effektivitetsresultater findes i tabel 9.
10-års median opfølgning Effektresultater fra ATAC-forsøget
I en efterfølgende analyse af ATAC-studiet blev patienter i de to monoterapiarme fulgt i median 120 måneder (10 år). Patienterne modtog undersøgelsesbehandling i en median på 60 måneder (5 år) (se tabel 10).
Figur 3: Sygdomsfri overlevelse Kaplan Meier overlevelseskurve for alle patienter randomiseret til ARIMIDEX eller Tamoxifen monoterapi i ATAC-forsøget (Intent-to-Treat)a 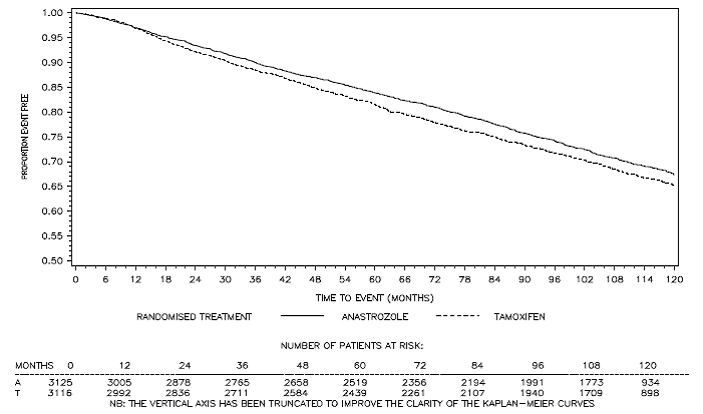
a Andelen af patienter med 120 måneders opfølgning var 29,4 %.
Figur 4: Sygdomsfri overlevelse for hormonreceptorpositiv subpopulation af patienter randomiseret til ARIMIDEX 1 mg eller Tamoxifen monoterapi i ATAC-forsøget 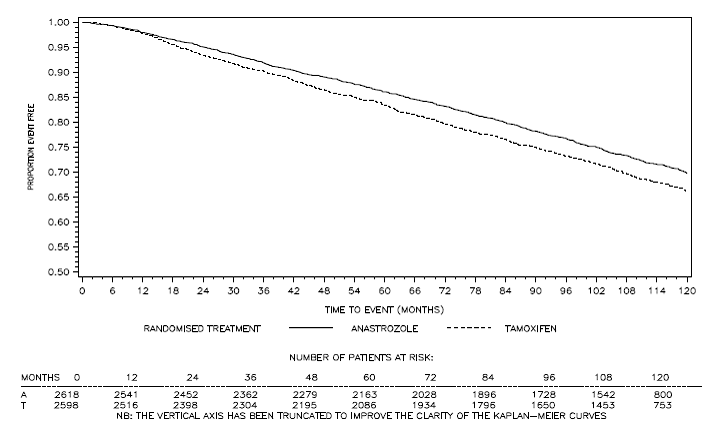
bAndelen af patienter med 120 måneders opfølgning var 29,8 %.
Førstelinjeterapi hos postmenopausale kvinder med avanceret brystkræft
To dobbeltblindede, kontrollerede kliniske undersøgelser af lignende design (0030, en nordamerikansk undersøgelse og 0027, en overvejende europæisk undersøgelse) blev udført for at vurdere effektiviteten af ARIMIDEX 1 mg sammenlignet med tamoxifen som førstelinjebehandling for hormonreceptorpositiv eller hormonreceptor ukendt lokalt fremskreden eller metastatisk brystkræft hos postmenopausale kvinder. I alt 1021 patienter mellem 30 og 92 år blev randomiseret til at modtage forsøgsbehandling. Patienterne blev randomiseret til at modtage 1 mg ARIMIDEX 1 mg én gang dagligt eller 20 mg tamoxifen én gang dagligt. De primære endepunkter for begge forsøg var tid til tumorprogression, objektiv tumorresponsrate og sikkerhed.
Demografi og andre baseline-karakteristika, herunder patienter, der havde målbar og ingen målbar sygdom, patienter, der fik tidligere adjuverende terapi, stedet for metastatisk sygdom og etnisk oprindelse var ens for de to behandlingsgrupper for begge forsøg. Følgende tabel opsummerer hormonreceptorstatus ved indgang for alle randomiserede patienter i forsøg 0030 og 0027.
For de primære endepunkter viste forsøg 0030, at ARIMIDEX havde en statistisk signifikant fordel i forhold til tamoxifen (p=0,006) med hensyn til tid til tumorprogression; objektive tumorresponsrater var ens for ARIMIDEX 1 mg og tamoxifen. Forsøg 0027 viste, at ARIMIDEX 1 mg og tamoxifen havde lignende objektive tumorresponsrater og tid til tumorprogression (se tabel 12 og figur 5 og 6).
Tabel 12 nedenfor opsummerer resultaterne af forsøg 0030 og forsøg 0027 for de primære effektmål.
Figur 5: Kaplan-Meier sandsynlighed for tid til sygdomsprogression for alle randomiserede patienter (intent-to-treat) i forsøg 0030 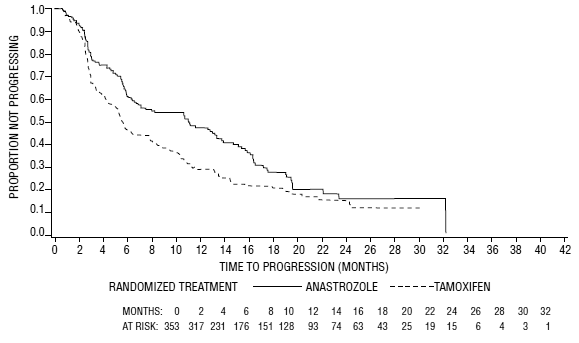
Figur 6: Kaplan-Meier sandsynlighed for tid til progression for alle randomiserede patienter (intent-to-treat) i forsøg 0027 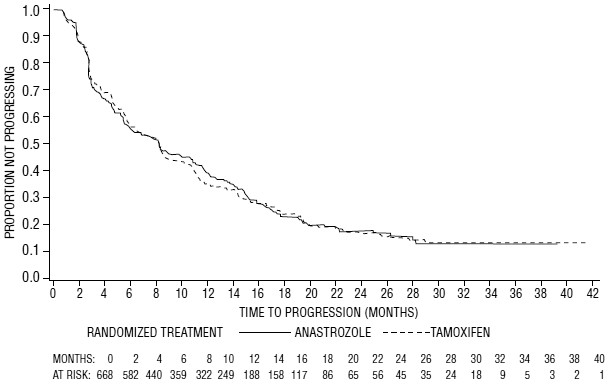
Resultater fra de sekundære endepunkter understøttede resultaterne af de primære effektmål. Der var for få dødsfald på tværs af behandlingsgrupper i begge forsøg til at drage konklusioner om de samlede overlevelsesforskelle.
Second-line terapi hos postmenopausale kvinder med avanceret brystkræft, som havde sygdomsprogression efter tamoxifenterapi
Anastrozol blev undersøgt i to kontrollerede kliniske forsøg (0004, en nordamerikansk undersøgelse; 0005, en overvejende europæisk undersøgelse) hos postmenopausale kvinder med fremskreden brystkræft, som havde sygdomsprogression efter tamoxifen-behandling for enten fremskreden eller tidlig brystkræft. Nogle af patienterne havde også tidligere fået cellegiftbehandling. De fleste patienter var ER-positive; en mindre fraktion var ER-ukendte eller ER-negative; de ER-negative patienter var kun kvalificerede, hvis de havde haft en positiv respons på tamoxifen. Kvalificerede patienter med målbar og ikke-målbar sygdom blev randomiseret til at modtage enten en enkelt daglig dosis på 1 mg eller 10 mg ARIMIDEX eller megestrolacetat 40 mg fire gange dagligt. Studierne var dobbeltblindede med hensyn til ARIMIDEX. Tid til progression og objektiv respons (kun patienter med målbar sygdom kunne betragtes som partielle respondere) var de primære effektvariabler. Objektive svarprocenter blev beregnet ud fra Union Internationale Contre le Cancer (UICC) kriterier. Hyppigheden af langvarig (mere end 24 uger) stabil sygdom, hastigheden af progression og overlevelse blev også beregnet.
Begge forsøg omfattede over 375 patienter; demografi og andre baseline-karakteristika var ens for de tre behandlingsgrupper i hvert forsøg. Patienter i 0005-studiet havde reageret bedre på tidligere behandling med tamoxifen. Af de indmeldte patienter, som tidligere havde haft tamoxifenbehandling for fremskreden sygdom (58 % i forsøg 0004; 57 % i forsøg 0005), blev 18 % af disse patienter i forsøg 0004 og 42 % i forsøg 0005 rapporteret af den primære investigator at have reageret. I forsøg 0004 var 81 % af patienterne ER-positive, 13 % var ER-ukendte og 6 % var ER-negative. I forsøg 0005 var 58 % af patienterne ER-positive, 37 % var ER-ukendte og 5 % var ER-negative. I forsøg 0004 havde 62 % af patienterne målbar sygdom sammenlignet med 79 % i forsøg 0005. Stederne for metastatisk sygdom var ens blandt behandlingsgrupperne for hvert forsøg. I gennemsnit havde 40 % af patienterne bløddelsmetastaser; 60 % havde knoglemetastaser; og 40 % havde viscerale (15 % lever) metastaser.
Effektresultaterne fra de to undersøgelser lignede som vist i tabel 13. I begge undersøgelser var der ingen signifikante forskelle mellem behandlingsarme med hensyn til nogen af de effektparametre, der er anført i tabellen nedenfor.
Når data fra de to kontrollerede forsøg samles, var de objektive responsrater og mediantider til progression og død ens for patienter randomiseret til ARIMIDEX 1 mg og megestrolacetat. Der er i disse data ingen indikation af, at ARIMIDEX 10 mg er bedre end ARIMIDEX 1 mg.
PATIENTOPLYSNINGER
ARIMIDEX® A-rim-eh-dex (anastrozol) tabletter til oral administration
Hvad er den vigtigste information, jeg bør vide om ARIMIDEX?
ARIMIDEX kan forårsage alvorlige bivirkninger, herunder:
- hjerte sygdom. Kvinder med tidlig brystkræft, som har en historie med blokering i deres hjertearterier (iskæmisk hjertesygdom), og som tager ARIMIDEX 1 mg, kan have en stigning i symptomer på nedsat blodgennemstrømning til deres hjerte sammenlignet med lignende kvinder, der tager tamoxifen.
Få lægehjælp med det samme, hvis du får nye eller forværrede brystsmerter eller åndenød under behandling med ARIMIDEX.
Hvad er ARIMIDEX?
ARIMIDEX 1mg er en receptpligtig medicin, der bruges til kvinder efter overgangsalderen ("livets forandring") til:
- behandling af tidlig brystkræft
- efter operationen
- hos kvinder, hvis brystkræft er hormonreceptor-positiv
- den første behandling af brystkræft, der har spredt sig til nærliggende væv eller lymfeknuder (lokalt fremskreden) eller har spredt sig til andre dele af kroppen (metastatisk), hos kvinder, hvis brystkræft er hormonreceptor-positiv, eller hormonreceptorerne ikke er kendte
- behandling af fremskreden brystkræft, hvis kræften er vokset, eller sygdommen har spredt sig efter tamoxifenbehandling
ARIMIDEX 1mg virker ikke hos kvinder med brystkræft, som ikke har været i overgangsalderen (præmenopausale kvinder).
Hvem bør ikke tage ARIMIDEX?
Tag ikke ARIMIDEX 1 mg, hvis du:
- er gravid eller kan blive gravid. ARIMIDEX kan skade dit ufødte barn. Hvis du bliver gravid, mens du tager ARIMIDEX, skal du straks fortælle det til din læge.
- ikke har været i overgangsalderen (er præmenopausale)
- har haft en alvorlig allergisk reaktion over for anastrozol eller et af indholdsstofferne i ARIMIDEX. Se slutningen af denne indlægsseddel for en komplet liste over ingredienser i ARIMIDEX. Symptomer på en alvorlig allergisk reaktion på ARIMIDEX omfatter: hævelse af ansigt, læber, tunge eller svælg, problemer med at trække vejret eller synke, nældefeber og kløe.
Hvad skal jeg fortælle min læge, før jeg tager ARIMIDEX 1mg?
Inden du tager ARIMIDEX, skal du fortælle det til din læge, hvis du:
- ikke har været i overgangsalderen. Tal med din læge, hvis du ikke er sikker.
- har eller haft et hjerteproblem
- er blevet fortalt, at du har knogleudtynding eller svaghed (osteoporose)
- har højt kolesteroltal
- har andre medicinske tilstande
- er gravid eller planlægger at blive gravid. ARIMIDEX kan skade dit ufødte barn. Se "Hvem bør ikke tage ARIMIDEX?"
- ammer eller planlægger at amme. Det vides ikke, om ARIMIDEX udskilles i modermælken. Du og din læge bør beslutte, om du vil tage ARIMIDEX 1 mg eller amme. Du bør ikke gøre begge dele.
Fortæl din læge om al den medicin du tager, herunder receptpligtig og håndkøbsmedicin, vitaminer og naturlægemidler. Fortæl det især din læge, hvis du tager:
- tamoxifen. Du bør ikke tage ARIMIDEX hvis du tager tamoxifen. Hvis du tager ARIMIDEX 1mg sammen med tamoxifen, kan det sænke mængden af ARIMIDEX 1mg i dit blod og kan forårsage, at ARIMIDEX 1mg ikke virker så godt.
- Medicin, der indeholder østrogen. ARIMIDEX 1mg virker muligvis ikke, hvis det tages sammen med nogen af disse lægemidler:
- hormonbehandling
- p-piller
- østrogen cremer
- vaginale ringe
- vaginale stikpiller
Kend den medicin du tager. Hold en liste over dem for at vise din læge og apotek, når du får en ny medicin.
Hvordan skal jeg tage ARIMIDEX?
- Tag ARIMIDEX nøjagtigt som din læge fortæller dig at tage det.
- Fortsæt med at tage ARIMIDEX, indtil din læge fortæller dig, at du skal stoppe.
- ARIMIDEX 1 mg kan tages med eller uden mad.
- Hvis du glemmer en dosis, skal du tage den, så snart du husker det. Hvis det næsten er tid til din næste dosis, skal du springe den glemte dosis over. Tag din næste regelmæssige planlagte dosis. Tag ikke to doser på samme tid.
Hvis du tager for meget ARIMIDEX 1 mg, skal du straks kontakte din læge eller gå til den nærmeste skadestue.
Hvad er de mulige bivirkninger af ARIMIDEX?
ARIMIDEX kan forårsage alvorlige bivirkninger, herunder:
- Se "Hvad er den vigtigste information, jeg bør vide om ARIMIDEX?"
- knogleudtynding eller svaghed (osteoporose). ARIMIDEX 1mg sænker østrogen i din krop, hvilket kan få dine knogler til at blive tyndere og svagere. Dette kan øge din risiko for brud, især i din rygsøjle, hofte og håndled. Din læge kan bestille en knoglemineraltæthedstest
- før du starter og under behandlingen med ARIMIDEX for at kontrollere dig for knogleforandringer.
- forhøjet kolesterol i blodet (fedt i blodet). Din læge kan tage blodprøver for at kontrollere dit kolesterol, mens du tager ARIMIDEX.
- hudreaktioner. Stop med at tage ARIMIDEX 1mg og kontakt din læge med det samme, hvis du får hudlæsioner, sår eller blærer.
- alvorlige allergiske reaktioner. Få lægehjælp med det samme, hvis du får:
- hævelse af dit ansigt, læber, tunge eller hals
- problemer med at synke eller trække vejret
- leverproblemer. ARIMIDEX 1mg kan forårsage betændelse i din lever og ændringer i leverfunktionsblodprøver. Din læge kan tjekke dig for dette. Stop med at tage ARIMIDEX 1mg og ring til din læge med det samme hvis du har nogle af disse tegn eller symptomer på et leverproblem:
- en generel følelse af ikke at have det godt
- gulfarvning af din hud eller det hvide i dine øjne
- smerter i højre side af dit maveområde (mave)
Almindelige bivirkninger hos kvinder, der tager ARIMIDEX 1mg omfatter:
- hedeture
- svaghed
- ledsmerter
- ledsmerter, stivhed eller hævelse (gigt)
- smerte
- ondt i halsen
- højt blodtryk
- depression
- kvalme og opkast
- udslæt
- rygsmerte
- søvnproblemer
- knoglesmerter
- hovedpine
- hævelse af dine ben, ankler eller fødder
- øget hoste
- stakåndet
- ophobning af lymfevæske i vævene i din berørte arm (lymfødem)
ARIMIDEX kan også få dig til at få kildren, prikken eller følelsesløshed i din hud.
Fortæl det til din læge, hvis du har en bivirkning, som generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af ARIMIDEX. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare ARIMIDEX 1mg?
- Opbevar ARIMIDEX 1mg ved stuetemperatur mellem 68°F til 77°F (20°C til 25°C).
Opbevar ARIMIDEX og al medicin utilgængeligt for børn.
Generel information om sikker og effektiv brug af ARIMIDEX.
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en patientinformationsfolder. Tag ikke ARIMIDEX 1 mg til en tilstand, som det ikke er ordineret til. Giv ikke ARIMIDEX til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Hvis du vil have mere information, så tal med din læge. Du kan bede din apoteker eller læge om oplysninger om ARIMIDEX, som er skrevet til sundhedspersonale. For mere information ring 1-866-992-9276 eller gå til www.ARIMIDEX.com.
Hvad er ingredienserne i ARIMIDEX?
Aktiv ingrediens: anastrozol
Inaktive ingredienser: lactose, magnesiumstearat, hydroxypropylmethylcellulose, polyethylenglycol, povidon, natriumstivelsesglycolat og titaniumdioxid.
