Ponstel 250mg, 500mg Mefenamic Acid Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
PONSTEL® (mefenaminsyre) Kapsler, USP 250 mg
Kardiovaskulær risiko
- NSAID'er kan forårsage en øget risiko for alvorlige kardiovaskulære trombotiske hændelser, myokardieinfarkt og slagtilfælde, som kan være dødelige. Denne risiko kan stige med varigheden af brugen. Patienter med hjerte-kar-sygdomme eller risikofaktorer for hjerte-kar-sygdomme kan have større risiko (se ADVARSLER ).
- PONSTEL® (mefenaminsyre) er kontraindiceret til behandling af perioperative smerter i forbindelse med koronararterie bypass-operation (CABG) (se ADVARSLER ).
Gastrointestinal risiko
- NSAID'er forårsager en øget risiko for alvorlige gastrointestinale bivirkninger, herunder blødning, ulceration og perforering af maven eller tarmene, som kan være dødelige. Disse hændelser kan forekomme når som helst under brug og uden advarselssymptomer. Ældre patienter har større risiko for alvorlige gastrointestinale hændelser (se ADVARSLER ).
BESKRIVELSE
Ponstel® (mefenaminsyre) er medlem af fenamatgruppen af ikke-steroide antiinflammatoriske lægemidler (NSAID'er). Hver blåbåndet, elfenbenskapsel indeholder 250 mg mefenaminsyre til oral administration. Mefenaminsyre er et hvidt til gråhvidt, lugtfrit, mikrokrystallinsk pulver med et smeltepunkt på 230°-231°C og en vandopløselighed på 0,004% ved pH 7,1. Det kemiske navn er N-2,3-xylylanthranilsyre. Molekylvægten er 241,29. Dens molekylære formel er C15H15NO2, og strukturformlen for mefenaminsyre er:
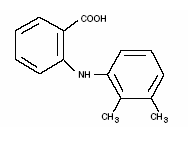
Hver kapsel indeholder også laktose, NF. Kapselskallen og/eller båndet indeholder citronsyre, USP; D&C gul nr. 10; FD&C blå nr. 1; FD&C rød nr. 3; FD&C gul nr. 6; gelatine, NF; glycerolmonooleat; siliciumdioxid, NF; natriumbenzoat, NF; natriumlaurylsulfat, NF; titaniumdioxid, USP.
INDIKATIONER
Overvej omhyggeligt de potentielle fordele og risici ved PONSTEL (mefenaminsyre) og andre behandlingsmuligheder, før du beslutter dig for at bruge PONSTEL (mefenaminsyre). Brug den laveste effektive dosis til den korteste varighed i overensstemmelse med individuelle patientbehandlingsmål (se ADVARSLER ).
PONSTEL (mefenaminsyre) er indiceret:
- Til lindring af milde til moderate smerter hos patienter = 14 år, når behandlingen ikke vil overstige en uge (7 dage).
- Til behandling af primær dysmenoré.
DOSERING OG ADMINISTRATION
Overvej omhyggeligt de potentielle fordele og risici ved PONSTEL (mefenaminsyre) og andre behandlingsmuligheder, før du beslutter dig for at bruge PONSTEL (mefenaminsyre). Brug den laveste effektive dosis til den korteste varighed i overensstemmelse med individuelle patientbehandlingsmål (se ADVARSLER ).
Efter observation af respons på initial behandling med PONSTEL (mefenaminsyre), bør dosis og frekvens justeres, så den passer til den enkelte patients behov.
Til lindring af akutte smerter hos voksne og unge =14 år er den anbefalede dosis 500 mg som startdosis efterfulgt af 250 mg hver 6. time efter behov, normalt ikke over en uge.4
Til behandling af primær dysmenoré er den anbefalede dosis 500 mg som en startdosis efterfulgt af 250 mg hver 6. time, givet oralt, startende med begyndende blødning og associerede symptomer. Kliniske undersøgelser indikerer, at effektiv behandling kan påbegyndes med starten af menstruationen og ikke bør være nødvendig i mere end 2 til 3 dage.5
HVORDAN LEVERET
Ponstel (mefenaminsyre) fås som 250 mg blåbåndede, elfenbenskapsler, præget med "FHPC 400" og "PONSTEL® (mefenaminsyre)".
BIVIRKNINGER
Hos patienter, der tager Ponstel (mefenaminsyre) eller andre NSAID'er, er de hyppigst rapporterede bivirkninger, der forekommer hos ca. 1-10 % af patienterne:
Mave-tarm-oplevelser, herunder - mavesmerter, forstoppelse, diarré, dyspepsi, flatulens, kraftig blødning/perforation, halsbrand, kvalme, mave-/duodenalsår, opkastning, unormal nyrefunktion, anæmi, svimmelhed, ødem, forhøjede leverenzymer, hovedpine, leverenzymer, øget blødningstid, kløe, udslæt, tinnitus
Yderligere bivirkninger rapporteret lejlighedsvis og listet her efter kropssystem inkluderer:
Kroppen som helhed - feber, infektion, sepsis
Kardiovaskulære system - kongestiv hjerteinsufficiens, hypertension, takykardi, synkope
Fordøjelsessystemet - mundtørhed, esophagitis, mavesår/mavesår, gastritis, gastrointestinal blødning, glossitis, hæmatemese, hepatitis, gulsot
Hemisk og lymfesystem - ekkymose, eosinofili, leukopeni, melena, purpura, rektal blødning, stomatitis, trombocytopeni
Metabolisk og ernæringsmæssig - vægtændringer
Nervesystem angst, asteni, forvirring, depression, drømmeabnormiteter, døsighed; søvnløshed, utilpashed, nervøsitet, paræstesi, somnolens, rysten, svimmelhed
Åndedrætsorganerne - astma, dyspnø
Hud og vedhæng - alopeci, lysfølsomhed, kløe, sved
Særlige sanser - sløret syn
Urogenital system - blærebetændelse, dysuri, hæmaturi, interstitiel nefritis, oliguri/polyuri, proteinuri, nyresvigt
Andre bivirkninger, som forekommer sjældent, er:
Kroppen som helhed - anafylaktoide reaktioner, ændringer i appetit, død
Kardiovaskulære system - arytmi, hypotension, myokardieinfarkt, hjertebanken, vaskulitis
Fordøjelsessystemet - udbrud, leversvigt, pancreatitis
Hemisk og lymfesystem - agranulocytose, hæmolytisk anæmi, aplastisk anæmi, lymfadenopati, pancytopeni
Metabolisk og ernæringsmæssig - hyperglykæmi
Nervesystem - kramper, koma, hallucinationer, meningitis.
Åndedræt respirationsdepression, lungebetændelse
Hud og vedhæng - angioødem, toksisk epidermal nekrose, erythema multiforme, eksfoliativ dermatitis, Stevens-Johnsons syndrom, nældefeber
Særlige sanser - conjunctivitis, hørenedsættelse
DRUGSINTERAKTIONER
En række forbindelser er hæmmere af CYP2C9. Lægemiddelinteraktionsundersøgelser af mefenaminsyre og disse forbindelser er ikke blevet udført. Muligheden for ændret sikkerhed og effekt bør overvejes, når Ponstel (mefenaminsyre) anvendes samtidig med disse lægemidler.
ACE-hæmmere
Rapporter tyder på, at NSAID'er kan mindske den antihypertensive virkning af ACE-hæmmere. Denne interaktion bør tages i betragtning hos patienter, der tager NSAID'er samtidig med ACE-hæmmere.
Aspirin
Når PONSTEL (mefenaminsyre) administreres sammen med aspirin, reduceres dets proteinbinding, selvom clearance af fri PONSTEL (mefenaminsyre) ikke ændres. Den kliniske betydning af denne interaktion er ikke kendt; men som med andre NSAID'er anbefales samtidig administration af MEFENAMINSYRE og aspirin generelt ikke på grund af muligheden for øgede bivirkninger.
Diuretika
Kliniske undersøgelser såvel som observationer efter markedsføring har vist, at PONSTEL (mefenaminsyre) kan reducere den natriuretiske effekt af furosemid og thiazider hos nogle patienter. Dette respons er blevet tilskrevet hæmning af nyreprostaglandinsyntese. Ved samtidig behandling med NSAID'er skal patienten observeres nøje for tegn på nyresvigt (se FORHOLDSREGLER, nyrepåvirkning ), samt for at sikre diuretisk virkning.
Lithium
NSAID'er har medført en stigning i plasmalithiumniveauer og en reduktion i renal lithiumclearance. Den gennemsnitlige minimale lithiumkoncentration steg 15 %, og renal clearance faldt med ca. 20 %. Disse virkninger er blevet tilskrevet hæmning af renal prostaglandinsyntese af NSAID. Når NSAID'er og lithium administreres samtidigt, skal forsøgspersoner derfor observeres omhyggeligt for tegn på lithiumtoksicitet.
Methotrexat
Det er rapporteret, at NSAID'er kompetitivt hæmmer ophobning af methotrexat i kaninnyreskiver. Dette kan tyde på, at de kan øge toksiciteten af methotrexat. Der bør udvises forsigtighed, når NSAID'er administreres samtidig med methotrexat.
Warfarin
Virkningerne af warfarin og NSAID'er på GI-blødninger er synergistiske, således at brugere af begge lægemidler tilsammen har en højere risiko for alvorlig GI-blødning end brugere af begge lægemidler alene.
Antacida
et enkeltdosisstudie (n=6) øgede indtagelse af et antacidum indeholdende 1,7 gram magnesiumhydroxid med 500 mg mefenaminsyre Cmax og AUC for mefenaminsyre med henholdsvis 125 % og 36 %.1
Interaktioner med lægemiddel/laboratorietest
Ponstel (mefenaminsyre) kan forlænge protrombintiden.4 Derfor, når lægemidlet administreres til patienter, der får orale antikoagulantia, er hyppig overvågning af protrombintiden nødvendig.
En falsk positiv reaktion for uringalde ved brug af diazo-tablettesten kan opstå efter administration af mefenaminsyre. Hvis der er mistanke om biliuri, bør andre diagnostiske procedurer, såsom Harrison plettesten, udføres.
REFERENCER
4. Glazko AJ: Eksperimentelle observationer af flufenaminsyre, mefenaminsyre og meclofenaminsyre. Del III. Metabolisk disposition, i Fenamates in Medicine. A Symposium, London, 1966. Annals of Physical Medicine, Supplement, s. 23-36, 1967.
ADVARSLER
Kardiovaskulære effekter
Kardiovaskulære trombotiske hændelser
Kliniske forsøg med flere COX-2 selektive og ikke-selektive NSAID'er af op til tre års varighed har vist en øget risiko for alvorlige kardiovaskulære (CV) trombotiske hændelser, myokardieinfarkt og slagtilfælde, som kan være fatale. Alle NSAID'er, både COX-2-selektive og ikke-selektive, kan have en lignende risiko. Patienter med kendt CV-sygdom eller risikofaktorer for CV-sygdom kan have større risiko. For at minimere den potentielle risiko for en uønsket CV-hændelse hos patienter behandlet med et NSAID, bør den laveste effektive dosis anvendes i den kortest mulige varighed. Læger og patienter bør forblive opmærksomme på udviklingen af sådanne hændelser, selv i fravær af tidligere CV-symptomer. Patienter bør informeres om tegn og/eller symptomer på alvorlige CV-hændelser og de skridt, der skal tages, hvis de opstår.
Der er ingen konsekvent evidens for, at samtidig brug af aspirin mindsker den øgede risiko for alvorlige CV-trombotiske hændelser forbundet med NSAID-brug. Samtidig brug af aspirin og et NSAID øger risikoen for alvorlige GI-hændelser (se GI ADVARSLER ).
To store, kontrollerede, kliniske forsøg med et COX-2-selektivt NSAID til behandling af smerte i de første 10-14 dage efter CABG-kirurgi fandt en øget forekomst af myokardieinfarkt og slagtilfælde (se KONTRAINDIKATIONER ).
Forhøjet blodtryk
NSAID'er, inklusive PONSTEL (mefenaminsyre), kan føre til indtræden af ny hypertension eller forværring af allerede eksisterende hypertension, som begge kan bidrage til den øgede forekomst af CV-hændelser. Patienter, der tager thiazider eller loop-diuretika, kan have nedsat respons på disse behandlinger, når de tager NSAID'er. NSAID, inklusive PONSTEL (mefenaminsyre), bør anvendes med forsigtighed hos patienter med hypertension. Blodtrykket (BP) bør overvåges nøje under påbegyndelse af NSAID-behandling og under hele behandlingsforløbet.
Kongestiv hjertesvigt og ødem
Væskeretention og ødem er blevet observeret hos nogle patienter, der tager NSAID'er. PONSTEL (mefenaminsyre) bør anvendes med forsigtighed til patienter med væskeretention eller hjertesvigt.
Gastrointestinale virkninger - Risiko for ulceration, blødning og perforering
NSAID'er, inklusive PONSTEL (mefenaminsyre), kan forårsage alvorlige gastrointestinale (GI) bivirkninger, herunder betændelse, blødning, ulceration og perforering af maven, tyndtarmen eller tyktarmen, som kan være dødelig. Disse alvorlige bivirkninger kan forekomme til enhver tid, med eller uden advarselssymptomer, hos patienter behandlet med NSAID'er. Kun én ud af fem patienter, som udvikler en alvorlig øvre GI-bivirkning under NSAID-behandling, er symptomatisk. Øvre mavesår, grov blødning eller perforation forårsaget af NSAID'er forekommer hos ca. 1 % af patienterne behandlet i 3-6 måneder og hos ca. 2-4 % af patienterne behandlet i et år. Disse tendenser fortsætter med længere brugstid, hvilket øger sandsynligheden for at udvikle en alvorlig GI-hændelse på et tidspunkt i løbet af behandlingen. Men selv kortvarig terapi er ikke uden risiko.
NSAID'er bør ordineres med ekstrem forsigtighed til personer med tidligere ulcussygdom eller gastrointestinal blødning. Patienter med en tidligere anamnese med mavesår og/eller gastrointestinal blødning, som bruger NSAID'er, har en større end 10 gange øget risiko for at udvikle en GI-blødning sammenlignet med patienter med ingen af disse risikofaktorer. Andre faktorer, der øger risikoen for gastrointestinale blødninger hos patienter, der behandles med NSAID'er, omfatter samtidig brug af orale kortikosteroider eller antikoagulantia, længere varighed af NSAID-behandling, rygning, brug af alkohol, højere alder og dårlig generel sundhedstilstand. De fleste spontane rapporter om fatale gastrointestinale hændelser er hos ældre eller svækkede patienter, og derfor bør der udvises særlig forsigtighed ved behandling af denne population.
For at minimere den potentielle risiko for en uønsket gastrointestinale hændelse hos patienter, der behandles med et NSAID, bør den laveste effektive dosis anvendes i den kortest mulige varighed. Patienter og læger bør forblive opmærksomme på tegn og symptomer på GI-ulceration og blødning under NSAID-behandling og straks påbegynde yderligere evaluering og behandling, hvis der er mistanke om en alvorlig GI-bivirkning. Dette bør omfatte seponering af NSAID, indtil en alvorlig GI-bivirkning er udelukket. For højrisikopatienter bør alternative behandlinger, der ikke involverer NSAID'er, overvejes.
Nyrepåvirkninger
Langvarig administration af NSAID'er har resulteret i nyrepapillær nekrose og anden nyreskade. Renal toksicitet er også set hos patienter, hvor renale prostaglandiner har en kompenserende rolle i opretholdelsen af renal perfusion. Hos disse patienter kan administration af et ikke-steroidt antiinflammatorisk lægemiddel forårsage en dosisafhængig reduktion i prostaglandindannelsen og sekundært i nyrernes blodgennemstrømning, hvilket kan fremkalde åbenlys nyreindekompensation. Patienter med størst risiko for denne reaktion er dem med nedsat nyrefunktion, hjertesvigt, leverdysfunktion, dem, der tager diuretika og ACE-hæmmere, og ældre. Seponering af NSAID-behandling efterfølges sædvanligvis af genopretning til forbehandlingstilstanden.
Avanceret nyresygdom
Der er ingen tilgængelig information om kontrollerede undersøgelser vedrørende brugen af PONSTEL (mefenaminsyre) hos patienter med fremskreden nyresygdom. Derfor anbefales behandling med PONSTEL (mefenaminsyre) ikke til disse patienter med fremskreden nyresygdom (se KONTRAINDIKATIONER ).
Anafylaktoide reaktioner
Som med andre NSAID'er kan anafylaktoide reaktioner forekomme hos patienter uden kendt forudgående eksponering for PONSTEL (mefenaminsyre). PONSTEL (mefenaminsyre) bør ikke gives til patienter med aspirintriaden. Dette symptomkompleks opstår typisk hos astmatiske patienter, som oplever rhinitis med eller uden næsepolypper, eller som udviser alvorlig, potentielt dødelig bronkospasme efter at have taget aspirin eller andre NSAID'er (se KONTRAINDIKATIONER og FORHOLDSREGLER - Eksisterende astma ). Der bør søges akut hjælp i tilfælde, hvor der opstår en anafylaktoid reaktion.
Hudreaktioner
NSAID'er, herunder PONSTEL (mefenaminsyre), kan forårsage alvorlige hudbivirkninger såsom eksfoliativ dermatitis, Stevens-Johnsons syndrom (SJS) og toksisk epidermal nekrolyse (TEN), som kan være dødelig. Disse alvorlige hændelser kan forekomme uden varsel. Patienterne skal informeres om tegn og symptomer på alvorlige hudmanifestationer, og brugen af lægemidlet bør afbrydes ved den første forekomst af hududslæt eller andre tegn på overfølsomhed.
Graviditet
I slutningen af graviditeten, som med andre NSAID'er, bør PONSTEL (mefenaminsyre) undgås, da det kan forårsage for tidlig lukning af ductus arteriosus.
FORHOLDSREGLER
Generel
PONSTEL (mefenaminsyre) kan ikke forventes at erstatte kortikosteroider eller at behandle kortikosteroidinsufficiens. Pludselig seponering af kortikosteroider kan føre til sygdomsforværring. Patienter i langvarig behandling med kortikosteroider bør have deres behandling nedtrappet langsomt, hvis der træffes en beslutning om at seponere kortikosteroider.
Den farmakologiske aktivitet af PONSTEL (mefenaminsyre) til at reducere feber og inflammation kan mindske anvendeligheden af disse diagnostiske tegn til påvisning af komplikationer af formodede ikke-infektiøse, smertefulde tilstande.
Leverpåvirkninger
Borderlineforhøjelser af en eller flere leverprøver kan forekomme hos op til 15 % af patienterne, der tager NSAID'er, inklusive PONSTEL (mefenaminsyre). Disse laboratorieabnormaliteter kan udvikle sig, kan forblive uændrede eller kan være forbigående ved fortsat behandling. Bemærkelsesværdige forhøjelser af ALAT eller ASAT (ca. tre eller flere gange den øvre normalgrænse) er blevet rapporteret hos ca. 1 % af patienterne i kliniske forsøg med NSAID'er. Derudover er sjældne tilfælde af alvorlige leverreaktioner, inklusive gulsot og fatal fulminant hepatitis, levernekrose og leversvigt, nogle af dem med dødelig udgang blevet rapporteret.
En patient med symptomer og/eller tegn, der tyder på leverdysfunktion, eller hvor der er opstået en unormal levertest, bør evalueres for tegn på udvikling af en mere alvorlig leverreaktion under behandling med PONSTEL (mefenaminsyre). Hvis der udvikles kliniske tegn og symptomer, der stemmer overens med leversygdom, eller hvis der opstår systemiske manifestationer (f.eks. eosinofili, udslæt osv.), skal PONSTEL (mefenaminsyre) seponeres.
Hæmatologiske virkninger
Anæmi ses nogle gange hos patienter, der får NSAID'er, inklusive PONSTEL (mefenaminsyre). Dette kan skyldes væskeretention, GI-blodtab eller en ufuldstændigt beskrevet effekt på erytropoiese. Patienter i langtidsbehandling med NSAID'er, inklusive PONSTEL (mefenaminsyre), bør have deres hæmoglobin eller hæmatokrit kontrolleret, hvis de udviser tegn eller symptomer på anæmi. NSAID'er hæmmer blodpladeaggregation og har vist sig at forlænge blødningstiden hos nogle patienter. I modsætning til aspirin er deres effekt på blodpladefunktionen kvantitativt mindre, af kortere varighed og reversibel. Patienter, der får PONSTEL (mefenaminsyre), og som kan blive negativt påvirket af ændringer i trombocytfunktionen, såsom dem med koagulationsforstyrrelser eller patienter, der får antikoagulantia, bør overvåges nøje.
Eksisterende astma
Patienter med astma kan have aspirinfølsom astma. Brugen af aspirin hos patienter med aspirinfølsom astma er blevet forbundet med alvorlig bronkospasme, som kan være dødelig. Da krydsreaktivitet, herunder bronkospasme, mellem aspirin og andre ikke-steroide antiinflammatoriske lægemidler er blevet rapporteret hos sådanne aspirinfølsomme patienter, bør PONSTEL (mefenaminsyre) ikke administreres til patienter med denne form for aspirinfølsomhed og bør anvendes med forsigtighed i patienter med allerede eksisterende astma.
Information til patienter
Patienter skal informeres om følgende information, før behandling med et NSAID påbegyndes og med jævne mellemrum i løbet af den igangværende behandling. Patienter bør også opfordres til at læse NSAID Medicinvejledning der følger med hver udleveret recept.
Laboratorieprøver
Fordi alvorlige sår og blødninger i mave-tarmkanalen kan forekomme uden advarselssymptomer, bør læger overvåge for tegn eller symptomer på mave-tarm-blødning. Patienter i langtidsbehandling med NSAID bør have deres CBC og en kemiprofil kontrolleret med jævne mellemrum. Hvis der udvikles kliniske tegn og symptomer, der stemmer overens med lever- eller nyresygdom, opstår der systemiske manifestationer (f.eks. eosinofili, udslæt osv.), eller hvis unormale leverprøver fortsætter eller forværres, bør Ponstel (mefenaminsyre) seponeres.
Graviditet
Teratogene virkninger
Graviditetskategori C
Reproduktionsundersøgelser udført på rotter og kaniner har ikke vist tegn på udviklingsmæssige abnormiteter. Dyreproduktionsundersøgelser er dog ikke altid forudsigelige for menneskelig reaktion. Der er ingen tilstrækkelige eller velkontrollerede undersøgelser af gravide kvinder. Postel bør kun anvendes under graviditet, hvis den potentielle fordel opvejer den potentielle risiko for fosteret.
Ikke-ratatogene virkninger
På grund af de kendte virkninger af ikke-steroide antiinflammatoriske lægemidler på det føtale kardiovaskulære system (lukning af ductus arteriosus), bør brug under graviditet (især sent i graviditeten) undgås.
Arbejde og levering
I rotteundersøgelser med NSAID'er, som med andre lægemidler, der vides at hæmme prostaglandinsyntesen, forekom en øget forekomst af dystoci, forsinket fødsel og nedsat overlevelse af hvalpe. Effekten af Ponstel (mefenaminsyre) på fødsel og fødsel hos gravide kvinder er ukendt.
Ammende mødre
Spormængder af Ponstel (mefenaminsyre) kan være til stede i modermælken og overføres til det ammende spædbarn.7 På grund af potentialet for alvorlige bivirkninger hos ammende spædbørn fra PONSTEL (mefenaminsyre), bør der tages en beslutning om, hvorvidt amningen skal afbrydes eller at seponere lægemidlet under hensyntagen til lægemidlets betydning for moderen.
Pædiatrisk brug
Sikkerhed og effektivitet hos pædiatriske patienter under 14 år er ikke blevet fastlagt.
Geriatrisk brug
Kliniske undersøgelser af Ponstel (mefenaminsyre) omfattede ikke et tilstrækkeligt antal forsøgspersoner på 65 år og derover til at afgøre, om de reagerer anderledes end yngre forsøgspersoner. Som med alle andre NSAID'er skal der udvises forsigtighed ved behandling af ældre (65 år og ældre).
Dette lægemiddel vides at udskilles væsentligt af nyrerne, og risikoen for toksiske reaktioner på dette lægemiddel kan være større hos patienter med nedsat nyrefunktion. Da ældre patienter er mere tilbøjelige til at have nedsat nyrefunktion, bør der udvises forsigtighed ved dosisvalg, og det kan være nyttigt at overvåge nyrefunktionen (se KLINISK FARMAKOLOGI og BIVIRKNINGER).
REFERENCER
7. Buchanan RA, et al. Modermælksudskillelsen af mefenaminsyre. Curr Ther Res. 10:592, 1968.
OVERDOSIS
Symptomer efter akutte NSAID-overdoser er normalt begrænset til sløvhed, døsighed, kvalme, opkastning og epigastriske smerter, som generelt er reversible med støttende behandling. Gastrointestinal hypertension, akut nyresvigt, respirationsdepression og koma kan forekomme, men er sjældne. Anafylaktoide reaktioner er blevet rapporteret ved terapeutisk indtagelse af NSAID'er og kan forekomme efter en overdosis.
Patienter bør behandles med symptomatisk og understøttende behandling efter en NSAID-overdosis. Der er ingen specifikke modgifte. Emesis og/eller aktivt kul (60 til 100 g hos voksne, 1 til 2 g/kg hos børn) og/eller osmotisk katharsis kan være indiceret hos patienter, der ses inden for 4 timer efter indtagelse med symptomer eller efter en stor overdosis (5 til 10 gange den sædvanlige dosis). Tvungen diurese, alkalinisering af urin, hæmodialyse eller hemoperfusion er muligvis ikke nyttige på grund af høj proteinbinding.
KONTRAINDIKATIONER
PONSTEL (mefenaminsyre) er kontraindiceret til patienter med kendt overfølsomhed over for mefenaminsyre.
PONSTEL (mefenaminsyre) bør ikke gives til patienter, der har oplevet astma, nældefeber eller allergiske reaktioner efter indtagelse af aspirin eller andre NSAID'er. Alvorlige, sjældent fatale, anafylaktisk-lignende reaktioner på NSAID'er er blevet rapporteret hos sådanne patienter (se ADVARSLER - Anafylaktoide reaktioner og FORHOLDSREGLER - Eksisterende astma ).
PONSTEL (mefenaminsyre) er kontraindiceret til behandling af perioperative smerter i forbindelse med koronararterie bypass-operation (CABG) (se ADVARSLER ).
Ponstel (mefenaminsyre) er kontraindiceret til patienter med akut aktiv ulceration eller kronisk betændelse i enten den øvre eller nedre mave-tarmkanal.
Ponstel (mefenaminsyre) bør ikke anvendes til patienter med allerede eksisterende nyresygdom.
KLINISK FARMAKOLOGI
Farmakodynamik
Ponstel (mefenaminsyre) er et ikke-steroidt antiinflammatorisk lægemiddel (NSAID), der udviser antiinflammatoriske, analgetiske og antipyretiske aktiviteter i dyremodeller. Virkningsmekanismen for Ponstel (mefenaminsyre) er ligesom andre NSAID'er ikke fuldstændigt forstået, men kan være relateret til prostaglandinsyntetasehæmning.
Farmakokinetik
Absorption
Mefenaminsyre absorberes hurtigt efter oral administration. I to 500-mg enkelt oral dosis undersøgelser var den gennemsnitlige grad af absorption 30,5 mcg/time/ml (17% CV).1,2 Biotilgængeligheden af kapslen i forhold til en IV dosis eller en oral opløsning er ikke blevet undersøgt.
Efter en enkelt 1-grams oral dosis er der rapporteret gennemsnitlige maksimale plasmaniveauer i området 10-20 mcg/mL3. Maksimal plasmaniveauer nås efter 2 til 4 timer, og eliminationshalveringstiden er cirka 2 timer. Efter flere doser er plasmaniveauer proportionale med dosis uden tegn på lægemiddelakkumulering. I et flerdosisforsøg med normale voksne forsøgspersoner (n=6), der fik 1 gram doser mefenaminsyre fire gange dagligt, blev steady-state koncentrationer på 20 mcg/ml nået på den anden dag af indgivelsen, i overensstemmelse med den korte halv- liv.
Effekten af mad på hastigheden og omfanget af absorption af mefenaminsyre er ikke blevet undersøgt. Samtidig indtagelse af antacida indeholdende magnesiumhydroxid har vist sig at øge hastigheden og omfanget af mefenaminsyreabsorption signifikant (se SIKKERHEDSFORANSTALTNINGER: LÆKEMIDDELINTERAKTIONER ).1
Fordeling
Mefenaminsyre er blevet rapporteret som værende mere end 90 % bundet til albumin.9 Forholdet mellem ubundet fraktion og lægemiddelkoncentration er ikke blevet undersøgt. Det tilsyneladende distributionsvolumen (Vzss/F) estimeret efter en 500 mg oral dosis mefenaminsyre var 1,06 l/kg.2
Baseret på dets fysiske og kemiske egenskaber forventes Ponstel (mefenaminsyre) at blive udskilt i human modermælk.
Metabolisme
Mefenaminsyre metaboliseres af cytochrom P450-enzymet CYP2C9 til 3-hydroxymethylmefenaminsyre (metabolit I). Yderligere oxidation til en 3-carboxymefenaminsyre (Metabolite II) kan forekomme.10 Aktiviteten af disse metabolitter er ikke blevet undersøgt. Metabolitterne kan gennemgå glukuronidering, og mefenaminsyre glukuronideres også direkte. Et maksimalt plasmaniveau på ca. 20 mcg/ml blev observeret efter 3 timer for hydroxymetabolitten og dens glucuronid (n=6) efter en enkelt dosis på 1 gram. Tilsvarende blev et maksimalt plasmaniveau på 8 mcg/ml observeret efter 6-8 timer for carboxymetabolitten og dens glucuronid.3
Udskillelse
Cirka 52 procent af en mefenaminsyredosis udskilles i urinen primært som glucuronider af mefenaminsyre (6%), 3-hydroxymefenaminsyre (25%) og 3-carboxymefenaminsyre (21%). Den fækale eliminationsvej tegner sig for op til 20 % af dosis, hovedsageligt i form af ukonjugeret 3-carboxymefenaminsyre.3
Eliminationshalveringstiden for mefenaminsyre er ca. to timer. Halveringstider for metabolitter I og II er ikke blevet præcist rapporteret, men synes at være længere end moderstoffet.3 Metabolitterne kan akkumulere hos patienter med nyre- eller leversvigt. Mefenaminsyre glucuronid kan bindes irreversibelt til plasmaproteiner. Fordi både renal og hepatisk udskillelse er signifikante eliminationsveje, kan dosisjusteringer hos patienter med nyre- eller leverdysfunktion være nødvendig. Ponstel (mefenaminsyre) bør ikke administreres til patienter med allerede eksisterende nyresygdom eller til patienter med signifikant nedsat nyrefunktion.
TABEL 1: Farmakokinetiske parameterestimater for mefenaminsyre
Særlige Populationer
Pædiatrisk
Ponstel (mefenaminsyre) er ikke blevet tilstrækkeligt undersøgt hos pædiatriske patienter under 14 år. En undersøgelse med 17 præmature spædbørn indgivet 2 mg/kg indikerede, at halveringstiden var omkring fem gange så lang som voksne, hvilket stemmer overens med den lave aktivitet af metaboliske enzymer hos nyfødte spædbørn. Den gennemsnitlige Cmax i denne undersøgelse var 4 mcg/ml (interval 2,9-6,1). Den gennemsnitlige tid til maksimal koncentration (Tmax) var 8 timer (interval 2-18 timer).11
Race
Farmakokinetiske forskelle på grund af race er ikke blevet identificeret.
Leverinsufficiens
Mefenaminsyres farmakokinetik er ikke blevet undersøgt hos patienter med leverdysfunktion. Da levermetabolisme er en væsentlig vej til eliminering af mefenaminsyre, kan patienter med akut og kronisk leversygdom have behov for reducerede doser af Ponstel (mefenaminsyre) sammenlignet med patienter med normal leverfunktion.
Nyreinsufficiens
Mefenaminsyres farmakokinetik er ikke blevet undersøgt hos personer med nyreinsufficiens. Da mefenaminsyre, dets metabolitter og konjugater primært udskilles af nyrerne, er der potentiale for, at mefenaminsyremetabolitter kan akkumulere. Ponstel (mefenaminsyre) bør ikke administreres til patienter med allerede eksisterende nyresygdom eller til patienter med signifikant nedsat nyrefunktion.
Kliniske Studier
kontrollerede, dobbeltblindede kliniske forsøg blev Ponstel (mefenaminsyre) evalueret til behandling af primær spasmodisk dysmenoré. De parametre, der blev brugt til at bestemme effektiviteten omfattede smertevurdering af både patient og investigator; behovet for samtidig smertestillende medicin; og evaluering af ændring i hyppighed og sværhedsgrad af symptomer, der er karakteristiske for spasmodisk dysmenoré. Patienterne fik enten Ponstel (mefenaminsyre), 500 mg (2 kapsler) som en startdosis på 250 mg hver 6. time eller placebo ved begyndende blødning eller smerte, alt efter hvad der begyndte først. Efter tre menstruationscyklusser blev patienterne sat over til den alternative behandling i yderligere tre cyklusser. Ponstel (mefenaminsyre) var signifikant bedre end placebo i alle parametre, og begge behandlinger (lægemiddel og placebo) blev lige tolereret.
REFERENCER
1. Neuvonen PJ, Kivisto KT: Forbedring af lægemiddelabsorption af antacida. En ikke-genkendt lægemiddelinteraktion. Clin Pharmacokinet. 27:120-8, august 1994.
2. Tall AR, Mistilits SP: Undersøgelser af Ponstan (mefenaminsyre): I. Gastrointestinalt blodtab; II. Absorption og udskillelse af en ny formulering. J Int Med Res (UK). 1975, 3 (3) s. 176-82.
3. Winder CV, Kaump DH, Glazko et al: Eksperimentelle observationer af flufenamin-, mefenamin- og meclofenaminsyrer. AnnPhys Med (Eng), Suppl p7-49.1967.
9. Champion GD, Graham GG: Farmakokinetik af ikke-steroide antiinflammatoriske midler. Aust NZ J Med. 8 (Supp 1): 94-100, juni 1978.
10. McGurk KA, Remmel RP, Hosagrahara VP, Tosh D, Burchell B: Reaktivitet af mefenaminsyre 1-o-acyl glucuronid med proteiner in vitro og ex vivo. Drug Metab Dispos. august 1996, 24 (8) s. 842-9.
11. Ito K, Niida Y, Sato J et al: Farmakokinetik af mefenaminsyre hos præmature spædbørn med patent ductus arteriosus. Acta Paediatr JPN. 36 (4): 387-91, 1994.
PATIENTOPLYSNINGER
Medicinvejledning til ikke-steroide antiinflammatoriske lægemidler (NSAID'er)
(Se slutningen af denne medicinvejledning for en liste over receptpligtig NSAID-medicin.)
Hvad er den vigtigste information, jeg bør vide om medicin kaldet ikke-steroide antiinflammatoriske lægemidler (NSAID'er)?
NSAID-medicin kan øge chancen for et hjerteanfald eller slagtilfælde, der kan føre til døden. Denne chance øges:
- ved længere brug af NSAID-medicin
- hos mennesker med hjertesygdomme
NSAID-medicin bør aldrig bruges lige før eller efter en hjerteoperation kaldet "koronararterie-bypassgraft (CABG)."
NSAID-medicin kan forårsage sår og blødninger i mave og tarme på ethvert tidspunkt under behandlingen.
Sår og blødning:
- kan ske uden advarselssymptomer
- kan forårsage død
Chancen for at en person får et sår eller blødning øges med:
- tager medicin kaldet "kortikosteroider" og "antikoagulantia"
- længere brug
- rygning
- drikke alkohol
- ældre alder
- have dårligt helbred
NSAID-medicin bør kun anvendes:
- præcis som foreskrevet
- ved den lavest mulige dosis til din behandling
- for den kortest nødvendige tid
Hvad er ikke-steroide antiinflammatoriske lægemidler (NSAID'er)?
NSAID-medicin bruges til at behandle smerter og rødme, hævelse og varme (betændelse) fra medicinske tilstande som:
- forskellige typer gigt
- menstruationssmerter og andre former for kortvarige smerter
Hvem bør ikke tage et ikke-steroid antiinflammatorisk lægemiddel (NSAID)?
Tag ikke NSAID-medicin:
- hvis du havde et astmaanfald, nældefeber eller anden allergisk reaktion med aspirin eller anden NSAID-medicin
- for smerter lige før eller efter hjertebypass-operation
Fortæl din sundhedsplejerske:
- om alle dine medicinske tilstande.
- om al den medicin, du tager. NSAID'er og nogle andre lægemidler kan interagere med hinanden og forårsage alvorlige bivirkninger. Hold en liste over dine lægemidler for at vise til din sundhedsplejerske og apotek.
- hvis du er gravid. NSAID-medicin bør ikke bruges af gravide sent i deres graviditet.
- hvis du ammer. Tal med din læge.
Hvad er de mulige bivirkninger af ikke-steroide antiinflammatoriske lægemidler (NSAID'er)?
Få akut hjælp med det samme, hvis du har nogle af følgende symptomer:
- åndenød eller åndedrætsbesvær
- brystsmerter
- svaghed i en del eller side af din krop
- utydelig tale
- hævelse af ansigt eller hals
Stop din NSAID-medicin og ring til din læge med det samme, hvis du har nogle af følgende symptomer:
Disse er ikke alle bivirkningerne ved NSAID-medicin. Tal med din sundhedsplejerske eller apotek for mere information om NSAID-medicin.
Andre oplysninger om ikke-steroide antiinflammatoriske lægemidler (NSAID'er)
- Aspirin er et NSAID-lægemiddel, men det øger ikke chancen for et hjerteanfald. Aspirin kan forårsage blødninger i hjernen, maven og tarmene. Aspirin kan også forårsage sår i maven og tarmene.
- Nogle af disse NSAID-lægemidler sælges i lavere doser uden recept (håndkøb). Tal med din læge, før du bruger NSAID'er i mere end 10 dage.
NSAID-medicin, der kræver recept
Denne medicinvejledning er godkendt af US Food and Drug Administration. Ikrafttrædelsesdato: 19/02/2008
