Fosamax 35mg, 70mg Alendronate Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Fosamax 70mg, og hvordan bruges det?
Fosamax 35mg er en receptpligtig medicin, der bruges til at forebygge og behandle visse typer knogletab (osteoporose) hos voksne. Fosamax 70mg kan bruges alene eller sammen med anden medicin.
Fosamax er et calciummetabolismemodificerende middel, bisphosphonatderivater.
Det vides ikke, om Fosamax er sikkert og effektivt til børn.
Hvad er de mulige bivirkninger af Fosamax?
Fosamax kan forårsage alvorlige bivirkninger, herunder:
- brystsmerter
- ny eller forværret halsbrand
- smerter eller svie under ribbenene eller i ryggen
- svær halsbrand
- brændende smerter i den øvre del af maven eller hoste blod op
- nye eller usædvanlige smerter i dit lår eller hofte
- kæbesmerter
- følelsesløshed
- hævelse
- svære led-, knogle- eller muskelsmerter
- muskelspasmer eller kramper
- følelsesløshed eller prikkende fornemmelser omkring din mund eller i dine fingre eller tæer
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Fosamax omfatter:
- halsbrand
- dårlig mave
- mavesmerter
- kvalme
- diarré
- forstoppelse
- knoglesmerter
- muskelsmerter
- ledsmerter
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Fosamax. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
FOSAMAX (natriumalendronat) er et bisfosfonat, der virker som en specifik hæmmer af osteoklastmedieret knogleresorption. Bisphosphonater er syntetiske analoger af pyrophosphat, der binder til hydroxyapatit, der findes i knogler.
Alendronatnatrium er kemisk beskrevet som (4-amino-1-hydroxybutyliden) bisphosphonsyre mononatriumsalttrihydrat.
Den empiriske formel for alendronatnatrium er C4H12NNaO7P2 •3H2O og dens formelvægt er 325,12. Strukturformlen er:
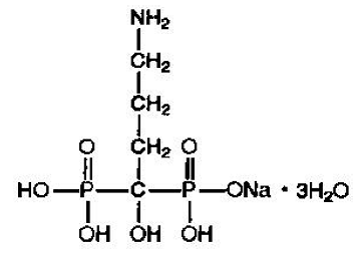
Alendronatnatrium er et hvidt, krystallinsk, ikke-hygroskopisk pulver. Det er opløseligt i vand, meget lidt opløseligt i alkohol og praktisk talt uopløseligt i chloroform.
FOSAMAX 70 mg tabletter til oral administration indeholder 91,37 mg alendronatmononatriumsalttrihydrat, som er den molære ækvivalent af 70 mg fri syre, og følgende inaktive ingredienser: mikrokrystallinsk cellulose, vandfri laktose, croscarmellosenatrium og magnesiumstearat.
INDIKATIONER
Behandling® af osteoporose hos postmenopausale kvinder
FOSAMAX er indiceret til behandling af osteoporose hos postmenopausale kvinder. Hos postmenopausale kvinder øger FOSAMAX 70 mg knoglemassen og reducerer forekomsten af frakturer, herunder brud i hoften og rygsøjlen (frakturer af hvirvelkompression). [Se Kliniske Studier ]
Forebyggelse af osteoporose hos postmenopausale kvinder
FOSAMAX 70mg er indiceret til forebyggelse af postmenopausal osteoporose [se Kliniske Studier ].
Behandling for at øge knoglemassen hos mænd med osteoporose
FOSAMAX er indiceret til behandling for at øge knoglemassen hos mænd med osteoporose [se Kliniske Studier ].
Behandling af glukokortikoid-induceret osteoporose
FOSAMAX er indiceret til behandling af glukokortikoid-induceret osteoporose hos mænd og kvinder, der får glukokortikoider i en daglig dosis svarende til 7,5 mg eller mere af prednison, og som har lav knoglemineraltæthed [se Kliniske Studier ].
Behandling af Pagets knoglesygdom
FOSAMAX 35mg er indiceret til behandling af Pagets knoglesygdom hos mænd og kvinder. Behandling er indiceret til patienter med Pagets knoglesygdom, som har alkalisk fosfatase mindst to gange den øvre grænse for normal, eller dem, der er symptomatiske, eller dem, der har risiko for fremtidige komplikationer fra deres sygdom. [Se Kliniske Studier ]
Vigtige brugsbegrænsninger
Den optimale brugstid er ikke fastlagt. Sikkerheden og effektiviteten af FOSAMAX til behandling af osteoporose er baseret på kliniske data af fire års varighed. Alle patienter i bisfosfonatbehandling bør have behovet for fortsat behandling revurderet med jævne mellemrum. Patienter med lav risiko for fraktur bør overvejes at seponere lægemidlet efter 3 til 5 års brug. Patienter, der ophører med behandlingen, bør have deres risiko for fraktur revurderet med jævne mellemrum.
DOSERING OG ADMINISTRATION
Selvom alendronat-tabletter 5 mg, 10 mg, 35 mg og 40 mg er tilgængelige på markedet, markedsføres FOSAMAX 35 mg ikke længere i styrkerne 5 mg, 10 mg, 35 mg og 40 mg.
Selvom en oral opløsning af alendronat kan være tilgængelig på markedet, markedsføres FOSAMAX 35 mg oral opløsning ikke længere.
Behandling af osteoporose hos postmenopausale kvinder
Den anbefalede dosis er:
- en 70 mg tablet én gang om ugen eller
- en flaske med 70 mg oral opløsning en gang om ugen eller
- en 10 mg tablet én gang dagligt
Forebyggelse af osteoporose hos postmenopausale kvinder
Den anbefalede dosis er:
- en 35 mg tablet én gang om ugen eller
- en 5 mg tablet én gang dagligt
Behandling for at øge knoglemassen hos mænd med osteoporose
Den anbefalede dosis er:
- en 70 mg tablet én gang om ugen eller
- en flaske med 70 mg oral opløsning en gang om ugen eller
- en 10 mg tablet én gang dagligt
Behandling af glukokortikoid-induceret osteoporose
Den anbefalede dosis er én 5 mg tablet én gang dagligt, undtagen for postmenopausale kvinder, der ikke får østrogen, for hvem den anbefalede dosis er én 10 mg tablet én gang dagligt.
Behandling af Pagets knoglesygdom
Det anbefalede behandlingsregime er 40 mg én gang dagligt i seks måneder.
Genbehandling af Pagets sygdom
Genbehandling med FOSAMAX 35 mg kan overvejes efter en seks måneders evalueringsperiode efter behandling hos patienter, som har fået tilbagefald, baseret på stigninger i serum alkalisk fosfatase, som bør måles med jævne mellemrum. Genbehandling kan også overvejes hos dem, der ikke formåede at normalisere deres serum alkalisk fosfatase.
Vigtige administrationsinstruktioner
Instruer patienterne til at gøre følgende:
- Tag FOSAMAX mindst en halv time før dagens første mad, drikkevare eller medicin kun med almindeligt vand [se Patientrådgivningsinformation ]. Andre drikkevarer (inklusive mineralvand), mad og visse lægemidler vil sandsynligvis reducere absorptionen af FOSAMAX [se DRUGSINTERAKTIONER ]. Venter du mindre end 30 minutter eller tager FOSAMAX 70mg sammen med mad, drikkevarer (bortset fra almindeligt vand) eller anden medicin, vil det mindske virkningen af FOSAMAX 70mg ved at nedsætte dets absorption i kroppen.
- Tag FOSAMAX, når du står op for dagen. For at lette tilførslen til maven og dermed reducere risikoen for irritation af spiserøret, bør en FOSAMAX 35 mg tablet sluges med et helt glas vand (6-8 ounces). For at lette gastrisk tømning bør FOSAMAX 70 mg oral opløsning efterfølges af mindst 2 ounce (en kvart kop) vand. Patienter bør ikke ligge ned i mindst 30 minutter og før efter deres første måltid på dagen. FOSAMAX bør ikke tages ved sengetid eller før den står op for dagen. Undladelse af at følge disse instruktioner kan øge risikoen for uønskede oplevelser i spiserøret [se ADVARSLER OG FORHOLDSREGLER og Patientrådgivningsinformation ].
Anbefalinger for tilskud af calcium og D-vitamin
Instruer patienterne i at tage supplerende calcium, hvis kosten er utilstrækkelig [se ADVARSLER OG FORHOLDSREGLER ]. Patienter med øget risiko for D-vitaminmangel (f.eks. over 70 år, bundet til plejehjem eller kronisk syge) kan have behov for D-vitamintilskud. Patienter med gastrointestinale malabsorptionssyndromer kan have behov for højere doser af D-vitamintilskud, og måling af 25-hydroxyvitamin D bør overvejes.
Patienter, der behandles med glukokortikoider, bør have tilstrækkelige mængder calcium og D-vitamin.
Administrationsinstruktioner for glemte doser
Hvis en dosis FOSAMAX glemmes én gang om ugen, skal du instruere patienterne i at tage en dosis om morgenen, efter de har husket det. De bør ikke tage to doser på samme dag, men bør vende tilbage til at tage én dosis en gang om ugen, som oprindeligt planlagt på deres valgte dag.
HVORDAN LEVERET
Doseringsformer og styrker
- 70 mg tabletter er hvide, ovale, uovertrukne tabletter med kode 31 på den ene side og et omrids af et knoglebillede på den anden.
Opbevaring og håndtering
nr. 3814 - FOSAMAX tabletter, 70 mg, er hvide, ovale, uovertrukne tabletter med kode 31 på den ene side og et omrids af et knoglebillede på den anden:
NDC 0006-0031-44 blisterpakning med 4 stk.
Opbevaring
FOSAMAX tabletter
Opbevares i en godt lukket beholder ved stuetemperatur, 15-30°C (59-86°F).
Distribueret af: Merck Sharp & Dohme Corp., et datterselskab af MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Revideret: august 2019
BIVIRKNINGER
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan frekvenser af bivirkninger observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med frekvenser i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke frekvenserne observeret i klinisk praksis.
Behandling af osteoporose hos postmenopausale kvinder
Daglig dosering
Sikkerheden af FOSAMAX 35 mg til behandling af postmenopausal osteoporose blev vurderet i fire kliniske undersøgelser, som omfattede 7453 kvinder i alderen 44-84 år. Undersøgelse 1 og undersøgelse 2 var identisk designet, treårige, placebokontrollerede, dobbeltblindede, multicenterundersøgelser (USA og multinationale n=994); Undersøgelse 3 var den treårige vertebrale frakturkohorte af frakturinterventionsforsøget [FIT] (n=2027), og undersøgelse 4 var den fireårige kliniske frakturkohorte af FIT (n=4432). Samlet set blev 3620 patienter eksponeret for placebo og 3432 patienter eksponeret for FOSAMAX. Patienter med allerede eksisterende gastrointestinal sygdom og samtidig brug af ikke-steroide antiinflammatoriske lægemidler blev inkluderet i disse kliniske forsøg. I undersøgelse 1 og undersøgelse 2 modtog alle kvinder 500 mg elementært calcium som carbonat. I undersøgelse 3 og undersøgelse 4 modtog alle kvinder med diætkalciumindtag mindre end 1000 mg dagligt 500 mg calcium og 250 internationale enheder D-vitamin pr. dag.
Blandt patienter behandlet med alendronat 10 mg eller placebo i undersøgelse 1 og undersøgelse 2, og alle patienter i undersøgelse 3 og undersøgelse 4, var forekomsten af dødelighed af alle årsager 1,8 % i placebogruppen og 1,8 % i FOSAMAX 35 mg-gruppen. Hyppigheden af alvorlige bivirkninger var 30,7 % i placebogruppen og 30,9 % i FOSAMAX-gruppen. Procentdelen af patienter, der afbrød undersøgelsen på grund af en hvilken som helst klinisk bivirkning, var 9,5 % i placebogruppen og 8,9 % i FOSAMAX 70 mg-gruppen. Bivirkninger fra disse undersøgelser anset af efterforskerne som muligvis, sandsynligvis eller helt sikkert lægemiddelrelaterede hos mere end eller lig med 1 % af patienter behandlet med enten FOSAMAX 35 mg eller placebo er vist i tabel 1.
Udslæt og erytem er forekommet.
Gastrointestinale bivirkninger
En patient behandlet med FOSAMAX (10 mg/dag), som havde en historie med mavesår og gastrectomy, og som samtidig tog aspirin, udviklede et anastomotisk ulcus med mild blødning, som blev betragtet som lægemiddelrelateret. Aspirin og FOSAMAX blev seponeret, og patienten kom sig. I undersøgelse 1- og undersøgelse 2-populationerne havde 49-54 % en historie med gastrointestinale lidelser ved baseline, og 54-89 % brugte ikke-steroide antiinflammatoriske lægemidler eller aspirin på et tidspunkt under undersøgelserne. [Se ADVARSLER OG FORHOLDSREGLER ]
Laboratorietestresultater
I dobbeltblinde, multicenter, kontrollerede undersøgelser blev der observeret asymptomatiske, milde og forbigående fald i serumcalcium og fosfat hos henholdsvis ca. 18 % og 10 % af patienterne, der tog FOSAMAX, mod ca. 12 % og 3 % af dem, der fik placebo. Imidlertid var forekomsten af fald i serumcalcium til mindre end 8,0 mg/dL (2,0 mM) og serumphosphat til mindre end eller lig med 2,0 mg/dL (0,65 mM) ens i begge behandlingsgrupper.
Ugentlig dosering
Sikkerheden af FOSAMAX 70 mg én gang ugentligt til behandling af postmenopausal osteoporose blev vurderet i et etårigt, dobbeltblindt multicenterstudie, hvor man sammenlignede FOSAMAX 70 mg én gang om ugen og FOSAMAX 10 mg dagligt. De overordnede sikkerheds- og tolerabilitetsprofiler for FOSAMAX 70 mg en gang om ugen og FOSAMAX 10 mg dagligt var ens. De bivirkninger, som efterforskerne betragter som muligvis, sandsynligvis eller helt sikkert lægemiddelrelaterede hos mere end eller lig med 1 % af patienterne i begge behandlingsgrupper er vist i tabel 2.
Forebyggelse af osteoporose hos postmenopausale kvinder
Daglig dosering
Sikkerheden af FOSAMAX 5 mg/dag hos postmenopausale kvinder i alderen 40-60 år er blevet evalueret i tre dobbeltblindede, placebokontrollerede undersøgelser med over 1.400 patienter randomiseret til at modtage FOSAMAX i enten to eller tre år. I disse undersøgelser var de overordnede sikkerhedsprofiler for FOSAMAX 5 mg/dag og placebo ens. Seponering af behandlingen på grund af enhver klinisk bivirkning forekom hos 7,5 % af 642 patienter behandlet med FOSAMAX 5 mg/dag og 5,7 % af 648 patienter behandlet med placebo.
Ugentlig dosering
Sikkerheden af FOSAMAX 35 mg én gang om ugen sammenlignet med FOSAMAX 5 mg dagligt blev evalueret i et etårigt, dobbeltblindt multicenterstudie med 723 patienter. De overordnede sikkerheds- og tolerabilitetsprofiler for FOSAMAX 35 mg en gang om ugen og FOSAMAX 5 mg dagligt var ens.
Bivirkningerne fra disse undersøgelser anset af efterforskerne som muligvis, sandsynligvis eller helt sikkert lægemiddelrelaterede hos mere end eller lig med 1 % af patienterne behandlet med enten FOSAMAX 35 mg én gang om ugen, FOSAMAX 5 mg/dag eller placebo, er vist i tabel 3 .
Samtidig brug med østrogen/hormonerstatningsterapi
I to undersøgelser (af et og to års varighed) af postmenopausale osteoporotiske kvinder (i alt: n=853) var sikkerheds- og tolerabilitetsprofilen for kombineret behandling med FOSAMAX 10 mg én gang dagligt og østrogen ± gestagen (n=354) i overensstemmelse med de individuelle behandlinger.
Osteoporose hos mænd
to placebokontrollerede, dobbeltblindede multicenterundersøgelser hos mænd (et toårigt studie med FOSAMAX 10 mg/dag og et etårigt studie med FOSAMAX 70 mg én gang om ugen) var frekvensen af seponering af behandlingen på grund af enhver klinisk bivirkning hændelsen var 2,7 % for FOSAMAX 10 mg/dag vs. 10,5 % for placebo og 6,4 % for FOSAMAX 70 mg én gang om ugen vs. 8,6 % for placebo. De bivirkninger, som efterforskerne betragtede som muligvis, sandsynligvis eller helt sikkert lægemiddelrelaterede hos mere end eller lig med 2 % af patienterne behandlet med enten FOSAMAX 70 mg eller placebo er vist i tabel 4.
Glukokortikoid-induceret osteoporose
to, et-årige, placebokontrollerede, dobbeltblindede, multicenterundersøgelser af patienter, der fik glukokortikoidbehandling, var de overordnede sikkerheds- og tolerabilitetsprofiler for FOSAMAX 5 og 10 mg/dag generelt de samme som for placebo. De bivirkninger, som efterforskerne betragtede som muligvis, sandsynligvis eller helt sikkert lægemiddelrelaterede hos mere end eller lig med 1 % af patienterne behandlet med enten FOSAMAX 5 eller 10 mg/dag eller placebo er vist i tabel 5.
Den overordnede sikkerheds- og tolerabilitetsprofil i den glukokortikoid-inducerede osteoporosepopulation, der fortsatte behandlingen i det andet år af undersøgelserne (FOSAMAX: n=147), var i overensstemmelse med den, der blev observeret i det første år.
Pagets knoglesygdom
kliniske undersøgelser (osteoporose og Pagets sygdom) var bivirkninger rapporteret hos 175 patienter, der tog FOSAMAX 40 mg/dag i 3-12 måneder, de samme som hos postmenopausale kvinder behandlet med FOSAMAX 10 mg/dag. Der var dog en tilsyneladende øget forekomst af øvre gastrointestinale bivirkninger hos patienter, der tog FOSAMAX 40 mg/dag (17,7 % FOSAMAX vs. 10,2 % placebo). Et tilfælde af esophagitis og to tilfælde af gastritis resulterede i seponering af behandlingen.
Derudover blev muskuloskeletale (knogle-, muskel- eller led) smerter, som er blevet beskrevet hos patienter med Pagets sygdom behandlet med andre bisfosfonater, af efterforskerne anset for at være muligvis, sandsynligvis eller helt sikkert lægemiddelrelateret hos ca. 6 % af patienterne behandlet med FOSAMAX 40 mg/dag versus ca. 1 % af patienterne behandlet med placebo, men resulterede sjældent i seponering af behandlingen. Seponering af behandlingen på grund af eventuelle kliniske bivirkninger forekom hos 6,4 % af patienterne med Pagets sygdom behandlet med FOSAMAX 40 mg/dag og 2,4 % af patienterne behandlet med placebo.
Post-marketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af FOSAMAX efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Kroppen som helhed: overfølsomhedsreaktioner inklusive urticaria og angioødem. Forbigående symptomer på myalgi, utilpashed, asteni og feber er blevet rapporteret med FOSAMAX, typisk i forbindelse med påbegyndelse af behandling. Symptomatisk hypocalcæmi er forekommet, generelt i forbindelse med disponerende tilstande. Perifert ødem.
Gastrointestinale: esophagitis, esophageal erosioner, esophageal ulcera, esophageal striktur eller perforation og oropharyngeal ulceration. Mave- eller duodenalsår, nogle alvorlige og med komplikationer, er også blevet rapporteret [se DOSERING OG ADMINISTRATION ; ADVARSLER OG FORHOLDSREGLER ].
Lokaliseret osteonekrose i kæben, generelt forbundet med tandudtrækning og/eller lokal infektion med forsinket heling, er blevet rapporteret [se ADVARSLER OG FORHOLDSREGLER ].
Muskuloskeletale: knogle-, led- og/eller muskelsmerter, lejlighedsvis alvorlige og invaliderende [se ADVARSLER OG FORHOLDSREGLER ]; led hævelse; lavenergi lårbensskaft og subtrokantære frakturer [se ADVARSLER OG FORHOLDSREGLER ].
Nervesystem: svimmelhed og svimmelhed.
Lunge: akutte astmaeksacerbationer.
Hud: udslæt (lejlighedsvis med lysfølsomhed), kløe, alopeci, alvorlige hudreaktioner, herunder Stevens-Johnsons syndrom og toksisk epidermal nekrolyse.
Særlige sanser: uveitis, skleritis eller episkleritis. Kolesteatom i den ydre auditive kanal (fokal osteonekrose).
DRUGSINTERAKTIONER
Calciumtilskud/antacida
Samtidig administration af FOSAMAX og calcium, antacida eller oral medicin indeholdende multivalente kationer vil interferere med absorptionen af FOSAMAX. Instruer derfor patienterne i at vente mindst en halv time efter at have taget FOSAMAX 35 mg, før de tager anden oral medicin.
Aspirin
I kliniske undersøgelser var forekomsten af øvre gastrointestinale bivirkninger øget hos patienter, der fik samtidig behandling med daglige doser af FOSAMAX 35 mg større end 10 mg og aspirinholdige produkter.
Ikke-steroide antiinflammatoriske lægemidler
FOSAMAX 35 mg kan administreres til patienter, der tager ikke-steroide antiinflammatoriske lægemidler (NSAID'er). I et 3-årigt, kontrolleret, klinisk studie (n=2027), hvor størstedelen af patienterne fik samtidig NSAID, var forekomsten af øvre gastrointestinale bivirkninger ens hos patienter, der tog FOSAMAX 5 eller 10 mg/dag sammenlignet med dem, der fik placebo. Men da brug af NSAID er forbundet med gastrointestinal irritation, bør der udvises forsigtighed ved samtidig brug med FOSAMAX.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Øvre gastrointestinale bivirkninger
FOSAMAX 35mg kan ligesom andre bisfosfonater indgivet oralt forårsage lokal irritation af den øvre mave-tarmslimhinde. På grund af disse mulige irriterende virkninger og et potentiale for forværring af den underliggende sygdom, bør der udvises forsigtighed, når FOSAMAX gives til patienter med aktive øvre gastrointestinale problemer (såsom kendt Barretts spiserør, dysfagi, andre esophageal sygdomme, gastritis, duodenitis eller sår).
Øsofageale bivirkninger, såsom esophagitis, esophageal ulcus og esophageal erosioner, lejlighedsvis med blødning og sjældent efterfulgt af esophageal striktur eller perforation, er blevet rapporteret hos patienter i behandling med orale bisfosfonater inklusive FOSAMAX. I nogle tilfælde har disse været alvorlige og krævet hospitalsindlæggelse. Læger bør derfor være opmærksomme på tegn eller symptomer, der signalerer en mulig esophageal reaktion, og patienter bør instrueres i at seponere FOSAMAX 70 mg og søge lægehjælp, hvis de udvikler dysfagi, odynofagi, retrosternale smerter eller ny eller forværret halsbrand.
Risikoen for alvorlige esophageale bivirkninger ser ud til at være større hos patienter, der ligger ned efter at have taget orale bisfosfonater inklusive FOSAMAX 70mg og/eller som undlader at sluge orale bisfosfonater inklusive FOSAMAX 35mg med det anbefalede fulde glas (6-8 ounce) vand, og /eller som fortsætter med at tage orale bisfosfonater inklusive FOSAMAX 70 mg efter at have udviklet symptomer, der tyder på irritation i spiserøret. Derfor er det meget vigtigt, at den fulde doseringsinstruktion gives til og forstås af patienten [se DOSERING OG ADMINISTRATION ]. Hos patienter, som ikke kan overholde doseringsinstruktionerne på grund af mental funktionsnedsættelse, bør terapi med FOSAMAX anvendes under passende overvågning.
Der har været post-marketing rapporter om mavesår og duodenalsår ved oral brug af bisfosfonater, nogle alvorlige og med komplikationer, selvom der ikke blev observeret øget risiko i kontrollerede kliniske forsøg [se BIVIRKNINGER ].
Mineralmetabolisme
Hypocalcæmi skal korrigeres, før behandling med FOSAMAX påbegyndes [se KONTRAINDIKATIONER ]. Andre lidelser, der påvirker mineralmetabolismen (såsom D-vitaminmangel) bør også behandles effektivt. Hos patienter med disse tilstande bør serumcalcium og symptomer på hypocalcæmi monitoreres under behandling med FOSAMAX.
Formodentlig på grund af virkningerne af FOSAMAX på øget knoglemineral, kan der forekomme små, asymptomatiske fald i serumcalcium og fosfat, især hos patienter med Pagets sygdom, hvor knogleomsætningshastigheden for forbehandling kan være meget forhøjet, og i patienter, der får glukokortikoider, hos hvem calciumabsorptionen kan være nedsat.
Det er især vigtigt at sikre tilstrækkeligt calcium- og D-vitaminindtag hos patienter med Pagets knoglesygdom og hos patienter, der får glukokortikoider.
Muskuloskeletale smerter
Efter markedsføring er der rapporteret alvorlige og lejlighedsvis invaliderende knogle-, led- og/eller muskelsmerter hos patienter, der tager bisfosfonater, der er godkendt til forebyggelse og behandling af osteoporose [se BIVIRKNINGER ]. Denne kategori af lægemidler omfatter FOSAMAX (alendronat). De fleste af patienterne var postmenopausale kvinder. Tiden til symptomernes begyndelse varierede fra en dag til flere måneder efter påbegyndelse af lægemidlet. Afbryd brugen, hvis der opstår alvorlige symptomer. De fleste patienter havde lindring af symptomer efter ophør. En undergruppe havde tilbagevendende symptomer, når de blev genudsat med det samme lægemiddel eller et andet bisfosfonat.
I placebokontrollerede kliniske undersøgelser af FOSAMAX var procentdelen af patienter med disse symptomer ens i FOSAMAX 35 mg- og placebogruppen.
Osteonekrose af kæben
Osteonekrose i kæben (ONJ), som kan opstå spontant, er generelt forbundet med tandudtrækning og/eller lokal infektion med forsinket heling og er blevet rapporteret hos patienter, der tager bisfosfonater, inklusive FOSAMAX. Kendte risikofaktorer for osteonekrose i kæben omfatter invasive tandprocedurer (f.eks. tandudtrækning, tandimplantater, knoglekirurgi), diagnose af cancer, samtidige behandlinger (f.eks. kemoterapi, kortikosteroider, angiogenesehæmmere), dårlig mundhygiejne og co-morbid lidelser (f.eks. paradentose og/eller anden allerede eksisterende tandsygdom, anæmi, koagulopati, infektion, dårligtsiddende tandproteser). Risikoen for ONJ kan stige med varigheden af eksponering for bisfosfonater.
For patienter, der har behov for invasive dentale procedurer, kan seponering af bisfosfonatbehandling reducere risikoen for ONJ. Klinisk vurdering af den behandlende læge og/eller oral kirurg bør vejlede i behandlingsplanen for hver patient baseret på individuel fordel/risiko-vurdering.
Patienter, der udvikler osteonekrose i kæben, mens de er i behandling med bisfosfonater, bør behandles af en mundkirurg. Hos disse patienter kan omfattende tandkirurgi til behandling af ONJ forværre tilstanden. Seponering af bisfosfonatbehandling bør overvejes baseret på en individuel vurdering af fordele/risici.
Atypiske subtrokantære og diafysiske lårbensfrakturer
Atypiske frakturer med lav energi eller lavt traume i lårbensskaftet er blevet rapporteret hos bisfosfonatbehandlede patienter. Disse frakturer kan forekomme hvor som helst i lårbensskaftet fra lige under den mindre trochanter til over den suprakondylære flare og er tværgående eller korte skrå i orientering uden tegn på findeling. Kausalitet er ikke fastlagt, da disse frakturer også forekommer hos osteoporotiske patienter, som ikke er blevet behandlet med bisfosfonater.
Atypiske lårbensbrud forekommer oftest med minimalt eller intet traume til det berørte område. De kan være bilaterale, og mange patienter rapporterer prodromale smerter i det berørte område, som sædvanligvis viser sig som kedelige, ømme lårsmerter, uger til måneder før en fuldstændig fraktur opstår. En række rapporter bemærker, at patienter også modtog behandling med glukokortikoider (f.eks. prednison) på tidspunktet for bruddet.
Enhver patient med en anamnese med eksponering for bisfosfonater, som viser sig med smerter i lår eller lyske, bør mistænkes for at have en atypisk fraktur og bør evalueres for at udelukke en ufuldstændig lårbensfraktur. Patienter med atypisk fraktur bør også vurderes for symptomer og tegn på fraktur i det kontralaterale lem. Afbrydelse af bisfosfonatbehandling bør overvejes på individuel basis i afventning af en risiko/benefit vurdering.
Nedsat nyrefunktion
FOSAMAX 35 mg anbefales ikke til patienter med kreatininclearance mindre end 35 ml/min.
Glukokortikoid-induceret osteoporose
Risikoen versus fordelen ved FOSAMAX til behandling ved daglige doser af glukokortikoider mindre end 7,5 mg prednison eller tilsvarende er ikke blevet fastlagt [se INDIKATIONER OG BRUG ]. Inden behandlingen påbegyndes, bør den hormonale gonadestatus for både mænd og kvinder fastslås, og passende erstatning overvejes.
En måling af knoglemineraltæthed bør foretages ved påbegyndelse af behandlingen og gentages efter 6 til 12 måneders kombineret FOSAMAX- og glukokortikoidbehandling.
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( Medicinvejledning ).
Instruer patienterne i at læse medicinvejledningen, før behandlingen med FOSAMAX påbegyndes, og at læse den igen, hver gang recepten fornyes.
Osteoporose-anbefalinger, herunder tilskud af calcium og D-vitamin
Instruer patienterne i at tage supplerende calcium og D-vitamin, hvis det daglige diætindtag er utilstrækkeligt. Vægtbærende motion bør overvejes sammen med ændring af visse adfærdsfaktorer, såsom cigaretrygning og/eller overdrevent alkoholforbrug, hvis disse faktorer eksisterer.
Doseringsinstruktioner
Instruer patienterne i, at de forventede fordele ved FOSAMAX 70mg kun kan opnås, når det tages med almindeligt vand, det første, når det opstår for dagen mindst 30 minutter før dagens første mad, drikkevare eller medicin. Selv dosering med appelsinjuice eller kaffe har vist sig at reducere absorptionen af FOSAMAX markant [se KLINISK FARMAKOLOGI ].
Instruer patienterne i ikke at tygge eller sutte på tabletten på grund af risiko for oropharyngeal ulceration.
Instruer patienterne i at sluge hver tablet FOSAMAX med et helt glas vand (6-8 ounces) for at lette leveringen til maven og dermed reducere risikoen for esophageal irritation. Instruer patienterne i at drikke mindst 2 ounce (en kvart kop) vand efter at have taget FOSAMAX 70 mg oral opløsning for at lette mavetømningen.
Instruer patienterne i ikke at ligge ned i mindst 30 minutter og før efter deres første mad på dagen.
Instruer patienterne i ikke at tage FOSAMAX ved sengetid eller før de står op for dagen. Patienter bør informeres om, at manglende overholdelse af disse instruktioner kan øge deres risiko for spiserørsproblemer.
Instruer patienterne i, at hvis de udvikler symptomer på esophageal sygdom (såsom synkebesvær eller smerte ved at synke, retrosternale smerter eller ny eller forværret halsbrand), skal de stoppe med at tage FOSAMAX og konsultere deres læge.
Hvis patienter glemmer en dosis på én gang om ugen FOSAMAX 70 mg, instruer patienterne i at tage én dosis om morgenen, efter de har husket det. De bør ikke tage to doser på samme dag, men bør vende tilbage til at tage én dosis en gang om ugen, som oprindeligt planlagt på deres valgte dag.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Harderian kirtel (en retro-orbital kirtel, der ikke findes hos mennesker) adenomer blev øget hos højdosis hunmus (p=0,003) i et 92-ugers oralt karcinogenicitetsstudie ved doser af alendronat på 1, 3 og 10 mg/kg/ dag (hanner) eller 1, 2 og 5 mg/kg/dag (hun). Disse doser svarer til ca. 0,1 til 1 gange den højeste anbefalede kliniske daglige dosis på 40 mg baseret på overfladeareal, mg/m². Relevansen af dette fund for mennesker er ukendt.
Parafollikulære celle (thyreoidea) adenomer blev øget hos højdosis hanrotter (p=0,003) i et 2-årigt oralt karcinogenicitetsstudie ved doser på 1 og 3,75 mg/kg legemsvægt. Disse doser svarer til ca. 0,3 og 1 gange den kliniske daglige dosis på 40 mg baseret på overfladeareal, mg/m². Relevansen af dette fund for mennesker er ukendt.
Alendronat var ikke genotoksisk i in vitro mikrobiel mutageneseassay med og uden metabolisk aktivering, i et in vitro pattedyrcellemutageneseassay, i et in vitro alkalisk elueringsassay i rottehepatocytter og i et in vivo kromosomafvigelsesassay i mus. I en in vitro kromosomafvigelsesanalyse i ovarieceller fra kinesisk hamster gav alendronat imidlertid tvetydige resultater.
Alendronat havde ingen effekt på fertiliteten (han eller hun) hos rotter ved orale doser op til 5 mg/kg/dag (ca. 1 gange den kliniske daglige dosis på 40 mg baseret på overfladeareal, mg/m²).
Brug i specifikke populationer
Graviditet
Risikooversigt
Tilgængelige data om brugen af FOSAMAX hos gravide kvinder er utilstrækkelige til at informere om en lægemiddelassocieret risiko for uønskede maternelle eller føtale resultater. Afbryd FOSAMAX 35mg, når graviditet er anerkendt.
reproduktionsstudier på dyr viste daglig oral administration af alendronat til rotter fra før parring til slutningen af drægtighed eller laktation nedsat overlevelse efter implantation og reduceret vægtøgning af hvalpe, begyndende med doser svarende til mindre end halvdelen af den højeste anbefalede kliniske daglige dosis på 40 mg ( baseret på kropsoverfladeareal, mg/m²). Oral administration af alendronat til rotter under organogenese resulterede i reduceret føtal ossifikation startende ved doser på 3 gange den kliniske daglige dosis på 40 mg. Ingen lignende føtale virkninger blev observeret hos drægtige kaniner doseret oralt under organogenese i doser svarende til ca. 10 gange den kliniske daglige dosis på 40 mg.
Forsinket eller mislykket fødsel af afkom, langvarig fødsel og sene graviditets- og føtale dødsfald på grund af maternel hypocalcæmi forekom hos rotter ved orale doser så lave som en tiendedel af den kliniske daglige dosis på 40 mg (se Data ).
Bisfosfonater inkorporeres i knoglematrixen, hvorfra de gradvist frigives over en årrække. Mængden af bisphosphonat, der er inkorporeret i voksnes knogler og tilgængelig til frigivelse i det systemiske kredsløb, er direkte relateret til dosis og varighed af bisphosphonatbrug. Baseret på virkningsmekanismen for bisfosfonater er der følgelig en potentiel risiko for fosterskader, overvejende skelet, hvis en kvinde bliver gravid efter at have afsluttet et kursus med bisfosfonatbehandling. Indvirkningen af variabler såsom tid mellem ophør af bisphosphonatbehandling til undfangelse, det særlige bisphosphonat, der anvendes, og indgivelsesvejen (intravenøs versus oral) på risikoen er ikke blevet undersøgt.
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort for de(n) angivne population(er) er ukendt. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre ugunstige udfald. I den generelle befolkning i USA er de estimerede baggrundsrisici for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2-4 % og 15-20 %.
Data
Dyredata
Reproduktionsundersøgelser hos rotter doseret oralt fra før parring til slutningen af drægtighed eller laktation viste nedsat postimplantationsoverlevelse startende ved 2 mg/kg/dag og nedsat kropsvægtstigning startende ved 1 mg/kg/dag, doser svarende til mindre end halvdelen af de 40 mg klinisk daglig dosis baseret på kropsoverfladeareal, mg/m². Hyppigheden af ufuldstændig føtal ossifikation i hvirvel-, kranie- og sternebrale knogler var øget hos rotter, der blev doseret oralt under organogenese startende ved 10 mg/kg/dag (ca. 3 gange den kliniske daglige dosis på 40 mg). Der blev ikke observeret lignende føtale virkninger hos drægtige kaniner, der blev doseret oralt under organogenese med op til 35 mg/kg/dag (svarende til ca. 10 gange den kliniske daglige dosis på 40 mg).
Både totalt og ioniseret calcium faldt hos gravide rotter, der fik oralt doseret 15 mg/kg/dag alendronat (ca. 4 gange den kliniske daglige dosis på 40 mg), hvilket resulterede i forsinkelser og leveringssvigt. Langvarig fødsel på grund af maternel hypocalcæmi blev observeret, når rotter blev behandlet fra før parring til drægtighed startende ved 0,5 mg/kg/dag (ca. en tiendedel af den kliniske daglige dosis på 40 mg). Maternotoksicitet (dødsfald under sen graviditet) forekom også hos hunrotter behandlet oralt med 15 mg/kg/dag (ca. 4 gange den kliniske daglige dosis på 40 mg) i varierende svangerskabsperioder. Disse mødredødsfald blev mindsket, men ikke elimineret ved ophør af behandlingen. Calciumtilskud i drikkevandet eller ved subkutan minipumpe til rotter doseret oralt med 15 mg/kg/dag alendronat kunne ikke lindre hypocalcæmien eller forhindre dystoki-relaterede dødsfald hos mødre og neonatale. Imidlertid forhindrede intravenøs calciumtilskud mødredødsfald, men ikke neonatale dødsfald.
Amning
Risikooversigt
Det vides ikke, om alendronat er til stede i human modermælk, påvirker human mælkeproduktion eller har virkninger på det ammede spædbarn. De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for FOSAMAX 70mg og eventuelle negative virkninger på det ammede barn fra FOSAMAX eller fra den underliggende moderens tilstand.
Pædiatrisk brug
FOSAMAX 70mg er ikke indiceret til brug hos pædiatriske patienter.
Sikkerheden og effekten af FOSAMAX blev undersøgt i et randomiseret, dobbeltblindt, placebokontrolleret to-årigt studie med 139 pædiatriske patienter i alderen 4-18 år med svær osteogenesis imperfecta (OI). Et hundrede og ni patienter blev randomiseret til 5 mg FOSAMAX 35 mg dagligt (vægt mindre end 40 kg) eller 10 mg FOSAMAX 70 mg dagligt (vægt større end eller lig med 40 kg) og 30 patienter til placebo. Den gennemsnitlige baseline BMD Z-score for lændehvirvelsøjlen for patienterne var -4,5. Den gennemsnitlige ændring i lændehvirvelsøjlens BMD Z-score fra baseline til måned 24 var 1,3 hos de FOSAMAX 35 mg-behandlede patienter og 0,1 hos de placebobehandlede patienter. Behandling med FOSAMAX 35 mg reducerede ikke risikoen for fraktur. Seksten procent af de FOSAMAX-patienter, som pådrog sig en radiologisk bekræftet fraktur inden for måned 12 af undersøgelsen, havde forsinket frakturheling (callus-remodeling) eller fraktur-ikke-sammenføjning, når de blev vurderet radiografisk ved måned 24 sammenlignet med 9% af de placebo-behandlede patienter. Hos FOSAMAX-behandlede patienter viste knoglehistomorfometridata opnået ved måned 24 nedsat knogleomsætning og forsinket mineraliseringstid; der var dog ingen mineraliseringsfejl. Der var ingen statistisk signifikante forskelle mellem FOSAMAX 35 mg- og placebogruppen med hensyn til reduktion af knoglesmerter. Den orale biotilgængelighed hos børn svarede til den, der blev observeret hos voksne.
Den overordnede sikkerhedsprofil for FOSAMAX hos patienter med osteogenesis imperfecta behandlet i op til 24 måneder var generelt den samme som for voksne med osteoporose behandlet med FOSAMAX. Der var dog en øget forekomst af opkastning hos patienter med osteogenesis imperfecta behandlet med FOSAMAX sammenlignet med placebo. I løbet af den 24-måneders behandlingsperiode blev opkastning observeret hos 32 ud af 109 (29,4 %) patienter behandlet med FOSAMAX 70 mg og 3 ud af 30 (10 %) patienter behandlet med placebo.
I en farmakokinetisk undersøgelse udviklede 6 af 24 pædiatriske osteogenesis imperfecta-patienter, som fik en enkelt oral dosis FOSAMAX 35 eller 70 mg, feber, influenzalignende symptomer og/eller mild lymfocytopeni inden for 24 til 48 timer efter administration. Disse hændelser, der ikke varer mere end 2 til 3 dage og reagerer på acetaminophen, er i overensstemmelse med et akut-fase-respons, der er blevet rapporteret hos patienter, der får bisfosfonater, inklusive FOSAMAX. [Se BIVIRKNINGER ]
Geriatrisk brug
Af de patienter, der fik FOSAMAX i frakturinterventionsforsøget (FIT), var 71 % (n=2302) ældre end eller lig med 65 år og 17 % (n=550) var større end eller lig med 75 år. Af de patienter, der får FOSAMAX 70 mg i USA og multinationale osteoporosebehandlingsundersøgelser hos kvinder, osteoporoseundersøgelser hos mænd, glukokortikoid-inducerede osteoporoseundersøgelser og Pagets sygdomsundersøgelser [se Kliniske Studier ], 45 %, 54 %, 37 % og 70 % var henholdsvis 65 år eller derover. Der blev ikke observeret nogen overordnede forskelle i effekt eller sikkerhed mellem disse patienter og yngre patienter, men større følsomhed hos nogle ældre personer kan ikke udelukkes.
Nedsat nyrefunktion
FOSAMAX 70mg anbefales ikke til patienter med kreatininclearance mindre end 35 ml/min. Dosisjustering er ikke nødvendig hos patienter med kreatininclearance-værdier mellem 35-60 ml/min [se KLINISK FARMAKOLOGI ].
Nedsat leverfunktion
Da der er tegn på, at alendronat ikke metaboliseres eller udskilles i galden, er der ikke udført undersøgelser af patienter med nedsat leverfunktion. Dosisjustering er ikke nødvendig [se KLINISK FARMAKOLOGI ].
OVERDOSIS
Signifikant dødelighed efter enkelt orale doser blev set hos hunrotter og mus ved henholdsvis 552 mg/kg (3256 mg/m²) og 966 mg/kg (2898 mg/m²). Hos mænd var disse værdier lidt højere, henholdsvis 626 og 1280 mg/kg. Der var ingen dødelighed hos hunde ved orale doser op til 200 mg/kg (4000 mg/m²).
Der er ingen specifik information tilgængelig om behandling af overdosering med FOSAMAX. Hypocalcæmi, hypofosfatæmi og øvre gastrointestinale bivirkninger, såsom mavebesvær, halsbrand, esophagitis, gastritis eller ulcus, kan skyldes oral overdosering. Mælk eller antacida bør gives for at binde alendronat. På grund af risikoen for esophageal irritation bør opkastning ikke fremkaldes, og patienten skal forblive helt oprejst.
Dialyse ville ikke være gavnligt.
KONTRAINDIKATIONER
FOSAMAX 35mg er kontraindiceret til patienter med følgende tilstande:
- Abnormiteter i spiserøret, som forsinker tømning af spiserøret, såsom forsnævring eller akalasi [se ADVARSLER OG FORHOLDSREGLER ]
- Manglende evne til at stå eller sidde oprejst i mindst 30 minutter [se DOSERING OG ADMINISTRATION ; ADVARSLER OG FORHOLDSREGLER ]
- Giv ikke FOSAMAX 35 mg oral opløsning til patienter med øget risiko for aspiration.
- Hypocalcæmi [se ADVARSLER OG FORHOLDSREGLER ]
- Overfølsomhed over for enhver komponent i dette produkt. Overfølsomhedsreaktioner inklusive nældefeber og angioødem er blevet rapporteret [se BIVIRKNINGER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Dyreforsøg har vist følgende virkemåde. På cellulært niveau viser alendronat præferentiel lokalisering til steder med knogleresorption, specifikt under osteoklaster. Osteoklasterne klæber normalt til knogleoverfladen, men mangler den pjuskede kant, der er tegn på aktiv resorption. Alendronat interfererer ikke med osteoklastrekruttering eller tilknytning, men det hæmmer osteoklastaktivitet. Undersøgelser i mus om lokalisering af radioaktivt [3H]alendronat i knogler viste omkring 10 gange højere optagelse på osteoklastoverflader end på osteoblastoverflader. Knogler undersøgt 6 og 49 dage efter [3H]alendronat-administration i henholdsvis rotter og mus viste, at normal knogle blev dannet oven på alendronatet, som var inkorporeret inde i matrixen. Mens det er inkorporeret i knoglematrix, er alendronat ikke farmakologisk aktivt. Alendronat skal således kontinuerligt administreres for at undertrykke osteoklaster på nydannede resorptionsoverflader. Histomorfometri hos bavianer og rotter viste, at alendronatbehandling reducerer knogleomsætningen (dvs. antallet af steder, hvor knoglerne ombygges). Derudover overstiger knogledannelsen knogleresorptionen på disse ombygningssteder, hvilket fører til progressive stigninger i knoglemasse.

Farmakodynamik
Alendronat er et bisphosphonat, der binder til knoglehydroxyapatit og specifikt hæmmer aktiviteten af osteoklaster, de knogleresorberende celler. Alendronat reducerer knogleresorption uden direkte effekt på knogledannelse, selvom sidstnævnte proces i sidste ende reduceres, fordi knogleresorption og dannelse er koblet under knogleomsætning.
Osteoporose hos postmenopausale kvinder
Osteoporose er karakteriseret ved lav knoglemasse, der medfører en øget risiko for fraktur. Diagnosen kan bekræftes ved fundet af lav knoglemasse, tegn på fraktur på røntgen, en historie med osteoporotisk fraktur eller højdetab eller kyfose, hvilket tyder på vertebral (spinal) fraktur. Osteoporose forekommer hos både mænd og kvinder, men er mest almindelig blandt kvinder efter overgangsalderen, når knogleomsætningen øges, og knogleresorptionshastigheden overstiger knogledannelsen. Disse ændringer resulterer i progressivt knogletab og fører til osteoporose hos en betydelig del af kvinder over 50 år. Brud, sædvanligvis i rygsøjlen, hoften og håndleddet, er de almindelige konsekvenser. Fra 50 år til 90 år øges risikoen for hoftebrud hos hvide kvinder 50 gange og risikoen for vertebral fraktur 15 til 30 gange. Det anslås, at cirka 40 % af 50-årige kvinder vil pådrage sig et eller flere osteoporose-relaterede brud på rygsøjlen, hoften eller håndleddet i løbet af deres resterende levetid. Især hoftebrud er forbundet med betydelig sygelighed, invaliditet og dødelighed.
Daglige orale doser af alendronat (5, 20 og 40 mg i seks uger) hos postmenopausale kvinder frembragte biokemiske ændringer, der tyder på dosisafhængig hæmning af knogleresorption, herunder fald i urincalcium og urinmarkører for knoglekollagennedbrydning (såsom deoxypyridinolin og kryds- forbundne N-telopeptider af type I kollagen). Disse biokemiske ændringer havde en tendens til at vende tilbage mod baseline-værdier så tidligt som 3 uger efter seponering af behandling med alendronat og adskilte sig ikke fra placebo efter 7 måneder.
Langtidsbehandling af osteoporose med FOSAMAX 10 mg/dag (i op til fem år) reducerede urinudskillelse af markører for knogleresorption, deoxypyridinolin og tværbundne N-telopeptider af type l kollagen med henholdsvis ca. 50 % og 70 %. , for at nå niveauer svarende til dem, der ses hos raske præmenopausale kvinder. Lignende fald blev set hos patienter i osteoporoseforebyggende undersøgelser, som fik FOSAMAX 5 mg/dag. Faldet i hastigheden af knogleresorption angivet af disse markører var tydeligt så tidligt som en måned og nåede efter tre til seks måneder et plateau, der blev opretholdt under hele behandlingen med FOSAMAX. I osteoporosebehandlingsundersøgelser reducerede FOSAMAX 10 mg/dag markørerne for knogledannelse, osteocalcin og knoglespecifik alkalisk fosfatase med ca. 50 % og total serum alkalisk fosfatase med ca. 25 til 30 % for at nå et plateau efter 6 til 12 måneder. I osteoporoseforebyggende undersøgelser reducerede FOSAMAX 5 mg/dag osteocalcin og total serum alkalisk fosfatase med henholdsvis ca. 40 % og 15 %. Lignende reduktioner i knogleomsætningshastigheden blev observeret hos postmenopausale kvinder i løbet af et-års studier med FOSAMAX 70 mg én gang om ugen til behandling af osteoporose og én gang ugentlig FOSAMAX 35 mg til forebyggelse af osteoporose. Disse data indikerer, at knogleomsætningshastigheden nåede en ny steady-state på trods af den progressive stigning i den samlede mængde alendronat aflejret i knoglen.
Som et resultat af hæmning af knogleresorption blev der også observeret asymptomatiske reduktioner i serumcalcium- og fosfatkoncentrationer efter behandling med FOSAMAX. I langtidsstudierne var reduktioner fra baseline i serumcalcium (ca. 2%) og fosfat (ca. 4 til 6%) tydelige den første måned efter påbegyndelse af FOSAMAX 10 mg. Der blev ikke observeret yderligere fald i serumcalcium i den femårige behandlingsvarighed; dog vendte serumfosfat tilbage til forstudieniveauer i løbet af år tre til fem. Lignende reduktioner blev observeret med FOSAMAX 5 mg/dag. I etårige studier med FOSAMAX 35 og 70 mg én gang om ugen blev der observeret lignende reduktioner efter 6 og 12 måneder. Reduktionen i serumfosfat kan afspejle ikke kun den positive knoglemineralbalance på grund af FOSAMAX 70mg, men også et fald i nyrernes fosfatreabsorption.
Osteoporose hos mænd
Behandling af mænd med osteoporose med FOSAMAX 10 mg/dag i to år reducerede urinudskillelsen af tværbundne N-telopeptider af type I kollagen med ca. 60 % og knoglespecifik alkalisk fosfatase med ca. 40 %. Lignende reduktioner blev observeret i et etårigt studie med mænd med osteoporose, som fik FOSAMAX 70 mg en gang om ugen.
Glukokortikoid-induceret osteoporose
Vedvarende brug af glukokortikoider er almindeligvis forbundet med udvikling af osteoporose og resulterende frakturer (især vertebral, hofte og ribben). Det forekommer både hos mænd og kvinder i alle aldre. Osteoporose opstår som et resultat af hæmmet knogledannelse og øget knogleresorption, hvilket resulterer i netto knogletab. Alendronat nedsætter knogleresorptionen uden direkte at hæmme knogledannelsen.
kliniske studier på op til to år' varighed, FOSAMAX 5 og 10 mg/dag reducerede tværbundne N-telopeptider af type I kollagen (en markør for knogleresorption) med ca. 60 % og reducerede knoglespecifik alkalisk phosphatase og total serum alkalisk phosphatase (markører for knogledannelse) vha. 15 til 30 % og 8 til 18 %. Som et resultat af hæmning af knogleresorption inducerede FOSAMAX 5 og 10 mg/dag asymptomatiske fald i serumcalcium (ca. 1 til 2%) og serumphosphat (ca. 1 til 8%).
Pagets knoglesygdom
Pagets knoglesygdom er en kronisk fokal skeletlidelse karakteriseret ved stærkt øget og uordnet knogleombygning. Overdreven osteoklastisk knogleresorption efterfølges af osteoblastisk ny knogledannelse, hvilket fører til udskiftning af den normale knoglearkitektur med uorganiseret, forstørret og svækket knoglestruktur.
Kliniske manifestationer af Pagets sygdom spænder fra ingen symptomer til alvorlig morbiditet på grund af knoglesmerter, knogledeformitet, patologiske frakturer og neurologiske og andre komplikationer. Alkalisk phosphatase i serum, det hyppigst anvendte biokemiske indeks for sygdomsaktivitet, giver et objektivt mål for sygdommens sværhedsgrad og respons på terapi.
FOSAMAX 70mg nedsætter hastigheden af knogleresorption direkte, hvilket fører til et indirekte fald i knogledannelsen. I kliniske forsøg gav FOSAMAX 40 mg én gang dagligt i seks måneder signifikante fald i serum alkalisk fosfatase samt i urinmarkører for knoglekollagennedbrydning. Som et resultat af hæmningen af knogleresorption inducerede FOSAMAX generelt milde, forbigående og asymptomatiske fald i serumcalcium og -fosfat.
Farmakokinetik
Absorption
forhold til en intravenøs referencedosis var den gennemsnitlige orale biotilgængelighed af alendronat hos kvinder 0,64 % for doser fra 5 til 70 mg, når det blev administreret efter en faste natten over og to timer før en standardiseret morgenmad. Den orale biotilgængelighed af 10 mg-tabletten hos mænd (0,59 %) svarede til den hos kvinder, når den blev administreret efter en faste natten over og 2 timer før morgenmad.
FOSAMAX 70 mg oral opløsning og FOSAMAX 70 mg tablet er lige så biotilgængelige.
En undersøgelse, der undersøgte effekten af timing af et måltid på biotilgængeligheden af alendronat, blev udført hos 49 postmenopausale kvinder. Biotilgængeligheden blev reduceret (med ca. 40%), når 10 mg alendronat blev administreret enten 0,5 eller 1 time før en standardiseret morgenmad, sammenlignet med dosering 2 timer før spisning. I undersøgelser af behandling og forebyggelse af osteoporose var alendronat effektivt, når det blev administreret mindst 30 minutter før morgenmad.
Biotilgængeligheden var ubetydelig, uanset om alendronat blev administreret sammen med eller op til to timer efter en standardiseret morgenmad. Samtidig administration af alendronat og kaffe eller appelsinjuice reducerede biotilgængeligheden med ca. 60 %.
Fordeling
Prækliniske undersøgelser (i hanrotter) viser, at alendronat forbigående distribueres til blødt væv efter 1 mg/kg intravenøs administration, men derefter hurtigt omfordeles til knogler eller udskilles i urinen. Det gennemsnitlige steady-state distributionsvolumen, eksklusive knogler, er mindst 28 L hos mennesker. Koncentrationer af lægemiddel i plasma efter terapeutiske orale doser er for lave (mindre end 5 ng/ml) til analytisk påvisning. Proteinbinding i humant plasma er ca. 78 %.
Metabolisme
Der er ingen evidens for, at alendronat metaboliseres i dyr eller mennesker.
Udskillelse
Efter en enkelt intravenøs dosis af [14C]alendronat blev ca. 50 % af radioaktiviteten udskilt i urinen inden for 72 timer, og ringe eller ingen radioaktivitet blev genfundet i fæces. Efter en enkelt 10 mg intravenøs dosis var den renale clearance af alendronat 71 ml/min (64, 78; 90 % konfidensinterval [CI]), og den systemiske clearance oversteg ikke 200 ml/min. Plasmakoncentrationerne faldt med mere end 95 % inden for 6 timer efter intravenøs administration. Den terminale halveringstid hos mennesker estimeres til at overstige 10 år, hvilket sandsynligvis afspejler frigivelse af alendronat fra skelettet. På baggrund af ovenstående vurderes det, at efter 10 års oral behandling med FOSAMAX (10 mg daglig) er mængden af alendronat, der frigives dagligt fra skelettet, ca. 25 % af den mængde, der absorberes fra mave-tarmkanalen.
Specifikke populationer
Køn
Biotilgængeligheden og andelen af en intravenøs dosis udskilt i urinen var ens hos mænd og kvinder.
Geriatrisk
Biotilgængelighed og disposition (urinudskillelse) var ens hos ældre og yngre patienter. Dosisjustering er ikke nødvendig hos ældre patienter.
Race
Farmakokinetiske forskelle på grund af race er ikke blevet undersøgt.
Nedsat nyrefunktion
Prækliniske undersøgelser viser, at hos rotter med nyresvigt er stigende mængder lægemiddel til stede i plasma, nyrer, milt og skinneben. Hos raske kontroller udskilles lægemiddel, der ikke er deponeret i knogler, hurtigt i urinen. Der blev ikke fundet tegn på mætning af knogleoptagelse efter 3 ugers dosering med kumulative intravenøse doser på 35 mg/kg hos unge hanrotter. Selvom der ikke er udført nogen formel farmakokinetisk undersøgelse med nedsat nyrefunktion hos patienter, er det sandsynligt, som hos dyr, at elimination af alendronat via nyrerne vil blive reduceret hos patienter med nedsat nyrefunktion. Derfor kan der forventes noget større akkumulering af alendronat i knogler hos patienter med nedsat nyrefunktion.
Ingen dosisjustering er nødvendig for patienter med kreatininclearance 35 til 60 ml/min. FOSAMAX 35 mg anbefales ikke til patienter med kreatininclearance mindre end 35 ml/min på grund af manglende erfaring med alendronat ved nyresvigt.
Nedsat leverfunktion
Da der er tegn på, at alendronat ikke metaboliseres eller udskilles i galden, er der ikke udført undersøgelser af patienter med nedsat leverfunktion. Ingen dosisjustering er nødvendig.
Lægemiddelinteraktioner
Intravenøs ranitidin blev vist at fordoble biotilgængeligheden af oral alendronat. Den kliniske betydning af denne øgede biotilgængelighed og om lignende stigninger vil forekomme hos patienter, der får orale H2-antagonister, er ukendt.
Hos raske forsøgspersoner frembragte oral prednison (20 mg tre gange dagligt i fem dage) ingen klinisk betydningsfuld ændring i den orale biotilgængelighed af alendronat (en gennemsnitlig stigning i området fra 20 til 44%).
Produkter, der indeholder calcium og andre multivalente kationer, vil sandsynligvis interferere med absorptionen af alendronat.
Dyretoksikologi og/eller farmakologi
De relative hæmmende aktiviteter på knogleresorption og mineralisering af alendronat og etidronat blev sammenlignet i Schenk-assayet, som er baseret på histologisk undersøgelse af epifyserne hos voksende rotter. I dette assay var den laveste dosis alendronat, der interfererede med knoglemineralisering (førende til osteomalaci), 6000 gange den antiresorptive dosis. Det tilsvarende forhold for etidronat var én til én. Disse data tyder på, at det er højst usandsynligt, at alendronat administreret i terapeutiske doser inducerer osteomalaci.
Kliniske Studier
Behandling af osteoporose hos postmenopausale kvinder
Daglig dosering
Effekten af FOSAMAX 10 mg dagligt blev vurderet i fire kliniske forsøg. Studie 1, et treårigt, multicenter, dobbeltblindt, placebokontrolleret, amerikansk klinisk studie inkluderede 478 patienter med en BMD T-score på eller under minus 2,5 med eller uden en tidligere vertebral fraktur; Studie 2, et treårigt, multicenter, dobbeltblindt, placebokontrolleret multinationalt klinisk studie inkluderede 516 patienter med en BMD T-score på eller under minus 2,5 med eller uden tidligere vertebral fraktur; Undersøgelse 3, den treårige undersøgelse af frakturinterventionsforsøget (FIT), en undersøgelse, der inkluderede 2027 postmenopausale patienter med mindst én baseline vertebral fraktur; og Studie 4, Fire-Year Study of FIT: en undersøgelse, der inkluderede 4432 postmenopausale patienter med lav knoglemasse, men uden en baseline vertebral fraktur.
Effekt på brudforekomst
For at vurdere virkningerne af FOSAMAX på forekomsten af vertebrale frakturer (påvist ved digitaliseret radiografi; ca. en tredjedel af disse var klinisk symptomatiske), blev de amerikanske og multinationale undersøgelser kombineret i en analyse, der sammenlignede placebo med de samlede dosisgrupper af FOSAMAX (5 eller 10 mg i tre år eller 20 mg i to år efterfulgt af 5 mg i et år). Der var en statistisk signifikant reduktion i andelen af patienter behandlet med FOSAMAX 70 mg, der oplevede en eller flere nye vertebrale frakturer i forhold til dem, der blev behandlet med placebo (3,2 % vs. 6,2 %; en relativ risikoreduktion på 48 %). En reduktion i det samlede antal nye vertebrale frakturer (4,2 vs. 11,3 pr. 100 patienter) blev også observeret. I den samlede analyse havde patienter, der fik FOSAMAX, et statistisk tab i statur, der var statistisk signifikant mindre, end det blev observeret hos dem, der fik placebo (-3,0 mm vs. -4,6 mm).
Fracture Intervention Trial (FIT) bestod af to undersøgelser med postmenopausale kvinder: Tre-års undersøgelsen af patienter, der havde mindst én baseline radiografisk vertebral fraktur og fire-års undersøgelsen af patienter med lav knoglemasse, men uden baseline vertebral fraktur. I begge undersøgelser af FIT gennemførte 96 % af randomiserede patienter undersøgelserne (dvs. havde et afslutningsbesøg ved den planlagte afslutning af undersøgelsen); ca. 80 % af patienterne tog stadig undersøgelsesmedicin efter afslutningen.
Frakturinterventionsforsøg: Tre-årigt studie (patienter med mindst én baseline radiografisk vertebral fraktur)
Denne randomiserede, dobbeltblindede, placebokontrollerede, 2027-patientundersøgelse (FOSAMAX 70mg, n=1022; placebo, n=1005) viste, at behandling med FOSAMAX resulterede i statistisk signifikante reduktioner i frakturincidensen efter tre år som vist i tabel 6 .
denne population af patienter med baseline vertebral fraktur reducerede behandling med FOSAMAX desuden forekomsten af hospitalsindlæggelser signifikant (25,0 % vs. 30,7 %).
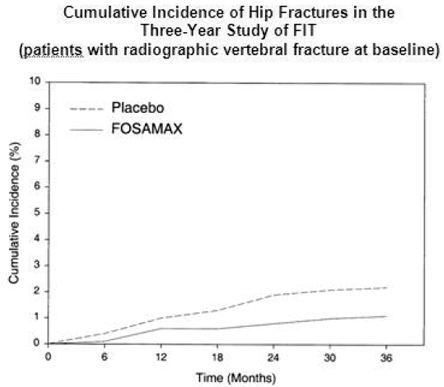
I det treårige studie af FIT forekom hoftebrud hos 22 (2,2 %) af 1005 patienter på placebo og 11 (1,1 %) af 1022 patienter på FOSAMAX, p=0,047. Figur 1 viser den kumulative forekomst af hoftebrud i denne undersøgelse.
Figur 1: Kumulativ forekomst af hoftefrakturer i den treårige undersøgelse af FIT (patienter med radiografisk vertebral fraktur ved baseline)
Frakturinterventionsforsøg: Fireårig undersøgelse (patienter med lav knoglemasse, men uden baseline radiografisk vertebral fraktur)
Denne randomiserede, dobbeltblindede, placebokontrollerede, 4432-patientundersøgelse (FOSAMAX 70mg, n=2214; placebo, n=2218) undersøgte yderligere reduktionen i frakturhyppighed på grund af FOSAMAX. Hensigten med undersøgelsen var at rekruttere kvinder med osteoporose, defineret som en baseline lårhals-BMD mindst to standardafvigelser under gennemsnittet for unge voksne kvinder. På grund af efterfølgende revisioner af de normative værdier for lårhals-BMD blev 31 % af patienterne imidlertid fundet ikke at opfylde dette adgangskriterium, og derfor inkluderede denne undersøgelse både osteoporotiske og ikke-nosteoporotiske kvinder. Resultaterne er vist i tabel 7 for patienter med osteoporose.
Brudresultater på tværs af undersøgelser
den treårige undersøgelse af FIT reducerede FOSAMAX 35 mg procentdelen af kvinder, der oplever mindst én ny radiografisk vertebral fraktur fra 15,0 % til 7,9 % (47 % relativ risikoreduktion, p
FOSAMAX reducerede procentdelen af kvinder, der oplever flere (to eller flere) nye hvirvelbrud fra 4,2 % til 0,6 % (87 % relativ risikoreduktion, p
Således reducerede FOSAMAX 35 mg forekomsten af radiografiske vertebrale frakturer hos osteoporotiske kvinder, uanset om de havde et tidligere radiografisk vertebral fraktur eller ej.
Effekt på knoglemineraltæthed
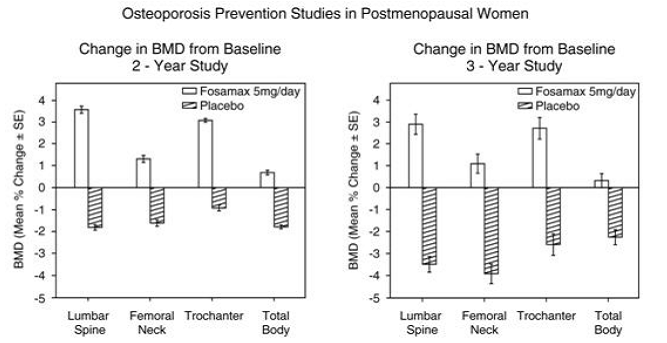
Knoglemineraltæthedens effekt af FOSAMAX 10 mg én gang dagligt hos postmenopausale kvinder i alderen 44 til 84 år med osteoporose (knoglemineraltæthed i lændehvirvelsøjlen [BMD] på mindst 2 standardafvigelser under præmenopausalt gennemsnit) blev påvist i fire dobbelt- blinde, placebokontrollerede kliniske studier af to eller tre år' varighed.
Figur 2 viser den gennemsnitlige stigning i BMD i lændehvirvelsøjlen, lårbenshalsen og trochanter hos patienter, der fik FOSAMAX 10 mg/dag i forhold til placebobehandlede patienter efter tre år for hver af disse undersøgelser.
Figur 2: Osteoporosebehandlingsundersøgelser hos postmenopausale kvinder Stigning i BMD FOSAMAX 10 mg/dag efter tre år
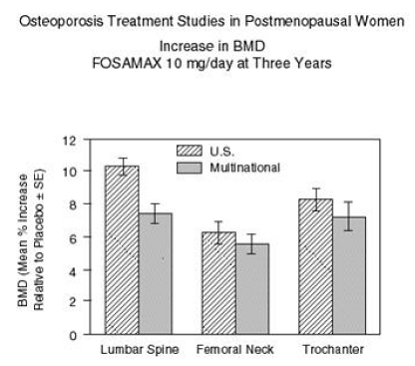
Efter tre år blev der set signifikante stigninger i BMD i forhold til både baseline og placebo på hvert målested i hver undersøgelse hos patienter, som fik FOSAMAX 10 mg/dag. BMD i hele kroppen steg også signifikant i hver undersøgelse, hvilket tyder på, at stigningerne i knoglemassen i rygsøjlen og hoften ikke skete på bekostning af andre skeletsteder. Stigninger i BMD var tydelige så tidligt som tre måneder og fortsatte gennem de tre år af behandlingen. (Se figur 3 for lændehvirvelsøjlens resultater.) I den toårige forlængelse af disse undersøgelser resulterede behandling af 147 patienter med FOSAMAX 10 mg/dag i fortsatte stigninger i BMD ved lændehvirvelsøjlen og trochanter (absolut yderligere stigning mellem år 3 og 5: lændehvirvelsøjlen, 0,94 %; trochanter, 0,88 %). BMD ved lårbenshalsen, underarmen og hele kroppen blev opretholdt. FOSAMAX var tilsvarende effektiv uanset alder, race, baseline rate af knogleomsætning og baseline BMD i det undersøgte interval (mindst 2 standardafvigelser under præmenopausalt gennemsnit).
Figur 3: Osteoporosebehandlingsundersøgelser hos postmenopausale kvinder Tidsforløb for effekt af FOSAMAX 10mg/dag versus placebo: Lumbalhvirvelsøjle BMD procentvis ændring fra baseline
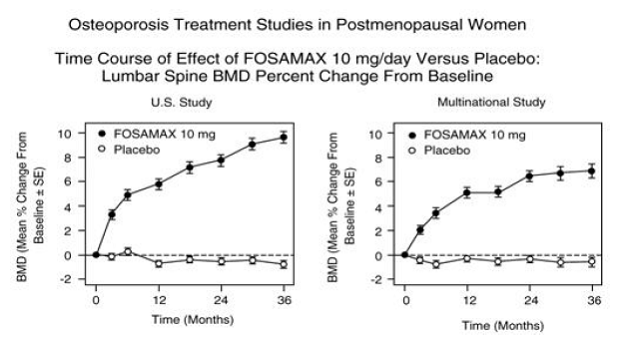
Hos patienter med postmenopausal osteoporose behandlet med FOSAMAX 10 mg/dag i et eller to år, blev virkningerne af behandlingsophør vurderet. Efter seponering var der ingen yderligere stigninger i knoglemasse, og hastigheden af knogletab svarede til placebogrupperne.
Knoglehistologi
Knoglehistologi hos 270 postmenopausale patienter med osteoporose behandlet med FOSAMAX i doser fra 1 til 20 mg/dag i et, to eller tre år afslørede normal mineralisering og struktur, såvel som det forventede fald i knogleomsætning i forhold til placebo. Disse data, sammen med den normale knoglehistologi og øgede knoglestyrke observeret hos rotter og bavianer udsat for langtidsbehandling med alendronat, understøtter konklusionen om, at knogle dannet under behandling med FOSAMAX 35 mg er af normal kvalitet.
Effekt på højden
FOSAMAX var over en tre- eller fireårig periode forbundet med statistisk signifikante reduktioner i højdetab i forhold til placebo hos patienter med og uden baseline radiografiske vertebrale frakturer. Ved afslutningen af FIT-studierne var forskellene mellem behandlingsgrupper 3,2 mm i det treårige studie og 1,3 mm i det fireårige studie.
Ugentlig dosering
Den terapeutiske ækvivalens af FOSAMAX 70 mg en gang om ugen (n=519) og FOSAMAX 10 mg dagligt (n=370) blev påvist i et etårigt, dobbeltblindt multicenterstudie af postmenopausale kvinder med osteoporose. I den primære analyse af fuldførere var den gennemsnitlige stigning fra baseline i lændehvirvelsøjlens BMD efter et år 5,1 % (4,8, 5,4 %; 95 % CI) i 70 mg én gang ugentlig-gruppen (n=440) og 5,4 % ( 5,0, 5,8 %; 95 % CI) i 10 mg daglig gruppe (n=330). De to behandlingsgrupper var også ens med hensyn til BMD-stigninger på andre skeletsteder. Resultaterne af intention-to-treat-analysen stemte overens med den primære analyse af fuldførere.
Samtidig brug med østrogen/hormonerstatningsterapi (HRT)
Virkningerne på BMD af behandling med FOSAMAX 10 mg én gang dagligt og konjugeret østrogen (0,625 mg/dag) enten alene eller i kombination blev vurderet i et toårigt, dobbeltblindt, placebokontrolleret studie af hysterektomerede postmenopausale osteoporotiske kvinder (n= 425). Efter to år var stigningerne i lændehvirvelsøjlens BMD fra baseline signifikant større med kombinationen (8,3 %) end med enten østrogen eller FOSAMAX alene (begge 6,0 %).
Effekten på BMD, når FOSAMAX 35 mg blev tilføjet til stabile doser (i mindst et år) af HRT (østrogen ± gestagen) blev vurderet i et etårigt, dobbeltblindt, placebokontrolleret studie med postmenopausale osteoporotiske kvinder (n=428). Tilføjelsen af FOSAMAX 10 mg én gang dagligt til HRT gav efter et år signifikant større stigninger i lændehvirvelsøjlens BMD (3,7 %) sammenlignet med HRT alene (1,1 %).
disse undersøgelser blev der set signifikante stigninger eller gunstige tendenser i BMD for kombineret behandling sammenlignet med HRT alene ved den totale hofte, lårbenshals og trochanter. Der blev ikke set nogen signifikant effekt for total krops-BMD.
Histomorfometriske undersøgelser af transiliacale biopsier i 92 forsøgspersoner viste normal knoglearkitektur. Sammenlignet med placebo var der en 98 % suppression af knogleomsætning (som vurderet ved mineralisering af overfladen) efter 18 måneders kombineret behandling med FOSAMAX 35 mg og HRT, 94 % på FOSAMAX 35 mg alene og 78 % på HRT alene. Langtidsvirkningerne af kombineret FOSAMAX 35 mg og HRT på frakturforekomst og frakturheling er ikke blevet undersøgt.
Forebyggelse af osteoporose hos postmenopausale kvinder
Daglig dosering
Forebyggelse af knogletab blev påvist i to dobbeltblindede, placebokontrollerede undersøgelser af postmenopausale kvinder i alderen 40-60 år. Et tusind seks hundrede ni patienter (FOSAMAX 5 mg/dag; n=498), som var mindst seks måneder postmenopausale, blev indgået i en to-årig undersøgelse uden hensyntagen til deres baseline BMD. I den anden undersøgelse blev 447 patienter (FOSAMAX 5 mg/dag; n=88), som var mellem seks måneder og tre år efter overgangsalderen, behandlet i op til tre år. Hos de placebobehandlede patienter sås BMD-tab på ca. 1 % om året i rygsøjlen, hoften (lårhals og trochanter) og hele kroppen. I modsætning hertil forhindrede FOSAMAX 5 mg/dag knogletab hos størstedelen af patienterne og inducerede signifikante stigninger i gennemsnitlig knoglemasse på hvert af disse steder (se figur 4). Derudover reducerede FOSAMAX 5 mg/dag hastigheden af knogletab ved underarmen med ca. halvdelen i forhold til placebo. FOSAMAX 5 mg/dag var tilsvarende effektiv i denne population uanset alder, tid siden overgangsalderen, race og baseline-hastigheden af knogleomsætning.
Figur 4: Osteoporoseforebyggende undersøgelser hos postmenopausale kvinder
Knoglehistologi
Knoglehistologi var normal hos de 28 patienter, der blev biopsieret ved udgangen af tre år, og som fik FOSAMAX i doser på op til 10 mg/dag.
Ugentlig dosering
Den terapeutiske ækvivalens af FOSAMAX 35 mg en gang om ugen (n=362) og FOSAMAX 5 mg dagligt (n=361) blev påvist i et etårigt, dobbeltblindt multicenterstudie af postmenopausale kvinder uden osteoporose. I den primære analyse af fuldførere var den gennemsnitlige stigning fra baseline i lændehvirvelsøjlens BMD efter et år 2,9 % (2,6, 3,2 %; 95 % CI) i 35 mg én gang ugentlig-gruppen (n=307) og 3,2 % ( 2,9, 3,5 %; 95 % CI) i 5 mg daglig gruppe (n=298). De to behandlingsgrupper var også ens med hensyn til BMD-stigninger på andre skeletsteder. Resultaterne af intention-to-treat-analysen stemte overens med den primære analyse af fuldførere.
Behandling for at øge knoglemassen hos mænd med osteoporose
Effekten af FOSAMAX 35 mg hos mænd med hypogonadal eller idiopatisk osteoporose blev påvist i to kliniske undersøgelser.
Daglig dosering
Et toårigt, dobbeltblindt, placebokontrolleret, multicenterstudie med FOSAMAX 10 mg én gang dagligt inkluderede i alt 241 mænd mellem 31 og 87 år (gennemsnit 63). Alle patienter i forsøget havde enten en BMD T-score mindre end eller lig med -2 ved lårbenshalsen og mindre end eller lig med -1 ved lændehvirvelsøjlen, eller en baseline osteoporotisk fraktur og en BMD T-score mindre end eller lig med -1 ved lårbenshalsen. Efter to år var den gennemsnitlige stigning i BMD i forhold til placebo hos mænd, der fik FOSAMAX 10 mg/dag, signifikante på følgende steder: lændehvirvelsøjlen, 5,3 %; lårbenshals, 2,6%; trochanter, 3,1%; og total krop, 1,6%. Behandling med FOSAMAX 70 mg reducerede også højdetab (FOSAMAX, -0,6 mm vs. placebo, -2,4 mm).
Ugentlig dosering
Et etårigt, dobbeltblindt, placebokontrolleret, multicenterstudie med FOSAMAX 70 mg én gang om ugen inkluderede i alt 167 mænd mellem 38 og 91 år (gennemsnit 66). Patienterne i undersøgelsen havde enten en BMD T-score mindre end eller lig med -2 ved lårbenshalsen og mindre end eller lig med -1 ved lændehvirvelsøjlen, eller en BMD T-score mindre end eller lig med -2 ved lændehvirvelsøjlen og mindre end eller lig med -1 ved lårbenshalsen, eller en baseline osteoporotisk fraktur og en BMD T-score mindre end eller lig med -1 ved lårbenshalsen. Efter et år var den gennemsnitlige stigning i BMD i forhold til placebo hos mænd, der fik FOSAMAX 70 mg en gang om ugen, signifikante på følgende steder: lændehvirvelsøjlen, 2,8 %; lårbenshals, 1,9%; trochanter, 2,0%; og total krop, 1,2%. Disse stigninger i BMD svarede til dem, der blev set efter et år i undersøgelsen på 10 mg én gang dagligt.
begge undersøgelser var BMD-responserne ens uanset alder (større end eller lig med 65 år vs. mindre end 65 år), gonadal funktion (baseline testosteron mindre end 9 ng/dL vs. større end eller lig med 9 ng/dL) , eller baseline BMD (lårhals og lændehvirvel T-score mindre end eller lig med -2,5 vs. større end -2,5).
Behandling af glukokortikoid-induceret osteoporose
Effekten af FOSAMAX 5 og 10 mg én gang dagligt hos mænd og kvinder, der får glukokortikoider (mindst 7,5 mg/dag af prednison eller tilsvarende) blev påvist i to, et-årige, dobbeltblindede, randomiserede, placebokontrollerede, multicenterundersøgelser af stort set identisk design, det ene udført i USA og det andet i 15 forskellige lande (Multinational [som også inkluderede FOSAMAX 2,5 mg/dag]). Disse undersøgelser inkluderede henholdsvis 232 og 328 patienter mellem 17 og 83 år med en række glukokortikoidkrævende sygdomme. Patienter fik supplerende calcium og vitamin D. Figur 5 viser de gennemsnitlige stigninger i forhold til placebo i BMD i lændehvirvelsøjlen, lårbenshalsen og trochanter hos patienter, der fik FOSAMAX 5 mg/dag for hver undersøgelse.
Figur 5: Undersøgelser i glukokortikoid-behandlede patienter Stigning i BMD FOSAMAX 5 mg/dag efter et år
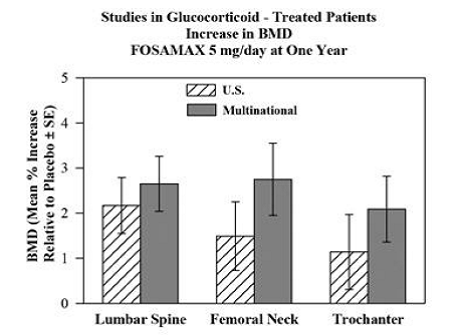
Efter et år blev der set signifikante stigninger i BMD i forhold til placebo i de kombinerede undersøgelser på hvert af disse steder hos patienter, som fik FOSAMAX 5 mg/dag. Hos de placebobehandlede patienter forekom et signifikant fald i BMD ved lårbenshalsen (-1,2%), og mindre fald blev set ved lændehvirvelsøjlen og trochanter. BMD i hele kroppen blev opretholdt med FOSAMAX 5 mg/dag. Forøgelserne i BMD med FOSAMAX 10 mg/dag svarede til dem med FOSAMAX 5 mg/dag hos alle patienter med undtagelse af postmenopausale kvinder, der ikke fik østrogenbehandling. Hos disse kvinder var stigningerne (i forhold til placebo) med FOSAMAX 10 mg/dag større end dem med FOSAMAX 5 mg/dag ved lændehvirvelsøjlen (4,1 % vs. 1,6 %) og trochanter (2,8 % vs. 1,7 %). men ikke på andre steder. FOSAMAX 35 mg var effektivt uanset dosis eller varighed af glukokortikoidbrug. Derudover var FOSAMAX tilsvarende effektiv uanset alder (mindre end 65 vs. større end eller lig med 65 år), race (kaukasisk vs. andre racer), køn, underliggende sygdom, baseline BMD, baseline knogleomsætning og brug med en forskellige almindelige lægemidler.
Knoglehistologi var normal hos de 49 patienter, der blev biopsieret ved udgangen af et år, og som fik FOSAMAX i doser på op til 10 mg/dag.
Af de oprindelige 560 patienter i disse undersøgelser fortsatte 208 patienter, som forblev på mindst 7,5 mg/dag af prednison eller tilsvarende, i en etårig dobbeltblindet forlængelse. Efter to års behandling steg rygsøjlens BMD med 3,7 % og 5,0 % i forhold til placebo med henholdsvis FOSAMAX 5 og 10 mg/dag. Signifikante stigninger i BMD (i forhold til placebo) blev også observeret ved lårbenshalsen, trochanter og hele kroppen.
Efter et år oplevede 2,3 % af patienterne behandlet med FOSAMAX 5 eller 10 mg/dag (samlet) mod 3,7 % af dem, der blev behandlet med placebo, en ny vertebral fraktur (ikke signifikant). I den population, der blev undersøgt i to år, reducerede behandling med FOSAMAX (poolede dosisgrupper: 5 eller 10 mg i to år eller 2,5 mg i et år efterfulgt af 10 mg i et år) signifikant forekomsten af patienter med en ny vertebral fraktur (FOSAMAX 0,7 % vs. placebo 6,8 %).
Behandling af Pagets knoglesygdom
Effekten af FOSAMAX 40 mg én gang dagligt i seks måneder blev påvist i to dobbeltblindede kliniske undersøgelser af mandlige og kvindelige patienter med moderat til svær Pagets sygdom (alkalisk fosfatase mindst to gange den øvre grænse for normal): en placebo -kontrolleret, multinational undersøgelse og en amerikansk sammenlignende undersøgelse med dinatriumetidronat 400 mg/dag. Figur 6 viser de gennemsnitlige procentvise ændringer fra baseline i serum alkalisk fosfatase i op til seks måneders randomiseret behandling.
Figur 6: Undersøgelser af Pagets knoglesygdom på serum alkalisk fosfatase af FOSAMAX 40 mg/dag versus placebo eller etidronat 400 mg/dag
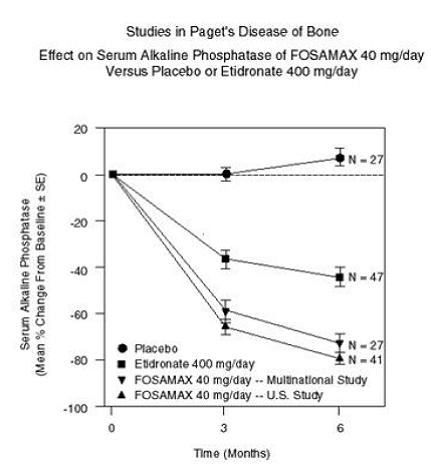
Efter seks måneder var suppressionen af alkalisk fosfatase hos patienter behandlet med FOSAMAX signifikant større end den, der blev opnået med etidronat og i modsætning til den fuldstændige mangel på respons hos placebobehandlede patienter. Respons (defineret som enten normalisering af serum alkalisk fosfatase eller fald fra baseline større end eller lig med 60%) forekom hos ca. 85 % af patienterne behandlet med FOSAMAX i de kombinerede undersøgelser vs. 30 % i etidronatgruppen og 0 % i placebogruppen. gruppe. FOSAMAX 70 mg var tilsvarende effektiv uanset alder, køn, race, tidligere brug af andre bisfosfonater eller baseline alkalisk fosfatase inden for det undersøgte interval (mindst to gange den øvre grænse for normal).
Knoglehistologi blev evalueret hos 33 patienter med Pagets sygdom behandlet med FOSAMAX 40 mg/dag i 6 måneder. Som hos patienter behandlet for osteoporose [se Kliniske Studier ], FOSAMAX svækkede ikke mineraliseringen, og det forventede fald i knogleomsætningshastigheden blev observeret. Normal lamelknogle blev produceret under behandling med FOSAMAX, selv hvor allerede eksisterende knogle var vævet og uorganiseret. Overordnet set understøtter knoglehistologidata konklusionen om, at knogle dannet under behandling med FOSAMAX 35mg er af normal kvalitet.
PATIENTOPLYSNINGER
FOSAMAX® (FOSS-ah-max)(natriumalendronat) Tabletter
Læs medicinvejledningen, der følger med FOSAMAX 70mg, før du begynder at tage den, og hver gang du får en genopfyldning. Der kan være nye oplysninger. Denne medicinvejledning træder ikke i stedet for at tale med din læge om din medicinske tilstand eller behandling. Tal med din læge, hvis du har spørgsmål om FOSAMAX.
Hvad er den vigtigste information, jeg bør vide om FOSAMAX 70mg?
FOSAMAX 70mg kan forårsage alvorlige bivirkninger, herunder:
1. Spiserørsproblemer.
Nogle mennesker, der tager FOSAMAX 35mg, kan udvikle problemer i spiserøret (røret, der forbinder munden og maven).
Disse problemer omfatter irritation, betændelse eller sår i spiserøret, som nogle gange kan bløde.
- Det er vigtigt, at du tager FOSAMAX 70mg nøjagtigt som foreskrevet for at hjælpe med at mindske din chance for at få problemer med spiserøret. (Se afsnittet "Hvordan skal jeg tage FOSAMAX?")
- Stop med at tage FOSAMAX og kontakt din læge med det samme, hvis du får brystsmerter, ny eller forværret halsbrand eller har problemer eller smerter, når du synker.
2. Lavt calciumniveau i dit blod (hypokalcæmi).
FOSAMAX kan sænke calciumniveauet i dit blod. Hvis du har lavt calcium i blodet, før du begynder at tage FOSAMAX, kan det blive værre under behandlingen. Dit lave blodkalcium skal behandles, før du tager FOSAMAX. De fleste mennesker med lavt calciumniveau i blodet har ikke symptomer, men nogle mennesker kan have symptomer. Ring til din læge med det samme, hvis du har symptomer på lavt calcium i blodet, såsom:
- Spasmer, trækninger eller kramper i dine muskler
- Følelsesløshed eller prikken i dine fingre, tæer eller omkring din mund
Din læge kan ordinere calcium og D-vitamin for at forhindre lave calciumniveauer i dit blod, mens du tager FOSAMAX. Tag calcium og D-vitamin, som din læge fortæller dig.
3. Knogle-, led- eller muskelsmerter.
Nogle mennesker, der tager FOSAMAX, udvikler alvorlige knogle-, led- eller muskelsmerter.
4. Alvorlige kæbeknogleproblemer (osteonekrose).
Der kan opstå alvorlige kæbeknogleproblemer, når du tager FOSAMAX. Din læge bør undersøge din mund, før du starter med FOSAMAX. Din læge kan bede dig om at se din tandlæge, før du starter FOSAMAX. Det er vigtigt for dig at praktisere god mundpleje under behandlingen med FOSAMAX.
5. Usædvanlige lårknoglebrud.
Nogle mennesker har udviklet usædvanlige brud i deres lårben. Symptomer på et brud kan omfatte nye eller usædvanlige smerter i din hofte, lyske eller lår.
Ring til din læge med det samme, hvis du har nogen af disse bivirkninger.
Hvad er FOSAMAX 70mg?
- FOSAMAX 70mg er en receptpligtig medicin, der bruges til at:
- Behandle eller forebygge osteoporose hos kvinder efter overgangsalderen. Det hjælper med at reducere risikoen for at få et hofte- eller rygbrud (brud).
- Øge knoglemassen hos mænd med osteoporose.
- Behandl osteoporose hos enten mænd eller kvinder, der tager kortikosteroidmedicin.
Behandl visse mænd og kvinder, der har Pagets knoglesygdom.
Det vides ikke, hvor længe FOSAMAX 70 mg virker til behandling og forebyggelse af osteoporose. Du bør se din læge regelmæssigt for at afgøre, om FOSAMAX 70mg stadig er det rigtige for dig.
FOSAMAX må ikke bruges til børn.
Hvem bør ikke tage FOSAMAX 70mg?
Tag ikke FOSAMAX, hvis du:
- Har visse problemer med din spiserør, det rør, der forbinder din mund med din mave
- Kan ikke stå eller sidde oprejst i mindst 30 minutter
- Har lave niveauer af calcium i dit blod
- Er allergisk over for FOSAMAX 70mg eller nogen af dets ingredienser. En liste over ingredienser er i slutningen af denne folder.
Hvad skal jeg fortælle min læge, før jeg tager FOSAMAX 35mg?
Før du starter FOSAMAX, skal du sørge for at tale med din læge, hvis du:
- Har problemer med at synke
- Har mave- eller fordøjelsesproblemer
- Har lavt calcium i blodet
- Planlæg at få tandoperation eller tænder fjernet
- Har nyreproblemer
- Er blevet fortalt, at du har problemer med at optage mineraler i din mave eller tarm (malabsorptionssyndrom)
- Er gravid, forsøger at blive gravid eller har mistanke om, at du er gravid. Hvis du bliver gravid, mens du tager FOSAMAX, skal du stoppe med at tage det og kontakte din læge. Det vides ikke, om FOSAMAX kan skade dit ufødte barn.
- Ammer eller planlægger at amme. Det vides ikke, om FOSAMAX udskilles i din mælk og kan skade din baby.
Fortæl det især din læge, hvis du tager:
- antacida
- aspirin
- Ikke-steroide antiinflammatoriske (NSAID) lægemidler
Fortæl din læge om al den medicin du tager, herunder receptpligtig og ikke-receptpligtig medicin, vitaminer og naturlægemidler. Visse lægemidler kan påvirke, hvordan FOSAMAX 70mg virker.
Kend den medicin du tager. Hold en liste over dem og vis den til din læge og apotek, hver gang du får en ny medicin.
Hvordan skal jeg tage FOSAMAX 35mg?
- Tag FOSAMAX 35mg nøjagtigt som din læge fortæller dig.
- FOSAMAX virker kun, hvis det tages på tom mave.
- Tag FOSAMAX 35mg, efter du står op for dagen, og før du tager din første mad, drikke eller anden medicin.
- Tag FOSAMAX, mens du sidder eller står.
- Du må ikke tygge eller sutte på en tablet FOSAMAX.
- Synk kun FOSAMAX tablet med et fuldt glas (6-8 oz) almindeligt vand.
- Lade være med tage FOSAMAX med mineralvand, kaffe, te, sodavand eller juice.
- Hvis du tager Alendronat dagligt:
- Tag 1 alendronat-tablet én gang om dagen, hver dag efter du står op for dagen, og før du tager din første mad, drikke eller anden medicin.
- Hvis du tager FOSAMAX én gang om ugen:
- Vælg den ugedag, der passer bedst til din tidsplan.
- Tag 1 dosis FOSAMAX hver uge på din valgte dag, efter du står op for dagen, og før du tager din første mad, drikke eller anden medicin.
- Hvis du tager Alendronat dagligt:
Efter indtagelse af FOSAMAX 35 mg tablet, vent mindst 30 minutter:
- Før du lægger dig ned. Du kan sidde, stå eller gå og lave normale aktiviteter som at læse.
- Før du tager din første mad eller drikke, bortset fra almindeligt vand.
- Før du tager anden medicin, herunder antacida, calcium og andre kosttilskud og vitaminer.
Læg dig ikke ned i mindst 30 minutter efter du har taget FOSAMAX og efter du har spist dagens første mad.
Hvis du glemmer en dosis FOSAMAX 70 mg, må du ikke tage den senere på dagen. Tag din glemte dosis næste morgen, efter du har husket det, og vend derefter tilbage til din normale tidsplan. Tag ikke 2 doser på samme dag.
Ring til din læge, hvis du tager for meget FOSAMAX 70 mg. Forsøg ikke at kaste op. Læg dig ikke ned.
Hvad er de mulige bivirkninger af FOSAMAX 70mg?
FOSAMAX kan forårsage alvorlige bivirkninger.
- Se "Hvad er den vigtigste information, jeg bør vide om FOSAMAX?"
De mest almindelige bivirkninger af FOSAMAX 70mg er:
- Smerter i maveområdet (mave).
- Halsbrand
- Forstoppelse
- Diarré
- Dårlig mave
- Smerter i dine knogler, led eller muskler
- Kvalme
Du kan få allergiske reaktioner, såsom nældefeber eller hævelse af dit ansigt, læber, tunge eller svælg.
Forværring af astma er blevet rapporteret.
Fortæl det til din læge, hvis du har en bivirkning, som generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af FOSAMAX. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan opbevarer jeg FOSAMAX?
- Opbevar FOSAMAX 35mg ved stuetemperatur, 59°F til 86°F (15°C til 30°C).
- Opbevar FOSAMAX i en tæt lukket beholder.
Opbevar FOSAMAX og al medicin utilgængeligt for børn.
Generel information om sikker og effektiv brug af FOSAMAX.
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en medicinvejledning. Brug ikke FOSAMAX 35 mg til en tilstand, som den ikke er ordineret til. Giv ikke FOSAMAX 35 mg til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Denne medicinvejledning opsummerer de vigtigste oplysninger om FOSAMAX. Hvis du vil have mere information, så tal med din læge. Du kan bede din læge eller apoteket om oplysninger om FOSAMAX, som er skrevet til sundhedspersonale. For mere information, gå til: www.FOSAMAX.com eller ring på 1-800-622-4477 (gratis).
Hvad er ingredienserne i FOSAMAX?
Aktiv ingrediens: alendronatnatrium
Inaktive ingredienser: mikrokrystallinsk cellulose, vandfri laktose, croscarmellosenatrium, magnesiumstearat.
Denne medicinvejledning er godkendt af US Food and Drug Administration.
