Diflucan 50mg, 100mg, 150mg, 200mg Fluconazole Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Diflucan, og hvordan bruges det?
Diflucan er en receptpligtig medicin, der bruges til at behandle symptomer på svampeinfektioner. Diflucan 50mg kan bruges alene eller sammen med anden medicin.
Diflucan 100mg tilhører en klasse af medicin kaldet svampedræbende midler.
Hvad er bivirkninger af Diflucan 150mg?
Diflucan 100mg kan forårsage alvorlige bivirkninger, herunder:
- hurtig eller bankende hjerteslag,
- flagre i dit bryst,
- stakåndet,
- pludselig svimmelhed,
- feber,
- kuldegysninger,
- kropssmerter,
- influenza symptomer,
- let blå mærker eller blødning,
- usædvanlig svaghed,
- krampeanfald (kramper),
- hududslæt eller læsioner,
- mistet appetiten,
- smerter i øvre mave,
- mørk urin,
- lerfarvet skammel, og
- gulfarvning af øjne eller hud (gulsot)
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Diflucan omfatter:
- kvalme,
- mavesmerter,
- diarré,
- dårlig mave,
- hovedpine,
- svimmelhed, og
- ændringer i din smagssans
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Diflucan. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
DIFLUCAN® (fluconazol), den første af en ny underklasse af syntetiske triazol-svampemidler, er tilgængelig som tabletter til oral administration, som et pulver til oral suspension.
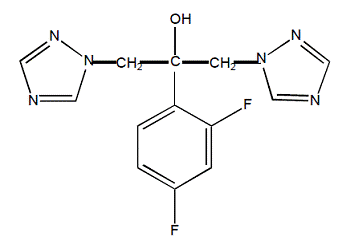
Fluconazol er kemisk betegnet som 2,4-difluor-α,α1-bis(1H-1,2,4-triazol-1-ylmethyl)benzylalkohol med en empirisk formel på C13H12F2N6O og en molekylvægt på 306,3. Strukturformlen er:
Fluconazol er et hvidt krystallinsk fast stof, som er let opløseligt i vand og saltvand.
DIFLUCAN tabletter indeholder 50, 100, 150 eller 200 mg fluconazol og følgende inaktive ingredienser: mikrokrystallinsk cellulose, dibasisk calciumphosphat vandfri, povidon, croscarmellosenatrium, FD&C Red No. 40 aluminium lake stearat og magnesium stearat.
DIFLUCAN til oral suspension indeholder 350 mg eller 1400 mg fluconazol og følgende inaktive ingredienser: saccharose, natriumcitratdihydrat, vandfri citronsyre, natriumbenzoat, titaniumdioxid, kolloid siliciumdioxid, xanthangummi og naturlig appelsinsmag. Efter rekonstituering med 24 ml destilleret vand eller renset vand (USP), indeholder hver ml rekonstitueret suspension 10 mg eller 40 mg fluconazol.
INDIKATIONER
DIFLUCAN (fluconazol) er indiceret til behandling af:
- Vaginal candidiasis (vaginale gærinfektioner på grund af Candida).
- Oropharyngeal og esophageal candidiasis. I åbne, ikke-komparative undersøgelser af relativt små antal patienter var DIFLUCAN også effektiv til behandling af Candida urinvejsinfektioner, peritonitis og systemiske Candida-infektioner, herunder candidæmi, dissemineret candidiasis og lungebetændelse.
- Kryptokok meningitis. Før du ordinerer DIFLUCAN (fluconazol) til AIDS-patienter med kryptokokmeningitis, se venligst Kliniske Studier afsnit. Der er ikke udført undersøgelser, der sammenligner DIFLUCAN 150mg med amphotericin B hos ikke-hiv-inficerede patienter.
Profylakse
DIFLUCAN er også indiceret til at reducere forekomsten af candidiasis hos patienter, der gennemgår knoglemarvstransplantation, og som får cytotoksisk kemoterapi og/eller strålebehandling.
Prøver til svampekultur og andre relevante laboratorieundersøgelser (serologi, histopatologi) bør indhentes før behandling for at isolere og identificere forårsagende organismer. Terapi kan iværksættes, før resultaterne af kulturerne og andre laboratorieundersøgelser er kendt; Men når disse resultater er tilgængelige, bør anti-infektionsterapi justeres i overensstemmelse hermed.
DOSERING OG ADMINISTRATION
Dosering og administration hos voksne
Enkelt dosis
Vaginal candidiasis
Den anbefalede dosis af DIFLUCAN til vaginal candidiasis er 150 mg som en enkelt oral dosis.
Multipel dosis
DA ORAL ABSORPTION ER HURTIG OG NÆSTEN FULDSTÆNDIG, ER DEN DAGLIGE DOSIS AF DIFLUCAN (FLUCONAZOL) DEN SAMME FOR ORAL (TABLETTER OG SUSPENSION) OG INTRAVENØS ADMINISTRATION. Generelt anbefales en startdosis på to gange den daglige dosis på den første behandlingsdag for at resultere i plasmakoncentrationer tæt på steady-state på den anden behandlingsdag.
Den daglige dosis af DIFLUCAN 100 mg til behandling af andre infektioner end vaginal candidiasis bør være baseret på den inficerende organisme og patientens respons på behandlingen. Behandlingen bør fortsættes, indtil kliniske parametre eller laboratorietest indikerer, at aktiv svampeinfektion er aftaget. En utilstrækkelig behandlingsperiode kan føre til gentagelse af aktiv infektion. Patienter med AIDS og kryptokokmeningitis eller tilbagevendende oropharyngeal candidiasis kræver normalt vedligeholdelsesbehandling for at forhindre tilbagefald.
Oropharyngeal candidiasis
Den anbefalede dosis af DIFLUCAN til oropharyngeal candidiasis er 200 mg den første dag, efterfulgt af 100 mg én gang dagligt. Kliniske tegn på oropharyngeal candidiasis forsvinder generelt inden for flere dage, men behandlingen bør fortsættes i mindst 2 uger for at mindske sandsynligheden for tilbagefald.
Esophageal Candidiasis
Den anbefalede dosis af DIFLUCAN 200 mg til esophageal candidiasis er 200 mg den første dag, efterfulgt af 100 mg én gang dagligt. Doser op til 400 mg/dag kan anvendes, baseret på medicinsk vurdering af patientens respons på behandlingen. Patienter med esophageal candidiasis bør behandles i mindst tre uger og i mindst to uger efter, at symptomerne er forsvundet.
Systemiske Candida-infektioner
For systemiske Candida-infektioner, herunder candidæmi, dissemineret candidiasis og lungebetændelse, er optimal terapeutisk dosering og behandlingsvarighed ikke blevet fastlagt. I åbne, ikke-komparative undersøgelser af et lille antal patienter er doser på op til 400 mg dagligt blevet brugt.
Urinvejsinfektioner og bughindebetændelse
Til behandling af Candida urinvejsinfektioner og bughindebetændelse er daglige doser på 50 til 200 mg blevet brugt i åbne, ikke-komparative undersøgelser af et lille antal patienter.
Kryptokok meningitis
Den anbefalede dosis til behandling af akut kryptokokmeningitis er 400 mg den første dag, efterfulgt af 200 mg én gang dagligt. En dosis på 400 mg én gang dagligt kan anvendes, baseret på medicinsk vurdering af patientens respons på behandlingen. Den anbefalede behandlingsvarighed for initial behandling af kryptokokmeningitis er 10 til 12 uger efter, at cerebrospinalvæsken er blevet kulturnegativ. Den anbefalede dosis af DIFLUCAN 150 mg til suppression af tilbagefald af kryptokokmeningitis hos patienter med AIDS er 200 mg én gang dagligt.
Profylakse hos patienter, der gennemgår knoglemarvstransplantation
Den anbefalede daglige dosis DIFLUCAN til forebyggelse af candidiasis hos patienter, der gennemgår knoglemarvstransplantation, er 400 mg én gang dagligt. Patienter, som forventes at have svær granulocytopeni (mindre end 500 neutrofile celler/mm³), bør starte DIFLUCAN-profylakse flere dage før den forventede begyndelse af neutropeni og fortsætte i 7 dage efter neutrofiltallet stiger til over 1000 celler/mm³.
Dosering og administration hos børn
Følgende dosisækvivalensskema bør generelt give tilsvarende eksponering hos pædiatriske og voksne patienter:
Erfaring med DIFLUCAN hos nyfødte er begrænset til farmakokinetiske undersøgelser hos præmature nyfødte. (Se KLINISK FARMAKOLOGI .) Baseret på den forlængede halveringstid, der ses hos præmature nyfødte (gestational alder 26 til 29 uger), bør disse børn i de første to uger af livet have samme dosis (mg/kg) som hos ældre børn, men administreret hver 72. time. Efter de første to uger bør disse børn doseres én gang dagligt. Der er ingen tilgængelig information vedrørende DIFLUCANs farmakokinetik hos fuldbårne nyfødte.
Oropharyngeal candidiasis
Den anbefalede dosis af DIFLUCAN 150 mg til orofaryngeal candidiasis hos børn er 6 mg/kg den første dag, efterfulgt af 3 mg/kg én gang dagligt. Behandlingen bør gives i mindst 2 uger for at mindske sandsynligheden for tilbagefald.
Esophageal Candidiasis
Til behandling af esophageal candidiasis er den anbefalede dosis af DIFLUCAN til børn 6 mg/kg den første dag, efterfulgt af 3 mg/kg én gang dagligt. Doser op til 12 mg/kg/dag kan anvendes, baseret på medicinsk vurdering af patientens respons på behandlingen. Patienter med esophageal candidiasis bør behandles i mindst tre uger og i mindst 2 uger efter, at symptomerne er forsvundet.
Systemiske Candida-infektioner
Til behandling af candidæmi og disseminerede Candida-infektioner er daglige doser på 6 til 12 mg/kg/dag blevet brugt i en åben, ikke-sammenlignende undersøgelse af et lille antal børn.
Kryptokok meningitis
Til behandling af akut kryptokokmeningitis er den anbefalede dosis 12 mg/kg den første dag efterfulgt af 6 mg/kg én gang dagligt. En dosis på 12 mg/kg én gang dagligt kan anvendes, baseret på medicinsk vurdering af patientens respons på behandlingen. Den anbefalede behandlingsvarighed for initial behandling af kryptokokmeningitis er 10 til 12 uger efter, at cerebrospinalvæsken er blevet kulturnegativ. Til suppression af tilbagefald af kryptokokmeningitis hos børn med AIDS er den anbefalede dosis af DIFLUCAN 6 mg/kg én gang dagligt.
Dosering hos patienter med nedsat nyrefunktion
Fluconazol udskilles primært ved renal udskillelse som uændret lægemiddel. Det er ikke nødvendigt at justere enkeltdosisbehandling for vaginal candidiasis på grund af nedsat nyrefunktion. Hos patienter med nedsat nyrefunktion, som vil modtage flere doser af DIFLUCAN, bør der gives en startdosis på 50 mg til 400 mg. Efter startdosis skal den daglige dosis (ifølge indikation) baseres på følgende tabel:
Patienter i hæmodialyse bør modtage 100 % af den anbefalede dosis efter hver hæmodialyse; På ikke-dialysedage bør patienterne få en reduceret dosis i henhold til deres kreatininclearance.
Disse er foreslåede dosisjusteringer baseret på farmakokinetik efter administration af flere doser. Yderligere justering kan være nødvendig afhængig af den kliniske tilstand.
Når serumkreatinin er det eneste tilgængelige mål for nyrefunktion, bør følgende formel (baseret på køn, vægt og patientens alder) bruges til at estimere kreatininclearance hos voksne:
Mænd: Vægt (kg) × (140 – alder)/ 72 × serumkreatinin (mg/100 ml)
Kvinder: 0,85 × over værdi
Selvom farmakokinetikken af fluconazol ikke er blevet undersøgt hos børn med nyreinsufficiens, bør dosisreduktion hos børn med nyreinsufficiens være parallel med den, der anbefales til voksne. Følgende formel kan bruges til at estimere kreatininclearance hos børn:
× lineær længde eller højde (cm)/ serumkreatinin (mg/100 ml)
(Hvor K=0,55 for børn over 1 år og 0,45 for spædbørn.)
Administration
DIFLUCAN 100mg indgives oralt. DIFLUCAN kan tages med eller uden mad.
Vejledning til blanding af den orale suspension
Forbered en suspension ved dispensering som følger: Tryk på flasken, indtil alt pulveret flyder frit. For at rekonstituere skal du tilsætte 24 ml destilleret vand eller renset vand (USP) til fluconazol-flasken og ryste kraftigt for at suspendere pulveret. Hver flaske vil levere 35 ml suspension. Koncentrationerne af de rekonstituerede suspensioner er som følger:
Bemærk: Ryst oral suspension godt før brug. Opbevar rekonstitueret suspension mellem 86°F (30°C) og 41°F (5°C), og kassér ubrugt portion efter 2 uger. Beskyt mod frysning.
HVORDAN LEVERET
DIFLUCAN 100mg tabletter Pink trapezformede tabletter indeholdende 50, 100 eller 200 mg fluconazol er pakket i flasker eller enhedsdosisblister. 150 mg fluconazol-tabletterne er lyserøde og ovale, pakket i en enkeltdosis-enhedsblister.
DIFLUCAN tabletter leveres som følger:
DIFLUCAN 50 mg tabletter : Graveret med "DIFLUCAN" og "50" på forsiden og "ROERIG" på bagsiden.
NDC 0049-3410-30 flasker med 30 stk
DIFLUCAN 100 mg tabletter : Graveret med "DIFLUCAN" og "100" på forsiden og "ROERIG" på bagsiden.
NDC 0049-3420-30 flasker med 30 stk NDC 0049-3420-41 Enhedsdosispakke med 100 stk
DIFLUCAN 150 mg tabletter : Graveret med "DIFLUCAN" og "150" på forsiden og "ROERIG" på bagsiden.
NDC 0049-3500-79 Enhedsdosispakke med 1
DIFLUCAN 200 mg tabletter : Graveret med "DIFLUCAN" og "200" på forsiden og "ROERIG" på bagsiden.
NDC 0049-3430-30 flasker med 30 stk NDC 0049-3430-41 Enhedsdosispakke med 100 stk
Opbevaring
Opbevar tabletter under 86°F (30°C).
DIFLUCAN 100mg til oral suspension : DIFLUCAN til oral suspension leveres som et pulver med appelsinsmag til at give 35 ml pr. flaske som følger:
NDC 0049-3440-19 Fluconazol 350 mg pr. flaske NDC 0049-3450-19 Fluconazol 1400 mg pr. flaske
Opbevaring
Opbevar tørt pulver under 86°F (30°C). Opbevar rekonstitueret suspension mellem 86°F (30°C) og 41°F (5°C), og kassér ubrugt portion efter 2 uger. Beskyt mod frysning.
Distribueret af: Roerig Division of Pfizer Inc., NY, NY 10017. Revideret: Okt 2021
BIVIRKNINGER
DIFLUCAN tolereres generelt godt.
Hos nogle patienter, især dem med alvorlige underliggende sygdomme som AIDS og cancer, er ændringer i nyre- og hæmatologiske funktionstestresultater og leverabnormiteter blevet observeret under behandling med fluconazol og sammenlignende midler, men den kliniske betydning og forholdet til behandlingen er usikker.
Hos patienter, der modtager en enkelt dosis mod vaginal candidiasis
Under sammenlignende kliniske undersøgelser udført i USA blev 448 patienter med vaginal candidiasis behandlet med DIFLUCAN, 150 mg enkeltdosis. Den samlede forekomst af bivirkninger, muligvis relateret til DIFLUCAN, var 26 %. Hos 422 patienter, der fik aktive sammenligningsmidler, var forekomsten 16 %. De mest almindelige behandlingsrelaterede bivirkninger rapporteret hos de patienter, der fik 150 mg enkeltdosis fluconazol mod vaginitis, var hovedpine (13 %), kvalme (7 %) og mavesmerter (6 %). Andre rapporterede bivirkninger med en forekomst lig med eller større end 1 % omfattede diarré (3 %), dyspepsi (1 %), svimmelhed (1 %) og smagsforstyrrelser (1 %). De fleste af de rapporterede bivirkninger var milde til moderate i sværhedsgraden. I sjældne tilfælde er der rapporteret angioødem og anafylaktiske reaktioner i markedsføringserfaringer.
Hos patienter, der modtager flere doser for andre infektioner
Seksten procent af over 4000 patienter behandlet med DIFLUCAN (fluconazol) i kliniske forsøg på 7 dage eller mere oplevede bivirkninger. Behandlingen blev afbrudt hos 1,5 % af patienterne på grund af uønskede kliniske hændelser og hos 1,3 % af patienterne på grund af unormale laboratorieprøver.
Kliniske bivirkninger blev rapporteret hyppigere hos HIV-inficerede patienter (21 %) end hos ikke-HIV-inficerede patienter (13 %). mønstrene hos HIV-inficerede og ikke-HIV-inficerede patienter var imidlertid ens. Andelen af patienter, der ophørte med behandlingen på grund af kliniske bivirkninger, var ens i de to grupper (1,5%).
Følgende behandlingsrelaterede kliniske bivirkninger forekom med en incidens på 1 % eller mere hos 4048 patienter, der fik DIFLUCAN 50 mg i 7 eller flere dage i kliniske forsøg: kvalme 3,7 %, hovedpine 1,9 %, hududslæt 1,8 %, opkastning 1,7 %, abdominal smerter 1,7 % og diarré 1,5 %.
Hepato-galdevejr
kombinerede kliniske forsøg og markedsføringserfaring har der været sjældne tilfælde af alvorlige leverreaktioner under behandling med DIFLUCAN. (Se ADVARSLER .) Spektret af disse leverreaktioner har varieret fra milde forbigående stigninger i transaminaser til klinisk hepatitis, kolestase og fulminant leversvigt, inklusive dødsfald. Forekomster af fatale leverreaktioner blev noteret at forekomme primært hos patienter med alvorlige underliggende medicinske tilstande (overvejende AIDS eller malignitet) og ofte under samtidig behandling af flere forskellige lægemidler. Forbigående leverreaktioner, herunder hepatitis og gulsot, er forekommet hos patienter uden andre identificerbare risikofaktorer. I hvert af disse tilfælde vendte leverfunktionen tilbage til baseline ved seponering af DIFLUCAN.
to sammenlignende undersøgelser, der evaluerede effektiviteten af DIFLUCAN til undertrykkelse af tilbagefald af kryptokokmeningitis, blev der observeret en statistisk signifikant stigning i median AST (SGOT) niveauer fra en baseline værdi på 30 IE/l til 41 IE/l i et forsøg og 34 IU/L til 66 IU/L i den anden. Den samlede frekvens af serumtransaminaseforhøjelser på mere end 8 gange den øvre normalgrænse var ca. 1 % hos fluconazolbehandlede patienter i kliniske forsøg. Disse stigninger forekom hos patienter med alvorlig underliggende sygdom, overvejende AIDS eller maligniteter, hvoraf de fleste fik flere samtidige lægemidler, herunder mange kendt for at være hepatotoksiske. Hyppigheden af unormalt forhøjede serumtransaminaser var større hos patienter, der tog DIFLUCAN samtidig med en eller flere af følgende lægemidler: rifampin, phenytoin, isoniazid, valproinsyre eller orale sulfonylurinstoffer hypoglykæmiske midler.
Post-marketing oplevelse
Derudover er følgende bivirkninger opstået efter markedsføring.
Immunologisk: I sjældne tilfælde er anafylaksi (inklusive angioødem, ansigtsødem og kløe) blevet rapporteret.
Kroppen som helhed: Asteni, træthed, feber, utilpashed.
Kardiovaskulær: QT-forlængelse, torsade de pointes. (Se FORHOLDSREGLER .)
Centralnervesystemet: Anfald, svimmelhed.
Hæmatopoietisk og lymfatisk: Leukopeni, herunder neutropeni og agranulocytose, trombocytopeni.
Metabolisk: Hyperkolesterolæmi, hypertriglyceridæmi, hypokaliæmi.
Gastrointestinale: Kolestase, mundtørhed, hepatocellulær skade, dyspepsi, opkastning.
Andre sanser: Smag perversion.
Muskuloskeletale system: myalgi.
Nervesystem: Søvnløshed, paræstesi, somnolens, tremor, svimmelhed.
Hud og vedhæng: Akut generaliseret eksantematøs pustulose, lægemiddeludbrud inklusive fast lægemiddeludbrud, øget svedtendens, eksfoliative hudlidelser inklusive Stevens-Johnsons syndrom og toksisk epidermal nekrolyse, lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS) (se ADVARSLER ), alopeci.
Bivirkninger hos børn
Mønstret og forekomsten af uønskede hændelser og laboratorieabnormiteter registreret under pædiatriske kliniske forsøg er sammenlignelige med dem, der er set hos voksne.
I kliniske fase II/III forsøg udført i USA og i Europa blev 577 pædiatriske patienter i alderen 1 dag til 17 år behandlet med DIFLUCAN i doser op til 15 mg/kg/dag i op til 1.616 dage. 13 procent af børnene oplevede behandlingsrelaterede bivirkninger. De hyppigst rapporterede hændelser var opkastning (5 %), mavesmerter (3 %), kvalme (2 %) og diarré (2 %). Behandlingen blev afbrudt hos 2,3 % af patienterne på grund af uønskede kliniske hændelser og hos 1,4 % af patienterne på grund af unormale laboratorieprøver. Størstedelen af behandlingsrelaterede laboratorieabnormiteter var forhøjelser af transaminaser eller alkalisk fosfatase.
Procentdel af patienter med behandlingsrelaterede bivirkninger
DRUGSINTERAKTIONER
(Se KONTRAINDIKATIONER .) Fluconazol er en moderat CYP2C9- og CYP3A4-hæmmer. Fluconazol er også en stærk hæmmer af CYP2C19. Patienter behandlet med DIFLUCAN, som også samtidig behandles med lægemidler med et snævert terapeutisk vindue metaboliseret gennem CYP2C9 og CYP3A4, bør overvåges for bivirkninger forbundet med de samtidig administrerede lægemidler. Ud over de observerede/dokumenterede interaktioner nævnt nedenfor, er der risiko for øget plasmakoncentration af andre forbindelser metaboliseret af CYP2C9, CYP2C19 og CYP3A4 administreret sammen med fluconazol. Derfor bør der udvises forsigtighed ved brug af disse kombinationer, og patienterne bør overvåges nøje. Den enzymhæmmende virkning af fluconazol varer ved 4 til 5 dage efter seponering af fluconazolbehandling på grund af fluconazols lange halveringstid. Klinisk eller potentielt signifikante lægemiddelinteraktioner mellem DIFLUCAN 200mg og følgende midler/klasser er blevet observeret og er beskrevet mere detaljeret nedenfor:
Alfentanil
En undersøgelse observerede en reduktion i clearance og distributionsvolumen samt forlængelse af t½ af alfentanil efter samtidig behandling med fluconazol. En mulig virkningsmekanisme er fluconazols hæmning af CYP3A4. Dosisjustering af alfentanil kan være nødvendig.
Amiodaron
Samtidig administration af fluconazol og amiodaron kan øge QT-forlængelsen. Der skal udvises forsigtighed, hvis samtidig brug af fluconazol og amiodaron er nødvendig, især med højdosis fluconazol (800 mg).
Amitriptylin, Nortriptylin
Fluconazol øger effekten af amitriptylin og nortriptylin. 5-Nortriptylin og/eller S-amitriptylin kan måles ved påbegyndelse af kombinationsbehandlingen og efter 1 uge. Dosering af amitriptylin/nortriptylin bør justeres om nødvendigt.
Amphotericin B
Samtidig administration af fluconazol og amphotericin B i inficerede normale og immunsupprimerede mus viste følgende resultater: en lille additiv svampedræbende effekt ved systemisk infektion med Candida albicans, ingen interaktion ved intrakraniel infektion med Cryptococcus neoformans og antagonisme af de to lægemidler ved systemisk infektion med A fumigatus. Den kliniske betydning af resultater opnået i disse undersøgelser er ukendt.
Azithromycin
Et åbent, randomiseret, trevejs crossover-studie med 18 raske forsøgspersoner vurderede effekten af en enkelt 1200 mg oral dosis azithromycin på farmakokinetikken af en enkelt 800 mg oral dosis fluconazol samt virkningen af fluconazol på farmakokinetikken. af azithromycin. Der var ingen signifikant farmakokinetisk interaktion mellem fluconazol og azithromycin.
Calciumkanalblokkere
Visse calciumkanalantagonister (nifedipin, isradipin, amlodipin, verapamil og felodipin) metaboliseres af CYP3A4. Fluconazol har potentiale til at øge den systemiske eksponering af calciumkanalantagonister. Hyppig monitorering for bivirkninger anbefales.
Carbamazepin
Fluconazol hæmmer metabolismen af carbamazepin, og en stigning i serumcarbamazepin på 30 % er blevet observeret. Der er risiko for at udvikle carbamazepin-toksicitet. Dosisjustering af carbamazepin kan være nødvendig afhængig af koncentrationsmålinger/effekt.
Celecoxib
Under samtidig behandling med fluconazol (200 mg dagligt) og celecoxib (200 mg) steg celecoxibs Cmax og AUC med henholdsvis 68 % og 134 %. Halvdelen af celecoxib-dosis kan være nødvendig, når det kombineres med fluconazol.
Antikoagulanter af kumarin-type
Protrombintiden kan øges hos patienter, der samtidig får DIFLUCAN 150 mg og antikoagulantia af coumarin-typen. Efter markedsføring er der, som med andre azol-antimykotika, blevet rapporteret blødningshændelser (blå mærker, næseblødning, gastrointestinal blødning, hæmaturi og melena) i forbindelse med øget protrombintid hos patienter, der får fluconazol samtidig med warfarin. Omhyggelig monitorering af protrombintid hos patienter, der får DIFLUCAN 50 mg og antikoagulantia af coumarin-typen, anbefales. Dosisjustering af warfarin kan være nødvendig. (Se KLINISK FARMAKOLOGI : Lægemiddelinteraktionsstudier .)
Cyclofosfamid
Kombinationsbehandling med cyclophosphamid og fluconazol resulterer i en stigning i serumbilirubin og serumkreatinin. Kombinationen kan anvendes, mens der tages øget hensyn til risikoen for øget serumbilirubin og serumkreatinin.
Cyclosporin
DIFLUCAN 100 mg øger signifikant ciclosporinniveauet hos nyretransplanterede patienter med eller uden nedsat nyrefunktion. Omhyggelig overvågning af ciclosporinkoncentrationer og serumkreatinin anbefales til patienter, der får DIFLUCAN og cyclosporin. (Se KLINISK FARMAKOLOGI : Lægemiddelinteraktionsstudier .) Denne kombination kan anvendes ved at reducere doseringen af cyclosporin afhængigt af cyclosporinkoncentrationen.
Fentanyl
Et fatalt tilfælde af mulig fentanyl-fluconazol-interaktion blev rapporteret. Forfatteren vurderede, at patienten døde af fentanylforgiftning. I et randomiseret crossover-studie med 12 raske frivillige blev det desuden vist, at fluconazol forsinkede eliminationen af fentanyl signifikant. Forhøjet fentanylkoncentration kan føre til respirationsdepression.
HMG-CoA-reduktasehæmmere
Risikoen for myopati og rhabdomyolyse øges, når fluconazol administreres sammen med HMG-CoA-reduktasehæmmere metaboliseret gennem CYP3A4, såsom atorvastatin og simvastatin, eller gennem CYP2C9, såsom fluvastatin. Hvis samtidig behandling er nødvendig, bør patienten observeres for symptomer på myopati og rhabdomyolyse, og kreatininkinase bør monitoreres. HMG-CoA-reduktasehæmmere bør seponeres, hvis der observeres en markant stigning i kreatininkinase eller diagnosticeres eller mistænkes myopati/rhabdomyolyse.
Hydrochlorthiazid
I et farmakokinetisk interaktionsstudie øgede samtidig administration af flerdosis hydrochlorthiazid til raske frivillige, der fik fluconazol plasmakoncentrationerne af fluconazol med 40 %. En effekt af denne størrelsesorden burde ikke nødvendiggøre en ændring af fluconazoldosisregimet hos forsøgspersoner, der samtidig får diuretika.
Ibrutinib
Moderate hæmmere af CYP3A4, såsom fluconazol, kan øge plasmakoncentrationen af ibrutinib og øge risikoen for bivirkninger forbundet med ibrutinib. Hvis ibrutinib og fluconazol administreres samtidigt, reduceres dosis af ibrutinib som anvist i ordinationsinformationen for ibrutinib, og patienten skal overvåges hyppigt for eventuelle bivirkninger forbundet med ibrutinib.
Lemborexant
Samtidig administration af fluconazol øgede lemborexant Cmax og AUC med henholdsvis ca. 1,6 og 4,2 gange, hvilket forventes at øge risikoen for bivirkninger, såsom somnolens. Undgå samtidig brug af DIFLUCAN og lemborexant.
Losartan
Fluconazol hæmmer metabolismen af losartan til dets aktive metabolit (E-31 74), som er ansvarlig for det meste af angiotensin Il-receptorantagonismen, som opstår under behandling med losartan. Patienter bør have deres blodtryk overvåget kontinuerligt.
Metadon
Fluconazol kan øge serumkoncentrationen af metadon. Dosisjustering af metadon kan være nødvendig.
Ikke-steroide antiinflammatoriske lægemidler
Cmax og AUC for flurbiprofen steg med henholdsvis 23 % og 81 %, når det blev administreret sammen med fluconazol sammenlignet med administration af flurbiprofen alene. Tilsvarende blev Cmax og AUC for den farmakologisk aktive isomer [S-(+)-ibuprofen] øget med henholdsvis 15 % og 82 %, når fluconazol blev administreret samtidigt med racemisk ibuprofen (400 mg) sammenlignet med administration af racemisk ibuprofen alene.
Selvom det ikke er specifikt undersøgt, har fluconazol potentialet til at øge den systemiske eksponering af andre ikke-steroide antiinflammatoriske lægemidler (NSAID'er), som metaboliseres af CYP2C9 (f.eks. naproxen, lornoxicam, meloxicam, diclofenac). Hyppig overvågning for bivirkninger og toksicitet relateret til NSAID'er anbefales. Justering af dosis af NSAID kan være nødvendig.
Olaparib
Moderate hæmmere af CYP3A4 såsom fluconazol øger olaparib plasmakoncentrationer; samtidig brug anbefales ikke. Hvis kombinationen ikke kan undgås, reduceres dosis af olaparib som anvist i LYNPARZA® (Olaparib) ordinationsinformation.
Orale præventionsmidler
To farmakokinetiske undersøgelser med et kombineret oralt præventionsmiddel er blevet udført med multiple doser af fluconazol. Der var ingen relevante effekter på hormonniveauet i 50 mg fluconazol-studiet, mens AUC'erne for ethinylestradiol og levonorgestrel ved 200 mg dagligt var øget med henholdsvis 40 % og 24 %. Det er derfor usandsynligt, at brug af flere doser af fluconazol i disse doser vil have en effekt på effektiviteten af det kombinerede orale præventionsmiddel.
Oral hypoglykæmi
Klinisk signifikant hypoglykæmi kan fremkaldes ved brug af DIFLUCAN sammen med orale hypoglykæmiske midler; Der er rapporteret en dødsfald som følge af hypoglykæmi i forbindelse med kombineret DIFLUCAN 150 mg og glyburidbrug. DIFLUCAN reducerer metabolismen af tolbutamid, glyburid og glipizid og øger plasmakoncentrationen af disse midler. Når DIFLUCAN 100 mg anvendes samtidig med disse eller andre orale hypoglykæmiske sulfonylurinstoffer, skal blodsukkerkoncentrationerne overvåges nøje, og dosis af sulfonylurinstof skal justeres efter behov. (Se KLINISK FARMAKOLOGI : Lægemiddelinteraktionsstudier .)
Phenytoin
DIFLUCAN øger plasmakoncentrationerne af phenytoin. Omhyggelig monitorering af phenytoinkoncentrationer hos patienter, der får DIFLUCAN 50 mg og phenytoin, anbefales. (Se KLINISK FARMAKOLOGI : Lægemiddelinteraktionsstudier .)
Pimozid
Selvom det ikke er undersøgt in vitro eller in vivo, kan samtidig administration af fluconazol og pimozid resultere i hæmning af pimozidmetabolismen. Forhøjede plasmakoncentrationer af pimozid kan føre til QT-forlængelse og sjældne forekomster af torsade de pointes. Samtidig administration af fluconazol og pimozid er kontraindiceret.
Prednison
Der var en caserapport om, at en levertransplanteret patient behandlet med prednison udviklede akut binyrebarkinsufficiens, når en 3 måneders behandling med fluconazol blev afbrudt. Seponeringen af fluconazol forårsagede formodentlig en øget CYP3A4-aktivitet, som førte til øget metabolisme af prednison. Patienter i langtidsbehandling med fluconazol og prednison bør overvåges nøje for binyrebarkinsufficiens, når fluconazol seponeres.
Quinidin
Selvom det ikke er undersøgt in vitro eller in vivo, kan samtidig administration af fluconazol og quinidin resultere i hæmning af quinidinmetabolismen. Brug af quinidin er blevet forbundet med QT-forlængelse og sjældne forekomster af torsade de pointes. Samtidig administration af fluconazol og quinidin er kontraindiceret. (Se KONTRAINDIKATIONER .)
Rifabutin
Der har været rapporter om, at der eksisterer en interaktion, når fluconazol administreres samtidig med rifabutin, hvilket fører til øgede serumniveauer af rifabutin op til 80 %. Der har været rapporter om uveitis hos patienter, til hvem fluconazol og rifabutin blev administreret samtidigt. Patienter, der samtidig får rifabutin og fluconazol, bør overvåges nøje. (Se KLINISK FARMAKOLOGI : Lægemiddelinteraktionsstudier .)
Rifampin
Rifampin øger metabolismen af samtidig administreret DIFLUCAN. Afhængigt af de kliniske omstændigheder bør det overvejes at øge dosis af DIFLUCAN 200 mg, når det administreres sammen med rifampin. (Se KLINISK FARMAKOLOGI : Lægemiddelinteraktionsstudier .)
Saquinavir
Fluconazol øger AUC for saquinavir med ca. 50%, Cmax med ca. 55% og reducerer clearance af saquinavir med ca. 50% på grund af hæmning af saquinavirs levermetabolisme af CYP3A4 og hæmning af P-glycoprotein. Dosisjustering af saquinavir kan være nødvendig.
Korttidsvirkende benzodiazepiner
Efter oral administration af midazolam resulterede fluconazol i væsentlige stigninger i midazolamkoncentrationer og psykomotoriske effekter. Denne effekt på midazolam synes at være mere udtalt efter oral administration af fluconazol end med fluconazol administreret intravenøst. Hvis korttidsvirkende benzodiazepiner, som metaboliseres af cytokrom P450-systemet, administreres samtidigt med fluconazol, bør det overvejes at reducere benzodiazepindosis, og patienterne bør monitoreres passende. (Se KLINISK FARMAKOLOGI : Lægemiddelinteraktionsstudier .)
Sirolimus
Fluconazol øger plasmakoncentrationerne af sirolimus formentlig ved at hæmme metabolismen af sirolimus via CYP3A4 og P-glykoprotein. Denne kombination kan bruges med en dosisjustering af sirolimus afhængigt af effekt/koncentrationsmålingerne.
Tacrolimus
Fluconazol kan øge serumkoncentrationerne af oralt administreret tacrolimus op til 5 gange på grund af hæmning af tacrolimus metabolisme gennem CYP3A4 i tarmene. Der er ikke observeret signifikante farmakokinetiske ændringer, når tacrolimus gives intravenøst. Forhøjede tacrolimus-niveauer er blevet forbundet med nefrotoksicitet. Dosis af oralt administreret tacrolimus bør nedsættes afhængigt af tacrolimus koncentration. (Se KLINISK FARMAKOLOGI : Lægemiddelinteraktionsstudier .)
Theophyllin
DIFLUCAN 50mg øger serumkoncentrationen af theophyllin. Omhyggelig overvågning af serum-theophyllinkoncentrationer hos patienter, der får DIFLUCAN 100 mg og theophyllin, anbefales. (Se KLINISK FARMAKOLOGI : Lægemiddelinteraktionsstudier .)
Tofacitinib
Systemisk eksponering for tofacitinib øges, når tofacitinib administreres samtidigt med fluconazol. Reducer dosis af tofacitinib, når det gives samtidig med fluconazol (dvs. fra 5 mg to gange dagligt til 5 mg én gang dagligt som anvist i XELJANZ [tofacitinib]-etiketten). (Se KLINISK FARMAKOLOGI : Lægemiddelinteraktionsstudier .)
Tolvaptan
Plasmaeksponering for tolvaptan er signifikant øget (200 % i AUC; 80 % i Cmax), når tolvaptan, et CYP3A4-substrat, administreres sammen med fluconazol, en moderat CYP3A4-hæmmer. Denne interaktion kan resultere i risikoen for en signifikant stigning i bivirkninger forbundet med tolvaptan, især signifikant diurese, dehydrering og akut nyresvigt. Hvis tolvaptan og fluconazol administreres samtidigt, skal tolvaptan-dosis reduceres som anvist i ordinationsinformationen for tolvaptan, og patienten skal overvåges hyppigt for eventuelle bivirkninger forbundet med tolvaptan.
Triazolam
Fluconazol øger AUC for triazolam (enkeltdosis) med ca. 50 %, Cmax med 20 % til 32 % og øger t½ med 25 % til 50 % på grund af hæmningen af triazolams metabolisme. Dosisjustering af triazolam kan være nødvendig.
Vinca Alkaloider
Selvom det ikke er undersøgt, kan fluconazol øge plasmaniveauerne af vinca-alkaloiderne (f.eks. vincristin og vinblastin) og føre til neurotoksicitet, som muligvis skyldes en hæmmende effekt på CYP3A4.
Vitamin A
Baseret på en case-rapport hos en patient, der fik kombinationsbehandling med all-trans-retinoidsyre (en syreform af vitamin A) og fluconazol, er der udviklet bivirkninger relateret til centralnervesystemet (CNS) i form af pseudotumor cerebri, som forsvandt efter seponering af fluconazolbehandling. Denne kombination kan bruges, men forekomsten af CNS-relaterede bivirkninger bør tages i betragtning.
Voriconazol
Undgå samtidig administration af voriconazol og fluconazol. Overvågning for uønskede hændelser og toksicitet relateret til voriconazol anbefales; især hvis voriconazol startes inden for 24 timer efter den sidste dosis fluconazol. (Se KLINISK FARMAKOLOGI : Lægemiddelinteraktionsstudier .)
Zidovudin
Fluconazol øger Cmax og AUC for zidovudin med henholdsvis 84 % og 74 % på grund af et cirka 45 % fald i oral zidovudin-clearance. Halveringstiden for zidovudin blev ligeledes forlænget med ca. 128 % efter kombinationsbehandling med fluconazol. Patienter, der får denne kombination, bør overvåges for udvikling af zidovudin-relaterede bivirkninger. Dosisreduktion af zidovudin kan overvejes.

Læger bør være opmærksomme på, at interaktionsundersøgelser med andre lægemidler end dem, der er anført i afsnittet KLINISK FARMAKOLOGI, ikke er blevet udført, men sådanne interaktioner kan forekomme.
ADVARSLER
FORHOLDSREGLER
Generel
Nogle azoler, herunder fluconazol, er blevet forbundet med forlængelse af QT-intervallet på elektrokardiogrammet. Fluconazol forårsager QT-forlængelse via hæmning af Rectifier Potassium Channel-strøm (Ikr). QT-forlængelsen forårsaget af andre lægemidler (såsom amiodaron) kan forstærkes via hæmningen af cytokrom P450 (CYP) 3A4. (Se FORHOLDSREGLER : Lægemiddelinteraktioner .) Under overvågning efter markedsføring har der været sjældne tilfælde af QT-forlængelse og torsade de pointes hos patienter, der tager fluconazol. De fleste af disse rapporter involverede alvorligt syge patienter med flere forvirrende risikofaktorer, såsom strukturel hjertesygdom, elektrolytabnormiteter og samtidig medicin, der kan have været medvirkende. Patienter med hypokaliæmi og fremskreden hjertesvigt har en øget risiko for forekomsten af livstruende ventrikulære arytmier og torsade de pointes.
Fluconazol bør administreres med forsigtighed til patienter med disse potentielt proarytmiske tilstande.
Samtidig brug af fluconazol og erythromycin har potentiale til at øge risikoen for kardiotoksicitet (forlænget QT-interval, torsade de pointes) og som følge heraf pludselig hjertedød. Denne kombination bør undgås.
Fluconazol bør administreres med forsigtighed til patienter med nedsat nyrefunktion.
Binyrebarkinsufficiens er blevet rapporteret hos patienter, der får azoler, herunder fluconazol. Reversible tilfælde af binyrebarkinsufficiens er blevet rapporteret hos patienter, der får fluconazol.
DIFLUCAN 100 mg pulver til oral suspension indeholder saccharose og bør ikke anvendes til patienter med arvelig fructose, glucose/galactosemalabsorption og sucrase-isomaltase-mangel.
Når du kører bil eller betjener maskiner, skal det tages i betragtning, at der lejlighedsvis kan forekomme svimmelhed eller kramper.
Enkelt dosis
Bekvemmeligheden og effektiviteten af den orale enkeltdosis fluconazol-tablet til behandling af vaginale gærinfektioner bør afvejes mod acceptabiliteten af en højere forekomst af lægemiddelrelaterede bivirkninger med DIFLUCAN (26 %) versus intravaginale midler (16 %) i USA sammenlignende kliniske undersøgelser. (Se BIVIRKNINGER og Kliniske Studier .)
Ikke-klinisk toksikologi
Karcinogenese, mutagenese og svækkelse af fertilitet
Fluconazol viste ingen tegn på kræftfremkaldende potentiale hos mus og rotter behandlet oralt i 24 måneder med doser på 2,5 mg/kg/dag, 5 mg/kg/dag eller 10 mg/kg/dag (ca. 2 til 7 gange den anbefalede humane dosis ). Hanrotter behandlet med 5 mg/kg/dag og 10 mg/kg/dag havde en øget forekomst af hepatocellulære adenomer.
Fluconazol, med eller uden metabolisk aktivering, var negativ i test for mutagenicitet i fire stammer af S. typhimurium og i muselymfom L5178Y-systemet. Cytogenetiske undersøgelser in vivo (murine knoglemarvsceller efter oral administration af fluconazol) og in vitro (humane lymfocytter udsat for fluconazol ved 1000 mcg/ml) viste ingen tegn på kromosomale mutationer.
Fluconazol påvirkede ikke fertiliteten hos han- eller hunrotter behandlet oralt med daglige doser på 5 mg/kg, 10 mg/kg eller 20 mg/kg eller med parenterale doser på 5 mg/kg, 25 mg/kg eller 75 mg /kg, selvom starten på fødslen var lidt forsinket ved 20 mg/kg PO. I en intravenøs perinatal undersøgelse med rotter ved 5 mg/kg, 20 mg/kg og 40 mg/kg blev dystoci og forlængelse af fødslen observeret hos nogle få moderdyr ved 20 mg/kg (ca. 5 til 15 gange den anbefalede humane dosis ) og 40 mg/kg, men ikke ved 5 mg/kg. Forstyrrelserne i fødslen blev afspejlet af en lille stigning i antallet af dødfødte unger og fald i neonatal overlevelse ved disse dosisniveauer. Virkningerne på fødslen hos rotter er i overensstemmelse med den artsspecifikke østrogen-sænkende egenskab frembragt af høje doser af fluconazol. En sådan hormonændring er ikke blevet observeret hos kvinder behandlet med fluconazol. (Se KLINISK FARMAKOLOGI .)
Graviditet
Teratogene virkninger
Potentiale for fosterskade
Brug under graviditet bør undgås, undtagen hos patienter med alvorlige eller potentielt livstruende svampeinfektioner, hos hvem fluconazol kan anvendes, hvis den forventede fordel opvejer den mulige risiko for fosteret. Nogle få offentliggjorte case-rapporter beskriver et mønster af tydelige medfødte anomalier hos spædbørn, der i utero blev eksponeret for højdosis maternal fluconazol (400 til 800 mg/dag) i det meste eller hele det første trimester. Disse rapporterede anomalier ligner dem, der er set i dyreforsøg. Effektive præventionsforanstaltninger bør overvejes hos kvinder i den fødedygtige alder, som behandles med DIFLUCAN 400 til 800 mg/dag og bør fortsætte gennem hele behandlingsperioden og i ca. 1 uge (5 til 6 halveringstider) efter den sidste dosis. Hvis DIFLUCAN anvendes under graviditet, eller hvis patienten bliver gravid, mens du tager lægemidlet, skal patienten informeres om den potentielle fare for fosteret. Spontane aborter og medfødte abnormiteter er blevet foreslået som potentielle risici forbundet med 150 mg fluconazol som en enkelt eller gentagen dosis i graviditetens første trimester baseret på retrospektive epidemiologiske undersøgelser. Der er ingen tilstrækkelige og velkontrollerede undersøgelser af DIFLUCAN 150mg hos gravide kvinder. (Se ADVARSLER : Potentiale for fosterskader .)
Menneskelige data
Caserapporter beskriver et karakteristisk og sjældent mønster af fødselsdefekter blandt spædbørn, hvis mødre fik højdosis (400 til 800 mg/dag) fluconazol i det meste af eller hele graviditetens første trimester. De træk, der ses hos disse spædbørn, omfatter brachycephaly, abnorm facies, unormal calvarial udvikling, ganespalte, lårbensbøjning, tynde ribben og lange knogler, arthrogryposis og medfødt hjertesygdom. Disse virkninger ligner dem, der er set i dyreforsøg.
Epidemiologiske undersøgelser tyder på en potentiel risiko for spontan abort og medfødte abnormiteter hos spædbørn, hvis mødre blev behandlet med 150 mg fluconazol som en enkelt eller gentagen dosis i første trimester, men disse epidemiologiske undersøgelser har begrænsninger, og disse fund er ikke blevet bekræftet i kontrollerede kliniske undersøgelser. forsøg.
Dyredata
Fluconazol blev administreret oralt til drægtige kaniner under organogenese i to undersøgelser i doser på henholdsvis 5 mg/kg, 10 mg/kg og 20 mg/kg og ved 5 mg/kg, 25 mg/kg og 75 mg/kg. Moderens vægtforøgelse var svækket ved alle dosisniveauer (ca. 0,25 til 4 gange den kliniske dosis på 400 mg baseret på kropsoverfladeareal [BSA] sammenligning), og aborter forekom ved 75 mg/kg (ca. 4 gange den kliniske dosis på 400 mg baseret på BSA); ingen uønskede føtale virkninger blev observeret.
flere undersøgelser, hvor gravide rotter fik fluconazol oralt under organogenese, var moderens vægtforøgelse svækket, og placentavægten blev øget med 25 mg/kg. Der var ingen føtale virkninger ved 5 mg/kg eller 10 mg/kg; stigninger i føtale anatomiske varianter (supernumerære ribben, nyrebækkenudvidelse) og forsinkelser i ossifikation blev observeret ved 25 mg/kg og 50 mg/kg og højere doser. Ved doser fra 80 til 320 mg/kg (ca. 2 til 8 gange den kliniske dosis på 400 mg baseret på BSA) var embryodødelighed hos rotter øget, og føtale abnormiteter omfattede bølgede ribben, ganespalte og unormal kraniofacial ossifikation. Disse virkninger er i overensstemmelse med hæmningen af østrogensyntese hos rotter og kan være et resultat af kendte virkninger af nedsat østrogen på graviditet, organogenese og fødsel.
Ammende mødre
Fluconazol var til stede i lave niveauer i modermælk efter administration af en enkelt dosis på 150 mg, baseret på data fra en undersøgelse med 10 ammende kvinder, som midlertidigt eller permanent ophørte med at amme 5 dage til 19 måneder efter fødslen. Den estimerede daglige spædbørnsdosis af fluconazol fra modermælk (forudsat et gennemsnitligt mælkeforbrug på 150 mL/kg/dag) baseret på den gennemsnitlige maksimale mælkekoncentration (2,61 mcg/mL [interval: 1,57 til 3,65 mcg/ml] 5,2 timer efter dosis) var 0,39 mg/kg/dag, hvilket er cirka 13 % af den anbefalede pædiatriske dosis til oropharyngeal candidiasis. (Mærket pædiatrisk dosis er 6 mg/kg/dag den første dag efterfulgt af 3 mg/kg/dag; estimeret spædbarnsdosis er 13 % af 3 mg/kg/dag vedligeholdelsesdosis). Der er ingen data om fluconazolniveauer i mælk efter gentagen brug eller efter højdosis fluconazol. En offentliggjort undersøgelse af 96 ammende kvinder, der blev behandlet med fluconazol 150 mg hver anden dag (gennemsnit på 7,3 kapsler [interval 1 til 29 kapsler]) for amningsassocieret candida i brysterne rapporterede ingen alvorlige bivirkninger hos spædbørn. Der skal udvises forsigtighed, når DIFLUCAN administreres til en ammende kvinde.
Pædiatrisk brug
Et åbent, randomiseret, kontrolleret forsøg har vist, at DIFLUCAN 100 mg er effektiv til behandling af oropharyngeal candidiasis hos børn i alderen 6 måneder til 13 år. (Se Kliniske Studier .)
Brugen af DIFLUCAN 200 mg til børn med kryptokokmeningitis, Candida-øsofagitis eller systemiske Candida-infektioner understøttes af den effekt, der er vist for disse indikationer hos voksne, og af resultaterne fra adskillige små ikke-komparative pædiatriske kliniske undersøgelser. Derudover farmakokinetiske undersøgelser hos børn (se KLINISK FARMAKOLOGI ) har etableret en dosisproportionalitet mellem børn og voksne. (Se DOSERING OG ADMINISTRATION .)
en ikke-sammenlignende undersøgelse af børn med alvorlige systemiske svampeinfektioner, hvoraf de fleste var candidæmi, var effektiviteten af DIFLUCAN den samme som den, der blev rapporteret til behandling af candidæmi hos voksne. Ud af 17 forsøgspersoner med kulturbekræftet candidæmi havde 11 ud af 14 (79%) med baseline-symptomer (3 var asymptomatiske) en klinisk helbredelse; 13/15 (87%) af de evaluerbare patienter havde en mykologisk helbredelse ved behandlingens afslutning, men to af disse patienter fik tilbagefald efter henholdsvis 10 og 18 dage efter behandlingens ophør.
Effekten af DIFLUCAN til undertrykkelse af kryptokokmeningitis var vellykket hos 4 ud af 5 børn, der blev behandlet i et studie med fluconazol til behandling af livstruende eller alvorlig mykose. Der er ingen information om effekten af fluconazol til primær behandling af kryptokok meningitis hos børn.
Sikkerhedsprofilen for DIFLUCAN 200 mg til børn er blevet undersøgt hos 577 børn i alderen 1 dag til 17 år, som fik doser fra 1 til 15 mg/kg/dag i 1 til 1.616 dage. (Se BIVIRKNINGER .)
Effekten af DIFLUCAN er ikke blevet fastslået hos spædbørn under 6 måneder. (Se KLINISK FARMAKOLOGI .) Et lille antal patienter (29) i alderen fra 1 dag til 6 måneder er blevet behandlet sikkert med DIFLUCAN.
Geriatrisk brug
Hos ikke-AIDS-patienter blev bivirkninger muligvis relateret til fluconazolbehandling rapporteret hos færre patienter på 65 år og ældre (9 %, n = 339) end hos yngre patienter (14 %, n=2240). Der var dog ingen konsekvent forskel mellem de ældre og yngre patienter med hensyn til individuelle bivirkninger. Af de hyppigst rapporterede (>1%) bivirkninger forekom udslæt, opkastning og diarré i større andele af ældre patienter. Lignende andel af ældre patienter (2,4 %) og yngre patienter (1,5 %) ophørte med fluconazolbehandling på grund af bivirkninger. Erfaring efter markedsføring var spontane rapporter om anæmi og akut nyresvigt hyppigere blandt patienter på 65 år eller ældre end hos patienter mellem 12 og 65 år. På grund af rapporternes frivillige karakter og den naturlige stigning i forekomsten af anæmi og nyresvigt hos ældre, er det dog ikke muligt at fastslå en årsagssammenhæng til lægemiddeleksponering.
Kontrollerede kliniske forsøg med fluconazol omfattede ikke et tilstrækkeligt antal patienter på 65 år og ældre til at vurdere, om de reagerer anderledes end yngre patienter på hver indikation. Andre rapporterede kliniske erfaringer har ikke identificeret forskelle i respons mellem ældre og yngre patienter.
Fluconazol udskilles primært ved renal udskillelse som uændret lægemiddel. Da ældre patienter er mere tilbøjelige til at have nedsat nyrefunktion, bør der udvises forsigtighed med at justere dosis baseret på kreatininclearance. Det kan være nyttigt at overvåge nyrefunktionen. (Se KLINISK FARMAKOLOGI og DOSERING OG ADMINISTRATION .)
OVERDOSIS
Der har været rapporter om overdosering med fluconazol ledsaget af hallucinationer og paranoid adfærd.
I tilfælde af overdosering bør symptomatisk behandling (med understøttende foranstaltninger og maveskylning, hvis det er klinisk indiceret) iværksættes.
Fluconazol udskilles stort set i urinen. En 3-timers hæmodialysesession reducerer plasmaniveauerne med ca. 50 %.
Hos mus og rotter, der fik meget høje doser af fluconazol, inkluderede kliniske virkninger hos begge arter nedsat motilitet og respiration, ptosis, tåreflåd, savlen, urininkontinens, tab af opretningsrefleks og cyanose; døden blev nogle gange forudgået af kloniske kramper.
KONTRAINDIKATIONER
DIFLUCAN (fluconazol) er kontraindiceret til patienter, der har vist overfølsomhed over for fluconazol eller over for et eller flere af dets hjælpestoffer. Der er ingen information om krydsoverfølsomhed mellem fluconazol og andre azol-svampemidler. Der bør udvises forsigtighed ved ordinering af DIFLUCAN til patienter med overfølsomhed over for andre azoler. Samtidig administration af andre lægemidler, der vides at forlænge QT-intervallet, og som metaboliseres via enzymet CYP3A4, såsom erythromycin, pimozid og quinidin, er kontraindiceret hos patienter, der får fluconazol. (Se KLINISK FARMAKOLOGI : Lægemiddelinteraktionsstudier og FORHOLDSREGLER .)
KLINISK FARMAKOLOGI
Farmakokinetik og metabolisme
De farmakokinetiske egenskaber af fluconazol er ens efter administration ad intravenøs eller oral vej. Hos normale frivillige er biotilgængeligheden af oralt administreret fluconazol over 90 % sammenlignet med intravenøs administration. Bioækvivalens blev etableret mellem 100 mg tabletten og begge suspensionsstyrker, når de blev administreret som en enkelt 200 mg dosis.
Maksimal plasmakoncentration (Cmax) hos fastende, normale frivillige forekommer mellem 1 og 2 timer med en terminal plasmaelimineringshalveringstid på ca. 30 timer (interval: 20 til 50 timer) efter oral administration.
Hos fastende, normale frivillige fører administration af en enkelt oral 400 mg dosis af DIFLUCAN (fluconazol) til en gennemsnitlig Cmax på 6,72 mcg/mL (interval: 4,12 til 8,08 mcg/ml) og efter enkelt orale doser på 50 til 400 mg, fluconazol plasmakoncentrationer og areal under plasmakoncentration-tidskurven (AUC) er dosisproportionale.
Cmax- og AUC-data fra en fødevare-effekt undersøgelse, der involverede administration af DIFLUCAN (fluconazol) tabletter til raske frivillige under fastende forhold og sammen med et fedtrigt måltid, indikerede, at eksponering for lægemidlet ikke påvirkes af mad. Derfor kan DIFLUCAN tages uden hensyntagen til måltider. (Se DOSERING OG ADMINISTRATION .)
Steady-state koncentrationer nås inden for 5 til 10 dage efter orale doser på 50 til 400 mg givet én gang dagligt. Administration af en startdosis (på dag 1) på to gange den sædvanlige daglige dosis resulterer i plasmakoncentrationer tæt på steady-state på den anden dag. Fluconazols tilsyneladende fordelingsvolumen er tilnærmelsesvis det for hele kropsvandet. Plasmaproteinbinding er lav (11 til 12%). Efter enten en enkelt eller flere orale doser i op til 14 dage trænger fluconazol ind i alle undersøgte kropsvæsker (se tabel nedenfor ). Hos normale frivillige var spytkoncentrationer af fluconazol lig med eller lidt større end plasmakoncentrationer uanset dosis, vej eller varighed af dosering. Hos patienter med bronkiektasi var sputumkoncentrationerne af fluconazol efter en enkelt 150 mg oral dosis lig med plasmakoncentrationerne både 4 og 24 timer efter dosis. Hos patienter med svampemeningitis er fluconazolkoncentrationerne i cerebrospinalvæsken (CSF) ca. 80 % af de tilsvarende plasmakoncentrationer.
En enkelt oral 150 mg dosis af fluconazol administreret til 27 patienter trængte ind i vaginalt væv, hvilket resulterede i væv: plasmaforhold i området fra 0,94 til 1,14 i løbet af de første 48 timer efter dosering.
En enkelt oral 150 mg dosis af fluconazol administreret til 14 patienter trængte ind i vaginal væske, hvilket resulterede i væske: plasma-forhold i området fra 0,36 til 0,71 i løbet af de første 72 timer efter dosering.
Hos normale frivillige udskilles fluconazol primært ved renal udskillelse, hvor ca. 80 % af den administrerede dosis vises i urinen som uændret lægemiddel. Ca. 11 % af dosis udskilles i urinen som metabolitter.
Fluconazols farmakokinetik påvirkes markant af nedsat nyrefunktion. Der er et omvendt forhold mellem eliminationshalveringstiden og kreatininclearance. Det kan være nødvendigt at reducere dosis af DIFLUCAN hos patienter med nedsat nyrefunktion. (Se DOSERING OG ADMINISTRATION .) En 3-timers hæmodialysesession reducerer plasmakoncentrationerne med ca. 50 %.
Hos normale frivillige var administration af DIFLUCAN (doser fra 200 mg til 400 mg én gang dagligt i op til 14 dage) forbundet med små og inkonsekvente effekter på testosteronkoncentrationer, endogene kortikosteroidkoncentrationer og det adrenokortikotropiske hormon (ACTH)-stimulerede kortisolrespons.
Farmakokinetik hos børn
Hos børn er følgende farmakokinetiske data {Mean (%cv)} blevet rapporteret:
Clearance korrigeret for kropsvægt blev ikke påvirket af alder i disse undersøgelser. Gennemsnitlig kropsclearance hos voksne er rapporteret at være 0,23 (17 %) ml/min/kg.
Hos præmature nyfødte (gestationsalderen 26 til 29 uger) var den gennemsnitlige (%cv) clearance inden for 36 timer efter fødslen 0,180 (35 %, N=7) ml/min/kg, hvilket steg med tiden til et gennemsnit på 0,218 ( 31 %, N=9) mL/min/kg seks dage senere og 0,333 (56 %, N=4) mL/min/kg 12 dage senere. Tilsvarende var halveringstiden 73,6 timer, som faldt med tiden til et gennemsnit på 53,2 timer seks dage senere og 46,6 timer 12 dage senere.
Farmakokinetik hos ældre
En farmakokinetisk undersøgelse blev udført med 22 forsøgspersoner, 65 år eller ældre, som fik en enkelt 50 mg oral dosis fluconazol. Ti af disse patienter fik samtidig diuretika. Cmax var 1,54 mcg/ml og forekom 1,3 timer efter dosis. Den gennemsnitlige AUC var 76,4 ± 20,3 mcg•t/mL, og den gennemsnitlige terminale halveringstid var 46,2 timer. Disse farmakokinetiske parameterværdier er højere end analoge værdier rapporteret for normale unge mandlige frivillige. Samtidig administration af diuretika ændrede ikke signifikant AUC eller Cmax. Derudover var kreatininclearance (74 ml/min), procentdelen af lægemidlet genfundet uændret i urinen (0 til 24 timer, 22%) og estimaterne for renal fluconazol-clearance (0,124 ml/min/kg) for ældre generelt lavere end yngre frivillige. Ændringen af fluconazoldisposition hos ældre synes således at være relateret til nedsat nyrefunktion, der er karakteristisk for denne gruppe. Et plot af hver forsøgspersons terminale eliminationshalveringstid versus kreatininclearance sammenlignet med den forudsagte halveringstid – kreatininclearancekurve afledt af normale forsøgspersoner og forsøgspersoner med varierende grader af nyreinsufficiens indikerede, at 21 ud af 22 forsøgspersoner faldt inden for 95 % konfidensgrænsen for de forudsagte halveringstid-kreatininclearance-kurver. Disse resultater er i overensstemmelse med hypotesen om, at højere værdier for de farmakokinetiske parametre observeret hos ældre forsøgspersoner sammenlignet med normale unge mandlige frivillige skyldes den nedsatte nyrefunktion, som forventes hos ældre.
Lægemiddelinteraktionsstudier
(Se DRUGSINTERAKTIONER )
Orale præventionsmidler
Orale præventionsmidler blev givet som en enkelt dosis både før og efter oral administration af DIFLUCAN 50 mg én gang dagligt i 10 dage hos 10 raske kvinder. Der var ingen signifikant forskel i ethinylestradiol eller levonorgestrel AUC efter administration af 50 mg DIFLUCAN. Den gennemsnitlige stigning i ethinylestradiol AUC var 6% (interval: -47 til 108%), og levonorgestrel AUC steg 17% (interval: -33 til 141%).
en anden undersøgelse fik femogtyve normale kvinder daglige doser af både 200 mg DIFLUCAN 150 mg tabletter eller placebo i to, ti-dages perioder. Behandlingscyklusserne var en måneds mellemrum, hvor alle forsøgspersoner fik DIFLUCAN i den ene cyklus og placebo i den anden. Rækkefølgen af undersøgelsesbehandlingen var tilfældig. Enkeltdoser af en oral præventionstablet indeholdende levonorgestrel og ethinylestradiol blev administreret på den sidste behandlingsdag (dag 10) i begge cyklusser. Efter administration af 200 mg DIFLUCAN var den gennemsnitlige procentvise stigning i AUC for levonorgestrel sammenlignet med placebo 25 % (interval: – 12 til 82 %), og den gennemsnitlige procentvise stigning for ethinylestradiol sammenlignet med placebo var 38 % (interval: –11 til 101 %). Begge disse stigninger var statistisk signifikant forskellige fra placebo.
En tredje undersøgelse evaluerede den potentielle interaktion af en gang ugentlig dosering af fluconazol 300 mg til 21 normale kvinder, der tog et oralt præventionsmiddel indeholdende ethinylestradiol og norethindron. I dette placebokontrollerede, dobbeltblindede, randomiserede, to-vejs crossover-studie udført over tre cyklusser af oral præventionsbehandling, resulterede fluconazoldosering i små stigninger i de gennemsnitlige AUC'er for ethinylestradiol og norethindron sammenlignet med tilsvarende placebo-dosering. De gennemsnitlige AUC'er for ethinylestradiol og norethindron steg med henholdsvis 24 % (95 % CI-interval: 18 til 31 %) og 13 % (95 % CI-interval: 8 til 18 %) i forhold til placebo. Fluconazolbehandling forårsagede ikke et fald i ethinyløstradiol AUC for nogen individuel forsøgsperson i denne undersøgelse sammenlignet med placebo-dosering. De individuelle AUC-værdier for norethindron faldt meget lidt (
Cimetidin
DIFLUCAN 100 mg blev administreret som en enkelt oral dosis alene og to timer efter en enkelt dosis cimetidin 400 mg til seks raske mandlige frivillige. Efter administration af cimetidin var der et signifikant fald i fluconazols AUC og Cmax. Der var et gennemsnitligt ± SD fald i fluconazol AUC på 13 % ± 11 % (interval: –3,4 til –31 %), og Cmax faldt 19 % ± 14 % (interval: –5 til –40) %). Imidlertid påvirkede administrationen af cimetidin 600 mg til 900 mg intravenøst over en fire timers periode (fra en time før til 3 timer efter en enkelt oral dosis af DIFLUCAN 200 mg) ikke biotilgængeligheden eller farmakokinetikken af fluconazol hos 24 raske mandlige frivillige. .
Antacida
Administration af Maalox® (20 ml) til 14 normale mandlige frivillige umiddelbart før en enkelt dosis DIFLUCAN 100 mg havde ingen effekt på absorption eller elimination af fluconazol.
Hydrochlorthiazid
Samtidig oral administration af 100 mg DIFLUCAN og 50 mg hydrochlorthiazid i 10 dage hos 13 normale frivillige resulterede i en signifikant stigning i fluconazols AUC og Cmax sammenlignet med DIFLUCAN givet alene. Der var en gennemsnitlig ± SD-stigning i fluconazols AUC og Cmax på henholdsvis 45 % ± 31 % (interval: 19 til 114 %) og 43 % ± 31 % (interval: 19 til 122 %). Disse ændringer tilskrives en gennemsnitlig ± SD-reduktion i renal clearance på 30 % ± 12 % (interval: -10 til -50%).
Rifampin
Administration af en enkelt oral 200 mg dosis af DIFLUCAN 200 mg efter 15 dages rifampin administreret som 600 mg daglig til otte raske mandlige frivillige, resulterede i et signifikant fald i fluconazol AUC og en signifikant stigning i tilsyneladende oral clearance af fluconazol. Der var en gennemsnitlig ± SD-reduktion i fluconazol AUC på 23% ± 9% (interval: -13 til -42%). Tilsyneladende oral clearance af fluconazol steg 32 % ± 17 % (interval: 16 til 72 %). Fluconazols halveringstid faldt fra 33,4 ± 4,4 timer til 26,8 ± 3,9 timer. (Se FORHOLDSREGLER .)
Warfarin
Der var en signifikant stigning i protrombintidsrespons (areal under protrombintid-tid-kurven) efter en enkelt dosis warfarin (15 mg) administreret til 13 normale mandlige frivillige efter oral DIFLUCAN 200 mg administreret dagligt i 14 dage sammenlignet med administrationen af warfarin alene. Der var en gennemsnitlig ± SD-stigning i protrombintidsresponset (arealet under protrombintids-tid-kurven) på 7 % ± 4 % (interval: – 2 til 13 %). (Se FORHOLDSREGLER .) Gennemsnit er baseret på data fra 12 forsøgspersoner, da en af 13 forsøgspersoner oplevede en 2-fold stigning i hans protrombintidsrespons.
Phenytoin
Phenytoin AUC blev bestemt efter 4 dages phenytoindosis (200 mg dagligt, oralt i 3 dage efterfulgt af 250 mg intravenøst for én dosis) både med og uden administration af fluconazol (oral DIFLUCAN 200 mg dagligt i 16 dage) hos 10 normale mænd frivillige. Der var en signifikant stigning i phenytoin AUC. Den gennemsnitlige ± SD-stigning i phenytoin AUC var 88 % ± 68 % (interval: 16 til 247 %). Den absolutte størrelse af denne interaktion er ukendt på grund af den iboende ikke-lineære disposition af phenytoin. (Se FORHOLDSREGLER .)
Cyclosporin
Cyclosporin AUC og Cmax blev bestemt før og efter administration af fluconazol 200 mg dagligt i 14 dage hos otte nyretransplanterede patienter, som havde været i ciclosporinbehandling i mindst 6 måneder og på en stabil ciclosporindosis i mindst 6 uger. Der var en signifikant stigning i cyclosporin AUC, Cmax, Cmin (24-timers koncentration) og en signifikant reduktion i tilsyneladende oral clearance efter administration af fluconazol. Den gennemsnitlige ± SD-stigning i AUC var 92 % ± 43 % (interval: 18 til 147 %). Cmax steg 60 % ± 48 % (interval: -5 til 133%). C steg 157 % ± 96 % (interval: 33 til 360 %). Den tilsyneladende orale clearance faldt 45 % ± 15 % (interval: -15 til -60%). (Se FORHOLDSREGLER .)
Zidovudin
Plasma-zidovudinkoncentrationer blev bestemt ved to lejligheder (før og efter fluconazol 200 mg dagligt i 15 dage) hos 13 frivillige med AIDS eller ARC, som var på en stabil zidovudin-dosis i mindst to uger. Der var en signifikant stigning i zidovudin AUC efter administration af fluconazol. Den gennemsnitlige ± SD-stigning i AUC var 20 % ± 32 % (interval: -27 til 104%). Forholdet mellem metabolitten, GZDV, og moderlægemidlet faldt signifikant efter administration af fluconazol, fra 7,6 ± 3,6 til 5,7 ± 2,2.
Theophyllin
Theophyllins farmakokinetik blev bestemt ud fra en enkelt intravenøs dosis aminophyllin (6 mg/kg) før og efter oral administration af fluconazol 200 mg dagligt i 14 dage hos 16 normale mandlige frivillige. Der var signifikante stigninger i theophyllin AUC, Cmax og halveringstid med et tilsvarende fald i clearance. Den gennemsnitlige ± SD theophyllin AUC steg 21 % ± 16 % (interval: -5 til 48%). Cmax steg 13 % ± 17 % (interval: -13 til 40 %). Theophyllin-clearance faldt 16 % ± 11 % (interval: -32 til 5 %). Halveringstiden for theophyllin steg fra 6,6 ± 1,7 timer til 7,9 ± 1,5 timer. (Se FORHOLDSREGLER .)
Quinidin
Selvom det ikke er undersøgt in vitro eller in vivo, kan samtidig administration af fluconazol og quinidin resultere i hæmning af quinidinmetabolismen. Brug af quinidin er blevet forbundet med QT-forlængelse og sjældne forekomster af torsade de pointes. Samtidig administration af fluconazol og quinidin er kontraindiceret. (Se KONTRAINDIKATIONER og FORHOLDSREGLER .)
Oral hypoglykæmi
Fluconazols virkning på farmakokinetikken af de orale hypoglykæmiske sulfonylurinstofmidler tolbutamid, glipizid og glyburid blev evalueret i tre placebokontrollerede undersøgelser med normale frivillige. Alle forsøgspersoner fik sulfonylurinstof alene som en enkelt dosis og igen som en enkelt dosis efter administration af DIFLUCAN 100 mg dagligt i 7 dage. I disse tre undersøgelser oplevede 22/46 (47,8 %) af de DIFLUCAN-behandlede patienter og 9/22 (40,1 %) af de placebobehandlede patienter symptomer i overensstemmelse med hypoglykæmi. (Se FORHOLDSREGLER .)
Tolbutamid
Hos 13 normale mandlige frivillige var der signifikant stigning i tolbutamid (500 mg enkeltdosis) AUC og Cmax efter administration af fluconazol. Der var en gennemsnitlig ± SD-stigning i tolbutamid AUC på 26 % ± 9 % (interval: 12 til 39 %). Tolbutamid Cmax steg 11 % ± 9 % (interval: -6 til 27%). (Se FORHOLDSREGLER .)
Glipizid
AUC og Cmax for glipizid (2,5 mg enkeltdosis) var signifikant øget efter administration af fluconazol hos 13 normale mandlige frivillige. Der var en gennemsnitlig ± SD-stigning i AUC på 49 % ± 13 % (interval: 27 til 73 %) og en stigning i Cmax på 19 % ± 23 % (interval: -11 til 79 %). (Se FORHOLDSREGLER .)
Glyburide
AUC og Cmax for glyburid (5 mg enkeltdosis) var signifikant øget efter administration af fluconazol hos 20 normale mandlige frivillige. Der var en gennemsnitlig ± SD-stigning i AUC på 44 % ± 29 % (interval: -13 til 115%), og Cmax steg 19 % ± 19 % (interval: -23 til 62%). Fem forsøgspersoner krævede oral glukose efter indtagelse af glyburid efter 7 dages administration af fluconazol. (Se FORHOLDSREGLER .)
Rifabutin
Der er publiceret rapporter om, at der eksisterer en interaktion, når fluconazol administreres samtidig med rifabutin, hvilket fører til øgede serumniveauer af rifabutin. (Se FORHOLDSREGLER .)
Tacrolimus
Der er offentliggjort rapporter om, at der forekommer en interaktion, når fluconazol administreres samtidig med tacrolimus, hvilket fører til øgede serumniveauer af tacrolimus. (Se FORHOLDSREGLER .)
Midazolam
Effekten af fluconazol på farmakokinetikken og farmakodynamikken af midazolam blev undersøgt i et randomiseret, cross-over studie med 12 frivillige. I undersøgelsen indtog forsøgspersoner placebo eller 400 mg fluconazol på dag 1 efterfulgt af 200 mg dagligt fra dag 2 til dag 6. Derudover blev en dosis på 7,5 mg midazolam indtaget oralt den første dag, 0,05 mg/kg blev administreret intravenøst. på den fjerde dag og 7,5 mg oralt på den sjette dag. Fluconazol reducerede clearance af IV midazolam med 51 %. På den første doseringsdag øgede fluconazol midazolams AUC og C med henholdsvis 259 % og 150 %. På den sjette doseringsdag øgede fluconazol midazolams AUC og C med henholdsvis 259 % og 74 %. De psykomotoriske virkninger af midazolam var signifikant øget efter oral administration af midazolam, men blev ikke signifikant påvirket efter intravenøs midazolam.
En anden randomiseret, dobbelt-dummy, placebokontrolleret, cross-over-undersøgelse i tre faser blev udført for at bestemme virkningen af administrationsvejen for fluconazol på interaktionen mellem fluconazol og midazolam. I hver fase fik forsøgspersonerne oral fluconazol 400 mg og intravenøs saltvand; oral placebo og intravenøs fluconazol 400 mg; og oral placebo og IV saltvand. En oral dosis på 7,5 mg midazolam blev indtaget efter fluconazol/placebo. AUC og Cmax for midazolam var signifikant højere efter oral end IV administration af fluconazol. Oral fluconazol øgede midazolams AUC og Cmax med henholdsvis 272 % og 129 %. IV fluconazol øgede midazolams AUC og Cmax med henholdsvis 244 % og 79 %. Både oral og IV fluconazol øgede de farmakodynamiske virkninger af midazolam. (Se FORHOLDSREGLER .)
Azithromycin
Et åbent, randomiseret, tre-vejs crossover-studie med 18 raske forsøgspersoner vurderede effekten af en enkelt 800 mg oral dosis fluconazol på farmakokinetikken af en enkelt 1200 mg oral dosis azithromycin samt virkningen af azithromycin på farmakokinetikken. af fluconazol. Der var ingen signifikant farmakokinetisk interaktion mellem fluconazol og azithromycin.
Voriconazol
Voriconazol er et substrat for både CYP2C9 og CYP3A4 isoenzymer. Samtidig administration af oral voriconazol (400 mg Q12h i 1 dag, derefter 200 mg Q12h i 2,5 dage) og oral fluconazol (400 mg på dag 1, derefter 200 mg Q24h i 4 dage) til 6 raske mandlige forsøgspersoner resulterede i en stigning i Cmax. og AUCτ for voriconazol med et gennemsnit på henholdsvis 57 % (90 % CI: 20 % til 107 %) og 79 % (90 % CI: 40 % til 128 %). I et opfølgende klinisk studie med 8 raske mandlige forsøgspersoner eliminerede eller mindskede reduceret dosering og/eller hyppighed af voriconazol og fluconazol ikke denne effekt. Samtidig administration af voriconazol og fluconazol i enhver dosis anbefales ikke. Tæt monitorering for bivirkninger relateret til voriconazol anbefales, hvis voriconazol anvendes sekventielt efter fluconazol, især inden for 24 timer efter den sidste dosis fluconazol. (Se FORHOLDSREGLER .)
Tofacitinib
Samtidig administration af fluconazol (400 mg på dag 1 og 200 mg én gang dagligt i 6 dage [dage 2-7]) og tofacitinib (30 mg enkeltdosis på dag 5) hos raske forsøgspersoner resulterede i øgede gennemsnitlige AUC- og Cmax-værdier for tofacitinib på ca. 79 % (90 % KI: 64 % til 96 %) og 27 % (90 % KI: 12 % til 44 %), sammenlignet med administration af tofacitinib alene. (Se FORHOLDSREGLER .)
Mikrobiologi
Handlingsmekanisme
Fluconazol er en meget selektiv hæmmer af svampecytokrom P450-afhængigt enzym lanosterol 14-α-demethylase. Dette enzym fungerer ved at omdanne lanosterol til ergosterol. Det efterfølgende tab af normale steroler korrelerer med akkumuleringen af 14-α-methylsteroler i svampe og kan være ansvarlig for den fungistatiske aktivitet af fluconazol. Demethylering af pattedyrceller er meget mindre følsom over for fluconazolhæmning.
Modstand
Et potentiale for udvikling af resistens over for fluconazol er velkendt. Svampeisolater, der udviser nedsat følsomhed over for andre azoler, kan også vise nedsat følsomhed over for fluconazol. Hyppigheden af udvikling af lægemiddelresistens for de forskellige svampe, som dette lægemiddel er indiceret for, kendes ikke.
Fluconazolresistens kan opstå som følge af en ændring i kvaliteten eller mængden af målenzymet (lanosterol 14-α-demethylase), nedsat adgang til lægemiddelmålet eller en kombination af disse mekanismer.
Punktmutationer i genet (ERG11), der koder for målenzymet, fører til et ændret mål med nedsat affinitet for azoler. Overekspression af ERG11 resulterer i produktionen af høje koncentrationer af målenzymet, hvilket skaber behovet for højere intracellulære lægemiddelkoncentrationer for at hæmme alle enzymmolekylerne i cellen.
Den anden hovedmekanisme for lægemiddelresistens involverer aktiv efflux af fluconazol ud af cellen gennem aktivering af to typer multidrug effluxtransportere; de vigtigste facilitatorer (kodet af MDR-gener) og dem fra den ATP-bindende kassettesuperfamilie (kodet af CDR-gener). Opregulering af MDR-genet fører til fluconazolresistens, hvorimod opregulering af CDR-gener kan føre til resistens over for flere azoler.
Resistens i Candida glabrata inkluderer normalt opregulering af CDR-gener, hvilket resulterer i resistens over for flere azoler. For et isolat, hvor den minimale hæmmende koncentration (MIC) er kategoriseret som mellemprodukt (16 til 32 mcg/ml), anbefales den højeste fluconazoldosis.
Candida krusei bør anses for at være resistent over for fluconazol. Resistens hos C. krusei synes at være medieret af reduceret følsomhed af målenzymet over for inhibering af midlet.
Der har været rapporter om tilfælde af superinfektion med andre Candida-arter end C. albicans, som ofte i sagens natur ikke er modtagelige for DIFLUCAN (f.eks. Candida krusei). Sådanne tilfælde kan kræve alternativ antifungal behandling.
Antimikrobiel aktivitet
Fluconazol har vist sig at være aktiv mod de fleste isolater af følgende mikroorganismer både in vitro og ved kliniske infektioner.
Candida albicans Candida glabrata (Mange isolater er intermediært modtagelige) Candida parapsilose Candida tropicalis Cryptococcus neoformans
Følgende in vitro-data er tilgængelige, men deres kliniske betydning er ukendt. Mindst 90 % af følgende svampe udviser en in vitro MIC mindre end eller lig med det modtagelige brudpunkt for fluconazol (https://www.fda.gov/STIC) mod isolater af lignende slægt eller organismegruppe. Effektiviteten af fluconazol til behandling af kliniske infektioner på grund af disse svampe er imidlertid ikke blevet fastslået i tilstrækkelige og velkontrollerede kliniske forsøg.
Candida dubliniensis Candida guilliermondii Candida kefyr Candida lusitaniae
Candida krusei bør anses for at være resistent over for fluconazol. Resistens hos C. krusei synes at være medieret af reduceret følsomhed af målenzymet over for inhibering af midlet.
Der har været rapporter om tilfælde af superinfektion med andre Candida-arter end C. albicans, som ofte i sagens natur ikke er modtagelige for DIFLUCAN (f.eks. Candida krusei). Sådanne tilfælde kan kræve alternativ antifungal behandling.
Modtagelighedstest
For specifik information om fortolkningskriterier for følsomhedstest og tilhørende testmetoder og kvalitetskontrolstandarder anerkendt af FDA for dette lægemiddel, se venligst: https://www.fda.gov/STIC.
Kliniske Studier
Kryptokok meningitis
I en multicenterundersøgelse, der sammenlignede DIFLUCAN (200 mg/dag) med amphotericin B (0,3 mg/kg/dag) til behandling af kryptokokmeningitis hos patienter med AIDS, afslørede en multivariat analyse tre førbehandlingsfaktorer, der forudsagde død i løbet af behandlingen: unormalt mental status, cerebrospinalvæske kryptokokantigentiter større end 1:1024 og cerebrospinalvæske antal hvide blodlegemer på mindre end 20 celler/mm³. Dødeligheden blandt højrisikopatienter var henholdsvis 33 % og 40 % for amphotericin B- og DIFLUCAN-patienter (p=0,58), med samlede dødsfald 14 % (9 ud af 63 forsøgspersoner) og 18 % (24 ud af 131 forsøgspersoner) for de 2 arme af undersøgelsen (p=0,48). Optimale doser og regimer til patienter med akut kryptokokmeningitis og med høj risiko for behandlingssvigt er endnu ikke fastlagt. (Saag, et al. N Engl J Med 1992; 326:83-9.)
Vaginal candidiasis
To tilstrækkelige og velkontrollerede undersøgelser blev udført i USA med 150 mg tabletten. I begge var resultaterne af fluconazol-kuren sammenlignelige med kontrol-kuren (clotrimazol eller miconazol intravaginalt i 7 dage) både klinisk og statistisk efter en måneds evaluering efter behandling.
Den terapeutiske helbredelsesrate, defineret som en fuldstændig opløsning af tegn og symptomer på vaginal candidiasis (klinisk helbredelse), sammen med en negativ KOH-undersøgelse og negativ kultur for Candida (mikrobiologisk udryddelse), var 55 % i både fluconazolgruppen og de vaginale produkter gruppe.
Ca. tre fjerdedele af de tilmeldte patienter havde akut vaginitis (
Der blev rapporteret væsentligt flere gastrointestinale hændelser i fluconazolgruppen sammenlignet med den vaginale produktgruppe. De fleste af hændelserne var milde til moderate. Da fluconazol blev givet som en enkelt dosis, skete der ingen seponeringer.
Pædiatriske studier
Oropharyngeal candidiasis
Et åbent, sammenlignende studie af virkningen og sikkerheden af DIFLUCAN (2 til 3 mg/kg/dag) og oralt nystatin (400.000 IE 4 gange dagligt) hos immunkompromitterede børn med orofaryngeal candidiasis blev udført. Kliniske og mykologiske responsrater var højere hos børn behandlet med fluconazol.
Klinisk helbredelse ved behandlingens afslutning blev rapporteret for 86 % af de fluconazolbehandlede patienter sammenlignet med 46 % af de nystatinbehandlede patienter. Mykologisk havde 76 % af de fluconazolbehandlede patienter den inficerende organisme udryddet sammenlignet med 11 % for nystatinbehandlede patienter.
Andelen af patienter med klinisk tilbagefald 2 uger efter afslutningen af behandlingen var 14 % for forsøgspersoner, der fik DIFLUCAN og 16 % for forsøgspersoner, der fik nystatin. 4 uger efter afslutningen af behandlingen var procentdelen af patienter med klinisk tilbagefald 22 % for DIFLUCAN 150 mg og 23 % for nystatin.
PATIENTOPLYSNINGER
DIFLUCAN® (farvestof-FLEW-kan) (fluconazol) Tabletter
Denne indlægsseddel indeholder vigtig information om DIFLUCAN. Det er ikke meningen, at den skal træde i stedet for din sundhedsudbyders instruktioner. Læs denne information omhyggeligt, før du tager DIFLUCAN. Spørg din læge, hvis du ikke forstår nogen af disse oplysninger, eller hvis du vil vide mere om DIFLUCAN.
Hvad er DIFLUCAN 100mg?
DIFLUCAN er en receptpligtig medicin, der bruges til at behandle vaginale gærinfektioner forårsaget af en gær kaldet Candida. DIFLUCAN 150mg hjælper med at stoppe for meget gær i at vokse i skeden, så gærinfektionen forsvinder.
DIFLUCAN 150mg adskiller sig fra andre behandlinger for vaginale gærinfektioner, fordi det er en tablet, der tages gennem munden. DIFLUCAN bruges også til andre tilstande. Denne indlægsseddel handler dog kun om at bruge DIFLUCAN 50 mg til vaginale gærinfektioner. For information om brug af DIFLUCAN 200mg af andre årsager, spørg din læge. Se afsnittet i denne folder for information om vaginale gærinfektioner.
Hvad er en vaginal gærinfektion?
Det er normalt, at der findes en vis mængde gær i skeden. Nogle gange begynder for meget gær at vokse i skeden, og det kan forårsage en gærinfektion. Vaginale gærinfektioner er almindelige. Omkring tre ud af fire voksne kvinder vil have mindst én vaginal gærinfektion i løbet af deres liv.
Nogle lægemidler og medicinske tilstande kan øge din chance for at få en gærinfektion. Hvis du er gravid, har diabetes, bruger p-piller eller tager antibiotika, kan du få gærinfektioner oftere end andre kvinder. Personlig hygiejne og visse typer tøj kan øge dine chancer for at få en svampeinfektion. Spørg din sundhedsplejerske om tips til, hvad du kan gøre for at forhindre vaginale gærinfektioner. Hvis du får en vaginal gærinfektion, kan du have et af følgende symptomer:
- kløe
- en brændende følelse, når du tisser
- rødme
- ømhed
- et tykt hvidt udflåd fra skeden, der ligner hytteost
Tag ikke DIFLUCAN, hvis du.
- tage følgende medicin:
- kinidin
- erythromycin
- pimozid
- er allergisk over for fluconazol, det aktive stof i DIFLUCAN 50mg eller et af indholdsstofferne i DIFLUCAN. Se slutningen af denne indlægsseddel for en komplet liste over ingredienser i DIFLUCAN.
Inden du tager DIFLUCAN, skal du fortælle din læge om alle dine medicinske tilstande, hvis du:
- har leverproblemer
- har nyreproblemer
- har hjerteproblemer, herunder hjertearytmier
- har hypokaliæmi (lavt kalium)
- er gravid eller planlægger at blive gravid. Fortæl din læge med det samme, hvis du bliver gravid, mens du tager DIFLUCAN. Du og din læge vil beslutte, om DIFLUCAN 100mg er det rigtige for dig. Hvis du kan blive gravid, skal du bruge en præventionsmetode, mens du tager DIFLUCAN og i 1 uge efter din sidste dosis.
- ammer eller planlægger at amme. DIFLUCAN kan gå over i din modermælk. Tal med din læge om den bedste måde at fodre din baby på, mens du tager DIFLUCAN.
Inden du begynder at tage DIFLUCAN, skal du fortælle din læge om al den medicin, du tager, herunder receptpligtig og håndkøbsmedicin, vitaminer og naturlægemidler. Fortæl især din læge, hvis du tager:
- diabetesmedicin såsom glyburid, tolbutamid, glipizid
- blodtryksmedicin som hydrochlorthiazid, losartan, amlodipin, verapamil nifedipin eller felodipin
- blodfortyndende midler såsom warfarin
- cyclosporin, tacrolimus eller sirolimus (bruges til at forhindre afstødning af organtransplantationer)
- rifampin eller rifabutin mod tuberkulose
- phenytoin eller carbamazepin til at kontrollere anfald
- theophyllin til at kontrollere astma
- quinidin (bruges til at korrigere forstyrrelser i hjerterytmen)
- amiodaron (bruges til behandling af ujævne hjerteslag 'arytmier')
- amitriptylin eller nortriptylin til depression
- pimozid til psykiatrisk sygdom
- amphotericin B eller voriconazol mod svampeinfektioner
- erythromycin mod bakterielle infektioner
- olaparib, cyclophosphamid eller vinca alkaloider såsom vincristin eller vinblastin til behandling af cancer
- fentanyl, alfentanil eller metadon mod kroniske smerter
- ibrutinib anvendes til behandling af blodkræft
- lemborexant, bruges til behandling af søvnløshed
- lipidsænkende lægemidler såsom atorvastatin, simvastatin og fluvastatin
- ikke-steroide antiinflammatoriske lægemidler, herunder celecoxib, ibuprofen og naproxen
- prednison, et steroid, der bruges til at behandle hud-, mave-tarm-, hæmatologiske eller luftvejslidelser
- antivirale lægemidler, der bruges til at behandle HIV som saquinavir eller zidovudin
- tofacitinib til reumatoid arthritis
- vitamin A kosttilskud
- tolvaptan bruges til at behandle hyponatriæmi (lave niveauer af natrium i dit blod) eller til at bremse nedsat nyrefunktion
Da der er mange mærkenavne for disse lægemidler, skal du kontakte din læge eller apotek, hvis du har spørgsmål.
Hvordan skal jeg tage DIFLUCAN?
- Tag DIFLUCAN nøjagtigt som din læge fortæller dig.
- Tag DIFLUCAN 100 mg gennem munden med eller uden mad.
- Hvis du tager for meget DIFLUCAN 50 mg, skal du ringe til din læge eller gå til den nærmeste skadestue med det samme.
Hvad skal jeg undgå, mens jeg tager DIFLUCAN 150mg?
DIFLUCAN kan forårsage svimmelhed og kramper. Du må ikke køre bil eller betjene maskiner, før du ved, hvordan DIFLUCAN påvirker dig.
Hvad er de mulige bivirkninger af DIFLUCAN 150mg?
DIFLUCAN 50mg kan forårsage alvorlige bivirkninger, herunder:
- alvorlige leverproblemer. Nogle mennesker med alvorlige medicinske problemer har udviklet alvorlige leverproblemer, der blev livstruende eller forårsagede døden, mens de tog DIFLUCAN. Nogle gange kan disse leverproblemer vendes, når du holder op med at tage DIFLUCAN. Fortæl din læge med det samme, hvis du har symptomer på alvorlige leverproblemer, herunder:
- mørk farvet urin
- svær hudkløe
- gulfarvning af hud og øjne (gulsot)
- lyse afføring
- træthed
- opkastning
- mistet appetiten
- alvorlige allergiske reaktioner: I sjældne tilfælde er der opstået alvorlige allergiske reaktioner (anafylaksi), mens du tager DIFLUCAN. Stop med at tage DIFLUCAN 50 mg, ring til din læge eller gå til den nærmeste skadestue, hvis du får tegn eller symptomer på en allergisk reaktion, herunder:
- stakåndet
- feber
- hævelse af øjenlågene
- hoste
- hududslæt, nældefeber, vabler eller hudafskalning
- ansigt, mund, hals eller enhver anden del af kroppen
- hvæsende vejrtrækning
- dunkende hjerte eller ører
- kuldegysninger
- alvorlige hudproblemer. Nogle mennesker med alvorlige medicinske problemer har udviklet alvorlige hudproblemer, der har forårsaget døden, mens de tager DIFLUCAN. Fortæl det med det samme til din læge, hvis du får udslæt, mens du tager DIFLUCAN.
De mest almindelige bivirkninger af DIFLUCAN 200mg omfatter:
- hovedpine
- svimmelhed
- diarré
- mavesmerter
- kvalme eller dårlig mave
- ændringer i måden, maden smager på
Andre bivirkninger omfatter:
- binyrebarkinsufficiens: Nogle mennesker, der har taget DIFLUCAN, udviklede binyrebarkinsufficiens, som var reversibel. Fortæl din læge med det samme, hvis du har symptomer på binyrebarkinsufficiens, herunder:
- langvarig træthed
- muskelsvaghed
- mistet appetiten
- vægttab
- mavesmerter
- svimmelhed
- kvalme
- opkastning
- svimmelhed eller kramper.
Disse er ikke alle de mulige bivirkninger af DIFLUCAN.
Ring til din læge for at få medicinsk rådgivning om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare DIFLUCAN?
Opbevar DIFLUCAN tabletter under 86°F (30°C).
Opbevar DIFLUCAN 50 mg og al medicin utilgængeligt for børn.
Generel information om sikker og effektiv brug af DIFLUCAN.
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en patientinformationsfolder. Brug ikke DIFLUCAN 50 mg til en tilstand, som den ikke er ordineret til. Giv ikke DIFLUCAN til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem. Du kan bede din sundhedsudbyder om oplysninger om DIFLUCAN 200mg, der er skrevet til sundhedspersonale.
Hvad er ingredienserne i DIFLUCAN 150mg?
Aktiv ingrediens: fluconazol
Inaktive ingredienser: mikrokrystallinsk cellulose, vandfri dibasisk calciumphosphat, povidon, croscarmellosenatrium, FD&C Red No. 40 aluminium lakfarve og magnesiumstearat.
Denne patientinformation er blevet godkendt af US Food and Drug Administration
