Parlodel 2.5mg Bromocriptine Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Parlodel, og hvordan bruges det?
Parlodel 2,5 mg er en receptpligtig medicin, der bruges til at behandle symptomer på hyperprolaktinæmi-associerede dysfunktioner, Parkinsons sygdom, akromegali. Parlodel 2,5 mg kan bruges alene eller sammen med anden medicin.
Parlodel 2,5 mg tilhører en klasse af lægemidler kaldet antiparkinsonmidler, dopaminagonister; hyperprolactinæmi; Metabolisk og endokrin, Andet.
Det vides ikke, om Parlodel 2,5 mg er sikkert og effektivt til børn under 10 år.
Hvad er de mulige bivirkninger af Parlodel?
Parlodel kan forårsage alvorlige bivirkninger, herunder:
- nældefeber,
- åndedrætsbesvær,
- hævelse af dit ansigt, læber, tunge eller hals,
- synsproblemer,
- konstant løbende næse,
- brystsmerter,
- smerte når du trækker vejret,
- hurtig puls,
- hurtig vejrtrækning,
- stakåndet,
- rygsmerte,
- hævelse i dine ankler eller fødder,
- urinere mindre eller slet ikke,
- forvirring,
- hallucinationer,
- svimmelhed,
- hovedpine,
- sult,
- svaghed,
- svedeture,
- rystelser,
- irritabilitet,
- koncentrationsbesvær,
- ufrivillige muskelbevægelser,
- tab af balance eller koordination,
- blodig eller tjæreagtig afføring,
- hoste blod op,
- opkast, der ligner kaffegrums,
- svær hovedpine,
- sløret syn,
- summende i dine ører,
- angst,
- forvirring,
- brystsmerter,
- stakåndet,
- ujævne hjerteslag, og
- anfald
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Parlodel 2,5 mg omfatter:
- svimmelhed,
- snurrende fornemmelse,
- let døsighed,
- træthed,
- mild hovedpine,
- nedtrykt humør,
- søvnproblemer (søvnløshed),
- tør mund,
- tilstoppet næse,
- dårlig mave,
- kvalme,
- opkastning,
- mavesmerter,
- mistet appetiten,
- diarré,
- forstoppelse, og
- kold følelse eller følelsesløshed i fingrene
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Parlodel. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
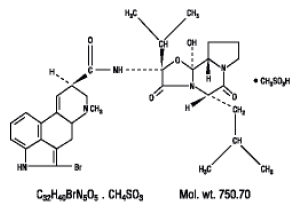
Parlodel® (bromocriptinmesylat) er et ergotderivat med potent dopaminreceptoragonistaktivitet. Hver Parlodel® (bromocriptinmesylat) SnapTabs® tablet til oral administration indeholder 2½ mg, og hver kapsel indeholder 5 mg bromocriptin (som mesylatet). Bromocriptinmesylat er kemisk betegnet som Ergotaman-3',6',18-trion, 2-brom-12'-hydroxy-2'-(1-methylethyl)-5'-( 2-methylpropyl)-, (5'a)-monomethansulfonat (salt).
Strukturformlen er:
2½ mg SnapTabs®
Aktiv ingrediens: bromocriptinmesylat, USP
Inaktive ingredienser: kolloid siliciumdioxid, laktose, magnesiumstearat, povidon, stivelse og en anden ingrediens
5 mg kapsler
Aktiv ingrediens: bromocriptinmesylat, USP
Inaktive ingredienser: kolloid siliciumdioxid, gelatine, laktose, magnesiumstearat, rødt jernoxid, siliciumdioxid, natriumlaurylsulfat, stivelse, titaniumdioxid, gult jernoxid og en anden ingrediens
INDIKATIONER
Hyperprolactinæmi-associerede dysfunktioner
Parlodel (bromocriptinmesylat) er indiceret til behandling af dysfunktioner forbundet med hyperprolaktinæmi inklusive amenoré med eller uden galaktoré, infertilitet eller hypogonadisme . Parlodel 2,5 mg behandling er indiceret til patienter med prolaktin-udskillende adenomer , som kan være den grundlæggende underliggende endokrinopati, der bidrager til ovennævnte kliniske præsentationer. Reduktion i tumor størrelse er blevet påvist hos både mandlige og kvindelige patienter med makroadenomer. I tilfælde, hvor adenektomi vælges, kan et kursus med Parlodel 2,5 mg-terapi bruges til at reducere tumormassen før operationen.
Akromegali
Parlodel 2,5 mg-behandling er indiceret til behandling af akromegali. Parlodelbehandling, alene eller som supplerende behandling med bestråling af hypofysen eller kirurgi, reducerer serumvæksthormon med 50 % eller mere hos ca. ½ af de behandlede patienter, dog normalt ikke til normale niveauer.
Da virkningerne af ekstern hypofysestråling måske ikke bliver maksimal i flere år, giver supplerende behandling med Parlodel 2,5 mg potentielle fordele, før virkningerne af bestråling viser sig.
Parkinsons sygdom
Parlodel 2,5 mg SnapTabs eller kapsler er indiceret til behandling af tegn og symptomer på idiopatisk eller postencephalitisk Parkinsons sygdom. Som supplerende behandling til levodopa (alene eller sammen med en perifer decarboxylasehæmmer) kan Parlodel-behandling give yderligere terapeutiske fordele hos de patienter, der i øjeblikket fastholdes på optimale doser af levodopa, dem, der begynder at forværres (udvikler tolerance) over for levodopa-behandling, og dem, der oplever "end of dosis failure" på levodopa-behandling. Parlodel 2,5 mg-behandling kan tillade en reduktion af vedligeholdelsesdosis af levodopa og kan således afhjælpe forekomsten og/eller sværhedsgraden af bivirkninger forbundet med langvarig levodopa-behandling, såsom unormale ufrivillige bevægelser (f.eks. dyskinesier) og de markante udsving i motorisk funktion ("on-off" fænomen). Fortsat effekt af Parlodel 2,5 mg-behandling under behandling i mere end 2 år er ikke blevet fastslået.
Data er utilstrækkelige til at vurdere potentielle fordele ved at behandle nyligt diagnosticeret Parkinsons sygdom med Parlodel. Undersøgelser har dog vist signifikant flere bivirkninger (især kvalme, hallucinationer, forvirring og hypotension) hos Parlodel-behandlede patienter end hos levodopa/carbidopa-behandlede patienter. Patienter, der ikke reagerer på levodopa, er dårlige kandidater til Parlodel-behandling.
DOSERING OG ADMINISTRATION
Generel
Det anbefales, at Parlodel (bromocriptinmesylat) tages sammen med mad. Patienter bør evalueres hyppigt under dosiseskalering for at bestemme den laveste dosis, der giver et terapeutisk respons.
Hyperprolaktinemiske indikationer
Den indledende dosis af Parlodel SnapTabs til voksne er en ½ til en 2½ mg tablet med delekærv daglig. En yderligere 2½ mg tablet kan tilføjes til behandlingsregimet som tolereret hver 2. til 7. dag, indtil et optimalt terapeutisk respons er opnået. Den terapeutiske dosis varierede fra 2,5-15 mg dagligt hos voksne undersøgt klinisk.
Baseret på begrænsede data for børn i alderen 11 til 15, (se Pædiatrisk brug ) startdosis er en ½ til en 2½ mg tablet med delekærv daglig. Det kan være nødvendigt at øge dosis som tolereret, indtil der opnås et terapeutisk respons. Den terapeutiske dosis varierede fra 2,5-10 mg dagligt til børn med prolaktin-udskillende hypofyseadenomer.
For at reducere sandsynligheden for langvarig eksponering for Parlodels, hvis der opstår en uanet graviditet, bør der anvendes et mekanisk præventionsmiddel sammen med Parlodel 2,5 mg-behandling, indtil normale ovulatoriske menstruationscyklusser er genoprettet. Prævention kan derefter seponeres hos patienter, der ønsker graviditet.
Derefter, hvis menstruation ikke indtræffer inden for 3 dage efter den forventede dato, bør behandlingen med Parlodel 2,5 mg seponeres og en graviditetstest udføres.
Akromegali
Stort set alle akromegale patienter, der modtager terapeutisk fordel af Parlodel 2,5 mg, har også reduktioner i cirkulerende niveauer af væksthormon. Derfor vil periodisk vurdering af cirkulerende niveauer af væksthormon i de fleste tilfælde tjene som en guide til at bestemme det terapeutiske potentiale af Parlodel. Hvis der efter en kort afprøvning med Parlodel-behandling ikke har fundet nogen signifikant reduktion i væksthormonniveauer sted, bør der foretages en omhyggelig vurdering af sygdommens kliniske karakteristika, og hvis der ikke er sket nogen ændring, bør dosisjustering eller seponering af behandlingen overvejes. .
Den anbefalede initiale dosis er en ½ til en 2½ mg Parlodel SnapTabs-tablet ved pensionering (med mad) i 3 dage. Yderligere en ½ til 1 SnapTabs-tablet bør tilføjes til behandlingsregimet som tolereret hver 3. til 7. dag, indtil patienten opnår optimal terapeutisk fordel. Patienter bør revurderes månedligt, og dosis justeres baseret på reduktion af væksthormon eller klinisk respons. Det sædvanlige optimale terapeutiske dosisområde af Parlodel varierer fra 20-30 mg/dag hos de fleste patienter. Den maksimale dosis bør ikke overstige 100 mg/dag.
Patienter, der behandles med hypofysebestråling, bør seponeres fra Parlodel 2,5 mg-behandling på årsbasis for at vurdere både de kliniske virkninger af stråling på sygdomsprocessen såvel som virkningerne af Parlodel-behandling. Normalt er en tilbagetrækningsperiode på 4 til 8 uger tilstrækkelig til dette formål. Tilbagevendende tegn/symptomer eller stigninger i væksthormon indikerer, at sygdomsprocessen stadig er aktiv, og yderligere forløb med Parlodel bør overvejes.
Parkinsons sygdom
Grundprincippet for Parlodel 2,5 mg-behandling er at påbegynde behandling med en lav dosis og på individuel basis øge den daglige dosis langsomt, indtil der opnås maksimal terapeutisk respons. Doseringen af levodopa i denne introduktionsperiode bør om muligt opretholdes. Startdosis af Parlodel 2,5 mg er en ½ af en 2½ mg SnapTabs-tablet to gange dagligt med måltider. Vurderinger tilrådes med 2-ugers intervaller under dosistitrering for at sikre, at den laveste dosis, der giver et optimalt terapeutisk respons, ikke overskrides. Om nødvendigt kan dosis øges hver 14. til 28. dag med 2½ mg/dag med måltider. Skulle det være tilrådeligt at reducere dosis af levodopa på grund af bivirkninger, bør den daglige dosis af Parlodel, hvis den øges, udføres gradvist i små (2½ mg) trin.
Sikkerheden af Parlodel er ikke blevet påvist i doser over 100 mg/dag.
HVORDAN LEVERET
Parlodel (Bromocriptine Mesylate) SnapTabs
2½ mg
Parlodel fås i flasker indeholdende 30 og 100 tabletter á 2 ½ mg, hver flaske indeholder et tørremiddel.
Runde, råhvide SnapTabs med skrå kant, som hver indeholder 2½ mg bromocriptin (som mesylatet). Indgraveret "PARLODEL 2½" på den ene side og "017" på den ridsede side. Overholder USP opløsningstest 1.
Pakker med 30 stk. NDC 30698-202-30 Pakker med 100 - NDC 30698-202-01
Parlodel (Bromocriptine Mesylate) Kapsler
5 mg
Karamel og hvide kapsler, som hver indeholder 5 mg bromocriptin (som mesylatet). Trykt med rødt blæk "PARLODEL 5 mg" på den ene halvdel og "102" på den anden halvdel.
Pakker med 30 stk. NDC 30698-201-30 Pakker med 100 - NDC 30698-201-01
Opbevar og dispenser
Opbevares ved 68° til 77°F (20° til 25°C); udflugter tilladt til 59° til 86°F (15° til 30°C) [Se USP kontrolleret rumtemperatur].
Dispenser i en tæt, lysbestandig beholder.
Fremstillet for og distribueret af: Validus Pharmaceuticals LLC Parsippany, NJ 07054. Revideret: juli 2021
BIVIRKNINGER
Bivirkninger fra kliniske forsøg
Hyperprolaktinemiske indikationer
Forekomsten af bivirkninger er ret høj (69 %), men disse er generelt milde til moderate. Behandlingen blev afbrudt hos ca. 5 % af patienterne på grund af bivirkninger. Disse i faldende frekvens er: kvalme (49%), hovedpine (19%), svimmelhed (17%), træthed (7%), svimmelhed (5%), opkastning (5%), mavekramper (4%) , tilstoppet næse (3%), forstoppelse (3%), diarré (3%) og døsighed (3%).
En let hypotensiv effekt kan ledsage Parlodel (bromocriptinmesylat) behandling. Forekomsten af bivirkninger kan mindskes ved midlertidigt at reducere dosis til ½ SnapTabs tablet 2 eller 3 gange dagligt. Nogle få tilfælde af cerebrospinalvæske rhinoré er blevet rapporteret hos patienter, der fik Parlodel 2,5 mg til behandling af store prolactinomer. Dette er forekommet sjældent, sædvanligvis kun hos patienter, som tidligere har modtaget transsphenoidal kirurgi, hypofysestråling eller begge dele, og som fik Parlodel 2,5 mg for tumortilbagefald. Det kan også forekomme hos tidligere ubehandlede patienter, hvis tumor strækker sig ind i sinus sphenoid.
Akromegali
De hyppigste bivirkninger hos akromegale patienter behandlet med Parlodel 2,5 mg var: kvalme (18 %), forstoppelse (14 %), postural/ortostatisk hypotension (6 %), anoreksi (4 %), mundtørhed/tilstoppet næse (4 %), fordøjelsesbesvær/dyspepsi (4%), digital vasospasme (3%), døsighed/træthed (3%) og opkastning (2%).
Mindre hyppige bivirkninger (mindre end 2%) var: gastrointestinal blødning, svimmelhed, forværring af Raynauds syndrom, hovedpine og synkope. Sjældent (mindre end 1%) hårtab, alkoholpotentiering, besvimelse, svimmelhed, arytmi, ventrikulær takykardi, nedsat søvnbehov, synshallucinationer, træthed, åndenød, bradykardi, svimmelhed, paræstesi, træghed, vasovagal anfald, vrangforestillingspsykose, , søvnløshed, tung hovedet, nedsat tolerance over for kulde, snurren i ørerne, bleghed i ansigtet og muskelkramper er blevet rapporteret.
Parkinsons sygdom
kliniske forsøg, hvor Parlodel 2,5 mg blev administreret med samtidig reduktion af dosis af levodopa/carbidopa, var de mest almindelige nyligt opståede bivirkninger: kvalme, unormale ufrivillige bevægelser, hallucinationer, forvirring, "on-off"-fænomen, svimmelhed, døsighed, besvimelse/besvimelse, opkastning, asteni, ubehag i maven, synsforstyrrelser, ataksi, søvnløshed, depression, hypotension, åndenød, forstoppelse og vertigo.
Mindre almindelige bivirkninger, som kan opstå, omfatter: anoreksi, angst, blefarospasme, mundtørhed, dysfagi, ødem i fødder og ankler, erythromelalgi, epileptiforme anfald, træthed, hovedpine, sløvhed, pletter af huden, tilstoppet næse, nervøsitet, paræstesi, hududslæt, hyppig vandladning, urininkontinens, urinretention og i sjældne tilfælde tegn og symptomer på ergotisme såsom snurren i fingre, kolde fødder, følelsesløshed, muskelkramper i fødder og ben eller forværring af Raynauds syndrom.
Abnormiteter i laboratorieprøver kan omfatte forhøjelser i blodurinstofnitrogen, SGOT, SGPT, GGPT, CPK, alkalisk fosfatase og urinsyre, som normalt er forbigående og ikke af klinisk betydning.
Bivirkninger fra Postmarketing-oplevelse
Følgende bivirkninger er blevet rapporteret under brug af Parlodel efter godkendelse (alle indikationer kombineret). Fordi bivirkninger fra spontane indberetninger er rapporteret frivilligt fra en population af usikker størrelse, er det generelt ikke muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Psykiatriske lidelser: Forvirring, psykomotorisk agitation/excitation, hallucinationer, psykotiske lidelser, søvnløshed, øget libido, hyperseksualitet og impulskontrol/kompulsiv adfærd (herunder gambling, forbrug og andre intense drifter).
Forstyrrelser i nervesystemet: Hovedpine, døsighed, svimmelhed, dyskinæsi, somnolens, paræstesi, overdreven søvnighed i dagtimerne, pludselig indsættende søvn.
Øjenlidelser: Synsforstyrrelser, sløret syn.
Øre- og labyrintlidelser: Tinnitus.
Hjertelidelser: Perikardiel effusion, konstriktiv pericarditis, takykardi, bradykardi, arytmi, hjerteklapfibrose.
Vaskulære lidelser: Hypotension, ortostatisk hypotension (meget sjældent fører til synkope), reversibel bleghed af fingre og tæer induceret af kulde (især hos patienter med Raynauds fænomen i anamnesen).
Åndedræts-, thorax- og mediastinumsygdomme: Tilstoppet næse, pleural effusion, pleural fibrose, pleuritis, lungefibrose, dyspnø.
Gastrointestinale lidelser: Kvalme, forstoppelse, opkastning, mundtørhed, diarré, mavesmerter, retroperitoneal fibrose, mavesår, gastrointestinal blødning.
Hud- og subkutane vævssygdomme: Allergiske hudreaktioner, hårtab.
Sygdomme i bevægeapparatet og bindevæv: Benkramper.
Generelle lidelser og tilstande på administrationsstedet: Træthed, perifert ødem, et syndrom, der ligner malignt neuroleptikasyndrom ved pludselig seponering af Parlodel, abstinenssymptomer (inklusive apati, angst, depression, træthed, søvnløshed, svedtendens og smerter) med nedtrapning eller efter seponering (se FORHOLDSREGLER ).
Uønskede hændelser observeret under andre forhold
Postpartum patienter (se ovenfor ADVARSLER )
postpartum undersøgelser med Parlodel 2,5 mg havde 23 procent af postpartum patienter behandlet mindst 1 bivirkning, men de var generelt milde til moderate i grad. Behandlingen blev afbrudt hos ca. 3 % af patienterne. De hyppigst forekommende bivirkninger var: hovedpine (10%), svimmelhed (8%), kvalme (7%), opkastning (3%), træthed (1,0%), synkope (0,7%), diarré (0,4%) og kramper (0,4%). Fald i blodtryk (≥ 20 mm Hg systolisk og ≥ 10 mm Hg diastolisk) forekom hos 28 % af patienterne mindst én gang i løbet af de første 3 dage efter fødslen; disse var sædvanligvis af forbigående karakter. Rapporter om besvimelse i barselperioden kan muligvis være relateret til denne effekt. Efter markedsføringserfaring i USA omfatter alvorlige bivirkninger rapporteret 72 tilfælde af anfald (herunder 4 tilfælde af status epilepticus), 30 tilfælde af slagtilfælde og 9 tilfælde af myokardieinfarkt blandt postpartum patienter. Anfaldstilfælde var ikke nødvendigvis ledsaget af udvikling af hypertension. En uophørlig og ofte progressivt alvorlig hovedpine, nogle gange ledsaget af synsforstyrrelser, ofte forudgået af timer til dage med mange tilfælde af anfald og/eller slagtilfælde. De fleste patienter havde ikke vist tegn på nogen af de hypertensive lidelser under graviditeten, herunder eklampsi, præeklampsi eller graviditetsinduceret hypertension. Et tilfælde af slagtilfælde var forbundet med sagittal sinus-trombose, og et andet var forbundet med cerebral og cerebellar vaskulitis. Et tilfælde af myokardieinfarkt var forbundet med uforklarlig dissemineret intravaskulær koagulation, og et andet opstod i forbindelse med brug af et andet ergotalkaloid. Sammenhængen mellem disse bivirkninger og administration af Parlodel er ikke fastlagt.
sjældne tilfælde er alvorlige bivirkninger, herunder hypertension, myokardieinfarkt, krampeanfald, slagtilfælde eller psykiske lidelser blevet rapporteret hos postpartum kvinder behandlet med Parlodel. Hos nogle patienter gik udviklingen af anfald eller slagtilfælde forud af alvorlig hovedpine og/eller forbigående synsforstyrrelser. Selvom årsagssammenhængen mellem disse hændelser og lægemidlet er usikker, er periodisk overvågning af blodtrykket tilrådeligt hos kvinder efter fødslen, der får Parlodel. Hvis hypertension, svær, progressiv eller uafbrudt hovedpine (med eller uden synsforstyrrelser) eller tegn på CNS-toksicitet udvikler sig, bør administrationen af Parlodel 2,5 mg afbrydes, og patienten bør evalueres omgående.
Særlig forsigtighed er påkrævet hos patienter, der for nylig er blevet behandlet eller er i samtidig behandling med lægemidler, der kan ændre blodtrykket, f.eks. vasokonstriktorer såsom sympatomimetika eller ergotalkaloider, inklusive ergometrin eller methylergometrin, og deres samtidige brug i puerperiet anbefales ikke.
Kontakt Validus Pharmaceuticals LLC på 1-866-982-5438 eller FDA på 1-800-FDA-1088 for at indberette MÆNKTE BIVIRKNINGER www.fda.gov/medwatch.
DRUGSINTERAKTIONER
Risikoen ved at bruge Parlodel i kombination med andre lægemidler er ikke blevet systematisk vurderet, men alkohol kan forstærke bivirkningerne af Parlodel. Parlodel 2,5 mg kan interagere med dopaminantagonister, butyrophenoner og visse andre midler. Forbindelser i disse kategorier resulterer i en nedsat virkning af Parlodel: phenothiaziner, haloperidol, metoclopramid og pimozid. Bromocriptin er et substrat for CYP3A4. Der bør derfor udvises forsigtighed ved samtidig administration af lægemidler, som er stærke hæmmere af dette enzym (såsom azol-antimykotika, HIV-proteasehæmmere). Samtidig brug af makrolidantibiotika, såsom erythromycin, har vist sig at øge plasmaniveauerne af bromocriptin (gennemsnitlige AUC- og Cmax-værdier steg henholdsvis 3,7 gange og 4,6 gange).1 Samtidig behandling af akromegale patienter med bromocriptin og octreotid førte til øget plasma-octreotid niveauer af bromocriptin (bromocriptin-AUC steg ca. 38%).4 Samtidig brug af Parlodel og andre ergotalkaloider anbefales ikke. Dosisjustering kan være nødvendig i de tilfælde, hvor høje doser bromocriptin anvendes (såsom indikation for Parkinsons sygdom).
ADVARSLER
Da der er fundet hyperprolaktinæmi med amenoré/galaktoré og infertilitet hos patienter med hypofysetumorer, er en fuldstændig evaluering af hypofysen indiceret før behandling med Parlodel (bromocriptinmesylat).
Hvis der opstår graviditet under administration af Parlodel, er omhyggelig observation af disse patienter obligatorisk. Prolaktin-udskillende adenomer kan udvide sig, og kompression af syns- eller andre kranienerver kan forekomme, og akut hypofysekirurgi bliver nødvendig. I de fleste tilfælde forsvinder kompressionen efter levering. Genoptagelse af Parlodel 2,5 mg-behandling er blevet rapporteret at give forbedringer i synsfelterne hos patienter, hvor nervekompression har fundet sted under graviditet. Sikkerheden ved Parlodel 2,5 mg-behandling under graviditet for moderen og fosteret er ikke blevet fastslået.
Parlodel 2,5 mg er blevet forbundet med somnolens og episoder med pludselig indsættende søvn, især hos patienter med Parkinsons sygdom. Pludselig indsættende søvn under daglige aktiviteter, i nogle tilfælde uden bevidsthed eller advarselstegn, er blevet rapporteret. Patienter skal informeres om dette og rådes til ikke at køre bil eller betjene maskiner under behandling med bromocriptin. Patienter, som har oplevet somnolens og/eller en episode med pludseligt faldende søvn, må ikke køre bil eller betjene maskiner. Endvidere kan en reduktion af dosis eller afbrydelse af behandlingen overvejes.
Symptomatisk hypotension kan forekomme hos patienter behandlet med Parlodel for enhver indikation. I postpartum undersøgelser med Parlodel er fald i systolisk og diastolisk tryk på mere end henholdsvis 20 mm og 10 mm Hg observeret hos næsten 30 % af patienterne, der fik Parlodel. Nogle gange var faldet i det systoliske tryk på liggende liggende så meget som 50-59 mm Hg.
Da der, især i løbet af de første behandlingsdage, lejlighedsvis kan forekomme hypotensive reaktioner og resultere i reduceret årvågenhed, bør der udvises særlig forsigtighed, når du kører bil eller betjener maskiner.
Mens hypotension under starten af behandlingen med Parlodel 2,5 mg forekommer hos nogle patienter, er der i sjældne tilfælde rapporteret alvorlige bivirkninger, herunder hypertension, myokardieinfarkt, krampeanfald, slagtilfælde hos postpartum kvinder behandlet med Parlodel 2,5 mg til hæmning af amning. Hypertension er blevet rapporteret, nogle gange i begyndelsen af behandlingen, men udvikler sig ofte i den anden uge af behandlingen; krampeanfald er også blevet rapporteret både med og uden forudgående udvikling af hypertension; slagtilfælde er for det meste blevet rapporteret hos postpartumpatienter, hvis prænatale og obstetriske forløb havde været ukomplicerede. Mange af disse patienter, der oplevede anfald (herunder tilfælde af status epilepticus) og/eller slagtilfælde, rapporterede at udvikle en konstant og ofte progressivt alvorlig hovedpine timer til dage før den akutte hændelse. Nogle tilfælde af slagtilfælde og anfald blev også forudgået af synsforstyrrelser (sløret syn og forbigående kortikal blindhed). Tilfælde af akut myokardieinfarkt er også blevet rapporteret.
Selvom en årsagssammenhæng mellem administration af Parlodel og hypertension, krampeanfald, slagtilfælde og myokardieinfarkt hos postpartum kvinder ikke er blevet fastslået, anbefales brug af lægemidlet til forebyggelse af fysiologisk laktation eller til patienter med ukontrolleret hypertension. Hos patienter, der behandles for hyperprolaktinæmi, bør Parlodel 2,5 mg seponeres, når graviditet er diagnosticeret (se FORHOLDSREGLER , Hyperprolaktinemiske tilstande ). I tilfælde af at Parlodel 2,5 mg genoptages for at kontrollere et hurtigt ekspanderende makroadenom (se FORHOLDSREGLER , Hyperprolaktinemiske tilstande og en patient oplever en hypertensiv sygdom under graviditeten, skal fordelen ved at fortsætte med Parlodel afvejes mod den mulige risiko ved brugen af det under en hypertensiv sygdom under graviditeten. Når Parlodel anvendes til behandling af akromegali eller Parkinsons sygdom hos patienter, der efterfølgende bliver gravide, skal der tages stilling til, om behandlingen fortsat er medicinsk nødvendig eller kan seponeres. Hvis det fortsættes, bør lægemidlet seponeres hos dem, der kan opleve hypertensive graviditetsforstyrrelser (inklusive eklampsi, præeklampsi eller graviditetsinduceret hypertension), medmindre seponering af Parlodel anses for at være medicinsk kontraindiceret. På grund af muligheden for en interaktion mellem Parlodel og andre ergotalkaloider frarådes samtidig brug af disse lægemidler. Periodisk monitorering af blodtrykket, især i de første uger af behandlingen, er fornuftigt. Hvis hypertension, svær, progressiv eller uafbrudt hovedpine (med eller uden synsforstyrrelser) eller tegn på CNS-toksicitet udvikler sig, bør lægemiddelbehandling afbrydes, og patienten bør evalueres omgående. Særlig opmærksomhed bør rettes mod patienter, der for nylig er blevet behandlet eller er i samtidig behandling med lægemidler, der kan ændre blodtrykket. Deres samtidig brug i barselperioden anbefales ikke.
Blandt patienter på Parlodel, især i langtids- og højdosisbehandling, er der rapporteret pleurale og perikardielle effusioner samt pleural og pulmonal fibrose og constrictive pericarditis. Patienter med uforklarlige pleuropulmonale lidelser bør undersøges grundigt, og seponering af Parlodel 2,5 mg-behandling bør overvejes. I de tilfælde, hvor behandlingen med Parlodel 2,5 mg blev afsluttet, vendte ændringerne langsomt tilbage til det normale.
Hos nogle få patienter på Parlodel, især i langtids- og højdosisbehandling, er retroperitoneal fibrose blevet rapporteret. For at sikre genkendelse af retroperitoneal fibrose på et tidligt reversibelt stadium anbefales det, at dens manifestationer (f.eks. rygsmerter, ødem i underekstremiteterne, nedsat nyrefunktion) overvåges hos denne patientkategori. Parlodel-medicin bør seponeres, hvis der diagnosticeres eller mistænkes fibrotiske forandringer i retroperitoneum.
FORHOLDSREGLER
Generel
Der har været rapporter om patienter, der har oplevet intens trang til at spille, øget seksuel trang, intens trang til at bruge penge ukontrolleret og/eller andre intense trang, og manglende evne til at kontrollere disse trang, mens de tager en eller flere af medicinerne, inklusive Parlodel 2,5 mg , der øger den centrale dopaminerge tonus. I nogle tilfælde, selvom ikke alle, blev disse trang rapporteret at være ophørt, når dosis blev reduceret, eller medicinen blev seponeret. Fordi patienter måske ikke genkender denne adfærd som unormal, er det vigtigt for ordinerende læger specifikt at spørge patienter eller deres pårørende om udviklingen af nye eller øgede spilletrang, seksuelle trang, ukontrolleret forbrug eller andre trang, mens de behandles med Parlodel 2,5 mg for Parkinsons sygdom eller hyperprolaktinæmi-associerede dysfunktioner. Læger bør overveje dosisreduktion eller at stoppe medicinen, hvis en patient udvikler sådanne trang, mens de tager Parlodel.
Sikkerhed og effekt af Parlodel (bromocriptinmesylat) er ikke blevet fastslået hos patienter med nyre- eller leversygdom. Der skal udvises forsigtighed, når Parlodel-behandling administreres samtidig med andre lægemidler, der vides at sænke blodtrykket.
Lægemidlet bør anvendes med forsigtighed hos patienter med en historie med psykose eller hjerte-kar-sygdom. Hvis akromegalipatienter eller patienter med prolactinom eller Parkinsons sygdom behandles med Parlodel 2,5 mg under graviditet, skal de observeres forsigtigt, især i postpartum-perioden, hvis de har en historie med kardiovaskulær sygdom.
Patienter med sjældne arvelige problemer med galactoseintolerans, svær laktasemangel eller glucose-galactosemalabsorption bør ikke tage denne medicin.
Hyperprolaktinemiske tilstande
Synsfeltsvækkelse er en kendt komplikation af makroprolactinom. Effektiv behandling med Parlodel 2,5 mg fører til en reduktion af hyperprolaktinæmi og ofte til en løsning af synsnedsættelsen. Hos nogle patienter kan der dog efterfølgende udvikles en sekundær forringelse af synsfelterne trods normaliserede prolaktinniveauer og tumorsvind, hvilket kan skyldes træk på den optiske chiasme, som trækkes ned i den nu delvis tomme sella. I disse tilfælde kan synsfeltdefekten forbedres ved reduktion af bromocriptin-dosis, mens der er en vis forhøjelse af prolaktin og en vis tumor-re-ekspansion. Monitorering af synsfelter hos patienter med makroprolaktinom anbefales derfor for en tidlig erkendelse af sekundært felttab på grund af chiasmal herniation og tilpasning af lægemiddeldosering.
Den relative effekt af Parlodel versus kirurgi til at bevare synsfelter kendes ikke. Patienter med hurtigt progressivt synsfelttab bør evalueres af en neurokirurg for at hjælpe med at beslutte den mest passende behandling.
Da graviditet ofte er det terapeutiske formål hos mange hyperprolaktinemiske patienter med amenoré/galaktoré og hypogonadisme (infertilitet), er en omhyggelig vurdering af hypofysen afgørende for at påvise tilstedeværelsen af et prolaktin-udskillende adenom. Patienter, der ikke søger graviditet, eller patienter med store adenomer, bør rådes til at bruge andre svangerskabsforebyggende midler end orale præventionsmidler under behandling med Parlodel. Da graviditet kan forekomme før genoptagelse af menstruation, anbefales en graviditetstest mindst hver 4. uge i den amenorrheiske periode, og, når menstruationen er genoptaget, hver gang en patient går glip af en menstruation. Behandling med Parlodel SnapTabs eller kapsler bør afbrydes, så snart graviditet er konstateret. Patienter skal overvåges nøje gennem hele graviditeten for tegn og symptomer, der kan signalere udvidelsen af en tidligere uopdaget eller eksisterende prolaktin-udskillende tumor. Seponering af Parlodel-behandling hos patienter med kendte makroadenomer har i de fleste tilfælde været forbundet med hurtig genvækst af tumor og stigning i serumprolaktin.
Cerebrospinalvæske rhinoré er blevet observeret hos nogle patienter med prolaktin-udskillende adenomer behandlet med Parlodel.
Akromegali
Forkølelsesfølsom digital vasospasme er blevet observeret hos nogle akromegale patienter behandlet med Parlodel. Responsen, hvis den skulle opstå, kan vendes ved at reducere dosis af Parlodel 2,5 mg og kan forhindres ved at holde fingrene varme. Der er rapporteret tilfælde af alvorlig gastrointestinal blødning fra mavesår, nogle med dødelig udgang. Selvom der ikke er tegn på, at Parlodel 2,5 mg øger forekomsten af mavesår hos akromegale patienter, bør symptomer, der tyder på mavesår, undersøges grundigt og behandles passende. Patienter med mavesår eller gastrointestinal blødning i anamnesen bør observeres omhyggeligt under behandling med Parlodel.
Mulig tumorudvidelse under behandling med Parlodel er blevet rapporteret hos nogle få patienter. Da den naturlige historie af væksthormon-udskillende tumorer er ukendt, bør alle patienter monitoreres omhyggeligt, og hvis der opstår tegn på tumorudvidelse, bør seponering af behandlingen og alternative procedurer overvejes.
Parkinsons sygdom
Sikkerhed ved langtidsbrug i mere end 2 år ved de doser, der kræves til parkinsonisme, er ikke blevet fastlagt.
Som med enhver kronisk behandling anbefales periodisk evaluering af lever-, hæmatopoietisk, kardiovaskulær og nyrefunktion. Symptomatisk hypotension kan forekomme, og der bør derfor udvises forsigtighed ved behandling af patienter, der får antihypertensiva.
Høje doser af Parlodel 2,5 mg kan være forbundet med forvirring og mentale forstyrrelser. Da parkinsonpatienter kan vise milde grader af demens, bør der udvises forsigtighed ved behandling af sådanne patienter.
Parlodel administreret alene eller samtidig med levodopa kan forårsage hallucinationer (visuelt eller auditivt). Hallucinationer forsvinder normalt med dosisreduktion; lejlighedsvis er seponering af Parlodel 2,5 mg påkrævet. Sjældent, efter høje doser, har hallucinationer varet ved i flere uger efter seponering af Parlodel.
Som med levodopa skal der udvises forsigtighed, når Parlodel administreres til patienter med en anamnese med myokardieinfarkt, som har en resterende atriel, nodal eller ventrikulær arytmi.
Retroperitoneal fibrose er blevet rapporteret hos nogle få patienter i langtidsbehandling (2 til 10 år) med Parlodel 2,5 mg i doser fra 30-140 mg dagligt.
Epidemiologiske undersøgelser har vist, at patienter med Parkinsons sygdom har en højere risiko (2ca. 6 gange højere) for at udvikle melanom end den generelle befolkning. Hvorvidt den observerede øgede risiko skyldtes Parkinsons sygdom eller andre faktorer, såsom lægemidler til behandling af Parkinsons sygdom, er uklart. Af ovennævnte årsager rådes patienter og behandlere til at overvåge for melanomer ofte og regelmæssigt, når de bruger Parlodel til enhver indikation. Ideelt set bør periodiske hudundersøgelser udføres af passende kvalificerede personer (f.eks. hudlæger).
Seponering af Parlodel bør foretages gradvist, når det er muligt, selvom patienten skal forblive på levodopa. Et symptomkompleks, der ligner det maligne neuroleptikasyndrom (karakteriseret ved forhøjet temperatur, muskelstivhed, ændret bevidsthed og autonom ustabilitet), uden anden åbenbar ætiologi, er blevet rapporteret i forbindelse med hurtig dosisreduktion, seponering af eller ændringer i antiparkinsonbehandling.
Symptomer, herunder apati, angst, depression, træthed, søvnløshed, svedtendens og smerter er blevet rapporteret under nedtrapning eller efter seponering af dopaminagonister, inklusive Parlodel. Disse symptomer reagerer generelt ikke på levodopa. Inden seponering af Parlodel bør patienterne informeres om potentielle abstinenssymptomer og overvåges nøje under og efter seponering af Parlodel. I tilfælde af alvorlige abstinenssymptomer kan genindgivelse af en dopaminagonist med den laveste effektive dosis overvejes.
Karcinogenese, mutagenese, svækkelse af fertilitet
En 74-ugers undersøgelse blev udført i mus, hvor man anvendte diætniveauer af bromocriptinmesylat svarende til orale doser på 10 og 50 mg/kg/dag. En 100-ugers undersøgelse med rotter blev udført med diætniveauer svarende til orale doser på 1,7, 9,8 og 44 mg/kg/dag. De højeste doser testet i mus og rotter var henholdsvis ca. 2,5 og 4,4 gange den maksimale humane dosis administreret i kontrollerede kliniske forsøg (100 mg/dag) baseret på kropsoverfladeareal. Maligne livmodertumorer, endometrie og myometrie, blev fundet hos rotter som følger: 0/50 hunner, 2/50 hunner, 1,7 mg/kg dagligt, 7/49 hunner 9,8 mg/kg dagligt, og 9/50 hunner fik 44 mg/kg dagligt. Forekomsten af disse neoplasmer kan sandsynligvis tilskrives det høje østrogen/progesteron-forhold, som forekommer hos rotter som et resultat af den prolactin-hæmmende virkning af bromocriptinmesylat. De endokrine mekanismer, der menes at være involveret i rotterne, er ikke til stede hos mennesker. Der er ingen kendt sammenhæng mellem uterine maligniteter hos bromocriptin-behandlede rotter og human risiko. I modsætning til fundene hos rotter udviste livmoderen fra mus dræbt efter 74 ugers behandling ikke tegn på lægemiddelrelaterede ændringer.
Bromocriptinmesylat blev evalueret for mutagent potentiale i en række af tests, der inkluderede Ames bakteriel mutationsassay, mutagen aktivitet in vitro på V79 kinesisk hamster fibroblaster, cytogenetisk analyse af kinesisk hamster knoglemarvsceller efter in vivo behandling og en in vivo mikronucleus test for mutagenic potentiale hos mus.
Ingen mutagene virkninger blev opnået i nogen af disse tests.
Fertilitet og reproduktionsevne hos hunrotter blev ikke påvirket negativt af behandling med bromocriptin ud over det forudsagte fald i ungernes vægt på grund af undertrykkelse af laktation. Hos hanner behandlet med 50 mg/kg af dette lægemiddel var parring og fertilitet inden for det normale område. Forøget perinatalt tab blev produceret i undergrupperne af moderdyr, aflivet på dag 21 postpartum (pp) efter parring med hanner behandlet med den højeste dosis (50 mg/kg).
Graviditet
Kategori B
Administration af 10-30 mg/kg bromocriptin til 2 rottestammer på dag 6 til 15 postcoitum (pc) samt en enkelt dosis på 10 mg/kg på dag 5 pc interfererede med nidation. Tre mg/kg givet på dag 6 til 15 var uden effekt på nidation og frembragte ingen anomalier. Hos dyr behandlet fra dag 8-15 pct., dvs. efter implantation, gav 30 mg/kg øget prænatal dødelighed i form af øget forekomst af embryonal resorption. En anomali, aplasi af ryghvirvler og ribben, blev fundet i gruppen af 262 fostre afledt af moderdyrene behandlet med 30 mg/kg bromocriptin. Der blev ikke fundet føtotoksiske effekter hos afkom fra moderdyr behandlet i den peri- eller postnatale periode.
To undersøgelser blev udført på kaniner (2 stammer) for at bestemme potentialet for at interferere med nidation. Dosisniveauer på 100 eller 300 mg/kg/dag fra dag 1 til dag 6 pct. påvirkede ikke nidationen negativt. Den høje dosis var ca. 63 gange den maksimale humane dosis administreret i kontrollerede kliniske forsøg (100 mg/dag), baseret på kropsoverfladeareal. Hos hvide New Zealand-kaniner forekom en vis embryodødelighed ved 300 mg/kg, hvilket var en afspejling af åbenlys maternel toksicitet. Tre undersøgelser blev udført i 2 kaninstammer for at bestemme det teratologiske potentiale af bromocriptin ved dosisniveauer på 3, 10, 30, 100 og 300 mg/kg givet fra dag 6 til dag 18 pct. I 2 undersøgelser med Yellow-silver stammen , blev ganespalte fundet hos 3 og 2 fostre ved modertoksiske doser på henholdsvis 100 og 300 mg/kg. Et kontrolfoster udviste også denne anomali. I den tredje undersøgelse udført med New Zealand hvide kaniner ved hjælp af en identisk protokol, blev der ikke produceret ganespalte.
Der blev ikke frembragt nogen teratologiske eller embryotoksiske virkninger af bromocriptin hos nogen af 6 afkom fra 6 aber ved et dosisniveau på 2 mg/kg.
Der er indsamlet oplysninger om 1276 graviditeter hos kvinder, der tager Parlodel. I de fleste tilfælde blev Parlodel seponeret inden for 8 uger inde i graviditeten (gennemsnitlig 28,7 dage), dog fik 8 patienter lægemidlet kontinuerligt gennem hele graviditeten. Den gennemsnitlige daglige dosis for alle patienter var 5,8 mg (interval 1-40 mg).
Af disse 1276 graviditeter var der 1088 fuldtidsfødsler (4 dødfødte), 145 spontane aborter (11,4%) og 28 fremkaldte aborter (2,2%). Desuden forårsagede 12 ekstrauterinegraviditeter og 3 hydatidiforme modermærker (to gange hos samme patient) tidlig graviditetsafbrydelse. Disse data kan sammenlignes positivt med abortraten (11 % -25 %) for graviditeter induceret af clomiphencitrat, menopausalt gonadotropin og choriongonadotropin.
Selvom spontane aborter ofte ikke bliver rapporteret, især før 20 ugers graviditet, er deres hyppighed blevet anslået til at være 15 %.
Forekomsten af fødselsdefekter i befolkningen generelt varierer fra 2% -4,5%. Incidensen i 1109 levendefødte børn fra patienter, der fik bromocriptin, er 3,3 %.
Der er ingen antydning om, at Parlodel 2,5 mg bidrog til typen eller forekomsten af fødselsdefekter hos denne gruppe af spædbørn.
Ammende mødre
Parlodel 2,5 mg bør ikke anvendes under amning hos kvinder efter fødslen.
Pædiatrisk brug
Sikkerheden og effektiviteten af bromocriptin til behandling af prolaktin-udskillende hypofyseadenomer er blevet fastslået hos patienter i alderen 16 til voksne. Der er ingen tilgængelige data for brug af bromocriptin til pædiatriske patienter under 8 år. En enkelt 8-årig patient behandlet med bromocriptin for et prolaktin-udskillende hypofyse-makroadenom er blevet rapporteret uden terapeutisk respons.
Brugen af bromocriptin til behandling af prolaktinudskillende adenomer hos pædiatriske patienter i aldersgruppen 11 til under 16 år understøttes af beviser fra velkontrollerede forsøg med voksne med yderligere data for et begrænset antal (n=14) børn og unge i alderen 11 til 15 år med prolaktin-udskillende hypofyse-makro- og mikroadenomer, som er blevet behandlet med bromocriptin. Af de 14 rapporterede patienter havde 9 vellykkede resultater, 3 delvise responser, og 2 reagerede ikke på bromocriptinbehandling. Kronisk hypopituitarisme komplicerede makroadenombehandling hos 5 af de responderende, både hos patienter, der fik bromocriptin alene, og hos dem, der fik bromocriptin i kombination med kirurgisk behandling og/eller hypofysebestråling.
Sikkerhed og effektivitet af bromocriptin hos pædiatriske patienter er ikke blevet fastslået for nogen anden indikation, der er anført i afsnittet INDIKATIONER OG ANVENDELSE.
Geriatrisk brug
Kliniske undersøgelser for Parlodel 2,5 mg inkluderede ikke et tilstrækkeligt antal forsøgspersoner på 65 år og derover til at afgøre, om ældre reagerer anderledes end yngre forsøgspersoner. Andre rapporterede kliniske erfaringer, herunder postmarketing rapportering af bivirkninger, har dog ikke identificeret forskelle i respons eller tolerabilitet mellem ældre og yngre patienter. Selvom der ikke er observeret nogen variation i effekt eller bivirkningsprofil hos geriatriske patienter, der tager Parlodel 2,5 mg, kan større følsomhed hos nogle ældre personer ikke kategorisk udelukkes. Generelt bør dosisvalg for en ældre patient være forsigtigt, begyndende i den nedre ende af dosisområdet, hvilket afspejler den større hyppighed af nedsat lever-, nyre- eller hjertefunktion og af samtidig sygdom eller anden lægemiddelbehandling i denne population.
OVERDOSIS
De mest almindeligt rapporterede tegn og symptomer forbundet med akut Parlodel (bromocriptinmesylat) overdosis er: kvalme, opkastning, forstoppelse, diaforese, svimmelhed, bleghed, svær hypotension, utilpashed, forvirring, sløvhed, døsighed, vrangforestillinger, hallucinationer og gentagne forvirringer. Den dødelige dosis er ikke fastlagt, og lægemidlet har en meget bred sikkerhedsmargin. Et dødsfald skete dog hos en patient, der begik selvmord med en ukendt mængde Parlodel 2,5 mg og klorokin.
Behandling af overdosering består af fjernelse af lægemidlet ved emesis (hvis bevidst), maveskylning, aktivt kul eller saltvandskatarsis. Omhyggelig overvågning og registrering af væskeindtag og -output er afgørende. Hypotension bør behandles ved at placere patienten i Trendelenburg-stilling og indgive IV væsker. Hvis tilfredsstillende lindring af hypotension ikke kan opnås ved at anvende ovenstående foranstaltninger i deres fulde omfang, bør vasopressorer overvejes.
Der har været isolerede rapporter om børn, der ved et uheld har indtaget Parlodel. Opkastning, somnolens og feber blev rapporteret som bivirkninger. Patienterne kom sig enten spontant inden for få timer eller efter passende behandling.
KONTRAINDIKATIONER
Overfølsomhed over for bromocriptin eller over for et eller flere af hjælpestofferne i Parlodel (bromocriptinmesylat), ukontrolleret hypertension og følsomhed over for eventuelle ergotalkaloider. Hos patienter, der behandles for hyperprolaktinæmi, bør Parlodel 2,5 mg seponeres, når graviditet er diagnosticeret (se FORHOLDSREGLER , Hyperprolaktinemiske tilstande ). I tilfælde af at Parlodel 2,5 mg genoptages for at kontrollere et hurtigt ekspanderende makroadenom (se FORHOLDSREGLER , Hyperprolaktinemiske tilstande og en patient oplever en hypertensiv sygdom under graviditeten, skal fordelen ved at fortsætte med Parlodel afvejes mod den mulige risiko ved brugen af det under en hypertensiv sygdom under graviditeten. Når Parlodel anvendes til behandling af akromegali, prolaktinom eller Parkinsons sygdom hos patienter, der efterfølgende bliver gravide, skal der tages stilling til, om behandlingen fortsat er medicinsk nødvendig eller kan seponeres. Hvis det fortsættes, bør lægemidlet seponeres hos dem, der kan opleve hypertensive graviditetsforstyrrelser (inklusive eklampsi, præeklampsi eller graviditetsinduceret hypertension), medmindre seponering af Parlodel anses for at være medicinsk kontraindiceret.
Lægemidlet bør ikke anvendes i postpartum-perioden hos kvinder med en historie med koronararteriesygdom og andre alvorlige kardiovaskulære tilstande, medmindre abstinenser anses for medicinsk kontraindiceret. Hvis lægemidlet anvendes i postpartum-perioden, skal patienten observeres med forsigtighed.
KLINISK FARMAKOLOGI
Parlodel (bromocriptinmesylat) er en dopaminreceptoragonist, som aktiverer postsynaptiske dopaminreceptorer. De dopaminerge neuroner i den tuberoinfundibulære proces modulerer sekretionen af prolaktin fra hypofysen ved at udskille en prolaktinhæmmende faktor (menes at være dopamin); i corpus striatum er de dopaminerge neuroner involveret i kontrollen af motorisk funktion. Klinisk reducerer Parlodel 2,5 mg signifikant plasmaniveauer af prolaktin hos patienter med fysiologisk forhøjet prolaktin samt hos patienter med hyperprolaktinæmi. Hæmningen af fysiologisk laktation såvel som galaktoré i patologiske hyperprolaktinemiske tilstande opnås ved dosisniveauer, der ikke påvirker udskillelsen af andre tropiske hormoner fra hypofysen. Eksperimenter har vist, at bromocriptin inducerer langvarig stereotyp adfærd hos gnavere og vendeadfærd hos rotter med ensidige læsioner i substantia nigra. Disse virkninger, der er karakteristiske for dem, der produceres af dopamin, hæmmes af dopaminantagonister og antyder en direkte virkning af bromocriptin på striatale dopaminreceptorer.
Bromocriptinmesylat er et ikke-hormonalt, ikke-østrogent middel, der hæmmer sekretionen af prolaktin hos mennesker, med ringe eller ingen effekt på andre hypofysehormoner, undtagen hos patienter med akromegali, hvor det sænker forhøjede blodniveauer af væksthormon hos de fleste patienter.
Bromocriptinmesylat frembringer sin terapeutiske virkning i behandlingen af Parkinsons sygdom, en klinisk tilstand karakteriseret ved en progressiv mangel i dopaminsyntese i substantia nigra, ved direkte at stimulere dopaminreceptorerne i corpus striatum. I modsætning hertil udøver levodopa kun sin terapeutiske virkning efter omdannelse til dopamin af neuronerne i substantia nigra, som vides at være numerisk formindsket i denne patientpopulation.
Farmakokinetik
Absorption
Efter enkeltdosis administration af Parlodel 2,5 mg tabletter, 2 x 2,5 mg til 5 raske frivillige under fastende forhold, var de gennemsnitlige maksimale plasmaniveauer af bromocriptin, tid til at nå maksimale plasmakoncentrationer og eliminationshalveringstid 465 pg/ml ± 226, 2,5 hhv. timer ± 2 og 4,85 timer.1 Der blev fundet lineær sammenhæng mellem enkeltdoser af Parlodel 2,5 mg og Cmax og AUC i dosisintervallet 1 til 7,5 mg.2 Farmakokinetikken af bromocriptinmetabolitter er ikke blevet rapporteret.
Mad påvirkede ikke signifikant den systemiske eksponering af bromocriptin efter administration af Parlodel-tabletter, 2,5 mg.3 Det anbefales, at Parlodel 2,5 mg tages sammen med mad på grund af den høje procentdel af forsøgspersoner, der kaster op efter at have fået bromocriptin under fastende forhold.
Efter Parlodel 5 mg indgivet to gange dagligt i 14 dage var bromocriptinets Cmax og AUC ved steady-state henholdsvis 628 ± 375 pg/mL og 2377 ± 1186 pg*t/mL.4
Fordeling
In vitro eksperimenter viste, at bromocriptin var 90% -96% bundet til serumalbumin.
Metabolisme
Bromocriptin gennemgår omfattende first-pass biotransformation, afspejlet af komplekse metabolitprofiler og af næsten fuldstændig fravær af moderlægemiddel i urin og fæces.
In vitro undersøgelser med humane levermikrosomer viste, at bromocriptin har en høj affinitet for CYP3A, og hydroxyleringer ved prolinringen af cyclopeptiddelen udgjorde en hovedmetabolismevej.5 Hæmmere og/eller potente substrater for CYP3A4 kan derfor hæmme clearance af bromcriptin og bly til øgede niveauer. (se FORHOLDSREGLER , DRUGSINTERAKTIONER afsnit). Deltagelsen af andre vigtige CYP-enzymer såsom 2D6, 2C8 og 2C19 på metabolismen af bromocriptin er ikke blevet evalueret. Bromocriptin er også en hæmmer af CYP3A4 med en beregnet IC50-værdi på 1,69 μM.6 På grund af de lave terapeutiske koncentrationer af bromocriptin hos patienter (Cmax=0,82 nM), bør en signifikant ændring af metabolismen af et andet lægemiddel, hvis clearance medieres af CYP3A4, ikke forventes. Den potentielle virkning af bromocriptin og dets metabolitter til at virke som inducere af CYP-enzymer er ikke blevet rapporteret.
Udskillelse
Omkring 82 % og 5,6 % af den orale radioaktive dosis blev genfundet i henholdsvis fæces og urin. Bromolyserginsyre og bromoisolyserginsyre stod for halvdelen af radioaktiviteten i urinen.5
Specifikke populationer
Virkning af nedsat nyrefunktion
Effekten af nyrefunktionen på bromocriptins farmakokinetik er ikke blevet evalueret.
Da moderlægemidlet og metabolitter næsten udskilles fuldstændigt via metabolisme og kun 6 % elimineres via nyrerne, har nedsat nyrefunktion muligvis ikke nogen signifikant indflydelse på PK af bromocriptin og dets metabolitter (se FORHOLDSREGLER , Generel ).
Virkning af nedsat leverfunktion
Virkningen af nedsat leverfunktion på PK af Parlodel og dets metabolitter er ikke blevet evalueret. Da Parlodel hovedsageligt elimineres ved metabolisme, kan nedsat leverfunktion øge plasmaniveauerne af bromocriptin, derfor kan forsigtighed være nødvendig (se FORHOLDSREGLER , Generel ).
Effekten af alder, race og køn på farmakokinetikken af bromocriptin og dets metabolitter er ikke blevet evalueret.
Kliniske Studier
I omkring 75 % af tilfældene af amenoré og galaktoré undertrykker Parlodel 2,5 mg-terapi galaktoréen fuldstændigt eller næsten fuldstændigt og genstarter normale ægløsningsmenstruationscyklusser.
Menstruation genoptages sædvanligvis før fuldstændig suppression af galaktorrhea; tiden for dette er i gennemsnit 6 til 8 uger. Nogle patienter reagerer dog inden for få dage, og andre kan tage op til 8 måneder.
Galaktorrhea kan tage længere tid at kontrollere afhængigt af graden af stimulering af brystvævet før behandlingen. Mindst en 75 % reduktion i sekretion observeres normalt efter 8 til 12 uger. Nogle patienter kan ikke reagere, selv efter 12 måneders behandling.
Hos mange akromegale patienter producerer Parlodel 2,5 mg en hurtig og vedvarende reduktion i cirkulerende niveauer af serumvæksthormon.
1 Nelson, M. et. al. (1990). Farmakokinetisk evaluering af erythromycin og koffein administreret med bromocriptin. Clin Pharmacol Ther; 47(6):694-7.
Schran, HF, Bhuta, SI, Schwartz, et al. (1980). Bromocriptins farmakokinetik hos mennesker. I: Golstein, M. Calne, DB, et. Al (red.). Ergotforbindelse og hjernefunktion: Neuroendokrine og neuropsykiatriske aspekter, s. 125-139, New York, Rave Press.
3 Kopitar, Z., Vrhovac, B., Povsic, L., Plavsic, F., Francetic, I., Urbancic, J. (1991). Virkningen af mad og metoclopramid på bromocriptins farmakokinetik og bivirkninger. Eur J Drug Metab Pharmacokinet; 16(3):177-81
4 Flogstad, AK, Halse, J., Grass, P., Abisch, E., Djoseland, O., Kutz, K., Bodd, E., og Jervell, J., (1994). En sammenligning af octreotid, bromocriptin eller en kombination af begge lægemidler ved akromegali. Journal of Clinical Endocrinology & Metabolism; bind 79, 461-465
5 Peyronneau MA, Delaforge M, Riviere R et al. 1994. Høj affinitet af ergopeptider for CYP P450 3A. Betydningen af deres peptiddel for P450-genkendelse og hydroxylering af bromocriptin. Eur J Biochem. 223:947-56.
Wynalda, MA, Wienkers, LC (1997). Vurdering af potentielle interaktioner mellem dopaminreceptoragonister og forskellige humane cytochrom P450-enzymer ved hjælp af en simpel in vitro-hæmningsscreening. Drug Metab Dispos; 25:1211-14.
PATIENTOPLYSNINGER
Under kliniske forsøg er svimmelhed, døsighed, besvimelse, besvimelse og synkope blevet rapporteret tidligt i behandlingsforløbet med Parlodel 2,5 mg. I postmarketingrapporter er Parlodel blevet forbundet med somnolens og episoder med pludselig indsættende søvn, især hos patienter med Parkinsons sygdom. Pludselig indsættende søvn under daglige aktiviteter, i nogle tilfælde uden bevidsthed eller advarselstegn, er blevet rapporteret meget sjældent. Alle patienter, der får Parlodel, bør advares med hensyn til at deltage i aktiviteter, der kræver hurtige og præcise reaktioner, såsom at køre bil eller betjene maskiner. Patienter, der behandles med Parlodel 2,5 mg og udviser somnolens og/eller pludselige søvnepisoder, skal rådes til ikke at køre bil eller deltage i aktiviteter, hvor nedsat opmærksomhed kan bringe dem selv eller andre i fare for alvorlig skade eller død (f.eks. betjene maskiner).
Patienter, der får Parlodel 2,5 mg for hyperprolaktinemiske tilstande forbundet med makroadenom eller dem, der tidligere har gennemgået transsphenoidal kirurgi, bør informeres om at rapportere ethvert vedvarende vandagtigt næseflåd til deres læge. Patienter, der får Parlodel 2,5 mg til behandling af et makroadenom, bør informeres om, at seponering af lægemidlet kan være forbundet med hurtig genvækst af tumoren og tilbagevenden af deres oprindelige symptomer.
Patienter og deres pårørende bør gøres opmærksom på muligheden for, at patienter kan opleve intense trang til at bruge penge ukontrolleret, intens trang til at spille, øget seksuel trang og andre intense drifter og manglende evne til at kontrollere disse drifter, mens de tager Parlodel. Råd patienter og deres pårørende til at informere deres sundhedsplejerske, hvis de udvikler nye eller øgede ukontrollerede udgifter, spilletrang, seksuelle trang eller andre trang, mens de behandles med Parlodel [se FORHOLDSREGLER ].
Især i løbet af de første dage af behandlingen kan hypotensive reaktioner lejlighedsvis forekomme og resultere i reduceret årvågenhed, særlig forsigtighed bør udvises, når du kører bil eller betjener maskiner.
Rådgiv patienterne om at kontakte deres læge, hvis de ønsker at seponere Parlodel eller reducere Parlodel-dosis. Rådgiv patienter, der har fået ordineret en lavere dosis, eller som er blevet trukket tilbage fra lægemidlet, om at underrette deres læge, hvis de har abstinenssymptomer såsom feber, muskelstivhed, ændret bevidsthed, apati, angst, depression, træthed, søvnløshed, svedtendens eller smerte (se FORHOLDSREGLER ).
