Medicin mod kvindesygdomme: Clomid 100mg, 25mg, 50mg Clomiphene Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Clomid 50mg, og hvordan bruges det?
Clomid 100mg er en receptpligtig medicin, der bruges til at behandle symptomer på infertilitet hos kvinder, der har ægløsningssvigt. Clomid kan bruges alene eller sammen med andre lægemidler.
Clomid tilhører en klasse af lægemidler kaldet selektive østrogenreceptormodulatorer.
Det vides ikke, om Clomid er sikkert og effektivt hos børn.
Hvad er de mulige bivirkninger af Clomid?
Clomid kan forårsage alvorlige bivirkninger, herunder:
- mavesmerter,
- oppustethed,
- kvalme,
- opkastning,
- diarré,
- hurtig vægtøgning (især i dit ansigt og midterste del),
- lidt eller ingen vandladning,
- smerte når du trækker vejret,
- hurtig puls, og
- stakåndet
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Clomid omfatter:
- rødmen (varme, rødme eller prikkende følelse),
- kvalme,
- opkastning,
- oppustethed,
- brystsmerter eller ømhed,
- hovedpine, og
- gennembrudsblødning eller pletblødning
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Clomid. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
CLOMID (clomiphenecitrat tabletter USP) er et oralt administreret, ikke-steroidt, ægløsningsstimulerende middel, kemisk betegnet 2-[p-(2-chlor-1,2-diphenylvinyl)phenoxy]triethylamincitrat (1:1). Det har molekylformlen C26H28ClNO • C6H8O7 og en molekylvægt på 598,09. Det er repræsenteret strukturelt som:
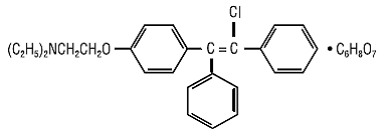
Clomiphenecitrat er et hvidt til bleggult, i det væsentlige lugtfrit, krystallinsk pulver. Det er frit opløseligt i methanol; opløselig i ethanol; let opløselig i acetone, vand og chloroform; og uopløseligt i ether.
CLOMID 50mg er en blanding af to geometriske isomerer [cis (zuclomiphene) og trans (enclomiphene)] indeholdende mellem 30 % og 50 % af cis-isomeren.
Hver hvide tablet med delekærv indeholder 50 mg clomiphencitrat USP. Tabletten indeholder også følgende inaktive ingredienser: majsstivelse, laktose, magnesiumstearat, prægelatineret majsstivelse og saccharose.
INDIKATIONER
CLOMID 100mg er indiceret til behandling af ovulatorisk dysfunktion hos kvinder, der ønsker graviditet. Forhindringer for at opnå graviditet skal udelukkes eller behandles tilstrækkeligt, før behandlingen med CLOMID 50 mg påbegyndes. De patienter med størst sandsynlighed for at opnå succes med clomiphene-terapi omfatter patienter med polycystisk ovariesyndrom (se ADVARSLER : Ovarialt hyperstimuleringssyndrom ), amenorrhea-galactorrhea syndrom, psykogen amenoré, post-oral-kontraceptiv amenoré og visse tilfælde af sekundær amenoré af ubestemt ætiologi.
Korrekt timet coitus i forhold til ægløsning er vigtig. En basal kropstemperaturgraf eller andre passende tests kan hjælpe patienten og hendes læge med at afgøre, om ægløsningen fandt sted. Når ægløsningen er etableret, skal hver kur med CLOMID 100 mg startes på eller omkring den 5. dag i cyklussen. Langvarig cyklisk terapi anbefales ikke ud over i alt omkring seks cyklusser (herunder tre ægløsningscyklusser). (Se DOSERING OG ADMINISTRATION og FORHOLDSREGLER .)
CLOMID er kun indiceret til patienter med påvist ovulatorisk dysfunktion, som opfylder betingelserne beskrevet nedenfor:
Derudover bør patienter udvalgt til CLOMID-behandling evalueres i forhold til følgende:
Der er ingen tilstrækkelige eller velkontrollerede undersøgelser, der viser effektiviteten af CLOMID 100 mg til behandling af mandlig infertilitet. Derudover er der rapporteret om testikeltumorer og gynækomasti hos mænd, der bruger clomiphene. Årsag og virkning sammenhæng mellem rapporter om testikeltumorer og administration af CLOMID 25mg er ikke kendt.
Selvom den medicinske litteratur foreslår forskellige metoder, er der ingen universelt accepteret standardbehandling for kombineret terapi (dvs. CLOMID i forbindelse med andre ægløsningsfremkaldende lægemidler). Tilsvarende er der ingen standard CLOMID-kur til ægløsningsinduktion i in vitro-fertiliseringsprogrammer til fremstilling af æg til befrugtning og genindførelse. Derfor anbefales CLOMID 50mg ikke til disse anvendelser.
DOSERING OG ADMINISTRATION
Generelle betragtninger
Oparbejdning og behandling af kandidater til CLOMID 100 mg-behandling bør overvåges af læger med erfaring i behandling af gynækologiske eller endokrine lidelser. Patienter bør kun vælges til behandling med CLOMID 50 mg efter omhyggelig diagnostisk evaluering (se INDIKATIONER ). Behandlingsplanen bør skitseres på forhånd. Forhindringer for at nå målet med behandlingen skal udelukkes eller behandles tilstrækkeligt, før CLOMID påbegyndes. Det terapeutiske mål bør afbalanceres med potentielle risici og diskuteres med patienten og andre involverede i opnåelsen af en graviditet.
Ægløsning sker oftest fra 5 til 10 dage efter et CLOMID-forløb. Coitus bør tidsindstilles til at falde sammen med det forventede tidspunkt for ægløsning. Passende tests for at bestemme ægløsning kan være nyttige i løbet af denne tid.
Anbefalet dosering
Behandling af den valgte patient bør begynde med en lav dosis, 50 mg dagligt (1 tablet) i 5 dage. Dosis bør kun øges hos de patienter, som ikke har ægløsning som reaktion på cyklisk 50 mg CLOMID. En lav dosis eller varighed af behandlingsforløb anbefales især, hvis der er mistanke om usædvanlig følsomhed over for hypofysegonadotropin, såsom hos patienter med polycystisk ovariesyndrom (se ADVARSLER ; Ovarialt hyperstimuleringssyndrom ).
Patienten bør evalueres omhyggeligt for at udelukke graviditet, ovarieforstørrelse eller dannelse af ovariecyster mellem hver behandlingscyklus.
Hvis progestininduceret blødning er planlagt, eller hvis der opstår spontan uterinblødning før behandling, bør kuren på 50 mg dagligt i 5 dage startes på eller omkring den 5. dag i cyklussen. Behandlingen kan påbegyndes når som helst hos patienten, som ikke har haft nogen nylig uterinblødning. Når ægløsning forekommer ved denne dosis, er der ingen fordel ved at øge dosis i efterfølgende behandlingscyklusser.
Hvis ægløsningen ikke ser ud til at forekomme efter det første behandlingsforløb, skal der gives en anden kur på 100 mg dagligt (to 50 mg tabletter givet som en enkelt daglig dosis) i 5 dage. Dette kursus kan startes så tidligt som 30 dage efter det foregående, efter at der er taget forholdsregler for at udelukke tilstedeværelsen af graviditet. Det anbefales ikke at øge dosis eller behandlingsvarighed ud over 100 mg/dag i 5 dage.
De fleste patienter, der skal have ægløsning, vil gøre det efter det første behandlingsforløb. Hvis ægløsning ikke forekommer efter tre behandlingsforløb, anbefales yderligere behandling med CLOMID 50 mg ikke, og patienten bør revurderes. Hvis der opstår tre ægløsningsreaktioner, men graviditet ikke er opnået, anbefales yderligere behandling ikke. Hvis menstruation ikke opstår efter et ovulatorisk respons, bør patienten revurderes. Langvarig cyklisk terapi anbefales ikke ud over i alt omkring seks cyklusser (se FORHOLDSREGLER ).
HVORDAN LEVERET
NDC 0068-0226-30: 50 mg tabletter i kartoner med 30 tabletter er runde, hvide, med delekærv og præget CLOMID 50. Opbevar tabletter ved kontrolleret stuetemperatur 59-86°F (15-30°C). Beskyt mod varme, lys og overdreven fugtighed og opbevar i lukkede beholdere.
Fremstillet af: A SANOFI COMPANY, sanofi-aventis US LLC, Bridgewater, NJ 08807. Revideret: juli 2017
BIVIRKNINGER
Uønskede hændelser i kliniske forsøg.
CLOMID, ved anbefalede doser, tolereres generelt godt. Bivirkninger har sædvanligvis været milde og forbigående, og de fleste er forsvundet umiddelbart efter, at behandlingen er blevet afbrudt. Bivirkninger rapporteret hos patienter behandlet med clomiphencitrat under kliniske undersøgelser er vist i tabel 2.
Følgende bivirkninger er blevet rapporteret hos færre end 1 % af patienterne i kliniske forsøg: Akut abdomen, øget appetit, forstoppelse, dermatitis eller udslæt, depression, diarré, svimmelhed, træthed, hårtab/tørt hår, øget vandladningsfrekvens/-volumen, søvnløshed, svimmelhed, nervøs spænding, vaginal tørhed, svimmelhed, vægtøgning/-tab.
Patienter i langvarig behandling med CLOMID 25 mg kan vise forhøjede serumniveauer af desmosterol. Dette skyldes højst sandsynligt en direkte interferens med kolesterolsyntese. Serumsterolerne hos patienter, der får den anbefalede dosis af CLOMID 50 mg, ændres dog ikke signifikant. Kræft i æggestokkene er sjældent rapporteret hos patienter, som har fået fertilitetsmedicin. Infertilitet er en primær risikofaktor for kræft i æggestokkene; epidemiologiske data tyder dog på, at langvarig brug af clomiphen kan øge risikoen for en borderline eller invasiv ovarietumor.
Uønskede hændelser efter markedsføring
Følgende bivirkninger er blevet identificeret under brug af Clomid efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Kroppen som helhed: Feber, tinnitus, svaghed
Kardiovaskulær: Arytmi, brystsmerter, ødem, hypertension, hjertebanken, flebitis, lungeemboli, åndenød, takykardi, tromboflebitis
Centralnervesystemet: Migræne hovedpine, paræstesi, anfald, slagtilfælde, synkope
Dermatologisk: Acne, allergisk reaktion, erytem, erythema multiforme, erythema nodosum, hypertrichosis, pruritus, nældefeber
Føtale/neonatale anomalier:
- Unormal knogleudvikling: skeletmisdannelser i kraniet, ansigtet, næsepassager, kæbe, hånd, lem (ekromelia inklusive amelia, hemimelia og phocomelia), fod (klumpfod), rygsøjle og led
- Hjerteabnormiteter: septalhjertedefekter, muskulær ventrikulær septaldefekt, patent ductus arteriosus, tetralogi af Fallot og coarctation af aorta
- Kromosomale lidelser: Downs syndrom
- Øreabnormiteter og døvhed
- Mave-tarmkanalens abnormiteter: læbe-ganespalte, uperforeret anus, trakeøsofageal fistel, diafragmatisk brok, omphalocele
- Genitalia abnormiteter: hypospadi, kloakeksstrofi
- Lungevævsmisdannelser
- Misdannelser af øjet og linsen (grå stær)
- Neoplasmer: neuroektodermal tumor, skjoldbruskkirteltumor, hepatoblastom, lymfatisk leukæmi
- Nervesystemabnormiteter: neuralrørsdefekter (anencefali, meningomyelocele), mikrocefali og hydrocephalus
- Nyreabnormaliteter: nyreagenese og nyredysgenese
- Andre: dværgvækst, mental retardering
Gastrointestinale: Pancreatitis
Genitourinære: Endometriose, ovariecyster (ovarieforstørrelse eller cyster kan som sådan være kompliceret af adnexal torsion), ovarieblødning, tubal graviditet, livmoderblødning, reduceret endometrietykkelse
Hepatisk: Transaminaser øget, hepatitis
Metabolismeforstyrrelser: Hypertriglyceridæmi, i nogle tilfælde med pancreatitis
Muskuloskeletale: Artralgi, rygsmerter, myalgi
Neoplasmer: Lever (hepatisk hæmangiosarkom, levercelleadenom, hepatocellulært karcinom); bryst (fibrocystisk sygdom, brystkarcinom); endometrium (endometriekarcinom); nervesystemet (astrocytom, hypofysetumor, prolaktinom, neurofibromatose, glioblastoma multiforme, hjerneabces); ovarie (luteom af graviditet, dermoid cyste i æggestokken, ovariekarcinom); trofoblastisk (hydatiform muldvarp, choriocarcinom); diverse (melanom, myelom, perianale cyster, nyrecellekarcinom, Hodgkins lymfom, tungekarcinom, blærekarcinom)
Psykiatrisk: Angst, irritabilitet, humørsvingninger, psykose
Synsforstyrrelser: Unormal akkommodation, grå stær, øjensmerter, makulært ødem, optisk neuritis, fotopsi, posterior glaslegemeløsning, retinal blødning, retinal trombose, retinal vaskulær spasmer, midlertidigt eller langvarigt tab af syn, muligvis irreversibelt.
Andet: Leukocytose, skjoldbruskkirtellidelse
DRUGSINTERAKTIONER
Lægemiddelinteraktioner med CLOMID er ikke blevet dokumenteret.
Stofmisbrug og afhængighed
Tolerance, misbrug eller afhængighed med CLOMID er ikke blevet rapporteret.
ADVARSLER
Visuelle symptomer
Patienter bør informeres om, at sløring eller andre visuelle symptomer såsom pletter eller blink (scintillerende scotomater) lejlighedsvis kan forekomme under behandling med CLOMID. Disse visuelle symptomer øges i forekomst med stigende totaldosis eller behandlingsvarighed. Disse synsforstyrrelser er normalt reversible; dog er der rapporteret tilfælde af længerevarende synsforstyrrelser, hvor nogle er forekommet efter seponering af CLOMID 50 mg. Synsforstyrrelserne kan være irreversible, især ved øget dosis eller varighed af behandlingen. Patienter bør advares om, at disse visuelle symptomer kan gøre aktiviteter som at køre bil eller betjene maskiner mere farlige end normalt, især under forhold med variabel belysning.
Disse visuelle symptomer synes at skyldes intensivering og forlængelse af efterbilleder. Symptomerne opstår ofte først eller forstærkes ved eksponering for et stærkt oplyst miljø. Mens målt synsstyrke sædvanligvis ikke er blevet påvirket, udviklede en undersøgelsespatient, der tog 200 mg CLOMID dagligt, synssløring på den 7. behandlingsdag, som udviklede sig til en alvorlig formindskelse af synsstyrken på den 10. dag. Der blev ikke fundet andre abnormiteter, og synsstyrken vendte tilbage til normal på 3. dagen efter behandlingen var stoppet.
Oftalmologisk definerbare scotomater og ændringer i retinalcellefunktion (elektroretinografiske) er også blevet rapporteret. En patient, der blev behandlet under kliniske undersøgelser, udviklede phosphener og scotomater under forlænget administration af CLOMID 50 mg, som forsvandt på den 32. dag efter behandlingens ophør.
Postmarketingovervågning af bivirkninger har også afsløret andre visuelle tegn og symptomer under CLOMID-behandling (se BIVIRKNINGER ).
Selvom ætiologien af disse visuelle symptomer endnu ikke er forstået, bør patienter med eventuelle visuelle symptomer afbryde behandlingen og få foretaget en fuldstændig oftalmologisk vurdering omgående.
Ovarialt hyperstimuleringssyndrom
Ovariehyperstimuleringssyndromet (OHSS) er blevet rapporteret at forekomme hos patienter, der får clomiphenecitratbehandling til ægløsningsinduktion. OHSS kan udvikle sig hurtigt (inden for 24 timer til flere dage) og blive en alvorlig medicinsk lidelse. I nogle tilfælde forekom OHSS efter cyklisk brug af clomiphencitratbehandling, eller når clomiphencitrat blev brugt i kombination med gonadotropiner. Forbigående abnormiteter i leverfunktionsprøver, der tyder på leverdysfunktion, som kan være ledsaget af morfologiske ændringer på leverbiopsi, er blevet rapporteret i forbindelse med OHSS.
OHSS er en medicinsk hændelse, der adskiller sig fra ukompliceret ovarieforstørrelse. De kliniske tegn på dette syndrom i alvorlige tilfælde kan omfatte kraftig ovarieforstørrelse, gastrointestinale symptomer, ascites, dyspnø, oliguri og pleural effusion. Derudover er følgende symptomer blevet rapporteret i forbindelse med dette syndrom: perikardiel effusion, anasarca, hydrothorax, akut abdomen, hypotension, nyresvigt, lungeødem, intraperitoneal og ovarieblødning, dyb venøs trombose, torsion af ovariet og akut respiratorisk nød. De tidlige advarselstegn på OHSS er mavesmerter og udspilning, kvalme, opkastning, diarré og vægtøgning. Forhøjede urinsteroidniveauer, varierende grader af elektrolyt-ubalance, hypovolæmi, hæmokoncentration og hypoproteinæmi kan forekomme. Dødsfald på grund af hypovolæmisk shock, hæmokoncentration eller tromboemboli er forekommet. På grund af skrøbelighed af forstørrede æggestokke i alvorlige tilfælde bør abdominal- og bækkenundersøgelse udføres meget forsigtigt. Hvis undfangelsen resulterer, kan der forekomme hurtig progression til den alvorlige form af syndromet.
For at minimere faren forbundet med lejlighedsvis unormal ovarieforstørrelse i forbindelse med CLOMID 100 mg-behandling, bør den laveste dosis, der er i overensstemmelse med forventede kliniske resultater, anvendes. Maksimal forstørrelse af æggestokken, hvad enten den er fysiologisk eller unormal, kan ikke forekomme før flere dage efter seponering af den anbefalede dosis af CLOMID. Nogle patienter med polycystisk ovariesyndrom, som er usædvanligt følsomme over for gonadotropin, kan have et overdrevet respons på sædvanlige doser af CLOMID. Derfor bør patienter med polycystisk ovariesyndrom startes med den laveste anbefalede dosis og korteste behandlingsvarighed i det første behandlingsforløb (se DOSERING OG ADMINISTRATION ).
Hvis der opstår en forstørrelse af æggestokken, bør der ikke gives yderligere CLOMID-behandling, før æggestokkene er vendt tilbage til størrelsen før behandlingen, og doseringen eller varigheden af den næste kur bør reduceres. Ovarieforstørrelse og cystedannelse i forbindelse med behandling med CLOMID 50 mg falder normalt spontant inden for få dage eller uger efter seponering af behandlingen. Den potentielle fordel ved efterfølgende CLOMID 25 mg-behandling i disse tilfælde bør overstige risikoen. Medmindre kirurgisk indikation for laparotomi eksisterer, bør en sådan cystisk forstørrelse altid behandles konservativt.
En årsagssammenhæng mellem ovariehyperstimulering og ovariecancer er ikke blevet fastlagt. Men fordi en sammenhæng mellem ovariecancer og nulliparitet, infertilitet og alder er blevet foreslået, bør der udføres en grundig evaluering for at udelukke tilstedeværelsen af ovarie neoplasi, hvis ovariecyster ikke regresserer spontant.
FORHOLDSREGLER
Generel
Der bør lægges stor vægt på udvælgelsen af kandidater til CLOMID-behandling. Undersøgelse af bækkenet er nødvendig før behandling med CLOMID og før hvert efterfølgende forløb (se KONTRAINDIKATIONER og ADVARSLER ).
Karcinogenese, mutagenese, svækkelse af fertilitet
Langtidstoksicitetsundersøgelser på dyr er ikke blevet udført for at vurdere det carcinogene eller mutagene potentiale af clomiphencitrat.
Oral administration af CLOMID 25 mg til hanrotter i doser på 0,3 eller 1 mg/kg/dag forårsagede nedsat fertilitet, mens højere doser forårsagede midlertidig infertilitet. Orale doser på 0,1 mg/kg/dag hos hunrotter afbrød midlertidigt det normale cykliske vaginale udstrygningsmønster og forhindrede undfangelse. Doser på 0,3 mg/kg/dag reducerede en smule antallet af ægløsninger og corpora lutea, mens 3 mg/kg/dag hæmmede ægløsning.
Graviditet
Sammendrag af fosterrisiko
Brug af CLOMID 100 mg til gravide kvinder er kontraindiceret, da behandling med CLOMID 25 mg ikke giver gavn for denne population.
Tilgængelige humane data tyder ikke på en øget risiko for medfødte anomalier over baggrundspopulationsrisikoen. Dog viste reproduktionstoksikologiske undersøgelser hos dyr øget embryo-føtalt tab og strukturelle misdannelser hos afkom. Hvis dette lægemiddel bruges under graviditet, eller hvis patienten bliver gravid, mens han tager dette lægemiddel, skal patienten informeres om de potentielle risici for fosteret.
Kliniske overvejelser
For at undgå utilsigtet administration af CLOMID 25 mg under tidlig graviditet, bør passende tests anvendes under hver behandlingscyklus for at bestemme, om ægløsning og/eller graviditet forekommer. Patienter bør evalueres omhyggeligt for at udelukke ovarieforstørrelse eller ovariecyster mellem hver behandlingscyklus. Det næste behandlingsforløb med CLOMID bør udskydes, indtil disse tilstande er udelukket.
Menneskelige data
De tilgængelige humane data fra epidemiologiske undersøgelser viser ikke nogen tilsyneladende årsag og virkning sammenhæng mellem clomiphenecitrat perikonceptuel eksponering og en øget risiko for overordnede fødselsdefekter eller nogen specifik anomali. På grund af det lille antal tilfælde af medfødte anomalier, der forekommer hos clomiphenecitratbehandlede kvinder, var disse epidemiologiske undersøgelser dog kun i stand til at udelukke store forskelle i risiko. Undersøgelserne tog ikke hensyn til faktorer forbundet med kvindelig subfertilitet og var ikke i stand til at justere for andre vigtige konfoundere. Derudover understøtter tilgængelige data ikke en øget frekvens af spontan abort blandt subfertile kvinder behandlet med clomiphencitrat til ægløsningsinduktion.
Dyredata
Oral administration af clomiphencitrat til gravide rotter under organogenese i doser på 1 til 2 mg/kg/dag resulterede i hydramnion og svage, ødematøse fostre med bølgede ribben og andre midlertidige knogleforandringer. Doser på 8 mg/kg/dag eller mere forårsagede også øgede resorptioner og døde fostre, dystoci og forsinket fødsel, og 40 mg/kg/dag resulterede i øget mødredødelighed. Enkeltdoser på 50 mg/kg forårsagede føtal grå stær, mens 200 mg/kg forårsagede ganespalte. Efter injektion af clomiphencitrat 2 mg/kg til mus og rotter under graviditeten udviste afkommet metaplastiske ændringer i forplantningskanalen. Nyfødte mus og rotter, der blev injiceret i løbet af de første par dage af livet, udviklede også metaplastiske ændringer i livmoder- og skedeslimhinden, såvel som for tidlig vaginal åbning og anovulatoriske ovarier. Disse resultater ligner den unormale reproduktive adfærd og sterilitet beskrevet med andre østrogener og antiøstrogener.
Hos kaniner blev der set nogle midlertidige knogleforandringer hos fostre fra moderdyr, der fik orale doser på 20 eller 40 mg/kg/dag under graviditeten, men ikke efter 8 mg/kg/dag. Der blev ikke observeret permanente misdannelser i disse undersøgelser. Også rhesusaber, der fik orale doser på 1,5 til 4,5 mg/kg/dag i forskellige perioder under graviditeten, havde ikke noget unormalt afkom.
Ammende mødre
Det vides ikke, om CLOMID udskilles i modermælk. Da mange lægemidler udskilles i modermælk, bør der udvises forsigtighed, hvis CLOMID administreres til en ammende kvinde. Hos nogle patienter kan CLOMID reducere amning.
Livmoderhalskræft
Langvarig brug af clomiphenecitrat-tabletter USP kan øge risikoen for en grænseoverskridende eller invasiv ovarietumor (se BIVIRKNINGER ).
OVERDOSIS
Tegn og symptomer
Toksiske virkninger, der ledsager akut overdosering af CLOMID 50 mg, er ikke blevet rapporteret. Tegn og symptomer på overdosering som følge af brug af mere end den anbefalede dosis under behandling med CLOMID 100 mg omfatter kvalme, opkastning, vasomotoriske flushes, visuelle sløring, pletter eller glimt, scotomater, ovarieforstørrelse med bækken- eller mavesmerter. (Se KONTRAINDIKATIONER : Ovariecyste .)
Oral LD50
Den akutte orale LD50 af CLOMID 25 mg er 1700 mg/kg hos mus og 5750 mg/kg hos rotter. Den toksiske dosis hos mennesker kendes ikke.
Dialyse
Det vides ikke, om CLOMID kan dialyseres.
Behandling
I tilfælde af overdosering bør passende understøttende foranstaltninger anvendes ud over gastrointestinal dekontaminering.
KONTRAINDIKATIONER
Overfølsomhed
CLOMID 100mg er kontraindiceret til patienter med kendt overfølsomhed eller allergi over for clomiphenecitrat eller over for nogen af dets ingredienser.
Graviditet
Brug af CLOMID til gravide kvinder er kontraindiceret, da CLOMID ikke giver fordele i denne population.
Tilgængelige humane data tyder ikke på en øget risiko for medfødte anomalier over baggrundspopulationsrisikoen, når de anvendes som indiceret. Dog viste reproduktionstoksikologiske undersøgelser hos dyr øget embryo-føtalt tab og strukturelle misdannelser hos afkom. Hvis dette lægemiddel bruges under graviditet, eller hvis patienten bliver gravid, mens han tager dette lægemiddel, skal patienten informeres om de potentielle risici for fosteret. (Se FORHOLDSREGLER : Graviditet .)
Lever sygdom
Behandling med CLOMID 25 mg er kontraindiceret til patienter med leversygdom eller tidligere leverdysfunktion (se også INDIKATIONER og BIVIRKNINGER ).
Unormal livmoderblødning
CLOMID 25 mg er kontraindiceret til patienter med unormal uterin blødning af ubestemt oprindelse (se INDIKATIONER ).
Ovariecyster
CLOMID er kontraindiceret til patienter med ovariecyster eller forstørrelse, der ikke skyldes polycystisk ovariesyndrom (se INDIKATIONER og ADVARSLER ).
Andet
CLOMID er kontraindiceret til patienter med ukontrolleret skjoldbruskkirtel- eller binyredysfunktion eller ved tilstedeværelse af en organisk intrakraniel læsion såsom hypofysetumor (se INDIKATIONER ).
KLINISK FARMAKOLOGI
Handling
CLOMID 25mg er et lægemiddel med betydelig farmakologisk styrke. Med omhyggelig udvælgelse og korrekt behandling af patienten har CLOMID 100mg vist sig at være en nyttig terapi til den anovulatoriske patient, der ønsker at blive gravid.
Clomiphenecitrat er i stand til at interagere med østrogen-receptor-holdigt væv, herunder hypothalamus, hypofysen, æggestokkene, endometrium, vagina og livmoderhalsen. Det kan konkurrere med østrogen om østrogen-receptor-bindingssteder og kan forsinke genopfyldning af intracellulære østrogenreceptorer. Clomiphenecitrat initierer en række endokrine hændelser, der kulminerer i en præovulatorisk gonadotropinstigning og efterfølgende follikulær ruptur. Den første endokrine hændelse som reaktion på et clomiphen-behandlingsforløb er en stigning i frigivelsen af hypofysegonadotropiner. Dette initierer steroidogenese og follikulogenese, hvilket resulterer i vækst af ovariefolliklen og en stigning i det cirkulerende niveau af østradiol. Efter ægløsning stiger og falder plasmaprogesteron og østradiol, som de ville i en normal ægløsningscyklus.
Tilgængelige data tyder på, at både de østrogene og antiøstrogene egenskaber af clomiphen kan deltage i initieringen af ægløsning. De to clomiphene-isomerer har vist sig at have blandede østrogene og antiøstrogene virkninger, som kan variere fra en art til en anden. Nogle data tyder på, at zuclomiphene har større østrogen aktivitet end enclomiphene.
Clomiphenecitrat har ingen tilsyneladende progestationelle, androgene eller antiandrogene virkninger og ser ikke ud til at forstyrre hypofyse-binyre- eller hypofyse-skjoldbruskkirtelfunktionen. Selvom der ikke er tegn på en "carryover-effekt" af CLOMID, er spontan ovulatorisk menstruation blevet observeret hos nogle patienter efter CLOMID 100 mg-behandling.
Farmakokinetik
Baseret på tidlige undersøgelser med 14C-mærket clomiphencitrat, viste det sig, at lægemidlet let absorberes oralt hos mennesker og hovedsageligt udskilles i fæces. Kumulativ urin- og fækal udskillelse af 14C var i gennemsnit omkring 50 % af den orale dosis og 37 % af en intravenøs dosis efter 5 dage. Den gennemsnitlige urinudskillelse var ca. 8 % med fækal udskillelse på ca. 42 %.
Noget 14C-mærke var stadig til stede i fæces 6 uger efter administration. Efterfølgende enkeltdosisundersøgelser hos normale frivillige viste, at zuclomiphen (cis) har en længere halveringstid end enclomiphen (trans). Påviselige niveauer af zuclomiphene varede i mere end en måned hos disse forsøgspersoner. Dette kan tyde på stereo-specifik enterohepatisk genbrug eller sekvestrering af zuclomiphene. Det er således muligt, at noget aktivt lægemiddel kan forblive i kroppen under tidlig graviditet hos kvinder, der bliver gravide i menstruationscyklussen under CLOMID-behandling.
Kliniske Studier
Under kliniske undersøgelser fik 7578 patienter CLOMID, hvoraf nogle havde andre hindringer for ægløsning end ægløsningsdysfunktion (se INDIKATIONER ). I disse kliniske forsøg forekom succesfuld terapi karakteriseret ved graviditet hos ca. 30 % af disse patienter.
Der blev rapporteret i alt 2635 graviditeter i den kliniske forsøgsperiode. Af disse graviditeter var oplysninger om udfald kun tilgængelige for 2369 af tilfældene. Tabel 1 opsummerer resultatet af disse sager.
Af de rapporterede graviditeter var forekomsten af flerfoldsgraviditeter 7,98 %: 6,9 % tvillinger, 0,5 % trillinger, 0,3 % firlinger og 0,1 % femlinger. Af de 165 tvillingegraviditeter, hvortil der var tilstrækkelig information, var forholdet mellem enæggede og tveæggede tvillinger omkring 1:5. Tabel 1 rapporterer overlevelsesraten for de levende flerfødte.
En sekstuplet-fødsel blev rapporteret efter afslutning af originale kliniske undersøgelser; ingen af sekstupletterne overlevede (hver vejede mindre end 400 g), selvom de hver forekom stort set normale.
Den samlede overlevelse af spædbørn fra flerfoldsgraviditeter inklusive spontane aborter, dødfødsler og neonatale dødsfald er 73 %.
Føtale/neonatale anomalier og dødelighed
Følgende føtale abnormiteter er blevet rapporteret efter graviditeter efter ovulationsinduktionsbehandling med CLOMID under kliniske forsøg. Hver af de følgende føtale abnormiteter blev rapporteret med en frekvens på
Derudover er der modtaget rapporter om medfødte anomalier under postmarketingovervågning af CLOMID (se BIVIRKNINGER ).
PATIENTOPLYSNINGER
Formålet med og risiciene ved CLOMID-behandling skal præsenteres for patienten, før behandlingen påbegyndes. Det skal understreges, at målet med CLOMID-behandling er ægløsning til efterfølgende graviditet. Lægen bør rådgive patienten med særlig hensyntagen til følgende potentielle risici:
Visuelle symptomer
Rådfør dig om, at sløring eller andre visuelle symptomer lejlighedsvis kan forekomme under eller kort efter CLOMID-behandling. Det skal gøres klart for patienten, at synsforstyrrelser i nogle tilfælde kan være langvarige og muligvis irreversible, især ved øget dosis eller varighed af behandlingen. Advarer om, at visuelle symptomer kan gøre sådanne aktiviteter som at køre bil eller betjene maskiner mere farlige end normalt, især under forhold med variabel belysning (se ADVARSLER ).
Patienten skal instrueres i at informere lægen, når der opstår usædvanlige visuelle symptomer. Hvis patienten har nogen visuelle symptomer, bør behandlingen afbrydes og en fuldstændig oftalmologisk undersøgelse udføres.
Mave-/bækkensmerter eller udspilning
Ovarieforstørrelse kan forekomme under eller kort efter behandling med CLOMID. For at minimere de risici, der er forbundet med ovarieforstørrelse, skal patienten instrueres i at informere lægen om eventuelle mave- eller bækkensmerter, vægtøgning, ubehag eller udspilning efter at have taget CLOMID (se ADVARSLER ).
Flerfoldsgraviditet
Informer patienten om, at der er en øget chance for flerfoldsgraviditet, herunder bilateral tubal graviditet og sameksisterende tubal og intrauterin graviditet, når undfangelse forekommer i forbindelse med CLOMID-behandling. De potentielle komplikationer og farerne ved flerfoldsgraviditet bør forklares.
Spontan abort og medfødte anomalier
Informer patienten om, at de tilgængelige data ikke tyder på nogen stigning i hyppigheden af spontan abort (abort) eller medfødte anomalier ved moderbrug af CLOMID 50 mg sammenlignet med hyppigheden i den generelle befolkning.
Under klinisk undersøgelse viser erfaringerne fra patienter med kendt graviditetsudfald (tabel 1) en spontan abortrate på 20,4 % og dødfødsel på 1,0 %. (Se Kliniske Studier ). Blandt de fødselsanomalier, der spontant er rapporteret som individuelle tilfælde siden kommerciel tilgængelighed af Clomid, har andelen af neuralrørsdefekter været høj blandt graviditeter forbundet med ægløsning induceret af Clomid, men dette er ikke blevet understøttet af data fra befolkningsbaserede undersøgelser.
