Symbicort 160/4.5mcg Budesonide Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Symbicort 4,5mcg, og hvordan bruges det?
Symbicort 4,5mcg er en receptpligtig medicin, der bruges til at behandle symptomer på astma og kronisk obstruktiv lungesygdom. Symbicort kan bruges alene eller sammen med anden medicin.
Symbicort tilhører en klasse af lægemidler kaldet Respiratory Inhalant Combos.
Det vides ikke, om Symbicort 4,5mcg er sikkert og effektivt til børn under 6 år.
Hvad er de mulige bivirkninger af Symbicort 4,5mcg?
Symbicort kan forårsage alvorlige bivirkninger, herunder:
- forværrede vejrtrækningsproblemer,
- sår eller hvide pletter i din mund eller hals,
- smerter ved synke,
- rystelser,
- nervøsitet,
- brystsmerter,
- hurtige eller bankende hjerteslag,
- hoste med slim,
- følelse af åndenød,
- hvæsen,
- kvælning,
- andre vejrtrækningsproblemer,
- sløret syn,
- tunnelsyn,
- øjensmerter eller rødme,
- ser glorier omkring lys,
- feber,
- kuldegysninger,
- kropssmerter,
- usædvanlig træthed,
- øget tørst,
- øget vandladning,
- tør mund,
- frugtig ånde lugt,
- kramper i benene,
- forstoppelse,
- uregelmæssige hjerteslag,
- flagrende i dit bryst,
- følelsesløshed eller prikken,
- muskelsvaghed,
- slap følelse,
- træthed,
- svaghed,
- svimmelhed,
- kvalme, og
- opkastning
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Symbicort omfatter:
- halssmerter eller irritation,
- hvide pletter i din mund eller hals,
- ubehag i maven,
- opkastning,
- rygsmerte,
- hovedpine,
- influenzasymptomer og
- forkølelsessymptomer (tilstoppet eller løbende næse, nysen, bihulesmerter eller ondt i halsen)
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Symbicort. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
SYMBICORT 80/4.5 og SYMBICORT 160/4.5 indeholder hver mikroniseret budesonid og mikroniseret formoterolfumaratdihydrat kun til oral inhalation.
Hver SYMBICORT 80/4.5 og SYMBICORT 160/4.5 beholder er formuleret som en hydrofluoralkan (HFA 227; 1,1,1,2,3,3,3-heptafluorpropan)-drevet trykmålt dosisinhalator indeholdende enten 60 eller 120 aktiveringer [se Doseringsformer og styrker og HVORDAN LEVERET / Opbevaring og håndtering ]. Efter priming måler hver aktivering enten 91/5,1 mcg eller 181/5,1 mcg fra ventilen og afgiver enten 80/4,5 mcg eller 160/4,5 mcg (budesonidmikroniseret/formoterolfumaratdihydratmikroniseret) fra aktuatoren. Den faktiske mængde lægemiddel, der leveres til lungen, kan afhænge af patientfaktorer, såsom koordinationen mellem aktivering af enheden og inspiration gennem leveringssystemet. SYMBICORT 160mg indeholder også povidon K25 USP som suspenderingsmiddel og polyethylenglycol 1000 NF som smøremiddel.
SYMBICORT 160mg bør primes før brug første gang ved at frigive to testsprays i luften væk fra ansigtet, ryste godt i 5 sekunder før hver spray. I tilfælde, hvor inhalatoren ikke har været brugt i mere end 7 dage, eller når den er blevet tabt, primer inhalatoren igen ved at ryste godt i 5 sekunder før hver spray og frigive to testsprays i luften væk fra ansigtet.
En aktiv komponent i SYMBICORT 4,5 mcg er budesonid, et kortikosteroid kemisk betegnet som (RS)11β, 16α, 17,21-Tetrahydroxypregna-1,4-dien-3,20-dion cyklisk 16,17-acetal med butyraldehyd. Budesonid leveres som en blanding af to epimerer (22R og 22S). Den empiriske formel for budesonid er C25H34O6 og dens molekylvægt er 430,5. Dens strukturformel er:
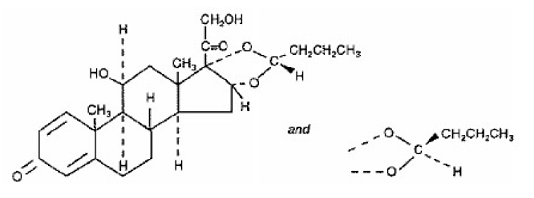
Budesonid er et hvidt til råhvidt, smagløst, lugtfrit pulver, som er praktisk talt uopløseligt i vand og heptan, tungtopløseligt i ethanol og let opløseligt i chloroform. Dens fordelingskoefficient mellem octanol og vand ved pH 7,4 er 1,6 x 103.
Den anden aktive komponent i SYMBICORT 160mg er formoterolfumaratdihydrat, en selektiv beta2-agonist kemisk betegnet som (R*,R*)-(±)-N-[2-hydroxy-5-[1-hydroxy-2-[[ 2-(4-methoxyphenyl)-1-methylethyl]amino]ethyl]phenyl]formamid, (E)-2-butendioat(2:1), dihydrat. Den empiriske formel for formoterol er C42H56N4O14 og dens molekylvægt er 840,9. Dens strukturformel er:
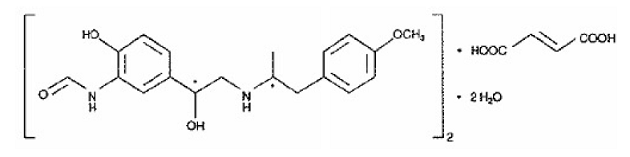
Formoterolfumaratdihydrat er et pulver, som er let opløseligt i vand. Dens oktanol-vand fordelingskoefficient ved pH 7,4 er 2,6. pKa for formoterolfumaratdihydrat ved 25°C er 7,9 for phenolgruppen og 9,2 for aminogruppen.
INDIKATIONER
Behandling af astma
SYMBICORT 4,5 mcg er indiceret til behandling af astma hos patienter på 6 år og ældre.
SYMBICORT bør anvendes til patienter, der ikke er tilstrækkeligt kontrolleret på en langvarig astmakontrolmedicin, såsom et inhaleret kortikosteroid (ICS), eller hvis sygdom berettiger indledning af behandling med både et inhaleret kortikosteroid og langtidsvirkende beta2-adrenerg agonist (LABA).
Vigtige brugsbegrænsninger
- SYMBICORT er IKKE indiceret til lindring af akut bronkospasme.
Vedligeholdelsesbehandling af kronisk obstruktiv lungesygdom
SYMBICORT 160/4.5 er indiceret til vedligeholdelsesbehandling af luftstrømsobstruktion hos patienter med kronisk obstruktiv lungesygdom (KOL) inklusive kronisk bronkitis og/eller emfysem. SYMBICORT 160/4.5 er også indiceret til at reducere eksacerbationer af KOL. SYMBICORT 160/4.5 er den eneste styrke, der er indiceret til behandling af KOL.
Vigtige brugsbegrænsninger
- SYMBICORT 4,5 mcg er IKKE indiceret til lindring af akut bronkospasme.
DOSERING OG ADMINISTRATION
Administrationsoplysninger
SYMBICORT 160mg bør administreres som 2 inhalationer to gange dagligt (morgen og aften, med ca. 12 timers mellemrum), hver dag kun ved oral inhalation. Efter inhalation skal patienten skylle munden med vand uden at synke.
Prime SYMBICORT 4,5mcg før brug første gang ved at frigive to testsprays i luften væk fra ansigtet, ryst godt i 5 sekunder før hver spray. I tilfælde, hvor inhalatoren ikke har været brugt i mere end 7 dage, eller når den er blevet tabt, primer inhalatoren igen ved at ryste godt før hver spray og frigive to testsprays i luften væk fra ansigtet.
Hyppigere administration eller et højere antal inhalationer (mere end 2 inhalationer to gange dagligt) af den foreskrevne styrke af SYMBICORT anbefales ikke, da nogle patienter er mere tilbøjelige til at opleve bivirkninger med højere doser af formoterol. Patienter, der bruger SYMBICORT, bør ikke bruge yderligere LABA af nogen grund [se ADVARSLER OG FORHOLDSREGLER ].
Astma
Hvis der opstår astmasymptomer i perioden mellem doser, bør en inhaleret, korttidsvirkende beta2-agonist tages for øjeblikkelig lindring.
Voksne og unge patienter i alderen 12 år og ældre
For patienter på 12 år og ældre er doseringen 2 inhalationer af SYMBICORT 80/4.5 eller SYMBICORT 160/4.5 to gange dagligt.
De anbefalede startdoser for SYMBICORT til patienter i alderen 12 år og ældre er baseret på patienternes sværhedsgrad af astma eller niveauet for kontrol af astmasymptomer og risiko for eksacerbationer på nuværende inhalerede kortikosteroider.
Den maksimalt anbefalede dosis til voksne og unge patienter på 12 år og ældre er SYMBICORT 160/4,5, to inhalationer to gange dagligt.
Forbedring af astmakontrol efter inhaleret administration af SYMBICORT kan forekomme inden for 15 minutter efter påbegyndelse af behandlingen, selvom maksimal fordel muligvis ikke opnås i 2 uger eller længere efter påbegyndt behandling. Individuelle patienter vil opleve en variabel tid til debut og grad af symptomlindring.
For patienter, som ikke reagerer tilstrækkeligt på startdosis efter 1-2 ugers behandling med SYMBICORT 80/4.5, kan erstatning med SYMBICORT 160/4.5 give yderligere astmakontrol.
Hvis et tidligere effektivt doseringsregime af SYMBICORT 4,5 mcg ikke giver tilstrækkelig kontrol med astma, bør det terapeutiske regime revurderes og yderligere terapeutiske muligheder, (f.eks. udskiftning af den lavere styrke af SYMBICORT 4,5 mcg med den højere styrke, tilføjelse af yderligere inhaleret kortikosteroid eller initiering af orale kortikosteroider) bør overvejes.
Pædiatriske patienter i alderen 6 til under 12 år
For patienter i alderen 6 til under 12 år er dosis 2 inhalationer af SYMBICORT 80/4,5 to gange dagligt.
Kronisk obstruktiv lungesygdom
For patienter med KOL er den anbefalede dosis SYMBICORT 160/4,5, to inhalationer to gange dagligt.
Hvis der opstår åndenød i perioden mellem doser, skal en inhaleret, korttidsvirkende beta2-agonist tages for øjeblikkelig lindring.
HVORDAN LEVERET
Doseringsformer og styrker
SYMBICORT fås som en afmålt dosisinhalator indeholdende en kombination af budesonid (80 eller 160 mcg) og formoterol (4,5 mcg) som inhalationsaerosol i følgende to styrker: 80/4,5 og 160/4,5. Hver doseringsstyrke indeholder 60 eller 120 aktiveringer pr. beholder. Hver styrke af SYMBICORT 160mg leveres med en rød plastaktuator med en grå støvhætte.
Opbevaring og håndtering
SYMBICORT fås i to styrker og leveres i følgende pakkestørrelser:
Doseringsformer og styrker
Hver styrke leveres som en trykbeholder af aluminium med en påsat tælleanordning, et rødt plastikaktuatorhus med et hvidt mundstykke og påsat grå støvhætte. Hver 120 inhalationsbeholder har en nettofyldningsvægt på 10,2 gram, og hver 60 inhalationsbeholder har en nettofyldningsvægt på 6,9 gram (SYMBICORT 80/4,5) eller 6 gram (SYMBICORT 160/4,5). Hver beholder er pakket i en foliepose med tørremiddelpose og anbragt i en karton. Hver karton indeholder en beholder og en patientinformationsfolder.
SYMBICORT 4,5mcg-beholderen bør kun bruges sammen med SYMBICORT 4,5mcg-aktuatoren, og SYMBICORT-aktuatoren bør ikke bruges sammen med andre inhalationslægemidler.
Den korrekte mængde medicin i hver inhalation kan ikke sikres, efter at det mærkede antal inhalationer fra beholderen er blevet brugt, selvom inhalatoren måske ikke føles helt tom og kan fortsætte med at fungere. Inhalatoren skal kasseres, når det mærkede antal inhalationer er blevet brugt eller inden for 3 måneder efter fjernelse fra folieposen. Nedsænk aldrig beholderen i vand for at bestemme den resterende mængde i beholderen ("flydetest").
Opbevares ved kontrolleret stuetemperatur 20°C til 25°C (68°F til 77°F) [se USP]. Opbevar inhalatoren med mundstykket nede.
For de bedste resultater skal beholderen have stuetemperatur før brug. Ryst godt i 5 sekunder før brug.
Opbevares utilgængeligt for børn. Undgå at sprøjte i øjnene.
INDHOLD UNDER TRYK.
Må ikke punkteres eller brændes. Må ikke opbevares i nærheden af varme eller åben ild. Udsættelse for temperaturer over 120°F kan forårsage sprængning. Smid aldrig beholderen i ild eller forbrændingsovn.
Fremstillet for: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850 af: AstraZeneca Dunkerque Production, Dunkerque, Frankrig. Revideret: december 2017
BIVIRKNINGER
Brug af LABA kan resultere i følgende:
- Alvorlige astma-relaterede hændelser - hospitalsindlæggelser, intubationer, død [se ADVARSLER OG FORHOLDSREGLER ].
- Kardiovaskulære og centralnervesystemets virkninger [se ADVARSLER OG FORHOLDSREGLER ].
Systemisk og inhaleret kortikosteroidbrug kan resultere i følgende:
- Candida albicans infektion [se ADVARSLER OG FORHOLDSREGLER ]
- Lungebetændelse eller nedre luftvejsinfektioner hos patienter med KOL [se ADVARSLER OG FORHOLDSREGLER ]
- Immunsuppression [se ADVARSLER OG FORHOLDSREGLER ]
- Hypercorticisme og binyrebarksuppression [se ADVARSLER OG FORHOLDSREGLER ]
- Væksteffekter hos pædiatriske patienter [se ADVARSLER OG FORHOLDSREGLER ]
- Grøn stær og grå stær [se ADVARSLER OG FORHOLDSREGLER ]
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Erfaring med kliniske forsøg ved astma
Voksne og unge patienter i alderen 12 år og ældre
De overordnede sikkerhedsdata for voksne og unge er baseret på 10 aktive og placebo-kontrollerede kliniske undersøgelser, hvor 3393 patienter i alderen 12 år og ældre (2052 kvinder og 1341 mænd) med astma af varierende sværhedsgrad blev behandlet med SYMBICORT 80/4,5 eller 160 /4,5 taget 2 inhalationer en eller to gange dagligt i 12 til 52 uger. I disse forsøg havde patienterne på SYMBICORT en gennemsnitsalder på 38 år og var overvejende kaukasiske (82%).
Hyppigheden af almindelige bivirkninger i tabel 2 nedenfor er baseret på poolede data fra tre 12-ugers, dobbeltblindede, placebokontrollerede kliniske undersøgelser, hvor 401 voksne og unge patienter (148 mænd og 253 kvinder) på 12 år og ældre blev behandlet med 2 inhalationer af SYMBICORT 80/4.5 eller SYMBICORT 160/4.5 to gange dagligt. SYMBICORT-gruppen var for det meste sammensat af kaukasiske (84%) patienter med en gennemsnitsalder på 38 år, og en gennemsnitlig procent forudsagde FEV1 ved baseline på 76 og 68 for henholdsvis 80/4,5 mcg og 160/4,5 mcg behandlingsgrupperne. Kontrolarme til sammenligning inkluderede 2 inhalationer af budesonid HFA inhalator til afmålt dosis (MDI) 80 eller 160 mcg, formoterol tørpulverinhalator (DPI) 4,5 mcg eller placebo (MDI og DPI) to gange dagligt. Tabel 2 inkluderer alle bivirkninger, der opstod med en incidens på >3 % i en SYMBICORT-gruppe og mere almindeligt end i placebogruppen med dosering to gange dagligt. Ved overvejelse af disse data bør den øgede gennemsnitlige varighed af patienteksponering for SYMBICORT-patienter tages i betragtning, da forekomsten ikke justeres for en ubalance i behandlingsvarigheden.
Langsigtet sikkerhed - Kliniske forsøg med astma hos patienter på 12 år og ældre
Langtidssikkerhedsundersøgelser hos unge og voksne patienter på 12 år og ældre, behandlet i op til 1 år med doser op til 1280/36 mikrogram/dag (640/18 mikrogram to gange dagligt), afslørede ingen af de klinisk vigtige ændringer i forekomsten heller ikke nye typer bivirkninger, der dukker op efter længere behandlingsperioder. Tilsvarende blev der ikke observeret signifikante eller uventede mønstre af abnormiteter i op til 1 år i sikkerhedsforanstaltninger, herunder kemi, hæmatologi, EKG, Holter-monitor og HPA-aksevurderinger.
Pædiatriske patienter i alderen 6 til under 12 år
Sikkerhedsdata for pædiatriske patienter i alderen 6 til under 12 år er baseret på 1 forsøg af 12 ugers behandlingsvarighed. Patienter (79 kvinder og 105 mænd), der fik inhaleret kortikosteroid ved start af forsøget, blev randomiseret til SYMBICORT 80/4,5 (n=92) eller budesonid pMDI 80 mcg (n=92), 2 inhalationer to gange dagligt. Den overordnede sikkerhedsprofil for disse patienter svarede til den, der blev observeret hos patienter på 12 år og ældre, som fik SYMBICORT 80/4,5 to gange dagligt i undersøgelser med lignende design. Almindelige bivirkninger, der forekom hos patienter behandlet med SYMBICORT 80/4,5 med en frekvens på ≥3 % og hyppigere end patienter, der kun blev behandlet med budesonid pMDI 80 mcg, omfattede øvre luftvejsinfektion, pharyngitis, hovedpine og rhinitis.
Erfaring fra kliniske forsøg med kronisk obstruktiv lungesygdom
Sikkerhedsdataene beskrevet nedenfor afspejler eksponering for SYMBICORT 160/4.5 hos 1783 patienter. SYMBICORT 160/4.5 blev undersøgt i to placebokontrollerede lungefunktionsundersøgelser (6 og 12 måneders varighed) og to aktivt kontrollerede eksacerbationsstudier (6 og 12 måneders varighed) hos patienter med KOL.
Hyppigheden af almindelige bivirkninger i tabel 3 nedenfor er baseret på poolede data fra to dobbeltblindede, placebokontrollerede lungefunktionsstudier (6 og 12 måneders varighed), hvor 771 voksne KOL-patienter (496 mænd og 275 kvinder) 40 år og ældre blev behandlet med SYMBICORT 160/4.5, to inhalationer to gange dagligt. Af disse patienter blev 651 behandlet i 6 måneder og 366 blev behandlet i 12 måneder. SYMBICORT-gruppen bestod af overvejende kaukasiske (93%) patienter med en gennemsnitsalder på 63 år, og en gennemsnitlig procent forudsagde FEV1 ved baseline på 33%. Kontrolarme til sammenligning inkluderede 2 inhalationer af budesonid HFA (MDI) 160 mcg, formoterol (DPI) 4,5 mcg eller placebo (MDI og DPI) to gange dagligt. Tabel 3 inkluderer alle bivirkninger, der opstod med en incidens på ≥3 % i SYMBICORT-gruppen og mere almindeligt end i placebogruppen. Ved overvejelse af disse data bør den øgede gennemsnitlige varighed af patienteksponering for SYMBICORT 4,5 mcg tages i betragtning, da forekomsten ikke justeres for en ubalance i behandlingsvarigheden.
Andre lungeinfektioner end lungebetændelse (for det meste bronkitis) forekom hos en større procentdel af forsøgspersoner behandlet med SYMBICORT 160/4,5 sammenlignet med placebo (henholdsvis 7,9 % vs. 5,1 %). Der var ingen klinisk vigtige eller uventede mønstre af abnormiteter observeret i op til 1 år i kemi, hæmatologi, EKG, EKG (Holter) monitorering, HPA-akse, knoglemineraltæthed og oftalmologiske vurderinger.
Sikkerhedsresultaterne fra de to dobbeltblindede, aktivt kontrollerede eksacerbationsstudier (6 og 12 måneders varighed), hvor 1012 voksne KOL-patienter (616 mænd og 396 kvinder) 40 år og ældre blev behandlet med SYMBICORT 160/4,5, to inhalationer to gange dagligt var i overensstemmelse med lungefunktionsundersøgelserne.
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af SYMBICORT efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering. Nogle af disse bivirkninger kan også være observeret i kliniske undersøgelser med SYMBICORT.
Hjertelidelser: angina pectoris, takykardi, atrielle og ventrikulære takyarytmier, atrieflimren, ekstrasystoler, hjertebanken
Endokrine lidelser: hyperkorticisme, væksthastighedsreduktion hos pædiatriske patienter
Øjenlidelser: grå stær, glaukom, øget intraokulært tryk
Gastrointestinale lidelser: orofaryngeal candidiasis, kvalme
Forstyrrelser i immunsystemet: øjeblikkelige og forsinkede overfølsomhedsreaktioner, såsom anafylaktisk reaktion, angioødem, bronkospasme, nældefeber, eksantem, dermatitis, pruritus
Metaboliske og ernæringsforstyrrelser: hyperglykæmi, hypokaliæmi
Muskuloskeletale, bindevævs- og knoglelidelser: muskelkramper
Forstyrrelser i nervesystemet: rysten, svimmelhed
Psykiatriske lidelser: adfærdsforstyrrelser, søvnforstyrrelser, nervøsitet, agitation, depression, rastløshed
Åndedræts-, thorax- og mediastinumsygdomme: dysfoni, hoste, halsirritation
Hud- og subkutane vævssygdomme: hud blå mærker
Vaskulære lidelser: hypotension, hypertension
DRUGSINTERAKTIONER
I kliniske undersøgelser har samtidig administration af SYMBICORT og andre lægemidler, såsom korttidsvirkende beta2-agonister, intranasale kortikosteroider og antihistaminer/dekongestanter, ikke resulteret i en øget hyppighed af bivirkninger. Der er ikke udført formelle lægemiddelinteraktionsstudier med SYMBICORT.
Inhibitorer af Cytokrom P4503A4
Hovedmetabolismen af kortikosteroider, inklusive budesonid, en komponent i SYMBICORT, er via cytokrom P450 (CYP) isoenzym 3A4 (CYP3A4). Efter oral administration af ketoconazol, en stærk hæmmer af CYP3A4, steg den gennemsnitlige plasmakoncentration af oralt administreret budesonid. Samtidig administration af CYP3A4 kan hæmme metabolismen af og øge den systemiske eksponering for budesonid. Der bør udvises forsigtighed, når man overvejer samtidig administration af SYMBICORT 4,5 mcg med langtidsholdbar ketoconazol og andre kendte stærke CYP3A4-hæmmere (f.eks. ritonavir, atazanavir, clarithromycin, indinavir, itraconazol, nefazodon, nelfinavir, saquinavir, teli). ADVARSLER OG FORHOLDSREGLER ].
Monoaminoxidasehæmmere og tricykliske antidepressiva
SYMBICORT bør administreres med forsigtighed til patienter, der behandles med monoaminoxidasehæmmere eller tricykliske antidepressiva, eller inden for 2 uger efter seponering af sådanne midler, fordi virkningen af formoterol, en komponent af SYMBICORT 160 mg, på det vaskulære system kan forstærkes af disse midler. . I kliniske forsøg med SYMBICORT fik et begrænset antal KOL- og astmapatienter tricykliske antidepressiva, og derfor kan der ikke drages nogen klinisk meningsfulde konklusioner om bivirkninger.
Beta-adrenerge receptorblokerende midler
Betablokkere (inklusive øjendråber) blokerer muligvis ikke kun den pulmonale virkning af beta-agonister, såsom formoterol, en komponent i SYMBICORT, men kan også forårsage alvorlig bronkospasme hos patienter med astma. Patienter med astma bør derfor normalt ikke behandles med betablokkere. Men under visse omstændigheder er der muligvis ingen acceptable alternativer til brugen af beta-adrenerge blokerende midler hos patienter med astma. I denne indstilling kan kardioselektive betablokkere overvejes, selvom de bør administreres med forsigtighed.
Diuretika
EKG-forandringer og/eller hypokaliæmi, der kan være et resultat af administration af ikke-kaliumbesparende diuretika (såsom loop- eller thiaziddiuretika) kan blive akut forværret af beta-agonister, især når den anbefalede dosis af beta-agonisten overskrides. Selvom den kliniske betydning af disse virkninger ikke er kendt, tilrådes forsigtighed ved samtidig administration af SYMBICORT og ikke-kaliumbesparende diuretika.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Alvorlige astma-relaterede hændelser – indlæggelser, intubationer og død
Brug af LABA som monoterapi (uden ICS) til astma er forbundet med en øget risiko for astma-relateret død [se Salmeterol Multicenter Asthma Research Trial (SMART)]. Tilgængelige data fra kontrollerede kliniske forsøg tyder også på, at brug af LABA som monoterapi øger risikoen for astma-relateret hospitalsindlæggelse hos pædiatriske og unge patienter. Disse resultater betragtes som en klasseeffekt af LABA. Når LABA anvendes i fast dosiskombination med ICS, viser data fra store kliniske forsøg ikke en signifikant stigning i risikoen for alvorlige astma-relaterede hændelser (indlæggelser, intubationer, død) sammenlignet med ICS alene (se Alvorlige astma-relaterede hændelser) med ICS/LABA).
Alvorlige astma-relaterede hændelser med ICS/LABA
Fire store, 26-ugers, randomiserede, blindede, aktivt kontrollerede kliniske sikkerhedsforsøg blev udført for at evaluere risikoen for alvorlige astma-relaterede hændelser, når LABA blev brugt i fast-dosis kombination med ICS sammenlignet med ICS alene hos patienter med astma. Tre forsøg omfattede voksne og unge patienter i alderen ≥12 år: et forsøg sammenlignede budesonid/formoterol (SYMBICORT) med budesonid [se Kliniske Studier ]; et forsøg sammenlignede fluticasonpropionat/salmeterol inhalationspulver med fluticasonpropionat inhalationspulver; og et forsøg sammenlignede mometasonfuroat/formoterol med mometasonfuroat. Det fjerde forsøg omfattede pædiatriske patienter i alderen 4 til 11 år og sammenlignede fluticasonpropionat/salmeterol inhalationspulver med fluticasonpropionat inhalationspulver. Det primære sikkerhedsendepunkt for alle fire undersøgelser var alvorlige astma-relaterede hændelser (indlæggelser, intubationer og død). En blindet bedømmelseskomité afgjorde, om hændelser var astma-relaterede.
De tre voksne og unge forsøg var designet til at udelukke en risikomargin på 2,0, og det pædiatriske forsøg var designet til at udelukke en risiko på 2,7. Hvert individuelt forsøg opfyldte dets forudspecificerede mål og viste, at ICS/LABA ikke var ringere end ICS alene. En meta-analyse af de tre voksne og unge forsøg viste ikke en signifikant stigning i risikoen for en alvorlig astma-relateret hændelse med ICS/LABA fast-dosis kombination sammenlignet med ICS alene (tabel 1). Disse forsøg var ikke designet til at udelukke al risiko for alvorlige astma-relaterede hændelser med ICS/LABA sammenlignet med ICS.
Det pædiatriske sikkerhedsforsøg omfattede 6208 pædiatriske patienter i alderen 4 til 11 år, som fik ICS/LABA (fluticasonpropionat/salmeterol inhalationspulver) eller ICS (fluticasonpropionat inhalationspulver). I dette forsøg oplevede 27/3107 (0,9 %) patienter randomiseret til ICS/LABA og 21/3101 (0,7 %) patienter randomiseret til ICS en alvorlig astma-relateret hændelse. Der var ingen astma-relaterede dødsfald eller intubationer. ICS/LABA viste ikke en signifikant øget risiko for en alvorlig astma-relateret hændelse sammenlignet med ICS baseret på den forudspecificerede risikomargen (2,7), med et estimeret hazard ratio for tid til første hændelse på 1,29 (95 % CI: 0,73) 2,27).
Salmeterol Multicenter Astma Research Trial (SMART)
Et 28-ugers, placebo-kontrolleret amerikansk forsøg, der sammenlignede sikkerheden af salmeterol med placebo, hver tilføjet til sædvanlig astmabehandling, viste en stigning i astma-relaterede dødsfald hos patienter, der fik salmeterol (13/13.176 hos patienter behandlet med salmeterol vs. 3) /13.179 hos patienter behandlet med placebo; relativ risiko: 4,37 [95 % CI 1,25, 15,34]). Brug af baggrunds-ICS var ikke påkrævet i SMART. Den øgede risiko for astma-relateret død betragtes som en klasseeffekt af LABA monoterapi.
Formoterol monoterapi undersøgelser
Kliniske undersøgelser med formoterol anvendt som monoterapi antydede en højere forekomst af alvorlig astmaforværring hos patienter, der fik formoterol, end hos dem, der fik placebo. Størrelsen af disse undersøgelser var ikke tilstrækkelige til præcist at kvantificere forskellen i alvorlige astma-eksacerbationer mellem behandlingsgrupper.
Forværring af sygdom og akutte episoder
SYMBICORT 4,5 mcg bør ikke initieres hos patienter under hurtigt forværrede eller potentielt livstruende episoder med astma eller KOL. SYMBICORT er ikke blevet undersøgt hos patienter med akut forværret astma eller KOL. Starten af SYMBICORT 4,5mcg i denne indstilling er ikke passende.
Stigende brug af inhalerede, korttidsvirkende beta2-agonister er en markør for forværret astma. I denne situation kræver patienten øjeblikkelig re-evaluering med revurdering af behandlingsregimet, idet der tages særligt hensyn til det mulige behov for at erstatte den nuværende styrke af SYMBICORT med en højere styrke, tilføje yderligere inhaleret kortikosteroid eller påbegynde systemiske kortikosteroider. Patienter bør ikke bruge mere end 2 inhalationer to gange dagligt (morgen og aften) af SYMBICORT.
SYMBICORT 160mg bør ikke anvendes til lindring af akutte symptomer, dvs. som redningsterapi til behandling af akutte episoder med bronkospasme. En inhaleret, korttidsvirkende beta2-agonist, ikke SYMBICORT, bør anvendes til at lindre akutte symptomer såsom åndenød.
Når behandlingen påbegyndes med SYMBICORT 4,5 mcg, skal patienter, der har taget orale eller inhalerede, korttidsvirkende beta2-agonister på regelmæssig basis (f.eks. 4 gange dagligt), instrueres i at afbryde den regelmæssige brug af disse lægemidler.
Overdreven brug af SYMBICORT 4,5 mcg og brug sammen med andre langtidsvirkende beta2-agonister
Som med andre inhalerede lægemidler, der indeholder beta2-adrenerge midler, bør SYMBICORT 4,5 mcg ikke anvendes oftere end anbefalet, i højere doser end anbefalet eller sammen med anden medicin, der indeholder LABA, da en overdosis kan resultere. Klinisk signifikante kardiovaskulære effekter og dødsfald er blevet rapporteret i forbindelse med overdreven brug af inhalerede sympatomimetika. Patienter, der bruger SYMBICORT, bør ikke bruge en yderligere LABA (f.eks. salmeterol, formoterolfumarat, arformoteroltartrat) af nogen grund, herunder forebyggelse af anstrengelsesinduceret bronkospasme (EIB) eller behandling af astma eller KOL.
Lokale effekter
kliniske undersøgelser er udviklingen af lokaliserede infektioner i munden og svælget med Candida albicans forekommet hos patienter behandlet med SYMBICORT. Når en sådan infektion udvikler sig, skal den behandles med passende lokal eller systemisk (dvs. oral antifungal) behandling, mens behandlingen med SYMBICORT 160mg fortsætter, men til tider kan det være nødvendigt at afbryde behandlingen med SYMBICORT 4,5mcg. Råd patienten til at skylle munden med vand uden at synke efter inhalation for at reducere risikoen for oropharyngeal candidiasis.
Lungebetændelse og andre nedre luftvejsinfektioner
Læger bør forblive på vagt over for mulig udvikling af lungebetændelse hos patienter med KOL, da de kliniske træk ved lungebetændelse og eksacerbationer ofte overlapper hinanden. Nedre luftvejsinfektioner, herunder lungebetændelse, er blevet rapporteret efter inhaleret administration af kortikosteroider.
et 6-måneders lungefunktionsstudie af 1704 patienter med KOL var der en højere forekomst af andre lungeinfektioner end lungebetændelse (f.eks. bronkitis, virale nedre luftvejsinfektioner osv.) hos patienter, der fik SYMBICORT 160/4,5 (7,6 %) end hos dem, der fik SYMBICORT 80/4,5 (3,2 %), formoterol 4,5 mcg (4,6 %) eller placebo (3,3 %). Lungebetændelse forekom ikke med større forekomst i SYMBICORT 160/4,5-gruppen (1,1 %) sammenlignet med placebo (1,3 %). I en 12-måneders lungefunktionsundersøgelse af 1964 patienter med KOL var der også en højere forekomst af andre lungeinfektioner end lungebetændelse hos patienter, der fik SYMBICORT 160/4,5 (8,1 %) end hos dem, der fik SYMBICORT 80/4,5 (6,9 %). formoterol 4,5 mcg (7,1 %) eller placebo (6,2 %). I lighed med 6-måneders studiet forekom lungebetændelse ikke med større forekomst i SYMBICORT 160/4,5-gruppen (4,0 %) sammenlignet med placebo (5,0 %).
Immunsuppression
Patienter, der er på medicin, der undertrykker immunsystemet, er mere modtagelige for infektion end raske personer. Skoldkopper og mæslinger kan for eksempel have et mere alvorligt eller endda dødeligt forløb hos modtagelige børn eller voksne, der bruger kortikosteroider. Hos sådanne børn eller voksne, som ikke har haft disse sygdomme eller er blevet ordentligt immuniseret, skal der udvises særlig forsigtighed for at undgå eksponering. Hvordan dosis, vej og varighed af kortikosteroidadministration påvirker risikoen for at udvikle en spredt infektion vides ikke. Bidraget fra den underliggende sygdom og/eller tidligere kortikosteroidbehandling til risikoen er heller ikke kendt. Hvis eksponeret, kan behandling med varicella zoster immunglobulin (VZIG) eller poolet intravenøst immunglobulin (IVIG), alt efter hvad der er relevant, være indiceret. Hvis de udsættes for mæslinger, kan profylakse med poolet intramuskulært immunglobulin (IG) være indiceret (se de respektive indlægssedler for fuldstændig VZIG- og IG-ordinationsinformation). Hvis der udvikles skoldkopper, kan behandling med antivirale midler overvejes. Immunresponsen over for skoldkoppevaccine blev evalueret hos pædiatriske patienter med astma i alderen 12 måneder til 8 år med budesonid-inhalationssuspension.
Et åbent, ikke-randomiseret klinisk studie undersøgte immunresponsen over for skoldkoppevaccine hos 243 astmapatienter i alderen 12 måneder til 8 år, som blev behandlet med budesonid inhalationssuspension 0,25 mg til 1 mg dagligt (n=151) eller noncorticosteroid astmabehandling (n) =92) (dvs. beta2-agonister, leukotrienreceptorantagonister, cromoner). Procentdelen af patienter, der udviklede en seroprotektiv antistoftiter på >5,0 (gpELISA-værdi) som respons på vaccinationen, var ens hos patienter behandlet med budesonid-inhalationssuspension (85 %) sammenlignet med patienter behandlet med noncorticosteroid astmabehandling (90 %). Ingen patient behandlet med budesonid-inhalationssuspension udviklede skoldkopper som følge af vaccination.
Inhalerede kortikosteroider bør anvendes med forsigtighed, hvis overhovedet, til patienter med aktive eller hvilende tuberkuloseinfektioner i luftvejene; ubehandlede systemiske svampe-, bakterie-, virus- eller parasitinfektioner; eller okulær herpes simplex.
Overførsel af patienter fra systemisk kortikosteroidterapi
Særlig forsigtighed er nødvendig for patienter, der er blevet overført fra systemisk aktive kortikosteroider til inhalerede kortikosteroider, fordi dødsfald på grund af binyrebarkinsufficiens er forekommet hos patienter med astma under og efter overgang fra systemiske kortikosteroider til mindre systemisk tilgængelige inhalationskortikosteroider. Efter seponering fra systemiske kortikosteroider kræves der et antal måneder til genopretning af hypothalamus-hypofyse-binyrefunktionen (HPA).
Patienter, der tidligere er blevet holdt på 20 mg eller mere pr. dag af prednison (eller tilsvarende), kan være mest modtagelige, især når deres systemiske kortikosteroider er blevet næsten fuldstændigt seponeret. I denne periode med HPA-undertrykkelse kan patienter udvise tegn og symptomer på binyrebarkinsufficiens, når de udsættes for traumer, kirurgi eller infektion (især gastroenteritis) eller andre tilstande forbundet med alvorligt elektrolyttab. Selvom SYMBICORT kan give kontrol over astmasymptomer under disse episoder, tilfører det i anbefalede doser mindre end normale fysiologiske mængder af glukokortikoid systemisk og giver IKKE den mineralokortikoid aktivitet, der er nødvendig for at klare disse nødsituationer.
perioder med stress, et alvorligt astmaanfald eller en alvorlig KOL-eksacerbation bør patienter, der er blevet seponeret fra systemiske kortikosteroider, instrueres i at genoptage orale kortikosteroider (i store doser) straks og kontakte deres læge for yderligere instruktion. Disse patienter bør også instrueres i at bære et advarselskort, der angiver, at de kan have behov for supplerende systemiske kortikosteroider i perioder med stress, et alvorligt astmaanfald eller en alvorlig KOL-eksacerbation.
Patienter, der har behov for orale kortikosteroider, bør vænnes langsomt fra systemisk kortikosteroidbrug efter overgang til SYMBICORT. Prednisonreduktion kan opnås ved at reducere den daglige prednisondosis med 2,5 mg på en ugentlig basis under behandling med SYMBICORT. Lungefunktion (gennemsnitlig forceret eksspiratorisk volumen på 1 sekund [FEV1] eller morgen peak ekspiratorisk flow [PEF]), brug af beta-agonist og astma- eller KOL-symptomer bør overvåges nøje under seponering af orale kortikosteroider. Derudover skal patienter observeres for tegn og symptomer på binyrebarkinsufficiens, såsom træthed, træthed, svaghed, kvalme og opkastning samt hypotension.
Overførsel af patienter fra systemisk kortikosteroidbehandling til inhalerede kortikosteroider eller SYMBICORT kan afsløre tilstande, der tidligere er undertrykt af den systemiske kortikosteroidbehandling (f.eks. rhinitis, conjunctivitis, eksem, arthritis, eosinofile tilstande). Nogle patienter kan opleve symptomer på systemisk aktiv kortikosteroidabstinens (f.eks. led- og/eller muskelsmerter, træthed, depression) på trods af vedligeholdelse eller endog forbedring af åndedrætsfunktionen.
Hyperkorticisme og binyrebarksuppression
Budesonid, en komponent i SYMBICORT, vil ofte hjælpe med at kontrollere astma- og KOL-symptomer med mindre undertrykkelse af HPA-funktionen end terapeutisk ækvivalente orale doser af prednison. Da budesonid absorberes i kredsløbet og kan være systemisk aktivt ved højere doser, kan de gavnlige virkninger af SYMBICORT til at minimere HPA-dysfunktion kun forventes, når anbefalede doser ikke overskrides, og individuelle patienter titreres til den laveste effektive dosis.
På grund af muligheden for systemisk absorption af inhalerede kortikosteroider, bør patienter, der behandles med SYMBICORT 160 mg, observeres omhyggeligt for tegn på systemiske kortikosteroideffekter. Der bør udvises særlig forsigtighed ved at observere patienter postoperativt eller i perioder med stress for tegn på utilstrækkelig binyrerespons.
Det er muligt, at systemiske kortikosteroideffekter såsom hyperkorticisme og binyrebarksuppression (inklusive binyrebarkkrise) kan forekomme hos et lille antal patienter, især når budesonid administreres i højere doser end anbefalet over længere perioder. Hvis sådanne effekter opstår, bør dosis af SYMBICORT reduceres langsomt, i overensstemmelse med accepterede procedurer til reduktion af systemiske kortikosteroider og til behandling af astmasymptomer.
Lægemiddelinteraktioner med stærke cytokrom P450 3A4-hæmmere
Der bør udvises forsigtighed, når man overvejer samtidig administration af SYMBICORT 4,5 mcg med ketoconazol og andre kendte stærke CYP3A4-hæmmere (f.eks. ritonavir, atazanavir, clarithromycin, indinavir, itraconazol, nefazodon, nelfinavir, saquinavir, saquinavir-effekt relateret til, øget systemisk eksponering relateret til telithromycin) til budesonid kan forekomme [se DRUGSINTERAKTIONER og KLINISK FARMAKOLOGI ].
Paradoksal bronkospasme og øvre luftvejssymptomer
Som med anden inhalationsmedicin kan SYMBICORT 160mg producere paradoksal bronkospasme, som kan være livstruende. Hvis der opstår paradoksal bronkospasme efter dosering med SYMBICORT 160mg, skal den behandles med det samme med en inhaleret, korttidsvirkende bronkodilatator, SYMBICORT bør seponeres med det samme, og alternativ behandling bør iværksættes.
Øjeblikkelige overfølsomhedsreaktioner
Umiddelbare overfølsomhedsreaktioner kan forekomme efter administration af SYMBICORT 160 mg, som vist ved tilfælde af nældefeber, angioødem, udslæt og bronkospasme.
Kardiovaskulære og centralnervesystemets effekter
Overdreven beta-adrenerg stimulering er blevet forbundet med kramper, angina, hypertension eller hypotension, takykardi med hastigheder på op til 200 slag/min, arytmier, nervøsitet, hovedpine, tremor, hjertebanken, kvalme, svimmelhed, træthed, utilpashed og søvnløshed [se OVERDOSERING ]. Derfor bør SYMBICORT 160mg, ligesom alle produkter, der indeholder sympatomimetiske aminer, anvendes med forsigtighed til patienter med kardiovaskulære lidelser, især koronar insufficiens, hjertearytmier og hypertension.
Formoterol, en komponent i SYMBICORT, kan give en klinisk signifikant kardiovaskulær effekt hos nogle patienter målt ved puls, blodtryk og/eller symptomer. Selvom sådanne virkninger er ualmindelige efter administration af formoterol i anbefalede doser, kan det være nødvendigt at seponere lægemidlet, hvis de opstår. Derudover er beta-agonister blevet rapporteret at producere EKG-ændringer, såsom udfladning af T-bølgen, forlængelse af QTc-intervallet og ST-segmentdepression. Den kliniske betydning af disse fund er ukendt. Dødsfald er blevet rapporteret i forbindelse med overdreven brug af inhalerede sympatomimetika.
Reduktion i knoglemineraltæthed
Fald i knoglemineraltæthed (BMD) er blevet observeret ved langvarig administration af produkter, der indeholder inhalerede kortikosteroider. Den kliniske betydning af små ændringer i BMD med hensyn til langsigtede konsekvenser såsom fraktur er ukendt. Patienter med væsentlige risikofaktorer for nedsat knoglemineralindhold, såsom langvarig immobilisering, familiehistorie med osteoporose, postmenopausal status, tobaksbrug, fremskreden alder, dårlig ernæring eller kronisk brug af lægemidler, der kan reducere knoglemasse (f.eks. antikonvulsiva, orale kortikosteroider ) bør overvåges og behandles med etablerede standarder for pleje. Da patienter med KOL ofte har flere risikofaktorer for nedsat BMD, anbefales vurdering af BMD før påbegyndelse af SYMBICORT 160 mg og periodisk derefter. Hvis der ses betydelige reduktioner i BMD, og SYMBICORT stadig anses for medicinsk vigtig for den pågældende patients KOL-behandling, bør brug af medicin til at behandle eller forebygge osteoporose kraftigt overvejes.
Effekter af behandling med SYMBICORT 160/4,5, SYMBICORT 80/4,5, formoterol 4,5 mcg eller placebo på BMD blev evalueret i en undergruppe af 326 patienter (kvindelige og mænd i alderen 41 til 88 år) med KOL i 12-måneders lungefunktion undersøgelse. BMD-evalueringer af hofte- og lændehvirvelsøjlen blev udført ved baseline og 52 uger ved hjælp af dobbeltenergi røntgenabsorptiometri (DEXA) scanninger. Gennemsnitlige ændringer i BMD fra baseline til afslutning af behandlingen var små (gennemsnitlige ændringer varierede fra -0,01 -0,01 g/cm²). ANCOVA-resultater for total rygsøjle og total hofte-BMD baseret på slutningen af behandlingstidspunktet viste, at alle geometriske LS-middelforhold for de parvise behandlingsgruppesammenligninger var tæt på 1, hvilket indikerer, at samlet set BMD for total hofte- og rygsøjleregioner for de 12 -måneders tidspunkt var stabile over hele behandlingsperioden.
Effekt på vækst
Oralt inhalerede kortikosteroider kan forårsage en reduktion i væksthastigheden, når de administreres til pædiatriske patienter. Overvåg væksten af pædiatriske patienter, der modtager SYMBICORT rutinemæssigt (f.eks. via stadiometri). For at minimere de systemiske virkninger af oralt inhalerede kortikosteroider, inklusive SYMBICORT, titreres hver patients dosis til den laveste dosis, der effektivt kontrollerer hans/hendes symptomer [se DOSERING OG ADMINISTRATION og Brug i specifikke populationer ].
Grøn stær og grå stær
Grøn stær, øget intraokulært tryk og grå stær er blevet rapporteret hos patienter med astma og KOL efter langvarig administration af inhalerede kortikosteroider, inklusive budesonid, en komponent i SYMBICORT. Derfor er tæt overvågning berettiget hos patienter med en ændring i synet eller med forhøjet intraokulært tryk, glaukom og/eller grå stær.
Effekter af behandling med SYMBICORT 160/4,5, SYMBICORT 80/4,5, formoterol 4,5 mcg eller placebo på udvikling af grå stær eller glaukom blev evalueret i en undergruppe af 461 patienter med KOL i 12-måneders lungefunktionsundersøgelsen. Oftalmiske undersøgelser blev udført ved baseline, 24 uger og 52 uger. Der var 26 forsøgspersoner (6%) med en stigning i posterior subkapsulær score fra baseline til maksimal værdi (>0,7) i løbet af den randomiserede behandlingsperiode. Ændringer i posterior subkapsulære score på >0,7 fra baseline til behandlingsmaksimum forekom hos 11 patienter (9,0 %) i SYMBICORT 160/4,5-gruppen, 4 patienter (3,8 %) i SYMBICORT 80/4,5-gruppen, 5 patienter (4,2 %) i formoterolgruppen og 6 patienter (5,2%) i placebogruppen.
Eosinofile tilstande og Churg-Strauss syndrom
sjældne tilfælde kan patienter på inhalerede kortikosteroider have systemiske eosinofile tilstande. Nogle af disse patienter har kliniske træk ved vaskulitis i overensstemmelse med Churg-Strauss syndrom, en tilstand, der ofte behandles med systemisk kortikosteroidbehandling. Disse hændelser har normalt, men ikke altid, været forbundet med reduktion og/eller seponering af oral kortikosteroidbehandling efter introduktion af inhalerede kortikosteroider. Læger bør være opmærksomme på eosinofili, vaskulitisk udslæt, forværrede lungesymptomer, hjertekomplikationer og/eller neuropati hos deres patienter. En årsagssammenhæng mellem budesonid og disse underliggende tilstande er ikke blevet fastlagt.
Sameksisterende forhold
SYMBICORT 4,5 mcg bør, som alle andre lægemidler, der indeholder sympatomimetiske aminer, anvendes med forsigtighed til patienter med krampesygdomme eller thyrotoksikose og til dem, der er usædvanligt reagerende på sympatomimetiske aminer. Doser af den relaterede beta2-adrenoceptoragonist albuterol er, når de administreres intravenøst, blevet rapporteret at forværre allerede eksisterende diabetes mellitus og ketoacidose.
Hypokaliæmi og hyperglykæmi
Beta-adrenerge agonister kan forårsage betydelig hypokaliæmi hos nogle patienter, muligvis gennem intracellulær shunting, som har potentiale til at forårsage uønskede kardiovaskulære virkninger [se KLINISK FARMAKOLOGI ]. Faldet i serumkalium er normalt forbigående og kræver ikke tilskud. Klinisk signifikante ændringer i blodglukose og/eller serumkalium blev sjældent set under kliniske undersøgelser med SYMBICORT i anbefalede doser.
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( PATIENTINFORMATION og brugsanvisning ).
Alvorlige astma-relaterede hændelser
Informer patienter med astma om, at LABA, når det bruges alene, øger risikoen for astma-relateret hospitalsindlæggelse eller astma-relateret død. Tilgængelige data viser, at når ICS og LABA bruges sammen, såsom med SYMBICORT, er der ikke en signifikant stigning i risikoen for disse hændelser.
Ikke til akutte symptomer
Informer patienterne om, at SYMBICORT 160mg ikke er beregnet til at lindre akutte symptomer på astma eller KOL, og at ekstra doser ikke bør anvendes til dette formål. Råd til patienter om at behandle akutte symptomer med en inhaleret, korttidsvirkende beta2-agonist såsom albuterol. Giv patienterne sådan medicin og instruer patienten i, hvordan den skal bruges.
Instruer patienterne i at søge lægehjælp med det samme, hvis de oplever noget af følgende:
- Faldende effektivitet af inhalerede, korttidsvirkende beta2-agonister
- Behov for flere inhalationer end normalt af inhalerede, korttidsvirkende beta2-agonister
- Betydeligt fald i lungefunktionen som skitseret af lægen
Fortæl patienterne, at de ikke bør stoppe behandlingen med SYMBICORT uden vejledning fra lægen/leverandøren, da symptomerne kan opstå igen efter seponering.
Brug ikke yderligere langtidsvirkende beta2-agonister
Instruer patienterne i ikke at bruge anden LABA til astma og KOL.
Lokale effekter
Informer patienterne om, at lokaliserede infektioner med Candida albicans forekom i munden og svælget hos nogle patienter. Hvis oropharyngeal candidiasis udvikler sig, skal den behandles med passende lokal eller systemisk (dvs. oral) antifungal behandling, mens behandlingen med SYMBICORT 4,5 mcg fortsættes, men til tider kan det være nødvendigt at afbryde behandling med SYMBICORT midlertidigt under tæt medicinsk overvågning. Det anbefales at skylle munden med vand uden at synke efter indånding for at reducere risikoen for trøske.
Lungebetændelse
Patienter med KOL har en højere risiko for lungebetændelse; instruere dem i at kontakte deres læge, hvis de udvikler symptomer på lungebetændelse.
Immunsuppression
Advar patienter, der er på immunsuppressive doser af kortikosteroider, for at undgå eksponering for skoldkopper eller mæslinger og, hvis de bliver udsat, om at konsultere deres læge uden forsinkelse. Informer patienter om potentiel forværring af eksisterende tuberkulose, svampe-, bakterie-, virus- eller parasitinfektioner eller okulær herpes simplex.
Hyperkorticisme og binyrebarksuppression
Rådfør patienterne om, at SYMBICORT kan forårsage systemiske kortikosteroidvirkninger af hyperkorticisme og binyrebarksuppression. Informer desuden patienterne om, at dødsfald på grund af binyrebarkinsufficiens er opstået under og efter overførsel fra systemiske kortikosteroider. Patienter bør langsomt nedtrappe fra systemiske kortikosteroider, hvis de skifter til SYMBICORT.
Reduktion i knoglemineraltæthed
Rådgiv patienter, der har en øget risiko for nedsat BMD, at brugen af kortikosteroider kan udgøre en yderligere risiko.
Reduceret væksthastighed
Informer patienterne om, at oralt inhalerede kortikosteroider, en komponent i SYMBICORT, kan forårsage en reduktion i væksthastigheden, når de administreres til pædiatriske patienter. Læger bør nøje følge væksten hos børn og unge, der tager kortikosteroider, uanset vej.
Øjeneffekter
Langvarig brug af inhalerede kortikosteroider kan øge risikoen for nogle øjenproblemer (grå stær eller glaukom); overveje regelmæssige øjenundersøgelser.
Risici forbundet med beta-agonistterapi
Informer patienterne om bivirkninger forbundet med beta2-agonister, såsom hjertebanken, brystsmerter, hurtig puls, tremor eller nervøsitet.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Budesonid
Langtidsundersøgelser blev udført på rotter og mus ved brug af oral administration for at evaluere det karcinogene potentiale af budesonid.
et 2-årigt studie med Sprague-Dawley-rotter forårsagede budesonid en statistisk signifikant stigning i forekomsten af gliomer hos hanrotter ved en oral dosis på 50 mcg/kg (ca. svarende til MRHDID hos voksne og børn på en mcg/m²) basis). Ingen tumorigenicitet blev set hos han- og hunrotter ved respektive orale doser op til 25 og 50 mcg/kg (ca. svarende til MRHDID hos voksne og børn på en mcg/m²-basis). I yderligere to 2-årige undersøgelser med Fischer- og Sprague-Dawley-hanrotter forårsagede budesonid ingen gliomer ved en oral dosis på 50 mcg/kg (ca. svarende til MRHDID hos voksne og børn på en mcg/m²-basis). Hos Sprague-Dawley hanrotter forårsagede budesonid imidlertid en statistisk signifikant stigning i forekomsten af hepatocellulære tumorer ved en oral dosis på 50 mcg/kg (ca. svarende til MRHDID hos voksne og børn på en mcg/m² basis). De samtidige referencekortikosteroider (prednisolon og triamcinolonacetonid) i disse to undersøgelser viste lignende resultater.
et 91-ugers studie med mus forårsagede budesonid ingen behandlingsrelateret karcinogenicitet ved orale doser op til 200 mcg/kg (ca. 2 gange MRHDID hos voksne og børn på en mcg/m² basis).
Budesonid var ikke mutagent eller klastogent i seks forskellige testsystemer: Ames Salmonella/mikrosompladetest, mikronukleustest hos mus, lymfomtest hos mus, kromosomafvigelsestest i humane lymfocytter, kønsbundet recessiv letal test i Drosophila melanogaster og DNA-reparationsanalyse hos rotter hepatocytkultur.
Fertilitet og reproduktionsevne var upåvirket hos rotter ved subkutane doser op til 80 mcg/kg (ca. lig med MRHDID på en mcg/m²-basis). Det forårsagede dog et fald i prænatal levedygtighed og levedygtighed hos ungerne ved fødslen og under diegivning sammen med et fald i moderens kropsvægtforøgelse ved subkutane doser på 20 mcg/kg og derover (mindre end MRHDID på en mcg/m² basis ). Ingen sådanne effekter blev noteret ved 5 mcg/kg (mindre end MRHDID på en mcg/m² basis).
Formoterol
Langtidsundersøgelser blev udført på mus, der anvendte oral administration, og rotter, der anvendte inhalationsadministration for at evaluere det karcinogene potentiale af formoterolfumarat.
I et 24-måneders karcinogenicitetsstudie i CD-1-mus forårsagede formoterol ved orale doser på 100 mcg/kg og derover (ca. 30 og 15 gange MRHDID hos henholdsvis voksne og børn på mcg/m²-basis) en dosis- relateret stigning i forekomsten af uterine leiomyomer.
I et 24-måneders carcinogenicitetsstudie i Sprague-Dawley-rotter blev der observeret en øget forekomst af mesovarian leiomyom og uterin leiomyosarcom ved den inhalerede dosis på 130 mcg/kg (ca. 70 og 35 gange MRHDID hos voksne og børn, hhv. mcg/m² basis). Ingen tumorer blev set ved 22 mcg/kg (ca. 12 og 6 gange MRHDID hos henholdsvis voksne og børn på en mcg/m²-basis).
Andre beta-agonister har tilsvarende vist stigninger i leiomyomer i kønsorganerne hos hungnavere. Relevansen af disse fund for menneskelig brug er ukendt.
Formoterol var ikke mutagent eller klastogent i Ames Salmonella/mikrosompladetest, muselymfomtest, kromosomafvigelsestest i humane lymfocytter og rottemikronukleustest.
En reduktion i fertilitet og/eller reproduktionsevne blev identificeret hos hanrotter behandlet med formoterol ved en oral dosis på 15.000 mcg/kg (ca. 2200 gange MRHDID på AUC-basis). Ingen sådan effekt blev set ved 3000 mcg/kg (ca. 1600 gange MRHDID på en mcg/m²-basis). I en separat undersøgelse med hanrotter behandlet med en oral dosis på 15.000 mcg/kg (ca. 8000 gange MRHDID på en mcg/m²-basis), var der fund af testikeltubulær atrofi og sædceller i testiklerne og oligospermi i epididymiderne. Der blev ikke påvist nogen effekt på fertiliteten hos hunrotter ved doser op til 15.000 mcg/kg (ca. 1100 gange MRHDID på AUC-basis).
Brug i specifikke populationer
Graviditet
Risikooversigt
Der er ingen tilstrækkelige og velkontrollerede undersøgelser af SYMBICORT 160mg eller en af dets individuelle komponenter, formoterolfumarat, hos gravide kvinder; der er dog tilgængelige undersøgelser for den anden komponent budesonid. I reproduktionsstudier på dyr var SYMBICORT 4,5 mcg, administreret ad inhalationsvejen, teratogent, embryocidal og reduceret fostervægt hos rotter ved mindre end den maksimalt anbefalede humane daglige inhalationsdosis (MRHDID) på mcg/m²-basis. Budesonid alene, indgivet ad subkutan vej, var teratogent, embryocidal og reducerede fostervægten hos rotter og kaniner ved mindre end MRHDID, men disse effekter blev ikke set hos rotter, der fik inhalerede doser op til 4 gange MRHDID. Undersøgelser af gravide kvinder har ikke vist, at inhaleret budesonid alene øger risikoen for abnormiteter, når det administreres under graviditet. Erfaring med orale kortikosteroider tyder på, at gnavere er mere tilbøjelige til teratogene virkninger af kortikosteroideksponering end mennesker. Formoterolfumarat alene, administreret ad oral vej, var teratogent hos rotter og kaniner ved henholdsvis 1600 og 65.000 gange MRHDID. Formoterolfumarat var også embryodræbende, øgede ungernes tab ved fødslen og under diegivning og nedsatte ungernes vægt hos rotter ved 110 gange MRHDID. Disse bivirkninger optrådte generelt ved store multipler af MRHDID, når formoterolfumarat blev administreret ad oral vej for at opnå høje systemiske eksponeringer. Der blev ikke set teratogene, embryocidale eller udviklingsmæssige virkninger hos rotter, der modtog inhalationsdoser op til 375 gange MRHDID.
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort hos de angivne populationer er ukendt. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 % til 4 % og 15 % til 20 %.
Kliniske overvejelser
Sygdomsassocieret moder- og/eller embryo-/fosterrisiko
Hos kvinder med dårligt eller moderat kontrolleret astma er der en øget risiko for adskillige perinatale uønskede udfald, såsom præeklampsi hos moderen og præmaturitet, lav fødselsvægt og lille for svangerskabsalderen hos den nyfødte. Gravide kvinder med astma bør overvåges nøje, og medicinen skal justeres efter behov for at opretholde optimal astmakontrol.
Arbejde eller levering
Der er ingen velkontrollerede humane undersøgelser, der har undersøgt virkningerne af SYMBICORT 4,5mcg under fødslen og fødslen. På grund af muligheden for beta-agonistinterferens med uterus kontraktilitet, bør brugen af SYMBICORT 4,5 mcg under fødslen begrænses til de patienter, hvor fordelene klart opvejer risikoen.
Data
Menneskelige data
Undersøgelser af gravide kvinder har ikke vist, at inhaleret budesonid øger risikoen for abnormiteter, når det administreres under graviditet. Resultaterne fra en stor befolkningsbaseret prospektiv kohorte epidemiologisk undersøgelse, der gennemgår data fra tre svenske registre, der dækker ca. 99 % af graviditeterne fra 1995-1997 (dvs. det svenske medicinske fødselsregister; register over medfødte misdannelser; børnekardiologisk register) indikerer ingen øget risiko for medfødte misdannelser ved brug af inhaleret budesonid under tidlig graviditet. Medfødte misdannelser blev undersøgt i 2014 spædbørn født af mødre, der rapporterede brugen af inhaleret budesonid til astma tidligt i graviditeten (sædvanligvis 10-12 uger efter den sidste menstruation), den periode, hvor de fleste større organmisdannelser forekommer. Hyppigheden af registrerede medfødte misdannelser var ens sammenlignet med den generelle befolkningsrate (henholdsvis 3,8 % vs. 3,5 %). Efter eksponering for inhaleret budesonid svarede antallet af spædbørn født med orofaciale kløfter desuden til det forventede antal i normalpopulationen (henholdsvis 4 børn vs. 3,3).
De samme data blev brugt i en anden undersøgelse, der bringer det samlede antal til 2534 spædbørn, hvis mødre blev udsat for inhaleret budesonid. I denne undersøgelse var frekvensen af medfødte misdannelser blandt spædbørn, hvis mødre blev udsat for inhaleret budesonid under tidlig graviditet, ikke forskellig fra frekvensen for alle nyfødte babyer i samme periode (3,6 %).
Dyredata
SYMBICORT
I et embryo-føtalt udviklingsstudie hos drægtige rotter doseret i organogeneseperioden fra drægtighedsdage 6-16, producerede SYMBICORT 160 mg navlebrok hos fostre ved doser mindre end MRHDID (på en mcg/m² basis ved moder inhalerede doser på 12/ 0,66 mcg/kg/dag og derover). Fostervægten blev reduceret med henholdsvis ca. 5 og 3 gange MRHDID (på AUC-basis ved en inhalationsdosis til moderen på 80/4,4 mcg/kg (budesonid/formoterol)). Ingen teratogene eller embryocidale virkninger blev påvist ved doser mindre end MRHDID (på en mcg/m²-basis ved en inhalationsdosis på 2,5/0,14 mcg/kg/dag hos moderen).
Budesonid
en fertilitets- og reproduktionsundersøgelse blev hanrotter doseret subkutant i 9 uger og hunner i 2 uger før parring og i hele parringsperioden. Hunnerne blev doseret indtil fravænning af deres afkom. Budesonid forårsagede et fald i prænatal levedygtighed og levedygtighed hos ungerne ved fødslen og under diegivning sammen med et fald i moderens kropsvægtforøgelse ved doser mindre end MRHDID (på en mcg/m² basis ved maternal subkutane doser på 20 mcg/ kg/dag og derover). Ingen sådanne virkninger blev observeret ved en dosis mindre end MRHDID (på en mcg/m² basis ved en maternel subkutan dosis på 5 mcg/kg/dag).
et embryo-føtalt udviklingsstudie hos drægtige kaniner doseret i løbet af organogeneseperioden fra drægtighedsdage 6-18 producerede budesonid fostertab, nedsat fostervægt og skeletabnormiteter ved doser mindre end MRHDID (på en mcg/m²-basis ved en maternal subkutan dosis på 25 mcg/kg/dag). I et embryo-føtalt udviklingsstudie hos drægtige rotter doseret i organogeneseperioden fra drægtighedsdage 6-15 frembragte budesonid lignende uønskede fostervirkninger ved doser ca. 8 gange MRHDID (på en mcg/m²-basis ved en maternal subkutan dosis på 500 mcg/kg/dag). I et andet embryo-føtal udviklingsstudie hos gravide rotter blev der ikke set teratogene eller embryocidale virkninger ved doser op til 4 gange MRHDID (på mcg/m² basis ved inhalationsdoser op til 250 mcg/kg/dag hos moderen).
et peri- og postnatalt udviklingsstudie, hvor rotter doseret fra drægtighedsdag 15 til postpartum dag 21, havde budesonid ingen effekt på fødslen, men havde en effekt på vækst og udvikling af afkom. Afkoms overlevelse var reduceret, og overlevende afkom havde nedsat gennemsnitlig kropsvægt ved fødslen og under amning ved doser mindre end MRHDID og højere (på en mcg/m² basis ved maternelle subkutane doser på 20 mcg/kg/dag og højere). Disse fund forekom i nærvær af maternel toksicitet.
Formoterol
en fertilitets- og reproduktionsundersøgelse blev hanrotter doseret oralt i 9 uger og hunner i 2 uger før parring og i hele parringsperioden. Hunnerne blev enten doseret op til drægtighedsdag 19 eller indtil fravænning af deres afkom. Hannerne blev doseret i op til 25 uger. Navlebrok blev observeret hos rottefostre ved orale doser 1600 gange og højere end MRHDID (på en mcg/m² basis ved moder orale doser på 3000 mcg/kg/dag og højere). Brachygnathia blev observeret hos rottefostre ved en dosis på 8000 gange MRHDID (på en mcg/m² basis ved en maternel oral dosis på 15.000 mcg/kg/dag). Graviditeten blev forlænget med en dosis på 8000 gange MRHDID (på en mcg/m²-basis ved en maternel oral dosis på 15.000 mcg/kg/dag). Foster- og hvalpedødsfald forekom ved doser ca. 1600 gange MRHDID og højere (på en mcg/m² basis ved orale doser på 3000 mcg/kg/dag og højere) under drægtighed.
et embryo-føtalt udviklingsstudie med drægtige rotter doseret i organogeneseperioden fra drægtighedsdage 6-15, sås der ingen teratogene, embryocidale eller udviklingsmæssige virkninger ved doser op til 375 gange MRHDID (på mcg/m²-basis med maternel inhalation doser op til 690 mcg/kg/dag).
I et embryo-føtalt udviklingsstudie hos drægtige kaniner doseret i løbet af organogeneseperioden fra drægtighedsdage 6-18, blev der observeret subkapsulære cyster på leveren hos fostrene i en dosis på 65.000 gange MRHDID (på en mcg/m²-basis med en maternel oral dosis på 60.000 mcg/kg/dag). Der blev ikke observeret teratogene virkninger ved doser op til 3800 gange MRHDID (på en mcg/m²-basis ved maternelle orale doser op til 3500 mcg/kg/dag).
et præ- og postnatalt udviklingsstudie modtog gravide hunrotter formoterol i orale doser på 0, 210, 840 og 3400 mcg/kg/dag fra drægtighedsdag 6 til diegivningsperioden. Ungeoverlevelse var nedsat fra fødslen til postpartum dag 26 ved doser på 110 gange MRHDID og højere (på en mcg/m² basis ved moder orale doser på 210 mcg/kg/dag og højere), selvom der ikke var tegn på en dosis-respons forhold. Der var ingen behandlingsrelaterede effekter på den fysiske, funktionelle og adfærdsmæssige udvikling af rotteunger.
Amning
Risikooversigt
Der er ingen tilgængelige data om virkningen af SYMBICORT 4,5 mcg, budesonid eller formoterolfumarat på det ammede barn eller på mælkeproduktionen. Budesonid er ligesom andre inhalerede kortikosteroider til stede i human mælk [se Data ]. Der er ingen tilgængelige data om tilstedeværelsen af formoterolfumarat i modermælk. Formoterolfumarat er til stede i rottemælk [se Data ]. De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for SYMBICORT 4,5mcg og eventuelle negative virkninger på det ammede spædbarn fra SYMBICORT 160mg eller fra den underliggende moderens tilstand.
Data
Humane data med budesonid leveret via tørpulverinhalator indikerer, at den samlede daglige orale dosis af budesonid, der er tilgængelig i modermælk til spædbarnet, er ca. 0,3 % til 1 % af den dosis, som moderen inhalerer [se KLINISK FARMAKOLOGI ]. For SYMBICORT 4,5 mcg forventes den dosis af budesonid, der er tilgængelig for spædbarnet i modermælk, som en procentdel af moderens dosis, at være ens.
I fertilitets- og reproduktionsstudiet med rotter blev plasmaniveauer af formoterol målt i unger på postnatal dag 15 [se Brug i specifikke populationer ]. Det blev anslået, at den maksimale plasmakoncentration, som ungerne modtog fra moderdyret, ved den højeste dosis på 15 mg/kg, efter amning, var 4,4 % (0,24 nmol/L for et kuld vs. 5,5 nmol/L for moderen). .
Pædiatrisk brug
Sikkerhed og effektivitet af SYMBICORT hos astmapatienter på 12 år og ældre er blevet fastslået i studier på op til 12 måneder. I de to 12-ugers, dobbeltblindede, placebokontrollerede amerikanske pivotale undersøgelser blev 25 patienter i alderen 12 til 17 år behandlet med SYMBICORT to gange dagligt [se Kliniske Studier ]. Effektresultater i denne aldersgruppe svarede til dem, der blev observeret hos patienter 18 år og ældre. Der var ingen tydelige forskelle i typen eller hyppigheden af bivirkninger rapporteret i denne aldersgruppe sammenlignet med patienter 18 år og ældre.
Sikkerheden og effektiviteten af SYMBICORT 80/4.5 hos astmapatienter i alderen 6 til under 12 år er blevet fastslået i undersøgelser af op til 12 ugers varighed [se Kliniske Studier ]. Sikkerhedsprofilen hos disse patienter var i overensstemmelse med den, der blev observeret hos patienter på 12 år og ældre, som også fik SYMBICORT [se BIVIRKNINGER ].
Sikkerheden og effektiviteten af SYMBICORT 160 mg hos astmapatienter under 6 år er ikke blevet fastlagt.
Kontrollerede kliniske undersøgelser har vist, at oralt inhalerede kortikosteroider inklusive budesonid, en komponent i SYMBICORT, kan forårsage en reduktion i væksthastigheden hos pædiatriske patienter. Denne effekt er blevet observeret i fravær af laboratoriebeviser for HPA-akseundertrykkelse, hvilket tyder på, at væksthastighed er en mere følsom indikator for systemisk kortikosteroideksponering hos pædiatriske patienter end nogle almindeligt anvendte test af HPA-aksefunktion. Den langsigtede effekt af denne reduktion i væksthastighed forbundet med oralt inhalerede kortikosteroider, herunder indvirkningen på den endelige højde, er ukendt. Potentialet for "catch-up" vækst efter seponering af behandling med oralt inhalerede kortikosteroider er ikke blevet tilstrækkeligt undersøgt.
en undersøgelse af astmatiske børn i alderen 5 til 12 år havde dem, der blev behandlet med budesonid DPI 200 mcg to gange dagligt (n=311), en reduktion på 1,1 centimeter i vækst sammenlignet med dem, der fik placebo (n=418) ved udgangen af et år. ; forskellen mellem disse to behandlingsgrupper steg ikke yderligere over tre års yderligere behandling. Ved udgangen af 4 år havde børn behandlet med budesonid DPI og børn behandlet med placebo lignende væksthastigheder. Konklusionerne fra denne undersøgelse kan forvirres af den ulige brug af kortikosteroider i behandlingsgrupperne og inklusion af data fra patienter, der når puberteten i løbet af undersøgelsen.
Væksten hos pædiatriske patienter, der får oralt inhalerede kortikosteroider, inklusive SYMBICORT, bør overvåges. Hvis et barn eller en ung, der tager et kortikosteroid, ser ud til at have væksthæmning, bør muligheden for, at han/hun er særligt følsom over for denne effekt, overvejes. De potentielle væksteffekter af langvarig behandling bør afvejes mod de opnåede kliniske fordele. For at minimere de systemiske virkninger af oralt inhalerede kortikosteroider, inklusive SYMBICORT, bør hver patient titreres til den laveste styrke, der effektivt kontrollerer hans/hendes astma [se DOSERING OG ADMINISTRATION ].
Geriatrisk brug
Af det samlede antal astmapatienter, der blev behandlet med SYMBICORT 160 mg to gange dagligt i to 12-ugers undersøgelser og et 26-ugers postmarketing-studie, var 791 65 år eller ældre, hvoraf 141 var 75 år eller ældre.
KOL-studierne af 6 til 12 måneders varighed var 810 patienter behandlet med SYMBICORT 160/4.5, to inhalationer to gange dagligt 65 år og derover, og af disse var 177 patienter 75 år og ældre. Der blev ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet mellem disse patienter og yngre patienter, og anden rapporteret klinisk erfaring har ikke identificeret forskelle i respons mellem ældre og yngre patienter.
Som med andre produkter, der indeholder beta2-agonister, skal der udvises særlig forsigtighed ved anvendelse af SYMBICORT til geriatriske patienter, som har samtidig hjerte-kar-sygdom, som kan blive negativt påvirket af beta2-agonister.
Baseret på tilgængelige data for SYMBICORT eller dets aktive komponenter er det ikke berettiget at justere dosis af SYMBICORT 4,5 mcg hos geriatriske patienter.
Nedsat leverfunktion
Formelle farmakokinetiske undersøgelser med SYMBICORT er ikke blevet udført hos patienter med nedsat leverfunktion. Men da både budesonid og formoterolfumarat overvejende udskilles af levermetabolisme, kan nedsat leverfunktion føre til akkumulering af budesonid og formoterolfumarat i plasma. Derfor bør patienter med leversygdom overvåges nøje.
Nedsat nyrefunktion
Formelle farmakokinetiske undersøgelser med SYMBICORT er ikke blevet udført hos patienter med nedsat nyrefunktion.
OVERDOSIS
SYMBICORT
SYMBICORT indeholder både budesonid og formoterol; derfor gælder de risici, der er forbundet med overdosering af de individuelle komponenter beskrevet nedenfor, for SYMBICORT. I farmakokinetiske undersøgelser blev enkeltdoser på 960/54 mcg (12 aktiveringer af SYMBICORT 80/4,5) og 1280/36 mcg (8 aktiveringer af 160/4,5) administreret til patienter med KOL. I alt 1920/54 mcg (12 aktiveringer af SYMBICORT 160/4,5) blev administreret som en enkelt dosis til både raske forsøgspersoner og patienter med astma. I et længerevarende, aktivt kontrolleret sikkerhedsstudie hos unge og voksne astmapatienter på 12 år og ældre, blev SYMBICORT 160/4,5 administreret i op til 12 måneder i doser op til det dobbelte af den højeste anbefalede daglige dosis. Der blev ikke observeret nogen klinisk signifikante bivirkninger i nogen af disse undersøgelser.
Budesonid
Potentialet for akutte toksiske virkninger efter overdosering af budesonid er lavt. Hvis det anvendes i for høje doser i længere perioder, kan systemiske kortikosteroidvirkninger såsom hyperkorticisme forekomme [se ADVARSLER OG FORHOLDSREGLER ]. Budesonid ved fem gange den højeste anbefalede dosis (3200 mcg dagligt) administreret til mennesker i 6 uger forårsagede en signifikant reduktion (27 %) i plasmacortisol-responset på en 6-timers infusion af ACTH sammenlignet med placebo (+1 %). Den tilsvarende effekt af 10 mg prednison dagligt var en 35 % reduktion i plasmacortisol-responset på ACTH.
Formoterol
En overdosis af formoterol vil sandsynligvis føre til en overdrivelse af virkninger, der er typiske for beta2-agonister: kramper, angina, hypertension, hypotension, takykardi, atrielle og ventrikulære takyarytmier, nervøsitet, hovedpine, tremor, hjertebanken, muskelkramper, kvalme, svimmelhed, svimmelhed , metabolisk acidose, hyperglykæmi, hypokaliæmi. Som med al sympatomimetisk medicin kan hjertestop og endda død være forbundet med misbrug af formoterol. Der blev ikke set nogen klinisk signifikante bivirkninger, når formoterol blev givet til voksne patienter med akut bronkokonstriktion i en dosis på 90 mcg/dag over 3 timer eller til stabile astmatikere 3 gange dagligt med en samlet dosis på 54 mcg/dag i 3 dage.
Behandling af formoterol-overdosering består af seponering af medicinen sammen med indførelse af passende symptomatisk og/eller understøttende behandling. Den fornuftige brug af en kardioselektiv beta-receptorblokker kan overvejes i betragtning af, at sådan medicin kan fremkalde bronkospasme. Der er ikke tilstrækkelig evidens til at afgøre, om dialyse er gavnligt ved overdosering af formoterol. Hjertemonitorering anbefales i tilfælde af overdosering.
KONTRAINDIKATIONER
Brugen af SYMBICORT er kontraindiceret under følgende forhold:
- Primær behandling af status asthmaticus eller andre akutte episoder med astma eller KOL, hvor intensive tiltag er påkrævet.
- Overfølsomhed over for et eller flere af indholdsstofferne i SYMBICORT.
KLINISK FARMAKOLOGI
Handlingsmekanisme
SYMBICORT
SYMBICORT indeholder både budesonid og formoterol; derfor gælder virkningsmekanismerne beskrevet nedenfor for de enkelte komponenter for SYMBICORT. Disse lægemidler repræsenterer to klasser af medicin (et syntetisk kortikosteroid og en langtidsvirkende selektiv beta2-adrenoceptoragonist), som har forskellige virkninger på kliniske, fysiologiske og inflammatoriske indekser for KOL og astma.
Budesonid
Budesonid er et antiinflammatorisk kortikosteroid, der udviser potent glukokortikoid aktivitet og svag mineralokortikoid aktivitet. I standard in vitro- og dyremodeller har budesonid ca. 200 gange højere affinitet for glukokortikoidreceptoren og en 1000 gange højere topisk antiinflammatorisk styrke end cortisol (rottekrotonolie-øreødemanalyse). Som et mål for systemisk aktivitet er budesonid 40 gange mere potent end cortisol, når det administreres subkutant og 25 gange mere potent, når det administreres oralt i rottethymus-involutionsanalysen.
glukokortikoidreceptoraffinitetsundersøgelser var 22R-formen af budesonid to gange så aktiv som 22S-epimeren. In vitro undersøgelser viste, at de to former for budesonid ikke interkonverterer.
Inflammation er en vigtig komponent i patogenesen af KOL og astma. Kortikosteroider har en bred vifte af hæmmende aktiviteter mod flere celletyper (f.eks. mastceller, eosinofiler, neutrofiler, makrofager og lymfocytter) og mediatorer (f.eks. histamin, eicosanoider, leukotriener og cytokiner) involveret i allergiske og ikke-allergisk-medierede betændelse. Disse antiinflammatoriske virkninger af kortikosteroider kan bidrage til deres effektivitet ved KOL og astma.
Undersøgelser af astmatiske patienter har vist et gunstigt forhold mellem topisk antiinflammatorisk aktivitet og systemiske kortikosteroideffekter over en bred vifte af doser af budesonid. Dette forklares af en kombination af en relativt høj lokal anti-inflammatorisk effekt, omfattende first pass levernedbrydning af oralt absorberet lægemiddel (85%-95%) og den lave styrke af dannede metabolitter.
Formoterol
Formoterolfumarat er en langtidsvirkende selektiv beta2-adrenerg agonist (beta2-agonist) med en hurtig indsættende virkning. Inhaleret formoterolfumarat virker lokalt i lungen som en bronkodilatator. In vitro undersøgelser har vist, at formoterol har mere end 200 gange større agonistaktivitet ved beta2-receptorer end ved beta1-receptorer. In vitro-bindingsselektiviteten til beta2-over beta1-adrenoceptorer er højere for formoterol end for albuterol (5 gange), hvorimod salmeterol har et højere (3 gange) beta2-selektivitetsforhold end formoterol.
Selvom beta2-receptorer er de dominerende adrenerge receptorer i bronkial glat muskulatur, og beta1-receptorer er de dominerende receptorer i hjertet, er der også beta2-receptorer i det menneskelige hjerte, der udgør 10% til 50% af de samlede beta-adrenerge receptorer. Den præcise funktion af disse receptorer er ikke blevet fastslået, men de rejser muligheden for, at selv meget selektive beta2-agonister kan have hjerteeffekter.
De farmakologiske virkninger af beta2-adrenoceptoragonistlægemidler, herunder formoterol, kan i det mindste delvis tilskrives stimulering af intracellulær adenylcyclase, det enzym, der katalyserer omdannelsen af adenosintriphosphat (ATP) til cyklisk-3',5'-adenosinmonofosfat ( cyklisk AMP). Forøgede cykliske AMP-niveauer forårsager afslapning af bronkial glat muskulatur og inhibering af frigivelse af mediatorer af øjeblikkelig overfølsomhed fra celler, især fra mastceller.
In vitro-tests viser, at formoterol er en hæmmer af frigivelsen af mastcellemediatorer, såsom histamin og leukotriener, fra den menneskelige lunge. Formoterol hæmmer også histamin-induceret plasmaalbumin-ekstravasation hos bedøvede marsvin og hæmmer allergen-induceret eosinofiltilstrømning hos hunde med hyperreaktivitet i luftvejene. Relevansen af disse in vitro- og dyrefund for mennesker er ukendt.
Farmakodynamik
Astma
Kardiovaskulære effekter
et enkeltdosis-cross-over-studie, der involverede 201 patienter med vedvarende astma, blev enkeltdosisbehandlinger på 4,5, 9 og 18 mcg formoterol i kombination med 320 mcg budesonid leveret via SYMBICORT sammenlignet med budesonid 320 mcg alene. Dosisordnede forbedringer i FEV1 blev påvist sammenlignet med budesonid. EKG'er og blodprøver for glukose og kalium blev taget efter dosis. For SYMBICORT 4,5 mcg blev der observeret små gennemsnitlige stigninger i serumglucose og fald i serumkalium (henholdsvis +0,44 mmol/L og -0,18 mmol/L ved den højeste dosis) med stigende doser af formoterol sammenlignet med budesonid. I EKG'er producerede SYMBICORT små dosisrelaterede gennemsnitlige stigninger i hjertefrekvens (ca. 3 slag/min ved den højeste dosis) og QTc-intervaller (3-6 msek.) sammenlignet med budesonid alene. Ingen forsøgspersoner havde en QT- eller QTc-værdi ≥500 msek.
USA evaluerede fem 12-ugers, aktive og placebo-kontrollerede undersøgelser og en 6-måneders aktiv-kontrolleret undersøgelse 2976 patienter i alderen 6 år og ældre med astma. Systemiske farmakodynamiske virkninger af formoterol (hjerte/pulsfrekvens, blodtryk, QTc-interval, kalium og glucose) var ens hos patienter behandlet med SYMBICORT sammenlignet med patienter behandlet med formoterol tørt inhalationspulver 4,5 mcg, 2 inhalationer to gange dagligt. Ingen patient havde en QT- eller QTc-værdi ≥500 msek under behandlingen.
I tre placebokontrollerede undersøgelser af unge og voksne med astma i alderen 12 år og ældre havde i alt 1232 patienter (553 patienter i SYMBICORT 160 mg-gruppen) evaluerbar kontinuerlig 24-timers elektrokardiografisk monitorering. Samlet set var der ingen vigtige forskelle i forekomsten af ventrikulær eller supraventrikulær ektopi og ingen tegn på øget risiko for klinisk signifikant dysrytmi i SYMBICORT 160 mg-gruppen sammenlignet med placebo.
HPA-akse effekter
Samlet set blev der ikke observeret nogen klinisk vigtige virkninger på HPA-aksen, målt ved 24-timers urincortisol, for SYMBICORT-behandlede voksne eller unge patienter ved doser op til 640/18 mcg/dag sammenlignet med budesonid.
Kronisk obstruktiv lungesygdom
Kardiovaskulære effekter
I to KOL-lungefunktionsundersøgelser, 6 måneder og 12 måneder af varighed, inklusive 3668 KOL-patienter, blev der ikke set nogen klinisk vigtige forskelle i pulsfrekvens, blodtryk, kalium og glukose mellem SYMBICORT, de individuelle komponenter i SYMBICORT 160mg og placebo [se Kliniske Studier ].
EKG'er registreret ved flere klinikbesøg på behandling i begge undersøgelser viste ingen klinisk vigtige forskelle for hjertefrekvens, PR-interval, QRS-varighed, hjertefrekvens, tegn på hjerteiskæmi eller arytmier mellem SYMBICORT 160/4.5 monoprodukterne og placebo, alle administreret som 2 inhalationer to gange om dagen. Baseret på EKG'er oplevede 6 patienter behandlet med SYMBICORT 160/4.5, 6 patienter behandlet med formoterol 4,5 mcg og 6 patienter i placebogruppen atrieflimren eller flagren, der ikke var til stede ved baseline. Der var ingen tilfælde af ikke-vedvarende ventrikulær takykardi i grupperne SYMBICORT 160/4,5, formoterol 4,5 mcg eller placebo.
det 12-måneders studie havde 520 patienter evaluerbar kontinuerlig 24-timers EKG (Holter) monitorering før den første dosis og efter ca. 1 og 4 måneder i behandling. Ingen klinisk vigtige forskelle i ventrikulære eller supraventrikulære arytmier, ventrikulære eller supraventrikulære ektopiske slag eller hjertefrekvens blev observeret blandt grupperne behandlet med SYMBICORT 160/4.5, formoterol eller placebo taget som 2 inhalationer to gange dagligt. Baseret på EKG-monitorering (Holter) oplevede én patient på SYMBICORT 160/4,5, ingen patienter på formoterol 4,5 mcg og tre patienter i placebogruppen atrieflimren eller flagren, der ikke var til stede ved baseline.
HPA-akse effekter
24 timers urinkortisolmålinger blev indsamlet i en poolet undergruppe (n=616) af patienter fra to KOL-lungefunktionsundersøgelser. Dataene indikerede ca. 30 % lavere gennemsnitlige 24-timers urinfri cortisolværdier efter kronisk administration (> 6 måneder) af SYMBICORT i forhold til placebo. SYMBICORT 4,5 mcg så ud til at udvise kortisolundertrykkelse sammenlignelig med budesonid 160 mcg alene eller samtidig administration af budesonid 160 mcg og formoterol 4,5 mcg. For patienter behandlet med SYMBICORT 160 mg eller placebo i op til 12 måneder, var procentdelen af patienter, der skiftede fra normal til lav for dette mål, generelt sammenlignelig.
Andre Budesonide-produkter
For at bekræfte, at systemisk absorption ikke er en signifikant faktor i den kliniske effekt af inhaleret budesonid, blev der udført et klinisk studie med patienter med astma, hvor man sammenlignede 400 mcg budesonid administreret via en inhalator med afmålt dosis under tryk med et rørafstandsstykke med 1400 mcg oralt budesonid og placebo . Undersøgelsen viste effektiviteten af inhaleret budesonid, men ikke oralt indtaget budesonid, på trods af sammenlignelige systemiske niveauer. Den terapeutiske virkning af konventionelle doser af oralt inhaleret budesonid er således i vid udstrækning forklaret af dets direkte virkning på luftvejene.
Inhaleret budesonid har vist sig at nedsætte luftvejsreaktiviteten til forskellige udfordringsmodeller, herunder histamin, methacholin, natriummetabisulfit og adenosinmonofosfat hos patienter med hyperreaktive luftveje. Den kliniske relevans af disse modeller er ikke sikker.
Forbehandling med inhaleret budesonid, 1600 mcg dagligt (800 mcg to gange dagligt) i 2 uger reducerede det akutte (tidlige fase-reaktion) og forsinkede (sen-fase-reaktion) fald i FEV1 efter inhaleret allergenpåvirkning.
De systemiske virkninger af inhalerede kortikosteroider er relateret til den systemiske eksponering for sådanne lægemidler. Farmakokinetiske undersøgelser har vist, at hos både voksne og børn med astma er den systemiske eksponering for budesonid lavere med SYMBICORT 160mg sammenlignet med inhaleret budesonid administreret i den samme indgivne dosis via en tørpulverinhalator [se KLINISK FARMAKOLOGI ]. Derfor forventes de systemiske virkninger (HPA-akse og vækst) af budesonid leveret fra SYMBICORT ikke at være større end det, der er rapporteret for inhaleret budesonid, når det administreres i sammenlignelige doser via tørpulverinhalatoren [se Brug i specifikke populationer ].
HPA-akse effekter
Virkningerne af inhaleret budesonid administreret via en tørpulverinhalator på HPA-aksen blev undersøgt hos 905 voksne og 404 pædiatriske patienter med astma. For de fleste patienter forblev evnen til at øge cortisolproduktionen som reaktion på stress, som vurderet ved cosyntropin (ACTH) stimuleringstest, intakt med budesonidbehandling ved anbefalede doser. For voksne patienter behandlet med 100, 200, 400 eller 800 mcg to gange dagligt i 12 uger havde henholdsvis 4 %, 2 %, 6 % og 13 % et unormalt stimuleret kortisolrespons (peak cortisol
Andre Formoterol-produkter
Mens den farmakodynamiske effekt er via stimulering af beta-adrenerge receptorer, fører overdreven aktivering af disse receptorer almindeligvis til skeletmuskeltremor og kramper, søvnløshed, takykardi, fald i plasmakalium og stigninger i plasmaglucose. Inhaleret formoterol kan, ligesom andre beta2-adrenerge agonister, fremkalde dosisrelaterede kardiovaskulære effekter og effekter på blodsukker og/eller serumkalium [se ADVARSLER OG FORHOLDSREGLER ]. For SYMBICORT 160mg er disse virkninger beskrevet i afsnittet Klinisk farmakologi, farmakodynamik, SYMBICORT (12.2).
Brug af LABA-lægemidler kan resultere i tolerance over for bronkobeskyttende og bronkodilaterende virkninger.
Rebound bronchial hyperresponsivitet efter ophør af kronisk langtidsvirkende beta-agonistbehandling er ikke blevet observeret.
Farmakokinetik
SYMBICORT
Absorption
Budesonid
Sunde emner
Oralt inhaleret budesonid absorberes hurtigt i lungerne, og maksimal koncentration nås typisk inden for 20 minutter. Efter oral administration af budesonid blev maksimal plasmakoncentration opnået i løbet af ca. 1 til 2 timer, og den absolutte systemiske tilgængelighed var 6%-13% på grund af omfattende first-pass metabolisme. I modsætning hertil blev det meste af budesonid leveret til lungerne systemisk absorberet. Hos raske forsøgspersoner blev 34 % af den afmålte dosis aflejret i lungen (som vurderet ved hjælp af plasmakoncentrationsmetoden og ved anvendelse af en budesonid-holdig tørpulverinhalator) med en absolut systemisk tilgængelighed på 39 % af den afmålte dosis.
Efter administration af SYMBICORT 160/4.5, to eller fire inhalationer to gange dagligt i 5 dage hos raske forsøgspersoner, steg plasmakoncentrationen af budesonid generelt i forhold til dosis. Akkumuleringsindekset for gruppen, der modtog 2 inhalationer to gange dagligt, var 1,32 for budesonid.
Astmapatienter
et enkeltdosisstudie blev højere end anbefalede doser af SYMBICORT (12 inhalationer af SYMBICORT 160/4,5) administreret til patienter med moderat astma. Maksimal budesonid-plasmakoncentration på 4,5 nmol/L forekom 20 minutter efter dosering. Denne undersøgelse viste, at den totale systemiske eksponering for budesonid fra SYMBICORT 4,5 mcg var ca. 30 % lavere end fra inhaleret budesonid via en tørpulverinhalator (DPI) ved den samme afgivne dosis. Efter administration af SYMBICORT var halveringstiden for budesonidkomponenten 4,7 timer.
et gentaget dosisstudie blev den højeste anbefalede dosis af SYMBICORT (160/4,5, to inhalationer to gange dagligt) givet til patienter med moderat astma og raske forsøgspersoner i 1 uge. Maksimal budesonid-plasmakoncentration på 1,2 nmol/L forekom efter 21 minutter hos astmapatienter. Den maksimale plasmakoncentration af budesonid var 27 % lavere hos astmapatienter sammenlignet med hos raske forsøgspersoner. Den totale systemiske eksponering af budesonid var dog sammenlignelig med den hos astmapatienter.
Maksimal steady-state plasmakoncentrationer af budesonid administreret af DPI hos voksne med astma var i gennemsnit 0,6 og 1,6 nmol/L ved doser på henholdsvis 180 mcg og 360 mcg to gange dagligt. Hos astmatiske patienter udviste budesonid en lineær stigning i AUC og Cmax med stigende dosis efter både enkelt og gentagen dosering af inhaleret budesonid.
KOL-patienter
et enkeltdosisstudie blev 12 inhalationer af SYMBICORT 80/4,5 (samlet dosis 960/54 mcg) administreret til patienter med KOL. Gennemsnitlig budesonid-peak plasmakoncentration på 3,3 nmol/L forekom 30 minutter efter dosering. Systemisk eksponering af budesonid var sammenlignelig mellem SYMBICORT pMDI og samtidig administration af budesonid via en afmålt dosisinhalator og formoterol via en tørpulverinhalator (budesonid 960 mcg og formoterol 54 mcg). I samme undersøgelse fik en åben gruppe af patienter med moderat astma også den samme højere dosis SYMBICORT. For budesonid udviste KOL-patienter 12 % større AUC og 10 % lavere Cmax sammenlignet med astmapatienter.
det 6-måneders pivotale kliniske lungefunktionsstudie blev steady-state farmakokinetiske data for budesonid opnået i en undergruppe af KOL-patienter med behandlingsarme af SYMBICORT 4,5 mcg pMDI 160/4,5, SYMBICORT 160 mg pMDI 80/4,5 m, budesonid 160 mcg, budesonid. 160 mcg og formoterol 4,5 mcg givet sammen, alle administreret som 2 inhalationer to gange dagligt. Systemisk budesonideksponering (AUC og Cmax) steg proportionalt med doser fra 80 mcg til 160 mcg og var generelt ens mellem de 3 behandlingsgrupper, der fik den samme dosis budesonid (SYMBICORT 4,5 mcg pMDI 160/4,5, budesonid 160 mcg og 16 budesonid formoterol 4,5 mcg administreret sammen).
Formoterol
Inhaleret formoterol absorberes hurtigt; maksimale plasmakoncentrationer nås typisk ved det første plasmaprøvetagningstidspunkt inden for 5-10 minutter efter dosering. Som med mange lægemidler til oral inhalation, er det sandsynligt, at størstedelen af den inhalerede formoterol, der leveres, sluges og derefter absorberes fra mave-tarmkanalen.
Sunde emner
Efter administration af SYMBICORT (160/4,5, to eller fire inhalationer to gange dagligt) i 5 dage hos raske forsøgspersoner steg plasmakoncentrationen af formoterol generelt i forhold til dosis. Akkumuleringsindekset for gruppen, der modtog 2 inhalationer to gange dagligt, var 1,77 for formoterol.
Astmapatienter
I et enkeltdosisstudie blev højere end anbefalede doser af SYMBICORT (12 inhalationer af SYMBICORT 160/4,5) administreret til patienter med moderat astma. Maksimal plasmakoncentration for formoterol på 136 pmol forekom 10 minutter efter dosering. Ca. 8 % af den afgivne dosis af formoterol blev genfundet i urinen som uændret lægemiddel.
et gentaget dosisstudie blev den højeste anbefalede dosis af SYMBICORT (160/4,5, to inhalationer to gange dagligt) givet til patienter med moderat astma og raske forsøgspersoner i 1 uge. Maksimal formoterol plasmakoncentration på 28 pmol/L forekom efter 10 minutter hos astmapatienter. Den maksimale plasmakoncentration af formoterol var omkring 42 % lavere hos astmapatienter sammenlignet med den hos raske forsøgspersoner. Den totale systemiske eksponering af formoterol var imidlertid sammenlignelig med den hos astmapatienter.
KOL-patienter
Efter enkeltdosisadministration af 12 inhalationer af SYMBICORT 80/4.5 blev den gennemsnitlige maksimale plasmakoncentration af formoterol på 167 pmol/L hurtigt opnået 15 minutter efter dosering. Formoteroleksponeringen var lidt større (~16-18%) fra SYMBICORT 160 mg pMDI sammenlignet med samtidig administration af budesonid via en afmålt dosisinhalator og formoterol via en tørpulverinhalator (samlet dosis af budesonid 960 mcg og formoterol 54 mcg). I samme undersøgelse fik en åben gruppe af patienter med moderat astma den samme dosis SYMBICORT. KOL-patienter udviste 12-15 % højere AUC og Cmax for formoterol sammenlignet med astmapatienter.
det 6-måneders pivotale kliniske lungefunktionsstudie blev steady-state farmakokinetiske data for formoterol opnået i en undergruppe af KOL-patienter med behandlingsarme på SYMBICORT 160 mg pMDI 160/4,5, SYMBICORT 160 mg pMDI 80/4,5, for. mcg og formoterol 4,5 mcg givet sammen, alle administreret som 2 inhalationer to gange dagligt. Den systemiske eksponering af formoterol, som påvist af AUC, var ca. 30 % og 16 % højere fra SYMBICORT pMDI sammenlignet med formoterol alene behandlingsarm og samtidig administration af individuelle komponenter i henholdsvis budesonid og formoterol behandlingsarm.
Fordeling
Budesonid
Fordelingsvolumenet af budesonid var ca. 3 l/kg. Det var 85%-90% bundet til plasmaproteiner. Proteinbindingen var konstant over koncentrationsområdet (1-100 nmol/L) opnået med og overskredet anbefalede inhalerede doser. Budesonid viste ringe eller ingen binding til kortikosteroidbindende globulin. Budesonid ækvilibrerede hurtigt med røde blodlegemer på en koncentrationsuafhængig måde med et blodplasmaforhold på ca. 0,8.
Formoterol
Over koncentrationsområdet på 10-500 nmol/L var plasmaproteinbindingen for RR- og SS-enantiomererne af formoterol henholdsvis 46 % og 58 %. Koncentrationerne af formoterol, der blev brugt til at vurdere plasmaproteinbindingen, var højere end dem, der blev opnået i plasma efter inhalation af en enkelt dosis på 54 mcg.
Metabolisme
Budesonid
In vitro undersøgelser med humane leverhomogenater har vist, at budesonid blev metaboliseret hurtigt og omfattende. To hovedmetabolitter dannet via cytochrom P450 (CYP) isoenzym 3A4 (CYP3A4) katalyseret biotransformation er blevet isoleret og identificeret som 16α-hydroxyprednisolon og 6ß-hydroxybudesonid. Kortikosteroidaktiviteten af hver af disse to metabolitter var mindre end 1 % af moderforbindelsens. Der blev ikke påvist nogen kvalitative forskelle mellem in vitro og in vivo metaboliske mønstre. Ubetydelig metabolisk inaktivering blev observeret i humane lunge- og serumpræparater.
Formoterol
Den primære metabolisme af formoterol er ved direkte glucuronidering og ved O-demethylering efterfulgt af konjugering til inaktive metabolitter. Sekundære metaboliske veje omfatter deformylering og sulfatkonjugering. CYP2D6 og CYP2C er blevet identificeret som værende primært ansvarlige for Odemethylering.
Elimination
Budesonid
Budesonid blev udskilt i urin og fæces i form af metabolitter. Ca. 60 % af en intravenøs radioaktivt mærket dosis blev genfundet i urinen.
Der blev ikke påvist uændret budesonid i urinen. 22R-formen af budesonid blev fortrinsvis elimineret af leveren med systemisk clearance på 1,4 l/min vs. 1,0 l/min for 22S-formen. Den terminale halveringstid, 2 til 3 timer, var den samme for begge epimerer og var uafhængig af dosis.
Formoterol
Udskillelsen af formoterol blev undersøgt hos fire raske forsøgspersoner efter samtidig administration af radioaktivt mærket formoterol via oral og IV. I denne undersøgelse blev 62 % af det radiomærkede formoterol udskilt i urinen, mens 24 % blev udskilt i fæces.
Særlige Populationer
Geriatrisk
Farmakokinetikken af SYMBICORT 4,5 mcg hos geriatriske patienter er ikke blevet specifikt undersøgt.
Pædiatrisk
Plasmakoncentrationer af budesonid blev målt efter administration af fire inhalationer af SYMBICORT 160/4,5 i et enkeltdosisstudie hos pædiatriske patienter med astma, 6 til under 12 år. Maksimal budesonidkoncentration på 1,4 nmol/L forekom 20 minutter efter dosis. Denne undersøgelse viste også, at den totale systemiske eksponering for budesonid fra SYMBICORT 4,5 mcg var ca. 30 % lavere end fra inhaleret budesonid via en tørpulverinhalator, der også blev evalueret ved den samme afgivne dosis. Den dosisnormaliserede Cmax og AUC0-inf for budesonid efter enkeltdosisinhalation hos børn i alderen 6 til under 12 år var numerisk lavere end det, der blev observeret hos voksne.
Efter 2 inhalationer af SYMBICORT 160/4,5 to gange daglig behandling var formoterol Cmax og AUC0-6 ved steady state hos børn i alderen 6 til under 12 år sammenlignelige med det, der blev observeret hos voksne.
Køn/race
Der er ikke udført specifikke undersøgelser for at undersøge virkningerne af køn og race på farmakokinetikken af SYMBICORT. Populations-PK-analyse af SYMBICORT 4,5 mcg-dataene indikerer, at køn ikke påvirker farmakokinetikken af budesonid og formoterol. Der kan ikke drages konklusioner om effekten af race på grund af det lave antal ikke-kaukasiere vurderet for PK.
Ammende mødre
Fordelingen af budesonid ved inhalation fra en tørpulverinhalator i doser på 200 eller 400 mcg to gange dagligt i mindst 3 måneder blev undersøgt hos otte ammende kvinder med astma fra 1 til 6 måneder efter fødslen. Systemisk eksponering for budesonid hos disse kvinder synes at være sammenlignelig med den hos ikke-ammende kvinder med astma fra andre undersøgelser. Modermælk opnået over otte timer efter dosis afslørede, at den maksimale koncentration af budesonid for de samlede daglige doser på 400 og 800 mcg var henholdsvis 0,39 og 0,78 nmol/L og forekom inden for 45 minutter efter dosering. Den estimerede orale daglige dosis af budesonid fra modermælk til spædbarnet er ca. 0,007 og 0,014 mcg/kg/dag for de to dosisregimer, der blev brugt i denne undersøgelse, hvilket repræsenterer ca. 0,3 % til 1 % af den dosis, som moderen inhalerer. Budesonidniveauer i plasmaprøver opnået fra fem spædbørn ca. 90 minutter efter amning (og ca. 140 minutter efter lægemiddeladministration til moderen) var under kvantificerbare niveauer ( Brug i specifikke populationer ].
Nyre- eller leverinsufficiens
Der er ingen data vedrørende den specifikke brug af SYMBICORT til patienter med nedsat lever- eller nyrefunktion. Nedsat leverfunktion kan påvirke eliminationen af kortikosteroider. Budesonids farmakokinetik var påvirket af kompromitteret leverfunktion, hvilket fremgår af en fordoblet systemisk tilgængelighed efter oral indtagelse. Den intravenøse farmakokinetik af budesonid var imidlertid ens hos cirrotiske patienter og hos raske forsøgspersoner. Specifikke data med formoterol er ikke tilgængelige, men fordi formoterol primært elimineres via levermetabolisme, kan en øget eksponering forventes hos patienter med alvorlig leverinsufficiens.
Lægemiddel-lægemiddelinteraktioner
En enkeltdosis crossover-undersøgelse blev udført for at sammenligne farmakokinetikken af otte inhalationer af følgende: budesonid, formoterol og budesonid plus formoterol administreret samtidigt. Resultaterne af undersøgelsen indikerede, at der ikke var tegn på en farmakokinetisk interaktion mellem de to komponenter i SYMBICORT.
Hæmmere af cytokrom P450 enzymer
Ketoconazol
Ketoconazol, en stærk hæmmer af cytochrom P450 (CYP) isoenzym 3A4 (CYP3A4), det vigtigste metaboliske enzym for kortikosteroider, øgede plasmaniveauer af oralt indtaget budesonid.
Cimetidin
Ved anbefalede doser havde cimetidin, en ikke-specifik hæmmer af CYP-enzymer, en lille, men klinisk ubetydelig effekt på farmakokinetikken af oralt budesonid.
Der er ikke udført specifikke lægemiddel-lægemiddelinteraktionsstudier med formoterol.
Dyretoksikologi og/eller farmakologi
Præklinisk
Forsøg med laboratoriedyr (minigrise, gnavere og hunde) har vist forekomsten af hjertearytmier og pludselig død (med histologiske tegn på myokardienekrose), når beta-agonister og methylxanthiner administreres samtidigt. Den kliniske betydning af disse fund er ukendt.
Kliniske Studier
Astma
Patienter med astma 12 år og ældre
to kliniske undersøgelser, der sammenlignede SYMBICORT 4,5 mcg med de individuelle komponenter, var forbedringer i de fleste effektmål større med SYMBICORT end med brug af enten budesonid eller formoterol alene. Derudover viste et klinisk studie lignende resultater mellem SYMBICORT og samtidig brug af budesonid og formoterol i tilsvarende doser fra separate inhalatorer.
Sikkerheden og effekten af SYMBICORT 160 mg blev påvist i to randomiserede, dobbeltblindede, placebokontrollerede amerikanske kliniske studier med 1076 patienter på 12 år og ældre. Faste SYMBICORT-doser på 160/9 mcg og 320/9 mcg to gange dagligt (hver dosis indgivet som 2 inhalationer af henholdsvis 80/4,5 og 160/4,5 mcg styrkerne) blev sammenlignet med monokomponenterne (budesonid og formoterol) og placebo tomoterol give oplysninger om passende dosering til at dække en række af astmaens sværhedsgrad.
Undersøgelse 1: Klinisk undersøgelse med SYMBICORT 160/4.5
Denne 12-ugers undersøgelse evaluerede 596 patienter 12 år og ældre ved at sammenligne SYMBICORT 160/4.5, den frie kombination af budesonid 160 mcg plus formoterol 4,5 mcg i separate inhalatorer, budesonid 160 mcg, formoterol 4,5 mcg; hver administreret som 2 inhalationer to gange dagligt. Undersøgelsen omfattede en 2-ugers indkøringsperiode med budesonid 80 mcg, 2 inhalationer to gange dagligt. De fleste patienter havde moderat til svær astma og brugte moderate til høje doser af inhalerede kortikosteroider før undersøgelsens start. Randomisering blev stratificeret ved tidligere inhaleret kortikosteroidbehandling (71,6 % på moderat og 28,4 % på højdosis inhaleret kortikosteroid). Gennemsnitlig procent forudsagt FEV1 ved baseline var 68,1 % og var ens på tværs af behandlingsgrupper. De co-primære effekt-endepunkter var 12-timers gennemsnitlig post-dosis FEV1 i uge 2, og præ-dosis FEV1 i gennemsnit i løbet af undersøgelsen. Undersøgelsen krævede også, at patienter, der opfyldte et foruddefineret kriterium for astmaforværring, blev trukket tilbage. De foruddefinerede kriterier for astmaforværring var et klinisk vigtigt fald i FEV1 eller PEF, stigning i brug af redningsalbuterol, opvågning om natten på grund af astma, akut intervention eller hospitalsindlæggelse på grund af astma eller krav om astmamedicin, som ikke er tilladt i henhold til protokollen. For kriteriet om natlig opvågning på grund af astma, fik patienterne lov til at forblive i undersøgelsen efter investigatorens skøn, hvis ingen af de andre astmaforværrende kriterier var opfyldt. Procentdelen af patienter, der trækker sig tilbage på grund af eller opfylder foruddefinerede kriterier for forværring af astma, er vist i tabel 4.
Den gennemsnitlige procentvise ændring fra baseline i FEV1 målt umiddelbart før dosering (før-dosis) over 12 uger er vist i figur 1. Fordi denne undersøgelse brugte foruddefinerede seponeringskriterier for forværring af astma, hvilket forårsagede en differentiel abstinensrate i behandlingsgrupperne, før- Dosis FEV1-resultater ved det sidste tilgængelige studiebesøg (slut på behandling, EOT) er også angivet. Patienter, der fik SYMBICORT 160/4,5 havde signifikant større gennemsnitlige forbedringer fra baseline i før-dosis FEV1 ved afslutningen af behandlingen (0,19 l, 9,4 %) sammenlignet med budesonid 160 mcg (0,10 l, 4,9 %), formoterol 4,5 mcg (-0,12 %). L, -4,8%) og placebo (-0,17 L, -6,9%).
Figur 1: Gennemsnitlig procentvis ændring fra baseline i præ-dosis FEV1 over 12 uger (undersøgelse 1)
PATIENTOPLYSNINGER
SYMBICORT (SIM-bi-kort) (budesonid 80 mcg og formoterolfumarat dihydrat 4,5 mcg) Inhalation Aerosol
SYMBICORT (SIM-bi-kort) (budesonid 160 mcg og formoterolfumarat dihydrat 4,5 mcg) Inhalation Aerosol
Hvad er SYMBICORT?
SYMBICORT kombinerer en inhaleret kortikosteroidmedicin (ICS), budesonid og en langtidsvirkende beta2-adrenerg agonist (LABA), formoterol.
- Inhalerede kortikosteroider hjælper med at mindske betændelse i lungerne. Betændelse i lungerne kan føre til vejrtrækningsproblemer.
- LABA-medicin bruges til mennesker med kronisk obstruktiv lungesygdom (KOL) og astma. LABA-medicin hjælper musklerne omkring luftvejene i dine lunger med at forblive afslappede for at forhindre symptomer som hvæsende vejrtrækning, hoste, trykken for brystet og åndenød. Disse symptomer kan opstå, når musklerne omkring luftvejene strammer. Dette gør det svært at trække vejret. I alvorlige tilfælde kan hvæsende vejrtrækning stoppe din vejrtrækning og kan føre til døden, hvis den ikke behandles med det samme.
SYMBICORT 4,5mcg bruges ikke til at lindre pludselige vejrtrækningsproblemer og erstatter ikke en redningsinhalator. SYMBICORT bruges til astma og KOL som følger:
- Astma: SYMBICORT bruges til at kontrollere symptomer på astma og forebygge symptomer som hvæsende vejrtrækning hos voksne og børn i alderen 6 år og ældre. SYMBICORT 4,5mcg indeholder formoterol. LABA-medicin såsom formoterol, når de bruges alene, øger risikoen for død og hospitalsindlæggelser af astmaproblemer. SYMBICORT indeholder en ICS og en LABA. Når en ICS og LABA bruges sammen, er der ikke en signifikant øget risiko ved indlæggelser og død af astmaproblemer. SYMBICORT 160mg er ikke til voksne og børn med astma, som er godt kontrolleret med en astma-kontrol medicin, såsom en lav til medium dosis af en ICS. SYMBICORT 160mg er til voksne og børn med astma, som har brug for både ICS og LABA medicin. Det vides ikke, om SYMBICORT er sikkert og effektivt til børn under 6 år med astma.
- KOL: KOL er en langvarig (kronisk) lungesygdom, der omfatter kronisk bronkitis, emfysem eller begge dele. SYMBICORT 160/4,5 mcg bruges i lang tid, som 2 inhalationer 2 gange hver dag, for at forbedre symptomerne på KOL for bedre vejrtrækning og for at reducere antallet af opblussen (forværringen af dine KOL-symptomer i flere dage).
Brug ikke SYMBICORT:
- til behandling af pludselige alvorlige symptomer på astma eller KOL.
- hvis du er allergisk over for et af indholdsstofferne i SYMBICORT. Se slutningen af denne indlægsseddel for en liste over ingredienser i SYMBICORT.
Inden du bruger SYMBICORT, skal du fortælle din læge om alle dine medicinske tilstande, inklusive hvis du:
- har hjerteproblemer.
- har forhøjet blodtryk.
- har anfald.
- har problemer med skjoldbruskkirtlen.
- har diabetes.
- har leverproblemer.
- har osteoporose.
- har et immunsystemproblem.
- har øjenproblemer såsom øget tryk i øjet, glaukom eller grå stær.
- er allergisk over for medicin.
- har enhver form for viral, bakteriel, svampe- eller parasitinfektion.
- er udsat for skoldkopper eller mæslinger.
- er gravid eller planlægger at blive gravid. Det vides ikke, om SYMBICORT 4,5 mcg kan skade dit ufødte barn.
- ammer. Budesonid, et af de aktive ingredienser i SYMBICORT, går over i modermælken. Du og din læge bør beslutte, om du vil tage SYMBICORT 160mg, mens du ammer.
Fortæl din sundhedsudbyder om al den medicin, du tager, inklusive receptpligtig og håndkøbsmedicin, vitaminer og naturlægemidler. SYMBICORT og visse andre lægemidler kan interagere med hinanden. Dette kan forårsage alvorlige bivirkninger. Fortæl det især til din læge, hvis du tager medicin mod svamp eller HIV.
Kend al den medicin, du tager. Hold en liste og vis den til din læge og apotek, hver gang du får en ny medicin.
Hvordan skal jeg bruge SYMBICORT?
Se trin-for-trin instruktionerne for brug af SYMBICORT i slutningen af denne indlægsseddel. Brug ikke SYMBICORT 4,5mcg, medmindre din læge har lært dig det, og du forstår alt. Spørg din læge eller apotek, hvis du har spørgsmål.
- Brug SYMBICORT nøjagtigt som foreskrevet. Brug ikke SYMBICORT 160mg oftere end foreskrevet. SYMBICORT kommer i 2 styrker. Din sundhedsplejerske har ordineret den styrke, der er bedst for dig. Bemærk forskellene mellem SYMBICORT og dine andre inhalationsmedicin, herunder forskellene i ordineret brug og fysisk udseende.
- Børn bør bruge SYMBICORT med en voksens hjælp, som instrueret af barnets sundhedsplejerske.
- SYMBICORT 160mg bør tages hver dag som 2 sug om morgenen og 2 sug om aftenen med ca. 12 timers mellemrum.
- Hvis du glemmer en dosis SYMBICORT 160 mg, skal du tage din næste dosis på samme tidspunkt, som du normalt gør.
- Skyl munden med vand og spyt vandet ud efter hver dosis (2 pust) af SYMBICORT. Slug ikke vandet. Dette vil bidrage til at mindske chancen for at få en svampeinfektion (trøske) i mund og svælg.
- Hvis du tager for meget SYMBICORT, skal du straks ringe til din læge eller gå til den nærmeste skadestue, hvis du har nogle usædvanlige symptomer, såsom forværret åndenød, brystsmerter, øget puls eller rysten.
- Spray ikke SYMBICORT 4,5mcg i dine øjne. Hvis du ved et uheld får SYMBICORT 160mg i dine øjne, skal du skylle øjnene med vand, og hvis rødmen eller irritationen fortsætter, skal du kontakte din læge.
- Du må ikke ændre eller stoppe nogen form for medicin, der bruges til at kontrollere eller behandle dine vejrtrækningsproblemer. Din læge vil ændre din medicin efter behov.
- Mens du bruger SYMBICORT 2 gange dagligt, må du af en eller anden grund ikke bruge anden medicin, der indeholder en LABA. Spørg din sundhedsplejerske eller apotekspersonalet, hvis nogen af dine andre lægemidler er LABA-medicin.
- SYMBICORT 4,5mcg lindrer ikke pludselige symptomer. Hav altid en redningsinhalator medicin med dig til at behandle pludselige symptomer. Hvis du ikke har en redningsinhalator, skal du ringe til din læge for at få en ordineret til dig.
- Ring til din sundhedsudbyder eller få lægehjælp med det samme, hvis:
- dine vejrtrækningsproblemer forværres med SYMBICORT.
- du skal bruge din redningsinhalator medicin oftere end normalt.
- din redningsinhalator medicin virker ikke så godt for dig til at lindre symptomer.
- dine peak flow meter resultater falder. Din sundhedsplejerske vil fortælle dig de tal, der passer til dig.
- dine symptomer forbedres ikke efter at have brugt SYMBICORT 160mg regelmæssigt i 1 uge.
Hvad er de mulige bivirkninger af SYMBICORT?
SYMBICORT 4,5mcg kan forårsage alvorlige bivirkninger, herunder:
- Brug af for meget af en LABA-medicin kan forårsage:
- brystsmerter
- øget blodtryk
- en hurtig og uregelmæssig hjerterytme
- hovedpine
- rysten
- nervøsitet
- Svampeinfektion i din mund eller svælg (trøske). Skyl munden med vand uden at synke efter brug af SYMBICORT 4,5mcg for at hjælpe med at reducere din chance for at få trøske.
- Lungebetændelse og andre nedre luftvejsinfektioner. Mennesker med KOL har større chance for at få lungebetændelse og andre lungeinfektioner. Inhalerede kortikosteroider kan øge chancen for at få lungebetændelse. Ring til din læge, hvis du bemærker nogle af disse symptomer:
- stigning i slim (sputum) produktion
- ændring i slimfarve
- feber
- kuldegysninger
- øget hoste
- øgede vejrtrækningsproblemer
- Effekter på immunsystemet og en større chance for infektioner. Fortæl din læge om eventuelle tegn på infektion såsom:
- feber
- smerte
- kropssmerter
- kuldegysninger
- træthedsfornemmelse
- kvalme
- opkastning
- Binyrebarkinsufficiens. Binyrebarkinsufficiens er en tilstand, hvor binyrerne ikke danner nok steroidhormoner. Dette kan ske, når du holder op med at tage orale kortikosteroidmedicin og begynder at inhalere kortikosteroidmedicin.
- Øget hvæsen lige efter indtagelse af SYMBICORT. Hav altid en redningsinhalator med dig til at behandle pludselig hvæsen.
- Alvorlige allergiske reaktioner, herunder udslæt, nældefeber, hævelse af ansigt, mund og tunge og vejrtrækningsproblemer. Ring til din læge eller få akut lægehjælp, hvis du får symptomer på en alvorlig allergisk reaktion.
- Lavere knoglemineraltæthed. Dette kan ske hos mennesker, der har en høj chance for lav knoglemineraltæthed (osteoporose). Din læge bør tjekke dig for dette under behandling med SYMBICORT.
- Langsom vækst hos børn. Et barns vækst bør kontrolleres regelmæssigt, mens du bruger SYMBICORT.
- Øjenproblemer, herunder glaukom og grå stær. Du bør have regelmæssige øjenundersøgelser, mens du bruger SYMBICORT.
- Hævelse af dine blodkar. Dette kan ske hos personer med astma. Fortæl din læge med det samme, hvis du har:
- en følelse af nåle eller
- influenzalignende symptomer følelsesløshed i dine arme eller ben
- smerter og hævelse af bihulerne
- udslæt
- Fald i blodets kaliumniveau (hypokalæmi).
- Stigning i blodsukkerniveauet (hyperglykæmi).
De mest almindelige bivirkninger af SYMBICORT omfatter:
Mennesker med astma:
- irritation i halsen
- hovedpine
- øvre luftvejsinfektion
- smerter i halsen
- betændelse i slimhinderne i bihulerne
- influenza (bihulebetændelse)
- tilstoppet næse
- rygsmerte
- opkastning
- ubehag i maven
- trøske i mund og svælg. Skyl munden med vand uden at synke efter brug for at forhindre trøske
Mennesker med KOL:
- irritation i halsen.
- trøske i mund og svælg. Skyl munden med vand uden at synke efter brug for at forhindre trøske.
- infektion og betændelse i slimhinderne i bronkierne (bronkitis).
- betændelse i slimhinder i bihulerne (bihulebetændelse).
- øvre luftvejsinfektion.
Fortæl din læge om enhver bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af SYMBICORT.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Du kan også indberette bivirkninger til AstraZeneca på 1-800-236-9933.
Hvordan skal jeg opbevare SYMBICORT?
- Opbevar SYMBICORT ved stuetemperatur mellem 68°F til 77°F (20°C til 25°C).
- Opbevar SYMBICORT med mundstykket nede.
- Indholdet af din SYMBICORT-beholder er under pres. Du må ikke punktere eller smide beholderen ind i en ild eller et forbrændingsanlæg. Brug eller opbevar det ikke i nærheden af varme eller åben ild. Opbevaring over 120°F kan få beholderen til at briste.
- Smid SYMBICORT 160mg væk, når tælleren når nul ("0") eller 3 måneder efter du har taget SYMBICORT ud af folieposen, alt efter hvad der kommer først.
- Opbevar SYMBICORT 4,5mcg og al medicin utilgængeligt for børn.
Generel information om sikker og effektiv brug af SYMBICORT.
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en patientinformationsfolder. Brug ikke SYMBICORT 4,5mcg til en tilstand, som den ikke er ordineret til. Giv ikke SYMBICORT til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Du kan bede din læge eller apotek om oplysninger om SYMBICORT 4,5mcg, der er skrevet til sundhedspersonale.
Hvad er ingredienserne i SYMBICORT 4,5mcg?
Aktive ingredienser: mikroniseret budesonid og mikroniseret formoterolfumaratdihydrat
Inaktive ingredienser: hydrofluroalkan (HFA 227), povidon K25 USP og polyethylenglycol 1000 NF
Brugsanvisning
SYMBICORT (SIM-bi-kort)(budesonid 80 mcg og formoterolfumarat dihydrat 4,5 mcg) Inhalation Aerosol
SYMBICORT (SIM-bi-kort) (budesonid 160 mcg og formoterolfumarat dihydrat 4,5 mcg) Inhalation Aerosol
figur 1  Oprejst position
Oprejst position
Sådan bruges SYMBICORT
Følg instruktionerne nedenfor for at bruge SYMBICORT. Du vil indånde (inhalere) medicinen. Spørg lægen eller apoteket, hvis du har spørgsmål.
Klargøring af din SYMBICORT-inhalator til brug
Figur 2 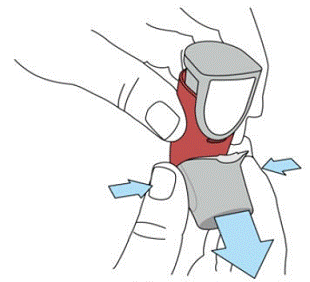
5. Spæd din SYMBICORT-inhalator
Før du bruger SYMBICORT første gang, skal du prime den. For at spæde SYMBICORT 160mg skal du holde den i oprejst position. Se figur 1. Ryst SYMBICORT 4,5 mcg inhalatoren godt i 5 sekunder. Hold din SYMBICORT 160mg inhalator vendt væk fra dig, og tryk fast og helt ned på toppen af tælleren på SYMBICORT 160mg inhalatoren for at frigive en testspray. Ryst det derefter igen i 5 sekunder, og slip endnu en testspray. Din SYMBICORT 160mg inhalator er nu klaret og klar til brug. Når du har primet SYMBICORT-inhalatoren for første gang, vil tælleren vise enten 120 eller 60, afhængigt af hvilken størrelse du har fået.
Hvis du ikke bruger din SYMBICORT-inhalator i mere end 7 dage, eller hvis du taber den, skal du prime igen.
Måder at holde SYMBICORT 160mg inhalatoren til brug
Figur 3 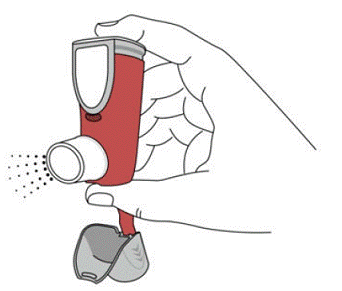
ELLER
Figur 4 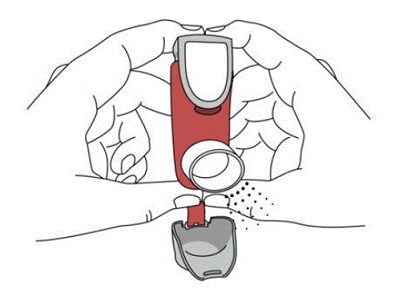
Brug af din SYMBICORT-inhalator
6. Ryst din SYMBICORT 160mg inhalator godt i 5 sekunder. Fjern mundstykkets dæksel. Kontroller mundstykket for fremmedlegemer.
7. Træk vejret helt ud (ånder ud). Hold SYMBICORT-inhalatoren op til munden. Placer det hvide mundstykke helt ind i din mund og luk dine læber omkring det. Sørg for, at SYMBICORT 4,5 mcg-inhalatoren står oprejst, og at mundstykkets åbning peger mod bagsiden af din hals (se figur 5).
Figur 5 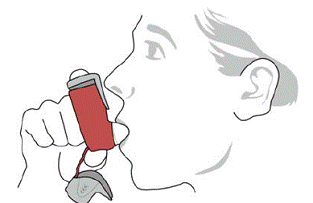
8. Træk vejret dybt og langsomt ind (indånd) gennem munden. Tryk fast og helt ned på toppen af tælleren på SYMBICORT-inhalatoren for at frigive medicinen (se figur 3 og 4).
9. Fortsæt med at trække vejret ind (indånd) og hold vejret i cirka 10 sekunder, eller så længe det er behageligt. Før du trækker vejret ud (ånder ud), skal du slippe fingeren fra toppen af disken. Hold SYMBICORT-inhalatoren oprejst og tag den ud af munden.
10. Ryst SYMBICORT-inhalatoren igen i 5 sekunder, og gentag trin 7 til 9.
Efter brug af din SYMBICORT-inhalator
11. Efter brug lukkes mundstykkedækslet ved at trykke, indtil det klikker på plads.
12. Når du er færdig med at tage SYMBICORT (2 pust), skal du skylle munden med vand. Spyt vandet ud. Må ikke sluge det.
Læser tælleren
- Pilen på tælleren øverst på SYMBICORT-inhalatoren peger på antallet af inhalationer (pust) tilbage i din inhalator.
TÆLLER 
- Tælleren tæller ned, hver gang du slipper et sug af medicin (enten når du spæder din SYMBICORT-inhalator eller når du tager medicinen).
- Når pilen på tælleren nærmer sig 20, vil du bemærke begyndelsen af et gult område, der fortæller dig, at det er tid til at ringe til din læge for at få genopfyldning.
TÆLLER 
- Det er vigtigt, at du er opmærksom på antallet af inhalationer (pust) tilbage i din SYMBICORT 160mg inhalator ved at læse tælleren. Smid SYMBICORT væk, når tælleren viser nul ("0") eller 3 måneder efter du har taget din SYMBICORT 160 mg inhalator ud af folieposen, alt efter hvad der kommer først. Din SYMBICORT-inhalator føles muligvis ikke tom, og den kan fortsætte med at fungere, men du vil ikke få den rigtige mængde medicin, hvis du bliver ved med at bruge den. Brug en ny SYMBICORT-inhalator og følg instruktionerne for priming (se instruktion 5 ovenfor).
Sådan rengøres din SYMBICORT-inhalator
Rengør det hvide mundstykke på din SYMBICORT 4,5 mcg inhalator hver 7. dag. Sådan rengøres mundstykket:
- Fjern det grå mundstykkedæksel
- Tør indersiden og ydersiden af den hvide mundstykkeåbning af med en ren, tør klud
- Sæt mundstykkedækslet på igen
- Læg ikke SYMBICORT-inhalatoren i vand
- Forsøg ikke at skille din ad SYMBICORT inhalator
Denne patientinformation og brugsanvisning er godkendt af US Food and Drug Administration.
