Pulmicort 100mcg, 200mcg Budesonide Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Pulmicort 100mcg Turbuhaler, og hvordan bruges det?
Pulmicort 100mcg Turbuhaler er en receptpligtig medicin, der bruges til at behandle symptomerne på astma. Pulmicort 100mcg Turbuhaler kan bruges alene eller sammen med anden medicin.
Pulmicort Turbuhaler tilhører en klasse af lægemidler kaldet kortikosteroider, inhalationsmidler.
Det vides ikke, om Pulmicort Turbuhaler er sikkert og effektivt til børn under 1 år.
Hvad er de mulige bivirkninger af Pulmicort 200mcg Turbuhaler?
Pulmicort 100mcg Turbuhaler kan forårsage alvorlige bivirkninger, herunder:
- nældefeber,
- åndedrætsbesvær,
- hævelse af dit ansigt, læber, tunge eller hals,
- usædvanlig træthed,
- synsproblemer,
- let blå mærker eller blødning,
- hævet ansigt,
- usædvanlig hårvækst,
- humørsvingninger,
- depression,
- humørsvingninger,
- agitation,
- muskelsvaghed eller smerte,
- tyndere hud,
- langsom sårheling, og
- øget tørst eller vandladning
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Pulmicort 100mcg Turbuhaler omfatter:
- tør, irriteret eller ondt i halsen,
- hæshed,
- stemmeændringer,
- dårlig smag i munden,
- løbende eller tilstoppet næse, og
- næseblod
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Pulmicort Turbuhaler. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Kun til oral indånding.
BESKRIVELSE
Budesonid, den aktive komponent i PULMICORT TURBUHALER (budesonid) 200 mcg, er et kortikosteroid kemisk betegnet (RS)-11β, 16α, 17,21-Tetrahydroxypregna-1,4-dien-3,20-dion cyklisk 16,17 acetal med butyraldehyd. Budesonid leveres som en blanding af to epimerer (22R og 22S). Den empiriske formel for budesonid er C25H34O6 og dens molekylvægt er 430,5. Dens strukturformel er:
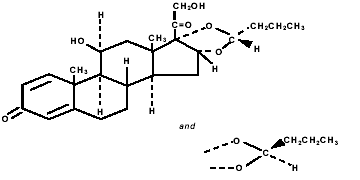
Budesonid er et hvidt til råhvidt, smagløst, lugtfrit pulver, der er praktisk talt uopløseligt i vand og i heptan, tungtopløseligt i ethanol og let opløseligt i chloroform. Dens fordelingskoefficient mellem octanol og vand ved pH 7,4 er 1,6 x 103.
PULMICORT 100mcg TURBUHALER (budesonid) er en inhalationsdrevet multi-dosis tørpulverinhalator, der kun indeholder mikroniseret budesonid. Hver aktivering af PULMICORT 100 mcg TURBUHALER giver 200 mcg budesonid pr. afmålt dosis, som afgiver ca. 160 mcg budesonid fra mundstykket (baseret på in vitro-test ved 60 l/min i 2 sek.).
In vitro-tests har vist, at dosistilførselen for PULMICORT 100mcg TURBUHALER (budesonid) er væsentligt afhængig af luftstrømmen gennem enheden. Patientfaktorer såsom inspiratoriske flowhastigheder vil også påvirke den dosis, der leveres til lungerne på patienter i faktisk brug (se Patientens brugsanvisning ). Hos voksne patienter med astma (gennemsnitlig FEV1 2,9 L [0,8 - 5,1 L]) var den gennemsnitlige maksimale inspiratoriske flow (PIF) gennem PULMICORT TURBUHALER (budesonid) 78 (40-111) L/min. Lignende resultater (gennemsnitlig PIF 82 [43-125] L/min) blev opnået hos astmatiske børn (6 til 15 år, gennemsnitlig FEV1 2,1 L [0,9 - 5,4 L]). Patienter bør omhyggeligt instrueres i brugen af dette lægemiddel for at sikre optimal dosisafgivelse.
INDIKATIONER
PULMICORT TURBUHALER (budesonid) er indiceret til vedligeholdelsesbehandling af astma som profylaktisk behandling hos voksne og pædiatriske patienter i alderen seks år eller ældre. Det er også indiceret til patienter, der har behov for oral kortikosteroidbehandling mod astma. Mange af disse patienter kan muligvis reducere eller eliminere deres behov for orale kortikosteroider over tid.
PULMICORT 100mcg TURBUHALER (budesonid) er IKKE indiceret til lindring af akut bronkospasme.
DOSERING OG ADMINISTRATION
PULMICORT 200 mcg TURBUHALER (budesonid) bør indgives oralt til astmatiske patienter på 6 år og derover. Individuelle patienter vil opleve en variabel debut og grad af symptomlindring. Generelt har PULMICORT TURBUHALER (budesonid) en relativt hurtig virkningsstart for et inhaleret kortikosteroid. Forbedring af astmakontrol efter inhaleret administration af PULMICORT 200mcg TURBUHALER (budesonid) kan forekomme inden for 24 timer efter påbegyndelse af behandlingen, selvom maksimal fordel muligvis ikke opnås inden for 1 til 2 uger eller længere. Sikkerheden og effekten af PULMICORT TURBUHALER (budesonid), når det administreres i overskridelse af anbefalede doser, er ikke blevet fastslået.
Den anbefalede startdosis og den højest anbefalede dosis af PULMICORT TURBUHALER (budesonid), baseret på tidligere astmabehandling, er angivet i følgende tabel.
*Hos patienter med let til moderat astma, som er velkontrolleret med inhalerede kortikosteroider, kan dosering med PULMICORT 100 mcg TURBUHALER (budesonid) 200 mcg eller 400 mcg én gang dagligt overvejes. PULMICORT 200mcg TURBUHALER (budesonid) kan administreres én gang dagligt enten om morgenen eller om aftenen.
Hvis behandlingen én gang dagligt med PULMICORT 200mcg TURBUHALER (budesonid) ikke giver tilstrækkelig kontrol over astmasymptomer, bør den samlede daglige dosis øges og/eller administreres som en delt dosis.
Patienter fastholdt på kroniske orale kortikosteroider
Indledningsvis bør PULMICORT TURBUHALER (budesonid) anvendes samtidig med patientens sædvanlige vedligeholdelsesdosis af systemisk kortikosteroid. Efter ca. en uge påbegyndes gradvis seponering af det systemiske kortikosteroid ved at reducere den daglige eller alternative daglige dosis. Den næste reduktion foretages efter et interval på en eller to uger, afhængigt af patientens respons. Generelt bør disse reduktioner ikke overstige 2,5 mg prednison eller tilsvarende. En langsom tilbagetrækningshastighed anbefales kraftigt. Under reduktion af orale kortikosteroider skal patienter overvåges omhyggeligt for astma-ustabilitet, herunder objektive målinger af luftvejsfunktion, og for binyrebarkinsufficiens (se ADVARSLER ). Under abstinenser kan nogle patienter opleve symptomer på systemisk kortikosteroidabstinenser, f.eks. led- og/eller muskelsmerter, træthed og depression, på trods af vedligeholdelse eller endog forbedring af lungefunktionen. Sådanne patienter bør opmuntres til at fortsætte med PULMICORT TURBUHALER (budesonid), men bør overvåges for objektive tegn på binyrebarkinsufficiens. Hvis der opstår tegn på binyrebarkinsufficiens, bør de systemiske kortikosteroiddoser øges midlertidigt, og derefter bør seponeringen fortsætte langsommere. I perioder med stress eller et alvorligt astmaanfald kan transferpatienter have behov for supplerende behandling med systemiske kortikosteroider.
BEMÆRK: Hos alle patienter er det ønskeligt at titrere til den laveste effektive dosis, når først astmastabilitet er opnået.
Brugsanvisning
Illustreret patientvejledning til brug medfølger hver pakke med PULMICORT 200mcg TURBUHALER (budesonid).
Patienter skal instrueres i at prime PULMICORT TURBUHALER (budesonid) før den første brug, og instrueres i at inhalere dybt og kraftigt, hver gang enheden bruges. Det anbefales også at skylle munden efter indånding.
HVORDAN LEVERET
PULMICORT TURBUHALER (budesonid) består af en række samlede plastdetaljer, hvor hoveddelene er doseringsmekanismen, opbevaringsenheden til lægemiddelstof og mundstykket. Inhalatoren er beskyttet af et hvidt ydre rørformet dæksel skruet på inhalatoren. Inhalatorens krop er hvid, og drejegrebet er brunt. Følgende ordlyd er trykt på grebet med hævet bogstav, "Pulmicort™ 200 mcg". TURBUHALER-inhalatoren kan ikke genopfyldes og skal kasseres, når den er tom.
PULMICORT TURBUHALER (budesonid) fås som 200 mcg/dosis, 200 doser (NDC 0186-0915-42) og har en målvægt på 104 mg.
Når der er 20 doser tilbage i PULMICORT 200mcg TURBUHALER (budesonid), vises et rødt mærke i indikatorvinduet. Hvis enheden bruges ud over det punkt, hvor det røde mærke vises i bunden af vinduet, kan den korrekte mængde medicin muligvis ikke opnås. Enheden skal kasseres.
Opbevares med dækslet strammet på et tørt sted ved kontrolleret stuetemperatur 20-25°C (68-77°F) [se USP]. Opbevares utilgængeligt for børn.
Alle varemærker tilhører AstraZeneca-koncernen. ©AstraZeneca 2001, 2006. Fremstillet for: AstraZeneca LP, Wilmington, DE 19850 Af: AstraZeneca AB, Södertälje, Sverige 33020-00. Rev. 10/06. FDA Rev. dato: 20/8/2007
BIVIRKNINGER
Følgende bivirkninger blev rapporteret hos patienter behandlet med PULMICORT 100mcg TURBUHALER (budesonid).
Hyppigheden af almindelige bivirkninger er baseret på dobbeltblindede, placebokontrollerede amerikanske kliniske forsøg, hvor 1116 voksne og pædiatriske patienter i alderen 6-70 år (472 kvinder og 644 mænd) blev behandlet med PULMICORT TURBUHALER (budesonid) (200 til 800) mcg to gange dagligt i 12 til 20 uger) eller placebo.
Følgende tabel viser forekomsten af bivirkninger hos patienter, der tidligere har fået bronkodilatatorer og/eller inhalerede kortikosteroider i amerikansk kontrollerede kliniske forsøg. Denne population omfattede 232 mandlige og 62 kvindelige pædiatriske patienter (alder 6 til 17 år) og 332 mandlige og 331 kvindelige voksne patienter (alder 18 år og ældre).
Bivirkninger med ≥ 3 % forekomst rapporteret af patienter på PULMICORT 100mcg TURBUHALER (budesonid)
Tabellen ovenfor inkluderer alle hændelser (uanset om de anses for lægemiddelrelaterede eller ikke-lægemiddelrelaterede af investigatorerne), der forekom med en frekvens på ≥3 % i en PULMICORT TURBUHALER (budesonid) gruppe og var mere almindelige end i placebogruppen. Ved overvejelse af disse data bør den øgede gennemsnitlige eksponeringsvarighed for PULMICORT 200mcg TURBUHALER (budesonid) patienter tages i betragtning.
Følgende andre bivirkninger forekom i disse kliniske forsøg med PULMICORT 100mcg TURBUHALER (budesonid) med en incidens på 1 til 3% og var mere almindelige på PULMICORT 200mcg TURBUHALER (budesonid) end på placebo.
Kroppen som helhed: nakke smerter
Kardiovaskulær: synkope
Fordøjelse: mavesmerter, mundtørhed, opkastning
Metabolisk og ernæringsmæssig: vægtøgning
Muskuloskeletale: fraktur, myalgi
Nervøs: hypertoni, migræne
Blodplader, blødning og størkning: ekkymose
Psykiatrisk: søvnløshed
Modstandsmekanismer: infektion
Særlige sanser: smagsforstyrrelse
et 20-ugers forsøg med voksne astmatikere, som tidligere havde brug for orale kortikosteroider, blev virkningerne af PULMICORT TURBUHALER (budesonid) 400 mcg to gange dagligt (N=53) og 800 mcg to gange dagligt (N=53) sammenlignet med placebo (N=53) ) om hyppigheden af rapporterede bivirkninger. Bivirkninger, uanset om de anses for lægemiddelrelaterede eller ikke-lægemiddelrelaterede af efterforskerne, rapporteret hos mere end fem patienter i PULMICORT 200mcg TURBUHALER (budesonid)-gruppen, og som forekom hyppigere med PULMICORT TURBUHALER (budesonid) end placebo, er vist nedenfor ( % PULMICORT TURBUHALER (budesonid) og % placebo). Ved overvejelse af disse data bør den øgede gennemsnitlige eksponeringsvarighed for PULMICORT 200 mcg TURBUHALER (budesonid) patienter (78 dage for PULMICORT TURBUHALER (budesonid) vs. 41 dage for placebo) tages i betragtning.
Patienter, der får PULMICORT TURBUHALER (budesonid) én gang dagligt
Bivirkningsprofilen for én gang daglig administration af PULMICORT 100 mcg TURBUHALER (budesonid) 200 mcg og 400 mcg og placebo blev evalueret hos 309 voksne astmatiske patienter i en 18-ugers undersøgelse. Undersøgelsespopulationen omfattede både patienter, der tidligere var behandlet med inhalerede kortikosteroider, og patienter, der ikke tidligere fik kortikosteroidbehandling. Der var ingen klinisk relevant forskel i mønsteret af bivirkninger efter administration én gang dagligt af PULMICORT 200 mcg TURBUHALER (budesonid) sammenlignet med dosering to gange dagligt.
Pædiatriske undersøgelser: et 12-ugers placebo-kontrolleret forsøg med 404 pædiatriske patienter i alderen 6 til 18 år, som tidligere har fået inhalerede kortikosteroider, var hyppigheden af bivirkninger for hver alderskategori (6 til 12 år, 13 til 18 år) sammenlignelig for PULMICORT TURBUHALER (budesonid) (ved 100, 200 og 400 mcg to gange dagligt) og placebo. Der var ingen klinisk relevante forskelle i mønsteret eller sværhedsgraden af bivirkninger hos børn sammenlignet med dem, der blev rapporteret hos voksne.
Rapporter om uønskede hændelser fra andre kilder: Sjældne bivirkninger rapporteret i den publicerede litteratur eller fra verdensomspændende markedsføringserfaring med enhver formulering af inhaleret budesonid omfatter: øjeblikkelige og forsinkede overfølsomhedsreaktioner, herunder udslæt, kontaktdermatitis, nældefeber, angioødem og bronkospasme; symptomer på hypokorticisme og hyperkorticisme; glaukom, grå stær; psykiatriske symptomer, herunder depression, aggressive reaktioner, irritabilitet, angst og psykose.
DRUGSINTERAKTIONER
kliniske undersøgelser har samtidig administration af budesonid og andre lægemidler, der almindeligvis anvendes til behandling af astma, ikke resulteret i en øget hyppighed af bivirkninger. Hovedmetabolismen af budesonid såvel som andre kortikosteroider er via cytokrom P450 (CYP) isoenzym 3A4 (CYP3A4). Efter oral administration af ketoconazol, en potent hæmmer af CYP3A4, steg den gennemsnitlige plasmakoncentration af oralt administreret budesonid. Samtidig administration af andre kendte hæmmere af CYP3A4 (f.eks. itraconazol, clarithromycin, erythromycin osv.) kan hæmme metabolismen af og øge den systemiske eksponering for budesonid. Der skal udvises forsigtighed, når budesonid administreres sammen med langtidsholdigt ketoconazol og andre kendte CYP3A4-hæmmere.
ADVARSLER
Særlig forsigtighed er nødvendig for patienter, der er overført fra systemisk aktive kortikosteroider til PULMICORT 200mcg TURBUHALER (budesonid), fordi dødsfald på grund af binyrebarkinsufficiens er forekommet hos astmatiske patienter under og efter overgang fra systemiske kortikosteroider til mindre systemisk tilgængelige inhalationskortikosteroider. Efter seponering fra systemiske kortikosteroider kræves der et antal måneder til genopretning af hypothalamus-hypofyse-binyrefunktionen (HPA).
Patienter, der tidligere er blevet holdt på 20 mg eller mere pr. dag af prednison (eller tilsvarende), kan være mest modtagelige, især når deres systemiske kortikosteroider er blevet næsten fuldstændigt seponeret. I denne periode med HPA-undertrykkelse kan patienter udvise tegn og symptomer på binyrebarkinsufficiens, når de udsættes for traumer, kirurgi eller infektion (især gastroenteritis) eller andre tilstande forbundet med alvorligt elektrolyttab. Selvom PULMICORT TURBUHALER (budesonid) kan give kontrol over astmasymptomer under disse episoder, tilfører den i anbefalede doser mindre end normale fysiologiske mængder af glukokortikoid systemisk og giver IKKE den mineralokortikoid aktivitet, der er nødvendig for at klare disse nødsituationer.
perioder med stress eller et alvorligt astmaanfald skal patienter, der er blevet seponeret fra systemiske kortikosteroider, instrueres i at genoptage orale kortikosteroider (i store doser) straks og kontakte deres læge for yderligere instruktion. Disse patienter bør også instrueres i at bære et medicinsk identifikationskort, der angiver, at de kan have behov for supplerende systemiske kortikosteroider i perioder med stress eller et alvorligt astmaanfald.
Patienter, der har behov for orale kortikosteroider, bør vænnes langsomt fra systemisk kortikosteroidbrug efter overgang til PULMICORT 100mcg TURBUHALER (budesonid). Lungefunktion (FEV1 eller AM PEF), brug af beta-agonister og astmasymptomer bør overvåges nøje under seponering af orale kortikosteroider. Ud over at overvåge astma-tegn og -symptomer skal patienterne observeres for tegn og symptomer på binyrebarkinsufficiens, såsom træthed, træthed, svaghed, kvalme og opkastning og hypotension.
Overførsel af patienter fra systemisk kortikosteroidbehandling til PULMICORT 200mcg TURBUHALER (budesonid) kan afsløre allergiske tilstande, der tidligere er undertrykt af den systemiske kortikosteroidbehandling, f.eks. rhinitis, conjunctivitis, arthritis, eosinofile tilstande og eksem (se DOSERING OG ADMINISTRATION ).
Patienter, der er på medicin, der undertrykker immunsystemet, er mere modtagelige for infektion end raske personer. Skoldkopper og mæslinger kan for eksempel have et mere alvorligt eller endda dødeligt forløb hos modtagelige pædiatriske patienter eller voksne på immunsuppressive doser af kortikosteroider. Hos pædiatriske eller voksne patienter, som ikke har haft disse sygdomme, skal der udvises særlig forsigtighed for at undgå eksponering. Hvordan dosis, vej og varighed af kortikosteroidadministration påvirker risikoen for at udvikle en spredt infektion vides ikke. Bidraget fra den underliggende sygdom og/eller tidligere kortikosteroidbehandling til risikoen er heller ikke kendt. Hvis eksponeret, kan behandling med varicella zoster immunglobulin (VZIG) eller poolet intravenøst immunglobulin (IVIG), alt efter hvad der er relevant, være indiceret. Ved eksponering for mæslinger kan profylakse med puljet intramuskulært immunglobulin (IG) være indiceret. (Se de respektive indlægssedler for fuldstændig VZIG- og IG-ordinationsinformation.) Hvis der udvikles skoldkopper, kan behandling med antivirale midler overvejes.
PULMICORT 200mcg TURBUHALER (budesonid) er ikke en bronkodilatator og er ikke indiceret til hurtig lindring af bronkospasmer eller andre akutte episoder af astma.
Som med anden inhaleret astmamedicin kan bronkospasme, med en øjeblikkelig stigning i hvæsen, forekomme efter dosering. Hvis der opstår bronkospasme efter dosering med PULMICORT TURBUHALER (budesonid), skal det behandles straks med en hurtigtvirkende inhaleret bronkodilatator. Behandling med PULMICORT TURBUHALER (budesonid) bør seponeres og alternativ behandling påbegyndes.
Patienter bør instrueres i at kontakte deres læge med det samme, når episoder med astma, der ikke reagerer på deres sædvanlige doser af bronkodilatatorer, opstår under behandling med PULMICORT TURBUHALER (budesonid). Under sådanne episoder kan patienter have behov for behandling med orale kortikosteroider.
FORHOLDSREGLER
Generel
Under abstinenser fra orale kortikosteroider kan nogle patienter opleve symptomer på systemisk aktiv kortikosteroidabstinens, f.eks. led- og/eller muskelsmerter, træthed og depression, på trods af vedligeholdelse eller endog forbedring af åndedrætsfunktionen (se DOSERING OG ADMINISTRATION ).
Hos responderende patienter kan PULMICORT TURBUHALER (budesonid) tillade kontrol af astmasymptomer med mindre undertrykkelse af HPA-aksefunktionen end terapeutisk ækvivalente orale doser af prednison. Da budesonid absorberes i kredsløbet og kan være systemisk aktivt, kan de gavnlige virkninger af PULMICORT 100mcg TURBUHALER (budesonid) til at minimere HPA-dysfunktion kun forventes, når de anbefalede doser ikke overskrides, og individuelle patienter titreres til den laveste effektive dosis. Da der eksisterer individuel følsomhed over for virkninger på kortisolproduktion, bør læger overveje denne information, når de ordinerer PULMICORT 100mcg TURBUHALER (budesonid).
På grund af muligheden for systemisk absorption af inhalerede kortikosteroider, bør patienter behandlet med PULMICORT 200mcg TURBUHALER (budesonid) observeres omhyggeligt for tegn på systemiske kortikosteroideffekter. Der bør udvises særlig forsigtighed ved at observere patienter postoperativt eller i perioder med stress for tegn på utilstrækkelig binyrerespons.
Det er muligt, at systemiske kortikosteroidvirkninger såsom hyperkorticisme, nedsat knoglemineraltæthed og binyrebarksuppression kan forekomme hos et lille antal patienter, især ved højere doser. Hvis sådanne ændringer forekommer, bør PULMICORT 100mcg TURBUHALER (budesonid) reduceres langsomt, i overensstemmelse med accepterede procedurer til behandling af astmasymptomer og til nedtrapning af systemiske steroider.
Oralt inhalerede kortikosteroider, inklusive budesonid, kan forårsage en reduktion i væksthastigheden, når de administreres til pædiatriske patienter. En reduktion i væksthastigheden kan forekomme som følge af utilstrækkelig kontrol af astma eller brug af kortikosteroider til behandling. De potentielle virkninger af forlænget behandling på væksthastigheden bør afvejes i forhold til de opnåede kliniske fordele og risici forbundet med alternative behandlinger. For at minimere de systemiske virkninger af oralt inhalerede kortikosteroider, inklusive PULMICORT 200mcg TURBUHALER (budesonid), bør hver patient titreres til sin laveste effektive dosis (se FORHOLDSREGLER, Pædiatrisk brug ).
Selvom patienter i kliniske forsøg har modtaget PULMICORT TURBUHALER (budesonid) på en kontinuerlig basis i perioder på 1 til 2 år, er de langsigtede lokale og systemiske virkninger af PULMICORT 200mcg TURBUHALER (budesonid) hos mennesker ikke fuldstændigt kendte. Specielt er virkningerne af kronisk brug af PULMICORT TURBUHALER (budesonid) på udviklingsmæssige eller immunologiske processer i munden, svælget, luftrøret og lungerne ukendte.
I kliniske forsøg med PULMICORT TURBUHALER (budesonid) forekom lokaliserede infektioner med Candida albicans i munden og svælget hos nogle patienter. Disse infektioner kan kræve behandling med passende antifungal behandling og/eller seponering af behandling med PULMICORT TURBUHALER (budesonid).
Inhalerede kortikosteroider bør anvendes med forsigtighed, hvis overhovedet, til patienter med aktiv eller hvilende tuberkuloseinfektion i luftvejene, ubehandlede systemiske svampe-, bakterie-, virus- eller parasitinfektioner eller okulær herpes simplex.
Sjældne tilfælde af glaukom, øget intraokulært tryk og grå stær er blevet rapporteret efter inhaleret administration af kortikosteroider.
Information til patienter
Patienter, der behandles med PULMICORT TURBUHALER (budesonid), skal modtage følgende information og instruktioner. Denne information er beregnet til at hjælpe patienten med sikker og effektiv brug af medicinen. Det er ikke en afsløring af alle mulige negative eller tilsigtede virkninger. For korrekt brug af PULMICORT 200mcg TURBUHALER (budesonid) og for at opnå maksimal forbedring, bør patienten læse og følge den medfølgende Patientens instruktioner til brug forsigtigt.
- Patienter bør bruge PULMICORT 200mcg TURBUHALER (budesonid) med regelmæssige intervaller som anvist, da dets effektivitet afhænger af regelmæssig brug. Patienten bør ikke ændre den ordinerede dosis, medmindre lægen har rådet det til at gøre det.
- Patienter bør informeres om, at PULMICORT 100mcg TURBUHALER (budesonid) ikke er en bronkodilatator og ikke er beregnet til at behandle akutte eller livstruende astmaepisoder.
- Patienterne skal informeres om, at effektiviteten af PULMICORT 100mcg TURBUHALER (budesonid) afhænger af korrekt brug af apparatet og inhalations-administrerende teknik:
- 1. PULMICORT TURBUHALER (budesonid) skal være i oprejst position (mundstykket øverst) under påfyldning for at give den korrekte dosis.
- 2. PULMICORT 100mcg TURBUHALER (budesonid) skal primes, når enheden tages i brug første gang. For at spæde enheden skal den holdes i oprejst position, og det brune greb skal drejes helt til højre og derefter drejes helt til venstre, indtil det klikker. Gentage.
- 3. For at påfylde den første dosis skal grebet drejes helt til højre og helt til venstre, indtil det klikker.
- 4. Efter den første dosis er det ikke nødvendigt at prime enheden. Den skal dog læsses i opretstående stilling umiddelbart før brug som beskrevet ovenfor.
- 5. Patienter bør rådes til ikke at ryste inhalatoren.
- Patienter skal placere mundstykket mellem læberne og inhalere kraftigt og dybt. Pulveret leveres derefter til lungerne.
- Patienter bør ikke ånde ud gennem PULMICORT TURBUHALER (budesonid).
- På grund af den lille mængde pulver kan patienten muligvis ikke smage eller mærke tilstedeværelsen af medicin, der trænger ind i lungerne, når han inhalerer fra TURBUHALER-inhalatoren. Denne manglende følelse indikerer ikke, at patienten ikke får gavn af PULMICORT TURBUHALER (budesonid).
- Patienter bør informeres om, at skylning af munden med vand uden at synke efter hver dosis kan mindske risikoen for udvikling af oral candidiasis.
- Patienterne skal instrueres i, at de vil modtage en ny PULMICORT TURBUHALER (budesonid) enhed, hver gang de genopfylder deres recept. Patienter bør rådes til at kassere hele enheden, efter at det angivne antal inhalationer er blevet brugt. Når der er 20 doser tilbage i PULMICORT TURBUHALER (budesonid), vises et rødt mærke i indikatorvinduet.
- PULMICORT TURBUHALER (budesonid) bør ikke bruges sammen med en spacer.
- Mundstykket må ikke bides eller tygges.
- Dækslet skal udskiftes sikkert efter hver åbning.
- Patienter bør til enhver tid holde PULMICORT TURBUHALER (budesonid) ren og tør.
- Patienter bør informeres om, at forbedring af astmakontrol efter inhalation af PULMICORT TURBUHALER (budesonid) kan forekomme inden for 24 timer efter påbegyndelse af behandlingen, selvom maksimal fordel muligvis ikke opnås i 1 til 2 uger eller længere. Hvis symptomerne ikke forbedres inden for den tidsramme, eller hvis tilstanden forværres, skal patienten instrueres i ikke at øge dosis, men kontakte lægen.
- Patienter, hvis systemiske kortikosteroider er blevet reduceret eller seponeret, skal instrueres i at bære et advarselskort, der angiver, at de kan have behov for supplerende systemiske kortikosteroider i perioder med stress eller et astmaanfald, der ikke reagerer på bronkodilatatorer.
- Patienter bør rådes til ikke at stoppe brugen af PULMICORT TURBUHALER (budesonid) pludseligt.
- Patienter bør advares om at undgå at blive udsat for skoldkopper eller mæslinger, og hvis de bliver udsat, skal de straks konsultere deres læge.
- Langtidsbrug af inhalerede kortikosteroider, inklusive budesonid, kan øge risikoen for nogle øjenproblemer (grå stær eller glaukom). Regelmæssige øjenundersøgelser bør overvejes.
- Kvinder, der overvejer at bruge PULMICORT TURBUHALER (budesonid), bør rådføre sig med deres læge, hvis de er gravide eller har til hensigt at blive gravide, eller hvis de ammer en baby.
- Patienter, der overvejer at bruge PULMICORT TURBUHALER (budesonid), bør rådføre sig med deres læge, hvis de er allergiske over for budesonid eller ethvert andet oralt inhaleret kortikosteroid.
- Patienter bør informere deres læge om anden medicin, de tager, da PULMICORT 100mcg TURBUHALER (budesonid) muligvis ikke er egnet under nogle omstændigheder, og lægen kan ønske at bruge en anden medicin.
Karcinogenese, mutagenese, svækkelse af fertilitet
Langtidsundersøgelser blev udført på rotter og mus ved brug af oral administration for at evaluere det karcinogene potentiale af budesonid.
et 104-ugers oralt studie med Sprague-Dawley-rotter blev der observeret en statistisk signifikant stigning i forekomsten af gliomer hos hanrotter, der fik en oral dosis på 50 mcg/kg/dag (mindre end den maksimalt anbefalede daglige inhalationsdosis hos voksne og børn på en mcg/m2 basis). Der blev ikke set tumorigenicitet hos han- og hunrotter ved respektive orale doser op til 25 og 50 mcg/kg (mindre end den maksimalt anbefalede daglige inhalationsdosis til voksne og børn på mcg/m2-basis). I yderligere to toårige undersøgelser med Fischer- og Sprague-Dawley-hanrotter forårsagede budesonid ingen gliomer ved en oral dosis på 50 mcg/kg (mindre end den maksimalt anbefalede daglige inhalationsdosis til voksne og børn på mcg/m2-basis). Hos Sprague-Dawley hanrotter forårsagede budesonid imidlertid en statistisk signifikant stigning i forekomsten af hepatocellulære tumorer ved en oral dosis på 50 mcg/kg (mindre end den maksimalt anbefalede daglige inhalationsdosis til voksne og børn på en mcg/m2 basis ). De samtidige referencekortikosteroider (prednison og triamcinolonacetonid) i disse to undersøgelser viste lignende resultater.
Der var ingen tegn på en karcinogen effekt, når budesonid blev administreret oralt i 91 uger til mus i doser på op til 200 mcg/kg/dag (mindre end den maksimalt anbefalede daglige inhalationsdosis til voksne og børn på mcg/m2-basis).
Budesonid var ikke mutagent eller klastogent i seks forskellige testsystemer: Ames Salmonella/mikrosompladetest, mikronukleustest hos mus, lymfomtest hos mus, kromosomafvigelsestest i humane lymfocytter, kønsbundet recessiv letal test i Drosophila melanogaster og DNA-reparationsanalyse hos rotter hepatocytkultur.
Hos rotter havde budesonid ingen effekt på fertiliteten ved subkutane doser op til 80 mcg/kg (mindre end den maksimalt anbefalede humane daglige inhalationsdosis på mcg/m2-basis).
Ved 20 mcg/kg/dag (mindre end den maksimalt anbefalede humane daglige inhalationsdosis på mcg/m2-basis) blev der observeret fald i moderens kropsvægtforøgelse, prænatal levedygtighed og levedygtighed af ungerne ved fødslen og under amning. Ingen sådanne effekter blev noteret ved 5 mcg/kg (mindre end den maksimalt anbefalede humane daglige inhalationsdosis hos voksne på en mcg/m2 basis).
Graviditet: Teratogene virkninger
Graviditetskategori B: Som med andre glukokortikoider producerede budesonid fostertab, nedsat vægt af hvalpen og skeletabnormiteter ved subkutane doser på 25 mcg/kg/dag hos kaniner (mindre end den maksimale anbefalede daglige inhalationsdosis til mennesker på en mcg/m2-basis) og 500 mcg/kg/dag hos rotter (ca. 3 gange den maksimalt anbefalede humane daglige inhalationsdosis på mcg/m2-basis).
Der blev ikke observeret teratogene eller embryocidale virkninger hos rotter, når budesonid blev administreret ved inhalation i doser op til 250 mcg/kg/dag (svarende til den maksimale anbefalede humane daglige inhalationsdosis på mcg/m2-basis).
Erfaring med orale kortikosteroider siden deres introduktion i farmakologiske i modsætning til fysiologiske doser tyder på, at gnavere er mere tilbøjelige til teratogene virkninger fra kortikosteroider end mennesker.
Undersøgelser af gravide kvinder har dog ikke vist, at PULMICORT TURBUHALER (budesonid) øger risikoen for abnormiteter, når det administreres under graviditet. Resultaterne fra en stor befolkningsbaseret prospektiv kohorte epidemiologisk undersøgelse, der gennemgår data fra tre svenske registre, der dækker ca. 99 % af graviditeterne fra 1995-1997 (dvs. det svenske medicinske fødselsregister; register over medfødte misdannelser; børnekardiologisk register) indikerer ingen øget risiko for medfødte misdannelser ved brug af inhaleret budesonid under tidlig graviditet. Medfødte misdannelser blev undersøgt hos 2.014 spædbørn født af mødre, der rapporterede brugen af inhaleret budesonid til astma tidligt i graviditeten (sædvanligvis 10-12 uger efter den sidste menstruation), den periode, hvor de fleste større organmisdannelser forekommer. Hyppigheden af registrerede medfødte misdannelser var ens sammenlignet med den generelle befolkningsrate (henholdsvis 3,8 % vs. 3,5 %). Efter eksponering for inhaleret budesonid svarede antallet af spædbørn født med orofaciale kløfter desuden til det forventede antal i normalpopulationen (henholdsvis 4 børn vs. 3,3).
De samme data blev brugt i en anden undersøgelse, der bragte det samlede antal til 2.534 spædbørn, hvis mødre blev udsat for inhaleret budesonid. I denne undersøgelse var frekvensen af medfødte misdannelser blandt spædbørn, hvis mødre blev udsat for inhaleret budesonid under tidlig graviditet, ikke forskellig fra frekvensen for alle nyfødte babyer i samme periode (3,6 %).
På trods af dyrefundene ser det ud til, at muligheden for fosterskader er fjern, hvis stoffet bruges under graviditeten. Ikke desto mindre, fordi undersøgelser på mennesker ikke kan udelukke muligheden for skade, bør PULMICORT TURBUHALER (budesonid) kun anvendes under graviditet, hvis det er klart nødvendigt.

Ikke-ratatogene virkninger
Hypoadrenalisme kan forekomme hos spædbørn født af mødre, der får kortikosteroider under graviditeten. Sådanne spædbørn bør observeres nøje.
Ammende mødre
Kortikosteroider udskilles i modermælk. På grund af risikoen for bivirkninger hos ammende spædbørn fra ethvert kortikosteroid, bør der tages en beslutning om, hvorvidt amningen skal afbrydes eller lægemidlet skal seponeres under hensyntagen til lægemidlets betydning for moderen. Faktiske data for budesonid mangler.
Pædiatrisk brug
Sikkerhed og effektivitet af PULMICORT 100mcg TURBUHALER (budesonid) hos pædiatriske patienter under 6 år er ikke blevet fastlagt.
Hos pædiatriske astmapatienter var hyppigheden af bivirkninger observeret med PULMICORT 100mcg TURBUHALER (budesonid) ens mellem 6- til 12-årige (N=172) sammenlignet med 13- til 17-årige aldersgruppe (N=124) .
Kontrollerede kliniske undersøgelser har vist, at oralt inhalerede kortikosteroider kan forårsage en reduktion i væksthastigheden hos pædiatriske patienter. Denne effekt er blevet observeret i fravær af laboratoriebeviser for hypothalamus-hypofyse-binyre (HPA) aksesuppression, hvilket tyder på, at væksthastighed er en mere følsom indikator for systemisk kortikosteroideksponering hos pædiatriske patienter end nogle almindeligt anvendte test af HPA-aksefunktion. De langsigtede virkninger af denne reduktion i væksthastighed forbundet med oralt inhalerede kortikosteroider, herunder indvirkningen på den endelige voksenhøjde, er ukendte. Potentialet for "indhente" vækst efter seponering af behandling med oralt inhalerede kortikosteroider er ikke blevet tilstrækkeligt undersøgt.
en undersøgelse af astmatiske børn i alderen 5-12 år havde dem, der blev behandlet med PULMICORT 200 mcg TURBUHALER (budesonid) 200 mcg to gange dagligt (n=311) en reduktion på 1,1 centimeter i vækst sammenlignet med dem, der fik placebo (n=418) kl. udgangen af et år; forskellen mellem disse to behandlingsgrupper steg ikke yderligere over tre års yderligere behandling. Ved udgangen af fire år havde børn behandlet med PULMICORT TURBUHALER (budesonid) og børn behandlet med placebo lignende væksthastigheder. Konklusionerne fra denne undersøgelse kan forvirres af den ulige brug af kortikosteroider i behandlingsgrupperne og inklusion af data fra patienter, der når puberteten i løbet af undersøgelsen.
Væksten hos pædiatriske patienter, der får oralt inhalerede kortikosteroider, inklusive PULMICORT TURBUHALER (budesonid), bør overvåges rutinemæssigt (f.eks. via stadiometri). De potentielle væksteffekter af langvarig behandling bør afvejes i forhold til opnåede kliniske fordele og risici og fordele forbundet med alternative behandlinger. For at minimere de systemiske virkninger af inhalerede kortikosteroider, inklusive PULMICORT 100mcg TURBUHALER (budesonid), bør hver patient titreres til sin laveste effektive dosis.
Geriatrisk brug
Et hundrede patienter 65 år eller ældre blev inkluderet i de amerikanske og ikke-amerikanske kontrollerede kliniske forsøg med PULMICORT 100mcg TURBUHALER (budesonid). Der var ingen forskelle i lægemidlets sikkerhed og virkning sammenlignet med dem, der blev set hos yngre patienter.
Generelt bør dosisvalg for en ældre patient være forsigtigt, sædvanligvis begyndende i den lave ende af doseringsområdet, hvilket afspejler den større hyppighed af nedsat lever-, nyre- eller hjertefunktion og af samtidig sygdom eller anden lægemiddelbehandling.
OVERDOSIS
Potentialet for akutte toksiske effekter efter overdosering af PULMICORT 100mcg TURBUHALER (budesonid) er lavt. Hvis det anvendes i for høje doser i længere perioder, kan systemiske kortikosteroideffekter som f.eks. hyperkorticisme forekomme (se FORHOLDSREGLER ). PULMICORT TURBUHALER ved to gange den højeste anbefalede dosis (3200 mcg dagligt) administreret i 6 uger forårsagede en signifikant reduktion (27%) i plasmacortisol-responset på en 6-timers infusion af ACTH sammenlignet med placebo (+1%). Den tilsvarende effekt af 10 mg prednison dagligt var en 35 % reduktion i plasmacortisol-responset på ACTH.
Den minimale dødelige inhalationsdosis hos mus var 100 mg/kg (ca. 320 gange den maksimalt anbefalede daglige inhalationsdosis hos voksne og ca. 380 gange den maksimalt anbefalede daglige inhalationsdosis hos børn på en mcg/m2 basis). Der var ingen dødsfald efter administration af en inhalationsdosis på 68 mg/kg til rotter (ca. 430 gange den maksimalt anbefalede daglige inhalationsdosis hos voksne og ca. 510 gange den maksimalt anbefalede daglige inhalationsdosis til børn på en mcg/m2 basis). Den minimale orale dødelige dosis var 200 mg/kg hos mus (ca. 630 gange den maksimalt anbefalede daglige inhalationsdosis hos voksne og ca. 750 gange den maksimalt anbefalede daglige inhalationsdosis hos børn på en mcg/m2 basis) og mindre end 100 mg/kg hos rotter (ca. 630 gange den maksimalt anbefalede daglige inhalationsdosis hos voksne og ca. 750 gange den maksimalt anbefalede daglige inhalationsdosis hos børn baseret på en mcg/m2 basis).
Erfaring efter markedsføring viste, at patienter, der oplevede akut overdosis af inhaleret budesonid, normalt forblev asymptomatiske. Anvendelse af for høje doser (op til 6400 mcg dagligt) i længere perioder viste systemiske kortikosteroideffekter såsom hyperkorticisme.
KONTRAINDIKATIONER
PULMICORT TURBUHALER (budesonid) er kontraindiceret til den primære behandling af status asthmaticus eller andre akutte episoder af astma, hvor intensive foranstaltninger er påkrævet.
Overfølsomhed over for budesonid kontraindicerer brugen af PULMICORT TURBUHALER (budesonid).
KLINISK FARMAKOLOGI
Virkningsmekanisme
Budesonid er et antiinflammatorisk kortikosteroid, der udviser potent glukokortikoid aktivitet og svag mineralokortikoid aktivitet. I standard in vitro- og dyremodeller har budesonid ca. en 200 gange højere affinitet for glukokortikoidreceptoren og en 1000 gange højere topisk antiinflammatorisk styrke end cortisol (rottekrotonolie-øreødemanalyse). Som et mål for systemisk aktivitet er budesonid 40 gange mere potent end cortisol, når det administreres subkutant og 25 gange mere potent, når det administreres oralt i rottethymus-involutionsanalysen.
Aktiviteten af PULMICORT 100mcg TURBUHALER skyldes moderlægemidlet budesonid. I glukokortikoidreceptoraffinitetsundersøgelser var 22R-formen to gange så aktiv som 22S-epimeren. In vitro undersøgelser viste, at de to former for budesonid ikke interkonverterer.
Den præcise mekanisme for kortikosteroidvirkninger på inflammation ved astma kendes ikke. Inflammation er en vigtig komponent i patogenesen af astma. Kortikosteroider har vist sig at have en bred vifte af hæmmende aktiviteter mod flere celletyper (f.eks. mastceller, eosinofiler, neutrofiler, makrofager og lymfocytter) og mediatorer (f.eks. histamin, eicosanoider, leukotriener og cytokiner) involveret i allergiske og ikke -allergisk-medieret inflammation. Disse antiinflammatoriske virkninger af kortikosteroider kan bidrage til deres effektivitet ved astma.
Undersøgelser af astmatiske patienter har vist et gunstigt forhold mellem topisk antiinflammatorisk aktivitet og systemiske kortikosteroideffekter over en bred vifte af doser fra PULMICORT 200mcg TURBUHALER (budesonid). Dette forklares med en kombination af en relativt høj lokal anti-inflammatorisk effekt, omfattende first pass levernedbrydning af oralt absorberet lægemiddel (85-95%) og den lave styrke af dannede metabolitter (se nedenfor).
Farmakokinetik
Absorption:
Efter oral administration af budesonid blev maksimal plasmakoncentration opnået efter ca. 1 til 2 timer, og den absolutte systemiske tilgængelighed var 6-13 %. I modsætning hertil absorberes det meste af budesonid leveret til lungerne systemisk. Hos raske forsøgspersoner blev 34 % af den afmålte dosis aflejret i lungerne (som vurderet ved plasmakoncentrationsmetoden) med en absolut systemisk tilgængelighed på 39 % af den afmålte dosis. Budesonids farmakokinetik adskiller sig ikke signifikant hos raske frivillige og astmatiske patienter. Maksimal plasmakoncentration af budesonid forekom inden for 30 minutter efter inhalation fra PULMICORT 200mcg TURBUHALER.Hos astmatiske patienter udviste budesonid en lineær stigning i AUC og Cmax med stigende dosis efter både en enkelt dosis og gentagen dosering fra PULMICORT 200mcg TURBUHALER (budesonid).
Fordeling:
Fordelingsvolumenet af budesonid var ca. 3 l/kg. Det var 85-90 % bundet til plasmaproteiner. Proteinbindingen var konstant over koncentrationsområdet (1-100 nmol/L) opnået med og oversteg anbefalede doser af PULMICORT TURBUHALER. Budesonid viste ringe eller ingen binding til kortikosteroidbindende globulin. Budesonid ækvilibrerede hurtigt med røde blodlegemer på en koncentrationsuafhængig måde med et blod/plasma-forhold på ca. 0,8.Metabolisme:
In vitro undersøgelser med humane leverhomogenater har vist, at budesonid metaboliseres hurtigt og omfattende. To hovedmetabolitter dannet via cytochrom P450 (CYP) isoenzym 3A4 (CYP3A4) katalyseret biotransformation er blevet isoleret og identificeret som 16α-hydroxyprednisolon og 6β-hydroxybudesonid. Kortikosteroidaktiviteten af hver af disse to metabolitter er mindre end 1 % af moderforbindelsens. Der er ikke påvist kvalitative forskelle mellem in vitro og in vivo metaboliske mønstre. Ubetydelig metabolisk inaktivering blev observeret i humane lunge- og serumpræparater.Udskillelse/eliminering:
22R-formen af budesonid blev fortrinsvis elimineret af leveren med systemisk clearance på 1,4 l/min vs. 1,0 l/min for 22S-formen. Den terminale halveringstid, 2 til 3 timer, var den samme for begge epimerer og var uafhængig af dosis. Budesonid blev udskilt i urin og fæces i form af metabolitter. Ca. 60 % af en intravenøs radiomærket dosis blev genfundet i urinen. Der blev ikke påvist uændret budesonid i urinen.Særlige populationer:
Ingen farmakokinetiske forskelle er blevet identificeret på grund af race, køn eller høj alder.Pædiatrisk:
Efter intravenøs dosering til pædiatriske patienter i alderen 10-14 år var plasmahalveringstiden kortere end hos voksne (1,5 timer vs. 2,0 timer hos voksne). I den samme population efter inhalation af budesonid via en tryksat afmålt dosisinhalator var den absolutte systemiske tilgængelighed den samme som hos voksne.Leverinsufficiens:
Nedsat leverfunktion kan påvirke eliminationen af kortikosteroider. Budesonids farmakokinetik blev påvirket af kompromitteret leverfunktion, hvilket fremgår af en fordoblet systemisk tilgængelighed efter oral indtagelse. Den intravenøse farmakokinetik af budesonid var imidlertid ens hos cirrosepatienter og hos raske forsøgspersoner.Lægemiddel-lægemiddelinteraktioner:
Ketoconazol, en potent hæmmer af cytochrom P450 (CYP) isoenzym 3A4 (CYP3A4), det vigtigste metaboliske enzym for kortikosteroider, øgede plasmaniveauer af oralt indtaget budesonid. Ved anbefalede doser havde cimetidin en lille, men klinisk ubetydelig effekt på farmakokinetikken af oral budesonid.Farmakodynamik
For at bekræfte, at systemisk absorption ikke er en signifikant faktor i den kliniske effekt af inhaleret budesonid, blev der udført et klinisk studie med patienter med astma, hvor man sammenlignede 400 mcg budesonid administreret via en tryksat afmålt dosisinhalator med en tube spacer med 1400 mcg oral budesonid og placebo. Undersøgelsen viste effektiviteten af inhaleret budesonid, men ikke oralt indtaget budesonid på trods af sammenlignelige systemiske niveauer. Den terapeutiske virkning af konventionelle doser af oralt inhaleret budesonid er således i vid udstrækning forklaret af dets direkte virkning på luftvejene.
Generelt har PULMICORT TURBUHALER (budesonid) en relativt hurtig virkningsstart for et inhaleret kortikosteroid. Forbedring af astmakontrol efter inhalation af PULMICORT TURBUHALER (budesonid) kan forekomme inden for 24 timer efter påbegyndelse af behandlingen, selvom maksimal fordel muligvis ikke opnås inden for 1 til 2 uger eller længere.
PULMICORT TURBUHALER (budesonid) har vist sig at reducere luftvejsreaktivitet i forskellige udfordringsmodeller, herunder histamin, metacholin, natriummetabisulfit og adenosinmonophosphat hos patienter med hyperreaktive luftveje. Den kliniske relevans af disse modeller er ikke sikker.
Forbehandling med PULMICORT 200 mcg TURBUHALER (budesonid) 1600 mcg dagligt (800 mcg to gange dagligt) i 2 uger reducerede det akutte (tidlige fase-reaktion) og forsinkede (sen-fase-reaktion) fald i FEV1 efter inhaleret allergenpåvirkning.
Virkningerne af PULMICORT 200mcg TURBUHALER (budesonid) på hypothalamus-hypofyse-binyre-aksen (HPA) blev undersøgt hos 905 voksne og 404 pædiatriske patienter med astma. For de fleste patienter forblev evnen til at øge cortisolproduktionen som reaktion på stress, som vurderet ved cosyntropin (ACTH) stimulationstest, intakt med PULMICORT TURBUHALER (budesonid) behandling ved anbefalede doser. For voksne patienter behandlet med 100, 200, 400 eller 800 mcg to gange dagligt i 12 uger havde henholdsvis 4 %, 2 %, 6 % og 13 % et unormalt stimuleret kortisolrespons (peak cortisol
Indgivelse af budesonid via PULMICORT 200 mcg TURBUHALER (budesonid) i doser op til 800 mcg/dag (gennemsnitlig daglig dosis 445 mcg/dag) eller via en tryksat afmålt dosisinhalator i doser op til 1200 mcg/dag (gennemsnitlig daglig dosis 620 mcg. /dag) til 216 pædiatriske patienter (i alderen 3 til 11 år) i 2 til 6 år havde ingen signifikant effekt på statural vækst sammenlignet med ikke-kortikosteroidbehandling hos 62 matchede kontrolpatienter. Den langsigtede effekt af PULMICORT TURBUHALER (budesonid) på væksten er dog ikke fuldt kendt.
Kliniske spor
Den terapeutiske effekt af PULMICORT 100mcg TURBUHALER (budesonid) er blevet evalueret i kontrollerede kliniske forsøg, der involverede mere end 1300 patienter (6 år og ældre) med astma af varierende sygdomsvarighed (20 år) og sværhedsgrad.
Dobbeltblindede, parallelle, placebokontrollerede kliniske forsøg af 12 ugers varighed og længere har vist, at sammenlignet med placebo, forbedrede PULMICORT TURBUHALER (budesonid) lungefunktionen signifikant (målt ved PEF og FEV1), signifikant nedsatte morgen- og aftensymptomer på astma , og reducerede signifikant behovet for efter behov inhaleret β2-agonistbrug ved doser på 400 mcg til 1600 mcg pr. dag (200 mcg til 800 mcg to gange dagligt) hos voksne og 400 mcg til 800 mcg pr. dag (200 mcg til 400 mcg til 400 mcg to gange dagligt) hos pædiatriske patienter på 6 år og ældre.
Forbedret lungefunktion (morgen PEF) blev observeret inden for 24 timer efter påbegyndelse af behandling hos både voksne og pædiatriske patienter på 6 år og ældre, selvom maksimal fordel ikke blev opnået i 1 til 2 uger eller længere efter behandlingsstart. Forbedret lungefunktion blev opretholdt gennem de 12 uger af den dobbeltblinde del af forsøgene.
Patienter, der ikke modtager kortikosteroidbehandling
et 12-ugers klinisk forsøg med 273 patienter med mild til moderat astma (gennemsnitlig baseline FEV1 2,27 L), som ikke var godt kontrolleret af bronkodilatatorer alene, blev PULMICORT 200 mcg TURBUHALER (budesonid) evalueret i doser på 200 mcg 2 gange dagligt og 400 mcg. daglig versus placebo. FEV1-resultaterne fra dette forsøg er vist i figuren nedenfor. Lungefunktionen forbedredes signifikant på begge doser af PULMICORT 100mcg TURBUHALER (budesonid) sammenlignet med placebo.
Et 12-ugers forsøg med patienter, der ikke er i kortikosteroidterapi, før studiestart
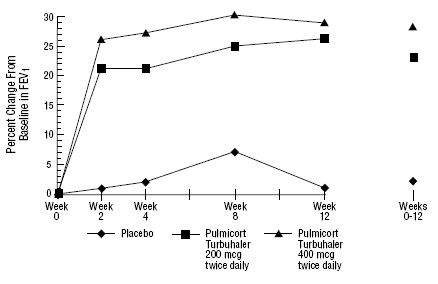
I et 12-måneders kontrolleret forsøg med 75 patienter, der ikke tidligere fik kortikosteroider, resulterede PULMICORT TURBUHALER (budesonid) ved 200 mcg to gange dagligt i forbedret lungefunktion (målt ved PEF) og reduceret bronkial hyperreaktivitet sammenlignet med placebo.
Patienter, der tidligere har været vedligeholdt på inhalerede kortikosteroider
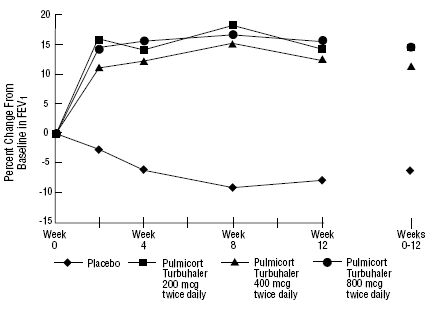
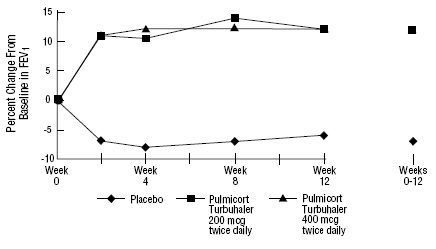
Sikkerheden og virkningen af PULMICORT 200mcg TURBUHALER (budesonid) blev også evalueret hos voksne og pædiatriske patienter (i alderen 6 til 18 år), der tidligere har været opretholdt på inhalerede kortikosteroider (voksne: N=473, gennemsnitlig baseline FEV1 2,04 L, baseline doser af bediclonat-dipropionatason, 1 -1008 mcg/dag; pædiatri: N=404, gennemsnitlig baseline FEV1 2,09 L, baselinedoser af beclomethasondipropionat 126-672 mcg/dag eller triamcinolonacetonid 300-1800 mcg/dag). FEV1-resultaterne af disse to forsøg, begge af 12 ugers varighed, er præsenteret i følgende figurer. Lungefunktionen forbedredes signifikant med alle doser af PULMICORT TURBUHALER (budesonid) sammenlignet med placebo i begge forsøg.
Voksne patienter, der tidligere har været vedligeholdt på inhalerede kortikosteroider
Pædiatriske patienter i alderen 6 til 18 år tidligere vedligeholdt på inhalerede kortikosteroider
Patienter, der får PULMICORT TURBUHALER (budesonid) én gang dagligt
Effekten og sikkerheden af én gang daglig administration af PULMICORT 100 mcg TURBUHALER (budesonid) 200 mcg og 400 mcg og placebo blev også evalueret hos 309 voksne astmatiske patienter (gennemsnitlig baseline FEV1 2,7 l) i en 18-ugers undersøgelse. Sammenlignet med placebo viste patienter, der fik Pulmicort 200 eller 400 mcg én gang dagligt, signifikant bedre astmastabilitet vurderet ved PEF og FEV1 over en indledende 6-ugers behandlingsperiode, som blev opretholdt med en daglig dosis på 200 mcg over de efterfølgende 12 uger. Selvom undersøgelsespopulationen omfattede både patienter, der tidligere var behandlet med inhalerede kortikosteroider, såvel som patienter, der ikke tidligere har modtaget kortikosteroidbehandling, viste resultaterne, at dosering én gang dagligt var mest tydeligt effektiv for de patienter, der tidligere blev opretholdt på oralt inhalerede kortikosteroider (se DOSERING OG ADMINISTRATION ).
Patienter, der tidligere har været vedligeholdt på orale kortikosteroider
et klinisk forsøg med 159 svære astmatiske patienter, der krævede kronisk peroral prednisonbehandling (gennemsnitlig baselinedosis af prednison 19,3 mg/dag) blev PULMICORT TURBUHALER (budesonid) i doser på 400 mcg to gange dagligt og 800 mcg to gange dagligt sammenlignet med placebo-ugers 20 uger. periode. Omtrent to tredjedele (68 % på 400 mcg to gange dagligt og 64 % på 800 mcg to gange dagligt) af PULMICORT TURBUHALER (budesonid)-behandlede patienter var i stand til at opnå vedvarende (mindst 2 uger) oral kortikosteroidophør (sammenlignet med 8 % af placebo-behandlede patienter) og forbedret astmakontrol. Den gennemsnitlige orale kortikosteroiddosis blev reduceret med 83 % på 400 mcg to gange dagligt og 79 % på 800 mcg to gange dagligt for PULMICORT TURBUHALER (budesonid)-behandlede patienter versus 27 % for placebo. Derudover forblev 58 ud af 64 patienter (91%), som fuldstændigt eliminerede orale kortikosteroider under den dobbeltblinde fase af forsøget, fra orale kortikosteroider i yderligere 12 måneder, mens de fik PULMICORT 200mcg TURBUHALER (budesonid).
PATIENTOPLYSNINGER
Patientens brugsanvisning
Læs venligst denne indlægsseddel omhyggeligt, før du begynder at tage din medicin. Det giver et resumé af oplysninger om din medicin. At følge disse instruktioner hjælper med at sikre, at du inhalerer medicinen korrekt.
SPØRG DIN LÆGE ELLER Apoteker FOR YDERLIGERE INFORMATION.
HVAD DU BØR VIDE OM PULMICORT TURBUHALER (budesonid)
Din læge har ordineret PULMICORT TURBUHALER 200 mcg. Det indeholder en medicin kaldet budesonid, som er et syntetisk kortikosteroid. Kortikosteroider er naturlige stoffer, der findes i kroppen, og som hjælper med at bekæmpe betændelse. De bruges til at behandle astma, fordi de reducerer hævelsen og irritationen i væggene i de små luftpassager i lungerne og letter vejrtrækningsproblemer. Når de indåndes regelmæssigt, hjælper kortikosteroider også til at forhindre astmaanfald.
PULMICORT TURBUHALER (budesonid) behandler betændelsen - den "stille del" af astma, som du ikke kan høre, se eller føle. Når betændelse efterlades ubehandlet, kan dine astmasymptomer og anfald øges. PULMICORT 200mcg TURBUHALER (budesonid) virker til at forebygge og reducere dine astmasymptomer og -anfald.
VIGTIGE PUNKTER AT HUSK OM PULMICORT TURBUHALER (budesonid)
SØRG FOR, at denne medicin er egnet til dig (se "FØR DU BRUGER DIN PULMICORT TURBUHALER (budesonid)").
Det er vigtigt, at du inhalerer hver dosis, som din læge har anbefalet.
Brug din Turbuhaler som anvist af din læge. STOP IKKE MED BEHANDLING ELLER REDUCER DIN DOSIS, SELVOM DU FØLER DU BEDRE, medmindre din læge har bedt det om det.
LADE VÆRE MED inhaler flere doser eller brug din Turbuhaler oftere end din læge har anvist.
Denne medicin er IKKE beregnet til at give hurtig lindring af dine vejrtrækningsbesvær under et astmaanfald. Det skal tages med jævne mellemrum som anbefalet af din læge, og ikke som en nødforanstaltning.
Din læge kan ordinere yderligere medicin (såsom bronkodilatatorer) til nødhjælp, hvis det er akut
Hvis du også bruger anden medicin ved inhalation, bør du kontakte din læge for at få instruktioner om, hvornår du skal bruge den i forhold til brugen af din PULMICORT 100mcg TURBUHALER (budesonid).
FØR DU BRUGER DIN PULMICORT TURBUHALER (budesonid)
FORTÆL DIN LÆGE, FØR DU BEGYNDER AT TAGE DENNE MEDICIN, HVIS DU:
- er gravid (eller har til hensigt at blive gravid),
- ammer en baby,
- er allergisk over for budesonid eller ethvert andet oralt inhaleret kortikosteroid,
- har nogen infektioner,
- har eller haft tuberkulose,
- har osteoporose,
- har for nylig været omkring nogen med skoldkopper eller mæslinger,
- planlægger at blive opereret,
- har taget en oral kortikosteroidmedicin som prednison. Du skal muligvis følge specifikke instruktioner for at undgå sundhedsrisici forbundet med at stoppe med at bruge disse typer medicin.
I nogle tilfælde er denne medicin muligvis ikke egnet, og din læge vil muligvis ordinere en anden medicin. Sørg for, at din læge ved, hvilken anden medicin du tager, herunder receptpligtig og ikke-receptpligtig medicin, samt eventuelle vitaminer eller kost- og urtetilskud.
HVAD ER DE MULIGE BIVIRKNINGER AF PULMICORT TURBUHALER (budesonid)?
Som med alle inhalerede kortikosteroider skal du være opmærksom på følgende bivirkninger:
- Øget hvæsen lige efter indtagelse af PULMICORT 100mcg TURBUHALER (budesonid). Hav altid en korttidsvirkende bronkodilaterende medicin med dig til behandling af pludselig hvæsende vejrtrækning. Korttidsvirkende bronkodilatatorer hjælper med at slappe af musklerne omkring luftvejene i dine lunger. Hvæsen opstår, når musklerne omkring luftvejene strammer. Dette gør det svært at trække vejret. I alvorlige tilfælde kan hvæsende vejrtrækning stoppe din vejrtrækning og forårsage død, hvis den ikke behandles med det samme.
- Effekter på immunsystemet og en større chance for infektioner.
- Øjenproblemer, herunder glaukom og grå stær. Øjenundersøgelser bør overvejes, mens du bruger PULMICORT TURBUHALER (budesonid).
- Et barns vækst bør kontrolleres regelmæssigt, mens de tager PULMICOR TURBUHALER på grund af muligheden for nedsat vækst.
Baseret på kliniske forsøg er de mest almindelige bivirkninger rapporteret af patienter, der bruger PULMICORT 100mcg TURBUHALER (budesonid):
- luftvejsinfektion
- hovedpine
- influenza symptomer
- ondt i halsen
- bihulebetændelse
Disse er ikke alle de mulige bivirkninger af PULMICORT TURBUHALER (budesonid). For mere information, spørg din læge, sundhedspersonale eller apotek.
BRUG AF DIN PULMICORT TURBUHALER (budesonid)
- Følg instruktionerne vist i afsnittet "SÅDAN BRUGER DU DIN PULMICORT 200mcg TURBUHALER". Fortæl det til lægen eller apoteket, hvis du har problemer.
- Det er vigtigt, at du inhalerer hver dosis som anvist af din læge. Apotekets etiket vil normalt fortælle dig, hvilken dosis du skal tage og hvor ofte. Hvis det ikke gør det, eller du ikke er sikker, så spørg din læge eller apoteket.
DOSERING
- Brug som anvist af din læge.
- det er MEGET VIGTIGT at du følger din læges anvisninger om, hvor mange inhalationer du skal tage, og hvor ofte du skal bruge din PULMICORT TURBUHALER (budesonid).
- LADE VÆRE MED inhaler flere doser eller brug din PULMICORT TURBUHALER (budesonid) oftere end din læge anbefaler.
- Det kan tage 1 til 2 uger eller længere, før du mærker maksimal forbedring, så DET ER MEGET VIGTIGT, AT DU BRUGER PULMICORT 100mcg TURBUHALER (budesonid) Jævnligt. STOP IKKE MED BEHANDLING ELLER REDUCER DIN DOSIS, SELVOM DU FÅR DU BEDRE, medmindre din læge har bedt det om det.
- Hvis du går glip af en dosis, skal du blot tage din regelmæssige planlagte næste dosis, når den skal. DU MÅ IKKE FORDOBLE dosis.
SÅDAN BRUGER DU DIN PULMICORT TURBUHALER (budesonid)
Læs hele instruktionerne omhyggeligt og brug kun som anvist.
PRIMING INSTRUKTIONER:
Før du bruger en ny PULMICORT 200mcg TURBUHALER (budesonid) for første gang, bør du prime den. For at gøre dette skal du dreje dækslet og løfte det af. Hold PULMICORT TURBUHALER (budesonid) oprejst (med mundstykket op), og drej derefter det brune greb helt til højre og tilbage igen til venstre. Gentage. Nu er du klar til at tage din første dosis (se instruktionerne for "AT TAGE EN DOSIS"). Du behøver ikke prime den anden gang efter dette, selvom du lægger den til side i længere tid.
INDTAGELSE AF EN DOSIS:
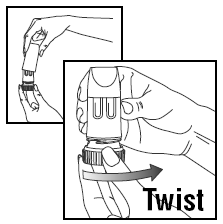
INDLÆSNING AF EN DOS
- Drej dækslet og løft af.
- For at give den korrekte dosis, PULMICORT TURBUHALER (budesonid) skal holdes i oprejst stilling (mundstykket oppe), når en dosis medicin fyldes.
- Drej det brune greb helt til højre, så langt det kan komme. Drej den helt tilbage igen til venstre.
- Du vil høre et klik.
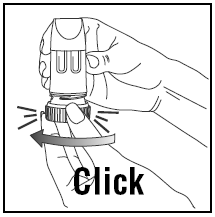
INDÅNDING AF DOSSEN
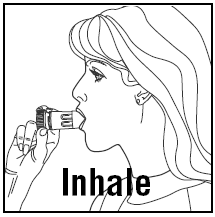
- Når du inhalerer, skal PULMICORT 200mcg TURBUHALER (budesonid) holdes i oprejst (mundstykke opad) eller vandret position.
- Vend hovedet væk fra inhalatoren og ånd ud. Ryst ikke inhalatoren efter isætning.
- Placer mundstykket mellem dine læber og inhaler dybt og kraftigt. Du kan ikke smage eller mærke medicinen.
- Du må ikke tygge eller bide på mundstykket.
- Fjern inhalatoren fra munden og ånd ud. Undgå at puste eller puste ind i mundstykket.
- Hvis mere end én dosis er påkrævet, skal du blot gentage ovenstående trin.
- Når du er færdig, sæt dækslet tilbage på inhalatoren og drej det. Skyl munden med vand. Slug ikke.
- Hold din PULMICORT TURBUHALER (budesonid) ren og tør til enhver tid.
- Brug ikke PULMICORT TURBUHALER (budesonid), hvis den er blevet beskadiget, eller hvis mundstykket er løsnet.
OPBEVARING AF DIN PULMICORT TURBUHALER (budesonid)
- Efter hver brug skal du sætte det hvide låg på igen og dreje det fast på plads.
- Opbevar PULMICORT TURBUHALER (budesonid) på et tørt sted ved kontrolleret stuetemperatur, 68-77°F (20-25°C).
- Opbevar din PULMICORT TURBUHALER (budesonid) på et sikkert sted uden for små børns rækkevidde.
- LADE VÆRE MED brug efter den dato, der er vist på kroppen af din Turbuhaler.
HVORDAN MAN VED, NÅR DIN PULMICORT TURBUHALER (budesonid) ER TOM
Etiketten på æsken eller låget vil fortælle dig, hvor mange doser der er i din PULMICORT TURBUHALER. Din PULMICORT TURBUHALER (budesonid) har et praktisk dosisindikatorvindue lige under mundstykket.
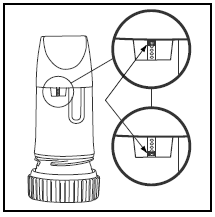
- Når et rødt mærke vises øverst i vinduet, er der 20 doser medicin tilbage. Nu er det tid til at få din næste PULMICORT 100mcg TURBUHALER (budesonid).
- Når det røde mærke når bunden af vinduet, skal din inhalator kasseres, da den muligvis ikke længere giver den korrekte mængde medicin. (Du kan stadig høre en lyd, hvis du ryster den – denne lyd er ikke medicinen. Denne lyd produceres af tørremidlet inde i Turbuhaleren.)
- Husk, at du får en ny inhalator, hver gang du genopfylder din recept.
- Nedsænk den ikke i vand for at finde ud af, om den er tom. Du skal blot tjekke dit dosisindikatorvindue.
YDERLIGERE OPLYSNINGER OM PULMICORT TURBUHALER (budesonid)
- PULMICORT 200mcg TURBUHALER (budesonid) leverer din medicin som et meget fint pulver. På grund af dette, kan du ikke smag, lugt eller fornemmelse enhver medicin, der kommer ind i dine lunger, når du inhalerer fra PULMICORT TURBUHALER (budesonid) Dette betyder ikke, at du ikke får din medicin.
- PULMICORT 100mcg TURBUHALER (budesonid) bør ikke bruges sammen med en spacer.
- PULMICORT 100mcg TURBUHALER indeholder kun budesonid og indeholder ingen inaktive ingredienser.
- PULMICORT TURBUHALER (budesonid) er specielt designet til kun at levere én dosis ad gangen, uanset hvor ofte du klikker på det brune greb. Hvis du ved et uheld blæser ind i din inhalator efter påfyldning af en dosis, skal du blot følge instruktionerne for påfyldning af en ny dosis.
Denne indlægsseddel indeholder ikke fuldstændig information om din medicin. Hvis du har spørgsmål eller er i tvivl om noget, skal du spørge din læge eller apoteket.
Du kan eventuelt læse denne folder igen. SLÅ DET IKKE VÆK, før du er færdig med din medicin.
HUSK: Denne medicin er ordineret til dig af din læge. Giv IKKE denne medicin til andre.
BRUG DETTE PRODUKT SOM ANVISET, MEDMINDRE DIN LÆGE ER ANORDNET AT GØRE ANDET.
Hvis du har yderligere spørgsmål om brugen af PULMICORT 100mcg TURBUHALER (budesonid), ring: 1-800-236-9933.
