Singulair 10mg, 4mg, 5mg Montelukast Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Singulair, og hvordan bruges det?
Singulair 5mg er en receptpligtig medicin, der bruges til at behandle symptomerne på astma, anstrengelsesudløst bronkospasme og allergisk eller helårs (flerårig) rhinitis. Singulair kan bruges alene eller sammen med anden medicin.
- Singulair tilhører en klasse af lægemidler kaldet Leukotriene Receptor Antagonister.
- Det vides ikke, om Singulair er sikkert og effektivt til børn under 1 år.
Hvad er de mulige bivirkninger af Singulair?
Singulair kan forårsage alvorlige bivirkninger, herunder:
- usædvanlige ændringer i humør eller adfærd,
- udslæt,
- blå mærker,
- kraftig prikken,
- følelsesløshed,
- smerte,
- muskelsvaghed,
- øresmerter,
- hævelse,
- varme,
- feber,
- ondt i halsen,
- hævelse i dit ansigt eller tunge,
- brændende i dine øjne, og
- hudsmerter, efterfulgt af et rødt eller lilla udslæt, der spreder sig til din overkrop og forårsager blærer og afskalning
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Singulair omfatter:
- mavesmerter,
- diarré,
- feber,
- influenza symptomer,
- forkølelsessymptomer (tilstoppet næse, bihulesmerter, hoste, ondt i halsen),
- hovedpine, og
- sengevædning eller tab af blærekontrol hos børn
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Singulair. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
Montelukastnatrium, den aktive ingrediens i SINGULAIR 4mg, er en selektiv og oralt aktiv leukotrienreceptorantagonist, der hæmmer cysteinylleukotrien CysLT1-receptoren.
Montelukastnatrium beskrives kemisk som [R-(E)]-1-[[[1-[3-[2-(7-chlor-2-quinolinyl)ethenyl]phenyl]-3-[2-(1-hydroxy] -1-methylethyl)phenyl]propyl]thio]methyl]cyclopropaneddikesyre, mononatriumsalt.
Den empiriske formel er C35H35ClNNaO3S, og dens molekylvægt er 608,18. Strukturformlen er:
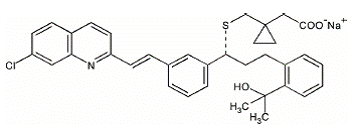
Montelukastnatrium er et hygroskopisk, optisk aktivt, hvidt til råhvidt pulver. Montelukastnatrium er frit opløseligt i ethanol, methanol og vand og praktisk talt uopløseligt i acetonitril.
Hver 10 mg filmovertrukken SINGULAIR-tablet indeholder 10,4 mg montelukastnatrium, hvilket svarer til 10 mg montelukast, og følgende inaktive ingredienser: mikrokrystallinsk cellulose, lactosemonohydrat, croscarmellosenatrium, hydroxypropylcellulose og magnesiumstearat. Filmcoatingen består af hydroxypropylmethylcellulose, hydroxypropylcellulose, titaniumdioxid, rød jernoxid, gul jernoxid og carnaubavoks.
Hver 4-mg og 5-mg tyggetablet SINGULAIR indeholder henholdsvis 4,2 og 5,2 mg montelukastnatrium, hvilket svarer til henholdsvis 4 og 5 mg montelukast. Begge tyggetabletter indeholder følgende inaktive ingredienser: mannitol, mikrokrystallinsk cellulose, hydroxypropylcellulose, rød jernoxid, croscarmellosenatrium, kirsebærsmag, aspartam og magnesiumstearat.
Hver pakke med SINGULAIR 4 mg orale granulat indeholder 4,2 mg montelukastnatrium, hvilket svarer til 4 mg montelukast. Den orale granulatformulering indeholder følgende inaktive ingredienser: mannitol, hydroxypropylcellulose og magnesiumstearat.
INDIKATIONER
Astma
SINGULAIR® er indiceret til profylakse og kronisk behandling af astma hos voksne og pædiatriske patienter på 12 måneder og ældre.
Træningsinduceret bronkokonstriktion (EIB)
SINGULAIR er indiceret til forebyggelse af anstrengelsesudløst bronkokonstriktion (EIB) hos patienter på 6 år og ældre.
Allergisk rhinitis
SINGULAIR 10mg er indiceret til lindring af symptomer på sæsonbetinget allergisk rhinitis hos patienter på 2 år og ældre og flerårig allergisk rhinitis hos patienter 6 måneder og ældre. Fordi fordelene ved SINGULAIR 4mg muligvis ikke opvejer risikoen for neuropsykiatriske symptomer hos patienter med allergisk rhinitis [se ADVARSLER OG FORHOLDSREGLER ], reservebrug til patienter, som har en utilstrækkelig respons eller intolerance over for alternative behandlinger.
Brugsbegrænsninger
SINGULAIR er ikke indiceret til behandling af et akut astmaanfald.
DOSERING OG ADMINISTRATION
Astma
For astma, indgive SINGULAIR oralt én gang dagligt om aftenen, med eller uden mad. Der har ikke været kliniske forsøg med patienter med astma til at evaluere den relative effekt af dosering morgen versus aften.
Følgende doser anbefales:
Patienter, der glemmer en dosis, bør tage den næste dosis på deres normale tidspunkt og bør ikke tage 2 doser på samme tid.
Træningsinduceret bronkokonstriktion (EIB)
For at forebygge EIB skal du administrere en enkelt dosis SINGULAIR 10 mg oralt mindst 2 timer før træning. Følgende doser anbefales:
En yderligere dosis SINGULAIR bør ikke tages inden for 24 timer efter en tidligere dosis. Patienter, der allerede tager SINGULAIR dagligt til en anden indikation (inklusive kronisk astma), bør ikke tage en yderligere dosis for at forhindre EIB. Alle patienter bør have en korttidsvirkende β-agonist til rådighed for redning.
Daglig administration af SINGULAIR til kronisk behandling af astma er ikke blevet etableret for at forhindre akutte episoder af EIB.
Allergisk rhinitis
For allergisk rhinitis, indgive SINGULAIR 5mg oralt én gang dagligt uden hensyntagen til tidspunktet for indtagelse af føde. Tidspunktet for administration hos patienter med allergisk rhinitis kan individualiseres, så det passer til patientens behov.
Følgende doser til behandling af symptomer på sæsonbestemt allergisk rhinitis anbefales:
Tabel 3: Anbefalet dosering ved sæsonbestemt allergisk rhinitis
Patienter, der glemmer en dosis, bør tage den næste dosis på deres normale tidspunkt og bør ikke tage 2 doser på samme tid.
Astma og Allergisk Rhinitis
Til patienter med både astma og allergisk rhinitis, indgiv kun én dosis SINGULAIR oralt én gang dagligt om aftenen.
Patienter, der glemmer en dosis, bør tage den næste dosis på deres normale tidspunkt og bør ikke tage 2 doser på samme tid.
Instruktioner til administration af orale granulat
SINGULAIR 4-mg orale granulat kan indgives enten direkte i munden, opløses i 1 teskefuld (5 ml) kold eller stuetemperatur babyerstatning eller modermælk, eller blandes med en skefuld kold eller stuetemperatur blød mad; baseret på stabilitetsundersøgelser bør kun æblemos, gulerødder, ris eller is bruges. Pakken bør ikke åbnes, før den er klar til brug. Efter åbning af pakken skal den fulde dosis (med eller uden blanding med modermælkserstatning, modermælk eller mad) administreres inden for 15 minutter. Hvis det blandes med modermælkserstatning, modermælk eller mad, må SINGULAIR 4 mg orale granulat ikke opbevares til fremtidig brug. Kassér enhver ubrugt portion. SINGULAIR orale granulat er ikke beregnet til at blive opløst i anden væske end modermælkserstatning eller modermælk til administration. Væsker kan dog indtages efter administration. SINGULAIR orale granulat kan indgives uden hensyntagen til tidspunktet for måltiderne.
HVORDAN LEVERET
Doseringsformer og styrker
Tabletter
10 mg, beige, afrundede firkantede, filmovertrukne tabletter med kode MSD 117 på den ene side og SINGULAIR 4mg på den anden.
Tyggetabletter
5 mg, pink, rund, bi-konveks-formet, med kode MSD 275 på den ene side og SINGULAIR på den anden.
Tyggetabletter
4 mg, pink, oval, bi-konveks-formet, med kode MSD 711 på den ene side og SINGULAIR på den anden.
Orale granulat
4 mg, hvidt granulat med 500 mg nettovægt, pakket i en børnesikret foliepakke.
Opbevaring og håndtering
SINGULAIR 4 mg orale granulat : hvidt granulat med 500 mg nettovægt, pakket i en børnesikret foliepakke.
NDC 0006-3841-30 brugsenhedskarton med 30 pakker.
SINGULAIR 4 mg tabletter : lyserøde, ovale, bi-konvekse tyggetabletter med kode MSD 711 på den ene side og SINGULAIR 10mg på den anden.
NDC 0006-1711-31 brugsenhed high-density polyethylen (HDPE) flasker á 30 med en børnesikret polypropylen låg, en aluminiumsfolie induktionsforsegling og silicagel tørremiddel.
SINGULAIR 5 mg tabletter lyserøde, runde, bi-konvekse tyggetabletter med kode MSD 275 på den ene side og SINGULAIR på den anden.
NDC 0006-9275-31 brugsenhed high-density polyethylen (HDPE) flasker á 30 med en børnesikret polypropylen låg, en aluminiumsfolie induktionsforsegling og silicagel tørremiddel.
SINGULAIR 10 mg tabletter : beige, afrundede firkantede, filmovertrukne tabletter med kode MSD 117 på den ene side og SINGULAIR 4mg på den anden.
NDC 0006-9117-31 brugsenhed højdensitets polyethylen (HDPE) flasker á 30 med en børnesikret låg af polypropylen, en induktionsforsegling af aluminiumsfolie og silicagel tørremiddel
NDC 0006-9117-54 brugsenhed højdensitets polyethylen (HDPE) flasker på 90 med en børnesikret polypropylen låg, en aluminiumsfolie induktionsforsegling og silicagel tørremiddel.
Opbevaring
Opbevar SINGULAIR 4 mg orale granulat, 4 mg tyggetabletter, 5 mg tyggetabletter og 10 mg filmovertrukne tabletter ved 20°C til 25°C (68°F til 77°F), bevægelser tilladt til 15° C til 30°C (59°F til 86°F) [se USP-kontrolleret rumtemperatur]. Beskyt mod fugt og lys. Opbevares i original emballage.
Distribueret af: Merck Sharp & Dohme Corp., et datterselskab af MERCK & CO., INC., Whitehouse Station, USA. Revideret: februar 2021
BIVIRKNINGER
Følgende klinisk signifikante bivirkninger er beskrevet andetsteds i mærkningen:
- Neuropsykiatriske hændelser [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan frekvenser af bivirkninger observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med frekvenser i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke frekvenserne observeret i klinisk praksis. I den følgende beskrivelse af erfaringer fra kliniske forsøg er bivirkninger anført uanset kausalitetsvurdering.
De mest almindelige bivirkninger (hyppighed ≥5 % og større end placebo; anført i faldende frekvens) i kontrollerede kliniske forsøg var: øvre luftvejsinfektion, feber, hovedpine, pharyngitis, hoste, mavesmerter, diarré, mellemørebetændelse, influenza, rhinoré, bihulebetændelse, otitis.
Voksne og unge 15 år og ældre med astma
SINGULAIR 10mg er blevet evalueret for sikkerhed hos ca. 2950 voksne og unge patienter på 15 år og ældre i kliniske forsøg. I placebokontrollerede kliniske undersøgelser forekom følgende bivirkninger rapporteret med SINGULAIR 4 mg hos mere end eller lig med 1 % af patienterne og med en hyppighed større end hos patienter behandlet med placebo:
Hyppigheden af mindre almindelige bivirkninger var sammenlignelig mellem SINGULAIR og placebo.
Sikkerhedsprofilen for SINGULAIR 10 mg, når den blev administreret som en enkelt dosis til forebyggelse af EIB til voksne og unge patienter på 15 år og ældre, var i overensstemmelse med den sikkerhedsprofil, der tidligere er beskrevet for SINGULAIR.
Kumulativt blev 569 patienter behandlet med SINGULAIR 10 mg i mindst 6 måneder, 480 i et år og 49 i to år i kliniske forsøg. Ved langvarig behandling ændrede bivirkningsprofilen sig ikke signifikant.
Pædiatriske patienter i alderen 6 til 14 år med astma
SINGULAIR 10mg er blevet evalueret for sikkerhed hos 476 pædiatriske patienter i alderen 6 til 14 år. Kumulativt blev 289 pædiatriske patienter behandlet med SINGULAIR 10 mg i mindst 6 måneder og 241 i et år eller længere i kliniske forsøg. SINGULAIRs sikkerhedsprofil i det 8-ugers, dobbeltblindede, pædiatriske effektforsøg svarede generelt til sikkerhedsprofilen for voksne. Hos pædiatriske patienter i alderen 6 til 14 år, der fik SINGULAIR 5 mg, forekom følgende reaktioner med en frekvens ≥2 % og hyppigere end hos pædiatriske patienter, der fik placebo: pharyngitis, influenza, feber, bihulebetændelse, kvalme, diarré, dyspepsi, otitis viral infektion og laryngitis. Hyppigheden af mindre almindelige bivirkninger var sammenlignelig mellem SINGULAIR 4 mg og placebo. Ved langvarig behandling ændrede bivirkningsprofilen sig ikke signifikant.
Sikkerhedsprofilen for SINGULAIR 4 mg, når den blev administreret som en enkelt dosis til forebyggelse af EIB hos pædiatriske patienter på 6 år og ældre, var i overensstemmelse med den sikkerhedsprofil, der tidligere er beskrevet for SINGULAIR.
I undersøgelser, der evaluerede væksthastigheden, var sikkerhedsprofilen hos disse pædiatriske patienter i overensstemmelse med den sikkerhedsprofil, der tidligere er beskrevet for SINGULAIR. I et 56-ugers dobbeltblindt studie, der evaluerede vækstraten hos pædiatriske patienter i alderen 6 til 8 år, der fik SINGULAIR, forekom følgende reaktioner, der ikke tidligere er observeret ved brug af SINGULAIR i denne aldersgruppe med en frekvens på ≥2 % og hyppigere end hos pædiatriske patienter, der fik placebo: hovedpine, rhinitis (infektiøs), varicella, gastroenteritis, atopisk dermatitis, akut bronkitis, tandinfektion, hudinfektion og nærsynethed.
Pædiatriske patienter i alderen 2 til 5 år med astma
SINGULAIR er blevet evalueret for sikkerhed hos 573 pædiatriske patienter i alderen 2 til 5 år i enkelt- og flerdosisundersøgelser. Kumulativt blev 426 pædiatriske patienter i alderen 2 til 5 år behandlet med SINGULAIR 10 mg i mindst 3 måneder, 230 i 6 måneder eller længere og 63 patienter i et år eller længere i kliniske forsøg. Hos pædiatriske patienter i alderen 2 til 5 år, der fik SINGULAIR, forekom følgende reaktioner med en frekvens ≥2 % og hyppigere end hos pædiatriske patienter, der fik placebo: feber, hoste, mavesmerter, diarré, hovedpine, rhinoré, bihulebetændelse, otitis, influenza, udslæt, øresmerter, gastroenteritis, eksem, nældefeber, skoldkopper, lungebetændelse, dermatitis og conjunctivitis.
Pædiatriske patienter i alderen 6 til 23 måneder med astma
Sikkerhed og effektivitet hos pædiatriske patienter yngre end 12 måneder med astma er ikke blevet fastslået.
SINGULAIR 4mg er blevet evalueret for sikkerhed hos 175 pædiatriske patienter i alderen 6 til 23 måneder. SINGULAIRs sikkerhedsprofil i et 6-ugers, dobbeltblindt, placebokontrolleret klinisk studie svarede generelt til sikkerhedsprofilen hos voksne og pædiatriske patienter i alderen 2 til 14 år. Hos pædiatriske patienter i alderen 6 til 23 måneder, der fik SINGULAIR 5 mg, forekom følgende reaktioner med en frekvens på ≥2 % og hyppigere end hos pædiatriske patienter, som fik placebo: øvre luftvejsinfektion, hvæsende vejrtrækning; mellemørebetændelse; pharyngitis, tonsillitis, hoste; og rhinitis. Hyppigheden af mindre almindelige bivirkninger var sammenlignelig mellem SINGULAIR og placebo.
Voksne og unge 15 år og ældre med sæsonbestemt allergisk rhinitis
SINGULAIR er blevet evalueret for sikkerhed hos 2199 voksne og unge patienter på 15 år og ældre i kliniske forsøg. SINGULAIR 10 mg administreret én gang dagligt om morgenen eller om aftenen havde en sikkerhedsprofil svarende til den for placebo. I placebokontrollerede kliniske forsøg blev følgende reaktion rapporteret med SINGULAIR 5 mg med en frekvens ≥1 % og med en hyppighed større end placebo: øvre luftvejsinfektion, 1,9 % af patienterne, der fik SINGULAIR 4 mg, mod 1,5 % af patienterne, der fik placebo. I et 4-ugers, placebokontrolleret klinisk studie var sikkerhedsprofilen i overensstemmelse med den, der blev observeret i 2-ugers undersøgelser. Hyppigheden af somnolens var den samme som for placebo i alle undersøgelser.
Pædiatriske patienter i alderen 2 til 14 år med sæsonbetinget allergisk rhinitis
SINGULAIR 5mg er blevet evalueret hos 280 pædiatriske patienter i alderen 2 til 14 år i et 2-ugers, multicenter, dobbeltblindt, placebokontrolleret, parallelgruppe sikkerhedsstudie. SINGULAIR administreret én gang dagligt om aftenen havde en sikkerhedsprofil svarende til placebos. I denne undersøgelse forekom følgende reaktioner med en frekvens ≥2 % og med en hyppighed større end placebo: hovedpine, mellemørebetændelse, pharyngitis og øvre luftvejsinfektion.
Voksne og unge 15 år og ældre med flerårig allergisk rhinitis
SINGULAIR er blevet evalueret for sikkerhed hos 3357 voksne og unge patienter i alderen 15 år og ældre med perennial allergisk rhinitis, hvoraf 1632 modtog SINGULAIR i to, 6-ugers, kliniske undersøgelser. SINGULAIR 10 mg administreret én gang dagligt havde en sikkerhedsprofil, der var i overensstemmelse med den, der blev observeret hos patienter med sæsonbetinget allergisk rhinitis og svarende til den for placebo. I disse to undersøgelser blev følgende reaktioner rapporteret med SINGULAIR med en frekvens på ≥1 % og med en hyppighed større end placebo: bihulebetændelse, øvre luftvejsinfektion, bihulehovedpine, hoste, epistaxis og øget ALAT. Hyppigheden af somnolens svarede til forekomsten af placebo.
Pædiatriske patienter i alderen 6 måneder til 14 år med flerårig allergisk rhinitis
Sikkerheden hos patienter i alderen 2 til 14 år med perennial allergisk rhinitis understøttes af sikkerheden hos patienter i alderen 2 til 14 år med sæsonbetinget allergisk rhinitis. Sikkerheden hos patienter i alderen 6 til 23 måneder understøttes af data fra farmakokinetiske undersøgelser og sikkerheds- og effektundersøgelser ved astma i denne pædiatriske population og fra farmakokinetiske undersøgelser for voksne.
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af SINGULAIR efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Blod og lymfesystem lidelser øget blødningstendens, trombocytopeni
Forstyrrelser i immunsystemet overfølsomhedsreaktioner inklusive anafylaksi, eosinofil leverinfiltration
Psykiatriske lidelser herunder, men ikke begrænset til, agitation, aggressiv adfærd eller fjendtlighed, angst, depression, desorientering, opmærksomhedsforstyrrelser, drømmeabnormiteter, dysfæmi (stamming), hallucinationer, søvnløshed, irritabilitet, hukommelsessvækkelse, tvangssymptomer, rastløshed, somnambulisme, selvmordstanker og -adfærd (inklusive selvmord), tic og tremor [se KASSET ADVARSEL , ADVARSLER OG FORHOLDSREGLER ]
Forstyrrelser i nervesystemet døsighed, paræstesi/hypæstesi, kramper
Hjertelidelser hjertebanken
Åndedræts-, thorax- og mediastinumsygdomme epistaxis, pulmonal eosinofili
Gastrointestinale lidelser diarré, dyspepsi, kvalme, pancreatitis, opkastning
Lever og galdevejslidelser Tilfælde af kolestatisk hepatitis, hepatocellulær leverskade og blandet leverskade er blevet rapporteret hos patienter behandlet med SINGULAIR. De fleste af disse forekom i kombination med andre forstyrrende faktorer, såsom brug af anden medicin, eller når SINGULAIR blev administreret til patienter, som havde et underliggende potentiale for leversygdom, såsom alkoholbrug eller andre former for hepatitis.
Hud- og subkutane vævssygdomme angioødem, blå mærker, erythema multiforme, erythema nodosum, pruritus, Stevens-Johnsons syndrom/toksisk epidermal nekrolyse, nældefeber
Muskel- og bindevævslidelser artralgi, myalgi inklusive muskelkramper
Nyre- og urinvejslidelser enuresis hos børn
Generelle lidelser og tilstande på administrationsstedet ødem
Patienter med astma i behandling med SINGULAIR kan vise sig med systemisk eosinofili, som nogle gange viser sig med kliniske tegn på vaskulitis i overensstemmelse med Churg-Strauss syndrom, en tilstand som ofte behandles med systemisk kortikosteroidbehandling. Disse reaktioner er nogle gange blevet forbundet med reduktion af oral kortikosteroidbehandling. Læger bør være opmærksomme på eosinofili, vaskulitisk udslæt, forværrede lungesymptomer, hjertekomplikationer og/eller neuropati hos deres patienter [se ADVARSLER OG FORHOLDSREGLER ].
DRUGSINTERAKTIONER
Dosisjustering er ikke nødvendig, når SINGULAIR 5 mg administreres sammen med theophyllin, prednison, prednisolon, orale præventionsmidler, fexofenadin, digoxin, warfarin, gemfibrozil, itraconazol, skjoldbruskkirtelhormoner, beroligende hypnotika, ikke-steroide antiinflammatoriske midler, benzodiazepiner, og Cytochrom P450 (CYP) enzyminducere [se KLINISK FARMAKOLOGI ].
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Neuropsykiatriske hændelser
Alvorlige neuropsykiatriske (NP) hændelser er blevet rapporteret ved brug af SINGULAIR. Disse postmarketingrapporter har været meget varierende og inkluderet, men var ikke begrænset til, agitation, aggressiv adfærd eller fjendtlighed, angst, depression, desorientering, opmærksomhedsforstyrrelser, drømmeabnormiteter, dysfemi (stammen), hallucinationer, søvnløshed, irritabilitet, hukommelsessvækkelse, obsessiv-kompulsive symptomer, rastløshed, døsighed, selvmordstanker og -adfærd (inklusive selvmord), tic og tremor. NP-hændelser er blevet rapporteret hos voksne, unge og pædiatriske patienter med og uden en tidligere historie med psykiatrisk lidelse. NP-hændelser er for det meste blevet rapporteret under behandling med SINGULAIR 10 mg, men nogle blev rapporteret efter seponering af SINGULAIR 5 mg. Dyreforsøg viste, at montelukast fordeler sig i hjernen hos rotter [se KLINISK FARMAKOLOGI ]; mekanismerne bag SINGULAIR-associerede NP-hændelser er dog i øjeblikket ikke godt forstået. Baseret på de tilgængelige data er det vanskeligt at identificere risikofaktorer for eller kvantificere risikoen for NP-hændelser ved brug af SINGULAIR 10 mg.
På grund af risikoen for NP-hændelser opvejer fordelene ved SINGULAIR muligvis ikke risiciene hos nogle patienter, især når symptomerne på sygdom kan være milde og tilstrækkeligt behandlet med alternative behandlinger. Reservebrug af SINGULAIR 4mg til patienter med allergisk rhinitis, som har en utilstrækkelig respons eller intolerance over for alternative behandlinger [se INDIKATIONER ]. Overvej fordele og risici hos patienter med astma eller anstrengelsesudløst bronkokonstriktion, før SINGULAIR ordineres.
Diskuter fordele og risici ved brug af SINGULAIR 10 mg med patienter og plejere, når de ordinerer SINGULAIR. Råd til patienter og/eller pårørende om at være opmærksomme på ændringer i adfærd eller nye NP-symptomer, når de tager SINGULAIR. Hvis ændringer i adfærd observeres, eller hvis der opstår nye NP-symptomer eller selvmordstanker og/eller adfærd, skal du rådgive patienterne om at seponere SINGULAIR 10 mg og kontakte en læge med det samme. I mange tilfælde forsvandt symptomerne efter ophør med SINGULAIR-behandlingen; i nogle tilfælde fortsatte symptomerne dog efter seponering af SINGULAIR. Fortsæt derfor med at overvåge og yde støttende behandling, indtil symptomerne forsvinder. Genvurder fordelene og risiciene ved at genoptage behandlingen med SINGULAIR 10 mg, hvis sådanne hændelser opstår.
Akut astma
SINGULAIR er ikke indiceret til brug ved reversering af bronkospasme ved akutte astmaanfald, inklusive status asthmaticus. Patienter bør rådes til at have passende redningsmedicin tilgængelig. Behandling med SINGULAIR 4mg kan fortsættes under akutte forværringer af astma. Patienter, der har forværring af astma efter træning, bør have en korttidsvirkende inhaleret β-agonist til rådighed for redning.
Samtidig brug af kortikosteroider
Mens dosis af inhaleret kortikosteroid kan reduceres gradvist under lægeligt tilsyn, bør SINGULAIR ikke pludselig erstattes med inhalerede eller orale kortikosteroider.
Aspirinfølsomhed
Patienter med kendt aspirinfølsomhed bør fortsætte med at undgå aspirin eller non-steroide antiinflammatoriske midler, mens de tager SINGULAIR. Selvom SINGULAIR er effektiv til at forbedre luftvejsfunktionen hos astmatikere med dokumenteret aspirinfølsomhed, har det ikke vist sig at trunkere bronkokonstriktorrespons på aspirin og andre ikke-steroide antiinflammatoriske lægemidler hos aspirinfølsomme astmatiske patienter [se Kliniske Studier ].
Eosinofile tilstande
Patienter med astma i behandling med SINGULAIR kan vise sig med systemisk eosinofili, som nogle gange viser sig med kliniske tegn på vaskulitis i overensstemmelse med Churg-Strauss syndrom, en tilstand som ofte behandles med systemisk kortikosteroidbehandling. Disse hændelser er nogle gange blevet forbundet med reduktion af oral kortikosteroidbehandling. Læger bør være opmærksomme på eosinofili, vaskulitisk udslæt, forværrede lungesymptomer, hjertekomplikationer og/eller neuropati hos deres patienter. En årsagssammenhæng mellem SINGULAIR 10mg og disse underliggende tilstande er ikke blevet fastlagt [se BIVIRKNINGER ].
Risiko hos patienter med phenylketonuri
SINGULAIR 4mg indeholder aspartam, en kilde til phenylalanin. Phenylalanin kan være skadeligt for patienter med phenylketonuri (PKU). Hver 4 mg og 5 mg tyggetablet indeholder henholdsvis 0,674 mg og 0,842 mg phenylalanin. Før du ordinerer SINGULAIR til en patient med PKU, skal du overveje den kombinerede daglige mængde phenylalanin fra alle kilder, inklusive SINGULAIR.
Patientrådgivningsinformation
For tabletterne og tyggetabletterne skal du rådgive patienten og/eller plejepersonalet til at læse den FDA-godkendte patientmærkning ( Medicinvejledning ).
For det orale granulat, råd patienten og/eller plejepersonalet til at læse den FDA-godkendte patientmærkning ( Medicinvejledning og brugsanvisning ).
- Rådgiv patienter om den potentielle risiko for alvorlige neuropsykiatriske symptomer og adfærdsændringer ved brug af SINGULAIR [se ADVARSLER OG FORHOLDSREGLER ].
- Diskuter fordele og risici ved SINGULAIR med patienter, når de ordinerer eller fortsætter behandlingen med SINGULAIR [se ADVARSLER OG FORHOLDSREGLER ].
- Rådgiv patienterne at overvåge for ændringer i adfærd eller neuropsykiatriske symptomer hos patienter, der tager SINGULAIR [se ADVARSLER OG FORHOLDSREGLER ].
- Instruer patienterne i at seponere SINGULAIR og kontakte en sundhedsplejerske med det samme, hvis der opstår ændringer i adfærd eller tankegang, som ikke er typiske for patienten, eller hvis patienten udvikler selvmordstanker eller selvmordsadfærd [se ADVARSLER OG FORHOLDSREGLER ].
- Rådgiv patienterne at tage SINGULAIR dagligt som foreskrevet, selv når de er asymptomatiske, såvel som i perioder med forværret astma, og at kontakte deres læge, hvis deres astma ikke er velkontrolleret.
- Rådgiv patienterne, at oral SINGULAIR ikke er til behandling af akutte astmaanfald. De bør have passende korttidsvirkende inhaleret β-agonistmedicin til rådighed til behandling af astmaeksacerbationer. Patienter, som har forværring af astma efter træning, bør instrueres i at have en korttidsvirkende inhaleret β-agonist til rådighed for redning. Daglig administration af SINGULAIR til kronisk behandling af astma er ikke blevet etableret for at forhindre akutte episoder af EIB [se ADVARSLER OG FORHOLDSREGLER ].
- Råd patienterne til at søge læge, hvis der er behov for korttidsvirkende inhalationsbronkodilatatorer oftere end normalt, eller hvis der er behov for mere end det maksimale antal inhalationer af korttidsvirkende bronkodilatatorbehandling ordineret i en 24-timers periode.
- Instruer patienterne i at fortsætte med anden anti-astma medicin som foreskrevet, medmindre det er instrueret af en læge.
- Instruer patienter med kendt aspirinfølsomhed i at fortsætte med at undgå aspirin eller ikke-steroide antiinflammatoriske midler, mens de tager SINGULAIR [se ADVARSLER OG FORHOLDSREGLER ].
- Informer phenylketonuriske patienter, at 4 mg og 5 mg tyggetabletterne indeholder phenylalanin (en kilde til aspartam) [se ADVARSLER OG FORHOLDSREGLER ].
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Der blev ikke set tegn på tumorigenicitet i carcinogenicitetsundersøgelser af hverken 2 år hos Sprague-Dawley-rotter eller 92 uger hos mus ved orale gavage-doser op til henholdsvis 200 mg/kg/dag eller 100 mg/kg/dag. Den estimerede eksponering hos rotter var ca. 120 og 75 gange AUC for henholdsvis voksne og børn ved den maksimalt anbefalede daglige orale dosis. Den estimerede eksponering hos mus var ca. 45 og 25 gange AUC for henholdsvis voksne og børn ved den maksimalt anbefalede daglige orale dosis.
Montelukast viste ingen tegn på mutagen eller klastogen aktivitet i følgende assays: mikrobiel mutageneseassay, V-79 pattedyrcellemutageneseassay, alkalisk elueringsassay i rotte-hepatocytter, kromosomafvigelsesassay i kinesisk hamster-ovarieceller og i vivo museknoglemarvskromosomafvigelsesassay.
fertilitetsundersøgelser hos hunrotter gav montelukast reduktioner i fertilitets- og frugtbarhedsindekser ved en oral dosis på 200 mg/kg (estimeret eksponering var ca. 70 gange AUC for voksne ved den maksimalt anbefalede daglige orale dosis). Der blev ikke observeret nogen effekt på kvindelig fertilitet eller frugtbarhed ved en oral dosis på 100 mg/kg (estimeret eksponering var ca. 20 gange AUC for voksne ved den maksimalt anbefalede daglige orale dosis). Montelukast havde ingen effekt på fertiliteten hos hanrotter ved orale doser op til 800 mg/kg (estimeret eksponering var ca. 160 gange AUC for voksne ved den maksimalt anbefalede daglige orale dosis).
Brug i specifikke populationer
Graviditet
Risikooversigt
Tilgængelige data fra publicerede prospektive og retrospektive kohortestudier over årtier med brug af montelukast til gravide kvinder har ikke påvist en lægemiddelassocieret risiko for større fødselsdefekter [se Data ]. I dyrereproduktionsstudier blev der ikke observeret uønskede udviklingseffekter ved oral administration af montelukast til drægtige rotter og kaniner under organogenese i doser på henholdsvis ca. 100 og 110 gange den maksimalt anbefalede humane daglige orale dosis (MRHDOD) baseret på AUC'er [se Data ].
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort for den angivne population er ukendt. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre ugunstige udfald. I
Den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2-4% og 15-20%.
Kliniske overvejelser
Sygdomsrelateret risiko for moder og/eller embryo/føtal
Dårligt eller moderat kontrolleret astma under graviditet øger moderens risiko for perinatale uønskede udfald såsom præeklampsi og præmaturitet hos spædbørn, lav fødselsvægt og lille i forhold til svangerskabsalderen.
Data
Menneskelige data
Publicerede data fra prospektive og retrospektive kohortestudier har ikke identificeret en sammenhæng med brug af SINGULAIR under graviditet og større fødselsdefekter. Tilgængelige undersøgelser har metodiske begrænsninger, herunder lille stikprøvestørrelse, i nogle tilfælde retrospektiv dataindsamling og inkonsekvente sammenligningsgrupper.
Dyredata
I undersøgelser af embryo-føtale udvikling forårsagede montelukast administreret til gravide rotter og kaniner under organogenese (drægtighedsdage 6 til 17 hos rotter og 6 til 18 hos kaniner) ingen uønskede udviklingsmæssige virkninger ved orale doser op til 400 og 300 mg/kg moder. /dag hos henholdsvis rotter og kaniner (henholdsvis ca. 100 og 110 gange AUC hos mennesker ved MRHDOD).
Amning
Risikooversigt
En offentliggjort klinisk laktationsundersøgelse rapporterer tilstedeværelsen af montelukast i modermælk. Data tilgængelige om lægemidlets virkning på spædbørn, enten direkte [se Pædiatrisk brug eller gennem modermælk, tyder ikke på en signifikant risiko for bivirkninger ved eksponering for SINGULAIR. Lægemidlets virkning på mælkeproduktionen er ukendt. De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for SINGULAIR 5mg og eventuelle bivirkninger på det ammede spædbarn fra SINGULAIR 10mg eller fra den underliggende moderens tilstand.
Pædiatrisk brug
SINGULAIRs sikkerhed og effektivitet mod astma er blevet fastslået hos pædiatriske patienter i alderen 6 til 14 år. Brug af SINGULAIR 4mg til denne indikation understøttes af beviser fra velkontrollerede undersøgelser. Sikkerheds- og effektdata i denne aldersgruppe svarer til dem, der er set hos voksne [se BIVIRKNINGER , KLINISK FARMAKOLOGI , Specifikke populationer , og Kliniske Studier ].
Effektiviteten af SINGULAIR til behandling af sæsonbestemt allergisk rhinitis hos pædiatriske patienter i alderen 2 til 14 år og til behandling af perennial allergisk rhinitis hos pædiatriske patienter i alderen 6 måneder til 14 år er blevet fastslået og understøttes af ekstrapolering fra den påviste effektivitet hos patienter 15 år og ældre med allergisk rhinitis samt antagelsen om, at sygdomsforløbet, patofysiologien og lægemidlets virkning er væsentligt ens blandt disse populationer.
Sikkerheden af SINGULAIR 4 mg tyggetabletter til pædiatriske patienter i alderen 2 til 5 år med astma er blevet påvist ved tilstrækkelige og velkontrollerede data [se BIVIRKNINGER ]. Effektiviteten af SINGULAIR 5 mg i denne aldersgruppe er ekstrapoleret fra den påviste effektivitet hos patienter i alderen 6 år og ældre med astma og er baseret på lignende farmakokinetiske data, samt antagelsen om, at sygdomsforløbet, patofysiologien og lægemidlets virkning er væsentligt ens. blandt disse befolkninger. Effektiviteten i denne aldersgruppe understøttes af eksplorative effektvurderinger fra et stort, velkontrolleret sikkerhedsstudie udført med patienter i alderen 2 til 5 år.
Sikkerheden af SINGULAIR 4-mg orale granulat hos pædiatriske patienter i alderen 12 til 23 måneder med astma er blevet påvist i en analyse af 172 pædiatriske patienter, hvoraf 124 blev behandlet med SINGULAIR, i en 6-ugers, dobbeltblindet placebo -kontrolleret undersøgelse [se BIVIRKNINGER ]. Effektiviteten af SINGULAIR i denne aldersgruppe er ekstrapoleret fra den påviste effektivitet hos patienter i alderen 6 år og ældre med astma baseret på tilsvarende gennemsnitlig systemisk eksponering (AUC), og at sygdomsforløbet, patofysiologien og lægemidlets virkning er væsentligt ens blandt disse populationer , understøttet af effektdata fra et sikkerhedsforsøg, hvor effekten var en eksplorativ vurdering.
Sikkerheden af SINGULAIR 4 mg og 5 mg tyggetabletter til pædiatriske patienter i alderen 2 til 14 år med allergisk rhinitis understøttes af data fra undersøgelser udført med pædiatriske patienter i alderen 2 til 14 år med astma. Et sikkerhedsstudie med pædiatriske patienter i alderen 2 til 14 år med sæsonbetinget allergisk rhinitis viste en lignende sikkerhedsprofil [se BIVIRKNINGER ]. Sikkerheden af SINGULAIR 4-mg orale granulat hos pædiatriske patienter så unge som 6 måneder med perennial allergisk rhinitis understøttes af ekstrapolering fra sikkerhedsdata opnået fra undersøgelser udført på pædiatriske patienter i alderen 6 måneder til 23 måneder med astma og fra farmakokinetiske data sammenligne systemisk eksponering hos patienter i alderen 6 måneder til 23 måneder med systemisk eksponering hos voksne.
Sikkerheden og effektiviteten hos pædiatriske patienter under 12 måneder med astma, 6 måneder med perennial allergisk rhinitis og 6 år med anstrengelsesinduceret bronkokonstriktion er ikke blevet fastlagt.
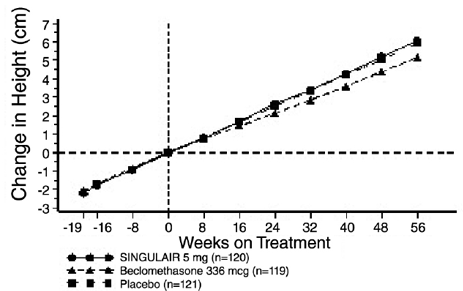
Vækstrate hos pædiatriske patienter
Et 56-ugers, multicenter, dobbeltblindt, randomiseret, aktiv- og placebokontrolleret parallelgruppestudie blev udført for at vurdere effekten af SINGULAIR 4 mg på væksthastigheden hos 360 patienter med mild astma i alderen 6 til 8 år. Behandlingsgrupper omfattede SINGULAIR 5 mg én gang dagligt, placebo og beclomethasondipropionat administreret som 168 mcg to gange dagligt med en spacer-anordning. For hvert individ blev en væksthastighed defineret som hældningen af en lineær regressionslinje, der passer til højdemålingerne over 56 uger. Den primære sammenligning var forskellen i vækstrater mellem SINGULAIR- og placebogrupperne. Vækstrater, udtrykt som mindste kvadraters (LS)-middelværdi (95 % CI) i cm/år, for SINGULAIR-, placebo- og beclomethason-behandlingsgrupperne var 5,67 (5,46, 5,88), 5,64 (5,42, 5,86) og 4,86 ( 4,64, 5,08). Forskellene i vækstrater, udtrykt som mindste kvadraters (LS) middelværdi (95 % CI) i cm/år, for SINGULAIR 5 mg minus placebo, beclomethason minus placebo og SINGULAIR 5 mg minus beclomethason behandlingsgrupper var 0,03 (-0,26, 0,31) , -0,78 (-1,06, -0,49); og henholdsvis 0,81 (0,53, 1,09). Væksthastighed (udtrykt som gennemsnitlig ændring i højde over tid) for hver behandlingsgruppe er vist i FIGUR 1.
Figur 1: Ændring i højde (cm) fra randomiseringsbesøg efter planlagt uge (middelværdi for behandlingsgruppe ± standardfejl* for gennemsnittet)
Geriatrisk brug
Af det samlede antal forsøgspersoner i kliniske studier med montelukast var 3,5 % 65 år og derover, og 0,4 % var 75 år og derover. Der blev ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet mellem disse forsøgspersoner og yngre forsøgspersoner, og anden rapporteret klinisk erfaring har ikke identificeret forskelle i respons mellem ældre og yngre patienter, men større følsomhed hos nogle ældre individer kan ikke udelukkes. Den farmakokinetiske profil og den orale biotilgængelighed af en enkelt 10 mg oral dosis montelukast er ens hos ældre og yngre voksne. Plasmahalveringstiden for montelukast er lidt længere hos ældre. Dosisjustering hos ældre er ikke nødvendig.
Nedsat leverfunktion
Ingen dosisjustering anbefales til patienter med let til moderat leverinsufficiens [se KLINISK FARMAKOLOGI ].
Nedsat nyrefunktion
Ingen dosisjustering anbefales til patienter med nyreinsufficiens [se KLINISK FARMAKOLOGI ].
OVERDOSIS
Der er ingen specifik information tilgængelig om behandling af overdosering med SINGULAIR. I tilfælde af overdosering er det rimeligt at anvende de sædvanlige støtteforanstaltninger; fjern f.eks. uabsorberet materiale fra mave-tarmkanalen, anvend klinisk overvågning og indled støttende behandling, hvis det er nødvendigt. Det vides ikke, om montelukast fjernes ved peritonealdialyse eller hæmodialyse.
KONTRAINDIKATIONER
SINGULAIR er kontraindiceret til patienter med overfølsomhed over for nogen af dets komponenter.
KLINISK FARMAKOLOGI
Handlingsmekanisme
Cysteinylleukotrienerne (LTC4, LTD4, LTE4) er produkter af arachidonsyremetabolisme og frigives fra forskellige celler, herunder mastceller og eosinofiler. Disse eicosanoider binder til cysteinylleukotrien (CysLT) receptorer. CysLT type-1 (CysLT1) receptoren findes i de menneskelige luftveje (inklusive glatte muskelceller i luftvejene og luftvejsmakrofager) og på andre pro-inflammatoriske celler (herunder eosinofiler og visse myeloid stamceller). CysLT'er er blevet korreleret med patofysiologien af astma og allergisk rhinitis. Ved astma inkluderer leukotrien-medierede virkninger luftvejsødem, sammentrækning af glatte muskler og ændret cellulær aktivitet forbundet med den inflammatoriske proces. Ved allergisk rhinitis frigives CysLT'er fra næseslimhinden efter allergeneksponering under både tidlig- og senfasereaktioner og er forbundet med symptomer på allergisk rhinitis.
Montelukast er et oralt aktivt stof, der binder sig med høj affinitet og selektivitet til CysLT1-receptoren (frem for andre farmakologisk vigtige luftvejsreceptorer, såsom den prostanoide, kolinerge eller β-adrenerge receptor). Montelukast hæmmer fysiologiske virkninger af LTD4 ved CysLT1-receptoren uden nogen agonistaktivitet.
Farmakodynamik
Montelukast forårsager hæmning af cysteinylleukotrien-receptorer i luftvejene som vist ved evnen til at hæmme bronkokonstriktion på grund af inhaleret LTD4 hos astmatikere. Doser så lave som 5 mg forårsager væsentlig blokering af LTD4-induceret bronkokonstriktion. I et placebo-kontrolleret, crossover-studie (n=12), hæmmede SINGULAIR 4 mg tidlig- og senfase bronkokonstriktion på grund af antigenpåvirkning med henholdsvis 75 % og 57 %.
Effekten af SINGULAIR 5mg på eosinofiler i det perifere blod blev undersøgt i kliniske forsøg. Hos patienter med astma i alderen 2 år og ældre, som fik SINGULAIR 10 mg, blev der observeret et fald i det gennemsnitlige eosinofiltal i perifert blod på fra 9 % til 15 % sammenlignet med placebo over de dobbeltblindede behandlingsperioder. Hos patienter med sæsonbestemt allergisk rhinitis i alderen 15 år og ældre, som fik SINGULAIR 4 mg, blev der observeret en gennemsnitlig stigning på 0,2 % i eosinofiltal i perifert blod sammenlignet med en gennemsnitlig stigning på 12,5 % hos placebobehandlede patienter i forhold til den dobbeltblindede behandling. perioder; dette afspejler en gennemsnitlig forskel på 12,3 % til fordel for SINGULAIR. Forholdet mellem disse observationer og de kliniske fordele ved montelukast, der er noteret i de kliniske forsøg, er ikke kendt [se Kliniske Studier ].
Farmakokinetik
Absorption
Montelukast absorberes hurtigt efter oral administration. Efter administration af den 10 mg filmovertrukne tablet til fastende voksne opnås den gennemsnitlige maksimale plasmakoncentration af montelukast (Cmax) efter 3 til 4 timer (Tmax). Den gennemsnitlige orale biotilgængelighed er 64%. Den orale biotilgængelighed og Cmax påvirkes ikke af et standardmåltid om morgenen.
For 5 mg tyggetabletten opnås den gennemsnitlige Cmax 2 til 2,5 timer efter administration til fastende voksne. Den gennemsnitlige orale biotilgængelighed er 73 % i fastende tilstand mod 63 %, når det administreres sammen med et standardmåltid om morgenen.
For 4 mg tyggetabletten opnås den gennemsnitlige Cmax 2 timer efter administration hos pædiatriske patienter i alderen 2 til 5 år i fastende tilstand.
Den orale granulatformulering på 4 mg er bioækvivalent med 4 mg tyggetabletten, når den administreres til fastende voksne. Samtidig administration af den orale granulatformulering med æblemos havde ikke en klinisk signifikant effekt på farmakokinetikken af montelukast. Et fedtrigt måltid om morgenen påvirkede ikke AUC for orale montelukastgranulat; måltidet reducerede imidlertid Cmax med 35 % og forlængede Tmax fra 2,3 ± 1,0 timer til 6,4 ± 2,9 timer.
SINGULAIRs sikkerhed og effektivitet hos patienter med astma blev påvist i kliniske forsøg, hvor formuleringerne af 10 mg filmovertrukne tabletter og 5 mg tyggetabletter blev administreret om aftenen uden hensyntagen til tidspunktet for fødeindtagelse. Sikkerheden af SINGULAIR 4 mg hos patienter med astma blev også påvist i kliniske forsøg, hvor 4 mg tyggetablet og 4 mg oral granulat blev administreret om aftenen uden hensyntagen til tidspunktet for fødeindtagelse. SINGULAIRs sikkerhed og effektivitet hos patienter med sæsonbestemt allergisk rhinitis blev påvist i kliniske forsøg, hvor den 10 mg filmovertrukne tablet blev administreret om morgenen eller aftenen uden hensyntagen til tidspunktet for indtagelse af føde.
Den sammenlignende farmakokinetik af montelukast administreret som to 5 mg tyggetabletter versus en 10 mg filmovertrukket tablet er ikke blevet evalueret.
Fordeling
Montelukast er mere end 99 % bundet til plasmaproteiner. Steady state fordelingsvolumen for montelukast er i gennemsnit 8 til 11 liter. Oralt administreret montelukast fordeler sig i hjernen hos rotter.
Elimination
Plasmaclearance af montelukast er i gennemsnit 45 ml/min hos raske voksne. Efter en oral dosis af radioaktivt mærket montelukast blev 86 % af radioaktiviteten genfundet i 5-dages fækal samlinger, og
I flere undersøgelser varierede den gennemsnitlige plasmahalveringstid for montelukast fra 2,7 til 5,5 timer hos raske unge voksne. Montelukasts farmakokinetik er næsten lineær for orale doser op til 50 mg. Ved dosering én gang dagligt med 10 mg montelukast er der ringe akkumulering af moderlægemidlet i plasma (14%).
Metabolisme
Montelukast metaboliseres i høj grad. I studier med terapeutiske doser er plasmakoncentrationer af metabolitter af montelukast ikke påviselige ved steady state hos voksne og pædiatriske patienter.
In vitro undersøgelser med humane levermikrosomer indikerer, at CYP3A4, 2C8 og 2C9 er involveret i metabolismen af montelukast. Ved klinisk relevante koncentrationer ser 2C8 ud til at spille en stor rolle i metabolismen af montelukast.
Specifikke populationer
Patienter med nedsat leverfunktion
Patienter med mild til moderat leverinsufficiens og kliniske tegn på cirrhose havde tegn på nedsat metabolisme af montelukast, hvilket resulterede i 41 % (90 % CI=7 %, 85 %) højere gennemsnitlig AUC for montelukast efter en enkelt dosis på 10 mg. Eliminationen af montelukast var let forlænget sammenlignet med den hos raske forsøgspersoner (gennemsnitlig halveringstid, 7,4 timer). Dosisjustering er ikke nødvendig hos patienter med let til moderat leverinsufficiens. Farmakokinetikken af SINGULAIR hos patienter med mere alvorlig leverinsufficiens eller med hepatitis er ikke blevet evalueret.
Patienter med nedsat nyrefunktion
Da montelukast og dets metabolitter ikke udskilles i urinen, blev montelukasts farmakokinetik ikke evalueret hos patienter med nyreinsufficiens. Ingen dosisjustering anbefales til disse patienter.
Mandlige og kvindelige patienter
Farmakokinetikken af montelukast er ens hos mænd og kvinder.
Racegrupper
Farmakokinetiske forskelle på grund af race er ikke blevet undersøgt.
Unge og pædiatriske patienter
Farmakokinetiske undersøgelser evaluerede den systemiske eksponering af 4 mg oral granula formulering hos pædiatriske patienter i alderen 6 til 23 måneder, 4 mg tyggetabletter hos pædiatriske patienter i alderen 2 til 5 år, 5 mg tyggetabletter hos pædiatriske patienter 6 til 14 år og de 10 mg filmovertrukne tabletter til unge voksne og unge ≥15 år.
Plasmakoncentrationsprofilen for montelukast efter administration af den 10 mg filmovertrukne tablet er ens hos unge ≥15 år og unge voksne. Den 10 mg filmovertrukne tablet anbefales til patienter ≥15 år.
Den gennemsnitlige systemiske eksponering af 4 mg tyggetablet hos pædiatriske patienter i alderen 2 til 5 år og 5 mg tyggetabletter hos pædiatriske patienter i alderen 6 til 14 år svarer til den gennemsnitlige systemiske eksponering af 10 mg film- overtrukket tablet hos voksne. 5 mg tyggetabletten bør anvendes til pædiatriske patienter i alderen 6 til 14 år, og 4 mg tyggetabletten bør anvendes til pædiatriske patienter i alderen 2 til 5 år.
Hos børn i alderen 6 til 11 måneder var den systemiske eksponering for montelukast og variabiliteten af plasmakoncentrationer af montelukast højere end dem, der blev observeret hos voksne. Baseret på populationsanalyser var den gennemsnitlige AUC (4296 ng•time/mL [interval 1200 til 7153]) 60 % højere, og den gennemsnitlige Cmax (667 ng/ml [interval 201 til 1058]) var 89 % højere end dem, der blev observeret i voksne (gennemsnitlig AUC 2689 ng•time/ml [interval 1521 til 4595]) og gennemsnitlig Cmax (353 ng/ml [interval 180 til 548]). Den systemiske eksponering hos børn i alderen 12 til 23 måneder var mindre variabel, men var stadig højere end den, der blev observeret hos voksne. Den gennemsnitlige AUC (3574 ng•time/mL [interval 2229 til 5408]) var 33 % højere, og den gennemsnitlige Cmax (562 ng/ml [interval 296 til 814]) var 60 % højere end dem, der blev observeret hos voksne. Sikkerhed og tolerabilitet af montelukast i en enkeltdosis farmakokinetisk undersøgelse med 26 børn i alderen 6 til 23 måneder var den samme som hos patienter to år og derover [se BIVIRKNINGER ]. Den orale granulatformulering på 4 mg bør anvendes til pædiatriske patienter i alderen 12 til 23 måneder til behandling af astma eller til pædiatriske patienter i alderen 6 til 23 måneder til behandling af perennial allergisk rhinitis. Da 4 mg oral granulatformulering er bioækvivalent med 4 mg tyggetabletten, kan den også bruges som en alternativ formulering til 4 mg tyggetabletten til pædiatriske patienter i alderen 2 til 5 år.
Lægemiddelinteraktionsstudier
Theophyllin, Prednison og Prednisolon
SINGULAIR er blevet administreret sammen med andre terapier, der rutinemæssigt anvendes til profylakse og kronisk behandling af astma uden nogen tilsyneladende stigning i bivirkninger. I lægemiddelinteraktionsstudier havde den anbefalede kliniske dosis af montelukast ikke klinisk vigtig effekt på farmakokinetikken af følgende lægemidler: theophyllin, prednison og prednisolon.
Montelukast i en dosis på 10 mg én gang dagligt doseret til farmakokinetisk steady state forårsagede ikke klinisk signifikante ændringer i kinetikken af en enkelt intravenøs dosis af theophyllin [overvejende et cytokrom P450 (CYP) 1A2-substrat]. Montelukast i doser på ≥100 mg dagligt doseret til farmakokinetisk steady state forårsagede ingen klinisk signifikant ændring i plasmaprofiler af prednison eller prednisolon efter administration af enten oral prednison eller intravenøs prednisolon.
Orale præventionsmidler, Fexofenadin, Digoxin og Warfarin
lægemiddelinteraktionsstudier havde den anbefalede kliniske dosis af montelukast ikke klinisk vigtig effekt på farmakokinetikken af følgende lægemidler: orale præventionsmidler (norethindron 1 mg/ethinylestradiol 35 mcg), digoxin og warfarin. Montelukast ved doser på ≥100 mg dagligt doseret til farmakokinetisk steady state ændrede ikke signifikant plasmakoncentrationerne af nogen af komponenterne i et oralt præventionsmiddel indeholdende norethindron 1 mg/ethinylestradiol 35 mcg. Montelukast i en dosis på 10 mg én gang dagligt doseret til farmakokinetisk steady state ændrede ikke plasmakoncentrationsprofilen af fexofenadin, ændrede ikke den farmakokinetiske profil eller urinudskillelse af immunreaktivt digoxin; ændrede ikke den farmakokinetiske profil af warfarin (primært et substrat af CYP2C9, 3A4 og 1A2) eller påvirkede virkningen af en enkelt 30 mg oral dosis warfarin på protrombintid eller International Normalized Ratio (INR).
Skjoldbruskkirtelhormoner, beroligende hypnotika, ikke-steroide antiinflammatoriske midler, benzodiazepiner og dekongestanter
Selvom yderligere specifikke interaktionsundersøgelser ikke blev udført, blev SINGULAIR brugt sammen med en lang række almindeligt ordinerede lægemidler i kliniske undersøgelser uden tegn på kliniske bivirkninger. Disse medikamenter omfattede thyreoideahormoner, beroligende hypnotika, ikke-steroide antiinflammatoriske midler, benzodiazepiner og dekongestanter.
Cytokrom P450 (CYP) enzyminducere
Phenobarbital, som inducerer levermetabolisme, reducerede arealet under plasmakoncentrationskurven (AUC) af montelukast med ca. 40 % efter en enkelt dosis på 10 mg montelukast. Ingen dosisjustering af SINGULAIR anbefales. Det er rimeligt at anvende passende klinisk monitorering, når potente CYP-enzyminducere, såsom phenobarbital eller rifampin, administreres sammen med SINGULAIR.
Virkning af Montelukast på cytokrom P450 (CYP) enzymer
Montelukast er en potent hæmmer af CYP2C8 in vitro. Data fra et klinisk lægemiddelinteraktionsstudie, der involverede montelukast og rosiglitazon (et probesubstrat, der er repræsentativt for lægemidler, der primært metaboliseres af CYP2C8) hos 12 raske personer, viste imidlertid, at farmakokinetikken af rosiglitazon ikke ændres, når lægemidlerne administreres samtidigt, hvilket indikerer, at montelukast gør hæmmer ikke CYP2C8 in vivo. Derfor forventes montelukast ikke at ændre metabolismen af lægemidler, der metaboliseres af dette enzym (f.eks. paclitaxel, rosiglitazon og repaglinid). Baseret på yderligere in vitro-resultater i humane levermikrosomer hæmmer terapeutiske plasmakoncentrationer af montelukast ikke CYP 3A4, 2C9, 1A2, 2A6, 2C19 eller 2D6.
Cytokrom P450 (CYP) enzymhæmmere
In vitro undersøgelser har vist, at montelukast er et substrat for CYP 2C8, 2C9 og 3A4. Samtidig administration af montelukast og itraconazol, en stærk CYP 3A4-hæmmer, resulterede ikke i nogen signifikant stigning i den systemiske eksponering af montelukast. Data fra et klinisk lægemiddelinteraktionsstudie, der involverede montelukast og gemfibrozil (en hæmmer af både CYP 2C8 og 2C9) viste, at gemfibrozil i en terapeutisk dosis øgede den systemiske eksponering af montelukast med 4,4 gange. Samtidig administration af itraconazol, gemfibrozil og montelukast øgede ikke yderligere den systemiske eksponering af montelukast. Baseret på tilgængelig klinisk erfaring er dosisjustering af montelukast ikke nødvendig ved samtidig administration med gemfibrozil [se OVERDOSIS ].
Kliniske Studier
Astma
Voksne og unge 15 år og ældre med astma
Kliniske forsøg med voksne og unge på 15 år og ældre viste, at der ikke er nogen yderligere klinisk fordel ved doser af montelukast over 10 mg én gang dagligt.
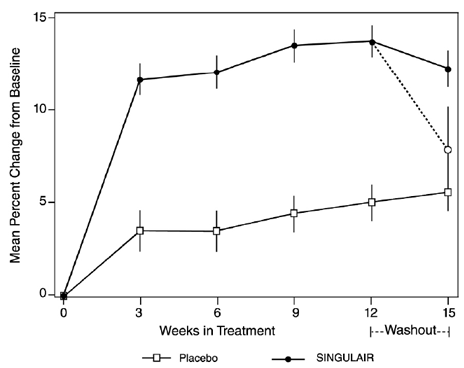
Effekten af SINGULAIR til kronisk behandling af astma hos voksne og unge på 15 år og ældre blev påvist i to (US og multinationale) lignende udformede, randomiserede, 12-ugers, dobbeltblindede, placebokontrollerede forsøg med 1576 patienter ( 795 behandlet med SINGULAIR, 530 behandlet med placebo og 251 behandlet med aktiv kontrol). Medianalderen var 33 år (interval 15 til 85); 56,8% var kvinder og 43,2% var mænd. Den etniske/racefordeling i disse undersøgelser var 71,6% kaukasiske, 17,7% latinamerikanske, 7,2% andre oprindelser og 3,5% sorte. Patienterne havde mild eller moderat astma og var ikke-rygere, som krævede ca. 5 pust af inhaleret β-agonist om dagen på en "efter behov". Patienterne havde en gennemsnitlig baselineprocent af forudsagt forceret eksspiratorisk volumen på 1 sekund (FEV1) på 66 % (omtrentligt interval, 40 til 90 %). De co-primære endepunkter i disse forsøg var FEV1 og astmasymptomer i dagtimerne. I begge undersøgelser efter 12 uger blev en tilfældig undergruppe af patienter, der fik SINGULAIR 5 mg, skiftet til placebo i yderligere 3 ugers dobbeltblind behandling for at evaluere for mulige rebound-effekter.
Resultaterne af det amerikanske forsøg med det primære endepunkt, FEV1 om morgenen, udtrykt som gennemsnitlig procentændring fra baseline i gennemsnit over den 12-ugers behandlingsperiode, er vist i FIGUR 2. Sammenlignet med placebo, behandling med én SINGULAIR 10 mg tablet dagligt i aftenen resulterede i en statistisk signifikant stigning i FEV1 procent ændring fra baseline (13,0 % ændring i gruppen behandlet med SINGULAIR 4 mg vs. 4,2 % ændring i placebogruppen, p
Figur 2: FEV1 gennemsnitlig procentændring fra baseline (USA-forsøg: SINGULAIR 5mg N=406; Placebo N=270) (ANOVA-model)
Effekten af SINGULAIR 5mg på andre primære og sekundære endepunkter, repræsenteret af det multinationale studie, er vist i Tabel 6. Resultaterne for disse endepunkter var ens i det amerikanske studie.
Begge undersøgelser evaluerede effekten af SINGULAIR 4mg på sekundære resultater, herunder astmaanfald (udnyttelse af sundhedsressourcer såsom et uplanlagt besøg på lægekontoret, skadestuen eller hospitalet; eller behandling med oral, intravenøs eller intramuskulært kortikosteroid) og brug af orale kortikosteroider til astmaredning. I det multinationale studie oplevede signifikant færre patienter (15,6 % af patienterne) på SINGULAIR astmaanfald sammenlignet med patienter på placebo (27,3 %, p
Indtræden af handling og vedligeholdelse af effekter
I hvert placebokontrolleret forsøg med voksne blev behandlingseffekten af SINGULAIR 4 mg, målt ved daglige dagbogskortparametre, inklusive symptomscore, "efter behov" brug af β-agonist og PEFR-målinger, opnået efter den første dosis og blev opretholdt gennem hele doseringsintervallet (24 timer). Der blev ikke observeret nogen signifikant ændring i behandlingseffekt under kontinuerlig administration én gang dagligt om aftenen i ikke-placebokontrollerede forlængelsesforsøg i op til et år. Seponering af SINGULAIR 4 mg hos astmatiske patienter efter 12 ugers kontinuerlig brug forårsagede ikke rebound-forværring af astma.
Pædiatriske patienter i alderen 6 til 14 år med astma
Effekten af SINGULAIR 5 mg hos pædiatriske patienter i alderen 6 til 14 år blev påvist i et 8-ugers, dobbeltblindt, placebo-kontrolleret forsøg med 336 patienter (201 behandlet med SINGULAIR og 135 behandlet med placebo) under anvendelse af en inhaleret β-agonist på "efter behov". Patienterne havde en gennemsnitlig baseline procent forudsagt FEV1 på 72 % (omtrentligt område, 45 til 90 %) og et gennemsnitligt dagligt behov for inhaleret β-agonist på 3,4 pust albuterol. Ca. 36 % af patienterne fik inhalerede kortikosteroider. Medianalderen var 11 år (interval 6 til 15); 35,4% var kvinder og 64,6% var mænd. Den etniske/racefordeling i denne undersøgelse var 80,1 % kaukasiske, 12,8 % sorte, 4,5 % latinamerikanske og 2,7 % af andre oprindelser.
Sammenlignet med placebo resulterede behandling med en 5 mg SINGULAIR 4 mg tyggetablet dagligt i en signifikant forbedring i den gennemsnitlige FEV1 procents ændring om morgenen fra baseline (8,7 % i gruppen behandlet med SINGULAIR 4 mg vs. 4,2 % ændring fra baseline i placebogruppen, p
lighed med voksne undersøgelser blev der ikke observeret nogen signifikant ændring i behandlingseffekten under kontinuerlig administration én gang dagligt i et åbent forlængelsesforsøg uden en samtidig placebogruppe i op til 6 måneder.
Pædiatriske patienter i alderen 2 til 5 år med astma
Effekten af SINGULAIR til kronisk behandling af astma hos pædiatriske patienter i alderen 2 til 5 år blev undersøgt i et 12-ugers placebokontrolleret sikkerheds- og tolerabilitetsstudie med 689 patienter, hvoraf 461 blev behandlet med SINGULAIR. Medianalderen var 4 år (interval 2 til 6); 41,5% var kvinder og 58,5% var mænd. Den etniske/racefordeling i denne undersøgelse var 56,5% kaukasiske, 20,9% latinamerikanske, 14,4% andre oprindelser og 8,3% sorte.
Mens det primære formål var at bestemme sikkerheden og tolerabiliteten af SINGULAIR 10mg i denne aldersgruppe, omfattede undersøgelsen eksplorative effektevalueringer, herunder astmasymptomer om dagen og natten over, brug af β-agonist, oral corticosteroid redning og lægens globale evaluering. Resultaterne af disse eksplorative effektevalueringer, sammen med farmakokinetik og ekstrapolering af effektdata fra ældre patienter, understøtter den overordnede konklusion om, at SINGULAIR er effektivt til vedligeholdelsesbehandling af astma hos patienter i alderen 2 til 5 år.
Virkninger hos patienter på samtidige inhalerede kortikosteroider
Separate undersøgelser hos voksne evaluerede SINGULAIR 10 mg's evne til at øge den kliniske effekt af inhalerede kortikosteroider og tillade nedtrapning af inhalerede kortikosteroider, når de bruges samtidigt.
Et randomiseret, placebo-kontrolleret, parallelgruppeforsøg (n=226) inkluderede voksne med stabil astma med en gennemsnitlig FEV1 på ca. 84 % af de forudsagte, som tidligere blev opretholdt på forskellige inhalerede kortikosteroider (udgivet af aerosol- eller tørpulverinhalatorer med afmålt dosis). ). Medianalderen var 41,5 år (interval 16 til 70); 52,2% var kvinder og 47,8% var mænd. Den etniske/racefordeling i denne undersøgelse var 92,0 % kaukasiske, 3,5 % sorte, 2,2 % latinamerikanske og 2,2 % asiatiske. Typerne af inhalerede kortikosteroider og deres gennemsnitlige baseline-krav inkluderede beclomethasondipropionat (gennemsnitlig dosis, 1203 mcg/dag), triamcinolonacetonid (gennemsnitlig dosis, 2004 mcg/dag), flunisolid (gennemsnitlig dosis, 1971 mcg/dag), fluticasonpropionat ( dosis, 1083 mcg/dag), eller budesonid (gennemsnitlig dosis, 1192 mcg/dag). Nogle af disse inhalerede kortikosteroider var ikke-amerikansk-godkendte formuleringer, og de udtrykte doser er muligvis ikke ex-aktuator. Kravet til inhaleret kortikosteroid før undersøgelsen blev reduceret med ca. 37 % i løbet af en 5- til 7-ugers placebo-indkøringsperiode designet til at titrere patienter mod deres laveste effektive inhalerede kortikosteroiddosis. Behandling med SINGULAIR 4 mg resulterede i en yderligere 47 % reduktion i den gennemsnitlige inhalerede kortikosteroiddosis sammenlignet med en gennemsnitlig reduktion på 30 % i placebogruppen over den 12-ugers aktive behandlingsperiode (p≤0,05). Det vides ikke, om resultaterne af denne undersøgelse kan generaliseres til patienter med astma, som kræver højere doser af inhalerede kortikosteroider eller systemiske kortikosteroider.
et andet randomiseret, placebokontrolleret, parallelgruppeforsøg (n=642) i en lignende population af voksne patienter, der tidligere var opretholdt, men ikke tilstrækkeligt kontrolleret, på inhalerede kortikosteroider (beclomethason 336 mcg/dag), resulterede tilføjelsen af SINGULAIR til beclomethason i statistisk signifikante forbedringer i FEV1 sammenlignet med de patienter, der blev fortsat på beclomethason alene eller de patienter, der blev seponeret fra beclomethason og behandlet med montelukast eller placebo alene i løbet af de sidste 10 uger af den 16-ugers, blindede behandlingsperiode. Patienter, der blev randomiseret til behandlingsarme indeholdende beclomethason, havde statistisk signifikant bedre astmakontrol end de patienter, der var randomiseret til SINGULAIR alene eller placebo alene som angivet ved FEV1, dagtimerne astmasymptomer, PEFR, natlige opvågninger på grund af astma og "efter behov" β- agonistkrav.
Hos voksne patienter med astma med dokumenteret aspirinfølsomhed, hvoraf næsten alle fik samtidig inhalerede og/eller orale kortikosteroider, viste et 4-ugers, randomiseret parallelgruppeforsøg (n=80), at SINGULAIR 10 mg sammenlignet med placebo resulterede i. i betydelig forbedring af parametrene for astmakontrol. Effektstørrelsen af SINGULAIR 4mg hos aspirinfølsomme patienter svarede til den effekt, der blev observeret i den generelle population af undersøgte astmapatienter. Effekten af SINGULAIR på det bronkokonstriktorrespons på aspirin eller andre ikke-steroide antiinflammatoriske lægemidler hos aspirinfølsomme astmatiske patienter er ikke blevet evalueret [se ADVARSLER OG FORHOLDSREGLER ].
Træningsinduceret bronkokonstriktion (EIB)
Træningsinduceret bronkokonstriktion (voksne, unge og pædiatriske patienter i alderen 6 år og ældre)
Effekten af SINGULAIR 5 mg, 10 mg, givet som en enkelt dosis 2 timer før træning til forebyggelse af EIB, blev undersøgt i tre (USA og multinationale), randomiserede, dobbeltblindede, placebokontrollerede crossover-studier, der omfattede i alt 160 voksne og unge patienter 15 år og ældre med EIB. Træningstestning blev udført 2 timer, 8,5 eller 12 timer og 24 timer efter administration af en enkelt dosis af undersøgelseslægemidlet (SINGULAIR 10 mg eller placebo). Det primære endepunkt var det gennemsnitlige maksimale procentvise fald i FEV1 efter 2 timers træningsudfordring efter dosis i alle tre undersøgelser (undersøgelse A, undersøgelse B og undersøgelse C). I undersøgelse A viste en enkelt dosis SINGULAIR 10 mg en statistisk signifikant beskyttende fordel mod EIB, når den blev taget 2 timer før træning. Nogle patienter blev beskyttet mod EIB 8,5 og 24 timer efter administration; nogle patienter var dog ikke. Resultaterne for det gennemsnitlige maksimale fald i procent på hvert tidspunkt i undersøgelse A er vist i TABEL 7 og er repræsentative for resultaterne fra de to andre undersøgelser.
Effekten af SINGULAIR 5-mg tyggetabletter, når de blev givet som en enkelt dosis 2 timer før træning for at forebygge EIB, blev undersøgt i et multinationalt, randomiseret, dobbeltblindt, placebokontrolleret crossover-studie, der omfattede i alt 64 pædiatriske patienter i alderen 6 til 14 år med EIB. Træningstest blev udført 2 timer og 24 timer efter administration af en enkelt dosis af undersøgelseslægemidlet (SINGULAIR 5 mg eller placebo). Det primære endepunkt var det gennemsnitlige maksimale procentvise fald i FEV1 efter 2 timers træningsudfordring efter dosis. En enkelt dosis SINGULAIR 5 mg viste en statistisk signifikant beskyttende fordel mod EIB, når den blev taget 2 timer før træning (TABEL 8). Lignende resultater blev vist 24 timer efter dosis (et sekundært endepunkt). Nogle patienter blev beskyttet mod EIB 24 timer efter administration; nogle patienter var dog ikke. Ingen tidspunkter blev vurderet mellem 2 og 24 timer efter dosis.
Effekten af SINGULAIR 5 mg til forebyggelse af EIB hos patienter under 6 år er ikke blevet fastslået.
Daglig administration af SINGULAIR 4 mg til kronisk behandling af astma er ikke blevet etableret for at forhindre akutte episoder af EIB.
et 12-ugers, randomiseret, dobbelt-blindt, parallelgruppestudie af 110 voksne og unge astmatikere på 15 år og ældre, med en gennemsnitlig baseline FEV1 procent af forventet på 83 % og med dokumenteret træningsinduceret forværring af astma, behandling med SINGULAIR, 10 mg, én gang dagligt om aftenen, resulterede i en statistisk signifikant reduktion i det gennemsnitlige maksimale procentvise fald i FEV1 og den gennemsnitlige tid til restitution til inden for 5 % af FEV1 før træning. Træningsudfordring blev udført ved slutningen af doseringsintervallet (dvs. 20 til 24 timer efter den foregående dosis). Denne effekt blev opretholdt i hele den 12-ugers behandlingsperiode, hvilket indikerer, at tolerance ikke forekom. SINGULAIR 4mg forhindrede dog ikke klinisk signifikant forringelse af maksimalt procentvis fald i FEV1 efter træning (dvs. ≥20 % fald fra før træningsbaseline) hos 52 % af de undersøgte patienter. I et separat crossover-studie med voksne blev en lignende effekt observeret efter to en gang daglige 10 mg doser af SINGULAIR.
Hos pædiatriske patienter i alderen 6 til 14 år, der brugte 5 mg tyggetabletten, viste en 2-dages crossover-undersøgelse virkninger svarende til dem, der blev observeret hos voksne, når træningsudfordring blev udført ved slutningen af doseringsintervallet (dvs. 20 til 24 timer efter den foregående dosis).
Allergisk rhinitis (sæsonbestemt og flerårig)
Sæsonbestemt allergisk rhinitis
Effekten af SINGULAIR-tabletter til behandling af sæsonbetinget allergisk rhinitis blev undersøgt i 5 lignende udformede, randomiserede, dobbeltblindede, parallelgruppe-, placebo- og aktiv-kontrollerede (loratadin) forsøg udført i Nordamerika. De 5 forsøg inkluderede i alt 5029 patienter, hvoraf 1799 blev behandlet med SINGULAIR-tabletter. Patienterne var i alderen 15 til 82 år med en anamnese med sæsonbetinget allergisk rhinitis, en positiv hudtest for mindst ét relevant sæsonbestemt allergen og aktive symptomer på sæsonbestemt allergisk rhinitis ved studiestart.
Perioden med randomiseret behandling var 2 uger i 4 forsøg og 4 uger i et forsøg. Den primære udfaldsvariabel var gennemsnitlig ændring fra baseline i score for næsesymptomer i dagtimerne (gennemsnittet af individuelle scorer af tilstoppet næse, rhinoré, næsekløe, nysen) vurderet af patienter på en kategorisk skala fra 0-3.
Fire af de fem forsøg viste en signifikant reduktion i score for nasale symptomer i dagtimerne med SINGULAIR 10 mg tabletter sammenlignet med placebo. Resultaterne af et forsøg er vist nedenfor. Medianalderen i dette forsøg var 35,0 år (interval 15 til 81); 65,4% var kvinder og 34,6% var mænd. Den etniske/racefordeling i denne undersøgelse var 83,1 % kaukasiske, 6,4 % andre oprindelser, 5,8 % sorte og 4,8 % latinamerikanske. De gennemsnitlige ændringer i forhold til baseline i næsesymptomer i dagtimerne i behandlingsgrupperne, der modtog SINGULAIR 4 mg tabletter, loratadin og placebo, er vist i TABEL 9. De resterende tre forsøg, der viste effekt, viste lignende resultater. Effekt blev påvist for sæsonbestemt allergisk rhinitis, når montelukast blev administreret om morgenen eller om aftenen.
Flerårig allergisk rhinitis
Effekten af SINGULAIR 5 mg tabletter til behandling af flerårig allergisk rhinitis blev undersøgt i 2 randomiserede, dobbeltblindede, placebokontrollerede undersøgelser udført i Nordamerika og Europa. De to undersøgelser inkluderede i alt 3357 patienter, hvoraf 1632 fik SINGULAIR 10 mg tabletter. Patienter i alderen 15 til 82 år med perennial allergisk rhinitis som bekræftet af historie og en positiv hudtest for mindst ét relevant flerårigt allergen (støvmider, dyreskæl og/eller skimmelsporer), som havde aktive symptomer på undersøgelsestidspunktet indgang, blev tilmeldt.
undersøgelsen, hvor virkning blev påvist, var medianalderen 35 år (interval 15 til 81); 64,1% var kvinder og 35,9% var mænd. Den etniske/racefordeling i denne undersøgelse var 83,2 % kaukasiske, 8,1 % sorte, 5,4 % latinamerikanske, 2,3 % asiatiske og 1,0 % af anden oprindelse. SINGULAIR 10 mg tabletter én gang dagligt viste sig at reducere symptomerne på flerårig allergisk rhinitis signifikant over en 6-ugers behandlingsperiode (TABEL 10); i denne undersøgelse var den primære udfaldsvariabel gennemsnitlig ændring fra baseline i score for næsesymptomer i dagtimerne (gennemsnittet af individuelle scorer for tilstoppet næse, rhinoré og nysen).
Den anden 6-ugers undersøgelse evaluerede SINGULAIR 10 mg (n=626), placebo (n=609) og en aktiv kontrol (cetirizin 10 mg; n=120). Den primære analyse sammenlignede den gennemsnitlige ændring fra baseline i score for nasale symptomer i dagtimerne for SINGULAIR vs. placebo i løbet af de første 4 ugers behandling; undersøgelsen var ikke designet til statistisk sammenligning mellem SINGULAIR og den aktive kontrol. Den primære udfaldsvariabel inkluderede næsekløe ud over tilstoppet næse, rhinoré og nysen. Den estimerede forskel mellem SINGULAIR og placebo var -0,04 med en 95 % CI på (-0,09, 0,01). Den estimerede forskel mellem den aktive kontrol og placebo var -0,10 med en 95 % CI på (-0,19, -0,01).
PATIENTOPLYSNINGER
SINGULAIR® (SING-u-lair)(montelukastnatrium) tyggetabletter
Hvad er den vigtigste information, jeg bør vide om SINGULAIR 4mg?Der er opstået alvorlige psykiske problemer hos personer, der tager SINGULAIR eller endda efter at behandlingen er stoppet.
Dette kan ske hos mennesker med eller uden en historie med psykiske problemer. Stop med at tage SINGULAIR og fortæl din læge med det samme, hvis du eller dit barn har nogle usædvanlige ændringer i adfærd eller tankegang, herunder nogle af disse symptomer:
- agitation, herunder aggressiv adfærd eller fjendtlighed
- opmærksomhedsproblemer
- dårlige eller livlige drømme
- depression
- desorientering (forvirring)
- føler sig angst
- irritabilitet
- hallucinationer (at se eller høre ting, der ikke rigtig er der)
- hukommelsesproblemer
- obsessiv-kompulsive symptomer
- rastløshed
- gå i søvne
- stammende
- selvmordstanker og -handlinger (inklusive selvmord)
- rysten
- problemer med at sove
- ukontrollerede muskelbevægelser
Hvad er SINGULAIR 10mg?
SINGULAIR 4mg er en receptpligtig medicin, der blokerer stoffer i kroppen kaldet leukotriener. Dette kan hjælpe med at forbedre symptomer på astma og betændelse i næseslimhinden (allergisk rhinitis). SINGULAIR indeholder ikke et steroid. SINGULAIR bruges til:
- udendørs allergier, der opstår en del af året (sæsonbestemt allergisk rhinitis) hos voksne og børn i alderen 2 år og ældre, og
- indendørs allergier, der forekommer hele året (perennial allergisk rhinitis) hos voksne og børn i alderen 6 måneder og ældre.
Lade være med tag SINGULAIR, hvis du er allergisk over for nogle af indholdsstofferne. Se slutningen af denne medicinvejledning for en komplet liste over ingredienserne i SINGULAIR.
Inden du tager SINGULAIR 4mg, skal du fortælle din læge om alle dine medicinske tilstande, herunder hvis du:
- er allergisk over for aspirin.
- har phenylketonuri. SINGULAIR tyggetabletter indeholder aspartam, en kilde til phenylalanin.
- har eller har haft psykiske problemer.
- er gravid eller planlægger at blive gravid. Tal med din læge, hvis du er gravid eller planlægger at blive gravid, SINGULAIR 4mg er muligvis ikke det rigtige for dig.
- ammer eller planlægger at amme. Det vides ikke, om SINGULAIR udskilles i din modermælk. Tal med din læge om den bedste måde at fodre din baby på, mens du tager SINGULAIR.
Fortæl din sundhedsudbyder om al den medicin, du tager, inklusive receptpligtig og håndkøbsmedicin, vitaminer og naturlægemidler. Nogle lægemidler kan påvirke, hvordan SINGULAIR virker, eller SINGULAIR 4mg kan påvirke, hvordan din anden medicin virker.
Hvordan skal jeg tage SINGULAIR 10mg?
Til nogen som helst hvem tager SINGULAIR:
- Læs den detaljerede Brugsanvisning der kommer med SINGULAIR orale granulat.
- Tag SINGULAIR 4mg nøjagtigt som foreskrevet af din læge. Din læge vil fortælle dig, hvor meget SINGULAIR du skal tage, og hvornår man skal tage det.
- Stop med at tage SINGULAIR 5mg og fortæl din læge med det samme, hvis du eller dit barn har nogle usædvanlige ændringer i adfærd eller tankegang.
- Du kan tage SINGULAIR 5mg med mad eller uden mad. Se afsnittet "Hvordan kan jeg give SINGULAIR orale granulat til mit barn?" i Brugsanvisning for information om, hvilke fødevarer og væsker der kan tages med SINGULAIR 10 mg orale granulat.
- Hvis du eller dit barn glemmer en dosis SINGULAIR, skal du blot tage den næste dosis på dit normale tidspunkt. Tag ikke 2 doser på samme tid.
- Hvis du tager for meget SINGULAIR, skal du straks kontakte din læge.
For voksne og børn fra 12 måneder og ældre med astma:
- Tag SINGULAIR 1 gang hver dag, om aftenen. Fortsæt med at tage SINGULAIR 5 mg hver dag, så længe din læge ordinerer det, selvom du ikke har nogen astmasymptomer.
- Fortæl din læge med det samme, hvis dine astmasymptomer bliver værre, eller hvis du skal bruge din redningsinhalator medicin oftere til astmaanfald.
- Hav altid din redningsinhalatormedicin med dig mod astmaanfald.
- Fortsæt med at tage din anden astmamedicin som foreskrevet, medmindre din læge fortæller dig at ændre, hvordan du tager disse lægemidler.
Til personer på 6 år og ældre til forebyggelse af anstrengelsesudløst astma:
- Tag SINGULAIR mindst 2 timer før træning.
- Hav altid din redningsinhalatormedicin med dig mod astmaanfald.
- Hvis du tager SINGULAIR 10 mg hver dag mod kronisk astma eller allergisk rhinitis, lade være med tage en anden dosis for at forhindre anstrengelsesudløst astma. Tal med din læge om din behandling for anstrengelsesudløst astma.
- Tag ikke 2 doser SINGULAIR 5 mg inden for 24 timer (1 dag).
For alle 2 år og ældre med sæsonbetinget allergisk rhinitis, eller for alle 6 måneder og ældre med perennial allergisk rhinitis:
- Tag SINGULAIR 1 gang hver dag, på omtrent samme tidspunkt hver dag.
Hvad skal jeg undgå, mens jeg tager SINGULAIR 10mg?
Hvis du har astma, og aspirin gør dine astmasymptomer værre, skal du fortsætte med at undgå at tage aspirin eller anden medicin kaldet non-steroide antiinflammatoriske lægemidler (NSAID'er), mens du tager SINGULAIR.
Hvad er de mulige bivirkninger af SINGULAIR?
SINGULAIR kan forårsage alvorlige bivirkninger, herunder:
- Se "Hvad er den vigtigste information, jeg bør vide om SINGULAIR 4mg?"
- Forøgelse af visse hvide blodlegemer (eosinofiler) og mulige betændte blodkar i hele kroppen (systemisk vaskulitis). Sjældent kan dette ske hos personer med astma, som tager SINGULAIR. Dette sker nogle gange hos personer, der også tager en steroidmedicin gennem munden, som stoppes eller dosis sænkes.
Fortæl din læge med det samme, hvis du får et eller flere af disse symptomer:
- en følelse af nåle eller følelsesløshed i arme eller ben
- en influenzalignende sygdom
- udslæt
- alvorlig betændelse (smerte og hævelse) i bihulerne (bihulebetændelse)
De mest almindelige bivirkninger af SINGULAIR omfatter:
- øvre luftvejsinfektion
- feber
- hovedpine
- ondt i halsen
- hoste
- mavesmerter
- diarré
- ørepine eller ørebetændelse
- influenza
- løbende næse
- sinus infektion
Disse er ikke alle de mulige bivirkninger af SINGULAIR. Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare SINGULAIR?
- Opbevar SINGULAIR 10mg ved stuetemperatur mellem 68°F til 77°F (20°C til 25°C).
- Opbevar SINGULAIR 4mg i pakken, den kommer i.
- Opbevar SINGULAIR 4mg på et tørt sted og hold det væk fra lys.
- Opbevar SINGULAIR og al medicin utilgængeligt for børn.
Generel information om sikker og effektiv brug af SINGULAIR.
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en medicinvejledning. Brug ikke SINGULAIR til en tilstand, som det ikke er ordineret til. Giv ikke SINGULAIR til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Du kan bede din apoteker eller sundhedsudbyder om oplysninger om SINGULAIR 10mg, der er skrevet til sundhedspersonale.
Hvad er ingredienserne i SINGULAIR?
Aktiv ingrediens: montelukast natrium
Inaktive ingredienser:
- 4 mg orale granulat: mannitol, hydroxypropylcellulose og magnesiumstearat.
- 4 mg og 5 mg tyggetabletter: mannitol, mikrokrystallinsk cellulose, hydroxypropylcellulose, rødt jernoxid, croscarmellosenatrium, kirsebærsmag, aspartam og magnesiumstearat.
- Mennesker med phenylketonuri: SINGULAIR 4 mg tyggetabletter indeholder 0,674 mg phenylalanin og SINGULAIR 5 mg tyggetabletter indeholder 0,842 mg phenylalanin.
- 10 mg tablet: mikrokrystallinsk cellulose, lactosemonohydrat, croscarmellosenatrium, hydroxypropylcellulose og magnesiumstearat. Filmcoatingen indeholder: hydroxypropylmethylcellulose, hydroxypropylcellulose, titaniumdioxid, rød ferrioxid, gul ferrioxid og carnaubavoks.
Brugsanvisning
SINGULAIR® (SING-u-lair)(montelukastnatrium) orale granulat
Denne brugsanvisning indeholder information om, hvordan man bruger SINGULAIR 10 mg orale granula.
Vigtig information:
- Før du giver en dosis SINGULAIR orale granulat, skal du læse denne brugsanvisning for at være sikker på, at du forbereder og giver det orale granulat korrekt.
- Giv SINGULAIR orale granulat til dit barn nøjagtigt som instrueret af din læge.
- Stop med at give SINGULAIR 5 mg og fortæl din læge med det samme, hvis dit barn har nogle usædvanlige ændringer i adfærd eller tankegang.
- Fortsæt med at give dit barn deres astmamedicin som foreskrevet, medmindre din sundhedsplejerske fortæller dig at ændre, hvordan du giver disse lægemidler.
- Du kan give SINGULAIR 5 mg orale granulat med mad eller uden mad.
Hvordan kan jeg give SINGULAIR 4 mg orale granulat til mit barn?
- Lade være med åbn pakken, indtil den skal bruges.
- Der er forskellige måder, hvorpå du kan give SINGULAIR 4-mg orale granulat. Du bør vælge den bedste metode til dit barn:
- lige ind i munden
- opløst i 1 teskefuld (5 ml) kold eller stuetemperatur babyerstatning eller modermælk
- blandet med 1 skefuld af en af følgende bløde fødevarer ved kold eller stuetemperatur: æblemos, mosede gulerødder, ris eller is.
- Giv barnet hele blandingen inden for 15 minutter.
- Opbevar ikke rester af SINGULAIR-blandingen (orale granulat blandet med mad, modermælkserstatning eller modermælk) til brug på et senere tidspunkt. Smid enhver ubrugt del væk.
- Bland ikke SINGULAIR orale granulat med andre flydende drikkevarer end modermælkserstatning eller modermælk. Dit barn kan drikke andre væsker efter at have slugt blandingen.
Hvordan skal jeg opbevare SINGULAIR 5mg?
- Opbevar SINGULAIR 4mg ved stuetemperatur mellem 68°F til 77°F (20°C til 25°C).
- Opbevar SINGULAIR i pakken, den kommer i.
- Opbevar SINGULAIR 5mg på et tørt sted og hold det væk fra lys.
- Opbevar SINGULAIR og al medicin utilgængeligt for børn.
Denne brugsanvisning er godkendt af US Food and Drug Administration
